БИОХИМИЯ, 2022, том 87, вып. 1, с. 16 - 25
УДК 577.322.52
СТРУКТУРНЫЕ И ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ
ВИРУСНЫХ ШАПЕРОНИНОВ
Обзор
© 2022
Л.П. Курочкина1*, П.И. Семенюк1, О.С. Соколова2
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: lpk56@mail.ru
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, кафедра биоинженерии, 119991 Москва, Россия
Поступила в редакцию 16.11.2021
После доработки 06.12.2021
Принята к публикации 06.12.2021
Шаперонины обеспечивают правильное сворачивание (фолдинг) белков in vivo и in vitro и, как считалось до
недавнего времени, свойственны прокариотам, эукариотам и археям. Однако оказалось, что и некоторые
вирусы бактерий (бактериофаги) кодируют собственные шаперонины. В данном обзоре представлены ре$
зультаты исследований первых представителей этой новой группы шаперонинов: двухкольцевого шаперо$
нина EL и однокольцевых шаперонинов OBP и AR9. Проведен сравнительный анализ биохимических
свойств и структуры фаговых шаперонинов между собой и с другими известными шаперонинами I и
II групп.
КЛЮЧЕВЫЕ СЛОВА: шаперонин, бактериофаг, пространственная структура, криоэлектронная микроско$
пия, кристаллография.
DOI: 10.31857/S032097252201002X
ВВЕДЕНИЕ
ний, включая болезни Альцгеймера и Паркин$
сона, и других патологических состояний [8-10].
Сворачивание (фолдинг) многих белков с
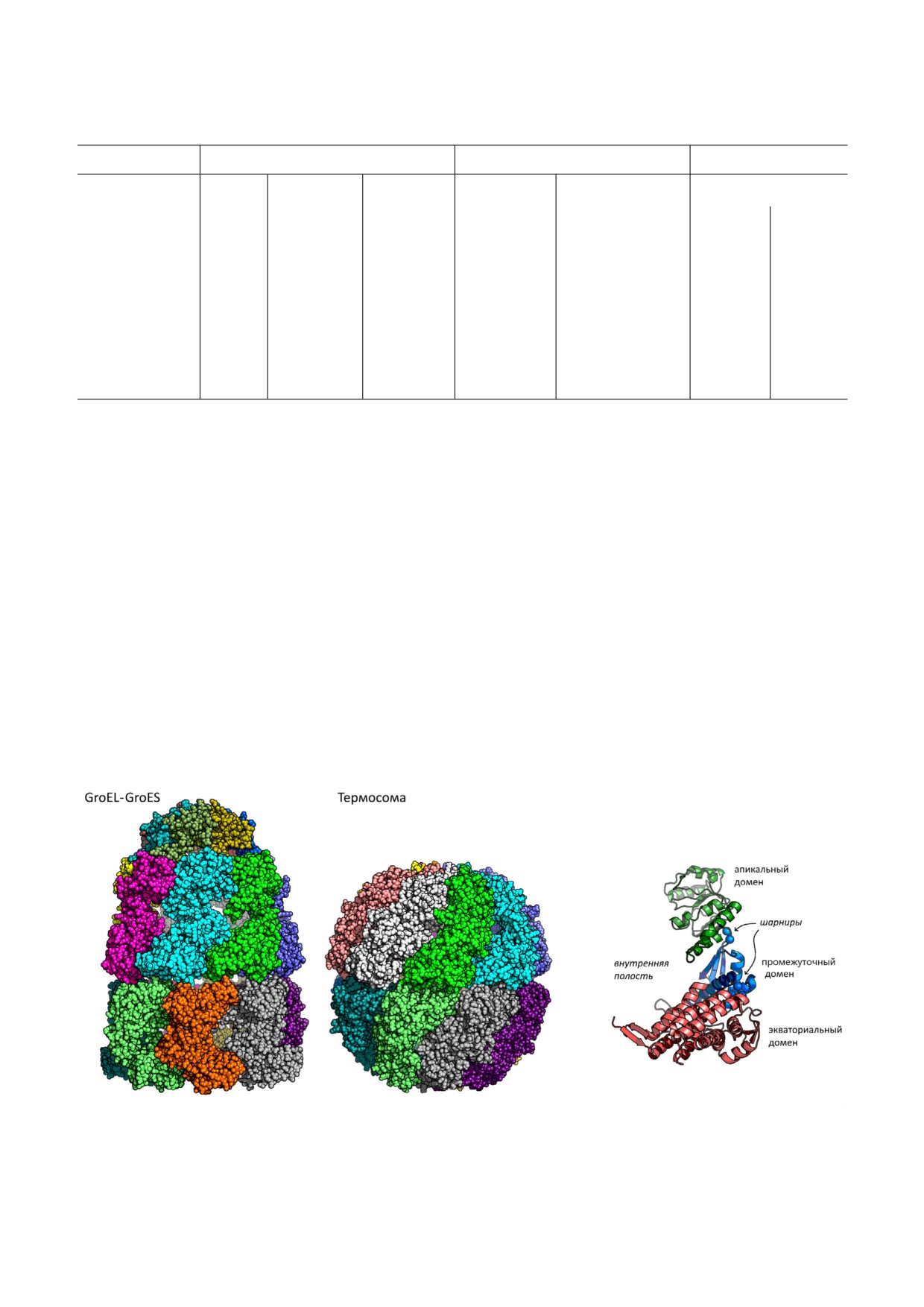
Шаперонины - очень консервативные бел$
образованием уникальной нативной структуры
ки, имеющие характерную архитектуру (рис. 1).
возможен только при участии молекулярных
Они, как правило, состоят из двух состыкован$
шаперонов [1-5]. Одним из наиболее изучен$
ных «спина к спине» колец, каждое из которых
ных классов молекулярных шаперонов являют$
содержит 7-9 субъединиц (молекулярная масса
ся шаперонины, которые встречаются во всех
отдельных субъединиц составляет около
царствах живой природы. Они помогают пра$
60 кДа), образующих полый бочонок, внутри
вильно сворачиваться как новосинтезирован$
которого и происходит сворачивание белков$
ным полипептидным цепям, так и денатуриро$
субстратов. Шаперонины принято делить на две
ванным под воздействием стресса белкам за счет
группы (таблица). К группе I относятся шаперо$
энергии гидролиза ATP [6]. Нарушение функ$
нины прокариот (в частности, наиболее изучен$
ций шаперонинов приводит к нарушению сво$
ный GroEL Escherichia coli) и эукариотических
рачивания белков, участвующих в широком
органелл - митохондрий (Hsp60) и хлороплас$
спектре клеточных процессов. Патогенные му$
тов (Cpn60) [11-13]. К группе II относятся ша$
тации или аберрантные посттрансляционные
перонины цитозоля архей (термосома) и эука$
модификации, влияющие на структуру и функ$
риот (TRiC/CCT) [14]. Шаперонины I группы
цию шаперонинов, вызывают так называемые
являются гомоолигомерными комплексами, со$
шаперонинопатии [7]. Это, в свою очередь, мо$
держащими по 7 субъединиц в каждом кольце.
жет повлиять на большинство жизненно важ$
Шаперонины II группы чаще всего представля$
ных процессов, происходящих на уровне всего
ют собой гетероолигомеры, кольца которых со$
организма, и стать причиной онкологических,
стоят из 8 или 9 различных, но гомологичных
аутоиммунных, нейродегенеративных заболева$
субъединиц. Кольца шаперонинов различаются
взаимным расположением субъединиц: у шапе$
ронинов I группы каждая субъединица одного
* Адресат для корреспонденции.
кольца взаимодействует с двумя субъединицами
16
ОСОБЕННОСТИ ВИРУСНЫХ ШАПЕРОНИНОВ
17
Сравнение вирусных шаперонинов с шаперонинами I и II групп
Группа I
Группа II
Вирусные шаперонины
Локализация
бактерии
митохондрии
хлоропласты
археи
цитозоль эукариот
бактериофаги
Название
GroEL
Hsp60
Cpn60
термосома
TRiC (CCT)
EL
OBP, AR9
Кошаперонин
GroES
Hsp10
Cpn10/20
-
-
-
-
Количество типов
1
1
2
2 или 3
8
1
1
субъединиц
Олигомеризация
2 × 7
2 × 7
2 × 7
2 × 8 или 2 × 9
2 × 8
2 × 7
1 × 7
Расположение
1 : 2
1 : 2
1 : 2
1 : 1
1 : 1
1 : 1
-
субъединиц
между кольцами
противоположного кольца (1 : 2), а у шаперони$
пы функционируют без кошаперонинов: роль
нов II группы каждая субъединица одного коль$
«крышки» у них выполняют встроенные в апи$
ца взаимодействует только с одной субъедини$
кальные домены длинные альфа$спирали, кото$
цей другого (1 : 1). Однако главным отличием
рые меняют свое положение на разных стадиях
между шаперонинами двух групп является то,
реакционного цикла, тем самым открывая или
что шаперонины I группы функционируют в па$
закрывая внутреннюю полость [18, 19]. На осно$
ре с другими белками, кошаперонинами:
вании структурных и биохимических исследова$
GroES - в бактериях, Hsp10 - в митохондриях и
ний установлено, что в реакционном цикле ша$
Cpn10/20 - в хлоропластах [15-17]. Кошаперо$
перонины I и II групп претерпевают ATP$зави$
нины состоят из 7 идентичных субъединиц
симые переходы между открытой и закрытой
(масса субъединицы около 10 кДа; у хлороплас$
конформациями.
тов встречаются кошаперонины с массой субъ$
Специфика масштабных конформационных
единиц около 20 кДа) и имеют куполообразную
перестроек, происходящих в процессе функцио$
форму. В процессе функционирования кошапе$
нирования шаперонинов, обусловлена структу$
ронин как «крышка» закрывает с торца внутрен$
рой их субъединиц (рис. 1). У шаперонинов обе$
нюю полость шаперонина, в которой происхо$
их групп каждая субъединица состоит из трех
дит сворачивание белка. Шаперонины II груп$
доменов: апикального, который распознает и
Рис. 1. Кристаллические структуры комплекса GroEL-GroES (группа I) и термосомы (группа II); коды PDB: 1aon и 1a6d
соответственно; субъединицы окрашены разными цветами; справа - трехдоменная организация субъединицы GroEL
2 БИОХИМИЯ том 87 вып. 1 2022
18
КУРОЧКИНА и др.
связывает субстрат (а у шаперонинов I группы -
указанием на давние эволюционные взаимосвя$
еще и кошаперонин); экваториального, кото$
зи между хвостатыми бактериофагами и вируса$
рый содержит ATP$связывающий сайт и ответ$
ми архей.
ственен за внутри$ и межкольцевые контакты
Биоинформатический
анализ
ряда
субъединиц; и промежуточного, соединяющего
GroEL$подобных белков, предсказанных на ос$
два вышеупомянутых домена. Промежуточный
нове известных к настоящему времени последо$
домен обеспечивает передачу конформацион$
вательностей геномов бактериофагов, показал,
ных изменений, инициированных связыванием
что подобно всем известным шаперонинам они
нуклеотида, от экваториального домена к апи$
имеют трехдоменную организацию и содержат в
кальному [20, 21].
целом консервативный сайт связывания ATP,
который больше похож на нуклеотид$связываю$
щий сайт шаперонинов I группы. Кроме того,
ФИЛОГЕНИЯ ФАГОВЫХ ШАПЕРОНИНОВ
аминокислотные последовательности этих бел$
ков, как и шаперонинов I группы, не содержат в
Шаперонины были открыты в 1970$х годах,
апикальном домене дополнительной спираль$
когда в процессе генетических исследований
ной вставки - встроенной «крышки», характер$
различных штаммов E. coli был идентифициро$
ной для представителей II группы [38]. На эво$
ван ген, мутации в котором влияли на способ$
люционную близость фаговых шаперонинов к
ность клеток поддерживать рост бактериофа$
шаперонинам I группы указывает также их рас$
гов [22-25]. Продукт этого бактериального гена
положение на филогенетическом древе (рис. 2)
назвали шаперонином GroEL. Было установле$
[39]. Однако у них имеются и некоторые отли$
но, что ряд бактериофагов, лямбда, T5, PRD1,
чия: в частности, аминокислотные остатки, ко$
Mu и другие, для сборки белков капсида или/и
торые по аналогии с бактериальным GroEL от$
хвоста использует клеточную систему шаперо$
вечают за межкольцевые взаимодействия субъ$
нинов GroEL-GroES [26-29]. У некоторых фа$
единиц, не консервативны у предсказанных фа$
гов функцию кошаперонина выполняют их
говых шаперонинов. Необходимо также отме$
собственные белки, ортологи GroES: например,
тить, что фаговые шаперонины нельзя объеди$
в фаге Т4 - продукт гена (gene product, gp) 31
нить в одну монофилетическую группу, посколь$
[30], а в фаге RB49 - CocO [31]. Более того, ока$
ку они существенно различаются между собой.
залось, что бактериофаги могут кодировать и
собственные шаперонины. Так, ген, кодирую$
щий гомолог GroEL, был впервые обнаружен в
БИОХИМИЧЕСКИЕ СВОЙСТВА
2005 г. в геноме гигантского бактериофага EL
ФАГОВЫХ ШАПЕРОНИНОВ
Pseudomonas aeruginosa [32]. Позже гены, коди$
рующие GroEL$подобные белки, были найдены
Для изучения структурных и функциональ$
у других фагов, и число таких белков$кандида$
ных особенностей фаговых шаперонинов нами
тов, потенциально являющихся шаперонинами,
были получены и охарактеризованы различны$
растет по мере депонирования в базу данных
ми физико$химическими методами рекомбинант$
GenBank последовательностей геномной ДНК
ные GroEL$подобные белки гигантских бакте$
новых бактериофагов [33-36].
риофагов: EL Pseudomonas aeruginosa [40], OBP
Как показал анализ метагеномных последо$
Pseudomonas fluorescens
[38] и AR9 Bacillus
вательностей из различных популяций вирио$
subtilis [39]. С помощью аналитического ультра$
планктона, литические и умеренные бактерио$
центрифугирования и электронной микроско$
фаги, несущие гены шаперонинов, сравнитель$
пии было установлено, что они имеют разную
но широко распространены в морских экосис$
архитектуру. Подобно большинству известных
темах [37]. Многие из этих бактериофагов коди$
шаперонинов белок фага EL имеет двухкольце$
руют гомологи GroEL и GroES, а часть бактерио$
вую морфологию: каждое из его колец состоит
фагов кодирует только GroEL$подобные шапе$
из 7 субъединиц gp146 (558 а.о., 61,68 кДа). В
ронины. По своей последовательности эти ша$
отличие от тетрадекамера EL, шаперонины фа$
перонины значительно отличаются от последо$
гов ОВР и AR9 представляют собой одноколь$
вательностей бактериальных шаперонинов, из
цевые гептамеры, состоящие из субъединиц
чего следует, что бактериофаги несут этот ген в
gp246 (520 а.о., 57,75 кДа) и gp228 (562 а.о.,
течение длительного эволюционного времени.
63,75 кДа) соответственно. Однокольцевые ша$
Интересно также, что у некоторых бактериофа$
перонины менее изучены по сравнению с двух$
гов были найдены потенциальные шаперонины,
кольцевыми. Однако известно, что одноколь$
филогенетически близкие к термосомам архей,
цевые формы мутантного шаперонина GroEL
а не шаперонинам I группы, что может являться
[41-43] и митохондриального шаперонина
БИОХИМИЯ том 87 вып. 1 2022
ОСОБЕННОСТИ ВИРУСНЫХ ШАПЕРОНИНОВ
19
Рис. 2. Расположение фаговых шаперонинов (красный цвет) среди шаперонинов I и II групп (черный цвет) на филогене$
тическом древе
[44-45] обладают функциональной актив$
Ген 188 был клонирован и экспрессирован в
ностью. Более того, сравнительно недавно было
клетках E. coli [40]. Рекомбинантный gp188
установлено, что в ATPазном цикле бактери$
(308 а.о., 34,29 кДа) был использован в опытах
альной системы GroEL-GroES происходит
in vitro для изучения биологической активности
временное разделение колец шаперонина [46],
фаговых шаперонинов. В качестве белка$
а в реакционном цикле митохондриального ша$
субстрата мы также использовали рекомбинант$
перонина, mHsp60-mHsp10, одновременно
ный эндолизин бактериофага ОВР - gp279
функционируют как однокольцевые, так и
(342 а.о., 38,17 кДа) [38].
двухкольцевые формы [47].
Было показано, что, несмотря на различия в
С целью изучения функциональной актив$
архитектуре, все три фаговых шаперонина обла$
ности фаговых шаперонинов был проведен по$
дают шаперонной активностью: в присутствии
иск их потенциальных белков$субстратов среди
ATP они способны сворачивать денатурирован$
фаговых белков. С использованием сыворотки
ные фаговые эндолизины, восстанавливая их
на рекомбинантные белки (gp146 и gp246) мы
ферментативную активность [39]. Для фаговых
показали, что гены, кодирующие шаперонины,
шаперонинов характерна и шапероноподобная
экспрессируются in vivo при инфицировании
активность: они защищают белки$субстраты от
бактериальных клеток P. aeruginosa и P. fluo
термической агрегации ATP$зависимым спосо$
rescens фагами EL и ОВР соответственно [38, 40].
бом [40]. При этом двухкольцевой шаперонин
С помощью метода иммунопреципитации из
EL, подобно шаперонину GroEL [48], способен
клеток P. aeruginosa, инфицированных фагом
предотвращать агрегацию эндолизина и в отсут$
EL, был выделен gp146, а также его возможные
ствие ATP за счет образования стабильного дол$
комплексы с белками$субстратами. С помощью
гоживущего комплекса с его развернутыми под
масс$спектрометрии был идентифицирован бе$
воздействием температуры полипептидными
лок$субстрат - фаговый эндолизин (gp188). Эн$
цепями [40, 49]. Однокольцевые шаперонины
долизин является ферментом, который участву$
функционируют только в присутствии ATP. Все
ет в лизисе клетки$хозяина в конце репликаци$
три фаговых шаперонина обладают слабой
онного цикла бактериофага. Разрушая изнутри
ATPазной активностью [39]. Важно отметить,
пептидогликановый слой бактериальной клет$
что для функционирования фаговым шаперо$
ки, он обеспечивает выход образовавшихся фа$
нинам не требуются кошаперонины. Видимо,
говых частиц наружу.
по этой причине при масс$спектрометрических
БИОХИМИЯ том 87 вып. 1 2022
2*
20
КУРОЧКИНА и др.
исследованиях среди фаговых и клеточных бел$
соответственно [50]. Интересно, что в апо$фор$
ков не был обнаружен кандидат на роль кошапе$
ме ОВР вращательная симметрия С7 наблюда$
ронина.
ется только на уровне экваториальных доменов.
В области промежуточного домена симметрия
нарушается, а на уровне апикальных доменов
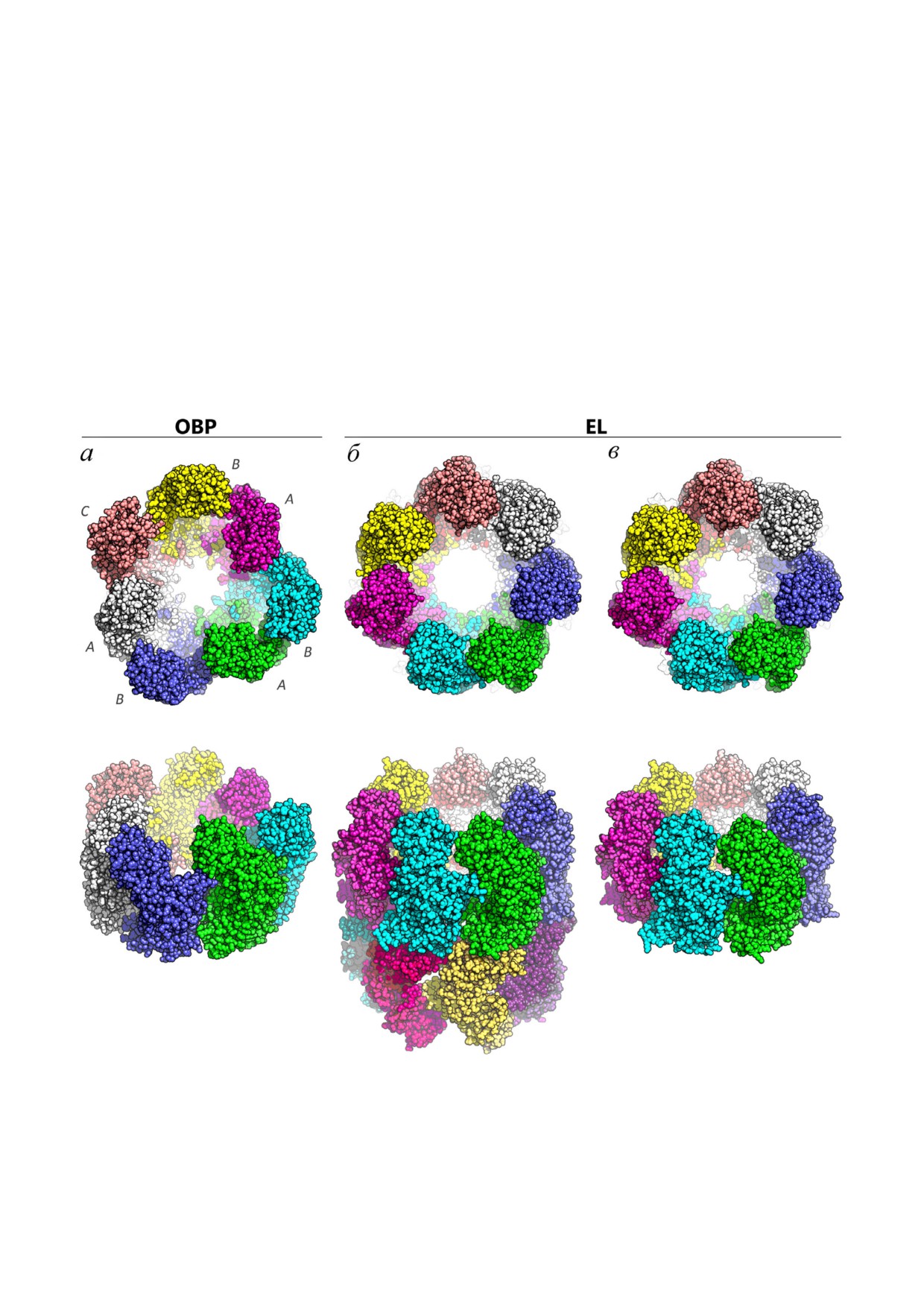
СТРУКТУРА ОДНОКОЛЬЦЕВОГО
наблюдается ярко выраженная асимметрия: геп$
ШАПЕРОНИНА ОВР
тамер состоит из трех пар субъединиц (обозна$
ченных условно как А и В) и одной непарной
На основе изображений, полученных с по$
субъединицы (С). В каждой паре субъединицы А
мощью криоэлектронной микроскопии, опре$
и В имеют разную конформацию, а субъединица
делена структура однокольцевого шаперонина
C, которая разрешена в структуре хуже из$за
ОВР в апо$форме, а также в связанных с ATPγS
своей подвижности, по$видимому, способна
(медленно гидролизуемый аналог ATP) и ADP
принимать разные конформации между кон$
состояниях с разрешением 4,3 Å, 5,0 Å и 6,0 Å
формациями А и В (рис. 3, а).
Рис. 3. Сравнение структур однокольцевого шаперонина ОВР и двухкольцевого шаперонина EL (верхний ряд - вид свер$
ху, нижний - вид сбоку под углом); субъединицы окрашены разными цветами. а, б - Апо$формы шаперонинов ОВР и EL,
полученные с помощью криоэлектронной микроскопии; коды PDB: 6hdd и 6tmv соответственно. Субъединицы ОВР, об$
разующие три пары, обозначены буквами А и В, а непарная подвижная субъединица - буквой С. в - Кристаллическая
структура шаперонина EL в присутствии ATP-BeFx; код PDB: 6tmu
БИОХИМИЯ том 87 вып. 1 2022
ОСОБЕННОСТИ ВИРУСНЫХ ШАПЕРОНИНОВ
21
На основе кристаллической структуры
субъединицы А и апикальным доменом субъ$
GroEL с учетом 17%$ной идентичности амино$
единицы В внутри каждой пары субъединиц.
кислотных последовательностей GroEL и gp246
Между парами такие межсубъединичные взаи$
для субъединиц А и В были построены атомные
модействия отсутствуют, вследствие чего и наб$
модели, которые затем встраивали в карту плот$
людается асимметричная картина в верхней час$
ности гептамера. Сравнение полученных моде$
ти шаперонина ОВР (рис. 3, а).
лей со структурой субъединицы шаперонина
На основе криоэлектронных изображений
GroEL в разных конформационных состояниях
получены структуры апо$формы другого одно$
позволило установить, что субъединица А шапе$
кольцевого шаперонина, AR9: без наложения
ронина ОВР похожа на состояние Т (низкая аф$
симметрии - с разрешением 4,5 Å и при наложе$
финность к ATP), которое соответствует закры$
нии симметрии С7 - с разрешением 4,0 Å. В от$
той конформации GroEL, а субъединица В боль$
личие от ОВР, для AR9 характерна менее выра$
ше похожа на состояние Rs1 (ATP$связанное
женная асимметрия субъединиц, хотя на уровне
состояние), которое соответствует открытой
апикальных и промежуточных доменов наблю$
конформации GroEL. Таким образом, в отличие
дается структурная гетерогенность [56, 57].
от GroEL, в апо$форме шаперонина ОВР субъ$
единицы присутствуют одновременно в двух кон$
формациях. В пользу этого могут свидетельство$
СТРУКТУРА ДВУХКОЛЬЦЕВОГО
вать экспериментальные данные, полученные
ШАПЕРОНИНА EL
нами с помощью метода изотермической титра$
ционной калориметрии. Кривые титрования
Ранние исследования структуры с помощью
шаперонина различными нуклеотидами (ATP,
криоэлектронной микроскопии позволили ре$
ADP, ATPγS) соответствуют модели «два набора
конструировать модели шаперонина EL в апо$
сайтов связывания». Это означает, что субъеди$
форме с разрешением 9 Å и в связанных с ATP и
ницы шаперонина имеют два типа нуклеотид$
ADP состояниях с разрешением 6,8 Å и 11,7 Å
связывающих сайтов, различающихся констан$
соответственно [58]. В отсутствие нуклеотидов и
тами связывания и тепловым эффектом [38, 39].
в связанном с ATP состоянии шаперонин имеет
Известно, что в GroEL переход из состоя$
двухкольцевую морфологию, при этом располо$
ния Т в состояние Rs1 обусловлен функциони$
жение его субъединиц на межкольцевом интер$
рованием нижнего шарнира, соединяющего
фейсе такое же, как у шаперонинов II группы -
промежуточный и экваториальный домены
1 : 1, а не ступенчатое - 1 : 2, как у GroEL. В апо$
субъединицы (рис. 1) [51]. Такой переход проис$
форме оба кольца шаперонина EL имеют закры$
ходит одновременно во всех субъединицах од$
тую конформацию, а в ATP$связанном состоя$
ного кольца (положительная внутрикольцевая
нии оба кольца находятся в открытой конфор$
кооперативность) [52]. Аминокислотные остат$
мации, способной связывать белок$субстрат.
ки Pro137 и Gly410, формирующие этот шарнир
ADP$связанная форма имеет однокольцевую
в GroEL, консервативны в шаперонине ОВР, что
сфероподобную структуру, что предполагает
обеспечивает вращение апикального и проме$
разделение колец в процессе функционирова$
жуточного доменов относительно экваториаль$
ния шаперонина. Согласно предложенному в
ного домена для каждой его субъединицы.
2016 г. гипотетическому механизму ATPазного
Наряду с нижним шарниром в GroEL функ$
цикла шаперонина EL неправильно свернутый
ционирует еще и верхний шарнир, который сое$
белок$субстрат входит во внутреннюю полость
диняет промежуточный домен с апикальным.
каждого из двух связанных с ATP колец и запус$
Согласованное вращение апикальных доменов
кает процесс гидролиза ATP, в результате чего
всех субъединиц приводит к открыванию/
происходит перемещение экваториальных до$
закрыванию внутренней полости шаперонина в
менов в субъединицах, приводящее к разделе$
процессе его ATPазного цикла. В GroEL верх$
нию колец шаперонина [58].
ний шарнир сформирован высококонсерватив$
Объем внутренней полости в каждом одно$
ными остатками Gly192 и Gly375 [53-55]. В ша$
кольцевом комплексе увеличивается почти
перонине ОВР соответствующие остатки Gly за$
вдвое, а за счет перестройки апикальных доме$
мещены на большие полярные остатки Glu191 и
нов белок$субстрат инкапсулируется во внут$
Asn376, поэтому верхний шарнир в ОВР не
ренней камере. После диссоциации ADP проис$
функционален. Более того, некоторые солевые
ходит реассоциация колец с образованием двух$
мостики, играющие ключевую роль в функцио$
кольцевой апо$формы. Связывание ATP вновь
нировании GroEL, отсутствуют в шаперонине
открывает внутреннюю полость, позволяя свер$
ОВР. Вместо них появляется новый набор соле$
нутому субстрату выйти наружу, и цикл начина$
вых мостиков между промежуточным доменом
ется снова. Таким образом, оба разделившихся
БИОХИМИЯ том 87 вып. 1 2022
22
КУРОЧКИНА и др.
кольца шаперонина EL активны и способны
ентацией апикальных доменов имеет низкое
сворачивать белок$субстрат одновременно. При
сродство к белку$субстрату. Связывание ATP
этом между кольцами шаперонина EL отсут$
инициирует разделение колец, при этом одно$
ствует отрицательный кооперативный эффект,
кольцевая форма имеет симметричную тополо$
характерный для бактериального шаперонина
гию апикальных доменов и обладает высокой
GroEL, в котором согласно ранее предложенной
аффинностью к белку$субстрату. Гидролиз ATP,
«bullet»$модели два кольца работают поочеред$
скорее всего, происходит в две стадии: сначала
но подобно двухтактному двигателю [59].
ATP гидролизуется в трех чередующихся субъ$
Недавние исследования структуры шаперо$
единицах, в результате чего конформация коль$
нина EL не подтвердили образования в присут$
ца становится похожей на апо$состояние. При
ствии ADP сфероподобных однокольцевых
этом может быть ослаблено взаимодействие со
комплексов, в которых, как предполагали ра$
связанным белком$субстратом, что приводит к
нее [58], происходит инкапсулирование белка$
его частичному высвобождению. На следующем
субстрата. Напротив, было показано, что деста$
этапе происходит гидролиз ATP в оставшихся
билизация межкольцевых взаимодействий в ша$
четырех субъединицах с последующей диссоциа$
перонине EL, приводящая к диссоциации его
цией ADP, что генерирует образование двухколь$
колец, происходит в присутствии ATP и только
цевой апо$формы и завершает высвобождение и
при физиологической концентрации соли
сворачивание субстрата. На всех этапах шаперо$
(100 мМ KCl); при более низкой концентрации
нин EL находится в открытой конформации.
соли (50 мМ KCl) двухкольцевая морфология
Так же, как и в шаперонине EL, связывание
сохраняется [60].
нуклеотидов приводит к увеличению конфор$
На основе криоэлектронных изображений
мационной вариабельности субъединиц в одно$
получена структура шаперонина EL в разных
кольцевом шаперонине ОВР [50]. В связанном с
состояниях [60]. Шаперонин в комплексах с
ATPγS или ADP состоянии на уровне апикаль$
ADP и ATPγS (разрешение 5,9 Å и 5,8 Å соответ$
ных доменов асимметрия сохраняется, но, в от$
ственно) имеет двухкольцевую морфологию,
личие от апо$формы, статичной остается только
причем оба кольца находятся в открытой кон$
одна пара субъединиц А и В, остальные субъеди$
формации. Более высокое разрешение (3,45 Å)
ницы становятся динамическими, что может
структуры апо$формы шаперонина EL позволи$
повлиять на связывание и сворачивание белка$
ло выявить асимметричную структуру его колец
субстрата. Невозможность вращения апикаль$
(рис. 3, б) [60].
ных доменов шаперонина OBP исключает нали$
Структуры двух разных форм однокольцево$
чие механизма закрывания внутренней полости
го шаперонина EL в открытой конформации
для инкапсулирования субстрата. Размер внут$
были также решены кристаллографическими
ренней полости при связывании нуклеотида
методами. Кристаллическая форма I (разреше$
увеличивается незначительно, что указывает на
ние 4,03 Å) имела симметричную структуру, со$
то, что шаперонин ОВР во всех состояниях на$
стоящую из однородных субъединиц в ATP$свя$
ходится в открытой конформации, как и шапе$
занной конформации. Кристаллическая фор$
ронин EL.
ма II (разрешение 3,54 Å) была асимметрична:
Таким образом, в процессе функционирова$
субъединицы, имеющие ATP$связанную кон$
ния вирусные шаперонины претерпевают нук$
формацию, чередовались с субъединицами в
леотид$зависимые конформационные перехо$
ADP$связанной конформации (рис. 3, в), что
ды, защищая белок$субстрат от агрегации без
похоже на структуру колец апо$формы шаперо$
его инкапсулирования. На основании этого
нина EL (рис. 3, б). Следует отметить, что по$
можно выдвинуть предположение о том, что фа$
добная структура с чередующимися субъедини$
говые шаперонины представляют собой эволю$
цами ранее была установлена нами для апо$
ционно более древние предшественники шапе$
формы однокольцевого шаперонина ОВР
ронинов I и II групп, функционирующих по бо$
(рис. 3, а) [50].
лее сложному механизму.
ATPазный ЦИКЛ ВИРУСНЫХ
ЗАКЛЮЧЕНИЕ
ШАПЕРОНИНОВ
Изучение шаперонинов, кодируемых виру$
На основании полученных реконструкций
сами бактерий, началось сравнительно недавно,
предложена гипотетическая модель ATPазного
и на сегодняшний день детально охарактеризо$
цикла шаперонина EL [60], согласно которой
вано только три шаперонина, кодируемых гигант$
двухкольцевая апо$форма с асимметричной ори$
скими бактериофагами: EL P. aeruginosa, OBP
БИОХИМИЯ том 87 вып. 1 2022
ОСОБЕННОСТИ ВИРУСНЫХ ШАПЕРОНИНОВ
23
P. fluorescens и AR9 B. subtilis. Сравнение их по
Как отмечалось выше, бактериальный
структуре и свойствам c другими известными
GroEL способен пассивно защищать белки$
шаперонинами позволяет предположить, что
субстраты от термической инактивации за счет
фаговые шаперонины имеют свои характерные
образования стабильного комплекса с разверну$
особенности (таблица). Фаговые шаперонины,
тыми молекулами субстрата [48]. В отсутствие
в отличие от шаперонинов I группы, функцио$
кошаперонина GroES инкапсулирования суб$
нируют без кошаперонинов и не имеют встро$
страта не происходит, поэтому в этом случае
енной «крышки», как у шаперонинов II группы.
GroEL не восстанавливает биологическую ак$
Эта уникальная особенность указывает на то,
тивность денатурированного белка$субстра$
что их механизм функционирования отличается
та [61]. Вопрос о том, каким образом фаговые
от механизма функционирования известных
шаперонины сворачивают денатурированный
шаперонинов I и II групп.
эндолизин с восстановлением ферментативной
Общепризнано, что главная функция любо$
активности без его инкапсулирования, пока ос$
го шаперонина заключается в том, что он пре$
тается открытым.
доставляет белку$субстрату свою внутреннюю
Для более полного понимания механизма
полость, куда временно заключается одна моле$
функционирования необходимо дальнейшее де$
кула субстрата. Чтобы избежать аберрантных
тальное изучение структуры и биохимических
взаимодействий, которые могут привести к аг$
свойств как уже охарактеризованных, так и но$
регации белка$субстрата, сворачивание его про$
вых представителей шаперонинов, кодируемых
текает изолированно. Поэтому шаперонины I и
вирусами бактерий.
II групп при функционировании претерпевают
ATP$зависимые переходы между открытой и
Финансирование. Работа поддержана гран$
закрытой конформациями. В отличие от них,
том Российского фонда фундаментальных ис$
фаговые шаперонины независимо от состояния
следований (№ 19$04$00605) в рамках Междис$
(апо$форма или комплексы с нуклеотидами) на$
циплинарной научно$образовательной школы
ходятся в открытой конформации. Можно пред$
Московского государственного университета
положить, что на разных стадиях их ATPазного
«Молекулярные технологии живых систем и
цикла исключается инкапсулирование белка$
синтетическая биология».
субстрата, то есть изоляция его от внешней сре$
Конфликт интересов. Авторы заявляют об от$
ды. Это характерно как для однокольцевых, так
сутствии конфликта интересов.
и для двухкольцевых шаперонинов. Разница
Соблюдение этических норм. Настоящий об$
между ними заключается в том, что в процессе
зор не содержит описания каких$либо исследо$
функционирования у двухкольцевых шаперони$
ваний с участием людей или животных в качест$
нов происходит разделение колец.
ве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Hartl, F. U. (1996) Molecular chaperones in cellular pro$
ical implications, Front. Mol. Biosci., 4, 99, doi: 10.3389/
tein folding, Nature, 381, 571$579, doi: 10.1016/0959$
fmolb.2017.00099.
440x(95)80014$r.
8. Chiti, F., and Dobson, C. M. (2006) Protein misfolding,
2.
Frydman, J. (2001) Folding of newly translated proteins
functional amyloid, and human disease, Annu. Rev.
in vivo: the role of molecular chaperones, Annu. Rev.
Biochem., 75, 333$366, doi: 10.1146/annurev.biochem.
Biochem., 70, 603$647, doi: 10.1146/annurev.biochem.70.
75.101304.123901.
1.603.
9. Tittelmeier, J., Nachman, E., and Nussbaum$
3.
Ellis, R. J. (2006) Molecular chaperones: assisting assem$
Krammer, C. (2020) Molecular chaperones: a double$
bly in addition to folding, Trends Biochem. Sci., 31, 395$
edged sword in neurodegenerative diseases, Front. Aging
401, doi: 10.1016/j.tibs.2006.05.001.
Neurosci., 12, 581374, doi: 10.3389/fnagi.2020.581374.
4.
Kim, Y. E., Hipp, M. S., Bracher, A., Hayer$Hartl, M.,
10. Hartl, F. U., Bracher, A., and Hayer$Hartl, M. (2011)
and Hartl, F. U. (2013) Molecular chaperone functions in
Molecular chaperones in protein folding and proteostasis,
protein folding and proteostasis, Annu. Rev. Biochem., 82,
Nature, 475, 324$332, doi: 10.1038/nature10317.
323$355, doi: 10.1146/annurev$biochem$060208$092442.
11. Hayer$Hartl, M. K., Martin, J., and Hartl, F. U. (1995)
5.
Balchin, D., Hayer$Hartl, M., and Hartl, F. U. (2020)
Asymmetrical interaction of GroEL and GroES in the
Recent advances in understanding catalysis of protein fold$
ATPase cycle of assisted protein folding, Science, 269, 836$
ing by molecular chaperones, FEBS Lett., 594, 2770$2781,
841, doi: 10.1126/science.7638601.
doi: 10.1002/1873$3468.13844.
12. Cheng, M. Y., Hartl, F. U., Martin, J., Pollock, R. A.,
6.
Horwich, A. L., and Fenton, W. A. (2020) Chaperonin$
Kalousek, F., et al. (1989) Mitochondrial heat$shock pro$
assisted protein folding: a chronologue, Q. Rev. Biophys.,
tein hsp60 is essential for assembly of proteins imported
53, e4, 1$127, doi: 10.1017/S0033583519000143.
into yeast mitochondria, Nature,
337,
620$625,
7.
Vilasi, S., Bulone, D., Caruso Bavisotto, C., Campanella,
doi: 10.1038/337620a0.
C., Marino Gammazza, A., et al. (2017) Chaperonin of
13. Dickson, R., Weiss, C., Howard, R. J., Alldrick, S. P., Ellis,
Group I: oligomeric spectrum and biochemical and biolog$
R. J., et al. (2000) Reconstitution of higher plant chloro$
БИОХИМИЯ том 87 вып. 1 2022
24
КУРОЧКИНА и др.
plast chaperonin 60 tetradecamers active in protein fold$
30.
Van der Vies, S. M., Gatenby, A. A., and Georgopoulos, C.
ing, J. Biol. Chem., 275, 11829$11835, doi: 10.1074/jbc.
(1994) Bacteriophage T4 encodes a co$chaperonin that
275.16.11829.
can substitute for Escherichia coli GroES in protein fold$
14.
Ranson, N. A., White, H. E., and Saibil, H. R. (1998)
ing, Nature, 368, 654$656, doi: 10.1038/368654a0.
Chaperonins, Biochem. J., 333, 233$242, doi: 10.1042/
31.
Ang, D., Richardson, A., Mayer, M. P., Keppel, F.,
bj3330233.
Krisch, H., et al. (2001) Pseudo$T$even bacteriophage
15.
Mande, S. C., Mehra, V., Bloom, B. R., and Hol, W. G.
RB49 encodes CocO, a cochaperonin for GroEL, which
(1996) Structure of the heat shock protein chaperonin$10
can substitute for Escherichia coli’s GroES and bacterio$
of Mycobacterium leprae, Science,
271,
203$207,
phage T4’s Gp31, J. Biol. Chem., 276, 8720$8726,
doi: 10.1126/science.271.5246.203.
doi: 10.1074/jbc.M008477200.
16.
Koumoto, Y., Shimada, T., Kondo, M., Hara$
32.
Hertveldt, K., Lavigne, R., Pleteneva, E., Sernova, N.,
Nishimura, I., and Nishimura, M. (2001) Chloroplasts
Kurochkina, L., et al. (2005) Genome comparison of
have a novel Cpn10 in addition to Cpn20 as co$chaper$
Pseudomonas aeruginosa large phages, J. Mol. Biol., 354,
onins in Arabidopsis thaliana, J. Biol. Chem., 276, 29688$
536$545, doi: 10.1016/j.jmb.2005.08.075.
29694, doi: 10.1074/jbc.M102330200.
33.
Kiljunen, S., Hakala, K., Pinta, E., Huttunen, S.,
17.
Sharkia, R., Bonshtien, A. L., Mizrahi, I., Weiss, C.,
Pluta, P., et al. (2005) Yersiniophage phiR1$37 is a tailed
Niv, A., et al. (2003) On the oligomeric state of chloroplast
bacteriophage having a 270 kb DNA genome with thymi$
chaperonin 10 and chaperonin 20, Biochim. Biophys. Acta,
dine replaced by deoxyuridine, Microbiology, 151, 4093$
1651, 76$84, doi: 10.1016/S1570$9639(03)00237$1.
4102, doi: 10.1099/mic.0.28265$0.
18.
Zhang, J., Ma, B., DiMaio, F., Douglas, N. R.,
34.
Cornelissen, A., Hardies, S. C., Shaburova, O. V., Krylov,
Joachimiak, L. A., et al. (2011) Cryo$EM structure of a
V. N., Mattheus, W., et al. (2012) Complete genome
group II chaperonin in the prehydrolysis ATP$bound state
sequence of the giant virus OBP and comparative genome
leading to lid closure, Structure,
19,
633$639,
analysis of the diverse ϕKZ$related phages, J. Virol., 86,
doi: 10.1016/j.str.2011.03.005.
1844$1852, doi: 10.1128/JVI.06330$11.
19.
Zang, Y., Jin, M., Wang, H., Cui, Z., Kong, L., et al.
35.
Jang, H. B., Fagutao, F. F., Nho, S. W., Park, S. B., Cha,
(2016) Staggered ATP binding mechanism of eukaryotic
I. S., et al. (2013) Phylogenomic network and comparative
chaperonin TRiC (CCT) revealed through high$resolution
genomics reveal a diverged member of the ΦKZ$related
cryo$EM, Nat. Struct. Mol. Biol.,
23,
1083$1091,
group, marine vibrio phage ϕJM$2012, J. Virol., 87, 12866$
doi: 10.1038/nsmb.3309.
12878, doi: 10.1128/JVI.02656$13.
20.
Braig, K., Otwinowski, Z., Hegde, R., Boisvert, D. C.,
36.
Lavysh, D., Sokolova, M., Minakhin, L., Yakunina, M.,
Joachimiak, A., et al. (1994) The crystal structure of the
Artamonova, T., et al. (2016) The genome of AR9, a giant
bacterial chaperonln GroEL at 2.8 Å, Nature, 371, 578$
transducing Bacillus phage encoding two multisubunit
586, doi: 10.1038/371578a0.
RNA polymerases, Virology, 495, 185$196, doi: 10.1016/
21.
Skjærven, L., Cuellar, J., Martinez, A., and Valpuesta, J.
j.virol.2016.04.030.
M. (2015) Dynamics, flexibility, and allostery in molecular
37.
Marine, R. L., Nasko, D. J., Wray, J., Polson, S. W., and
chaperonins, FEBS Lett., 589, 2522$2532, doi: 10.1016/
Wommack, K. E. (2017) Novel chaperonins are prevalent
j.febslet.2015.06.019.
in the virioplankton and demonstrate links to viral biology
22.
Georgopoulos, C. P., Hendrix, R. W., Kaiser, A. D., and
and ecology, ISME J., 11, 2479$2491, doi: 10.1038/
Wood, W. B. (1972) Role of the host cell in bacteriophage
ismej.2017.102.
morphogenesis: effects of a bacterial mutation on T4 head
38.
Semenyuk, P. I., Orlov, V. N., Sokolova, O. S., and
assembly, Nat. New Biol., 239, 38$41, doi: 10.1038/new$
Kurochkina, L. P. (2016) New GroEL$like chaperonin of
bio239038a0.
bacteriophage OBP Pseudomonas fluorescens suppresses
23.
Georgopoulos, C. P., and Hohn, B. (1978) Identification
thermal protein aggregation in an ATP$dependent manner,
of a host protein necessary for bacteriophage morphogene$
Biochem. J., 473, 2383$2393, doi: 10.1042/BCJ20160367.
sis (the groE gene product), Proc. Natl. Acad. Sci. USA, 75,
39.
Semenyuk, P. I., Moiseenko, A. V., Sokolova, O. S.,
131$135, doi: 10.1073/pnas.75.1.131.
Muronetz, V. I., and Kurochkina, L. P. (2020) Structural
24.
Takano, T., and Kakefuda, T. (1972) Involvement of a bac$
and functional diversity of novel and known bacteriophage$
terial factor in morphogenesis of bacteriophage capsid,
encoded chaperonins, Int. J. Biol. Macromol., 157, 544$
Nat. New Biol., 239, 34$37, doi: 10.1038/newbio239034a0.
552, doi: 10.1016/j.ijbiomac.2020.04.189.
25.
Coppo, A., Manzi, A., Pulitzer, J. F., and Takahashi, H.
40.
Kurochkina, L. P., Semenyuk, P. I., Orlov, V. N.,
(1973) Abortive bacteriophage T4 head assembly in
Robben, J., Sykilinda, N. N., et al. (2012) Expression and
mutants of Escherichia coli, J. Mol. Biol., 76, 61$87,
functional characterization of the first bacteriophage$
doi: 10.1016/0022$2836(73)90081$8.
encoded chaperonin, J. Virol.,
86,
10103$10111,
26.
Georgopoulos, C. P., Hendrix, R. W., Casjens, S. R., and
doi: 10.1128/JVI.00940$12.
Kaiser, A. D. (1973) Host participation in bacteriophage
41.
Sun, Z., Scott, D. J., and Lund, P. A. (2003) Isolation and
lambda head assembly, J. Mol. Biol.,
76,
45$60,
characterisation of mutants of GroEL that are fully func$
doi: 10.1016/0022$2836(73)90080$6.
tional as single rings, J. Mol. Biol., 332, 715$728,
27.
Zweig, M., and Cummings, D. J. (1973) Cleavage of head
doi: 10.1016/S0022$2836(03)00830$1.
and tail proteins during bacteriophage T5 assembly: selective
42.
Illingworth, M., Ramsey, A., Zheng, Z., and Chen, L.
host involvement in the cleavage of a tail protein, J. Mol.
(2011) Stimulating the substrate folding activity of a single
Biol., 80, 505$518, doi: 10.1016/0022$2836(73)90418$x.
ring GroEL variant by modulating the cochaperonin
28.
Hänninen, A. L., Bamford, D. H., and Bamford, J. K.
GroES, J. Biol. Chem., 286, 30401$30408, doi: 10.1074/
(1997) Assembly of membrane$containing bacteriophage
jbc.M111.255935.
PRD1 is dependent on GroEL and GroES, Virology, 227,
43.
Illingworth, M., Salisbury, J., Li, W., Lin, D., and Chen, L.
207$210, doi: 10.1006/viro.1996.8308.
(2015) Effective ATPase activity and moderate chaper$
29.
Grimaud, R., and Toussaint, A. (1998) Assembly of both
onin$cochaperonin interaction are important for the func$
the head and tail of bacteriophage Mu is blocked in
tional single$ring chaperonin system, Biochem. Biophys.
Escherichia coli groEL and groES mutants, J. Bacteriol.,
Res. Commun., 466, 15$20, doi: 10.1016/j.bbrc.2015.
180, 1148$1153, doi: 10.1128/JB.180.5.1148$1153.1998.
08.034.
БИОХИМИЯ том 87 вып. 1 2022
ОСОБЕННОСТИ ВИРУСНЫХ ШАПЕРОНИНОВ
25
44.
Viitanen, P. V., Lorimer, G. H., Seetharam, R., Gupta,
53. Xu, Z., Horwich, A. L., and Sigler, P. B. (1997) The crystal
R. S., Oppenheim, J., et al. (1992) Mammalian mitochon$
structure of the asymmetric GroEL$GroES$(ADP)7 chap$
drial chaperonin 60 functions as a single toroidal ring,
eronin complex, Nature, 388, 741$750, doi: 10.1038/
J. Biol. Chem., 267, 695$698.
41944.
45.
Nielsen, K. L., and Cowan, N. J. (1998) A single ring is
54. Brocchieri, L., and Karlin, S. (2000) Conservation among
sufficient for productive chaperonin$mediated folding
HSP60 sequences in relation to structure, function, and
in vivo, Mol. Cell,
2,
93$99, doi:
10.1016/S1097$
evolution, Protein Sci., 9, 476$486, doi: 10.1110/ps.9.3.
2765(00)80117$3.
476.
46.
Yan, X., Shi, Q., Bracher, A., Miličić, G., Singh, A. K.,
55. Fei, X., Yang, D., LaRonde$LeBlanc, N., and Lorimer,
et al. (2018) GroEL ring separation and exchange in the
G. H. (2013) Crystal structure of a GroEL$ADP complex
chaperonin reaction, Cell,
172,
605$617.e11,
in the relaxed allosteric state at 2.7 Å resolution, Proc. Natl.
doi: 10.1016/j.cell.2017.12.010.
Acad. Sci. USA, 110, E2958$E2966, doi: 10.1073/pnas.
47.
Gomez$Llorente, Y., Jebara, F., Patra, M., Malik, R.,
1311996110.
Nisemblat, S., et al. (2020) Structural basis for active single
56. Sokolova, O., Pichkur, E., and Kurochkina, L. (2020)
and double ring complexes in human mitochondrial
Cryo$EM structure of the novel viral chaperonin, encoded
Hsp60$Hsp10 chaperonin, Nat. Commun., 11, 1916,
by gene 228 of bacteriophage AR9 Bacillus subtilis, Microsc.
doi: 10.1038/s41467$020$15698$8.
Microanal., 26, 1286$1287, doi: 10.1017/S1431927620017584.
48.
Buchner, J., Schmidt, M., Fuchs, M., Jaenicke, R.,
57. Maslova, E., Pichkur, E., Semenyuk, P., Kurochkina, L.,
Rudolph, R., et al. (1991) GroE facilitates refolding of cit$
and Sokolova, O. (2021) Abstract P$45: Structure of the
rate synthase by suppressing aggregation, Biochemistry, 30,
bacteriophage AR9 Bacillus subtilis chaperonin according
1586$1591.
to cryo$electron microscopy, Int. J. Biomed., 11, S32,
49.
Semenyuk, P. I., Orlov, V. N., and Kurochkina, L. P. (2015)
doi: 10.21103/IJBM.11.Suppl_1.P45.
Effect of chaperonin encoded by gene 146 on thermal
58. Molugu, S. K., Hildenbrand, Z. L., Morgan, D. G.,
aggregation of lytic proteins of bacteriophage EL
Sherman, M. B., He, L., et al. (2016) Ring separation
Pseudomonas aeruginosa, Biochemistry (Moscow), 80, 172$
highlights the protein$folding mechanism used by the
179, doi: 10.1134/S0006297915020042.
phage EL$encoded chaperonin, Structure, 24, 537$546,
50.
Stanishneva$Konovalova, T. B., Semenyuk, P. I.,
doi: 10.1016/j.str.2016.02.006.
Kurochkina, L. P., Pichkur, E. B., Vasilyev, A. L., et al.
59. Xu, Z., and Sigler, P. B. (1998) GroEL/GroES: structure
(2020) Cryo$EM reveals an asymmetry in a novel single$
and function of a two$stroke folding machine, J. Str. Biol.,
ring viral chaperonin, J. Struct. Biol., 209, 107439,
124, 129$141, doi: 10.1006/jsbi.1998.4060.
doi: 10.1016/j.jsb.2019.107439.
60. Bracher, A., Paul, S. S., Wang, H., Wischnewski, N., Hartl,
51.
Clare, D. K., Vasishtan, D., Stagg, S., Quispe, J., Farr,
F. U., et al. (2020) Structure and conformational cycle of a
G. W., et al. (2012) ATP$triggered conformational changes
bacteriophage$encoded chaperonin, PLoS One,
15,
delineate substrate$binding and $folding mechanics of the
e0230090, doi: 10.1371/journal.pone.0230090.
GroEL chaperonin, Cell, 149, 113$123, doi: 10.1016/j.cell.
61. Horwich, A. L., Apetri, A. C., and Fenton, W. A. (2009)
2012.02.047.
The GroEL/GroES cis cavity as a passive anti$aggregation
52.
Horwich, A. L. (2011) Protein folding in the cell: An inside
device, FEBS Lett., 583, 2654$2662, doi: 10.1016/j.febslet.
story, Nat. Med., 17, 1211$1216, doi: 10.1038/nm.2468.
2009.06.049.
STRUCTURAL AND FUNCTIONAL FEATURES
OF VIRAL CHAPERONINS
Review
L. P. Kurochkina1*, P. I. Semenyuk1, and O. S. Sokolova2
1 Belozersky Research Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e mail: lpk56@mail.ru
2 Department of Bioengineering, Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Chaperonins provide a proper folding of proteins in vivo and in vitro and, as was thought until recently, are character$
istic of prokaryotes, eukaryotes, and archaea. However, it turned out that some bacteria viruses (bacteriophages)
encode their own chaperonins. This review presents the results of investigations of the first representatives of this new
group chaperonins: the double$ring EL chaperonin and the single$ring OBP and AR9 chaperonins. A comparative
analysis of the biochemical properties and structure of phage chaperonins with each other and with other known
group I and group II chaperonins was carried out.
Keywords: chaperonin, bacteriophage, spatial structure, cryoelectron microscopy, crystallography
БИОХИМИЯ том 87 вып. 1 2022