БИОХИМИЯ, 2022, том 87, вып. 1, с. 86 - 103
УДК 577.71;576.385;575.113;612.67;575.1
ЛАБИЛЬНОСТЬ ЗАЩИТНОЙ СИСТЕМЫ КЛЕТКИ Nrf2/Keap/ARE
В РАЗЛИЧНЫХ МОДЕЛЯХ КЛЕТОЧНОГО СТАРЕНИЯ
И ВОЗРАСТНЫХ ПАТОЛОГИЯХ
Обзор
© 2022
Г.А. Шиловский1,2,3
1 Московский государственный университет имени М.В. Ломоносова,
НИИ физико"химической биологии имени А.Н. Белозерского, 119991 Москва, Россия;
электронная почта: gregory_sh@list.ru, grgerontol@gmail.com
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
3 Институт проблем передачи информации РАН, 127051 Москва, Россия
Поступила в редакцию 11.11.2021
После доработки 10.12.2021
Принята к публикации 10.12.2021
Известно, что с возрастом в организме растёт уровень окислительного стресса. Накопление повреждений,
приводящее к нарушению целостности генома, может быть причиной развития многих возрастных заболе$
ваний и появления фенотипических и физиологических признаков старения. В связи с этим большой ин$
терес вызывает система Nrf2, регулирующая экспрессию многочисленных ферментов, ответственных за ан$
тиоксидантную защиту и детоксикацию. В обзоре обобщены и проанализированы данные, касающиеся из$
менений системы Nrf2 при старении in vivo и in vitro в различных органах и тканях. Анализ литературы поз$
воляет сделать вывод, что способность Nrf2 к активации (запускаемая повышенным уровнем окислитель$
ного стресса) неуклонно снижается с возрастом. В то же время динамика активности Nrf2, измеряемая в
бесстрессовых условиях, такой чёткой направленности не имеет: во многих работах приведённые различия
статистически недостоверны, хотя точно известно, что при старении уровень окислительного стресса неук$
лонно повышается. В обзоре рассматривается роль существующих в клетке систем регуляции, ограничива$
ющих способность Nrf2 реагировать на окислительный стресс. Стареющие клетки уязвимы к окислитель$
ному повреждению из$за нарушения передачи сигналов Nrf2, и активация пути Nrf2 является перспектив$
ной мишенью для новых фармакологических или генетических терапевтических стратегий. Супрессоры
экспрессии Nrf2, такие как Keap1, c$Myc, Gsk3 и Bach1, могут способствовать возрастному нарушению ин$
дуцибельности Nrf2$регулируемых антиоксидантных генов. Понимание механизмов взаимодействия регу$
ляторных каскадов, связывающих программы поддержания гомеостаза и ответа клетки на окислительный
стресс, способствует выяснению молекулярных механизмов, лежащих в основе старения и долголетия.
КЛЮЧЕВЫЕ СЛОВА: Nrf2, Keap1, старение, продолжительность жизни, окислительный стресс,
возрастные нарушения, антиоксиданты.
DOI: 10.31857/S0320972522010067
ВВЕДЕНИЕ
ваны в геноме [1-3], несмотря на то что, с эво$
люционной точки зрения, первоочередной эво$
Продолжительность жизни (ПЖ) является
люционной «задачей» для живых организмов
такой же устойчивой видовой характеристикой,
является не долголетие как таковое, а проблемы
как размеры тела или плодовитость. Её длитель$
адаптации к окружающей среде, связанные с
ность, а также механизмы, её обеспечивающие,
нуждами выживания, обеспечения пищей и
должны быть хотя бы частично запрограммиро$
размножения. К внутренним факторам, опреде$
Принятые сокращения: АФК - активные формы кислорода; ПЖ - продолжительность жизни; УКП - удвоение
клеточной популяции; ARE - антиоксидант$респонс(ив)ный элемент (antioxidant response element); Bach1 - белок BTB
domain and CNC homolog 1; Gcl - глутаматцистеинлигаза; Gclc - каталитическая субъединица глутаматцистеинлигазы
(glutamate$cysteine ligase catalytic); Gclm - регуляторная субъединица глутаматцистеинлигазы (glutamate$cysteine modifier);
GSK3 - киназа гликогенсинтазы 3; Ho$1 - гемоксигеназа 1; Keap1 - Kelch$подобный ECH$ассоциированный белок$1
(Kelch$like ECH$associated protein 1); NIHL - потеря слуха, вызванная шумом (noise$induced hearing loss); Nqo1 -
NAD(P)H:хиноноксидоредуктаза 1; Nrf2 - транскрипционный фактор 2 семейства NFE (nuclear factor erythroid 2$related
factor 2); NSPC - предшественники стволовых нервных клеток (neural stem progenitor cells); RPE - пигментный эпителий
сетчатки; VSMC - гладкомышечные клетки сосудов (vascular smooth muscle cells).
86
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
87
ляющим ПЖ и форму кривых выживания (pace
and shape of aging), относятся программы старе$
ния и антистарения, представляющие собой, по
современным представлениям, совокупность
сигнальных генных каскадов [4]. Регуляция
поддержания гомеостаза и репарации представ$
ляет собой сложную сеть взаимозависимых ре$
акций, а эффективность этих процессов ухуд$
шается с возрастом [1-6]. Nrf2 (nuclear factor
erythroid 2$related factor 2) является ключевым
фактором транскрипции, участвующим в под$
держании окислительно$восстановительного
баланса клеток и передаче сигналов, и играет
центральную роль в снижении внутриклеточно$
го окислительного стресса, замедлении старе$
Рис. 1. Схема регуляции транскрипционного факто$
ра Nrf2, управляющего экспрессией более чем 200 цито$
ния клеток и предотвращении возрастных забо$
протекторных ферментов, ответственных за детоксика$
леваний [4-9].
цию и антиоксидантную защиту. Активация Nrf2 вызыва$
Nrf2, кроме всего прочего, является основ$
ется действием активных форм кислорода (АФК). В то же
ным регулятором клеточного гомеостаза, кото$
время активируемая многими сигнальными путями кина$
за гликогенсинтазы 3 (GSK3) оказывает подавляющее
рый контролирует поддержание стабильности
действие, ингибируя транскрипционный фактор Nrf2.
генома. Он регулирует экспрессию более 1% ге$
Светлыми линиями обозначены эффекты, стимулирую$
нов человека, связанных с реакциями биотранс$
щие активность Nrf2 (и последующую экспрессию анти$
формации, редокс$гомеостазом, энергетичес$
оксидантных ферментов); темными линиями - ингибито$
ким метаболизмом, репарацией ДНК и протеос$
ров Nrf2. Стрелкой обозначено прямое стимулирующее
воздействие, включая катализ; линией с тупым концом
тазом, а также регуляцией транскрипции анти$
обозначено ингибирующее действие. АФК - активные
оксидантных и детоксифицирующих фермен$
формы кислорода; Bach1 - белок BTB domain and CNC
тов, которые в совокупности представляют со$
homolog 1; GSK3 - киназа гликогенсинтазы 3; Keap1 -
бой мощную защитную систему клетки [4, 5].
Kelch$подобный ECH$ассоциированный белок 1 (Kelch$
Общей характеристикой таких генов является
like ECH$associated protein
1); Nrf2
- NFE2$related
factor 2 (транскрипционный фактор 2 семейства NFE);
наличие последовательности($ей) ARE (antioxi$
β$TrCP - белок, содержащий β$трансдуциновые повто$
dant response element) в промоторном участке.
ры (β$transducin repeat containing protein)
Активность Nrf2 оказывает огромное влияние
на самые разные физиологические и патологи$
ческие процессы, поэтому он подвергается
сию различных генов, связанных с воспалени$
строгой регуляции в основном на уровне ста$
ем, посредством связывания с их проксималь$
бильности белка. Nrf2 активируется окисли$
ными регуляторными областями [11]. Всё это
тельными стрессорами и электрофильными
позволяет считать его компонентом особой ан$
агентами. Продукты его генов$мишеней регули$
тивозрастной программы - хранителем периода
руют множество защитных функций, в том чис$
здоровой жизни и долголетия [5]. Согласно
ле - детоксикацию лекарств, пентозофосфат$
Skulachev et al. [4], транскрипционный фак$
ный шунт и аутофагию [7]. Nrf2 регулирует син$
тор Nrf2 является представителем одной из наи$
тез глутатиона, а также ферментов, участвую$
более явных клеточных программ антистаре$
щих в его гомеостазе, а именно: каталитичес$
ния (рис. 1).
кую (Gclc) и регуляторную глутаматцистеин$
В предыдущем обзоре [9] мы уделили внима$
модифицирующую (Gclm) субъединицы глута$
ние защитной системе Nrf2/Keap1/ARE и её ре$
матцистеинлигазы (Gcl), которые, объединяясь,
гуляции со стороны системы циркадных био$
образуют гетеродимер Gcl. Nrf2 также опосреду$
ритмов. Целью данной работы является анализ
ет индукцию некоторых других классов антиок$
данных о возрастных изменениях защитной
сидантных белков (например, тиоредоксина,
системы Nrf2/Keap1/ARE в контексте программ
пероксиредоксина, сульфиредоксина, феррити$
старения и антистарения.
на, металлотионеина и гемоксигеназы 1 (Ho$1))
С возрастом происходит ухудшение работы
и опосредует индукцию ферментов, метаболи$
антиоксидантных систем клетки, в том числе и
зирующих лекарственные средства фазы I и фа$
пути Nrf2/ARE, что приводит к снижению уров$
зы II (например, альдо$кеторедуктазы, глутати$
ня экспрессии генов$мишеней Nrf2
[5,
8,
он$S$трансферазы и NAD(P)H:хиноноксидоре$
12-17]. Это приводит к повышению уровня ак$
дуктазы 1 (Nqo1)) [10]. Также Nrf2 непосред$
тивных форм кислорода (АФК) в тканях, исто$
ственно ингибирует индуцированную экспрес$
щению глутатиона и повышенному окислитель$
БИОХИМИЯ том 87 вып. 1 2022
88
ШИЛОВСКИЙ
ному повреждению белков, ДНК и липидов
24-26 мес. хронические дегенеративные заболе$
[12, 13]. Наряду с этим растёт уровень экспрес$
вания и смертность резко возрастают [16]. По$
сии генов$мишеней NF$κB, таких как молекула
этому более старых мышей исследуют редко,
межклеточной адгезии 1 (ICAM$1) и интерлей$
чтобы свести к минимуму возможное влияние
кин$6 (IL$6) [14, 18].
на общее состояние организма развившейся
Активация пути Nrf2 состоит из нескольких
острой/хронической патологии того или иного
стадий, включая экспрессию и синтез белка
органа. Считается, что при здоровом старе$
Nrf2, его транспорт в ядро, связывание с эле$
нии (healthy aging) по физиологическому воз$
ментом ARE соответствующего гена$мишени (в
расту 6$месячная мышь эквивалентна 30$летне$
том числе и самого Nrf2), а затем экспрессии ге$
му человеку, в то время как 21$месячная мышь
на$мишени и синтеза соответствующего белка.
эквивалентна 60$летнему человеку [16]. Также
Предлагаемый в настоящей работе количест$
отметим, что практически все приведённые в
венный анализ возрастной динамики активнос$
литературе данные по изменению активности и
ти различных компонентов пути Nrf2 в различ$
экспрессии Nrf2 являются результатами не лон$
ных органах и тканях позволит выявить наибо$
гитудинальных, а поперечных (cross$sectional)
лее чувствительные к возрастным изменениям
исследований, поэтому, хотя мы, следуя сложив$
стадии этого процесса и позволит предполо$
шейся в литературе традиции, и будем пользо$
жить, какие ткани и при каких условиях экспе$
ваться термином «изменение активности и
римента наиболее устойчивы к окислительному
экспрессии Nrf2 с возрастом», надо подчерк$
стрессу за счёт индукции экспрессии генов$ми$
нуть, что речь идёт о сравнении этого показате$
шеней Nrf2, а также оценить степень компен$
ля у животных разного возраста.
сации возрастных нарушений работы этого
пути за счёт различных препаратов$активато$
ров Nrf2.
ЭКСПРЕССИЯ БЕЛКА И мРНК Nrf2
Большое число работ посвящено сравнению
И ЕГО ГЕНОВ)МИШЕНЕЙ
уровня экспрессии мРНК и белка Nrf2 и спо$
В РАЗЛИЧНЫХ ОРГАНАХ И ТКАНЯХ
собности его к активации в ответ на окисли$
тельный (электрофильный) стресс в препара$
Печень. Shih и Yen [19] изучали уровень
тах, полученных из различных тканей линей$
экспрессии Nrf2 (с помощью Вестерн$блоттин$
ных крыс (Fischer и Sprague$Dawley) и мышей
га), уровень окислительного стресса, а также ак$
(C57BL/6J) разного возраста [5, 8, 12-15, 17].
тивность и уровень экспрессии Nrf2 в экстрактах
Этот показатель, по существу, определяет уро$
печени 2$, 12$ и 18-24$мес. крыс линии Sprague$
вень активных антиоксидантных ферментов,
Dawley. Эти исследования особенно интересны,
борющихся с окислительным стрессом, усили$
так как печень характеризуется наиболее высо$
вающемся в клетках при старении in vitro и
ким уровнем антиоксидантных и детоксифици$
in vivo. Обычно в качестве свидетельства акти$
рующих ферментов, экспрессия которых нахо$
вации Nrf2 судят по активности трёх антиокси$
дится под контролем Nrf2. С возрастом увеличи$
дантных ферментов: Nqo1, Ho$1 и двух субъ$
вается уровень окислительного стресса: карбо$
единиц Gcl (Gclc и Gclm). Ещё одной характе$
нилирование белка становится в 1,5 раза выше у
ристикой функциональной активации Nrf2 яв$
12$мес. крыс и в 3 раза - у 18-24$мес. крыс, тог$
ляется увеличение количества белка Nrf2, пере$
да как показатель перекисного окисления липи$
мещённого в ядро.
дов (уровень TBARS [thiobarbituric acid reactive
Ниже мы приводим обзор работ, посвящён$
substances]) выше в 1,5 раза в возрасте 18-24 мес.
ный возраст$зависимой экспрессии белка и
по сравнению с 2$мес. крысами. При этом ак$
мРНК Nrf2 и его генов$мишеней в различных
тивность Nqo1 монотонно снижается с возрас$
органах и тканях. Обсуждаемые здесь исследо$
том и составляет ~5000 нмоль/мин/мг белка у
вания на грызунах охватывают различные воз$
2$мес. крыс, ~3000 - у 12$мес. крыс и ~1000 - у
растные периоды жизни, которые обычно со$
18-24$мес. крыс (p < 0,05). Активность каталазы
ставляют 28-32 мес. Важно, что животные, на$
не различается у
2$ и
12$мес. крыс
зываемые «старыми», могут сильно различаться
(~20 нмоль/мин/мг белка), а у 18-24$мес. со$
по возрасту в разных работах. Для мышей воз$
ставляет ~15 нмоль/мин/мг белка; (p < 0,05).
растные изменения можно представить как пе$
При этом у 2$ и 12$мес. крыс уровень экспрес$
риод созревания (2-5 мес.) и период «среднего
сии антиоксидантных ферментов не отличается
возраста» (12-24 мес.), которые характеризуют$
достоверно, но у 18-24$мес. крыс он cоставляет
ся низким уровнем смертности и заболеваемос$
53%, 60%, 62%, 69% и 72% (для глутатионперок$
ти раком, гломерулонефритом и другими деге$
сидазы, глутатионредуктазы, Nqo1 и каталазы
неративными заболеваниями. В возрасте
соответственно) по сравнению с 2$мес. крысами
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
89
(p < 0,05). При этом уровень экспрессии Nrf2 в
Уровень белка Nrf2, а также белка Ho$1 (опреде$
печени также не различается у 2$ и 12$мес. крыс;
ляемых с помощью Вестерн$блоттинга) в астро$
а для крыс 18-24 мес. - более чем в 2 раза ниже
цитах спинного мозга у 13$мес. мышей C57Bl6/J
по сравнению с 2$мес. животными (p < 0,05).
был вдвое ниже, чем у
1$мес. животных
Сходные результаты получены в работе
(p < 0,05). При этом не было выявлено различий
Suh et al. [12], показавшими (Вестерн$блоттинг)
в этих показателях у 1$ и 5$мес. животных. Так$
снижение общего уровня Nrf2 (на
56,2%,
же не было выявлено достоверных различий в
p < 0,001) с одновременным сопоставимым сни$
уровне экспрессии Nqo1 во всех исследованных
жением ядерного (т.е. транскрипционно актив$
возрастах. Кроме того, сравнивали уровни
ного) (на 51,7%, p < 0,0001) уровня Nrf2 у старых
экспрессии этих белков в стационарной культу$
крыс Fischer 344 (24-28 мес.) по сравнению с
ре астроцитов спинного мозга после 14, 30 и
молодыми (2-5 мес.). Связывание Nrf2 с кон$
60 сут. культивирования (с заменой среды 2 раза
сенсусной последовательностью ARE в ядерных
в неделю). Уровень экспрессии белка Nrf2 (а
экстрактах печени старых крыс также было ни
также белка Nqo1) в 60$сут. астроцитах был
же (примерно на 40%), чем у молодых живот$
вдвое ниже, чем в 14$сут. клетках (p < 0,05). При
ных (анализ гель$шифт). Снижение транскрип$
этом достоверных различий в этих показателях в
ционной активности Nrf2 вызывает снижение
14$ и 30$сут. клетках выявлено не было. В отли$
синтеза глутатиона [12].
чие от Nqo1, уровень экспрессии белка Ho$1 в
В одном из самых объёмных исследований,
30$ и 60$сут. астроцитах был в 2,3 и 4 раза ниже,
проведённом Xu et al. [17], изучали изменение
чем в 14$сут. клетках (p < 0,05).
работы системы Nrf2 в образцах печени крыс
Бронхи. Используя (видимо, впервые) пер$
Sprague$Dawley, собранных в 11 возрастных точ$
вичные эпителиальные клетки бронхов челове$
ках (пренатальные (-2), а также 1, 7, 14, 21, 28,
ка от доноров разных возрастов, Zhou et al. [21]
35, 60, 180, 540 и 800 сут. после рождения). По$
подтвердили предыдущие исследования других
казали, что экспрессия мРНК, определяемая
авторов, проведённые на животных, и показали,
RT$PCR этих генов (Gclm, Nqo1, Ho"1), равно
что базальная экспрессия белка NRF2 ниже у
как и Nrf2 и Kelch$подобного ECH$ассоцииро$
пожилых людей (60-69 лет), чем у молодых
ванного белка$1 (Keap1), была высокой в пече$
(25-29 лет). В то же время базальная экспрессия
ни плода, снижалась при рождении, достигала
трёх репрезентативных генов$мишеней NRF2
первого пика в семидневном возрасте и затем
(GCLC, GCLM и NQO1) была выше у пожилых,
постепенно снижалась до 6$месячного возраста
чем у молодых [21].
(p < 0,001). Экспрессия всех этих генов остава$
Мышцы. С возрастом у крыс Fischer 344 на$
лась на высоком уровне до возраста 18 мес., но
капливаются дефектные митохондрии с пов$
затем снижалась до возраста 26 мес. Экспрессия
реждением митохондриальных крист, набухани$
белков (Вестерн$блоттинг) Nrf2, Nqo1, Ho$1,
ем и образованием внутримитохондриальных
Gclc и Gclm изменялась сходным образом.
вакуолей [22]. Уровень АФК был в 1,36 раза вы$
Smith et al. [20] показали, что в культивируе$
ше в ткани языка у старых крыс (22 мес.), чем у
мых гепатоцитах молодых (4-6 мес.) и старых
молодых (7 мес.), p = 0,001, а уровень белка Nrf2
(24-28 мес.) крыс Fischer 344 нет различий в
(Вестерн$блоттинг) - в 1,75 раза ниже у старых
уровне мРНК Nrf2 (p > 0,05). При этом содержа$
животных (22 мес.) по сравнению с молодыми
ние белка Nrf2 и базальная и индуцированная
(7 мес.), p = 0,021 [22].
анетолтритионом (A3T) экспрессия Nrf2$зави$
Сердечно)сосудистая система. С возрастом
симых генов была ниже в гепатоцитах старых
уменьшается активность связывания Nrf2-ARE
животных. И, наоборот, сверхэкспрессия Nrf2 в
в сердце [23]. Вестерн$блоттинг выявил почти
клетках старых животных восстанавливала ин$
троекратное снижение уровня Nrf2 с возрастом
дукцию генов. Дополнительная серия экспери$
(1,0 ± 0,18 в ядерных экстрактах миокарда моло$
ментов позволила выявить шесть микроРНК,
дых мышей C57/Bl6/SJ (2 мес.) по сравнению с
содержание которых увеличивается с возрастом
0,35 ± 0,12 у старых (>23 мес.)). Также в сердце
более чем в 2 раза (p < 0,05). Предполагается, что
на 40% снижена экспрессия антиоксидантных
одна из них, miRNA$146a, связывает мРНК
генов$мишеней [23].
Nrf2. Трансфекция гепатоцитов молодых крыс$
Возрастная дисфункция Nrf2 в эндотелиаль$
миметиком miRNA$146a вызывала ослабление
ных клетках изменяет передачу сигналов и спо$
трансляции Nrf2 на 55%, что соответствовало
собствует развитию сосудистых заболеваний
возрастной потере Nrf2 [20].
[24]. Индукция программ старения в мозговых
Спинной мозг. Duan et al. [8] изучали возраст$
артериях связана с активацией широкого спект$
ные изменения экспрессии белков Nrf2, Ho$1,
ра воспалительных цитокинов и хемокинов,
Nqo1 с использованием моделей in vitro и in vivo.
вносящих вклад в развитие ассоциированного
БИОХИМИЯ том 87 вып. 1 2022
90
ШИЛОВСКИЙ
со старением секреторного фенотипа (SASP).
как$резус Macaca mulatta по сравнению с моло$
Уровень экспрессия молекулярных маркёров
дыми (10,5 ± 0,9 года) в 6 раз выше содержание
старения (p16INK4a, p21) выше в мозговых ар$
8$изо$PGF2α (8$изопростагландина F2α, био$
териях старых (24 мес.) мышей C57BL/6J, по
маркёра перекисного окисления липидов). Так$
сравнению с молодыми (3 мес.) [25].
же у них в 1,8 раза выше уровень 4$HNE (4$гид$
Ungvari et al.
[14] сравнивали уровень
рокси$2$ноненаль
[окисленный вторичный
экспрессии мРНК и белка Nrf2 и его генов$ми$
продукт, который образует стабильный аддукт с
шеней в аорте 3$, 12$, 18$, 24$ и 28$месячных
белками]) и усилено воспаление (повышена ак$
крыс Fischer 344х Brown Norway (F344xBN).
тивность NF$κB). Уровень антиоксидантов глу$
Анализ интенсивности ядерной флуоресценции
татиона и аскорбата при этом ниже соответ$
с помощью редокс$чувствительного флуоресцент$
ственно в 4 и 8 раз у старых животных, чем у мо$
ного красителя дигидроэтидия (dihydroethidi$
лодых. Однако это возрастное усиление окисли$
um, DHE) показал значительное возрастное уве$
тельного стресса не вызывало активации Nrf2
личение продукции O– в аорте крыс. Показали,
(отсутствовали достоверные различия в уровне
что в сосудах старых крыс наблюдается преиму$
мРНК и белка Nrf2 и его генов$мишеней (Nqo1,
щественно цитоплазматическое окрашивание
Gclc и Ho$1). Возможно, это является следстви$
на Nrf2, тогда как окрашивание на Nrf2 в ядре
ем возраста сравниваемых животных (обезьяны,
гораздо менее выражено, и этот показатель схо$
названные старыми, прожили лишь около поло$
ден в артериях молодых и старых животных
вины своей видовой ПЖ) [15].
(3 мес.). Таким образом, с возрастом сокращает$
Основные данные по возрастному измене$
ся именно ядерная фракция Nrf2, ответственная
нию активности Nrf2 приведены в таблице
за связывание с ARE и активацию транскрип$
(см. далее). Видно, что, несмотря на данные
ции ферментов антиоксидантной защиты и
промежуточных возрастов (возрастную динами$
II фазы детоксикации. Уровень связывания Nrf2
ку) и различия в выбранных возрастах [самых]
с ARE (определяемый ELISA) в ядерных
молодых и старых животных, с возрастом прак$
экстрактах артерий был вдвое ниже у 12$мес.
тически во всех исследованных тканях имеет
крыс по сравнению с 3$мес. и сохранялся на
место снижение экспрессии мРНК и белка Nrf2
этом уровне во всех исследованных возрастах
(и его генов$мишеней) в 2-4 раза. Наибольшее
(p < 0,05). Содержание ядерного Nrf2 в аорте
снижение показано для мышц, что соответству$
снижается с возрастом параллельно со сниже$
ет их статусу наиболее метаболически активной
нием общего (цитоплазма + ядро) уровня Nrf2,
ткани. Наиболее устойчивыми к уменьшению
однако достоверное (p < 0,05) снижение мРНК
уровня Nrf2 оказываются, по всей видимости,
(70% от уровня, характерного для 3$мес. крыс) и
клетки сосудистого эндотелия (таблица). При$
белка Nrf2 (30% от уровня, характерного для
мечательно, что при получении из тканей раз$
3$мес. крыс) наблюдается лишь начиная с воз$
ного возраста первичных культур (т.е. смены ок$
раста 24 мес. Сходную возрастную динамику
ружения) результаты могут быть прямо проти$
экспрессии мРНК (RT$PCR) и белка (Вестерн$
воположными (см., например, [13, 21, 26-28]).
блоттинг) наблюдали и для генов$мишеней
В клетках, полученных из тканей старых живот$
Nrf2. У 24$мес. крыс по сравнению с 3$мес. кры$
ных, уровень мРНК и белка Nrf2 будет выше,
сами уровень экспрессии мРНК Gclc снижен
чем в клетках от молодых животных, что согла$
до 60% (p < 0,05). Снижение уровня экспрессии
суется с тем представлением, что Nrf2 активиру$
мРНК Nqo1 и Ho1 до 70% и 60% соответственно
ется (а большинство регулирующих его систем в
было достоверным уже для 12$мес. животных
клетке инактивируются) окислительным стрес$
(p < 0,05 по сравнению с 3$мес. крысами). Уро$
сом (рис. 1). Аналогично, более высокому уров$
вень экспрессии белка Gclc был снижен до
ню окислительного стресса должны соответ$
~70%, а Nqo1 - до 25% у 24$мес. крыс по срав$
ствовать и более высокий уровень Nrf2, и более
нению с 3$мес. [14]. Ungvari et al. наблюдали, что
высокий уровень продуктов индуцируемых им
базальный уровень мРНК Gclc в сегменте аорты
генов антиоксидантной защиты. Ещё одним ин$
оставался стабильным с 3 до 18 мес. и начинал
тересным примером влияния окружения на сис$
снижаться с 24 мес. и индуцировался в ответ на
тему Nrf2 являются физические упражнения.
H2O2 у молодых (3 мес.), но не старых (24 мес.)
Так, в работе Safdar et al. [13] показано, что у по$
крыс.
жилых (~70 лет) людей, ведущих активный об$
В другом исследовании, проведённом в этой
раз жизни, уровень белка NRF2 не только не
же лаборатории и с использованием тех же под$
снижается по сравнению с таковым у взрослых,
ходов, обнаружили значительное увеличение с
но даже повышается. Аналогичные данные по$
возрастом уровня окислительного стресса [15].
лучены для получающих физическую нагрузку
В сонных артериях старых (22,2 ± 1,7 года) ма$
крыс [26].
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
91
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ
незе возрастной дегенерации жёлтого пятна, од$
СПОСОБНОСТИ СИСТЕМЫ Nrf2/ARE
ного из наиболее распространённых возрастных
К АКТИВАЦИИ ПОД ВЛИЯНИЕМ
глазных заболеваний [28]. Sachdeva et al. [28]
ЭКЗОГЕННОГО И ЭНДОГЕННОГО
сравнивали RPE молодых (2 мес.) и старых
ОКИСЛИТЕЛЬНОГО СТРЕССА
(15 мес.) мышей C57Bl6/J в бесстрессовых и
стрессовых (йодат натрия (NaIO3, 5 мг/кг)) ус$
Культивирование клеток на среде с глюкозой.
ловиях. В бесстрессовых условиях в RPE старых
С возрастом меняется способность клеток реа$
(15 мес.) мышей уровень экспрессии (определя$
гировать на окислительный стресс и способ$
емый RT$qPCR) генов$мишеней Nrf2 (Nqo1
ность к активации Nrf2 (как главного регулято$
и Ho"1) был соответственно в 11 и 10 раз выше,
ра высокоскоординированного антиоксидант$
чем у молодых (2 мес.) (p < 0,05). Это указывает
ного ответа). В упомянутой выше работе
на возрастное усиление базального окислитель$
Ungvari et al. [15], в культивируемых на ранних
ного стресса и показывает, что RPE старых мы$
(четвёртом$пятом) пассажах клетках гладких
шей более уязвимы к окислительному повреж$
мышц сосудов (vascular smooth muscle cells,
дению из$за нарушения передачи сигналов Nrf2.
VSMC) из молодых (10,5 ± 0,9 года) Macaca
В RPE молодых мышей обработка NaIO3 инду$
mulatta, обработка глюкозой в высокой концен$
цировала
2,2$кратное увеличение уровня
трации (30 мМ) или H2O2 (14-100 мкМ) значи$
мРНК Nrf2 и соответствующее увеличение
тельно увеличивает транскрипционную актив$
уровня транскриптов Gclm, Ho$1 и Nqo1 (в 2, 9
ность Nrf2 и усиливает экспрессию генов$ми$
и 10 раз соответственно). Тем не менее NaIO3 не
шеней Nrf2. Напротив, в культивируемых клет$
стимулировал индукцию мРНК Nrf2 в RPE у
ках гладких мышц сосудов, полученных от ста$
старых мышей (15 мес.) (р < 0,05) [28]. Кроме то$
рых макак (22,2 ± 1,7 года), индуцирован$
го, в RPE старых мышей, подвергшихся воздей$
ная H2O2 и глюкозой в высокой концентрации,
ствию йодата натрия, наблюдали более высокий
активность Nrf2 и экспрессия генов$мишеней
уровень супероксид$аниона и малонового ди$
Nrf2 не выражена. Это говорит о сниженной
альдегида, чем у молодых, что в совокупности
способности клеток старых животных реагиро$
свидетельствует о недостаточной защите от
вать на окислительный стресс. Ungvari et al. [14]
окислительного повреждения. Наоборот, сверх$
изучали индукцию Nqo1 в аорте в ответ на
экспрессия Nrf2 в RPE сохраняет морфологию
H2O2 и глюкозу и обнаружили, что индукция
клеток и улучшает выживаемость у мышей в мо$
Nqo1 снижалась в аорте старых крыс (24 мес.
делях дегенерации сетчатки и является потенци$
против 3 мес.). Также они продемонстрировали,
альным терапевтическим средством для лечения
что, хотя уровень экспрессии Nqo1 не изменял$
заболеваний, связанных с дегенерацией
ся, её индукция в ответ на H2O2 была невелика в
RPE [29].
сонной артерии и VSMC у старых (20 лет) по
Компенсация возрастных изменений активато)
сравнению с молодыми макаками$резус (10 лет).
рами Nrf2. Одним из общепринятых способов
В VSMC, полученных от старых (24 мес.)
компенсации такого рода снижения является
крыс Fischer 344, уровень белка Nrf2 в ядре (но
применение веществ, активирующих Nrf2.
не в цитоплазме) был выше, чем в VSMC моло$
Обычно это достигается за счёт применения со$
дых (6 мес.) [27]. Это справедливо как для
единений, взаимодействующих с тиольными
VSMC, выращенных в обычной среде (содержа$
группами цистеинов главного ингибитора Nrf2,
щей 5 мМ глюкозы) (p = 0,02), так и в среде с
Keap1 [7, 10, 30].
высоким содержанием глюкозы
(12,5
мМ,
Липоевая кислота. Показано, что (R)$альфа$
p = 0,01). В VSMC, подвергнутых воздействию
липоевая кислота индуцирует активацию Nrf2
глюкозы (25 мМ, 24 ч), связывание Nrf2 с ARE
in vitro и повышает уровень глутатиона in vivo,
было на 54,5 ± 14,1% выше в VSMC старых крыс;
видимо, за счёт образования липоил$цистеи$
в то время как в контрольных VSMC (выращен$
нильных смешанных дисульфидов на ингибито$
ных на 5 мМ глюкозе) оно было на 33,5 ± 17,4%
ре Nrf2, Keap1, препятствующих его связыва$
выше в старом возрасте, приводя к более высо$
нию с Nrf2. Ещё одним предполагаемым меха$
кому уровню экспрессии гена Gclc [27]. Таким
низмом является опосредованная через фосфо$
образом, у старых животных снижается как ба$
рилирование протеинкиназой С активация Nrf2
зальный ядерный уровень Nrf2, так и индукция
[10]. У старых (24-28 мес.) крыс Fischer 344 ли$
в ответ на H2O2 и глюкозу.
поевая кислота (40 мг/кг внутрибрюшинно) уве$
Окислительный стресс в пигментном эпителии
личивала уровень ядерного Nrf2, связывание
сетчатки (RPE). Моделирование возрастных де$
Nrf2 с ARE и соответствующее повышение
генеративных изменений сетчатки важно для
уровня Gclc (в 1,7 раза) (в то время как Gclm не
изучения роли окислительного стресса в патоге$
индуцировалась), а также и активности Gcl (че$
БИОХИМИЯ том 87 вып. 1 2022
92
ШИЛОВСКИЙ
рез 24 ч после введения) до уровня, наблюдае$
У старых мышей (>24 мес.) наблюдалось значи$
мого у молодых (2-5 мес.) животных [12].
тельное повышение уровня АФК, а также сни$
Сульфорафан. Ещё один активатор Nrf2, со$
жение уровня глутатиона в скелетных мышцах у
держащийся в крестоцветных изотиоцианат
Nrf2-/- по сравнению с молодыми. Кроме того,
сульфорафан (в пище в течение 12 недель), вчет$
признаки окислительного стресса (уровень
веро повышает уровень экспрессии мРНК
АФК, HNE$позитивных белков, убиквитиниро$
Nrf2 (RT$qPCR) в сердце у старых мышей
вания и проапоптотических сигналов) указыва$
C57BL/6 (21-22 мес.) (0,17 ± 0,06 и 0,67 ± 0,13;
ют на то, что скелетная мускулатура старых мы$
p < 0,001)), а у молодых мышей - в 6 раз
шей гораздо более уязвима к нарушению регуля$
(0,35 ± 0,04 и 2,12 ± 0,50; p < 0,0001), а в скелет$
ции пути Nrf2. Kitaoka et al. [34] продемонстри$
ных мышцах - в 2 раза у молодых мышей
ровали, что митохондриальные маркёры окис$
(0,90 ± 0,37 и 1,77 ± 0,82; p < 0,01) и почти в
лительного стресса (гидроксиноненаль и белко$
3,5
раза у старых мышей
(0,26
± 0,07 и
вые карбонилы) были значительно повышены у
0,90 ± 0,40; p < 0,05). Интересно отметить, что
старых мышей с нокаутом Nrf2 (Nrf2-/-) из$за
при этом уровень экспрессии Nrf2 у старых мы$
снижения экспрессии антиоксидантных генов
шей, получавших сульфорафан с пищей, в 2 ра$
Nrf2$мишеней. Митохондриальное дыхание
за превышает (в сердце) и равен (в скелетных
снижалось с возрастом; однако не было разли$
мышцах) уровню экспрессии Nrf2 у молодых
чий между мышами Nrf2-/- и дикого типа соот$
здоровых мышей, не получавших сульфорафан.
ветствующего возраста. Точно так же активность
Связывание Nrf2/ARE (определяемое с по$
цитохромоксидазы с была ниже у старых мышей
мощью Nrf2$DNA$binding ELISA kit) ниже в
дикого типа и Nrf2-/- по сравнению с молодыми
2,1 раза в сердце и в 1,9 раз в скелетных мышцах
мышами дикого типа. Продукция АФК митохон$
у старых мышей по сравнению с молоды$
дриями в расчёте на потребляемый кислород
ми (p < 0,001). Сульфорафан улучшает также
была увеличена у старых мышей Nrf2-/-. Тем не
связывание Nrf2/ARE в 1,225 и в 1,17 раза
менее нокаут Nrf2 не влиял на возрастное сни$
(p < 0,05) у молодых мышей (в сердце и скелет$
жение мышечной массы, приведённой к массе
ных мышцах соответственно). Интересно, что,
тела. Эти результаты предполагают, что дефицит
хотя уровень связывания Nrf2 у старых мышей,
Nrf2 усугубляет возрастной окислительный
получавших с пишей сульфорафан, увеличился
стресс митохондрий, но не влияет на снижение
в 1,67 раза в сердце (p < 0,01) и в 2,08 раза в ске$
дыхательной функции в скелетных мышцах [34].
летных мышцах (p < 0,001), он не достиг уровня,
Возрастные нарушения слуха. Иммунореак$
характерного для молодых здоровых мышей, не
тивность Nrf2 обнаруживается у человека пре$
получавших сульфорафан. Кроме того, сульфо$
имущественно в апикальной, медиальной и ба$
рафан улучшает общее физическое состояние
зальной областях, во внутренних и внешних во$
организма: сердечную функцию, способность к
лосковых клетках и поддерживающих клетках
физической нагрузке, митохондриальную функ$
кортиева органа в улитке [35, 36]. Для изучения
цию, толерантность к глюкозе и актива$
возможных возрастных различий иммунореак$
цию/дифференцировку сателлитных клеток
тивности Nrf2 в кортиевом органе у людей
скелетных мышц до уровня, характерного для
18-92 лет, разделённых на группу взрослых
молодых (2 мес.) мышей [31].
(<70 лет) и пожилых (70-92 года). Для каждого
Трет бутилгидрохинон. Тем не менее эффек$
образца средние значения площади иммунореа$
тивность активации Nrf2 также зависит от воз$
гировавшей области усредняли и подвергали од$
раста. Время, в течение которого Nrf2 остаётся
ностороннему повторному анализу измере$
активным, зависит от стимула, генерируемого
ний (ANOVA). Показали, что иммунореактив$
индуктором, а также от возраста животных. Так,
ность Nrf2 в кортиевом органе сохраняется и у
трет$бутилгидрохинон (tBHQ) способствует
самого старого человека в рассмотренной груп$
связыванию Nrf2 с ARE лишь в течение 30 мин в
пе (92 года), но снижена на 20% у пожилых (в
первичных астроцитах, полученных от старых
группе старше 70 лет, p ≤ 0,0372) [36]. Потеря
крыс Wistar (24 мес.). В то же время астроциты,
слуха, вызванная шумом (noise$induced hearing
выделенные из молодых (9 мес.) крыс, поддер$
loss, NIHL), является одним из наиболее рас$
живают этот ответ до 180 мин [32].
пространённых нейросенсорных нарушений слу$
Инактивация Nrf2 в моделях возрастных пато)
ха. Патогенез NIHL тесно связан с ишемичес$
логий. Miller et al. [33] показали, что уровни
ким реперфузионным повреждением улитки,
мРНК и белка Nqo1 были резко (p < 0,001) сни$
которое вызвано уменьшением кровотока и вы$
жены в скелетных мышцах у двухмесячных мы$
работкой свободных радикалов из$за чрезмер$
шей Nfe2l2-/- (далее обозначаемых Nrf2-/-) по
ного шума [35]. Повреждение и потеря волоско$
сравнению с мышами C57/BL6х дикого типа.
вых клеток, вызванные окислительным стрес$
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
93
сом, считаются важными причинами потери
сенесцентными (в отличие от контрольных).
слуха и тесно связаны с антиоксидантным стату$
Действие этого вещества опосредуется систе$
сом клетки и Nrf2 [35, 36]. Нокаут Nrf2 делает
мой Nrf2/Keap1, втрое повышая уровень Nrf2 и
органы слуха (и волосковые клетки, в частнос$
втрое понижая уровень Keap1 [40].
ти) гораздо более чувствительными к воздей$
В соответствии с этим, Nrf2-/-$фибробласты
ствию шума [37]. Нарушение слуха через 7 дней
имеют короткую ПЖ
[41]. Кроме того,
после воздействия были значительно больше у
Jуdar et al. [41] показали, что Nrf2-/- эмбрио$
мышей Nrf2-/-, чем у мышей дикого типа. Акти$
нальные фибробласты мыши (MEF) склонны к
ватор Nrf2, CDDO$Im (2$циано$3,12$диоксо$
иммортализации после 15 УКП. Напротив, по$
олеана$1,9$диен$28$имидазол), при примене$
казано, что селективные активаторы Nrf2, такие
нии до, но не после воздействия шума, сохранял
как рапамицин [42], предотвращают клеточное
целостность волосковых клеток и улучшал уро$
старение и даже увеличивают ожидаемую ПЖ в
вень слуха после воздействия у мышей дикого
нормальных MEF [43]. Регулируемые Nrf2 фер$
типа, но не оказывал воздействия у мышей
менты, такие как супероксиддисмутаза 1 (Sod1),
Nrf2-/-. Это подтверждает эффективность акти$
также способны предотвращать старение и вос$
вации Nrf2 для предотвращения NIHL за счёт
паление в некоторых условиях [44]. Сенесцент$
защиты улитки от повреждений, вызванных шу$
ные клетки, в свою очередь, способствуют воз$
мом [38].
растной патологии и потере функции, а их изби$
Valcarcel$Ares et al. [39] показали, что подав$
рательное удаление улучшает физиологическую
ление сигнального пути Nrf2 (нокдаун siRNA
функцию и увеличивает ПЖ [42]. В мозговых
Nrf2 или сверхэкспрессия ингибитора Nrf2 -
артериях 24$месячных мышей уровень экспрес$
Keap1) нарушает ангиогенные процессы в куль$
сии p16INK4a и p21 повышен по сравнению с
тивируемых коронарных артериях эндотелиаль$
таковым у молодых контрольных животных [25].
ных клеток человека, вызывает нарушение про$
Corenblum et al. [45] показали, что, хотя
лиферации и адгезии к гликопротеину витро$
функция предшественников стволовых нервных
нектину и коллагену в эндотелиальных клетках
клеток (neural stem progenitor cells, NSPC) пос$
коронарных артерий. Нарушение передачи сиг$
тоянно снижается с возрастом у крыс Fisher 344,
налов Nrf2 также снижает клеточную миграцию
существует критический период времени в сред$
и нарушает способность эндотелиальных клеток
нем возрасте (13-15 мес.), когда происходит
коронарных артерий формировать капилляро$
резкое снижение выживаемости и регенера$
подобные структуры [39].
ции NSPC. Этот специфический временной
Клеточное старение и экспрессия молекуляр)
паттерн ухудшения NSPC сопровождается сни$
ных маркеров старения. Kapeta et al. [40] изучали
жением экспрессии Nrf2 (p < 0,05), после чего
функцию Nrf2 в модели репликативного старе$
(как и до этого возраста) не наблюдается значи$
ния фибробластов лёгких человека HFL$1.
мых изменений этого показателя, до возраста
Кратко, фибробласты пересевали (1 : 2) по дос$
26 мес. При подавлении экспрессии Nrf2 в «мо$
тижении монослоя и через определенное число
лодых» NSPC (с помощью коротких интерфери$
удвоений клеточной популяции (УКП, опреде$
рующих РНК) выживание и регенерация NSPC
ляемое по формуле ln(Nf/Ni)/ln2, где Nf - ко$
значительно нарушается. Напротив, сверхэкс$
нечное количество клеток после пересева, а
прессия Nrf2 в «старых» NSPC делает их похо$
Ni - начальное количество посеянных жизнес$
жими на «молодые», и они демонстрируют по$
пособных клеток) становятся репликативно
вышенную выживаемость и регенерацию. Кро$
старыми (неспособными за определенный срок
ме того, пролиферативный и нейрогенный по$
удвоить свою численность). В репликативно
тенциал NSPC также нарушен у мышей
старых фибробластах HFL$1 (42 УКП) был вы$
Nrf2-/- [45].
ше уровень окислительного стресса и призна$
В ещё одной модели старения, вызванного
ков старения (процент клеток, окрашиваемых
окислительным стрессом (SIPS, stress$unduced
на ассоциированную со старением β$галактози$
premature senescence), признаки клеточного ста$
дазу, и уровень экспрессии белков$маркёров
рения были менее выражены (по сравнению с
старения (p16INK4a, p21)) [40]. Также в HFL$1
контролем) при инактивации ещё одного инги$
снижены уровень белка
(~65%) и мРНК
битора Nrf2, кавеолина$1, препятствующего пе$
(45%) Nrf2 по сравнению с молодыми, а также
ремещению Nrf2 в ядро (с увеличением в 2 раза
уровень экспрессии Nqo1, гена$мишени Nrf2.
уровня экспрессии Nrf2). Интересно, что угне$
В дополнительной серии экспериментов пока$
тающее действие кавеолина$1 на Nrf2 не опос$
зали, что молодые фибробласты HFL$1, обра$
редуется активностью Keap1 [46].
ботанные индуктором Nrf2, тритерпеноидом
Связь активности Nrf2 с продолжительностью
18$глицирретиновой кислотой, не становятся
жизни и долголетием. Nrf2 является важным ре$
БИОХИМИЯ том 87 вып. 1 2022
94
ШИЛОВСКИЙ
гулятором ПЖ [47-50]. Предполагается, что
гией и противодействующего протеасомной де$
долгоживущие виды имеют активный цитопро$
градации Nrf2) и β$TrCP (E3 убиквитинлигазы),
тективный путь Nrf2. Сверхэкспрессия нижеле$
способствующего протеасомной деградации Nrf2
жащих компонентов сигнального пути Nrf2
[5] (см. далее). Из других физиологических адап$
продлевает ПЖ дрозофилы [48]. Долгоживущие
таций, связанных с Nrf2, можно отметить повы$
модели Caenorhabditis elegans также демонстри$
шение в
1,5
раза у
13$полосного суслика
руют повышенную экспрессию Skn$1, гомоло$
Spermophilus tridecemlineatus конститутивного
га Nrf2 [49]. Активность Nrf2 является важным
уровня Nrf2, а также нижележащих компонентов
регулятором ПЖ и у позвоночных [50]. Тем не
пути Nrf2 при подготовке к спячке, и возвраще$
менее общий белок Nrf2 не обязательно умень$
ние этих показателей к нормальному уровню пос$
шается с возрастом. Так, например, уровень бел$
ле возвращения к активному образу жизни [52].
ка Nrf2 (и его транслокация в ядро) были сход$
Основные данные по возрастному измене$
ными в сердце у взрослых и старых крыс в отсу$
нию уровня белка Nrf2 приведены на рис. 2.
тствие окислительного стресса (однако эффек$
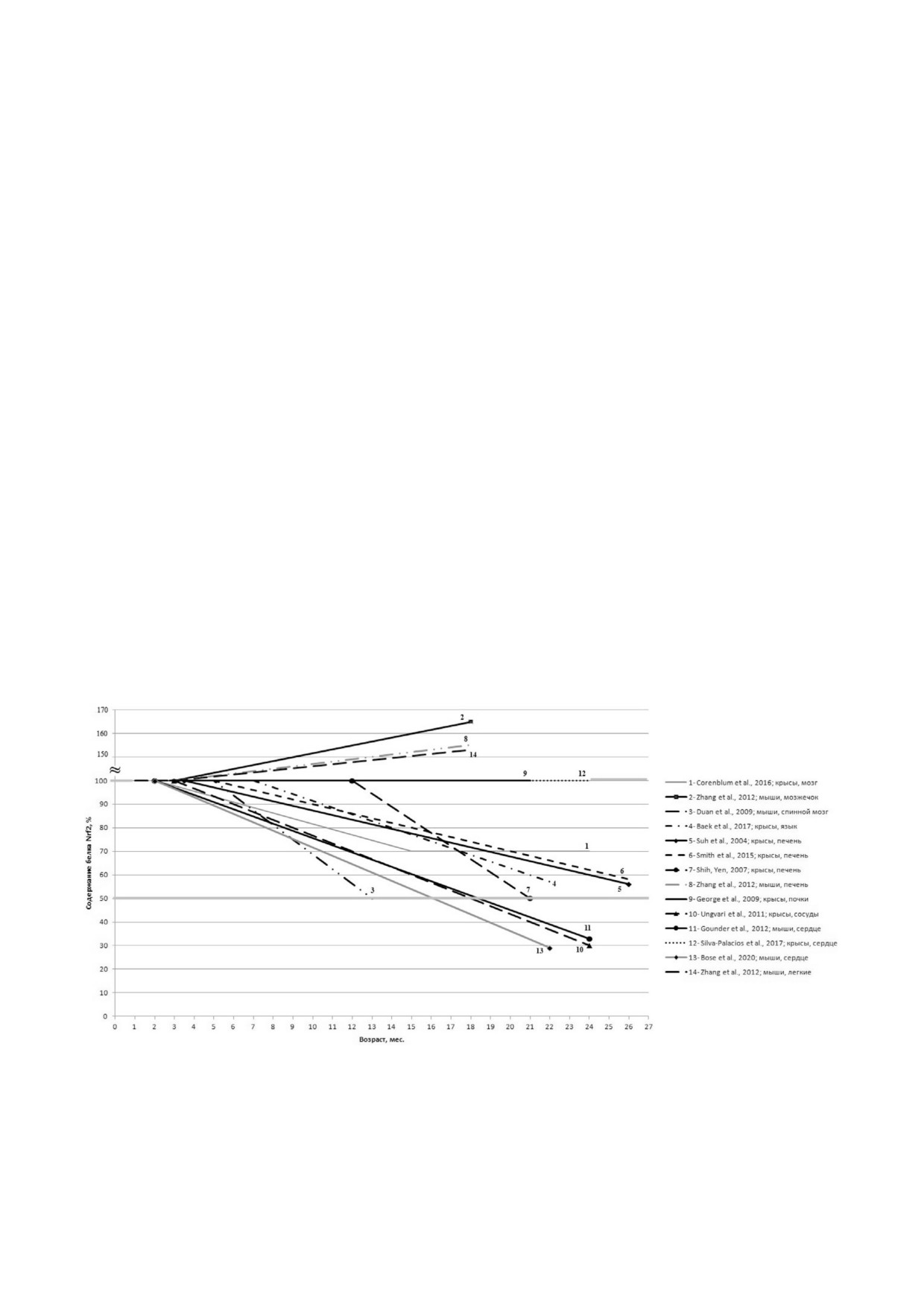
Видно, что, несмотря на данные промежуточ$
тивность связывания Nrf2-ARE была наруше$
ных возрастов (возрастную динамику) и разли$
на, снижая экспрессию основных антиоксида$
чия в выбранных возрастах [самых] молодых и
нтных ферментов$мишеней (Ho$1, Gst и
старых животных, с возрастом снижение белка
Gcl) [51].
Nrf2 выражено в меньшей степени в печени (ос$
Также и содержание Nrf2 у долгоживущего го$
новном месте антиоксидантной зашиты и де$
лого землекопа Heterocephalus glaber было сопо$
токсикации организма), причём содержание
ставимым с таковым у других видов грызунов с
белка не падает ниже 50% от исходного уровня.
меньшей видовой ПЖ [5]. Lewis e al. [5] предпо$
Постоянным снижением характеризуется со$
ложили, что защитная функция зависит не столь$
держание белка Nrf2 в сердечно$сосудистой
ко от содержания Nrf2, сколько от его активнос$
системе, тогда как органы нервной системы за$
ти. Важным событием в этом случае является
нимают промежуточное положение.
снижение уровня Keap1, позволяющее избежать
Далее мы сопоставили эти данные с измене$
убиквитинирования Nrf2 и последующей протеа$
нием других этапов активации Nrf2 (включая уро$
сомной деградации. Кроме того, они также пред$
вень экспрессии гена Nfe2l2, кодирующего Nrf2, и
положили важную роль двух других регуляторов
его генов$мишеней, а также связывание Nrf2
Nrf2: p62/SQSTM1 (белка, связанного с аутофа$
c ARE). Результаты собраны в итоговой таблице.
Рис. 2. Возрастные изменения содержания белка Nrf2 у лабораторных крыс и мышей. За 100% принят уровень белка Nrf2
у молодых животных. Представлены данные следующих работ: 1 - Corenblum et al. 45], мозг; 2 - Zhang et al. [67], мозг
(мозжечок); 3 - Duan et al. [8], спинной мозг; 4 - Baek et al. [22], язык; 5 - Suh et al. [12], печень; 6 - Smith et al. [20], пе$
чень; 7 - Shih and Yen [19], печень; 8 - Zhang et al. [67], печень; 9 - George et al. [26], почки; 10 - Ungvari et al. [14], сосу$
ды; 11 - Gounder et al. [23], сердце; 12 - Silva$Palacios et al. [51], сердце; 13 - Bose et al. [31], сердце; 14 - Zhang et al. [67],
лёгкие
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
95
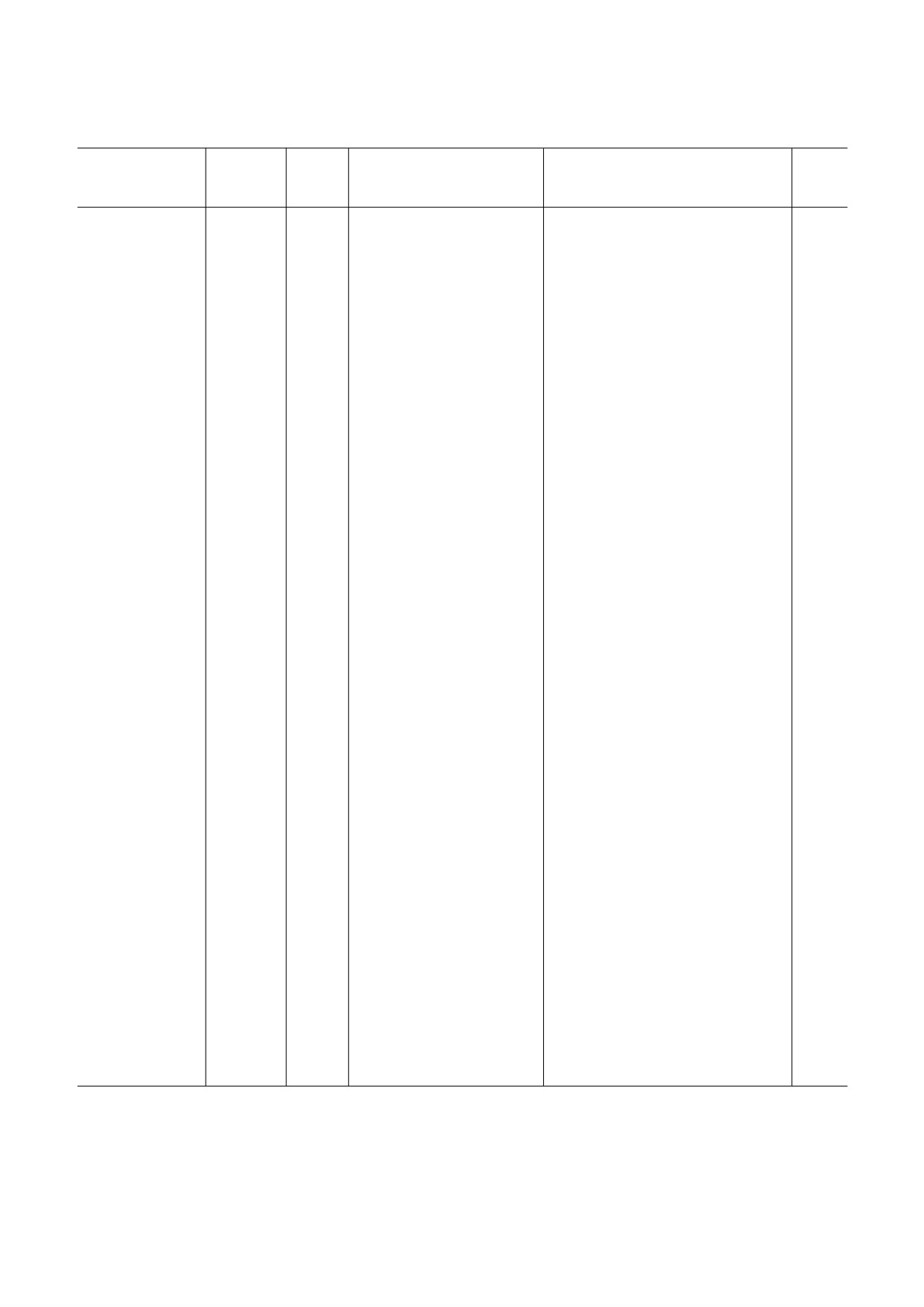
Возрастные изменения экспрессии Nrf2 и его генов$мишеней
Молодые,
Старые,
Уровень белка и мРНК Nrf2
Уровень экспрессии генов$мишеней
Орган/(объект)
мес.
мес.
(у старых животных
Nrf2 (у старых животных
Ссылка
по сравнению с молодыми)
по сравнению с молодыми)
Печень (крысы
4-6
24-28
уровень белка Nrf2 ниже на
уровень мРНК Gclc, Gclm и Gst2a
[20]
Fischer 344)
42%; нет различий в уровне
ниже на 19,6%, 31,4% и 40% соответ$
мРНК
ственно
Печень (крысы
2-5
24-28
уровень белка Nrf2 ниже в
связывание Nrf2 с ARE ниже на
[12]
Fischer 344)
1,79 раза для общего белка
~40%
Nrf2 и в 2 раза - для его
ядерной фракции
Печень (крысы
2
18-24
уровень белка Nrf2 ниже в 2
уровень экспрессии cоставлял 60%,
[19]
Sprague$Dawley)
раза
62%, 69% для глутатионредуктазы,
Nqo1 и каталазы соответственно
Печень (крысы
2-5
24-28
связывание Nrf2 с ARE Gclc ниже
[68]
Sprague$Dawley)
(50 ± 17% от такового у молодых)
Печень (крысы
6
26
уровень экспрессии гена
экспрессия генов Gclm, Nqo1, Gclc,
[17]
Sprague$Dawley)
Nrf2 не различается у 6$мес.
Ho$1 не различается у 6$мес. и
и 26$мес. крыс
26$мес. крыс
Скелетные мышцы
7
22
уровень белка Nrf2 ниже в
[22]
(крысы Fischer 344)
1,75 раза
Скелетные мышцы
2
22
уровень мРНК Nrf2 в 3,5 ра$
связывание Nrf2/ARE ниже в 2,1 раза
[31]
и сердце (мыши
за ниже в мышцах и в 2 раза
в сердце и в 1,9 раз - в скелетных
C57BL/6)
в сердце
мышцах; в сердце уровень мРНК
Gclc ниже в 2 раза, Gclm - ниже в
1,5 раза; в скелетных мышцах уро$
вень Gclc не менялся, Gclm - ниже в
1,5 раза
Сердце (мыши
2
23
уровень белка Nrf2 ниже
связывание Nrf2/ARE ниже в 1,65 раза
[23]
C57BL/6/SJ)
в 3 раза
Сердце (крысы
9
24
уровень белка Nrf2 не ме$
[51]
Wistar)
нялся
Сосуды (макака$
126
264
нет возрастных различий в
нет возрастных различий в уровне
[15]
резус)
уровне мРНК и белка Nrf2
мРНК и белка генов$мишеней Nrf2
(Nqo1, Gclc и Ho$1)
Сосуды (крысы
3
24
уровень мРНК Nrf2 в 1,4 ра$
уровень связывания Nrf2 с ARE
[14]
F344xBN)
за ниже; уровень белка Nrf2
вдвое ниже у старых крыс
в 3,3 раза ниже
Сосуды (крысы
6
24
в первичной культуре эндо$
в первичной культуре эндотелия со$
[27]
Fischer 344)
телия сосудов старых крыс
судов старых крыс связывание Nrf2 с
уровень белка Nrf2 в 1,5 раза
ARE выше на 33,5 ± 17%
выше в ядре (но не в цитоп$
лазме)
[8]
Спинной мозг
5
13
уровень белка Nrf2 вдвое
уровень белка Ho$1 в спинном мозге
(мыши ICR)
ниже
вдвое ниже, у Nqo1 изменений нет
[28]
Пигментный
2
15
в первичной культуре эпителия сет$
эпителий сетчатки
чатки уровень экспрессии Nqo1 и
(мыши C57Bl6/J)
Ho$1 соответственно в 11 и 10 раз выше
Бронхи (человек)
21-29*
60-69*
уровень белка Nrf2 в первич$
уровень белка в 1,8, 2,2 и 2,5 раза вы
[21]
ной культуре бронхиального
ше (для GCLC, GCLC и NQO1 соот$
эпителия в 1,34 раза ниже
ветственно)
Примечание. ARE - антиоксидант$респонс(ив)ный элемент (antioxidant response element); Gclc - каталитическая субъ$
единица глутаматцистеинлигазы; Gclm - регуляторная субъединица глутаматцистеинлигазы; Ho$1 - гемоксигеназа 1;
Nqo1 - NAD(P)H:хиноноксидоредуктаза 1.
* Лет.
БИОХИМИЯ том 87 вып. 1 2022
96
ШИЛОВСКИЙ
Регуляторы пути Nrf2. Cистемы, подавляю$
хондриального гомеостаза из$за Keap1$обуслов$
щие активность Nrf2, представляют собой ком$
ленной деградации белка Miro2 [62]. Также по$
поненты программы старения [4]. Наиболее из$
казано, что Keap1 негативно регулирует проли$
вестными из них, как уже отмечалось, являются
ферацию эндотелиальных клеток и вызывает их
редокс$зависимая система Keap1 и редокс$неза$
старение [59, 60]. В дополнительной серии экс$
висимая система белка, содержащего β$трансду$
периментов в упоминавшейся выше работе
циновые повторы и киназы гликогенсинтазы 3
Sachdeva et al. [28] изучали последствия генети$
(GSK3) (рис. 1). Кроме того, ещё одним белком,
ческой инактивации Keap1 в RPE у моло$
подавляющим действие Nrf2, является c$Myc
дых (2 мес.) и среднего возраста (15 мес.) мышей
[53] (рис. 1). Белок Bach1, не являясь прямым
C57Bl6/J в бесстрессовых и стрессовых (йодат
ингибитором Nrf2, конкурирует с ним за связы$
натрия, 5 мг/кг) условиях [28]. Сравнивали ин$
вание с последовательностью ARE [10]. Кроме
дуцируемый окислительным стрессом уровень
упомянутого выше, воздействие и других киназ
экспрессии Nrf2 и его генов$мишеней у мышей
(например, Fyn$киназы), может приводить к
с трансгеном рекомбиназы Cre, индуцируемый
иниактивации Nrf2 и его экспорту из ядра [54].
тамоксифеном (Tam$Cre; Keap1loxP) и мышей
Keap1. Keap1 является основным регулято$
того же возраста Keap1loxP, экспрессирующими
ром активности Nrf2 [54]. Хотя сообщалось, что
уровни Keap1 дикого типа [28]. Тамоксифен
мыши Keap1-/- нежизнеспособны и умирают в
снижал экспрессию Keap1 на 50% (как было оп$
течение первых 3$х недель жизни [55], подавле$
ределено с помощью количественной RT$qPCR
ние Keap1 повышает устойчивость к токсинам и
у мышей Tam$Cre Keap1loxP по сравнению с
в некоторых случаях увеличивает ПЖ у таких
мышами Keap1loxP, у которых отсутствовал
видов, как Drosophila melanogaster [56]. Интерес$
трансген рекомбиназы Cre, индуцируемый та$
но, что у наиболее эволюционно продвинутой
моксифеном). Обработка NaIO3 индуцировала в
части птиц (таксон Neoaves) Keap1 подвергся
2,5 раза более высокий уровень экспресии гена$
столь серьёзным перестройкам, что практичес$
мишени Nrf2 Nqo1 у старых (15 мес.) мышей по
ки утратил способность ингибировать Nrf2 [57].
сравнению с молодыми (p < 0,05), что свидетель$
Получившаяся в результате конститутивная ак$
ствует о частичном восстановлении нарушенно$
тивация Nrf2 (и индуцируемых им антиоксидант$
го ответа Nrf2 на окислительный стресс в RPE.
ных ферментов) очень важна для животных со
Транскрипты Gclm и Ho"1 не были изменены при
столь быстрым метаболизмом [57, 58]. Также
нокдауне Keap1 у 15$мес. мышей. У старых мы$
уровень белка Keap1 не различается у быстро
шей с уровнем Keap1, характерным для дикого
стареющих мышей SAMP8 и «устойчивых к ста$
типа (Keap1loxP), обработка NaIO3 не вызывала
рению» мышей SAMR1 [18]. Не было выявлено
экспрессию Nqo1, что согласуется с данными,
возрастных изменений уровня мРНК Keap1 у
приведёнными выше. При этом индукция пу$
10-50$дневных дрозофил [58]. Сообщается, что
ти Nrf2 в ответ на йодат натрия была частично
избыточный уровень Keap1 пагубно влияет на
восстановлена в RPE старых (15 мес.) мышей
клеточный гомеостаз, и наоборот, в моделях
C57Bl6/J с помощью нокдауна Nrf2$негативного
преждевременного старения уровень Keap1 уве$
регулятора Keap1 (Tam$Cre; Keap1loxP) по срав$
личивается [59-61]. Palsamy et al. [61] продемон$
нению с мышами Keap1loxP. Эти данные пока$
стрировали, что ответ на несвёрнутые белки,
зывают, что старые RPE более уязвимы к окис$
стимулированный стрессорами и оксидантами
лительному повреждению из$за нарушения сиг$
эндоплазматического ретикулума, вызывал по$
нального пути Nrf2, активация которого пред$
терю метилирования промотора Keap1 и повы$
ставляется многообещающим способом для но$
шал экспрессию Keap1, тем самым снижая
вых фармакологических или генетических тера$
экспрессию генов$мишеней NRF2 и NRF2 в
певтических стратегий [28]. Клиническое значе$
эпителии хрусталика человека. При этом мети$
ние дисбаланса Nrf2/Keap1 может быть связано
лирование промотора Keap1 снижается в хруста$
с возрастными заболеваниями [60].
лике при старении, достигая самого низкого
уровня в возрасте около 75 лет, создавая, таким
образом, предпосылки для роста уровня
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
экспрессии Keap1 с возрастом [61]. Тем не менее
РОЛИ ОТДЕЛЬНЫХ ПРЕДСТАВИТЕЛЕЙ
в работах Safdar et al. [13] и Xu et al. [17] не наб$
СИСТЕМЫ Nrf2/ARE В МЕХАНИЗМАХ
людали возрастного повышения уровня Keap1.
ВОЗРАСТНЫХ ИЗМЕНЕНИЙ,
Кроме того, Keap1 может быть критическим
СТАРЕНИЯ И ДОЛГОЛЕТИЯ
регулятором клеточного цикла и независимо
от Nrf2. Истощённые по Nrf2 клетки обнаружи$
Говоря о принадлежности того или иного
вают существенное нарушение регуляции мито$
белка к участникам «программы старения» или
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
97
«программы антистарения», обычно имеют в
на 50% в печени и на 150% в лёгких. Хроничес$
виду следующие его свойства: увеличение со$
кое воздействие частиц выхлопного газа (nPM)
держания (активности) с возрастом, участие в
увеличивало уровень c$Myc в тканях 6$месяч$
развитии возрастных патологий и противодей$
ных мышей, но не у более старых. Напротив,
ствие клеточным процессам репарации и анти$
Bach1 не был увеличен nPM в тканях 6$месяч$
оксидантной защиты (для Keap1 таким действи$
ных мышей, но был индуцирован nPM у более
ем является связывание с Nrf2 с последующей
старых мышей [67].
протеасомной деградацией последнего). При
p62. Белок p62/sequestosome1 (SQSTM1),
этом (сверх)активация Keap1 приводит к ухуд$
адаптер, который связывает и доставляет в ауто$
шению работы антиоксидантной системы клет$
фагосомы убиквитинированные белки во время
ки. Кроме того, хотя для Keap1 и показана воз$
аутофагии и имеет сходный (STGE) мотив с
можность импорта/экспорта из ядра [62], подав$
Keap1$взаимодействующим мотивом ETGE в
ляющая часть активности Keap1 приходится на
Neh2$домене Nrf2. Этот мотив делает возмож$
цитоплазму. Вместе с тем из анализа работ вид$
ным прямое взаимодействие между p62 и Keap1,
но, что чаще всего возрастному снижению в
вследствие чего p62 секвестрирует Keap1 в ауто$
большей степени подвержена не цитоплазмати$
фагосомы для его последующей деградации [69].
ческая, а ядерная фракция Nrf2.
Видимо, аутофагия может быть ещё одной кри$
Таким образом, можно сделать вывод, что
тической точкой для регуляции Nrf2 при старе$
Keap1, несмотря на то что он является наиболее
нии. Известно, что экспрессия p62 снижается с
мощным ингибитором Nrf2 и (вследствие это$
возрастом [70] и что потеря и/или уменьшение
го) главной мишенью для фармакологического
этого белка ведёт к уменьшению ПЖ [71]. У мы$
вмешательства [30], не может быть в полной ме$
шей p62-/- наблюдается ускоренное развитие
ре признан белком «программы старения».
старческого фенотипа, в тканях этих мышей
В качестве таковых, видимо, следует рассматри$
создаётся прооксидантная среда из$за наруше$
вать белки, ответственные за транспорт Nrf2 в
ния транспорта электронов в митохондриях.
ядро и за его активность в качестве фактора
GSK3β. Фосфорилирование киназой GSK3β
транскрипции.
зачастую приводит к последующему убиквити$
Bach1 и c)Myc. Предполагается, что ARE$
нированию модифицированного белка и опо$
опосредованная экспрессия генов зависит от
средуемой соответствующими адаптерами (на$
ядерного баланса между Nrf2 и Bach1 [63].
пример, F$box$белками) протеасомной деграда$
Bach1 подавляет экспрессию генов, конкурируя
ции. Активность GSK3β увеличивается с воз$
с Nrf2 за связывание с сайтом ARE в промоторе
растом in vivo и in vitro. Так, базальный уровень
регулируемых генов, что, в частности, приводит
неактивного белка GSK3 у старых (18 мес.) си$
к потере индуцибельности некоторых из Nrf2$
рийских хомячков (Mesocricetus auratus) намного
регулируемых генов [64]. Уровень гема влияет на
ниже, чем у молодых (1-3 мес.) [72]. Доля неак$
внутриклеточное распределение Bach1, его экс$
тивной изоформы также вдвое ниже у самок в
порт из ядра и активацию экспрессии Ho$1 [65].
возрасте 1,5 года, чем у трёхнедельных [73].
Остатки С557 и С574 в Bach1 участвуют в диссо$
Кроме того, в возрасте 10 мес. активность Akt и
циации комплекса ARE/Ho$1, что указывает на
GSK3β значительно выше в печени мышей
зависимости активности Bach1 от окислитель$
SAMP8, чем у SAMR. Предполагается, что выз$
но$восстановительного статуса клетки [66]. Уро$
ванное повышением активности GSK3β умень$
вень Bach1 увеличивается с возрастом: у старых
шение транслокации Nrf2 в ядро может приво$
мышей C57BL/6J (21 мес.) он выше, чем у моло$
дить к увеличению окислительного стресса у
дых (6 мес.) [67]. Аналогично в клетках бронхи$
мышей SAMP8 [18]. Показано, что в стационар$
ального эпителия пожилых людей (67-69 лет)
ной культуре первичных нейронов коры голов$
содержание BACH1 также выше, чем у молодых
ного мозга мыши при практически неизменном
(28-29 лет) [21]. Shenvi et al. [68] обнаружили,
общем уровне GSK3β доля фосфорилированной
что связывание Nrf2 с ARE Gclc значительно ни
по S9 (т.е. неактивной) формы GSK3β снижа$
же (50 ± 17%, p ≤ 0,05) у старых (24-28 мес.)
лась с более чем 30% через 3 сут. культивирова$
крыс Fischer 344 по сравнению с молодыми
ния без пересева до 15% - через 12 сут. [73].
(2-5 мес.) и что активность транскрипционного
«Старые» фибробласты человека WI$38 (диапа$
ответа ARE снижается при старении в присут$
зон числа удвоений клеточной популяции,
ствии Bach1. Кроме того, показано увеличение
УКП - 58-64), в отличие от клеток «среднего
уровня базального белка с$Myc и Bach1 с воз$
возраста» (УКП 38-41) и «молодых» (диапазон
растом во всех тканях: с$Myc повышался
УКП - 26-30), проявляют признаки, типичные
на 170% в мозжечке, на 87% в печени и на 90% в
для старения, включая увеличенный размер, уп$
лёгких; Bach1 был увеличен на 80% в мозжечке,
лощённую форму и повышенный уровень ак$
7 БИОХИМИЯ том 87 вып. 1 2022
98
ШИЛОВСКИЙ
тивности ассоциированной со старением β$га$
ний [24]. Эволюционно консервативный путь
лактозидазы, которые практически отсутствуют
антиоксидантного ответа, опосредуемый Nrf2,
в клетках «молодого» и «среднего возраста».
поддерживает клеточный окислительно$восста$
В отличие от «молодых» и клеток «среднего воз$
новительный гомеостаз и способствует сохране$
раста», в ядрах «старых» клеток повышен уро$
нию молодого клеточного фенотипа, регулируя
вень обеих изоформ GSK3
- GSK3β и
транскрипцию ряда цитопротекторных генов.
GSK3β [74]. Ещё одним подтверждением учас$
Уровень экспрессии Nrf2 снижается с возрастом
тия GSK3β в программе старения можно счи$
как in vivo, так и in vitro, что ведёт к усилению
тать изменение её активности при возрастных
окислительного стресса. Возрастные изменения
заболеваниях. В нейронах она избирательно
могут приводить к нарушению уровня экспрес$
фосфорилирует тау$белок в участках, которые
сии генов$мишеней Nrf2 (Nqo1, Ho"1, Gcl) вслед$
являются гиперфосфорилированными в мозге
ствие снижения общего уровня мРНК и белка,
при болезни Альцгеймера (БА) [75]. В ткани
уменьшения его содержания в ядре, ухудшения
мозга пациентов с БА уровень белка GSK3β по$
связывания Nrf2 с элементом антиоксидантного
вышен на 50% [75]. Ингибирование GSK3β
ответа (ARE), негативной регуляцией экспрес$
уменьшает когнитивные дефициты, ассоцииро$
сии, опосредованной Nrf2. Таким образом, на$
ванные с БА и другими вышеупомянутыми за$
рушение работы системы антиоксидантной за$
болеваниями. Активность GSK3β увеличена в
щиты у старых животных из$за дефицита Nrf2
клеточной (при депривации ростовых факто$
может привести к пагубному накоплению
ров) и животной (церебральная ишемия) моде$
АФК [22]. Генетическая инактивация Nrf2 уси$
лях нейродегенерации [76]. Провоспалительный
ливает возрастную индукцию маркёров старе$
эффект GSK3β обусловлен стимуляцией про$
ния и воспалительных факторов SASP [25] и ус$
дукции IL$β, IFN$γ, IL$6, IL$12 и подавлением
коряет клеточное старение, вызывая хроничес$
синтеза IL$10 [77]. Интерес к этой киназе в рам$
кое воспаление [25, 79, 80]. У Nrf2$дефицитных
ках нашей статьи продиктован её регуляторным
мышей также повышена чувствительность к ря$
влиянием на Nrf2, осуществляемым по меньшей
ду фармакологических и экологических токсич$
мере тремя способами: i) GSK3 (с участием
ных веществ [81]. Недостаточная активность пу$
адаптера βTrCP) напрямую связана с деградаци$
ти Nrf2 играет важную роль в возникновении и
ей Nrf2, способствуя его убиквитинированию и
развитии ряда токсических и хронических забо$
протеасомной деградации (а не просто инакти$
леваний, связанных с окислительным стрессом.
вации, как другие киназы); ii) GSK3 управляет
Животные с дефицитом Nrf2 более уязвимы к
ультрадианными ритмами Nrf2: фосфорилирует
развитию возрастных заболеваний, таких как
Fyn$киназу, которая перемещается в ядро, мо$
болезни сердца
[82], атрофия скелетных
дифицирует там Nrf2, после чего Nrf2 удаляется
мышц [83], рак [46], нарушение зрения [84], на$
из ядра; и iii) GSK3 фосфорилирует белки поло$
ряду с сокращением ПЖ и преждевременным
жительной ветви регуляции циркадных биорит$
старением [46]. Так, возрастное снижение син$
мов Bmal1 и Clock, также вызывая их протеа$
теза основного антиоксиданта клетки, глутатио$
сомную деградацию, что снижает экспрес$
на, может быть вызвано нарушением регуляции
сию Nrf2 (следует отметить, что в промоторах
ARE$опосредованной экспрессии генов, но на$
как генов негативных регуляторов биоритмов
целенные на Keap1 хемопротекторные агенты,
Cry1, Cry2 и Rev"erbα, так и в самом гене Nfe2l2,
такие как липоевая кислота, сульфорафан и дру$
кодирующем Nrf2, содержится E$box, вслед$
гие известные активаторы Nrf2, могут лишь (с
ствие чего их транскрипция позитивно регули$
возрастом всё хуже и хуже) компенсировать эту
руется комплексом Clock/Bmal1 [9, 78]). Все вы$
потерю [30, 85-92], подавляя опосредованный
шеперечисленное косвенно подтверждает пред$
Keap1 путь деградации, но не предотвратить её.
ложенную роль GSK3β как явного представите$
Наиболее вероятными претендентами на роль
ля программы старения.
«серого кардинала», исподволь определяющего
возрастное снижение функции Nrf2, претендует
тройка с$Myc, GSK3β и Bach1.
ЗАКЛЮЧЕНИЕ
Таким образом, помимо сравнения работы
защитных систем у коротко$ и долгоживущих
Старение связано с увеличением производ$
видов [2, 5, 6, 57, 93-98] и поиска новых антиок$
ства АФК и повышенным окислительным
сидантов [99-101] и активаторов Nrf2 [30,
стрессом с одновременным снижением актив$
85-89], ещё одним перспективным направлени$
ности основных антиоксидантов (супероксид$
ем биогеронтологических исследований может
дисмутаз, каталазы, глутатиона), что способ$
быть конструирование и синтез веществ, обла$
ствует развитию широкого спектра заболева$
дающих множественным действием. Известны,
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
99
например, вещество, являющееся гибридом
различных веществ, активирующих путь Nrf2,
сульфорафана (активатора Nrf2) и мелатонина
предотвращать хронические возрастные заболе$
(регулятора биоритмов) [102], а также вещества,
вания, связанные со старением, позволят глуб$
являющиеся одновременно ингибитора$
же понять роль активации Nrf2 как возможного
ми GSK3β и активаторами Nrf2 (2,4$дигидропи$
вмешательства, способствующего долголетию.
рано[2,3$c]пиразолы) [103] или разных путей
инактивации Nrf2 (GSK3β, FYN, и DYRK1A)
Финансирование. Исследование выполнено
[104]. Т.о. сигнальный путь Nrf2 (как главного
при финансовой поддержке Российского фонда
регулятора высокоскоординированного антиок$
фундаментальных исследований (проект № 18$
сидантного ответа) может быть потенциальной
29$13037).
терапевтической мишенью для защиты клеток
Конфликт интересов. Авторы заявляют об от$
от возрастного накопления АФК путём восста$
сутствии конфликта интересов.
новления окислительно$восстановительного
Соблюдение этических норм. В данной работе
гомеостаза для предотвращения возрастных па$
не было никаких исследований, в которых были
тологий. Кроме того, будущие исследования пе$
использованы в качестве объектов люди или
редачи сигналов Nrf2 у людей и способности
животные.
СПИСОК ЛИТЕРАТУРЫ
1.
Skulachev, M. V., Severin, F. F., and Skulachev, V. P. (2015)
the transcription factor Nrf2 by redox stressors, nutrient
Aging as an evolvability$increasing program which can be
cues, and energy status and the pathways through which it
switched off by organism to mobilize additional resources
attenuates degenerative disease, Free Radic. Biol. Med., 88,
for survival, Curr. Aging Sci., 8, 95$109, doi: 10.2174/
108$146, doi: 10.1016/j.freeradbiomed.2015.06.021.
1874609808666150422122401.
11.
Kobayashi, E. H., Suzuki, T., Funayama, R., Nagashima,
2.
Skulachev, V. P., Holtze, S., Vyssokikh, M. Y., Bakeeva, L.
T., Hayashi, M., et al. (2016) Nrf2 suppresses macrophage
E., Skulachev, M. V., et al. (2017) Neoteny, prolongation of
inflammatory response by blocking proinflammatory
youth: From naked mole rats to “naked apes” (humans),
cytokine transcription, Nat. Commun.,
7,
11624,
Physiol. Rev.,
97,
699$720, doi:
10.1152/physrev.
doi: 10.1038/ncomms11624.
00040.2015.
12.
Suh, J. H., Shenvi, S. V., Dixon, B. M., Liu, H., Jaiswal,
3.
Skulachev, V. P. (2019) Phenoptosis as a phenomenon wide$
A. K., et al. (2004) Decline in transcriptional activity of
spread among many groups of living organisms including
Nrf2 causes age$related loss of glutathione synthesis, which
mammals (Commentary to the paper by E. R. Galimov,
is reversible with lipoic acid, Proc. Natl. Acad. Sci. USA,
J. N. Lohr, and D. Gems (2019), Biochemistry (Moscow),
101, 3381$3386, doi: 10.1073/pnas.0400282101.
84, 1433$1437), Biochemistry (Moscow), 84, 1438$1441,
13.
Safdar, A., deBeer, J., and Tarnopolsky, M. A. (2010)
doi: 10.1134/S0006297919120022.
Dysfunctional Nrf2$Keap1 redox signaling in skeletal mus$
4.
Skulachev, V. P., Shilovsky, G. A., Putyatina, T. S., Popov,
cle of the sedentary old, Free Radic. Biol. Med., 49, 1487$
N. A., Markov, A. V., et al. (2020) Perspectives of Homo
1493, doi: 10.1016/j.freeradbiomed.2010.08.010.
sapiens lifespan extension: focus on external or internal
14.
Ungvari, Z., Bailey$Downs, L., Sosnowska, D., Gautam,
resources? Aging (Albany NY),
12,
5566$5584,
T., Koncz, P., et al. (2011) Vascular oxidative stress in
doi: 10.18632/aging.102981.
aging: a homeostatic failure due to dysregulation of NRF2$
5.
Lewis, K. N., Wason, E., Edrey, Y. H., Kristan, D. M.,
mediated antioxidant response, Am. J. Physiol. Heart Circ.
Nevo, E., et al. (2015) Regulation of Nrf2 signaling and
Physiol., 301, 363$372, doi: 10.1152/ajpheart.01134.2010.
longevity in naturally long$lived rodents, Proc. Natl. Acad.
15.
Ungvari, Z., Bailey$Downs, L., Gautam, T., Sosnowska,
Sci. USA, 112, 3722$3727, doi: 10.1073/pnas.1417566112.
D., Wang, M., et al. (2011) Age$associated vascular oxida$
6.
Vyssokikh, M. Y., Holtze, S., Averina, O. A., Lyamzaev, K. G.,
tive stress, Nrf2 dysfunction, and NF${kappa}B activation
Panteleeva, A. A., et al. (2020) Mild depolarization of the
in the nonhuman primate Macaca mulatta, J. Gerontol. A
inner mitochondrial membrane is a crucial component of
Biol. Sci. Med. Sci., 66, 866$875, doi: 10.1093/gerona/
an anti$aging program, Proc. Natl. Acad. Sci. USA, 117,
glr092.
6491$6501, doi: 10.1073/pnas.1916414117.
16.
Zhang, H., Davies, K. J. A., and Forman, H. J. (2015)
7.
Cuadrado, A. (2015) Structural and functional characteri$
Oxidative stress response and Nrf2 signaling in aging, Free
zation of Nrf2 degradation by glycogen synthase
Radic. Biol. Med., 88 (Pt B), 314$336, doi: 10.1016/
kinase 3/β$TrCP, Free Radic. Biol. Med., 88, 147$157,
j.freeradbiomed.2015.05.036.
doi: 10.1016/j.freeradbiomed.2015.04.029.
17.
Xu, S. F., Ji, L. L., Wu, Q., Li, J., and Liu, J. (2018)
8.
Duan, W. S., Zhang, R. Y., Guo, Y. S., Jiang, Y. F., Huang,
Ontogeny and aging of Nrf2 pathway genes in livers of rats,
Y. L., et al. (2009) Nrf2 activity is lost in the spinal cord and
Life Sci., 203, 99$104, doi: 10.1016/j.lfs.2018.04.018.
its astrocytes of aged mice, In vitro Cell. Dev. Biol. Anim.,
18.
Tomobe, K., Shinozuka, T., Kuroiwa, M., and Nomura, Y.
45, 388$397, doi: 10.1007/s11626$009$9194$5.
(2012) Age$related changes of Nrf2 and phosphorylated
9.
Shilovsky, G. A., Putyatina, T. S., Morgunova, G. V.,
GSK$3β in a mouse model of accelerated aging (SAMP8),
Seliverstov, A. V., Ashapkin, V. V., et al. (2021) A crosstalk
Arch. Gerontol. Geriatr., 54, 1$7, doi: 10.1016/j.archger.
between the biorhythms and gatekeepers of longevity: dual
2011.06.006.
role of glycogen synthase kinase$3, Biochemistry (Moscow),
19.
Shih, P. H., and Yen, G. C. (2007) Differential expressions
86, 433$448, doi: 10.1134/S0006297921040052.
of antioxidant status in aging rats: the role of transcription$
10.
Tebay, L. E., Robertson, H., Durant, S. T., Vitale, S. R.,
al factor Nrf2 and MAPK signaling pathway,
Penning, T. M., et al. (2015) Mechanisms of activation of
Biogerontology, 8, 71$80, doi: 10.1007/s10522$006$9033$y.
БИОХИМИЯ том 87 вып. 1 2022
7*
100
ШИЛОВСКИЙ
20.
Smith, E. J., Shay, K. P., Thomas, N. O., Butler, J. A.,
34.
Kitaoka, Y., Tamura, Y., Takahashi, K., Takeda, K.,
Finlay, L. F., et al. (2015) Age$related loss of hepatic Nrf2
Takemasa, T., et al. (2019) Effects of Nrf2 deficiency on
protein homeostasis: potential role for heightened expres$
mitochondrial oxidative stress in aged skeletal muscle,
sion of miR$146a, Free Radic. Biol. Med., 89, 1184$1191,
Physiol. Rep., 7, e13998, doi: 10.14814/phy2.13998.
doi: 10.1016/j.freeradbiomed.2015.11.003.
35.
Li, D., Zhao, H., Cui, Z. K., and Tian, G. (2021) The role
21.
Zhou, L., Zhang, H., Davies, K. J. A., and Forman, H. J.
of Nrf2 in hearing loss, Front. Pharmacol., 12, 620921,
(2018) Aging$related decline in the induction of Nrf2$regu$
doi: 10.3389/fphar.2021.620921.
lated antioxidant genes in human bronchial epithelial cells,
36.
Hosokawa, K., Hosokawa, S., Ishiyama, G., Ishiyama, A.,
Redox Biol., 14, 35$40, doi: 10.1016/j.redox.2017.08.014.
and Lopez, I. A. (2018) Immunohistochemical localiza$
22.
Baek, M. K., Lee, H., Kim, K. O., Kwon, H. J., Chung,
tion of Nrf2 in the human cochlea, Brain Res., 1700, 1$8,
M. H., et al. (2017) Age$related changes in nuclear factor
doi: 10.1016/j.brainres.2018.07.004.
erythroid 2$related factor 2 and reactive oxygen species and
37.
Hoshino, T., Tabuchi, K., Nishimura, B., Tanaka, S.,
mitochondrial structure in the tongues of Fischer 344 rats,
Nakayama, M., et al. (2011) Protective role of Nrf2 in age$
Clin. Exp. Otorhinolaryngol., 10, 357$362, doi: 10.21053/
related hearing loss and gentamicin ototoxicity, Biochem.
ceo.2016.01095.
Biophys. Res. Commun., 415, 94$98, doi: 10.1016/j.bbrc.
23.
Gounder, S. S., Kannan, S., Devadoss, D., Miller, C. J.,
2011.10.019.
Whitehead, K. J., et al. (2012) Impaired transcriptional
38.
Honkura, Y., Matsuo, H., Murakami, S., Sakiyama, M.,
activity of Nrf2 in age$related myocardial oxidative stress is
Mizutari, K., et al. (2016) Nrf2 is a key target for prevention
reversible by moderate exercise training, PLoS One, 7,
of noise$induced hearing loss by reducing oxidative damage
e45697, doi: 10.1371/journal.pone.0045697.
of cochlea, Sci. Rep., 6, 19329, doi: 10.1038/srep19329.
24.
Ungvari, Z., Tarantini, S., Kiss, T., Wren, J. D., Giles, C.
39.
Valcarcel$Ares, M. N., Gautam, T., Warrington, J. P.,
B., et al. (2018) Endothelial dysfunction and angiogenesis
Bailey$Downs, L., Sosnowska, D., et al. (2012) Disruption
impairment in the ageing vasculature, Nat. Rev. Cardiol.,
of Nrf2 signaling impairs angiogenic capacity of endothe$
15, 555$565, doi: 10.1038/s41569$018$0030$z.
lial cells: implications for microvascular aging, J. Gerontol.
25.
Fulop, G. A., Kiss, T., Tarantini, S., Balasubramanian, P.,
A Biol. Sci. Med. Sci., 67, 821$829, doi: 10.1093/gerona/
Yabluchanskiy, A., et al. (2018) Nrf2 deficiency in aged
glr229.
mice exacerbates cellular senescence promoting cere$
40.
Kapeta, S., Chondrogianni, N., and Gonos, E. S. (2010)
brovascular inflammation, GeroScience, 40, 513$521,
Nuclear erythroid factor 2$mediated proteasome activation
doi: 10.1007/s11357$018$0047$6.
delays senescence in human fibroblasts, J. Biol. Chem.,
26.
George, L., Lokhandwala, M. F., and Asghar, M. (2009)
285, 8171$8184, doi: 10.1074/jbc.M109.031575.
Exercise activates redox$sensitive transcription factors and
41.
Jódar, L., Mercken, E. M., Ariza, J., Younts, C.,
restores renal D1 receptor function in old rats, Am. J.
González Reyes, J. A., et al. (2011) Genetic deletion of
Physiol. Renal Physiol., 297, 1174$1180, doi: 10.1152/
Nrf2 promotes immortalization and decreases life span of
ajprenal.00397.2009.
murine embryonic fibroblasts, J. Gerontol. A Biol. Sci. Med.
27.
Li, M., Liu, R. M., Timblin, C. R., Meyer, S. G.,
Sci., 66, 247$256, doi: 10.1093/gerona/glq181.
Mossman, B. T., et al. (2006) Age affects ERK1/2 and Nrf2
42.
Wang, R., Yu, Z., Sunchu, B., Shoaf, J., Dang, I., et al.
signaling in the regulation of GCLC expression, J. Cell
(2017) Rapamycin inhibits the secretory phenotype of
Physiol., 206, 518$525.
senescent cells by a Nrf2$independent mechanism, Aging
28.
Sachdeva, M. M., Cano, M., and Handa, J. T. (2014) Nrf2
Cell, 16, 564$574, doi: 10.1111/acel.12587.
signaling is impaired in the aging RPE given an oxidative
43.
Lerner, C., Bitto, A., Pulliam, D., Nacarelli, T.,
insult, Exp. Eye Res., 119, 111$114, doi: 10.1016/j.exer.
Konigsberg, M., et al. (2013) Reduced mammalian target
2013.10.024.
of rapamycin activity facilitates mitochondrial retrograde
29.
Wu, D. M., Ji, X., Ivanchenko, M. V., Chung, M.,
signaling and increases life span in normal human fibrob$
Piper, M., et al. (2021) Nrf2 overexpression rescues the
lasts, Aging Cell, 12, 966$977, doi: 10.1111/acel.12122.
RPE in mouse models of retinitis pigmentosa, JCI Insight,
44.
Zhang, Y., Unnikrishnan, A., Deepa, S. S., Liu, Y., Li, Y.,
6, e145029, doi: 10.1172/jci.insight.145029.
et al. (2017) A new role for oxidative stress in aging: The
30.
Robledinos$Antón, N., Fernández Ginés, R., Manda, G.,
accelerated aging phenotype in Sod1-/- mice is correlated
and Cuadrado, A. (2019) Activators and inhibitors of
to increased cellular senescence, Redox Biol., 11, 30$37,
NRF2: a review of their potential for clinical development,
doi: 10.1016/j.redox.2016.10.014.
Oxid. Med. Cell. Longev., 2019, 9372182, doi: 10.1155/
45.
Corenblum, M. J., Ray, S., Remley, Q. W., Long, M., et al.
2019/9372182.
(2016) Reduced Nrf2 expression mediates the decline in
31.
Bose, C., Alves, I., Singh, P., Palade, P. T., Carvalho, E.,
neural stem cell function during a critical middle$age peri$
et al. (2020) Sulforaphane prevents age$associated cardiac
od, Aging Cell, 15, 725$736, doi: 10.1111/acel.12482.
and muscular dysfunction through Nrf2 signaling, Aging
46.
Volonte, D., Liu, Z., Musille, P. M., Stoppani, E.,
Cell, 19, e13261, doi: 10.1111/acel.13261.
Wakabayashi, N., et al. (2013) Inhibition of nuclear factor$
32.
Alarcón Aguilar, A., Luna López, A., Ventura$Gallegos, J.
erythroid 2$related factor (Nrf2) by caveolin$1 promotes
L., Lazzarini, R., Galván$Arzate, S., et al. (2014) Primary
stress$induced premature senescence, Mol. Biol. Cell, 24,
cultured astrocytes from old rats are capable to activate the
1852$1862, doi: 10.1091/mbc.E12$09$0666.
Nrf2 response against MPP+ toxicity after tBHQ pretreat$
47.
Kubben, N., Zhang, W., Wang, L., Voss, T. C., Yang, J.,
ment, Neurobiol. Aging, 35, 1901$1912, doi: 10.1016/
et al. (2016) Repression of the antioxidant Nrf2 pathway in
j.neurobiolaging.2014.01.143.
premature aging, Cell, 165, 1361$1374, doi: 10.1016/j.cell.
33.
Miller, C. J., Gounder, S. S., Kannan, S., Goutam, K.,
2016.05.017.
Muthusamy, V. R., et al. (2012) Disruption of Nrf2/ARE
48.
Orr, W. C., Radyuk, S. N., Prabhudesai, L., Toroser, D.,
signaling impairs antioxidant mechanisms and promotes
Benes, J. J., et al. (2005) Overexpression of glutamate$cys$
cell degradation pathways in aged skeletal muscle, Biochim.
teine ligase extends life span in Drosophila melanogaster,
Biophys. Acta, 1822, 1038$1050, doi: 10.1016/j.bbadis.
J. Biol. Chem., 280, 37331$37338, doi: 10.1074/jbc.
2012.02.007.
M508272200.
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
101
49.
Jasper, H. (2008) SKNy worms and long life, Cell, 132,
gene expression and induction in response to antioxidants,
915$916, doi: 10.1016/j.cell.2008.03.002.
J. Biol. Chem., 280, 16891$16900, doi: 10.1074/jbc.
50.
Bruns, D. R., Drake, J. C., Biela, L. M., Peelor, F. F. 3rd,
M500166200.
Miller, B. F., et al. (2015) Nrf2 signaling and the slowed
64.
Tian, X., Cong, F., Guo, H., Fan, J., Chao, G., and
aging phenotype: evidence from long$lived models, Oxid.
Song, T. (2019) Downregulation of Bach1 protects
Med. Cell. Longev., 2015, 732596, doi: 10.1155/2015/
osteoblasts against hydrogen peroxide$induced oxidative
732596.
damage in vitro by enhancing the activation of Nrf2/ARE
51.
Silva$Palacios, A., Ostolga$Chavarr a, M., Buelna
signaling, Chem. Biol. Interact., 309, 108706, doi: 10.1016/
Chontal, M., Garibay, C., Hernández Reséndiz, S., et al.
j.cbi.2019.06.019.
(2017) 3$NP$induced Huntington’s$like disease impairs
65.
Yamaoka, M., Shimizu, H., Takahashi, T., Omori, E., and
Nrf2 activation without loss of cardiac function in aged
Morimatsu, H. (2017) Dynamic changes in Bach1 expres$
rats, Exp. Gerontol., 96, 89$98, doi: 10.1016/j.exger.2017.
sion in the kidney of rhabdomyolysis$associated acute kid$
06.009.
ney injury, PLoS One, 12, e0180934, doi: 10.1371/journal.
52.
Morin, P. Jr, Ni, Z., McMullen, D. C., and Storey, K. B.
pone.0180934.
(2008) Expression of Nrf2 and its downstream gene targets
66.
Meng, D., Wang, X., Chang, Q., Hitron, A., Zhang, Z.,
in hibernating 13$lined ground squirrels, Spermophilus
et al. (2010) Arsenic promotes angiogenesis in vitro via a
tridecemlineatus, Mol. Cell. Biochem., 312, 121$129,
heme oxygenase$1$dependent mechanism, Toxicol. Appl.
doi: 10.1007/s11010$008$9727$3.
Pharmacol., 244, 291$299, doi: 10.1016/j.taap.2010.01.
53.
Levy, S., and Forman, H. J. (2010) C$Myc is a Nrf2$inter$
004.
acting protein that negatively regulates phase II genes
67.
Zhang, H., Liu, H., Davies, K. J., Sioutas, C., Finch, C.
through their electrophile responsive elements, IUBMB
E., et al. (2012) Nrf2$regulated phase II enzymes are
Life, 62, 237$246, doi: 10.1002/iub.314.
induced by chronic ambient nanoparticle exposure in
54.
Jain, A. K., and Jaiswal, A. K. (2007) GSK3β acts
young mice with age$related impairments, Free Radic.
upstream of Fyn kinase in regulation of nuclear export and
Biol. Med., 52, 2038$2046, doi: 10.1016/j.freeradbiomed.
degradation of NF$E2 related factor 2, J. Biol. Chem., 282,
2012.02.042.
16502$16510, doi: 10.1074/jbc.M611336200.
68.
Shenvi, S. V., Smith, E., and Hagen, T. M.
(2012)
55.
Wakabayashi, N., Itoh, K., Wakabayashi, J., Motohashi,
Identification of age$specific Nrf2 binding to a novel
H., Noda, S., et al. (2003) Keap1$null mutation leads to
antioxidant response element locus in the Gclc promoter: a
postnatal lethality due to constitutive Nrf2 activation, Nat.
compensatory means for the loss of glutathione synthetic
Genet., 35, 238$425, doi: 10.1038/ng1248.
capacity in the aging rat liver? Aging Cell, 11, 297$304,
56.
Sykiotis, G. P., and Bohmann, D. (2010) Stress$activated
doi: 10.1111/j.1474$9726.2011.00788.x.
cap‘n’collar transcription factors in aging and human dis$
69.
Jiang, T., Harder, B., Rojo de la Vega, M., Wong, P. K.,
ease, Sci. Signal., 3, re3, doi: 10.1126/scisignal.3112re3.
Chapman, E., et al. (2015) p62 links autophagy and Nrf2
57.
Castiglione, G. M., Xu, Z., Zhou, L., and Duh, E. J.
signaling, Free Radic. Biol. Med., 88 (Pt B), 199$204,
(2020) Adaptation of the master antioxidant response con$
doi: 10.1016/j.freeradbiomed.2015.06.014.
nects metabolism, lifespan and feather development path$
70.
Kwon, J., Han, E., Bui, C. B., Shin, W., Lee, J., et al.
ways in birds, Nat. Commun., 11, 2476, doi: 10.1038/
(2012) Assurance of mitochondrial integrity and mam$
s41467$020$16129$4.
malian longevity by the p62$Keap1$Nrf2$Nqo1 cascade,
58.
Rahman, M. M., Sykiotis, G. P., Nishimura, M., Bodmer,
EMBO Rep., 13, 150$156, doi: 10.1038/embor.2011.246.
R., and Bohmann, D. (2013) Declining signal dependence
71.
Bitto, A., Lerner, C. A., Nacarelli, T., Crowe, E.,
of Nrf2$MafS$regulated gene expression correlates with
Torres, C., et al. (2014) P62/SQSTM1 at the interface of
aging phenotypes, Aging Cell, 12, 554$562, doi: 10.1111/
aging, autophagy, and disease, Age (Dordr.), 36, 9626,
acel.12078.
doi: 10.1007/s11357$014$9626$3.
59.
Kopacz, A., Klóska, D., Proniewski, B., Cysewski, D.,
72.
Iwahana, E., Hamada, T., Uchida, A., and Shibata, S.
Personnic, N., et al. (2020) Keap1 controls protein S$
(2007) Differential effect of lithium on the circadian
nitrosation and apoptosis-senescence switch in endothe$
oscillator in young and old hamsters, Biochem. Biophys.
lial cells, Redox Biol., 28, 101304, doi: 10.1016/j.redox.
Res. Commun., 354, 752$756, doi: 10.1016/j.bbrc.2007.
2019.101304.
01.042.
60.
Kloska, D., Kopacz, A., Cysewski, D., Aepfelbacher, M.,
73.
Krishnankutty, A., Kimura, T., Saito, T., Aoyagi, K.,
Dulak, J., et al. (2019) Nrf2 sequesters Keap1 preventing
Asada, A., et al. (2017) In vivo regulation of glycogen syn$
podosome disassembly: a quintessential duet moonlights in
thase kinase 3β activity in neurons and brains, Sci. Rep., 7,
endothelium, Antioxid. Redox Signal, 30, 1709$1730,
8602, doi: 10.1038/s41598$017$09239$5.
doi: 10.1089/ars.2018.7505.
74.
Zmijewski, J. W., and Jope, R. S. (2004) Nuclear accumu$
61.
Palsamy, P., Bidasee, K. R., Ayaki, M., Augusteyn, R. C.,
lation of glycogen synthase kinase$3 during replicative
Chan, J. Y., et al. (2014) Methylglyoxal induces endoplas$
senescence of human fibroblasts, Aging Cell, 3, 309$317,
mic reticulum stress and DNA demethylation in the Keap1
doi: 10.1111/j.1474$9728.2004.00117.x.
promoter of human lens epithelial cells and age$related
75.
Hoshi, M., Takashima, A., Noguchi, K., Murayama, M.,
cataracts, Free Radic. Biol. Med.,
72,
134$148,
Sato, M., et al. (1996) Regulation of mitochondrial pyru$
doi: 10.1016/j.freeradbiomed.2014.04.010.
vate dehydrogenase activity by tau protein kinase I/glyco$
62.
Cloer, E. W., Goldfarb, D., Schrank, T. P., Weissman, B.
gen synthase kinase 3beta in brain, Proc. Natl. Acad. Sci.
E., and Major, M. B. (2019) NRF2 activation in cancer:
USA, 93, 2719$2723, doi: 10.1073/pnas.93.7.2719.
from DNA to protein, Cancer Res.,
79,
889$898,
76.
Salcedo$Tello, P., Ortiz$Matamoros, A., and Arias, C.
doi: 10.1158/0008$5472.CAN$18$2723.
(2011) GSK3 function in the brain during development,
63.
Dhakshinamoorthy, S., Jain, A. K., Bloom, D. A., and
neuronal plasticity, and neurodegeneration, Int. J.
Jaiswal, A. K. (2005) Bach1 competes with Nrf2 leading to
Alzheimer’s Dis., 11, 1$12, doi: 10.4061/2011/189728.
negative regulation of the antioxidant response element
77.
Iitaka, C., Miyazaki, K., Akaike, T., and Ishida, N. (2005)
(ARE)$mediated NAD(P)H:quinone oxidoreductase 1
A role for glycogen synthase kinase$3β in the mammalian
БИОХИМИЯ том 87 вып. 1 2022
102
ШИЛОВСКИЙ
circadian clock, J. Biol. Chem., 280,
29397$29402,
91. Hushpulian, D. M., Ammal Kaidery, N., Ahuja, M.,
doi: 10.1074/jbc.M503526200.
Poloznikov, A. A., Sharma, S. M., et al. (2021) Challenges
78.
Early, J. O., Menon, D., Wyse, C. A., Cervantes$Silva, M.
and limitations of targeting the Keap1$Nrf2 pathway for
P., Zaslona, Z., et al. (2018) Circadian clock protein
neurotherapeutics: Bach1 de$repression to the rescue,
BMAL1 regulates IL$1β in macrophages via NRF2, Proc.
Front. Aging Neurosci., 13, 673205, doi: 10.3389/fnagi.
Natl. Acad. Sci. USA, 115, 8460$8468, doi: 10.1073/pnas.
2021.673205.
1800431115.
92. Ulasov, A. V., Rosenkranz, A. A., Georgiev, G. P., and
79.
Hiebert, P., Wietecha, M. S., Cangkrama, M., Haertel, E.,
Sobolev, A. S. (2021) Keap1/ARE signaling: Towards spe$
Mavrogonatou, E., et al. (2018) Nrf2$mediated fibroblast
cific regulation, Life Sci., 291, 120111, doi: 10.1016/
reprogramming drives cellular senescence by targeting the
j.lfs.2021. 120111.
matrisome, Dev. Cell, 46, 145$161.e10, doi: 10.1016/j.devcel.
93. Farré, X., Molina, R., Barteri, F., Timmers, P. R. H. J.,
2018.06.012.
Joshi, P. K., et al. (2021) Comparative analysis of mammal
80.
Yuan, H., Xu, Y., Luo, Y., Wang, N. X., and Xiao, J. H.
genomes unveils key genomic variability for human life
(2021) Role of Nrf2 in cell senescence regulation, Mol.
span, Mol. Biol. Evol., 38, 4948$4961, doi: 10.1093/molbev/
Cell. Biochem., 476, 247)259, doi: 10.1007/s11010$020$
msab219.
03901$9.
94. Holtze, S., Gorshkova, E., Braude, S., Cellerino, A.,
81.
Kensler, T. W., Wakabayashi, N., and Biswal, S. (2007) Cell
Dammann, P., et al. (2021) Alternative animal models of
survival responses to environmental stresses via the Keap1$
aging research, Front. Mol. Biosci.,
8,
660959,
Nrf2$ARE pathway, Annu. Rev. Pharmacol. Toxicol., 47, 89$
doi: 10.3389/fmolb.2021.660959.
116, doi: 10.1146/annurev.pharmtox.46.120604.141046.
95. Miskevich, D., Chaban, A., Dronina, M., Abramovich, I.,
82.
Shanmugam, G., Narasimhan, M., Conley, R. L.,
Gottlieb, E., et al. (2021) Comprehensive analysis of 13C6
Sairam, T., Kumar, A., et al. (2017) Chronic endurance
Glucose fate in the hypoxiatolerant blind mole rat skin fibrob$
exercise impairs cardiac structure and function in middle$
lasts, Metabolites, 11, 734, doi: 10.3390/metabo11110734.
aged mice with impaired Nrf2 signaling, Front. Physiol., 8,
96. Miskevich, D., Chaban, A., Dronina, M., Abramovich, I.,
268, doi: 10.3389/fphys.2017.00268.
Gottlieb, E., et al. (2021) Glutamine homeostasis and its
83.
Ahn, B., Pharaoh, G., Premkumar, P., Huseman, K.,
role in the adaptive strategies of the blind mole rat, Spalax,
Ranjit, R., et al. (2018) Nrf2 deficiency exacerbates age$
Metabolites, 11, 755, doi: 10.3390/metabo11110755.
related contractile dysfunction and loss of skeletal muscle
97. Omotoso, O., Gladyshev, V. N., and Zhou, X. (2021)
mass, Redox Biol., 17, 47$58, doi: 10.1016/j.redox.2018.
Lifespan extension in long$lived vertebrates rooted in eco$
04.004.
logical adaptation, Front. Cell Dev. Biol., 9, 704966,
84.
Nakagami, Y. (2016) Nrf2 is an attractive therapeutic target
doi: 10.3389/fcell.2021.704966.
for retinal diseases, Oxid. Med. Cell. Longev., 2016,
98. Podder, A., Raju, A., and Schork, N. J. (2021) Cross$
7469326, doi: 10.1155/2016/7469326.
species and human inter$tissue network analysis of genes
85.
Vnukov, V. V., Gutsenko, O. I., Milutina, N. P., Kornienko,
implicated in longevity and aging reveal strong support for
I. V., Ananyan, A. A., et al. (2015) Influence of SkQ1 on
nutrient sensing, Front. Genet., 12, 719713, doi: 10.3389/
expression of Nrf2 gene, are$controlled genes of antioxi$
fgene.2021.719713.
dant enzymes and their activity in rat blood leukocytes
99. Dontsov, A. E., Sakina, N. L., Yakovleva, M. A., Bastrakov,
under oxidative stress, Biochemistry (Moscow), 80, 1598$
A. I., Bastrakova, I. G., et al. (2020) Ommochromes from
1605, doi: 10.1134/S0006297915120081.
the compound eyes of insects: Physicochemical properties
86.
Vnukov, V. V., Gutsenko, O. I., Milyutina, N. P.,
and antioxidant activity, Biochemistry (Moscow), 85, 668$
Kornienko, I. V., Ananyan, A. A., et al. (2017) SkQ1 regu$
678, doi: 10.1134/S0006297920060048.
lates expression of Nrf2, ARE$controlled genes encoding
100. Omran, B., and Baek, K. H. (2021) Nanoantioxidants:
antioxidant enzymes, and their activity in cerebral cortex
pioneer types, advantages, limitations, and future insights,
under oxidative stress, Biochemistry (Moscow), 82, 942$
Molecules, 26, 7031, doi: 10.3390/molecules26227031.
952, doi: 10.1134/S0006297917080090.
101. Ushakova, N. A., Brodsky, E. S., Tikhonova, O. V.,
87.
Cuadrado, A., Manda, G., Hassan, A., Alcaraz, M. J.,
Dontsov, A. E., Marsova, M. V., et al. (2021) Novel extract
Barbas, C., et al. (2018) Transcription factor NRF2 as a
from beetle Ulomoides dermestoides: a study of composition
therapeutic target for chronic diseases: a systems medicine
and antioxidant activity. Antioxidants (Basel), 10, 1055,
approach, Pharmacol. Rev., 70, 348$383, doi: 10.1124/
doi: 10.3390/antiox10071055.
pr.117.014753.
102. Egea, J., Buendia, I., Parada, E., Navarro, E.,
88.
Brandes, M. S., and Gray, N. E. (2020) NRF2 as a thera$
Cuadrado, P., et al. (2015) Melatonin$sulforaphane hybrid
peutic target in neurodegenerative diseases, ASN Neuro,
ITH12674 induces neuroprotection in oxidative stress
12, 1759091419899782, doi: 10.1177/1759091419899782.
conditions by a “drug$prodrug” mechanism of action,
89.
Cui, L., Zhou, Q., Zheng, X., Sun, B., and Zhao, S. (2020)
Br. J. Pharmacol., 172, 1807$1821, doi: 10.1111/bph.
Mitoquinone attenuates vascular calcification by suppress$
13025.
ing oxidative stress and reducing apoptosis of vascular
103. Gameiro, I., Michalska, P., Tenti, G., Cores, Á.,
smooth muscle cells via the Keap1/Nrf2 pathway, Free
Buendia, I., et al. (2017) Discovery of the first dual GSK3β
Radic. Biol. Med., 161, 23$31, doi: 10.1016/j.freeradbiomed.
inhibitor/Nrf2 inducer. A new multitarget therapeutic
2020.09.028.
strategy for Alzheimer’s disease, Sci. Rep., 7, 45701,
90.
Zinovkin, R. A., and Grebenchikov, O. A.
(2020)
doi: 10.1038/srep45701.
Transcription factor Nrf2 as a potential therapeutic target
104. Demuro, S., Di Martino, R. M. C., Ortega, J. A., and
for prevention of cytokine storm in COVID$19 patients,
Cavalli, A. (2021) GSK$3β, FYN, and DYRK1A: Master
Biochemistry (Moscow),
85,
833$837, doi:
10.1134/
regulators in neurodegenerative pathways, Int. J. Mol. Sci.,
S0006297920070111.
22, 9098, doi: 10.3390/ijms22169098.
БИОХИМИЯ том 87 вып. 1 2022
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ СОДЕРЖАНИЯ Nrf2
103
LABILITY OF THE Nrf2/Keap/ARE CELL PROTECTIVE SYSTEM
IN DIFFERENT MODELS OF CELL AGING
AND AGE)RELATED PATHOLOGIES
Review
G. A. Shilovsky1,2,3
1 Belozersky Institute of Physico"Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e"mail: gregory_sh@list.ru, grgerontol@gmail.com
2 Faculty of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia
3 Institute for Information Transmission Problems, Russian Academy of Sciences, 127051 Moscow, Russia
It is known that the level of oxidative stress in the organism increases with age. Accumulation of damage leading to
disruption of the genome integrity can be the cause of the development of many age$related diseases and the appear$
ance of phenotypic and physiological signs of aging. In this regard, the Nrf2 system, which regulates the expression of
numerous enzymes responsible for antioxidant protection and detoxification, is of great interest. The review summa$
rizes and analyzes data on changes in the Nrf2 system during aging in vivo and in vitro in various organs and tissues.
Analysis of the literature suggests that the ability of Nrf2 to activate (triggered by an increased level of oxidative stress)
steadily decreases with age. At the same time, the dynamics of Nrf2 activity measured under stress$free conditions
does not have such a clear direction: in many studies, the above differences are statistically insignificant, although it
is known for sure that the level of oxidative stress steadily increases with aging. This review examines the role of reg$
ulatory systems existing in the cell that limit the ability of Nrf2 to respond to oxidative stress. Senescent cells are vul$
nerable to oxidative damage due to impaired Nrf2 signaling, and activation of the Nrf2 pathway is a promising target
for new pharmacological or genetic therapeutic strategies. Suppressors of Nrf2 expression, such as Keap1, Gsk3, c$
Myc and Bach1, may contribute to age$related impairment of the inducibility of Nrf2$regulated antioxidant genes.
Understanding the mechanisms of interaction of regulatory cascades linking programs for maintaining homeostasis
and the cell’s response to oxidative stress contributes to the elucidation of the molecular mechanisms underlying aging
and longevity.
Keywords: Nrf2, Keap1, aging, lifespan, oxidative stress, age$related disorders, antioxidants
БИОХИМИЯ том 87 вып. 1 2022