БИОХИМИЯ, 2022, том 87, вып. 1, с. 104 - 115
УДК 577.218
ЛИЗИН СПЕЦИФИЧЕСКАЯ ГИСТОНОВАЯ ДЕМЕТИЛАЗА 1
СПОСОБСТВУЕТ ОНКОГЕНЕЗУ ПЛОСКОКЛЕТОЧНОГО РАКА
ПИЩЕВОДА ПУТЕМ АКТИВАЦИИ DUSP4
© 2022
J. Han1,2#, S. Ye3#, J. Chen1,2, K. Wang1,2, J. Jin1,2, Z. Zeng3*, S. Xue1,2*
1 Department of Immunization, Fujian Academy of Medical Sciences,
350003 Fuzhou, Fujian, China; e mail: fjykyxsj@126.com
2 Fujian Institute of Medical Sciences, Fujian Provincial Key Laboratory of Medical Analysis, 350003 Fuzhou, Fujian, China
3 Department of Cardiothoracic Surgery, 900 Hospital of the Joint Logistics Team,
350025 Fuzhou, Fujian, China; e mail: 13809542597@139.com
Поступила в редакцию 06.05.2021
После доработки 20.10.2021
Принята к публикации 21.11.2021
Плоскоклеточный рак пищевода (ПРП) преобладает среди существующих подтипов рака пищевода (РП) и
имеет неблагоприятный прогноз из за агрессивного характера протекания болезни. Поэтому поиск новых
прогностических биомаркеров и терапевтических мишеней при ПРП является актуальной задачей. Лизин
специфическая гистоновая деметилаза 1 (LSD1) играет ключевую роль в регуляции онкогенеза ПРП. Тем не
менее на текущий момент подробный механизм регулируемого LSD1 развития ПРП не установлен. Насто
ящее исследование направлено на изучение молекулярного механизма, лежащего в основе онкогенеза
ПРП, регулируемого LSD1. Путем секвенирования транскриптома на фоне сайленсинга гена LSD1 мы об
наружили дифференциально экспрессируемые гены (ДЭГ) в линии клеток ПРП человека TE 1. Далее мы
исследовали паттерны экспрессии выбранных молекул в тканях и клеточных линиях ПРП с помощью
RT qPCR и вестерн блоттинга. Кроме того, мы исследовали роль выбранных молекул в развитии ПРП с по
мощью сайленсинга и анализа сверхэкспрессии генов. Секвенирование транскриптома показало, что
экспрессия фосфатазы 4 с двойной специфичностью (DUSP4) в TE 1 была значительно снижена после по
давления экспрессии LSD1. Кроме того, уровень экспрессии мРНК DUSP4 был значительно выше в тканях
ПРП, в особенности полученных от пациентов с инвазией или метастазами. Более того, экспрессия DUSP4
положительно коррелировала с экспрессией LSD1 в тканях ПРП. Сверхэкспрессия DUSP4 способствовала
пролиферации, инвазии и миграции клеток ПРП, тогда как сайленсинг гена DUSP4 имел противополож
ный эффект. Сверхэкспрессия DUSP4 также способствовала онкогенности клеток ПРП in vivo, в то время
как подавление экспрессии DUSP4 ингибировало рост опухоли. Важно отметить, что подавление пролифе
рации, инвазии и миграции клеток ингибитором LSD1 (ZY0511) обращалось при сверхэкспрессии DUSP4.
Таким образом, мы обнаружили, что LSD1 способствует онкогенезу ПРП, активируя DUSP4, которая явля
ется потенциальной терапевтической и диагностической мишенью при ПРП.
КЛЮЧЕВЫЕ СЛОВА: фосфатаза 4 с двойной специфичностью, плоскоклеточный рак пищевода, лизин
специфическая гистоновая деметилаза 1.
DOI: 10.31857/S0320972522010079
ВВЕДЕНИЕ
высокой инвазивностью и плохим клиническим
прогнозом, что представляет серьезную угрозу
Рак пищевода (РП) занимает 8 е место среди
для здоровья людей [1, 2]. Плоскоклеточный рак
наиболее распространенных злокачественных
пищевода (ПРП) является основным подтипом
новообразований и является одним из основных
РП. Из за его злокачественности, в частности
видов опухолей желудочно кишечного тракта.
высокой инвазивности и уровня метастазирова
Данный вид рака характеризуется в основном
ния в лимфатические узлы, протекание ПРП за
частую приводит к плохому клиническому исхо
ду [3]. Следовательно, основным направлением
Принятые сокращения: CCK 8 - набор для подсче
та клеток 8; ДЭГ - дифференциально экспрессируемые ге
онкологических исследований у пациентов с
ны; DUSP4 - фосфатаза 4 с двойной специфичностью;
ПРП является повышение терапевтической эф
РП - рак пищевода; ПРП - плоскоклеточный рак пище
вода; H3K4me2 - гистон H3 с диметилированным лизи
фективности и улучшение прогноза болезни.
ном в четвертом положении; LSD1 - лизин специфичес
Лизин специфическая гистоновая демети
кая гистоновая деметилаза 1.
лаза 1 (LSD1) представляет собой ядерную гис
* Адресат для корреспонденции.
тоновую деметилазу, которая является членом
# Авторы внесли равный вклад в работу.
семейства аминоксидаз (АО). LSD1 - флавин
104
LSD1 СПОСОБСТВУЕТ РАЗВИТИЮ ПРП ПУТЕМ АКТИВАЦИИ DUSP4
105
содержащая АО, которая катализирует демети
МАТЕРИАЛЫ И МЕТОДЫ
лирование гистона H3 по лизину в 4 м положе
нии посредством ФАД зависимого окисления.
Клеточные линии и культуры. Линия нормаль
LSD1 участвует в эмбриональной дифференци
ных эпителиальных клеток пищевода человека
ровке, пролиферации плюрипотентных стволо
Het 1A и линии ПРП, TE 1, TE 13 и KYSE 450,
вых клеток и развитии ВИЧ инфекции [4-6].
были получены из Американской коллекции ти
Известно, что экспрессия LSD1 повышается в
повых культур (ATCC, American Type Culture
различных раковых тканях и вносит большой
Collection). Het 1A инкубировали в бессыворо
вклад в онкогенез множества опухолей [7-10].
точной среде для кератиноцитов (Keratinocyte
Более того, экспрессия LSD1 при ПРП и ее влия
Serum Free Medium (K SFM),
«Invitrogen»,
ние на пролиферацию, инвазию и миграцию
США). TE 1, TE 13 и KYSE 450 инкубировали в
клеток ПРП описаны во многих исследованиях.
среде RPMI 1640 («Invitrogen») с добавлением
Yu et al. выявили, что экспрессия LSD1 повыша
10% ной фетальной бычьей сыворотки (FBS,
лась в тканях ПРП, что, в свою очередь, ассоции
«Invitrogen»). Все клетки культивировали в ув
ровалось с метастазированием в лимфатические
лажненной атмосфере при 37 °C с 5% ным CO2.
узлы и плохой выживаемостью [11]. Исследова
Для обработки клеток TE 1 был использован но
ние in vitro также показало, что регуляция
вый ингибитор LSD1, ZY0511 (предоставленный
экспрессии LSD1 в инвазивных клеточных ли
Государственной лабораторией биотерапии, Сы
ниях ПРП нарушена, а подавление экспрессии
чуаньский университет, Сычуань, Китай), в кон
и фармакологическое ингибирование LSD1 ас
центрации 2 мкМ [17, 18].
социированы со снижением миграции и инва
Клинические образцы тканей. В общей слож
зии клеток ПРП [11]. Проведенные ранее иссле
ности 43 пары образцов ПРП и прилегающих
дования также подтвердили подавляющее
доброкачественных тканей были получены пу
действие ингибитора LSD1 на рост клеток, а
тем хирургической резекции в больнице про
также индуцирование им апоптоза в клетках
винции Фуцзянь (Фучжоу, Фуцзянь, Китай) с
ПРП [12, 13]. Аналогичные результаты были по
письменного информированного согласия па
лучены и в других исследованиях [14, 15]. Если
циентов, среди которых было 28 мужчин и
объединить все полученные результаты, стано
15 женщин. До операции пациенты не получали
вится очевидно, что действие LSD1 имеет важ
ни химиотерапию, ни лучевую терапию. Все об
ное значение в диагностике и лечении ПРП.
разцы тканей были гистопатологически иссле
Hou et al. показали, что LSD1 положительно ре
дованы тремя независимыми патологами. Об
гулирует передачу сигналов в путях Notch и
разцы свежих тканей замораживали в жидком
PI3K/Akt/mTOR за счет связывания с промо
азоте и до использования хранили при темпера
торными областями соответствующих генов пу
туре -80 °C. Все пациенты дали согласие на дан
ти Notch в клетках ПРП [16]. Однако в выше
ное исследование в соответствии с установлен
упомянутом исследовании не обсуждалась под
ными больницей этическими нормами. Данное
робно роль сигнальных путей, регулируемых
исследование было рассмотрено и одобрено
LSD1, при онкогенезе ПРП. Следовательно, де
Экспертным советом больницы провинции
тальный механизм регулируемого LSD1 разви
Фуцзянь [No. (DL) 2019 01]. Все клинические
тия ПРП остается неясным.
исследования проводились в соответствии с
В настоящем исследовании путем сайлен
принципами, изложенными в Хельсинкской
синга LSD1 в клеточной линии ПРП TE 1 мы
декларации.
обнаружили при помощи секвенирования тран
Трансфекция миРНК. Контрольные малые
скриптома, что уровень экспрессии фосфата
интерферирующие РНК (миРНК, siRNA) и
зы 4 двойной специфичности (DUSP4) был зна
миРНК к LSD1 и к DUSP4 человека были при
чительно снижен. Кроме того, была подтверж
обретены в компании «Invitrogen». Целевые
дена сверхэкспрессия DUSP4 в опухолевых тка
последовательности были следующими:
нях и ее влияние на пролиферацию, функцию и
онкогенность клеток ПРП. Также была подтве
Контроль, 5′ UUCUCCGAACGUGUCACGUTT 3′,
рждена способность DUSP4 компенсировать
LSD1, 5′ CCGGAUGACUUCUCAAGAATT 3′;
ингибирование LSD1. Таким образом, наше ис
следование предоставляет первые доказатель
Контроль, 5′ CCCATCCTTCAACGAGCAT 3′,
ства, демонстрирующие, что LSD1 способствует
DUSP4, 5′ CCCAGTACCTTACCAGCAT 3′.
развитию ПРП, вероятно, посредством нижес
тоящих сигналов, что улучшает наше понима
Клетки культивировали в 6 луночных планше
ние процесса LSD1 регулируемого развития
тах, а затем трансфицировали миРНК (100 пмоль/
ПРП.
лунку) с использованием реагента RNAiMAX
БИОХИМИЯ том 87 вып. 1 2022
106
HAN и др.
(«Invitrogen») в соответствии с протоколом про
тризола. Синтез кДНК и qRT PCR были прове
изводителя. Через 48 ч проводили определения
дены по раннее описанному протоколу [19].
уровней эндогенного LSD1 или DUSP4 с по
Последовательности праймеров для qRT PCR
мощью qRT PCR.
были следующими:
Конструирование и трансфекция векторов.
Экспрессионный вектор DUSP4 (pCMV myc
LSD1, 5′ CCAGAGATATTACTGCCGAGTT 3′
DUSP4) был получен в лаборатории «BioVector
(смысловой праймер) и 5′ GCTTTCCTTGT
Science» (Пекин, Китай). Вектор стабильно
GTTTCAGCTAA 3′ (антисмысловой праймер);
экспрессировался в клетках ТЕ 1. В качестве от
рицательного контроля использовали pCMV
DUSP4, 5′ CTACATCCTAGGTTCGGTCAAC 3′
myc control. Трансфекцию выполняли с по
(смысловой праймер) и 5′ TAGACGATGACC
мощью липофектамина 3000 («Invitrogen») в со
GCCGAGTA 3′ (антисмысловой праймер);
ответствии с протоколом производителя.
Экспрессию DUSP4 оценивали с помощью
β актин, 5′ GGGAAATCGTGCGTGACATTAAG 3′
qRT PCR.
(смысловой праймер) и 5′ TGTGTTGGCGTA
Секвенирование РНК. Тотальную РНК полу
CAGGTCTTTG 3′ (антисмысловой праймер).
чали из приблизительно 5 млн клеток TE 1 с
сайленсингом LSD1 и из контрольных клеток с
Относительную экспрессию рассчитывали с
использованием тризола («Ambion», США) в со
использованием метода 2-ΔΔCt.
ответствии с инструкциями производителя. За
qRT PCR выполняли с использованием на
тем тотальную РНК (2 мкг) использовали для
бора «SYBR Premix Ex TaqTM» («TakaRa», Япо
приготовления библиотеки RNA seq с использо
ния) и системы ПЦР ABI7500
(«Applied
ванием набора «NEBNext UltraTM RNA Library
Biosystems», США).
Prep Kit» («Illumina», США) в соответствии с
Измерение жизнеспособности клеток. Для
протоколом производителя. Образцы из библио
оценки пролиферации клеток использовали на
теки секвенировали на платформе Illumina
бор для подсчета клеток 8 (CCK 8). Для этого об
Hiseq 4000 с длиной парноконцевых прочтений
работанные указанным выше образом клетки по
150 нуклеотидов (2 × 150). «Сырые данные» в
мещали в 96 луночные планшеты (2000 кле
формате FASTQ обрабатывали с помощью
ток/лунку). По истечении указанного времени
собственных скриптов на Perl. Прочтения вы
обработанные клетки инкубировали с 10 мкл реа
равнивали на геном человека (сборка GRCh38) с
гента CCK 8 («Dojindo», Япония). После 2 часо
использованием TopHat 2 (версия 2.1.0). Уровни
вой инкубации измеряли оптическую плотность с
экспрессии генов (FPKM, количество фрагмен
помощью ридера Varioskan Flash («Thermo Fisher
тов на килобазу транскрипта на миллион карти
Scientific») при длине волны 450 нм (OD450).
рованных прочтений) рассчитывали с помощью
Анализ способности клеток к инвазии. Спо
HTSeq (версия 0.5.4 p3). Все последующие ста
собность клеток TE 1 к инвазии оценивали с
тистические анализы, включая PCA (анализ
помощью миграционного анализа в Transwell
главных компонентов), были выполнены с по
системе. Для этого клетки, суспендированные в
мощью программного пакета edgeR.
бессывороточной питательной среде DMEM с
Вестерн блоттинг. Цельноклеточные лизаты
добавлением 1 мг/мл митомицина C (ингибито
клеток, обработанные как указано выше, были
ра пролиферации клеток) и ZY0511 (добавлен
отобраны из 6 луночных планшетов. Лизаты
ного в соответствии с планом эксперимента),
разделяли в 10% ном полиакриламидном геле в
высевали в верхнюю камеру Transwell системы.
присутствии додецилсульфата (SDS PAAG), за
В нижнюю камеру добавляли среду DMEM, со
тем переносили на мембраны из поливинилиден
держащую 20% FBS. После 36 часовой инкуба
фторида, которые инкубировали с антителами к
ции клетки, мигрировавшие в нижнюю часть
LSD1 (# 2139), DUSP4 (# 5149), диметилирован
системы, фиксировали, затем окрашивали
ного по лизину 4 гистона H3 (H3K4me2, # 9725)
1% ным кристаллическим фиолетовым и фо
и GAPDH (# 5174) («Cell Signaling Technology»,
тографировали. Степень инвазии измеряли пу
США). Вторичные антитела, связанные с пе
тем подсчета числа окрашенных клеток.
роксидазой хрена (# 3999), использовали для
Анализ миграционной активности клеток.
визуализации иммунореактивности с использо
Способность клеток TE 1 к миграции измеряли
ванием
системы
хемилюминесценции
с помощью скретч теста. Для этого клетки вы
Amersham Image 600 («General Electric», США).
сеивали в 12 луночные планшеты и культивиро
Количественный анализ методом ПЦР в ре
вали до 75% ного уровня конфлюэнтности. За
альном времени (qRT PCR). Тотальную РНК
тем создавали царапину на поверхности клеточ
экстрагировали и очищали с использованием
ного монослоя с помощью кончика 200 микро
БИОХИМИЯ том 87 вып. 1 2022
LSD1 СПОСОБСТВУЕТ РАЗВИТИЮ ПРП ПУТЕМ АКТИВАЦИИ DUSP4
107
литровой пипетки. Для удаления плавающих
регулируемого канцерогенеза при ПРП мы ана
клеток культуры промывали, а затем прикреп
лизировали глобальную экспрессию в клетках
ленные клетки инкубировали в среде DMEM,
TE 1 в условиях сайленсинга LSD1. Для анализа
содержащей 1% FBS и ZY0511 (добавленные в
клеток ТЕ 1, трансфицированных контрольной
соответствии с планом эксперимента). Мигра
и миРНК LSD1, использовали RNA seq
цию клеток в область царапины определяли че
(рис. 1, a). Транскриптомный анализ выявил
рез 36 ч для каждой группы. Площадь царапины
большое количество дифференциально экс
рассчитывали с помощью программы ImageJ.
прессируемых генов (ДЭГ) (рис. 1, а и b). По
Эксперименты с использованием животных.
сравнению с контролем в клетках TE 1, транс
Самцы бестимусной линии мышей BALB/c nude
фицированных миРНК LSD1, было обнаруже
возрастом 4-5 недель (весом 20-22,5 г) были
но 439 генов с повышенной и 69 генов - с пони
предоставлены Центром животных
«Gem
женной экспрессией (рис. 1, b).
Pharmatech Co., Ltd.» (Нанкин, Китай). Клетки,
Следует отметить, что мы обнаружили зна
трансфицированные DUSP4 миРНК, вектором
чительное снижение экспрессии DUSP4 в клет
DUSP4, и соответствующие контрольные клетки
ках с сайленсингом LSD1 (рис. 1, c и табл. 1).
линии ТЕ 1 инокулировали подкожно на вент
Снижение экспрессии DUSP4 в клетках TE 1 с
ральную сторону правого ребра; плотность ино
сайленсингом LSD1 было подтверждено при по
куляции составляла 5 × 106 клеток на мышь
мощи анализа вестерн блот и qRT PCR
(6 мышей на группу). Чтобы проследить рост
(рис. 1, d). Кроме того, в присутствии ингибито
опухоли, объем опухоли измеряли каждые три
ра LSD1, ZY0511, экспрессия LSD1 не измени
дня у всех мышей. Для определения объема опу
лась, однако экспрессия DUSP4 значительно
холи самый маленький диаметр (A) и самый
снизилась (рис. 1, e). Предыдущие исследова
большой диаметр (B) измеряли штангенцирку
ния показали, что деметилирование H3K4me2
лем. Объем (V) рассчитывали по формуле
может быть использовано для определения ак
V = (A2×B)/2. Через 30 дней всех мышей анесте
тивности LSD1 [20, 21]. Отмечено, что ZY0511
зировали изофлураном (2%, ингаляционная
приводит к повышению уровня H3K4me2
анестезия), а затем умерщвляли путем смещения
(рис. 1, e), что указывает на надежность экспе
шейных позвонков. Все мыши считались мерт
риментальной системы. В целом, данные ре
выми после остановки сердца и дыхания. Опухо
зультаты продемонстрировали ингибирующий
ли мышей были удалены и взвешены. Все прото
эффект LSD1 на экспрессию DUSP4 в клетках
колы экспериментов были одобрены Комитетом
ПРП.
по уходу за животными и их использованию Ака
Сверхэкспрессия DUSP4 в образцах ПРП.
демии медицинских наук Фуцзянь. Мышей со
Уровни DUSP4 в 43 парах тканей ПРП и сосед
держали в специальном помещении, свободном
них доброкачественных определяли с помощью
от патогенов (specific pathogen free, SPF) и огра
qRT PCR. На рис. 2, а продемонстрирована зна
ниченном барьером, при температуре 20-30 °C,
чительная сверхэкспрессия DUSP4 в образцах
влажностью 60-80%, кормили SPF кормом для
ткани ПРП по сравнению с расположенными
мышей, вода была доступна ad libitum.
рядом доброкачественными тканями. Анализ
Статистическая обработка полученных ре
корреляции между уровнями DUSP4 и клинико
зультатов. Статистическую обработку результа
патологическими характеристиками пациентов
тов экспериментов проводили с использовани
с ПРП показал, что высокий уровень экспрес
ем программного обеспечения GraphPad
сии DUSP4 положительно коррелировал с раз
Prism 6. Были выполнены следующие тесты:
мером опухоли при ПРП и патологической ста
Т критерий Вилкоксона, односторонний тест
дией T/N (табл. 2). Более того, 18 образцов ПРП
ANOVA или t критерий Стьюдента (в соответ
с метастазами характеризовались более высокой
ствующих случаях). Тест Бонферрони приме
экспрессией DUSP4, чем 25 неметастатических
нялся для апостериорного множественного
образцов ПРП (рис. 2, b). Кроме того, по срав
сравнения. Для анализа корреляций применяли
нению с 21 образцом ПРП диаметром менее
метод Пирсона и критерий хи квадрат Пирсона.
3 см, 22 образца ПРП диаметром более 3 см ха
Значение p < 0,05 считалось статистически зна
рактеризовались более высокой экспрессией
чимым.
DUSP4 (рис. 2, c). Важно отметить, что корреля
ционный анализ между уровнями DUSP4 и
LSD1 в тканях ПРП показал, что уровни
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
экспрессии DUSP4 были положительно ассоци
ированы с уровнем экспрессии LSD1 в тканях
LSD1 способствует экспрессии DUSP4 в клет
ПРП (r = 0,8996, p < 0,0001) (рис. 2, d), что сви
ках ПРП. Для исследования механизмов LSD1
детельствует о положительном эффекте LSD1 на
БИОХИМИЯ том 87 вып. 1 2022
108
HAN и др.
a
b
ZY0511
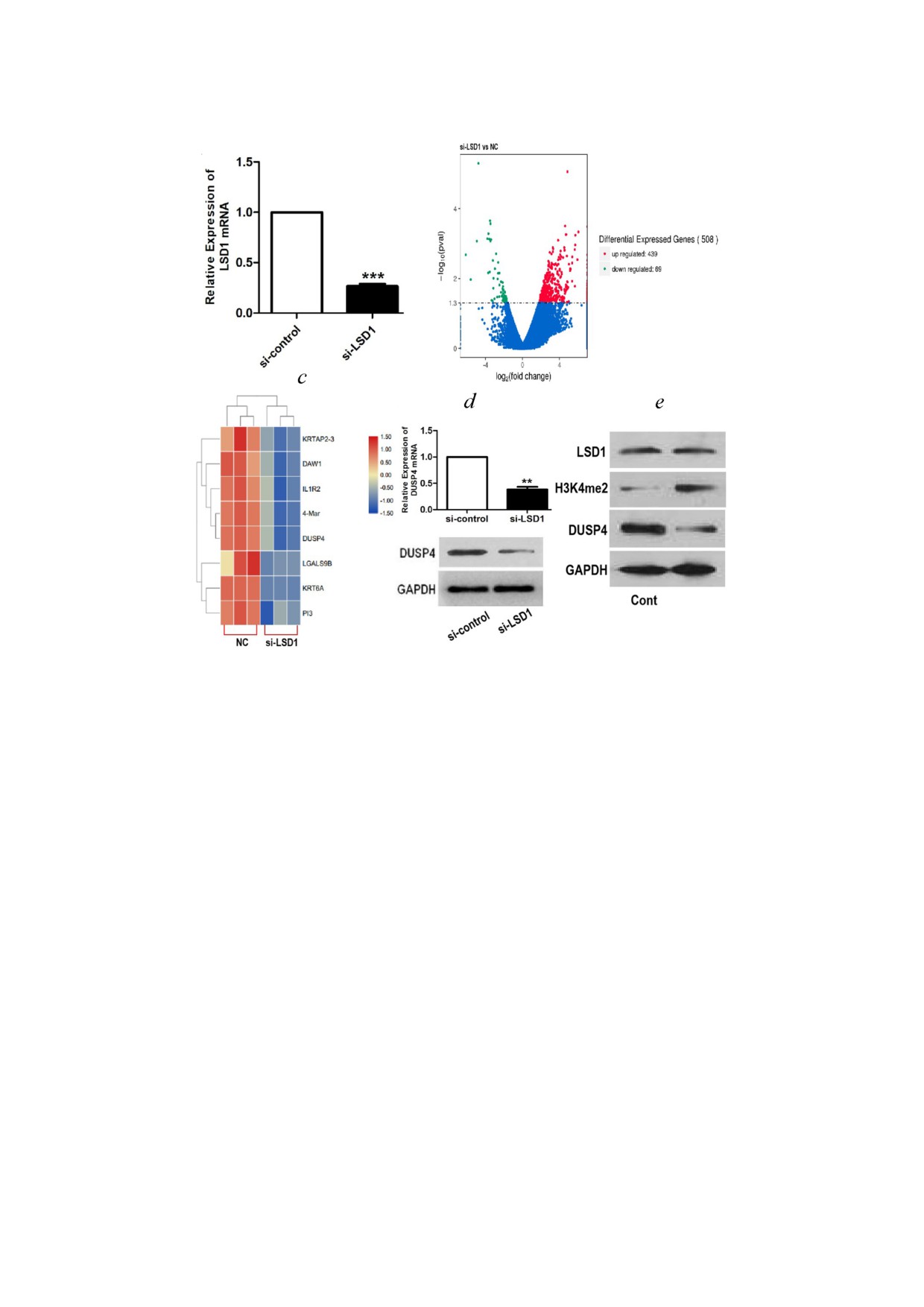
Рис. 1. LSD1 способствует экспрессии DUSP4 в клетках ПРП. а - Уровни мРНК LSD1 в клетках TE 1, трансфицирован
ных указанными миРНК, через 48 часов после трансфекции. b - Диаграмма Volcano, представляющая анализ дифферен
циальной экспрессии 508 генов, основанный на результатах секвенирования РНК клеток TE 1, трансфицированных
миРНК контролем и миРНК LSD1 (n = 3 в каждой группе). По оси X показано изменение в логарифмическом масшта
бе (log2), по оси Y - отрицательный логарифм значения p (log10). Каждый ген представлен одной точкой на графике; крас
ные точки - повышенная экспрессия (439 генов), зеленые - пониженная (69 генов). c - Тепловая карта, представляющая
анализ дифференциальной экспрессии нескольких репрезентативных генов между клетками TE 1, трансфицированны
ми миРНК контролем и миРНК LSD1 (n = 3 в каждой группе). d - Уровни мРНК или белка DUSP4 в клетках TE 1,
трансфицированных миРНК контролем и миРНК LSD1. e - После обработки 2 мкМ ZY0511 или без нее через 48 ч оце
нивали уровни белка LSD1, H3K4me2 и DUSP4 с помощью вестерн блоттинга. Результаты представлены как среднее зна
чение ± стандартная ошибка среднего трех независимых экспериментов. *** p < 0,001 по t критерию Стьюдента. Приме
чание: NC - клетки, трансфицированные миРНК контролем (si control); Cont - контрольная группа, ZY0511 - в присут
ствии ингибитора LSD1
экспрессию DUSP4 in vivo. Кроме того, были
агрессивных раковых клеток KYSE 450 (рис. 2,
определены уровни экспрессии мРНК DUSP4 и
f-i), что доказывает вклад DUSP4 в злокачест
белков LSD1, DUSP4 и H3K4me2 в нормальной
венность ПРП.
эпителиальной линии клеток пищевода Het 1A
Сверхэкспрессия DUSP4 способствует проли
и клеточных линиях ПРП: TE 1, TE 13 и
ферации, инвазии и миграции клеток ПРП, тогда
KYSE 450. Как показано на рис. 2, e-i, LSD1 и
как нокдаун DUSP4 имеет противоположный эф
DUSP4 были значительно сверхэкспрессирова
фект. Чтобы исследовать роль DUSP4 в онкоге
ны в клеточных линиях ПРП. Тем не менее из
незе ПРП, мы активировали или ингибировали
менение уровня экспрессии H3K4me2 было
экспрессию DUSP4 путем трансфекции клеток
противоположным таковому для LSD1 (рис. 2,
ТЕ 1 вектором, кодирующим DUSP4 (DUSP4
f-i), что указывает на деметилирование
вектор) или миРНК DUSP4 соответственно
H3K4me2 в клеточных линиях ПРП, что под
(рис. 3, a). Анализ CCK 8 показал, что сверхэкс
тверждает функцию LSD1. Примечательно, что
прессия DUSP4 усиливала пролиферацию кле
уровни DUSP4 были самыми высокими в линии
ток TE 1 (рис. 3, b). Кроме того, результаты ана
БИОХИМИЯ том 87 вып. 1 2022
LSD1 СПОСОБСТВУЕТ РАЗВИТИЮ ПРП ПУТЕМ АКТИВАЦИИ DUSP4
109
Таблица 1. Репрезентативные ДЭГ при анализе транскриптома (число прочтений)
Группа
si Cont 1
si Cont 2
si Cont 3
si LSD1 1
si LSD1 2
si LSD1 3
log2 (FC)
Значение p
Гены со сниженной
экспрессией
DUSP4
3360
2597
2840
232
307
585
-3,407
0,000771
KRTAP2 3
118
69
57
4
8
12
-3,8013
0,000728
DAW1
252
151
250
11
21
38
-3,6926
0,000521
IL1R2
302
196
232
12
24
50
-3,595
0,000744
MARCHF4
648
522
524
36
54
125
-3,4751
0,000845
KRT6A
1911
1707
1824
84
80
72
-4,7817
5,10E 06
PI3
988
710
658
109
82
31
-3,5168
0,000222
Гены с повышенной
экспрессией
AGXT
1
3
7
120
51
50
4,2234
0,020883
VTCN1
4
6
10
116
394
274
4,8795
8,79E 06
TRANK1
2
10
17
42
119
214
3,1454
0,001990
FOXN1
1
2
1
32
37
19
4,2008
0,002346
ZCCHC12
6
22
19
191
271
105
3,3335
0,001416
Примечание. log2 (FC, Fold Change) - изменение в логарифмическом масштабе по основанию 2; si Cont - клетки, транс
фицированные миРНК контролем; si LSD1 - клетки, трансфицированные миРНК LSD1.
лиза миграции в Transwell системе показали, что
Таблица 2. Корреляция между DUSP4 и клинико патоло
гическими характеристиками у пациентов с ПРП
сверхэкспрессия DUSP4 увеличивает количест
во инвазивных клеток. Скретч тест показал, что
Число случаев с
сверхэкспрессия DUSP4 приводит к увеличе
соответствующим
Характеристики
Число
Значение
нию числа мигрирующих клеток (рис. 3, c-f).
уровнем DUSP4
случаев
p
Нокдаун DUSP4 дает противоположные резуль
таты (рис. 3, b-f). В целом, DUSP4 играет значи
низкий
высокий
тельную роль в усилении пролиферации, инва
зии и миграции клеток ПРП. Также мы прово
Всего
43
21
22
дили сайленсинг DUSP4 в клеточной линии
Пол
p = 0,2838
ПРП KYSE 450 посредством трансфекции
Мужской
28
12
16
миРНК (рис. S1, a в Приложении). Как показа
Женский
15
9
6
но на рис. S1, b-f в Приложении, клетки
Возраст
p = 0,2797
KYSE 450 с сайленсингом DUSP4 демонстриру
ют более низкий уровень пролиферации, инва
≥65
20
8
12
зии и миграции, что дополнительно подтверж
<65
23
13
10
дает результаты, представленные выше.
Диаметр опухоли ПРП
p = 0,0223
Сверхэкспрессия DUSP4 способствует онко
≥3,0 см
22
7
15
генности клеток ПРП, в то время как сайленсинг
<3,0 см
21
14
7
DUSP4 имеет обратный эффект. Влияние DUSP4
на онкогенность клеток ПРП также исследова
Патологическая
p = 0,0191
ли in vivo. Как показано на рис. 4, a и b, актива
стадия (T)
цию или ингибирование экспрессии DUSP4
T2
25
16
9
оценивали путем определения уровней мРНК
T3 T4
18
5
13
или белка. Примечательно, что размеры и масса
Патологическая
p = 0,0075
опухолей, сформированных DUSP4 сверхэкс
стадия (N)
прессирующими TE 1 клетками у мышей линии
N0
30
18
12
nude, были значительно больше, чем у мышей,
инокулированных соответствующими конт
N1 N3
13
3
10
рольными TE 1 клетками (рис. 4, c и e). Кроме
Примечание. В качестве порогового значения использова
того, увеличение объема опухоли у мышей nude,
ли средний уровень экспрессии DUSP4. Значение p опре
инокулированных TE 1 со сверхэкспрессией
деляли с помощью критерия хи квадрат Пирсона.
БИОХИМИЯ том 87 вып. 1 2022
110
HAN и др.
DUSP4, было более значительным, чем у соот
клетках ПРП. Может ли DUSP4 опосредовать
ветствующей контрольной группы, инокулиро
онкогенез ПРП, регулируемый LSD1? При при
ванной TE 1 (рис. 4, d). Тем не менее клетки ТЕ
менении ZY0511 для ингибирования активности
1 с сайленсингом DUSP4 демонстрировали бо
LSD1 было обнаружено, что пролиферация, ин
лее слабую онкогенность по сравнению с соот
вазия и миграция клеток TE 1 значительно сни
ветствующими контрольными TE 1, основыва
жались, аналогично результатам нокдауна
ясь из вышеупомянутых параметрах (рис. 4,
DUSP4 (рис. 5, a-e). Сверхэкспрессия DUSP4 в
c-e). Эти результаты позволяют предположить,
значительной степени обратила ингибирующее
что DUSP4 способствует онкогенезу клеток
влияние ZY0511 на пролиферацию, инвазию и
ПРП in vivo.
миграцию клеток TE 1 (рис. 5, a-e). Получен
Сверхэкспрессия DUSP4 частично восстанав
ные результаты позволяют предполагать, что
ливает уровень пролиферации, инвазии и мигра
DUSP4 является нижестоящим эффектором при
ции, которые были снижены ингибитором LSD1 в
онкогенезе ПРП, регулируемом LSD1 in vitro.
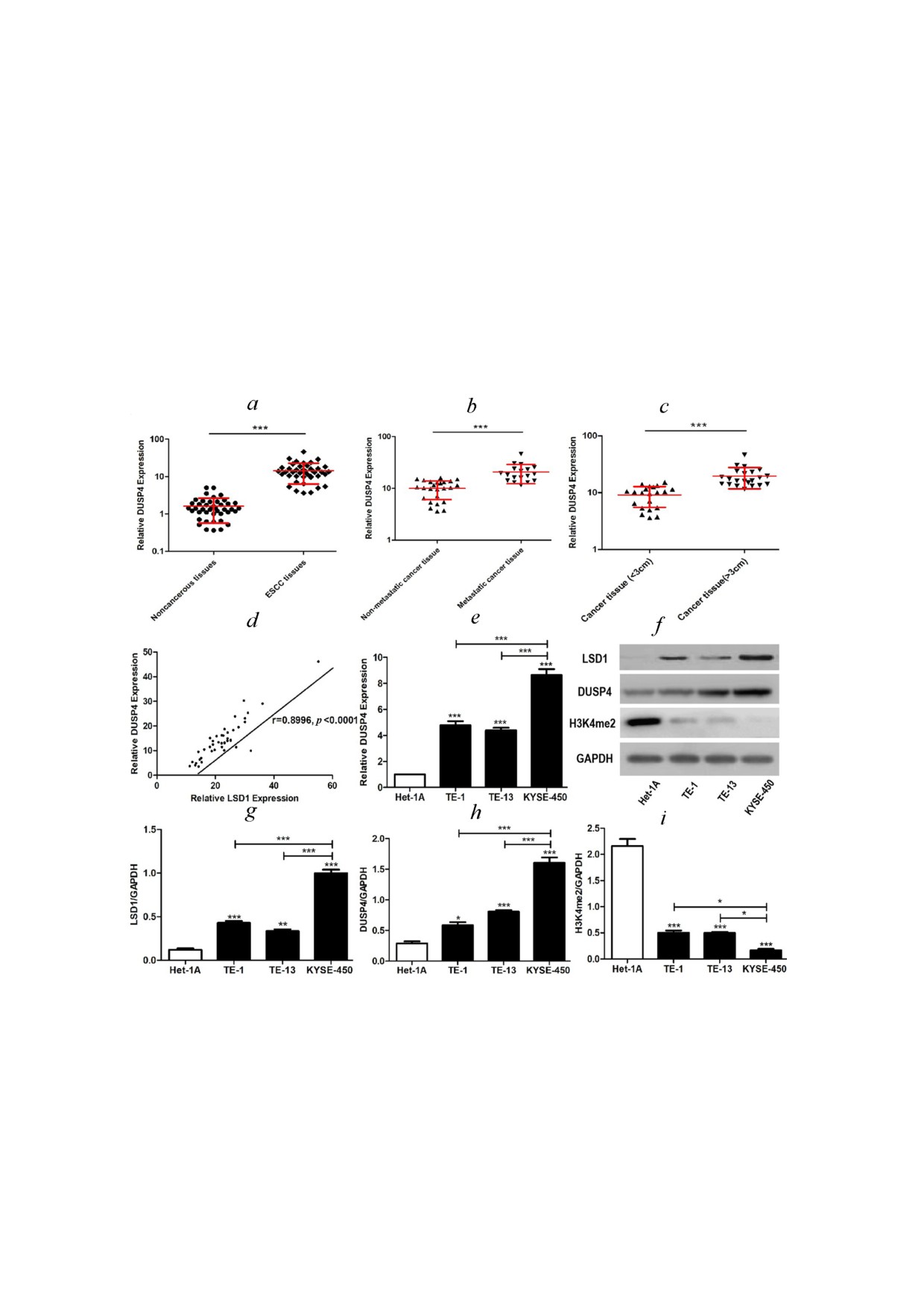
Рис. 2. Экспрессия DUSP4 в образцах ПРП (ESCC). a - Уровни мРНК DUSP4 в 43 парах тканей ПРП и прилегающих доб
рокачественных. b - Уровни мРНК DUSP4 в 18 образцах ПРП с метастазами и 25 неметастатических образцах ПРП.
с - Уровни мРНК DUSP4 в 22 образцах ПРП диаметром более 3 см и 21 образце ПРП диаметром менее 3 см. Результаты
a-c представлены в виде медианы с межквартильным размахом. *** p < 0,001 по критерию Вилкоксона. d - Ассоциация
между уровнями мРНК LSD1 и DUSP4 в тканях ПРП (проанализировано с помощью корреляционного анализа Пирсо
на, n = 43, r = 0,8996, p < 0,0001). e - Уровни мРНК DUSP4 в нормальной линии эпителиальных клеток пищевода, Het 1A
и клеточных линиях ПРП, TE 1, TE 13 и KYSE 450. f-i - Уровни белков LSD1, DUSP4 и H3K4me2 в Het 1A, TE 1, TE 13
и KYSE 450 оценивали с помощью вестерн блоттинга. Результаты e-i представлены как среднее значение ± стандартная
ошибка среднего из трех независимых экспериментов. * p < 0,05, ** p < 0,01, *** p < 0,001 по однофакторному анализу
ANOVA
БИОХИМИЯ том 87 вып. 1 2022
LSD1 СПОСОБСТВУЕТ РАЗВИТИЮ ПРП ПУТЕМ АКТИВАЦИИ DUSP4
111
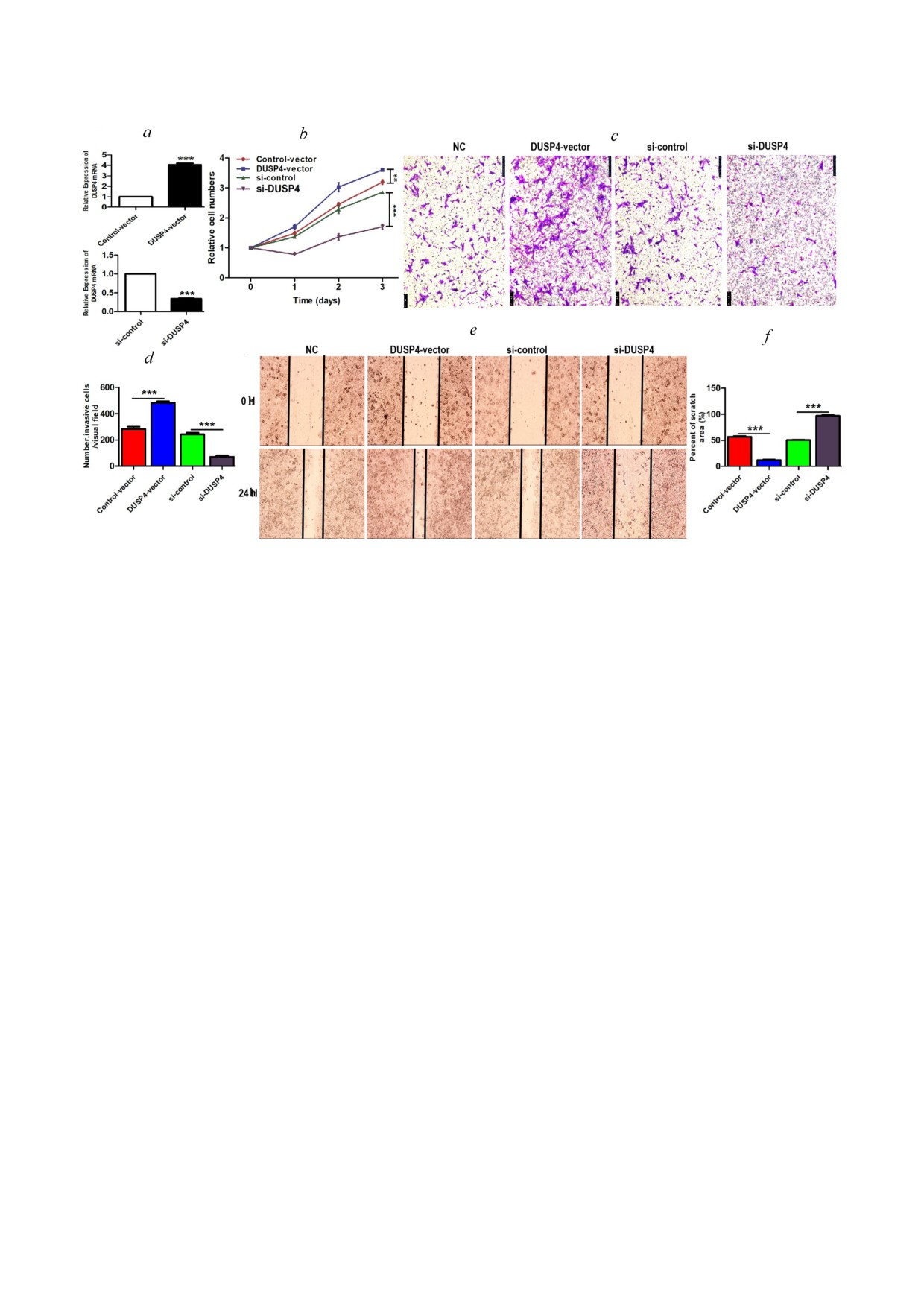
Рис. 3. Сверхэкспрессия DUSP4 способствует пролиферации, инвазии и миграции клеток ПРП, тогда как нокдаун DUSP4
имеет противоположный эффект. а - Уровни мРНК DUSP4 в клетках TE 1, трансфицированных указанными миРНК (si )
или плазмидами, через 48 ч. b - Пролиферация клеток ТЕ 1, трансфицированных указанными миРНК или плазмидами,
оцениваемая с помощью анализа CCK 8. с, d - Инвазия клеток TE 1, трансфицированных указанными миРНК или плаз
мидами, оцениваемая с помощью анализа миграции в Transwell системе (масштаб 200 мкм). e - Миграция клеток ТЕ 1,
трансфицированных указанными миРНК или плазмидами, оцениваемая с помощью скретч тестов. Изображения полу
чали под микроскопом через 0 и 24 часа. f - Коэффициенты миграции клеток (24 ч / 0 ч) показаны на гистограмме. Ре
зультаты представлены как среднее значение ± стандартная ошибка среднего из трех независимых экспериментов.
** p < 0,01, *** p < 0,001 по однофакторному анализу ANOVA. Примечание. NC - группа с контрольным вектором;
DUSP4 - группа с DUSP4 вектором
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
белок является членом семейства фосфатаз с
двойной специфичностью и может негативно
Важность роли LSD1/KDM1A в онкогенезе
регулировать активность MAP киназ [22]. Из
привлекает большое внимание [7-10]. Приме
менения экспрессии DUSP4 вовлечены в онко
чательно, что все большее количество исследо
генез множества опухолей. Уровень экспрессии
ваний, касающихся ПРП, также сосредоточива
DUSP4 повышается при карциномах толстой
ется на LSD1 [11-16]. Проведенные ранее ис
кишки, молочной железы, прямой кишки, пече
следования продемонстрировали критическую
ни и поджелудочной железы, поэтому повыше
роль LSD1 в патогенезе ПРП [11-16], однако
ние экспрессии DUSP4 может быть маркером
конкретный механизм LSD1 регуляции возник
неблагоприятного прогноза при различных зло
новения и развития ПРП не был установлен; ис
качественных опухолях [23-26].
следование этого механизма составляет инте
Zhang et al. показали, что сангвинарин по
ресную научную проблему.
давляет рост и инвазию клеток рака желудка
В условиях сайленсинга LSD1 с помощью
посредством ингибирования передачи сигналов
транскриптомного анализа мы обнаружили, что
DUSP4 [27]. Xu et al. продемонстрировали, что
экспрессия DUSP4 в клетках ПРП также была
miR 122 5p ингибирует миграцию и инвазию
значительно ингибирована; данный факт под
клеток рака желудка, воздействуя на
тверждает, что LSD1 положительно регулирует
DUSP4 [28]. De et al. подтвердили, что высокая
экспрессию DUSP4 в клетках ПРП. Те же выво
экспрессия DUSP4 ассоциирована со снижен
ды были получены при анализе уровней мРНК и
ной общей выживаемостью и с клиническими
белка. DUSP4 известен как биологический мар
характеристиками, типичными для высокоин
кер множества злокачественных опухолей. Этот
вазивного колоректального рака (КРР) [29]. Бо
БИОХИМИЯ том 87 вып. 1 2022
112
HAN и др.
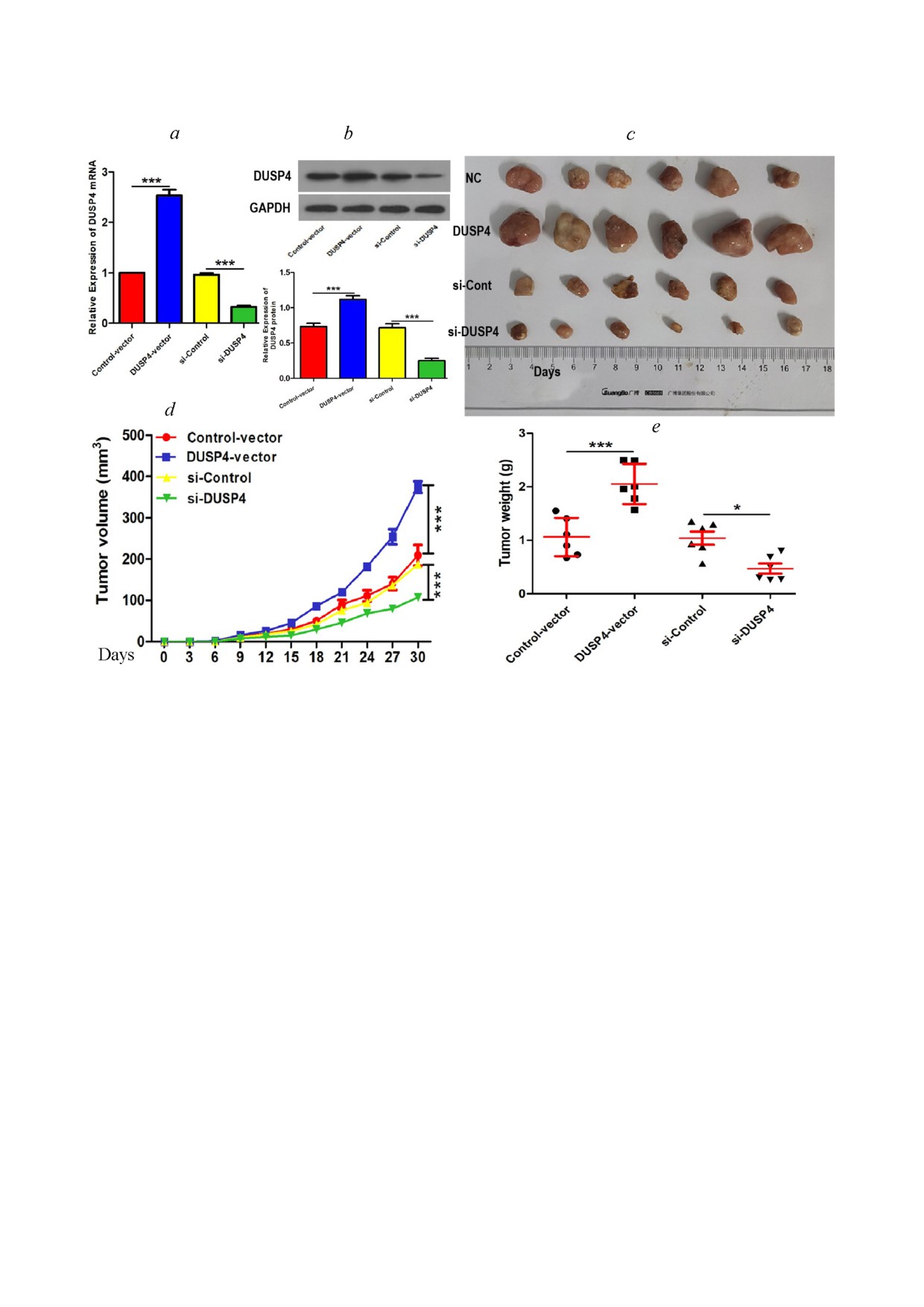
Рис. 4. Сверхэкспрессия DUSP4 способствует онкогенности клеток ПРП, в то время как нокдаун DUSP4 имеет противо
положный эффект. Трансфицированные вектором DUSP4, трансфицированные миРНК DUSP4 или соответствующие
контрольные клетки TE 1 инокулировали бестимусным мышам. Спустя 30 дней мышей с опухолями умерщвляли, все
опухоли удаляли и взвешивали. а - Экспрессия мРНК DUSP4 в опухолевых тканях 4 групп мышей, оцениваемая с по
мощью количественной ПЦР (n = 6). b - Экспрессия белка DUSP4 в опухолевых тканях из четырех групп мышей, оцени
ваемая с помощью вестерн блоттинга (n = 6). c - Репрезентативные изображения удаленных у мышей опухолей. d - Объем
опухоли измеряли каждые три дня для каждой мыши и строили кривую роста объема опухоли (n = 6). e - Сравнение ве
са опухолей (n = 6). Результаты представлены как среднее значение ± стандартная ошибка среднего. * p < 0,05, *** p < 0,001
по однофакторному анализу ANOVA. Примечание. NC - удаленные у мышей опухоли с клетками, трансфицированными
контрольным вектором; DUSP4 - удаленные опухоли с клетками, трансфицированными вектором DUSP4
лее того, сверхэкспрессия DUSP4 приводит к
между экспрессией DUSP4 и клинико патоло
повышенной пролиферации клеток линий
гическими особенностями показал, что повы
КРР [23]. Таким образом, становится ясно, что
шенная экспрессия DUSP4 ассоциирована с бо
DUSP4 не только активно экспрессируется в
лее низкой общей выживаемостью. Соответ
различных опухолевых тканях, но также служит
ственно, приведенные выше данные позволяют
промотором роста и распространения некото
рассматривать DUSP4 в качестве нового прог
рых опухолей пищеварительного тракта. Тем не
ностического биомаркера при ПРП.
менее публикаций о роли DUSP4 в развитии РП
Функциональные анализы in vitro и in vivo
(особенно ПРП) не так много. Как и ожидалось,
показали, что сверхэкспрессия DUSP4 способ
уровень экспрессии DUSP4 был повышен в тка
ствует пролиферации, инвазии, миграции и
нях и клеточных линиях ПРП по сравнению с
канцерогенности клеток ПРП в моделях на жи
доброкачественными тканями и нормальной
вотных. Напротив, нокдаун DUSP4 подавлял
линией эпителиальных клеток пищевода. Также
пролиферацию, инвазию, миграцию и онкоген
следует отметить, что экспрессия DUSP4 в рако
ность клеток ПРП в моделях на животных. Эти
вых тканях также усиливалась с ростом и метас
результаты предполагают, что DUSP4 может
тазированием ПРП. Корреляционный анализ
служить потенциальной терапевтической ми
БИОХИМИЯ том 87 вып. 1 2022
LSD1 СПОСОБСТВУЕТ РАЗВИТИЮ ПРП ПУТЕМ АКТИВАЦИИ DUSP4
113
шенью при ПРП. DUSP4 может играть двойную
та (eNOS) [31]. Соответственно, мы предполага
роль в ингибировании и стимулировании кан
ем, что DUSP4 способствует росту опухоли ПРП
церогенеза; при этом DUSP4 оказывает поло
при гипоксии, что может быть потенциальным
жительное влияние на некоторые опухоли пи
механизмом регулируемого DUSP4 онкогенеза
щеварительного тракта. Канцерогенез ПРП,
при ПРП. Взаимосвязь между экспрессией
стимулируемый DUSP4, может быть связан с
DUSP4, уровнем гипоксии и онкогенезом при
конкретными характеристиками опухоли, что
ПРП требует всестороннего и глубокого иссле
требует дальнейшего исследования. Основыва
дования в будущем.
ясь на анализе клинических образцов ткани и
Мы продемонстрировали стимулирующий
исследованиях in vivo, стоит отметить, что повы
эффект LSD1 на экспрессию DUSP4 в ПРП и
шенная экспрессия DUSP4 является признаком
вклад DUSP4 в рост и развитие ПРП. LSD1 так
большего размера опухоли. Хорошо известно,
же может играть ключевую роль в патогенезе
что уровень гипоксии может положительно кор
ПРП посредством DUSP4 сигналинга. Как и
релировать с ростом опухоли. В проведенном
ожидалось, ZY0511 ингибировал пролифера
ранее исследовании было продемонстрировано,
цию, инвазию и миграцию клеток ПРП до уров
что гипоксия может приводить к ингибирова
ня, аналогичного наблюдаемому при нокдауне
нию активности деметилазы, что, в свою оче
DUSP4. Важно отметить, что сверхэкспрессия
редь, приводит к метилированию генов, что в
DUSP4 могла быть обращена ингибирующим
конечном итоге препятствует экспрессии генов
действием ZY0511 на вышеуказанные парамет
супрессоров опухоли и способствует росту опу
ры в клетках ПРП. Приведенные выше данные
холи [30]. Примечательно, что сверхэкспрессия
указывают на то, что положительная регуляция
DUSP4 может предотвращать гибель клеток,
DUSP4, по крайней мере частично, опосредует
вызванную гипоксией/реоксигенацией, за счет
роль LSD1 в патогенезе ПРП. Тем не менее ре
активации эндотелиальной синтазы оксида азо
зультаты настоящей работы ограничены отсут
Рис. 5. Сверхэкспрессия DUSP4 обращает ZY0511 ингибирующее действие на пролиферацию, инвазию и миграцию кле
ток ПРП. а - Пролиферация клеток ТЕ 1, трансфицированных указанными плазмидами, оцениваемая с помощью ана
лиза CCK 8 в присутствии или в отсутствие 2 мкМ ZY0511. b, c - Инвазия клеток TE 1, трансфицированных указанны
ми плазмидами, оцениваемая путем анализа миграции в Transwell системе в присутствии или в отсутствие 2 мкМ ZY0511
(масштаб 200 мкм). d - Миграция клеток TE 1, трансфицированных указанными плазмидами, оцениваемая с помощью
скретч тестов в присутствии или в отсутствие 2 мкМ ZY0511. Изображения получали под микроскопом через 0 и 36 ч.
e - Коэффициенты миграции клеток (36 ч/0 ч) показаны на гистограмме. Результаты представлены как среднее значение ±
± стандартная ошибка среднего из трех независимых экспериментов. *** p < 0,001 по результатам однофакторного дис
персионного анализа. Примечание. NC
- группа клеток, трансфицированных контрольным вектором;
NC + ZY0511 - клетки, трансфицированные контрольным вектором, обработанные ZY0511; DUSP4 + ZY0511 - клетки,
трансфицированные вектором DUSP4, обработанные ZY0511
8 БИОХИМИЯ том 87 вып. 1 2022
114
HAN и др.
ствием исследований, показывающих насколь
го биомаркера при ПРП, но также указывают на
ко сверхэкспрессированный LSD1 способствует
возможные пути улучшения терапевтических
экспрессии DUSP4 в ПРП. Подробные меха
стратегий при лечении ПРП - таким образом,
низмы, лежащие в основе регулируемой LSD1
DUSP4 может быть потенциально эффектив
экспрессии DUSP4 в ПРП, требуют дальнейше
ной мишенью для подавления онкогенеза
го изучения. Деметилирующая функция LSD1
при ПРП.
делает HIF 1α устойчивым к деградации, опос
редованной метилированием [32]. Кроме того,
LSD1 косвенно репрессирует деградацию, опос
Финансирование. Настоящая работа поддер
редованную гидроксилированием HIF 1α [32].
жана проектами фундаментальных научных ис
Более того, деметилирование RACK1 с по
следований Научно исследовательских инсти
мощью LSD1 ингибирует RACK1 опосредован
тутов общественного благосостояния провин
ную деградацию HIF 1α [32]. Соответственно,
ции Фуцзянь (2016R1029 2, 2019R1011 3) и
LSD1 также является ключевым регуляторным
Проектом обучения талантов в области научных
сигналом для раковых клеток при адаптирова
исследований в области здравоохранения и пла
нии к гипоксическому микроокружению [32].
нирования семьи провинции Фуцзянь (2018
Следовательно, усиление адаптации клеток
ZQN 20).
ПРП к гипоксии является возможным механиз
Конфликт интересов. Авторы заявляют об от
мом онкогенеза ПРП, регулируемым осью
сутствии конфликта интересов в финансовой
LSD1/DUSP4; это также требует дополнитель
или иной сфере.
ных исследований.
Соблюдение этических норм. Были соблюде
В заключение, настоящее исследование
ны все применимые международные, нацио
продемонстрировало роль DUSP4 как нижестоя
нальные и/или институциональные инструкции
щего по отношению к LSD1 онкогенного эф
по уходу и использованию лабораторных живот
фектора при ПРП, что в некоторой степени
ных.
объясняет регуляцию патогенеза ПРП, ассоции
Дополнительные материалы. Приложение к
рованную с LSD1. Что еще более важно, благо
статье на английском языке опубликовано на
даря выявлению нижестоящих молекул, регу
сайте журнала «Biochemistry» (Moscow) (http://
лируемых LSD1, наши экспериментальные дан
protein.bio.msu.ru/biokhimiya/) и на сайте изда
ные не только позволяют рассматривать DUSP4
в качестве многообещающего прогностическо
10541), том 86, вып. 12, 2021.
СПИСОК ЛИТЕРАТУРЫ
1.
Pennathur, A., Gibson, M. K., Jobe, B. A., and Luketich,
9. Ding, J., Zhang, Z. M., Xia, Y., Liao, G. Q., Pan, Y., et al.
J. D. (2013) Oesophageal carcinoma, Lancet, 38, 400 412.
(2013) LSD1 mediated epigenetic modifcation contributes
2.
Umar, S. B., and Fleischer, D. E. (2018) Esophageal can
to proliferation and metastasis of colon cancer, Br. J.
cer: epidemiology, pathogenesis and prevention, Nat. Clin.
Cancer, 109, 994 1003.
Pract. Gastroenterol. Hepatol., 5, 517 526.
10. Wu, Y., Wang, Y., Yang, X. H., Kang, T., Zhao, Y., et al. (2013)
3.
Matsuda, T., Ajiki, W., Marugame, T., Ioka, A.,
The deubiquitinase USP28 stabilizes LSD1 and confers stem
Tsukuma, H., et al. (2011) Population based survival of
cell like traits to breast cancer cells, Cell. Rep., 5, 224 236.
cancer patients diagnosed between 1993 and 1999 in Japan:
11. Yu, Y., Wang, B., Zhang, K., Lei, Z., Guo, Y., et al. (2013)
a chronological and international comparative study, Jpn. J.
High expression of lysine specific demethylase 1 correlates
Clin. Oncol., 41, 40 51.
with poor prognosis of patients with esophageal squamous cell
4.
McGraw, S., Vigneault, C., and Sirard, M. A. (2007)
carcinoma, Biochem. Biophys. Res. Commun., 437, 192 198.
Temporal expression of factors involved in chromatin
12. Hoshino, I., Akutsu, Y., Murakami, K., Akanuma, N.,
remodeling and in gene regulation during early bovine
Isozaki, Y., et al. (2016) Histone demethylase LSD1
in vitro embryo development, Reproduction, 133, 597 608.
inhibitors prevent cell growth by regulating gene expression
5.
Wang, Q., Xu, X., Li, J., Liu, J., Gu, H., et al. (2011)
in esophageal squamous cell carcinoma cells, Ann. Surg.
Lithium, an anti psychotic drug, greatly enhances the gen
Oncol., 23, 312 320.
eration of induced pluripotent stem cells, Cell. Res., 21,
13. Wang, B., Zhao, B., Pang, L. P., Zhao, Y. D., Guo, Q., et al.
1424 1435.
(2017) LPE 1, an orally active pyrimidine derivative,
6.
Sakane, N., Kwon, H. S., Pagans, S., Kaehlcke, K.,
inhibits growth and mobility of human esophageal cancers
Mizusawa, Y., et al. (2011) Activation of HIV transcription
by targeting LSD1, Pharmacol. Res., 122, 66 77.
by the viral Tat protein requires a demethylation step medi
14. Alsaqer, S. F., Tashkandi, M. M., Kartha, V. K., Yang, Y. T.,
ated by lysine specific demethylase 1 (LSD1/KDM1),
Alkheriji, Y., et al. (2017) Inhibition of LSD1 epigenetical
PLoS Pathog., 7, e1002184.
ly attenuates oral cancer growth and metastasis, Oncotarget,
7.
Lv, T., Yuan, D., Miao, X., Lv, Y., Zhan, P., et al. (2012) Over
8, 73372 73386.
expression of LSD1 promotes proliferation, migration and
15. Lu, Z., Ren, Y., Zhang, M., Fan, T., Wang, Y., et al. (2018)
invasion in non small cell lung cancer, PLoS One, 7, e35065.
FLI 06 suppresses proliferation, induces apoptosis and cell
8.
Amente, S., Lania, L., and Majello, B. (2013) The histone
cycle arrest by targeting LSD1 and Notch pathway in
LSD1 demethylase in stemness and cancer transcription
esophageal squamous cell carcinoma cells, Biomed.
programs, Biochim. Biophys. Acta, 1829, 981 986.
Pharmacother., 107, 1370 1376.
БИОХИМИЯ том 87 вып. 1 2022
LSD1 СПОСОБСТВУЕТ РАЗВИТИЮ ПРП ПУТЕМ АКТИВАЦИИ DUSP4
115
16.
Hou, G., Zhao, Q., Zhang, M., Wang, P., Ye, H., et al.
24. Wang, H. Y., Cheng, Z., and Malbon, C. C. (2003)
(2019) LSD1 regulates Notch and PI3K/Akt/mTOR path
Overexpression of mitogen activated protein kinase phos
ways through binding the promoter regions of Notch target
phatases MKP1, MKP2 in human breast cancer, Cancer
genes in esophageal squamous cell carcinoma, Onco Targets.
Lett., 191, 229 237.
Ther., 12, 5215 5225.
25. Yin, Y., Liu, Y. X., Jin, Y. J., Hall, E. J., and Barrett, J. C.
17.
Peng, W., Zhang, H., Tan, S., Li, Y., Zhou, Y., et al. (2020)
(2003) PAC1 phosphatase is a transcription target of p53 in
Synergistic antitumor effect of 5 fluorouracil with the novel
signaling apoptosis and growth suppression, Nature, 422,
LSD1 inhibitor ZY0511 in colorectal cancer, Ther. Adv.
527 531.
Med. Oncol., 12, 1758835920937428.
26. Yip Schneider, M. T., Lin, A., and Marshall, M. S. (2001)
18.
Li, Y., Tao, L., Zuo, Z., Zhou, Y., Qian, X., et al. (2019)
Pancreatic tumor cells with mutant K ras suppress ERK
ZY0511, a novel, potent and selective LSD1 inhibitor,
activity by MEK dependent induction of MAP kinase phos
exhibits anticancer activity against solid tumors via the
phatase 2, Biochem. Biophys. Res. Commun., 280, 992 997.
DDIT4/mTOR pathway, Cancer Lett., 454, 179 190.
27. Zhang, R., Wang, G., Zhang, P. F., Zhang, J., Huang, Y. X.,
19.
Li, S., Lin, Z., Zheng, W., Zheng, L., Chen, X., et al.
et al. (2017) Sanguinarine inhibits growth and invasion of
(2019) IL 17A inhibits autophagic activity of HCC cells by
gastric cancer cells via regulation of the DUSP4/ERK path
inhibiting the degradation of Bcl2, Biochem. Biophys. Res.
way, J. Cell. Mol. Med., 21, 1117 1127.
Commun., 509, 194 200.
28. Xu, X. F., Gao, F., Wang, J. J., Tao, L., Ye, J. S., et al.
20.
Popova, E. Y., Pinzon Guzman, C., Salzberg, A. C.,
(2018) MiR 122 5p inhibits cell migration and invasion in
Zhang, S. S., and Barnstable, C. J. (2016) LSD1 mediated
gastric cancer by down regulating DUSP4, Cancer. Biol.
demethylation of H3K4me2 is required for the transition
Ther., 19, 427 435.
from late progenitor to differentiated mouse rod photore
29. De Vriendt, V., De Roock, W., Di Narzo, A. F., Tian, S.,
ceptor, Mol. Neurobiol., 53, 4563 4581.
et al. (2013) DUSP 4 expression identifies a subset of col
21.
Liu, Y. W., Xia, R., Lu, K., Xie, M., Yang, F., et al. (2017)
orectal cancer tumors that differ in MAPK activation,
LincRNAFEZF1 AS1 represses p21 expression to promote
regardless of the genotype, Biomarkers, 18, 516 524.
gastric cancer proliferation through LSD1 Mediated
30. Thienpont, B., Steinbacher, J., Zhao, H., D’Anna, F.,
H3K4me2 demethylation, Mol. Cancer, 16, 39.
Kuchnio, A., et al. (2016) Tumour hypoxia causes DNA
22.
Gaedcke, J., Grade, M., Jung, K., Camps, J., Jo, P., et al.
hypermethylation by reducing TET activity, Nature, 537,
(2010) Mutated KRAS results in overexpression of DUSP4,
63 68.
a MAP kinase phosphatase, and SMYD3, a histone
31. Dougherty, J. A., Kilbane Myers, J., Khan, M., Angelos,
methyltransferase, in rectal carcinomas, Genes
M. G., and Chen, C. A. (2017) Dual specificity phos
Chromosomes Cancer, 49, 1024 1034.
phatase 4 overexpression in cells prevents hypoxia/reoxy
23.
Gröschl, B., Bettstetter, M., Giedl, C., Woenckhaus, M.,
genation induced apoptosis via the upregulation of eNOS,
Edmonston, T., et al. (2013) Expression of the MAP kinase
Front. Cardiovasc. Med., 4, 22.
phosphatase DUSP4 is associated with microsatellite insta
32. Kim, D., Kim, K. I., and Baek, S. H. (2021) Roles of
bility in colorectal cancer (CRC) and causes increased cell
lysine specific demethylase 1 (LSD1) in homeostasis and
proliferation, Int. J. Cancer, 132, 1537 1546.
diseases, J. Biomed. Sci., 28, 41.
LYSINE SPECIFIC HISTONE DEMETHYLASE 1
PROMOTES ONCOGENESIS OF THE ESOPHAGEAL
SQUAMOUS CELL CARCINOMA BY UPREGULATING DUSP4
J. Han1,2#, S. Ye3#, J. Chen1,2, K. Wang1,2, J. Jin1,2, Z. Zeng3*, and S. Xue1,2*
1 Department of Immunization, Fujian Academy of Medical Sciences, 350003 Fuzhou, Fujian, China; e mail: fjykyxsj@126.com
2 Fujian Institute of Medical Sciences, Fujian Provincial Key Laboratory of Medical Analysis, 350003 Fuzhou, Fujian, China
3 Department of Cardiothoracic Surgery, 900 Hospital of the Joint Logistics Team,
350025 Fuzhou, Fujian, China; e mail: 13809542597@139.com
Esophageal squamous cell carcinoma (ESCC) is a predominant subtype of esophageal cancer (EC) and has a poor
prognosis due to its aggressive nature. Accordingly, it is necessary to find novel prognostic biomarkers and therapeu
tic targets for ESCC. Lysine specific histone demethylase 1 (LSD1) plays a core role in the regulation of ESCC onco
genesis. However, the detailed mechanism of LSD1 regulated ESCC growth has not been elucidated. This study aims
to explore molecular mechanism underlying the LSD1 regulated ESCC’s oncogenesis. After LSD1 silencing, we
detected differentially expressed genes (DEGs) in human ESCC cell line, TE 1, by transcriptome sequencing.
Subsequently, we investigated expression pattern of the selected molecules in the ESCC tissues and cell lines by
qRT PCR and Western blotting. Furthermore, we explored the roles of selected molecules in ESCC using gene silenc
ing and overexpression assays. Transcriptome sequencing showed that the expression of dual specificity phosphatase 4
(DUSP4) in TE 1 was significantly attenuated after the LSD1 silencing. In addition, the DUSP4 mRNA expression
level was significantly higher in the ESCC tissues, especially in those derived from patients with invasion or metasta
sis. Moreover, the DUSP4 expression was positively associated with the LSD1 expression in the ESCC tissues.
DUSP4 overexpression promoted proliferation, invasion, and migration of the ESCC cells, while DUSP4 silencing
had an opposite effect. DUSP4 overexpression also enhanced tumorigenicity of the ESCC cells in vivo, while DUSP4
silencing inhibited tumor growth. Importantly, inhibition of cell proliferation, invasion, and migration by the LSD1
inhibitor (ZY0511) was reversed by DUSP4 overexpression. Conclusively, we found that LSD1 promotes ESCC’s
oncogenesis by upregulating DUSP4, the potential therapeutic and diagnostic target in ESCC.
Keywords: dual specificity phosphatase 4, esophageal squamous cell carcinoma, lysine specific histone demethylase 1
БИОХИМИЯ том 87 вып. 1 2022
8*