БИОХИМИЯ, 2022, том 87, вып. 1, с. 116 - 125
УДК 577.114.4
ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ
КВАТЕРНИЗИРОВАННОГО ХИТОЗАНА,
МОДИФИЦИРОВАННОГО ОСТАТКОМ ГАЛЛОВОЙ КИСЛОТЫ,
С ИСПОЛЬЗОВАНИЕМ ПЕРОКСИДАЗЫ,
ПРОДУЦИРУЮЩЕЙ АКТИВНЫЕ ФОРМЫ КИСЛОРОДА
© 2022
Д.Б. Киселевский1*, А.В. Ильина2, А.П. Луньков2,
В.П. Варламов2, В.Д. Самуилов1
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
кафедра иммунологии, 119234 Москва, Россия; электронная почта: dkiselevs@mail.ru
2 Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН,
Институт биоинженерии имени К.Г. Скрябина, лаборатория инженерии биополимеров, 119071 Москва, Россия
Поступила в редакцию 10.11.2021
После доработки 15.12.2021
Принята к публикации 22.12.2021
Синтезирован хитозан, модифицированный (2 гидрокси 3 триметиламмоний)пропильной группой и ос
татком галловой кислоты - кватернизированный хитозан с галловой кислотой (КХГ). Исследованы его ан
тиоксидантные свойства. Пероксидаза в комбинации с NADH и салицилгидроксаматом (СГ) вызывала по
глощение кислорода и образование Н2О2 в водном растворе в результате восстановления О2 в пероксидаз
но оксидазных реакциях. КХГ снижал скорости поглощения О2 и образования Н2О2. Таким же действием
обладали антиоксидант пропилгаллат (ПГ) и супероксиддисмутаза (СОД), но не кватернизированный хи
тозан (КХ) без галловой кислоты. Испытан эффект производных хитозана на образование активных форм
кислорода (АФК) в клетках эпидермиса гороха и их гибель, которую регистрировали по разрушению кле
точных ядер. КХГ, КХ и СОД не оказывали эффекта, а ПГ уменьшал скорость образования АФК в клетках
эпидермиса, которое было вызвано NADH с СГ или менадионом. КХГ и КХ предотвращали разрушение
ядер устьичных клеток в эпидермисе из листьев гороха, вызванное NADH с СГ или KCN. СОД не оказыва
ла влияния на разрушение ядер, а действие ПГ зависело от индуктора гибели клеток. Подавление разруше
ния ядер производными хитозана связано не с их антиоксидантным действием, а с повреждением плазма
тической мембраны клеток. Полученные результаты свидетельствуют о том, что КХГ проявляет антиокси
дантые свойства в растворах, но не препятствует образованию АФК в клетках растений. Механизм его ан
тиоксидантного действия сходен с таковыми для ПГ и СОД.
КЛЮЧЕВЫЕ СЛОВА: хитозан, кватернизированный хитозан, пероксидаза, супероксиддисмутаза, актив
ные формы кислорода, пропилгаллат.
DOI: 10.31857/S0320972522010080
ВВЕДЕНИЕ
включающий остатки N ацетилглюкозамина и
глюкозамина. В отличие от хитина хитозан
Хитин - основной структурный полисаха
растворим в кислых водных растворах и облада
рид покровов членистоногих и один из важней
ет большей реакционной способностью благо
ших компонентов клеточных стенок грибов. Он
даря свободным аминогруппам в составе поли
состоит из остатков N ацетилглюкозамина, со
мера. Модификация хитозана различными хи
единённых β 1,4 гликозидными связями. Деза
мическими группами усиливает его реакцион
цетилированием хитина получают хитозан,
ную способность. Хитозан и его производные
проявляют антимикробное, антиоксидантное и
иммуномодулирующее действия. Благодаря
Принятые сокращения: АФК - активные формы
кислорода; КХ - кватернизированный хитозан; КХГ - своим свойствам они могут использоваться в
кватернизированный хитозан с галловой кислотой; ПГ - различных отраслях промышленности и в здра
пропилгаллат; СГ - салицилгидроксамат; СОД - суперок
воохранении [1]. Из за биоразлагаемости, ан
сиддисмутаза; Amplex Red - N ацетил 3,7 дигидроксифе
ноксазин; DCF - 2′,7′ дихлорфлуоресцеин; DCFH DA -
тимикробных и антиоксидантных свойств, ко
диацетат 2′,7′ дихлорфлуоресцина; PI - йодид пропидия.
торые важны при хранении пищевых продук
* Адресат для корреспонденции.
тов, перспективно применение хитозана и его
116
АНТИОКСИДАНТНЫЕ СВОЙСТВА ПРОИЗВОДНОГО ХИТОЗАНА
117
производных в качестве упаковочных материа
лов [2].
Противомикробные эффекты хитозана,
предположительно, включают агглютинацию
клеток микроорганизмов, повреждение их кле
точной мембраны, угнетение роста микро
организмов и продукции ими токсинов за счёт
хелатирования металлов хитозаном, ингиби
рование транскрипции и трансляции, подавле
ние активности H+ ATPазы и хемиосмосмоти
чески регулируемого транспорта веществ [3].
Антимикробную активность хитозана опреде
ляют его молекулярная масса и катионный за
ряд [2].
Синтезировано производное хитозана, в ко
тором к аминогруппе в остатке глюкозамина
присоединена
(2 гидрокси 3 триметиламмо
ний)пропильная группа (реакция кватерниза
ции). Коммерчески доступный алкилирующий
агент (хлорид глицидилтриметиламмония), од
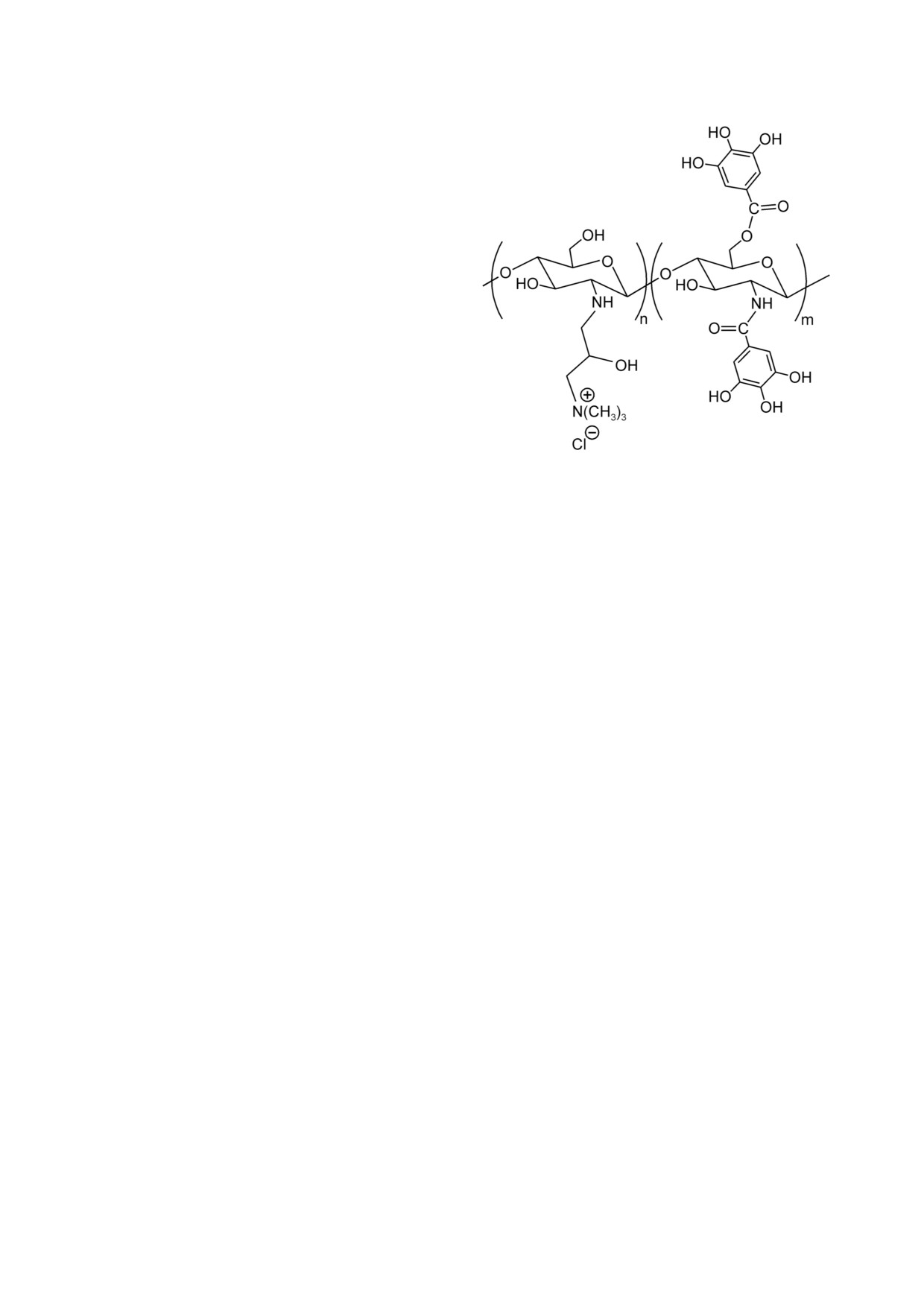
Рис. 1. Структура КХГ
ностадийность и селективность реакции делают
получение катионных производных хитозана
данного типа наиболее привлекательным [4].
ности клеток растений имеются рецепторы, рас
Кватернизированный хитозан обладал более
познающие хитиновые олигосахариды и иници
широким интервалом растворимости (pH 3-11),
ирующие иммунный ответ к фитопатогенным
чем исходный хитозан, а также эффективнее по
грибам [14]. Однако полностью дезацетилиро
давлял рост бактерий и грибов [5].
ванные хитозановые олигомеры не связываются
Хитозан и его производные взаимодейству
с рецепторами для хитина [15]. Таким образом,
ют с активными формами кислорода (АФК).
хитозан до сих пор остаётся PAMP (pathogen
Низкомолекулярный хитозан обладал более
associated molecular pattern), для которого не
сильным антиоксидантным действием, чем вы
найден специфичный рецептор PRR (pattern
сокомолекулярный [6]. Кватернизация хитозана
recognition receptor) [13].
путём присоединения триметиламмонийной
Судя по данным литературы, присоединение
группы к атому азота усиливала его антиоксидант
галловой кислоты к полимеру на основе хитоза
ные свойства [7]. Для утилизации АФК перспек
на будет усиливать его антиоксидантное
тивны производные хитозана, содержащие гал
действие. Благодаря своим антиоксидантным и
ловую кислоту [8] в качестве антиоксидан
противомикробным свойствам, а также раство
та [9, 10].
римости кватернизированный хитозан пред
Антиоксидантные свойства галловой кисло
ставляется хорошей платформой для такой мо
ты могут усиливаться в результате её связывания
дернизации. Кроме того, от этого производного
с полимером. Полисахарид ламинарин, моди
можно ожидать меньшего вмешательства в про
фицированный галловой кислотой, проявлял
цессы, протекающие внутри клеток, по сравне
большую антиоксидантную активность, чем ла
нию с низкомолекулярными антиоксидантами
минарин и галловая кислота сами по себе [11].
и обычным хитозаном.
Анализ свойств галловой кислоты и её конъюга
Получено производное низкомолекулярного
та с хитозаном показал, что эффективность по
хитозана, модифицированное (2 гидрокси 3
лимера как антиоксиданта в модели перекисно
триметиламмоний)пропильной группой и при
го окисления линолевой кислоты была вы
родным фенольным антиоксидантом - галло
ше [12].
вой кислотой (КХГ). Его структура представле
Немодифицированный хитозан обладает
на на рис. 1. В качестве контроля и исходного
множеством эффектов на клетки растений: по
соединения для синтеза КХГ использован ква
вышает их иммунную защиту, инициирует ги
тернизированный хитозан (КХ) без галловой
бель клеток, усиливает образование АФК, вызы
кислоты. Цель работы - изучить антиоксидант
вает приток Ca2+ в клетки, активирует MAP ки
ные свойства КХГ в сравнении с КХ, а также ис
назы, ингибирует H+ ATPазу плазматической
пытать действие этих производных хитозана на
мембраны, стимулирует синтез фитогормонов и
образование АФК в клетках растений и их ги
вызывает изменение хроматина [3, 13]. На поверх
бель.
БИОХИМИЯ том 87 вып. 1 2022
118
КИСЕЛЕВСКИЙ и др.
МАТЕРИАЛЫ И МЕТОДЫ
но Н2О2 с участием пероксидаз, превращаясь во
флуоресцирующий DCF. В образование DCF
КХ (N [(2 гидрокси 3 триметиламмоний)про
могут быть вовлечены ионы металлов перемен
пил]хитозан хлорид) синтезирован на основе
ной валентности и цитохром с, обладающий ак
хитозана с молекулярной массой 20 кДа и сте
тивностью, сходной с пероксидазной [19, 20].
пенью дезацетилирования 98% в результате взаи
Плёнку эпидермиса, закреплённую на пласти
модействия с (2,3 эпоксипропил)триметилам
ковой пластинке с помощью силиконового геля,
моний хлоридом в водной среде. Степень заме
помещали в кювету с 2 мл среды инкубации,
щения по данным кондуктометрического титро
содержащей
50
мМ Tricin KOH (рН
7,8),
вания и 1H ЯМР составила 58% [5].
35 мМ NaCl и 1 мМ MgCl2. В кювету последова
КХГ получали в результате введения в КХ
тельно добавляли DCFH DA и другие реагенты.
остатков галловой кислоты с использованием
Флуоресценцию DCF измеряли с помощью
(N этил N’ (3 диметиламинопропил) карбо
флуориметра VersaFluor, возбуждая её светом
диимид гидрохлорида и N гидроксисукциними
485-495 нм и регистрируя при 515-525 нм.
да [16]. Содержание галловой кислоты было оп
Для определения действия реагентов на со
ределено с использованием реактива Фоли
стояние клеток плёнки эпидермиса помещали в
на-Чокалтеу и составило 163 мг/г полимера.
2 мл бидистиллированной воды в полистироль
Содержание О2 в растворе регистрировали в
ных планшетах, добавляли реагенты и инкуби
полярографической ячейке при помощи закры
ровали. Контроль - без добавок реагентов. Ус
того платинового электрода, подключенного к
ловия инкубации представлены в подписях к
аналого цифровому преобразователю Record4
рисункам.
(Пущино, Россия), с использованием сопут
Гибель клеток гороха регистрировали по раз
ствующего программного обеспечения. Поля
рушению клеточных ядер [21]. После инкуба
рографическая ячейка объёмом 1,5 мл содержа
ции эпидермис 5 мин обрабатывали фиксатором
ла среду инкубации: 50 мМ Tricin KOH (рН 7,8),
Батталья (смесь хлороформа, 96% ного этанола,
35 мМ NaCl и 1 мМ MgCl2. В полярографичес
ледяной уксусной кислоты и 40% ного форма
кую ячейку последовательно вносили реагенты.
лина в соотношении 5/5/1/1), промывали в эти
Содержание Н2О2 в растворе измеряли мето
ловом спирте и воде в течение 10 и 5 мин соот
дом флуориметрии с применением N ацетил
ветственно, затем окрашивали ядерным краси
3,7 дигидроксифеноксазина, Amplex Red,
телем гематоксилином Карацци в течение 1 ч.
(«Molecular Probes», США). Реакция нефлуорес
Окрашенные плёнки эпидермиса промывали
цирующего Amplex Red с Н2О2 катализируется
водой и исследовали на световом микроскопе
пероксидазой и ведёт к образованию флуорес
Primo Star («Carl Zeiss», Германия). Для каждого
цирующего резоруфина [17, 18]. В пластиковую
варианта опыта определяли долю клеток с раз
кювету с 2 мл среды инкубации, содержащей
рушенными ядрами и лишённых ядер.
50 мМ Tricin KOH (рН 7,8), 35 мМ NaCl и
Проницаемость плазматической мембраны
1 мМ MgCl2, последовательно добавляли Amplex
клеток определяли с помощью флуоресцирую
Red и другие реагенты. Флуоресценцию резору
щего красителя йодида пропидия (PI, («Fluka»,
фина детектировали с помощью флуориметра
США)), связывающегося с ДНК клеточных ядер
VersaFluor («Bio Rad», США), возбуждая её све
и не проникающего через неповреждённую
том 505-515 нм и регистрируя при 585-595 нм.
мембрану [22]. После инкубации плёнки эпидер
Проростки гороха (Pisum sativum L. сорт Аль
миса окрашивали 2 мкМ PI в течение 20 мин и
фа) выращивали 11-18 сут. при периодическом
исследовали с использованием флуоресцентного
освещении (свет - 16 ч, темнота - 8 ч) металло
микроскопа Axiovert 200M («Carl Zeiss»). Флуо
галогеновой лампой ДРиЗ, 250 Вт, с интенсив
ресценцию PI возбуждали светом 525-565 нм и
ностью света ∼100 мкE⋅м-2⋅с-1. Интенсивность
регистрировали при 575-640 нм. Подсчитывали
света измеряли сенсором Quantitherm PAR/Temp
долю клеток, в ядрах которых флуоресцирует PI,
(«Hansatech», Великобритания). Плёнки эпи
т.е. с проницаемой для PI плазматической мем
дермиса отделяли от нижней поверхности
браной.
листьев пинцетом.
Для определения количества клеток с разру
АФК в клетках гороха определяли по флуо
шенными ядрами или с проницаемой для PI
ресценции 2′,7′ дихлорфлуоресцеина (DCF), об
клеточной мембраной в каждом варианте опыта
разующегося из нефлуоресцирующего диацетата
исследовали 300-600 клеток в 2-3 плёнках эпи
2′,7′ дихлорфлуоресцина (DCFH DA). Прони
дермиса. Эксперименты повторяли 2-3 раза.
кая в клетки через плазматическую мембрану,
Приводятся результаты типичных эксперимен
DCFH DA дезацетилируется внутриклеточными
тов: средние значения ± 95% ные доверитель
эстеразами и окисляется АФК, преимуществен
ные интервалы.
БИОХИМИЯ том 87 вып. 1 2022
АНТИОКСИДАНТНЫЕ СВОЙСТВА ПРОИЗВОДНОГО ХИТОЗАНА
119
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
фенольной природы, например, фенолом или
2,4 дихлорфенолом, но не салициловой кисло
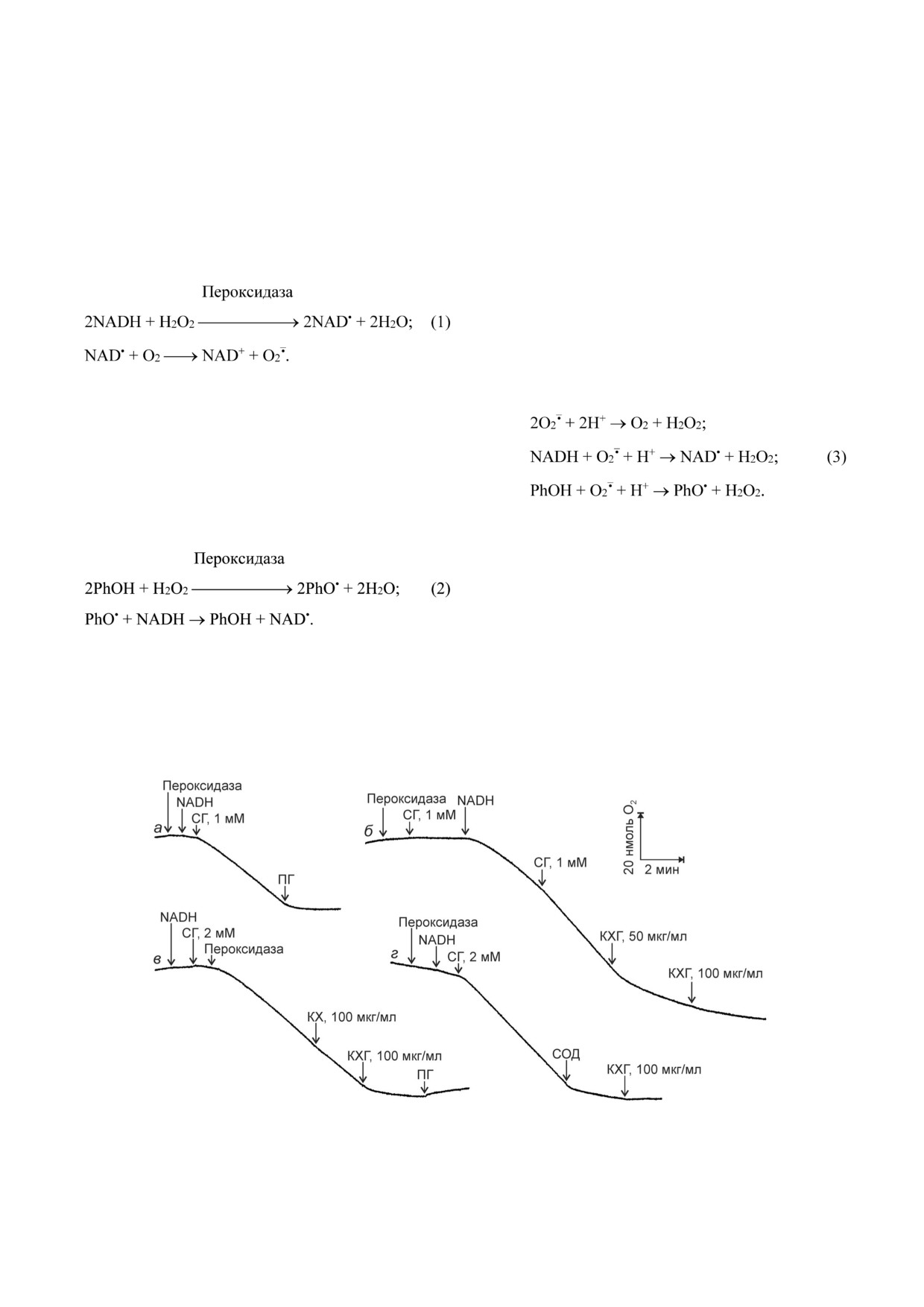
Испытано действие КХГ в системе, генери
той [26]. Реакция шла с высокой скоростью
рующей супероксидный анион радикал (O2 ).
лишь после добавки всех трёх компонентов
Используя NADH как донор электронов, фер
в любой последовательности. Антиоксидант
мент пероксидаза хрена (КФ 1.11.1.7) катализи
пропилгаллат (ПГ) подавлял поглощение О2
рует реакции с образованием O2 , называемые
(рис. 2, а). КХГ (рис. 2, б и в), но не КХ
пероксидазно оксидазными [23]:
(рис. 2, в), снижал скорость поглощения О2. Су
пероксиддисмутаза (СОД), катализирующая
превращение O2 в О2 и Н2О2, также уменьшала
скорость поглощения О2 (рис. 2, г).
В результате спонтанной дисмутации [27] и в
реакциях O2 с NADH или фенольными соеди
нениями (например, СГ) [23, 25] образует
ся Н2О2:
NADH восстанавливает пероксидазу и
без Н2О2. Н2О2 или О2 впоследствии нужны для
возвращения фермента в исходное состоя
ние [23]. Ряд фенольных соединений (PhOH),
включая использованный в работе салицилгид
роксамат (СГ), - субстраты пероксидазы, кото
рые ускоряют окисление NADH и образова
ние O2 [24, 25]:
Таким образом, пероксидаза с NADH и СГ
служит также и источником Н2О2, который де
тектировали флуориметрически с помощью
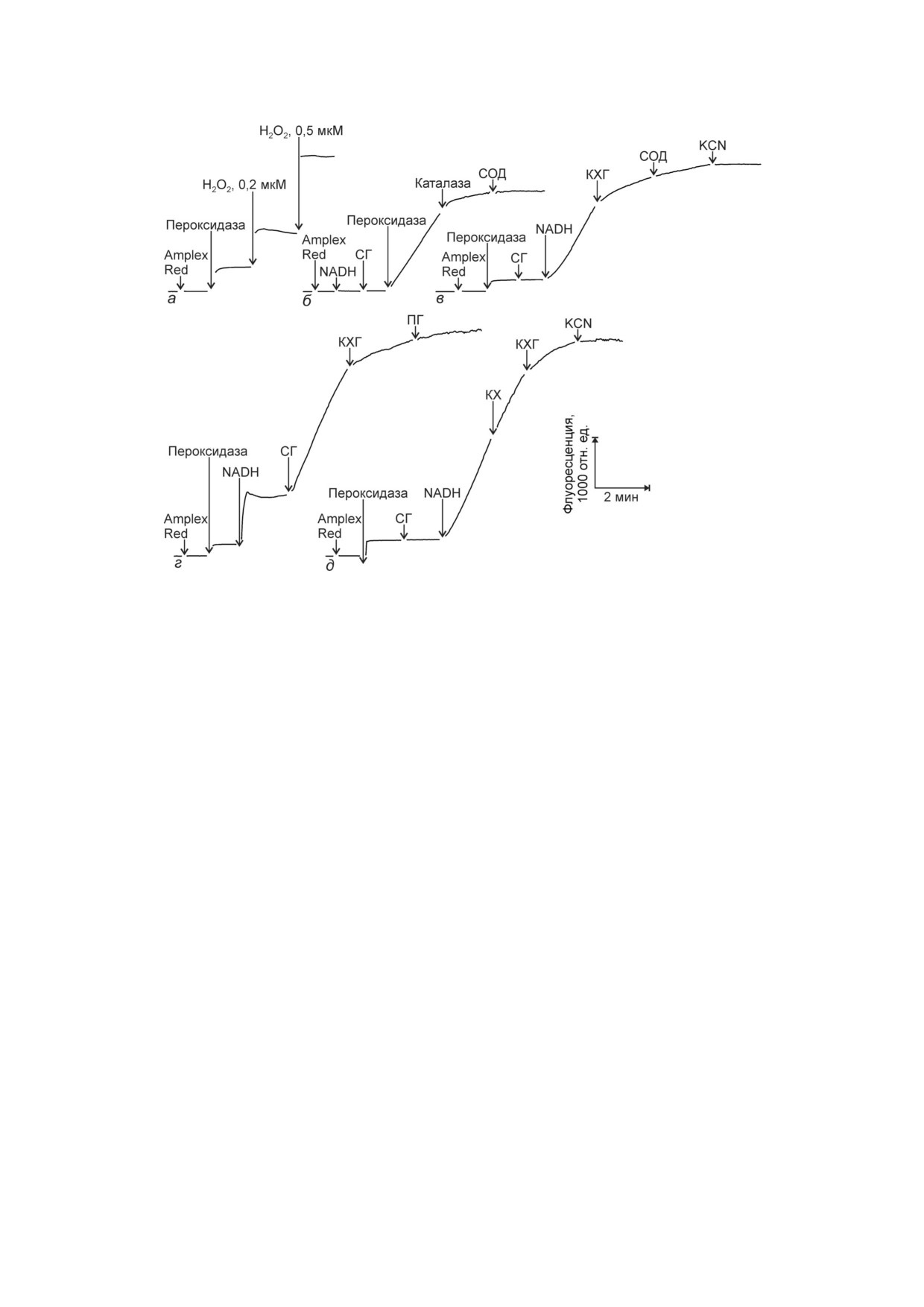
Amplex Red. Добавка пероксидазы и Н2О2 вызы
вала образование флуоресцирующего резоруфи
на (рис. 3, а). Величина квантового выхода флуо
ресценции зависела от концентрации Н2О2.
Оксиметрически регистрировали содержа
Комбинация пероксидазы, NADH и СГ (незави
ние О2 в водном растворе. Пероксидаза, NADH
симо от последовательности их добавления) вела
и СГ инициировали поглощение О2 в результа
к росту выхода флуоресценции (рис. 3, б-д), ко
те его восстановления до O2 (рис. 2). В этой ре
торый подавлялся каталазой, утилизирующей
акции СГ можно заменить другим соединением
Н2О2, СОД (рис. 3, б) и ингибитором пероксида
Рис. 2. Действие КХГ на поглощение О2 в оксидазной реакции пероксидазы. Добавки: 40 ед. активности/мл пероксидазы
хрена; 1 мМ NADH; СГ; 0,2 мМ ПГ; КХГ; КХ; 40 ед. активности/мл супероксиддисмутазы (СОД)
БИОХИМИЯ том 87 вып. 1 2022
120
КИСЕЛЕВСКИЙ и др.
Рис. 3. Действие КХГ на Н2О2 зависимое образование флуоресцирующего резоруфина в результате окисления нефлуорес
цирующего Amplex Red пероксидазой. Добавки: 5 мкМ Amplex Red; 20 (а) или 5 (б-д) ед. активности/мл пероксидазы хре
на; Н2О2; 0,1 мМ NADH; 0,5 мМ СГ; 40 ед. активности/мл каталазы; 20 ед. активности/мл СОД; 100 мкг/мл КХГ;
2,5 мМ KCN; 0,2 мМ ПГ; 100 мкг/мл КХ
зы KCN (рис. 3, в и д). Скорость образования
ресцирующего DCF, в отличие от ПГ и KCN
флуоресцирующего резоруфина уменьшалась
(рис. 4, а).
после добавки КХГ (рис. 3, в-д), но не КХ
Другой индуктор образования АФК - мена
(рис. 3, д). Снижение скорости образования ре
дион (2 метил 1,4 нафтохинон, витамин К3).
зоруфина СОД и ПГ на фоне добавленного КХГ
Менадион в клетках подвергается окислению и
было небольшим (рис. 3, в и г). Данные рис. 2 и 3
восстанавливает О2 [30, 31]. Менадион увеличи
демонстрируют антиоксидантные свойства КХГ
вал скорость образования DCF, которая была
и свидетельствуют о сходстве эффектов КХГ,
нечувствительна к последующим добавкам КХ,
СОД и ПГ на образование АФК: O2 и Н2О2.
КХГ и СОД, но снижалась ПГ и KCN (рис. 4, б).
Может ли КХГ действовать как антиокси
Разрушение ядер клеток у растений - надёж
дант применительно к живым клеткам и защи
ный и удобный для микроскопии признак прог
щать их от окислительного повреждения и гибе
раммируемой клеточной смерти (ПКС). По
ли? Испытано действие КХГ на генерацию АФК
скольку хлоропласты могут участвовать в ПКС у
в клетках эпидермиса, изолированных из листь
растений, инкубацию эпидермиса из листьев го
ев гороха. АФК в клетках детектировали по флуо
роха с реагентами проводили в темноте или при
ресценции DCF. Добавка к плёнкам эпидермиса
освещении, т.е. в условиях, поддерживающих фо
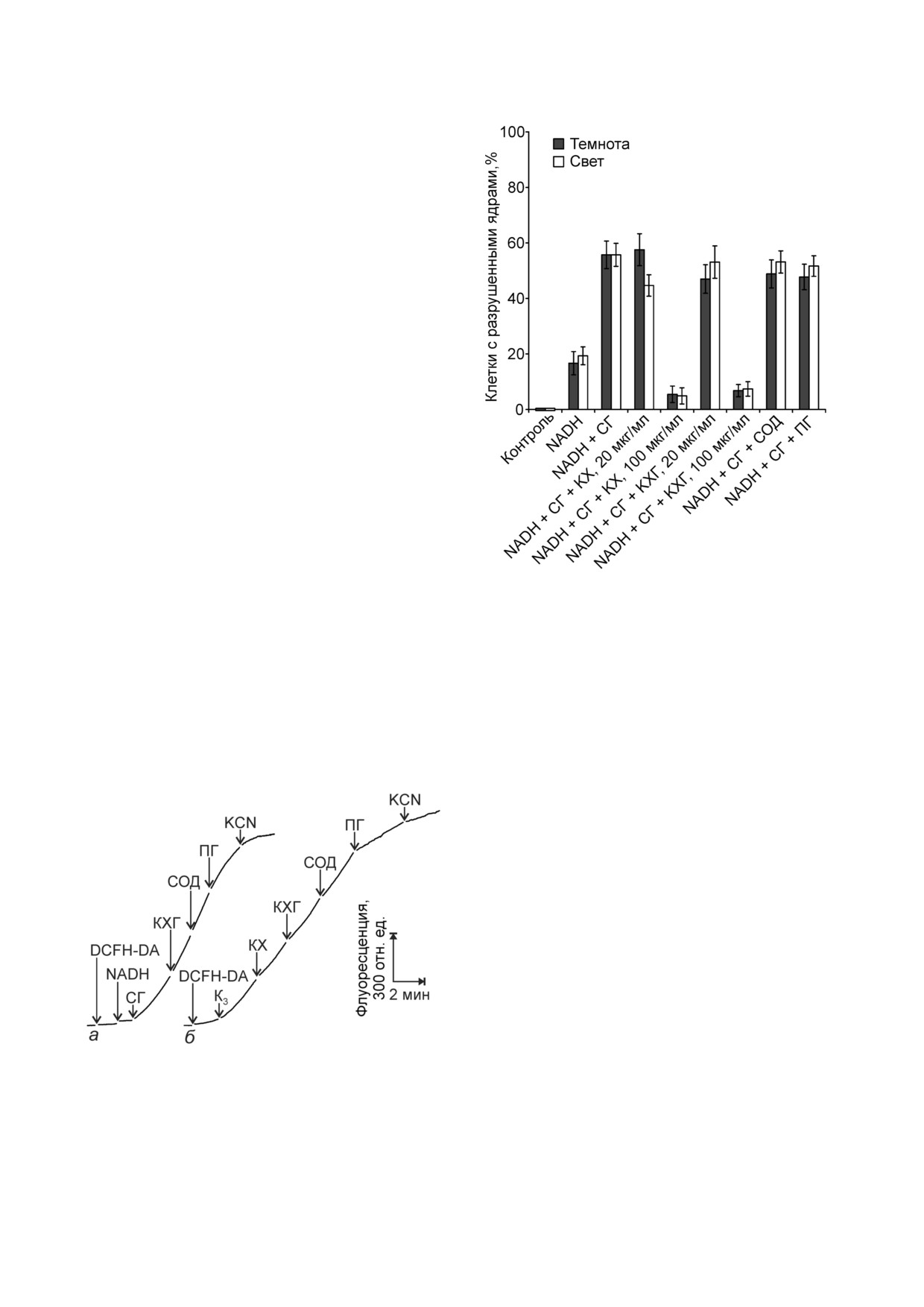
гороха NADH в комбинации с СГ вызывала об
тосинтез [21]. NADH вызывал разрушение ядер
разование АФК в клетках, проявляющееся в
замыкающих клеток устьиц (устьичных клеток) в
росте выхода флуоресценции (рис. 4, а). Клеточ
эпидермисе из листьев гороха (рис. 5). Эффект
ные мембраны непроницаемы для NADH, одна
NADH не различался в темноте и на свету.
ко снаружи клеток в апопласте есть оксидоре
СГ увеличивал NADH зависимое разрушение
дуктазы, составляющие третью по величине
ядер. КХ и КХГ в концентрации 20 мкг/мл, СОД
группу среди всех белков клеточной стенки у
и ПГ не влияли на разрушение ядер, вызванное
растений. Около половины апопластных окси
NADH в комбинации с СГ. КХ и КХГ в концент
доредуктаз - это пероксидазы [28, 29]. Ни КХГ,
рации 100 мкг/мл подавляли разрушение ядер,
ни СОД не снижали скорость образования флуо
индуцированное NADH и СГ (рис. 5).
БИОХИМИЯ том 87 вып. 1 2022
АНТИОКСИДАНТНЫЕ СВОЙСТВА ПРОИЗВОДНОГО ХИТОЗАНА
121
KCN, ингибирующий гем содержащие фер
менты, в том числе каталазу и пероксидазы, вы
зывал разрушение ядер устьичных клеток
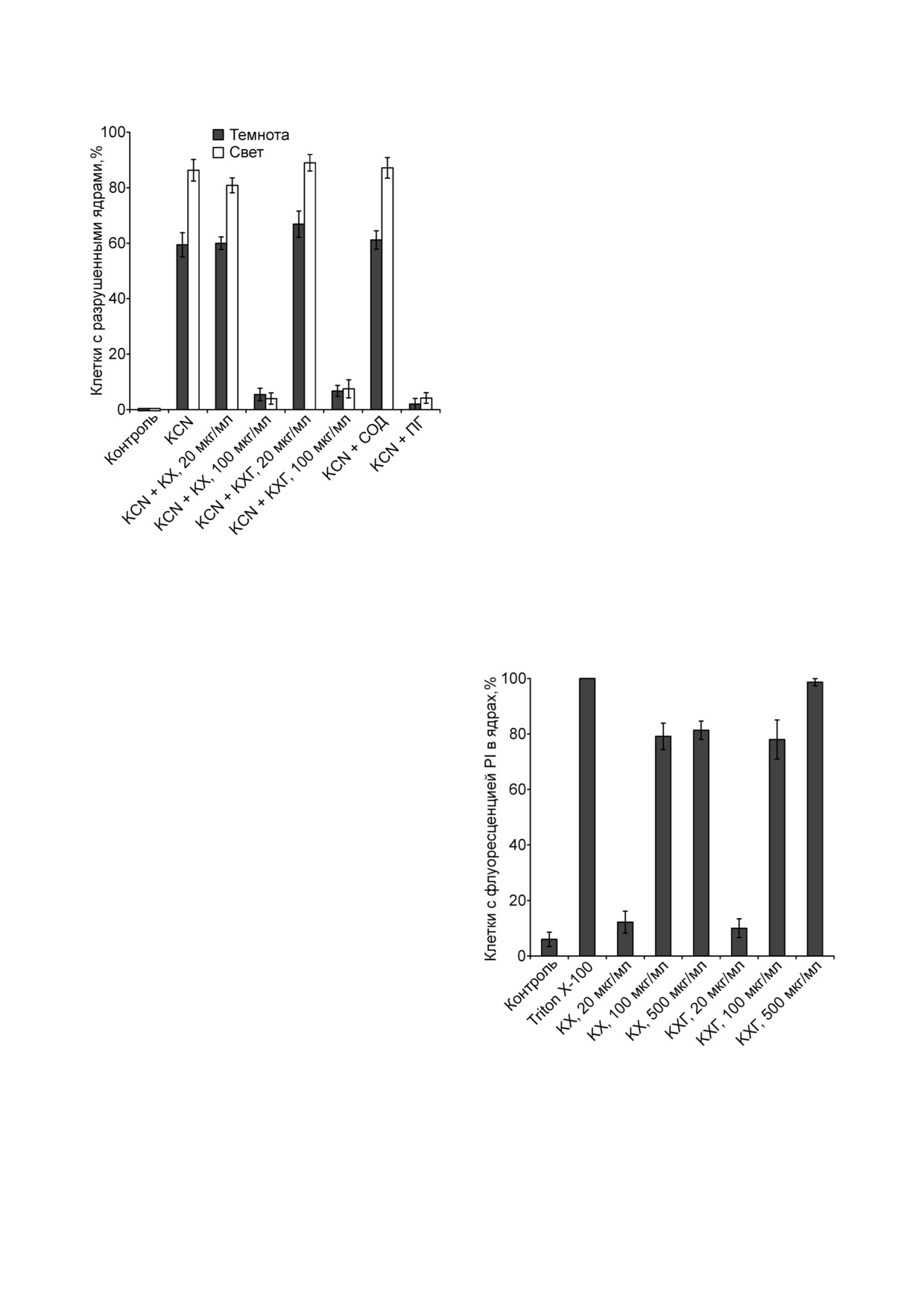
(рис. 6). Освещение усиливало эффект KCN, что
соответствует данным, полученным ранее [21].
KCN воздействует на хлоропласты: выключает
фотосинтетическое выделение О2, ингибируя
рибулозо 1,5 бисфосфаткарбоксилазу. Это долж
но вести к уменьшению пула конечного акцеп
тора электронов NADP+ и восстановлению ком
понентов фотосинтетической электронтранс
портной цепи [32]. Ингибиторы переноса элект
ронов и акцепторы электронов, окисляющие
компоненты электронтранспортной цепи хло
ропластов, уменьшали разрушение ядер устьич
ных клеток, которое вызывала инкубация эпи
дермиса из листьев гороха с KCN на свету. Ана
лиз разрушения ядер устьичных клеток, имею
щих хлоропласты, и основных клеток эпидер
миса (эпидермальных клеток), не содержащих
хлоропластов, позволил сделать вывод о влия
нии света и участии хлоропластов в гибели кле
ток растений. KCN Индуцированное разруше
ние клеточных ядер на свету зависит от АФК и
редокс состояния пластохинона [21]. Однако
свет не влиял на разрушение ядер, вызванное
Рис. 5. Действие КХ и КХГ на разрушение ядер устьичных
NADH или NADH в комбинации c СГ (рис. 5).
клеток в плёнках эпидермиса из листьев гороха, вызванное
Учитывая, что NADH не проникает в клетки, и
NADH и СГ. К плёнкам эпидермиса добавляли
его эффект, предположительно, связан с перок
4 мМ NADH; 2 мМ СГ; КХ; КХГ; 40 ед. активности/мл
СОД; 1 мМ ПГ и инкубировали 23 ч в темноте или на свету
сидазной активностью в апопласте, неудиви
тельно, что действие NADH не зависит от осве
щения, в отличие от KCN.
КХ и КХГ в темноте и на свету не оказывали
100 мкг/мл. СОД не влияла на разрушение ядер,
эффекта при 20 мкг/мл и уменьшали количество
вызванное KCN, а ПГ ингибировал его (рис. 6).
клеток с разрушенными ядрами в концентрации
ПГ не оказывал действия на разрушение
ядер, зависимое от NADH и СГ (рис. 5), но пре
дотвращал KCN индуцированное разрушение
ядер (рис. 6). ПГ эффективнее подавлял образо
вание АФК, вызванное менадионом, а не NADH
с СГ (рис. 4). По видимому, эффект ПГ зависит
от локализации источника АФК. Вероятно, так
же играет роль взаимодействие реагентов с ком
понентами митохондриальной электрон транс
портной цепи: KCN подавляет цитохром с ок
сидазу, фермент основной ветви дыхательной
цепи у растений, а СГ и ПГ - ингибиторы аль
тернативной оксидазы, нечувствительной к
KCN [33]. Нарушение работы альтернативной
оксидазы усиливает продукцию АФК митохон
дриями в клетках растений [34, 35].
Поликатионы хитозан, цитохром с, полили
зин, полиэтиленимин и протамин, а также де
тергенты Triton X 100 и лаурилдиметиламин N
Рис. 4. Действие КХГ на Н2О2 зависимое образование флуо
ресцирующего DCF из нефлуоресцирующего DCFH DA в
оксид вызывали повреждение плазматической
клетках эпидермиса из листьев гороха. Добавки:
мембраны устьичных клеток, которое регистри
20 мкМ DCFH DA; 1 мМ NADH; 2 мМ СГ; 100 мкг/мл
КХГ; 20 ед. активности/мл СОД; 0,5 мМ ПГ; 2,5 мМ KCN;
ровали по флуоресценции PI в клеточных ядрах.
0,1 мМ менадиона (К3); 100 мкг/мл КХ
Этот краситель не проникает через интактную
БИОХИМИЯ том 87 вып. 1 2022
122
КИСЕЛЕВСКИЙ и др.
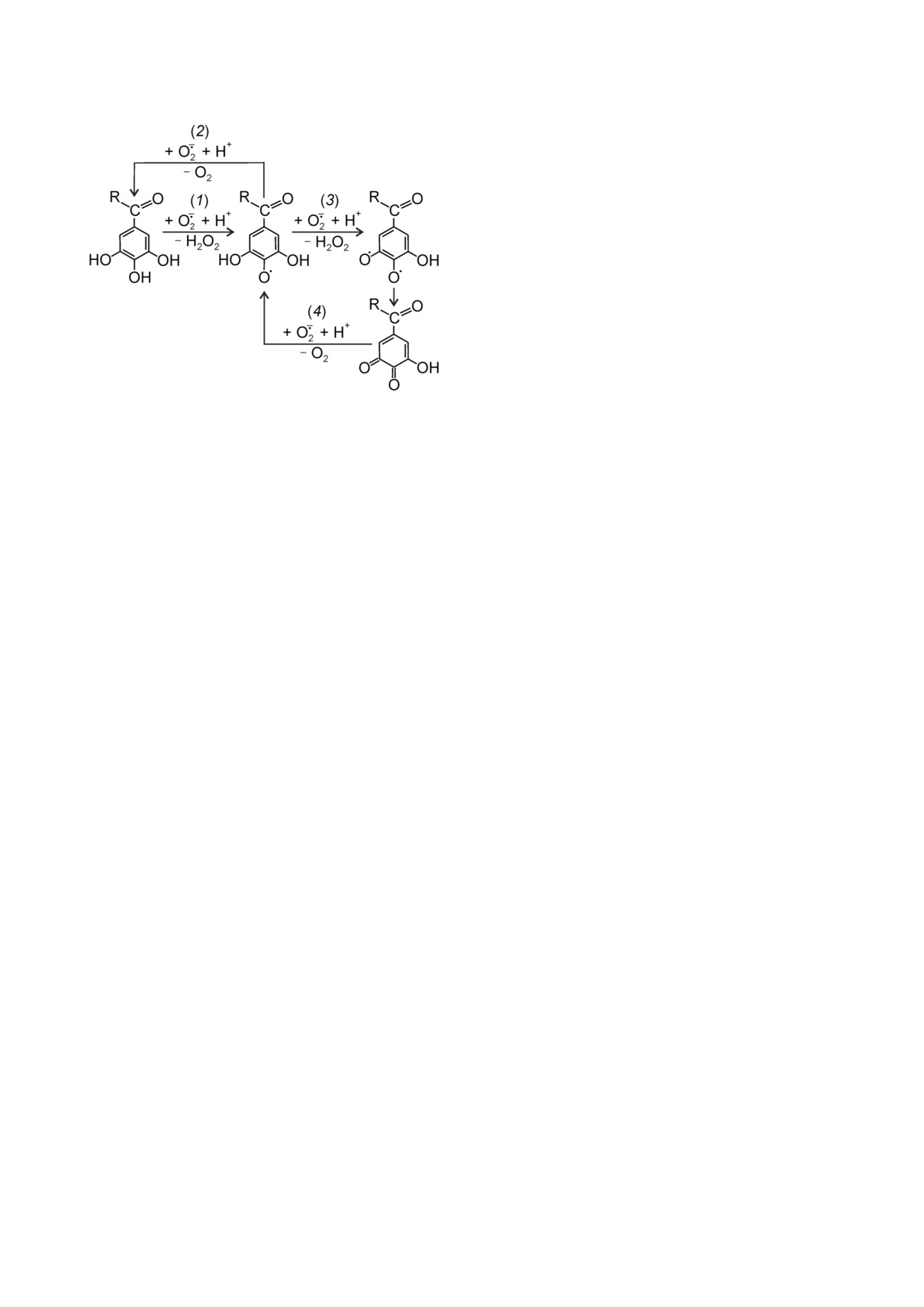
но, зависят от остатка галловой кислоты в соста
ве полимера, поскольку КХ не обладал действи
ем, подобным КХГ (рис. 2 и 3). На рис. 8 пред
ставлены возможные химические реакции O2 с
остатком галловой кислоты в КХГ, аналогичные
предполагаемому взаимодействию O2 и ПГ [38].
ПГ, вероятно, каталитически осуществляет дис
мутацию O2 , имитируя СОД [39]. Происходит
окисление остатка галловой кислоты с образова
нием феноксильного радикала и Н2О2 (1). Даль
ше возможно его восстановление с выделением
О2 (2). Возможно также повторное окисление
феноксильного радикала в реакции с O2 (3), ко
торое ведёт к образованию Н2О2 и впоследствии
гидрокси о хинона [38]. Однако при этом O2 бу
дет эквимолярно превращён в Н2О2, а это проти
воречит данным с Amplex Red (рис. 3), в которых
добавка КХГ снижала образование Н2О2. Поэто
му представляется более вероятной реакция (2)
или происходящее вслед за окислением фенок
сильного радикала (3) O2 зависимое восстанов
ление гидрокси о хинона с образованием О2 (4).
Суммарно реакции (1) и (2) и реакции (3) и (4)
представляют собой дисмутацию O2 .
Рис. 6. Действие КХ и КХГ на KCN индуцированное раз
рушение ядер устьичных клеток в плёнках эпидермиса из
Первые работы, в которых описано включе
листьев гороха. К плёнкам эпидермиса добавляли
ние остатка галловой кислоты в состав хитозана,
2,5 мМ KCN; КХ; КХГ; 20 ед. активности/мл СОД; 0,5 мМ
опубликованы в 2009 г. [40, 41]. Присоединение
ПГ и инкубировали 18 ч в темноте или на свету
галловой кислоты к хитозану и его производным,
клеточную мембрану. При этом детергенты и
поликатионы предотвращали разрушение кле
точных ядер, вызванное KCN [36, 37]. Повреж
дение плазматической мембраны - признак
некроза, очевидно, может сопровождаться час
тичным высвобождением содержимого клетки,
нарушением внутриклеточных процессов и пре
пятствует разрушению ядер клеток.
Чем обусловлен эффект КХ и КХГ в концен
трации 100 мкг/мл, который проявлялся в по
давлении разрушения ядер, индуцированном
NADH и СГ (рис. 5) или KCN (рис 6): антиокси
дантными свойствами или повреждением кле
точной мембраны? Испытано действие KX и
КХГ на проницаемость плазматической мемб
раны устьичных клеток для PI в сравнении с де
тергентом Triton X 100. Triton X 100 вызывал
проникновение PI в клетки (рис. 7). КХ и КХГ в
концентрации 20 мкг/мл не влияли на проница
емость плазматической мембраны клеток
для PI, а в более высоких концентрациях (100
или 500 мкг/мл) способствовали проникнове
нию PI в клетки (рис. 7). Данные показывают,
Рис. 7. Действие КХ и КХГ на проницаемость плазмати
ческой мембраны устьичных клеток в плёнках эпидермиса
что подавление разрушения ядер КХ и КХГ свя
из листьев гороха для PI. К плёнкам эпидермиса добавля
зано с повреждением клеточной мембраны.
ли 1 мМ Triton X 100, КХ, КХГ, инкубировали 30 мин при
Полученные результаты свидетельствуют об
перемешивании на магнитной мешалке, а затем ещё 3 ч
антиоксидантных свойствах КХГ. Они, очевид
инкубировали в темноте без перемешивания
БИОХИМИЯ том 87 вып. 1 2022
АНТИОКСИДАНТНЫЕ СВОЙСТВА ПРОИЗВОДНОГО ХИТОЗАНА
123
ет антиоксидантые свойства в растворах, но не
препятствует образованию АФК внутри клеток
растений, как показывают опыты с DCF. По ме
ханизму его антиоксидантное действие сходно
с ПГ и особенно с СОД. СОД и КХГ - высоко
молекулярные соединения, не проникают в
клетки и не защищают их от гибели, вызванной
NADH с СГ или KCN. Однако, обладая, в отли
чие от СОД, свойствами поликатиона, КХГ в
концентрации от 100 мкг/мл и выше вызывает
повреждение плазматической мембраны клеток.
Финансирование. Исследование выполнено в
рамках научного проекта государственного за
дания МГУ № 121042600047 9, а также Междис
Рис. 8. Предполагаемые реакции остатка галловой кисло
ты в составе КХГ с O2 . R - остаток кватернизированного
циплинарной научно образовательной школы
хитозана
Московского университета «Молекулярные тех
нологии живых систем и синтетическая биоло
гия». Работа по получению и анализу производ
в том числе кватернизированным, повышало ан
ных хитозана частично поддержана Российским
тимикробный эффект и обеспечивало или в зна
фондом фундаментальных исследований (про
чительной степени усиливало антиоксидантную
ект № 20 016 00205).
активность полимера, которую определяли раз
Конфликт интересов. Авторы заявляют об от
личными методами in vitro и in vivo [42-45]. Та
сутствии конфликта интересов.
ким образом, данные литературы соответствуют
Соблюдение этических норм. Настоящее ис
результатам настоящего исследования.
следование проводили без использования жи
В целом, полученные результаты позволяют
вотных и без привлечения людей в качестве ис
заключить, что КХГ, в отличие от КХ, проявля пытуемых.
СПИСОК ЛИТЕРАТУРЫ
1.
Wang, W., Xue, C., and Mao, X. (2020) Chitosan:
8. Ильина А. В., Варламов В. П. (2016) Нейтрализация
Structural modification, biological activity and application,
активных форм кислорода хитозаном и его производ
Int. J. Biol. Macromol., 164, 4532 4546, doi: 10.1016/
ными in vitro/in vivo, Прикладная биохимия и микробио>
j.ijbiomac.2020.09.042.
логия, 52, 5 20, doi: 10.7868/S0555109916010062.
2.
Pal, K., Bharti, D., Sarkar, P., Anis, A., Kim, D., et al.
9. Yen, G. C., Duh, P. D., and Tsai, H. L. (2002) Antioxidant
(2021) Selected applications of chitosan composites, Int. J.
and pro oxidant properties of ascorbic acid and gallic acid,
Mol. Sci., 22, 10968, doi: 10.3390/ijms222010968.
Food Chem.,
79,
307313, doi:
10.1016/S0308
3.
Malerba, M., and Cerana, R. (2016) Chitosan effects on
8146(02)00145 0.
plant systems, Int. J. Mol. Sci., 17, 996, doi: 10.3390/
10. Yilmaz, Y., and Toledo, R. T. (2004) Major flavonoids in
ijms17070996.
grape seeds and skins: Antioxidant capacity of catechin,
4.
Andreica, B. I., Cheng, X., and Marin, L.
(2020)
epicatechin, and gallic acid, J. Agric. Food Chem., 52, 255
Quaternary ammonium salts of chitosan. A critical overview
260, doi: 10.1021/jf030117h.
on the synthesis and properties generated by quaternization,
11. Fernandes Negreiros, M. M., Batista, L. A. N. C., Viana,
Eur. Polym. J., 139, 110016, doi: 10.1016/j.eurpolymj.
R. L. S., Sabry, D. A., Paiva, A. A. O., et al. (2020) Gallic
2020.110016.
acid Laminarin conjugate is a better antioxidant than sul
5.
Shagdarova, B., Lunkov, A., Il’ina, A., and Varlamov, V.
fated or carboxylated laminarin, Antioxidants, 9, 1192,
(2019) Investigation of the properties of N [(2 hydroxy 3
doi: 10.3390/antiox9121192.
trimethylammonium) propyl] chloride chitosan derivatives,
12. Xie, M., Hu, B., Wang, Y., and Zeng, X. (2014) Grafting of
Int. J. Biol. Macromol., 124, 994 1001, doi: 10.1016/j.ijbiomac.
gallic acid onto chitosan enhances antioxidant activities and
2018.11.209.
alters rheological properties of the copolymer, J. Agric. Food
6.
Tomida, H., Fujii, T., Furutani, N., Michihara, A.,
Chem., 62, 9128 9136, doi: 10.1021/jf503207s.
Yasufuku, T., et al. (2009) Antioxidant properties of some
13. Hidangmayum, A., Dwivedi, P., Katiyar, D., and
different molecular weight chitosans, Carbohydr. Res., 344,
Hemantaranjan, A. (2019) Application of chitosan on plant
1690 1696, doi: 10.1016/j.carres.2009.05.006.
responses with special reference to abiotic stress, Physiol.
7.
Luan, F., Wei, L., Zhang, J., Tan, W., Chen, Y., et al. (2018)
Mol. Biol. Plants, 25, 313 326, doi: 10.1007/s12298 018
Preparation and characterization of quaternized chitosan
0633 1.
derivatives and assessment of their antioxidant activity,
14. Zipfel, C. (2014) Plant pattern recognition receptors, Trends
Molecules, 23, 516, doi: 10.3390/molecules23030516.
Immunol., 35, 345 351, doi: 10.1016/j.it.2014.05.004.
БИОХИМИЯ том 87 вып. 1 2022
124
КИСЕЛЕВСКИЙ и др.
15.
Ye, W., Munemasa, S., Shinya, T., Wu, W., Ma, T., et al.
32.
Samuilov, V. D., Kiselevsky, D. B., Sinitsyn, S. V., Shestak,
(2020) Stomatal immunity against fungal invasion compris
A. A., Lagunova, E. M., et al. (2006) H2O2 intensifies CN-
es not only chitin induced stomatal closure but also chi
induced apoptosis in pea leaves, Biochemistry (Moscow), 71,
tosan induced guard cell death, Proc. Natl. Acad. Sci. USA,
384 394, doi: 10.1134/s0006297906040067.
117, 20932 20942, doi: 10.1073/pnas.1922319117.
33.
Moore, A. L., and Siedow, J. N. (1991) The regulation and
16.
Pasanphan, W., and Chirachanchai, S. (2008) Conjugation
nature of the cyanide resistant alternative oxidase of plant
of gallic acid onto chitosan: an approach for green and
mitochondria, Biochim. Biophys. Acta, 1059, 121140,
water based antioxidant, Carbohydr. Polym., 72, 169 177,
doi: 10.1016/s0005 2728(05)80197 5.
doi: 10.1016/j.carbpol.2007.08.002.
34.
Popov, V. N., Simonian, R. A., Skulachev, V. P., and
17.
Gomes, A., Fernandes, E., and Lima, J. L. F. C. (2005)
Starkov, A. A. (1997) Inhibition of the alternative oxidase
Fluorescence probes used for detection of reactive oxygen
stimulates H2O2 production in plant mitochondria, FEBS
species, J. Biochem. Biophys. Methods,
65,
4580,
Lett., 415, 87 90, doi: 10.1016/s0014 5793(97)01099 5.
doi: 10.1016/j.jbbm.2005.10.003.
35.
Maxwell, D. P., Wang, Y., and McIntosh, L. (1999)
18.
Rhee, S. G., Chang, T. S., Jeong, W., and Kang, D. (2010)
The alternative oxidase lowers mitochondrial reactive oxy
Methods for detection and measurement of hydrogen per
gen production in plant cells, Proc. Natl. Acad. Sci. USA, 96,
oxide inside and outside of cells, Mol. Cells, 29, 539 549,
8271 8276, doi: 10.1073/pnas.96.14.8271.
doi: 10.1007/s10059 010 0082 3.
36.
Киселевский Д. Б., Самуилов В. Д. (2019) Проницае
19.
LeBel, C.P., Ischiropoulos, H., and Bondy, S. C. (1992)
мость плазматической мембраны для йодида пропидия
Evaluation of the probe 2′,7′ dichiorofluorescin as an indi
и разрушение ядер клеток в эпидермисе листьев горо
cator of reactive oxygen species formation and oxidative
ха: действие полиэлектролитов и детергентов, Вестник
stress, Chem. Res. Toxicol., 5, 227 231, doi: 10.1021/
Московского университета, Серия 16, Биология, 74, 188
tx00026a012.
194, doi: 10.3103/S0096392519030052.
20.
Karlsson, M., Kurz, T., Brunk, U. T., Nilsson, S. E., and
37.
Киселевский Д. Б., Шагдарова Б. Ц., Варламов В. П.,
Frennesson, C. I. (2010) What does the commonly used
Самуилова О. В., Самуилов В. Д. (2021) Действие низ
DCF test for oxidative stress really show? Biochem. J., 428,
комолекулярного хитозана на клетки эпидермиса из
183 190, doi: 10.1042/BJ20100208.
листьев гороха, Вестник Московского университета,
21.
Samuilov, V. D., Lagunova, E. M., Kiselevsky, D. B.,
Серия
16, Биология,
76,
1823, doi:
10.3103/
Dzyubinskaya, E. V., Makarova, Y. V., et al.
(2003)
S0096392521010016.
Participation of chloroplasts in plant apoptosis, Biosci. Rep.,
38.
Deeble, D. J., Parson, B. J., Phillips, G. O.,
23, 103 117, doi: 10.1023/a:1025576307912.
Schuchmann, H. P., and von Sonntag, C.
(1988)
22.
Darzynkiewicz, Z., Bruno, S., Del Bino, G., Gorczyca, W.,
Superoxide radical reactions in aqueous solutions of pyro
Hotz, M. A., et al. (1992) Features of apoptotic cells mea
gallol and n propyl gallate: the involvement of phenoxyl
sured by flow cytometry, Cytometry,
13,
795808,
radicals. A pulse radiolysis study, Int. J. Radiat. Biol., 54,
doi: 10.1002/cyto.990130802.
179 193.
23.
Yamazaki, I., and Yokota, K. (1973) Oxidation states of per
39.
Reddan, J. R., Giblin, F. J., Sevilla, M., Padgaonkar, V.,
oxidase, Mol. Cell. Biochem., 2, 3952, doi: 10.1007/
Dziedzic, D. C., et al. (2003) Propyl gallate is a superoxide
BF01738677.
dismutase mimic and protects cultured lens epithelial cells
24.
Brooks, J. L. (1983) Stimulation of peroxidase reactions by
from H2O2 insult, Exp. Eye Res., 76, 49 59, doi: 10.1016/
hydroxamates, Biochem. Biophys. Res. Comm., 116, 916
s0014 4835(02)00256 7.
921, doi: 10.1016/s0006 291x(83)80229 0.
40.
Curcio, M., Puoci, F., Iemma, F., Parisi, O. I., Cirillo, G.,
25.
Hauser, M. J. B., and Olsen, L. F. (1998) The role of natu
et al. (2009) Covalent insertion of antioxidant molecules on
rally occurring phenols in inducing oscillations in the per
chitosan by a free radical grafting procedure, J. Agric. Food
oxidase oxidase reaction, Biochemistry, 37, 2458 2469,
Chem., 57, 5933 5938, doi: 10.1021/jf900778u.
doi: 10.1021/bi972424k.
41.
Pasanphan, W., Buettner, G. R., and Chirachanchai, S.
26.
Самуилов В. Д., Киселевский Д. Б. (2016) Салицилгид
(2010) Chitosan gallate as a novel potential polysaccharide
роксамат усиливает НАДН оксидазную активность пе
antioxidant: an EPR study, Carbohydr. Res., 345, 132 140,
роксидазы в суспензиях митохондрий и хлоропластов
doi: 10.1016/j.carres.2009.09.038.
гороха, Вестник Московского университета, Серия 16,
42.
Ren, J., Li, Q., Dong, F., Feng, Y., and Guo, Z. (2013)
Биология, 1, 23 28, doi: 10.3103/S0096392516010089.
Phenolic antioxidants functionalized quaternized chitosan:
27.
Lee Ruff, E. (1977) The organic chemistry of superoxide,
synthesis and antioxidant properties, Int. J. Biol. Macromol.,
Chem. Soc. Rev., 6, 195 214, doi: 10.1039/CS9770600195.
53, 77 81, doi: 10.1016/j.ijbiomac.2012.11.011.
28.
Jamet, E., Canut, H., Boudart, G., and Pont Lezica, R. F.
43.
Hu, Q., Wang, T., Zhou, M., Xue, J., and Luo, Y. (2016)
(2006) Cell wall proteins: a new insight through proteomics,
In vitro antioxidant activity evaluation of gallic acid graft
Trends Plant Sci., 11, 33 39, doi: 10.1016/j.tplants.2005.
ed chitosan conjugate synthesized by free radical induced
11.006.
grafting method, J. Agric. Food Chem., 64, 5893 5900,
29.
Liu, Y., Ma, L., Cao, D., Gong, Z., Fan, J., et al. (2021)
doi: 10.1021/acs.jafc.6b02255.
Investigation of cell wall proteins of C. sinensis leaves by
44.
Wang, Y., Xie, M., Ma, G., Fang, Y., Yang, W., et al. (2019)
combining cell wall proteomics and N glycoproteomics,
The antioxidant and antimicrobial activities of different
BMC Plant Biol., 21, 384, doi: 10.1186/s12870 021 03166 4.
phenolic acids grafted onto chitosan, Carbohydr. Polym.,
30.
Goldberg, B., and Stern, A. (1976) Production of superox
225, 115238, doi: 10.1016/j.carbpol.2019.115238.
ide anion during the oxidation of hemoglobin by mena
45.
Bai, R., Yong, H., Zhang, X., Liu, J., and Liu, J. (2020)
dione, Biochim. Biophys. Acta, 437, 628 632, doi: 10.1016/
Structural characterization and protective effect of gallic
0304 4165(76)90029 5.
acid grafted O carboxymethyl chitosan against hydrogen
31.
Rosen, G. M., and Freeman, B. A. (1984) Detection of
peroxide induced oxidative damage, Int. J. Biol.
superoxide generated by endothelial cells, Proc. Natl. Acad.
Macromol., 143, 49 59, doi: 10.1016/j.ijbiomac.2019.12.
Sci. USA, 81, 7269 7273, doi: 10.1073/pnas.81.23.7269.
037.
БИОХИМИЯ том 87 вып. 1 2022
АНТИОКСИДАНТНЫЕ СВОЙСТВА ПРОИЗВОДНОГО ХИТОЗАНА
125
INVESTIGATION OF THE ANTIOXIDANT PROPERTIES
OF THE QUATERNIZED CHITOSAN MODIFIED
WITH A GALLIC ACID RESIDUE USING A PEROXIDASE
THAT PRODUCES REACTIVE OXYGEN SPECIES
D. B. Kiselevsky1*, A. V. Il’ina2, A. P. Lunkov2, V. P. Varlamov2, and V. D. Samuilov1
1 Department of Immunology, Faculty of Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; E>mail: dkiselevs@mail.ru
2 Laboratory of Biopolymer Engineering, Skryabin Institute of Bioengineering,
Research Center of Biotechnology of the Russian Academy of Sciences, 119071 Moscow, Russia
Chitosan modified with a (2 hydroxy 3 trimethylammonium) propyl group and a gallic acid residue, or quaternized
chitosan with gallic acid (QCG), was synthesized. Its antioxidant properties have been investigated. Peroxidase in
combination with NADH and salicylhydroxamate (SHAM) caused the consumption of oxygen and the formation of
Н2О2 in an aqueous solution as a result of О2 reduction in peroxidase oxidase reactions. QCG reduced the rates of О2
consumption and Н2О2 generation. The antioxidant propyl gallate (PG) and superoxide dismutase (SOD) had the
same effect, but not quaternized chitosan (QC) without gallic acid. The effect of chitosan derivatives on the produc
tion of reactive oxygen species (ROS) in cells of the epidermis from pea leaves and on their death, which was detect
ed by the destruction of cell nuclei, was investigated. QCG, QC, and SOD had no effect, while PG reduced the rate
of ROS generation in cells of the epidermis, which was caused by NADH with SHAM or by menadione. QCG and
QC prevented the destruction of guard cell nuclei in the epidermis from pea leaves that was caused by NADH with
SHAM or by KCN. SOD had no effect on the destruction of nuclei, while the effect of PG depended on the inducer
of cell death. The suppression of destruction of the nuclei of guard cells by chitosan derivatives is associated not with
their antioxidant effect, but with the disruption of the plasma membrane of the cells. The results obtained indicate
that QCG exhibits antioxidant properties in solutions, but does not prevent the formation of ROS in plant cells. The
mechanism of its antioxidant action is similar to that of PG and SOD.
Keywords: chitosan, quaternized chitosan, peroxidase, superoxide dismutase, reactive oxygen species, propyl gallate
БИОХИМИЯ том 87 вып. 1 2022