БИОХИМИЯ, 2022, том 87, вып. 10, с. 1425 - 1433
УДК 577.344
СЕЛЕКТИВНОЕ ВОЗБУЖДЕНИЕ КАРОТИНОИДОВ
СВЕТОСОБИРАЮЩИХ КОМПЛЕКСОВ LH2 Allochromatium vinosum
ПРИВОДИТ К ОКИСЛЕНИЮ БАКТЕРИОХЛОРОФИЛЛА
© 2022 И.Б. Кленина, З.К. Махнева, А.А. Москаленко, И.И. Проскуряков*
Институт фундаментальных проблем биологии РАН,
142290 Пущино, Московская обл., Россия; электронная почта: pros@issp.serpukhov.su
Поступила в редакцию 15.06.2022
После доработки 13.07.2022
Принята к публикации 14.07.2022
Механизм процесса фотоокисления бактериохлорофилла светособирающих комплексов ряда пур-
пурных фототрофных бактерий при освещении в полосу поглощения каротиноидов в течение
многих лет остается невыясненным. С использованием узкополосного лазерного излучения нами
проведено измерение спектра действия этого процесса в спектральных диапазонах поглощения каро-
тиноидов и бактериохлорофиллов. Показано, что фотоокисление бактериохлорофилла практически
не происходит при возбуждении этих молекул, а при возбуждении каротиноидов - протекает с кван-
товым выходом около 0,0003. Столь низкое значение квантового выхода позволило предположить,
что изучаемый процесс инициируется триплетными состояниями основных каротиноидов с длиной
цепи сопряженных двойных связей N = 11. При взаимодействии с кислородом воздуха эти триплет-
ные состояния вызывают, хотя и с низкой эффективностью, образование синглетно-возбужденного
состояния кислорода, при взаимодействии с которым происходит окисление бактериохлорофилла.
Триплетные состояния каротиноидов образуются в результате изученного ранее синглет-триплетно-
го деления возбуждения. Полученные результаты указывают на необходимость пересмотра взглядов
на функции каротиноидов светособирающих антенн пурпурных бактерий.
КЛЮЧЕВЫЕ СЛОВА: бактериохлорофилл, каротиноиды, фотоокисление, спектр действия, квантовый
выход, триплетные состояния, синглетный кислород, светособирающие комплексы, пурпурные серные
бактерии.
DOI: 10.31857/S0320972522100086, EDN: BCGGDQ
ВВЕДЕНИЕ
филла а (БХл) - в бескаротиноидных мутантах
несерной бактерии Rhodobacter sphaeroides в при-
По современным представлениям, две ос-
сутствии воздуха. Эти эффекты отсутствовали у
новные функции, выполняемые каротиноида-
клеток дикого типа, содержащих каротиноиды.
ми (Кар) в составе фотосинтезирующих орга-
В сопутствующем комментарии [2] было сделано
низмов, - расширение спектрального диапазона
предположение, что наблюдаемые явления вы-
поглощения солнечного света, используемого
званы генерацией синглетного кислорода за счет
затем реакционными центрами, и защита от ге-
взаимодействия кислорода воздуха с триплет-
нерации химически активной формы кислоро-
ными состояниями БХл (3БХл) и подавлением
да - синглетно-возбужденного 1О2*, а также ней-
этого процесса по механизму тушения 3БХл ка-
трализация этого состояния, если синглетный
ротиноидами. За прошедшие почти 70 лет такой
кислород все же образовался. Защитная функ-
взгляд на защитную функцию каротиноидов
ция каротиноидов впервые экспериментально
стал общепринятым [3-5].
продемонстрирована в работе Griffiths et al. [1]
В противоречие с этими взглядами вступают
по прекращению деления клеток и разруше-
результаты многолетних исследований реакции
нию основного пигмента
- бактериохлоро- пурпурных фототрофных бактерий на освеще-
Принятые сокращения: БХл - бактериохлорофилл а; 3БХл - триплетное состояние БХл; БХл850 - форма бактерио-
хлорофилла а с максимумом поглощения при 850 нм; Кар - каротиноид; 3Кар - триплетное состояние каротиноида;
ССК - светособирающий комплекс; LH2 - периферийные светособирающие комплексы.
* Адресат для корреспонденции.
1425
6
1426
КЛЕНИНА и др.
ние в полосу поглощения входящих в их состав
Allochromatium minutissimum) из коллекции кафе-
каротиноидов. Наиболее ярко эти эффекты про-
дры микробиологии Биологического факультета
являются в случае серных бактерий. Так, было
МГУ выращивали в анаэробных условиях (фо-
показано, что освещение клеток Allochromatium
тотрофно). Для получения хроматофоров клет-
vinosum светом, возбуждающим Кар, приводит к
ки разрушали ультразвуком (УЗДН-1, СССР) и
более интенсивному выцветанию БХл, чем при
проводили дифференциальное центрифугиро-
возбуждении самого бактериохлорофилла [6].
вание. Хроматофоры солюбилизировали 2,0-
Аналогичный эффект наблюдался при осве-
2,5%-ным додецилмальтозидом, и светособи-
щении изолированных светособирающих ком-
рающие комплексы выделяли хроматографией
плексов (ССК) ряда пурпурных бактерий [7].
на колонке Toyopearl DEAE-650S («Toyo Soda»,
В обоих случаях выцветает форма бактерио-
Япония) в градиенте концентрации NaCl.
хлорофилла с максимумом поглощения в районе
Подробное описание процедуры приведено
850 нм (БХл850), и фотовыцветание прекращает-
ранее [11]. Препарат LH2-комплексов приго-
ся после удаления кислорода. В работе Махневой
тавливали в количестве, достаточном для про-
и соавт. [8] показано, что похожие спектральные
ведения всех экспериментов.
изменения происходят в мембранах хроматофо-
Фотоокисление LH2-комплексов в 10 мМ
ров и в изолированных периферийных свето-
Tris-HCl (pН 7,5) проводили в 1 см спектрофо-
собирающих комплексах (LH2) при их окисле-
тометрической кювете при оптической плот-
нии феррицианидом калия. При этом продукт
ности около 1 в полосе поглощения 850 нм при
окисления с максимумом поглощения в районе
интенсивном перемешивании. Использовали
700 нм был идентифицирован как 3-ацетил хло-
свет импульсной лазерной системы («Solar Laser
рофилл. В работах Махневой и соавт. [9, 10] было
Systems», Белоpуccия), cоcтоящей из лазеpа на-
показано, что возбуждение внесенного в среду
качки LQ 529B и паpаметpичеcкого пpеобpазо-
бенгальского розового, известного генерато-
вателя LP 603. Система позволяет получать им-
ра 1О2*, вызывает в спектрах поглощения хрома-
пульсы длительностью 6-8 нс в диапазоне длин
тофоров и изолированных ССК ряда бактерий
волн λ ≥ 430 нм с шириной полосы не более 1 нм;
изменения, аналогичные наблюдаемым при воз-
частота следования импульсов составляла 15 Гц.
буждении каротиноидов. Фотовыцветание БХл
Энергия вспышки не превышала 0,15 мДж⋅см-2 и
прекращалось при добавке тушителей синглет-
была выбрана так, чтобы не вызывать насыще-
ного кислорода. На основе всех перечисленных
ния процесса фотовыцветания БХл850 (рис. 1
наблюдений был сделан парадоксальный вывод,
в Приложении); ее регулировали с помощью
что возбуждение каротиноидов ССК приводит
нейтральных светофильтров. Среднюю мощ-
к генерации синглетного кислорода. Затем в
ность падающего на образец света измеряли тер-
результате взаимодействия 1О2* с БХл происхо-
моэлектрической головкой 3A-P-v1-SH с устрой-
дит окисление БХл850 с выцветанием полосы
ством индикации NOVA II («Ophir», Израиль).
поглощения при 850 нм и образованием 3-аце-
Спектры поглощения измеряли на спектрофото-
тил хлорофилла. Таким образом, каротиноиды
метре Shimadzu UV-1800 («Shimadzu», Япония).
способны нести не защитную, а деструктивную
Для измерения каждой точки спектра действия
функцию.
фотовыцветания использовали свежую порцию
Механизм генерации 1О2* при возбуждении
ССК-комплексов. На результаты измерений при
каротиноидов остается неизвестным. Исполь-
импульсном возбуждении может влиять эффект
зованное в перечисленных выше работах широ-
просветления образца во время вспышки. При
кополосное возбуждение Кар усложняет интер-
этом образец поглощает меньше света, чем сле-
претацию результатов и не позволяет провести
дует из его стационарного спектра поглощения.
корректную оценку квантового выхода фото-
При использованных энергиях вспышки и кон-
окисления БХл850. В данной работе с использо-
центрации ССК в образце возбуждалось не бо-
ванием узкополосного лазерного возбуждения
лее 4% молекул БХл, поэтому данным эффектом
мы провели оценку квантового выхода этого
мы пренебрегали. Квантовый выход фотоокис-
процесса и измерили спектр действия фото-
ления определяли по формуле: φox = NБХл/Nфот,
окисления бактериохлорофилла LH2-комплек-
где NБХл - число молекул БХл850, окисленных
сов Alc. vinosum.
в результате 10-минутного освещения образца,
а Nфот - число поглощенных за то же время фото-
нов. Были также проведены измерения фото-
МАТЕРИАЛЫ И МЕТОДЫ
окисления БХл850 при возбуждении добавленно-
го красителя бенгальского розового. Краситель
Получение
LH2-комплексов.
Клет-
добавляли в количестве, дающем поглощение
ки Allochromatium vinosum strain MSU (ранее
1 опт. ед. в максимуме 560 нм. Процедура освеще-
БИОХИМИЯ том 87 вып. 10 2022
ФОТООКИСЛЕНИЕ БАКТЕРИОХЛОРОФИЛЛА АНТЕННЫ
1427
ния образца была та же, что описана выше, при
освещения. Данные о структуре LH2-комплек-
длительности освещения 10 мин.
сов этой бактерии пока что не получены, однако
Коэффициент экстинкции БХл850. Для
совпадение многих характеристик с изученны-
определения числа молекул БХл850 в образце
ми ССК [18, 19] позволяет с хорошей достовер-
необходимо знать их коэффициент экстинк-
ностью предположить общие мотивы струк-
ции ε850 в ССК. Поскольку литературные зна-
турной организации пигментов. Поглощение в
чения этого параметра значительно варьиру-
районе 800 нм и 850 нм - ИК-полосы по-раз-
ют, мы провели его определение. Пигменты
ному пространственно организованных моле-
LH2-комплексов с известной оптической плот-
кул БХл а. При 850 нм поглощают достаточно
ностью экстрагировали смесью ацетон/мета-
сильно экситонно взаимодействующие между
нол = 7/2 (v/v) и определяли количество БХл в
собой бактериохлорофиллы, что вызывает зна-
экстракте, используя коэффициент экстинкции
чительное длинноволновое смещение полосы
ε770 = 76 мМ-1⋅см-1 [12]. При подсчете коэффи-
поглощения по сравнению с БХл а в растворе.
циента экстинкции БХл850 в LH2-комплексах
Поглощение в районе 800 нм определяется сла-
было учтено то обстоятельство, что ССК содер-
бо взаимодействующими БХл, сохраняющими
жит также бактериохлорофиллы, поглощающие
в значительной степени свойства мономерных
при 800 нм, в соотношении 1 : 2 с БХл850 [13].
молекул [13]. Полоса при 590 нм принадлежит
Полученное значение ε850 = 197 ± 30 мМ-1⋅см-1
всем бактериохлорофиллам ССК. В районе
(среднее из 4 измерений) хорошо совпада-
400-550 нм основное поглощение осуществля-
ет с величиной 184 ± 13 мМ-1⋅см-1, приведен-
ется каротиноидами, далее, в коротковолновой
ной в статье Clayton и Clayton [14] для БХл850
области поглощают снова БХл. На рис. 1, ли-
Rhodopseudomonas sphaeroides.
ния 2 приведен спектр того же образца после
Количественный анализ каротиноидного
10-минутного освещения лазерной вспышкой
состава LH2-комплексов проводили методом
при λ = 480 нм. Основные изменения сводятся
ВЭЖХ [15] на колонке Spherisorb ODS2, 5 мкм
к уменьшению поглощения в полосе БХл850.
(«Waters», США). Концентрацию каротинои-
На врезке показан разностный спектр (2) - (1) в
дов рассчитывали, согласно полученным ранее
диапазоне 540-750 нм, на котором заметно так-
коэффициентам экстинкции [16], а площадей
же выцветание общей полосы БХл при 590 нм
полос поглощения в области 360-550 нм - с по-
и появление полосы 3-ацетил хлорофилла -
мощью программы LC-solution («Shimadzu»).
в районе 700 нм.
Измерения ЭПР высокого временного раз-
В данной работе мы сравнили квантовые
решения (ВР-ЭПР) проводили на модифици-
выходы фотовыцветания БХл850 при возбуж-
рованном спектрометре РЭ1306 (СССР), как
дении в полосы поглощения каротиноидов и
описано ранее [17] при Т = 120 К и λвозб = 470
бактериохлорофиллов. Результаты измерений
и 850 нм. Для приготовления использовали
представлены на рис. 2, из которого видно, что
LH2-комплексы с оптической плотностью око-
возбуждение Кар значительно более эффек-
ло 50 в полосе 850 нм. Температуру понижа-
тивно. Возбуждение БХл в полосы поглощения
ли до Т = 120 К с помощью криостата ESR900
при 590 нм и в диапазоне 800-870 нм вызывает
(«Oxford Instruments», Англия) для предотвра-
фотоокисление бактериохлорофилла лишь на
щения деградации образца. Образцы в качестве
уровне погрешности измерения. Квантовый
криопротектора содержали 66% глицерина. Для
выход процесса чрезвычайно низок даже при
возбуждения использовали ту же лазерную си-
возбуждении Кар (φox составляет ~0,25 × 10-3).
стему, которая описана выше; энергия вспышки
Для сравнения мы определили квантовый вы-
была ~1,5 мДж. В спектрометре ВР-ЭПР для ре-
ход фотоокисления БХл при возбуждении
гистрации сигнала используется стробоскопи-
добавленного к LH2-комплексам красителя
ческий (бокскар) интегратор SR250 («Stanford
бенгальского розового, известного сенсиби-
Research Systems», США). Бокскар-интегра-
лизатора 1О2* (квантовый выход синглетного
тор регистрирует сигнал ЭПР в коротком ин-
кислорода в воде - 0,76 [20]). В этом случае
тервале времени, синхронно с возбуждающей
также получено низкое значение квантового
вспышкой света. В работе применяли интервал
выхода фотоокисления - φox = 0,27 × 10-3 (рис. 2
регистрации 0,15-1 мкс после вспышки.
в Приложении).
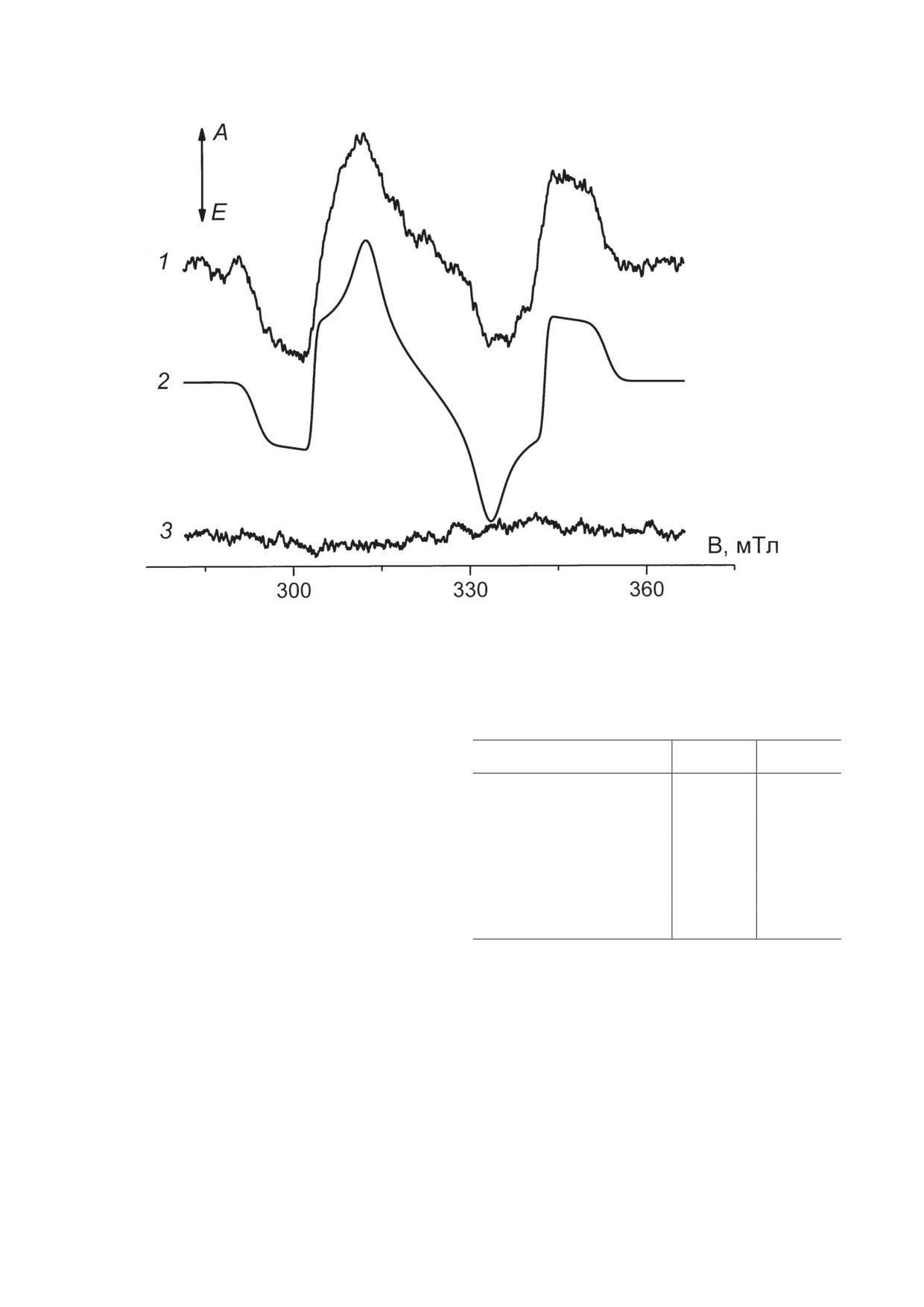
На рис. 3 приведены результаты изме-
рения спектров ВР-ЭПР комплексов LH2
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Alc. vinosum при возбуждении каротиноидов
(λвозб = 470 нм) (рис. 3, линия 1) и бактерио-
На рисунке 1, линия 1 представлен спектр
хлорофиллов (рис. 3, линия 3). Возбуждение в
поглощения LH2-комплексов Alc. vinosum до
полосу поглощения Кар приводит к заселению
БИОХИМИЯ том 87 вып. 10 2022
6*
1428
КЛЕНИНА и др.
Рис. 1. Спектр поглощения светособирающих LH2-комплексов Alc. vinosum до освещения (1) и после 10-минутного ос-
вещения вспышками лазера при λ = 480 нм (2). На врезке - дифференциальный спектр (2) - (1)
Рис. 2. Спектр действия (спектральная зависимость квантового выхода) фотоокисления БХл850 (1). Спектр (1 - Т)
LH2-комплексов Alc. vinosum до освещения (2), Т - пропускание света. Погрешности измерений спектра действия (1)
рассчитаны исходя из погрешностей измерения оптической плотности образца и энергии лазерной вспышки
БИОХИМИЯ том 87 вып. 10 2022
ФОТООКИСЛЕНИЕ БАКТЕРИОХЛОРОФИЛЛА АНТЕННЫ
1429
Рис. 3. Спектр ВР-ЭПР LH2-комплексов Alc. vinosum, измеренный в период 0,15-1 мкс при λвозб = 470 нм (1). Спектр ЭПР
триплетного состояния, рассчитанный для параметров расщепления в нулевом поле каротиноида родопина (N = 11),
|D| = 0,0279 см-1, |E| = 0,0029 см-1и Т0 спиновой поляризации (2). Спектр ВР-ЭПР LH2-комплексов Alc. vinosum, измерен-
ный в период 0,15-1 мкс при λвозб = 850 нм (3). Все измерения проведены при Т = 120 К. Стрелки в левом верхнем углу
указывают направление поглощения (А) и излучения (Е) мощности СВЧ
триплетного состояния каротиноида с харак-
Каротиноидный состав LH2-комплексов Alc. vinosum
терной картиной спиновой поляризации и па-
Каротиноид
Мол %
N
раметрами расщепления в нулевом поле, со-
ответствующими родопину (|D| = 0,0279 см-1,
Родопин
89,8
11
|E| = 0,0029 см-1, [21]) (рис. 3, линия 2). Расчет
спектра ЭПР проведен в предположении селек-
Ликопин
3,5
11
тивной заселенности Т0 спинового подуровня
триплета [22, 23]. Несоответствие эксперимен-
Ангидрородовибрин
3,2
12
тального (1) и расчетного спектра (2) сводится
Дидегидрородопин
2,4
12
в основном к различию амплитуд центральных
пиков. Это различие вызвано быстрой ани-
Спириллоксантин
1,1
13
зотропной спин-решеточной релаксацией и
Примечание. Мол % - молярный процент каротиноида;
подробно рассмотрено ранее [17]. Спектр при
N - число сопряженных двойных связей каротиноида.
возбуждении бактериохлорофиллов (рис.
3,
линия 3) слишком слабый для проведения
подробного анализа, однако можно сделать
предположение, что он принадлежит
3БХл,
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
которые заселены за счет спин-орбитальной
связи [22, 23].
В задачи настоящей работы входило из-
Каротиноидный состав (таблица) того же
учение спектральной зависимости процесса
препарата LH2-комплексов согласуется с ре-
фотоокисления БХл850 при возбуждении ка-
зультатами ЭПР. Преобладающим каротинои-
ротиноидов ССК, оценка квантового выхода
дом является родопин. Важно отметить, что ка-
этого процесса и использование полученной
ротиноиды с короткой системой сопряженных
информации для выработки представлений
двойных связей не обнаружены.
о возможном механизме данного необычно-
БИОХИМИЯ том 87 вып. 10 2022
1430
КЛЕНИНА и др.
го явления. Результаты работ Махневой и со-
Триплетные состояния Кар при этом образу-
авт. [9, 10] указывают на механизм с участием
ются в процессе синглет-триплетного деления
синглетно-возбужденного кислорода. В под-
возбуждения: 1Кар* + Кар → 3Кар + 3Кар. Этот
тверждение этого вывода можно также приве-
процесс разрешен по спину и достаточно хо-
сти наблюдение, что фотоокисление БХл850
рошо известен в области исследования фото-
сопровождается поглощением кислорода [10].
физики органических соединений [30, 31]. Ра-
Фотофизическая генерация
1О2* происходит
нее он был описан в случае ССК Alc. vinosum
по схеме 3О2 + 3D → 1О2* + 1D и требует участия
в работах Клениной и соавт. [17, 32]. Форма
триплетного состояния сенсибилизатора D,
спектра ЭПР, приведенная на рис. 3, линия 1,
имеющего достаточную энергию. В растворе
подтверждает функционирование этого меха-
такими эффективными сенсибилизаторами
низма при заселении наблюдаемых триплет-
являются хлорофиллы и бактериохлорофил-
ных состояний. Заселение 3Кар в результате
лы [24]. Из рис. 2 видно, однако, что эффект
деления возбуждения происходит чрезвычай-
фотоокисления БХл850 характеризуется высо-
но быстро, в пико- и субпикосекундном вре-
кой спектральной селективностью и происхо-
менном диапазоне
[33]. Квантовый выход
дит практически только при возбуждении каро-
триплетов каротиноидов ССК Alc. vinosum
тиноидов. Отсюда представляется неизбежным
не определялся. Для другой пурпурной бак-
парадоксальный вывод, что триплетным сен-
терии (Rhodospirillum rubrum) для квантово-
сибилизатором являются сами молекулы ка-
го выхода была получена достаточно высокая
ротиноидов.
оценка (0,32) [34].
Известно, что фотофизические свой-
Учитывая низкий квантовый выход фото-
ства Кар существенно зависят от числа сопря-
окисления Бхл850 (рис. 2), нельзя полностью ис-
женных двойных связей (N) этих молекул [4,
ключить возможность участия в этом процессе
25-27]. Энергия их синглетных возбужденных
небольшой примеси Кар с N ≤ 10, присутству-
уровней и триплетных уровней повышается
ющих в количестве ниже порога детектирова-
при уменьшении N. При определенных зна-
ния. Необходимо, однако, отметить, что в этом
чениях N энергии триплетного состояния Кар
случае следует ожидать влияния таких кароти-
становится достаточно для заселения состо-
ноидов на измеренный спектр действия (рис. 2,
яния 1О2*. В работах Foote et al. [28, 29] оцен-
линия 1). В работе Niedzwiedzki et al. [27] при-
ка относительных энергий 3Кар и синглет-
ведены данные о спектрах поглощения каро-
ного кислорода проведена путем изучения
тиноидов с различным числом двойных свя-
зависимости константы скорости тушения
зей (N) в ацетоне. При изменении N от 9 до 13
каротиноидами синглетно-возбужденного со-
положение пика поглощения Кар смещается
стояния О2 от значения N. Оказалось, что при
на 60 нм - от 470 до 530 нм. Похожие измене-
N ≤ 10 происходит экспоненциальное паде-
ния можно ожидать и для каротиноидов в со-
ние константы скорости тушения синглетно-
ставе ССК. Это привело бы к заметному от-
го кислорода каротиноидами. Это означает,
клонению спектра действия от спектра 1 - Т,
что уровень триплетного состояния таких ка-
определяемому основными каротиноидами
ротиноидов оказывается выше уровня
1О2*,
LH2-комплексов. Поскольку такое отклонение
и обратный процесс возбуждения кислорода
не наблюдается, участие Кар с короткой систе-
в синглетное состояние при взаимодействии
мой сопряженных двойных связей в генера-
с 3Кар становится энергетически возможным.
ции 1О2* представляется маловероятным.
При N ≥ 11 тушение синглетного кислорода
Возбуждение в длинноволновые полосы
идет практически с диффузионной константой
поглощения бактериохлорофиллов при
800
скорости.
и 850 нм не вызывает практически никакого
Анализ каротиноидного состава LH2-ком-
фотоокисления БХл850 (рис. 2). Это связано,
плексов показывает (таблица), что кароти-
с одной стороны, с эффективным тушением
ноиды с короткой системой сопряженных
триплетов бактериохлорофилла каротиноида-
двойных связей (N ≤ 10) в этих комплексах
ми. С другой стороны, квантовый выход 3БХл
не детектируются. Этот факт привел к выра-
в светособирающих комплексах вообще не-
ботке представления, что в ССК образование
высокий. Так, в работе Monger et al. [35] этот
1О2* при взаимодействии с 3Кар невозможно.
квантовый выход определен как 0,02, причем
Полученное в данной работе низкое значе-
появление одной триплетной молекулы БХл
ние квантового выхода фотоокисления БХл
вызывает резкое тушение возбуждения ССК.
позволяет предположить, что такой процесс
Низкая амплитуда сигнала ЭПР при воз-
генерации 1О2* идет при возбуждении каро-
буждении БХл (рис. 3, линия 3) согласуется
тиноидов, хотя и с низкой эффективностью.
с этими данными.
БИОХИМИЯ том 87 вып. 10 2022
ФОТООКИСЛЕНИЕ БАКТЕРИОХЛОРОФИЛЛА АНТЕННЫ
1431
При возбуждении добавленного к ССК
но с быстрым и достаточно эффективным син-
бенгальского розового, известного эффектив-
глет-триплетным делением возбуждения [34].
ного генератора синглетного кислорода, кван-
Вторая функция - тушение 3БХл - также не
товый выход окисления БХл850 также оказался
представляется жизненно важной вследствие
низким (рис. 2 в Приложении). Частично это
низкого квантового выхода триплетов бак-
связано с тем обстоятельством, что, в отличие
териохлорофилла в экситонно-связанных
от возбуждения каротиноидов, входящих в со-
кольцевых структурах [35]. С этим выводом
став ССК, возбуждение бенгальского розово-
согласуются результаты работ Торопыгиной
го приводит к генерации 1О2* во всем объеме
и соавт. [7] и Махневой и соавт. [9, 10], в ко-
растворителя. При этом, учитывая короткое
торых показано, что фотовыцветание БХл850
время жизни синглетного кислорода (2 мкс
слабо зависит от присутствия каротиноидов
в воде [36]), вероятность контакта и реакции
в ССК. К тому же Alc. vinosum обитают в анаэ-
с бактериохлорофиллом ССК будет замет-
робных условиях, хотя нельзя исключить их
но понижена. Снижение квантового выхода
периодическое попадание в аэробные усло-
фотоокисления бактериохлорофиллов может
вия. Таким образом, на первый план выходит
быть также связано с тушением 1О2* самими
третья, структурная функция молекул кароти-
бактериохлорофиллами, как отмечено в статье
ноидов в светособирающих комплексах. Под-
Krasnovsky [24].
тверждение этого вывода требует дальнейших
Необходимо отметить, что полученные
исследований.
значения квантовых выходов фотоокисле-
Биологический смысл синглет-триплет-
ния БХл850 являются приблизительными.
ного деления возбуждения каротиноидов ССК
Зависимость уменьшения поглощения экси-
остается непонятным. Этот процесс суще-
тонно-связанных пигментов БХл850 от чис-
ственно понижает эффективность переноса
ла окисленных молекул БХл может иметь
энергии на бактериохлорофиллы. В настоя-
достаточно сложный характер и в данной ра-
щее время единственным объяснением этой
боте не исследовалась. Такой расчет про-
функции Кар может быть рассеяние избыт-
веден в работе Leiger et al. [37] в случае сер-
ка энергии в условиях высокой интенсив-
ной пурпурной бактерии Ectothiorhodospira
ности света. В анаэробных условиях заселе-
haloalkaliphila. Основываясь на результатах
ние 3Кар не будет приводить к деструктивным
этой работы, можно оценить, что в условиях
последствиям.
наших экспериментов фотоокисление претер-
певает приблизительно одна молекула БХл в
Вклад авторов. И.И. Проскуряков, А.А. Мо-
LH2-комплексе. Учет экситонного взаимодей-
скаленко - концепция и руководство работой;
ствия БХл в любом случае не вызовет прин-
З.К. Махнева, И.Б. Кленина, И.И. Проскуря-
ципиальных изменений в оценке квантового
ков - проведение экспериментов; А.А. Моска-
выхода.
ленко - обсуждение результатов исследования;
И.И. Проскуряков, И.Б. Кленина - написание
текста; З.К. Махнева, А.А. Москаленко - ре-
ЗАКЛЮЧЕНИЕ
дактирование текста статьи.
Финансирование. Работа выполнена в рам-
Полученные данные еще раз заставляют за-
ках проекта № 121040200027-1 Минобрнауки.
думаться о роли каротиноидов ССК пурпурных
Благодарности.
Авторы
благодарят
бактерий. Рассмотрим эту проблему на при-
М.А. Большакова за приготовление LH2-ком-
мере каротиноидов Alc. vinosum. Принято счи-
плексов Allochromatium vinosum и В.В. Терен-
тать, что к основным функциям Кар относят-
тьева за предоставленную возможность изме-
ся: 1) поглощение света и передача энергии на
рений на спектрофотометре Shimadzu.
молекулы БХл; 2) защита биологических струк-
Конфликт интересов. Авторы заявляют об
тур от активных форм кислорода, в частности,
отсутствии конфликта интересов.
предотвращение генерации 1О2* путем тушения
Соблюдение этических норм. Настоящая
триплетов БХл; 3) возможная роль в стабилиза-
статья не содержит описания каких-либо ис-
ции структуры ССК, в состав которых они вхо-
следований с участием людей или животных в
дят. В случае ССК Alc. vinosum эффективность
качестве объектов.
передачи поглощенной Кар энергии на БХл
Дополнительные материалы. Приложение к
невысокая: около 0,36 [18]. Низкое значение
статье опубликовано на сайте журнала «Биохи-
этого параметра не в последнюю очередь связа-
БИОХИМИЯ том 87 вып. 10 2022
1432
КЛЕНИНА и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Griffiths, M., Sistrom, W. R., Cohen-Bazire, G.,
13.
Cogdell, R. J., Gall, A., and Köhler, J. (2006) The
and Stanier, R. Y. (1955) Function of carotenoids
architecture and function of the light harvesting
in
photosynthesis, Nature,
176,
1211-1214,
apparatus of purple bacteria: from single molecules to
doi: 10.1038/1761211a0.
in vivo membranes, Quart. Rev. Biophys., 39, 227-324,
2.
Calvin, M. (1955) Nature, 176, 1215, doi: 10.1038/
doi: 10.1017/S0033583506004434.
1761215a0.
14.
Clayton, R. K., and Clayton, B. J. (1981) B850
3.
Krinsky, N. I. (1979) Carotenoid protection against
pigment-protein complex of Rhodopseudomonas
oxidation, Pure Appl. Chem., 51, 649-660, doi: 10.1351/
sphaeroides: extinction coefficients, circular dichroism,
pac197951030649.
and the reversible binding of bacteriochlorophyll, Proc.
4.
Frank, H. A., and Cogdell, R. J.
(1993)
Natl. Acad. Sci. USA, 78, 5583-5587, doi: 10.1073/
The photochemistry and function of carotenoids in
pnas.78.9.5583.
photosynthesis, Chapt. 8, in Carotenoids in Photo-
15.
Ashikhmin, A., Makhneva, Z., and Moskalenko, A.
synthesis (Young, A. J. and Britton, G., eds)
(2014) The LH2 complexes are assembled in the
Springer, Dordrecht, pp.
252-326, doi:
10.1007/
cells of purple sulfur bacterium Ectothiorhodospira
978-94-011-2124-8_8.
haloalkaliphila with inhibition of carotenoid
5.
Telfer A., Pascal, A., and Gall, A. (2008) Carotenoids
biosynthesis, Photosynth. Res.,
119,
291-303,
in Photosynthesis, Chapt. 10, in Carotenoids, Vol. 4:
doi: 10.1007/s11120-013-9947-6.
Natural Functions (Britton, G., Liaaen-Jensen, S., and
16.
Gall, A., Henry, S., Takaichi, S., Robert, B., and
Pfander, H., eds) Birkhäuser Verlag, Basel, pp. 265-
Cogdell, R. J. (2005) Preferential incorporation of
308, doi: 10.1007/978-3-7643-7499-0_14.
coloured-carotenoids occurs in the LH2 complexes
6.
Махнева З. К., Ерохин Ю. Е., Москаленко А. А.
from non-sulphur purple bacteria under carotenoid-
(2007) Фотосенсибилизированное каротиноидами
limiting conditions, Photosynth. Res.,
86,
25-35,
окисление димеров бактериохлорофилла светосо-
doi: 10.1007/s11120-005-3481-0.
бирающих комплексов В800-850 в клетках Allochro-
17.
Кленина И. Б., Маxнева З. К., Моcкаленко А.
matium minutissimum, Докл. Акад. Наук, 416, 408-411.
А., Кузьмин А. Н., Пpоcкуpяков И. И. (2013)
7.
Торопыгина О. А., Махнева З. К., Москаленко А. А.
Cинглет-триплетное деление возбуждения в
(2003) Кластерам бактериохлорофилла не требу-
светособирающих комплексах пурпурных фото-
ются каротиноиды для защиты от фотоокисления в
синтезирующих бактерий и в изолированных
светособирающих комплексах фотосинтезирующих
каротиноидах, Биофизика, 58, 54-63.
бактериях, Докл. Акад. Наук, 391, 828-831.
18.
Niedzwiedzki, D. M., Bina, D., Picken, N.,
8.
Махнева З. К., Ашихмин А. А., Большаков М. А.,
Honkanen, S., Blankenship, R. E., et al.
(2012)
Москаленко А. А. (2016) Образование 3-ацетил-
Spectroscopic studies of two spectral variants of light-
хлорофилла в светособирающих комплексах
harvesting complex 2 (LH2) from the photosynthetic
пурпурных бактерий при химическом окислении,
purple sulfur bacterium Allochromatium vinosum,
Биохимия, 81, 282-294.
Biochim. Biophys. Acta, 1817, 1576-1587, doi: 10.1016/
9.
Махнева З. К., Ашихмин А. А., Большаков М. А.,
j.bbabio.2012.05.009.
Москаленко А. А. (2019) Защита БХл850 от дейст-
19.
Löhner, A., Carey, A. M., Hacking, K., Picken, N.,
вия синглетного кислорода в мембранах серной
Kelly, S., et al. (2015) The origin of the split B800
фотосинтезирующей бактерии Allochromatium
absorption peak in the LH2 complexes from
vinosum с помощью тушителей, Микробиология, 88,
Allochromatium vinosum, Photosynth. Res., 123, 23-31,
91-99, doi: 10.1134/S0026365619010129.
doi: 10.1007/s11120-014-0036-2.
10.
Makhneva, Z. K., Bolshakov, M. A., and
20.
Kochevar, I. E., and Redmond, R. W.
(2000)
Moskalenko, A. A. (2021) Carotenoids do not protect
Photosensitized production of singlet oxygen,
bacteriochlorophylls in isolated light-harvesting LH2
Methods Enzymol.,
319,
20-28, doi:
10.1016/
complexes of photosynthetic bacteria from destructive
s0076-6879(00)19004-4.
interactions with singlet oxygen, Molecules, 26, 5120,
21.
Frank, H. A., Chadwick, B. W., Oh, J. J.,
doi: 10.3390/molecules26175120.
Gust, D., Moore, T. A., et al.
(1987) Triplet-
11.
Большаков М. А., Ашихмин А. А., Махнева З. К.,
triplet energy transfer in B800-850 light-harvesting
Москаленко А. А. (2016) Влияние интенсивности
complexes of photosynthetic bacteria and synthetic
освещения и ингибирования биосинтеза кароти-
carotenoporphyrin molecules investigated by electron
ноидов на сборку периферийных светособираю-
spin resonance, Biochim. Biophys. Acta, 892, 253-263,
щих комплексов пурпурной серной бактерии
doi: 10.1016/0005-2728(87)90229-5.
Allochromatium vinosum ATCC 17899, Микробиология,
22.
Budil, D. E., and Thurnauer, M. C.
(1991)
85, 403-414, doi: 10.7868/S0026365616040029.
The chlorophyll triplet state as a probe of
12.
Clayton, R. K. (1966) Spectroscopic analysis of bacte-
structure
and function in photosynthesis,
riochlorophylls in vitro and in vivo, Photochem. Photobi-
Biochim. Biophys. Acta, 1057, 1-41, doi: 10.1016/
ol., 5, 669-677, doi: 10.1111/j.1751-1097.1966.tb05813.x.
S0005-2728(05)80081-7.
БИОХИМИЯ том 87 вып. 10 2022
ФОТООКИСЛЕНИЕ БАКТЕРИОХЛОРОФИЛЛА АНТЕННЫ
1433
23.
Angerhofer, A. (1991) Chlorophyll triplets and radical
31. Smith, M. B., and Michl, J. (2013) Recent advances in
pairs, Chapt. 4.8, in Chlorophylls (Scheer, H., ed.)
singlet fission, Annu. Rev. Phys. Chem., 64, 361-386,
CRC Press, Boca Raton, pp. 945-991.
doi: 10.1146/annurev-physchem-040412-110130.
24.
Krasnovsky, A. A., Jr. (1994) Singlet molecular oxygen
32. Кленина И. Б., Махнева З. К., Москаленко А.
and primary mechanisms of photo-oxidative damage of
А., Гудков Н. Д., Большаков М. А., и др. (2014),
chloroplasts. Studies based on detection of oxygen and
Синглет-триплетное деление возбуждения кароти-
pigment phosphorescence, Proc. R. Soc. Edinburgh,
ноидов светособирающих комплексов LH2 пурпур-
102B, 219-235, doi: 10.1017/S0269727000014147.
ных фототрофных бактерий, Биохимия, 79, 310-317.
25.
Christensen, R. L. (1999) The electronic states of
33. Gradinaru, C. C., Kennis, J. T. M., Papagiannakis, E.,
carotenoids, Chapt.
8, in The Photochemistry of
van Stokkum, I. H. M., Cogdell, R. J., et al. (2001)
Carotenoids, Advances in Photosynthesis, vol. 10 (Frank,
An unusual pathway of excitation energy deactivation in
H. A., Young, A. J., Britton, G., and Cogdell, R. J.,
carotenoids: Singlet-to-triplet conversion on an ultrafast
eds) Kluwer Acad. Publ., N.Y., pp. 137-159.
timescale in a photosynthetic antenna, Proc. Natl. Acad.
26.
Angerhofer, F., Bornhäuser, F., Gall, A., and Cogdell,
Sci. USA, 98, 2364-2369, doi: 10.1073/pnas.051501298.
R. J. (1995) Optical and optically detected magnetic
34. Rademaker, H., Hoff, A. J., van Grondelle, R., and
resonance investigation on purple photosynthetic
Duysens, L. N. M. (1980) Carotenoid triplet yields in
bacterial antenna complexes, Chem. Phys., 194, 259-
normal and deuterated Rhodospirillum rubrum, Biochim.
274, doi: 10.1016/0301-0104(95)00022-G.
Biophys. Acta,
592,
240-257, doi:
10.1016/0005-
27.
Niedzwiedzki, D., Koscielecki, J. F., Cong, H.,
2728(80)90185-1.
Sullivan, J. O., Gibson, G. N., et al. (2007) Ultrafast
35. Monger, T. G., Cogdell, R. J., and Parson, W. W. (1976)
dynamics and excited state spectra of open-chain
Triplet states of bacteriochlorophyll and carotenoids in
carotenoids at room and low temperatures, J. Phys.
chromatophores of photosynthetic bacteria, Biochim.
Chem. B, 111, 5984-5998, doi: 10.1021/jp070500f.
Biophys. Acta,
449,
136-153, doi:
10.1016/0005-
28.
Foote, C. S., Chang, Y. C., and Denny, R. W. (1970)
2728(76)90013-X.
Chemistry of singlet oxygen. X. Carotenoid quenching
36. Kearns, D. R. (1979) Solvent and solvent isotope effects
parallels biological protection, J. Am. Chem. Soc., 92,
on the lifetime of singlet oxygen, Chapt. 4, in Singlet
5216-5218, doi: 10.1021/ja00720a036.
Oxygen. Organic Chemistry, vol. 40 (Wasserman, H. H.,
29.
Foote, C. S. (1979) Quenching of singlet oxygen,
Murray, R. W., eds) Academic Press, N.Y., pp. 115-137.
Chapt. 5, in Singlet Oxygen. Organic Chemistry, vol. 40
37. Leiger, K., Linnanto, J. M., Rätsep, M.,
(Wasserman, H. H., and Murray, R. W., eds) Academic
Timpmann, K., Ashikhmin, A. A., et al.
(2019)
Press, N.Y., pp. 139-171.
Controlling photosynthetic excitons by selective
30.
Smith, M. B., and Michl, J. (2010) Singlet fission,
pigment photooxidation, J. Phys. Chem. B, 123, 29-38,
Chem. Rev., 110, 6891-6936, doi: 10.1021/cr1002613.
doi: 10.1021/acs.jpcb.8b08083.
SELECTIVE EXCITATION OF CAROTENOIDS
OF THE Allochromatium vinosum LIGHT-HARVESTING LH2 COMPLEXES
LEADS TO THE OXIDATION OF BACTERIOCHLOROPHYLL
I. B. Klenina, Z. K. Makhneva, A. A. Moskalenko, and I. I. Proskuryakov*
Institute of Basic Biological Problems, Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia; e-mail: pros@issp.serpukhov.su
The mechanism of bacteriochlorophyll photooxidation in light-harvesting complexes of a number of purple
photosynthetic bacteria when the complexes are excited into the carotenoid absorption bands remains unclear
for many years. Here, using narrow-band laser illumination we measured the action spectrum of this process for
the spectral ranges of carotenoid and bacteriochlorophyll. It is shown that bacteriochlorophyll excitation results
in almost no photooxidation of these molecules, while at carotenoid excitation it proceeds with a quantum
yield of about 0.0003. The low value of the yield enabled an assumption that the studied process is initiated by
the triplet states of the main carotenoids of the complexes with the number of conjugated double-bond chain
length of N = 11. Interacting with oxygen, these states promote formation, though with low efficiency, of the
singlet-excited oxygen, which oxidizes bacteriochlorophylls. The carotenoid triplet states are populated in the
process of the earlier studied singlet-triplet fission. The obtained results point at the necessity of reconsidering
the functions of carotenoids in the light-harvesting complexes of purple bacteria.
Keywords: bacteriochlorophyll а, carotenoids, photooxidation, action spectrum, quantum yield, triplet states, singlet
oxygen, light-harvesting complexes, purple sulfur bacteria
БИОХИМИЯ том 87 вып. 10 2022