БИОХИМИЯ, 2022, том 87, вып. 10, с. 1471 - 1482
УДК 577.32
ζ-КАРОТИН: ГЕНЕРАЦИЯ И ТУШЕНИЕ СИНГЛЕТНОГО КИСЛОРОДА,
СРАВНЕНИЕ С ФИТОФЛУИНОМ
© 2022 А.А. Ашихмин1, А.С. Бендиткис2, А.А. Москаленко1, А.А. Красновский (мл.)2*
1 ФИЦ «Пущинский научный центр биологических исследований РАН»,
Институт фундаментальных проблем биологии РАН, 142290 Пущино, Московская обл., Россия
2 ФИЦ «Фундаментальные основы биотехнологии» РАН, Институт биохимии имени А.Н. Баха,
119071 Москва, Россия; электронная почта: phoal@mail.ru
Поступила в редакцию 29.05.2022
После доработки 24.08.2022
Принята к публикации 24.08.2022
Известно, что фитофлуин и ζ-каротин - C40-каротиноиды с короткой цепью сопряженных двойных
связей (СДС) (5 и 7 соответственно), являются универсальными предшественниками в биосинтезе
окрашенных каротиноидов в растительных клетках. Ранее, используя стационарные измерения фо-
тосенсибилизированной фосфоресценции синглетного кислорода (1O2), мы впервые показали, что
фитофлуин эффективно генерирует 1О2 в аэрированных растворах и поэтому может служить источ-
ником фотодинамического стресса при УФ-возбуждении живых клеток (Ашихмин и соавт. (2020)
Биохимия, 85, 907-915). В настоящей работе, используя новые импульсные светодиоды, аэрирован-
ный гексафторбензол в качестве растворителя и разрешенные во времени измерения фосфоресцен-
ции 1О2, мы подтвердили высокую эффективность генерации 1O2 фитофлуином, квантовый выход
которой по этим данным ≈ 0,4. Обнаружено, что ζ-каротин фотосенсибилизирует образование 1О2,
хотя квантовый выход этого процесса почти в 30 раз ниже, чем у фитофлуина. Установлено, что оба
каротиноида тушат 1O2 в темноте, измерены константы скорости тушения, равные соответственно
(3,6 ± 0,9) × 107 и (2,1 ± 0,2) × 108 М-1⋅с-1, причем для ζ-каротина эта константа получена, вероятно,
впервые. Данные показывают, что константы скорости тушения 1О2 обоими каротиноидами значи-
тельно (на 2 и 3 порядка соответственно) меньше, чем константа скорости ограниченных диффузией
бимолекулярных процессов. Следовательно, протекторная способность каротиноидов - ингибиро-
вание 1О2 - относительно слабо выражена. Поэтому оба каротиноида можно рассматривать как по-
тенциальные сенсибилизаторы фотодинамического стресса в клетках живых организмов.
КЛЮЧЕВЫЕ СЛОВА: ζ-каротин, фитофлуин, синглетный кислород, фотосенсибилизация, фотоди-
намический стресс.
DOI: 10.31857/S0320972522100128, EDN: BDJBYO
ВВЕДЕНИЕ
ссылки). Полагают, что протекторные свойства
этих каротиноидов основаны на их способно-
Известно, что фитоин, фитофлуин и ζ-ка-
сти дезактивировать триплетные состояния
ротин - С40-каротиноиды с относительно ко-
хлорофиллов и бактериохлорофиллов, тушить
роткими цепями сопряженных двойных связей
синглетный кислород (1O2) и нейтрализовать
(3-7 СДС) в клетках фотосинтезирующих ор-
свободные радикалы [1-7]. Напротив, изомеры
ганизмов являются универсальными предше-
зрительного пигмента - ретиналя (транс-фор-
ственниками в биосинтезе окрашенных каро-
мы, 11-цис и 13-цис) - полиена с короткой
тинов и ксантофиллов, имеющих длинную цепь
цепью СДС (6 СДС), эффективно фотосенси-
СДС [1]. Показано, что каротиноиды с числом
билизируют образование 1O2 в неполярной сре-
СДС более 9 служат эффективными протек-
де в результате переноса энергии на кислород от
торами живых тканей, защищая их от фото-
триплетного состояния ретиналя [7-9]. Пола-
окислительного стресса ([1-7] и указанные там гают, что именно этот процесс вызывает фото-
динамическое повреждение сетчатки глаза [10].
Поэтому было высказано предположение, что
Принятые сокращения: 1О2 - синглетный кислород;
полиены с короткой цепью СДС могут участво-
СДС - сопряженная двойная связь; ΦΔ - квантовый выход
генерации 1О2.
вать также в фотодинамическом повреждении
* Адресат для корреспонденции.
фотосинтетических тканей [11]. В последнее
1471
1472
АШИХМИН и др.
время в серии работ лаборатории A.A. Моска-
ного 1Δg-уровня кислорода. Кроме того, извест-
ленко (ИФБП РАН) получены эксперимен-
но, что листья мутантов кукурузы, биосинтез
тальные данные, которые свидетельствуют о
каротиноидов которых заканчивается на ста-
том, что каротиноиды LН2-комплексов пур-
дии образования ζ-каротина (ζ-каротиновые
пурных бактерий способны генерировать син-
мутанты кукурузы), отличаются низкой фото-
глетный кислород и вызывать фотодеструкцию
устойчивостью и высоким выходом триплетных
пигментов фотосинтетического аппарата, при-
состояний хлорофилла [19]. Таким образом,
чем предполагается, что в фотосенсибилиза-
можно предположить, что у ζ-каротина антиок-
ции могут принимать участие как каротинои-
сидантные свойства выражены слабо.
ды с короткой, так и с протяженной системой
Структурные формулы исследуемых каро-
СДС [12-16]. До недавнего времени триплет-
тиноидов показаны на рис. 1.
ные состояния каротиноидов и синглетный
В отличие от ранее проведенных экспери-
кислород не удавалось наблюдать при прямом
ментов [18], в настоящей работе использованы
фотовозбуждении каротиноидов, выделенных
новые более мощные светодиоды и новая элек-
из фотосинтезирующих организмов. Триплет-
тронная система их модуляции. Это позволило
ные состояния каротиноидов с протяженной
сравнить разрешенные во времени кинетиче-
системой СДС регистрировались лишь сен-
ские и стационарные измерения фосфоресцен-
сибилизированно за счет переноса энергии от
ции в растворах каротиноидов. Применение
триплетных состояний хлорофиллов и бакте-
новой техники позволило подтвердить высокую
риохлорофиллов и других фотосенсибилизато-
фотосенсибилизирующую активность фито-
ров ([1-6] и указанные там ссылки).
флуина и уточнить квантовый выход этого про-
В связи с изложенным недавно мы при-
цесса, а также впервые достоверно установить,
ступили к систематическому фотофизическо-
что ζ-каротин генерирует 1O2 при фотовозбуж-
му исследованию способностей каротиноидов
дении. Измерены также константы скорости
с разной длиной системы СДС путем прямого
тушения 1O2 изученными каротиноидами, при-
измерения фотосенсибилизированной кароти-
чем для ζ-каротина, насколько нам известно,
ноидами фосфоресценции 1O2, используя мно-
эта константа получена впервые. В ближайшей
голетний опыт работы в этой области группы
перспективе мы планируем применить разра-
А.А. Красновского (ФИЦ биотехнологии РАН)
ботанные экспериментальные подходы к ис-
и новые фосфоресцентные спектрометры,
следованию генерации синглетного кислорода
собранные этой группой [17]. В первой рабо-
каротиноидами с более длинной цепью СДС.
те этой серии мы обнаружили, что фитофлу-
ин (5 СДС) эффективно генерирует 1О2 в аэроб-
ных растворах, тогда как фитоин (3 СДС) почти
МАТЕРИАЛЫ И МЕТОДЫ
не активен [18]. Главная задача настоящей ра-
боты состояла в экспериментальном изучении
Фитофлуин и ζ-каротин (транс-формы)
способности ζ-каротина генерировать и тушить
были выделены из клеток пурпурной серной фо-
синглетный кислород в аэрированных раство-
тосинтезирующей бактерии Ectothiorhodospira
рах и сравнении полученных данных с анало-
haloalkaliphila ATCC 51935T. Клетки выращива-
гичными параметрами растворов фитофлуина.
ли при 28 ± 2 °С в анаэробных условиях на сре-
Действительно, по оценкам, приведенным в ра-
де Пфеннига, приготовленной самостоятельно
ботах Bensasson et al. [4] и Niedzwiedzki et al. [6],
согласно составу, приведенному в работе Imhoff
триплетный уровень ζ-каротина выше синглет-
и Trüper [20], при освещении белым светом
Рис. 1. Структурные формулы каротиноидов, исследованных в настоящей работе
БИОХИМИЯ том 87 вып. 10 2022
ζ-КАРОТИН И СИНГЛЕТНЫЙ КИСЛОРОД
1473
лампы накаливания 90 Вт/м2. Для накопления
сти кюветы не превышала 10 мВт/см2. Полуши-
в клетках фитофлуина и ζ-каротина в среду для
рина полос излучения светодиодов составляла
выращивания добавляли 53 мкМ дифенилами-
12-26 нм. Для разрешенных во времени изме-
на, который блокирует синтез каротиноидов с
рений использованы новые импульсные свето-
длинной цепью СДС [21]. Клетки разрушали
диоды с максимумом излучения 365 нм (полу-
методом ультразвукового дезинтегрирования,
ширина - 18 нм) и 395 нм (полуширина - 11 нм)
как описано в работе Ашихмина и соавт. [18].
(«Полироник»), снабженные разработанным
Выделение каротиноидов проводили в два
специально для наших исследований модулиру-
этапа. На первом этапе из мембран экстраги-
ющим электронным чипом. Излучение свето-
ровали смесь фотосинтетических пигментов
диодов фокусировали в пятно диаметром 5 мм
(каротиноиды и бактериохлорофилл), и затем
на поверхности кварцевой кюветы (1 см) с
получали общий экстракт каротиноидов по ме-
исследуемым раствором. Интенсивность воз-
тодике, описанной в работе Ashikhmin et al. [21].
буждающего света контролировали измери-
На втором этапе отдельные каротиноиды выде-
телем мощности ThorLabs PM-100D с сен-
ляли методом ВЭЖХ на приборе Agilent 1200
сорной фотоэлектрической головкой S120VC
(«Agilent Technologies», США) с препаративной
(«ThorLabs», США) и измерителем мощности
колонкой (10 × 250 мм) с обращенной фазой
Ophir ORION-TH с термической сенсорной го-
Waters Spherisorb ODS2 («Waters», США), ис-
ловкой 20C-SH («Ophir Optronics», Израиль).
пользуя градиент растворителей, описанный
Фосфоресценцию 1O2 измеряли под углом 90°
ранее [20]. Скорость подачи растворителей со-
по отношению к возбуждающему лучу с помо-
ставляла 4 мл/мин. Разделение проводили при
щью охлаждаемого фотоумножителя ФЭУ-112
комнатной температуре. Всего было проведено
(«Экран оптические системы», Россия) со
четыре независимых выделения фитофлуина и
спектральной характеристикой С-1 через отсе-
ζ-каротина. Чистоту полученных каротиноидов
кающие фильтры, которые пропускают ИК-из-
дополнительно проверяли с помощью аналити-
лучение на λ ≥ 1000 нм, и один из трех сменных
ческой ВЭЖХ-системы Shimadzu («Shimadzu»,
интерференционных фильтров с максимумами
Япония) при 22 °C, а также путем спектрофо-
пропускания при 1230, 1270 и 1310 нм и полу-
тометрии [21]. Примесь каротиноидов с боль-
ширине 10 нм. Стационарную интенсивность
шим количеством СДС в среднем составляла
фосфоресценции измеряли цифровым милли-
менее 0,1%.
вольтметром («Эконикс-Эксперт», Россия).
Синглетный кислород исследовали путем
Для кинетических измерений частоту по-
измерения его собственной инфракрасной
вторения и длительность импульсов светоди-
фосфоресценции при 1270 нм, которая возни-
одов регулировали с помощью внешних гене-
кает в результате переноса энергии от триплет-
раторов импульсов. Длительность импульса
ного состояния молекул фотосенсибилизатора
в большинстве измерений составляла 10 мкс,
на кислород с последующим заселением воз-
частоту повторения импульсов изменяли в диа-
бужденного синглетного (1Δg) состояния мо-
пазоне 5-100 Гц [13]. Сигнал фотоумножителя
лекул кислорода. Это явление, впервые обна-
через широкополосный (400 мГц) предвари-
руженное в растворах фотосенсибилизаторов
тельный усилитель поступал на электронную
в работах Красновского [22, 23], в настоящее
плату, работающую в режиме разрешенного
время широко применяется в аналитической
во времени счета фотонов («Парсек», Россия).
практике
[24-27]. Измерения проводили с
Счетная плата, которая запускалась от допол-
использованием спектрометра, принципи-
нительного импульса генератора, синхронизи-
альная схема которого описана в работе Крас-
рованного с импульсом светодиода, делила вре-
новского и соавт. [17]. Спектрометр позволял
менной интервал между вспышками на 256, 512
регистрировать фосфоресценцию при стацио-
или 1024 канала. Сигнал платы через USB-порт
нарном светодиодном возбуждении, а также
поступал на персональный компьютер, кото-
проводить измерение ее спектральных пара-
рый осуществлял обработку сигнала. Кинетиче-
метров (спектров излучения и возбуждения)
ские кривые были получены путем накопления
и кинетики затухания после возбуждающей
импульсов фотоумножителя в каждом канале
вспышки. Для измерения спектров возбуж-
в интервале 2-30 мин. Квантовый выход гене-
дения лаборатория располагала набором из
рации 1O2 (ΦΔ) измеряли, используя в качестве
пяти светодиодов с максимумами излучения
эталона органический фотосенсибилизатор фе-
при 347, 367, 400, 421 и 460 нм, полученными
наленон (perinaphthenone, 1H_phenalen-1-one)
от фирм «Полироник» и «Артледс» (Россия).
(«Merk», США), который имеет широкую по-
При измерении параметров фосфоресценции
лосу поглощения с максимумом при 350 нм и
мощность излучения светодиодов на поверхно-
заметное поглощение при 400 нм. Известно,
9
БИОХИМИЯ том 87 вып. 10 2022
1474
АШИХМИН и др.
что квантовый выход фотогенерации 1O2 фена-
поглощения фитофлуина (368 нм). Представ-
леноном близок к 1 (0,95 ± 0,05) [27, 28]. Экс-
ляло интерес выяснить, насколько совпада-
перименты проводили, используя в качестве
ют результаты стационарных и кинетических
растворителя гексафторбензол (C6F6), специ-
измерений.
ально очищенный для наших экспериментов
Для экспериментов подбирали такую мощ-
(«Пим-Инвест», Россия). Выбор этого раство-
ность светового потока (≤ 1,5 мВт), при кото-
рителя обусловлен тем, что из-за отсутствия
рой выцветание фитофлуина за время записи
атомов водорода в его молекуле время жизни
экспериментальных кривых не превышало 4%.
синглетного кислорода в гексафторбензоле
При этой мощности фотовозбуждения фос-
очень велико (16 мс) [13], что облегчает обна-
форесценция 1О2, фотосенсибилизированная
ружение и исследование свойств 1О2. Кроме
аэрированным растворителем без фитофлуи-
того, гексафторбензол химически достаточно
на, на нашем спектрометре не обнаруживалась.
инертен и не вступает в химическое взаимодей-
При облучении раствора фитофлуина и фена-
ствие с каротиноидами и синглетным кислоро-
ленона светодиодными импульсами возникала
дом [17, 18].
быстро затухающая фосфоресценция 1О2 в об-
ласти 1270 нм, кривые затухания которой хоро-
шо описываются экспонентами (рис. 2):
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Ip = (Ip)0 exp(-kobst),
(1)
Фитофлуин. В предшествующей работе
для кинетических измерений мы располага-
где Ip - интенсивность фосфоресценции в фо-
ли импульсным светодиодом с длиной волны
тонах в единицу времени, (Ip)0 - начальная
405 нм [18], т.е. в области, в которой фитофлу-
интенсивность фосфоресценции, соответству-
ин очень слабо поглощает свет, поэтому ранее
ющая нулевому времени; kobs - константа ско-
основные измерения были выполнены при ста-
рости затухания фосфоресценции; t - время.
ционарном возбуждении. В настоящей рабо-
По оси ординат на рис. 2 отложено отноше-
те использован новый импульсный светодиод
ние числа импульсов фотоумножителя, накоп-
365 нм, максимум спектра излучения которого
ленных за время измерения в каждом канале
практически совпадает с максимумом спектра
счетчика фотонов (Ip), нормированное на ско-
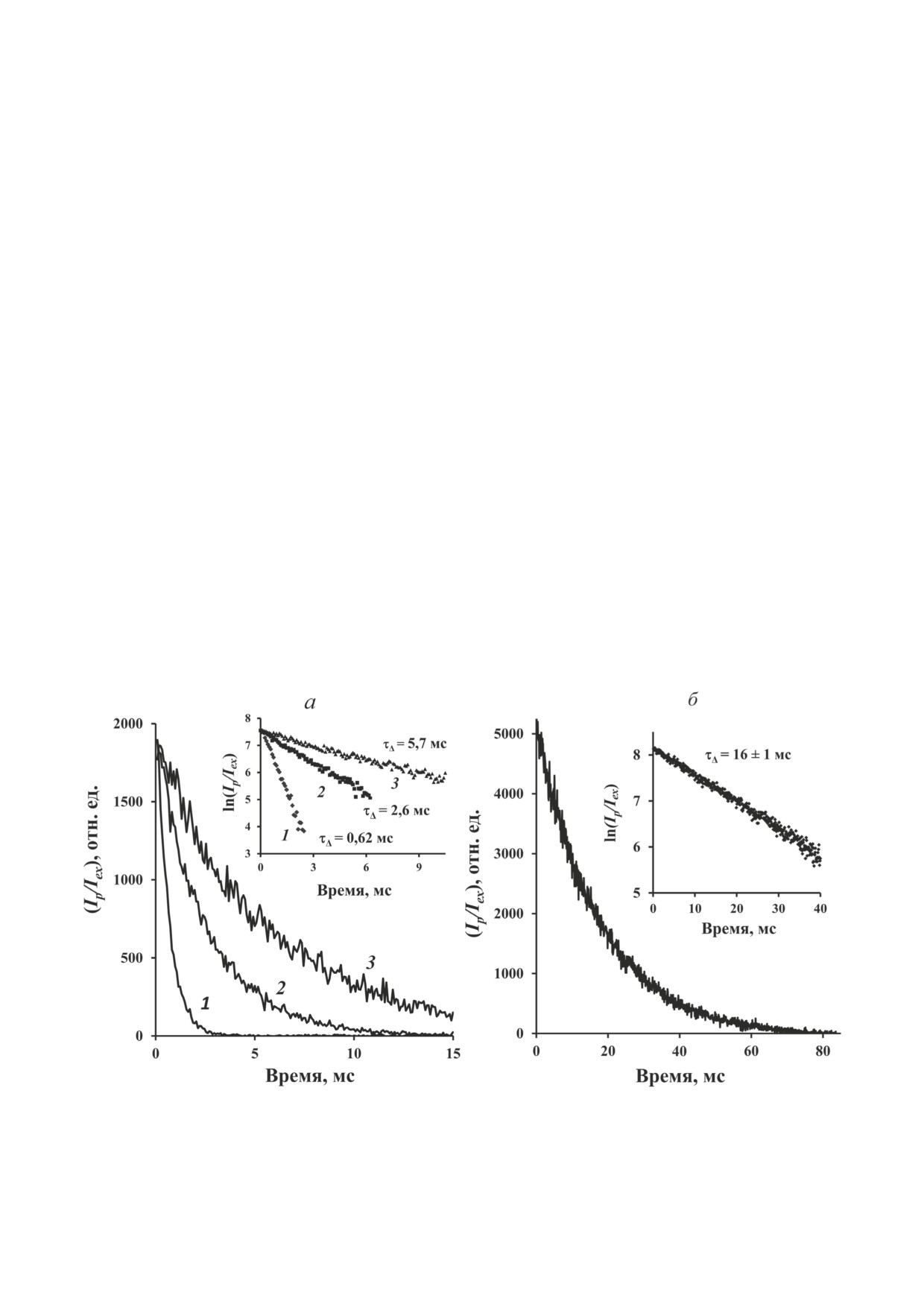
Рис. 2. Кривые затухания фосфоресценции синглетного кислорода в аэрированных растворах фитофлуина (а) и фенале-
нона (б) в гексафторбензоле после облучения 10-микросекундными вспышками светодиода 365 нм с частотой повторе-
ния 20 Гц (а) и 10 Гц (б); (Iр/Iex) - отношение интенсивности фосфоресценции (Iр) к скорости поглощения фотонов (Iex)
пигментами. На вставках показаны те же кривые затухания в полулогарифмическом масштабе. Средняя мощность све-
тового потока светодиода составляла примерно 1,5 мВт. Время накопления сигнала 2 мин, ширина канала - 81,92 мкс.
Концентрация растворов фитофлуина - 34 (1), 7,4 (2) и 2,5 (3) мкМ; концентрация феналенона - 17 мкМ
БИОХИМИЯ том 87 вып. 10 2022
ζ-КАРОТИН И СИНГЛЕТНЫЙ КИСЛОРОД
1475
рость поглощения фотонов (Iex) фотосенсиби-
зованной концентрации слабо тушит син-
лизаторами:
глетный кислород, поэтому время затухания
фосфоресценции практически соответствует
Iex = ILED(1-T) = ILED(1-10-A),
(2)
времени жизни 1О2 в аэрированном гексафтор-
бензоле (~16 мс) [17].
где ILED - скорость генерации фотонов све-
На рис. 3, а представлен спектр фосфорес-
тодиодом, T
- коэффициент пропускания
ценции в аэрированном растворе фитофлуина
света раствором; A - оптическая плотность
при стационарном возбуждении светодиодом
фотосенсибилизаторов в области излучения
367 нм. Спектр имеет максимум при ~1270 нм,
светодиода (365 нм). Очевидно, что отноше-
соответствующий максимуму спектра фосфо-
ние (Ip)0/Iex прямо пропорционально кванто-
ресценции 1О2. Точно такой же спектр получа-
вому выходу генерации синглетного кислорода
ется при измерении начальной интенсивности
при фотовозбуждении фотосенсибилизатора.
фосфоресценции при импульсном возбужде-
Из рис. 2 видно, что величина (Ip)0/Iex остава-
нии (не показано). На рис. 3, б показан результат
лась неизменной при более чем десятикрат-
оценки спектра возбуждения фосфоресценции
ном уменьшении концентрации фитофлуина,
в растворе фитофлуина с помощью набора ста-
тогда как время жизни фосфоресценции (τΔ)
ционарных светодиодов с разной длиной вол-
резко уменьшалось, а обратная величина -
ны излучения. Спектры поглощения и возбуж-
константа скорости затухания (kobs) - резко
дения нормированы в точке 367 нм. Как видно
увеличивалась с увеличением концентрации
из рис. 3, квантовая эффективность возбуж-
фитофлуина (рис. 2, а). Эти данные показыва-
дения фосфоресценции (Ip/ILED) максимальна
ют, что квантовый выход генерации 1О2 фито-
для светодиодов, длина волны излучения кото-
флуином не зависит от его концентрации, тог-
рых соответствует основным максимумам по-
да как увеличение концентрации фитофлуина
глощения фитофлуина. В области 400 нм, где
приводит к тушению синглетного кислорода
фитофлуин не поглощает свет, квантовая эф-
каротиноидом.
фективность фосфоресценции близка к нулю.
На рис. 2, б показана кинетика затухания
Полученные данные не оставляют сомнения в
фосфоресценции синглетного кислорода в
том, что фосфоресценция принадлежит 1О2, ко-
аэрированном растворе феналенона при от-
торый генерируется в результате фотовозбуж-
сутствии каротиноидов. Феналенон в исполь-
дения фитофлуина.
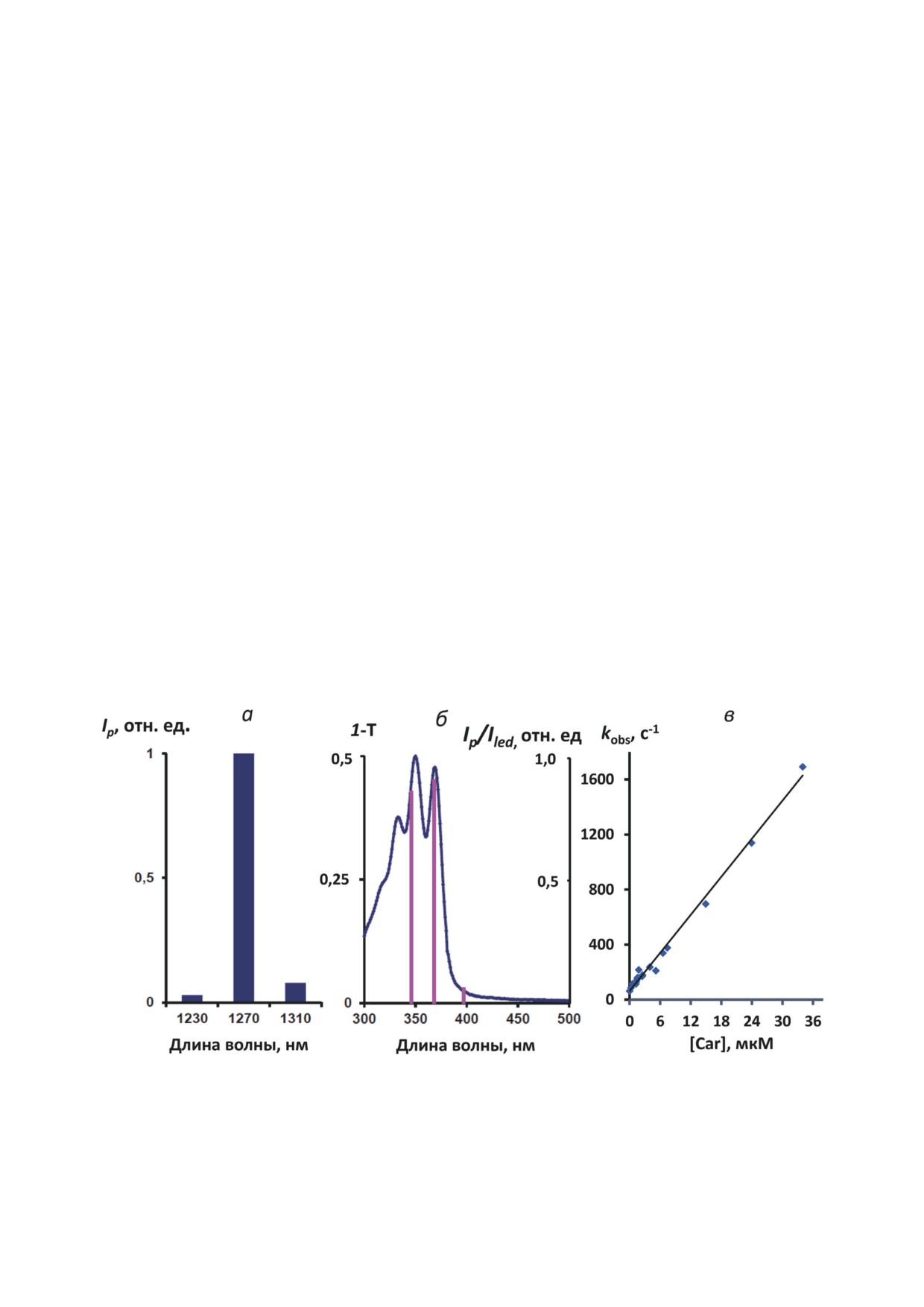
Рис. 3. Спектральные и кинетические параметры фосфоресценции синглетного кислорода в аэрированных растворах
фитофлуина в гексафторбензоле. а - Спектр фосфоресценции, измеренный при стационарном возбуждении (367 нм)
раствора фитофлуина (7,4 мкМ) с помощью набора из трех интерференционных светофильтров (Ip - интенсивность
фосфоресценции при стационарном возбуждении). б - Спектр поглощения раствора фитофлуина 4 мкМ (T - коэффи-
циент пропускания света раствором), и спектр возбуждения фосфоресценции того же раствора (вертикальные линии),
измеренный с помощью трех стационарных светодиодов с длиной волны 347, 367 и 400 нм, ILED - скорость излучения
фотонов (фотоны в секунду) светодиодом; в - зависимость константы скорости затухания фосфоресценции 1О2 (kobs)
после возбуждающей вспышки от концентрации фитофлуина в аэрированном гексафторбензоле
БИОХИМИЯ том 87 вып. 10 2022
9*
1476
АШИХМИН и др.
Из рис. 3, в видно, что зависимость кон-
(ФΔ)phyt/(ФΔ)phen = [(Ip)0/Iex]phyt/[(Ip)0/Iex]phen. (4)
станты скорости затухания фосфоресценции
(kobs) от концентрации фитофлуина определя-
Значения (Ip)0 рассчитывали путем экстра-
ется уравнением Штерна-Фольмера:
поляции экспоненциальных кривых затухания
фосфоресценции к нулевому моменту време-
kobs = (kobs)o + kq × [Car],
(3)
ни. Как указывалось, в растворах фитофлуина
значения (Ip)0/Iex не зависели от концентрации
где (kobs)o - константа скорости затухания фос-
каротиноида, т.е. квантовые выходы генерации
форесценции в аэрированном гексафторбен-
синглетного кислорода одинаковы при всех
золе (~ 60 с-1 [17]). Следует отметить, что для
использованных концентрациях фитофлуи-
этих измерений мы использовали четыре не-
на. Для количественных измерений, учитывая
зависимо выделенных препарата фитофлуина.
широкую полосу излучения светодиода (18 нм),
Рис. 3, в показывает линейную функцию, по-
величину Iex для каротиноида и стандарта опре-
лученную путем усреднения всех полученных
деляли как:
данных, хотя при работе с каждым отдельным
препаратом мы наблюдали несколько иной угол
Iex = ILED [∫(ILED)0(1-10-A)dv]/∫(ILED)0dv,
(5)
наклона прямой. В итоге, по этим данным, наи-
более вероятная величина константы скорости
где ILED - суммарная интенсивность излучения
тушения составляет (3,6 ± 0,9) × 107 М-1⋅с-1,
фотодиода в фотонах в секунду, (ILED)0 - контур
т.е. в пределах погрешности измерений соот-
спектральной полосы излучения светодиода,
ветствует тому значению, которое было полу-
величина (ILED)0 изменяется от 0 до 1, ν - часто-
чено нами ранее путем тушения фитофлуином
та, соответствующая длине волны излучения
фосфоресценции 1О2, фотосенсибилизирован-
светодиода.
ной феналеноном [18].
По данным кинетических измерений мы
Данные рис. 2 были использованы для рас-
получили, что:
чета квантового выхода генерации синглетного
кислорода (ФΔ) фитофлуином. Относительные
(ФΔ)phyt/(ФΔ)phen = [(Ip)0/Iex]phyt/[(Ip)0/Iex]phen =
значения ФΔ в растворах фитофлуина и фенале-
= 0,41 ± 0,06.
(6)
нона, (ФΔ)phyt/(ФΔ)phen, очевидно, соответствуют
относительным значениям параметра (Ip)0/Iex в
Отсюда следует, что квантовый выход
растворах этих фотосенсибилизаторов:
генерации
1О2 фитофлуином соответствует
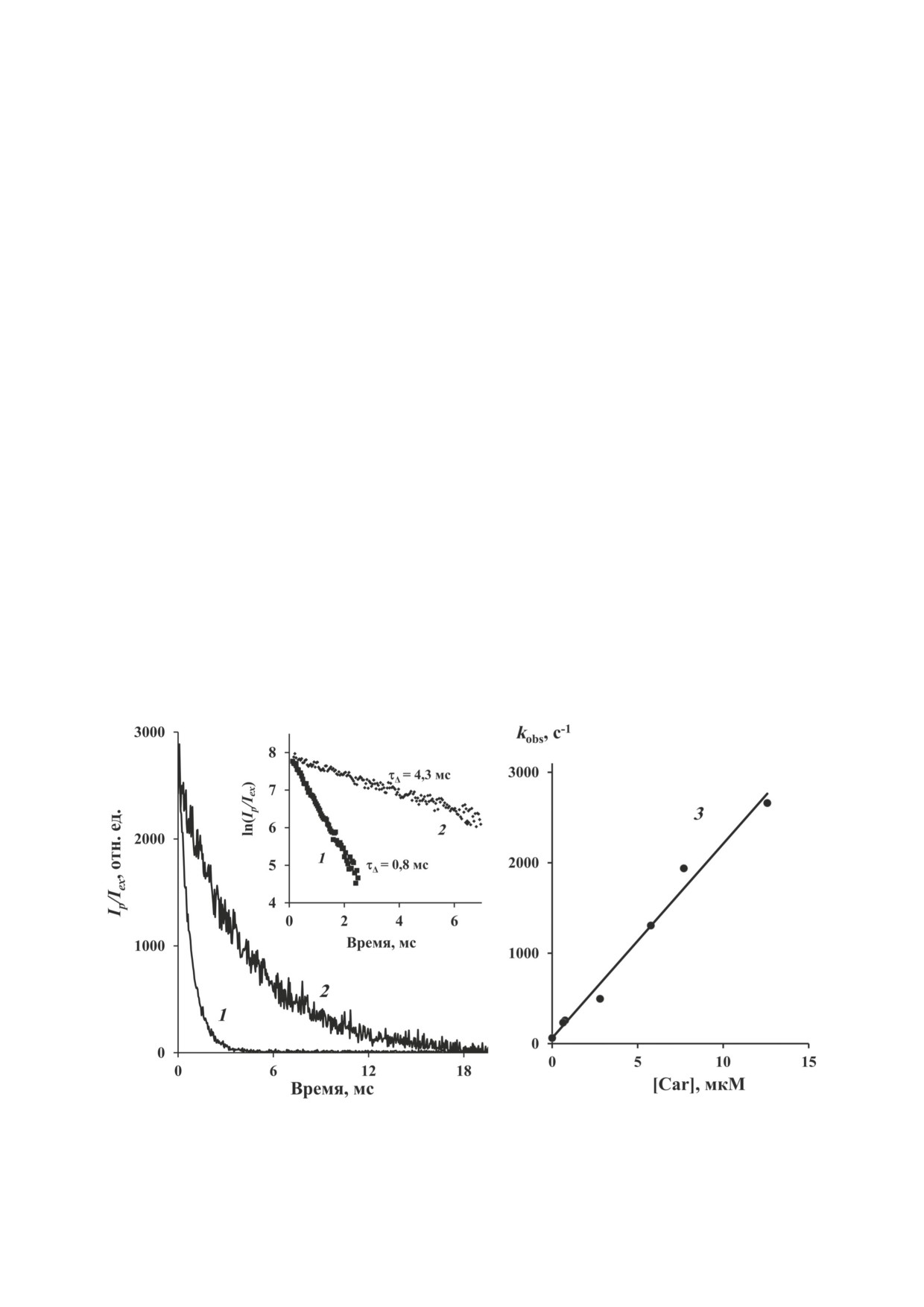
Рис. 4. Кривые затухания (1 и 2) и тушение фосфоресценции синглетного кислорода (1270 нм) в растворах ζ-каротина
(1 - 5,9 мкM; 2 - 0,64 мкM) в гексафторбензоле после облучения 10-микросекундными вспышками светодиода (395 нм)
с частотой повторения 50 Гц. На вставке показаны кривые затухания в полулогарифмическом масштабе. Средняя мощ-
ность возбуждающего излучения светодиода - 5 мВт. Время накопления сигнала - 5 мин. 3 - Зависимость констант
скоростей затухания фосфоресценции от концентрации ζ-каротина
БИОХИМИЯ том 87 вып. 10 2022
ζ-КАРОТИН И СИНГЛЕТНЫЙ КИСЛОРОД
1477
0,41 * 0,95 = 0,39 ± 0,06. Этот результат под-
ζ-каротина показана на рис. 4 (кривые 1 и 2).
тверждает описанный нами ранее факт, что фи-
Для наблюдения этих кинетических кривых
тофлуин эффективно генерирует синглетный
потребовалось более длительное время на-
кислород при фотовозбуждении [18]. Однако
копления сигнала и более высокая средняя
полученное в настоящей работе значение кван-
мощность светового облучения, чем при ис-
тового выхода примерно вдвое меньше, чем
следовании фитофлуина. Это показывает, что
опубликованное нами ранее [18]. Мы полагаем,
квантовый выход фосфоресценции в растворах
что ранее точность измерений была ниже из-за
ζ-каротина существенно ниже. Тем не менее
того, что измерения выполняли, используя ста-
начальная интенсивность этой фосфоресцен-
ционарную интенсивность фосфоресценции
ции (Ip)0 в исследованных растворах ζ-кароти-
Ip, которая определяется не только квантовым
на превышала интенсивность фосфоресцен-
выходом генерации синглетного кислорода фо-
ции 1О2 в чистом растворителе при отсутствии
тосенсибилизаторами, но также и временем
ζ-каротина более чем на два порядка величины
жизни фосфоресценции, которое при стацио-
(не показано).
нарных измерениях не контролируется.
Как видно из рис. 4 (кривые 1 и 2), ско-
ζ-каротин. Приемы, разработанные в экс-
рость затухания фосфоресценции возрастает
периментах с растворами фитофлуина, были
с увеличением концентрации каротина. Отсю-
затем применены к растворам ζ-каротина.
да следует, что ζ-каротин эффективно тушит
Для фотовозбуждения ζ-каротина использо-
синглетный кислород. Тушение подчиняется
вали новый импульсный светодиод с длиной
уравнению Штерна-Фольмера (рис. 4, кри-
волны 395 нм. Для измерений подбирали та-
вая 3). Константа скорости тушения, рассчи-
кую мощность светового потока (≤ 5 мВт),
танная по этим данным для четырех неза-
при которой выцветание ζ-каротина за вре-
висимых выделений ζ-каротина, составила
мя регистрации экспериментальных кривых
(2,1 ± 0,2) × 108 М-1⋅с-1. Таким образом, ζ-ка-
не превышало 2%. При облучении импуль-
ротин тушит 1О2 на порядок сильнее, чем фи-
сами этого светодиода мы наблюдали фото-
тофлуин. Однако в обоих случаях константы
сенсибилизированную фосфоресценцию
1О2
скорости тушения в 100-1000 раз меньше кон-
при 1270 нм, кинетика затухания которой при
стант скорости тушения 1О2, например β-каро-
двух сильно различающихся концентрациях
тином ~1010 М-1⋅с-1 [15].
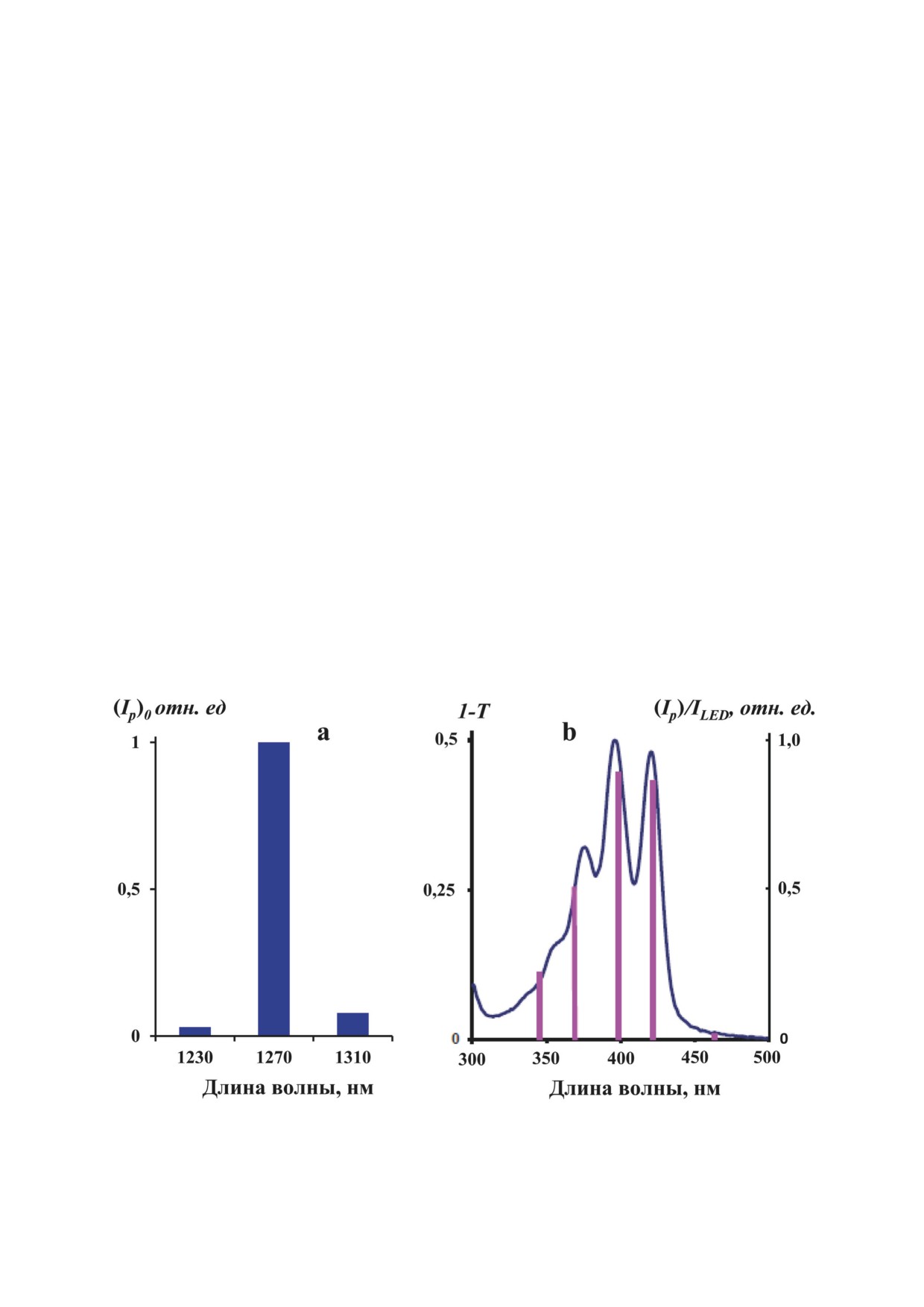
Рис. 5. Спектр фосфоресценции синглетного кислорода в растворе ζ-каротина (5,9 мкМ) в гексафторбензоле (а) при
импульсном возбуждении светодиодом (395 нм), измеренный с помощью интерференционных светофильтров. Спектр
поглощения ζ-каротина (сплошная линия), измеренный в единицах 1-Т (б), где Т - светопропускание раствора; верти-
кальные линии - спектр возбуждения фосфоресценции в единицах Ip/ILED, измеренный при стационарном возбуждении
набором из нескольких светодиодов с длиной волны излучения 347, 367, 400, 421 и 460 нм
БИОХИМИЯ том 87 вып. 10 2022
1478
АШИХМИН и др.
Из рис. 5, а следует, что спектр фосфорес-
Тем не менее константы скорости тушения 1О2
ценции в аэрированном растворе ζ-каротина
каротиноидами в 100-1000 раз меньше, чем
имеет максимум при ~1270 нм, т.е. соответству-
константа скорости ограниченных только диф-
ет максимуму фосфоресценции 1О2. Рис. 5, б
фузией бимолекулярных реакций (~1010 М-1 с-1).
показывает, что спектр возбуждения этой фос-
Полученная нами константа скорости тушения
форесценции (зависимость квантовой эффек-
синглетного кислорода фитофлуином в преде-
тивности фосфоресценции от длины волны
лах экспериментальных погрешностей соответ-
возбуждения) соответствует спектру поглоще-
ствует значению, которое было получено в на-
ния ζ-каротина. Таким образом, данные убеди-
шей предшествующей работе [18] и согласуется
тельно показывают, что ζ-каротин генерирует
с величиной верхнего предела этой константы,
синглетный кислород при фотовозбуждении в
приведенной в работе Mathews-Roth et al. [2].
аэрированном растворе.
Для ζ-каротина эта константа, по-видимому,
Квантовый выход генерации синглетного
измерена в настоящей работе впервые. Из зна-
кислорода (ФΔ) ζ-каротином измеряли методом
чений констант следует, что изученные каро-
сравнения относительных значений (Ip)0/Iex в
тиноиды не могут служить эффективными ин-
растворах ζ-каротина и феналенона по методи-
гибиторами синглетного кислорода в живых
ке, аналогичной описанной выше для фитофлу-
системах. Это заключение находится в согласии
ина. Установлено, что в растворах ζ-каротина
с низкой фотоустойчивостью ζ-каротиновых
значения (Ip)0/Iex не зависели от концентрации
мутантов кукурузы [19]. В связи с этим наиболее
каротиноида, т.е. квантовые выходы генерации
вероятно, что ζ-каротин и фитофлуин можно
синглетного кислорода одинаковы при всех ис-
рассматривать как потенциальные фотосенси-
пользованных концентрациях ζ-каротина. По
билизаторы фотодинамического стресса в жи-
данным кинетических измерений мы получи-
вых клетках, а не как протекторы их структур.
ли, что:
Предположительный механизм генерации
синглетного кислорода каротиноидами пока-
(ФΔ)car/(ФΔ)phen = [(Ip)0/Iex]car/[(Ip)0/Iex]phen =
зан на рис. 6. Известно, что главные полосы
= 0,015 ± 0,003.
(7)
поглощения каротиноидов соответствуют пе-
реходу из основного на второй короткоживу-
Отсюда следует, что квантовый выход
щий синглетный уровень их молекул, а переход
генерации
1О2 ζ-каротином соответствует
из основного на первый синглетный уровень
0,015 * 0,95 = 0,014 ± 0,003. Эта величина при-
запрещен и имеет малую интенсивность [29].
мерно в 30 раз меньше, чем у фитофлуина.
Из полученных нами спектров действия фосфо-
ресценции синглетного кислорода следует, что
фотовозбуждение каротиноидов определяется
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
заселением именно S2-состояния. Дальнейшие
этапы предположительны. В результате спон-
Таким образом, с помощью новых импуль-
танной релаксации молекул происходит засе-
сных светодиодов и разрешенных во времени
ление состояния S1, а затем интерконверсия в
измерений фосфоресценции
1О2, показано,
Т1-состояние. Перенос энергии с Т1 на молеку-
что фитофлуин и ζ-каротин, которые явля-
лярный кислород приводит к образованию 1О2
ются универсальными предшественниками в
и излучению фосфоресценции. Не исключено,
биосинтезе окрашенных С40-каротиноидов у
что тушение 1О2 изученными каротиноидами
растений и бактерий, фотосенсибилизируют
являются результатом обратного термоакти-
образование 1О2 при фотовозбуждении, а не-
вированного переноса энергии от синглетного
возбужденные молекулы этих каротиноидов
кислорода на триплетный уровень каротинои-
тушат 1О2. Результаты измерения квантовых
да. Однако это требует отдельного обоснования
выходов генерации и константы скорости ту-
и выходит за рамки предмета настоящей статьи.
шения синглетного кислорода каротиноидами
суммированы в таблице. Для ζ-каротина эти
Квантовые выходы генерации 1O2 и константы скорости
данные получены впервые.
тушения 1O2 каротиноидами в аэрированном гексафтор-
бензоле
Из таблицы видно, что каротиноиды силь-
но различаются по своей способности фо-
Каротиноид
СДС
ΦΔ
kq, М-1 с-1
тосенсибилизировать и тушить
1O2. Фито-
флуин - эффективный фотосенсибилизатор
Фитофлуин
5
0,39 ± 0,06
(3,6 ± 0,9) × 107
генерации 1О2. ζ-Каротин примерно в 30 раз
менее эффективен как фотосенсибилизатор,
ζ-каротин
7
0,014 ± 0,003
(2,1 ± 0,2) × 108
но на порядок более эффективен как тушитель.
БИОХИМИЯ том 87 вып. 10 2022
ζ-КАРОТИН И СИНГЛЕТНЫЙ КИСЛОРОД
1479
Рис. 6. Предположительная энергетическая диаграмма переходов в молекулах каротиноидов, приводящая к фотосенси-
билизации образования 1О2
Предложенная схема согласуется с литера-
В литературе, к сожалению, не описаны
турными данными [4, 6], свидетельствующи-
точные данные о квантовом выходе образова-
ми о том, что энергия триплетных состояний
ния триплетных состояний у изученных в на-
исследованных каротиноидов (ET) выше энер-
стоящей работе каротиноидов. Нам удалось
гии 1Δg - состояния кислорода (0,96 эв). Со-
найти только одну работу [4], в которой была
гласно Bensasson et al. [4], значения ET равны
сделана попытка количественно измерить этот
1,45 и 1,12 эв соответственно для фитофлуина и
параметр методом наносекундного импульсно-
ζ-каротина. Однако эти данные нельзя считать
го фотолиза. Полученный для ζ-каротина кван-
полностью достоверными, так как они рассчи-
товый выход практически равен нулю (меньше
таны путем экстраполяции эмпирической ли-
минимального, доступного для измерений ав-
нейной зависимости между ET-1 и числом СДС,
торами [4]). Отсюда следует, что, по нашим дан-
полученной для синтетических полиенов с ко-
ным, квантовые выходы заселения триплетного
роткой СДС [4]. Прямые измерения фосфорес-
состояния изученными каротиноидами суще-
ценции этих каротиноидов, которые позволили
ственно выше, чем следует из сделанных ранее
бы установить точную энергию их триплетных
методом флеш-фотолиза измерений [4].
состояний, пока не выполнены.
Представляет интерес, что полученные нами
Известно, что время жизни триплетного
квантовые выходы образования триплетного
состояния ζ-каротина составляет 23 мкс [4].
состояния каротиноидов и синглетного кисло-
Эта величина, полученная методом импульсно-
рода коррелируют с информацией о квантовом
го радиолиза, коррелирует с механизмом, при-
выходе флуоресценции каротиноидов. Извест-
веденным на рис. 6. Нам не удалось найти в ли-
но, что фитофлуин излучает относительно силь-
тературе константу скорости взаимодействия
ную флуоресценцию из состояния S1 (500 нм) с
триплетного состояния ζ-каротина с кислоро-
квантовым выходом 0,05 ± 0,01 при комнатной
дом. Однако она измерена в растворах синте-
температуре [32, 33]. Литературных данных о
тических аналогов - полиенов. Получено, что
квантовом выходе флуоресценции ζ-каротина
для всех каротиноидов эта конcтанта равна
нам найти не удалось. Однако известен кван-
(2-4) × 109 М-1 с-1 [30]. Кинетический анализ
товый выход флуоресценции из состояния S1
показывает, что при такой константе и обыч-
у аналога - синтетического полиена с 7 СДС [34].
ной для аэрированных растворов концентра-
Он примерно на порядок ниже, чем у синтети-
ции кислорода (2-4 мМ) [31] все триплетные
ческого аналога с 5 СДС. Следовательно, можно
молекулы пигментов дезактивируются путем
предположить, что выход синглетного кислоро-
переноса энергии на растворенный кисло-
да, долгоживущего триплетного состояния (T1)
род [23]. Таким образом, измеренные нами
и длинноволновой S1-флуоресценции кароти-
значения ΦΔ примерно равны значениям кван-
ноидов, определяется вероятностью внутримо-
тового выхода триплетных состояний молекул
лекулярного заселения S1-состояния при спон-
каротиноидов.
танной дезактивации состояния S2.
БИОХИМИЯ том 87 вып. 10 2022
1480
АШИХМИН и др.
Вклад авторов. А.А. Красновский мл.,
фонда фундаментальных исследований (грант
А.А. Ашихмин, А.А. Москаленко - концепция
№ 19-04-00331-а) и государственных заданий
и руководство работой; А.А. Ашихмин - вы-
ФИЦ Биотехнологии РАН
(12241100080-3)
деление каротиноидов; А.А. Красновский
и ФИЦ ПНЦБИ РАН (122041100204-3).
и А.С. Бендиткис - конструирование приборов
Благодарности. Авторы благодарят OOO
и проведение экспериментов; А.А. Ашихмин,
«Полироник» (Москва) за техническую помощь
А.С. Бендиткис, А.А. Москаленко, А.А. Крас-
и OOO «ПиМ-Инвест» (Москва) за предоставле-
новский мл. - обсуждение результатов иссле-
ние и очистку растворителей, а также Журавле-
дования; А.А. Красновский мл., А.А. Аших-
ву З.А. (ИФПБ РАН) за помощь в выращивании
мин и А.С. Бендиткис - написание текста и его
культуры Ectothiorhodospira haloalkaliphila.
редактирование.
Конфликт интересов. Авторы заявляют об
Финансирование. Работа выполнена при
отсутствии конфликта интересов.
частичной поддержке гранта Президента Рос-
Соблюдение этических норм. Настоящая
сийской Федерации для государственной под-
статья не содержит описания каких-либо ис-
держки молодых российских ученых - канди-
следований с участием людей или животных
датов наук (МК-1352.2021.1.4), Российского
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Britton, G. (2008) Functions of Intact Carotenoids,
9.
Krasnovsky, A. A., Jr., and Kagan, V. E.
(1979)
in Carotenoids. Natural Functions (Britton, G.,
Photosensitization and quenching of singlet oxygen
Liaaen-Jensen, S., and Pfanger, H., eds) Birkhauser
by pigments and lipids of photoreceptor cells of the
Verlag, Switzerland, Vol. 4, pp. 189-212, doi: 10.1007/
retina, FEBS Lett., 108, 152-154, doi: 10.1016/0014-
978-3-7643-7499-0_10.
5793(79)81198-9.
2.
Mathews-Roth, M., Wilson, T., Fujimori, E., and
10.
Островский М. А., Федорович И. Б.
(1994)
Krinsky, N. (1974) Carotenoid chromophore length
Ретиналь как сенсибилизатор фотоповреждения
and protection against photosensitization, Photochem.
ретинальсодержащих белков сетчатки глаза,
Photobiol., 19, 217-222, doi: 10.1111/j.1751-1097.1974.
Биофизика, 39, 13-25.
tb06501.x.
11.
Красновский A. A. (мл)
(1986) Синглетный
3.
Krinsky, N. (1974) Сarotenoid protection against oxi-
кислород в фотосинтезирующих организмах,
dation, Pure Appl. Chem., 51, 649-660, doi: 10.1351/
Журнал Всесоюзного химического общества им.
pac197951030649.
Д.И. Менделеева (Российский химический журнал),
4.
Bensasson, R., Land, E. J., Maudinas, B.
(1976)
издательство Химия, Москва, 31, 562-567.
Triplet states of carotenoids from photosynthetic
12.
Махнева З. К., Ерохин Ю. Е., Москаленко А. А.
bacteria studied by nanosecond ultraviolet pulse
(2007)
Фотосенсибилизированное каротино-
irradiation, Photochem. Photobiol.,
23,
189-193,
идами окисление димеров бактериохлорофилла
doi: 10.1111/j.1751-1097.1976.tb07240.x.
светособирающих комплексов B800-850 в клетках
5.
Cogdell, R. J., Howard, T. D., Bittl, R., Schlodder,
Allochromatium minutissimum, Доклады Академии
E., Geisenheimer, I., et al. (2000) How carotenoids
наук, 416, 408-411.
protect bacterial photosynthesis, Philos. Trans. R.
13.
Махнева З. К., Большаков М. А., Ашихмин А. А.,
Soc. B Biol. Sci., 355, 1345-1349, doi: 10.1098/
Ерохин Ю. Е., Москаленко А. А. (2009) Влияние
rstb.2000.0696.
синего света на стабильность структуры антенных
6.
Niedzwiedzki, D. M., Swainsbury, D. J. K.,
комплексов из Allochromatium minutissimum с раз-
Canniffed, D. P., Hunter, C. N., and Hitchcock, А.
ным содержанием каротиноидов, Биологические
(2020) A photosynthetic antenna complex foregoes
мембраны, 26, 188-193.
unity
carotenoid-to-bacteriochlorophyll
energy
14.
Махнева З. К., Ашихмин А. А., Большаков М. А.,
transfer efficiency to ensure photoprotection, Proc.
Москаленко А. А.
(2020) Выделение синглет-
Nat. Acad. Sci.,
117,
6502-6508, doi:
10.1073/
ного кислорода мембранами пурпурных фото-
pnas.1920923117.
синтезирующих бактерий при облучении све-
7.
Edge, R., and Truscott, T. G.
(2018) Singlet
том происходит при возможном участии
oxygen and free radical reactions of retinoids and
каротиноидов, Микробиология,
89,
169-179,
carotenoids
- a review, Antioxidants,
7,
5-16,
doi: 10.31857/S0026365620010097.
doi: 10.3390/antiox7010005.
15.
Махнева З. К., Ашихмин А. А., Большаков М. А.,
8.
Красновский A. A. (мл), Каган В. Е.
(1978)
Москаленко А. А.
(2019) Взаимодействие бак-
Генерация и тушение синглетного кислорода
териохлорофилла с синглетным кислородом в мем-
ретиналями, Доклады АН СССР, 242, 229-232.
бранах пурпурных фотосинтезирующих бактерий:
БИОХИМИЯ том 87 вып. 10 2022
ζ-КАРОТИН И СИНГЛЕТНЫЙ КИСЛОРОД
1481
существует ли защитная функция каротиноидов?
24.
Krasnovsky A. A., Jr. (1998) Phosphorescence studies
Доклады Академии наук,
486,
504-508,
of singlet oxygen in photobiochemical systems,
doi: 10.31857/S0869-56524864504-508.
Membr. Cell Biol., 12, 665-690.
16.
Makhneva, Z. K., Bolshakov, M. A., and
25.
Krasnovsky A. A. Jr.
(2008) Luminescence and
Moskalenko, A. A.
(2021) Carotenoids do not
photochemical studies of singlet oxygen photonics,
protect bacteriochlorophylls in isolated light-
J. Photochem. Photobiol. A Chem.,
196,
210-218,
harvesting LH2 complexes of photosynthetic
doi: 10.1016/j.jphotochem.2007.12.015.
bacteria from destructive interactions with singlet
26.
Schweitzer, C., and Schmidt, R. (2003) Physical mech-
oxygen, Molecules,
26,
5120, doi:
10.3390/
anisms of generation and deactivation of singlet oxygen,
molecules26175120.
Chem. Rev., 103, 1685-1757, doi: 10.1021/cr010371d.
17.
Красновский А. А., Бендиткис А. С., Козлов А. С.
27.
Oliveros, E., Suardi-Murasecco, P., Aminian-
(2019) Кинетические измерения фосфоресценции
Saghafi, T., and Braun, A. M. (1991) 1H-Phenalen-
синглетного кислорода методом разрешенного
1-one: photophysical properties and singlet oxygen
во времени счета фотонов в растворителях, не
production, Helv. Chim. Acta, 74, 79-90, doi: 10.1002/
содержащих водородных атомов, Биохимия, 84,
hlca.19910740110.
240-251, doi: 10.1134/S0320972519020076.
28.
Schmidt, R., Tanelian, C., Dunsbach, R., and Wolf, C.
18.
Ашихмин А. А., Бендиткис А. С., Москаленко А. А.,
(1994) Phenalenone, a universal compound for the
Красновский А. А. мл.
(2020) Фитофлуин
-
determination of quantum yields of singlet oxygen
эффективный фотосенсибилизатор образования
O2 (1Δg) sensitization, J. Photochem. Photobiol. A Chem.,
синглетного кислорода под действием УФ-А
79, 11-17, doi: 10.1016/1010-6030(93)03746-4.
излучения, Биохимия, 85, 907-915, doi: 10.31857/
29.
Frank, H. A., and Christensen, R. L. (2008) Excited
S0320972520070052.
electronic states, photochemistry and photophysics
19.
Красновский А. А. мл., Ковалев Ю. В., Фалуди-
of carotenoids, in Carotenoids, vol. 4, Chapt. 9,
Даниэль А. (1980) Фосфоресценция и замедлен-
Birkhaeuser Verlag, Basel, pp. 167-188.
ная флуоресценция хлорофилла в мутантах
30.
Mathis, P., and Schenck, C. C. (1982) Functions
кукурузы с аномальным составом каротиноидов,
of carotenoids in photosynthesis, in Carotenoids
Доклады Академии наук СССР, 251, 1264-1267.
chemistry and Biochemistry (Britton, G., and
20.
Imhoff, J. F., and Trüper, H. G.
(1977) Ecto-
Goodwin, T. W., eds) Pergamon Press, Oxford, New
thiorhodospira halochloris sp. now., a new extremely
York, p. 339-351.
halophilic
phototrophic bacterium containing
31.
Murov, S. L., Charmichael, I., and Hug, G. L. (1993)
bacteriochlorophyll b, Arch. Microbiol., 114, 115-121,
Handbook of Photochemistry, Marcel Dekker Inc.,
doi: 10.1007/BF0041077220.
New York, Basel, Hong Kong, p. 290.
21.
Ashikhmin, A., Makhneva, Z., and Moskalenko, A.
32.
Cogdell, R. J., Gillbro, T., Andersson, P. O., Liu, R. S. H.,
(2014) The LH2 complexes are assembled in the
and Asato, A. E. (1994) Carotenoids as accessory light-
cells of purple sulfur bacterium Ectothiorhodospira
harvesting pigments, Pure Appl. Chem., 66, 1041-1046.
haloalkaliphila with inhibition of carotenoid bio-
33.
Andersson, P. O., Takaichi, S., Cogdell, R. J., and
synthesis,
Photosynth.
Res.,
119,
291-303,
Gillbro, T. (2001) Photophysical characterization of
doi: 10.1007/s11120-013-9947-6.
natural cis- carotenoids, Photochem. Photobiol., 74,
22.
Красновский A. A., мл.
(1976) Фотосенси-
549-557, doi:
10.1562/0031-8655(2001)074<0549:
билизированная люминесценция синглетного
pconcc>2.0.co;2.
кислорода в растворе, Биофизика, 21, 748-749.
34.
Andersson, P. O., Bachilo, S. M., Chen, R.-L., and
23.
Krasnovsky A. A., Jr.
(1979) Photoluminescence
Gillbro, T. (1995) Solvent and temperature effects on
of singlet oxygen in pigment solutions, Photochem.
dual fluorescence in a series of carotenes. Energy gap
Photobiol., 29, 29-36, doi: 10.1111/j.1751-1097.1979.
dependence of the internal conversion rate, J. Phys.
tb09255.x.
Chem., 99, 16199-16209, doi: 10.1021/j100044a002.
ζ-CAROTENE: GENERATION AND QUENCHING OF SINGLET OXYGEN,
COMPARISON WITH PHYTOFLUENE
A. A. Ashikhmin1, A. S. Benditkis2, A. A. Moskalenko1, and A. A. Krasnovsky, Jr.2*
1 Institute of Basic Biological Problems, Federal Research Center “Pushchino Scientific Center for Biological Research, Russian
Academy of Sciences”, 142290 Pushchino, Moscow Region, Russia
2 Bach Institute of Biochemistry, Federal Research Center of Biotechnology, Russian Academy of Sciences, 119071 Moscow,
Russia; E-mail: phoal@mail.ru
БИОХИМИЯ том 87 вып. 10 2022
1482
АШИХМИН и др.
It is known that phytofluene and ζ-carotene, C40 carotenoids with a short chain of conjugated double bonds
(CDB) (5 and 7, respectively), are universal precursors in the biosynthesis of colored carotenoids in plant
cells. Previously, using mainly stationary measurements of photosensitized phosphorescence of singlet oxygen
(1O2), we discovered that phytofluene efficiently generates 1О2 in aerated solution and therefore, can serve as
a source of the UV photodynamic stress in living cells [Ashikhmin et al. (2020) Biochemistry (Moscow), 85,
773-780]. In the present paper, by using novel pulsed light emitting diodes (LEDs), aerated hexafluorobenzene
as a solvent and time-resolved measurements of 1О2 phosphorescence we confirmed that phytofluene efficiently
photosensitizes 1O2 formation. The quantum yield of this process according to the novel experiments is
about 0.4. An ability to generate 1О2 was also found in aerated solutions of ζ-carotene although the quantum
yield of this process is 30-fold lower that in phytofluene solutions. Both carotenoids were found to quench 1O2
in the dark with the quenching rate constants equal to (3,6 ± 0,9) × 107 and (2,1 ± 0,2) × 108 M-1 s-1respectively.
To our knowledge, the rate constant of 1O2 quenching by ζ-carotene has been reported in the present paper for
the first time. It follows from the data obtained that the rate constants of 1O2 quenching by both carotenoids
are much (by 2-3 orders of magnitude) smaller than the rate constant of the diffusion-limited biomolecular
reactions. Hence, both carotenoids are weak protectors against 1O2 oxidative activity. It is more likely that they
are potential promoters of photodynamic stress in living cells.
Keywords: ζ-carotene, phytofluene, singlet oxygen, photosensitivity, photodynamic stress
БИОХИМИЯ том 87 вып. 10 2022