БИОХИМИЯ, 2022, том 87, вып. 11, с. 1683 - 1699
УДК 57.016
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ КАЛЬЦИЙ-
МАГНИЕВОЙ СИЛИКАТНОЙ КЕРАМИКИ ДИОПСИДА
В КАЧЕСТВЕ НОСИТЕЛЯ РЕКОМБИНАНТНОГО BMP-2
И ДЕМИНЕРАЛИЗОВАННОГО КОСТНОГО МАТРИКСА
В КАЧЕСТВЕ КАРКАСА: ДИНАМИКА РЕПАРАТИВНОГО
ОСТЕОГЕНЕЗА НА МОДЕЛИ КРАНИОТОМИИ У МЫШЕЙ
© 2022 А.С. Карягина1,2,3*, П.А. Орлова1, М.С. Попонова1, И.Н. Булыгина1,4,
Р. Чоудхари5,6, А.В. Жулина1, Т.М. Грунина1,3, К.Е. Никитин1, Н.В. Струкова1,
М.С. Генералова1, А.В. Рязанова1, П.А. Ковалёва4, А.И. Зимина4, Е.М. Лукинова4,
Е.Д. Плахотнюк4, М.А. Кирсанова7, Е.А. Колесников4, Е.В. Захарова4, В.Н. Манских2,
Ф.С. Сенатов1,4, А.В. Громов1*
1 Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России,
123098 Москва, Россия; электронная почта: akaryagina@gmail.com, alexander.v.gromov@gmail.com
2 НИИ физико-химической биологии им. А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова, 119992 Москва, Россия
3 Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии,
127550 Москва, Россия
4 Национальный исследовательский технологический университет «МИСиС», 119049 Москва, Россия
5 Рижский технический университет, LV-1007 Рига, Латвия
6 Балтийский центр передового опыта в области биоматериалов,
штаб-квартира в Рижском техническом университете, LV-1048 Рига, Латвия
7 Сколковский институт науки и технологий, 121205 Москва, Россия
Поступила в редакцию 05.07.2022
После доработки 30.08.2022
Принята к публикации 09.09.2022
Кальций-магниевая силикатная керамика диопсид является перспективным материалом для ис-
пользования в костной пластике, однако до сих пор возможность его применения в качестве носи-
теля рекомбинантного костного морфогенетического белка-2 (BMP-2) не была исследована, как и
особенности репаративного остеогенеза с использованием материалов на основе диопсида с BMP-2.
Порошок кальций-магниевой силикатной керамики был получен твердофазным методом с ис-
пользованием в качестве исходных компонентов биоотходов - рисовой шелухи и яичной скорлупы.
Основная фаза полученной керамики представляла собой диопсид. Частицы имели неправильную
форму со средним размером около 2,3 мкм и ~20% объёмной пористостью со средним размером пор
около 24 нм, что позволяет классифицировать материал как мезопористый. 1 мг частиц диопсида сор-
бирует более 150 мкг рекомбинантного BMP-2, что превышает сорбционную ёмкость гидроксилапа-
тита, кальций-фосфатной керамики, часто используемой в составе гибридных имплантатов, более
чем в 3 раза. Кинетика выхода BMP-2 in vitro характеризуется взрывным выходом в первые 2 суток и
постепенным выходом примерно по 0,4-0,5% от нанесённого белка в последующие 7 суток. Экспе-
рименты in vivo проводили на мышиной модели краниальных дефектов критического размера с им-
плантацией суспензии порошка диопсида с/без BMP-2 в гиалуроновой кислоте, введённой в диски
из деминерализованного костного матрикса (ДКМ), обладающего 73-90% объёмной пористостью с
размером макропор от 50 до 650 мкм. Гистологически исследована динамика процессов неоостеоге-
неза и ремоделирования костной ткани на сроках 12, 21, 48 и 63 дня. Частицы диопсида равномерно
распределяются в матрице и вызывают минимальную реакцию на введение инородного тела. При на-
личии BMP-2 к 63 суткам в порах имплантата образуются значительные фокусы новообразованной
костной ткани с очагами костного мозга и вовлечением в ремоделирование больших областей ДКМ
в центре имплантата и материнской кости по краям. Диопсид может рассматриваться как перспек-
тивный материал для введения в гибридные имплантаты в качестве эффективного носителя BMP-2.
КЛЮЧЕВЫЕ СЛОВА: диопсид, кальций-магниевая силикатная керамика, имплантат, BMP-2, деминера-
лизованный костный матрикс, краниальные дефекты, регенерация костной ткани.
DOI: 10.31857/S0320972522110136, EDN: LWWPOZ
* Адресат для корреспонденции.
1683
1684
КАРЯГИНА и др.
ВВЕДЕНИЕ
Graft Kit («Medtronic», США), продаваемого в
Европе под названием InductOS Kit («Wyeth»,
Дефекты костной ткани, зачастую очень
США), в котором в качестве носителя исполь-
обширные, могут образовываться как след-
зуется коллагеновая губка [10, 11]. Использова-
ствие травм или операций, связанных с уда-
ние значительных количеств рекомбинантного
лением злокачественных новообразований
BMP-2, в тысячи раз превышающих физиоло-
или участков кости, поражённых остеомие-
гические концентрации (в зависимости от раз-
литом [1]. Для восстановления функциональ-
мера дефекта имплантат содержит от 1 до 12 мг
ности костной ткани требуется заполнение
белка), в ряде случаев может приводить к тя-
дефектов остеопластическими материалами,
жёлым последствиям для пациентов, выражаю-
выполняющими, с одной стороны, каркасную
щихся в эктопическом остеогенезе, резорбции
функцию, а с другой - обладающими остеоин-
кости в месте имплантации и др. [12, 13]. Кро-
дуктивными свойствами. Золотым стандартом
ме того, следует отметить очень высокую стои-
материалов для заполнения дефектов костной
мость INFUSE Bone Graft Kit и InductOS Kit,
ткани до сих пор считается аутогенная кост-
ограничивающую возможность их применения
ная ткань. Однако объем аутогенной кости
в Российской Федерации. Она, в свою оче-
ограничен, а забор костного материала связан
редь, определяется высокой стоимостью вхо-
с дополнительным травмированием пациен-
дящего в состав препаратов рекомбинантного
та [2]. Хорошей альтернативой аутотрансплан-
BMP-2, нарабатываемого в эукариотических
тату может быть ксеногенный деминерализо-
клетках. В настоящее время разработана тех-
ванный костный матрикс (ДКМ), получаемый
нология получения рекомбинантного BMP-2
из костей крупного рогатого скота [3], а также
с помощью микробиологического синтеза в
гибридные имплантаты на его основе [4, 5].
клетках Escherichia coli, обеспечивающего зна-
Этот материал обладает высокой остеокондук-
чительно больший выход белка по сравнению
тивностью, может быть наработан в значитель-
с эукариотическими продуцентами, что при-
ных количествах, ему легко придать требуемую
водит к существенному снижению стоимости
форму, он может выполнять каркасную функ-
препаратов белка. При этом активность in vitro
цию и использоваться для замещения дефектов
препаратов BMP-2, получаемых на основе
несущих нагрузку костей; возможно получение
E. coli, и эффективность их применения in vivo
низкоиммуногенного ДКМ со сниженным со-
в сочетании с различными носителями для ре-
держанием неколлагеновых белков с целью
парации дефектов костной ткани не уступа-
минимизировать нежелательные эффекты при
ют таковым для препаратов эукариотического
имплантации [6, 7]. При этом недостатком вы-
BMP-2 [14-29]. В Республике Корея для при-
сокоочищенного ДКМ является его ограни-
менения в ортопедии и стоматологии компания-
ченная остеоиндуктивность, которая может
ми «Cowellmedi Co.» (Пусан, Корея) и «CGBIO
быть преодолена за счёт совместного приме-
Inc.» (Соннам, Корея) производятся препараты
нения ДКМ с рекомбинантным костным мор-
на основе рекомбинантного BMP-2 прокарио-
фогенетическим белком 2 (bone morphogenetic
тического происхождения, в которых в каче-
protein-2, BMP-2) [6, 8], который может быть
стве носителя белка используются β-трикаль-
введён как непосредственно в ДКМ, так и с
ций фосфат/гидроксилапатит (β-ТКФ/ГАП) и
помощью других компонентов гибридных им-
гидроксилапатит соответственно [28, 29]. При
плантатов.
этом следует отметить, что гидроксилапатит
BMP-2 - основной фактор роста и реге-
характеризуется наименьшей растворимостью,
нерации костной ткани, введение которого в
коррелирующей со скоростью резорбции в
область дефекта кости способно индуцировать
организме и кинетикой выхода иммобилизо-
неоостеогенез [9]. Для успешного использова-
ванного BMP-2, среди используемых для ре-
ния BMP-2 в качестве остеоиндуктора крайне
генерации костной ткани кальций-фосфат-
важным является выбор носителя, обеспечи-
ных керамик [30]. Использование бифазной
вающего постепенное высвобождение белка.
β-ТКФ/ГАП кальций-фосфатной керамики
В США и Европе для спондилодеза при трав-
должно способствовать улучшению характери-
мах позвоночника, хирургического лечения
стик носителя [31]. Однако, несмотря на ши-
травм большеберцовой кости и реконструк-
рокое применение, оба носителя имеют ряд
тивной хирургии верхнечелюстной пазухи одо-
ограничений, в частности, с точки зрения био-
брено применение препарата INFUSE Bone
миметических свойств и ёмкости в отношении
Принятые сокращения: ГАП - гидроксилапатит; ГК - гиалуроновая кислота; ДКМ - деминерализованный костный
матрикс; ДТТ - дитиотрейитол; BMP-2 - bone morphogenetic protein-2 (костный морфогенетический белок-2).
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1685
белка [32], и поиск новых эффективных носи-
ванного протокола [38] с некоторыми модифи-
телей рекомбинантного BMP-2 по-прежнему
кациями, основная из которых заключалась в
является одной из ключевых задач современ-
использовании шаровой мельницы для смеши-
ной регенеративной медицины.
вания прекурсора. В качестве источников каль-
Относительно новым материалом, с точ-
ция и кремния использовали, соответственно,
ки зрения использования в регенеративной
яичную скорлупу и рисовую шелуху. Кратко,
медицине, является кальций-магниевая сили-
бытовую яичную скорлупу промывали под про-
катная керамика диопсид (CaMgSi2O6), харак-
точной водой, а затем кипятили при 100 °C в
теризующаяся хорошей биоактивностью, био-
течение 3 ч при постоянном перемешивании.
совместимостью и лучшими механическими
Очищенную яичную скорлупу сушили в тече-
свойствами, чем ГАП [33]. Исследование био-
ние 24 ч в сушильном шкафу при температуре
минерализации показало, что при инкубации
150 °C, а затем измельчали вручную до обра-
диопсида в SBF (simulated body fluid, раствор,
зования тонкодисперсного порошка. Рисовую
имитирующий внеклеточную жидкость орга-
шелуху, предоставленную местным поставщи-
низма) и при имплантации биоминерализация
ком («BeerMachines», Россия), промывали ди-
протекает достаточно быстро: за несколько ча-
стиллированной водой. Органические компо-
сов поверхность диопсида покрывается слоем
ненты удаляли погружением в серную кислоту
апатита [34], основного минерального компо-
различных концентраций. Обработанную кис-
нента кости, что и является причиной высокой
лотой рисовую шелуху промывали, сушили при
биосовместимости. Кроме того, при введении
110 °C и нагревали до 730 °C, при этой темпера-
в организм диопсид может высвобождать ионы
туре выдерживали 25 мин до образования бело-
Ca2+, Mg2+ и SiO2-, которые усиливают проли-
го порошка. Измельчённую яичную скорлупу,
ферацию остеобластов [35-37], таким образом
порошок диоксида кремния, извлечённый из
обеспечивая определённый уровень остеоин-
рисовой шелухи, и синтетический оксид маг-
дуктивности самого носителя. Это делает ди-
ния («Русхим», Россия) брали в соотношении
опсид потенциально перспективным в каче-
1 : 2 : 1 и смешивали в планетарной шаровой
стве замены кальций-фосфатной керамики,
мельнице Fritsch Pulverisette 5 («Fritsch GmbH»,
такой как ГАП или ТКФ, часто используемой
Германия). Полученную смесь выдерживали
для восстановления костных дефектов. Однако
при температуре 1100 °C в течение 6 ч для по-
до сих пор способность диопсида выступать в
лучения диопсида. Рентгенофазный анализ
качестве носителя BMP-2 и его остеоиндуктив-
образцов полученной керамики проводили на
ность в такой комбинации не исследовались.
дифрактометре Дифрей-401 («Научные прибо-
Целью данной работы была характеристи-
ры», Россия) (CrKα-излучение, λ = 2,29106 Å).
ка фазового состава, морфологии и пористости
Изображения тёмного поля в режиме сканирую-
порошка силикатной керамики, синтезиро-
щей просвечивающей электронной микро-
ванной твердофазным методом из материалов
скопии (СПЭМ) получали на просвечиваю-
природного происхождения, оценка пористо-
щем электронном микроскопе Titan Themis Z
сти ксеногенного ДКМ, используемого в каче-
(«Thermo Fisher Scientific», США) при ускоряю-
стве материала, обеспечивающего каркасную
щем напряжении 200 кВ. Оценку размера,
функцию и одновременно способного участво-
морфологии и пористости частиц диопсида
вать в ремоделировании костной ткани при
проводили с использованием программного
имплантации, исследование способности ча-
обеспечения ImageJ.
стиц диопсида выступать в качестве носителя
Получение ДКМ. ДКМ получали из диа-
фактора роста костной ткани BMP-2, изучение
физа бедренной кости крупного рогатого ско-
кинетики выхода BMP-2 из порошка диопсида,
та, как описано ранее [5], с некоторыми мо-
исследование динамики репаративного остео-
дификациями для удаления неколлагеновых
генеза при имплантации в краниальные де-
белков [4]. Для оценки объёмной пористости
фекты мышей гибридных имплантатов, вклю-
изготавливали образцы ДКМ размером при-
чающих диопсид в качестве носителя BMP-2 и
мерно 6 × 6 × 6 мм, для оценки эффективно-
ДКМ в качестве каркаса.
сти связывания BMP-2 использовали крошку
размером 1-2 мм, которую получали фракцио-
нированием с помощью грохота Retsch SM-200
МАТЕРИАЛЫ И МЕТОДЫ
(«Retsch GmbH», Германия), для имплантации
в краниальные дефекты использовали диски
Твердофазный синтез диопсида. Диопсид
толщиной 1,0 ± 0,1 мм и диаметром 4,0 ± 0,1 мм,
(CaMgSi2O6) был синтезирован твердофазным
которые вырезали из костных пластин с помо-
методом при использовании ранее опублико-
щью пробойника собственного изготовления.
БИОХИМИЯ том 87 вып. 11 2022
1686
КАРЯГИНА и др.
Оценку размера пор образцов ДКМ проводили
свежего буфера того же состава и продолжали
с помощью анализа изображений, полученных
инкубирование. Отобранные пробы замора-
с использованием сканирующего электронного
живали и хранили на -80 °С до измерения кон-
микроскопа (СЭМ) Tescan Vega 3 («TESCAN»,
центрации белка с помощью ИФА по разрабо-
Чехия), в программе ImageJ. Оценку объёмной
танному ранее протоколу [26]. Аналогичным
пористости образцов ДКМ проводили тремя
образом исследовали кинетику выхода BMP-2
различными способами: при оценке по микро-
из ДКМ, используя в качестве носителя диски
фотографиям, полученным методом СЭМ, и
диаметром 4,0 ± 0,1 мм, толщиной 1,0 ± 0,1 мм,
двумя способами с помощью гидростатическо-
масса диска 1,5 ± 0,5 мг. На каждый из трёх
го взвешивания (детальные протоколы приво-
дисков наносили по 15 мкг BMP-2 по методу,
дятся в Приложении).
описанному в работе Bartov et al. [4].
Оценка эффективности связывания BMP-2
Подготовка имплантатов, содержащих и не
с диопсидом, ГАП и ДКМ. Рекомбинантный
содержащих BMP-2, для введения в краниальные
BMP-2 нарабатывали в клетках E. coli и очи-
дефекты мышей. Для приготовления 2%-ного
щали, как описано ранее [18]. Удельная актив-
(m/v) раствора сухой порошок стерильной гиа-
ность белка составляла 0,1 Ед./мкг. Для иммо-
луроновой кислоты (ГК, ~100 кДа, «Shanghai
билизации BMP-2 10 мг порошка диопсида,
Macklin Biochemical Industry Co., Ltd.», Шан-
наноразмерного ГАП
(85-УД,
«Полистом»,
хай, Китай) добавляли в стерильный физио-
Россия) или крошки ДКМ (0,5-1 мм) инкуби-
логический раствор до конечной концентра-
ровали в 200 мкл раствора, содержащего 10 мM
ции 2%, осторожно перемешивали и оставляли
натрий-фосфатный буфер (рН 5,5) с 50 мM
для растворения на ночь в орбитальном шей-
NaCl, при встряхивании на орбитальном шей-
кере («Elmi Ltd.») при 10 об./мин. Затем 50 мг
кере S-3 («Elmi Ltd.», Латвия) при 10 об./мин
порошка диопсида (с 10 мкг/мг BMP-2 или без
и угле платформы 5° в течение 30 мин, да-
него) в 250 мкл стерильного физиологическо-
лее проводили центрифугирование в течение
го раствора добавляли к 750 мкл 2%-ной ГК в
10 мин при 9000 g. Затем раствор удаляли, до-
физиологическом растворе и тщательно пере-
бавляли 100 мкл того же раствора с различны-
мешивали до получения однородной массы с
ми концентрациями BMP-2 и инкубацию в тех
помощью стерильного шприца. Диски ДКМ
же условиях продолжали в течение 2 ч. После
(диаметр 4,0 ± 0,1 мм, толщина 1,0 ± 0,1 мм)
центрифугирования надосадочную жидкость,
выдерживали в 96%-ном спирте 1 ч, отмыва-
содержащую несвязавшийся белок, отбирали,
ли стерильным PBS и высушивали в ламинар-
а оставшийся осадок трижды промывали 1 мл
ном шкафу с ультрафиолетом в течение ночи.
того же буфера в течение 20 мин. К промытому
Непосредственно перед имплантацией диски
порошку диопсида добавляли 100 мкл того же
погружали в предварительно ещё раз пере-
раствора и осторожно перемешивали. 10 мкл
мешанную 5%-ную (m/v) суспензию порош-
суспензии порошка диопсида и 10 мкл раство-
ка диопсида в ГК. Один диск (объёмом около
ра с несвязавшимся белком переносили в про-
12,5 мм3) впитывал около 7 мкл суспензии и, та-
бирки Эппендорф объёмом 1,5 мл и добавляли
ким образом, содержал около 0,35 мг диопсида
по 50 мкл буфера для образцов с дитиотрейи-
и 3,5 мкг BMP-2.
толом (ДТТ) для электрофореза по Лэммли.
Имплантация в краниальные дефекты кри-
Пробирки инкубировали при 95 °C в течение
тического размера у мышей дисков из ДКМ с
15 мин, центрифугировали 5 мин при 9000 g,
суспензией порошка диопсида, содержащего или
после чего по 10 мкл супернатанта вносили в
не содержащего BMP-2, и дисков из ДКМ с/без
лунки геля и проводили электрофорез с после-
BMP-2, нанесённым из раствора. Эксперимент
дующей окраской бромфеноловым синим.
проводили на 60 самцах аутбредных мышей
Исследование кинетики выхода BMP-2 из
линии ICR (CD-1) возраста 38-47 дней. Жи-
диопсида, ГАП и ДКМ in vitro. В три пробирки
вотных случайным образом делили на 2 груп-
Эппендорф объёмом 1,5 мл с крышками поме-
пы по 30 мышей в каждой. В группе 1 в дефект
щали по 3 мг порошка диопсида или ГАП с на-
имплантировали диски из ДКМ с суспензией
несёнными на них 30 мкг BMP-2. В пробирки
порошка диопсида, не содержащего BMP-2, в
добавляли по 1 мл фосфатно-солевого буфе-
группе 2 - диски с суспензией порошка, содер-
ра (PBS), содержащего 1% (m/v) БСА и 0,02%
жащего BMP-2, около 3,5 мкг на диск. На 12,
(m/v) азида натрия. Пробы инкубировали при
21, 42 и 63 сутки животным проводили эвтана-
комнатной температуре на круговой качалке
зию углекислым газом, по 6 голов из каждой
при 300 об./мин. Через 1, 5, 24, 48, 72, 168 и 220 ч
группы. Также провели имплантацию двум
пробирки центрифугировали при 1900 g, надо-
контрольным группам мышей, в каждой по
садочную жидкость отбирали, добавляли 1 мл
6 животных. Одной группе вводили диски из
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1687
ДКМ, другой - диски из ДКМ с нанесённым на
них BMP-2 в количестве 3,5 мкг на диск по ме-
тодике, описанной выше. Животным этих двух
групп проводили эвтаназию на 42 сутки. Об-
разцы тканей, включающие область импланта-
ции и окружающие кости черепа, фиксировали
формалином, декальцинировали, проводили
через батарею спиртов возрастающей концен-
трации и заливали в парафин, затем готовили
срезы толщиной 3 мкм во фронтальной пло-
скости и окрашивали гематоксилином и эози-
ном. Срезы толщиной 6 мкм, полученные от
животных двух опытных групп, окрашивали
пикро-полихромом по Хировичи [39] для вы-
явления степени созревания коллагена в ре-
генерате. Гистоморфометрию проводили с ис-
пользованием Adobe Photoshop по методу Egan
et al. [40] с модификациями с определением
доли новообразованной и ремоделированной
костной ткани, доли костного мозга, доли сое-
динительной ткани и доли носителя (ДКМ) по
отношению к общей площади тканей в образце.
Статистические расчёты проводились с ис-
пользованием пакета программ Statistica 12.0
(«Statsoft», США). Для количественных оценок
данные были представлены в виде среднего ±
стандартное отклонение (SD). В случае ги-
стоморфометрии данные представляли в виде
среднего, рассчитывалась стандартная ошибка
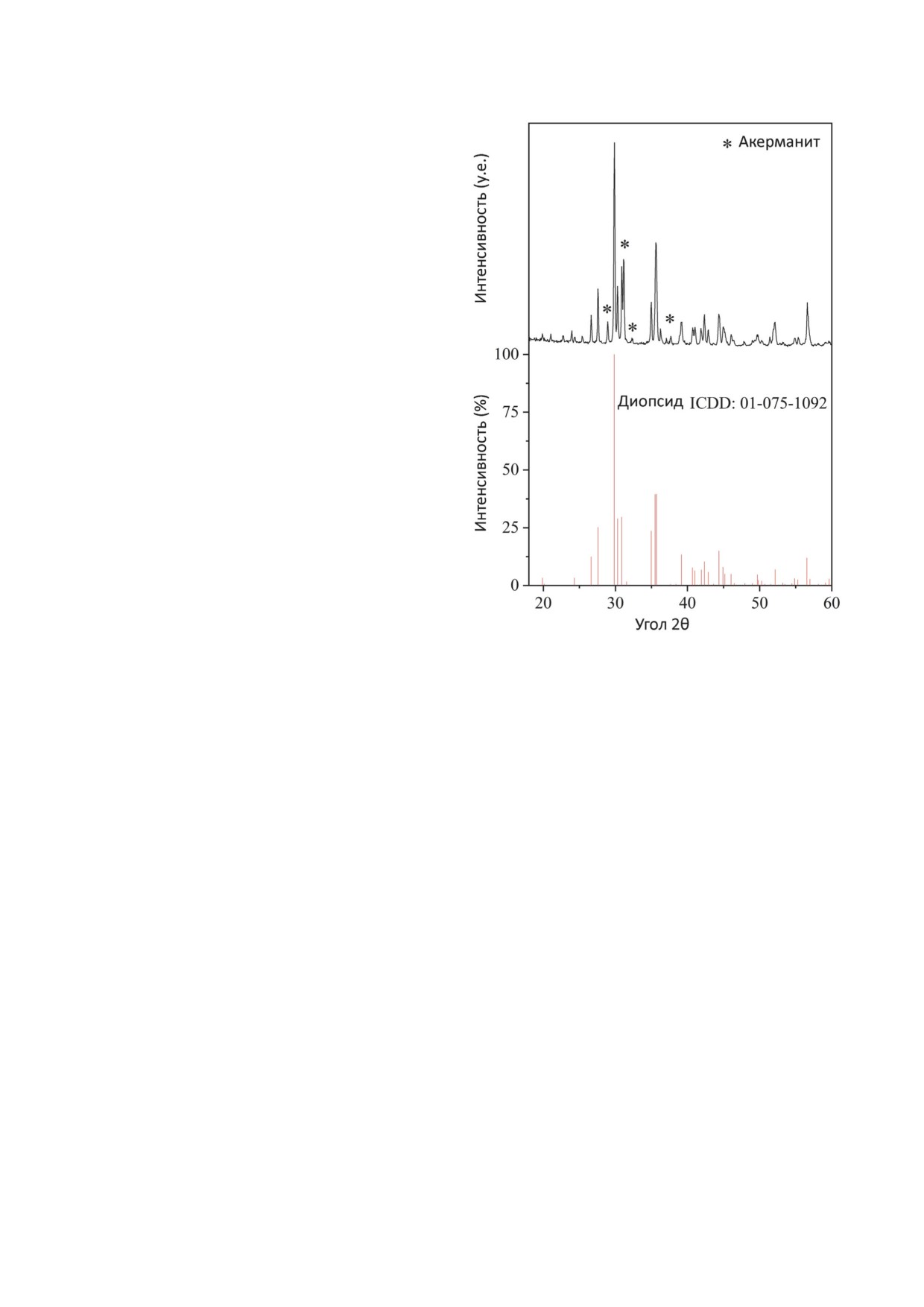
Рис. 1. Рентгенограмма порошка диопсида. Звёздочками
обозначены пики, соответствующие вторичной фазе -
среднего и стандартное отклонение. Проверку
акерманиту
на нормальность проводили с помощью теста
Колмогорова-Смирнова. Для оценки досто-
верности отличий проводили дисперсионный
вил 2,3 мкм с минимальным и максимальным
анализ с последующей пост-обработкой с при-
значениями 0,11 мкм и 8,66 мкм соответствен-
менением критерия Ньюмена-Кейлса. Разли-
но. Объёмная пористость образца составляла
чия считались значимыми при р < 0,05.
примерно 20% со средним размером пор около
24 нм. Соответственно, материал можно клас-
сифицировать как мезопористый, то есть име-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
ющий размер пор от 2 до 50 нм [41].
Характеристика образцов ДКМ. Оценка раз-
Характеристика порошка диопсида. Наличие
мера пор в образцах проводилась по микрофо-
фазы диопсида было подтверждено рентгено-
тографиям, полученным методом СЭМ. Размер
фазовым анализом (рис. 1). Рентгенограмма
пор в образцах ДКМ имеет разброс по среднему
демонстрирует наличие характерных пиков
от 300 до 450 мкм с максимальным разбросом
диопсида, являющегося основной фазой, в то
от 50 до 650 мкм (Таблица S1 в Приложении).
время как акерманит (Ca2MgSi2O7) наблюдался
Пористость, измеренная по микрофотографи-
в качестве вторичной фазы. Появление акер-
ям, имеет разброс от 50 до 70%, а измеренная
манита, обычно наблюдающееся при синтезе
двумя способами на основе гидростатическо-
диопсида, связано с наличием нестехиометри-
го взвешивания очень близка по значениям
ческих участков, богатых кальцием, в образце
для каждого из образцов и имеет разброс от 73
после кальцинации, что и приводит к образо-
до 90% (Таблица S1 в Приложении). Посколь-
ванию вторичной фазы [35]. Рентгенограмма
ку поры ДКМ во много раз превышают размер
полученного диопсида соответствовала стан-
частиц диопсида, и ДКМ является очень высоко-
дартной карточке ICDD № 01-075-1092.
пористым материалом, он представляет собой
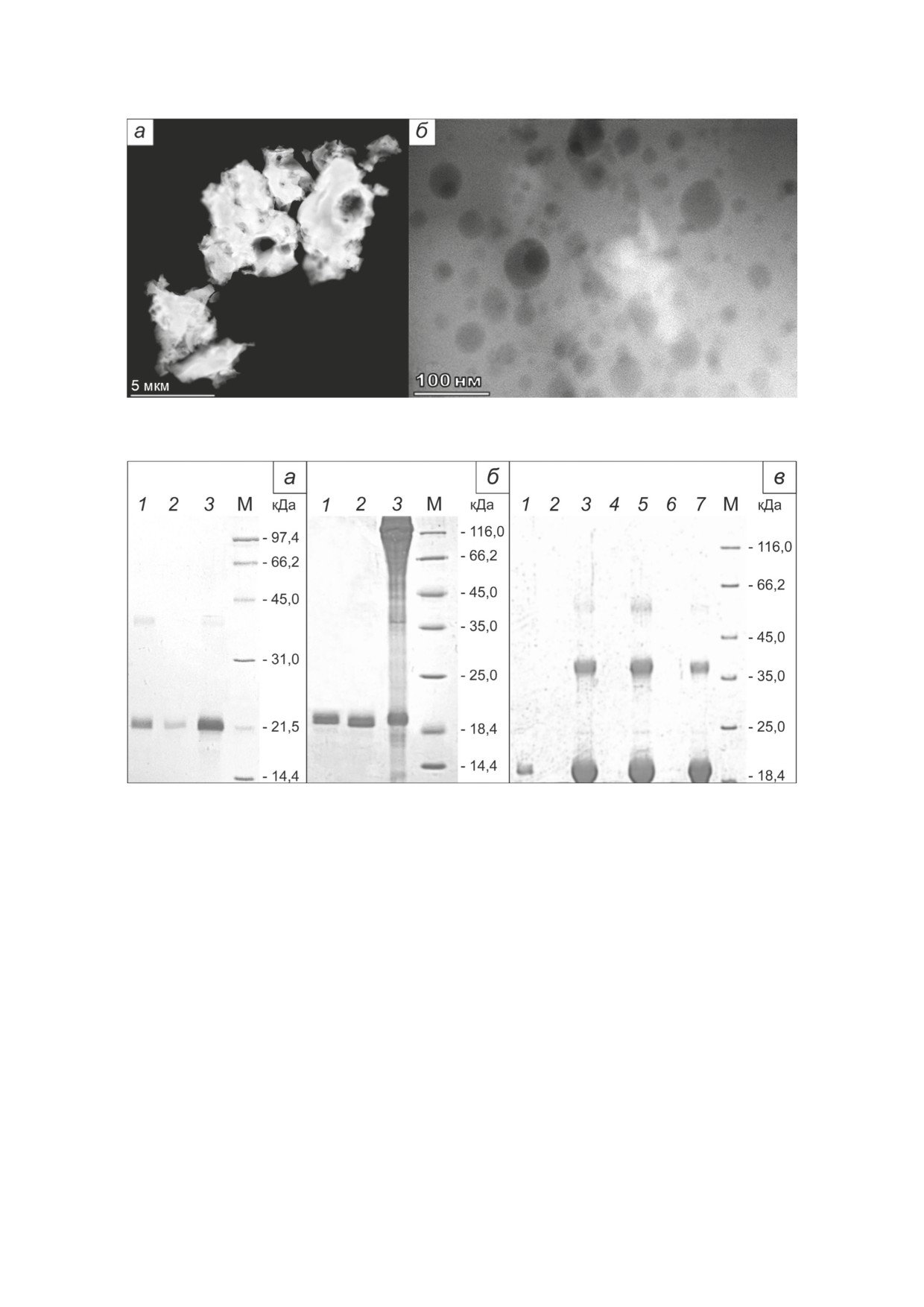
Изображения СПЭМ на рис. 2 дают пред-
хороший каркас для имплантации суспензии
ставление о морфологии частиц полученно-
порошка диопсида. Фотография диска ДКМ,
го порошка, средний размер которых соста-
аналогичного используемым в экспериментах
БИОХИМИЯ том 87 вып. 11 2022
1688
КАРЯГИНА и др.
Рис. 2. Темнопольные СПЭМ-изображения порошка диопсида. Слева - обзорное изображение отдельных частиц (a),
справа - изображение пор на поверхности частицы (б)
Рис. 3. Электрофореграммы разделения в ПААГ проб, полученных при оценке эффективности связывания BMP-2
с ГАП (а), ДКМ (б) и диопсидом (в). а - Связывание 500 мкг BMP-2 с 10 мг ГАП. 1 - BMP-2, используемый для свя-
зывания; 2 - несвязавшийся белок; 3 - связавшийся белок, снятый прогреванием в буфере для электрофореза с
ДТТ; M - маркер молекулярной массы 14-97 кДа («Bio-Rad», США). б - Связывание 500 мкг BMP-2 с 10 мг ДКМ.
1 - BMP-2, используемый для связывания; 2 - несвязавшийся белок; 3 - связавшийся белок, снятый прогреванием в
буфере для электрофореза с ДТТ; M - маркер молекулярной массы 14-116 кДа («Bio-Rad»). в - Связывание 500, 1000
и 1500 мкг BMP-2 (треки 2-3, 4-5 и 6-7 соответственно) с 10 мг диопсида. 1 - BMP-2, используемый для связывания;
2, 4, 6 - несвязавшийся белок; 3, 5, 7 - связавшийся белок, снятый прогреванием в буфере для электрофореза с ДТТ;
M - маркер молекулярной массы 14-116 кДа («Bio-Rad»)
по кинетике выхода BMP-2 и в экспериментах
таты, представленные на рис. 3, показывают,
in vivo, приведена на рис. S1 Приложения.
что ГАП и ДКМ в используемых условиях свя-
Эффективность связывания BMP-2 диопси-
зывают BMP-2 в количестве менее 50 мкг/мг,
дом, ГАП и ДКМ. Для оценки эффективно-
а диопсид - в количестве более 150 мкг/мг но-
сти связывания навески порошка диопсида
сителя, причём минимальной ёмкостью обла-
по 10 мг инкубировали с 500, 1000 и 1500 мкг
дает крошка из ДКМ. Связанный с носителя-
BMP-2, отмывали и анализировали пробы с
ми BMP-2 снимали прогреванием при 95 °С
несвязавшимся и связавшимся белком элек-
в буфере для нанесения на ПААГ с ДТТ. При
трофорезом по Лэммли. Для сравнения оце-
этом из частиц ДКМ, помимо BMP-2, частич-
нили также способность 10 мг наноразмерного
но выходил коллаген, что приводило к появле-
ГАП и 10 мг частиц ДКМ размером 1-2 мм свя-
нию массивной размазанной по треку полосы
зать 500 мкг BMP-2 в тех же условиях. Резуль-
в области высоких молекулярных масс. Полу-
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1689
ченные данные свидетельствуют о высокой сор-
бционной ёмкости диопсида, синтезирован-
ного твердофазным методом, по отношению
к BMP-2.
Кинетика выхода BMP-2 из диопсида, ГАП
и ДКМ in vitro. Кинетику выхода из порош-
ка диопсида оценивали также в сравнении с
выходом из ГАП и ДКМ. При исследовании
кинетики выхода in vitro носители содержали
BMP-2 в количестве 10 мкг/мг. Сравнение кри-
вых кумулятивного выхода (рис. 4) показывает,
что для всех трёх носителей за первые 9 суток в
используемых условиях выходит от 12 (в случае
ГАП) до 19 (в случае ДКМ) % от нанесённого
белка с первоначальным бурным выходом в те-
Рис.
4. Кумулятивный выход BMP-2 из ДКМ, ГАП и
чение 1-2 суток. При этом в случае диопсида,
диопсида. Точки на кривых и верхняя и нижняя планки
начиная со вторых суток, отмечается постоян-
погрешностей соответствуют среднему значению и стан-
дартному отклонению соответственно. Все измерения
ный выход белка примерно по 0,4-0,5% в сут-
проводились в трёх повторностях. Средние значения для
ки. В случае ГАП и ДКМ кривые существенно
ДКМ обозначены квадратами, для ГАП - треугольника-
более пологие, что говорит о меньшем выходе ми, для диопсида - окружностями
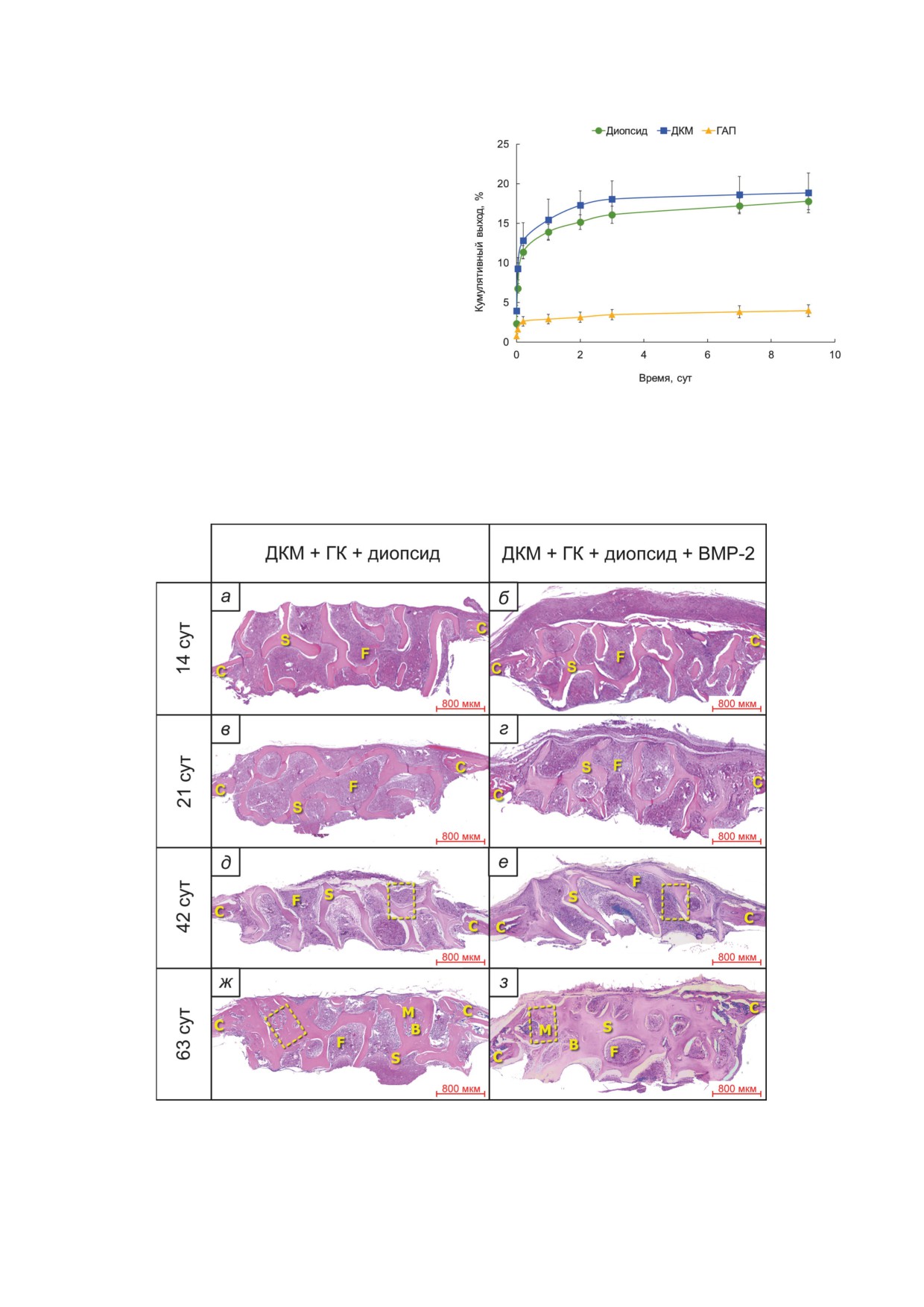
Рис. 5. Результаты гистологического анализа на сроках 12, 21, 42 и 63 суток на модели краниальных дефектов критиче-
ского размера у мышей после имплантации дисков ДКМ с диопсидом и ГК с/без добавления рекомбинантного BMP-2
(3,5 мкг/имплантат). С - кость черепа, B - новообразованная костная ткань, M - костный мозг, F - фиброзная ткань,
S - каркас (скаффолд). Жёлтыми пунктирными линиями выделены области, представленные в увеличенном виде на
рис. 8. Подробные гистологические описания приведены в тексте Приложения
11
БИОХИМИЯ том 87 вып. 11 2022
1690
КАРЯГИНА и др.
белка, начиная со вторых суток, по сравнению
имплантации в краниальные дефекты мышей
с диопсидом. Из ДКМ в течение первых 2 су-
дисков из ДКМ с суспензией порошка диопси-
ток выходит такой же процент белка, как из ди-
да, содержащего или не содержащего BMP-2,
опсида за 9 суток.
на сроках 14, 21, 42 и 63 суток оценивали ги-
Имплантация в краниальные дефекты кри-
стологически, используя окраску гематокси-
тического размера у мышей дисков из ДКМ с су-
лином и эозином с последующей гистоморфо-
спензией порошка диопсида в ГК, содержащего
метрией, а также окраску пикро-полихромом
или не содержащего BMP-2. Динамику репа-
для выявления степени созревания коллагена
ративных процессов, наблюдающихся после
в регенерате.
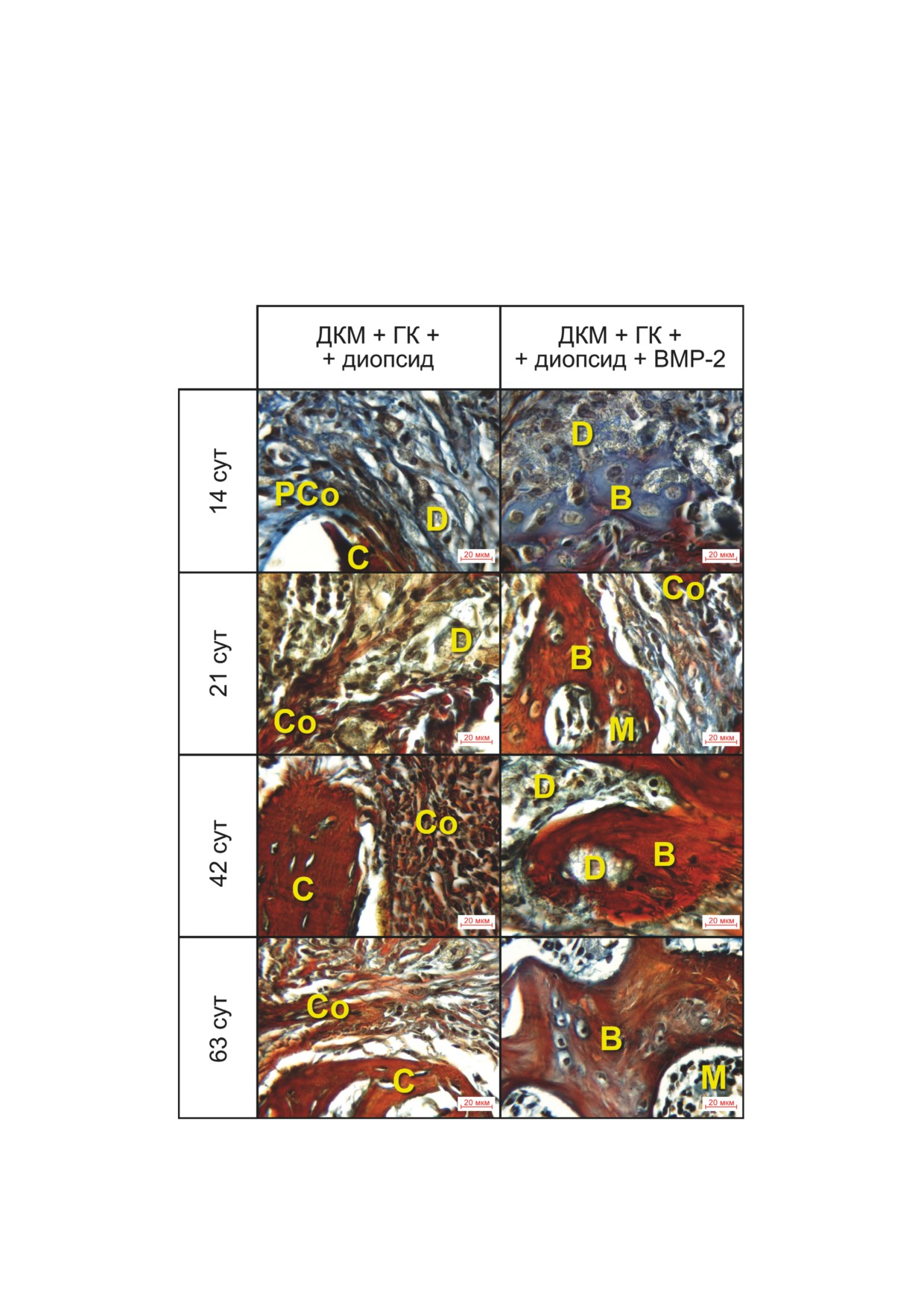
Рис. 6. Результаты гистологического анализа на сроках 12, 21, 42 и 63 суток на модели краниальных дефектов критиче-
ского размера у мышей после имплантации дисков ДКМ с диопсидом и ГК с/без BMP-2 (3,5 мкг/имплантат). Увели-
чение 400×, окраска пикро-полихромом. С - кость черепа, B - новообразованная костная ткань, M - костный мозг,
Co - зрелый коллаген, Pco - преколлаген, D - диопсид
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1691
Гистологический анализ латеральных сре-
брозной) тканью, состоящей из пучков зрело-
зов области имплантации с использованием
го коллагена, фибробластоподобных клеток
окраски гематоксилином и эозином (рис. 5), а
и иммунных клеток. Наблюдались частицы
также пикро-полихромом по Хировичи (рис. 6),
диопсида в окружении эпителиоидных кле-
полученных на разных сроках после имплан-
ток, формирующих узелки, в области краёв
тации, позволяет проанализировать динами-
дефекта видны следы перестройки костной
ку репаративного процесса для двух опытных
ткани (рис. 6). В группе 2 на 63 сутки на месте
групп - группы 1, где в дефект имплантировали
дефекта имелась хорошо выраженная костная
диски из ДКМ с суспензией порошка диопси-
ткань, состоящая из сети трабекул (утолщён-
да без BMP-2 в ГК, и группы 2, где имплантат
ных костных балок), которая объединяла края
был таким же, но порошок диопсида содер-
дефекта с диском ДКМ. В межтрабекулярном
жал BMP-2.
пространстве наблюдались участки, заполнен-
На сроке 12 суток в группе 1 в области де-
ные костным мозгом, и тяжи зрелой фиброз-
фекта имплантат был окружён молодой волок-
ной ткани (рис. 5, 6).
нистой соединительной тканью, состоящей из
Таким образом, в группе без BMP-2 ре-
тяжей молодого коллагена, фибробластоподоб-
парация дефекта происходила с заполнением
ных клеток и умеренного количества иммунных
пор имплантата фиброзной тканью, и только
клеток (рис. 5). У краёв дефекта следов пере-
на последнем сроке были заметны начальные
стройки костной ткани не наблюдалось. В груп-
этапы ремоделирования/перестройки костной
пе 2 на сроке 12 дней в области имплантации
ткани. В группе с BMP-2 уже с самых ранних
наблюдались признаки остеогенеза с образова-
сроков микроскопически определялся актив-
нием костных трабекул в направлении от кра-
ный репаративный остеогенез.
ёв дефекта к диску ДКМ. Края костей черепа
Диопсид во всех случаях вызывал умерен-
вблизи дефекта значительно утолщались за счёт
ное гранулематозное воспаление с агрегаци-
перестройки костной ткани.
ей макрофагов или эпителиоидных клеток и
На 21 сутки в группе 1 диск ДКМ был окру-
гигантских многоядерных клеток инородных
жён рыхлой грануляционной клеточно-волок-
тел, что является нормальной реакцией на им-
нистой соединительной тканью, местами уплот-
плантируемый материал. На поздних сроках в
няющейся, состоящей из пучков коллагена,
группе с BMP-2 большинство частиц диопси-
фибробластоподобных клеток и умеренного
да оказывалось полностью окружённым ново-
количества клеток-эффекторов воспаления -
образованной костной тканью, что может сви-
лимфоцитов, нейтрофилов и плазмоцитов,
детельствовать о роли диопсида - носителя
формирующих диффузный инфильтрат. Вокруг
BMP-2 - в остеогенезе.
свободных частиц диопсида (рис. 6) локализо-
Окрашивание пикро-полихромом [39] по-
вались эпителиоидные клетки и нейтрофилы,
зволило оценить динамику созревания колла-
формирующие гранулёмы. Следов резорбции
гена в регенерате. В обеих группах созревание
ДКМ и неоостеогенеза не наблюдалось. В груп-
коллагена шло от периферии регенерата к цен-
пе 2 на 21 сутки наблюдались признаки репара-
тру. По наличию красной окраски видно, что в
тивного остеогенеза с образованием молодой
группе с BMP-2 зрелый коллаген присутство-
костной ткани на периферии дефекта, где шло
вал в зоне у краёв дефекта уже на 12 день, тогда
объединение диска ДКМ с краями костей чере-
как в группе без BMP-2 пучки зрелого колла-
па, а также образование костных островков с за-
гена определялись у краёв дефекта только на
паянными в них частицами диопсида.
21 день (и на 63 день внутри пор имплантата)
Через 42 суток в группе 1 в зоне дефекта
(рис. 6).
определялся имплантат, окружённый молодой
Данные гистоморфометрии позволили
волокнистой соединительной тканью с образо-
провести оценку достоверности отличий в
ванием зрелых коллагеновых волокон у краёв
группах с и без BMP-2, а также результатов на
дефекта (рис. 6). Наблюдалась слабовыражен-
трёх последних сроках после имплантации с
ная перестройка материнской костной ткани.
результатами на первом сроке (14 суток) по че-
В группе 2 на 42 сутки после имплантации в
тырём измеряемым параметрам - отношению
зоне дефекта определялась сеть тонких кост-
площади новообразованной костной ткани и
ных балок, сросшихся с ДКМ. В пространстве
остеоида, площади костного мозга, площади
между балками наблюдались тяжи фиброзной
соединительной ткани и площади ДКМ к об-
ткани, а также структуры, имеющие строение
щей площади тканей в образце (рис. 7). Доля
нормального костного мозга.
новообразованной костной ткани и остеоида
На 63 сутки в группе 1 имплантат был
в образцах группы с BMP-2 неизменно растёт,
окружён и заполнен грубоволокнистой (фи-
достоверно отличаясь на каждом последующем
БИОХИМИЯ том 87 вып. 11 2022
11*
1692
КАРЯГИНА и др.
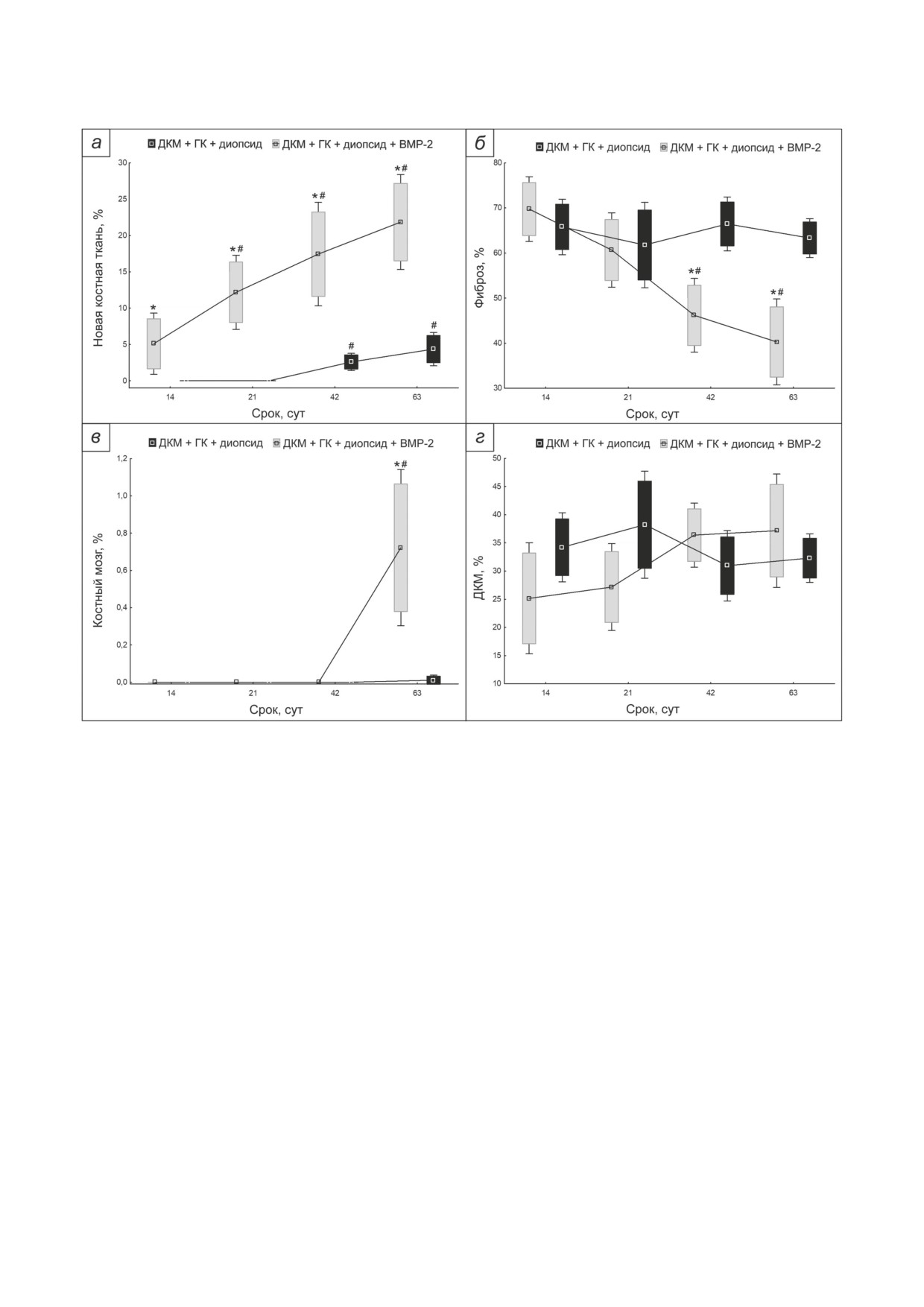
Рис. 7. Результаты гистоморфометрического исследования с оценкой относительной площади новой костной тка-
ни (а), фиброза (б), костного мозга (в) и ДКМ (г) на разных сроках после имплантации дисков из ДКМ, заполненных
суспензией порошка диопсида в ГК, насыщенного (серые ящики) и не насыщенного (чёрные ящики) BMP-2. Квадра-
ты - среднее; «ящики» - стандартная ошибка среднего; «усы» - стандартное отклонение. * p < 0,05 по сравнению с
группой без BMP-2; # p < 0,05 по сравнению с группой со сроком 14 суток
сроке от первого срока, а также от соответствую-
Имплантация в краниальные дефекты крити-
щей доли в группе без BMP-2. В группе без
ческого размера у мышей дисков из ДКМ, содер-
BMP-2 доля новообразованной костной тка-
жащих и не содержащих BMP-2. Для сравнения
ни начинает достоверно отличаться от первого
процессов репаративного остеогенеза в случае
срока лишь на 42 и 63 сутки после импланта-
внесения BMP-2 в составе порошка диопсида
ции. Костный мозг появляется в значительных
и в составе собственно ДКМ провели экспери-
количествах лишь в группе с BMP-2 на 63 сут-
мент по имплантации в краниальные дефекты
ки. Достоверных отличий по доле ДКМ не на-
мышей дисков ДКМ без BMP-2, а также дис-
блюдается ни между группами, ни по срокам
ков, в которые BMP-2 вводили с помощью ин-
после имплантации. В группе с BMP-2 досто-
кубации дисков ДКМ в растворе BMP-2. Доза
верно снижается доля, занятая фиброзом (со-
BMP-2 - 3,5 мкг на диск - соответствовала
единительной тканью), замещаясь новообра-
расчётной дозе BMP-2, внесённой на порошок
зованной костной тканью. Данные результаты
диопсида, в опытной группе 2. Длительность
хорошо соответствуют картине выраженного
этого эксперимента составила 42 дня для того,
репаративного остеогенеза в группе с диопси-
чтобы была возможность провести сравнение
дом, насыщенным BMP-2, и свидетельствуют
разных способов введения BMP-2 в имплантат
лишь о начальных стадиях перестройки кост-
на стадии самого активного этапа ремоделиро-
ной ткани в группе с диопсидом без BMP-2.
вания костной ткани. Гистологический анализ
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1693
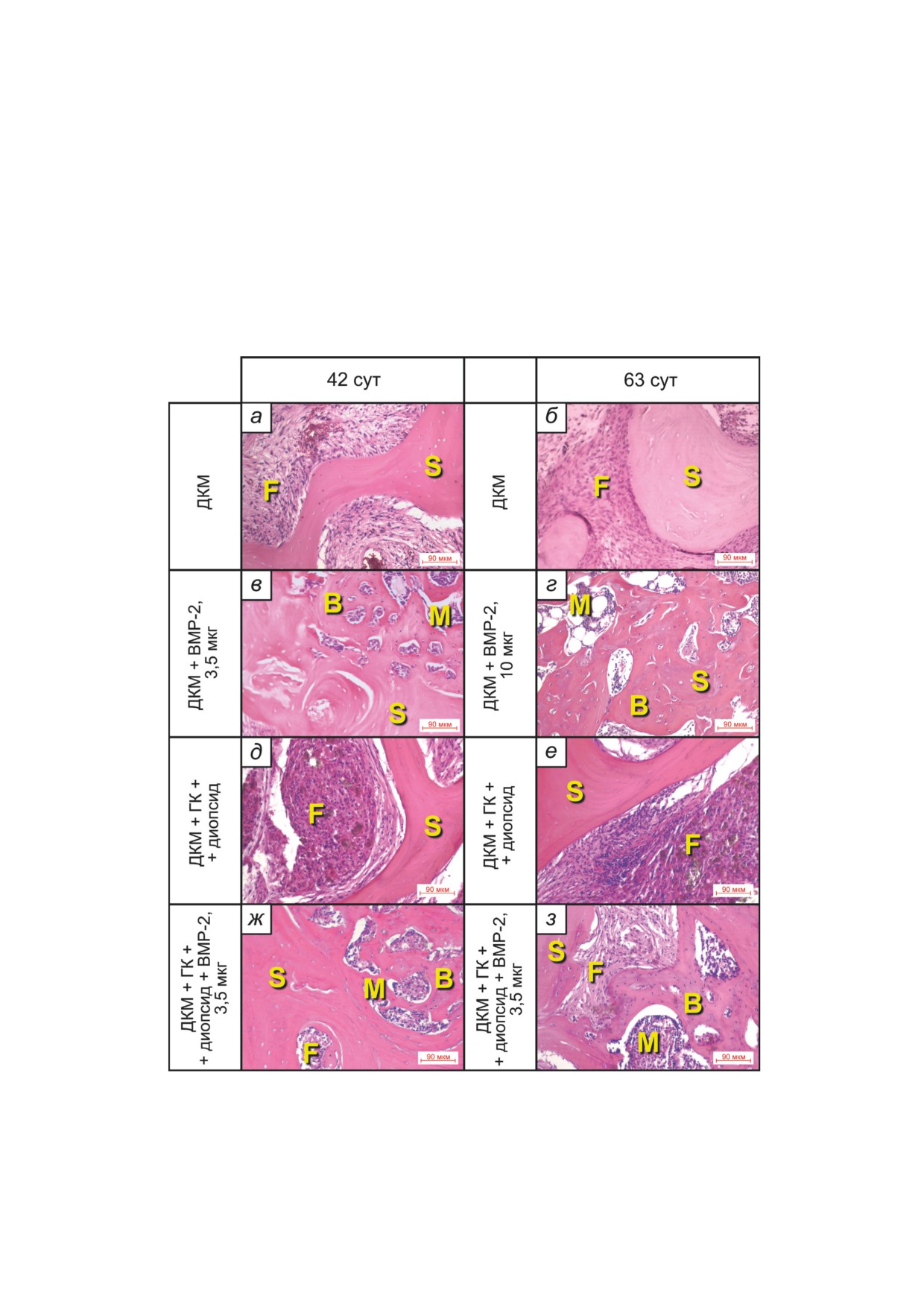
показал, что в случае обоих экспериментов в
BMP-2 в составе порошка диопсида наблю-
присутствии BMP-2 на сроке 42 дня наблюда-
дается несколько более активное формирова-
ется картина активного ремоделирования кост-
ние новообразованной костной ткани в порах
ной ткани в имплантате (рис. 8, в, ж). На этой
имплантата с заключением частиц диопсида
стадии новообразованная кость, которую мож-
внутрь костных структур. В образцах ДКМ с
но отличить от остатков ДКМ по непараллель-
присутствием диопсида и отсутствием BMP-2 в
ности тяжей коллагена, более тёмной окраске
несколько большем количестве обнаруживают-
гематоксилином и присутствию остеоцитов с
ся гигантские клетки инородных тел, при этом
синими ядрами в лакунах кости, срастается как
сильной воспалительной реакции не выявлено.
с материнской костью черепа по краям дефек-
В присутствии BMP-2 количество гигантских
та, так и с трабекулами ДКМ. При введении
клеток инородных тел снижено.
Рис. 8. Результаты гистологического анализа на сроках 42 и 63 суток на модели краниальных дефектов критического
размера у мышей после имплантации дисков из ДКМ без/с BMP-2 на сроке 42 суток (3,5 мкг/имплантат, а, в), дисков
из ДКМ без/с BMP-2 на сроке 63 суток (10 мкг/имплантат, б, г), а также дисков из ДКМ с диопсидом и ГК без/с BMP-2
(3,5 мкг/имплантат, д, е, ж, з), B - новообразованная костная ткань, M - костный мозг, F - фиброзная ткань, S - кар-
кас (скаффолд). Окраска гематоксилином и эозином. Полноразмерные фотографии образцов а-г представлены на
рис. S2 Приложения, образцов д-з - на соответствующих панелях рис. 5. Подробные гистологические описания при-
ведены в тексте Приложения
БИОХИМИЯ том 87 вып. 11 2022
1694
КАРЯГИНА и др.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
средний размер пор в ДКМ составляет 119 мкм,
что попадает в интервал определённых нами
Диопсид, используемый в работе
величин; средняя пористость, определённая
(рис. 1, 2), получен твердофазным синтезом из
по микрофотографиям, составляет 60%, что
биоотходов, что соответствует современным
полностью соответствует нашим данным по
тенденциям получения веществ, применяе-
объёмной пористости с учётом только макро-
мых в биотехнологии, на основе использова-
пористости. В любом случае размер пор ДКМ
ния пищевых отходов или отходов пищевых
обеспечивает беспрепятственное проникно-
производств
[38]. Основной модификацией
вение суспензии порошка диопсида размером
разработанной ранее методики является ис-
2-3 мкм в имплантируемый диск из ДКМ.
пользование шаровой мельницы, которое в
Нами было показано, что один диск ДКМ объё-
последние годы стало распространено в каче-
мом около 12,5 мкл в среднем впитывает около
стве дополнительной стадии синтеза биокера-
7 мкл суспензии диопсида в ГК, что составля-
мики [42, 43]. Механоактивация способству-
ет 56% от объёма имплантата и хорошо соот-
ет уменьшению размера частиц прекурсора
ветствует измеренной объёмной пористости
и увеличению площади поверхности, а также
образцов.
усиливает межфазные взаимодействия между
Порошок диопсида вводился в пористую
реагентами. Это обеспечивает гомогенность
матрицу ДКМ (рис. S1 в Приложении) в виде
смеси, а также улучшает кинетику реакции в
взвеси в высокомолекулярной ГК, которая, об-
процессе кальцинации [43]. Такой подход об-
ладая достаточно большой вязкостью, должна
легчает синтез диопсида в качестве основной
была препятствовать быстрому оседанию ча-
фазы при низкой температуре (1100 °C).
стиц и обеспечивать более равномерное рас-
Для экспериментов in vivo по исследованию
пределение частиц в имплантате. Выбор ГК в
способности чистого диопсида и диопсида с
качестве связующего агента был обусловлен
BMP-2 индуцировать репаративный остеоге-
также тем, что этот природный линейный гли-
нез было решено использовать классическую
козаминогликан является одним из основных
модель имплантации остеопластических мате-
компонентов внеклеточного матрикса в соеди-
риалов в краниальные дефекты критического
нительных тканях млекопитающих и обладает
размера у мыши. В качестве материала, обеспе-
высокой гидрофильностью, нетоксичностью,
чивающего каркасную функцию, мы использо-
низкой иммуногенностью и хорошей биосо-
вали диски из ДКМ, полученные по ранее раз-
вместимостью [45]. ГК обеспечивает благопри-
работанной технологии [4, 5]. Была проведена
ятную среду для инженерии костной ткани [46],
оценка размера пор и объёмной пористости
поскольку может стимулировать клеточную
полученных образцов ДКМ. Размер пор со-
адгезию, пролиферацию и дифференцировку
ставлял от 50 до 650 мкм с разбросом по сред-
клеток [47] для ускорения заживления дефек-
ним значениям от 300 до 450 мкм (таблица S1 в
тов костей черепа [48].
Приложении). Интересно отметить, что объём-
Высокопористые образцы керамики об-
ная пористость ДКМ, измеренная с помощью
ладают большой площадью поверхности, что
двух различных подходов - по микрофотогра-
может способствовать связыванию большего
фиям и методом гидростатического взвешива-
количества молекул белка. Показано, что мезо-
ния - существенным образом различалась (в
пористый диоксид кремния со средним разме-
файле с дополнительными материалами при-
ром пор 15,4 нм адсорбировал в 2,5 раза больше
ведены подробные описания с формулами рас-
БСА и лизоцима, чем образец с размером пор
чётов для понимания особенностей методик).
13,2 нм [49], то есть размер пор может определять
По микрофотографиям получился разброс от
адсорбцию биомолекул на поверхности биома-
50 до 70%, в то время как по измерению двумя
териала. Действительно, полученный вариант
способами с помощью гидростатического взве-
диопсида с пористостью около 20% и средним
шивания - от 73 до 90%. Мы предполагаем,
размером пор около 24 нм обладает очень вы-
что эта разница - почти в 20% - соответствует
сокой сорбционной ёмкостью по отношению к
объёму микропор, которые пронизывают кост-
используемому в нашей работе рекомбинант-
ный матрикс. В них проникает смачивающая
ному BMP-2, полученному микробиологиче-
диск жидкость, и её масса учитывается при
ским синтезом [18]: 1 мг диопсида связывает
взвешивании, однако на микрофотографиях
более 150 мкг BMP-2, что более чем в 3 раза
при используемом увеличении микропор не
превышает ёмкость наноразмерного ГАП, ко-
видно, стенки трабекул ДКМ воспринимают-
торый мы использовали для сравнения. Кро-
ся как гладкие, и микропоры не учитываются
ме того, это значительно превышает ёмкость
при расчётах. По данным других авторов [44],
частиц ДКМ размером 1-2 мм, которую мы
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1695
также использовали в экспериментах по оцен-
дефекты критического размера у мышей дис-
ке эффективности связывания BMP-2 (рис. 3).
ков из ДКМ с порами, заполненными суспен-
ДКМ достаточно широко используется в каче-
зией порошка диопсида в ГК, проводилась в
стве носителя BMP-2 в различных эксперимен-
двух вариантах - в одном случае использова-
тальных исследованиях [6, 8, 14, 50, 51], однако
ли порошок без BMP-2, в другом - с BMP-2.
продемонстрированная в наших эксперимен-
На выбранных сроках наблюдения - 12, 21, 48 и
тах относительно невысокая ёмкость в каче-
63 суток - проводили гистологическую оценку
стве носителя BMP-2 (по приблизительным
стадий репарации и ремоделирования костной
оценкам - около 20 мкг BMP-2 на 1 мг ДКМ)
ткани в пределах дефекта (рис. 5, 6). В случае
может приводить к ограничениям для приме-
отсутствия BMP-2 на всех четырёх сроках на-
нения комбинации ДКМ с BMP-2 в качестве
блюдения в образцах тканей в области имплан-
остеоиндуктивного материала, особенно при
тации отмечали небольшую воспалительную
его использовании для репарации костных
реакцию с образованием грубоволокнистой
дефектов у крупных животных или человека,
соединительной ткани в порах имплантата, на
где требуется введение более высоких доз бел-
двух последних сроках наблюдался незначи-
ка, а также при использовании частиц ДКМ с
тельно выраженный репаративный остеоге-
BMP-2 в качестве остеоиндуктивного компо-
нез, выражающийся в появлении небольших
нента в композитах и гибридных имплантатах.
островков незрелой костной ткани и зрелого
Тем не менее высокоочищенный ДКМ облада-
коллагена в порах имплантата, и незначитель-
ет хорошими остеокондуктивными свойства-
ная перестройка материнской кости в области,
ми и биосовместимостью, а также природной
примыкающей к имплантату. В присутствии
пористостью, соответствующей пористости
BMP-2 с самого первого срока наблюдались
костной ткани, что позволило остановить вы-
признаки репаративного остеогенеза с появле-
бор на данном материале в качестве импланти-
нием через 9 недель выраженных очагов ново-
руемого каркаса для исследования особенно-
образованной костной ткани, между трабеку-
стей репаративного остеогенеза, вызываемого
лами которой присутствовали участки зрелого
порошком диопсида, насыщенным и не насы-
костного мозга.
щенным BMP-2.
На сроке 6 недель картина репаративного
При исследовании кинетики выхода BMP-2
остеогенеза в образцах с диопсидом проявляет-
in vitro из диопсида, ГАП и ДКМ во всех слу-
ся максимально разнообразно: видны участки
чаях в первые 2 дня наблюдался бурный выход
новообразованной костной ткани с непарал-
белка, при этом только в случае диопсида, на-
лельно расположенными волокнами коллаге-
чиная с 3 дня, наблюдался длительный посто-
на вокруг частиц диопсида, в лакунах которой
янный выход BMP-2 приблизительно по 0,5%
находятся остеоциты, между трабекулами кост-
от нанесённого белка в сутки (рис. 4). В случае
ной ткани находятся участки костного мозга,
ГАП и ДКМ постоянный выход был значитель-
что очень похоже на картину, наблюдающуюся
но меньше. Возможно, это связано с разницей
при введении такой же дозы BMP-2 непосред-
в растворимости материалов. Аналогичный
ственно в ДКМ (рис. 8). Негативных послед-
результат с длительным очень низким посто-
ствий при использовании диопсида для введе-
янным выходом BMP-2 из ГАП был также по-
ния BMP-2 в имплантат не наблюдается.
казан другими авторами с помощью ИФА [52].
Оценка сорбционной ёмкости порошка
Следует отметить, что кинетика выхода BMP-2
диопсида по отношению к BMP-2 свидетель-
in vivo может существенно отличаться за счёт
ствует о том, что в случае их использования в
отличающихся условий, в которых находится
качестве носителя BMP-2 возможно много-
имплантат. Например, для кальций-магние-
кратное увеличение дозы рекомбинантного
вой силикатной керамики в присутствии био-
белка, вводимой в дефект. Увеличение дозы до
логических жидкостей в организме показано
определённого предела имеет смысл, посколь-
быстрое образование слоя апатита на поверх-
ку это может ускорить репарацию дефекта.
ности частиц, который может создавать барь-
Так, в полученных в ранее проведённых экс-
ер для диффузии BMP-2, тем самым снижая
периментах [8] образцах костей черепа мышей
скорость его высвобождения
[34]. Поэтому
с имплантатами из ДКМ, в которые было вве-
единственным критерием эффективности ма-
дено 10 мкг BMP-2 на диск, на сроке 9 недель
териала в качестве носителя BMP-2 является
наблюдалось практически завершённое ремо-
успешность эксперимента in vivo.
делирование костной ткани в области дефек-
Для оценки принципиальной возможности
та (рис. 8, г), при котором наблюдалось почти
использования порошка диопсида в качестве
полное замещение ДКМ новообразованной
носителя BMP-2 имплантация в краниальные
костной тканью, причём эта ткань была пол-
БИОХИМИЯ том 87 вып. 11 2022
1696
КАРЯГИНА и др.
ностью минерализована [8]. Поскольку ём-
Дальнейшие направления работы могут
кость ДКМ по отношению к BMP-2 ограниче-
быть связаны с исследованием особенностей
на, введение большего количества BMP-2 на
регенерации, опосредуемой порошком ди-
порошке диопсида, возможно, сможет сокра-
опсида с BMP-2 на других экспериментальных
тить сроки ремоделирования костной ткани.
моделях, в составе гибридных имплантатов с
Важным обстоятельством при этом является
другими материалами (каркасами, гидрогеля-
подбор максимальной дозы BMP-2, которая
ми), исследованием влияния на регенерацию
при этом обеспечивала бы отсутствие нежела-
различных доз BMP-2, использованием по-
тельных последствий, таких как эктопический
рошка диопсида в качестве носителя других
остеогенез, лизис материнской кости и др.
белков или их сочетания с BMP-2 и т.п.
Результаты гистологического анализа при
введении суспензии порошка диопсида в диски
Вклад авторов. А.С. Карягина, Ф.С. Сена-
из ДКМ демонстрируют равномерное распре-
тов, А.В. Громов - концепция и руководство
деление частиц в порах имплантатов. В описан-
работой; А.С. Карягина - написание статьи;
ных экспериментах с имплантацией порошка
П.А. Орлова, А.В. Жулина, М.С. Попонова,
диопсида с BMP-2 размер групп сравнительно
И.Н. Булыгина, Р. Чоудхари, П.А. Ковалёва,
небольшой - по 4 животных на каждом сроке.
А.И. Зимина, Т.М. Грунина, К.Е. Никитин,
Однако хотелось бы отметить то обстоятель-
Н.В. Струкова, М.С. Генералова, А.В. Рязанова,
ство, что в случае введения BMP-2 на диопсиде
Е.М. Лукинова, Е.Д. Плахотнюк, М.А. Кирса-
новая кость стабильно образовывалась у всех
нова, Е.А. Колесников, Е.В. Захарова - проведе-
животных, и разброс по данным гистоморфо-
ние экспериментов; П.А. Орлова, М.С. Попоно-
метрии был относительно небольшим (рис. 7),
ва, И.Н. Булыгина, П.А. Ковалёва, А.И. Зимина,
при этом в ранее проведённых нами экспери-
Т.М. Грунина, К.Е. Никитин, А.В. Громов - на-
ментах с ДКМ и другими материалами, когда
писание фрагментов статьи, подготовка иллю-
BMP-2 вводился непосредственно в материа-
страций; А.С. Карягина, Ф.С. Сенатов, А.В. Гро-
лы [6, 8, 19, 22-26], помимо примеров хорошего
мов, В.Н. Манских - обсуждение результатов
роста, практически во всех группах обнаружи-
исследования, редактирование текста статьи.
вались животные, у которых рост новой кости
Финансирование. Исследование выполнено
был минимален или неравномерен в пределах
при поддержке Российского научного фонда
имплантата. То есть описанный способ введе-
(проект № 22-15-00216).
ния BMP-2 обеспечивает большую стабиль-
Конфликт интересов. Авторы заявляют об
ность при репарации дефекта.
отсутствии конфликта интересов.
Таким образом, в результате проведённых
Соблюдение этических норм. Все процеду-
экспериментов in vitro и in vivo показана прин-
ры, выполненные в исследованиях с участием
ципиальная возможность использования дио-
животных, соответствовали этическим стан-
псида в качестве носителя BMP-2. Суспензия
дартам учреждения, в котором проводились ис-
порошка диопсида, насыщенного BMP-2, в
следования, и утвержденным правовым актам
ГК потенциально может быть универсальным
РФ и международных организаций.
средством, повышающим регенеративный по-
Дополнительные материалы. Приложе-
тенциал широкого спектра пористых остеопла-
ние к статье опубликовано на сайте журнала
стических материалов при костной пластике.
СПИСОК ЛИТЕРАТУРЫ
1. Ma, J., Both, S. K., Yang, F., Cui, F. Z., Pan, J., et al.
their clinical applications: an overview, Orthopaedic
(2014) Concise review: cell-based strategies in bone
Surg., 11, 725-737, doi: 10.1111/os.12509.
tissue engineering and regenerative medicine, Stem Cells
4. Plantz, M. A., Minardi, S., Lyons, J. G., Greene, A. C.,
Translat. Med., 3, 98-107, doi: 10.5966/sctm.2013-0126.
Ellenbogen, D. J., et al. (2021) Osteoinductivity and
2. Arrington, E. D., Smith, W. J., Chambers, H. G.,
biomechanical assessment of a 3D printed demineral-
Bucknell, A. L., and Davino, N. A. (1996) Compli-
ized bone matrix-ceramic composite in a rat spine fu-
cations of iliac crest bone graft harvesting, Clin. Or-
sion model, Acta Biomater., 127, 146-158, doi: 10.1016/
thopaedics Related Res., 329, 300-309, doi: 10.1097/
j.actbio.2021.03.060.
00003086-199608000-00037.
5. Driscoll, J. A., Lubbe, R., Jakus, A. E., Chang, K.,
3. Zhang, H., Yang, L., Yang, X. G., Wang, F., Feng, J. T.
Haleem, M., et al. (2020) 3D-printed ceramic-de-
et al. (2019) Demineralized bone matrix carriers and
mineralized bone matrix hyperelastic bone compos-
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1697
ite scaffolds for spinal fusion, Tissue Engin. A, 26,
чение рекомбинантного костного морфогенети-
157-166, doi: 10.1089/ten.TEA.2019.0166.
ческого белка 2 человека в клетках Escherichia coli
6.
Bartov, M. S., Gromov, A. V., Poponova, M. S.,
и тестирование его биологической активности in
Savina, D. M., Nikitin, K. E., et al. (2016) Modern
vitro и in vivo, Молек. биол., 44, 1036-1044.
approaches to research of new osteogenic biomaterials
17.
Karyagina, A. S., Boksha, I. S., Grunina, T. M.,
on the model of regeneration of cranial critical-sized
Demidenko, A. V., Poponova, M. S., et al. (2016)
defects in rats, Bull. Exp. Biol. Med., 162, 273-276, doi:
Optimization of rhBMP-2 active-form production in a
10.1007/s10517-017-3693-2.
heterologous expression system using microbiological
7.
Громов А. В., Никитин К. Е., Карпова Т. А.,
and molecular genetic approaches, Mol. Genet.
Зайцев В. В., Сидорова Е. И. и др. (2012) Разработ-
Microbiol. Virol.,
31,
208-213, doi:
10.3103/
ка методики получения остеопластического мате-
S0891416816040030.
риала на основе деминерализованного костного
18.
Karyagina, A. S., Boksha, I. S., Grunina, T. M.,
матрикса с максимальным содержанием нативных
Demidenko, A. V., Poponova, M. S., et al. (2017) Two
факторов роста костной ткани, Биотехнология, 5,
variants of recombinant human bone morphogenetic
66-75.
protein 2 (rhBMP-2) with additional protein domains:
8.
Gromov,A.V.,Bartov,M.S.,Orlova,P.A.,Manskikh,V.N.,
synthesis in an Escherichia coli heterologous expres-
Krivozubov, M. S., et al. (2019) Combined effect of
sion system, Biochemistry (Moscow), 82, 613-624,
bone morphogenetic protein-2 and erythropoietin
doi: 10.1134/S0006297917050091.
on regeneration of cranial bone defects in mice,
19.
Bartov, M. S., Gromov, A. V., Manskih, V. N.,
Bull. Exp. Biol. Med., 167, 408-412, doi: 10.1007/
Makarova, E. B., Rubshtein, A. P., et al. (2017) Re-
s10517-019-04538-5.
combinant human bone morphogenetic protein-2
9.
Gromov, A. V., Poponova, M. S., and Karyagina, A. S.
(rhBMP-2) with additional protein domain synthe-
(2020) Recombinant human bone growth factor
sized in E. coli: in vivo osteoinductivity in experimen-
BMP-2 produced in Escherichia coli. Part 1: from
tal models on small and large laboratory animals,
protein purification to experimental models for efficacy
Bull. Exp. Biol. Med., 164, 148-151, doi: 10.1007/
research, Mol. Genet. Microbiol. Virol., 35, 22-31,
s10517-017-3945-1.
doi: 10.3103/S0891416820010036.
20.
Гайфуллин Н. М., Карягина А. С., Громов А. В.,
10.
Li, R. H., and Wozney, J. M.
(2001) Deliver-
Терпиловский А. А., Маланин Д. А. и др. (2016)
ing on the promise of bone morphogenetic pro-
Морфологические особенности остеоинтегра-
teins, Trends Biotechnol., 19, 255-265, doi: 10.1016/
ции при использовании титановых имплантатов
s0167-7799(01)01665-1.
с биоактивным покрытием и рекомбинантного
11.
Kirker-Head, C. A.
(2000) Potential applications
костного морфогенетического белка rhBMP-2,
and delivery strategies for bone morphogenetic pro-
Морфология, 149, 7-84.
teins, Adv. Drug Deliv. Rev., 43, 65-92, doi: 10.1016/
21.
Karpov, T. E., Peltek, O. O., Muslimov, A. R.,
s0169-409x(00)00078-8.
Tarakanchikova, Y. V., Grunina, T. M., et al. (2020)
12.
Halloran, D., Durbano, H. W., and Nohe, A. (2020)
Development of optimized strategies for growth factor
Bone morphogenetic protein-2 in development and
incorporation onto electrospun fibrous scaffolds to
bone homeostasis, J. Dev. Biol., 8, 19, doi: 10.3390/
promote prolonged release, ACS Appl. Mater. Interfaces,
jdb8030019.
12, 5578-5592, doi: 10.1021/acsami.9b20697.
13.
Robinson, Y., Heyde, C. E., Tschöke, S. K., Mont, M. A.,
22.
Senatov, F., Amanbek, G., Orlova, P., Bartov, M.,
Seyler, T. M., et al. (2008) Evidence supporting the
Grunina, T., et al. (2020) Biomimetic UHMWPE/
use of bone morphogenetic proteins for spinal fusion
HA scaffolds with rhBMP-2 and erythropoietin for
surgery, Exp. Rev. Med. Devices, 5, 75-84, doi: 10.1586/
reconstructive surgery, Mater. Sci. Engin. C, 111,
17434440.5.1.75.
110750, doi: 10.1016/j.msec.2020.110750.
14.
Jin, Y. Z., Zheng, G. B., and Lee, J. H. (2019) Esche-
23.
Chubrik, A., Senatov, F., Kolesnikov, E., Orlova, P.,
richia coli BMP-2 showed comparable osteoinductivity
Poponova, M., et al. (2020) Highly porous PEEK
with Chinese hamster ovary derived BMP-2 with de-
and PEEK/HA scaffolds with Escherichia coli-derived
mineralized bone matrix as carrier, Growth Factors, 4,
recombinant BMP-2 and erythropoietin for enhanced
1-10, doi: 10.1080/08977194.2019.1596905.
osteogenesis and angiogenesis, Polymer Testing, 87,
15.
Vallejo, L. F., Brokelmann, M., Marten, S., Trappe, S.,
106518, doi: 10.1016/j.polymertesting.2020.106518.
Cabrera-Crespo, J., et al.
(2002) Renaturation
24.
Zimina, A., Senatov, F., Choudhary, R., Koles-
and purification of bone morphogenetic protein-2
nikov, E., Anisimova, N., et al. (2020) Biocompatibility
produced as inclusion bodies in high-cell-density
and physico-chemical properties of highly porous
cultures of recombinant Escherichia coli, J. Biotechnol.,
PLA/HA scaffolds for bone reconstruction, Polymers,
94, 185-194, doi: 10.1016/s0168-1656(01)00425-4.
12, 2938, doi: 10.3390/polym12122938.
16.
Шарапова Н. Е., Котнова А. П., Галушкина З. М.,
25.
Senatov, F., Maksimkin, A., Chubrik, A., Orlova, P.,
Лаврова Н. В., Полетаева Н. Н. и др. (2010) Полу-
Krivozubov, M., et al. (2021) Osseointegration eval-
БИОХИМИЯ том 87 вып. 11 2022
1698
КАРЯГИНА и др.
uation of UHMWPE and PEEK-based scaffolds with
37.
Sun, J., Li, J., Liu, X., Wei, L., Wang, G., et al.
BMP-2 using model of critical-size cranial defect in
(2009) Proliferation and gene expression of osteoblasts
mice and push-out test, J. Mech. Behav. Biomed. Mate-
cultured in DMEM containing the ionic products of
rials, 119, 104477, doi: 10.1016/j.jmbbm.2021.104477.
dicalcium silicate coating, Biomed. Pharmacother., 63,
26.
Senatov, F., Zimina, A., Chubrik, A., Kolesnikov, E.,
650-657, doi: 10.1016/j.biopha.2009.01.007.
Permyakova, E., et al. (2022) Effect of recombinant
38.
Choudhary, R., Venkatraman, S. K., Bulygina, I.,
BMP-2 and erythropoietin on osteogenic properties of
Senatov, F., Kaloshkin, S., et al. (2021) Biomin-
biomimetic PLA/PCL/HA and PHB/HA scaffolds in
eralization, dissolution and cellular studies of sil-
critical-size cranial defects model, Biomater. Adv., 135,
icate bioceramics prepared from eggshell and rice
112680, doi: 10.1016/j.msec.2022.112680.
husk, Mater. Sci. Engin. C, 118, 111456, doi: 10.1016/
27.
Gromov, A. V., Poponova, M. S., and Karyagina, A. S.
j.msec.2020.111456.
(2020) Recombinant human bone growth factor
39.
Friend, W. G.
(1963) A polychrome stain for
BMP-2 synthesized in Escherichia coli cells. Part 2:
differentiating precollagen from collagen, Stain
from combined use with other protein factors in
Technol., 38, 204-206.
animal models to application in medicine, Mol.
40.
Egan, K. P., Brennan, T. A., and Pignolo, R. J. (2012)
Genet. Microbiol. Virol., 35, 61-68, doi: 10.3103/
Bone histomorphometry using free and commonly
S0891416820020056.
available software, Histopathology, 61, 1168-1173, doi:
28.
Huh, J.-B., Lee, H.-J., Jang, J.-W., Kim, M.-J.,
10.1111/j.1365-2559.2012.04333.x.
Yun, P.-Y., et al. (2011) Randomized clinical trial on
41.
Rouquerol, J., Avnir, D., Fairbridge, C. W., Everett,
the efficacy of Escherichia coli-derived rhBMP-2 with
D. H., Haynes, J. H., et al. (1994) Recommendations
β-TCP/HA in extraction socket, J. Adv. Prosthodont.,
for the characterization of porous solids (Technical
3, 161-165, doi: 10.4047/jap.2011.3.3.161.
Report), Pure Appl. Chem.,
66,
1739-1758, doi:
29.
Kim, H.-S., Park, J.-C., Yun, P.-Y., and Kim, Y.-K.
10.1351/pac199466081739.
(2017) Evaluation of bone healing using rhBMP-2
42.
Myat-Htun, M., Noor, A.-F. M., Kawashita, M., and
soaked hydroxyapatite in ridge augmentation: a pro-
Baba Ismail, Y. M. (2022) Tailoring mechanical and
spective observational study, Maxillofac. Plast. Recon-
in vitro biological properties of calcium-silicate based
str. Surg., 39, 40, doi: 10.1186/s40902-017-0138-9.
bioceramic through iron doping in developing future
30.
Klein, C. P., Driessen, A. A., de Groot, K., and van
material, J. Mech. Behav. Biomed. Mater., 128, 105-
den Hooff, A. (1983) Biodegradation behavior of
122, doi: 10.2139/ssrn.3962042.
various calcium phosphate materials in bone tissue,
43.
Hafezi, M., Nadernezhad, A., Mohammadi, M.,
J. Biomed. Mater. Res., 17, 769-784, doi: 10.1002/
Barzegar, H., and Mohammadi, H. (2014) Effect of
jbm.820170505.
ball milling time on the synthesis of nanocrystalline
31.
Daculsi, G., LeGeros, R. Z., Nery, E., Lynch, K., and
merwinite via mechanical activation, Int. J. Mater.
Kerebel, B. (1989) Transformation of biphasic calcium
Res., 105, 469-473, doi: 10.3139/146.111048.
phosphate ceramics in vivo: ultrastructural and
44.
Wang, X., Li, Y., Han, R., He, C., Wang, G., et al.
physicochemical characterization, J. Biomed. Mater.
(2014) Demineralized bone matrix combined bone
Res., 23, 883-894, doi: 10.1002/jbm.820230806.
marrow mesenchymal stem cells, bone morphogenetic
32.
Fernandez-Yague, M. A., Abbah, S. A., McNamara, L.,
protein-2 and transforming growth factor-β3 gene
Zeugolis, D. I., Pandit, A., et al. (2015) Biomimetic
promoted pig cartilage defect repair, PLoS One, 9,
approaches in bone tissue engineering: Integrating
e116061, doi: 10.1371/journal.pone.0116061.
biological and physicomechanical strategies, Adv. Drug
45.
Petta, D., Fussell, G., Hughes, L., Buechter, D. D.,
Deliv. Rev., 84, 1-29, doi: 10.1016/j.addr.2014.09.005.
Sprecher, C. M., et al. (2016) Calcium phosphate/
33.
Fosca, M., Rau, J. V., and Uskoković, V.
(2022)
thermoresponsive hyaluronan hydrogel composite
Factors influencing the drug release from calcium
delivering hydrophilic and hydrophobic drugs,
phosphate cements, Bioactive Materials, 7, 341-363,
J. Orthop. Translat.,
5,
57-68, doi:
10.1016/j.
doi: 10.1016/j.bioactmat.2021.05.032.
jot.2015.11.001.
34.
Wu, C., and Chang, J. (2013) A review of bioactive
46.
Chircov, C., Grumezescu, A. M., and Bejenaru, L. E.
silicate ceramics, Biomed. Mater., 8, 032001, doi:
(2018) Hyaluronic acid-based scaffolds for tissue
10.1088/1748-6041/8/3/032001.
engineering, Rom. J. Morphol. Embryol., 59, 71-76.
35.
Wu, C., and Chang, J. (2007) Degradation, bioactivity,
47.
Liu, M., Zeng, X., Ma, C., Yi, H., Ali, Z., et al.
and cytocompatibility of diopside, akermanite, and
(2017) Injectable hydrogels for cartilage and bone
bredigite ceramics, J. Biomed. Mater. Res. Part B Appl.
tissue engineering, Bone Res., 5, 17014, doi: 10.1038/
Biomater., 83, 153-160, doi: 10.1002/jbm.b.30779.
boneres.2017.14.
36.
Wu, C., Ramaswamy, Y., and Zreiqat, H. (2010) Porous
48.
Sasaki, T., and Watanabe, C. (1995) Stimulation
diopside (CaMgSi2O6) scaffold: a promising bioactive
of osteoinduction in bone wound healing by high-
material for bone tissue engineering, Acta Biomater., 6,
molecular hyaluronic acid, Bone,
16,
9-15, doi:
2237-2245, doi: 10.1016/j.actbio.2009.12.022.
10.1016/s8756-3282(94)00001-8.
БИОХИМИЯ том 87 вып. 11 2022
ГИБРИДНЫЕ ИМПЛАНТАТЫ НА ОСНОВЕ ДИОПСИДА
1699
49. Diao, X., Wang, Y., Zhao, J., and Zhu, S. (2010) Effect
Tissue Eng. Part A, 23, 1321-1330, doi: 10.1089/
of pore-size of mesoporous SBA-15 (mesoporous
ten.TEA.2017.0005.
silica) on adsorption of bovine serum albumin and
51. Jin, Y. Z., Zheng, G. B., Lee, J. H., and Han, S. H. (2021)
lysozyme protein, Chinese J. Chem. Eng., 18, 493-499,
Comparison of demineralized bone matrix and hydroxyapa-
doi: 10.1016/S1004-9541(10)60248-0.
tite as carriers of Escherichia coli recombinant human BMP-
50. Huber, E., Pobloth, A. M., Bormann, N., Kolarczik, N.,
2, Biomater. Res., 25, 25, doi: 10.1186/s40824-021-00225-7.
Schmidt-Bleek, K., et al. (2017) Demineralized bone
52. Kang, W., Lee, D. S., and Jang, J. H. (2015) Evaluation
matrix as a carrier for bone morphogenetic protein-2:
of sustained BMP-2 release profiles using a novel fluo-
burst release combined with long-term binding and
rescence-based retention assay, PLoS One, 10, e0123402,
osteoinductive activity evaluated in vitro and in vivo,
doi: 10.1371/journal.pone.0123402.
HYBRID IMPLANTS BASED ON CALCIUM-MAGNESIUM SILICATE
CERAMICS DIOPSIDE AS A CARRIER OF RECOMBINANT BMP-2
AND DEMINERALIZED BONE MATRIX AS A SCAFFOLD: DYNAMICS
OF REPARATIVE OSTEOGENESIS IN A MOUSE CRANIOTOMY MODEL
A. S. Karyagina1,2,3*, P. A. Orlova1, M. S. Poponova1, I. N. Bulygina1,4, R. Choudhary5,6,
A. V. Zhulina1, T. M. Grunina1,3, K. E. Nikitin1, N. V. Strukova1, M. S. Generalova1,
A. V. Ryazanova1, P. A. Kovalyova4, A. I. Zimina4, E. M. Lukinova4, E. D. Plakhotniuk4,
M. A. Kirsanova7, E. A. Kolesnikov4, E. V. Zakharova4, V. N. Manskikh2,
F. S. Senatov1,4, and A. V. Gromov1*
1 Gamaleya National Research Center of Epidemiology and Microbiology,
Ministry of Healthcare of the Russian Federation, 123098 Moscow, Russia;
e-mail: akaryagina@gmail.com, alexander.v.gromov@gmail.com
2 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University, 119992 Moscow, Russia
3 All-Russia Research Institute of Agricultural Biotechnology, 127550 Moscow, Russia
4 National University of Science and Technology “MISIS”, 119049 Moscow, Russia
5 Riga Technical University, LV-1007 Riga, Latvia
6 Baltic Biomaterials Centre of Excellence, Headquarters at Riga Technical University, LV-1048 Riga, Latvia
7 Skolkovo Institute of Science and Technology, 121205 Moscow, Russia
Calcium-magnesium silicate ceramics, diopside, is a promising material for use in bone plastics, but until now
the possibility of its use as a carrier of recombinant bone morphogenetic protein-2 (BMP-2) has not been
studied, as well as the features of reparative osteogenesis mediated by the materials based on diopside with
BMP-2. Powder of calcium-magnesium silicate ceramics was obtained by solid-state synthesis using biowaste -
rice husks and egg shells - as source components. Main phase of the obtained ceramics was diopside. The
obtained particles were irregularly shaped with an average size of about 2.3 μm and ~20% porosity; average pore
size was about 24 nm, which allowed the material to be classified as mesoporous. Diopside powder adsorbs
more than 150 μg of recombinant BMP-2 per milligram, which exceeds binding capacity of hydroxyapatite,
a calcium-phosphate ceramic often used in hybrid implants, by more than 3 times. In vitro release kinetics
of BMP-2 was characterized by a burst release in the first 2 days and a sustained release of approximately 0.4
to 0.5% of the loaded protein over the following 7 days. In vivo experiments were performed with a mouse
model of cranial defects of critical size with implantation of a suspension of diopside powder with/without
BMP-2 in hyaluronic acid incorporated into the disks of demineralized bone matrix with 73-90% volume
porosity and macropore size from 50 to 650 μm. Dynamics of neoosteogenesis and bone tissue remodeling was
investigated histologically at the time points of 12, 21, 48, and 63 days. Diopside particles were evenly spread
in the matrix and caused minimal foreign body reaction. In the presence of BMP-2 by the day 63 significant
foci of newly formed bone tissue were formed in the implant pores with bone marrow areas, moreover, large
areas of demineralized bone matrix in the implant center and maternal bone at the edges were involved in the
remodeling. Diopside could be considered as a promising material for introduction into hybrid implants as an
effective carrier of BMP-2.
Keywords: diopside, calcium-magnesium silicate ceramics, implant, BMP-2, demineralized bone matrix, cranial
defects, bone tissue regeneration
БИОХИМИЯ том 87 вып. 11 2022