БИОХИМИЯ, 2022, том 87, вып. 12, с. 1842 - 1855
УДК 575.1;575.113;576.385;577.71;612.67
ЯВЛЯЕТСЯ ЛИ Nrf2 ОСНОВНЫМ РЕГУЛЯТОРОМ
СТАРЕНИЯ МЛЕКОПИТАЮЩИХ?
Обзор
© 2022 Р.А. Зиновкин1,2*, Н.Д. Кондратенко1,2,3, Л.А. Зиновкина3
1 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: roman.zinovkin@gmail.com
2 ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России,
Российский геронтологический научно-клинический центр, 129226 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
Поступила в редакцию 13.09.2022
После доработки 05.11.2022
Принята к публикации 07.11.2022
Транскрипционный фактор Nrf2 давно находится в центре внимания исследователей феномена ста-
рения. В многочисленных работах были обнаружены его эффекты как на старение целых организ-
мов, так и на процессы клеточного старения. Транскрипционному фактору Nrf2 зачастую приписы-
вают центральную роль в процессах старения, хотя этот тезис нуждается в доказательствах. Следует
отметить, что большинство работ проводили не на млекопитающих, а на беспозвоночных модель-
ных животных, таких как нематоды и дрозофилы. В данном обзоре кратко рассматриваются основ-
ные механизмы старения млекопитающих, роль воспалительных реакций и окислительного стресса
в процессах старения. Также рассматриваются основные механизмы регуляции активности тран-
скрипционного фактора Nrf2, участие Nrf2 в клеточном старении и появлении секреторного феноти-
па, ассоциированного со старением. Основная часть обзора посвящена критическому анализу экспе-
риментальных данных по изучению роли Nrf2 в старении млекопитающих.
КЛЮЧЕВЫЕ СЛОВА: транскрипционный фактор Nrf2, старение, воспаление, окислительный стресс, те-
ории старения, возрастные изменения.
DOI: 10.31857/S0320972522120053, EDN: NGCFVI
ВВЕДЕНИЕ
меняется с возрастом и напрямую влияет
на
процессы старения на клеточном и организ-
К настоящему моменту опубликовано более
менном уровнях. Но справедливо ли применять
полутора тысяч экспериментальных и обзорных
такой термин к Nrf2? Данный обзор не ставит
работ, посвящённых транскрипционному фак-
своей целью подробный анализ влияния акти-
тору Nrf2 и старению. Действительно, участие
вации или ингибирования активности Nrf2 на
Nrf2 в процессах старения клеток и организма
процессы старения, что было сделано ранее [2].
не вызывает сомнений. Зачастую Nrf2 называ-
Также настоящий обзор не рассматривает дан-
ют «главным регулятором процесса старения»
ные, полученные на беспозвоночных животных,
(master regulator of the aging process) [1]. Однако,
поскольку у них механизмы старения могут от-
если какой-либо белок является главным ре-
личаться от таковых у млекопитающих. Цель на-
гулятором старения, то его активность должна
стоящего обзора - провести критический ана-
регулировать работу тех генов, чья экспрессия лиз роли Nrf2 в старении млекопитающих.
Принятые сокращения: АФК - активные формы кислорода; КС - клеточное старение; ARE - элемент антиокси-
дантного ответа; GSK3β - гликогенсинтаза 3 бета; KEAP1 - Kelch-подобный ECH(Nrf2)-ассоциированный белок-1;
Nrf2 - родственный эритроидному фактору 2 ядерный фактор 2; p62/SQSTM1 - полиубиквитин-связывающий белок
p62/секвестосома 1; SASP - секреторный фенотип, ассоциированный со старением; β-TrCP - белок, содержащий
повторы бета-трансдуцина.
* Адресат для корреспонденции.
1842
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1843
ТЕОРИИ И МЕХАНИЗМЫ СТАРЕНИЯ
пиды и белки, что приводит к дисфункции
клеток и тканей. Широко известная свобод-
Старение является сложным процессом,
норадикальная теория старения постулиру-
затрагивающим практически все клетки орга-
ет, что свободные радикалы - основная дви-
низма. В процессе старения развивается ми-
жущая сила старения [5], хотя эта теория и
тохондриальная дисфункция, нарушается го-
оспаривается рядом исследователей [6]. По-
меостаз, развивается окислительный стресс, а
скольку митохондрии являются основными
также изменяется эпигеном, транскриптом и
источниками АФК, воздействие на митохон-
протеом клеток [3]. Эти изменения происходят
дрии является перспективным подходом в ан-
на всех уровнях организации живого: молеку-
тивозрастной терапии [7]. Ещё один важный
лярном, клеточном и тканевом. В результате с
признак старения - состояние, называемое
возрастом экспоненциально возрастает веро-
«inflammaging» - хроническое воспаление, со-
ятность развития болезней и состояний, угро-
путствующее процессу старения организма [8].
жающих жизни.
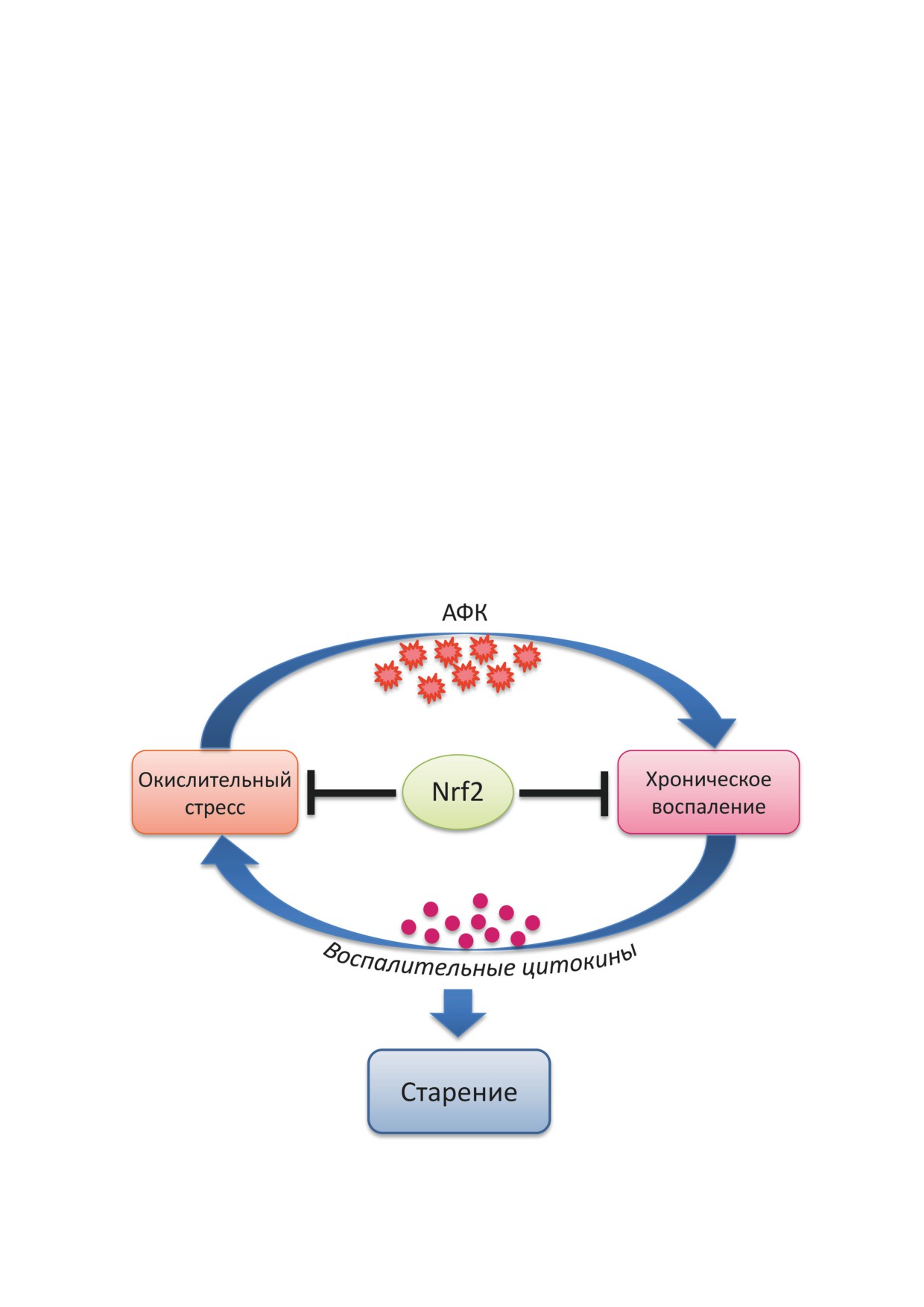
Важно отметить, что между окислительным
Известно много признаков старения, за-
стрессом и хроническим воспалением суще-
трагивающих биохимические и физиологи-
ствует петля положительной обратной связи:
ческие параметры организма [4]. Одним из
АФК и свободные радикалы являются важны-
важнейших признаков старения является
ми сигнальными молекулами, вызывающи-
окислительный стресс, под которым подразу-
ми воспалительные реакции, которые, в свою
мевается нарушение баланса между антиокси-
очередь, приводят к образованию АФК и иных
дантной системой и прооксидантной в пользу
радикалов (рис. 1).
последней. Возникающие в результате этого
Исследование причин и механизмов ста-
стресса активные формы кислорода (АФК) и
рения является чрезвычайно актуальной зада-
азота повреждают нуклеиновые кислоты, ли-
чей. Существует множество теорий старения,
Рис. 1. Схема «порочного круга», состоящего из петли положительной связи между окислительным стрессом и хрониче-
ским воспалением. Активация Nrf2 как подход к противовозрастной терапии. Подробности в тексте
БИОХИМИЯ том 87 вып. 12 2022
6*
1
844
ЗИНОВКИН и др.
которые в первом приближении можно клас-
лительного и электрофильного стрессов. Этот
сифицировать на теории программируемого
транскрипционный фактор относится к семей-
старения, теории накопления повреждений,
ству основных белков с лейциновой молнией.
а также объединяющие их комбинированные
Nrf2 был открыт более четверти века назад [16]
теории [9].
и с тех пор неизменно остаётся в центре внима-
Теории программируемого старения посту-
ния исследователей [17].
лируют, что старение является онтогенетиче-
Nrf2 управляет экспрессией ~250 генов,
ской программой, обеспечивающей организму
продукты которых участвуют в антиоксидант-
эволюционное преимущество [10]. Согласно
ном ответе, редокс-гомеостазе, детоксика-
концепции феноптоза, гибель организма за-
ции токсичных соединений, биогенезе мито-
программирована в его геноме [11]. Такой под-
хондрий и многих других процессах (рис. 2).
ход предполагает, что старение является из-
Активация этих генов защищает клетки от
лечимым состоянием, что открывает новые
окислительного стресса и развития воспа-
возможности к предотвращению развития воз-
ления [18, 19]. При активации Nrf2 повыша-
растных заболеваний и продлению жизни [12].
ется экспрессия гена HMOX1, кодирующего
Теории накопления повреждений оспа-
гемоксигеназу-1 (HO-1), ответственную за де-
ривают постулаты теории программируемого
градацию провоспалительных свободных ге-
старения, приводя доводы, что старение может
мов и образование противовоспалительных
объясняться отсутствием естественного отбора
соединений, таких как угарный газ (CO) и би-
на пострепродуктивном этапе жизни и возни-
лирубин; NAD(P)H:хинон оксидоредуктазы-1
кать за счёт накопления мутаций и побочных
(NQO1), обладающей антиоксидантными ак-
продуктов обмена веществ, которые вызыва-
тивностями; цитоплазматической формы ан-
ют повреждение клеток, органов и тканей [13].
тиоксидантного фермента супероксиддисму-
Хотя накопление повреждений и является
тазы-1 (SOD1), а также ключевых ферментов
спонтанным энтропийным процессом, его ки-
биосинтеза глутатиона (тяжёлой каталитиче-
нетика может регулироваться как генетически,
ской субъединицы глутамат-цистеинлигазы,
так и под влиянием окружающей среды, что
GCLC, и лёгкой регуляторной субъединицы
и приводит к различной продолжительности
глутамат-цистеинлигазы, GCLM), который яв-
жизни у разных генотипов [14].
ляется основным клеточным тиолом, необхо-
Несмотря на различие в определении дви-
димым для поддержания редокс-гомеостаза.
жущих сил и причин старения, все теории
Индукция экспрессии Nrf2 также приво-
сходятся в том, что продолжительность жизни
дит к понижению уровня цитокинов воспа-
организма определяется динамическим взаи-
ления за счёт эпигенетического сайленсинга
модействием двух факторов: (1) процесса на-
соответствующих промоторов в иммунных
копления вредных изменений (за счёт действия
клетках [20]. Через активацию Nrf2 осущест-
программы старения либо накопления повреж-
вляет свои противовоспалительные функции
дений); и (2) противодействующих механизмов
и эндогенный метаболит итаконат [21]. Отсут-
восстановления и поддержания гомеостаза (за
ствие Nrf2 у мышей вызывает неконтролируе-
счёт программы антистарения либо ответа на
мый воспалительный ответ: активацию клеток
возникающие стрессы) [13, 15].
врождённого иммунитета, высокую продук-
Таким образом, независимо от точки зре-
цию цитокинов, хемокинов и АФК - все эти
ния на причины старения, в качестве противо-
факторы способствуют повреждению клеток и
возрастной терапии весьма перспективно воз-
тканей [22]. Активация Nrf2 рассматривается
действовать на сигнальные пути, снижающие
как терапевтическая возможность снижения
воспаление и уровень АФК. Одним из таких
избыточного воспалительного ответа при сте-
подходов является активация транскрипцион-
рильном воспалении и некоторых вирусных
ного фактора Nrf2 (рис. 1).
инфекциях [23].
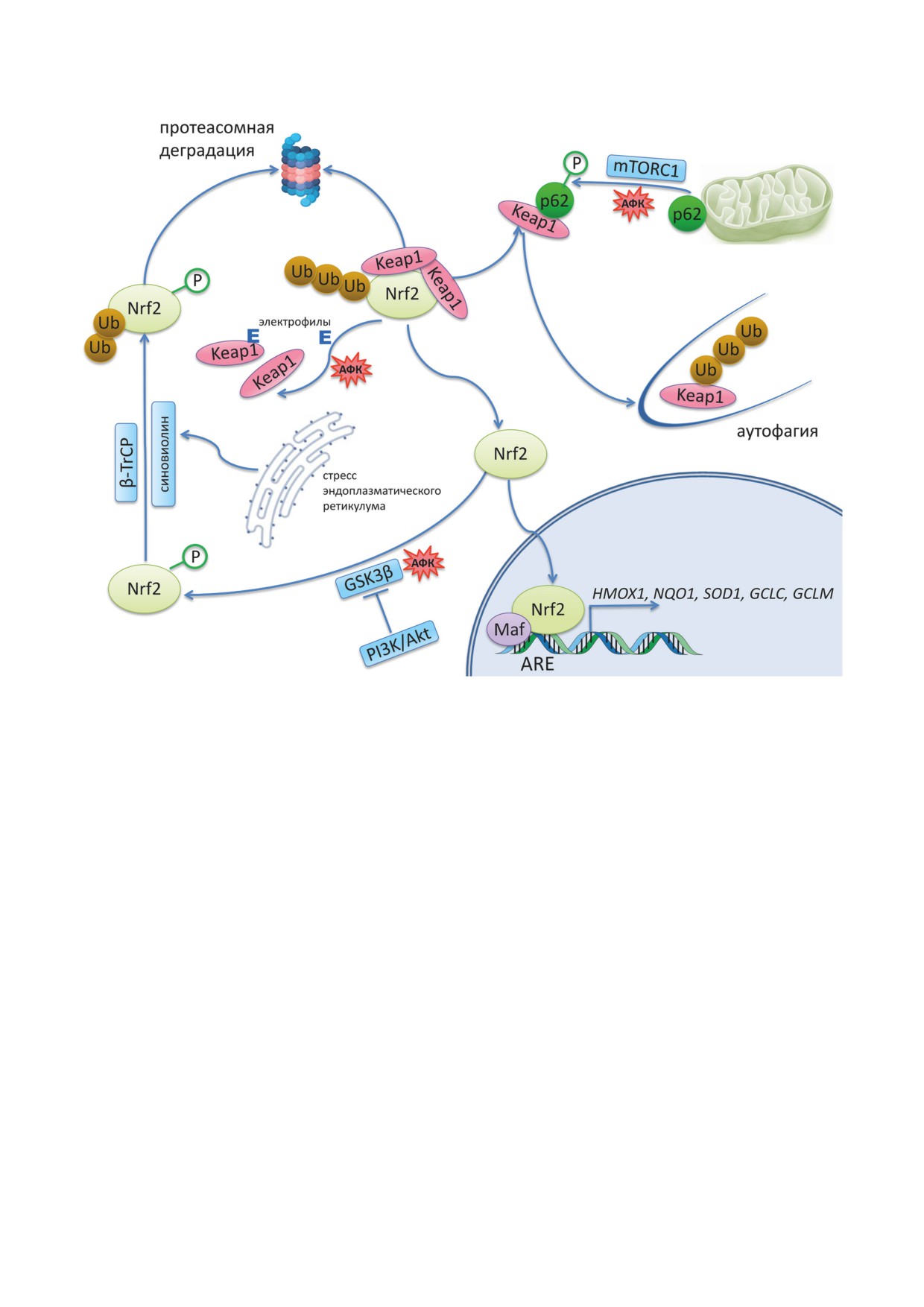
Известно несколько способов регуляции
активности Nrf2, который в обычных условиях
ТРАНСКРИПЦИОННЫЙ ФАКТОР Nrf2
является короткоживущим белком [24].
И ЕГО РЕГУЛЯЦИЯ
Первый (классический) вариант заключа-
ется в следующем: в нормальных условиях Nrf2
Транскрипционный фактор Nrf2 (nuclear
локализован в цитоплазме и связан со своим
factor (erythroid-derived 2)-like 2 (NFE2L2) или
ингибитором - белком KEAP1 (Kelch-подоб-
NF-E2 related factor 2) является центральным
ный ECH(Nrf2)-ассоциированный белок-1,
звеном в обеспечении защиты организма от
Kelch-like ECH (Nrf2) associated protein-1), ко-
различных воздействий, в том числе от окис-
торый стимулирует убиквитинилирование Nrf2
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1845
Рис. 2. Способы регуляции активности Nrf2. В нормальных условиях Nrf2 в цитоплазме связан со своим ингибитором
KEAP1 (Kelch-подобный ECH(Nrf2)-ассоциированный белок-1), который стимулирует его убиквитинилирование и
протеасомную деградацию. Окислители или электрофилы (E) связываются с тиоловыми группами цистеиновых остат-
ков белка KEAP1. В результате Nrf2 накапливается в ядре и связывается с элементами антиоксидантного ответа ARE
(antioxidant response elements) - последовательностями в промоторах своих генов-мишеней (HMOX1, NQO1, SOD1,
GCLC, GCLM), стимулируя таким образом их транскрипцию. При окислительном стрессе также происходит фосфо-
рилирование полиубиквитин-связывающего белка p62/секвестосома 1 (p62/SQSTM1), что облегчает его связывание
с KEAP1 и приводит к убиквитинилированию и протеасомной деградации последнего. К протеасомной деградации
самого Nrf2 приводит связывание с E3 убиквитинлигазами синовиолином и β-TrCP (белок, содержащий повторы бета-
трансдуцина). Киназа GSK3β (гликогенсинтаза 3 бета) напрямую фосфорилирует Nrf2 и облегчает его взаимодействие
с β-TrCP. При окислительном стрессе происходит активация киназ Akt и PI3K (фосфатидилинозитол-3-киназы),
которые ингибируют GSK3β и соответственно протеасомную деградацию Nrf2. Обозначения: E - электрофил,
АФК - активные формы кислорода
и его последующую протеасомную деградацию.
меркаптаны, восстанавливающие дисульфид-
Окислители или электрофилы связываются с
ные связи белка KEAP1 [27].
KEAP1 через SH-группу, в результате чего Nrf2
Второй вариант активации Nrf2 - дегра-
освобождается от его влияния, избегая дегра-
дация KEAP1 с помощью аппарата аутофагии.
дации, и накапливается в ядре. Там Nrf2 вме-
При этом происходит взаимодействие KEAP1 с
сте с набором транскрипционных кофакторов,
убиквитин-связывающим белком p62/SQSTM1,
таких как белки Maf, взаимодействует со специ-
что способствует его деградации в аутофаго-
фическими последовательностями (ARE) в
соме и активации Nrf2 [28]. В промоторе гена,
промоторах генов, стимулируя таким образом
кодирующего белок p62/SQSTM1, присутству-
их транскрипцию [25]. Важно отметить, что
ет последовательность ARE, его транскрипция
последовательность ARE находится и в про-
повышается при активации Nrf2, что дополни-
моторе самого Nrf2, что обеспечивает петлю
тельно способствует его активации. Окисли-
положительной обратной связи [26]. Помимо
тельный стресс вызывает фосфорилирование
окислителей и электрофилов, индукцию Nrf2
Ser349 в мотиве STGE белка p62/SQSTM1 с
способны вызывать сероводород и некоторые
помощью белка-сенсора mTORC1 (комплекс 1
БИОХИМИЯ том 87 вып. 12 2022
1846
ЗИНОВКИН и др.
мишени рапамицина млекопитающих, mam-
сом, дисфункцией митохондрий, активацией
malian target of rapamycin C1). Такое фосфори-
онкогенов [43]. С одной стороны, феномен КС
лирование приводит к увеличению аффинно-
является фундаментальным биологическим
сти p62/SQSTM1 к KEAP1 и его эффективному
процессом, который полезен для организма,
элиминированию [29-32]. Важно отметить, что
так как он обеспечивает защиту от онкогенной
белок р62/SQSTM1 также обнаруживается на
трансформации. С другой стороны, состарен-
внешней мембране митохондрий и участвует в
ные клетки синтезируют провоспалительные
селективной аутофагии (митофагии) [33]. Взаи-
цитокины и матриксные металлопротеиназы,
модействие KEAP1 с p62 зависит от белка се-
что вызывает воспаление и локальную дис-
стрин-2 (SESN2) [34], который также локализо-
функцию тканей [44, 45]. Такое состояние
ван в митохондриях [35].
называется секреторным фенотипом, ассоци-
Третий путь регуляции Nrf2 осуществляет-
ированным со старением (SASP). Хотя SASP
ся с помощью двух E3 убиквитинлигаз: β-TrCP
и вносит заметный вклад в хроническое вос-
и синовиолина (также известного как Hrd1).
паление, его действие этим не ограничивает-
Синовиолин активируется при стрессе эндо-
ся, а носит сложный плейотропный характер,
плазматического ретикулума (ER-stress), что
который подробно изложен в недавнем обзоре
снижает количество белка Nrf2 [36]. Помимо
Birch и Gil [46]. Уничтожение клеток с SASP
этого, киназа GSK3β может напрямую фос-
приводит к восстановлению функций органов
форилировать белок Nrf2, что приводит к его
и тканей и является перспективным подходом
узнаванию убиквитинлигазой β-TrCP и по-
в борьбе против старения [47].
следующей деградации [37]. Киназа GSK3β
Nrf2 широко известен как фактор, ин-
проявляет конститутивную активность и ин-
гибирующий процессы КС. Nrf2 влияет на
гибируется киназами PI3K/Akt, которые ак-
многочисленные сигнальные пути, включаю-
тивируются при окислительном стрессе [38].
щие антиоксидантную систему, аутофагию,
Таким образом, при окислительном стрессе
систему мониторинга целостности генома с
происходит ингибирование β-TrCP-зависимой
помощью р53, AMP-активируемой протеин-
деградации Nrf2.
киназы (AMPK), транскрипционного фак-
Помимо этого, киназа GSK3β может фос-
тора «каппа-би» (NF-κB), и др. (см. обзор
форилировать тирозинкиназу Fyn из семей-
Yuan et al. [48]). Активность Nrf2 уменьша-
ства Src-киназ, что приводит к транслокации
ется при старении фибробластов человека,
Fyn в ядро, где она фосфорилирует Nrf2, вызы-
его сайленсинг индуцирует преждевременное
вая экспорт Nrf2 из ядра [39, 40].
старение, а фармакологическая активация
На
5′-конце нетранслируемой области
Nrf2 увеличивает продолжительность жизни
мРНК Nrf2 находится внутренний сайт по-
клеток [49]. В соответствии с этими данны-
садки рибосомы (IRES), который позволяет
ми, негативный регулятор Nrf2 кавеолин-1
быстро производить трансляцию в условиях
(caveolin-1) также вызывал преждевременное
стресса. Окислительный стресс, вирусная ин-
старение фибробластов [50]. В состоянии по-
фекция, тепловой шок, депривация питатель-
коя Nrf2 частично локализуется в кавеолах -
ных веществ, алкилирующие агенты - все эти
инвагинациях плазматической мембраны, где
воздействия приводят к активации кэп-неза-
он находится в комплексе со своим эндоген-
висимой трансляции через IRES и увеличению
ным ингибитором кавеолином-1. При окис-
количества Nrf2 [41, 42].
лительном стрессе кавеолин-1 ограничивает
миграцию Nrf2 в ядро, тем самым предотвра-
щая активацию генов-мишеней Nrf2. При
Nrf2 В КЛЕТОЧНОМ СТАРЕНИИ
сверхэкспрессии кавеолина на фоне окисли-
тельного стресса происходит ингибирование
На клеточном уровне процессы старе-
Nrf2-сигналинга и развитие преждевремен-
ния выражаются в изменении внеклеточно-
ного старения клеток [50]. Парадоксальным
го матрикса, клеточного состава, накоплении
образом у мышей с делецией участка Nrf2,
повреждения макромолекул, а также в появ-
ответственного за связывание с KEAP1, пер-
лении «состаренных клеток». Клеточное ста-
манентная активация Nrf2 приводит к преж-
рение (КС, cell senescence) - это остановка
девременному старению фибробластов и
деления клеток, которая происходит в нор-
повышает вероятность развития раковых за-
мально функционирующих тканях при до-
болеваний [51]. При этом большинство иссле-
стижении предела Хейфлика. КС может быть
дователей полагают, что активация Nrf2 изна-
также инициировано целым рядом факторов:
чально мешает онкогенной трансформации
повреждением ДНК, окислительным стрес-
клеток, но помогает выжить уже возникшим
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1847
раковым клеткам, предотвращая их гибель за
характер: грызуны с высокой активностью Nrf2
счёт снижения окислительного стресса и эли-
обладают большей продолжительностью жиз-
минации химиопрепаратов. Более подробно
ни, чем грызуны с низкой активностью [70].
неоднозначная роль Nrf2 в онкогенезе рассма-
Подобная ситуация наблюдается и у птиц -
тривается в обзоре Wu et al. [52].
животных с высокой метаболической актив-
С одной стороны, имеется множество экс-
ностью и продукцией АФК, но парадоксально
периментальных свидетельств, что активация
большой продолжительностью жизни. У клады
Nrf2 снижает окислительный стресс, замед-
Neoaves, представляющей до 95% всех видов
ляет КС и уменьшает фенотип SASP [53-57].
птиц, система Nrf2 постоянно активирована,
Тем не менее имеются данные, что избыточ-
что, как предполагается, обеспечивает адапта-
ная активация Nrf2 может вызывать окисли-
цию птиц к высоким уровням АФК и, как след-
тельный стресс за счёт увеличения активности
ствие, высокую продолжительность жизни [71].
NADPН-оксидазы NOX4 [58], что может спо-
Активация этой системы произошла за счёт
собствовать КС. Таким образом, продолжи-
мутации гена KEAP1 у предка Neoavian, что
тельность и амплитуда активации Nrf2 чрезвы-
нарушило репрессию Nrf2 с помощью KEAP1
чайно важны для регуляции уровня АФК и КС.
в тканях и клетках диких Neoaves [71]. Одна-
ко среди представителей клады Neoaves доля
видов с высокой продолжительностью жизни
СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
является не очень большой [72]. При этом дру-
И АКТИВНОСТЬ Nrf2
гие виды птиц, которые не относятся к этой
кладе, например лебеди, характеризуются вы-
В пионерской работе Suh et al. [59] было
сокой продолжительностью жизни [73]. Таким
показано, что при старении у крыс снижается
образом, повышенная активация Nrf2 у птиц
как количество Nrf2, так и его транскрипцион-
не может служить единственным объяснением
ная активность, что приводит к уменьшению
феномена высокой продолжительности жизни.
экспрессии ферментов биосинтеза глутатио-
Генетический нокаут Nrf2 обычно при-
на, и, как следствие, понижению его количе-
водит к усилению старческого фенотипа в
ства, что способствует развитию окислитель-
самых разных органах и тканях животных:
ного стресса. Впоследствии ряд работ прямо
гиппокампе [74], скелетных мышцах [75, 76],
или косвенно связали снижение активности
сетчатке [77], слуховой системе [78], а также
Nrf2 со старением организма [60]. В скелетных
уменьшает продолжительность жизни самок
мышцах пожилых людей, ведущих сидячий
мышей [79]. Как правило, эти изменения со-
образ жизни, активность Nrf2 снижена [61].
провождаются воспалительными реакциями
В миокарде старых мышей транскрипционная
и повышением уровня АФК, в том числе ми-
активность Nrf2 снижалась, но её можно было
тохондриальных. Тем не менее существуют и
восстановить умеренными физическими на-
противоположные примеры влияния нокау-
грузками [62].
та Nrf2 на окислительный стресс и признаки
Количество Nrf2 или его активность также
старения. Так, например, нокаут Nrf2 у старе-
снижались с возрастом в спинном мозге мы-
ющих мышей уменьшил отложение ионов же-
шей [63], эндотелии сосудов [64], ткани языка
леза в головном мозге, понизил уровень окис-
крыс [65], печени крыс [66], а также в эпители-
лительного повреждения в полосатом теле, а
альных клетках бронхов человека [67]. Тем не
также смягчил возрастную двигательную дис-
менее до сих пор имеется лишь небольшое ко-
функцию [80]. Авторы связывают этот эффект
личество экспериментальных работ, в которых
со снижением экспрессии в эндотелии голов-
измеряли возрастное изменение активности
ного мозга гена ферропонтина 1, находящего-
Nrf2 в органах и тканях млекопитающих [2].
ся под контролем Nrf2: у нокаутных животных
При этом в некоторых работах не было обна-
уменьшение ферропонтина в мозге приводит
ружено возрастного снижения Nrf2 в артери-
к уменьшению отложения железа и, соответ-
ях макак [68]. А в других работах, напротив,
ственно, снижается окислительный стресс.
детектировали увеличение активности Nrf2
Следовательно, действие транскрипционно-
в гладкомышечных клетках сосудов старых
го фактора Nrf2 на уровне организма было бы
крыс [69]. Требуются дальнейшие усилия ис-
неверно рассматривать как исключительно
следователей для заполнения этого пробела.
антиоксидантное, противовоспалительное и в
Несмотря на имеющиеся эксперименталь-
конечном счёте антивозрастное. Под контро-
ные несоответствия, можно сделать предпо-
лем Nrf2 находится множество генов, продук-
ложение, что возрастное уменьшение актив-
ты которых оказывают на организм сложное,
ности Nrf2 носит универсальный межвидовой
плейотропное действие. Так, избыточная ак-
БИОХИМИЯ том 87 вып. 12 2022
1848
ЗИНОВКИН и др.
тивация Nrf2 в печени мышей приводит к раз-
только с Nrf2, но и с другими клеточными суб-
витию гепатомегалии за счёт активации сиг-
стратами [92, 93].
нального пути Akt [81].
При этом есть косвенные указания, что
Активация Nrf2 химическим или генети-
повышение активности Nrf2 действитель-
ческим путём может приводить к уменьшению
но может продлевать жизнь: так происходит
признаков старения. К сожалению, до сих пор
у мышей, нокаутных по гену, кодирующему
не было проведено экспериментов по исполь-
глутатион-трансферазу mGSTA4-4 (изоформа
зованию химических индукторов Nrf2 как
A4-4 глутатион-S-трансферазы млекопитаю-
противовозрастных препаратов. При этом ак-
щих) [94]. Поскольку этот фермент обеспечи-
тивация Nrf2 с помощью электрофилов из экс-
вает детоксикацию конечного продукта окис-
трактов растений (протандимом (Protandim))
ления липидов, 4-гидроксиноненаля (4-HNE),
увеличила медианную продолжительность жиз-
ожидалось, что делеция кодирующего его гена
ни мышей, правда, только самцов [82].
будет способствовать накоплению окислитель-
Рапамицин является одним из немно-
ных повреждений и сокращению жизни. Веро-
гих соединений, чья способность продлевать
ятно, компенсаторная активация Nrf2 у этих
жизнь модельным животным подтверждается
мышей не только способствовала детоксикации
многими независимыми исследованиями [83].
4-HNE, но и замедлила процессы старения.
Хотя основной мишенью рапамицина явля-
Важным модельным организмом для из-
ется mTOR, рапамицин также способен акти-
учения старения и роли митохондрий в этом
вировать Nrf2 [84], но это свойство оказалось
процессе являются так называемые бы-
не обязательным для предотвращения процес-
стро стареющие
«мутаторные» мыши. Эти
сов КС in vitro.
трансгенные животные экспрессируют ми-
Ещё один известный кандидат на «лекар-
тохондриальную ДНК-полимеразу гамма без
ство против старения» - антидиабетический
корректирующей 3′→5′-экзонуклеазной актив-
препарат метформин, чьё действие на продол-
ности, что приводит к накоплению мутаций в
жительность жизни было проверено во множе-
мтДНК, дисфункции дыхательной цепи, окис-
стве экспериментов [85]. Интересно, что мет-
лительному стрессу и преждевременному ста-
формин также способен активировать Nrf2 у
рению [95, 96]. Снижение митохондриального
Caenorhabditis elegans [86], но, по-видимому, у
окислительного стресса с помощью митохон-
мышей метформин обладает противополож-
дриально-направленного антиоксиданта SkQ1
ным эффектом, ингибируя Nrf2 в мозге [87].
(пластохинолил-10(6′-децилтрифенил)фос-
Перманентная активация Nrf2 путём ге-
фоний) продлевает жизнь животным [97]. До-
нетического нокаута его негативного регуля-
вольно неожиданное участие Nrf2 в старении
тора KEAP1 крайне неблагоприятна для ор-
мутаторных мышей было обнаружено в недав-
ганизма: новорождённые нокаутные мыши
ней работе Lei et al. [98]: оказалось, что мтДНК
быстро умирают от голода, скорее всего, из-за
выходит из митохондрий в цитоплазму, акти-
повышения экспрессии α-кератинов и по-
вирует интерфероновый ответ, который инги-
следующего кератоза желудочно-кишечного
бирует Nrf2, что ведёт к усилению окислитель-
тракта [88]. У мышей со сниженной экспрес-
ного стресса и ускоренному старению.
сией KEAP1 уровень активации Nrf2 повыша-
Голый землекоп широко известен как дол-
ется не так сильно, как у нокаутных живот-
гоживущее животное, устойчивое к раку и воз-
ных, что даёт возможность исследовать вклад
растным заболеваниям, а также обладающее
Nrf2 в возрастные изменения. У таких мышей
признаками неотении, что может объяснять
действительно замедлено развитие некоторых
его феноменальную продолжительность жиз-
признаков старения: замедлено прогресси-
ни [99]. Относительно других грызунов у голых
рование возрастной потери слуха [89], менее
землекопов повышен базовый уровень Nrf2,
выражены старческие изменения в слюнных
в том числе имеется больше Nrf2 в ядре, по-
железах [90]. Можно было бы ожидать, что та-
вышена способность Nrf2 связываться с ARE
кие животные будут обладать большей продол-
и, соответственно, выше уровень экспрессии
жительностью жизни, но экспериментальных
подконтрольных ему генов [70, 100]. Исследо-
доказательств этого до сих пор нет. Напротив,
ватели предполагают, что Nrf2 вносит значи-
по предварительным данным, снижение экс-
тельный вклад в обеспечении высокой продол-
прессии KEAP1 приводит к уменьшению вы-
жительности жизни голого землекопа [101].
живаемости в когорте двухлетних мышей [91].
Одним из немногих надёжных способов
Дополнительной проблемой в трактовке дей-
продления жизни животных является огра-
ствия Nrf2 на продолжительность жизни яв-
ничение питания. В работе Pearson et al. [102]
ляется факт, что KEAP1 взаимодействует не
было установлено, что ограничение калорий-
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1849
ности продлевает жизнь и нокаутным по Nrf2
тами мишеней Nrf2 [109]. Обнаружение так
мышам, следовательно, Nrf2 не принимает
называемых «эпигенетических часов», отражаю-
участия в обеспечении продления жизни, вы-
щих биологический возраст человека и живот-
зываемого ограничением питания.
ных [110], также, к сожалению, не позволило
Про роль Nrf2 в старении человека извест-
выявить транскрипционные факторы, чья ак-
но немного. Предполагается, что у долгожите-
тивность меняется со старением [111].
лей может быть повышена активность Nrf2 за
Следует отметить, что омиксные техно-
счёт специфической диеты, содержащей его
логии, описывающие старение людей и жи-
индукторы, и что именно Nrf2 может играть
вотных, сталкиваются с рядом объективных
ключевую роль в такой большой продолжи-
трудностей. Во-первых, разный генетический
тельности жизни [103]. Тем не менее до сих
бэкграунд и разный образ жизни вносит зна-
пор нет экспериментальных свидетельств, что
чительный вклад в детектируемые изменения.
у долгожителей действительно повышена ак-
Во-вторых, неизбежные старческие болезни
тивность Nrf2.
и патологии также изменяют профили экс-
прессии генов. В-третьих, клеточный состав
тканей значительно меняется с возрастом, что
ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ
безусловно, искажает картину происходящего.
В ПРОФИЛЕ ЭКСПРЕССИИ ГЕНОВ И Nrf2
К сожалению, в большинстве исследований
не проводилось предварительной сортировки
Логично предположить, что если Nrf2 дей-
клеток, что не позволяет сделать однозначные
ствительно является одним из центральных
выводы. Наконец, активация Nrf2 может но-
регуляторов старения, то профиль экспрессии
сить транзиентный характер, т.е. быстро воз-
регулируемых им генов в стареющих тканях
растать и так же быстро снижаться. На этот
должен изменяться соответствующим обра-
процесс могут влиять различные факторы,
зом. К настоящему времени накоплены мно-
такие как диета и употребление лекарствен-
гочисленные омиксные данные по возрастным
ных средств. Например, употребление побегов
изменениям в различных тканях и органах.
брокколи, содержащих сульфорафан (индук-
Некоторые из этих изменений действительно
тор Nrf2), повышает его экспрессию в крови
имеют признаки ослабления транскрипци-
людей [112], а многие лекарственные средства
онной активности Nrf2. Так, например, тран-
являются известными активаторами Nrf2 [113].
скриптомные данные указывают, что в мозгах
нокаутных по Nrf2 мышей наблюдаются такие
изменения сигнальных путей, которые типич-
ЗАКЛЮЧЕНИЕ
ны для мозга пожилых людей [104].
Однако подавляющее большинство иссле-
Старение организмов сопровождается:
дований, использующих непредвзятый под-
(1) накоплением окислительных повреждений
ход к анализу паттернов старческих измене-
и (2) повышением уровня воспаления. Акти-
ний, не обнаруживают признаков заметного
вация транскрипционного фактора Nrf2 может
изменения активности транскрипционного
повлиять на оба эти фактора, замедлив разви-
фактора Nrf2. Транскриптомный анализ об-
тие старческих изменений. Косвенным под-
разцов кожи человека (30-45 лет) демонстри-
тверждением этого предположения является
рует центральную роль TNF (фактора некроза
тот факт, что долгоживущие животные, такие
опухоли), p53 и NF-κB в возрастных измене-
как голый землекоп, имеют повышенный уро-
ниях [105]. Независимый метаанализ баз дан-
вень активации Nrf2. Важным направлением
ных по 18 тканям людей различного возраста
исследований должно стать получение неза-
не обнаружил Nrf2 среди транскрипционных
висимых экспериментальных данных о воз-
факторов, контролирующих транскрипцию
растной динамике изменения активности Nrf2
генов, экспрессия которых изменяется с воз-
у животных и человека, так как имеется недо-
растом [106], что соответствует более ранним
статок данных подобного рода.
работам (см. обзор Stegeman и Weake [107]).
Заманчиво предположить, что людям
Полномасштабный эпигеномный и тран-
для успешной борьбы со старением, подоб-
скриптомный ландшафт четырёх тканей при
но голым землекопам, необходимо научиться
старении мыши выявил индукцию воспали-
должным образом активировать Nrf2. Однако
тельного ответа, но не активацию Nrf2 [108].
следует учесть, что долгоживущие организмы
Системный анализ возрастных изменений в
эволюционно адаптировались к высокой ак-
протеоме человека также не выявил измене-
тивности Nrf2 и произвели тонкую настройку
ния количества белков, являющихся продук-
сложной системы взаимодействий сигналь-
БИОХИМИЯ том 87 вып. 12 2022
1850
ЗИНОВКИН и др.
ных и метаболических путей. Поэтому простая
Вклад авторов. Р.А. Зиновкин - концепция
фармакологическая активация Nrf2 с целью
обзора; Л.А. Зиновкина - подготовка рисунков;
продления жизни представляется не самым
Р.А. Зиновкин, Л.А. Зиновкина и Н.Д. Кондра-
перспективным подходом, несущим риски серь-
тенко - написание и редактирование текста.
ёзных побочных эффектов. Более того, в ли-
Благодарности. Авторы благодарны госпо-
тературе отсутствуют надёжные данные, од-
дину Е.С. Егорову за помощь в редактировании
нозначно доказывающие, что активация Nrf2
статьи. Работа осуществлена при поддержке
действительно приводит к увеличению про-
Междисциплинарной научно-образовательной
должительности жизни млекопитающих.
школы Московского университета «Молеку-
Старение сопровождается изменением
лярные технологии живых систем и синтетиче-
профиля экспрессии генов, который является
ская биология».
ткане- и видоспецифичным. Эти изменения
Конфликт интересов. Авторы заявляют об
лишь в небольшой степени соответствуют пат-
отсутствии конфликта интересов.
терну генов, контролируемых Nrf2. Таким об-
Соблюдение этических норм. Настоящая
разом, в настоящий момент нельзя сделать вы-
статья не содержит описания выполненных ав-
вод, что Nrf2 является «главным регулятором
тором исследований с участием людей или ис-
процесса старения».
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Lewis, K. N., Mele, J., Hayes, J. D., and Buffenstein, R.
opsis on aging-theories, mechanisms and future
(2010) Nrf2, a guardian of healthspan and gatekeeper
prospects, Ageing Res. Rev., 29, 90-112, doi: 10.1016/
of species longevity, Integr. Comp. Biol., 50, 829-843,
j.arr.2016.06.005.
doi: 10.1093/icb/icq034.
10. Longo, V. D., Mitteldorf, J., and Skulachev, V. P.
2. Shilovsky, G. A. (2022) Lability of the Nrf2/Keap/ARE
(2005) Programmed and altruistic ageing, Nat. Rev.
cell defense system in different models of cell aging
Genet., 6, 866-872, doi: 10.1038/nrg1706.
and age-related pathologies, Biochemistry (Moscow),
11. Skulachev, V. P. (1999) Phenoptosis: programmed
87, 70-85, doi: 10.1134/S0006297922010060.
death of an organism, Biochemistry (Moscow), 64,
3. Van der Rijt, S., Molenaars, M., McIntyre, R. L.,
1418-1426.
Janssens, G. E., and Houtkooper, R. H.
(2020)
12. Goldsmith, T. C. (2016) Evolution of aging theories:
Integrating the hallmarks of aging throughout the
why modern programmed aging concepts are
tree of life: a focus on mitochondrial dysfunction,
transforming medical research, Biochemistry (Moscow),
Front. Cell Dev. Biol.,
8,
594416, doi:
10.3389/
81, 1406-1412, doi: 10.1134/S0006297916120026.
fcell.2020.594416.
13. Johnson, F. B., Sinclair, D. A., and Guarente, L.
4. Moskalev, A. (2019) Biomarkers of Human Aging,
(1999) Molecular biology of aging, Cell, 96, 291-302,
Springer International Publishing, doi:
10.1007/
doi: 10.1016/s0092-8674(00)80567-x.
978-3-030-24970-0.
14. Carlos Aledo, J., and Maria Blanco, J.
(2015)
5. Harman, D. (1955) Aging: a theory based on free radical
Aging is neither a failure nor an achievement
and radiation chemistry, J. Gerontol., 3, 298-300,
of natural selection, Curr. Aging Sci.,
8,
4-10,
doi: 10.1093/geronj/11.3.298.
doi: 10.2174/1874609808666150421130033.
6. Gladyshev, V. N. (2014) The free radical theory of
15. Skulachev, M. V., and Skulachev, V. P.
(2017)
aging is dead. Long live the damage theory! Antioxid.
Programmed aging of mammals: proof of concept
Redox Signal., 20, 727-731, doi: 10.1089/ars.2013.5228.
and prospects of biochemical approaches for anti-
7. Skulachev, V. P., Anisimov, V. N., Antonenko, Y.
aging therapy, Biochemistry (Moscow), 82, 1403-1422,
N., Bakeeva, L. E., Chernyak, B. V., Erichev, V.
doi: 10.1134/S000629791712001X.
P., et al. (2009) An attempt to prevent senescence: a
16. Moi, P., Chan, K., Asunis, I., Cao, A., and Kan, Y. W.
mitochondrial approach, Biochim. Biophys. Acta, 1787,
(1994) Isolation of NF-E2-related factor 2 (Nrf2),
437-461, doi: 10.1016/j.bbabio.2008.12.008.
a NF-E2-like basic leucine zipper transcriptional
8. Franceschi, C., Capri, M., Monti, D., Giunta, S.,
activator that binds to the tandem NF-E2/AP1
Olivieri, F., Sevini, F., et al. (2007) Inflammaging and
repeat of the beta-globin locus control region, Proc.
anti-inflammaging: a systemic perspective on aging and
Natl. Acad. Sci. USA, 91, 9926-9930, doi: 10.1073/
longevity emerged from studies in humans, Mech. Age-
pnas.91.21.9926.
ing Dev., 128, 92-105, doi: 10.1016/j.mad.2006.11.016.
17. Liu, T., Lv, Y.-F., Zhao, J.-L., You, Q.-D., and Jiang,
9. Da Costa, J. P., Vitorino, R., Silva, G. M., Vogel, C.,
Z.-Y. (2021) Regulation of Nrf2 by phosphorylation:
Duarte, A. C., and Rocha-Santos, T. (2016) A syn-
Consequences for biological function and therapeutic
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1851
implications, Free Radic. Biol. Med., 168, 129-141,
29. Hay, N., and Sonenberg, N. (2004) Upstream and
doi: 10.1016/j.freeradbiomed.2021.03.034.
downstream of mTOR, Genes Dev., 18, 1926-1945,
18. Ahmed, S. M. U., Luo, L., Namani, A., Wang, X. J.,
doi: 10.1101/gad.1212704.
and Tang, X.
(2017) Nrf2 signaling pathway:
30. Kim, D.-H., Sarbassov, D. D., Ali, S. M., King, J. E.,
pivotal roles in inflammation, Biochim. Biophys.
Latek, R. R., Erdjument-Bromage, H., et al. (2002)
Acta. Mol. Bas. Dis., 1863, 585-597, doi: 10.1016/
mTOR interacts with raptor to form a nutrient-sensitive
j.bbadis.2016.11.005.
complex that signals to the cell growth machinery, Cell,
19. Chen, Q. M. (2021) Nrf2 for cardiac protection:
110, 163-175, doi: 10.1016/s0092-8674(02)00808-5.
pharmacological options against oxidative stress,
31. Ichimura, Y., Waguri, S., Sou, Y.-S., Kageyama, S.,
Trends Pharmacol. Sci., 42, 729-744, doi: 10.1016/
Hasegawa, J., Ishimura, R., et al. (2013) Phospho-
j.tips.2021.06.005.
rylation of p62 activates the Keap1-Nrf2 pathway
20. Kobayashi, E. H., Suzuki, T., Funayama, R.,
during selective autophagy, Mol. Cell, 51, 618-631,
Nagashima, T., Hayashi, M., Sekine, H., et al. (2016)
doi: 10.1016/j.molcel.2013.08.003.
Nrf2 suppresses macrophage inflammatory response
32. Saito, T., Ichimura, Y., Taguchi, K., Suzuki, T.,
by blocking proinflammatory cytokine transcription,
Mizushima, T., Takagi, K., et al. (2016) p62/Sqstm1
Nat. Commun., 7, 11624, doi: 10.1038/ncomms11624.
promotes malignancy of HCV-positive hepatocellular
21. Mills, E. L., Ryan, D. G., Prag, H. A., Dikovskaya, D.,
carcinoma through Nrf2-dependent metabolic repro-
Menon, D., Zaslona, Z., et al. (2018) Itaconate
gramming, Nat. Commun., 7, 12030, doi: 10.1038/
is an anti-inflammatory metabolite that activates
ncomms12030.
Nrf2 via alkylation of KEAP1, Nature, 556, 113-117,
33. Ma, K., Chen, G., Li, W., Kepp, O., Zhu, Y.,
doi: 10.1038/nature25986.
and Chen, Q.
(2020) Mitophagy, mitochondrial
22. Kensler, T. W., Wakabayashi, N., and Biswal, S.
homeostasis, and cell fate, Front. Cell Dev. Biol., 8,
(2007) Cell survival responses to environmental
467, doi: 10.3389/fcell.2020.00467.
stresses via the Keap1-Nrf2-ARE pathway, Annu.
34. Fan, Y., Xing, Y., Xiong, L., and Wang, J. (2020)
Rev. Pharmacol. Toxicol., 47, 89-116, doi: 10.1146/
Sestrin2 overexpression alleviates hydrogen peroxide-
annurev.pharmtox.46.120604.141046.
induced apoptosis and oxidative stress in retinal
23. Zinovkin, R. A., and Grebenchikov, O. A. (2020)
ganglion cells by enhancing Nrf2 activation via Keap1
Transcription factor Nrf2 as a potential therapeutic
downregulation, Chem. Biol. Interact., 324, 109086,
target for prevention of cytokine storm in COVID-19
doi: 10.1016/j.cbi.2020.109086.
patients, Biochemistry (Moscow),
85,
833-837,
35. Kovaleva, I. E., Tokarchuk, A. V., Zheltukhin, A. O.,
doi: 10.1134/S0006297920070111.
Dalina, A. A., Safronov, G. G., Evstafieva, A. G., et al.
24. Katoh, Y., Iida, K., Kang, M.-I., Kobayashi, A.,
(2020) Mitochondrial localization of SESN2, PLoS
Mizukami, M., Tong, K. I., et al. (2005) Evolutionary
One, 15, e0226862, doi: 10.1371/journal.pone.0226862.
conserved N-terminal domain of Nrf2 is essential for
36. Wu, T., Zhao, F., Gao, B., Tan, C., Yagishita, N.,
the Keap1-mediated degradation of the protein by
Nakajima, T., et al. (2014) Hrd1 suppresses Nrf2-
proteasome, Arch. Biochem. Biophys., 433, 342-350,
mediated cellular protection during liver cirrhosis,
doi: 10.1016/j.abb.2004.10.012.
Genes Dev., 28, 708-722, doi: 10.1101/gad.238246.114.
25. Motohashi, H., and Yamamoto, M. (2004) Nrf2-
37. Chowdhry, S., Zhang, Y., McMahon, M., Suther-
Keap1 defines a physiologically important stress
land, C., Cuadrado, A., and Hayes, J. D. (2013) Nrf2
response mechanism, Trends Mol. Med., 10, 549-557,
is controlled by two distinct β-TrCP recognition motifs
doi: 10.1016/j.molmed.2004.09.003.
in its Neh6 domain, one of which can be modulated by
26. Kwak, M.-K., Itoh, K., Yamamoto, M., and Kensler, T. W.
GSK-3 activity, Oncogene, 32, 3765-3781, doi: 10.1038/
(2002) Enhanced expression of the transcription
onc.2012.388.
factor Nrf2 by cancer chemopreventive agents: role
38. Purdom-Dickinson, S. E., Sheveleva, E. V., Sun, H.,
of antioxidant response element-like sequences in
and Chen, Q. M. (2007) Translational control of
the nrf2 promoter, Mol. Cell. Biol., 22, 2883-2892,
nrf2 protein in activation of antioxidant response by
doi: 10.1128/mcb.22.9.2883-2892.2002.
oxidants, Mol. Pharmacol., 72, 1074-1081, doi: 10.1124/
27. Xie, L., Gu, Y., Wen, M., Zhao, S., Wang, W.,
mol.107.035360.
Ma, Y., et al. (2016) Hydrogen sulfide induces Keap1
39. Shang, G., Tang, X., Gao, P., Guo, F., Liu, H.,
S-sulfhydration and suppresses diabetes-accelerated
Zhao, Z., et al. (2015) Sulforaphane attenuation of
atherosclerosis via Nrf2 activation, Diabetes,
65,
experimental diabetic nephropathy involves GSK-3
3171-3184, doi: 10.2337/db16-0020.
beta/Fyn/Nrf2 signaling pathway, J. Nutr. Biochem.,
28. Jiang, T., Harder, B., Rojo de la Vega, M., Wong,
26, 596-606, doi: 10.1016/j.jnutbio.2014.12.008.
P. K., Chapman, E., and Zhang, D. D. (2015) p62
40. Culbreth, M., Zhang, Z., and Aschner, M. (2017)
links autophagy and Nrf2 signaling, Free Radic. Biol.
Methylmercury augments Nrf2 activity by downregu-
Med.,
88,
199-204, doi:
10.1016/j.freeradbiomed.
lation of the Src family kinase Fyn, Neurotoxicology,
2015.06.014.
62, 200-206, doi: 10.1016/j.neuro.2017.07.028.
БИОХИМИЯ том 87 вып. 12 2022
1852
ЗИНОВКИН и др.
41. Li, W., Thakor, N., Xu, E. Y., Huang, Y., Chen, C.,
effect of Exendin-4 against angiotensin II-induced
Yu, R., et al. (2010) An internal ribosomal entry site
vascular smooth muscle cell senescence, Am. J.
mediates redox-sensitive translation of Nrf2, Nucleic
Physiol. Cell Physiol., 311, C572-C582, doi: 10.1152/
Acids Res., 38, 778-788, doi: 10.1093/nar/gkp1048.
ajpcell.00093.2016.
42. Lee, S. C., Zhang, J., Strom, J., Yang, D., Dinh, T. N.,
54. Romero, A., San Hipólito-Luengo, Á., Villalobos, L. A.,
Kappeler, K., et al. (2017) G-quadruplex in the NRF2
Vallejo, S., Valencia, I., Michalska, P., et al. (2019)
mRNA 5′ untranslated region regulates de novo NRF2
The angiotensin-(1-7)/Mas receptor axis protects from
protein translation under oxidative stress, Mol. Cell.
endothelial cell senescence via klotho and Nrf2 acti-
Biol., 37, e00122-16, doi: 10.1128/MCB.00122-16.
vation, Aging Cell, 18, e12913, doi: 10.1111/acel.12913.
43. Kumari, R., and Jat, P. (2021) Mechanisms of cellular
55. Wang, Z., Chen, Z., Jiang, Z., Luo, P., Liu, L., Huang,
senescence: cell cycle arrest and senescence associated
Y., et al. (2019) Cordycepin prevents radiation ulcer
secretory phenotype, Front. Cell Dev. Biol., 9, 645593,
by inhibiting cell senescence via NRF2 and AMPK
doi: 10.3389/fcell.2021.645593.
in rodents, Nat. Commun., 10, 2538, doi: 10.1038/
44. Rodier, F., Coppé, J.-P., Patil, C. K., Hoeijmakers,
s41467-019-10386-8.
W. A. M., Muñoz, D. P., Raza, S. R., et al. (2009)
56. Chen, L., Yang, R., Qiao, W., Zhang, W., Chen, J.,
Persistent DNA damage signalling triggers senescence-
Mao, L., et al. (2019) 1,25-Dihydroxyvitamin D exerts
associated inflammatory cytokine secretion, Nat. Cell
an antiaging role by activation of Nrf2-antioxidant
Biol., 11, 973-979, doi: 10.1038/ncb1909.
signaling and inactivation of p16/p53-senescence
45. Coppé, J.-P., Patil, C. K., Rodier, F., Sun, Y.,
signaling, Aging Cell,
18, e12951, doi:
10.1111/
Muñoz, D. P., Goldstein, J., et al. (2008) Senescence-
acel.12951.
associated secretory phenotypes reveal cell-
57. Lu, D., Le, Y., Ding, J., Dou, X., Mao, W., and Zhu, J.
nonautonomous functions of oncogenic RAS and
(2021) CLIC1 Inhibition protects against cellular
the p53 tumor suppressor, PLoS Biol., 6, 2853-2868,
senescence and endothelial dysfunction via the Nrf2/
doi: 10.1371/journal.pbio.0060301.
HO-1 pathway, Cell Biochem. Biophys., 79, 239-252,
46. Birch, J., and Gil, J. (2020) Senescence and the SASP:
doi: 10.1007/s12013-020-00959-6.
many therapeutic avenues, Genes Dev., 34, 1565-1576,
58. Kovac, S., Angelova, P. R., Holmström, K. M., Zhang,
doi: 10.1101/gad.343129.120.
Y., Dinkova-Kostova, A. T., and Abramov, A. Y. (2015)
47. Cai, Y., Zhou, H., Zhu, Y., Sun, Q., Ji, Y., Xue, A.,
Nrf2 regulates ROS production by mitochondria and
et al.
(2020) Elimination of senescent cells by
NADPH oxidase, Biochim. Biophys. Acta, 1850, 794-
β-galactosidase-targeted prodrug attenuates inflam-
801, doi: 10.1016/j.bbagen.2014.11.021.
mation and restores physical function in aged mice,
59. Suh, J. H., Shenvi, S. V., Dixon, B. M., Liu, H.,
Cell Res., 30, 574-589, doi: 10.1038/s41422-020-0314-9.
Jaiswal, A. K., Liu, R.-M., et al. (2004) Decline in
48. Yuan, H., Xu, Y., Luo, Y., Wang, N.-X., and Xiao, J.-H.
transcriptional activity of Nrf2 causes age-related loss
(2021) Role of Nrf2 in cell senescence regulation,
of glutathione synthesis, which is reversible with lipoic
Mol. Cell. Biochem., 476, 247-259, doi: 10.1007/
acid, Proc. Natl. Acad. Sci. USA, 101, 3381-3386,
s11010-020-03901-9.
doi: 10.1073/pnas.0400282101.
49. Kapeta, S., Chondrogianni, N., and Gonos, E. S.
60. Matsumaru, D., and Motohashi, H.
(2021) The
(2010) Nuclear erythroid factor 2-mediated protea-
KEAP1-NRF2 system in healthy aging and longevity, Anti-
some activation delays senescence in human fibro-
oxidants (Basel), 10, 1929, doi: 10.3390/antiox10121929.
blasts, J. Biol. Chem., 285, 8171-8184, doi: 10.1074/
61. Safdar, A., deBeer, J., and Tarnopolsky, M. A. (2010)
jbc.M109.031575.
Dysfunctional Nrf2-Keap1 redox signaling in skeletal
50. Volonte, D., Liu, Z., Musille, P. M., Stoppani, E.,
muscle of the sedentary old, Free Radic. Biol. Med., 49,
Wakabayashi, N., Di, Y.-P., et al. (2013) Inhibition
1487-1493, doi: 10.1016/j.freeradbiomed.2010.08.010.
of nuclear factor-erythroid 2-related factor (Nrf2)
62. Gounder, S. S., Kannan, S., Devadoss, D., Miller,
by caveolin-1 promotes stress-induced premature
C. J., Whitehead, K. J., Odelberg, S. J., et al. (2012)
senescence, Mol. Biol. Cell,
24,
1852-1862,
Impaired transcriptional activity of Nrf2 in age-related
doi: 10.1091/mbc.E12-09-0666.
myocardial oxidative stress is reversible by moderate
51. Hiebert, P., Wietecha, M. S., Cangkrama, M., Haertel, E.,
exercise training, PLoS One, 7, e45697, doi: 10.1371/
Mavrogonatou, E., Stumpe, M., et al. (2018) Nrf2-
journal.pone.0045697.
mediated fibroblast reprogramming drives cellular
63. Duan, W., Zhang, R., Guo, Y., Jiang, Y., Huang, Y.,
senescence by targeting the matrisome, Dev. Cell, 46,
Jiang, H., et al. (2009) Nrf2 activity is lost in the
145-161.e10, doi: 10.1016/j.devcel.2018.06.012
spinal cord and its astrocytes of aged mice, In vitro
52. Wu, S., Lu, H., and Bai, Y. (2019) Nrf2 in cancers:
Cell Dev. Biol. Anim., 45, 388-397, doi: 10.1007/
a double-edged sword, Cancer Med., 8, 2252-2267,
s11626-009-9194-5.
doi: 10.1002/cam4.2101.
64. Ungvari, Z., Bailey-Downs, L., Sosnowska, D.,
53. Zhou, T., Zhang, M., Zhao, L., Li, A., and Qin, X.
Gautam, T., Koncz, P., Losonczy, G., et al. (2011)
(2016) Activation of Nrf2 contributes to the protective
Vascular oxidative stress in aging: a homeostatic failure
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1853
due to dysregulation of NRF2-mediated antioxidant
exacerbates age-related contractile dysfunction and
response, Am. J. Physiol. Heart Circ. Physiol., 301,
loss of skeletal muscle mass, Redox Biol., 17, 47-58,
H363-H372, doi: 10.1152/ajpheart.01134.2010.
doi: 10.1016/j.redox.2018.04.004.
65. Baek, M.-K., Lee, H., Kim, K.-O., Kwon, H.-J.,
76. Kitaoka, Y., Tamura, Y., Takahashi, K., Takeda, K.,
Chung, M.-H., Park, H.-M., et al. (2017) Age-related
Takemasa, T., and Hatta, H. (2019) Effects of Nrf2
changes in nuclear factor erythroid 2-related factor
deficiency on mitochondrial oxidative stress in aged
2 and reactive oxygen species and mitochondrial
skeletal muscle, Physiol. Rep., 7, e13998, doi: 10.14814/
structure in the tongues of Fischer 344 rats, Clin.
phy2.13998.
Exp. Otorhinolaryngol., 10, 357-362, doi: 10.21053/
77. Zhao, Z., Chen, Y., Wang, J., Sternberg, P., Freeman,
ceo.2016.01095.
M. L., Grossniklaus, H. E., et al. (2011) Age-related
66. Shih, P.-H., and Yen, G.-C.
(2007) Differential
retinopathy in NRF2-deficient mice, PLoS One, 6,
expressions of antioxidant status in aging rats: the role
e19456, doi: 10.1371/journal.pone.0019456.
of transcriptional factor Nrf2 and MAPK signaling
78. Hoshino, T., Tabuchi, K., Nishimura, B., Tanaka, S.,
pathway, Biogerontology,
8,
71-80, doi:
10.1007/
Nakayama, M., Ishii, T., et al. (2011) Protective role
s10522-006-9033-y.
of Nrf2 in age-related hearing loss and gentamicin
67. Zhou, L., Zhang, H., Davies, K. J. A., and Forman, H. J.
ototoxicity, Biochem. Biophys. Res. Commun., 415, 94-
(2018) Aging-related decline in the induction of
98, doi: 10.1016/j.bbrc.2011.10.019.
Nrf2-regulated antioxidant genes in human bronchial
79. Yoh, K., Itoh, K., Enomoto, A., Hirayama, A.,
epithelial cells, Redox Biol., 14, 35-40, doi: 10.1016/
Yamaguchi, N., Kobayashi, M., et al. (2001) Nrf2-
j.redox.2017.08.014.
deficient female mice develop lupus-like autoimmune
68. Ungvari, Z., Bailey-Downs, L., Gautam, T., Sos-
nephritis, Kidney Int., 60, 1343-1353, doi: 10.1046/
nowska, D., Wang, M., Monticone, R. E., et al. (2011)
j.1523-1755.2001.00939.x.
Age-associated vascular oxidative stress, Nrf2 dysfunc-
80. Han, K., Jin, X., Guo, X., Cao, G., Tian, S.,
tion, and NF-{kappa}B activation in the nonhuman
Song, Y., et al. (2021) Nrf2 knockout altered brain
primate Macaca mulatta, J. Gerontol. A Biol. Sci. Med.
iron deposition and mitigated age-related motor
Sci., 66, 866-875, doi: 10.1093/gerona/glr092.
dysfunction in aging mice, Free Radic. Biol. Med., 162,
69. Li, M., Liu, R.-M., Timblin, C. R., Meyer, S. G.,
592-602, doi: 10.1016/j.freeradbiomed.2020.11.019.
Mossman, B. T., and Fukagawa, N. K. (2006) Age
81. He, F., Antonucci, L., Yamachika, S., Zhang, Z., Tan-
affects ERK1/2 and NRF2 signaling in the regulation
iguchi, K., Umemura, A., et al. (2020) NRF2 activates
of GCLC expression, J. Cell Physiol., 206, 518-525,
growth factor genes and downstream AKT signaling to
doi: 10.1002/jcp.20496.
induce mouse and human hepatomegaly, J. Hepatol.,
70. Lewis, K. N., Wason, E., Edrey, Y. H., Kristan, D. M.,
72, 1182-1195, doi: 10.1016/j.jhep.2020.01.023.
Nevo, E., and Buffenstein, R. (2015) Regulation of
82. Strong, R., Miller, R. A., Antebi, A., Astle, C. M.,
Nrf2 signaling and longevity in naturally long-lived
Bogue, M., Denzel, M. S., et al. (2016) Longer
rodents, Proc. Natl. Acad. Sci. USA, 112, 3722-3727,
lifespan in male mice treated with a weakly estrogenic
doi: 10.1073/pnas.1417566112.
agonist, an antioxidant, an α-glucosidase inhibitor or
71. Castiglione, G. M., Xu, Z., Zhou, L., and Duh, E. J.
a Nrf2-inducer, Aging Cell, 15, 872-884, doi: 10.1111/
(2020) Adaptation of the master antioxidant response
acel.12496.
connects metabolism, lifespan and feather develop-
83. Selvarani, R., Mohammed, S., and Richardson, A.
ment pathways in birds, Nat. Commun., 11, 2476,
(2021) Effect of rapamycin on aging and age-related
doi: 10.1038/s41467-020-16129-4.
diseases - past and future, GeroScience, 43, 1135-1158,
72. Jones, O. R., Scheuerlein, A., Salguero-Gómez, R.,
doi: 10.1007/s11357-020-00274-1.
Camarda, C. G., Schaible, R., Casper, B. B., et al.
84. Wang, R., Yu, Z., Sunchu, B., Shoaf, J., Dang, I.,
(2014) Diversity of ageing across the tree of life,
Zhao, S., et al. (2017) Rapamycin inhibits the secretory
Nature, 505, 169-173, doi: 10.1038/nature12789.
phenotype of senescent cells by a Nrf2-independent
73. Charmantier, A., Perrins, C., McCleery, R. H., and
mechanism, Aging Cell, 16, 564-574, doi: 10.1111/
Sheldon, B. C. (2006) Quantitative genetics of age at
acel.12587.
reproduction in wild swans: support for antagonistic
85. Mohammed, I., Hollenberg, M. D., Ding, H., and
pleiotropy models of senescence, Proc. Natl. Acad. Sci.
Triggle, C. R. (2021) A critical review of the evidence
USA, 103, 6587-6592, doi: 10.1073/pnas.0511123103.
that metformin is a putative anti-aging drug that en-
74. Fulop, G. A., Kiss, T., Tarantini, S., Balasubramanian,
hances healthspan and extends lifespan, Front. Endo-
P., Yabluchanskiy, A., Farkas, E., et al. (2018) Nrf2
crinol., 12, 718942, doi: 10.3389/fendo.2021.718942.
deficiency in aged mice exacerbates cellular senescence
86. Onken, B., and Driscoll, M. (2010) Metformin induces
promoting cerebrovascular inflammation, Geroscience,
a dietary restriction-like state and the oxidative stress
40, 513-521, doi: 10.1007/s11357-018-0047-6.
response to extend C. elegans healthspan via AMPK,
75. Ahn, B., Pharaoh, G., Premkumar, P., Huseman, K.,
LKB1, and SKN-1, PLoS One, 5, e8758, doi: 10.1371/
Ranjit, R., Kinter, M., et al. (2018) Nrf2 deficiency
journal.pone.0008758.
БИОХИМИЯ том 87 вып. 12 2022
1854
ЗИНОВКИН и др.
87. Allard, J. S., Perez, E. J., Fukui, K., Carpenter, P.,
ed antioxidant SkQ1, Aging, 9, 315-339, doi: 10.18632/
Ingram, D. K., and de Cabo, R. (2016) Prolonged
aging.101174.
metformin treatment leads to reduced transcription of
98. Lei, Y., Guerra Martinez, C., Torres-Odio, S., Bell, S. L.,
Nrf2 and neurotrophic factors without cognitive im-
Birdwell, C. E., Bryant, J. D., et al. (2021) Elevat-
pairment in older C57BL/6J mice, Behav. Brain Res.,
ed type I interferon responses potentiate metabol-
301, 1-9, doi: 10.1016/j.bbr.2015.12.012.
ic dysfunction, inflammation, and accelerated aging
88. Wakabayashi, N., Itoh, K., Wakabayashi, J.,
in mtDNA mutator mice, Sci. Adv., 7, doi: 10.1126/
Motohashi, H., Noda, S., Takahashi, S., et al. (2003)
sciadv.abe7548.
Keap1-null mutation leads to postnatal lethality due to
99. Skulachev, V. P., Holtze, S., Vyssokikh, M. Y.,
constitutive Nrf2 activation, Nat. Genet., 35, 238-245,
Bakeeva, L. E., Skulachev, M. V., Markov, A. V., et al.
doi: 10.1038/ng1248.
(2017) Neoteny, prolongation of youth: from naked
89. Oishi, T., Matsumaru, D., Ota, N., Kitamura, H.,
mole rats to “naked apes” (humans), Physiol. Rev., 97,
Zhang, T., Honkura, Y., et al. (2020) Activation
699-720, doi: 10.1152/physrev.00040.2015.
of the NRF2 pathway in Keap1-knockdown mice
100. Lewis, K. N., Mele, J., Hornsby, P. J., and Buffenstein, R.
attenuates progression of age-related hearing
(2012) Stress resistance in the naked mole-rat: the bare
loss, NPJ Aging Mech. Dis., 6, 14, doi: 10.1038/
essentials - a mini-review, Gerontology, 58, 453-462,
s41514-020-00053-4.
doi: 10.1159/000335966.
90. Wati, S. M., Matsumaru, D., and Motohashi, H.
101. Bruns, D. R., Drake, J. C., Biela, L. M., Peelor, F. F.,
(2020) NRF2 pathway activation by KEAP1 inhibition
Miller, B. F., and Hamilton, K. L. (2015) Nrf2
attenuates the manifestation of aging phenotypes in
signaling and the slowed aging phenotype: evidence
salivary glands, Redox Biol., 36, 101603, doi: 10.1016/
from long-lived models, Oxid. Med. Cell. Longev.,
j.redox.2020.101603.
2015, 732596, doi: 10.1155/2015/732596.
91. Taguchi, K., Maher, J. M., Suzuki, T., Kawatani, Y.,
102. Pearson, K. J., Lewis, K. N., Price, N. L., Chang, J. W.,
Motohashi, H., and Yamamoto, M. (2010) Genetic
Perez, E., Cascajo, M. V., et al. (2008) Nrf2 mediates
analysis of cytoprotective functions supported by
cancer protection but not prolongevity induced by
graded expression of Keap1, Mol. Cell. Biol., 30, 3016-
caloric restriction, Proc. Natl. Acad. Sci. USA, 105,
3026, doi: 10.1128/MCB.01591-09.
2325-2330, doi: 10.1073/pnas.0712162105.
92. Lee, D.-F., Kuo, H.-P., Liu, M., Chou, C.-K.,
103. Davinelli, S., Willcox, D. C., and Scapagnini, G.
Xia, W., Du, Y., et al. (2009) KEAP1 E3 ligase-
(2012) Extending healthy ageing: nutrient sensitive
mediated downregulation of NF-κB signaling by
pathway and centenarian population, Immun. Ageing,
targeting IKKβ, Mol. Cell, 36, 131-140, doi: 10.1016/
9, 9, doi: 10.1186/1742-4933-9-9.
j.molcel.2009.07.025.
104. Rojo, A. I., Pajares, M., Rada, P., Nuñez, A.,
93. Mulvaney, K. M., Matson, J. P., Siesser, P. F., Tamir,
Nevado-Holgado, A. J., Killik, R., et al.
(2017)
T. Y., Goldfarb, D., Jacobs, T. M., et al.
(2016)
NRF2 deficiency replicates transcriptomic changes
Identification and characterization of MCM3 as a
in Alzheimer’s patients and worsens APP and TAU
Kelch-like ECH-associated protein 1 (KEAP1) sub-
pathology, Redox Biol., 13, 444-451, doi: 10.1016/
strate, J. Biol. Chem., 291, 23719-23733, doi: 10.1074/
j.redox.2017.07.006.
jbc.M116.729418.
105. Haustead, D. J., Stevenson, A., Saxena, V., Marriage, F.,
94. Singh, S. P., Niemczyk, M., Saini, D., Sadovov, V.,
Firth, M., Silla, R., et al. (2016) Transcriptome
Zimniak, L., and Zimniak, P. (2010) Disruption of the
analysis of human ageing in male skin shows mid-life
mGsta4 gene increases life span of C57BL mice,
period of variability and central role of NF-κB, Sci.
J. Gerontol. A Biol. Sci. Med. Sci., 65, 14-23, doi: 10.1093/
Rep., 6, 26846, doi: 10.1038/srep26846.
gerona/glp165.
106. Alfego, D., Rodeck, U., and Kriete, A. (2018) Global
95. Trifunovic, A., Wredenberg, A., Falkenberg, M.,
mapping of transcription factor motifs in human
Spelbrink, J. N., Rovio, A. T., Bruder, C. E., et al.
aging, PLoS One, 13, e0190457, doi: 10.1371/journal.
(2004) Premature ageing in mice expressing defective
pone.0190457.
mitochondrial DNA polymerase, Nature, 429, 417-
107. Stegeman, R., and Weake, V. M. (2017) Transcriptional
423, doi: 10.1038/nature02517.
signatures of aging, J. Mol. Biol., 429, 2427-2437,
96. Kujoth, G. C., Hiona, A., Pugh, T. D., Someya, S.,
doi: 10.1016/j.jmb.2017.06.019.
Panzer, K., Wohlgemuth, S. E., et al. (2005) Mitochon-
108. Benayoun, B. A., Pollina, E. A., Singh, P. P.,
drial DNA mutations, oxidative stress, and apoptosis in
Mahmoudi, S., Harel, I., Casey, K. M., et al. (2019)
mammalian aging, Science, 309, 481-484, doi: 10.1126/
Remodeling of epigenome and transcriptome
science.1112125.
landscapes with aging in mice reveals widespread
97. Shabalina, I. G., Vyssokikh, M. Y., Gibanova, N., Csi-
induction of inflammatory responses, Genome Res.,
kasz, R. I., Edgar, D., Hallden-Waldemarson, A., et al.
29, 697-709, doi: 10.1101/gr.240093.118.
(2017) Improved health-span and lifespan in mtDNA
109. Johnson, A. A., Shokhirev, M. N., Wyss-Coray, T.,
mutator mice treated with the mitochondrially target-
and Lehallier, B. (2020) Systematic review and analysis
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И СТАРЕНИЕ МЛЕКОПИТАЮЩИХ
1855
of human proteomics aging studies unveils a novel
aging clocks: challenges and recommendations, Genome
proteomic aging clock and identifies key processes
Biol., 20, 249, doi: 10.1186/s13059-019-1824-y.
that change with age, Ageing Res. Rev., 60, 101070,
112. Dinkova-Kostova, A. T., Fahey, J. W., Kostov, R. V.,
doi: 10.1016/j.arr.2020.101070.
and Kensler, T. W. (2017) KEAP1 and done? Targeting
110. Horvath, S. (2013) DNA methylation age of human
the NRF2 pathway with sulforaphane, Trends Food Sci.
tissues and cell types, Genome Biol.,
14,
3156,
Technol., 69, 257-269, doi: 10.1016/j.tifs.2017.02.002.
doi: 10.1186/gb-2013-14-10-r115.
113. Taguchi, K., and Kensler, T. W. (2020) Nrf2 in
111. Bell, C. G., Lowe, R., Adams, P. D., Baccarelli, A.
liver toxicology, Arch. Pharm. Res., 43, 337-349,
A., Beck, S., Bell, J. T., et al. (2019) DNA methylation
doi: 10.1007/s12272-019-01192-3.
DOES Nrf2 APPEAR TO BE A MASTER REGULATOR
OF MAMMALIAN AGING?
Review
R. A. Zinovkin1,2*, N. D. Kondratenko1,2,3, and L. A. Zinovkina3
1 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E-mail: roman.zinovkin@gmail.com
2 Russian Clinical Research Center for Gerontology of the Ministry of Healthcare of the Russian Federation,
Pirogov Russian National Research Medical University, 129226, Moscow, Russia
3 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, Moscow 119991, Russia
For a long time Nrf2 transcription factor has been keeping close attention of aging phenomenon researchers.
Numerous studies have investigated Nrf2 effects on the aging and cell senescence. Nrf2 is often ascribed to have
a central role in aging processes, however this thesis needs to be proven. It should be noted, that most studies
were carried out on invertebrate model organisms, such as nematodes and fruit flies, but not on mammals.
This paper briefly overviews main mechanisms of mammalian aging and role of inflammation and oxidative
stress in this process. The mechanisms of Nrf2 activity regulation, its involvement in aging and development of
senescence-associated secretory phenotype (SASP) are also discussed. The main part of this review is devoted
to critical analysis of experimental data on the role of Nrf2 in mammalian aging.
Keywords: transcription factor Nrf2, aging, inflammation, oxidative stress, aging theories, age-related changes
БИОХИМИЯ том 87 вып. 12 2022