БИОХИМИЯ, 2022, том 87, вып. 12, с. 1856 - 1867
УДК 577.71: 576.385:575.113: 612.67: 575.1
ТРАНСКРИПЦИОННЫЙ ФАКТОР Nrf2 И МИТОХОНДРИИ -
ДРУЗЬЯ ИЛИ ПРОТИВНИКИ В РЕДОКС-РЕГУЛЯЦИИ
ТЕМПОВ СТАРЕНИЯ
Обзор
© 2022 Г.А. Шиловский1,2,3*, В.В. Ашапкин1
1 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119992 Москва, Россия; электронная почта: gregory_sh@list.ru, grgerontol@gmail.com
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
3 Институт проблем передачи информации РАН, 127051 Москва, Россия
Поступила в редакцию 17.10.2022
После доработки 24.11.2022
Принята к публикации 25.11.2022
На первый взгляд, главный регулятор активности антиоксидантных систем клетки, транскрипци-
онный фактор Nrf2, и главный источник активных форм кислорода, митохондрии, должны играть
противоположные роли в определении темпов старения. Однако, так же как причины старения да-
леко не исчерпываются окислительным стрессом, роль Nrf2 не исчерпывается регуляцией активно-
сти антиоксидантных систем, и тем более роль митохондрий не исчерпывается генерацией АФК.
В данном обзоре мы постарались рассмотреть лишь один из частных аспектов этой проблемы - мо-
лекулярные механизмы взаимодействия Nrf2 и митохондрий, так или иначе влияющие на темпы
старения и продолжительность жизни. Накопившиеся к сегодняшнему дню экспериментальные
данные показывают, что активность Nrf2 положительно связана с митохондриальной динамикой
и контролем качества митохондрий. Nrf2 может влиять на работу митохондрий разными способа-
ми: регулируя продукцию закодированных в ядерном геноме митохондриальных белков или изме-
няя баланс АФК и других существенных для функционирования митохондрий метаболитов. В свою
очередь, многие регуляторные белки, функционально связанные с митохондриями, влияют также
и на активность системы Nrf2 и даже образуют с ней взаимные регуляторные петли. Есть все осно-
вания полагать, что существование таких регуляторных петель связано с тонкой настройкой редокс-
систем клетки, а возможно, и метаболизма в целом. Долгое время считалось, что все регуляторные
сигналы митохондрий связаны с белками, закодированными в ядре, в то время как роль митохон-
дриального генома сводится к кодированию небольшого числа структурных белков респираторной
цепи и двух рибосомных РНК. Относительно недавно обнаружены и исследованы закодированные
в митохондриальном геноме пептиды, играющие роль митохондриально генерируемых сигналов.
Мы рассмотрим данные о молекулярных механизмах их взаимодействия с ядерными регуляторны-
ми системами, в первую очередь Nrf2, и возможной роли в определении темпов старения. Меха-
низмы взаимодействия регуляторных каскадов, связывающих программы поддержания гомеоста-
за и ответа клетки на окислительный стресс, являются существенной частью программ старения
и антистарения, а их понимание способствует поиску перспективных молекулярных мишеней для
борьбы с болезнями преклонного возраста и старением в целом.
КЛЮЧЕВЫЕ СЛОВА: Nrf2, митохондрия, старение, продолжительность жизни, окислительный стресс,
возрастные нарушения, антиоксиданты.
DOI: 10.31857/S0320972522120065, EDN: NGGKHI
Принятые сокращения: АФК - активные формы кислорода; ТФ - транскрипционный фактор; ARE - антиокси-
дант-респонс(ив)ный элемент (antioxidant response element); GSK3β - киназа гликогенсинтазы 3β; Hmox1 - гемокси-
геназа1; Keap1 - Kelch-подобный ECH-ассоциированный белок 1 (Kelch-like ECH-associated protein 1); MOTS-c -
mitochondrial open reading frame of the twelve S rRNA type-c; Nrf2 - ТФ 2 семейства NFE (nuclear factor erythroid 2-related
factor 2); SOD - супероксиддисмутаза.
* Адресат для корреспонденции.
1856
Nrf2 И МИТОХОНДРИИ
1857
ВВЕДЕНИЕ
точном пространстве [12]. Гены-мишени Nrf2
с цис-элементами антиоксидантного ответа
К внутренним факторам, определяющим
(ARE), которые кодируют белки, относящие-
темпы старения и форму кривых выживания
ся к митохондриям, включают, среди прочих,
(pace and shape of aging), относятся программы
тиоредоксин, глюкозо-6-фосфат-дегидрогена-
старения и антистарения, представляющие
зу, глутатион-S-трансферазу, NAD(P)H:хинон-
собой, по современным представлениям, со-
оксидоредуктазу 1 (Nqo1) и гемоксигеназу 1
вокупность сигнальных генных каскадов [1].
(Hmox1) [13]. Эти белки относятся к системам
Поддержание гомеостаза зависит от множе-
антиоксидантной защиты, регенерации NADH
ства взаимозависимых реакций, и его эффек-
и метаболизма железа. Таким образом, суще-
тивность ухудшается с возрастом [1-7]. Пред-
ствует тесная связь между Nrf2 и гомеостазом
полагается, что ядерный и митохондриальный
митохондриальных АФК [14].
геномы эволюционировали совместно и ко-
Старение имеет сложную природу, и его
дируют факторы взаимной регуляции, обра-
темпы зависят от многих факторов. Однако
зуя генетически детерминированную систему
митохондрии и система антиоксидантной за-
двунаправленной коммуникации. Со времён
щиты Nrf2 являются важными «игроками» в
D. Harman митохондрии считаются машиной,
регуляции этого процесса. В обзоре рассмо-
вызывающей клеточную гибель и в значитель-
трены пути их взаимного влияния в редокс-
ной степени определяющей продолжитель-
опосредованной регуляции темпов старения.
ность жизни (ПЖ) и скорость старения орга-
низма [8-10].
Nrf2 (nuclear factor erythroid 2-related fac-
РЕГУЛЯТОРНЫЕ ПЕРЕКРЁСТНЫЕ
tor 2) является ключевым транскрипционным
ВЛИЯНИЯ МЕЖДУ ТФ Nrf2
фактором (ТФ) поддержания редокс-баланса
И МИТОХОНДРИЯМИ
клеток и играет центральную роль в снижении
внутриклеточного окислительного стресса,
Регуляторные перекрёстные влияния меж-
замедлении старения и предотвращении воз-
ду ТФ Nrf2 и митохондриями играют важную
растных заболеваний [1, 2, 11]. Nrf2 является
роль в клеточной биоэнергетике, биосинтезе и
одним из главных регуляторов клеточного го-
апоптозе. Для поддержания гомеостаза и кон-
меостаза. Он контролирует экспрессию бо-
троля качества митохондрий митохондриаль-
лее 200 генов человека, связанных с реакция-
ная морфология быстро изменяется в ответ на
ми биотрансформации, редокс-гомеостазом,
внешние воздействия и изменения метаболи-
энергетическим метаболизмом, репарацией
ческого статуса посредством слияния и деления
ДНК и протеостазом, которые в совокупности
(так называемая митохондриальная динамика),
представляют собой мощную защитную систе-
а повреждённые митохондрии удаляются по-
му клетки [1, 2].
средством митофагии. Хотя митохондрии яв-
Для борьбы с генерируемыми активными
ляются одним из источников АФК, сами они
формами кислорода (АФК) клетки имеют эф-
также уязвимы для окислительного стресса.
фективную антиоксидантную систему, состоя-
Системы эндогенной антиоксидантной защи-
щую из ферментативных и неферментативных
ты играют важную роль в выживании клеток
антиоксидантов. Ферментативные антиокси-
в физиологических и патологических услови-
данты включают каталазу (CAT, находится в
ях. Так, в противоположность известному пути
основном в пероксисомах и в меньшей степени
ингибирования Nrf2 синовиолином (Hrd1)
в митохондриях), глутатионпероксидазу (GPX,
при стрессе эндоплазматического ретикулума
находится как в цитоплазме, так и в митохон-
(ЭР) [15], опосредуемая PERK активация Nrf2
дриях), глутатионредуктазу (GR, находится как
при стрессе ЭР защищает митохондрии, стаби-
в цитоплазме, так и в митохондриях), глутати-
лизируя динамику, метаболизм и контроль ка-
он-S-трансферазу (GST, находится в цитозоле),
чества митохондрий [16].
NAD(P)H-оксидазу (в мембране и цитозоле),
Баланс митохондриального деления/сли-
пероксиредоксины (в различных внутрикле-
яния, оборота (биогенез/митофагия), гоме-
точных компартментах) и супероксиддисмута-
остаз кальция и АФК важны для поддержа-
зы (SOD). Последние включают три изоформы:
ния нормального функционирования митохонд-
SOD1 [Cu-Zn-супероксиддисмутаза], располо-
рий [17]. При их нарушении митохондрии мо-
женную в митохондриях/межмембранном про-
гут стать дисфункциональными, производя
странстве и цитозоле, SOD2 (Mn-SOD), рас-
повышенное количество АФК и, соответствен-
положенную в митохондриальном матриксе, и
но, усиливая окислительный стресс, что мо-
SOD3 (Cu-ZnSOD), расположенную во внекле-
жет приводить к развитию патологий [17, 18].
7
БИОХИМИЯ том 87 вып. 12 2022
1858
ШИЛОВСКИЙ, АШАПКИН
АФК продуцируются в нескольких клеточных
митохондрий [36-38]. Гены ключевых факторов
компартментах, таких как клеточная мембра-
биогенеза митохондрий, NRF1 и TFAM, яв-
на, цитоплазма, ЭР, пероксисомы и аппарат
ляются прямыми мишенями Nrf2 [38]. Актив-
Гольджи, но основным их источником явля-
ность ключевого кофактора митохондриогене-
ются митохондрии [19, 20]. В зависимости от
за PGC-1α также стимулируется Nrf2; в свою
уровня продукции АФК митохондрии естест-
очередь, PGC-1α инактивирует GSK3β (киназу
венным образом влияют на активность Nrf2.
гликогенсинтазы 3β), индуцирующую проте-
В свою очередь, Nrf2, а также ТФ NRF1 (ядер-
осомную деградацию Nrf2. Следовательно, су-
ный респираторный фактор 1) и коактиваторы
ществуют положительная регуляторная петля
транскрипции PGC-1α и PGC-1β являются
между ТФ Nrf2 и фактором митохондриогенеза
ключевыми регуляторами митохондриально-
PGC-1α, играющая важную роль в поддержа-
го биогенеза (рисунок). Они участвуют в тран-
нии количества митохондрий и редокс-гомеос-
скрипции ядерных генов, кодирующих митохон-
таза. Взаимные регуляторные связи с Nrf2 опи-
дриальные белки и фактор транскрипции TFAM,
саны и для других митохондриальных белков,
контролирующий транскрипцию генов респи-
таких как DJ-1, PGAM5, фратаксин [38].
раторной цепи, закодированных в мтДНК [21].
Помимо митохондриального биогенеза и го-
Так как Nrf2 является ядерным фактором,
меостаза, Nrf2 также играет хорошо известную
чувствительным к АФК, его активность изме-
роль в поддержании клеточного редокс-гоме-
няется в зависимости от уровня АФК. Адап-
остаза, контролируя выработку АФК посредством
тация клетки к таким изменениям затрагивает
регулирования биосинтеза, использования и
различные клеточные функции, в том числе го-
регенерации глутатиона (GSH), тиоредоксина и
меостаз глюкозы и липидов [18]. Нокаут гена,
NADPH [39]. Активация Nrf2 индуцирует экс-
кодирующего белок Nrf2 (Nfe2l2), уменьшает
прессию митохондриальных антиоксидантных
потенциал митохондриальной мембраны и уро-
белков GR, GPX, тиоредоксинредуктазы 2, пе-
вень продукции ATP [22]. Ген разобщающего
роксиредоксина 3, пероксиредоксина 5 и SOD2,
белка UCP3 содержит ARE и является мишенью
противодействуя увеличению продукции АФК
Nrf2, который связывается с промотором UCP3
в ответ на окислительный стресс [25].
после воздействия H2O2. Это позволяет предпо-
Nrf2 также участвует в регуляции редокс-ак-
ложить, что UCP3-опосредованная утечка про-
тивности ионов металлов, в том числе в гоме-
тонов в ответ на H2O2 влияет на выживаемость
остазе железа [40, 41]. Окисление железа тес-
клеток [23]. Ген ядерного респираторного фак-
но взаимосвязано с транспортом кислорода,
тора NRF1 также содержит ARE и регулируется
потреблением и продукцией АФК [42]. Ген фер-
ТФ Nrf2. Показано, что при гиперактивации
рохелатазы, фермента, который осуществляет
Hmox1 в кардиомиоцитах происходит Nrf2-за-
последнюю стадию биосинтеза гема путём встра-
висимая стимуляция экспрессии гена NRF1 и
ивания двухвалентного железа в протопорфи-
митохондриального биогенеза [24].
рин, является прямой мишенью Nrf2 [43]. Экс-
От активности Nrf2 зависят многие аспек-
прессия генов, кодирующих обе цепи ферритина
ты митохондриальной физиологии и гомеоста-
и ферропортин, также регулируется Nrf2 [42].
за [25-27], такие как митохондриальная энерге-
Особую роль в координации ответов на
тика [28], биогенез митохондрий [29], окисле-
окислительный и другие стрессы между ядром
ние жирных кислот [30], дыхание [22], продук-
и митохондриями могут играть митохондриаль-
ция АТФ [31], мембранный потенциал [32],
ные пептиды. В мтДНК человека содержится
окислительно-восстановительный гомеостаз [33],
только 13 генов, кодирующих белки дыхатель-
структурная целостность и защита от окисли-
ной цепи, для которых не описано каких-либо
тельного стресса [34], подвижность и динами-
сигнальных функций. Долгое время считалось,
ка митохондрий [35]. Показано, что в условиях
что активные пути митонуклеарной комму-
стресса Nrf2 поддерживает качество и целост-
никации опосредуются исключительно фак-
ность митохондрий, стимулируя p62-зависи-
торами, закодированными в ядерном геноме.
мую митофагию: ген, кодирующий белок p62
Подавляющее большинство митохондриальных
(SQSTM1), является прямой мишенью Nrf2, а
белков кодируется ядерными генами, позво-
сам белок p62 конкурирует с Nrf2 за связыва-
ляя ядру практически полностью контролиро-
ние с белком-ингибитором Keap1 (Kelch-по-
вать биогенез, динамику и функцию митохон-
добный ECH-ассоциированный белок 1, Kelch-
дрий [44, 45]. Однако в последние несколько
like ECH-associated protein 1) [26]. Nrf2 может
лет активно исследуется регуляторная роль
влиять на активность митохондрий и косвен-
биоактивных пептидов митохондриального
ным образом, изменяя уровень метаболитов и
происхождения (mitochondrial-derived peptides,
антиоксидантов, существенных для функции
MDPs), закодированных в коротких открытых
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И МИТОХОНДРИИ
1859
рамках считывания (short open reading frames,
ется важным «митокином», то есть носителем
sORFs) в митохондриальном геноме [44]. В на-
митохондриальных сигналов, которые воз-
стоящее время описано восемь MDP: гуманин,
действуют на клетки разных органов подоб-
MOTS-c (mitochondrial open reading frame of the
ным гормону способом [61]. Он предотвра-
twelve S rRNA type-c) и шесть небольших гума-
щает ожирение и инсулинорезистентность,
ниноподобных пептидов SHLP1-SHLP6 (small
вызванные неправильным питанием, воз-
humanin-like peptides). Как ясно из названия,
вращает чувствительность мышц к инсулину
MOTS-c закодирован в 12S рРНК. Гуманин
у пожилых мышей, активирует AMPK в ске-
и SHLP1-6 закодированы в митохондриаль-
летных мышцах, улучшает физическую вы-
ной 16S рРНК. Гуманин имеет специфическое
носливость к бегу независимо от веса тела,
сродство к белку 3, связывающему инсулинопо-
влияя на энергетический метаболизм и по-
добный фактор роста (insulin-like growth factor
вышая адаптивный ответ на холодовой шок и
binding protein 3, IGFBP-3) [46], и к антиапоп-
вызванный упражнениями стресс в скелетных
тотическому фактору Bcl-2 [47]. Он был иден-
мышцах [61]. Показано, что MOTS-c обладает
тифицирован во фракции мозга при болезни
противовоспалительными и сосудопротектор-
Альцгеймера как защитный фактор против
ными свойствами, снижая экспрессию факто-
токсинов, таких как β-амилоид, характерных
ров воспаления (TNF-α, IL-6, IL-1β) [62, 63].
для этой патологии [48], и как важный фактор
Все эти эффекты MOTS-c частично зависят от
для нормальной сердечной функции [49]. Си-
SIRT1 и AMPK [44, 53] - двух важных взаимо-
стематическое применение митохондриальных
связанных факторов, которые регулируют ПЖ
пептидов в различных моделях метаболическо-
у различных модельных организмов [64, 65].
го стресса у грызунов обнаружило их благопри-
Примечательно, что, перемещаясь в ядро при
ятное действие [50].
клеточных стрессах, MOTS-c регулирует экс-
Существуют достаточно убедительные до-
прессию адаптивных генов путём взаимодей-
казательства положительного влияния мито-
ствия с другими стресс-зависимыми ТФ, в том
хондриальных пептидов на состояния, связан-
числе Nrf2 [44, 45, 61, 66]. Механизмы выбора
ные с заболеваниями преклонного возраста и
генов-мишеней MOTS-c мало изучены. Судя
возрастными нарушениями метаболизма. Уров-
по имеющимся данным, и транслокация в
ни гуманина, SHLP2 и MOTS-c снижаются с
ядро, и взаимодействие с промоторами ге-
возрастом, а их активность положительно кор-
нов-мишеней зависят от его взаимодействия с
релирует с долголетием [51-57]. Уровень гума-
ядерными белками [44]. Например, в экспери-
нина у мыши и человека отрицательно регу-
ментах по совместной иммуннопреципитации
лируется связанной со старением сигнальной
обнаружено физическое связывание MOTS-c с
осью GH/IGF [58]. У долгоживущих GH-дефи-
ТФ Nrf2. Тем не менее при действии индукто-
цитных мышей Ames уровень гуманина в крови
ров стресса Nrf2 и MOTS-c транслоцируются в
повышен, а у короткоживущих GH-трансген-
ядро независимо друг от друга [44]. Более того,
ных мышей, наоборот, снижен [58].
в тестах ретардации в электрофоретическом
MOTS-c действует как регулятор метабо-
геле обнаружено прямое связывание MOTS-c
лического гомеостаза, который может предот-
с последовательностями ДНК ARE-содержа-
вратить обусловленные диетой ожирение и
щих промоторных областей генов-мишеней
инсулинорезистентность, а также возрастную
Nrf2, таких как Hmox1, Nqo1, Ugt1A1, Ugt1A6,
инсулинорезистентность у мышей [53, 59, 60].
Txn, Ftl и Gpx2, а связывание Nrf2 с ARE-
Клетки HEK293, сверхэкспрессирующие MOTS-c,
содержащими промоторными участками значи-
устойчивы к метаболическому стрессу, вы-
тельно стимулируется в присутствии MOTS-c.
званному депривацией глюкозы и сыворот-
Однако сульфорафан (10 мкМ, 16 ч) вызы-
ки [44]. Показано, что в базовом состоянии
вал Nrf2-зависимую экспрессию Hmox1 даже
клеток лишь небольшая часть MOTS-c лока-
в условиях истощения MOTS-c актинони-
лизована в ядре, а при различных видах кле-
ном. Очевидно, MOTS-c - не единственный
точного стресса происходит быстрая индукция
кофактор Nrf2
[67]. Можно предположить,
его транслокации в ядро, сопровождающаяся
что, нарушая функционирование дыхатель-
изменениями в экспрессии генов [44, 61]. Ин-
ной цепи, актинонин приводит к повышен-
тересно, что уровень MOTS-c в митохондриях
ной генерации АФК и, как следствие, переме-
и цитоплазме при этом снижается. Складыва-
щению Nrf2 в ядро и увеличению экспрессии
ется впечатление, что этот митохондриальный
Hmox1 [68]. При ограничении глюкозы в клет-
пептид играет роль стресс-индуцированного
ках HEK293, трансфицированных суперэкс-
сигнала между клеточными компартментами.
прессирующим MOTS-c вектором, изменя-
MOTS-c присутствует в плазме крови и явля-
лась экспрессия 802 генов (у 412 подавлялась
БИОХИМИЯ том 87 вып. 12 2022
7*
1860
ШИЛОВСКИЙ, АШАПКИН
и у 390 повышалась) [44]. При этом часть генов,
Белок PGC-1α представляет собой коакти-
активируемых MOTS-c, совпадает с генами-
ватор ядерного рецептора PPAR-γ, контроли-
мишенями Nrf2. В промоторах генов, регули-
рующего развитие и метаболизм жировой ткани
руемых MOTS-c, также обнаружены мотивы
и мышц [73]. Вместе с Nrf2 PGC-1α коактиви-
активирующих факторов транскрипции 1 и 7
рует NRF1 и затем при фосфорилировании Akt
(ATF1, ATF7) и JUND, родственных Nrf2 и,
и инактивации GSK3β активирует митохон-
как известно, перекрёстно регулирующих гены с
дриальный фактор транскрипции A (TFAM),
ARE [69, 70]. И в этом случае гены-мишени ТФ
необходимый для поддержания нормальных
ATF1 и JUND частично совпадают с генами,
уровней мтДНК [74] (рисунок). Ещё один белок,
регулируемыми MOTS-c. Интересно, что пе-
кодируемый геном-мишенью Nrf2, Hmox1,
рекрывание между наборами генов-мишеней
стимулирует митохондриальный биогенез, ак-
Nrf2, ATF1 и JUND также неполное, хотя все
тивируя сигнальный каскад Akt-Nrf2-NRF1 в
они регулируют экспрессию генов через ARE.
сердце мыши [24]. Позже в той же лаборатории
Это указывает на сложный механизм отбора
показали, что митохондриальный биогенез
генов-мишеней такой регуляции.
связан с увеличением экспрессии двух про-
тивовоспалительных генов, IL10 и IL1Ra, по-
средством редокс-регуляции Hmox1/CO и Nrf2
МИТОХОНДРИАЛЬНЫЙ БИОГЕНЕЗ
в митохондриях клеток гепатомы человека
HepG2 и клетках печени in vivo [75]. PGC1-α не
Митохондриогенез - сложный строго регу-
только является основным регулятором мито-
лируемый процесс, требующий тесной коорди-
хондриального биогенеза, но также участвует
нации между митохондриальными и ядерными
в антиоксидантной защите, в том числе путём
ТФ [71]. Маркеры митохондриального биоге-
модуляции транскрипции гена SOD2 и уровня
неза включают соотношение мтДНК/яДНК
самой SOD2 [74]. Сверхэкспрессия PGC1-α в
(ядерной ДНК) и уровни экспрессии генов, ко-
клеточной линии HK-2 защищала клетки от
дирующих регуляторные белки митохондрий,
окислительного стресса, индуцированного пере-
такие как PGC-1α, TFAM, NRF1 и митохон-
кисью водорода [76]. С помощью нокаута гена,
дриальный фактор транскрипции B1 (TFB1M).
кодирующего белок Nrf2 (Nfe2l2), было пока-
Помимо экспрессии митохондриальных генов,
зано, что это цитопротекторное действие опо-
митохондриальный биогенез также требует
средовано Nrf2. Оно подавлялось ингибитором
синтеза нуклеотидов и фосфолипидов. Nrf2
p38; это позволило предположить, что в его ос-
способствует экспрессии генов, участвующих в
нове лежит активация Nrf2 путём инактивации
пентозофосфатном пути, синтезе нуклеотидов
его негативного регулятора GSK3β, которая, в
de novo и продукции NADPH, биосинтезе пури-
свою очередь, вызывается активацией p38 (ри-
нов и метаболизме глутамина путём активации
сунок). С другой стороны, уменьшение про-
передачи сигналов PI3K-Akt [72].
дукции Nrf2 с помощью siRNA снижает уровни
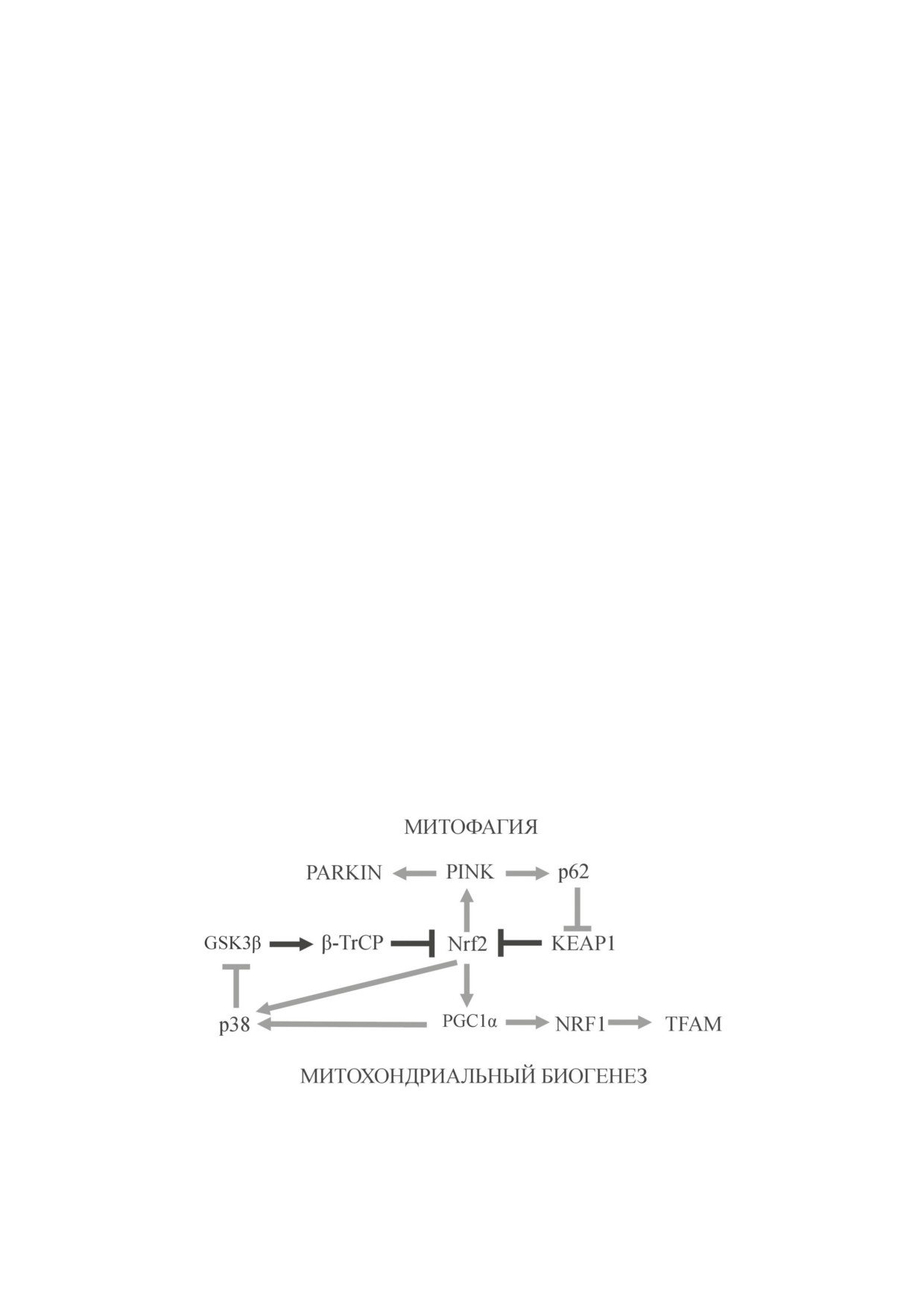
Nrf2 играет важную роль в митохондриальном и клеточном гомеостазе. Представлена упрощённая схема путей мито-
фагии и митохондриального биогенеза, опосредованных p62 и PGC1-α соответственно, при активации Nrf2, свиде-
тельствующая о существовании регуляторной петли, включающей p62, Keap1 и Nrf2 и коррелирующей с митофагией,
и другой регуляторной петли, включающей PGC1-α, p38, GSK3β и Nrf2 и связанной с митохондриальным биогенезом.
Стрелкой обозначено прямое стимулирующее воздействие, включая катализ; линией с тупым концом обозначено ин-
гибирующее активность Nrf2 действие
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И МИТОХОНДРИИ
1861
PGC1-α [77]. Повышенные уровни АФК, на-
счёт присутствующего в его молекуле сигнала
пример, при раке, могут приводить к ретроград-
митохондриальной локализации [88]. Нокда-
ной передаче сигналов через путь JNK-PGC1-α
ун Keap1 и/или PGAM5 повышает активность
с повышением фосфорилирования комплек-
Nrf2. Ингибитор PGAM5 - LFHP-1c усилива-
са II электрон-транспортной цепи и усилением
ет активацию Nrf2 при ишемическом инсульте
митохондриального биогенеза [78, 79]. Кроме
головного мозга, вызванном нарушением ге-
того, при нокдауне Nrf2 в клеточной линии рака
матоэнцефалического барьера [89].
толстой кишки человека блокируется индуци-
рованная гипоксией активация HIF-1α [80].
AMP-активируемая протеинкиназа (AMPK).
ЗАКЛЮЧЕНИЕ
AMPK является основным сенсором энергии
в эукариотических клетках, также известным
Старение связано с увеличением произ-
как хранитель метаболизма и митохондриаль-
водства АФК и повышенным окислительным
ного гомеостаза [81], участвующим в несколь-
стрессом с одновременным снижением актив-
ких важных митохондриальных процессах,
ности основных антиоксидантных систем, что
таких как митофагия, митохондриальная ди-
способствует развитию широкого спектра за-
намика и транскрипция, а также митохондри-
болеваний [90]. Возрастные изменения могут
альный биогенез. Она также влияет на цир-
приводить к нарушению уровня экспрессии
кадные ритмы путём фосфорилирования и
генов-мишеней Nrf2 (Nqo1, Ho-1, GCL) вслед-
дестабилизации белков CRY и PER. Известно,
ствие снижения общего уровня мРНК и бел-
например, что AMPK фосфорилирует и тем
ка Nrf2, уменьшения его содержания в ядре,
самым способствует деградации белка циркад-
ухудшения его связывания с ARE, негативной
ных биоритмов CRY1 [82]. С другой стороны,
регуляции экспрессии, опосредованной Nrf2
состав субъединиц AMPK, её субклеточная
(см. обзоры [91-93]). Так, возрастное сниже-
локализация и фосфорилирование субстра-
ние синтеза основного антиоксиданта клетки,
тов зависят от времени суток [83]. Показано,
глутатиона, может быть вызвано нарушением
что AMPK активирует Nrf2 путём ингибиро-
регуляции ARE-опосредованной экспрессии
вания GSK3β [84]. Конвергенция между пу-
генов, но нацеленные на Keap1 хемопротек-
тями AMPK и Nrf2 важна, например, для про-
торные агенты, такие как липоевая кислота,
тивовоспалительного действия берберина на
сульфорафан и другие известные активаторы
макрофаги, стимулированные липополиса-
Nrf2, могут лишь частично (а с возрастом -
харидом, и мышей, подвергшихся эндотокси-
всё хуже и хуже) компенсировать эту поте-
новому шоку [85].
рю [94-99], подавляя опосредованный Keap1
Активация AMPK приводит к перепро-
путь деградации Nrf2, но не предотвратить
граммированию метаболизма на усиление ка-
её. Функциональная связь между Nrf2 и ми-
таболизма и снижение анаболизма путём фос-
тохондриальной сетью может реализоваться
форилирования ключевых факторов во многих
через прямое взаимодействие этого ТФ с не-
биосинтетических путях, в том числе мишени
которыми митохондриальными белками или
рапамицина млекопитающих (mTOR)
[81].
через тонкую настройку баланса АФК. Хоро-
Nrf2 также может напрямую регулировать экс-
шо известны механизмы ретроградного сиг-
прессию гена mTOR, связываясь с его промото-
налинга митохондрий в ядро при реакциях на
ром [86]. Одним из активаторов AMPK явля-
клеточный стресс, включая ответы на нару-
ется серин/треонин киназа LKB1 - известный
шения структуры митохондриальных белков
опухолевый супрессор
[87]. Эксперименты
(UPRmt) [100-102] и молекулярные паттерны,
на тканеспецифических нокаутах гена LKB1
связанные с повреждением (DAMP)
[103]).
у мышей показали, что в большинстве тканей
Закодированный в митохондриальном геноме
именно LKB1 является главным посредником
16-аминокислотный пептид MOTS-c в ответ
в адаптивной активации AMPK при энергети-
на метаболический стресс активно трансло-
ческих стрессах. Это демонстрирует наличие
цируется в ядро в координации с ядерной
связи между регуляцией энергетического мета-
AMPK и SIRT1 и непосредственно регулирует
болизма и подавлением опухолей.
экспрессию ARE-содержащих генов-мише-
Один из механизмов регуляции экспрес-
ней в ядерном геноме, частично взаимодей-
сии антиоксидантных генов со стороны мито-
ствуя с Nrf2. Взаимодействие с MOTS-c уси-
хондрий связан с белком PGAM5. Имея срод-
ливает связывание Nrf2 с генами-мишенями.
ство одновременно к белкам Nrf2 и Keap1, он
Сверхэкспрессия MOTS-c защищает клетки
образует с ними третичные комплексы, увле-
от стрессов депривации глюкозы и сыворотки.
кая их к внешней мембране митохондрий за
Эти результаты демонстрируют важную роль
БИОХИМИЯ том 87 вып. 12 2022
1862
ШИЛОВСКИЙ, АШАПКИН
транслоцируемого в ядро митохондриального
лят глубже понять роль активации Nrf2 как
пептида в ответах ядерных генов на метаболи-
возможного вмешательства, способствующего
ческий стресс [44]. Эта и подобные ей функ-
долголетию.
циональные связи потенциально могут стать
краеугольным камнем для новых терапевтиче-
Вклад авторов. Г.А. Шиловский - кон-
ских подходов к борьбе с широким спектром
цепция работы и написание текста статьи;
возрастных патологий человека, включая он-
В.В. Ашапкин
- написание текста статьи;
кологию [104]. Такие пептиды млекопитающих
Г.А. Шиловский и В.В. Ашапкин - написание
функционально сходны с пептидами эндосим-
и редактирование текста статьи, подготовка
биотических протомитохондриальных бакте-
таблиц и графиков
рий, используемых ими для связи с клетками
Благодарности. Авторы сердечно благодарят
предков эукариот [105]. Вполне вероятно, что
акад. В.П. Скулачёва за оригинальную идею и
два генома эволюционировали совместно,
ценные советы в процессе написания статьи.
чтобы перекрёстно регулировать друг друга
Конфликт интересов. Авторы заявляют об
для координации клеточных функций. Буду-
отсутствии конфликта интересов.
щие исследования передачи сигналов Nrf2 и
Соблюдение этических норм. В данной ра-
способности различных веществ, активиру-
боте не было никаких исследований, в которых
ющих путь Nrf2, предотвращать хронические
были использованы в качестве объектов люди
заболевания, связанные со старением, позво-
или животные.
СПИСОК ЛИТЕРАТУРЫ
1. Skulachev, V. P., Shilovsky, G. A., Putyatina, T. S.,
link to aging, Aging (Albany NY), 13, 25694-25716,
Popov, N. A., Markov, A. V, Skulachev, M. V., and
doi: 10.18632/aging.203788.
Sadovnichii, V. A.
(2020) Perspectives of Homo
7. Holtze, S., Gorshkova, E., Braude, S., Cellerino, A.,
sapiens lifespan extension: focus on external or internal
Dammann, P., Hildebrandt, T. B., Hoeflich, A.,
resources? Aging (Albany NY), 12, 5566-5584, doi:
Hoffmann, S., Koch, P., Terzibasi Tozzini, E.,
10.18632/aging.102981.
Skulachev, M. V., Skulachev, V. P., and Sahm, A.
2. Lewis, K. N., Wason, E., Edrey, Y. H., Kristan, D. M.,
(2021) Alternative animal models of aging research,
Nevo, E., and Buffenstein, R. (2015) Regulation of
Front. Mol. Biosci.,
8,
660959, doi:
10.3389/
Nrf2 signaling and longevity in naturally long-lived
fmolb.2021.660959.
rodents, Proc. Natl. Acad. Sci. USA, 112, 3722-3727,
8. Harman, D.
(1972) The biologic clock: the
doi: 10.1073/pnas.1417566112.
mitochondria? J. Am. Ger. Soc.,
20,
145-147,
3. Skulachev, M. V., Severin, F. F., and Skulachev, V. P.
doi: 10.1111/j.1532-5415.1972.tb00787.x.
(2015) Aging as an evolvability-increasing program
9. Austad, S. N. (2018) The comparative biology of
which can be switched off by organism to mobilize
mitochondrial function and the rate of aging, Integr.
additional resources for survival, Curr. Aging Sci., 8,
Comp. Biol., 58, 559-566, doi: 10.1093/icb/icy068.
95-109, doi: 10.2174/1874609808666150422122401.
10. Son, J. M., and Lee, C. (2021) Aging: all roads lead
4. Skulachev, V. P., Holtze, S., Vyssokikh, M. Y.,
to mitochondria, Semin. Cell Dev. Biol., 116, 160-168,
Bakeeva, L. E., Skulachev, M. V., Markov, A. V.,
doi: 10.1016/j.semcdb.2021.02.006.
Hildebrandt, T. B, and Sadovnichii, V. A.
(2017)
11. Tebay, L. E., Robertson, H., Durant, S. T., Vitale, S. R.,
Neoteny, prolongation of youth: from naked mole rats
Penning, T. M., Dinkova-Kostova, A. T., and Hayes, J. D.
to “naked apes” (humans), Physiol. Rev., 97, 699-720,
(2015) Mechanisms of activation of the transcription
doi: 10.1152/physrev.00040.2015.
factor Nrf2 by redox stressors, nutrient cues, and
5. Vyssokikh, M. Y., Holtze, S., Averina, O. A, Lyam-
energy status and the pathways through which it
zaev, K. G., Panteleeva, A. A., Marey, M. V.,
attenuates degenerative disease, Free Radic. Biol. Med.,
Zinovkin, R. A., Severin, F. F., Skulachev, M. V.,
88, 108-146, doi: 10.1016/j.freeradbiomed.2015.06.021.
Fasel, N., Hildebrandt, T. B., and Skulachev, V. P.
12. Irato, P., and Santovito, G. (2021) Enzymatic and
(2020) Mild depolarization of the inner mitochondrial
non-enzymatic molecules with antioxidant function,
membrane is a crucial component of an anti-aging
Antioxidants, 10, 579, doi: 10.3390/antiox10040579.
program, Proc. Natl. Acad. Sci. USA, 117, 6491-6501,
13. Tonelli, C., Chio, I. I. C., and Tuveson, D. A. (2018)
doi: 10.1073/pnas.1916414117.
Transcriptional regulation by Nrf2, Antioxid. Redox
6. Barth, E., Srivastava, A., Wengerodt, D., Stojiljkovic, M.,
Signal., 29, 1727-1745, doi: 10.1089/ars.2017.7342.
Axer, H., Witte, O. W., Kretz, A., and Marz, M. (2021)
14. Shin, D., Kim, E. H., Lee, J., and Roh, J. L. (2018)
Age-dependent expression changes of circadian
Nrf2 inhibition reverses resistance to GPX4 inhibitor-
system-related genes reveal a potentially conserved
induced ferroptosis in head and neck cancer, Free
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И МИТОХОНДРИИ
1863
Radic. Biol. Med.,
129,
454-462, doi:
10.1016/
26. Holmström, K. M., Kostov, R. V., and Dinkova-
j.freeradbiomed.2018.10.426.
Kostova, A. T. (2016) The multifaceted role of Nrf2 in
15. Wu, T., Zhao, F. Gao, B., Tan, C., Yagishita, N.,
mitochondrial function, Curr. Opin. Toxicol., 1, 80-91,
Nakajima, T., Wong, P. K., Chapman, E., Fang, D.,
doi: 10.1016/j.cotox.2016.10.002.
and Zhang, D. D. (2014) Hrd1 suppresses Nrf2-
27. Panieri, E., Pinho, S. A., Afonso, G. J. M., Oliveira, P. J.,
mediated cellular protection during liver cirrhosis,
Cunha-Oliveira, T., and Saso, L. (2022) Nrf2 and
Genes Dev., 28, 708-722, doi: 10.1101/gad.238246.114.
mitochondrial function in cancer and cancer stem
16. Almeida, L. M., Pinho, B. R., Duchen, M. R., and
cells, Cells, 11, 2401, doi: 10.3390/cells11152401.
Oliveira, J. M. A. (2022) The PERKs of mitochondria
28. Dinkova-Kostova, A. T., Baird, L., Holmstrom, K. M.,
protection during stress: insights for PERK modu-
Meyer, C. J., and Abramov, A. Y. (2015) The spatio-
lation in neurodegenerative and metabolic diseases,
temporal regulation of the Keap1-Nrf2 pathway and
Biol. Rev. Camb. Philos. Soc., 97, 1737-1748, doi:
its importance in cellular bioenergetics, Biochem. Soc.
10.1111/brv.12860.
Trans., 43, 602-610, doi: 10.1042/BST20150003.
17. Bennett, C. F., Latorre-Muro, P., and Puigserver, P.
29. MacGarvey, N. C., Suliman, H. B., Bartz, R. R., Fu, P.,
(2022) Mechanisms of mitochondrial respiratory
Withers, C. M., Welty-Wolf, K. E., and Piantadosi, C. A.
adaptation, Nat. Rev. Mol. Cell. Biol., 23, 817-835, doi:
(2012) Activation of mitochondrial biogenesis by
10.1038/s41580-022-00506-6.
heme oxygenase-1-mediated NF-E2-related factor-2
18. Zarkovic, N. (2020) Roles and functions of ROS and
induction rescues mice from lethal Staphylococcus
RNS in cellular physiology and pathology, Cells, 9,
aureus sepsis, Am. J. Respir. Crit. Care Med., 185, 851-
767, doi: 10.3390/cells9030767.
861, doi: 10.1164/rccm.201106-1152OC.
19. Sies, H., and Jones, D. P. (2020) Reactive oxygen
30. Ludtmann, M. H., Angelova, P. R., Zhang, Y.,
species (ROS) as pleiotropic physiological signalling
Abramov, A. Y., and Dinkova-Kostova, A. T. (2014)
agents, Nat. Rev. Mol. Cell Biol.,
21,
363-383,
Nrf2 affects the efficiency of mitochondrial fatty acid
doi: 10.1038/s41580-020-0230-3.
oxidation, Biochem. J., 457, 415-424, doi: 10.1042/
20. Sies, H., Belousov, V. V., Chandel, N. S., Davies, M. J.,
BJ20130863.
Jones, D. P., Mann, G. E., Murphy, M. P., Yamamoto, M.,
31. Abdullah, A., Kitteringham, N. R., Jenkins, R. E.,
and Winterbourn, C. (2022) Defining roles of specific
Goldring, C., Higgins, L., Yamamoto, M., Hayes, J.,
reactive oxygen species (ROS) in cell biology and
and Park, B. K. (2012) Analysis of the role of Nrf2
physiology, Nat. Rev. Mol. Cell Biol., 23, 499-515,
in the expression of liver proteins in mice using two-
doi: 10.1038/s41580-022-00456-z.
dimensional gel-based proteomics, Pharmacol. Rep.,
21. Bouchez, C., and Devin, A. (2019) Mitochondrial
64, 680-697, doi: 10.1016/S1734-1140(12)70863-0.
biogenesis and mitochondrial reactive oxygen species
32. De Oliveira, M. R., de Souza, I. C. C., and Brasil, F. B.
(ROS): a complex relationship regulated by the cAMP/
(2021) Promotion of mitochondrial protection by
PKA signaling pathway, Cells, 8, 287, doi: 10.3390/
emodin in methylglyoxal-treated human neuro-
cells8040287.
blastoma SH-SY5Y cells: Involvement of the AMPK/
22. Holmström, K. M., Baird, L., Zhang, Y., Hargreaves, I.,
Nrf2/HO-1 axis, Neurotox. Res.,
39,
292-304,
Chalasani, A., Land, J. M., Stanyer, L., Yamamoto, M.,
doi: 10.1007/s12640-020-00287-w.
Dinkova-Kostova, A. T., and Abramov, A. Y. (2013)
33. Hayes, J. D., and Dinkova-Kostova, A. T. (2014) The
Nrf2 impacts cellular bioenergetics by controlling
Nrf2 regulatory network provides an interface between
substrate availability for mitochondrial respiration,
redox and intermediary metabolism, Trends Biochem.
Biol. Open, 2, 761-770, doi: 10.1242/bio.20134853.
Sci., 39, 199-218, doi: 10.1016/j.tibs.2014.02.002.
23. Hirschenson, J., Melgar-Bermudez, E., and Mailloux,
34. Goodfellow, M. J., Borcar, A., Proctor, J. L.,
R. J. (2022) The uncoupling proteins: a systematic
Greco, T., Rosenthal, R. E., and Fiskum, G. (2020)
review on the mechanism used in the prevention
Transcriptional activation of antioxidant gene
of oxidative stress, Antioxidants (Basel), 11, 322,
expression by Nrf2 protects against mitochondrial
doi: 10.3390/antiox11020322.
dysfunction and neuronal death associated with acute
24. Piantadosi, C. A., Carraway, M. S., Babiker, A.,
and chronic neurodegeneration, Exp. Neurol., 328,
and Suliman, H. B. (2008) Heme oxygenase-1 regu-
113247, doi: 10.1016/j.expneurol.2020.113247.
lates cardiac mitochondrial biogenesis via Nrf2-
35. O’Mealey, G. B., Plafker, K. S., Berry, W. L.,
mediated transcriptional control of nuclear respiratory
Janknecht, R., Chan, J. Y., and Plafker, S. M. (2017)
factor-1, Circ. Res., 103, 1232-1240, doi: 10.1161/
A PGAM5-Keap1-Nrf2 complex is required for stress-
01.RES.0000338597.71702.ad.
induced mitochondrial retrograde trafficking, J. Cell
25. Itoh, K., Ye, P., Matsumiya, T., Tanji, K., and
Sci., 130, 3467-3480, doi: 10.1242/jcs.203216.
Ozaki, T.
(2015) Emerging functional cross-talk
36. Jobbagy, S., Vitturi, D. A., Salvatore, S. R., Turell, L.,
between the Keap1-Nrf2 system and mitochondria,
Pires, M. F., Kansanen, E., Batthyany, C., Lancaster,
J. Clin. Biochem. Nutr., 56, 91-97, doi: 10.3164/
J. R., Jr., Freeman, B. A., and Schopfer, F. J. (2019)
jcbn.14-134.
Electrophiles modulate glutathione reductase acti-
БИОХИМИЯ том 87 вып. 12 2022
1
864
ШИЛОВСКИЙ, АШАПКИН
vity via alkylation and upregulation of glutathione
48. Hashimoto, Y., Niikura, T., and Tajima, H., Yasukawa, T.,
biosynthesis, Redox Biol., 21, 101050, doi: 10.1016/
Sudo, H., et al. (2001) A rescue factor abolishing
j.redox.2018.11.008.
neuronal cell death by a wide spectrum of familial
37. Piloni, N. E., Vargas, R., Fernández, V., Videla, L. A.,
Alzheimer’s disease genes and Abeta, Proc. Natl. Acad.
and Puntarulo, S. (2021) Effects of acute iron over-
Sci. USA, 98, 6336-6341, doi: 10.1073/pnas.101133498.
load on Nrf2-related glutathione metabolism in
49. Widmer, R. J., Flammer, A. J., Herrmann, J., Rodriguez-
rat brain, Biometals, 34, 1017-1027, doi: 10.1007/
Porcel, M., Wan, J., Cohen, P., Lerman, L. O.,
s10534-021-00324-x.
and Lerman, A. (2013) Circulating humanin levels
38. Ryoo, I. G., and Kwak, M. K. (2018) Regulatory
are associated with preserved coronary endothelial
crosstalk between the oxidative stress-related
function, Am. J. Physiol. Heart Circ. Physiol., 304, 393-
transcription factor Nfe2l2/Nrf2 and mitochondria,
397, doi: 10.1152/ajpheart.00765.2012.
Toxicol. Appl. Pharmacol., 359, 24-33, doi: 10.1016/
50. Merry, T. L., Chan, A., Woodhead, J. S. T., Rey-
j.taap.2018.09.014.
nolds, J. C., Kumagai, H., Kim, S. J., and Lee, C.
39. Dinkova-Kostova, A. T., and Abramov, A. Y. (2015)
(2020) Mitochondrial-derived peptides in energy
The emerging role of Nrf2 in mitochondrial function,
metabolism, Am. J. Physiol. Endocrinol. Metab., 319,
Free Radic. Biol. Med., 88, 179-188, doi: 10.1016/
659-666, doi: 10.1152/ajpendo.00249.2020.
j.freeradbiomed.2015.04.036.
51. Muzumdar, R. H., Huffman, D. M., Atzmon, G.,
40. Lim, P. J., Duarte, T. L., Arezes, J., Garcia-Santos, D.,
Buettner, C., et al. (2009) Humanin: a novel central
Hamdi, A., et al. (2019) Nrf2 controls iron homeostasis
regulator of peripheral insulin action, PLoS One, 4,
in haemochromatosis and thalassaemia via Bmp6
e6334, doi: 10.1371/journal.pone.0006334.
and hepcidin, Nat. Metab., 1, 519-531, doi: 10.1038/
52. Bachar, A. R., Scheffer, L., Schroeder, A. S., Naka-
s42255-019-0063-6.
mura, H. K., Cobb, L. J., et al. (2010) Humanin
41. Duarte, T. L., Talbot, N. P., and Drakesmith, H.
is expressed in human vascular walls and has a
(2021)
NRF2 and hypoxia-inducible factors:
cytoprotective effect against oxidized LDL-induced
key players in the redox control of systemic iron
oxidative stress, Cardiovasc. Res.,
88,
360-366,
homeostasis, Antioxid. Redox Signal., 35, 433-452,
doi: 10.1093/cvr/cvq191.
doi: 10.1089/ars.2020.8148.
53. Lee, C., Zeng, J., Drew, B. G., Sallam, T., Martin-
42. He, F., Ru, X., and Wen, T.
(2020) NRF2, a
Montalvo, A., et al. (2015) The mitochondrial-derived
transcription factor for stress response and beyond,
peptide MOTS-c promotes metabolic homeostasis and
Int. J. Mol. Sci., 21, 4777, doi: 10.3390/ijms21134777.
reduces obesity and insulin resistance, Cell Metab., 21,
43. Chorley, B. N., Campbell, M. R., Wang, X., Ka-
443-454, doi: 10.1016/j.cmet.2015.02.009.
raca, M., Sambandan, D., Bangura, F., Xue, P.,
54. Cobb, L. J., Lee, C., Xiao, J., Yen, K., Wong, R. G.,
Pi, J., Kleeberger, S. R., and Bell, D. A. (2012) Identi-
et al.
(2016) Naturally occurring mitochondri-
fication of novel NRF2-regulated genes by ChIP-Seq:
al-derived peptides are age-dependent regulators
influence on retinoid X receptor alpha, Nucleic Acids
of apoptosis, insulin sensitivity, and inflamma-
Res., 40, 7416-7429, doi: 10.1093/nar/gks409.
tory markers, Aging,
8,
796-809, doi:
10.18632/
44. Kim, K. H., Son, J. M., Benayoun, B. A., and Lee, C.
aging.100943.
(2018) The mitochondrial-encoded peptide MOTS-c
55. Kim, S. J., Xiao, J., Wan, J., Cohen, P., and Yen, K.
translocates to the nucleus to regulate nuclear gene
(2017) Mitochondrially derived peptides as novel
expression in response to metabolic stress, Cell Metab.,
regulators of metabolism, J. Physiol., 595, 6613-6621,
28, 516-524, doi: 10.1016/j.cmet.2018.06.008.
doi: 10.1113/JP274472.
45. Mangalhara, K. C., and Shadel, G. S. (2018) A
56. Conte, M., Ostan, R., Fabbri, C., Santoro, A.,
mitochondrial-derived peptide exercises the nuclear
Guidarelli, G., et al.
(2019) Human aging and
option, Cell Metab.,
28,
330-331, doi:
10.1016/
longevity are characterized by high levels of mitokines,
j.cmet.2018.08.017.
J. Gerontol. A Biol. Sci. Med. Sci., 74, 600-607,
46. Ikonen, M., Liu, B., Hashimoto, Y., Ma, L., Lee, K. W.,
doi: 10.1093/gerona/gly153.
Niikura, T., Nishimoto, I., and Cohen, P. (2003)
57. D’Souza, R. F., Woodhead, J. S. T, Hedges, C. P.,
Interaction between the Alzheimer’s survival peptide
Zeng, N., Wan, J., et al. (2020) Increased expression
humanin and insulin-like growth factor-binding
of the mitochondrial derived peptide, MOTS-c, in
protein 3 regulates cell survival and apoptosis, Proc.
skeletal muscle of healthy aging men is associated with
Natl. Acad. Sci. USA, 100, 13042-13047, doi: 10.1073/
myofiber composition, Aging (Albany NY), 12, 5244-
pnas.2135111100.
5258, doi: 10.18632/aging.102944.
47. Guo, B., Zhai, D., Cabezas, E., Welsh, K., Nou-
58. Lee, C., Wan, J., Miyazaki, B., Fang, Y., Guevara-
raini, S., Satterthwait, A. C., and Reed, J. C.
Aguirre, J., Yen, K., Longo, V., Bartke, A., and Cohen, P.
(2003) Humanin peptide suppresses apoptosis by
(2014) IGF-I regulates the age-dependent signaling
interfering with Bax activation, Nature, 423, 456-461,
peptide humanin, Aging Cell, 13, 958-961, doi: 10.1111/
doi: 10.1038/nature01627.
acel.12243.
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И МИТОХОНДРИИ
1865
59. Zarse, K., and Ristow, M. (2015) A mitochondrially
71. Jornayvaz, F. R., and Shulman, G. I. (2010) Regulation
encoded hormone ameliorates obesity and insulin
of mitochondrial biogenesis, Essays Biochem., 47, 69-
resistance, Cell Metab., 21, 355-356, doi: 10.1016/
84, doi: 10.1042/bse0470069.
j.cmet.2015.02.013.
72. Mitsuishi, Y., Taguchi, K., Kawatani, Y., Shibata, T.,
60. Lee, C., Kim, K. H., and Cohen, P. (2016) MOTS-c: a
Nukiwa, T., Aburatani, H., Yamamoto, M., and
novel mitochondrial-derived peptide regulating muscle
Motohashi, H. (2012) Nrf2 redirects glucose and
and fat metabolism, Free Radic. Biol. Med., 100, 182-
glutamine into anabolic pathways in metabolic
187, doi: 10.1016/j.freeradbiomed.2016.05.015.
reprogramming, Cancer Cell, 22, 66-79, doi: 10.1016
61. Mohtashami, Z., Singh, M. K., Salimiaghdam, N.,
/j.ccr.2012.05.016.
Ozgul, M., Kenney, M. C. (2022) MOTS-c, the most
73. Chen, L., Qin, Y., Liu, B., Gao, M., Li, A., Li, X., and
recent mitochondrial derived peptide in human aging
Gong, G. (2022) PGC-1α-mediated mitochondrial
and age-related diseases, Int. J. Mol. Sci., 23, 11991,
quality control: molecular mechanisms and
doi: 10.3390/ijms231911991.
implications for heart failure, Front. Cell. Dev. Biol.,
62. Fuku, N., Pareja-Galeano, H., and Zempo, H., et al.
10, 871357, doi: 10.3389/fcell.2022.871357.
(2015) The mitochondrial-derived peptide MOTS-c:
74. Gureev, A. P., Shaforostova, E. A., and Popov, V. N.
a player in exceptional longevity? Aging Cell, 14, 921-
(2019) Regulation of mitochondrial biogenesis as a way
923, doi: 10.1111/acel.12389.
for active longevity: interaction between the Nrf2 and
63. Zempo, H., Fuku, N., Nishida, Y., Higaki, Y., Naito, H.,
PGC-1alpha signaling pathways, Front. Genet., 10,
Hara, M., and Tanaka, K. (2016) Relation between
435, doi: 10.3389/fgene.2019.00435.
type
2 diabetes and m.1382 A>C polymorphism
75. Piantadosi, C. A., Withers, C. M., Bartz, R. R.,
which occurs amino acid replacement (K14Q) of
MacGarvey, N. C., Fu, P., Sweeney, T. E., Welty-
mitochondria-derived MOTS-c, FASEB J., 30, 956.1,
Wolf, K. E., and Suliman, H. B. (2011) Heme oxy-
doi: 10.1096/fasebj.30.1_supplement.956.1.
genase-1 couples activation of mitochondrial bio-
64. Cantó, C., Gerhart-Hines, Z., Feige, J. N., Lagouge, M.,
genesis to anti-inflammatory cytokine expression,
Noriega, L., Milne, J. C., Elliott, P. J., Puigserver, P.,
J. Biol. Chem., 286, 16374-16385, doi: 10.1074/jbc.
and Auwerx, J.
(2009) AMPK regulates energy
M110.207738.
expenditure by modulating NAD+ metabolism and
76. Choi, H. I., Kim, H. J., Park, J. S., Kim, I. J.,
SIRT1 activity, Nature, 458, 1056-1060, doi: 10.1038/
Bae, E. H., Ma, S. K., and Kim, S. W. (2017) PGC-1α
nature07813.
attenuates hydrogen peroxide-induced apoptotic cell
65. Price, N. L., Gomes, A. P., Ling, A. J., Duarte, F. V.,
death by upregulating Nrf-2 via GSK3β inactivation
Martin-Montalvo, A., et al. (2012) SIRT1 is required
mediated by activated p38 in HK-2 cells, Sci. Rep., 7,
for AMPK activation and the beneficial effects of
4319, doi: 10.1038/s41598-017-04593-w.
resveratrol on mitochondrial function, Cell Metab., 15,
77. Whitman, S. A., Long, M., Wondrak, G. T., Zheng, H.,
675-690, doi: 10.1016/j.cmet.2012.04.003.
and Zhang, D. D. (2013) Nrf2 modulates contractile
66. Wong, W. (2018) Going nuclear with stress, Sci.
and metabolic properties of skeletal muscle in
Signal., 11, eaav4285, doi: 10.1126/scisignal.aav4285.
streptozotocin-induced diabetic atrophy, Exp. Cell
67. Hirotsu, Y., Katsuoka, F., Funayama, R., Nagashima, T.,
Res., 319, 2673-2683, doi: 10.1016/j.yexcr.2013.07.015.
Nishida, Y., Nakayama, K., Engel, J. D., and
78. Acín-Pérez, R., Carrascoso, I., Baixauli, F., Roche-
Yamamoto, M.
(2012) Nrf2-MafG heterodimers
Molina, M., Latorre-Pellicer, A., et al. (2014) ROS-
contribute globally to antioxidant and metabolic
triggered phosphorylation of complex II by Fgr kinase
networks, Nucleic Acids Res.,
40,
10228-10239,
regulates cellular adaptation to fuel use, Cell Metab.,
doi: 10.1093/nar/gks827.
19, 1020-1033, doi: 10.1016/j.cmet.2014.04.015.
68. Richter, U., Lahtinen, T., Marttinen, P., Myöhänen, M.,
79. Keerthiga, R., Pei, D. S., and Fu, A. (2021) Mito-
Greco, D., Cannino, G., Jacobs, H. T., Lietzén, N.,
chondrial dysfunction, UPR(mt) signaling, and tar-
Nyman, T. A., and Battersby, B. J. (2013) A mito-
geted therapy in metastasis tumor, Cell Biosci., 11, 186,
chondrial ribosomal and RNA decay pathway
doi: 10.1186/s13578-021-00696-0.
blocks cell proliferation, Curr. Biol., 23, 535-541,
80. Kim, T. H., Hur, E. G., Kang, S. J., Kim, J. A.,
doi: 10.1016/j.cub.2013.02.019.
Thapa, D., Lee, Y. M., Ku, S. K., Jung, Y., and
69. Chepelev, N. L, Zhang, H., Liu, H., McBride, S.,
Kwak, M. K. (2011) Nrf2 blockade suppresses colon
Seal, A. J., et al. (2013) Competition of nuclear
tumor angiogenesis by inhibiting hypoxia-induced
factor-erythroid 2 factors related transcription factor
activation of HIF-1alpha, Cancer Res., 71, 2260-2275,
isoforms, Nrf1 and Nrf2, in antioxidant enzyme
doi: 10.1158/0008-5472.CAN-10-3007.
induction, Redox Biol., 1, 183-189, doi: 10.1016/
81. Herzig, S., and Shaw, R. J. (2018) AMPK: Guardian of
j.redox.2013.01.005.
metabolism and mitochondrial homeostasis, Nat. Rev.
70. Willyard, C. (2017) The drug-resistant bacteria that
Mol. Cell Biol., 19, 121-135, doi: 10.1038/nrm.2017.95.
pose the greatest health threats, Nature, 543, 15,
82. Morgunova, G. V., and Klebanov, A. A. (2019) Age-
doi: 10.1038/nature.2017.21550.
related AMP-activated protein kinase alterations: from
БИОХИМИЯ том 87 вып. 12 2022
1866
ШИЛОВСКИЙ, АШАПКИН
cellular energetics to longevity, Cell Biochem. Funct.,
94. Robledinos-Antón, N., Fernández-Ginés, R., Manda, G.,
37, 169-176, doi: 10.1002/cbf.3384.
and Cuadrado, A. (2019) Activators and inhibitors
83. Jordan, S. D., and Lamia, K. A. (2013) AMPK at
of NRF2: a review of their potential for clinical
the crossroads of circadian clocks and metabolism,
development, Oxid. Med. Cell. Longev., 2019, 9372182,
Mol. Cell. Endocrinol., 366, 163-169, doi: 10.1016/
doi: 10.1155/2019/9372182.
j.mce.2012.06.017.
95. Cuadrado, A., Manda, G., Hassan, A., Alcaraz, M. J.,
84. Joo, M. S., Kim, W. D., Lee, K. Y., Kim, J. H.,
Barbas, C., et al. (2018) Transcription factor NRF2
Koo, J. H., and Kim, S. G. (2016) AMPK facilitates
as a therapeutic target for chronic diseases: a systems
nuclear accumulation of Nrf2 by phosphorylating
medicine approach, Pharmacol. Rev., 70, 348-383,
at serine
550, Mol. Cell. Biol.,
36,
1931-1942,
doi: 10.1124/pr.117.014753.
doi: 10.1128/MCB.00118-16.
96. Hushpulian, D. M., Ammal Kaidery, N., Ahuja, M.,
85. Mo, C., Wang, L., Zhang, J., Numazawa, S., Tang, H.,
Poloznikov, A. A., Sharma, S. M., et al.
(2021)
et al. (2014) The crosstalk between Nrf2 and AMPK
Challenges and limitations of targeting the Keap1Nrf2
signal pathways is important for the anti-inflammatory
pathway for neurotherapeutics: Bach1 derepression
effect of berberine in LPS-stimulated macrophages
to the rescue, Front. Aging Neurosci., 13, 673205, doi:
and endotoxin-shocked mice, Antioxid. Redox Signal.,
10.3389/fnagi.2021.673205.
20, 574-588, doi: 10.1089/ars.2012.5116.
97. Ulasov, A. V., Rosenkranz, A. A., Georgiev, G. P.,
86. Bendavit, G., Aboulkassim, T., Hilmi, K., Shah, S.,
and Sobolev, A. S. (2021) Keap1/ARE signaling: to-
and Batist, G. (2016) Nrf2 transcription factor can
wards specific regulation, Life Sci., 291, 120111, doi:
directly regulate mTOR: linking cytoprotective
10.1016/j.lfs.2021.120111.
gene expression to a major metabolic regulator that
98. Ushakova, N. A., Brodsky, E. S., Tikhonova, O. V.,
generates redox activity, J. Biol. Chem., 291, 25476-
Dontsov, A. E., Marsova, M. V., et al. (2021) Novel
25488, doi: 10.1074/jbc.M116.760249.
extract from beetle Ulomoides dermestoides: a study
87. Shackelford, D. B., and Shaw, R. J. (2009) The LKB1-
of composition and antioxidant activity, Antioxidants
AMPK pathway: metabolism and growth control in
(Basel), 10, 1055, doi: 10.3390/antiox10071055.
tumour suppression, Nat. Rev. Cancer, 9, 563-575,
99. Qin, X., Xu, X., Hou, X., Liang, R., Chen, L., Hao, Y.,
doi: 10.1038/nrc2676.
Gao, A., Du, X., Zhao, L., Shi, Y., and Li, Q. (2022)
88. Lo, S. C., and Hannink, M. (2008) PGAM5 tethers
The pharmacological properties and corresponding
a ternary complex containing Keap1 and Nrf2
mechanisms of farrerol: a comprehensive review, Pharm.
to mitochondria, Exp. Cell Res., 314, 1789-1803,
Biol., 60, 9-16, doi: 10.1080/13880209.2021.2006723.
doi: 10.1016/j.yexcr.2008.02.014.
100. Jovaisaite, V., and Auwerx, J. (2015) The mitochondrial
89. Gao, C., Xu, Y., Liang, Z., Wang, Y., Shang, Q., et al.
unfolded protein response - synchronizing genomes,
(2021) A novel PGAM5 inhibitor LFHP-1c protects
Curr. Opin. Cell. Biol.,
33,
74-81, doi:
10.1016/
blood-brain barrier integrity in ischemic stroke,
j.ceb.2014.12.003.
Acta Pharm. Sin. B, 11, 1867-1884, doi: 10.1016/
101. Zinovkin, R. A., Skulachev, M. V., and Skulachev, V. P.
j.apsb.2021.01.008.
(2016) Mitochondrial genome and longevity, Bio-
90. Ungvari, Z., Tarantini, S., Kiss, T., Wren, J. D.,
chemistry (Moscow),
81,
1401-1405, doi:
10.1134/
Giles, C. B., et al. (2018) Endothelial dysfunction and
S0006297916120014.
angiogenesis impairment in the ageing vasculature,
102. Miskevich, D., Chaban, A., Dronina, M.,
Nat. Rev. Cardiol., 15, 555-565, doi: 10.1038/s41569-
Abramovich, I., Gottlieb, E., et al. (2021) Glutamine
018-0030-z.
homeostasis and its role in the adaptive strategies of
91. Shilovsky, G. A., Putyatina, T. S., Morgunova, G. V.,
the blind mole rat, Spalax, Metabolites, 11, 755, doi:
Seliverstov, A. V., Ashapkin, V. V., and Skulachev, V. P.
10.3390/metabo11110755.
(2021) A crosstalk between the biorhythms and gate-
103. Galluzzi, L., Kepp, O., and Kroemer, G.
(2012)
keepers of longevity: dual role of glycogen synthase
Mitochondria: master regulators of danger signalling,
kinase-3, Biochemistry (Moscow), 86, 433-448, doi:
Nat. Rev. Mol. Cell Biol., 13, 780-788, doi: 10.1038/
10.1134/S0006297921040052.
nrm3479.
92. Shilovsky, G. A. (2022) Lability of the Nrf2/Keap/ARE
104. Miller, B., Kim, S. J., Kumagai, H., Yen, K., and
cell defense system in different models of cell aging
Cohen, P. (2022) Mitochondria-derived peptides in
and age-related pathologies, Biochemistry (Moscow),
aging and healthspan, J. Clin. Invest., 132, e158449,
87, 70-85, doi: 10.1134/S0006297922010060.
doi: 10.1172/JCI158449.
93. Zinovkin R. A, Kondratenko, N. D., and Zinovki-
105. Waters, C. M., and Bassler, B. L. (2005) Quorum
na, L. A. (2022) Does NRF2 appear to be a master
sensing: cell-to-cell communication in bacteria, Annu.
regulator of mammalian aging? Biochemistry (Moscow),
Rev. Cell Dev. Biol., 21, 319-346, doi: 10.1146/annurev.
87, 1465-1476, doi: 10.1134/S0006297922120045.
cellbio.21.012704.131001.
БИОХИМИЯ том 87 вып. 12 2022
Nrf2 И МИТОХОНДРИИ
1867
TRANSCRIPTION FACTOR Nrf2 AND MITOCHONDRIA -
FRIENDS OR FOES IN THE AGING PACE REGULATION
Review
G. A. Shilovsky1,2,3* and V. V. Ashapkin1
1 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; e-mail: gregory_sh@list.ru, grgerontol@gmail.com
2 Faculty of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia
3 Institute for Information Transmission Problems, Russian Academy of Sciences, 127051 Moscow, Russia
At the first sight, the transcription factor Nrf2, being the master regulator of cellular antioxidant systems,
and mitochondria, being the main source of reactive oxygen species (ROS), should play opposite roles in
determination of the aging pace. However, as much as the aging causes could not be confined to oxidative
stress, Nrf2 role could not be confined to the antioxidant system regulation, and even more so, the role of
mitochondria is not confined to ROS production. Indeed, significance of both Nrf2 and mitochondria in
aging has been studied for a long time rather successfully. In the current review, we will discuss a small aspect
of this problem only, specifically, molecular mechanisms of Nrf2-mitochondria interaction that, one way
or another, influence the pace of aging and the lifespan. Experimental data accumulated so far show that
Nrf2 activity positively affects both the mitochondrial dynamics and quality control. Nrf2 could affect the
mitochondrial function via different modes, either directly via regulation of nuclear encoded mitochondrial
proteins or indirectly via changing balance of ROS or other metabolites affecting mitochondrial functioning.
In turn, multiple regulatory proteins functionally associated with mitochondria affect Nrf2 activity and
even form mutual regulatory loops with Nrf2. It well be suggested that these loops enable fine-tuning of the
cellular redox balance and possibly the cellular metabolism as a whole. It has been believed for quite a long
time that all mitochondrial regulatory signals are mediated by the nuclear genome encoded proteins whereas
the mitochondrial genome has been considered to encode a few respiratory chain proteins and two ribosomal
RNAs. Relatively recently, mtDNA encoded signal peptides were discovered and investigated. In this paper,
we will discuss data concerning molecular features of their interaction with nuclear regulatory systems, Nrf2
in the first place, and their possible involvement in determining the pace of aging. Mechanisms of interaction
of regulatory cascades that link programs of the cellular homeostasis and cellular responses to oxidative stress
are a significant part of the aging and anti-aging programs. Therefore, the respective knowledge should be of
great help in searching the promising molecular targets to counteract the aging diseases and the aging per se.
Keywords: Nrf2, mitochondria, aging, lifespan, oxidative stress, aging diseases, antioxidants
БИОХИМИЯ том 87 вып. 12 2022