БИОХИМИЯ, 2022, том 87, вып. 12, с. 2033 - 2045
УДК 616-006.6
ВЫЯСНЕНИЕ РОЛИ АДАПТЕРНОГО БЕЛКА Anks1a В РЕГУЛЯЦИИ
ПОДВИЖНОСТИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
© 2022 А.О. Жолудева1, М.Е. Ломакина1,2, Е.А. Орлова1, Я. Ванг2, А. Фокин2,
А. Полесская2, А.М. Готро2, А.Ю. Александрова1*
1 ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина»
Минздрава России, 115478 Москва, Россия; электронная почта: tonya_alex@yahoo.com
2 Национальный центр научных исследований Франции, Политехническая школа,
Парижский политехнический институт, 91120 Палезо, Франция
Поступила в редакцию 20.09.2022
После доработки 30.10.2022
Принята к публикации 31.10.2022
Критическим этапом опухолевой прогрессии является эпителиально-мезенхимальный переход,
в результате которого опухолевые клетки (ОК) приобретают способность к мезенхимальной ми-
грации, основным регулятором которой является сигнальный путь Rac→WAVE→Arp2/3. Ранее было
показано, что белки, взаимодействующие с Rac, могут регулировать мезенхимальную миграцию
и влиять на эффективность метастазирования. Поиск новых регуляторов миграции является акту-
альной теоретической и практической задачей. Одним из белков, взаимодействующих с Rac, являет-
ся адаптерный белок Anks1a, изменение экспрессии которого показано для многих опухолей. Зада-
чей исследования было выяснение вопроса, влияет ли Anks1а на подвижность ОК и каков механизм
его действия. Предполагается, что Anks1a может оказывать влияние на миграцию ОК либо как эф-
фектор Rac1, либо за счет усиления интенсивности обмена рецепторов к эпидермальному фактору
роста HER2. Был исследован эффект усиления и подавления экспрессии Anks1a на миграцию кле-
ток рака молочной железы (МЖ) с разным статусом HER2. Показано, что Anks1a взаимодействует
с активированной формой Rac1. В линии MDA-MB-231 (тройной негативный рак), в которой от-
сутствуют HER2, Anks1a накапливается на активном крае клетки, для которого характерно обога-
щение активным Rac1. Тогда как у клеток SK-BR-3 (HER2 оверэкспрессирован) не наблюдалось
концентрации Anks1a на активном крае. Подавление экспрессии Anks1a практически не влияет на
подвижность ОК, лишь немного увеличивается скорость миграции у MDA-MB-231. Оверэкспрессия
Anks1a приводит к увеличению скорости движения лишь у клеток SK-BR-3, т.е оказывает влияние
на миграцию только в том случае, когда есть оверэкспрессия HER2. Мы показали, что Anks1a яв-
ляется эффектором активированного Rac1, но его влияние в этом качестве на исследованные нами
клетки МЖ минимально. Anks1a может оказывать влияние на подвижность клеток МЖ благодаря
его участию в механизме обмена рецепторов к EGF.
КЛЮЧЕВЫЕ СЛОВА: Anks1a, клеточная подвижность, рак молочной железы, метастазирование.
DOI: 10.31857/S0320972522120193, EDN: NIPAVU
ВВЕДЕНИЕ
грацию опухолевых клеток и, следовательно,
метастазирование - это важнейшая задача, на
Приобретение клетками подвижного ме-
решение которой направлены работы многих
зенхимального фенотипа в процессе роста
лабораторий. Известно, что в основе клеточ-
злокачественной опухоли является следстви-
ного движения лежат перестройки актинового
ем эпителиально-мезенхимального перехо-
цитоскелета [2], однако попытки остановить
да (ЭМП) и одним из ключевых событий, ве-
миграцию опухолевых клеток с помощью
дущих к образованию метастазов [1]. Поиск
прямого разрушения актиновых филаментов
новых подходов, позволяющих остановить ми- или ингибирования их перестроек оказались
Принятые сокращения: МЖ - молочная железа; ОК - опухолевые клетки; РТК - рецептор тирозин киназы; Anks1a -
белок, содержащий анкириновый повтор и стерильный альфа-мотив 1А; EGF - эпидермальный фактор роста; HER2 -
рецептор 2 эпидермального фактора роста человека.
* Адресат для корреспонденции.
2033
18
2034
ЖОЛУДЕВА и др.
невозможными из-за очень большой токсич-
открыты новые регуляторы процессов поли-
ности подобных агентов [3]. Поэтому представ-
меризации актина. Описание таких ранее не-
ляется целесообразным искать более тонкие
известных участников процесса представляет
регуляторы, влияющие на процессы клеточ-
отдельный интерес, потому что именно они
ной миграции. Важными регуляторами пере-
могут быть использованы в качестве мишеней
строек актинового цитоскелета и клеточной
для разработки противоопухолевых агентов,
подвижности являются малые ГТФазы семей-
останавливающих метастазирование. Измене-
ства Rho - Cdc42, Rac и Rho [4, 5]. При этом
ние их экспрессии также может служить полез-
каждая из этих ГТФаз выполняет строго опре-
ным прогностическим фактором при выборе
деленные функции, они также взаимно регу-
стратегии лечения и оценке прогнозов данно-
лируют друг друга. Так, Cdc42 отвечает за фор-
го конкретного пациента. С целью выявления
мирование филоподий, RhoA способствует
новых возможных регуляторов клеточной ми-
росту сократимости, образованию и сокраще-
грации был проведен поиск новых ранее не
нию актиновых пучков и формированию специ-
известных эффекторов Rac, и среди прочих
фических протрузий - блебов, являющихся
белков функция эффектора Rac была показана
основой амебоидной миграции опухолевых и
для белка Anks1a.
стволовых клеток [6, 7]. Формирование кле-
Anks1a (Ankyrin Repeat and Sterile Alpha
точных протрузий, обеспечивающих мезенхи-
Motif Domain Containing 1A), (другое назва-
мальную миграцию клеток, - ламеллиподий и
ние - ODIN) - белок, относящийся к семейству
филоподий - регулируется сигнальным каска-
Anks1, в состав которого входит всего два белка
дом Rac→WAVE→Arp2/3, который отвечает за
Anks1a и Anks1b. По своей структуре Anks1a яв-
Arp2/3-зависимую полимеризацию актиновых
ляется адаптерным белком, который обеспечи-
филаментов. Активность многих белков, во-
вает связь тирозинкиназных рецепторов (РТК)
влеченных в этот каскад, изменяется при раз-
типа EGFR, PDGFR и EphA8, с их эффекто-
витии злокачественных опухолей [8-9]. Было
рами [21-22]. РТК являются ключевыми регу-
показано, что даже незначительные изменения
ляторами многих сигнальных путей в клетках,
общей активности Rac оказывают влияние на
и нарушение их функционирования связано
характер миграции клеток, в частности, регу-
с развитием многих типов опухолей [23-24].
лируют направленность движения клеток раз-
Anks1a активно экспрессируется в клетках мле-
ных типов [10]. Значение регуляторного пути
копитающих, в нервных клетках его экспрессия
Rac1 в опухолевой прогрессии было показано в
характерна для эмбриональных клеток мозга
недавно опубликованной работе, прямо иллю-
мыши, но подавлена в клетках взрослого моз-
стрирующей вовлечение Rac1 в процесс ЭМП
га мыши [25]. Недавнее исследование большой
и регуляцию метастазирования [11]. Увеличе-
когорты пациентов с немелкоклеточным раком
ние экспрессии белка WAVE2, регулирующе-
легких на поздних стадиях выявило ANKS1A в
го активность комплекса Arp2/3, коррелирует
числе 17 генов, однонуклеотидный полимор-
с возрастанием риска метастазирования при
физм (single nucleotide polymorphisms, SNP) в
различных типах опухолей [12-13], а подавле-
которых ассоциирован с плохим прогнозом
ние такой экспрессии с помощью РНК-интер-
болезни [26]. Подавление экспрессии Anks1a
ференции приводит к существенному сниже-
с помощью shRNA в клетках колоректального
нию метастатической активности клеток рака
рака (CT26 - клетки, полученные из карцино-
поджелудочной железы [14-15] и высоко ме-
мы толстой кишки) и в клетках, полученных из
тастазирующих клеток рака молочной железы
первичных опухолей MMTV-Neu мышей, при-
MDA-MB-231 [14]. Усиление экспрессии кофи-
водило к снижению способности этих клеток
лина, отвечающего за возобновление пула
формировать колонии в мягком агаре и к подав-
глобулярного актина, необходимого для даль-
лению образования опухолей при перевивке у
нейшей полимеризации [16], наблюдается во
мышей. Согласно данным Lee et al. [27], подав-
многих опухолях (в глиомах, при раке легких,
ление Anks1a в клетках карциномы молочной
раке яичников, плоскоклеточном раке полости
железы SK-BR-3 также приводило к снижению
рта и др.) [17-18]. Оверэкспрессия регулятора
способности этих клеток к образованию коло-
активности кофилина, LIM-киназы 1, отме-
ний в мягком агаре.
чена в метастазирующих опухолях молочной
Основным механизмом, посредством ко-
железы (МЖ) и простаты [19-20]. Несмотря
торого Anks1a участвует в регуляции развития
на огромный интерес к изучению внутрикле-
злокачественных новообразований, считается
точных механизмов, регулирующих движение
его участие в обмене РТК и вовлечение в сиг-
клеток, многие вопросы исследованы недо-
налинг EphA2/ErbB2. На клетках HEK293 и на
статочно, в частности, в последнее время были
линии клеток немелкоклеточного рака легко-
БИОХИМИЯ том 87 вып. 12 2022
Anks1a КАК РЕГУЛЯТОР МИГРАЦИИ КЛЕТОК
2035
го RVH6849 было показано, что усиленная экс-
во влажной атмосфере в присутствии 5% CO2.
прессия Anks1a приводит к усилению циркуля-
Клеточные линии аденокарцином культиви-
ции EGFR, а подавление экспрессии Anks1a
ровали в среде DMEM («Sigma», США), со-
приводит к увеличению скорости деградации
держащей
10% эмбриональной сыворотки
EGFR в лизосомах [28]. На основании этих и
теленка («PAA Laboratories») и антибиотики
других данных предложена модель, согласно
(по 100 ед./мл пенициллина и стрептомицина),
которой Anks1a выступает как регулятор сиг-
при 37 °С во влажной атмосфере в присутствии
нальных путей, активируемых ростовыми фак-
5% CO2.
торами [21, 29].
Трансфекция плазмидами. Для получе-
Играет ли какую-нибудь роль в определе-
ния клеток с оверэкспрессией Anks1a прово-
нии характера миграции и пролиферации опу-
дили трансфекцию клеток линий MCF-10A,
холевых клеток функция Anks1a в качестве эф-
SK-BR-3 и MDA-MD-231 плазмидами. За 24 ч
фектора ГТФазы Rac, остается неизвестным.
до трансфекции клетки пересевали на чаш-
Нас интересовало, как влияет изменение
ки Петри в полную среду DMEM/F12 в при-
экспрессии Anks1а на миграцию клеток опу-
сутствии 5% лошадиной сыворотки и других
холи МЖ человека и зависит ли это влияние
добавок (см. выше) без антибиотиков, так
от статуса рецепторов к EGF в этих клетках.
чтобы к моменту трансфекции клетки об-
Поэтому мы исследовали эффекты усиления
разовывали субмонослой. В качестве кон-
и подавления экспрессии Anks1a на линиях
трольной плазмиды мы использовали MXS
клеток рака молочной железы с разным ста-
AAVS1L SA2A PurobGHpA EF1Flag GFP Blue
тусом рецепторов к эпидермальному фактору
SV40pA AAVS1R (1929с), собранную при по-
роста 2 (HER2, human epidermal growth factor
мощи MXS-клонирования в лаборатории
receptor-2). Так, линия клеток SK-BR-3 об-
А. Готро [30, 31]. В качестве плазмид, транс-
ладает повышенным содержанием HER2, а
фекция которых приводила к оверэкспрес-
клетки MDA-MB-231 (тройной негативный
сии исследуемого белка, мы использовали два
рак МЖ) характеризуются отсутствием экс-
варианта: плазмиды, содержащие последо-
прессии HER2. В качестве контроля мы ис-
вательности мышиного (1929m) и человече-
пользовали клетки условно-нормального эпи-
ского (1929h) ANKS1A. Для создания плазми-
телия молочной железы MCF-10A.
ды
1929m кодирующая последовательность
ANKS1A мыши, любезно предоставленная
нам доктором С. Север (Центральная боль-
МАТЕРИАЛЫ И МЕТОДЫ
ница штата Массачусетс, Отделение неф-
рологии, США)
[27], была амплифициро-
Клеточные линии. Были использованы сле-
вана из кДНК (BC050847), полученной при
дующие клеточные линии: MCF-10A
- ус-
помощи обратной транскрипции из тоталь-
ловно нормальные эпителиальные клетки
ной РНК клеток мыши, а затем клониро-
молочной железы человека с нормальной экс-
вана нами по сайтам эндонуклеаз рестрик-
прессией HER2, а также их производная -
ции Fsel и Ascl в плазмиду
1929с, вместо
MCF-10A RacQL, для которой характерна экс-
бактериального репортера Blue. Кроме того,
прессия конститутивно активного Rac (обе
из кДНК ANKS1A (NP_056060), полученной
линии получены из лаборатории биохимии По-
посредством обратной транскрипции из то-
литехнической школы, Палезо, Франция), и две
тальной РНК клеток человека линии MCF-10A
клеточные линии аденокарцином МЖ челове-
при помощи набора NucleoSpin RNA Plus Kit
ка - SK-BR-3 («АТСС», США) с амплификаци-
(«Macherey-Nagel», Франция), мы выделили
ей HER2/neu и MDA-MB-231 («АТСС»), относя-
мРНК ANKS1A-ΔС с отсутствующим участком
щаяся к тройному негативному типу рака, т.е. не
длиной 60 нуклеотидов на C-конце. Для созда-
содержащая прогестеронового и эстрогенового
ния плазмиды 1929h эта кодирующая последо-
рецепторов и не экспрессирующая HER2. Клет-
вательность была амплифицирована по частям
ки MCF-10A и MCF-10A RacQL культивирова-
с использованием следующих пар праймеров:
ли в среде DMEM/F12 («Sigma», США) c добав-
прямой - 5′-CCCGGAGACGGAAAGTTTGG-3′ и
лением 5% лошадиной сыворотки (Horse Serum,
обратный - 5′-GAGGTAGCCCACTCTCTTGC-3′;
«PAA Laboratories» Австрия), 10 мкг/мл инсули-
прямой - 5′-AGCTGGAGGAGACGGGTG-3′ и
на, 100 нг/мл холерного токсина (Cholera Toxin),
обратный - 5′-GTCTTCAGAGCTGCAGGTGA-3′.
0,5 мкг/мл гидрокортизона и 20 нг/мл EGF
Затем последовательность ANKS1A-ΔС была от-
(«Sigma», США), а также 32,5 мкг/мл NaHCO3
секвенирована на соответствие мРНК ANKS1A
и антибиотиков (по 100 ед./мл пенициллина и
(NM_015245) и клонирована в вышеописан-
стрептомицина) («ПанЭко», Россия) при 37 °С
ную плазмиду 1929с по сайтам Fsel и Ascl.
БИОХИМИЯ том 87 вып. 12 2022
18*
2036
ЖОЛУДЕВА и др.
Изготовление праймеров и секвенирование
на изображениях с иммунофлуоресценцией
проводилось компанией «Eurofins Genomics»
F-актина и Anks1a использовали программу
(Эберсберг, Германия).
Fiji/ImageJ. Для этого строили прямую линию
Временную трансфекцию клеток плаз-
длиной 20 мкм (400 пикселей) перпендикуляр-
мидами проводили с использованием Lipo-
но активному краю клетки так, чтобы центр
fectamine LTX («Invitrogen», США), согласно
прямой находился на краю клетки. График по-
протоколу производителя. Спустя сутки инку-
строили по средним значениям 25 профилей
бации при 37 °С во влажной атмосфере в при-
(25 разных зон на активном крае) на клетках из
сутствии 5% CO2 каждую чашку рассаживали
трех независимых экспериментов.
на 3 эксперимента: одну чашку со стеклами
Видеомикроскопия. Через 24 ч после пере-
для дальнейшего иммунофлуоресцентного
несения клеток в 4-луночную μ-слайд-камеру
окрашивания, другую - для анализа методом
среду меняли на бесцветную DMEM/F12 со
Вестерн-блот; и в 4-луночную μ-слайд-камеру
всеми добавками и с 15 мМ HEPES. Для ра-
(«Ibidi», Дания) для съемки на видеомикроскопе.
боты мы использовали дифференциальную
РНК-интерференция. Для подавления экс-
интерференционно-контрастную (DIC) мик-
прессии исследуемого белка Anks1а использо-
роскопию на микроскопе Nikon Eclipse-Ti с
вали малые интерферирующие РНК, подго-
объективом Plan Fluor 20×. Видеосъемку про-
товленные эндорибонуклеазой, нацеленные
водили в режиме Time-Lapse в течение 10 ч с
на человеческий ген ANKS1A (human Anks1a
межкадровым интервалом 5 мин, при темпера-
esiRNA, esiAnks1a) («Sigma», Германия); Esi egfp
туре 37 °С при помощи цифровой камеры с ох-
(esiGFP) («Sigma», Германия) в концентрации
лаждением ORCA-ER («Hamamatsu Protonics»,
320 нМ, использовали в качестве негативно-
Япония), используя программное обеспечение
го контроля. Для трансфекции использовали
NIS- Elements AR 3.22 software («Nikon»).
Lipofectamine RNAi MAX Reagent («Invitrogen»,
Анализ миграционной способности кле-
США) в концентрации, рекомендованной про-
ток. Для определения траекторий и скорости
изводителем. Спустя сутки инкубации при 37 °С
движения исследуемых клеток в культуре мы
во влажной атмосфере в присутствии 5% CO2
строили треки движения клеток на последова-
каждую чашку рассаживали на две в полную
тельностях видеокадров в программе ImageJ.
среду, добавляя в одну из чашек ростовой фак-
Подсчет средних скоростей клеток на основа-
тор EGF; еще через сутки чашки рассажива-
нии построенных треков был проведен в про-
ли для дальнейшего иммунофлуоресцентного
грамме MS Excel при помощи макросов Speed,
окрашивания, анализа методом Вестерн-блот;
Plot_at_Origin и Dir_Ratio [32]. Для каждой
и в 4-луночную μ-слайд-камеру («Ibidi», Дания)
клеточной линии были получены данные по
для видеомикроскопии.
трем опытам, оценивалось в среднем около
Флуоресцентная микроскопия. Для после-
20 полей зрения в каждом опыте. Подвижны-
дующего проведения флуоресцентного окра-
ми считали клетки, которые смещались на рас-
шивания и выявления внутриклеточной ло-
стояние больше своего радиуса.
кализации Anks1a, актина и клеточных ядер
Приготовление белковых лизатов. Транс-
применяли фиксацию 3,7%-ным параформаль-
фицированные и контрольные клетки, расса-
дегидом (PFA). В качестве первичных антител
женные на чашки Петри промывали холодным
использовали поликлональные кроличьи анти-
фосфатным буфером (1× PBS, pH 7,4) и лизи-
тела к белку Anks1a («Bethyl Laboratories, Inc»,
ровали в буфере RIPA (50 мM Tris-HCl, pH 7,4
США). В качестве вторичных антител исполь-
(«MP Biomedicals», Франция); 150 мM NaCl
зовали анти-кроличьи антитела, конъюгиро-
(«Sigma», США); 2 мM EDTA («Sigma», США);
ванные с флуоресцентной меткой (Alexa 594)
1% NP-40 («Fluka», США); 0,1% SDS («Appli-
(«Jackson Immuno Research», США). Актино-
Chem», Испания)) с добавлением коктейля
вые филаменты выявляли при помощи фалло-
ингибиторов протеаз («Roche», Германия) в те-
идина с флуоресцентной меткой Alexa Fluor 488
чение 20-30 мин на льду. После инкубации ли-
(«Molecular Probes», США), а ядра окрашива-
заты центрифугировали при 19 721 g в течение
ли красителем DAPI («Sigma-Aldrich», США).
30 мин. Отбирали супернатант (лизат) в новые
При окрашивании антитела использовали в
пробирки и измеряли концентрацию белка ме-
разведениях, рекомендованных производи-
тодом Бредфорда, после чего лизаты хранили
телями. Препараты исследовали с помощью
при -20 °С.
флуоресцентного микроскопа Nikon Eclipse-Ti
Анализ GST pull-down. Клетки MCF-10A ли-
(«Nikon», Япония).
зировали в буфере XB-NP-40 (50 мМ HEPES,
Измерение интенсивности флуоресценции.
50 мМ KCl, 1% NP-40, 10 мМ EDTA, pH 7,7)
Для построения профилей флуоресценции
с добавлением протеазного ингибитора в
БИОХИМИЯ том 87 вып. 12 2022
Anks1a КАК РЕГУЛЯТОР МИГРАЦИИ КЛЕТОК
2037
течение 30 мин при 4 °C, после чего центри-
ние графиков во всех количественных экспе-
фугировали при 19 721 g 15 мин. 20 мкг очи-
риментах проводили в программе MS Excel
щенных GST-белков инкубировали с 20 мкл
(«Microsoft», США), используя t-критерий
гранул глутатион-сефарозы («GE Healthcare»,
Стьюдента. Данные представляли как сред-
США) в 500 мкл буфера (50 мМ Tris-HCl,
нее значение ± стандартная ошибка среднего
100 мМ NaCl, 2,5 мМ CaCl2, 10 мМ MgCl2,
(standard error of mean, SEM).
1% (w/v) Triton X-100, 5% (v/v) глицерина,
1 мМ DTT, pH 8,0) при 4 °C в течение 1 ч. Грану-
лы глутатион-сефарозы отмывали и инкубиро-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
вали в 1 мл клеточного экстракта MCF-10A 1 ч
при 4 °C. Затем отмывали буфером XB-NP-40 и
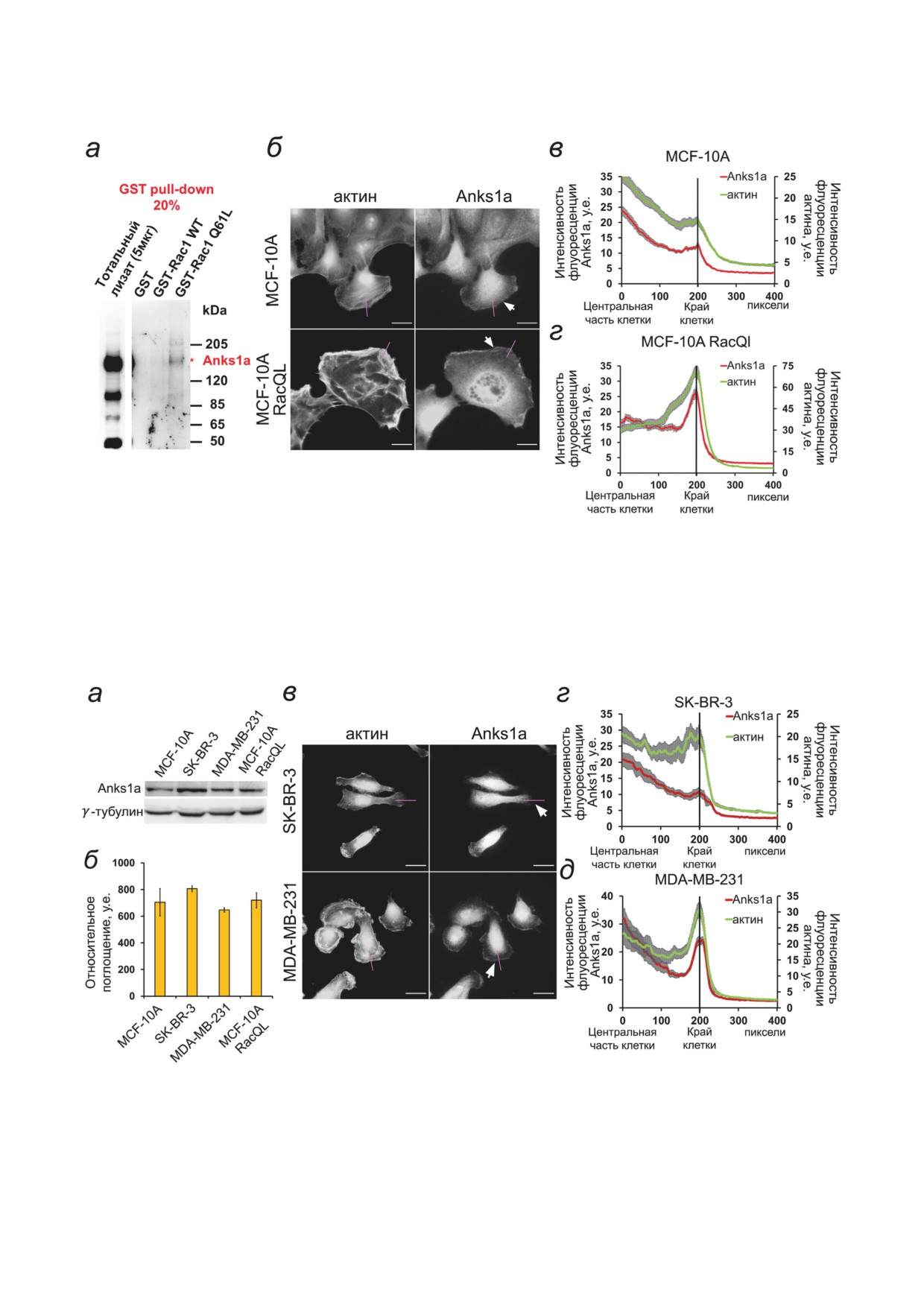
Оценка способности Anks1a взаимодей-
исследовали состав иммунопреципитата мето-
ствовать с Rac1. Чтобы выяснить, способен
дом Вестерн-блота.
ли Anks1a образовывать комплекс с малой
Вестерн-блот. Данный метод использовали
ГТФазой Rac1, был проведен анализ GST pull-
для качественного и количественного анали-
down для Rac1 (WT) и RacQ61L (активирован-
за экспрессируемого клетками белка Anks1a,
ная форма Rac1). Мы определили, что Anks1a
для оценки эффективности проведенной
способен связываться с Rac1, но только в том
трансфекции, а также для анализа содержа-
случае, когда Rac1 находится в активированном
ния иммунопреципитата. Нормализованные
состоянии (рис. 1, а). Это говорит о потенциа-
по концентрации белка образцы клеточных
ле Anks1a быть эффектором активированной
лизатов смешивали с 5× буфером для нане-
малой ГТФазы Rac. Мы рассмотрели, как рас-
сения (250 мM Tris-HCl (pH 6,8), 10% SDS,
пределяется Anks1a в псевдонормальных клет-
30% (v/v) глицерин, 5% β-меркапто-этанол,
ках МЖ MCF-10A и клетках MCF-10A с кон-
0,02% бромфеноловый синий) и инкубирова-
ститутивно активным Rac - MCF-10A RacQL.
ли при 95 °C в течение 10 мин. Далее образцы
В контрольных MCF-10A Anks1a выявляется
наносили на 7,5%-ный SDS-полиакриламид-
в околоядерном пространстве, а также наблю-
ный гель и проводили вертикальный электро-
дается усиление интенсивности окрашива-
форез согласно протоколу («Bio-Rad», США).
ния на активном крае в зоне ламеллиподий,
Белки после электрофореза переносили с гелей
где активность Rac наиболее высока [33-34].
на Amersham Hybond-P PVDF-мембраны («GE
Клетки MCF-10A RacQL с конститутивно ак-
Healthcare»). Мембраны блокировали 5%-ным
тивным Rac сильно распластаны, но мало
раствором молока («Fluka», США) на фосфат-
подвижны, Anks1a располагается как в около-
ном буфере (1× PBS, pH 7,4) с добавлением
ядерном пространстве, так и на активном крае
0,1% (v/v) Tween-20 («AppliChem», Испания) в
клетки (рис. 1, б), причем увеличение концен-
течение 1 ч на качалке. Далее мембраны инку-
трации Anks1a на активном крае выражено го-
бировали с первичными антителами 16 ч при
раздо сильнее, чем у контрольных клеток.
4 °C. В качестве первичных антител использова-
Таким образом, Anks1a взаимодействует
ли поликлональные кроличьи антитела к белку
с активированной формой Rac1, и в клетках с
Anks1a. В качестве контроля загрузки исполь-
конститутивно активным Rac1 Anks1a частич-
зовали моноклональные мышиные антитела
но перераспределяется к активному клеточно-
к γ-тубулину GTU88 («Sigma», США). После
му краю, что указывает на то, что Anks1a мо-
отмывки фосфатным буфером с добавлением
жет принимать участие в регуляции клеточной
0,1% (v/v) Tween-20 мембраны инкубировали
подвижности в качестве эффектора Rac.
со вторыми антителами, конъюгированными
Распределение Anks1а в опухолевых клет-
с пероксидазой
(«Jackson ImmunoResearch»,
ках молочной железы. Для исследования уча-
Великобритания), в течение 1 ч при комнатной
стия Anks1a в регуляции движения клеток МЖ
температуре. Сигнал детектировали с помощью
в качестве опухолевых линий МЖ мы выбрали
Pierce ECL Western Blotting Substrate («Thermo
клетки SK-BR-3 и MDA-MB-231 с разным стату-
Fisher Scientific», США), изображения получа-
сом HER2. Опухолевые клетки обеих линий (SK-
ли с помощью прибора Image Quant LAS 4000
BR-3 и MDA-MB-231) в редкой культуре не об-
(«GE Healthcare»). Для денситометрии полу-
разуют плотных островков и располагаются или
ченных изображений блотов использовали
в разреженных островках, или поодиночке, при
программу ImageJ. Значения относительного
этом имеют активные края с ярко выраженными
поглощения полос Anks1a (в у.е.) нормировали
ламеллиподиями, что хорошо видно при окраске
на маркерный белок - γ-тубулин.
актина фаллоидином (рис. 2). С помощью Ве-
Статистическая обработка данных. Ста-
стерн-блота мы оценили количество Anks1a в ис-
тистическую обработку данных и построе-
следуемых линиях. Разницы в количестве Anks1a
БИОХИМИЯ том 87 вып. 12 2022
2038
ЖОЛУДЕВА и др.
Рис. 1. Взаимодействие Anks1a с Rac1. а - GST pull-down-анализ. Для Вестерн-блота использовали 20% от получен-
ного объема лизата после отмывки гранул глутатион-сефарозы. Звездочкой обозначена молекулярная масса Anks1a
(170 kDa). б - Распределение Anks1a в псевдонормальных (MCF-10A) клетках и в клетках с конститутивно активным
Rac1 (MCF-10A RacQL). Окрашивание актина - фаллоидин-Alexa 488. Стрелкой указано распределение Anks1a на
краю клетки. Масштабная линия - 10 мкм. в и г - Графики изменения интенсивности флуоресценции белка Anks1a
вдоль фиолетовой линии (б), на активном крае клеток MCF-10A (в) и MCF-10A RacQL (г). Показана средняя интен-
сивность флуоресценции ± SEM; n = 25 клеток для каждого графика
Рис. 2. Распределение белка Anks1a в опухолевых клетках молочной железы. а - Вестерн-блот клеточных линий
MCF-10A, SK-BR-3, MDA-MB-231 и MCF-10A RacQL с окрашиванием на Anks1a и γ-тубулин. б - Денситометрия
Вестерн-блота, приведенного на панели а, с выравниванием по γ-тубулину. в - Распределение белка Anks1a в опухо-
левых клетках (SK-BR-3 и MDA-MB-231) МЖ человека. Окрашивание актина - фаллоидин-Alexa 488. Масштабная
линия - 20 мкм. г и д - Графики изменения интенсивности флуоресценции белка Anks1a на активном крае клеток
SK-BR-3 (г) и MDA-MB-231 (д) вдоль фиолетовых линий на панели в. Показана средняя интенсивность флуоресцен-
ции ± SEM; n = 25 клеток для каждого графика
БИОХИМИЯ том 87 вып. 12 2022
Anks1a КАК РЕГУЛЯТОР МИГРАЦИИ КЛЕТОК
2039
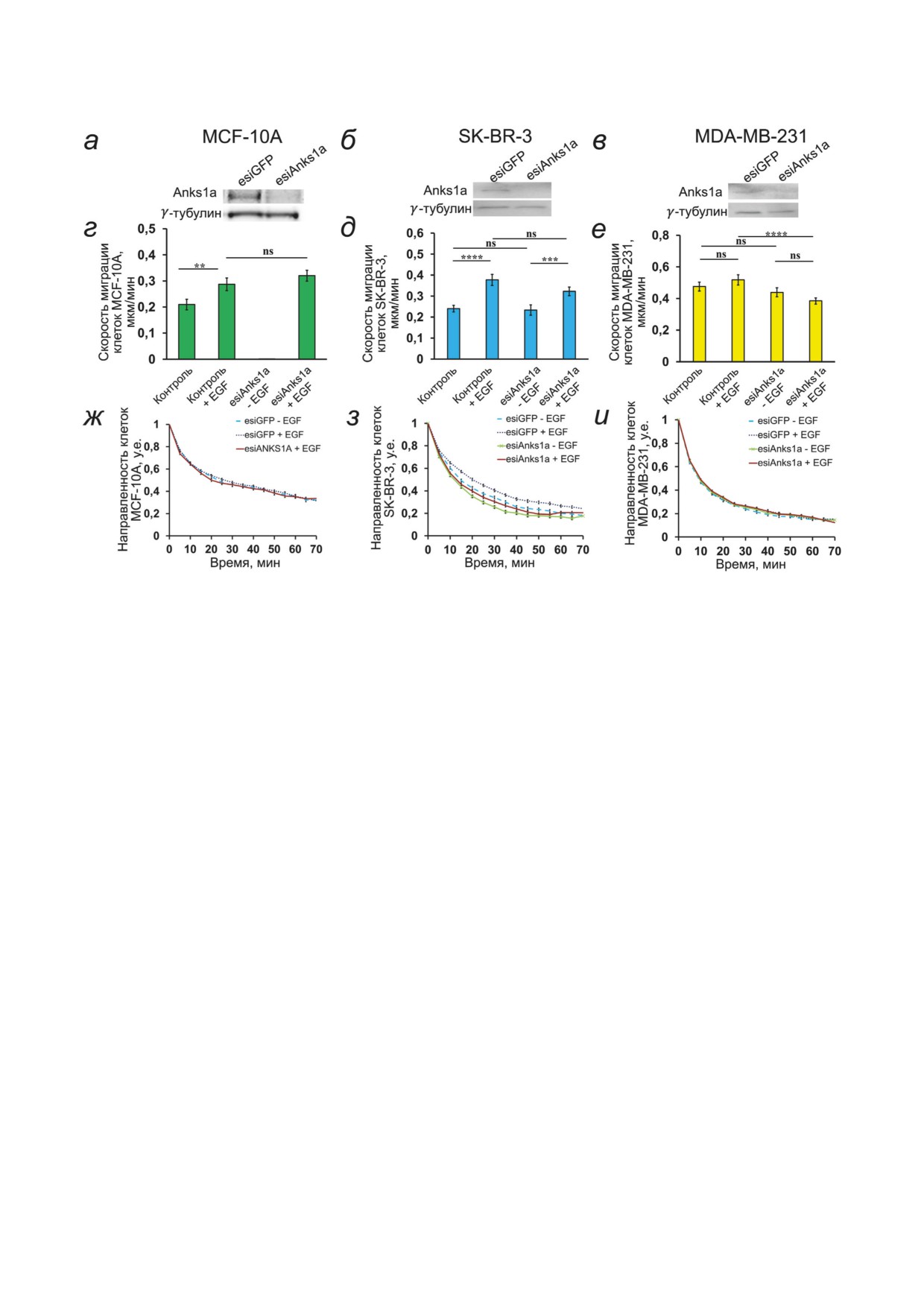
Рис. 3. Влияние подавления экспрессии Anks1а на миграционную активность клеток МЖ. а-в - Контроль экспрессии
Anks1a после подавления Anks1a с помощью esiRNA (esiAnks1a), нормирование по γ-тубулину; г-е - скорости мигра-
ции клеток; ж-и - оценка направленности движения клеток с подавленной экспрессией белка Anks1a в присутствии и
при отсутствии EGF. Данные представляют собой среднее значение ± SEM, n = 25, использованы данные по меньшей
мере от трех независимых экспериментов. Статистическая значимость разницы определена по t-критерию Стьюдента:
* p < 0,05; ** p < 0,01; *** p < 0,001; **** p < 0,0001; ns - статистически незначительные изменения
среди исследуемых культур обнаружено не
лении EGF их подвижность увеличивается,
было (рис. 2, а и б). При этом у SK-BR-3 Anks1а
увеличивается количество активно мигрирую-
локализуется в центральной части клетки и в
щих клеток, наблюдается расползание клеток
ядре, а на активном крае Anks1а практически не
из островка. Подавление Anks1a при отсут-
выявляется (рис. 2, в и г). У клеток MDA-MB-231
ствии EGF приводило к почти полной оста-
(тройной негативный рак) Anks1а выявляется
новке клеток, а при добавлении EGF скоро-
как в центральной части клеток, так и на актив-
сти движения подвижных контрольных клеток
ном крае: там, где происходит Arp2/3-зависимая
и клеток с подавленной экспрессией Anks1a
полимеризация актина (рис. 2, в и д).
практически не различались (рис. 3, г). На-
Таким образом, в линии MDA-MB-231,
правленность движения MCF-10A также не ме-
в которой отсутствуют HER2, локализация
нялась при подавлении Anks1a (рис. 3, ж).
Anks1a наблюдается в зоне краевой активно-
Клетки SK-BR-3 (оверэспрессирован HER2)
сти, тогда как у клеток SK-BR-3 не наблюда-
очень чувствительны к присутствию EGF в сре-
лось концентрации Anks1a на активном крае.
де, при добавлении EGF количество подвижных
Влияние подавления экспрессии Anks1а на
клеток увеличивается примерно на 10% (с 55
миграционную активность клеток МЖ. Экспрес-
до 65%), а также возрастает скорость их мигра-
сия Anks1a была подавлена с помощью транс-
ции (рис. 3, д). Подавление активности Anks1a
фекции клеток малыми интерферирующими
не оказывает существенного влияния на мигра-
РНК (Anks1a esiRNA). Контроль за подавле-
ционные способности этих клеток как при от-
нием экспрессии осуществляли с помощью
сутствии, так и в присутствии EGF, однако не-
Вестерн-блота (рис. 3, а-в). Мы оценивали
сколько снижает стимулирующий эффект EGF,
количество движущихся клеток и характер их
хотя разница недостоверна. В то же время при
движения в контрольных культурах и в культу-
подавлении экспрессии Anks1a движение клеток
рах, трансфицированных Anks1a esiRNA.
SK-BR-3 становится более хаотичным, направ-
Клетки MCF-10A в редкой культуре ма-
ленность их движения по сравнению с контроль-
лоподвижны, образуют островки. При добав- ными значениями снижается (рис. 3, з).
БИОХИМИЯ том 87 вып. 12 2022
2040
ЖОЛУДЕВА и др.
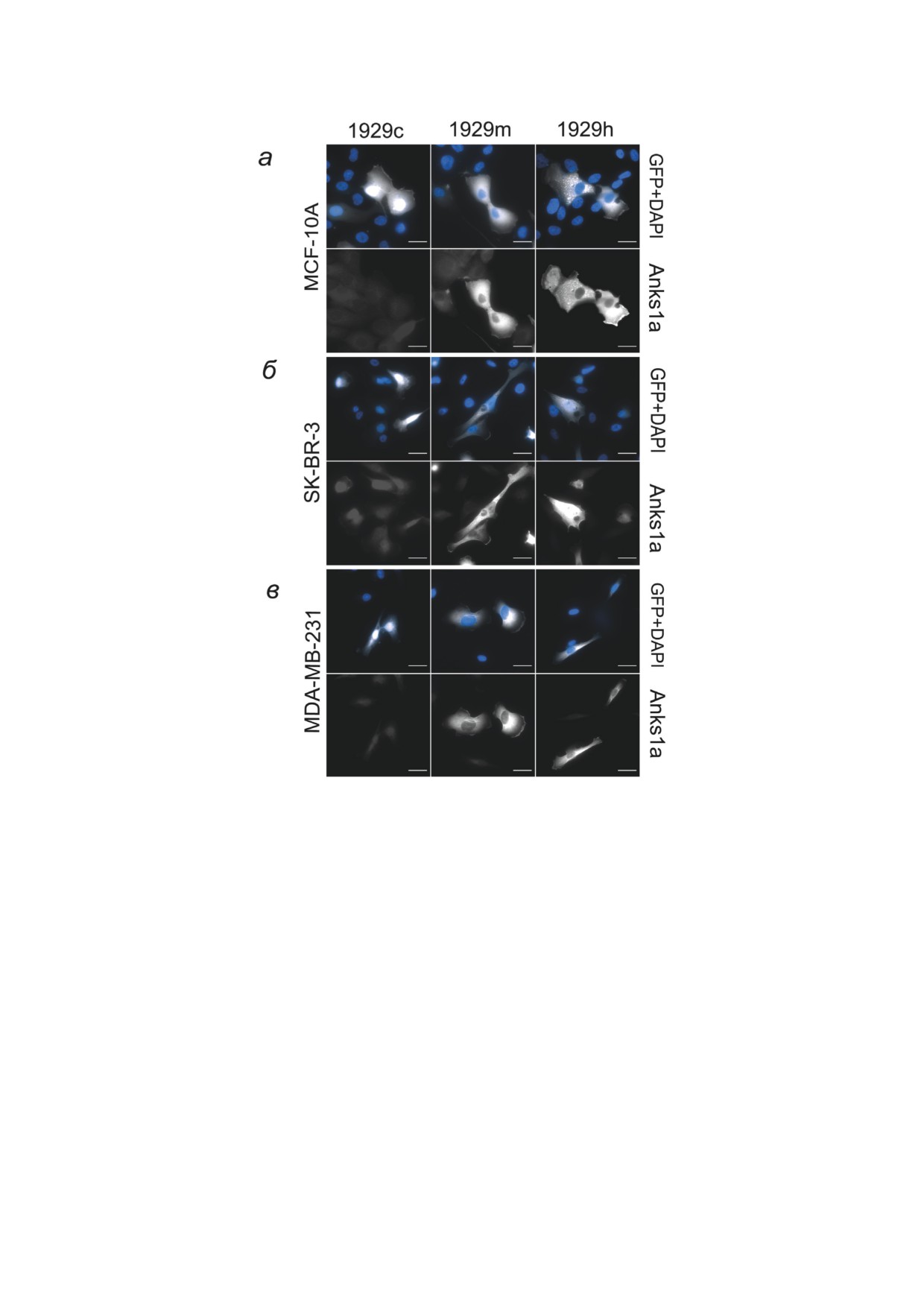
Рис. 4. Распределение Anks1a при оверэкспрессии. 1929с, 1929m и 1929h - клетки, трансфицированные контрольной
плазмидой 1929c и плазмидами 1929m и 1929h соответственно, трансфекция которыми приводит к увеличению экс-
прессии белка Anks1a. Окрашивание на Anks1a, DAPI, GFP. Трансфицированными считаем клетки, в которых детекти-
руется свечение GFP, DAPI демонстрирует общее количество клеток на препарате. а - Распределение Anks1a в клетках
MCF-10; б - распределение Anks1a в клетках SK-BR-3 с оверэкспрессией HER2; в - распределение Anks1a в клетках
MDA-MB-231 (трижды негативный рак). Флуоресцентная микроскопия. Масштабная линия - 20 мкм
Миграционная активность клеток MDA-
клеток мы проводили в обычной для этих кле-
MB-231 (отсутствуют HER2), как и следова-
ток культуральной среде без дополнительного
ло ожидать, практически не зависит от нали-
стимулирования EGF. Контрольными считали
чия EGF. Подавление экспрессии Anks1a не
клетки, полученные за счет трансфекции плаз-
влияло на количество мигрирующих клеток,
мидой 1929c, экспрессирующие GFP. В клетках
но скорость миграции активированных EGF
MCF-10A в результате трансфекции контроль-
клеток достоверно снижалась, направленность
ной плазмидой
1929c при флуоресцентном
движения при этом не менялась (рис. 3, е и и).
окрашивании интенсивность и распределе-
Этот эффект не зависит от участия Anks1a в
ние свечения Anks1a не менялись. В клетках с
обмене рецепторов HER2, и, таким образом,
оверэкспрессией Anks1a (полученной за счет
может зависеть от другой активности Anks1a,
трансфекции как плазмидой 1929m, так и плаз-
например, от его функции как эффектора Rac.
мидой 1929h) наблюдается существенное увели-
Внутриклеточное распределение Anks1a при
чение интенсивности флуоресценции Anks1a,
оверэкспрессии. Опыты по исследованию влия-
кроме того, наблюдается перераспределение
ния оверэкспрессии Anks1а на подвижность
Anks1a к активному свободному краю клеток
БИОХИМИЯ том 87 вып. 12 2022
Anks1a КАК РЕГУЛЯТОР МИГРАЦИИ КЛЕТОК
2041
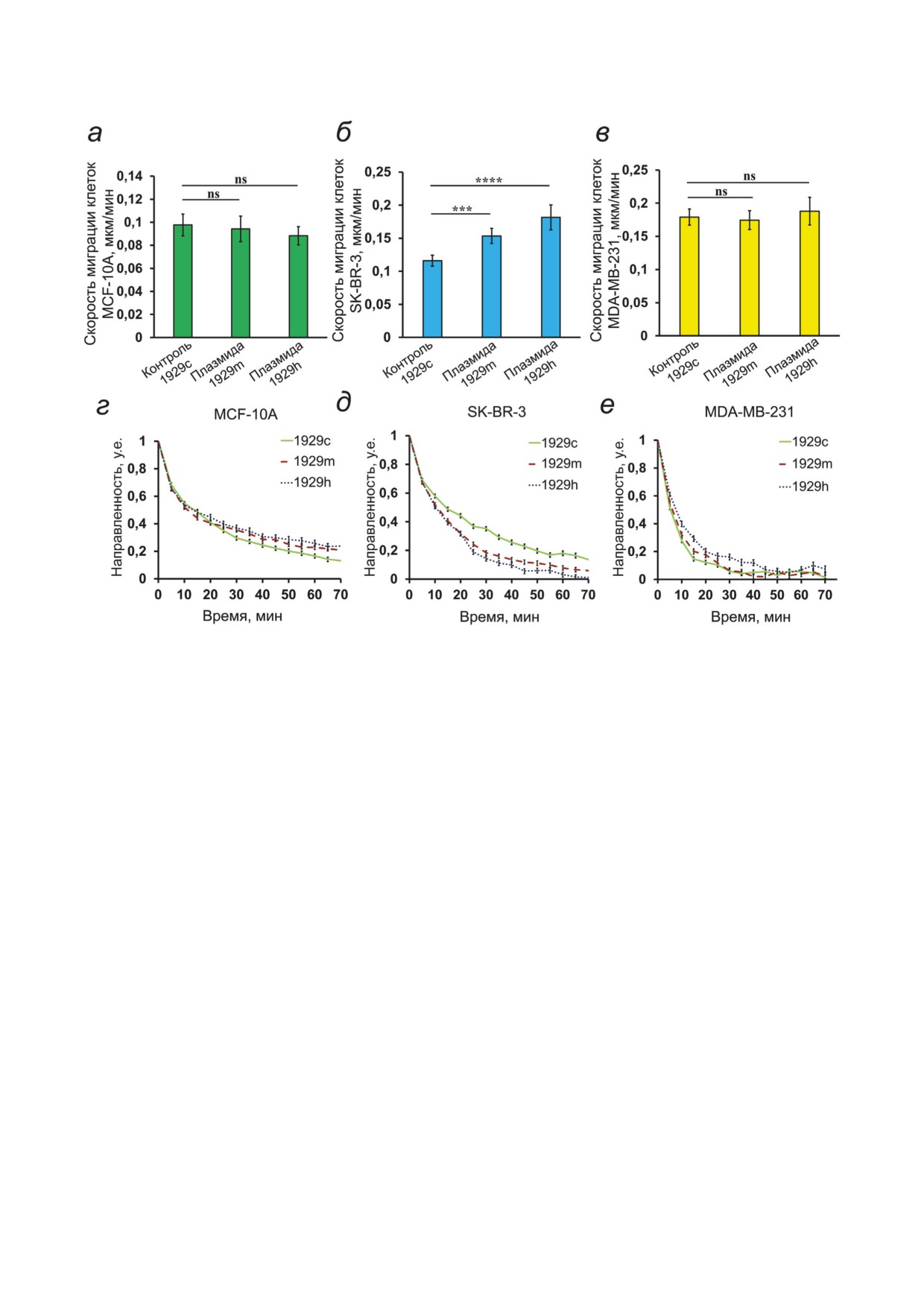
Рис. 5. Влияние оверэкспрессии Anks1а на миграционную активность клеток МЖ. а-в - Скорости и г-е - направ-
ленность движения клеток с оверэкспрессией белка Anks1a. 1929с, 1929m и 1929h - клетки, трансфицированные кон-
трольной плазмидой 1929c и плазмидами 1929m и 1929h соответственно, трансфекция которых приводит к увеличению
экспрессии белка Anks1a. Данные представляют собой среднее значение ± SEM по меньшей мере трех независимых
экспериментов. Статистическая значимость разницы определена по t-критерию Стьюдента: * p < 0,05; ** p < 0,01;
*** p < 0,001; **** p < 0,0001; ns - статистически незначительные изменения
(обозначено белыми стрелками) (рис. 4, а).
ся в околоядерной области, а также на актив-
Степень распластанности клеток с оверэкс-
ном крае клетки. В клетках с оверэкспрессией
прессией Anks1a существенно не отличается от
Anks1a не наблюдается заметного перераспре-
контрольной.
деления Anks1a. Степень распластанности кле-
Клетки аденокарциномы SK-BR-3 мелкие,
ток с оверэкспрессией Anks1a также существен-
преимущественно одиночные, часто поляризо-
но не отличается от контрольных (рис. 4, в).
ваны, образуют ламеллиподию на ведущем крае.
Влияние оверэкспрессии Anks1а на мигра-
В контрольных SK-BR-3, трансфициро-
ционную активность клеток. Мы анализирова-
ванных 1929c, Anks1a располагается в около-
ли изменение скорости движения клеток при
ядерной области. Клетки с оверэкспрессией
оверэкспрессии Anks1a (рис. 5). Полученные
Anks1a, полученной в результате трансфекции
данные свидетельствуют, что достоверно зна-
плазмидами 1929m и 1929h, выглядят более
чимое изменение в скорости миграции про-
распластанными, по сравнению с контрольны-
исходит только при оверэкспрессии белка в
ми, наблюдается перераспределение Anks1a,
клетках SK-BR-3, при этом эффект увеличения
увеличивается его свечение на активном крае
скорости миграции происходит как в клетках,
клетки (рис. 4, б).
трансфицированных плазмидой 1929m, так и
Контрольные клетки трижды негативной
плазмидой 1929h. При этом уменьшалась на-
аденокарциномы МЖ человека MDA-MB-231
правленность движения этих клеток. В клетках
имеют фибробластоподобную форму. В культу-
MCF-10A и MDA-MB-231 при оверэкспрес-
ре, преимущественно, располагаются одиночно
сии Anks1a достоверных изменений скорости
или парами, редко небольшими островками.
движения отмечено не было, незначитель-
В клетках MDA-MB-231, трансфициро-
но увеличивалась направленность движения
ванных 1929c (контроль), Anks1a располагает- MCF-10A.
БИОХИМИЯ том 87 вып. 12 2022
2042
ЖОЛУДЕВА и др.
Таким образом, оверэкспрессия Anks1a
рован [26], мы исследовали, как оверэкспрес-
большее влияние оказывает на подвижность
сия Anks1a влияет на миграционное поведение
тех клеток, в которых отмечено повышенное
нормальных и опухолевых клеток МЖ. Мы
содержание HER2. Вероятно, это можно объ-
показали, что при оверэкспрессии Anks1a в
яснить участием Anks1a в обмене тирозин-
клеточных линиях MCF-10А и SK-BR-3, содер-
киназных рецепторов (РТК) и вовлечением в
жащих HER2, наблюдалось увеличение степе-
сигналинг EphA2/ErbB2.
ни распластанности клеток. При этом интен-
сивность свечения Anks1a на активном крае
клеток возрастала (рис 4, а и б). Это может яв-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ляться следствием того, что при оверэкспрес-
сии избыток Anks1a может аккумулироваться в
Целью нашей работы была оценка участия
местах взаимодействия с активированным Rac
Anks1a в регуляции миграции клеток и выясне-
и проявлять активность в качестве его эффек-
ние возможных клеточных механизмов такого
тора. А клетки SK-BR-3 с амплифицирован-
участия. По имеющимся литературным дан-
ным HER2 в результате оверэкспрессии Anks1a
ным, Anks1a участвует в обмене рецепторов к
приобретали большую скорость и меньшую на-
эпидермальному фактору роста HER2 [27]. Ме-
правленность миграции. Поскольку такого эф-
тодом GST pull-down мы показали, что Anks1a
фекта не наблюдалось в других исследованных
способен связываться с активированным Rac1,
клеточных линиях, действие Anks1a в этом слу-
т.е. теоретически может быть его эффектором.
чае, скорее всего, опосредовано его активно-
Согласно результатам Вестерн-блот-анализа, ко-
стью при регуляции обмена тирозинкиназных
личество белка Anks1a среди исследуемых куль-
рецепторов.
тур не различалось. При этом в клетках с нор-
Таким образом, мы предполагаем, что
мальным содержанием рецепторов к EGF и при
Anks1a является эффектором активированно-
их отсутствии Anks1a выявляется с помощью им-
го Rac, но влияние его в этом качестве, по край-
мунофлуоресцентного окрашивания как в цен-
ней мере на исследованных нами клетках МЖ,
тральной части клеток, так и на клеточном крае
минимально. Этот белок способен оказывать
в местах ламеллиподиальной активности. Таким
влияние на подвижность клеток МЖ благода-
образом, его распределение на активном крае сов-
ря его участию в механизме обмена рецепторов
падает с распределением активного Rac, отвечаю-
к EGF, а в клетках, где данные рецепторы от-
щего за образование протрузий и за миграцию
сутствуют (тройной негативный рак МЖ), зна-
клеток [34-37]. В клетках SK-BR-3 с оверэкс-
чимого влияния Anks1a на миграционный по-
прессией рецептора EGF Anks1a выкрашивается
тенциал опухолевых клеток отмечено не было.
в центральной части клеток и в ядре, а на краю
Из этого следует, что имеет смысл рассматри-
ламеллиподии отсутствует. Можно предполо-
вать подавление Anks1a в качестве возможно-
жить, что при оверэкспрессии рецептора весь
го терапевтического подхода для подавления
пул Anks1a оказывается вовлечен в обмен рецеп-
метастазирования только в случае опухолей,
торов, и он не поступает в места активности Rac.
у которых отмечена повышенная экспрессия
Подвижность клеток MDA-MB-231, харак-
HER2/Neu, EphA2/ErbB2 или других РТК [23,
теризующихся отсутствием экспрессии HER2,
27]. Эффект такого подавления сводится не
практически не зависела от присутствия EGF,
только к ингибированию миграции опухоле-
но подавление Anks1a с помощью малых ин-
вых клеток, но и будет обладать более широким
терферирующих РНК приводило к незначи-
действием, так как РТК вовлечены в регуля-
тельному снижению скорости миграции этих
цию многих клеточных функций [23, 24].
клеток. Также подавление экспрессии Anks1a
привело к практически полной остановке дви-
Вклад авторов. А.Ю. Александрова,
жения клеток MCF-10A при отсутствии EGF и
А.М. Готро - концепция и руководство рабо-
значительному снижению скорости этих клеток
той; А.О. Жолудева, М.Е. Ломакина, Е.А. Ор-
в присутствии EGF. Известно, что понижение
лова, Я. Ванг, А. Фокин, А. Полесская - про-
активности Rac приводит к нарушению кле-
ведение экспериментов; А.Ю. Александрова,
точной миграции [38]. Это позволяет предпо-
А.М. Готро, А.О. Жолудева, М.Е. Ломакина,
ложить, что в клетках с недостатком рецепторов
А. Фокин, А. Полесская - обсуждение результа-
EGF Anks1a может принимать участие в регу-
тов исследования; А.Ю. Александрова, А.О. Жо-
ляции миграции в качестве эффектора Rac, но,
лудева, М.Е. Ломакина, А. Фокин - написание и
вероятно, этот эффект незначителен.
редактирование текста.
Поскольку, согласно литературным дан-
Финансирование. Работа выполнена в рам-
ным, в опухолях Anks1a часто оверэкспресси-
ках Международной ассоциированной лабора-
БИОХИМИЯ том 87 вып. 12 2022
Anks1a КАК РЕГУЛЯТОР МИГРАЦИИ КЛЕТОК
2043
тории (ЛИА) «Поиск и характеристика новых
Конфликт интересов. Авторы заявляют
белков, регулирующих клеточное движение
об отсутствии конфликта интересов.
и отвечающих за диссеминацию опухолевых
Соблюдение этических норм. Настоящая
клеток» и поддержана Российским фондом
статья не содержит описания каких-либо ис-
фундаментальных исследований НЦНИЛ_а
следований с использованием людей и живот-
(грант № 18-54-16006).
ных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Hanahan, D., and Weinberg, R. A. (2011) Hallmarks
12.
Kurisu, S., Suetsugu, S., Yamazaki, D., Yamaguchi, H.,
of cancer: the next generation, Cell, 144, 646-674,
and Takenawa, T. (2005) Rac-WAVE2 signaling is in-
doi: 10.1016/j.cell.2011.02.013.
volved in the invasive and metastatic phenotypes of
2.
Svitkina, T. (2018) The actin cytoskeleton and actin-
murine melanoma cells, Oncogene, 24, 1309-1319,
based motility, Cold Spring Harb. Perspect. Biol., 10,
doi: 10.1038/sj.onc.1208177.
a018267, doi: 10.1101/cshperspect.a018267.
13.
Rana, P. S., Alkrekshi, A., Wang, W., Markovic, V.,
3.
Bonello, T. T., Stehn, J. R., and Gunning, P. W. (2009)
and Sossey-Alaoui, K. (2021) The role of WAVE2
New approaches to targeting the actin cytoskeleton
signaling in cancer, Biomedicines, 9,1217, doi: 10.3390/
for chemotherapy, Future Med. Chem., 1, 1311-1331,
biomedicines9091217.
doi: 10.4155/fmc.09.99.
14.
Taniuchi, K., Yawata, T., Tsuboi, M., Ueba, T., and
4.
Raftopoulou, M., and Hall, A. (2004) Cell migration:
Saibara, T. (2019) Efficient delivery of small interfer-
Rho GTPases lead the way, Dev. Biol., 265, 23-32,
ing RNAs targeting particular mRNAs into pancre-
doi: 10.1016/j.ydbio.2003.06.003.
atic cancer cells inhibits invasiveness and metastasis
5.
Hall, A., and Nobes, C. D. (2000) Rho GTPases:
of pancreatic tumors, Oncotarget,
10,
2869-2886,
molecular switches that control the organization and
doi: 10.18632/oncotarget.26880.
dynamics of the actin cytoskeleton, Philos. Trans. R.
15.
Takahashi, K., and Suzuki, K.
(2011) WAVE2,
Soc. Lond. B Biol. Sci., 355, 965-970, doi: 10.1098/
N-WASP, and Mena facilitate cell invasion via
rstb.2000.0632.
phosphatidylinositol
3-kinase-dependent
local
6.
Krugmann, S., Jordens, I., Gevaert, K., Driessens, M.,
accumulation of actin filaments, J. Cell Biochem., 112,
Vandekerckhove, J., and Hall, A. (2001) Cdc42 in-
3421-3429, doi: 10.1002/jcb.23276.
duces filopodia by promoting the formation of an
16.
Wang, W., Eddy, R., and Condeelis, J. (2007) The co-
IRSp53: Mena complex, Curr. Biol., 11, 1645-1655,
filin pathway in breast cancer invasion and metastasis,
doi: 10.1016/s0960-9822(01)00506-1.
Nat. Rev. Cancer, 7, 429-440, doi: 10.1038/nrc214.
7.
Charras, G., and Paluch, E. (2008) Blebs lead the way:
17.
Sinha, P., Hütter, G., Köttgen, E., Dietel, M., Scha-
how to migrate without lamellipodia, Nat. Rev. Mol.
dendorf, D., and Kage, H. (1999) Increased expres-
Cell Biol., 9, 730-736, doi: 10.1038/nrm2453.
sion of epidermal fatty acid binding protein, cofilin,
8.
Wang, W., Wyckoff, J. B., Frohlich, V. C., Oleynikov, Y.,
and 14-3-3-sigma (stratifin) detected by two-dimen-
Hüttelmaier, S. et al. (2002) Single cell behavior in
sional gel electrophoresis, mass spectrometry and mi-
metastatic primary mammary tumors correlated with
crosequencing of drug-resistant human adenocarci-
gene expression patterns revealed by molecular profil-
noma of the pancreas, Electrophoresis, 20, 2952-2960,
ing, Cancer Res., 62, 6278-6288.
doi: 10.1002/(SICI)1522-2683(19991001)20:14<2952::
9.
Wang, W., Wyckoff, J. B., Goswami, S., Wang, Y.,
AID-ELPS2952>3.0.CO;2-H.
Sidani, M., et al. (2007) Coordinated regulation of path-
18.
Gunnersen, J. M., Spirkoska, V., Smith, P. E., Danks,
ways for enhanced cell motility and chemotaxis is con-
R. A., and Tan, S. S. (2000) Growth and migration
served in rat and mouse mammary tumors, Cancer Res.,
markers of rat C6 glioma cells identified by serial anal-
67, 3505-3511, doi: 10.1158/0008-5472.CAN-06-3714.
ysis of gene expression, Glia, 32, 146-154.
10.
Pankov, R., Endo, Y., Even-Ram, S., Araki, M.,
19.
Davila, M., Frost, A. R., Grizzle, W. E., and
Clark, K., Cukierman, E., Matsumoto, K., and
Chakrabarti, R. (2003) LIM kinase 1 is essential for the
Yamada, K. M. (2005) A Rac switch regulates random
invasive growth of prostate epithelial cells: implications
versus directionally persistent cell migration, J. Cell
in prostate cancer, J. Biol. Chem., 278, 36868-36875,
Biol., 170, 793-802, doi: 10.1083/jcb.200503152.
doi: 10.1074/jbc.M306196200.
11.
Zhou, K., Rao, J., Zhou, Z. H., Yao, X. H., Wu, F.,
20.
Yoshioka, K., Foletta, V., Bernard, O., and Itoh, K.
Yang, J., Yang, L., Zhang, X., Cui, Y.-H., Bian, X.-W.,
(2003) A role for LIM kinase in cancer invasion, Proc.
Shi, Yu, and Ping, Yi-F. (2018), RAC1-GTP promotes
Natl. Acad. Sci. USA, 100, 7247-7252, doi: 10.1073/
epithelial-mesenchymal transition and invasion of
pnas.1232344100.
colorectal cancer by activation of STAT3, Lab. Invest.,
21.
Pandey, A., Blagoev, B., Kratchmarova, I., Fernandez,
98, 989-998, doi: 10.1038/s41374-018-0071-2.
M., Nielsen, M., Kristiansen, T. Z., Ohara, O.,
БИОХИМИЯ том 87 вып. 12 2022
2044
ЖОЛУДЕВА и др.
Podtelejnikov, A. V., Roche, S., Lodish, H. F., and
Vacher, S., Denisov, E. V., Tashireva, L. A., Perel-
Mann, M. (2002) Cloning of a novel phosphotyrosine
muter, V. M., Cherdyntseva, N. V., Bièche, I., and
binding domain containing molecule, Odin, involved
Gautreau, A. M.
(2019) Cortical branched actin
in signaling by receptor tyrosine kinases, Oncogene, 21,
determines cell cycle progression, Cell Res., 29, 432-
8029-8036, doi: 10.1038/sj.onc.1205988.
445, doi: 10.1038/s41422-019-0160-9.
22.
Shin, J., Gu, C., Park, E., and Park, S. (2007) Identi-
32.
Gorelik, R., and Gautreau, A. (2014) Quantitative
fication of phosphotyrosine binding domain-contain-
and unbiased analysis of directional persistence in cell
ing proteins as novel downstream targets of the EphA8
migration, Nat. Protoc., 9, 1931-1943, doi: 10.1038/
signaling function, Mol. Cell Biol., 27, 8113-8126,
nprot.2014.131.
doi: 10.1128/MCB.00794-07.
33.
Holliday, D. L., and Speirs, V. (2011) Choosing the
23.
Casaletto, J. B., and McClatchey, A. I. (2012) Spa-
right cell line for breast cancer research, Breast Cancer
tial regulation of receptor tyrosine kinases in devel-
Res., 13, 215, doi: 10.1186/bcr2889.
opment and cancer, Nat. Rev. Cancer, 12, 387-400,
34.
Kraynov, V. S., Chamberlain, C., Bokoch, G. M.,
doi: 10.1038/nrc3277.
Schwartz, M. A., Slabaugh, S., and Hahn, K. N.
24.
Lemmon, M. A., and Schlessinger, J. (2010) Cell
(2000) Localized Rac activation dynamics visualized
signaling by receptor tyrosine kinases, Cell, 141, 1117-
in living cells, Science, 290, 333-337, doi: 10.1126/
1134, doi: 10.1016/j.cell.2010.06.011.
science.290.5490.333.
25.
Park, S., Lee, H., Lee, J., Park, E., and Park, S. (2019)
35.
Mehidi, A., Rossier, O., Schaks, M., Chazeau, A.,
Ependymal cells require Anks1a for their proper
Binamé, F., Remorino, A., Coppey, M., Karatas, Z.,
development, Mol. Cells, 42, 245-251, doi: 10.14348/
Sibarita, J.-P., Rottner, K., Moreau, V., and Gi-
molcells.2018.0432.
annone, G. (2019) Transient activations of Rac1
26.
Lee, Y., Yoon, K. A., Joo, J., Lee, D., Bae, K., Han,
at the lamellipodium tip trigger membrane protru-
Ji-Y., and Lee, J.-S. (2013) Prognostic implications of
sion, Curr. Biol., 29, 2852-2866.e5, doi: 10.1016/
genetic variants in advanced non-small cell lung cancer:
j.cub.2019.07.035.
a genome-wide association study, Carcinogenesis, 34,
36.
Itoh, R. E., Kurokawa, K., Ohba, Y., Yoshizaki, H.,
307-313, doi: 10.1093/carcin/bgs356.
Mochizuki, N., and Matsuda, M. (2002) Activation of
27.
Lee, H., Noh, H., Mun, J., Gu, C., Sever, S., and
rac and cdc42 video imaged by fluorescent resonance
Park, S. (2016) Anks1a regulates COPII-mediated
energy transfer-based single-molecule probes in the
anterograde transport of receptor tyrosine kinases
membrane of living cells, Mol. Cell Biol., 22, 6582-
critical for tumorigenesis, Nat. Commun., 7, 12799,
6591, doi: 10.1128/MCB.22.18.6582-6591.2002.
doi: 10.1038/ncomms12799.
37.
Steffen, A., Ladwein, M., Dimchev, G. A., Hein, A.,
28.
Tong, J., Sydorskyy, Y., St-Germain, J. R., Taylor, P.,
Schwenkmezger, L., Arens, S., Ladwein, K. I.,
Tsao, M. S., and Moran, M. F. (2013) Odin (ANKS1A)
Holleboom, J. M., Schur, F., Small, J. V., Schwarz, J.,
modulates EGF receptor recycling and stability, PLoS
Gerhard, R., Faix, J., Stradal, T. E. B., Brakebusch, C.,
One, 8, e64817, doi: 10.1371/journal.pone.006481.
and Rottner, K. (2013) Rac function is crucial for cell
29.
Kristiansen, T. Z., Nielsen, M. M., Blagoev, B.,
migration but is not required for spreading and focal
Pandey, A., and Mann, M. (2004) Mouse embryonic
adhesion formation, J. Cell Sci., 126, 4572-4588,
fibroblasts derived from Odin deficient mice display a
doi: 10.1242/jcs.118232.
hyperproliiferative phenotype, DNA Res., 11, 285-292.
38.
Weiss-Haljiti, C., Pasquali, C., Ji, H., Gillieron, C.,
30.
Sladitschek, H. L., and Neveu, P. A. (2015) MXS-
Chabert, C., Curchod, M. L., Hirsch, E., Ridley, A. J.,
chaining: a highly efficient cloning platform for
van Huijsduijnen, R. H., Camps, M., and Rom-
imaging and flow cytometry approaches in mammalian
mel, C.
(2004) Involvement of phosphoinosit-
systems, PLoS One,
10, e0124958, doi:
10.1371/
ide
3-kinase gamma, Rac, and PAK signaling
journal.pone.0124958.
in
chemokine-induced macrophage migration,
31.
Molinie, N., Rubtsova, S. N., Fokin, A., Viswesh-
J. Biol. Chem., 279, 43273-43284, doi: 10.1074/jbc.
waran, S. P., Rocques, N., Polesskaya, A., Schnitzler, A.,
M402924200.
ROLE OF THE ADAPTER PROTEIN Anks1a
IN REGULATING BREAST CANCER CELL MOTILITY
A. O. Zholudeva1, M. E. Lomakina1,2, E. A. Orlova1, Y. Wang2, A. Fokin2, A. Polesskaya2,
A. M. Gautreau2, and A. Y. Alexandrova1*
1 Blokhin National Medical Research Center of Oncology, Ministry of Health of Russia,
115478 Moscow, Russia; e-mail: tonya_alex@yahoo.com
2 CNRS UMR7654, Ecole Polytechnique, Institut Polytechnique de Paris, 91120 Palaiseau, France
БИОХИМИЯ том 87 вып. 12 2022
Anks1a КАК РЕГУЛЯТОР МИГРАЦИИ КЛЕТОК
2045
A critical step in tumor progression is the epithelial-mesenchymal transition, as a result of which cancer cells
(CCs) acquire the ability to mesenchymal migration, the main regulator of which is the Rac→WAVE→Arp2/3
signaling pathway. It was previously shown that proteins interacting with Rac can regulate mesenchymal
migration and thus determine the metastasis efficiency. The search for new regulators of migration is an actual
theoretical and practical task. The adaptor protein Anks1a is one of the proteins interacting with Rac, the
change in its expression has been shown for many tumors. The aim of this study was to find out whether
Anks1a affects CC migration and to identify the mechanism underlying its effect. It has been suggested that
Anks1a can influence CC migration either as a Rac1 effector or by activation of exchange of human epidermal
growth factor receptor-2 (HER2). The effect of enhancing and downregulation of Anks1a expression on the
migration of breast cancer cells with different HER2 status was investigated. Anks1a was shown to interact with
the activated form of Rac1. In the MDA-MB-231 cells (triple negative cancer), which lacks HER2, Anks1a
accumulates at the active cell edge, which is characterized by enrichment with active Rac1, whereas in SK-
BR-3 cells (HER2 overexpressed) no concentration of Anks1a at the active edge was observed. Inhibition of
ANKS1a expression by esiRNA had almost no effect on the CC motility; there was only a slight increase in
the average rate of cell migration in MDA-MB-231 cells. Overexpression of Anks1a leads to an increase in
migration rate of only SK-BR-3 cells, i.e., it affects migration only in case of overexpression of HER2. We
showed that Anks1a is an effector of activated Rac1, but its influence on cell migration in this capacity is
minimal, at least on the breast cell cultures we studied. Anks1a affects the motility of breast cancer cells due to
its involvement in the mechanism of EGF receptor exchange.
Keywords: Anks1a, cell migration, breast cancer, metastasis
БИОХИМИЯ том 87 вып. 12 2022