БИОХИМИЯ, 2022, том 87, вып. 2, с. 160 - 176
УДК 577.112.7;617.741
СВЯЗЬ МЕЖДУ СТРУКТУРОЙ И ШАПЕРОННОЙ АКТИВНОСТЬЮ
αA КРИСТАЛЛИНА ЧЕЛОВЕКА ПОСЛЕ ЕГО МОДИФИКАЦИИ
АССОЦИИРОВАННЫМИ С САХАРНЫМ ДИАБЕТОМ
ОКИСЛИТЕЛЬНЫМИ АГЕНТАМИ И ЗАЩИТНАЯ РОЛЬ
АНТИОКСИДАНТНЫХ МОЛЕКУЛ
© 2022
S.S. Moghadam1, M. Ghahramani1, K. Khoshaman1, A. Oryan2,
A.A. Moosavi Movahedi3,
B.I. Kurganov4
, and R. Yousefi1,3*
1 Protein Chemistry Laboratory, Department of Biology, College of Sciences,
Shiraz University, Shiraz, Iran; e mail: ryousefi@shirazu.ac.ir; r.yousefi2000@gmail.com
2 Department of Pathology, School of Veterinary Medicine, Shiraz University, Shiraz, Iran
3 Institute of Biochemistry and Biophysics (IBB), University of Tehran, Tehran, Iran
4 Bach Institute of Biochemistry, Research Center of Biotechnology
of the Russian Academy of Sciences, 119071 Moscow, Russia
Поступила в редакцию 12.09.2021
После доработки 16.10.2021
Принята к публикации 16.10.2021
Целью исследования было оценить влияние пероксинитрита (PON, агент окислительного стресса при диа
бете), метилглиоксаля (MGO, диабет ассоциированное реактивное карбонильное соединение) и их одно
временного воздействия на структурные и функциональные характеристики αA кристаллина человека
(αA Cry) с помощью различных методов спектроскопии. Кроме того, с помощью метода тензиометрическо
го анализа и метода динамического светорассеяния были определены такие параметры, как поверхностное
натяжение и размеры олигомеров обработанного и необработанного белка. Наши результаты показали, что
инкубация PON и MGO с αA Cry человека приводит к образованию новых хромофоров, вызывает измене
ния в структурах этого белка (от вторичной и до четвертичной), уменьшение размера белковых олигомеров
и значительное усиление шаперонной активности αA Cry. Для отмены действия протестированных хими
ческих соединений применяли аскорбиновую кислоту и глутатион (основные компоненты антиоксидант
ной защиты хрусталика глаза). Как ожидалось, оба изученных антиоксиданта в значительной степени пре
дотвращают образование высокомолекулярных агрегатов белка αA Cry (по результатам SDS ПААГ). Полу
ченные нами результаты свидетельствуют о том, что антиоксидантная защита клеток хрусталика, в частнос
ти глутатион, может обеспечивать эффективную защиту от быстрого возникновения и прогрессирования
диабетической катаракты, предотвращая деструктивные реакции высокореактивных метаболитов, ассоции
рованных с сахарным диабетом.
КЛЮЧЕВЫЕ СЛОВА: αA кристаллин человека, диабетическая катаракта, антиоксиданты хрусталика гла
за, структура белка, шаперонная активность.
DOI: 10.31857/S0320972522020026
ВВЕДЕНИЕ
данты. Следовательно, СД рассматривается как
нарушение обмена веществ, связанное как с
Высокореакционноспособные химические
окислительным, так и с карбонильным стрес
соединения, ассоциированные с сахарным диа
сом ]1[. К карбонильным соединениям, содер
бетом (СД), обычно подразделяют на соедине
жание которых в организме увеличивается
ния, содержащие карбонильные группы, и окси
при СД, относятся многие сахара и производные
сахаров, различные формы продуктов окисле
Принятые сокращения: СД - сахарный диабет;
ния аскорбиновой кислоты и высокореакцион
αA Cry - αA кристаллин; AGE - конечный продукт гли
носпособные побочные продукты метаболизма,
кирования; ANS - 1 анилино 8 нафталиносульфонат; такие как метилглиоксаль (MGO) и малоновый
ASA - аскорбиновая кислота; DLS - динамическое свето
диальдегид (MDA) [2, 3]. Кроме того, СД вызы
рассеяние, dynamic light scattering; α Gls - α глюкозидаза;
вает повышение содержания в организме раз
GSH - глутатион; HMM - высокая молекулярная масса;
MGO - метилглиоксаль; PON - пероксинитрит; ThT - тио
личных активных форм кислорода (ROS) и ак
флавин Т.
тивных форм азота (RNS). Наиболее известным
* Адресат для корреспонденции.
представителем активных форм азота является
160
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
161
пероксинитрит (PON) [4]. Реакционноспособ
стресс, мы изучили роль MGO (реакционноспо
ные соединения, ассоциированные с СД, могут
собный карбонильный метаболит) и PON (ассо
взаимодействовать с широким кругом биомоле
циированный с диабетом оксидант) в структур
кул, в частности с долгоживущими белками, вы
ных и функциональных нарушениях αA Cry че
зывая в них структурные и функциональные
ловека. Высокореактивный карбонильный мета
повреждения и создавая предпосылки для воз
болит MGO вступает в реакцию с аминогруппа
никновения серьёзных осложнений, связанных
ми в белке с образованием шиффовых основа
с данным нарушением обмена веществ [5].
ний, которые затем превращаются в продукты
Кристаллины хрусталика глаза в силу длитель
Амадори. Этот деструктивный путь приводит к
ного периода полураспада и ограниченного об
образованию высокотоксичных для клетки ад
новления являются одними из важных молеку
дуктов белка и сахаров, которые хорошо извест
лярных мишеней для реакционноспособных со
ны как конечные продукты гликирования
единений, ассоциированных с СД. С течением
(AGE) [16]. Кроме того, диабет и воспалитель
времени в кристаллинах накапливаются много
ные процессы сопровождаются образованием в
численные химические модификации, которые
тканях радикалов супероксида и оксида азота, и
в конечном итоге вызывают серьёзные структур
эти два соединения способны образовывать
ные повреждения, приводя к денатурации и аг
PON, который, в свою очередь, является основ
регации белка, что служит основной причиной
ным окислителем и сильным нитрующим аген
рассеяния света в тканях хрусталика [6]. По этим
том [17]. С другой стороны, окислительная сре
причинам СД играет важную роль в развитии ка
да, создаваемая этими соединениями в организ
таракты. Недавние исследования показывают,
ме больных диабетом, способна катализировать
что у людей с диабетом вероятность развития ка
реакции белков с реакционноспособными и со
таракты в 2-5 раз выше, чем у людей без диабе
держащими карбонильные группы соединения
та [7]. Более того, у больных сахарным диабетом
ми, приводя к образованию AGE [18-20]. Есть
катаракта формируется в более молодом возрас
сообщения об одновременном повышении уров
те и быстрее прогрессирует [8].
ня MGO и PON у больных с хронической гипер
Три основные группы белков (α , β и γ
гликемией и катарактой, что может привести к
кристаллины) имеют высокую концентрацию в
серьёзным повреждениям биомолекул хрустали
тканях хрусталика позвоночных. Они образуют
ка глаза, особенно кристаллинам [21, 22]. В хрус
прозрачный матрикс с высоким показателем
таликах глаза имеется сильная антиоксидантная
преломления [9]. Эти белки богаты чрезвычайно
защитная система, которая может противостоять
стабильными структурами бета листов, которые
деструктивному влиянию окислительных аген
играют важную структурную роль в хрусталике
тов, создавать восстановительную среду, в кото
глаза [10]. α Кристаллин (α Cry) состоит из
рой существенно понижается скорость реакций
субъединиц αA и αB и принадлежит к семейству
между карбонильными соединениями и белка
белков теплового шока. Он защищает хрустали
ми [23]. В этом исследовании мы провели изуче
ки глаза от накопления в них развёрнутых белко
ние характера структурных повреждений, выз
вых структур [11]. В целом, любой внутренний
ванных воздействием MGO и PON и их комби
или внешний фактор, влияющий на структуру и
нации на рекомбинатный белок αA Cry челове
функцию кристаллинов или вызывающий ка
ка. Мы также изучили способность двух основ
кое либо изменение взаимодействий между эти
ных антиоксидантов хрусталика глаза человека,
ми белками, будет существенно влиять на каче
а именно: глутатиона (GSH) и аскорбиновой
ство зрения [12]. Генетические мутации и пост
кислоты (ASA), устранять эффекты связанных
трансляционные неферментативные модифика
с СД реактивных соединений.
ции являются двумя основными факторами, ко
торые могут повреждать нативную структуру
кристаллинов хрусталика, приводя к денатура
МАТЕРИАЛЫ И МЕТОДЫ
ции белков и образованию крупных светорассеи
вающих агрегатов в тканях хрусталика [13, 14].
Материалы. Кумасси бриллиантовый голу
Диабетическая катаракта, по видимому, являет
бой (CBB), β меркаптоэтанол (β ME), 1 анили
ся частью многофакторного механизма, и нес
но 8 нафталиносульфонат (ANS), тиофла
колько реактивных метаболитов способствуют
вин Т (ThT), GSH и другие реагенты были полу
развитию помутнения хрусталика наряду с хро
чены от компании «Sigma Aldrich» (США). Ка
ническим повышением содержания сахара в
намицин и изопропил β D 1 тиогалактопира
крови [15]. Поскольку одними из наиболее важ
нозид (IPTG) поступили от компании «Merck»
ных факторов, приводящих к осложнениям при
(США). Для приготовления всех растворов ис
СД, считаются карбонильный и окислительный
пользовали дважды дистиллированную воду.
БИОХИМИЯ том 87 вып. 2 2022
162
MOGHADAM et al.
Экспрессия и очистка рекомбинантного белка
Флуоресцентный анализ. Изменения структу
αA Cry. Клетки Escherichia coli BL21 (DE3)
ры рекомбинантного αA Cry человека (0,15 мг/мл
трансфицировали кДНК αA Cry человека, кло
в 50 мМ фосфатном буфере, pH 7,4) после его
нированной в вектор экспрессии pET 28(b+), и
модификации реагентами MGO и PON анали
их использовали для получения рекомбинант
зировали по внутренней (Trp/Tyr) и внеш
ного белка. Вкратце, клетки выращивали в сте
ней (ANS) флуоресценции с использованием
рильной культуральной среде (LB) при 37 °C в
спектрофотометра Cary Eclipse. Остатки тиро
течение 16 ч. Экспрессию рекомбинантного
зина и триптофана возбуждали при длинах волн
белка αA Cry индуцировали добавлением IPTG
280 и 295 нм соответственно [32, 33]. Для опре
(0,25 мМ). После завершения инкубации клетки
деления флуоресценции дитирозина образцы
центрифугировали и затем лизировали ультра
белков подвергали возбуждению при длине вол
звуком. Рекомбинантный белок выделяли из су
ны 320 нм [34].
пернатанта с помощью ионообменной хрома
Для оценки содержания экспонированных
тографии на колонке с ДЕАЕ целлюлозой и
гидрофобных участков использовали значения
последующей гель фильтрации на колонке
флуоресценции ANS. αA Cry человека инкуби
с Sephacryl S 300 [24-26]. Для оценки чистоты
ровали с 100 мкМ ANS в течение 30 мин при
полученных препаратов белка использовали
комнатной температуре в темноте, и регистри
электрофорез в SDS ПААГ (в 12% ном геле).
ровали спектры эмиссии в диапазоне длин волн
Очищенный αA Cry человека лиофилизировали
400-600 нм при фиксированной длине волны
и до его дальнейшего использования в экспери
возбуждения, равной 365 нм.
ментах хранили при -20 °C.
Для определения возможного образования
Синтез PON и модификация белка пероксинит
амилоидных фибрилл белка использовали
ритом. PON синтезировали, используя реакцию
ThT [35, 36]. С этой целью белки в концентра
холодных растворов 0,6 M нитрита натрия и
ции 0,15 мг/мл инкубировали с ThT (конечная
0,7 M перекиси водорода в 0,6 M соляной кисло
концентрация - 20 мкМ) в течение 5 мин при
те в ледяной бане [27]. Реакцию быстро останав
комнатной температуре. Растворы белков воз
ливали добавлением гидроокиси натрия (1,5 M).
буждали при длине волны 440 нм и регистриро
Чистоту PON определяли спектрофотометричес
вали спектры эмиссии в диапазоне длин волн
ки с использованием коэффициента молярного
450-600 нм.
поглощения - 1670 М-1 см-1 при длине волны
Определение кругового дихроизма белка в
302 нм [28]. Конечный раствор (чистый препа
дальнем ультрафиолетовом диапазоне. Измене
рат PON) замораживали и хранили при -20 °C.
ния вторичной структуры αA Cry человека изу
Рекомбинантный белок (3 мг/мл) инкубиро
чали с помощью метода спектрометрии круго
вали с 2 мМ PON при комнатной температуре в
вого дихроизма (КД). Эти эксперименты про
течение 30 мин в 5 мл 50 мМ натрий фосфатно
водили при фиксированной концентрации бел
го буфера, содержащего 10 мМ бикарбонат нат
ка (0,2 мг/мл), в 50 мМ фосфатном буфере при
рия при pH 7,4 (буфер A). После завершения ре
pH 7 и 25 °C с использованием спектрополяри
акции, для удаления избытка PON, белковый
метра («JASCO», Япония). Длина оптического
раствор подвергали диализу дважды в течение
пути была равна 0,1 см. Полученные спектры
24 ч против дистиллированной воды. Модифи
КД в дальнем ультрафиолетовом диапазоне вы
кацию белка пероксинитритом подтверждали
ражали в виде молярной эллиптичности. Про
путём определения остатков нитротирозина,
центное содержание элементов вторичной
нитротриптофана и дитирозина с помощью УФ
структуры рассчитывали с использованием сер
видимой (UV Vis) спектрофотометрии [29, 30].
вера DICHROWEB с помощью алгоритма
Неферментативное гликирование αA Cry че
CONTIN [37].
ловека. αA Cry человека (3 мг/мл) инкубировали
Определение хромофоров AGE. Образование
с 5 мМ MGO в 200 мМ фосфатном буфере
различных хромофоров AGE в αA Cry человека
(pH 7,4), содержащем 0,01% ный азид натрия, в
определяли флуориметрически [38] в растворе
темноте при 37 °C в течение трех дней. Затем об
белка (0,15 мг/мл) в 50 мМ фосфатном буфере
разцы белка подвергали диализу против фос
при pH 7,4. Были проанализированы различные
фатного буфера в течение 24 ч, чтобы удалить не
хромофоры конечных продуктов гликирования
вступившие в реакцию производные сахаров.
(AGE), такие как аргпиримидин (возбуждения
αA Cry
(3
мг/мл) также модифицировали
при 322 и 381 нм), K2P [1 (5 амино 5 карбокси
смесью PON (2 мМ) и MGO (5 мМ) в 50 мМ
пентил) 4 (5 амино 5 карбоксипентил ами
фосфатном буфере, содержащем 0,01% ный
но) 3 гидрокси 2,3 дигидропиридиний; воз
азид натрия (pH 7,4) в течение 30 мин. Избыток
буждение при 342 нм], карбоксиметиллизин
реагентов в образцах удаляли диализом [31].
(возбуждение при 352 нм), пентозидин (возбуж
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
163
дение при 335, 370 и 375 нм) и весперли
концентрации 0,2 Ед./мл и затем инкубировали
зин A (возбуждение при 370 нм) [39-42].
при 46 °C в присутствии αA Cry (0,05 мг/мл) или
Определение поверхностного натяжения. По
при его отсутствии. Для определения кинетики
верхностное натяжение раствора белка (1 мг/мл)
процесса инактивации фермента его активность
определяли в
100
мМ фосфатном буфере
измеряли через каждые 5 мин [49].
(pH 7,4) при 25 °C с использованием тензиомет
Электрофорез белков в SDS ПААГ. Электро
ра (Krüss K100) по кольцевому методу Du
форетическую подвижность белков в 12% ном
Noüy [43].
полиакриламидном геле оценивали по стандарт
Метод динамического рассеяния света (DLS).
ному протоколу проведения электрофореза в
Распределение олигомеров αA Cry человека по
SDS ПААГ [50, 51]. На каждую дорожку нано
их размеру определяли в образцах белков
сили по 12,5 мкг белка. Для визуализации бел
(1,5 мг/мл), приготовленных в 50 мМ фосфат
ковых полос гель окрашивали CBB.
ном буфере (pH 7,4), при 25 °C с использовани
Определение концентрации белка. Чтобы оп
ем прибора Nanotrac Wave («Microtrac», США).
ределить концентрацию αA Cry человека,
При использовании данного метода лазерный
1 мг белка растворяли в 50 мМ фосфатном буфе
луч с длиной волны 780 нм и под углом 90° отра
ре (pH 7,4), и определяли концентрацию полу
жался белковым образцом [44]. Полученные ре
ченного раствора белка на спектрофотометре
зультаты анализировались с помощью програм
Т90+ UV Vis («PG Instruments Ltd.», Китай) при
много обеспечения Microtrac FLEX.
длине волны 280 нм с использованием коэффи
Определение шапероноподобной активности.
циента экстинкции 0,725 для 1 мг/мл раствора
Шапероноподобную активность αA Cry челове
белка [52, 53]. Концентрацию инсулина (коэф
ка, препятствующую агрегации инсулина, опре
фициент экстинкции - 1,08 на 1 мг/мл) опреде
деляли при
40
°C на спектрофотометре
ляли путём измерения его поглощения
VisUV Cecil CE 7200 («Cecil Instruments Ltd.»,
при 276 нм.
Великобритания), снабжённом регулятором
Статистический анализ. Для анализа данных
температуры. Регистрировали количество света,
использовали однофакторный дисперсионный
отражённого при 360 нм, как функцию времени.
анализ ANOVA (One way ANOVA test) и прог
Агрегацию инсулина вызвали добавлением ди
рамму Sigma Plot 12. Значение p < 0,05 рассмат
тиотрейтола (DTT). Для количественной оцен
ривалось как статистически достоверное [54].
ки шапероноподобной активности αA Cry ис
пользовали следующее уравнение [45, 46]:
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
% защиты = (1 - Ar/Ar0) × 100,
(1)
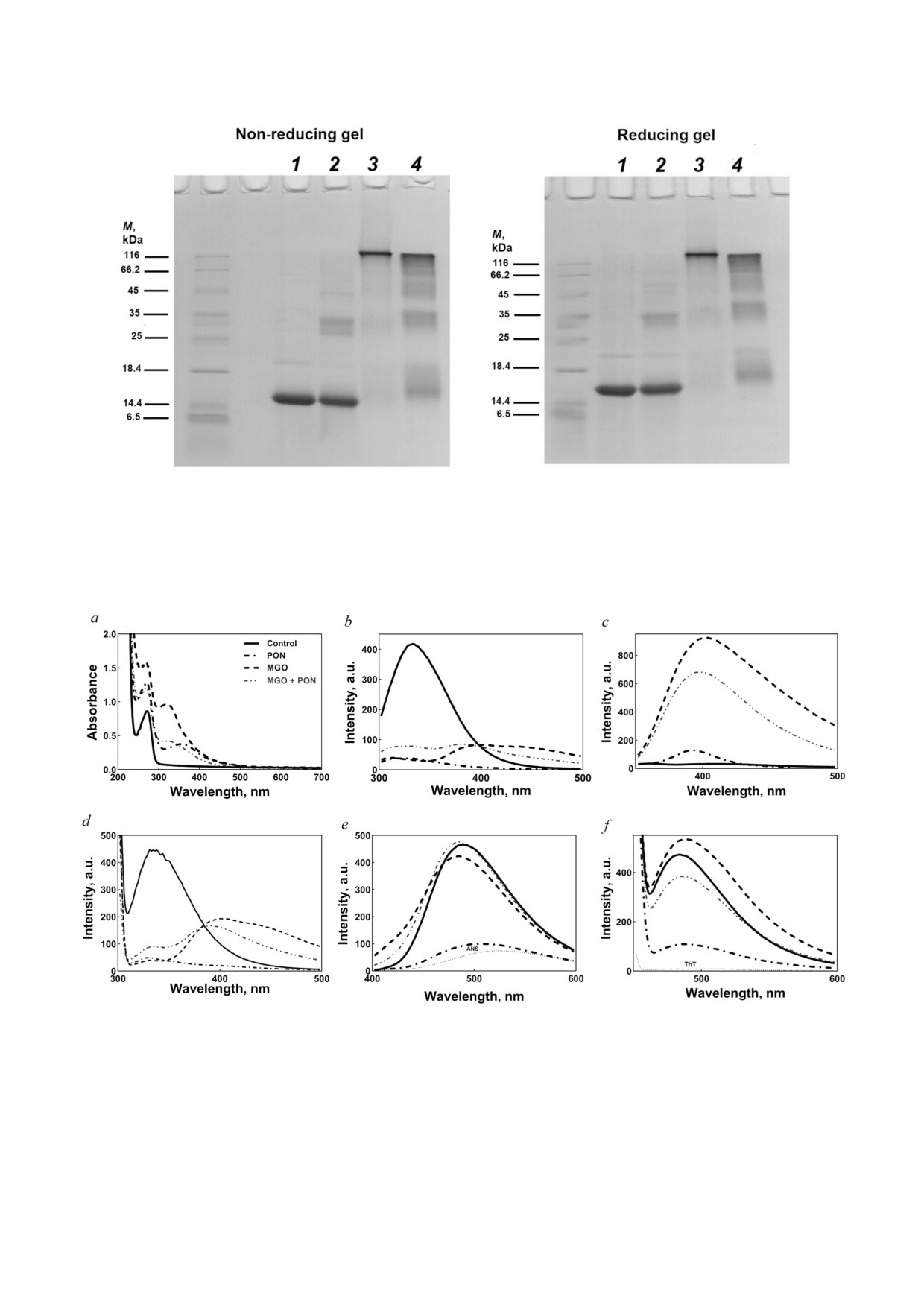
Оценка образования ковалентных сшивок в
где Ar и Ar0 - это площади под поглощением све
модифицированном белке αA Cry человека с по
та против времени в присутствии шаперона
мощью метода электрофореза в SDS ПААГ. Бел
(αA Cry) и при его отсутствии соответственно.
ки кристаллины образуют большие олигомер
Способность αA Cry вызывать рефолдинг дру
ные комплексы, которые играют важную роль в
гих белков. Дрожжевая α глюкозидаза (α Gls)
помутнении хрусталика и образовании катарак
полностью разворачивалась и инактивирова
ты [55]. Пероксинитрит (PON) и метилглиок
лась в присутствии 8 М мочевины. Затем рас
саль (MGO) способствуют образованию ката
твор фермента разводили в 100 раз фосфатным
ракты, индуцируя окислительный и карбониль
буфером в присутствии αA Cry или при его от
ный стресс соответственно в хрусталиках гла
сутствии. Далее определяли активность α Gls, и
за [56, 57]. Одним из наиболее распространён
в качестве индекса рефолдинга рассматривали
ных методов оценки образования белковых оли
восстановление ферментативной активнос
гомеров большого размера является электрофо
ти [47].
рез в SDS ПААГ, который можно проводить как
Способность αA Cry восстанавливать фермен
в восстанавливающих условиях, так и при отсут
тативную активность α Gls в условиях теплового
ствии восстановителей (рис. 1).
стресса определяли с помощью термической
В этом исследовании образцы рекомбинант
инактивации дрожжевой α глюкозидазы. Этот
ного αA Cry человека, обработанные PON и
фермент очень чувствителен к высокой темпе
MGO, подвергали электрофорезу, чтобы оце
ратуре, и инкубация при 52 °C через 1 мин при
нить степень олигомеризации белков и образо
водит к потере его активности на 50%. При 46 °C
вание в них перекрестных сшивок [58]. Как по
50% ная инактивация фермента достигается
казано на рис. 1, в образце, обработанном PON,
примерно за 15 мин [48]. Фермент разводили в
в невосстанавливающих условиях полоса, соот
0,1 M фосфатном буфере (pH 7,0) до конечной
ветствующая нативному белку, исчезла, и в то же
БИОХИМИЯ том 87 вып. 2 2022
164
MOGHADAM et al.
время появились белковые олигомеры большо
и 405 нм, что предполагает образование дитиро
го размера. Наблюдались полосы с молекуляр
зиновых перекрёстных сшивок [64]. Реакция
ными массами примерно 30-35 кДа, указываю
αA Cry с метилглиоксалем приводила к макси
щие на перекрестные сшивки модифицирован
муму поглощения, указывая на образование но
ного белка. Наличие нескольких белковых по
вых хромофорных групп. Обработка αA Cry
лос в восстанавливающих условиях указывало
смесью PON и MGO вызывала значительное
на то, что помимо дисульфидных связей другие
снижение пика поглощения, расположенного
ковалентные связи участвовали в образовании
между пиками поглощения αA Cry после его
агрегатов белков с высокой молекулярной мас
инкубации или с PON, или с MGO.
сой (HMM). Обработка αA Cry человека метил
Влияние PON и MGO на структуру αA Cry
глиоксалем также приводила к образованию
человека дополнительно оценивали по флуорес
высокомолекулярного белка. Эти агрегаты
ценции остатков триптофана, тирозина и дити
HMM способствуют развитию катаракты, вызы
розина. Как показано на рис. 2, b и d, белок, мо
вая помутнение хрусталика и рассеивание пада
дифицированный PON, MGO (гликированный)
ющего света. Как показано на рис. 1, основная
и смесью PON + MGO, демонстрировал сниже
часть гликированных белков задерживалась из за
ние интенсивности флуоресценции остатков ти
их очень большого размера на границе между
розина и триптофана. Наше исследование выя
концентрирующим и разделяющим гелем [59,
вило способность PON превращать остатки ти
60]. Также на рис. 1 показаны картины электро
розина и триптофана в новые хромофоры, такие
форетической подвижности в восстанавливаю
как дитирозин, нитротирозин и нитротрипто
щих и невосстанавливающих условиях модифи
фан. Согласно нашим предыдущим результатам,
цированного MGO белка, которые свидетель
для образцов белка, инкубированных с MGO, ха
ствуют о том, что в образовании HMM агрега
рактерны максимумы на двух длинах волн в этой
тов участвуют ковалентные связи, отличающие
области из за переноса энергии от тирозина к
ся от дисульфидных ковалентных связей. Более
новым хромофорам. Значительное снижение ин
того, при обработке αA Cry человека смесью
тенсивности флуоресценции тирозина и трипто
MGO и PON наблюдались значительные изме
фана наблюдали после индивидуальной инкуба
нения электрофоретической подвижности и ин
ции αA Cry человека с PON и MGO [20, 22].
тенсивности окраски белковых полос. Одновре
Выявленное снижение интенсивности флуо
менная обработка белка пероксинитритом и ме
ресценции тирозина и триптофана может быть
тилглиоксалем также приводила к образованию
связано с крупными структурными изменения
HMM агрегатов. Сравнение картин электрофо
ми в микроокружении остатков ароматических
ретического разделения белков в восстанавли
аминокислот. Изучение флуоресценции дитиро
вающих условиях и без восстановителей не выя
зина (рис. 2, c) выявило неожиданно сильное
вило существенных различий, что позволяет
увеличение интенсивности флуоресценции бел
предположить, что белковые олигомеры сшиты
ка, обработанного MGO или смесью PON и
ковалентными связями, отличными от дисуль
MGO, в то время как образование дитирозина
фидных.
является специфичным для реакции белка с
Оценка структуры модифицированного αA Cry
PON [29]. Поскольку измерения на спектрофо
с помощью УФ видимой (UV Vis) спектрофото
тометре в ближнем ультрафиолетовом диапазо
метрии и флуоресцентной спектроскопии. По дан
не и видимой части спектра показали, что пе
ным UV Vis спектрофотометрии и флуоресцент
рекрестные ковалентные сшивки с образовани
ной спектроскопии, модификация αA Cry чело
ем дитирозина происходят только в PON моди
века метилглиоксалем и пероксинитритом или
фицированном белке, пики высокой интенсив
смесью этих реагентов (MGO + PON) приводи
ности, которые появляются в белке, обработан
ла к значительным структурно функциональ
ном метилглиоксалем, или в образцах белка, ин
ным изменениям белка, образованию новых
кубированных со смесью PON и MGO, могут
хромофоров и олигомеризации белка. Как пока
быть отнесены на счёт ассоциированных с про
зано на рис. 2, a, спектры поглощения белка, об
цессом гликирования хромофоров, пики эмис
работанного PON, указывают на увеличение ко
сии которых перекрываются с пиком дитирози
личества дитирозина, нитротирозина и нитро
на. Новые пики эмиссии флуоресценции в бел
триптофана, что видно из величин оптического
ках, обработанных MGO, и в меньшей степе
поглощения при 428 нм (ε428нм = 4200 М-1 см-1),
ни - в белке, модифицированном смесью
400
нм (ε400нм =
5200
М-1 см-1) и
330
нм
PON + MGO, указывают на образование специ
(ε330нм = 4000 М-1 см-1) соответственно [61-63].
фичных хромофоров [22, 29].
Обработка αA Cry человека пероксинитритом
Степень экспонирования гидрофобных по
вызывала повышение эмиссии между
375
верхностей напрямую связана со скоростью аг
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
165
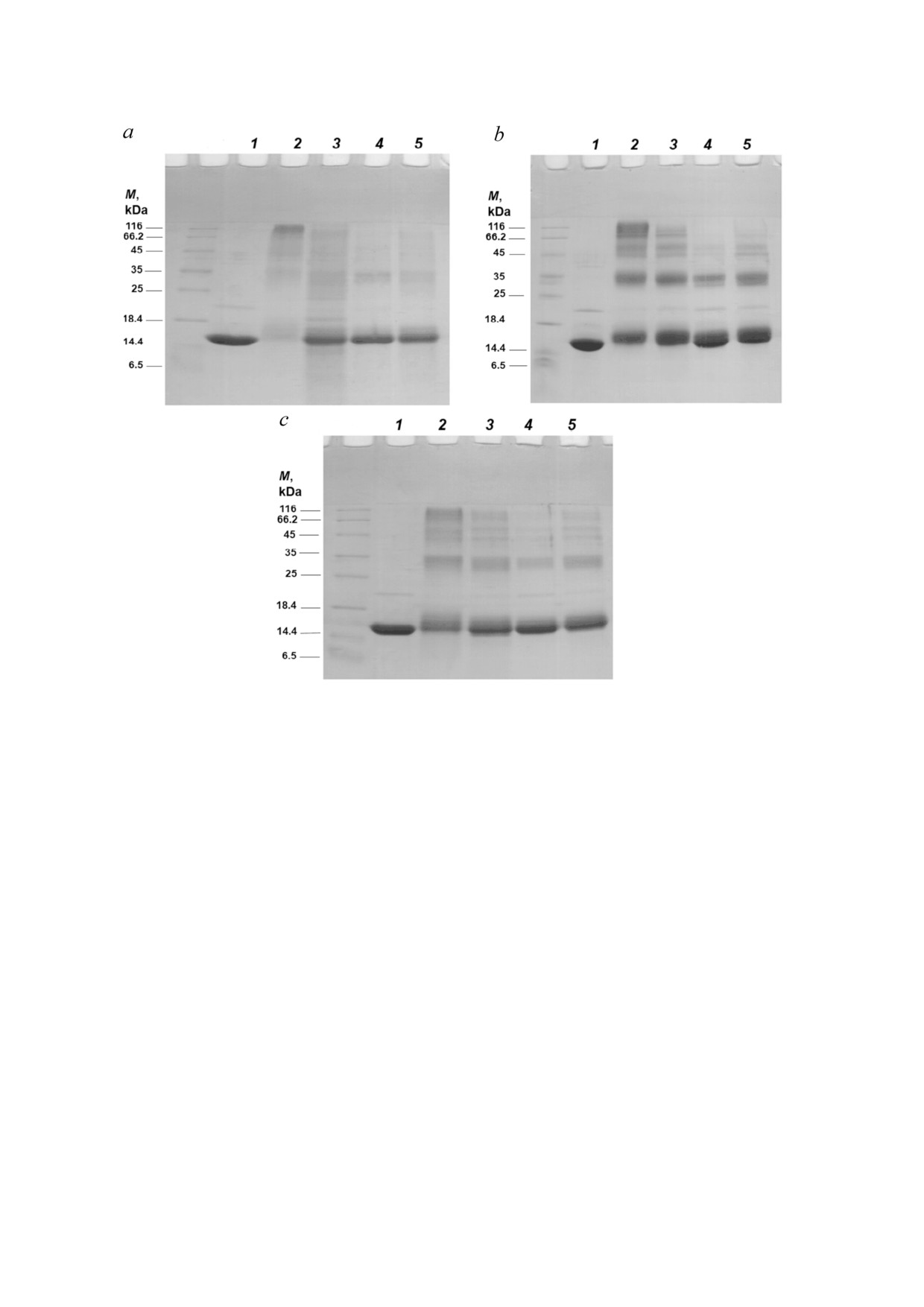
Рис. 1. Результаты проведения электрофореза в SDS ПААГ αA Cry человека. αA Cry (3 мг/мл) инкубировали с 2 мМ PON
в 50 мМ Na фосфатном буфере (pH 7,4) при комнатной температуре в течение 30 мин (дорожка 2); с 5 мМ MGO в 200 мМ
Na фосфатном буфере (pH 7,4) в течение 3 дней при 37 °C (дорожка 3) или со смесью MGO и PON в течение 30 мин при
комнатной температуре, а затем в течение трех дней - при 37 °C (дорожка 4); дорожка 1 - немодифицированный белок
αA Cry (контроль). Образцы белка анализировали с помощью электрофореза в SDS PAGE в восстанавливающих и невос
станавливающих условиях
Рис. 2. Изучение структуры модифицированного αA Cry с помощью UV Vis спектрофотометрии и флуоресцентной
спектроскопии. a - Спектры поглощения в диапазоне UV Vis образцов модифицированного αA Cry (1 мг/мл) при
200-700 нм. Измерения интенсивности флуоресценции проводили при концентрации белка 0,15 мг/мл. b-d - Анализ об
разцов модифицированного αA Cry по флуоресценции тирозина, дитирозина и триптофана после их возбуждения при
длинах волн 280, 320 и 295 нм соответственно. Спектры эмиссии регистрировали в диапазоне 300-500 нм. Ширину щели
фиксировали на уровне 5, 10 и 10 нм для каналов возбуждения и на уровне 10, 20 и 10 нм - для каналов эмиссии для ти
розина, дитирозина и триптофана соответственно. e - Использование флуоресценции ANS (возбуждение при 365 нм) для
оценки гидрофобности поверхности белка. f - Регистрация флуоресценции ThT (возбуждение при 440 нм) для определе
ния амилоидогенных свойств модифицированного αA Cry
БИОХИМИЯ том 87 вып. 2 2022
166
MOGHADAM et al.
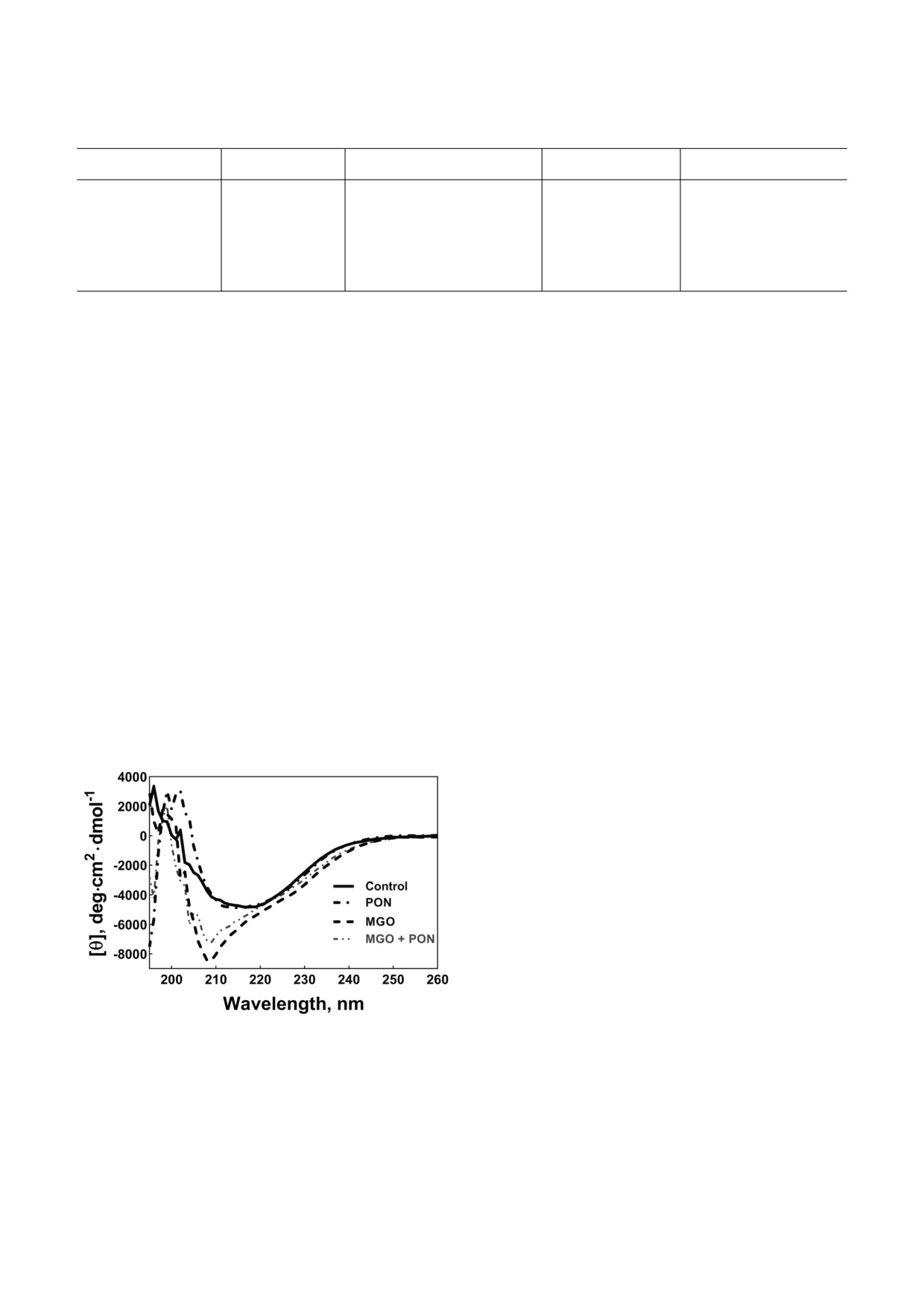
Таблица 1. Процентное содержание элементов вторичной структуры в различных образцах белка αA Cry
αA Cry
α спираль
β складчатая структура
β поворот
Случайный клубок
Контроль
4,2
41,1
28,2
26,5
PON
3,9
41,0
28,2
26,8
MGO
6,0
37,9
29,4
26,7
MGO + PON
5,1
39,4
28,9
26,6
регации белка, а в случае α Cry влияет на его
рованных в раствор гидрофобных поверхностей
шаперонную активность. Изменения структуры
этого белка в результате его модификации раз
в модифицированном белке были далее изучены
личными соединениями может играть роль в
с помощью экспонирования гидрофобных по
модуляции его шаперонной функции.
верхностей белка в раствор с использованием
Возможность образования амилоидных
ANS (возбуждение при 365 нм). ANS связывает
фибрилл модифицированным αA Cry исследо
ся с гидрофобными участками белка, экспони
вали с помощью флуоресцентного зонда ThT,
рованными в водную фазу, что приводит к повы
флуоресценция которого усиливается при его
шению интенсивности флуоресценции [65]. Как
связывании с поперечной β складчатой струк
показано на рис. 2, e, PON модифицированный
турой в амилоидных фибриллах [66]. Как пока
белок демонстрировал значительно более низ
зано на рис. 2, f, флуоресценция ThT увеличива
кую интенсивность флуоресценции ANS, чем
лась в образцах белка, модифицированно
немодифицированный белок. Флуоресцен
го MGO, но уменьшалась в образцах, одновре
ция ANS в модифицированном метилглиокса
менно инкубированных с PON и MGO, в срав
лем αA Cry была немного снижена, что свиде
нении с немодифицированным белком. Белок
тельствует о небольшом снижении гидрофоб
αA Cry, обработанный PON, показывал сущест
ности поверхности белка. Флуоресценция ANS
венно сниженную флуоресценцию ThT, что ука
в αA Cry, инкубированном со смесью PON и
зывает на то, что агрегация αA Cry человека не
MGO, немного увеличивалась. Гидрофобность
связана с образованием амилоидных фибрилл.
играет важную роль в шаперонной активности
Анализ вторичной структуры модифицирован
αA Cry и его связывании с белками мишенями.
ного αA Cry с помощью метода КД. Чтобы выя
Следовательно, изменение количества экспони
вить изменения в структуре белка αA Cry, в осо
бенности в его вторичной структуре, после его
модификации двумя окислительными агента
ми (PON и MGO), мы изучили спектры КД мо
дифицированного белка в дальнем ультрафио
летовом диапазоне [67]. Спектры КД немодифи
цированных и PON модифицированных белков
имели минимумы при ~217 нм, что предполага
ет образование больших количеств β складча
тых структур. Отрицательный пик в спектрах
αA Cry, модифицированного MGO или
PON + MGO был сдвинут к 209 нм, что предпо
лагает образование α спиральной структуры.
Как показано на рис. 3, обработка αA Cry
метилглиоксалем или смесью PON + MGO при
водила к значительным изменениям вторичной
структуры белка, особенно в случае MGO мо
дифицированного белка. Реакция с этими двумя
Рис. 3. Изучение структуры белка αA Cry человека с ис
пользованием спектроскопии КД. Для выявления измене
химическими реагентами привела к переходу от
ний во вторичной структуре были записаны спектры КД в
β складчатой к α спиральной структуре. Други
дальнем ультрафиолетовом диапазоне (far UV CD spectra)
ми словами, в белке, модифицированном этими
необработанного белка αA Cry и его модифицированных
двумя соединениями, ассоциированными с са
форм при концентрации белка, равной 0,2 мг/мл и
1,5 мг/мл, с использованием оптического пути 0,1 и 1 см
харным диабетом, снижено содержание β
для дальнего и ближнего УФ КД спектров соответственно
складчатой структуры и увеличено количество
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
167
α спиралей (табл. 1). Обработка пероксинитри
Таблица 2. Поверхностное натяжение различных образцов
белка αA Cry
том также вызывала небольшие изменения вто
ричной структуры белка.
αA Cry
Поверхностное натяжение (мН/м)
Изучение структуры белка αA Cry путём оцен
ки поверхностного натяжения. Поверхностное
Контроль
45,4 ± 1,3
натяжение может быть использовано в качестве
PON
48,1 ± 1,6
индекса гидрофобности поверхности, чтобы да
MGO
50,1 ± 1,5*
лее определить структурные изменения в бел
ках [68]. В нашем исследовании мы определили
MGO + PON
47,8 ± 1,3
и сравнили значения поверхностного натяже
∗ p < 0,05
ния для необработанного белка αA Cry и для его
модифицированных вариантов. Как показано
в табл. 2, поверхностное натяжение модифици
рованных белков по сравнению с контролем
K2P (возбуждение при 342 нм, рис. 4, f) и кар
увеличено. Более ранние результаты показали,
боксиметиллизин (возбуждение при 352 нм,
что количество гидрофобных поверхностей бел
рис. 4, g), которые образовывались при гликиро
ка, экспонированных в раствор, понижается по
вании αA Cry метилглиоксалем [72].
мере увеличения поверхностного натяжения
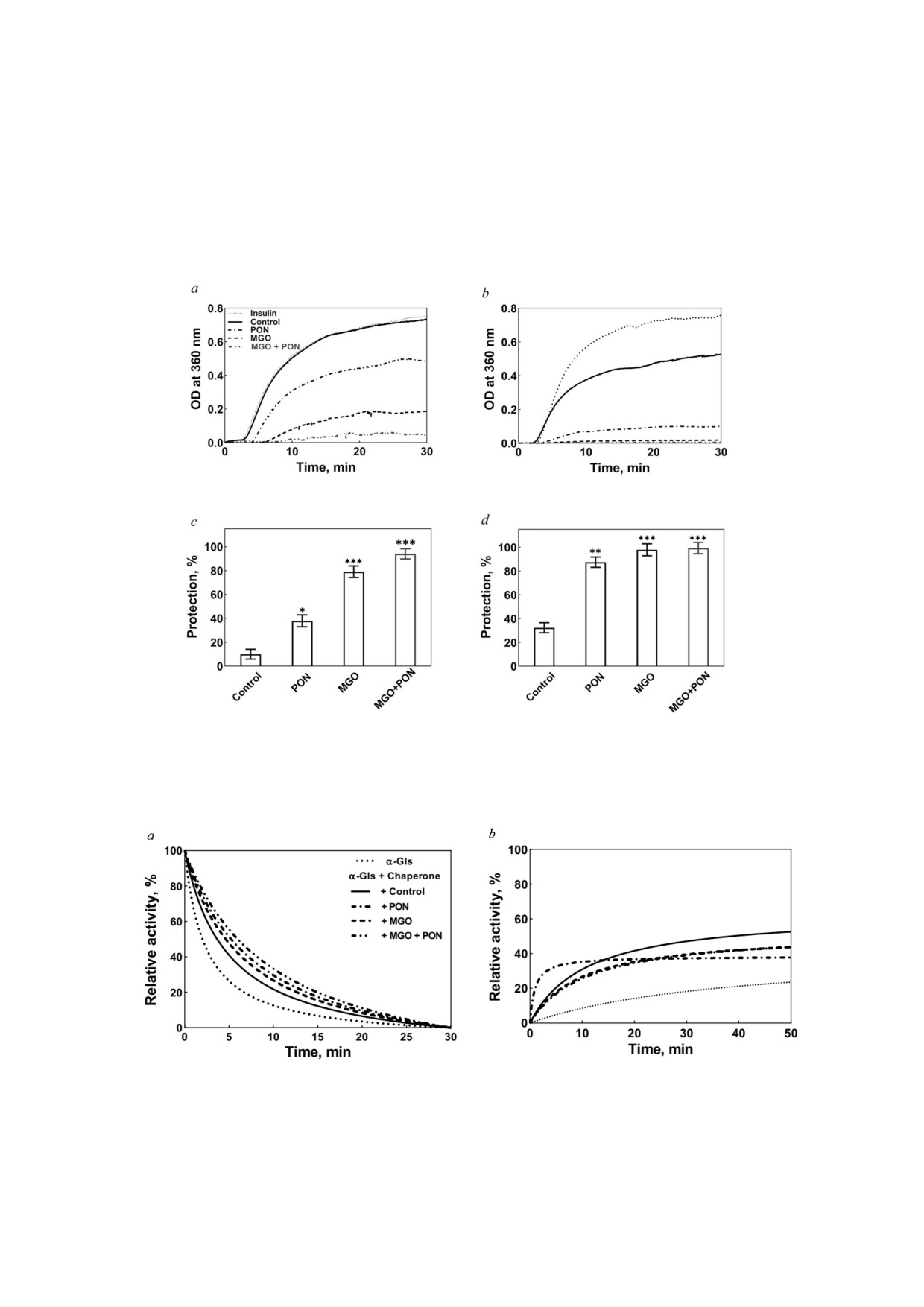
Шаперонная активность модифицированного
белка [43, 69]. Повышенное поверхностное на
αA Cry человека. Агрегация белков хрусталика
тяжение PON модифицированного белка соот
глаза является одним из основных факторов
ветствовало уменьшению количества гидрофоб
развития помутнения хрусталика и катаракты,
ных поверхностей, подвергшихся воздействию
которые можно предотвратить с помощью α
растворителя, на что указывает флуоресцен
Cry [73-75]. Мы определили шаперонную ак
ция ANS (рис. 2, е).
тивность необработанного αA Cry и его образ
Поверхностное натяжение белка, обрабо
цов, обработанных различными концентрация
танного PON + MGO, было ниже поверхност
ми PON и MGO (0,07 и 0,1 мг/ мл), в отношении
ного натяжения αA Cry, обработанного каждым
индуцированной DTT агрегации инсулина при
из этих реагентов по отдельности. Этот вывод
40 °C путём регистрации поглощения образцов
свидетельствует о том, что при взаимодействии
при 360 нм. Как видно на рис. 5, шаперонная ак
αA Cry со смесью двух веществ его гидрофоб
тивность белка αA Cry была значительно увели
ность немного увеличивалась [70].
чена после обработки этими реагентами, ассо
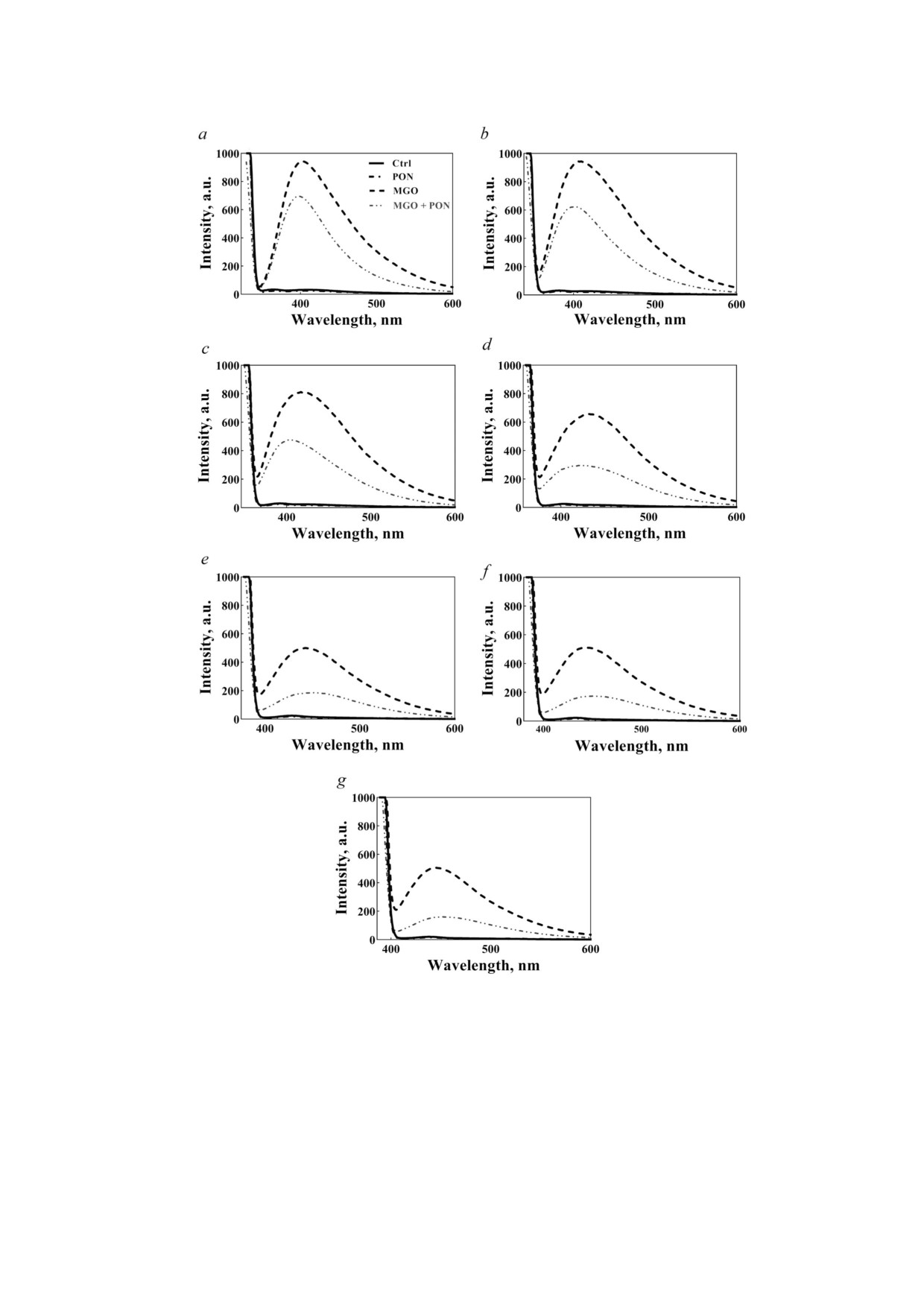
Оценка образования хромофоров AGE в моди
циированными с СД. Наибольшее повышение
фицированном белке. Окисление может приво
шаперонной активности αA Cry наблюдалось
дить к образованию конечных продуктов глики
после его инкубации с обоими реагентами.
рования (AGE), которые могут играть важную
Вероятно, что инкубация αA Cry с MGO
роль в снижении прозрачности хрусталика гла
имела решающее значение для повышения его
за [71]. В этом исследовании с помощью флуо
биологической активности. В целом, получен
ресцентной спектрометрии при соответствую
ные нами результаты позволяют предположить,
щих длинах волн было изучено образование со
что реакция αA Cry человека с PON и MGO по
единений AGE при инкубации αA Cry человека
отдельности или с их смесью усиливает шаперон
с PON и MGO.
ную активность этого белка и может обладать за
Как показано на рис. 4, реакция белка αA
щитной функцией против различных типов хи
Cry с MGO приводила к образованию больших
мических повреждений, ассоциированных с СД.
количеств новых флуоресцентных хромофоров.
Усиление шаперонной активности αA Cry носит
Когда PON реагировал с гликированным бел
дозозависимый характер (рис. 5, b и d).
ком, интенсивность излучения этих хромофо
Рефолдинг и восстановление активности
ров сильно снижалась, что позволяет предполо
дрожжевой α глюкозидазы. Мы также оценили
жить, что хромофоры, полученные в результате
влияние αA Cry на рефолдинг и восстановление
реакции белка с MGO, были чувствительны к
ферментативной активности дрожжевой α Gls,
окислению PON.
подвергнутой тепловому и химическому (моче
Для определения этих вновь образующихся
вина) развёртыванию, используя методику, опи
хромофоров образцы белка были подвергнуты
санную в работе Khoshaman et al. [76]. Как пока
возбуждению при определённых длинах волн.
зано на рис. 6, a, белок αA Cry, обработанный
Мы идентифицировали некоторые соединения
PON, MGO или смесью PON + MGO, немного
AGE, такие как аргпиримидин (возбуждение
лучше восстанавливал ферментативную актив
при 322 и 381 нм, рис. 4, a и b), пентозидин (воз
ность α Gls по сравнению с необработанным
буждение при 335, 370 и 375 нм, рис. 4, c-e),
шапероном.
БИОХИМИЯ том 87 вып. 2 2022
168
MOGHADAM et al.
Рис. 4. Обнаружение хромофоров AGE в αA Cry человека. Возможное образование аргпиримидина (a и b), пентозиди
на (c, d и e), K2P (f) и карбоксиметиллизина (g) в модифицированном αA Cry была изучена с помощью флуоресцентной
спектроскопии при длинах волн возбуждения: 322 и 381 нм (a и b); 335, 370 и 375 нм (c, d и e); 342 нм (f) и 352 нм (g). Ши
рина щели при возбуждении/эмиссии была установлена на 10 нм. Концентрация αA Cry составляла 0,15 мг/мл
Как видно из рис. 6, a, модифицированный
татов можно предположить, что немодифици
белок αA Cry лучше предотвращал тепловую
рованный и модифированный белки αA Cry бу
инактивацию дрожжевой α Gls, чем немодифи
дут иметь различную антиагрегационную спо
цированный белок. На основании этих резуль
собность. Однако немодифицированный αA Cry
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
169
восстанавливал активность α Gls, денатуриро
ляются двумя основными компонентами анти
ванной мочевиной, более эффективно, чем мо
оксидантной системы, которая защищает клетки
дифицированные белки (рис. 6, b).
от окислительного и карбонильного стрессов, и
Защитная роль ASA и GSH против структурно
они играют ключевую роль в предотвращении
функциональных изменений αA Cry человека, мо
прогрессирования катаракты в тканях хрустали
дифицированного соединениями, ассоциированны
ка глаза [77, 78]. Как показано на рис. 7, ASA час
ми с СД. Аскорбиновая кислота и глутатион яв
тично устраняет перекрёстное сшивание αA Cry
Рис. 5. Шапероноподобная активность αA Cry после модификации пероксинитритом и метилглиоксалем. Индуцирован
ную DTT агрегацию бычьего панкреатического инсулина измеряли в присутствии 0,07 мг/мл (a и c) и 0,1 мг/мл (b и d) не
модифицированного и модифицированного αA Cry. Агрегацию инсулина регистрировали при 360 нм в течение 30 мин.
b и d - Шапероноподобная активность αA Cry, выраженная в виде процента защиты (%), рассчитанного с использовани
ем уравнения (1). * p < 0,05, ** p < 0,01, *** p < 0,001
Рис. 6. Способность модифицированного αA Cry человека к рефолдингу и восстановлению активности α Gls. a - Терми
ческое разворачивание дрожжевого α Gls в присутствии и при отсутствии модифицированного и немодифицированного
αA Cry определяли по восстановлению ферментативной активности α Gls через определенные промежутки времени.
b - Рефолдинг дрожжевой α Gls после денатурации мочевиной, инициированный 100 кратным разведением в буфере для
рефолдинга в присутствии модифицированного и немодифицированного αA Cry
2 БИОХИМИЯ том 87 вып. 2 2022
170
MOGHADAM et al.
Рис. 7. Анализ белка αA Cry человека с помощью электрофореза в SDS ПААГ в присутствии ASA и GSH. Препараты не
модифицированного и модифицированного белков αA Cry человека инкубировали с ASA и GSH (10 мМ) по отдельнос
ти или с их смесью. После окончания инкубации 15 мкг каждого образца белка наносили на 12% ный гель в присутствии
восстановителей. Профили SDS ПААГ белка, модифицированного PON (a), белка, модифицированного MGO (b), и бел
ка, модифицированного смесью MGO + PON (c). Дорожка 1 - немодифицированный белок. Дорожки 2-4 - белки, мо
дифицированные соответствующим реагентом при отсутствии (дорожка 2) или в присутствии ASA (дорожка 3), GSH (до
рожка 4) или смеси ASA и GSH (дорожка 5)
и образованные большие белковые комплексы,
лем или их смесью (рис. 8, b-d соответственно)
возникшие в результате реакции белка с PON и
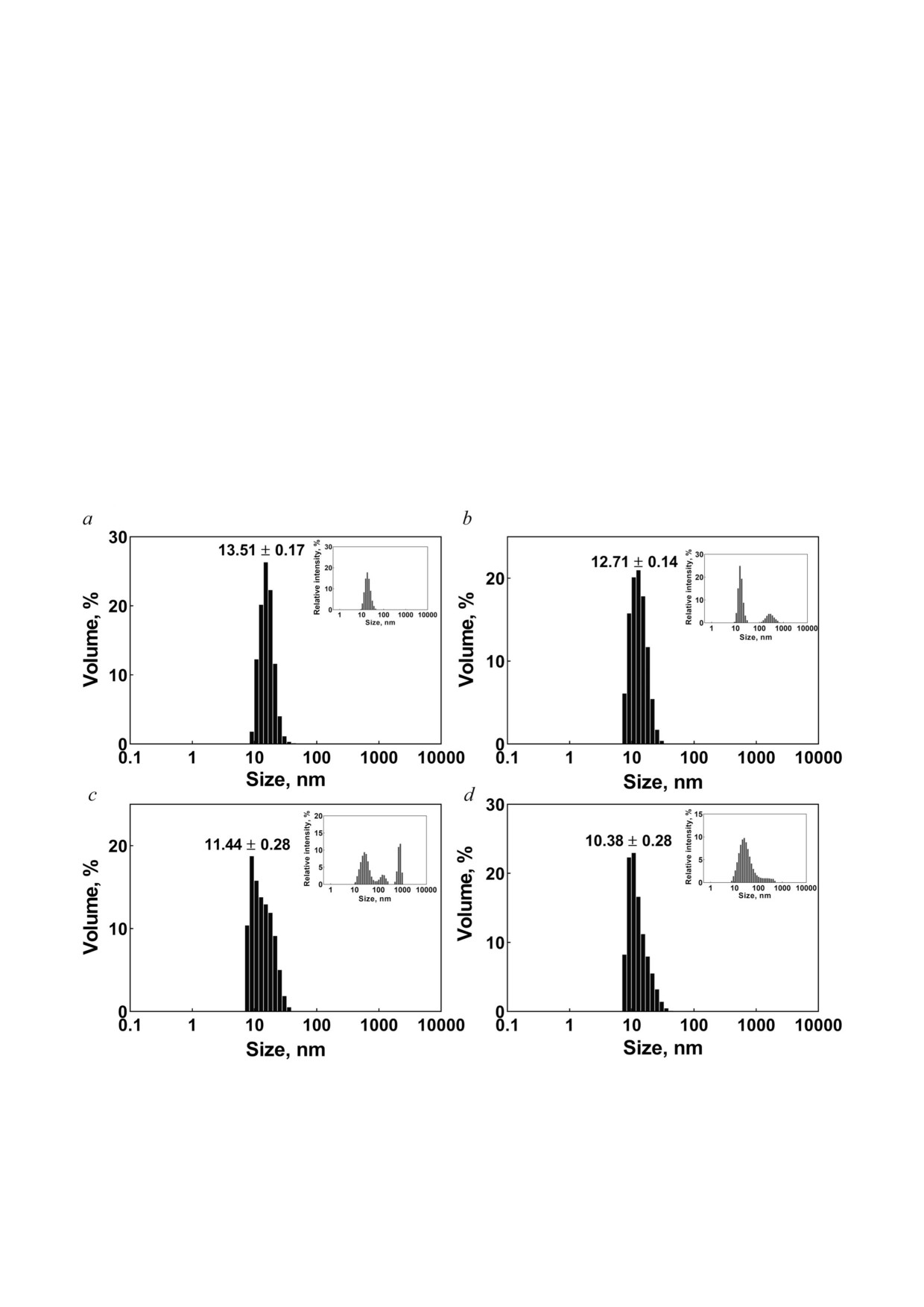
уменьшала средний гидродинамический радиус
MGO или смесью этих соединений.
олигомеров до 12,71; 11,44 и 10,38 нм соответ
GSH в значительной степени предотвращал
ственно.
агрегацию белка αA Cry и образование HMM.
Шаперонная активность αA Cry была обрат
Эффект GSH + ASA был почти таким же, как и
но пропорциональна распределению его олиго
у одного GSH, и в значительной степени предо
меров по размерам. Иными словами, реакция с
твращал агрегацию модифицированного белка.
ассоциированными с СД соединениями увели
Особенности агрегации αA Cry человека в
чивает шаперонную активность αA Cry. Умень
присутствии PON и MGO. Чтобы изучить влия
шение размера и повышение активности шапе
ние модификации белка αA Cry на его агрега
рона были особенно значительными для αA Cry,
цию и олигомеризацию, мы определили гидро
модифицированного PON и MGO.
динамические радиусы олигомеров с помощью
метода динамического рассеяния света (DLS)
[79]. Как показано на рис. 8, a, средний размер
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
олигомеров белка αA Cry (немодифицирован
ный) человека составлял 13,51 нм. Модифика
Являясь одним из активаторов окислитель
ция белка пероксинитритом или метилглиокса ного и карбонильного стресса, хроническая
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
171
(длительная) гипергликемия может неблагопри
лезнь Альцгеймера и катаракта [84, 85]. Следова
ятно влиять на различные органы, включая хрус
тельно, RCS может способствовать развитию диа
талик глаза. Структурные изменения белков
бета и его осложнений [86]. Кроме того, СД ассо
хрусталика глаза под воздействием окислитель
циирован с повышенным окислительным стрес
ного/карбонильного стрессов приводят к обра
сом, который играет важную роль в развитии ос
зованию как возрастной, так и диабетической
ложнений и сопровождается образованием PON.
катаракты [80-82]. Сахарный диабет сопровож
Являясь сильным окислителем, PON атакует
дается усилением химической модификации
различные биомолекулы, что приводит к образо
белков и липидов, скорее всего из за карбониль
ванию производных аминокислот, таких как
ного и окислительного стресса, изменяющего
нитротирозин, дитирозин и нитротриптофан
функции белков [83]. Карбонильные группы ре
[87, 88]. Поскольку и MGO, и PON являются вы
активных карбонильных частиц (RCS) могут ата
сокореактивными модификаторами белков, вы
ковать аминогруппы в аминокислотах, пептидах
рабатываемыми в относительно высоких количе
или белках с образованием соединений AGE и
ствах во время гипергликемии, и способны мо
вызывать карбонильный стресс, за которым сле
дифицировать любые белки, их возможное учас
дует окислительный стресс и повреждения тка
тие в модификации белков хрусталика может
ней. Метилглиоксаль, как важный представитель
привести к сильным структурным и функцио
RCS, ассоциирован с гипергликемией как при
нальными изменениям этих белков [89].
СД 1 го, так и при СД 2 го типов и связанными с
В нашем предыдущем исследовании было
СД осложнениями, такими как нефропатия, бо показано, что MGO и PON играют ключевую
Рис. 8. Анализ белка αA Cry с использованием DLS. Олигомеры немодифицированного белка αA Cry (a); белка, моди
фицированного PON (b); белка, модифицированного MGO (c), и белка, модифицированного PON + MGO (d), исследо
вали на гидродинамическое распределение по размерам. Перед проведением измерений образцы белка разводили в 50 мМ
фосфатно солевом буфере (pH 7,4) до концентрации 2 мг/мл. Распределение размеров представлено для относительного
объёма. На вставках - относительная интенсивность рассеяния
БИОХИМИЯ том 87 вып. 2 2022
2*
172
MOGHADAM et al.
роль в изменении структуры, олигомеризации и
повреждения структуры в значительной степе
агрегации белков хрусталика [22]. В настоящей
ни были снижены в присутствии двух сильных
работе мы показали, что эти два ассоциирован
антиоксидантных соединений (GSH и ASA)
ных с СД соединения не только сильно меняют
(рис. 7).
вторичную и четвертичную структуры αA Cry
Для поддержания биологической целостнос
человека (рис. 2, 3, и 8), но также они повыша
ти клеток и тканей необходим баланс между
ют его шаперонную активность (рис. 5 и 6, a).
производством и катаболизмом оксидантных
Другими словами, повреждения структуры бел
молекул. По этой причине в тканях глаза имеет
ка αA Cry, возникшие в результате его реакции
ся мощная система антиоксидантной защиты,
с этими двумя соединениями, могут быть в ка
предотвращающая повреждения, вызванные из
кой то степени компенсированы повышением
бытком метаболитов кислорода. Антиоксидант
шаперонной активности белка. Является ли это
ная защита глазной системы включает в себя
защитным механизмом, развившимся в глазных
ферменты, белки, ASA, GSH, аминокислоты
линзах для ослабления/предотвращения моле
(цистеин и тирозин), мочевую кислоту и др. Не
кулярного повреждения, связанного с СД?
давние исследования указывают на то, что GSH
Вступая в реакцию с αA кристаллином челове
и ASA являются важными антиоксидантами, за
ка, эти небольшие и высокореактивные моле
щищающими белки хрусталика глаза от окисли
кулы, содержание которых резко возрастает
тельных агентов, что важно для нормального
при диабете, могут индуцировать особую кон
функционирования эпителия хрусталика [95].
формацию белка с более высокой активностью.
В нашем исследовании GSH продемонстриро
В белке αA Cry имеются несколько пептидных
вал более выраженный эффект в предотвраще
фрагментов, которые играют ключевую роль в
нии структурных повреждений, вызываемых со
его шаперонной активности [90], и реакция
единениями, ассоциированными с сахарным
этого белка с MGO и PON может приводить к
диабетом (рис. 7).
экспонированию этих аминокислотных после
довательностей, обеспечивая лучшие условия
для взаимодействия белка αA Cry с белками
ЗАКЛЮЧЕНИЕ
клиентами. Предыдущие исследования показа
ли, что четвертичная структура α Cry находится
Таким образом, результаты нашего исследо
в тесной связи с его шаперонной актив
вания показывают, что два ассоциированных
ностью [91]. Этот белок существует в состоянии
с СД соединения (метилглиоксаль и перокси
равновесия в основном между димером и оли
нитрит) вызывают важные структурные измене
гомером. Такое равновесие, и в особенности
ния в αA Cry человека. Эти два высокореакци
размер олигомеров, играют важную роль в про
онноспособных соединения могут существенно
явлении его шаперонной активности [92]. Во
изменять вторичную, третичную и четвертич
многих исследованиях показано, что уменьше
ную структуры белка. В то же время их химичес
ние размеров олигомеров белка αA Cry приво
кое взаимодействие с αA Cry повышает его ша
дит к повышению его шаперонной активнос
перонную активность. Повышенная шаперон
ти [93]. Как показано на рис. 8, реакция PON и
ная активность этого белка связана с уменьше
MGO с αA Cry человека уменьшала размер его
нием размера его олигомеров. Антиоксидант
олигомеров и в то же время увеличивала его ша
ные соединения (GSH и ASA) оказались способ
перонную активность. Эти наблюдения нахо
ны обращать структурные изменения в белке
дятся в соответствии с результатами предыду
αA Cry. Вероятно, что повышение шаперонной
щих работ [94]. Результаты, полученные при
активности αA Cry человека связано с его не
анализе картины электрофоретической под
полным окислением. Повышение шаперонной
вижности (рис. 1), позволяют предположить,
активности этого белка при окислении может
что αA Cry, обработанный MGO, склонен к об
играть важную роль в преодолении деструктив
разованию поперечно сшитых агрегатов HMM.
ных эффектов окислительного стресса в хруста
Ковалентное сшивание этого белка наблюда
лике глаза больных сахарным диабетом.
лось, хотя и в меньшей степени, при инкубации
αA Cry с одним PON или с PON + MGO. Более
того, модификация αA Cry человека с PON и
Финансирование. Проведение настоящей ра
MGO индуцировала образование в структуре
боты было поддержано Ученым советом универ
белка новых хромофоров (рис. 4). Также PON и
ситета Шираза, Научным фондом Ирана (INSF)
MGO вызывали структурные изменения αA
(проекты 9914455 и 9610387), Национальным
Cry, приводящие к увеличению поверхностного
институтом медицинских исследований
натяжения белка (рис. 2 и 3; табл. 1 и 2). Эти
(NIMAD) (проект 964854) и Министерством на
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
173
уки и высшего образования Российской Феде
Соблюдение этических норм. Настоящая
рации (Б.И.К).
статья не содержит описания каких либо иссле
Конфликт интересов. Авторы заявляют об от
дований с участием людей или животных в каче
сутствии конфликта интересов.
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Nowotny, K., Jung, T., Höhn, A., Weber, D., and Grune, T.
18.
Dalle Donne, I., Rossi, R., Giustarini, D., Milzani, A.,
(2015) Advanced glycation end products and oxidative
and Colombo, R. (2003) Protein carbonyl groups as bio
stress in type 2 diabetes mellitus, Biomolecules, 5, 194 222,
markers of oxidative stress, Clin. Chim. Acta, 329, 23 38,
doi: 10.3390/biom5010194.
doi: 10.1016/s0009 8981(03)00003 2.
2.
Semchyshyn, H. M. (2014) Reactive carbonyl species
19.
Dayanand, C. D., Pradeep, K. V., and Kutty, A. V. (2012)
in vivo: Generation and dual biological effects, Sci.
Protein carbonyl content as a stable oxidative stress mark
World J., 2014, 1 10, doi: 10.1155/2014/417842.
er in type II diabetes, Int. J. Biol. Med. Res., 3, 2362 2365.
3.
Vander Jagt, D. L. (2008) Methylglyoxal, diabetes mellitus
20.
Ghahramani, M., Yousefi, R., Khoshaman, K., Sasan
and diabetic complications, Drug Metabol. Drug Interact.,
Moghadam, S., and Kurganov, B. I. (2016) Evaluation of
23, 93 124, doi: 10.1515/dmdi.2008.23.1 2.93.
structure, chaperone like activity and protective ability of
4.
Pacher, P., Beckman, J. S., and Liaudet, L. (2007) Nitric
peroxynitrite modified human α crystallin subunits against
oxide and peroxynitrite in health and disease, Physiol. Rev.,
copper mediated ascorbic acid oxidation, Int. J. Biol.
87, 315 424, doi: 10.1152/physrev.00029.2006.
Macromol.,
87,
208221, doi:
10.1016/j.ijbiomac.
5.
Sasaki, K., Sasaki, H., Jonasson, F., Kojima, M., and
2016.02.040.
Cheng, H. M. (2004) Racial differences of lens transparen
21.
Chang, W., Wang, R., and Wu, L. (2005) Methylglyoxal
cy properties with aging and prevalence of age related
induced nitric oxide and peroxynitrite production in vascu
cataract applying the WHO classification system,
lar smooth muscle cells, Free Radic. Biol. Med., 38, 286
Ophthalmic. Res., 36, 332 340, doi: 10.1159/000081636.
293, doi: 10.1016/j.freeradbiomed.2004.10.034.
6.
Linetsky, M., Shipova, E., Cheng, R., and Ortwerth, B. J.
22.
Moghadam, S., Oryan, A., Kurganov, B. I., Tamaddon,
(2008) Glycation by ascorbic acid oxidation products leads
A. M., Alavianehr, M. M., et al. (2017) The structural
to the aggregation of lens proteins, Biochim. Biophys. Acta,
damages of lens crystallins induced by peroxynitrite and
1782, 22 34.
methylglyoxal, two causative players in diabetic complica
7.
Kiziltoprak, H., Tekin, K., Inanc, M., and Sakir Goker, Y.
tions and preventive role of lens antioxidant components,
(2019) Cataract in diabetes mellitus, World J. Diabetes, 10,
Int. J. Biol. Macromol., 103, 74 88, doi: 10.1016/j.ijbiomac.
140 153.
2017.04.090.
8.
Šimunović, M., Paradžik, M., Škrabić, R., Unić, I.,
23.
Chen, Y., Mehta, G., and Vasiliou, V. (2014) Antioxidant
Bućan, K., et al. (2018) Cataract as early ocular complica
defenses in the ocular surface, Ocul. Surf., 7, 176 185,
tion in children and adolescents with type 1 diabetes melli
doi: 10.1016/s1542 0124(12)70185 4.
tus, Int. J. Endocrinol.,
2018,
1 6, doi:
10.1155/
24.
Merck, K. B., Groenen, P. J., Voorter, C. E., de Haard
2018/6763586.
Hoekman, W. A., Horwitz, J., et al. (1993) Structural and
9.
Benedek, G. B. (1971) Theory of transparency of the eye,
functional similarities of bovine alpha crystallin and mouse
Appl. Opt., 10, 459 473, doi: 10.1364/AO.10.000459.
small heat shock protein. A family of chaperones, J. Biol.
10.
Delaye, M., and Tardieu, A. (1983) Short range order of
Chem., 268, 1046 1052.
crystallin proteins accounts for eye lens transparency,
25.
Biswas, A., and Das, K. P. (2004) Role of ATP on the inter
Nature, 302, 415 417, doi: 10.1038/302415a0.
action of α crystallin with its substrates and its implications
11.
Bhat, S. P., and Nagineni, C. N. (1989) Alpha B subunit of
for the molecular chaperone function, J. Biol. Chem., 279,
lens specific protein alpha crystallin is present in other
42648 42657, doi: 10.1074/jbc.M404444200.
ocular and non ocular tissues, Biochem. Biophys. Res.
26.
Nagaraj, R. H., Panda, A. K., Shanthakumar, S.,
Commun.,
158,
319325, doi:
10.1016/s0006
Santhoshkumar, P., Pasupuleti, N., et al.
(2012)
291x(89)80215 3.
Hydroimidazolone modification of the conserved Arg12 in
12.
Robman, L., and Taylor, H. (2005) External factors in the
small heat shock proteins: studies on the structure and
development of cataract, Eye (Lond), 19, 1074 1082,
chaperone function using mutant mimics, PLoS One, 7, 1
doi: 10.1038/sj.eye.6701964.
10, doi: 10.1371/journal.pone.0030257.
13.
Ma, Z., Hanson, S. R., Lampi, K. J., David, L. L., and
27.
Robinson, K. M., and Beckman, J. S. (2005) Synthesis of
Smith, J. B. (1998) Age related changes in human lens
peroxynitrite from nitrite and hydrogen peroxide, Methods
crystallins identified by HPLC and mass spectrometry, Exp.
Enzymol.,
396,
207214, doi:
10.1016/S0076
Eye Res., 67, 21 30, doi: 10.1006/exer.1998.0482.
6879(05)96019 9.
14.
Fu, L., and Liang, J. J. (2003) Alteration of protein-pro
28.
Ghahramani, M., Yousefi, R., Khoshaman, K., and
tein interactions of congenital cataract crystallin mutants,
Alavianmehr, M. M. (2015) The impact of calcium ion on
Invest. Ophthalmol. Vis. Sci.,
44,
11551159,
structure and aggregation propensity of peroxynitrite mod
doi: 10.1167/iovs.02 0950.
ified lens crystallins: new insights into the pathogenesis of
15.
Reddy, V. S., Kumar, C. U., and Reddy, G. B. (2014) Effect
cataract disorders, Colloids Surf. B Biointerfaces, 125, 170
of chronic hyperglycemia on crystallin levels in rat lens,
180, doi: 10.1016/j.colsurfb.2014.11.002.
Biochem. Biophys. Res. Commun.,
446,
602607,
29.
Ischiropoulos, H., and Al Mehdi, A. B.
(1995)
doi: 10.1016/j.bbrc.2014.03.012.
Peroxynitrite mediated oxidative protein modifications,
16.
Wang, Y., and Ho, C. T. (2012) Flavour chemistry of
FEBS Lett.,
364,
279282, doi:
10.1016/0014
methylglyoxal and glyoxal, Chem. Soc. Rev., 41, 4140
5793(95)00307 u.
4149, doi: 10.1039/c2cs35025d.
30.
Alvarez, B., Rubbo, H., Kirk, M., Barnes, S., Freeman,
17.
Alvarez, B., and Radi, R. (2003) Peroxynitrite reactivity
B. A., et al. (1996) Peroxynitrite dependent tryptophan
with amino acids and proteins, Amino Acids, 25, 295 311,
nitration, Chem. Res. Toxicol., 9, 390 396, doi: 10.1021/
doi: 10.1007/s00726 003 0018 8.
tx950133b.
БИОХИМИЯ том 87 вып. 2 2022
174
MOGHADAM et al.
31.
Kumar, P. A., Kumar, M. S., and Reddy, G. B. (2007)
ence of a chaperone, Int. J. Mol. Sci., 11, 4556 4579,
Effect of glycation on alpha crystallin structure and chap
doi: 10.3390/ijms11114556.
erone like function, Biochem. J.,
408,
251258,
46.
Kurganov, B. I. (2002) Kinetics of protein aggregation.
doi: 10.1042/BJ20070989.
Quantitative estimation of the chaperone like activity in
32.
Al Hilaly, Y. K., Williams, T. L., Stewart Parker, M.,
test systems based on suppression of protein aggregation,
Ford, L., Skaria, E., et al. (2013) A central role for dityro
Biochemistry (Moscow),
67,
409422, doi:
10.1023/
sine crosslinking of amyloid β in Alzheimer’s disease, Acta
a:1015277805345.
Neuropathol. Commun., 1, 83, doi: 10.1186/2051 5960 1
47.
Biswas, A., and Das, K. P. (2007) Alpha crystallin assisted
83.
refolding of enzyme substrates: Optimization of external
33.
Hospes, M., Hendriks, J., and Hellingwerf, K. J. (2013)
parameters, Protein J., 4, 247 255, doi: 10.1007/s10930
Tryptophan fluorescence as a reporter for structural
006 9066 8.
changes in photoactive yellow protein elicited by photo
48.
Khoshaman, K., Yousefi, R., Niazi, A., Oryan, A.,
activation, Photochem. Photobiol. Sci., 12, 479488,
Moosavi Movahedi, A. A., et al. (2018) Importance of the
doi: 10.1039/c2pp25222h.
positively charged residue at position 54 to the chaperoning
34.
Heinecke, J. W., Li, W., Daehnke, H. L. 3rd, and
function, conformational stability and amyloidogenic
Goldstein, J. A. (1993) Dityrosine, a specific marker of
nature of human αA crystallin, J. Biochem., 163, 187 199,
oxidation, is synthesized by the myeloperoxidase hydrogen
doi: 10.1093/jb/mvx071.
peroxide system of human neutrophils and macrophages,
49.
Jakob, U., Gaestel, M., Engel, K., and Buchner, J. (1993)
J. Biol. Chem., 268, 4069 4077.
Small heat shock proteins are molecular chaperones,
35.
Paoli, P. Sbrana, F., Tiribilli, B., Caselli, A., Pantera, B.,
J. Biol. Chem., 268, 1517 1520.
et al. (2010) Protein N homocysteinylation induces the
50.
Weber, K., and Osborn, M. (1969) The reliability of mole
formation of toxic amyloid like protofibrils, J. Mol. Biol.,
cular weight determinations by dodecyl sulfate poly
400, 889 907, doi: 10.1016/j.jmb.2010.05.039.
acrylamide gel electrophoresis, J. Biol. Chem., 244, 4406
36.
Meehan, S., Knowles, T. P., Baldwin, A. J., Smith, J. F.,
4412.
Squires, A. M., et al. (2007) Characterisation of amyloid
51.
Schägger, H., and von Jagow, G. (1987) Tricine sodium
fibril formation by small heat shock chaperone proteins
dodecyl sulfate polyacrylamide gel electrophoresis for the
human αA , αB and R120G αB crystallins, J. Mol. Biol.,
separation of proteins in the range from 1 to 100 kDa, Anal.
372, 470 484, doi: 10.1016/j.jmb.2007.06.060.
Biochem.,
166,
368379, doi:
10.1016/0003
37.
Whitmore, L., and Wallace, B. A. (2004) DICHROWEB,
2697(87)90587 2.
an online server for protein secondary structure analyses
52.
Porter, R. R. (1953) Partition chromatography of insulin
from circular dichroism spectroscopic data, Nucleic Acids
and other proteins, Biochem. J.,
53,
320328,
Res., 32, W668 W673, doi: 10.1093/nar/gkh371.
doi: 10.1042/bj0530320.
38.
Gakamsky, A., Duncan, R. R., Howarth, N. M.,
53.
Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., and Gray, T.
Dhillon, B., Buttenschön, K. K., et al. (2017) Tryptophan
(1995) How to measure and predict the molar absorption
and non tryptophan fluorescence of the eye lens proteins
coefficient of a protein, Protein. Sci., 4, 24112423,
provides diagnostics of cataract at the molecular level, Sci.
doi: 10.1002/pro.5560041120.
Rep., 7, 40375, doi: 10.1038/srep40375.
54.
Scientist for Experimental Data Fitting (1995) Microsoft
39.
Kessel, L., Kalinin, S., Nagaraj, R. H., Larsen, M., and
Windows Version 2.0. Salt Lake City: Micro Math, Inc.
Johansson, L. B. (2002) Time resolved and steady state
55.
Moreau, K. L., and King, J. A. (2012) Protein misfolding
fluorescence spectroscopic studies of the human lens with
and aggregation in cataract disease and prospects for pre
comparison to argpyrimidine, pentosidine and 3 OH
vention, Trends Mol. Med., 18, 273 282, doi: 10.1016/
kynurenine, Photochem. Photobiol.,
76,
549554,
j.molmed.2012.03.005.
doi: 10.1562/0031 8655(2002)076<0549:trassf>2.0.co;2.
56.
Argirova, M., and Breipohl, W. (2002) Comparison
40.
Coussons, P. J., Jacoby, J., Mckay, A., Kelly, S. M., Price,
between modifications of lens proteins resulted from glyca
N. C., et al. (1997) Glucose modification of human serum
tion with methylglyoxal, glyoxal, ascorbic acid, and fruc
albumin: A structural study, Free Radic. Bio. Med., 22,
tose, J. Biochem. Mol. Toxicol., 16, 140 145, doi: 10.1002/
1217 1227, doi: 10.1016/s0891 5849(96)00557 6.
jbt.10031.
41.
Munch, G., Keis, R., Wessels, A., Riederer, P., Bahner, U.,
57.
Thiagarajan, G., Lakshmanan, J., Chalasani, M., and
et al. (1997) Determination of advanced glycation end
Balasubramanian, D. (2004) Peroxynitrite reaction with
products in serum by fluorescence spectroscopy and com
eye lens proteins: α crystallin retains its activity despite
petitive ELISA, Eur. J. Clin. Chem. Clin. Biochem., 35, 669
modification, Biochem. Mol. Biol.,
45,
21152121,
677, doi: 10.1515/cclm.1997.35.9.669.
doi: 10.1167/iovs.03 0929.
42.
Cheng, R., Feng, Q., Argirov, O. K., and Ortwerth, B. J.
58.
Cubillos Rojas, M., Schneider, T., Sánchez Tena, S.,
(2005) K2P - a novel cross link from human lens protein,
Bartrons, R., Ventura, F., et al. (2016) Analysis of protein
Ann. N. Y. Acad. Sci., 1043, 184 194, doi: 10.1196/annals.
oligomerization by electrophoresis, Methods Mol. Biol.,
1333.023.
1449, 341 348, doi: 10.1007/978 1 4939 3756 1_22.
43.
Alavi, P., Yousefi, R., Amirghofran, S., Karbalaei Heidari,
59.
Nowak, P., Zbikowska, H. M., Ponczek, M.,
H. R., and Moosavi Movahedi, A. A. (2013) Structural
Kolodziejczyk, J., and Wachowicz, B. (2007) Different
analysis and aggregation propensity of reduced and nonre
vulnerability of fibrinogen subunits to oxidative/nitrative
duced glycated insulin adducts, Appl. Biochem. Biotechnol.,
modifications induced by peroxynitrite: Functional conse
170, 623 638, doi: 10.1007/s12010 013 0207 1.
quences, Thromb. Res., 121, 163174, doi: 10.1016/
44.
Zhou, C., Qi, W., Lewis, E. N., and Carpenter, J. F. (2015)
j.thromres.2007.03.017.
Concomitant Raman spectroscopy and dynamic light scat
60.
Akhand, A. A., Hossain, K., Cato, M., Miyata, T., Du, J.,
tering for characterization of therapeutic proteins at high
et al. (2001) Glyoxal and methylglyoxal induce lyoxal and
concentrations, Anal. Biochem., 472, 7 20, doi: 10.1016/
methyglyoxal induce aggergation and inactivation of ERK
j.ab.2014.11.016.
in human endothelial cells, Free Radic. Biol. Med., 31,
45.
Bumagina, Z., Gurvits, B., Artemova, N., Muranov, K.,
1228 1235, doi: 10.1016/s0891 5849(01)00702 x.
and Kurganov, B. I. (2010) Paradoxical acceleration of
61.
Bray, M. R., and Clarke, A. J. (1995) Identification of an
dithiothreitol induced aggregation of insulin in the pres
essential tyrosyl residue in the binding site of
БИОХИМИЯ том 87 вып. 2 2022
СТРУКТУРА И ШАПЕРОННАЯ АКТИВНОСТЬ αA КРИСТАЛЛИНА
175
Schizophyllum commune xylanase A, Biochemistry, 34,
causing mutations R54L, R54P and R54C, Biochim.
2006 2014, doi: 10.1021/bi00006a022.
Biophys. Acta Proteins Proteom.,
1865,
604618,
62.
Ye, Y., Quijano, C., Robinson, K. M., Ricart, K. C.,
doi: 10.1016/j.bbapap.2017.02.003.
Strayer, A. L., et al. (2007) Prevention of peroxynitrite
77.
Kisic, B., Miric, D., Zoric, L., Ilic, A., and Dragojevic, I.
induced apoptosis of motor neurons and pc12 cells by tyro
(2012) Antioxidant capacity of lenses with age related
sine containing peptides, J. Biol. Chem., 282, 6324 6337,
cataract, Oxid. Med. Cell. Longev.,
2012,
467130,
doi: 10.1074/jbc.M610800200.
doi: 10.1155/2012/467130.
63.
Annibal, A., Colombo, G., Milzani, A., Dalle Donne, I.,
78.
Donma, O., Yorulmaz, E. Ö., Pekel, H., and Suyugül, N.
Fedorova, M., et al. (2016) Identification of dityrosine
(2002) Blood and lens lipid peroxidation and antioxidant
cross linked sites in oxidized human serum albumin,
status in normal individuals, senile and diabetic catarac
J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 1019,
tous patients, Curr. Eye Res., 25, 9 16, doi: 10.1076/
147 155, doi: 10.1016/j.jchromb.2015.12.022.
ceyr.25.1.9.9960.
64.
Maina, M. B., Al Hilaly, Y. K., Burra, G., Rickard, J.,
79.
Amin, S., Barnett, G., Pathak, J., Roberts, C., and
Harrington, C., et al. (2021) Oxidative stress conditions
Sarangpani, P. (2014) Protein aggregation, particle forma
result in trapping of PHF core tau (297 391) intermedi
tion, characterization & rheology, Curr. Opin. Colloid
ates, Cells, 10, 703, doi: 10.3390/cells10030703.
Interface Sci., 19, 438 449, doi: 10.1016/j.cocis.2014.
65.
Hawe, A., Sutter, M., and Jiskoot, W. (2008) Extrinsic flu
10.002.
orescent dyes as tools for protein characterization, Pharm.
80.
Singh, V. P., Bali, A., Singh, N., and Jaggi, A. S. (2014)
Res., 25, 1487 1499, doi: 10.1007/s11095 007 9516 9.
Advanced glycation end products and diabetic complica
66.
Xue, C., Lin, T. Y., Chang, D., and Guo, Z. (2017)
tions, Korean J. Physiol. Pharmacol.,
18,
1 14,
Thioflavin T as an amyloid dye: Fibril quantification, opti
doi: 10.4196/kjpp.2014.18.1.1.
mal concentration and effect on aggregation, R. Soc. Open.
81.
Gul, A., Rahman, M. A., Hasnain, S. N., Salim, A., and
Sci., 4, 1 12, doi: 10.1098/rsos.160696.
Simjee, S. U. (2008) Could oxidative stress associate with
67.
Greenfield, N. J. (2006) Using circular dichroism spectra
age products in cataractogenesis? Curr. Eye Res., 33, 669
to estimate protein secondary structure, Nat. Protoc., 1,
675, doi: 10.1080/02713680802250939.
2876 2890, doi: 10.1038/nprot.2006.202.
82.
Beswick, H. T., and Harding, J. J. (1987) Conformational
68.
Schor, M., Reid, J. L., MacPhee, C. E., and Stanley Wall,
changes induced in lens alpha and gamma crystallins by
N. R. (2016) The diverse structures and functions of sur
modification with glucose 6 phosphate. Implications for
factant proteins, Trends Biochem. Sci., 41, 610620,
cataract, Biochem. J.,
246,
761769, doi:
10.1042/
doi: 10.1016/j.tibs.2016.04.009.
bj2460761.
69.
Sattarahmady, N., Moosavi Movahedi, A. A., and Habibi
83.
Baynes, J. W., and Thorpe, S. R. (1999) Role of oxidative
Rezaei, M. (2011) A biophysical comparison of human
stress in diabetic complications: A new perspective on an
serum albumin to be glycated in vivo and in vitro, J. Med.
old paradigm, Diabetes, 48, 1 9, doi: 10.2337/diabetes.
Biochem., 30, 5 10, doi: 10.2478/v10011 010 0026 7.
48.1.1.
70.
Yousefi, R., Javadi, S., Amirghofran, S., Oryan, A., and
84.
Bizzozero, O. A. (2009) Protein carbonylation in neurode
Moosavi Movahedi, A. A. (2016) Assessment of structure,
generative and demyelinating CNS diseases, Handbook
stability and aggregation of soluble lens proteins and alpha
Neurochem. Mol. Neurobiol., 543 562, doi: 10.1007/978 0
crystallin upon non enzymatic glycation: The pathomech
387 30375 8_23.
anisms underlying cataract development in diabetic
85.
Luthra, M., and Balasubramanian, D.
(1993)
patients, Int. J. Biol. Macromol., 82, 328 338, doi: 10.1016/
Nonenzymatic glycation alters protein structure and stabil
j.ijbiomac.2015.10.036.
ity. A study of two eye lens crystallins, J. Biol. Chem., 268,
71.
Ho, M. C., Peng Y. J., Chen, S. J., and Chiou, S. H.
18119 18127.
(2010) Senile cataracts and oxidative stress, J. Clin.
86.
Asmat, U., Abad, K., and Ismail, K. (2015) Diabetes mel
Gerontol. Geriatr., 1, 1721, doi: 10.1016/j.jcgg.2010.
litus and oxidative stress A concise review, Saudi Pharm. J.,
10.006.
24, 547 553, doi: 10.1016/j.jsps.2015.03.013.
72.
Javadi, S., Yousefi, R., Hosseinkhani, S., Tamaddon,
87.
Bartesaghi, S., and Radi, R. (2018) Fundamentals on the
A. M., and Uversky, V. N. (2017) Protective effects of
biochemistry of peroxynitrite and protein tyrosine nitra
carnosine on dehydroascorbate induced structural alter
tion, Redox Biol., 14, 618625, doi: 10.1016/j.redox.
ation and opacity of lens crystallins: Important implica
2017.09.009.
tions of carnosine pleiotropic functions to combat catarac
88.
Nuriel, T., Hansler, A., and Gross, S. S. (2011) Protein
togenesis, J. Biomol. Struct. Dyn.,
35,
17661784,
nitrotryptophan: formation, significance and identifica
doi: 10.1080/07391102.2016.1194230.
tion, J. Proteomics, 74, 2300 2312, doi: 10.1016/j.jprot.
73.
Das, K. P., and Surewicz, W. K. (1995) On the substrate
2011.05.032.
specificity of α crystallin as a molecular chaperone,
89.
Nagai, R., Unno, Y., Hayashi, M. C., Masuda, S.,
Biochem. J., 311, 367 370, doi: 10.1042/bj3110367.
Hayase, F., et al. (2002) Peroxynitrite induces formation of
74.
Hook, D. W. A., and Harding, J. J. (1998) Protection of
Nε (carboxymethyl) lysine by the cleavage of Amadori
enzymes by α crystallin acting as a molecular chaperone,
product and generation of glucosone and glyoxal from glu
Int. J. Biol. Macromol., 22, 295 306, doi: 10.1016/s0141
cose, Diabetes, 51, 28332839, doi: 10.2337/diabetes.
8130(98)00027 0.
51.9.2833.
75.
Reddy, G. B., Das, K. P., Petrash, J. M., and Surewicz,
90.
Kumar, M. S., Mrudula, T., Mitra, N., and Reddy, G. B.
W. K. (2000) Temperature dependent chaperone activity
(2004) Enhanced degradation and decreased stability of
and structural properties of human alphaA and alphaB
eye lens alpha crystallin upon methylglyoxal modification,
crystallins,
J.
Biol.
Chem.,
275,
45654570,
Exp. Eye Res., 79, 577 583, doi: 10.1016/j.exer.2004.
doi: 10.1074/jbc.275.7.4565.
07.003.
76.
Khoshaman, K., Yousefi, R., Tamaddon, A. M.,
91.
Raman, B., and Rao, C. M. (1994) Chaperone like activi
Abolmaali, S. S., Oryan, A., et al. (2017) The impact of dif
ty and quaternary structure of alpha crystallin, J. Biol.
ferent mutations at Arg54 on structure, chaperone like
Chem., 269, 27264 27268.
activity and oligomerization state of human αA crystallin:
92.
Boelens, W. C. (2020) Structural aspects of the human
The pathomechanism underlying congenital cataract
small heat shock proteins related to their functional activi
БИОХИМИЯ том 87 вып. 2 2022
176
MOGHADAM et al.
ties, Cell Stress Chaperones, 25, 581 591, doi: 10.1007/
94. Sharma, K. K., and Santhoshkumar, P. (2009) Lens aging:
s12192 020 01093 1.
Effects of crystallins, Biochim. Biophys. Acta, 1790, 1095
93. Nagaraj, R. H., Nahomi, R. B., Mueller, N. H., Raghavan,
1108, doi: 10.1016/j.bbagen.2009.05.008.
C. T., Ammar, D. A., et al. (2016) Therapeutic potential of
95. Cabrera, M. P., and Chihuailaf, R. H. (2011) Antioxidants
α crystallin, Biochim. Biophys. Acta, 1860, 252257,
and the integrity of ocular tissues, Vet. Med. Int., 2011,
doi: 10.1016/j.bbagen.2015.03.012.
905153, doi: 10.4061/2011/905153.
RELATIONSHIP BETWEEN THE STRUCTURE AND CHAPERONE
ACTIVITY OF HUMAN αA CRYSTALLIN AFTER ITS MODIFICATION
WITH DIABETES ASSOCIATED OXIDATIVE AGENTS
AND PROTECTIVE ROLE OF ANTIOXIDANT COMPOUNDS
S. S. Moghadam1, M. Ghahramani1, K. Khoshaman1, A. Oryan2,
A. A. Moosavi Movahedi3, B. I. Kurganov4
, and R. Yousefi1,3*
1 Protein Chemistry Laboratory, Department of Biology, College of Sciences,
Shiraz University, Shiraz, Iran; e mail: ryousefi@shirazu.ac.ir; r.yousefi2000@gmail.com
2 Department of Pathology, School of Veterinary Medicine, Shiraz University, Shiraz, Iran
3 Institute of Biochemistry and Biophysics (IBB), University of Tehran, Tehran, Iran
4 Bach Institute of Biochemistry, Research Center of Biotechnology
of the Russian Academy of Sciences, 119071 Moscow, Russia
The study was aimed to evaluate the impact of peroxynitrite (PON, oxidative stress agent in diabetes), methylglyoxal
(MGO, diabetes associated reactive carbonyl compound), and their simultaneous application on the structural and
functional features of human αA crystallin (αA Cry) using various spectroscopy techniques. Additionally, the surface
tension and oligomer size distribution of the treated and untreated protein were tested using tensiometric analysis and
dynamic light scattering, respectively. Our results indicated that the reaction of PON and MGO with human αA Cry
leads to the formation of new chromophores, alterations in the secondary to quaternary protein structure, reduction
in the size of protein oligomers, and significant enhancement in the chaperone activity of αA Cry. To reverse the
effects of the tested compounds, ascorbic acid and glutathione (main components of lens antioxidant defense system)
were applied. As expected, the two antioxidant compounds significantly prevented formation of high molecular weight
aggregates of αA Cry (according to SDS PAGE). Our results suggest that the lens antioxidant defense system, in par
ticular, glutathione, may provide a strong protection against rapid incidence and progression of diabetic cataract by
preventing the destructive reactions of highly reactive DM associated metabolites.
Keywords: human αA crystallin, diabetic cataract, lens antioxidant, protein structure, chaperone activity
БИОХИМИЯ том 87 вып. 2 2022