БИОХИМИЯ, 2022, том 87, вып. 2, с. 177 - 193
УДК 577.112.7;617.741
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
Обзор
© 2022
К.О. Муранов*, М.А. Островский
Институт биохимической физики им. Н.М. Эмануэля РАН,
119334 Москва, Россия; электронная почта: k.muranov@sky.chph.ras.ru
Поступила в редакцию 28.07.2021
После доработки 30.09.2021
Принята к публикации 30.09.2021
В обзоре рассматриваются структурно функциональные особенности строения хрусталика, с одной сторо
ны, обеспечивающие его исключительные оптические свойства, а с другой - приводящие к возникновению
катаракты. Отсутствие клеточных органелл в волоконных клетках, высокая концентрация белка
(до 900 мг/мл) в цитоплазме минимизируют светорассеяние в хрусталике и обеспечивают его прозрачность.
Низкая концентрация кислорода, мощные системы защиты (антиоксиданты, антиоксидантные ферменты,
шапероноподобный белок α кристаллин и др.) поддерживают прозрачность хрусталика в течение жизни
организма. С другой стороны, способность кристаллинов накапливать с возрастом посттрансляционные
модификации, снижающие устойчивость белков к окислительному стрессу, является важнейшим факто
ром, способствующим образованию катаракты. На основе анализа морфологических и биохимических дан
ных о возникновении и развитии катаракт разной этиологии (возрастная, радиационная, ультрафиолето
вая, диабетическая и др.) авторы высказывают гипотезу о едином механизме, лежащем в основе возникно
вения помутнения хрусталика. Указанные катарактогенные факторы вызывают повреждение и гибель кле
ток хрусталикового эпителия, в результате чего кислород через образовавшиеся дефекты эпителиального
слоя проникает в хрусталик. Это вызывает окислительное повреждение кристаллинов. Белки вследствие
этого денатурируют, агрегируют и образуют так называемые мультиламеллярные тела, что и является глав
ной причиной помутнения. В обзоре рассматриваются различные подходы к торможению развития помут
нения (катаракты), в частности, использование комбинации антиоксидантов и соединений, усиливающих
шапероноподобные свойства α кристаллина. Обсуждается парадокс применения антикатарактальных пре
паратов, которые в лабораторных исследованиях демонстрируют высокую эффективность, но при широком
использовании в клинике оказываются бесполезны. Такой парадокс - результат позднего применения пре
паратов. По мнению авторов обзора, выход из создавшегося положения состоит не столько в поиске более
активных антикатарактальных соединений, сколько в развитии новых методов диагностики, которые поз
волили бы прогнозировать риск возникновения катаракты у пациента и начинать профилактическое лече
ние задолго до проявления клинических признаков заболевания.
КЛЮЧЕВЫЕ СЛОВА: хрусталик, катаракта, патогенез, кристаллины, малые белки теплового шока, анти
катарактальные средства.
DOI: 10.31857/S0320972522020038
Посвящается памяти Бориса Ивановича Курганова
ВВЕДЕНИЕ
коэффициент преломления цитоплазмы срав
ним с коэффициентом преломления плазмати
Целостный взгляд на хрусталик открывает
ческой мембраны клетки, что исключает свето
удивительно логичное построение этого органа.
рассеяние на мембранах. Во вторых, за счёт ку
Выполнение основной физиологической функ
лоновских взаимодействий в цитоплазме воло
ции хрусталика как фокусирующей линзы тре
конных клеток хрусталика минимизируются
бует прозрачности ткани хрусталика. Достигает
флуктуации концентрации белка, а именно
ся это с помощью исключительно высокой кон
флуктуации концентрации, на границе которых
центрации белка в цитоплазме волоконных кле
существует значительный градиент коэффици
ток хрусталика. Действительно, во первых, при
ента преломления среды, представляют собой
концентрациях белка порядка 400-900 мг/мл
физическую основу светорассеяния коллоид
ных растворов.
Принятые сокращения: АФК - активные формы
Отсутствие возможности в изолированной
кислорода, а.о. - аминокислотные остатки.
ткани хрусталика удалять поврежденные струк
* Адресат для корреспонденции.
туры (клетки, молекулы белка и др.) предопре
177
178
МУРАНОВ, ОСТРОВСКИЙ
деляет необходимость существования в хруста
образуется первичное ядро хрусталика. Клетки
лике системы поддержания структурной ста
слоя, отдалённого от сетчатки, превращаются в
бильности белковых молекул. Примером может
клетки кубического эпителия. По периферии
служить α кристаллин - шапероноподобный
передней поверхности хрусталика клетки эпите
белок, предупреждающий агрегацию дестабили
лия, образующие замкнутый круг, начинают ак
зированных молекул.
тивно делиться. Постепенно они сдвигаются к
Следуя этой логической цепочке, в настоя
экватору хрусталика, образуя меридиональные
щем обзоре мы постараемся рассмотреть и свя
ряды (рис. 1, в2). Клетки, находящиеся в эквато
зать воедино многочисленные эксперименталь
риальной зоне хрусталика, вытягиваются и обра
ные данные, касающиеся как механизмов, обес
зуют вторичные волоконные клетки (рис. 1, г).
печивающих прозрачность хрусталика, так и ме
В процессе формирования волоконные клетки
ханизмов, лежащих в основе её потери (катарак
теряют органеллы (ядра, митохондрии и др.) и в
тогенез) и указывающих пути предотвращения
конечном итоге превращаются практически в
потери прозрачности хрусталика.
«мешки» с цитоплазмой. Постепенно образуют
ся всё новые и новые волокна, которые окружа
ют ядро хрусталика всё новыми и новыми слоя
СТРОЕНИЕ И МОРФОГЕНЕЗ ХРУСТАЛИКА
ми (рис. 1, д). Волоконные клетки настолько
плотно прилегают друг к другу, что в сечении
Главным элементом глаза, фокусирующим
имеют форму равностороннего шестиугольни
изображение на сетчатке, является хрусталик.
ка. Таким образом, в хрусталике формируются
Хрусталик «подвешен» с помощью цинновой
три зоны: 1) слой кубического эпителия, высти
связки непосредственно за радужной оболоч
лающий изнутри переднюю поверхность капсу
кой, которая разделяет глаз на переднюю и зад
лы хрусталика, 2) кортикальный слой, образо
нюю камеры. Образование хрусталика начина
ванный формирующимися волоконными клет
ется на ранних стадиях эмбрионального разви
ками и 3) ядро, состоящее из терминально диф
тия (рис. 1).
ференцированных волоконных клеток. Клетки
На 11 день внутриутробного развития мыши
выделяют гликопротеины, которые образуют
хорошо различим пузырёк отделившейся экто
капсулу снаружи хрусталика. Активные метабо
дермы (рис. 1, a), который уплощается и образу
лические процессы, сопровождающие форми
ет двухслойный зачаток хрусталика (рис. 1, б).
рование хрусталика, требуют интенсивного об
Под воздействием ростовых факторов сетчатки
мена веществ. Такой обмен обеспечивается со
примыкающие к ней клетки зачатка хрусталика
судистой оболочкой, которой окружён хруста
начинают вытягиваться и образуют слой длин
лик в ходе внутриутробного развития. Впослед
ных волоконных клеток (рис. 1, в1). В результате
ствии питающая хрусталик кровеносная систе
ма рассасывается.
Форма и размер хрусталика у животных раз
ных видов широко варьируют и не коррелиру
ют ни с размером самого животного, ни с диа
метром глазного яблока. Вариации формы и
размера хрусталика у животных разных видов
можно рассматривать как адаптацию к среде
обитания. Например, хрусталик крысы близок
по форме к сфере, коэффициент его преломле
ния в районе главной оптической оси равен ко
эффициенту преломления чистого белка (1,45),
то есть раствору белка с содержанием воды,
стремящимся к нулю. Поэтому хрусталик кры
сы очень твёрд и практически не обладает спо
собностью к аккомодации. Действительно,
грызунам не требуется «рассматривать» пред
меты вдали, а в их ориентации в пространстве
ведущую роль играют осязание и обоняние.
У приматов, в том числе и у человека, зрение,
напротив, играет ведущую роль во взаимодей
ствии со средой. Поэтому хрусталик у них спо
Рис. 1. Схема формирования хрусталика. (Объяснения -
собен фокусировать на сетчатке изображения
в тексте)
объектов с разных расстояний и практически
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
179
без аберраций. Это достигается тем, что в ядре
кинуренина и 3 ОН кинуренин О гликозида.
хрусталика, через которое проходит основной
Наличие хромофоров в хрусталике, которые
световой поток, отсутствует градиент коэффи
могли бы вызывать фотохимическое поврежде
циента преломления [1-3].
ние белков хрусталика, компенсируется корот
ким временем жизни возбуждённых состояний
молекул хромофоров и низким уровнем кисло
ОСНОВНЫЕ ФУНКЦИИ ХРУСТАЛИКА
рода (2 мм рт. ст.) в ткани хрусталика [20]. Кон
центрация в хрусталике 3 ОН кинуренин О
Хрусталик в глазу выполняет две основные
гликозида с возрастом падает, происходит его
физиологические функции: фокусирование
связывание с белками - образуются так называ
изображения на сетчатке и световую фильтра
емые желтые белки, у которых резко снижена
цию. У млекопитающих ведущую роль в акко
способность рассеивать поглощённую световую
модации играет изменение кривизны поверх
энергию и увеличена способность индуцировать
ности хрусталика, тогда как у рептилий и у птиц
образование активных форм кислорода
изменяется кривизна и хрусталика, и рогови
(АФК) [21].
цы [4]. Структура и организация волоконных
клеток являются ключевыми компонентами ме
ханизма аккомодации, поскольку от них зависят
БИОХИМИЧЕСКИЙ СОСТАВ ХРУСТАЛИКА
упругие свойства хрусталика, обеспечивающие
его «округление» [5-8]. Поскольку с возрастом
Первые биохимические исследования хрус
количество слоёв волоконных клеток увеличи
талика, упомянутые в литературе, относятся к
вается, жёсткость хрусталика возрастает. След
концу XIX века, когда Морнером был выделен
ствием этого становится неспособность хруста
растворимый белок хрусталика, названный
лика изменять кривизну за счёт своих упругих
кристаллином (цитируется по [22]). В 50 х гг.
свойств - возникает старческая дальнозоркость.
прошлого века сначала Орехович с сотр. [23], а
Хрусталики многих животных содержат хро
потом Resnik [24] выделили из растворимых
мофоры, поглощающие свет в области
фракций белков хрусталика три фракции разно
300-400 нм. Хромофорами служат соединения
го молекулярного веса, которые были названы
различных химических групп. Так, у рыб - это
α , β и γ кристаллинами.
микоспорино подобные аминокислоты [9], у
Хрусталик содержит около
35% белков,
дневного геккона (Lygodactylus picturatus) - это
1% липидов и 64% воды. Белки хрусталика при
3,4 дигидроретинол [10]; у приматов, серых бе
нято разделять на водорастворимые и водоне
лок (Spermophilus tridecemlineatus) и рыбок гура
ми (Trichogaster) в качестве УФ фильтров ис
пользуются производные триптофана [11-13].
Надо отметить, что хрусталики лабораторных
животных (крысы, кролики, мыши), крупного
рогатого скота и домашних кур вообще не со
держат УФ фильтров. Можно считать доказан
ным, что у дневных сухопутных животных окра
шенный хрусталик выполняет роль светофильт
ра, защищающего сетчатку от опасности пов
реждающего действия ультрафиолетового и
сине фиолетового света [14-17].
На основе этих сведений в середине 80 х гг.
прошлого века были созданы интраокулярные
линзы «Спектр», имеющие желтоватую окраску
хрусталика человека
45-50 летнего возрас
та [18]. Анализ отдалённых результатов имплан
таций более 1 300 000 таких хрусталиков пока
зал, что они надежно защищают сетчатку и пиг
ментный эпителий от опасности фотоповрежде
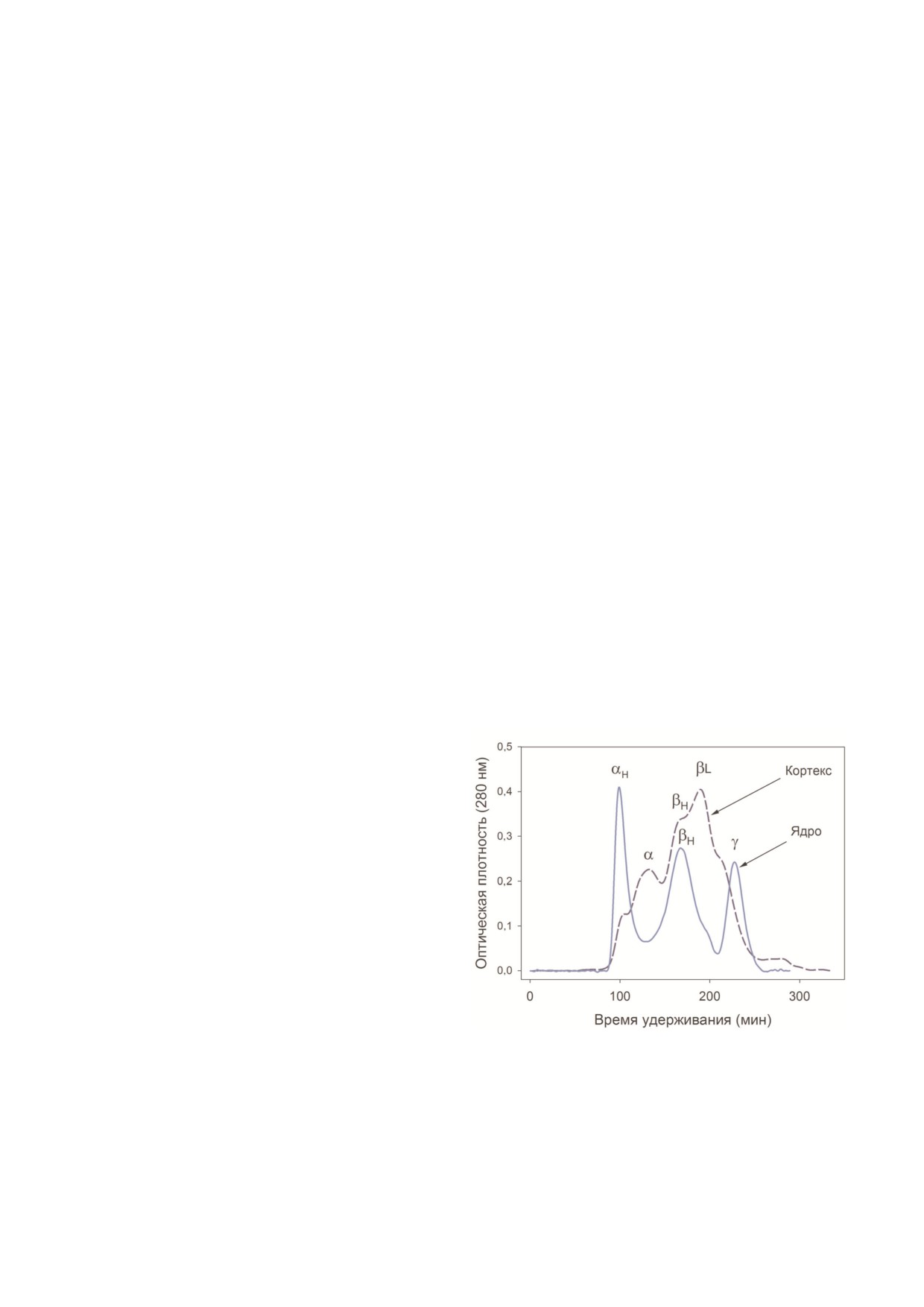
Рис. 2. Профиль элюции растворимых белков кортекса и
ния и заметно улучшают качество зрительного
ядра хрусталика крупного рогатого скота (колонка
2,5 × 90 см, Toyopearl HW55 fine). Синяя пунктирная ли
восприятия [19].
ния - кортекс, голубая непрерывная линия - ядро.
Пожелтение хрусталика у человека является
αH Кристаллин > 1500 кДа, α кристаллин - 700 кДа,
результатом фотохимических превращений
βH кристаллин - 160 кДа, βL кристаллин - 46 кДа, γ крис
триптофана с образованием кинуренина, 3 ОН
таллин - 20 кДа
БИОХИМИЯ том 87 вып. 2 2022
180
МУРАНОВ, ОСТРОВСКИЙ
растворимые [25]. Более 90% растворимых бел
кодирующих все известные 17 кристаллинов,
ков хрусталика приходится на долю α , β и
показано, что активность экспрессии генов
γ кристаллинов [26]. Хрусталик имеет неодно
сильно варьирует в зависимости от степени
родный белковый состав. В ядре преобладают
дифференцировки и, соответственно, локализа
фракции высокомолекулярных форм α ,
ции волоконной клетки [28].
β кристаллинов и γ кристаллина, тогда как в
кортексе основными белками являются α и
βL кристаллины (рис. 2).
МОЛЕКУЛЯРНЫЕ ОСНОВЫ
α Кристаллин принадлежит к семейству ма
ПРОЗРАЧНОСТИ ХРУСТАЛИКА
лых белков теплового шока, в то время как β и
γ кристаллины входят в суперсемейство,
Первые попытки подойти к вопросу о моле
родственное стрессовым белкам прокариот [27].
кулярных основах прозрачности хрусталика бы
Соотношение α , β и γ кристаллинов в тканях
ли предприняты в 1962 г. Troekel [22]. Позднее
хрусталика меняется с возрастом, что обуслов
Benedek [32] разработал теоретические основы
лено особенностями синтеза разных типов бел
прозрачности хрусталика. Минимальное свето
ков в онтогенезе [28]. Кроме кристаллинов,
рассеяние концентрированного раствора белка,
клетки хрусталика содержат белки цитоскелета,
которым и является цитоплазма волоконных
мембранные белки и цитоплазматические фер
клеток хрусталика, обеспечивается простран
менты. Однако именно кристаллины играют
ственным упорядочением близлежащих моле
ключевую роль в обеспечении оптических
кул белка [33].
свойств хрусталика.
Исследования методом малоуглового рассе
α Кристаллин - олигомерный белок с моле
яния рентгеновских лучей кортекса и ядра цело
кулярной массой 160-1000 кДа; он образован
го хрусталика животных разных классов (рыбы,
двумя полипептидами - αA и αB кристаллина
земноводные, млекопитающие) показали, что
ми массой около 20 кДа. Как и другие малые
периодическое изменение плотности белка,
белки теплового шока, α кристаллин обладает
свидетельствующее об упорядоченности белков,
способностью блокировать агрегацию дестаби
присутствует только в кортексе, но не в ядре
лизированных белков и играет важную роль в
хрусталиков [34]. Аналогичные результаты так
поддержании прозрачности хрусталика. Более
же с использованием малоуглового рассеяния
подробно особенности строения и функции α
рентгеновских лучей были получены в работе
кристаллина будут обсуждены ниже.
Mirarefi et al. [35]. Авторы исследовали срезы
β Кристаллины - структурные белки, преоб
хрусталика, что позволило более точно позици
ладающие по содержанию в хрусталике (до 60%
онировать исследуемый отдел. По всей види
всех кристаллинов). Это комплексная группа
мости, отсутствие упорядоченности белка в ядре
олигомерных белков. Различают две основные
является кажущимся. В действительности
подгруппы, а именно βА (кислые) и βB (ще
пространство между флуктуациями плотности
лочные) кристаллины, каждая из которых пред
белка заполнено низкомолекулярным γ крис
ставлена четырьмя изоформами, обозначаемы
таллином. Таким образом, кортикальную часть
ми арабскими цифрами 1-4. Субъединицы β
хрусталика отличает от ядерной области нали
кристаллинов комбинируются в разных сочета
чие флуктуаций концентрации белка. Это под
ниях с образованием гомо и гетероолигомеров.
тверждается тем, что светорассеяние кортекса
γ Кристаллины, имеющие молекулярную
хрусталика превосходит светорассеяние его
массу около 20 кДа, представлены семью изо
ядерной области [36, 37].
формами и обозначаются латинскими буква
ми A-F, а также буквой S. γ Кристаллины суще
ствуют только в виде мономеров [29, 30].
ПОМУТНЕНИЕ ХРУСТАЛИКА - КАТАРАКТА
Молекулы β/γ кристаллинов имеют двухдо
менную структуру. Каждый из доменов содер
Помутнение хрусталика или катаракта явля
жит по два гомологичных мотива «греческого
ется основной причиной слабовидения и слепо
ключа», составленного из четырёх антипарал
ты в мире [38]. Помутнения хрусталика класси
лельных β структур, образующих клиновидный
фицируют по локализации помутнения (ядер
β сэндвич с двусторонней симметрией. В отли
ная, кортикальная, диффузная и др.), по внеш
чие от γ кристаллинов β кристаллины имеют
нему виду (голубая, черная, дисковидная, по
удлинённые N концевые и С концевые после
рошкообразная, кораллообразная и т.д.), по этио
довательности - «руки», которые играют важ
логической причине (возрастная, диабетичес
ную роль в олигомеризации β кристалли
кая (сахарная), радиационная и т.д.), а также по
нов [31]. При исследовании экспрессии генов,
времени образования (наследственная, неона
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
181
тальная, ювенильная, пресенильная и сениль
возраста различается в 7,5 раз [63, 64]. Удиви
ная) [39]. Однако, с нашей точки зрения, ката
тельно, но высокомолекулярные агрегаты, появ
ракты удобно разделить на две большие группы:
ление которых в хрусталике связывали с помут
наследственные и приобретенные.
нением, не могут создать достаточный уровень
Наследственные катаракты относят к так на
флуктуаций концентрации белка, необходимый
зываемым Менделевским заболеваниям. Под
для увеличения светорассеяния [62].
робно генетика и патофизиология наследствен
Ключевая роль нарушения ближнего поряд
ных катаракт рассмотрена в нескольких обзо
ка упаковки белковых молекул в возникновении
рах [40-42].
помутнения хрусталика была предсказана ещё в
Среди основных этиологических причин
1971 г. Benedek [32], однако экспериментальное
возникновения приобретённых помутнений
подтверждение этому предположению было по
хрусталика называют, прежде всего, возраст, за
лучено только через 50 лет [58]!
тем следуют ультрафиолетовый свет, диабет, ле
чение системными стероидами, радиацию
[43-46]. Интересно отметить, что в 2012 г. была
ЕДИНЫЙ МЕХАНИЗМ КАТАРАКТОГЕНЕЗА
существенно снижена (с 2 до 0,6 Гр) норма ми
нимальной дозы радиоактивного излучения,
Классификация катаракт по этиологическо
вызывающая образование катаракты у челове
му признаку вызывает естественное предполо
ка [47]. Необходимо отметить вклад мутаций ге
жение, что и механизмы возникновения различ
нов в формирование приобретённой катаракты.
ных видов катаракт должны различаться. Для
Дефектный белок может лишь со временем при
проверки этого предположения было исследо
воздействии каких либо неблагоприятных фак
вано появление и развитие помутнений хруста
торов проявить свои негативные свойства. При
лика, возникающих при действии катарактоген
мером может быть дефектный βA3 кристаллин,
ных факторов, механизмы действия которых
который характерен для аутосомно доминант
должны принципиально различаться [65-68].
ной зонулярной катаракты и обладает понижен
Так, по сложившимся к 2010 г. представлениям,
ной устойчивостью к действию ультрафиолета
радиационная катаракта возникала вследствие
по сравнению с белком дикого типа [48-50].
нарушений пролиферации клеток эпителия и
Исследование микроскопической картины
образования дефектов упаковки волоконных
возрастных катаракт показало, что в хрусталиках
клеток в заднем кортикальном пространстве [69,
обнаруживаются различного рода морфологи
70]. В механизме действия ультрафиолета, наря
ческие изменения - изменения формы волокон
ду с воздействием на эпителий, большую роль
ных клеток, разрывы мембран, появление вакуо
отводили прямому фотохимическому поврежде
лей, набухание клеток и др. [51-54]. При диабе
нию белка [71]. Развитие старческой катаракты
тической катаракте отмечено образование боль
связывали с возрастными дегенеративными из
шого количества набухших волоконных кле
менениями ткани хрусталика [72].
ток [55]. Радиационная катаракта сопровождает
Нами были проведены эксперименты на од
ся нарушением упаковки волоконных клеток
ной линии мышей (гибрид F1(C57BlXCBA))
задней кортикальной зоны хрусталика [56].
двойным слепым методом в условиях одного ви
Вместе с тем оценить вклад тех или иных морфо
вария [67]. Было обнаружено, что в хрусталике
логических дефектов в увеличение светорассея
животных, получавших столь разные по своей
ния долгое время не представлялось возможным.
природе воздействия - облучение гамма луча
В цикле работ, проведённых в лаборатории
ми, облучение ультрафиолетом диапазона А и
Костелло, на основе расчётов с использованием
старение - образуются одинаковые типы помут
теории рассеяния Густава Ми были выявлены
нений. У животных всех групп наблюдали диф
структуры, ответственные за помутнение. Оказа
фузные и ограниченные (точечные, нитевид
лось, что перечисленные выше морфологичес
ные, кораллообразные и др.) помутнения, кото
кие изменения клеток хрусталика не могут быть
рые затрагивали как кортикальную, так и ядер
причиной помутнения [57]. Главными «рассеи
ную зоны хрусталика. Действие этих факторов
вателями» света в хрусталике являются флуктуа
различалось только по интенсивности: наиме
ции концентрации белка в цитоплазме волокон
нее катарактогенным был фактор возраста, эф
ных клеток и так называемые мультиламелляр
фект воздействия ультрафиолета и радиации в
ные тела, присутствующие в этих клетках хруста
использованных дозах был примерно одинаков,
лика [58-62]. Мультиламеллярные тела - это бе
наиболее «вредным» было совместное действие
лок липидные образования сферической формы
нескольких факторов. При исследовании мик
и размером порядка 1-4 мкм. Их количество в
роскопической структуры тканей катаракталь
прозрачном и катарактальном хрусталике одного
ных хрусталиков во всех экспериментальных
БИОХИМИЯ том 87 вып. 2 2022
182
МУРАНОВ, ОСТРОВСКИЙ
группах, по сравнению с молодыми 3 месячны
участием NADH KoQ редуктазы и KoQH2 ци
ми животными, обнаруживались лишь неспеци
тохром с редуктазы начинают образовываться
фические изменения, связанные со старением
активные супероксидные анион радикалы.
животных, а именно: уплощение клеток эпите
В результате запускается окислительная моди
лия, вакуолизация и дефрагментация их ядер,
фикация белков хрусталика. Напомним, что по
образование участков свободных от клеток и
мутнения в хрусталике колокализованы с мито
многослойных структур из фибробласто подоб
хондриями и зонами повышенной концентра
ных клеток, появление в цитоплазме волокон
ции АФК.
ных клеток микровакуолей, набухание и слия
Развитие диабетической катаракты также
ние клеток кортекса [66]. При анализе белково
сопровождается гибелью клеток эпителия [80].
го состава, проведённого методом разностного
При этом наблюдаемые изменения структуры
электрофореза, также не было найдено разли
волоконных клеток при диабетической катарак
чий между исследованными группами [65, 68].
те аналогичны изменениям при возрастной ка
Важные данные по сравнительному разви
таракте [81]. Косвенным указанием на участие
тию радиационной и старческой катаракты бы
АФК в формировании диабетической катаракты
ли получены в группе Пендерграсса. При иссле
является торможение развития помутнения с
довании хрусталиков молодых и старых мышей
помощью антиоксидантов [82-85].
линии C57BL/6 выяснилось, что у старых мы
В фундаментальном обзоре, посвящённом
шей (27-31 мес.) наблюдается образование в
механизмам формирования стероидной ката
слое эпителия больших участков свободных от
ракты, указывается, что наиболее правдоподоб
клеток. В кортексе хрусталика было обнаружено
ной гипотезой является нарушение дифферен
присутствие ядер, митохондрий, что свидетель
цировки и миграции волоконных клеток [45].
ствовало о нарушении процесса дифференци
Таким образом, к настоящему времени нако
ровки волоконных клеток. У молодых (3 мес.) и
пилось достаточное количество убедительных
годовалых мышей таких изменений отмечено не
доказательств того, что развитие катаракты под
было. Однако если 3 месячных мышей облучить
действием различных катарактогенных факто
рентгеновскими лучами в дозе 11 Гр, то к 14 мес.
ров может быть объяснено в рамках единого ме
у них развиваются точно такие же изменения в
ханизма. Суть этого механизма сводится к тому,
хрусталике, какие наблюдали у 26 месячных ин
что под воздействием повреждающего фактора
тактных животных [73, 74]. При исследовании
гибнут клетки эпителиального слоя хрусталика,
цельных хрусталиков мыши с помощью конфо
и в нём появляются пустоты («бреши»). Вслед
кальной микроскопии была обнаружена коло
ствие этого усиливается поступление кислорода
кализация митохондрий, участков выработки
внутрь хрусталика, а это нарушает морфогенез
АФК, белковых агрегатов и участков помутне
волоконных клеток, в частности распад клеточ
ний хрусталика [75, 76].
ных органелл. В результате в кортексе появля
Таким образом, полученные данные указы
ются клетки, в которых сохранились полуразру
вали на то, что важнейшие катарактогенные
шенные митохондрии. Увеличение в хрусталике
факторы - возраст, ультрафиолет и ионизирую
концентрации кислорода приводит и к усиле
щая радиация - вызывают одинаковые морфо
нию образования в митохондриях АФК, откуда
логические и биохимические изменения в ткани
они диффундируют в цитоплазму. Воздействие
хрусталика.
АФК приводит к денатурации и агрегации бел
Какой же механизм может привести к тако
ка, нарушению белок белковых взаимодей
му результату? Известно, что низкое парциаль
ствий, изменению упаковки белков цитоплазмы
ное давление кислорода (всего 2 мм рт. ст.) явля
и усилению светорассеяния в цитоплазме хрус
ется необходимым условием для нормальной
талика. Помутнение сначала затрагивает корти
деградации митохондрий и других органелл во
кальные области, но постепенно распространя
локонной клетки [20, 77-79]. Однако при гибе
ется и на ядерную область хрусталика [86].
ли клеток эпителиального слоя, вызванной
действием катарактогенного фактора, кислород
через образовавшиеся бреши диффундирует в
МЕХАНИЗМЫ ПОДДЕРЖИВАНИЯ
ткань хрусталика. Повышение концентрации
ПРОЗРАЧНОСТИ ХРУСТАЛИКА
кислорода приводит к тому, что нарушается
процесс формирования волоконных клеток - в
Белки хрусталика в отличие от белков других
них остаются полуразрушенные митохонд
органов практически не обмениваются [27]. Это
рии [76]. В таких полуразрушенных митохонд
означает, что белки, появившиеся ещё на стадии
риях, да ещё при повышенной концентрации
эмбрионального развития глаза, должны слу
кислорода, в цепи электронного транспорта с
жить в течение всей жизни организма. Поэтому в
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
183
хрусталике существуют и функционируют меха
остатков (а.о.) и имеют молекулярную массу
низмы, которые противодействуют посттранс
19,8 и 20,0 кДа [27]. Эти полипептиды формиру
ляционной модификации белков или блокируют
ют пул олигомерных молекул с массой
их негативное воздействие. Эффективность та
160-1200 кДа [103]. Соотношение αA кристал
ких механизмов исключительно высока. По этой
лина и αB кристаллина в α кристаллине варьи
причине в природе продолжительность жизни
рует. Например, у телят это отношение равно
животного обычно короче, чем время, необходи
2 : 1, тогда как у взрослых особей крупного рога
мое для развития старческой катаракты.
того скота - 3 : 1 [104]. Молярное отношение
Систему защиты хрусталика можно разде
αA : αB различается и у разных видов. Так, на
лить на три уровня. Первый уровень - это систе
пример, у акулы это отношение равно 1 : 3, у со
ма антиоксидантной защиты, препятствующая
ма - 19 : 1, у кенгуру - 9 : 1 и у человека 54 лет -
возникновению посттрансляционных модифи
3 : 2 [105, 106]. Физиологический смысл таких
каций окислительной природы, а также фермен
вариаций пока непонятен.
ты, способствующие восстановлению окислен
Как и у остальных представителей семейства
ных белков [87-92]. Второй уровень - это систе
малых белков теплового шока, в полипептиде α
ма, предотвращающая негативные последствия
кристаллина можно выделить три участка: N
влияния посттрансляционных модификаций на
концевой участок, состоящий из 60 а.о., цент
взаимодействие белков, а именно это α крис
ральный участок, состоящий из 90 а.о, и C кон
таллин, способный предупреждать агрегацию
цевой участок, состоящий из 25 а.о. [107, 108].
белков [93, 94]. Третий уровень - это система
Укорочение N концевого и С концевого участ
элиминации повреждённых белков системами
ков приводит как к потере способности образо
20S и 26S протеазных комплексов [95, 96].
вывать олигомеры, так и к снижению шаперо
По каждому из этих уровней защиты сущест
ноподобной функции белка [109-111]. Точеч
вует обширная литература, обзор которой выхо
ные мутации в центральном участке делают бе
дит за рамки данной статьи. Но некоторые эле
лок склонным к агрегации [112]. Замены а.о. в
менты этих уровней мы проиллюстрируем. Инъ
консервативном участке IPV/I С концевого
екция селенита натрия 10-12 дневным крыся
участка нарушают взаимодействие полипепти
там вызывает окислительный стресс в хрустали
дов при формировании олигомера [113].
ке, что приводит к быстрому (в течение несколь
Молекула α кристаллина является высоко
ких дней) образованию плотной ядерной ката
динамичной системой, построенной из блоков,
ракты [97]. Однако если предварительно ввести
в роли которых выступают как мономеры белка,
крысятам йодид калия, что вызывает небольшой
так и небольшие олигомеры, которые присоеди
окислительный стресс в хрусталике, то в нём ак
няются и отсоединяются от основной молеку
тивизируется синтез глутатиона, в результате че
лы [94]. Это процесс зависит от многих факто
го катаракта не развивается [98]. Отметим инте
ров: температуры, ионной силы раствора, кон
ресную особенность системы удаления повреж
центрации и т.д. Так, например снижение тем
дённых белков в хрусталике, связанную с убик
пературы с 37 до 4 °C приводит к увеличению
витиновым циклом. В условиях окислительного
диаметра олигомера от 17,9 до 19,75 нм [114].
стресса убиквитиновый протеолиз в хрусталике
Поэтому размер нативного α кристаллина
ингибируется [95, 99, 100]. Поэтому предполага
in vitro зависит от условий выделения. Вместе с
ется, что преодоление последствий окислитель
тем изучение хрусталика in vivo с помощью ди
ного стресса в хрусталике достигается не удале
намического рассеяния света, а также изолиро
нием всех повреждённых белков, как в других
ванного хрусталика с помощью малоуглового
тканях, а их максимальной репарацией.
рассеяния рентгеновских лучей показало, что
размер частицы α кристаллина равен примерно
20 нм [33, 35].
α-КРИСТАЛЛИН: СТРУКТУРА
Было предложено несколько различных мо
И ШАПЕРОНОПОДОБНАЯ ФУНКЦИЯ
лекулярных моделей белка: мицеллярная мо
дель [115, 116] - это модель, в которой олигомер
α Кристаллин как шапероноподобный бе
образовывался из полипептидных тетраме
лок тормозит агрегацию повреждённых белков и
ров [117]; трехслойная модель [118]; модель бо
таким образом поддерживает прозрачность
ба с отростками [114]. Фундаментальный обзор
хрусталика [101, 102]. Два гена с 60% ной иден
Haslbeck et al. [119] подробно рассматривает мо
тичностью, CRYAA и CRYAB, кодируют поли
лекулярные модели гомоолигомеров, образо
пептиды αA кристаллин и αB кристаллин, об
ванных αA и αB кристаллинами. Однако сле
разующие α кристаллин [29]. αА и αВ крис
дует подчеркнуть, что задача создания модели
таллины состоят из 173 и 175 аминокислотных
нативного α кристаллина ещё не решена.
БИОХИМИЯ том 87 вып. 2 2022
184
МУРАНОВ, ОСТРОВСКИЙ
на затруднено вследствие его высокой полидис
персности. Есть сведения о том, что шапероно
подобная активность αH кристаллина, измерен
ная на модели тепловой агрегации белков, пони
жена [126, 127]. Вместе с тем на модели агрега
ции инсулина в присутствии дитиотреитола по
казано, что активность αH кристаллина не отли
чается от таковой для α кристаллина из кортек
са [128]. Учитывая то, что основной световой по
ток проходит через ядерную область хрусталика,
исследование роли αH кристаллина как шаперо
ноподобного белка в противодействии развитию
помутнения чрезвычайно важно.
Свойства молекулярного шаперона были об
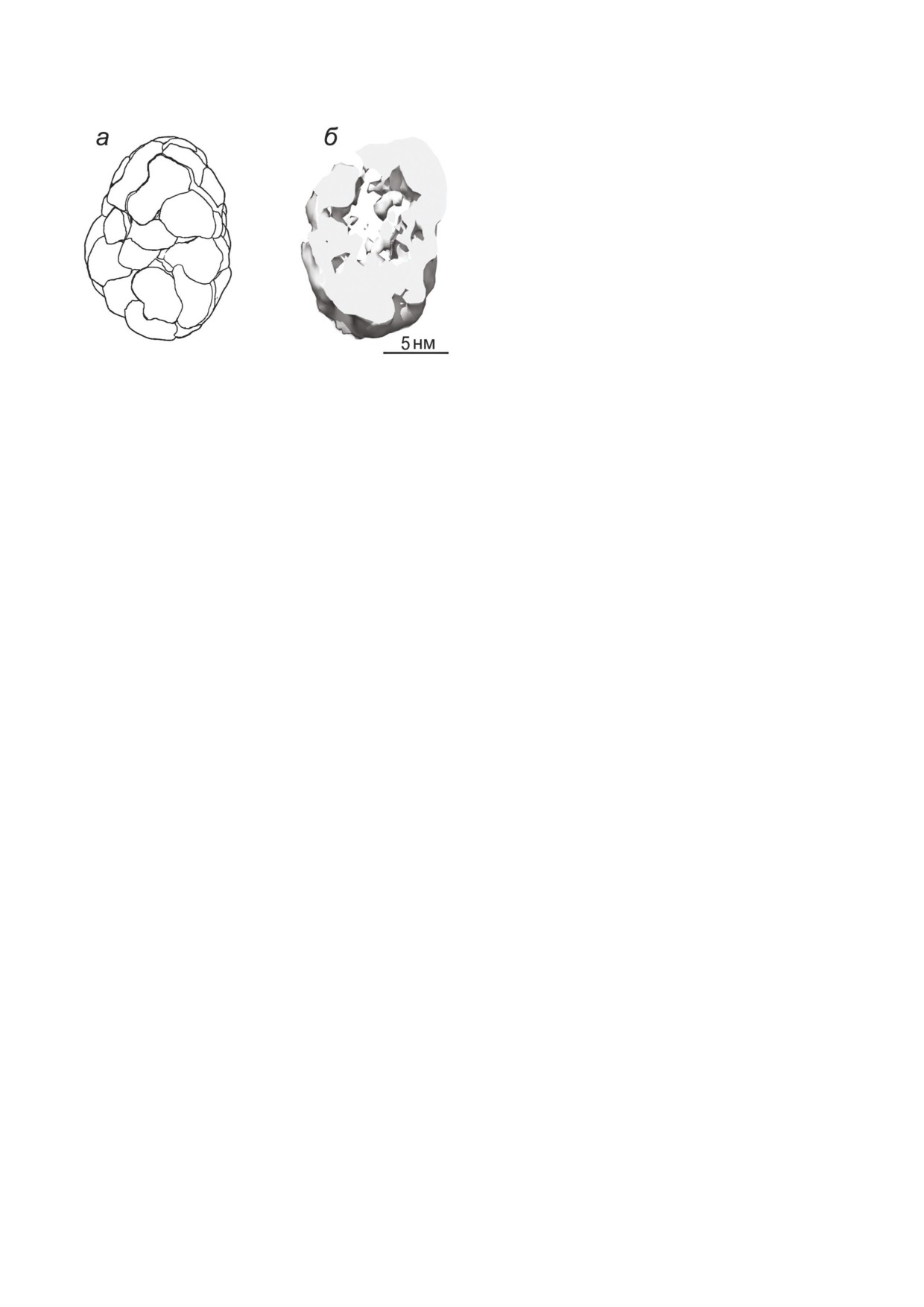
Рис. 3. Схема строения α кристаллина. а - Расположение
наружены у α кристаллина около 30 лет на
отдельных полипептидов; б - сечение частицы α кристал
зад [101, 102]. α Кристаллин оказался способен
лина
не только предупреждать агрегацию дестабили
зированных белков, но и частично восстанавли
вать структуру денатурированных моле
Недавно мы исследовали структуру α крис
кул [129-131]. Однако свойства истинного ша
таллина, используя комбинацию методов дина
перона α кристаллин демонстрировал лишь в
мического светорассеяния, аналитического
модельных системах, в которых целевыми бел
центрифугирования и электронной микроско
ками служили белки, денатурированные воздей
пии в сочетании с 3D реконструкцией изобра
ствием детергентов. Рефолдинг этих белков в
жений [103]. Оказалось, что в растворе одновре
присутствии α кристаллина после удаления де
менно присутствует целая популяция олигоме
тергента проходил более полно, чем в его отсут
ров α кристаллина, размеры которых варьиру
ствие. Однако если использовать в качестве це
ют от 8 до 25 нм. При этом один из олигомеров
левого белка химически модифицированный
размером 12-14 нм превалирует в популяции
белок, например, окисленный βL кристаллин,
молекул. На основании полученных данных бы
то восстановить его структуру в присутствии α
ла построена трёхмерная модель (рис. 3), сог
кристаллина не удаётся [132].
ласно которой белок имеет асимметричную
Для исследования механизма шаперонопо
форму, близкую к форме боба размером
добного действия α кристаллина широко ис
13
×
19
нм. Масса частицы составляла
пользуются модельные системы, основанные на
750-830 кДа. Анализ электронных плотностей
исследовании кинетики процесса агрегации
показал, что молекула имеет плотный корковый
повреждённых белков. Эта тема подробно рас
слой и разряженную заполненную нитевидны
смотрена в нескольких обзорах [133-139]. При
ми структурами, но не пустую, ядерную область.
менение методов кинетического анализа позво
Такая молекула α кристаллина находится
лило количественно оценивать шаперонопо
преимущественно в кортикальной области хрус
добную активность белков, что исключительно
талика, тогда как в ядерной части хрусталика
важно как для понимания механизма шаперо
преобладает его высокомолекулярная форма -
ноподобной активности, так и для подбора по
αH кристаллин. Исключительно гетерогенный
тенциальных претендентов для создания новых
αH кристаллин имеет массу от 50 000 кДа. Под
антикатарактальных препаратов. Например, с
электронным микроскопом αH кристаллин вы
помощью кинетического анализа кривых агре
глядит как конгломерат частиц, размер которых
гации удалось показать, что активность извест
несколько меньше α кристаллина [120, 121].
ного химического шаперона аргинина в 300 раз
Размеры αH кристаллина увеличиваются с воз
меньше, чем активность α кристаллина [140].
растом, также возрастает и его относительное
Исследование механизма шапероноподоб
количество [122, 123]. Считается, что к образо
ной активности в условиях in vitro показало, что
ванию αH кристаллина приводят посттрансля
диссоциация α кристаллина является важным,
ционные модификации α кристаллина. Однако
хотя и не необходимым звеном в этом ак
прямое повреждение белка ультрафиолетом не
те [140, 141]. При этом целевой белок образует
приводило in vitro к образованию αΗ кристалли
первичные низкомолекулярные комплексы с
на [124]. Вероятно, для образования αΗ кристал
диссоциированной формой α кристаллина.
лина необходимо присутствие и других бел
Впоследствии низкомолекулярные комплексы
ков [125]. Исследование свойств αH кристалли
образуют более крупные агломераты, которые
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
185
Рис. 4. Схема шапероноподобной активности α кристаллина в хрусталике
могут даже выпадать в осадок [132]. Однако ус
временем шапероноподобная активность α
ловия in vitro далеки от условий в клетках хруста
кристаллина в хрусталике ослабевает. В резуль
лика. Во первых, высокая концентрация белка в
тате в клетках накапливаются денатурирован
цитоплазме будет препятствовать диссоциации
ные формы белков (γ и β кристаллинов), начи
α кристаллина. Действительно, показано, что в
нается их агрегация, в результате чего усилива
условиях краудинга, моделирующего высокую
ются флуктуации концентрации белка, на гра
концентрацию белка в цитоплазме клеток хрус
нице этих флуктуаций возникает светорассея
талика, шапероноподобная активность α крис
ние и хрусталик мутнеет [32]. Действительно, в
таллина оказалась сниженной [142-145]. Во
опытах in vivo было обнаружено возрастное
вторых, диссоциация α кристаллина обнаруже
снижение шапероноподобной активности как
на при достаточно высоких концентрациях це
α кристаллина, так и αH кристаллина; подоб
левого белка в среде, сравнимых с концентраци
ное снижение активности наблюдается и при
ей, собственно, α кристаллина. Это означает,
образовании катаракты [146-150]. Как возраст
что в условиях реального хрусталика, чтобы дос
ное снижение шапероноподобной активности
тичь значимого уровня диссоциации α кристал
α кристаллина, так и снижение его активности
лина, практически треть белков (β и γ кристал
при катаракте сопровождается образованием
лина) должна быть одномоментно повреждена.
посттрансляционных модификаций различной
Очевидно, такие условия в живом хрусталике
природы [148, 151, 152]. Отсюда возникло пред
просто невозможны. Поэтому мы предложили
положение, что снижение шапероноподобной
следующий механизм шапероноподобного
активности α кристаллина вызвано именно его
действия α кристаллина в хрусталике (рис. 4).
посттрансляционной модификацией. Это было
α Кристаллин в клетке существует в виде ди
подтверждено в многочисленных эксперимен
намической системы, состоящей из олигомера
тах in vitro [153-155]. Например, повреждение
белка и диссоциированных фрагментов (вероят
α кристаллина с помощью диметил 3,3′ дитио
но, мелких олигомеров и мономеров). Любой из
биспропионимидата, вызывающее образование
этих компонентов в результате диффузии может
дисульфидных связей, снижало его активность.
столкнуться с дестабилизированными формами
При этом добавка дитиотреитола, восстанавли
γ или β кристаллина и образовать с ними комп
вающего дисульфидные связи, частично вос
лекс. Учитывая, что степень диссоциации белка в
станавливала шапероноподобную активность
хрусталике невелика, то, скорее всего, это будет
белка [156]. УФ Повреждение α кристаллина
олигомер α кристаллина. При этом повреждён
вызывало экспоненциальное снижение его ак
ный белок связывается на поверхности олигоме
тивности, что хорошо коррелировало со струк
ра α кристаллина. В дальнейшем вследствие
турными изменениями α кристаллина [157].
постоянного обмена частицами белка с другими
Однако, несмотря на огромный массив ин
олигомерами α кристаллина повреждённый бе
формации, касающейся влияния посттрансля
лок постепенно оказывается «погребённым»
ционных модификаций α кристаллина на сни
внутри комплекса, что исключает взаимодей
жение его активности в хрусталике, строгих до
ствие и агрегацию поврежденных молекул [132].
казательств, которые связывали бы количество
конкретных посттрансляционных модифика
ций со степенью снижения его шапероноподоб
ВОЗРАСТНОЕ СНИЖЕНИЕ
ной активности пока не получено. На наш
ШАПЕРОНОПОДОБНОЙ АКТИВНОСТИ
взгляд, сочетание расчётных методов физики
α-КРИСТАЛЛИНА
полимеров, оценивающих влияние модифика
ций тех или иных а.о. на структуру белковой це
В основе современной концепции катарак
пи, и данных масс спектрометрии может позво
тогенеза лежит предположение о том, что со
лить доказать наличие такой связи.
3 БИОХИМИЯ том 87 вып. 2 2022
186
МУРАНОВ, ОСТРОВСКИЙ
Очевидно, что молекула α кристаллина мо
Предпринимались попытки усилить шапероно
жет связать лишь какое то определённое коли
подобную активность α кристаллина в хруста
чество дестабилизированного белка. Поэтому
лике, используя участки молекулы α кристал
исчерпание способности α кристаллина связы
лина, которые могли бы отвечать за его шаперо
вать повреждённый белок является ещё одной
ноподобную активность [163, 164]. Однако са
причиной уменьшения шапероноподобной ак
мый активный пептид с последовательностью
тивности α кристаллина в хрусталике. При ис
KFVIFLDVKHFSPEDLTVK, хотя и препятство
следовании in vitro взаимодействия УФ повреж
вал преципитации белка, но не тормозил обра
денного βL кристаллина с нативным α крис
зование агрегатов размером 50-500 нм [165].
таллином было показано, что белковый комп
Некоторые соединения, например, трегало
лекс остаётся растворимым в том случае, если
за, аргинин, циклодекстрины, выступая как хи
содержание целевого белка не превышает 5-7%
мические шапероны, способны затормозить
[132]. При связывании большего количества
процесс агрегации белков в условиях in vitro
повреждённого белка масса комплекса возрас
[166-169]. Однако действуют такие соединения
тает существенно, и растворимость его падает.
в очень больших концентрациях, а именно
Вероятно, в хрусталике происходит аналогич
0,2 М и выше, и поэтому они вряд ли могут рас
ный процесс: α кристаллин, перегруженный
сматриваться в качестве потенциальных антика
связанными с ним повреждёнными белками,
тарактальных средств.
сначала образует высокомолекулярные формы,
Исследование механизма антикатаракталь
а затем выпадает в осадок. Интересно отметить,
ного эффекта карнозина и его производных по
что шапероноподобная активность α кристал
казало, что в основе действия этих соединений
лина, полученного из водонерастворимой
может лежать их способность тормозить агрега
фракции белка хрусталика, была снижена
цию дестабилизированных белков. Наиболее
на 40% по сравнению с нативным белком, но не
активным среди производных карнозина ока
полностью потеряна [156]. Это указывает на то,
зался N ацетилкарнозин [170]. Свою актив
что нарушение растворимости (выпадение в
ность N ацетилкарнозин в отношении агрега
осадок) комплекса α кристаллин-повреждён
ции УФ повреждённого βL кристаллина прояв
ный белок начинается задолго до того, как все
лял уже в миллимолярных концентрациях, что
связывающие сайты α кристаллина будут заня
существенно отличало его от химических шапе
ты дестабилизированными белками. В этой свя
ронов. Вероятно, антиагрегационный эффект
зи необходимо упомянуть недавнее исследова
этого соединения связан с его амфифильными
ние механизма возникновения помутнения
свойствами и целевым связыванием на гидро
хрусталика при врождённой катаракте [158]. По
фобных сайтах денатурированного белка, участ
мнению авторов исследования, причиной воз
вующих в агрегации. Для таких соединений мы
никновения помутнения хрусталика является
предложили термин «минишаперон» [171].
вовсе не исчерпание способности α кристалли
Привлекательной выглядела идея объеди
на связывать повреждённые белки, а изменение
нить в одном препарате соединение, увеличива
белок белковых взаимодействий, возникающее
ющее способность α кристаллина связывать де
вследствие замены аминокислот в случае насле
натурированные белки, и вещества, которые са
дственных катаракт, или посттрансляционные
ми обладают шапероноподобными свойствами,
модификации белков в случае катаракт возраст
а именно пантетин и N ацетилкарнозин. Оказа
ных. Однако, как нам представляется, хотя та
лось, что такая композиция соединений способ
кая гипотеза и может иметь право на существо
на предупреждать развитие помутнения хруста
вание, но пока она ещё слабо подкреплена экс
лика, индуцированное облучением ближним
периментальными данными.
ультрафиолетом в опытах in vivo [172-175].
Средства, применяемые для консервативно
го лечения катаракты, были способны лишь за
МОДУЛЯЦИЯ ШАПЕРОНОПОДОБНОЙ
медлить развитие катаракты. Но возможно ли
АКТИВНОСТИ α-КРИСТАЛЛИНА
обратить этот процесс, растворив каким то об
ЭКЗОГЕННЫМИ СОЕДИНЕНИЯМИ
разом белковые агрегаты в хрусталике? Соеди
И КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ КАТАРАКТЫ
нение ланостерол, а также некоторые другие
производные стероидов оказались способными
Было показано, что производное β аланина
не только предупреждать агрегацию in vitro, но и
и пантотеновой кислоты - пантетин - способно
растворять агрегаты белка in vivo [176, 177].
за счёт усиления шапероноподобных свойств α
В журналах Nature и Science были опубликованы
кристаллина эффективно предупреждать разви
оптимистичные отзывы ведущих исследовате
тие селенитовой катаракты у крыс [159-162].
лей в области патогенеза катаракты, прогнози
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
187
рующие на этой основе создание лекарственно
его действия основан на методе измерения ди
го препарата, способного излечивать это заболе
намического рассеяния света. Динамическое
вание [178, 179]. Правда, дальнейшие исследо
рассеяние света позволяет in vivo не только диаг
вания показали, что не все так просто: в некото
ностировать начальные стадии катаракты, кото
рых случаях препараты показывали хороший ре
рые невозможно зафиксировать другими извест
зультат, а в некоторых были неэффективны
ными методами, но и оценить количество ак
[180-183]. Очевидно, что это направление тре
тивного, то есть способного связывать повреж
бует дальнейших исследований.
дённые белки, α кристаллина в хрусталике.
Идея замедлить образование катаракты с по
Снижение уровня активного α кристаллина ни
мощью соединений, тормозящих процесс сво
же некоторого порогового значения является
боднорадикального окисления (о роли свобод
указанием на скорое появление в хрусталике по
норадикального окисления в формировании ка
мутнения. В заключение заметим, что в США в
таракты см. выше), возникла давно. Например, в
последние годы активно ведутся уже клиничес
состав антикатарактальных капель вводили глу
кие испытания прибора Ansari [192].
татион и цистеин [184]. Считается, что лечебный
Таким образом, применение комплекса ан
эффект широко применяемого антикатарак
тикатарактальных препаратов шапероноподоб
тального препарата Сенкаталин (Каталин) обус
ного и антиоксидантного действия в сочетании
ловлен его антиоксидантными свойствами [185].
с ранней диагностикой опасности возникнове
Однако возник удивительный парадокс - анти
ния катаракты может позволить предупреждать
катарактальные препараты демонстрировали
развития катаракты и, как следствие, умень
высокую активность в лабораторном экспери
шить число случаев, требующих хирургического
менте, но были бесполезными в клинической
лечения.
практике [186]. Секрет оказался прост. Как по
казало специальное исследование, применение
препаратов начинали тогда, когда в хрусталике
Финансирование. Работа выполнена при под
уже образовалась катаракта. Кроме того, нема
держке Российского научного фонда (грант
ловажным оказался и человеческий фактор: ос
№ 21 14 00178 для К.О.М.) и Министерства на
новная масса и врачей, и пациентов не верила в
уки и высшего образования Российской Феде
эффективность консервативного лечения ката
рации (соглашение № 075 15 2020 795, внут
ракты [187]. Таким образом, с одной стороны,
ренний № 13.1902.21.0027 для М.А.О.).
разработаны препараты, пригодные для консер
Конфликт интересов. Авторы заявляют об от
вативного лечения катаракты, с другой стороны,
сутствии конфликта интересов.
их применение в клинике оказывается неэффек
Соблюдение этических норм. Описанные в
тивным вследствие слишком позднего примене
настоящей статье результаты, полученные в ис
ния. Выход нам видится в разработке и широком
следованиях с участием животных, соответство
применении в практике средств и методов ран
вали этическим стандартам учреждений, в кото
ней диагностики катаракты.
рых проводились исследования, а именно «На
Профилактику и лечение катаракты надо на
учно исследовательский институт глазных бо
чинать задолго до появления клинических приз
лезней» (г. Москва) и «Объединенный институт
наков заболевания. Примером ранней диагнос
ядерных исследований» (г. Дубна), и утвержден
тики может быть диагностика с использованием
ным правовыми актам РФ и международных ор
прибора, созданного Ansari [188-191]. Принцип
ганизаций.
СПИСОК ЛИТЕРАТУРЫ
1.
De Korte, C. L., Van Der Steen, A. F., Thijssen, J. M.,
4.
Ott, M. (2006) Visual accommodation in vertebrates:
Duindam, J. J., Otto, C., et al. (1994) Relation between
mechanisms, physiological response and stimuli, J. Comp.
local acoustic parameters and protein distribution in
Physiol. A Neuroethol. Sens. Neural Behav. Physiol., 192,
human and porcine eye lenses, Exp. Eye Res., 59, 617 627,
97 111, doi: 10.1007/s00359 005 0049 6.
doi: 10.1006/exer.1994.1147.
5.
Kuszak, J. R., Zoltoski, R. K., and Tiedemann, C. E.
2.
Fagerholm, P. P., and Philipson, B. T. (1981) Human lens
(2004) Development of lens sutures, Int. J. Dev. Biol., 48,
epithelium in normal and cataractous lenses, Invest.
889 902, doi: 10.1387/ijdb.041880jk.
Ophthalmol. Vis. Sci., 21, 408 414.
6.
Kuszak, J. R., Mazurkiewicz, M., and Zoltoski, R. (2006)
3.
Siebinga, I., Vrensen, G. F., De Mul, F. F., and Greve, J.
Computer modeling of secondary fiber development and
(1991) Age related changes in local water and protein con
growth: I. Nonprimate lenses, Mol. Vis., 12, 251 270.
tent of human eye lenses measured by Raman microspec
7.
Kuszak, J. R., Mazurkiewicz, M., Jison, L., Madurski, A.,
troscopy, Exp. Eye Res., 53, 233 239, doi: 10.1016/0014
Ngando, A., et al. (2006) Quantitative analysis of animal
4835(91)90079 t.
model lens anatomy: accommodative range is related to
БИОХИМИЯ том 87 вып. 2 2022
3*
188
МУРАНОВ, ОСТРОВСКИЙ
fiber structure and organization, Vet. Ophthalmol., 9, 266
26.
Bloemendal, H. (1977) The vertebrate eye lens, Science,
280, doi: 10.1111/j.1463 5224.2006.00506.x.
197, 127 138, doi: 10.1126/science.877544.
8.
Kuszak, J. R. and Zoltoski, R. K. (2006) in Focus on Eye
27.
Bloemendal, H., De Jong, W., Jaenicke, R., Lubsen,
Research (Ioseliani, O. R., ed.) New York, pp. 117 132.
N. H., Slingsby, C., et al. (2004) Ageing and vision: struc
9.
Shick, J. M., and Dunlap, W. C. (2002) Mycosporine like
ture, stability and function of lens crystallins, Prog.
amino acids and related Gadusols: biosynthesis, acumula
Biophys. Mol. Biol., 86, 407 485, doi: 10.1016/j.pbiomolbio.
tion, and UV protective functions in aquatic organisms,
2003.11.012.
Annu. Rev. Physiol., 64, 223 262, doi: 10.1146/annurev.
28.
Gangalum, R. K., Kim, D., Kashyap, R. K., Mangul, S.,
physiol.64.081501.155802.
Zhou, X., et al. (2018) Spatial analysis of single fiber cells
10.
Werten, P. J., Roll, B., van Aalten, D. M., and de Jong, W. W.
of the developing ocular lens reveals regulated heterogene
(2000) Gecko iota crystallin: how cellular retinol binding
ity of gene expression, iScience, 10, 66 79, doi: 10.1016/
protein became an eye lens ultraviolet filter, Proc. Natl. Acad.
j.isci.2018.11.024.
Sci. USA, 97, 3282 3287, doi: 10.1073/pnas.050500597.
29.
Bloemendal, H., and de Jong, W. W. (1991) Lens proteins
11.
Truscott, R. J., Carver, J. A., Thorpe, A., and Douglas, R. H.
and their genes, Prog. Nucleic Acid Res. Mol. Biol., 41, 259
(1992) Identification of 3 hydroxykynurenine as the lens
281, doi: 10.1016/s0079 6603(08)60012 4.
pigment in the gourami Trichogaster trichopterus, Exp. Eye
30.
Sharma, K. K., and Santhoshkumar, P. (2009) Lens aging:
Res., 54, 1015 1017, doi: 10.1016/0014 4835(92)90167 q.
effects of crystallins, Biochim. Biophys. Acta, 1790, 1095
12.
Van Heyningen, R. (1971) Fluorescent derivatives of 3
1108, doi: 10.1016/j.bbagen.2009.05.008.
hydroxy L kynurenine in the lens of man, the baboon and
31.
Sergeev, Y. V., Hejtmancik, J. F., and Wingfield, P. T.
the grey squirrel, Biochem. J., 123, 30P 31P, doi: 10.1042/
(2004) Energetics of domain domain interactions and
bj1230030p.
entropy driven association of beta crystallins,
13.
Van Heyningen, R. (1971) Fluorescent glucoside in the
Biochemistry, 43, 415 424, doi: 10.1021/bi034617f.
human lens, Nature, 230, 393 394, doi: 10.1038/230393a0.
32.
Benedek, G. B. (1971) Theory of transparency of the eye,
14.
Cuthbertson, F. M., Peirson, S. N., Wulff, K., Foster,
Appl. Opt., 10, 459 473, doi: 10.1364/AO.10.000459.
R. G., and Downes, S. M. (2009) Blue light filtering
33.
Delaye, M., and Tardieu, A. (1983) Short range order of
intraocular lenses: review of potential benefits and side
crystallin proteins accounts for eye lens transparency,
effects, J. Cataract Refract. Surg.,
35,
12811297,
Nature, 302, 415 417, doi: 10.1038/302415a0.
doi: 10.1016/j.jcrs.2009.04.017.
34.
Krivandin, A. V., and Muranov, K. O. (1999) Comparative
15.
Meyers, S. M., Ostrovsky, M. A., and Bonner, R. F. (2004)
study of the crystallin supramolecular structure in the carp,
A model of spectral filtering to reduce photochemical dam
frog, and rat lenses by small angle roentgen ray scattering,
age in age related macular degeneration, Trans. Am.
Biofizika, 44, 1088 1093.
Ophthalmol. Soc., 102, 83 93.
35.
Mirarefi, A. Y., Boutet, S., Ramakrishnan, S., Kiss, A. J.,
16.
Nolan, J. M., O’Reilly, P., Loughman, J., Stack, J.,
Cheng, C. H., et al. (2010) Small angle X ray scattering
Loane, E., et al. (2009) Augmentation of macular pigment
studies of the intact eye lens: Effect of crystallin composi
following implantation of blue light filtering intraocular
tion and concentration on microstructure, Biochim.
lenses at the time of cataract surgery, Invest. Ophthalmol.
Biophys. Acta, 1800, 556 564, doi: 10.1016/j.bbagen.2010.
Vis. Sci., 50, 4777 4785, doi: 10.1167/iovs.08 3277.
02.004.
17.
Wu, J., Seregard, S., and Algvere, P. V.
(2006)
36.
Nomura, H., Shimokata, H., Niino, N., Ando, F.,
Photochemical damage of the retina, Surv. Ophthalmol.,
Sugita, J., et al. (2000) Estimation of anterior nucleus of
51, 461 481, doi: 10.1016/j.survophthal.2006.06.009.
lens by Scheimpflug image before and after pupil dilata
18.
Линник Л. Ф., Островский М. А., Салиев М. А. (1991)
tion, Jpn. J. Ophthalmol., 44, 682 685, doi: 10.1016/s0021
Искусственные хрусталики, поглощающие ультрафио
5155(00)00287 2.
летовые лучи: безопасность, эффективность и пер
37.
Yaroslavsky, I. V., Yaroslavsky, A. N., Otto, C., Puppels,
спектива использования в офтальмохирургии, Оф-
G. J., Vrensen, G. F., et al. (1994) Combined elastic and
тальмохирургия, 4, 3 7.
Raman light scattering of human eye lenses, Exp. Eye Res.,
19.
Тахчиди Х. П., Линник Л. Ф., Островский М. А., Зак
59, 393 399, doi: 10.1006/exer.1994.1123.
П. П. (2007) Отдаленные результаты наблюдений пос
38.
Fricke, T. R., Holden, B. A., Wilson, D. A.,
ле имплантации искусственного хрусталика «Спектр»
Schlenther, G., Naidoo, K. S., et al. (2012) Global cost of
с естественной спектральной характеристикой, Оф-
correcting vision impairment from uncorrected refractive
тальмохирургия, 1, 11 21.
error, Bull. World Health Organ.,
90,
728738,
20.
McNulty, R., Wang, H., Mathias, R. T., Ortwerth, B. J.,
doi: 10.2471/BLT.12.104034.
Truscott, R. J., et al. (2004) Regulation of tissue oxygen
39.
Вит В. В. (2002) в кн. Катаракта (под ред. Веселовс
levels in the mammalian lens, J. Physiol., 559, 883 898,
кая З. Ф.) Книга плюс, Киев, с. 41 53.
doi: 10.1016/0014 5793(94)00601 6.
40.
Berry, V., Georgiou, M., Fujinami, K., Quinlan, R.,
21.
Мажуль В. М., Зайцева Е. М., Щербин Д. Г., Чекана
Moore, A., et al. (2020) Inherited cataracts: molecular
А. Ю., Голуб О. М. (2003) Фосфоресцентный анализ
genetics, clinical features, disease mechanisms and novel
ткани хрусталика в норме и при катаракте, Белорус-
therapeutic approaches, Br. J. Ophthalmol., 104, 1331
ский офтальмологический журнал, 2-3, 13 16.
1337, doi: 10.1136/bjophthalmol 2019 315282.
22.
Troekel, S. (1962) The physical basis for transparency of
41.
Shiels, A., Bennett, T. M., and Hejtmancik, J. F. (2010)
the crystalline lens, Invest. Ophthalmol., 1, 493 501.
Cat Map: Putting cataract on the map, Mol. Vis., 16, 2007
23.
Орехович В. Н., Фирфарова К. Ф., Шпикитер В. О.
2015.
(1955) Физико химическая характеристика раствори
42.
Shiels, A., and Hejtmancik, J. F. (2013) Genetics of human
мых белков хрусталика, Український біохімічний жур-
cataract, Clin. Genet., 84, 120 127, doi: 10.1111/cge.12182.
нал, XXVII, 355 363.
43.
Harding, J. J. (2002) Viewing molecular mechanisms of
24.
Resnik, R. A. (1957) Lens proteins. I. Alpha crystallin of
ageing through a lens, Ageing Res. Rev., 1, 465 479,
calf lens, Am. J. Ophthalmol., 44, 357 362.
doi: 10.1016/s1568 1637(02)00012 0.
25.
Harrington, V., Srivastava, O. P., and Kirk, M. (2007)
44.
Head, K. A. (2001) Natural therapies for ocular disorders,
Proteomic analysis of water insoluble proteins from normal
part two: cataracts and glaucoma, Altern. Med. Rev., 6,
and cataractous human lenses, Mol. Vis., 13, 1680 1694.
141 166.
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
189
45.
James, E. R. (2007) The etiology of steroid cataract,
nuclear fiber cell cytoplasm, Exp. Eye Res., 69, 163 174,
J. Ocul. Pharmacol. Ther., 23, 403 420, doi: 10.1089/jop.
doi: 10.1006/exer.1999.0679.
2006.0067.
63.
Gilliland, K. O., Freel, C. D., Lane, C. W., Fowler, W. C.,
46.
McCarty, C. A., and Taylor, H. R. (2002) A review of the
and Costello, M. J. (2001) Multilamellar bodies as poten
epidemiologic evidence linking ultraviolet radiation and
tial scattering particles in human age related nuclear
cataracts, Dev. Ophthalmol., 35, 21 31, doi: 10.1159/
cataracts, Mol. Vis., 7, 120 130.
000060807.
64.
Gilliland, K. O., Freel, C. D., Johnsen, S., Craig, F. W.,
47.
Thorne, M. C. (2012) Regulating exposure of the lens of
and Costello, M. J. (2004) Distribution, spherical structure
the eye to ionising radiations, J. Radiol. Prot., 32, 147 154,
and predicted Mie scattering of multilamellar bodies in
doi: 10.1088/0952 4746/32/2/147.
human age related nuclear cataracts, Exp. Eye Res., 79,
48.
Hejtmancik, J. F., and Kantorow, M. (2004) Molecular
563 576, doi: 10.1016/j.exer.2004.05.017.
genetics of age related cataract, Exp. Eye Res., 79, 3 9,
65.
Kurova, V. S., Muranov, K. O., Polianskii, N. B.,
doi: 10.1016/j.exer.2004.03.014.
Sheremet, N. L., Fedorov, A. A., et al. (2012) Experimental
49.
Kannabiran, C., Rogan, P. K., Olmos, L., Basti, S., Rao,
study of influence of different damaging factors on lens.
G. N., et al. (1998) Autosomal dominant zonular cataract
Report 3. Changes of lens protein composition, Vestn.
with sutural opacities is associated with a splice mutation in
Oftalmol., 128, 17 19.
the betaA3/A1 crystallin gene, Mol. Vis., 4, 21.
66.
Muranov, K. O., Polianskii, N. B., Bannik, K. I.,
50.
Sergeev, Y. V., Soustov, L. V., Chelnokov, E. V., Bityurin,
Sheremet, N. L., Fedorov, A. A., et al. (2012) Experimental
N. M., Backlund, P. S., Jr., et al. (2005) Increased sensitiv
study of influence of different damaging factors on lens.
ity of amino arm truncated betaA3 crystallin to UV light
Report 2. Features of microscopic lens changes, Vestn.
induced photoaggregation, Invest. Ophthalmol. Vis. Sci.,
Oftalmol., 128, 12 16.
46, 3263 3273, doi: 10.1167/iovs.05 0112.
67.
Sheremet, N. L., Muranov, K. O., Polianskii, N. B.,
51.
Bron, A. J., Vrensen, G. F., Koretz, J., Maraini, G., and
Fedorov, A. A., Bannik, K. I., et al. (2012) Experimental
Harding, J. J. (2000) The ageing lens, Ophthalmologica,
study of influence of different damaging factors on lens.
214, 86 104, doi: 10.1159/000027475.
Report 1. Features of biomicroscopic changes, Vestn.
52.
Vrensen, G. F. (1995) Aging of the human eye lens - a
Oftalmol., 128, 8 12.
morphological point of view, Comp. Biochem. Physiol.
68.
Muranov, K. O., Polianskii, N. B., Kurova, V. S.,
A Physiol.,
111,
519532, doi:
10.1016/0300
Riabokon’, A. M., Sheremet, N. L., et al.
(2010)
9629(95)00053 a.
Comparative study of aging, UV treatment, and radiation
53.
Creighton, M. O., Trevithick, J. R., Mousa, G. Y., Percy,
on cataract formation, Radiats. Biol. Radioecol., 50, 276
D. H., McKinna, A. J., et al. (1978) Globular bodies: a pri
285.
mary cause of the opacity in senile and diabetic posterior
69.
Broglio, T. M., and Worgul, B. V. (1982) The lens epitheli
cortical subcapsular cataracts? Can. J. Ophthalmol., 13,
um and radiation cataract. IV. Ultrastructural studies of
166 181.
interphase death in the meridional rows, Virchows Arch.
54.
Dilley, K. J., Bron, A. J., and Habgood, J. O. (1976)
B Cell Pathol. Incl. Mol. Pathol.,
39,
4957,
Anterior polar and posterior subcapsular cataract in a
doi: 10.1007/BF02892836.
patient with retinitis pigmentosa: a light microscopic and
70.
Merriam, G. R., Jr., and Worgul, B. V.
(1983)
ultrastructural study, Exp. Eye Res.,
22,
155167,
Experimental radiation cataract - its clinical relevance,
doi: 10.1016/0014 4835(76)90042 7.
Bull. N. Y. Acad. Med., 59, 372 392.
55.
Kinoshita, J. H. (1974) Mechanisms initiating cataract for
71.
Hockwin, O., Kojima, M., Sakamoto, Y., Wegener, A.,
mation. Proctor Lecture, Invest. Ophthalmol., 13, 713 724.
Shui, Y. B., et al. (1999) UV damage to the eye lens: further
56.
Worgul, B. V., Merriam, G. R., Jr., and Medvedovsky, C.
results from animal model studies: a review, J. Epidemiol.,
(1989) Cortical cataract development - an expression of
9, S39 S47, doi: 10.2188/jea.9.6sup_39.
primary damage to the lens epithelium, Lens Eye Toxic.
72.
Schmitt, C., and Hockwin, O. (1990) The mechanisms of
Res., 6, 559 571.
cataract formation, J. Inherit. Metab. Dis., 13, 501 508,
57.
Al Ghoul, K. J., and Costello, M. J. (1996) Fiber cell mor
doi: 10.1007/BF01799507.
phology and cytoplasmic texture in cataractous and normal
73.
Wolf, N., Pendergrass, W., Singh, N., Swisshelm, K., and
human lens nuclei, Curr. Eye Res.,
15,
533542,
Schwartz, J. (2008) Radiation cataracts: mechanisms
doi: 10.3109/02713689609000764.
involved in their long delayed occurrence but then rapid
58.
Costello, M. J., Burette, A., Weber, M., Metlapally, S.,
progression, Mol. Vis., 14, 274 285.
Gilliland, K. O., et al. (2012) Electron tomography of fiber
74.
Pendergrass, W., Zitnik, G., Tsai, R., and Wolf, N. (2010)
cell cytoplasm and dense cores of multilamellar bodies
X ray induced cataract is preceded by LEC loss, and coin
from human age related nuclear cataracts, Exp. Eye Res.,
cident with accumulation of cortical DNA, and ROS; sim
101, 72 81, doi: 10.1016/j.exer.2012.06.005.
ilarities with age related cataracts, Mol. Vis., 16, 1496 1513.
59.
Costello, M. J., Oliver, T. N., and Cobo, L. M. (1992)
75.
Pendergrass, W., Penn, P., Possin, D., and Wolf, N. (2005)
Cellular architecture in age related human nuclear
Accumulation of DNA, nuclear and mitochondrial debris,
cataracts, Invest. Ophthal. Mol. Vis. Sci., 33, 3209 3227.
and ROS at sites of age related cortical cataract in mice,
60.
Costello, M. J., Johnsen, S., Metlapally, S., Gilliland,
Invest. Ophthalmol. Vis. Sci., 46, 4661 4670, doi: 10.1167/
K. O., Ramamurthy, B., et al. (2008) Ultrastructural analy
iovs.05 0808.
sis of damage to nuclear fiber cell membranes in advanced
76.
Pendergrass, W. R., Penn, P. E., Possin, D. E., and Wolf,
age related cataracts from India, Exp. Eye Res., 87, 147
N. S. (2006) Cellular debris and ROS in age related corti
158, doi: 10.1016/j.exer.2008.05.009.
cal cataract are caused by inappropriate involution of the
61.
Costello, M. J., Johnsen, S., Metlapally, S., Gilliland,
surface epithelial cells into the lens cortex, Mol. Vis., 12,
K. O., Frame, L., et al. (2010) Multilamellar spherical par
712 724, doi: 10.1167/iovs.05 0808.
ticles as potential sources of excessive light scattering in
77.
Bassnett, S. (2002) Lens organelle degradation, Exp. Eye
human age related nuclear cataracts, Exp. Eye Res., 91,
Res., 74, 1 6, doi: 10.1006/exer.2001.1111.
881 889, doi: 10.1016/j.exer.2010.09.013.
78.
Bassnett, S. (2009) On the mechanism of organelle degra
62.
Taylor, V. L., and Costello, M. J. (1999) Fourier analysis of
dation in the vertebrate lens, Exp. Eye Res., 88, 133 139,
textural variations in human normal and cataractous lens
doi: 10.1016/j.exer.2008.08.017.
БИОХИМИЯ том 87 вып. 2 2022
190
МУРАНОВ, ОСТРОВСКИЙ
79.
Shestopalov, V. I., and Bassnett, S. (2003) Development of
alphaA crystallins by the ubiquitin proteasome pathway,
a macromolecular diffusion pathway in the lens, J. Cell
Invest. Ophthalmol. Vis. Sci., 48, 4200 4208, doi: 10.1167/
Sci., 116 (Pt 20), 4191 4199, doi: 10.1242/jcs.00738.
iovs.07 0196.
80.
Tkachov, S. I., Lautenschlager, C., Ehrich, D., and Struck,
97. Ostadalova, I., Babicky, A., and Obenberger, J. (1978)
H. G. (2006) Changes in the lens epithelium with respect
Cataract induced by administration of a single dose of sodi
to cataractogenesis: Light microscopic and Scheimpflug
um selenite to suckling rats, Experientia, 34, 222 223,
densitometric analysis of the cataractous and the clear lens
doi: 10.1007/BF01944690.
of diabetics and non diabetics, Graefes Arch. Clin. Exp.
98. Muranov, K., Poliansky, N., Winkler, R., Rieger, G.,
Ophthalmol., 244, 596602, doi: 10.1007/s00417 005
Schmut, O., et al. (2004) Protection by iodide of lens from
0091 7.
selenite induced cataract, Graefes Arch. Clin. Exp.
81.
Al Ghoul, K. J., and Costello, M. J. (1993) Morphological
Ophthalmol., 242, 146151, doi: 10.1007/s00417 003
changes in human nuclear cataracts of late onset diabetics,
0790 x.
Exp. Eye Res., 57, 469 486, doi: 10.1006/exer.1993.1149.
99. Shang, F., Gong, X., and Taylor, A. (1997) Activity of ubiq
82.
Ansari, N. H., and Srivastava, S. K. (1990) Allopurinol pro
uitin dependent pathway in response to oxidative stress.
motes and butylated hydroxy toluene prevents sugar
Ubiquitin activating enzyme is transiently up regulated,
induced cataractogenesis, Biochem. Biophys. Res. Commun.,
J. Biol. Chem., 272, 23086 23093, doi: 10.1074/jbc.272.37.
168, 939 943, doi: 10.1016/0006 291x(90)91119 d.
23086.
83.
Kyselova, Z., Stefek, M., and Bauer, V.
(2004)
100. Shang, F., and Taylor, A. (1995) Oxidative stress and recov
Pharmacological prevention of diabetic cataract,
ery from oxidative stress are associated with altered ubiqui
J. Diabetes Complications, 18, 129 140, doi: 10.1016/
tin conjugating and proteolytic activities in bovine lens
S1056 8727(03)00009 6.
epithelial cells, Biochem. J., 307, 297 303, doi: 10.1042/
84.
Kyselova, Z., Gajdosik, A., Gajdosikova, A., Ulicna, O.,
bj3070297.
Mihalova, D., et al. (2005) Effect of the pyridoindole
101. Horwitz, J. (1992) Alpha crystallin can function as a mol
antioxidant stobadine on development of experimental dia
ecular chaperone, Proc. Natl. Acad. Sci. USA, 89, 10449
betic cataract and on lens protein oxidation in rats:
10453, doi: 10.1073/pnas.89.21.10449.
Comparison with vitamin E and BHT, Mol. Vis., 11, 56 65.
102. Rao, P. V., Huang, Q. L., Horwitz, J., and Zigler, J. S., Jr.
85.
Ross, W. M., Creighton, M. O., Trevithick, J. R., Stewart
(1995) Evidence that alpha crystallin prevents non specif
DeHaan, P. J., and Sanwal, M. (1983) Modelling cortical
ic protein aggregation in the intact eye lens, Biochim.
cataractogenesis: VI. Induction by glucose in vitro or in dia
Biophys. Acta,
1245,
439447, doi:
10.1016/0304
betic rats: prevention and reversal by glutathione, Exp. Eye
4165(95)00125 5.
Res., 37, 559 573, doi: 10.1016/0014 4835(83)90132 x.
103. Ryazantsev, S. N., Poliansky, N. B., Chebotareva, N. A., and
86.
Муранов К. О., Островский М. А. (2013) Молекулярная
Muranov, K. O. (2018) 3D structure of the native alpha
физиология хрусталика, Издательство «Торус Пресс»,
crystallin from bovine eye lens, Int. J. Biol. Macromol., 117,
Москва.
1289 1298, doi: 10.1016/j.ijbiomac.2018.06.004.
87.
Cui, X. L., and Lou, M. F. (1993) The effect and recovery
104. Horwitz, J., Bova, M. P., Ding, L. L., Haley, D. A., and
of long term H2O2 exposure on lens morphology and bio
Stewart, P. L. (1999) Lens alpha crystallin: function and
chemistry, Exp. Eye Res., 57, 157 167, doi: 10.1006/exer.
structure, Eye, 13, 403 408, doi: 10.1038/eye.1999.114.
1993.1111.
105. De Jong, W. W., Lubsen, N. H., and Kraft, H. J. (1994)
88.
Ganea, E., and Harding, J. J. (2006) Glutathione related
Molecular evolution of the eye lens, Prog. Retin. Eye Res.,
enzymes and the eye, Curr. Eye Res.,
31,
1 11,
12, 391 442, doi: 10.1016/1350 9462(94)90018 3.
doi: 10.1080/02713680500477347.
106. Ma, Z., Hanson, S. R., Lampi, K. J., David, L. L., Smith,
89.
Leske, M. C., Wu, S. Y., Hyman, L., Sperduto, R.,
D. L., et al. (1998) Age related changes in human lens
Underwood, B., et al. (1995) Biochemical factors in the
crystallins identified by HPLC and mass spectrometry, Exp.
lens opacities. Case control study. The Lens Opacities
Eye Res., 67, 21 30, doi: 10.1006/exer.1998.0482.
Case Control Study Group, Arch. Ophthalmol., 113, 1113
107. Caspers, G. J., Leunissen, J. A., and de Jong, W. W. (1995)
1119, doi: 10.1001/archopht.1995.01100090039020.
The expanding small heat shock protein family, and struc
90.
McCarty, C. A., and Taylor, H. R. (1996) Recent develop
ture predictions of the conserved
“alpha crystallin
ments in vision research: light damage in cataract, Invest.
domain”, J. Mol. Evol., 40, 238248, doi: 10.1007/
Ophthalmol. Vis. Sci., 37, 1720 1723.
BF00163229.
91.
McNeil, J. J., Robman, L., Tikellis, G., Sinclair, M. I.,
108. De Jong, W. W., Caspers, G. J., and Leunissen, J. A. (1998)
McCarty, C. A., et al. (2004) Vitamin E supplementation
Genealogy of the alpha crystallin small heat shock pro
and cataract: randomized controlled trial, Ophthalmology,
tein superfamily, Int. J. Biol. Macromol., 22, 151 162,
111, 75 84, doi: 10.1016/j.ophtha.2003.04.009.
doi: 10.1016/s0141 8130(98)00013 0.
92.
Wolf, N., Penn, P., Pendergrass, W., Van Remmen, H.,
109. Kundu, M., Sen, P. C., and Das, K. P. (2007) Structure,
Bartke, A., et al. (2005) Age related cataract progression in
stability, and chaperone function of alphaA crystallin: role
five mouse models for anti oxidant protection or hormon
of N terminal region, Biopolymers,
86,
177192,
al influence, Exp. Eye Res., 81, 276 285, doi: 10.1016/
doi: 10.1002/bip.20716.
j.exer.2005.01.024.
110. Thampi, P., and Abraham, E. C. (2003) Influence of the C
93.
Horwitz, J., Huang, Q. L., Ding, L., and Bova, M. P.
terminal residues on oligomerization of alphaA Crystallin,
(1998) Lens alpha crystallin: chaperone like properties,
Biochemistry, 42, 11857 11863, doi: 10.1021/bi030129w.
Methods Enzymol., 290, 365 383, doi: 10.1016/s0076
111.
Yang, C., Salerno, J. C., and Koretz, J. F. (2005) NH2 ter
6879(98)90032 5.
minal stabilization of small heat shock protein structure: a
94.
Horwitz, J. (2003) Alpha crystallin, Exp. Eye Res., 76,
comparison of two NH2 terminal deletion mutants of
145 153, doi: 10.1016/s0014 4835(02)00278 6.
alphaA crystallin, Mol. Vis., 11, 641 647.
95.
Shang, F., and Taylor, A. (2004) Function of the ubiquitin
112. Sreelakshmi, Y., and Sharma, K. K. (2006) The interaction
proteolytic pathway in the eye, Exp. Eye Res., 78, 1 14,
between alphaA and alphaB crystallin is sequence specif
doi: 10.1016/j.exer.2003.10.003.
ic, Mol. Vis., 12, 581 587.
96.
Zhang, X., Dudek, E. J., Liu, B., Ding, L., Fernandes,
113. Pasta, S. Y., Raman, B., Ramakrishna, T., and Rao, C.
A. F., et al. (2007) Degradation of C terminal truncated
(2004) The IXI/V motif in the C terminal extension of
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
191
alpha crystallins: Alternative interactions and oligomeric
of xylanase: enhancement of refolding by metal ions,
assemblies, Mol. Vis., 10, 655 662.
Protein Sci., 11, 2727 2734, doi: 10.1110/ps.0213802.
114. Vanhoudt, J., Abgar, S., Aerts, T., and Clauwaert, J. (2000)
131. Rachdan, D., Lou, M. F., and Harding, J. J. (2005)
A small angle X ray solution scattering study of bovine
Glutathione reductase from human cataract lenses can be
alpha crystallin, Eur. J. Biochem., 267, 3848 3858, doi:
revived by reducing agents and by a molecular chaperone,
10.1046/j.1432 1327.2000.01423.x.
alpha crystallin, Curr. Eye Res., 30, 919 925, doi: 10.1080/
115. Augusteyn, R. C., and Koretz, J. F. (1987) A possible struc
02713680590953110.
ture for alpha crystallin, FEBS Lett.,
222,
1 5,
132. Muranov, K. O., Poliansky, N. B., Chebotareva, N. A.,
doi: 10.1016/0014 5793(87)80180 1.
Kleimenov, S. Y., Bugrova, A. E., et al. (2019) The mecha
116. Groth Vasselli, B., Kumosinski, T. F., and Farnsworth,
nism of the interaction of alpha crystallin and UV dam
P. N. (1995) Computer generated model of the quaternary
aged betaL crystallin, Int. J. Biol. Macromol., 140, 736
structure of alpha crystallin in the lens, Exp. Eye Res., 61,
748, doi: 10.1016/j.ijbiomac.2019.08.178.
249 253, doi: 10.1016/s0014 4835(05)80044 2.
133. Kurganov, B. I. (2002) Kinetics of protein aggregation.
117. Wistow, G. (1993) Possible tetramer based quaternary
Quantitative estimation of the chaperone like activity in
structure for alpha crystallins and small heat shock pro
test systems based on suppression of protein aggregation,
teins, Exp. Eye Res., 56, 729 732, doi: 10.1006/exer.
Biochemistry (Moscow),
67,
409422, doi:
10.1023/
1993.1090.
a:1015277805345.
118. Walsh, M. T., Sen, A. C., and Chakrabarti, B. (1991) Micel
134. Kurganov, B. I. (2017) Quantification of anti aggregation
lar subunit assembly in a three layer model of oligomeric
activity of chaperones, Int. J. Biol. Macromol., 100, 104
alpha crystallin, J. Biol. Chem., 266, 20079 20084.
117, doi: 10.1016/j.ijbiomac.2016.07.066.
119. Haslbeck, M., Peschek, J., Buchner, J., and Weinkauf, S.
135. Markossian, K. A., Kurganov, B. I., Levitsky, D. I.,
(2016) Structure and function of alpha crystallins: travers
Khanova, H. A., Chebotareva, N. A., et al. (2006) in
ing from in vitro to in vivo, Biochim. Biophys. Acta, 1860,
Protein Folding: New Research (Obalinsky, T. R., ed.) Nova
149 166, doi: 10.1016/j.bbagen.2015.06.008.
Science Publishers, Inc., New York, USA, pp. 89 171.
120. Kenworthy, A. K., Magid, A. D., Oliver, T. N., and
136. Kurganov, B. I. (2013) Antiaggregation activity of chaper
McIntosh, T. J. (1994) Colloid osmotic pressure of steer
ones and its quantification, Biochemistry (Moscow), 78,
alpha and beta crystallins: Possible functional roles for
1554 1566, doi: 10.1134/S0006297913130129.
lens crystallin distribution and structural diversity, Exp. Eye
137. Kurganov, B. I. (2013) How to quantify the chaperone like
Res., 59, 11 30, doi: 10.1006/exer.1994.1077.
(anti aggregation) activity? Biochem. Anal. Biochem., 2,
121. Kramps, H. A., Stols, A. L., and Hoenders, H. J. (1975)
e136, doi: 10.4172/2161 1009.1000e136.
On the quaternary structure of high molecular weight pro
138. Kurganov, B. I.
(2013) Thermal denaturation and
teins from the bovine eye lens, Eur. J. Biochem., 50, 503
aggregation assays in analytical biochemistry, Biochem.
509, doi: 10.1111/j.1432 1033.1975.tb09889.x.
Anal. Biochem.,
2, e143, doi:
10.4172/2161 1009.
122. Harding, J. J., and Dilley, K. J. (1976) Structural proteins
1000e143.
of the mammalian lens: a review with emphasis on changes
139. Kurganov, B. I. (2014) Estimation of chaperone like activ
in development, aging and cataract, Exp. Eye Res., 22, 1
ity using test systems based on protein amyloid aggrega
73, doi: 10.1016/0014 4835(76)90033 6.
tion, Biochem. Anal. Biochem., 4, 160, doi: 10.4172/2161
123. Srivastava, O. P., Srivastava, K., and Silney, C. (1996)
1009.1000160.
Levels of crystallin fragments and identification of their
140. Borzova, V. A., Markossian, K. A., Kara, D. A.,
origin in water soluble high molecular weight (HMW) pro
Chebotareva, N. A., Makeeva, V. F., et al.
(2013)
teins of human lenses, Curr. Eye Res., 15, 511520,
Quantification of anti aggregation activity of chaperones: a
doi: 10.3109/02713689609000762.
test system based on dithiothreitol induced aggregation of
124. Krivandin, A. V., Muranov, K. O., Yakovlev, F. Y.,
bovine serum albumin, PLoS One, 8, e74367, doi: 10.1371/
Poliansky, N. B., Wasserman, L. A., et al.
(2009)
journal.pone.0074367.
Resistance of alpha crystallin quaternary structure to UV
141. Augusteyn, R. C. (2004) Dissociation is not required for
irradiation, Biochemistry (Moscow),
74,
633642,
alpha crystallin’s chaperone function, Exp. Eye Res., 79,
doi: 10.1134/s0006297909060078.
781 784, doi: 10.1016/j.exer.2004.08.010.
125. Padgaonkar, V. A., Leverenz, V. R., Fowler, K. E., Reddy,
142. Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
V. N., and Giblin, F. J. (2000) The effects of hyperbaric
Borzova, V. A., Yudin, I. K., et al. (2018) Mechanism of
oxygen on the crystallins of cultured rabbit lenses: a possi
aggregation of UV irradiated glycogen phosphorylase b at a
ble catalytic role for copper, Exp. Eye Res., 71, 371 383,
low temperature in the presence of crowders and trimethy
doi: 10.1006/exer.2000.0887.
lamine N oxide, Biophys. Chem., 232, 12 21, doi: 10.1016/
126. Carver, J. A., Nicholls, K. A., Aquilina, J. A., and Truscott,
j.bpc.2017.10.001.
R. J. (1996) Age related changes in bovine alpha crystallin
143. Chebotareva, N. A., Filippov, D. O., and Kurganov, B. I.
and high molecular weight protein, Exp. Eye Res., 63,
(2015) Effect of crowding on several stages of protein
639 647, doi: 10.1006/exer.1996.0158.
aggregation in test systems in the presence of α crystallin,
127. Takemoto, L., and Boyle, D. (1994) Molecular chaperone
Int. J. Biol. Macromol., 80, 358 365, doi: 10.1016/j.ijbiomac.
properties of the high molecular weight aggregate from
2015.07.002.
aged lens, Curr. Eye Res., 13, 3544, doi: 10.3109/
144. Roman, S. G., Chebotareva, N. A., Eronina, T. B.,
02713689409042396.
Kleymenov, S. Y., Makeeva, V. F., et al. (2011) Does the
128. Liang, J. J., and Akhtar, N. J. (2000) Human lens high
crowded cell like environment reduce the chaperone like
molecular weight alpha crystallin aggregates, Biochem.
activity of α crystallin? Biochemistry, 50, 10607 10623,
Biophys. Res. Commun., 275, 354 359, doi: 10.1006/bbrc.
doi: 10.1021/bi201030y.
2000.3306.
145. Kurganov, B. I., and Chebotareva, N. A. (2013) The func
129. Ganea, E., and Harding, J. J. (2000) Alpha crystallin
tioning of chaperones possessing the anti aggregation
assists the renaturation of glyceraldehyde 3 phosphate
activity in a crowded medium, Biochem. Anal. Biochem., 2,
dehydrogenase, Biochem. J., 345, 467 472.
e138, doi: 10.4172/2161 1009.1000e138.
130. Nath, D., Rawat, U., Anish, R., and Rao, M. (2002)
146. Derham, B. K., and Harding, J. J. (1997) Effect of aging on
Alpha crystallin and ATP facilitate the in vitro renaturation
the chaperone like function of human alpha crystallin
БИОХИМИЯ том 87 вып. 2 2022
192
МУРАНОВ, ОСТРОВСКИЙ
assessed by three methods, Biochem. J., 328, 763 768,
tion in the selenite cataract model, Exp. Eye Res., 62, 11
doi: 10.1042/bj3280763.
19, doi: 10.1006/exer.1996.0002.
147. Derham, B. K., and Harding, J. J. (1997) The effects of
162. Hiraoka, T., and Clark, J. I. (1995) Inhibition of lens
ageing on the chaperone like function of rabbit alpha crys
opacification during the early stages of cataract formation.,
tallin, comparing three methods of assay, Biochim. Biophys.
Invest. Ophthalmol. Vis. Sci., 36, 2550 2555.
Acta, 1336, 187 194, doi: 10.1016/s0304 4165(97)00029 9.
163. Santhoshkumar, P., and Sharma, K. K.
(2002)
148. Fujii, N., Takata, T., Kim, I., Morishima, K., Inoue, R.,
Identification of a region in alcohol dehydrogenase that
et al. (2020) Asp isomerization increases aggregation of
binds to alpha crystallin during chaperone action, Biochim.
alpha crystallin and decreases its chaperone activity in
Biophys. Acta,
1598,
115121, doi:
10.1016/s0167
human lens of various ages, Biochim. Biophys. Acta Proteins
4838(02)00356 4.
Proteom., 1868, 140446, doi: 10.1016/j.bbapap.2020.
164. Sharma, K. K., Kumar, R. S., Kumar, G. S., and Quinn,
140446.
P. T. (2000) Synthesis and characterization of a peptide iden
149. Huang, F. Y., Ho, Y., Shaw, T. S., and Chuang, S. A. (2000)
tified as a functional element in alphaA crystallin, J. Biol.
Functional and structural studies of alpha crystallin from
Chem., 275, 3767 3771, doi: 10.1074/jbc.275.6.3767.
galactosemic rat lenses, Biochem. Biophys. Res. Commun.,
165. Sreelakshmi, Y., and Sharma, K. K. (2001) Interaction of
273, 197 202, doi: 10.1006/bbrc.2000.2924.
alpha lactalbumin with mini alphaA crystallin, J. Protein
150. Kumar, P. A., Suryanarayana, P., Reddy, P. Y., and Reddy,
Chem., 20, 123 130, doi: 10.1023/a:1011077307262.
G. B. (2005) Modulation of alpha crystallin chaperone
166. Srinivas, V., Raman, B., Rao, K. S., Ramakrishna, T., and
activity in diabetic rat lens by curcumin, Mol. Vis., 11, 561
Rao, C. (2005) Arginine hydrochloride enhances the
568.
dynamics of subunit assembly and the chaperone like
151. Inomata, M., Nomura, K., Takehana, M., Saido, T. C.,
activity of alpha crystallin, Mol. Vis., 11, 249 255.
Kawashima, S., et al. (1997) Evidence for the involvement
167. Viner, R. I., and Clegg, J. S. (2001) Influence of tre
of calpain in cataractogenesis in Shumiya cataract rat
halose on the molecular chaperone activity of p26,
(SCR), Biochim. Biophys. Acta,
1362,
1123,
a small heat shock/alpha crystallin protein, Cell
doi: 10.1016/s0925 4439(97)00050 1.
Stress. Chaperones, 6, 126 135, doi: 10.1379/1466
152. Nandi, S. K., Nahomi, R. B., Rankenberg, J., Glomb,
1268(2001)006<0126:iototm>2.0. co;2.
M. A., and Nagaraj, R. H. (2020) Glycation mediated
168. Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
inter protein cross linking is promoted by chaperone
Shubin, V. V., Kleymenov, S. Y., et al. (2020) Effect of argi
client complexes of α crystallin: Implications for lens
nine on stability and aggregation of muscle glycogen phos
aging and presbyopia, J. Biol. Chem., 295, 5701 5716,
phorylase b, Int. J. Biol. Macromol., 165, 365374,
doi: 10.1074/jbc.RA120.012604.
doi: 10.1016/j.ijbiomac.2020.09.101.
153. Brennan, L. A., Lee, W., Giblin, F. J., David, L. L., and
169. Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
Kantorow, M. (2009) Methionine sulfoxide reductase A
Shubin, V. V., Sluchanko, N. N., et al. (2019) Comparative
(MsrA) restores alpha crystallin chaperone activity lost
effects of trehalose and 2 hydroxypropyl OІ cyclodextrin
upon methionine oxidation, Biochim. Biophys. Acta, 1790,
on aggregation of UV irradiated muscle glycogen phos
1665 1672, doi: 10.1016/j.bbagen.2009.08.011.
phorylase b, Biochimie, 165, 196205, doi: 10.1016/
154. Moschini, R., Marini, I., Malerba, M., Cappiello, M.,
j.biochi.2019.08.006.
Del, C. A., et al. (2006) Chaperone like activity of alpha
170. Muranov, K. O., Dizhevskaya, A. K., Poliansky, N. B.,
crystallin toward aldose reductase oxidatively stressed by
Dodonova, S. O., and Ostrovsky, M. A. (2010) Short chain
copper ion, Arch. Biochem. Biophys.,
453,
1317,
peptides as a promising class of chaperone like anticataract
doi: 10.1016/j.abb.2006.03.008.
agents: Molecular mechanism of inhibition of crystallin
155. Van Boekel, M. A., Hoogakker, S. E., Harding, J. J., and de
aggregation by pantethine, Rus. Chem. Bull., 59, 225 231,
Jong, W. W. (1996) The influence of some post translation
doi: 10.1007/s11172 010 0066 7.
al modifications on the chaperone like activity of alpha
171. Dizhevskaya, A. K., Muranov, K. O., Boldyrev, A. A., and
crystallin, Ophthalmic Res.,
28 Suppl
1,
3238,
Ostrovsky, M. A. (2012) Natural dipeptides as mini chap
doi: 10.1159/000267940.
erones: Molecular mechanism of inhibition of lens betaL
156. Sharma, K. K., and Ortwerth, B. J. (1995) Effect of cross
crystallin aggregation, Curr. Aging Sci., 5, 236241,
linking on the chaperone like function of alpha crystallin,
doi: 10.2174/1874609811205030011.
Exp. Eye Res.,
61,
413421, doi:
10.1016/s0014
172. Avetisov, S. E., Polunin, G. S., Sheremet, N. L., Makarov,
4835(05)80136 8.
I. A., Fedorov, A. A., et al. (2008) Chaperon like anti
157. Borzova, V. A., Markossian, K. A., Muranov, K. O.,
cataract agents, the antiaggregants of lens crystallin.
Polyansky, N. B., Kleymenov, S. Y., et al.
(2015)
Communication 4. Study of the effect of a mixture of di
Quantification of anti aggregation activity of UV irradiat
and tetrapeptides on a prolonged rat model of UV induced
ed alpha crystallin, Int. J. Biol. Macromol., 73, 84 91,
cataract, Vestn. Oftalmol., 124, 12 16.
doi: 10.1016/j.ijbiomac.2014.10.060.
173. Avetisov, S. E., Polunin, G. S., Sheremet, N. L., Muranov,
158. Schmid, P. W. N., Lim, N. C. H., Peters, C., Back, K. C.,
K. O., Makarov, I. A., et al. (2008) Search for chaperon
Bourgeois, B., et al. (2021) Imbalances in the eye lens pro
like anticataract agents, the antiaggregants of lens crys
teome are linked to cataract formation, Nat. Struct. Mol.
tallin. Communication 3. Possibilities of a follow up of
Biol., 28, 143 151, doi: 10.1038/s41594 020 00543 9.
caractogenesis processes on a prolonged rat model of UV
159. Clark, J. I., and Huang, Q. L. (1996) Modulation of the
induced cataract, Vestn. Oftalmol., 124, 8 12.
chaperone like activity of bovine alpha crystallin, Proc.
174. Muranov, K. O., Dizhevskaia, A. K., Boldyrev, A. A.,
Natl. Acad. Sci. USA, 93, 15185 15189, doi: 10.1073/pnas.
Karpova, O. E., Sheremet, N. L., et al. (2008) Search for
93.26.15185.
chaperon like anticataract drugs, the antiaggregants of lens
160. Clark, J. I., Livesey, J. C., and Steele, J. E. (1996) Delay or
crystallins. Communication. 1. Chaperon like activity of
inhibition of rat lens opacification using pantethine and
N acetyl carnosine dipeptide: in vitro study on a model of
WR 77913, Exp. Eye Res., 62, 75 84, doi: 10.1006/exer.
ultraviolet induced aggregation of betaL crystallin, Vestn.
1996.0009.
Oftalmol., 124, 3 6.
161. Hiraoka, T., Clark, J. I., LI, X. Y., and Thurston, G. M.
175. Soustov, L. V., Chelnokov, E. V., Sapogova, N. V., Bitiurin,
(1996) Effect of selected anti cataract agents on opacifica
N. M., Nemov, V. V., et al. (2008) Like anticataract agents,
БИОХИМИЯ том 87 вып. 2 2022
БИОХИМИЯ ХРУСТАЛИКА ГЛАЗА: НОРМА И КАТАРАКТОГЕНЕЗ
193
the antiaggregants of lens crystallin. Communication 2.
185. Ciuffi, M., Neri, S., Franchi Micheli, S., Failli, P.,
Study of the impact of chaperon like (protective) activity
Zilletti, L., et al. (1999) Protective effect of pirenoxine and
of short chain peptides on the rate of UV induced aggre
U74389F on induced lipid peroxidation in mammalian
gation of betaL crystallins by eximer laser, Vestn. Oftalmol.,
lenses. An in vitro, ex vivo and in vivo study, Exp. Eye Res.,
124, 6 8.
68, 347 359, doi: 10.1006/exer.1998.0612.
176. Makley, L. N., McMenimen, K. A., DeVree, B. T.,
186. Age Related Eye Disease Study Research Group (2001)
Goldman, J. W., McGlasson, B. N., et al.
(2015)
A randomized, placebo controlled, clinical trial of high
Pharmacological chaperone for alpha crystallin partially
dose supplementation with vitamins C and E and beta
restores transparency in cataract models, Science, 350,
carotene for age related cataract and vision loss: AREDS
674 677, doi: 10.1126/science.aac9145.
report no.
9, Arch. Ophthalmol.,
119,
14391452,
177. Zhao, L., Chen, X. J., Zhu, J., Xi, Y. B., Yang, X., et al.
doi: 10.1001/archopht.119.10.1439.
(2015) Lanosterol reverses protein aggregation in cataracts,
187. Sekimoto, M., Imanaka, Y., Kitano, N., Ishizaki, T., and
Nature, 523, 607 611, doi: 10.1038/nature14650.
Takahashi, O. (2006) Why are physicians not persuaded
178. Hejtmancik, J. F. (2015) Ophthalmology: cataracts dis
by scientific evidence? A grounded theory interview study,
solved, Nature, 523, 540 541, doi: 10.1038/nature14629.
BMC. Health Serv. Res., 6, 1 9, doi: 10.1186/1472 6963
179. Quinlan, R. A. (2015) Drug discovery. A new dawn for
6 92.
cataracts, Science, 350, 636 637, doi: 10.1126/science.
188. Datiles, M. B., III, Ansari, R. R., Suh, K. I., Vitale, S.,
aad6303.
Reed, G. F., et al. (2008) Clinical detection of precatarac
180. Daszynski, D. M., Santhoshkumar, P., Phadte, A. S.,
tous lens protein changes using dynamic light scattering,
Sharma, K. K., Zhong, H. A., et al. (2019) Failure of oxys
Arch. Ophthalmol.,
126,
16871693, doi:
10.1001/
terols such as lanosterol to restore lens clarity from
archophthalmol.2008.507.
cataracts, Sci. Rep., 9, 8459, doi: 10.1038/s41598 019
189. Ansari, R. R. (2004) Ocular static and dynamic light scat
44676 4.
tering: a noninvasive diagnostic tool for eye research and
181. Huang, C., Li, C., and Muhemaitia, P. (2019) Impediment
clinical practice, J. Biomed. Opt., 9, 22 37, doi: 10.1117/
of selenite induced cataract in rats by combinatorial drug
1.1626663.
laden liposomal preparation, Libyan. J. Med., 14, 1548252,
190. Datiles, M. B., III, Ansari, R. R., and Reed, G. F. (2002)
doi: 10.1080/19932820.2018.1548252.
A clinical study of the human lens with a dynamic light
182. Nagai, N., Fukuoka, Y., Sato, K., Otake, H., Taga, A.,
scattering device, Exp. Eye Res., 74, 93 102, doi: 10.1006/
et al. (2020) The intravitreal injection of lanosterol
exer.2001.1106.
nanoparticles rescues lens structure collapse at an early
191. Ansari, R. R., Suh, K. I., Dunker, S., Kitaya, N., and
stage in Shumiya cataract rats, Int. J. Mol. Sci., 21, 1048,
Sebag, J. (2001) Quantitative molecular characterization of
doi: 10.3390/ijms21031048.
bovine vitreous and lens with non invasive dynamic light
183. Shen, X., Zhu, M., Kang, L., Tu, Y., Li, L., et al. (2018)
scattering, Exp. Eye Res., 73, 859 866, doi: 10.1006/
Lanosterol synthase pathway alleviates lens opacity in age
exer.2001.1097.
related cortical cataract, J. Ophthalmol., 2018, 4125893,
192. Datiles, M. B., III, Ansari, R. R., Yoshida, J., Brown, H.,
doi: 10.1155/2018/4125893.
Zambrano, A. I., et al. (2016) Longitudinal study of age
184. Gupta, S. K., Selvan, V. K., Agrawal, S. S., and Saxena, R.
related cataract using dynamic light scattering: Loss of
(2009) Advances in pharmacological strategies for the pre
alpha crystallin leads to nuclear cataract development,
vention of cataract development, Indian J. Ophthalmol., 57,
Ophthalmology, 123, 248254, doi: 10.1016/j.ophtha.
175 183, doi: 10.4103/0301 4738.49390.
2015.10.007.
BIOCHEMISTRY OF LENS: NORM AND CATARACTOGENESIS
Review
K. O. Muranov* and M. A. Ostrovsky
Emanuel Institute of Biochemical Physics of the Russian Academy of Sciences,
119334 Moscow, Russia; E-mail k.muranov@sky.chph.ras.ru
The absence of cellular organelles in fiber cells, very high protein concentration (up to 900 mg/ml) in the cytoplasm
minimize light scattering in the lens and ensure its transparency. Low oxygen concentration, powerful defense systems
(antioxidants, antioxidant enzymes, chaperone like protein alpha crystallin, etc.) maintain the lens transparency. In
contrast, the ability of crystallins to accumulate post translational modifications with age, which reduces the resis
tance of proteins to oxidative stress, is an important factor contributing to the cataract’s formation. Authors suggest a
single mechanism of cataractogenesis. The cataractogenic factors like age, radiation, ultraviolet, diabetic, etc. cause
damage and death of the lens epithelium. As a result, oxygen penetrates the lens through the formed defects of the
epithelial layer that causes oxidative damage to the crystallins. In consequence of the damage the proteins denature,
aggregate and form the so called multilamellar bodies, which are the main cause of lens opacity. The review discuss
es various approaches to inhibiting of opacity (cataracts) development, in particular the use of a combination of
antioxidants and compounds that enhance the chaperone like properties of alpha crystallin. The paradox of anti
cataract drugs high efficiency in laboratory but useless in clinic is discussed. We think that the paradox is associated
with the too late use of the drug, when the opacity has already formed. The way we can get out of this situation is to
develop new diagnostic methods that would make it possible to predict the occurrence of cataracts long before the
manifestation of clinical signs of the disease and stimulate early preventive treatment.
Keywords: lens, cataract, pathogenesis, crystallins, small heat shock proteins, anti cataract drugs
БИОХИМИЯ том 87 вып. 2 2022