БИОХИМИЯ, 2022, том 87, вып. 2, с. 194 - 204
УДК 577.29
ВЛИЯНИЕ ТРЕГАЛОЗЫ НА ОЛИГОМЕРНОЕ СОСТОЯНИЕ И
АНТИАГРЕГАЦИОННУЮ АКТИВНОСТЬ αB КРИСТАЛЛИНА
© 2022
Н.А. Чеботарева*, Т.Б. Еронина, В.В. Михайлова,
С.Г. Роман, К.В. Тугаева, Б.И. Курганов
Институт биохимии имени А.Н. Баха, ФГУ ФИЦ «Фундаментальные основы биотехнологии» РАН,
119071 Москва, Россия; электронная почта: n.a.chebotareva@gmail.com
Поступила в редакцию 20.09.2021
После доработки 21.10.2021
Принята к публикации 22.10.2021
αB Кристаллин (αB Cr), один из главных белков хрусталика глаза, вместе с другими кристаллинами под
держивает прозрачность хрусталика, предотвращая агрегацию белков и, таким образом, защищая глаз от ка
таракты. αB Cr относится к классу молекулярных шаперонов, он широко экспрессируется во многих тка
нях и имеет динамичную четвертичную структуру, которая необходима для проявления шапероноподобной
активности. Сдвиг в равновесии ансамблей олигомеров αB Cr с различным числом субъединиц позволяет
регулировать активность шаперона. Известно, что трегалоза ингибирует агрегацию белков in vivo и in vitro и
широко используется в биотехнологии. Результаты изучения влияния трегалозы на шапероноподобную ак
тивность кристаллинов могут послужить основой для создания препаратов, способствующих замедлению
катарактогенеза. В настоящей работе мы исследовали влияние трегалозы на четвертичную структуру и ан
тиагрегационную активность αB Cr с использованием мышечной гликогенфосфорилазы b (ФБ) в качестве
модельного белка мишени. По данным динамического светорассеяния, трегалоза влияет на процесс тепло
вой агрегации ФБ при 48 °С преимущественно на стадии нуклеации, причем в присутствии белкового ша
перона основной эффект трегалозы связан с увеличением адсорбционной емкости (AC0) αB Cr (для 66 мМ
трегалозы увеличение AC0 является 1,5 кратным). По данным седиментационного анализа, трегалоза ста
билизирует димерную форму ФБ на стадии диссоциации и денатурации ФБ и усиливает взаимодействие
αB Cr с белком мишенью. Кроме того, трегалоза сдвигает равновесие между олигомерными формами
αB Cr в сторону образования малых олигомерных форм. Таким образом, трегалоза оказывает влияние на
четвертичную структуру αB Cr и увеличивает его антиагрегационную активность на стадии нуклеации про
цесса агрегации белка мишени.
КЛЮЧЕВЫЕ СЛОВА: αB кристаллин, антиагрегационная активность, трегалоза, гликогенфосфорилаза b,
динамическое светорассеяние, аналитическое ультрацентрифугирование.
DOI: 10.31857/S032097252202004X
ВВЕДЕНИЕ
Кристаллины, α , β , γ , составляют более
90% растворимых белков, входящих в состав
Денатурация и агрегация белков, входящих в
хрусталика глаза [2, 3], и обеспечивают его проз
состав хрусталика, приводит к образованию круп
рачность. Концентрация белков в хрусталике
ных светорассеивающих агрегатов и потере проз
глаза очень высокая, у человека она достигает
рачности хрусталика - катаракте [1]. Катаракто
450 мг/мл [4]. В течение жизни белки хрустали
генез очень часто обусловлен естественными воз
ка не обновляются, поэтому в процессе старе
растными изменениями. Единственным эффек
ния в них накапливаются посттрансляционные
тивным методом лечения катаракты в настоящее
изменения, которые могут приводить к их дена
время является замена помутневшего хрусталика
турации и агрегации. Зависимое от возраста
на искусственную линзу, поэтому понимание ме
снижение растворимости кристаллинов и их аг
ханизмов катарактогенеза и поиск веществ, спо
регация являются патологическими признаками
собных замедлить этот процесс, является актуаль
катаракты.
ной и социально значимой проблемой.
α Кристаллин, гетероолигомер, состоящий
из αA и αB кристаллинов, принадлежит к
классу молекулярных шаперонов и является од
Принятые сокращения: ДЛС- динамическое лазер
ним из главных белков хрусталика, обладающих
ное светорассеяние; ФБ
- гликогенфосфорилаза b;
AUC
- аналитическое ультрацентрифугирование;
шапероноподобной функцией. α Кристаллин
SV - скоростная седиментация; αB Cr - αB кристаллин.
связывается с поврежденными белками и под
* Адресат для корреспонденции.
держивает их растворимость, препятствуя агре
194
ВЛИЯНИЕ ТРЕГАЛОЗЫ НА αB КРИСТАЛЛИН
195
гации [5-9], в том числе предотвращает нежела
молекул для стабилизации нативного состояния
тельную агрегацию кристаллинов и развитие ка
кристаллинов [29]. Было обнаружено, что при
таракты [10].
сутствие амилоидоподобных структур в белко
αB Кристаллин (αB Cr) широко экспресси
вых агрегатах хрусталика, индуцированных на
руется во многих тканях и имеет динамичную
греванием, значительно снижается в присут
четвертичную структуру, которая позволяет ему
ствии трегалозы [30]. Трегалоза является при
образовывать in vitro полидисперсные ансамбли
родным осмолитом и стабилизирует белки при
обменивающихся субъединицами олигомеров,
всевозможных стрессах (тепловом, осмотичес
обладающих шапероноподобной актив
ком, высыхании и др.); поэтому ее называют хи
ностью [11]. Подвижное равновесие между раз
мическим шапероном [31, 32].
ными олигомерными формами αB Cr очень
Авторы работы [30] показали, что трегалоза
чувствительно к факторам внешней среды: тем
значительно уменьшает агрегацию растворимых
пературе, присутствию ионов, условиям крау
белков хрусталика, вызванную нагреванием в
динга и др. [12-18]. В современных моделях ша
течение 4 ч при 55 °С. При высоких концентра
пероноподобной активности αB Cr сдвиг рав
циях трегалозы (30% w/v) количество нераство
новесия в ансамбле олигомеров позволяет регу
римых агрегатов уменьшается вдвое, однако
лировать активность шаперона, в результате че
полного подавления процесса агрегации в при
го олигомеры малого размера (мономер и ди
сутствии трегалозы не происходит. Известно,
мер) обычно являются более активными форма
что трегалоза вызывает преимущественную гид
ми [5, 11, 14]. Существует предположение, что
ратацию поверхности белка, тем самым препят
симметричные олигомерные комплексы высше
ствуя его разворачиванию и агрегации [30]. Та
го порядка могут использоваться для хранения,
кое свойство трегалозы может быть полезно для
тогда как формы, способные к связыванию раз
отсрочки возникновения катаракты. Показано,
вернутых белков, представляют собой либо бо
что трегалозу можно использовать в глазных
лее мелкие комплексы (возможно, димеры), ли
каплях для защиты эпителия роговицы от сухос
бо неполные сферы, дающие место для связыва
ти, вызванной синдромом сухого глаза [33]. В
ния белков клиентов [5, 11]. Однако остается
биотехнологии и фармацевтике трегалоза широ
много неясного в вопросе о том, как функцио
ко используется благодаря своей нетоксичности
нирует αB Cr в хрусталике в условиях краудин
и высокой растворимости в воде.
га, и какую роль играют разные олигомерные
Для выяснения молекулярных механизмов
формы αB Cr. Кроме того, известно, что струк
катарактогенеза необходимо понимать, как ос
турные изменения, мутации и дисфункция са
молиты, такие как трегалоза, влияют на шапе
мого αB Cr также связаны с некоторыми вида
ронную активность кристаллинов. Было обна
ми катаракты [9, 10, 19-24].
ружено, что трегалоза стабилизирует нативную
Считается, что образование аморфных агре
структуру α кристаллина, ингибирует его агре
гатов - это быстрый путь формирования ката
гацию и дезагрегирует ранее сформированные
ракты, а образование амилоидных фибрилл свя
низкомолекулярные агрегаты, но не влияет на
зывается с медленным развитием катаракты
его шапероноподобную активность [34].
[10]. αB Cr ингибирует оба типа агрегации [25].
В настоящей работе мы исследовали влия
Однако механизмы действия αB Cr in vitro при
ние трегалозы на шапероноподобную актив
образовании аморфных агрегатов или амилоид
ность αB Cr. Для этой цели была выбрана тест
ных фибрилл проявляют существенные разли
система, основанная на тепловой агрегации мы
чия [26]. Агрегация самого αB Cr также может
шечной гликогенфосфорилазы b (ФБ) при 48 °С.
приводить к образованию как аморфных агрега
Эта тест система была охарактеризована нами
тов, так и амилоидоподобных структур. В усло
ранее, и для нее было показано, что скорость
виях краудинга происходит изменение конфор
лимитирующей стадией процесса агрегации на
мации, олигомерного состояния и увеличение
этапе роста агрегатов является диссоциация ди
размера αB Cr [10, 16], уменьшение его тепло
мера ФБ на мономеры [27, 35].
вой стабильности и антиагрегационной актив
ности [10, 27], при этом αB Cr способен образо
вывать кинетически различные аморфные и
МАТЕРИАЛЫ И МЕТОДЫ
фибриллярные агрегаты [10]. Интересно отме
тить, что α кристаллин сохраняет шаперонную
Выделение ФБ. ФБ выделяли из скелетных
активность и при образовании амилоидных
мышц кролика, как описано ранее [36], и храни
фибрилл [28].
ли в
0,04
М β глицерофосфатном буфере,
Одним из вариантов терапевтического лече
pH 6,8, содержащем 0,03 М β меркаптоэтанол и
ния катаракты является использование малых
50% ный раствор глицерина, при -20 °С. Перед
БИОХИМИЯ том 87 вып. 2 2022
196
ЧЕБОТАРЕВА и др.
экспериментом раствор ФБ был пропущен че
процесса агрегации на стадии нуклеации. На
рез колонку с Сефадексом (Sephadex G 15),
этой стадии значение AC0 может быть определе
уравновешенную с 0,03 М HEPES, pH 6,8, со
но как величина, обратная длине отрезка, отсе
держащим 0,1 М NaCl. Концентрацию фермен
каемого на оси абсцисс начальным линейным
та определяли спектрофотометрически при
участком зависимости Kagg/Kagg,0 от отношения
280 нм с использованием коэффициента погло
молярных концентраций [αB Cr]/[ФБ], где Kagg
щения A1%см 13,2 [37].
и Kagg,0 - значения параметров, полученные в
Выделение αB Cr (HspB5). Кодирующая
присутствии и в отсутствие шаперона соответ
последовательность HspB5 человека была кло
ственно.
нирована в векторе pET23 для экспрессии в
Начальный участок процесса агрегации на
клетках E. coli как описано в работе [38]. Сверх
стадии роста белковых агрегатов описывается
экспрессированный HspB5 очищали с помощью
уравнением [43]:
высаливания сульфатом аммония с последую
щей гель фильтрацией. Наиболее чистые фрак
I - I0 = v0(t - t*) - B(t - t*)2, (t > t*),
(2)
ции по электрофорезу в присутствии додецил
сульфата натрия объединяли, концентрировали,
где v0 - начальная скорость процесса агрегации
разделяли на аликвоты и хранили при -80 °С.
на стадии роста агрегатов, t* - длительность ста
Динамическое лазерное светорассеяние
дии нуклеации, определяемая отрезком на оси
(ДЛС). При исследовании кинетики агрегации
абсцисс, отсекаемым теоретической кривой,
белков рассеивающийся под углом 90° свет
рассчитанной из этого уравнения при I - I0 = 0,
He Ne лазера («Coherent», США, Model 31 2082,
и B - константа. На стадии роста белковых агре
632,8 нм, 10 мВ) анализировали с использовани
гатов для определения AC0 может быть исполь
ем коммерческого прибора Photocor Complex
зовано предложенное ранее уравнение [41]:
(«Photocor Instruments, Inc.», США). Полидис
персный анализ данных ДЛС проводили с по
v0 = v0(0)(1 - AC0x),
(3)
мощью программы DYNALS («Alango», Изра
иль). Кинетику агрегации ФБ при 48 °C изучали
где x - отношение молярной концентрации
в 0,03 М HEPES, pH 6,8, содержащем 0,15 М
αB Cr, рассчитанной на субъединицу белка с
NaCl и 0,5 мМ дитиотреитол (ДТТ), в цилинд
молекулярной массой 20 кДа, к молярной кон
рической кювете с внутренним диаметром
центрации ФБ, рассчитанной на мономер с мо
6,3 мм. Процесс агрегации ФБ запускали добав
лекулярной массой 97,4 кДа (x = [αB Cr]/[ФБ]),
лением белка до концентрации 0,3 мг/мл в пред
и v0(0) - значение v0 при x = 0. AC0 определяется
варительно прогретую в течение 5 мин при 48 °C
как величина, обратная величине отрезка, отсе
кювету, содержащую буфер. Для изучения эф
каемого на оси абсцисс начальным линейным
фектов трегалозы, αB Cr и их смесей эти веще
участком зависимости v0/v0(0) от отношения
ства также инкубировали в кювете в течение
[αB Cr]/[ФБ].
5 мин при 48 °C перед началом эксперимента.
Отметим, что адсорбционная емкость αB Cr,
Определение адсорбционной емкости шаперо
рассчитанная из начального участка зависимос
на на разных стадиях агрегации белка мишени.
ти Kagg/Kagg,0 от отношения [αB Cr]/[ФБ] или за
Антиагрегационная активность белкового ша
висимости v0/v0(0) от отношения [αB Cr]/[ФБ],
перона αB Cr может быть охарактеризована ве
характеризует максимальную адсорбционную
личиной его начальной адсорбционной емкости
емкость αB Cr, которая реализуется при избыт
(AC0) [39-41], которая показывает, сколько мо
ке белка мишени.
лекул белка мишени связывается одной моле
Определение антиагрегационной активности
кулой шаперона.
химического шаперона на разных стадиях агрега
Стадия нуклеации описывается уравнени
ции белка мишени. В случае химических шапе
ем [39, 40, 42]:
ронов, которые обратимо связываются с бел
ком мишенью, антиагрегационная активность
I - I0 = Kagg(t - t0)2, (t > t0),
(1)
шаперона может быть охарактеризована его
концентрацией полунасыщения [L]0.5, которая
где I - интенсивность светорассеяния, t - вре
рассчитывается по формулам, аналогичным
мя, I0 - начальное значение интенсивности све
уравнению Хилла [44]. На стадии нуклеации ис
торассеяния при t = 0, t0 - момент времени, в
пользована формула:
который регистрируется начальное приращение
интенсивности светорассеяния, т.е. лаг период
Kagg/Kagg,0 = 1/{1 + ([L]/[L]0.5)h},
(4)
на кинетических кривых агрегации ФБ, и
Kagg - параметр, характеризующий ускорение
а на стадии роста агрегатов - формула:
БИОХИМИЯ том 87 вып. 2 2022
ВЛИЯНИЕ ТРЕГАЛОЗЫ НА αB КРИСТАЛЛИН
197
v0/v0(0) = 1/{1 + ([L]/[L]0.5)h},
(5)
1,0536 г/см3 для растворов 350 мМ трегалозы при
48 °С и 20 °C соответственно. Динамическую
где [L] - молярная концентрация химического
вязкость растворов определяли на автоматичес
шаперона, [L]0.5 - значение [L], при котором
ком микровискозиметре AMVn («Anton Paar») в
Kagg/Kagg,0 = 0,5 или v0/v0(0) = 0,5, и h - коэффи
капиллярной системе 1,6/1,5 мм. Динамическая
циент Хилла.
вязкость растворов 350 мМ трегалозы равна
Аналитическое ультрацентрифугирование
0,8156 и 1,5218 (мПа⋅с) при 48 °С и 20 °C соответ
(AUC). Эксперименты по скоростной седимен
ственно.
тации (SV) проводили в аналитической ультра
Анализ данных. Для вычислений использова
центрифуге, модель E («Beckman», США), осна
ли программу Origin Pro 2017 («Origin Lab Corp.»,
щенной абсорбционной оптикой, фотоэлектри
США). Для характеристики степени соответствия
ческим сканером, монохроматором и компью
между экспериментальными данными и расчет
тером в режиме онлайн. В опытах использовали
ными значениями мы использовали коэффици
титановый ротор An F Ti и двухсекторные ячей
ент детерминации R2 как описано в работе [27].
ки. Седиментационные профили регистрирова
ли путем измерения оптической плотности при
280 нм. Все ячейки сканировали одновременно
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
c интервалом в 2,5 мин. Дифференциальные
распределения по коэффициентам седимента
Влияние трегалозы на агрегацию ФБ в присут
ции [c(s) в зависимости от коэффициента седи
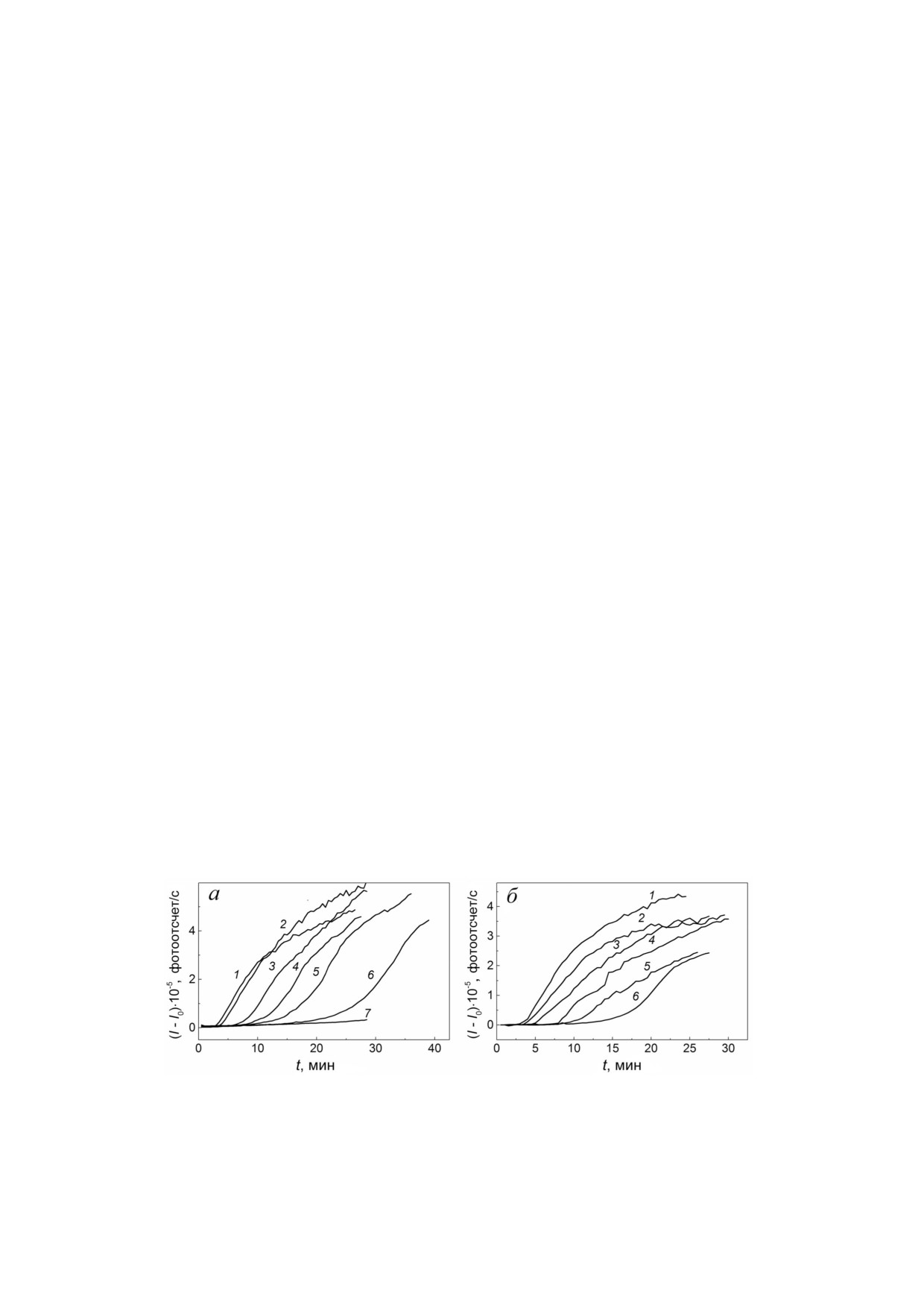
ствии αB Cr. На рис. 1 изображены кинетичес
ментации s] были определены и приведены к
кие кривые агрегации ФБ, регистрируемые ме
стандартным условиям (растворитель с плот
тодом ДЛС при 48 °С в присутствии различных
ностью и вязкостью воды при 20 °C) с помощью
концентраций αB Cr в отсутствие (рис. 1, а) и в
программы SEDFIT [45].
присутствии 66 мМ трегалозы (рис. 1, б).
SV опыты выполняли в 0,03 М HEPES бу
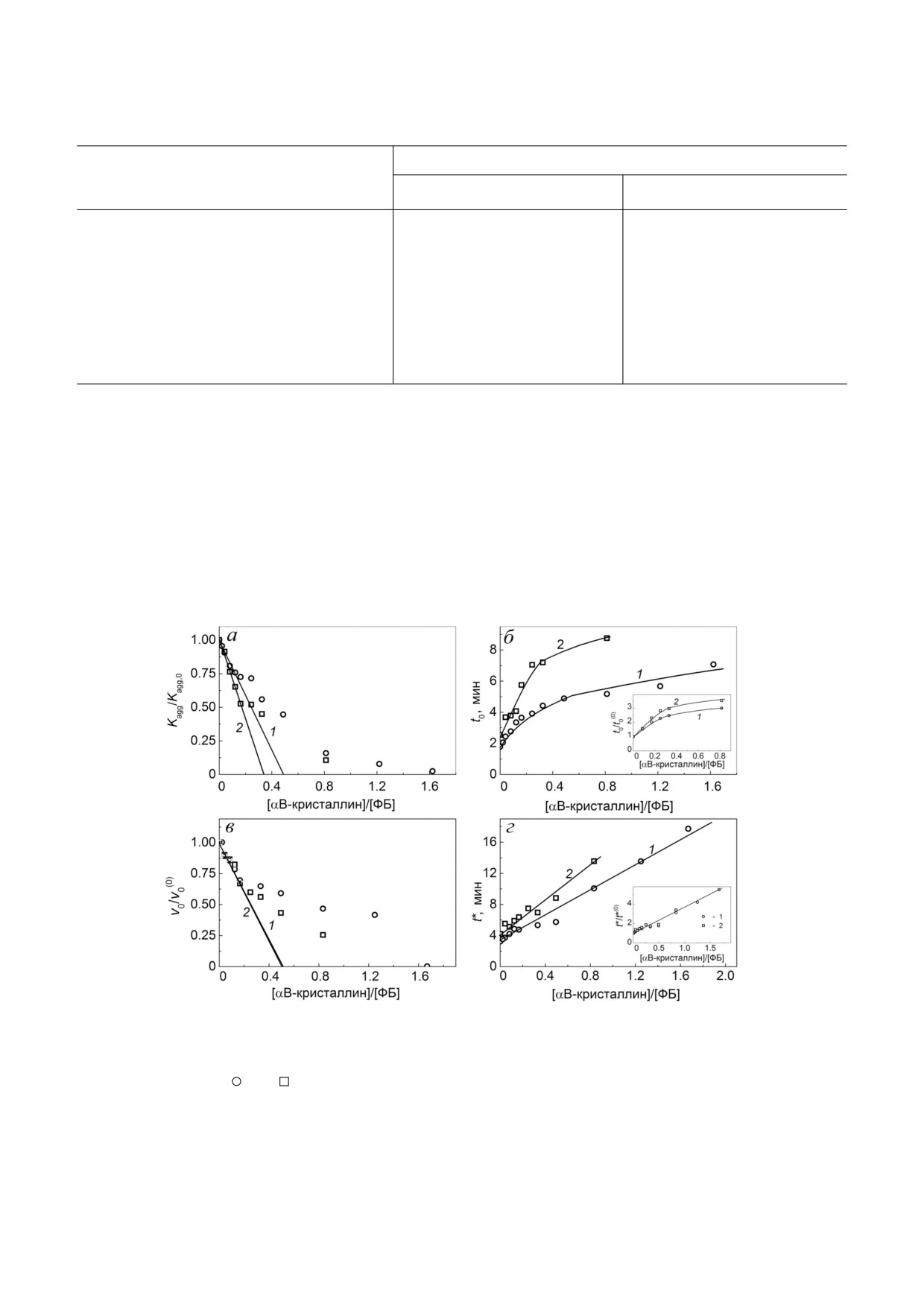
Используя уравнение (1), можно оценить ос
фере, pH 6,8, содержащем 0,15 М NaCl. Все об
новные параметры стадии нуклеации t0 и Kagg.
разцы, если не указано иначе, предварительно
Чтобы оценить на этой стадии значения AC0 для
инкубировали в термостате в течение 3 ч при
αB Cr по отношению к ФБ в отсутствие (кривая 1
48 °С, затем охлаждали 2 мин в воде со льдом,
на рис. 2, а) и в присутствии 66 мМ трегалозы
вносили в ячейки и проводили опыт при 20 °С.
(кривая 2 на рис. 2, а), были построены графики
Часть опытов SV проведена при 48 °С. Перед
зависимости Kagg/Kagg,0 от [αB Cr]/[ФБ]. Показа
этими опытами ротор предварительно выдержи
но, что на стадии нуклеации трегалоза в концен
вали в термостате при 48 °С в течение ночи.
трации 66 мМ в 1,5 раза увеличивает адсорбци
Значения плотности и динамической вязкос
онную емкость αB Cr (табл. 1).
ти растворов 350 мМ трегалозы в 0,03 М HEPES,
Из рис. 2, б (вставка) видно, что прирост ве
pH 6,8, содержащем 0,15 М NaCl, использован
личины t0/t0(0) с ростом концентрации αB Cr
ных в опытах AUC, были измерены непосред
становится более заметным в присутствии
ственно при 48 °C и 20 °C. Плотность растворов
66 мМ трегалозы.
измерена в денситометре DMA 4500 («Anton
С использованием уравнения (2) были оце
Paar», Австрия) и определена равной 1,0408 и
нены основные параметры процесса агрегации
Рис. 1. Влияние αB Cr на кинетику агрегации ФБ (0,3 мг/мл; 0,03 M HEPES, 0,15 М NaCl, 0,5 мМ ДТТ, pH 6,8) при 48 °С
в отсутствие (а) и в присутствии 66 мМ трегалозы (б). Зависимости интенсивности светорассеяния (I - I0) от времени, по
лученные при следующих концентрациях αB Cr: (а) (1) 0, (2) 0,0025, (3) 0,03, (4) 0,05, (5) 0,075, (6) 0,1 и (7) 0,2 мг/мл;
(б) (1) ФБ без добавок, (2) 0, (3) 0,0025, (4) 0,01, (5) 0,03 и (6) 0,05 мг/мл
БИОХИМИЯ том 87 вып. 2 2022
198
ЧЕБОТАРЕВА и др.
Таблица 1. Параметры, характеризующие влияние трегалозы на агрегацию ФБ (0,3 мг/мл) при 48 °С
Эффективность действия шаперона
Изучаемый шаперон
стадия нуклеации
стадия роста агрегатов
αB Cr
AC0 = 2,04 ± 0,04 ФБ мономер
AC0 = 1,96 ± 0,04 ФБ мономер
на 1 субъединицу αB Cr
на 1 субъединицу αB Cr
αB Cr в присутствии 66 мМ трегалозы
AC0 = 2,94 ± 0,08 ФБ мономер
AC0 = 2,00 ± 0,04 ФБ мономер
на 1 субъединицу αB Cr
на 1 субъединицу αB Cr
Трегалоза
[L]0.5 = 86,2 ± 1,4 мМ
[L]0.5 = 85,3 ± 4,1 мМ
Трегалоза в присутствии αB Cr (0,015 мг/мл)
[L]0.5 = 67,0 ± 4,0 мМ
[L]0.5 = 86,6 ± 5,0 мМ
ФБ, а именно длительность стадии нуклеации
практически не влияет на величину AC0 на ста
(t*) и начальная скорость процесса агрегации на
дии роста агрегатов (рис. 2, в; табл. 1). Из
стадии роста агрегатов (v0). Чтобы оценить зна
рис. 2, г (вставка) видно, что прирост величины
чения AC0 для αB Cr по отношению к ФБ на
t*/t*(0) с ростом концентрации αB Cr не меняет
стадии роста агрегатов в отсутствие (кривая 1 на
ся в присутствии 66 мМ трегалозы.
рис. 2, в) и в присутствии 66 мМ трегалозы (кри
Влияние αB Cr на агрегацию ФБ в присут
вая 2 на рис. 2, в), были построены графики за
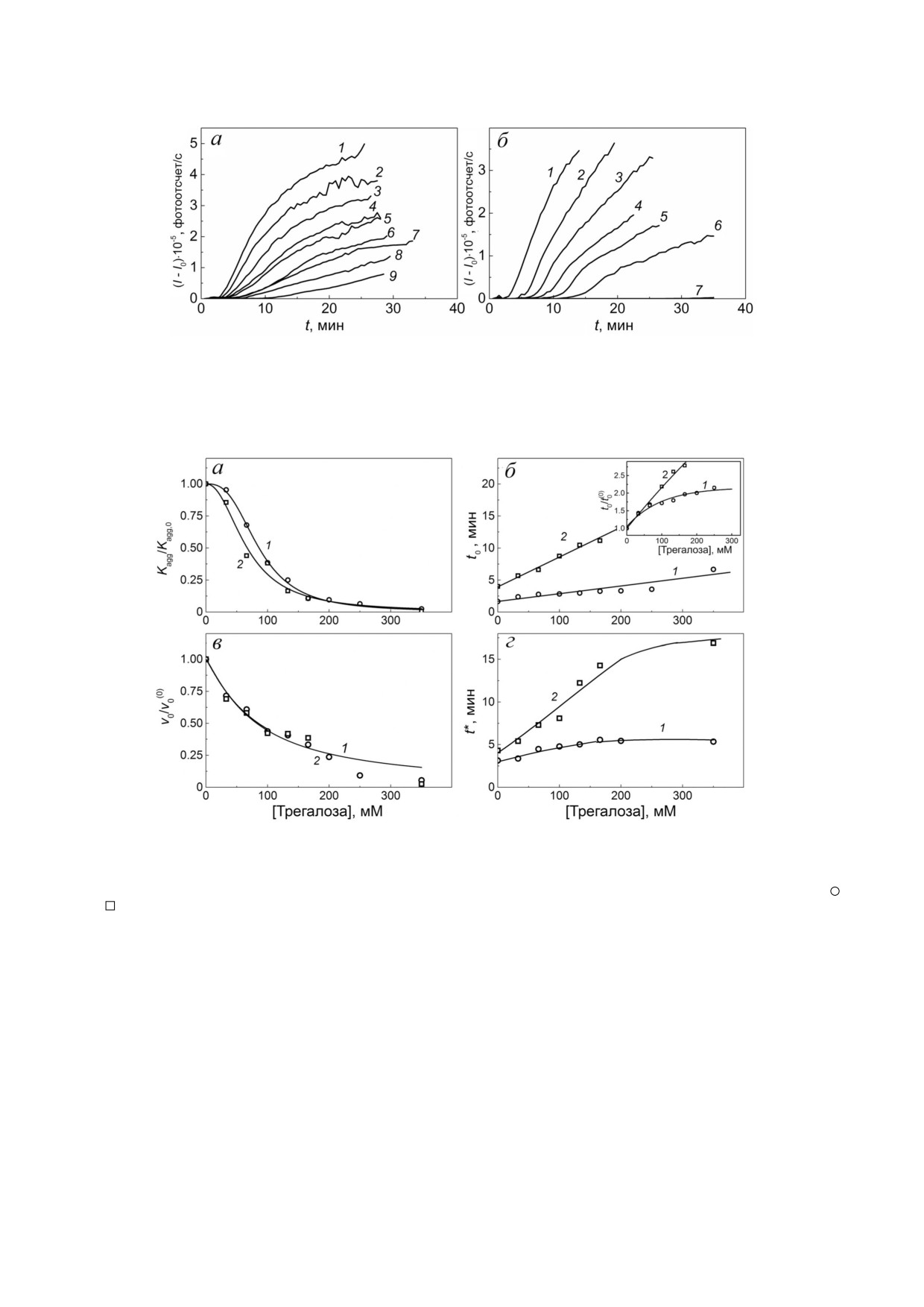
ствии трегалозы. На рис. 3 представлены кине
висимостей v0/v0(0) от отношения [αB Cr]/[ФБ].
тические кривые агрегации ФБ (0,3 мг/мл), ре
Показано, что трегалоза в концентрации 66 мМ
гистрируемые методом ДЛС, при 48 °С в присут
Рис. 2. Влияние αB Cr на кинетические параметры агрегации ФБ (0,3 мг/мл) в отсутствие и в присутствии 66 мМ трега
лозы при 48 °С. Зависимости относительного ускорения процесса агрегации на стадии нуклеации (Kagg/Kagg,0) (а), значе
ний лаг периодов (t0) на кинетических кривых агрегации ФБ (б), относительной начальной скорости агрегации (v0/v0(0))
на стадии роста агрегатов (в) и значений длительности стадии нуклеации (t*) (г) от отношения молярных концентраций
αB Cr и ФБ. Кривые 1 (
) и 2 (
) на рисунках а, б, в и г получены в отсутствие и в присутствии 66 мМ трегалозы соотве
тственно. На вставках на рис. 2, б и г изображены зависимости относительных значений лаг периодов (t0/t0(0)) и длитель
ности стадии нуклеации (t*/t*(0)) от отношения молярных концентраций αB Cr и ФБ. t0 и t0(0) - значения лаг периода в
присутствии и в отсутствие αB Cr соответственно; t* и t*(0) - значения длительности стадии нуклеации в присутствии и в
отсутствие αB Cr соответственно
БИОХИМИЯ том 87 вып. 2 2022
ВЛИЯНИЕ ТРЕГАЛОЗЫ НА αB КРИСТАЛЛИН
199
Рис. 3. Влияние трегалозы на кинетику агрегации ФБ (0,3 мг/мл) при 48 °С в отсутствие (а) и в присутствии 0,015 мг/мл
αB Cr (б). Зависимости интенсивности светорассеяния (I - I0) от времени, полученные при следующих концентрациях
трегалозы: (а) (1) 0, (2) 33, (3) 66, (4) 100, (5) 133, (6) 166, (7) 200, (8) 250 и (9) 350 мМ; (б) (1) ФБ без добавок, (2) 0, (3) 33,
(4) 66, (5) 100, (6) 200 и (7) 350 мМ
Рис. 4. Влияние трегалозы на кинетические параметры агрегации ФБ (0,3 мг/мл) в отсутствие и в присутствии 0,015 мг/мл
αB Cr при 48 °С. Зависимости относительного ускорения процесса агрегации на стадии нуклеации (Kagg/Kagg,0) (а), лаг пе
риода (t0) на кинетических кривых агрегации ФБ (б), величины относительной начальной скорости процесса агрегации
на стадии роста агрегатов (v0/v0(0)) (в) и длительности стадии нуклеации (t*) (г) от концентрации трегалозы. Кривые 1 (
)
и 2 (
) на панелях а, б, в и г получены в отсутствие и присутствии 0,015 мг/мл αB Cr соответственно. На вставке на рис. 4, б
изображены зависимости относительных значений лаг периодов (t0/t0(0)) от концентрации трегалозы (t0 и t0(0) - значения
лаг периода в присутствии и в отсутствие трегалозы соответственно)
ствии различных концентраций трегалозы в от
ство трегалозы к ФБ на стадии нуклеации
сутствие (рис. 3, а) и в присутствии 0,015 мг/мл
(табл. 1).
αB Cr (рис. 3, б). В обоих случаях наблюдалось
Из рис. 4, б (вставка) видно, что прирост ве
подавление агрегации ФБ (рис. 3, а и б).
личины t0/t0(0) с ростом концентрации трегалозы
На основании зависимости Kagg/Kagg,0 от
становится более заметным в присутствии
концентрации трегалозы (рис. 4, а) показано,
0,015 мг/мл αB Cr.
что αB Cr в концентрации 0,015 мг/мл в 1,3 ра
Анализ зависимости v0/v0(0) от концентрации
за уменьшал значение параметра [L]0.5, рассчи
трегалозы (рис. 4, в) показал, что αB Cr в концен
танного по формуле (4), т.е. увеличивал срод
трации 0,015 мг/мл практически не оказывал
БИОХИМИЯ том 87 вып. 2 2022
200
ЧЕБОТАРЕВА и др.
влияния на величину параметра [L]0.5, рассчи
танного по формуле (5) (табл. 1).
Из рис. 4, г видно, что длительность стадии
нуклеации (t*) в отсутствие αB Cr растет с уве
личением концентрации трегалозы от 0 до
150 мМ, а затем при дальнейшем ее увеличении
до 350 мМ практически не меняется (кривая 1 на
рис. 4, г). В присутствии же 0,015 мг/мл αB Cr
(кривая 2 на рис. 4, г) величина t* растет с увели
чением концентрации трегалозы.
Таким образом, можно сделать вывод, что
влияние трегалозы на процесс агрегации ФБ в
присутствии αB Cr связано в основном с увели
чением адсорбционной емкости αB Cr на ста
дии нуклеации. Подобное влияние полностью
отсутствует на стадии роста агрегатов.
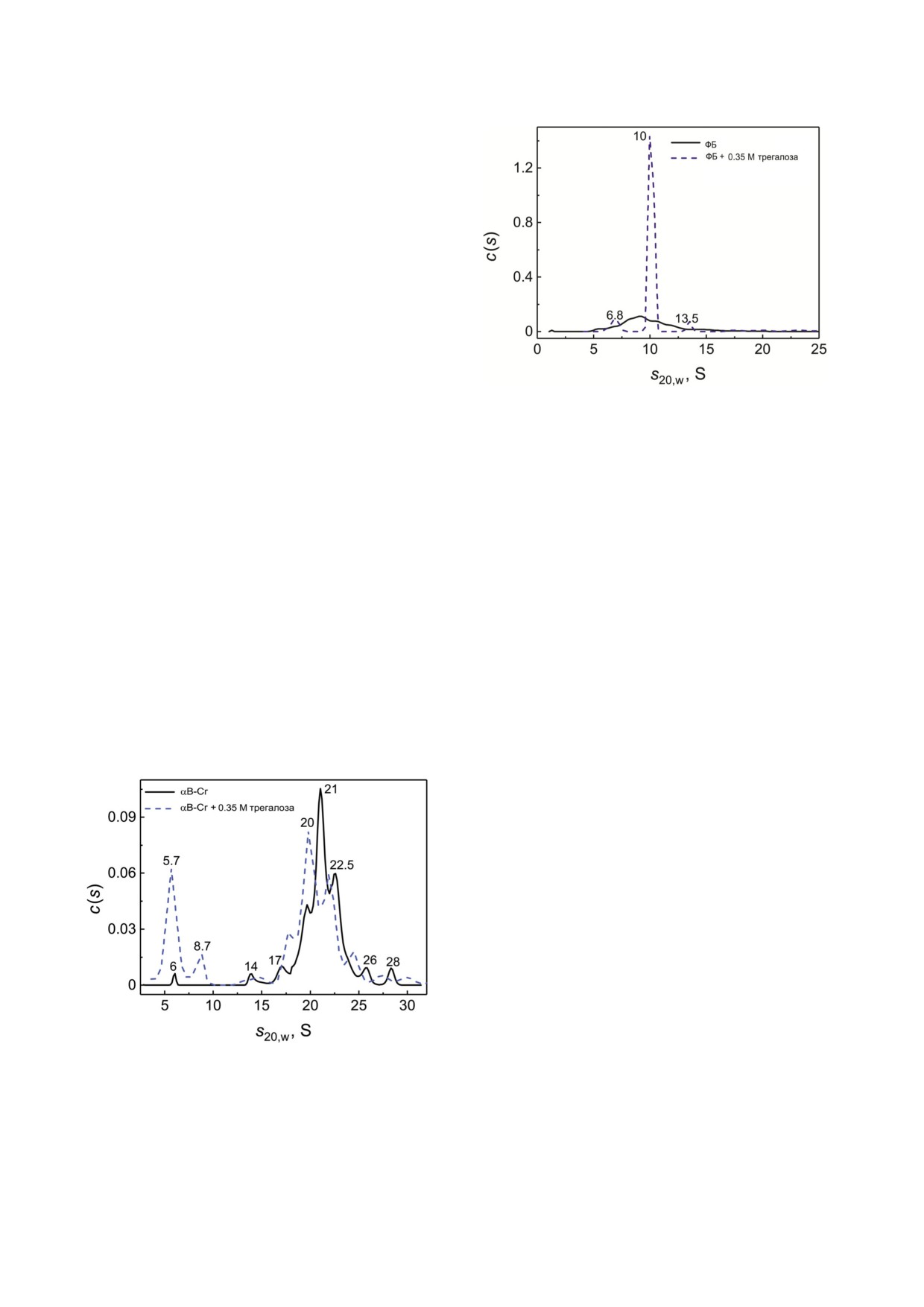
Рис. 6. Распределения c(s) по коэффициентам седимента
Можно предположить, что развернутые мо
ции при 20 °С для ФБ (0,6 мг/мл, сплошная кривая) и сме
лекулы ФБ образуют комплексы с αB Cr, кото
си ФБ + 350 мМ трегалоза (штриховая кривая)
рые некоторое время не агрегируют, т.к. в них
нет «липких» мест для агрегации. Формирова
ние ядер происходит благодаря образованию до
цесса тепловой агрегации ФБ включают стадию
полнительных контактов между развернутыми
конформационных изменений димеров ФБ и
молекулами ФБ в составе этих комплексов, что
стадию их обратимой диссоциации на мономеры
требует большего времени и замедляет стадию
[36, 46], за которыми следуют стадии денатура
нуклеации. При этом относительный рост вели
ции мономеров, нуклеации и роста агрега
чины лаг периода выражен тем сильнее, чем
тов [35]. Ввиду того что активность αB Cr нераз
выше концентрация αB Cr. Трегалоза «усилива
рывно связана с его четвертичной структурой,
ет» действие αB Cr. Комплекс белка мишени с
представляло интерес исследовать влияние тре
αB Cr лучше связывает трегалозу (рис. 4, а), и
галозы на олигомерное состояние белкового ша
на начальных этапах в присутствии трегалозы
перона и белка мишени, а также на их взаимо
растет адсорбционная емкость αB Cr (рис. 2, а).
действие в течение более длительного времени, а
Седиментационный анализ влияния трегалозы
именно после 3 часового инкубирования при
на олигомерное состояние αB Cr и белка мишени.
48 °С. Для этой цели использовали метод AUC.
Ранее было показано, что начальные этапы про
Как видно из рис. 5, трегалоза влияет на
распределение c(s) αB Cr: все распределение
сдвинуто в сторону меньших значений коэффи
циента седиментации (s20,w). Это указывает на
то, что доля более мелких олигомеров в распре
делении возрастает в присутствии трегалозы.
Кроме того, в присутствии трегалозы значитель
но возрастает доля диссоциированных форм
αB Cr: на это указывает присутствие пиков с
s20,w 5,7 и 8,7 S. Вследствие этого трегалоза мо
жет оказывать влияние на шапероноподобную
активность αB Cr.
Влияние 350 мМ трегалозы на олигомерное
состояние ФБ. Распределение по коэффициен
там седиментации c(s) для ФБ при 20 °С после
прогревания белка в течение 3 ч при 48 °С и
быстрого охлаждения представляет собой широ
кий пик в области значений коэффициентов се
диментации от 5 до 20 S, включающий разные
олигомерные формы частично развернутого
Рис. 5. Влияние трегалозы на олигомерное состояние
αB Cr (0,2 мг/мл). Дифференциальные распределения по
белка от мономера до тетрамера и небольших аг
коэффициентам седиментации, c(s), для αB Cr в отсут
регатов. Трегалоза в концентрации 350 мМ ста
ствие (сплошная кривая) и в присутствии (пунктирная
кривая) 350 мМ трегалозы. Скорость вращения рото
билизирует преимущественно димерную форму
ра - 48 000 об./мин
(пик 10 S), а также мономерную и/или частично
БИОХИМИЯ том 87 вып. 2 2022
ВЛИЯНИЕ ТРЕГАЛОЗЫ НА αB КРИСТАЛЛИН
201
Таблица 2. Оценка доли агрегированного белка (γagg), осаж
Добавление к смеси (ФБ + αB Cr) 350 мМ
дающегося в процессе ускорения ротора в опыте AUC при
трегалозы препятствует образованию крупных
20 °С
агрегатов (табл. 2). Доля γagg сокращается в 5 раз,
Образец
γagg (%)
с 60% до 12% агрегированного белка. Влияние
350 мМ трегалозы на взаимодействие αB Cr с
ФБ (0,5 мг/мл)
33
белком мишенью продемонстрировано на
ФБ в присутствии αB Cr (0,2 мг/мл)
60
рис. 7, б. Распределение c(s) в присутствии тре
*ФБ в присутствии αB Cr и 350 мM трегалозы
12
галозы имеет главный узкий пик с s20,w = 10,4 S и
*ФБ в присутствии 350 мM трегалозы
0
небольшие пики с 4; 7,5 и 14 S. Сравнение и ана
лиз трех распределений c(s) для смеси αB Cr и
Примечание. Образцы до опыта были прогреты при 48 °С в
ФБ в отсутствие (рис. 7, а, сплошная кривая) и в
течение 3 ч, затем быстро (в течение 2 мин) охлаждены.
присутствии 350 мМ трегалозы, а также c(s) для
* Если трегалозу добавить к образцам после 3 часового
прогрева при 48 °С, то она не препятствует выпадению в
αB Cr в присутствии
350
мМ трегалозы
осадок белка (58% от общего количества) в процессе уско
(рис. 7, б) позволяют сделать вывод о взаимо
рения ротора, т.е. не действует на агрегацию крупных час
действии диссоциированных форм белкового
тиц, образованных ФБ или ФБ и αB Cr.
развернутую димерную (пик 6,8 S) и тетрамер
ную с пиком 13,5 S (см. рис. 6). Кроме того, в
присутствии осмолита ФБ не оседает в процессе
ускорения ротора (табл. 2).
При анализе влияния трегалозы на денатура
цию ФБ должны быть учтены следующие дан
ные: 1) 350 мМ трегалоза защищает ФБ от обра
зования крупных агрегатов и выпадения их в
осадок; 2) если агрегаты уже сформированы, то
добавление трегалозы увеличивает долю агреги
рованного белка (58%) по сравнению с ФБ
(33%, табл. 2); 3) трегалоза стабилизирует преи
мущественно димерную форму белка (с s20,w =
10 S, рис. 6). При интерпретации влияния трега
лозы следует учитывать, что процесс агрегации
олигомерного белка включает в себя стадию об
ратимой диссоциации димера ФБ на мономеры,
подвергающиеся денатурации (см. обзор [46]).
Связываясь в зоне контакта субъединиц, лиган
ды, как, например, аденозинмонофосфат или
глюкозо 6 фосфат, препятствуют диссоциации
димера ФБ [36, 46]. На основании вышесказан
ного и полученных результатов можно предпо
лагать, что трегалоза стабилизирует нативную
димерную форму ФБ.
Влияние трегалозы на седиментацию ФБ в
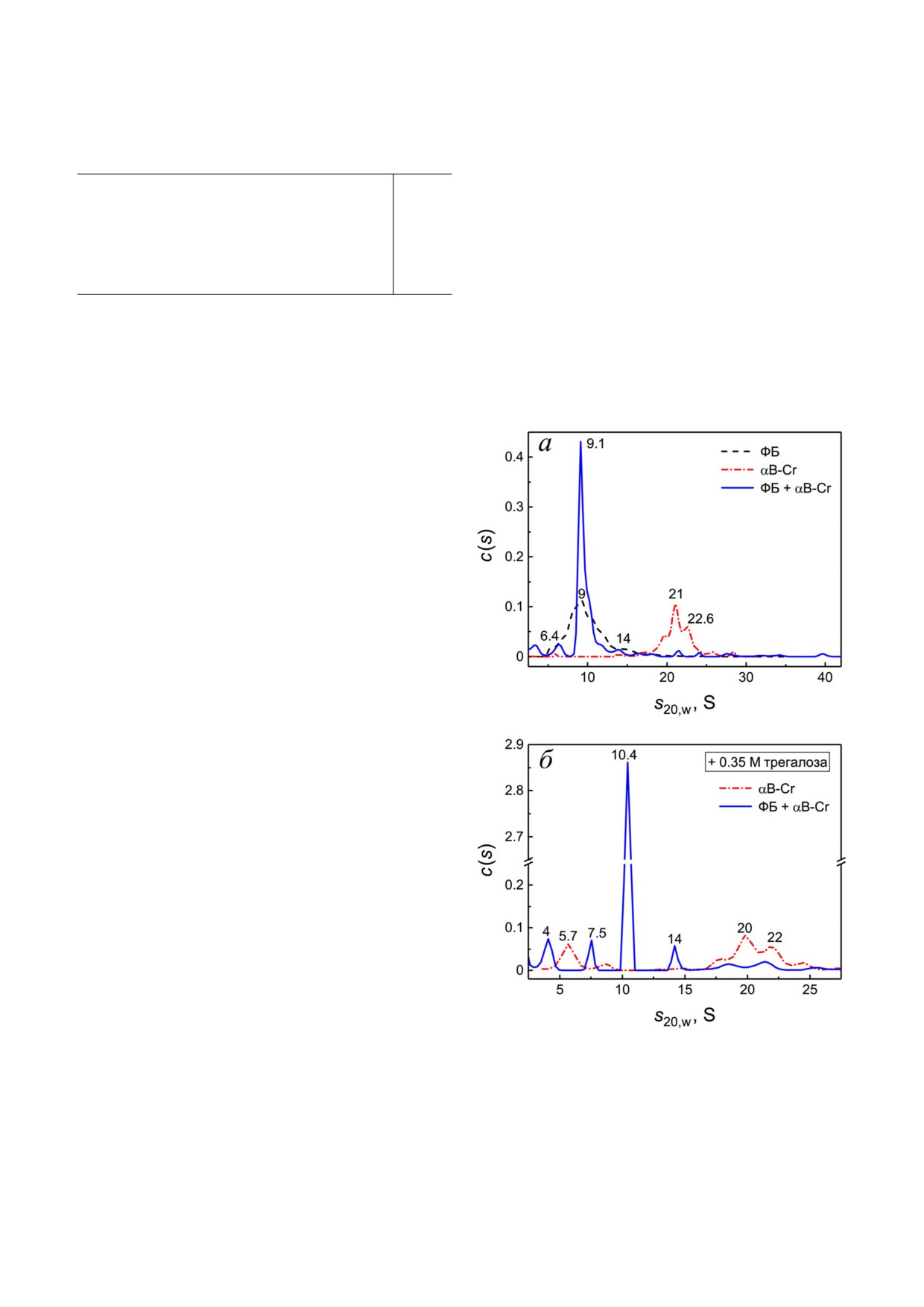
присутствии αB Cr. Из рис. 7, а видно, что для
смеси ФБ и αB Cr пики свободного αB Cr с s20,w
21 и 22,6 S практически исчезают, а пик, соответ
ствующий ФБ (9S), увеличивается и становится
более компактным с s20,w = 9,1 S. Пики на 6,4 и
14 S могут соответствовать взаимодействию мо
номера или тетрамера ФБ с мономерной/димер
ной формой шаперона. В присутствии αB Cr в
изученных условиях значительная часть ФБ осе
Рис. 7. Взаимодействие ФБ (0,6 мг/мл) и αB Cr (0,2 мг/мл)
дает при ускорении ротора (около 60%), что
в отсутствие и в присутствии 350 мМ трегалозы. а - Рас
пределения c(s) при 20 °С для ФБ (пунктирная кривая),
почти вдвое больше, чем в отсутствие шаперона.
αB Cr (штрих пунктирная) и их смеси (сплошная).
Это указывает на слипание части комплексов
б - Распределения c(s) при 20 °С в присутствии 350 мМ
ФБ-αB Cr с образованием более крупных агре
трегалозы для αB Cr (штрих пунктирная кривая) и смеси
гатов.
ФБ и αB Cr (сплошная кривая)
4 БИОХИМИЯ том 87 вып. 2 2022
202
ЧЕБОТАРЕВА и др.
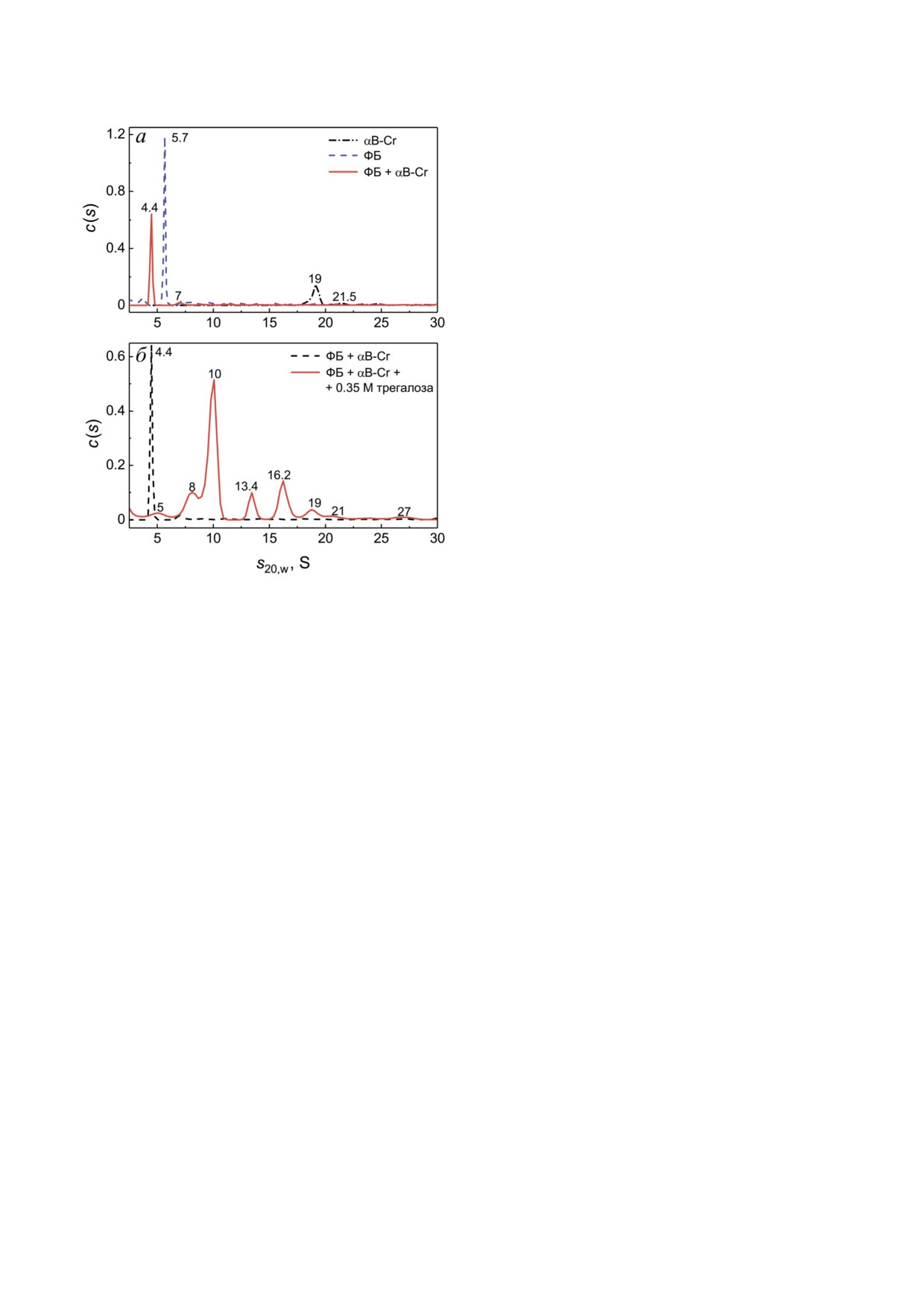
Олигомерные состояния αB Cr и ФБ в опы
тах при 48 °С отличаются от таковых в опытах
при 20 °С (после 3 часового прогрева при 48 °С и
быстрого 2 минутного охлаждения во льду с во
дой). При повышенной температуре ФБ на
распределении c(s) представлена преимущест
венно мономерной формой (пик 5,7 S) и не
большими агрегатами, в то время как крупные
агрегаты осаждаются в процессе ускорения ро
тора. αB Cr дает два пика на распределении c(s),
а именно 19 и 21,5 S, а распределение c(s) для
смеси шаперона с белком мишенью имеет ос
новной пик 4,4 S и небольшой пик 7 S (рис. 8, а).
Это позволяет предположить, что мономер ФБ
взаимодействует с мономером/димером αB Cr,
что приводит к формированию более асиммет
ричного комплекса и уменьшению коэффици
ента седиментации с 5,7 до 4,4 S. При добавле
нии 350 мМ трегалозы распределение c(s) для
смеси меняется коренным образом (рис. 8, б).
Трегалоза, по видимому, стабилизирует димер
ную форму ФБ (пик 10 S) и усиливает взаимо
действие диссоциированных форм αB Cr с ФБ
(пики 5, 8, 13,4, 16,2 S); при таких условиях воз
можно также присутствие небольшого количе
ства свободного αB Cr (19 S) и более крупных
Рис. 8. Влияние 350 мМ трегалозы на взаимодействие
комплексов (27 S).
αB Cr с ФБ при 48 °С. а - Распределения c(s) для αB Cr
Различия распределений на рис. 7 и 8 свиде
(0,2 мг/мл, штрих пунктирная кривая), ФБ (0,6 мг/мл,
штриховая) и их смеси (сплошная) были получены при
тельствуют о том, что начальные стадии процес
48 °С и приведены к стандартным условиям при 20 °С.
са тепловой агрегации ФБ, такие как диссоциа
б - Распределения c(s) для смеси αB Cr с ФБ в отсутствие
ция и денатурация, а также нуклеация, могут
(штриховая кривая) и в присутствии (сплошная кривая)
быть частично обратимы.
350 мМ трегалозы, полученные при 48 °С и приведенные к
Трегалоза, по данным ДЛС, оказывает влия
стандартным условиям при 20 °С. Общее время прогрева
образцов (время предварительного инкубирования и вре
ние на стадию нуклеации процесса тепловой аг
мя седиментации при 48 °С) составляло 3 ч
регации ФБ. При этом основной эффект трега
лозы в присутствии белкового шаперона связан с
увеличением адсорбционной емкости αB Cr по
шаперона с разными формами белка мишени в
отношению к белку мишени на стадии нуклеа
присутствии химического шаперона. Главный
ции (для 66 мМ трегалозы увеличение AC0 явля
пик 10,4 S предполагает возрастание доли на
ется 1,5 кратным): подобный эффект полностью
тивного димера ФБ, а также взаимодействие ди
отсутствует на стадии роста агрегатов. По дан
мера ФБ с мономером/димером αB Cr. Образо
ным седиментационного анализа, трегалоза, по
вание более крупных высокомолекулярных
видимому, стабилизирует димерную форму ФБ и
комплексов также возможно, поскольку 12%
усиливает взаимодействие αB Cr с ФБ. Таким
белка оседает в виде агрегатов в процессе уско
образом, можно сделать следующие выводы:
рения ротора (табл. 2).
(1) трегалоза влияет на шапероноподобную ак
Поскольку при нагревании образцов в тече
тивность αB Cr, увеличивая его адсорбционную
ние 3 ч с последующим быстрым охлаждением
емкость по отношению к белку мишени на ста
(в течение 2 мин) и проведением опытов AUC
дии нуклеации; (2) трегалоза сдвигает равнове
при 20 °С некоторые стадии общего процесса аг
сие между олигомерными формами αB Cr в сто
регации ФБ могут быть обратимы, например,
рону более мелких олигомерных форм; (3) при
начальные стадии диссоциации и денатурации
тепловом стрессе более активными являются,
белка. Представляет интерес сравнить эти дан
по видимому, диссоциированные формы αB Cr.
ные с теми, что были получены непосредствен
но при 48 °С. Действие трегалозы на смесь
Финансирование. Работа Н.А.Ч., Т.Б.Е.,
(ФБ + αB Cr) в опыте, проведенном при 48 °С,
В.В.М., С.Г.Р. и Б.И.К. проводилась при под
показано на рис. 8.
держке Российского научного фонда (грант
БИОХИМИЯ том 87 вып. 2 2022
ВЛИЯНИЕ ТРЕГАЛОЗЫ НА αB КРИСТАЛЛИН
203
№ 21 14 00178); К.В.Т. - при поддержке Ми
Конфликт интересов. Авторы заявляют об от
нистерства науки и высшего образования Рос
сутствии конфликта интересов.
сийской Федерации.
Соблюдение этических норм. Настоящая
Благодарности. Авторы выражают благодар
статья не содержит описания каких либо иссле
ность Калмыкову П.В. (посмертно) за техничес
дований с участием людей или животных в каче
кую помощь в проведении SV опытов.
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Muranov, K. O., and Ostrovsky, M. A. (2022) Molecular
15.
Chebotareva, N. A., Eronina, T. B., Sluchanko, N. N., and
mechanisms of the lens transparency maintenance and
Kurganov, B. I. (2015) Effect of Ca2+ and Mg2+ ions on
clouding, Biochemistry (Moscow), 87, in press.
oligomeric state and chaperone like activity of
2.
Dilley, K. J., and Harding, J. J. (1975) Changes in proteins
αB Crystallin in crowded media, Int. J. Biol. Macromol.,
of the human lens in development and aging, Biochem.
76, 86 93, doi: 10.1016/j.ijbiomac.2015.02.022.
Biophys. Acta Protein Struct., 386, 391 408, doi: 10.1016/
16.
Chebotareva, N. A., Eronina, T. B., Roman, S. G.,
0005 2795(75)90283 4.
Mikhaylova, V. V., Sluchanko, N. N., et al.
(2019)
3.
Siezen, R. J., Thomson, J. A., Kaplan, E. D., and
Oligomeric state of αB Crystallin under crowded condi
Benedek, G. B. (1987) Human lens gamma crystallins:
tions, Biochem. Biophys. Res. Commun., 508, 1101 1105,
Isolation, identification, and characterization of the
doi: 10.1016/j.bbrc.2018.12.015.
expressed gene products, Proc. Natl. Acad. Sci. USA, 84,
17.
Roman, S. G., Chebotareva, N. A., and Kurganov, B. I.
6088 6092, doi: 10.1073/pnas.84.17.6088.
(2017) Anti aggregation activity of small heat shock pro
4.
Fagerholm, P. P., Philipson, B. T., and Lindström, B.
teins under crowded conditions, Int. J. Biol. Macromol.,
(1981) Normal human lens - the distribution of protein,
100, 97 103, doi: 10.1016/j.ijbiomac.2016.05.080.
Exp. Eye Res.,
33,
615620, doi:
10.1016/s0014
18.
Kuznetsova, I. M., Turoverov, K. K., and Uversky, V. N.
4835(81)80101 7.
(2014) What macromolecular crowding can do to a pro
5.
Sprague Piercy, M. A., Rocha, M. A., Kwok, A. O., and
tein? Int. J. Mol. Sci., 15, 23090 23140, doi: 10.3390/
Martin, R. W. (2021) α Crystallins in the vertebrate eye
ijms151223090.
lens: complex oligomers and molecular chaperones, Annu.
19.
Clark, A. R., Lubsen, N. H., and Slingsby, C. (2012) sHSP
Rev. Phys. Chem., 72, 143 163, doi: 10.1146/annurev
in the eye lens: protein mutations, cataract and proteosta
physchem 090419 121428.
sis, Int. J. Biochem. Cell Biol., 44, 1687 1697, doi: 10.1016/
6.
Shamsi, A., Mohammad, T., Anwar, S., Hassan, Md. I.,
j.biocel.2012.02.015.
Ahmad, F., et al. (2020) Biophysical insights into implica
20.
Berry, V., Francis, P., Reddy, M. A., Collyer, D.,
tions of PEG 400 on the α crystallin structure: multispec
Vithana, E., et al. (2001) Alpha B crystallin gene (CRYAB)
troscopic and microscopic approach, ACS Omega, 5,
mutation causes dominant congenital posterior polar
19210 19216, doi: 10.1021/acsomega.0c02648.
cataract in humans, Am. J. Hum. Genet., 69, 1141 1145,
7.
Derham, B. K., and Harding, J. J. (1999) Alpha crystallin
doi: 10.1086/324158.
as a molecular chaperone, Prog. Retin. Eye Res., 18, 463
21.
Graw, J. (2009) Genetics of crystallins: Cataract and
509, doi: 10.1016/s1350 9462(98)00030 5.
beyond, Exp. Eye Res., 88, 173 189, doi: 10.1016/j.exer.
8.
Horwitz, J. (1992) Alpha crystallin can function as a mol
2008.10.011.
ecular chaperone, Proc. Natl. Acad. Sci. USA, 89, 10449
22.
Gerasimovich, E. S., Strelkov, S. V., and Gusev, N. B.
10453, doi: 10.1073/pnas.89.21.10449.
(2017) Some properties of three αB Crystallin mutants
9.
Haslbeck, M., Peschek, J., Buchner, J., and Weinkauf, S.
carrying point substitutions in the C terminal domain and
(2016) Structure and function of α crystallins: Traversing
associated with congenital diseases, Biochimie, 142, 168
from in vitro to in vivo, Biochim. Biophys. Acta, 186, 149
178, doi: 10.1016/j.biochi.2017.09.008.
166, doi: 10.1016/j.bbagen.2015.06.008.
23.
Makley, L. N., McMenimen, K. A., DeVree, B. T.,
10.
Grosas, A. B., Rekas, A., Mata, J. P., Thorn, D. C., and
Goldman, J. W., McGlasson, B. N., et al.
(2015)
Carver, J. A. (2020) The Aggregation of αB crystallin
Pharmacological chaperone for α crystallin partially
under crowding conditions is prevented by αA crystallin:
restores transparency in cataract models, Science, 350,
implications for α crystallin stability and lens transparen
674 677, doi: 10.1126/science. aac9145.
cy, J. Mol. Biol., 432, 5593 5613, doi: 10.1016/j.jmb.2020.
24.
Ghahramani, M., Yousefi, R., Krivandin, A., Muranov, K.,
08.011.
Kurganov, B., et al. (2020) Structural and functional charac
11.
Riedl M., Strauch, A., Catici, D. A. M., and Haslbeck, M.
terization of D109H and R69C mutant versions of human
(2020) Proteinaceous transformers: structural and func
αB Crystallin: the biochemical pathomechanism underlying
tional variability of human sHsps, Int. J. Mol. Sci., 21,
cataract and myopathy development, Int. J. Biol. Macromol.,
5448, doi: 10.3390/ijms21155448.
146, 1142 1160, doi: 10.1016/j.ijbiomac.2019.09.239.
12.
Inoue, R., Takata, T., Fujii, N., Ishii, K., Uchiyama, S.,
25.
Treweek, T. M., Meehan, S., Ecroyd, H., and Carver, J. A.
et al. (2016) New insight into the dynamical system of
(2015) Small heat shock proteins: Important players in
αB crystallin oligomers, Sci. Rep., 6, 29208, doi: 10.1038/
regulating cellular proteostasis, Cell. Mol. Life Sci., 72,
srep29208.
429 451, doi: 10.1007/s00018 014 1754 5.
13.
Hayashi, J., and Carver, J. A. (2020) The multifaceted
26.
Kulig, M., and Ecroyd, H. (2012) The small heat shock
nature of αB Crystallin, Cell Stress Chaperones, 25, 639
protein αB Crystallin uses different mechanisms of chap
654, doi: 10.1007/s12192 020 01098 w.
erone action to prevent the amorphous versus fibrillar
14.
Liu, Z., Wang, C., Li, Y., Zhao, C., Li, T., et al. (2018)
aggregation of α lactalbumin, Biochem. J., 448, 343 352,
Mechanistic insights into the switch of αB Crystallin
doi: 10.1042/BJ20121187.
chaperone activity and self multimerization, J. Biol.
27.
Chebotareva, N. A., Roman, S. G., Borzova, V. A.,
Chem.,
293,
14880e14890. doi:
10.1074/jbc.RA118.
Eronina, T. B., Mikhaylova, V. V., et al. (2020) Chaperone
004034.
like activity of HSPB5: The effects of quaternary structure
БИОХИМИЯ том 87 вып. 2 2022
4*
204
ЧЕБОТАРЕВА и др.
dynamics and crowding, Int. J. Mol. Sci., 21,
4940,
cle glycogen phosphorylase b, Biochemistry, 39, 13144
doi: 10.3390/ijms21144940.
13152, doi: 10.1021/bi000975w.
28.
Garvey, M., Ecroyd, H., Ray, N. J., Gerrard, J. A., and
37. Kastenschmidt, L. L., Kastenschmidt, J., and
Carver, J. A. (2017) Functional amyloid protection in the
Helmreich, E. (1968) Subunit interactions and their rela
eye lens: Retention of α crystallin molecular chaperone
tionship to the allosteric properties of rabbit skeletal mus
activity after modification into amyloid fibrils,
cle phosphorylase b, Biochemistry,
7,
35903607,
Biomolecules, 7, 67, doi: 10.3390/biom7030067.
doi: 10.1021/bi00850a037.
29.
Moreau, K. L., and King, J. A. (2012) Protein misfolding
38. Mymrikov, E. V., Bukach, O. V., Seit Nebi, A. S., and
and aggregation in cataract disease and prospects for pre
Gusev, N. B. (2010) The pivotal role of the beta 7 strand in
vention, Trends Mol. Med., 18, 273 282, doi: 10.1016/
the intersubunit contacts of different human small heat
j.molmed.2012.03.005.
shock proteins, Cell Stress Chaperones, 15, 365377,
30.
Ram, L., Mittal, C., Harsolia, R. S., and Yadav, J. K.
doi: 10.1007/s12192 009 0151 8.
(2020) Trehalose inhibits the heat induced formation of
39. Kurganov, B. I. (2013) Antiaggregation activity of chaper
the amyloid like structure of soluble proteins isolated from
ones and its quantification, Biochemistry (Moscow), 78,
human cataract lens, Protein J., 39, 509 518, doi: 10.1007/
1554 1566, doi: 10.1134/S0006297913130129.
s10930 020 09919 8.
40. Kurganov, B. I. (2017) Quantification of anti aggregation
31.
Jain, N. K., and Roy, I. (2009) Effect of trehalose on pro
activity of chaperones, Int. J. Biol. Macromol., 100, 104
tein structure, Protein Sci., 18, 24 36, doi: 10.1002/pro.3.
117, doi: 10.1016/j.ijbiomac.2016.07.066.
32.
Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
41. Eronina, T. B., Chebotareva, N. A., Roman, S. G.,
Shubin, V. V., Sluchanko, N. N., et al. (2019) Comparative
Kleymenov, S. Y., Makeeva, V. F., et al. (2014) Thermal
effects of trehalose and 2 hydroxypropyl β cyclodextrin
denaturation and aggregation of apoform of glycogen phos
on aggregation of UV irradiated muscle glycogen phos
phorylase b. Effect of crowding agents and chaperones,
phorylase b, Biochimie, 165, 196205, doi: 10.1016/
Biopolymers, 101, 504 516, doi: 10.1002/bip.22410.
j.biochi.2019.08.006.
42. Kurganov, B. I. (1998) Kinetics of heat aggregation of pro
33.
Matsuo, T., Tsuchida, Y., and Morimoto, N. (2002)
teins, Biochemistry (Moscow), 63, 364 366.
Trehalose eye drops in the treatment of dry eye syndrome,
43. Mikhaylova, V. V., Eronina, T. B., Chebotareva, N. A.,
Ophthalmology, 109, 20242029, doi: 10.1016/s0161
Shubin, V. V., Kalacheva, D. I., and Kurganov, B. I. (2020)
6420(02)01219 8.
Effect of arginine on chaperone like activity of HspB6 and
34.
Attanasio, F., Cascio, C., Fisichella, S., Nicoletti, V. G.,
monomeric
1433ζ, Int. J. Mol. Sci.,
21,
2039,
Pignataro, B., et al. (2007) Trehalose effects on α crystallin
doi: 10.3390/ijms21062039.
aggregates, Biochem. Biophys. Res. Commun., 354, 899
44. Kurganov, B. I.
(1982) Allosteric Enzymes. Kinetic
905, doi: 10.1016/j.bbrc.2007.01.061.
Behaviour, John Wiley & Sons, Chichester, pp. 56 60.
35.
Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A., and
45. Brown, P. H., and Schuck, P. (2006) Macromolecular size
Kurganov, B. I. (2016) Kinetic regime of thermal aggrega
and shape distributions by sedimentation velocity analyti
tion of holo and apoglycogen phosphorylases b, Int. J.
cal ultracentrifugation, Biophys. J.,
90,
46514661,
Biol. Macromol., 92, 12521257, doi: 10.1016/j.ijbio
doi: 10.1529/biophysj.106.081372.
mac.2016.08.038.
46. Chebotareva, N. A., Roman, S. G., and Kurganov, B. I.
36.
Kurganov, B. I., Chebotareva, N. A., Kornilaev, B. A.,
(2016) Dissociative mechanism for irreversible thermal
Malikov, V. P., Orlov, V. N., et al. (2000) Dissociative
denaturation of oligomeric proteins, Biophys. Rev., 8, 397
mechanism of thermal denaturation of rabbit skeletal mus
407, doi: 10.1007/s12551 016 0220 z.
EFFECT OF TREHALOSE ON OLIGOMERIC STATE
AND ANTI AGGREGATION ACTIVITY OF αB CRYSTALLIN
N. A. Chebotareva*, T. B. Eronina, V. V. Mikhaylova,
S. G. Roman, K. V. Tugaeva, and B. I. Kurganov
Bach Institute of Biochemistry, Federal Research Centre “Fundamentals of Biotechnology”
of the Russian Academy of Sciences, 119071 Moscow, Russia; e-mail: n.a.chebotareva@gmail.com
αB Crystallin (αB Cr), one of the main crystalline lens proteins, along with other crystallins maintains lens trans
parency suppressing protein aggregation and thus preventing cataractogenesis. αB Cr belongs to the class of molecu
lar chaperones; being expressed in many tissues it has a dynamic quaternary structure, which is essential for its chap
erone-like activity. A shift in the equilibrium between ensembles of oligomers of different size allows regulating the
chaperone activity. Trehalose is known to inhibit protein aggregation in vivo and in vitro, and it is widely used in
biotechnology. The results of studying the effect of trehalose on the chaperone like activity of crystallins can serve as
a basis for the design of drugs delaying cataractogenesis. We have studied the trehalose effect on the quaternary struc
ture and anti aggregation activity of αB Cr using muscle glycogen phosphorylase b (Phb) as a target protein.
According to the dynamic light scattering data, trehalose affects the nucleation stage of Phb thermal aggregation at
48 °C, and an increase in αB Cr adsorption capacity (AC0) is the main effect of trehalose on the aggregation process
in the presence of the protein chaperone (AC0 increases 1.5 fold in the presence of 66 mM trehalose). According to
the sedimentation analysis data, trehalose stabilizes the dimeric form of Phb at the stages of denaturation and disso
ciation and enhances the interaction of αB Cr with the target protein. Moreover, trehalose shifts the equilibrium
between αB Cr oligomers towards the smaller forms. Thus, trehalose affects the quaternary structure of αB Cr and
increases its anti aggregation activity at the nucleation stage.
Keywords: αB crystallin, anti aggregation activity, trehalose, glycogen phosphorylase b, dynamic light scattering, ana
lytical ultracentrifugation
БИОХИМИЯ том 87 вып. 2 2022