БИОХИМИЯ, 2022, том 87, вып. 2, с. 205 - 215
УДК 577.21
ПОТЕНЦИАЛЬНОЕ ВЛИЯНИЕ ПОСТТРАНСКРИПЦИОННЫХ
ЗАМЕН ТИРОЗИНОВЫХ ОСТАТКОВ НА ЦИСТЕИНОВЫЕ
НА ТРАНСФОРМАЦИЮ АМИЛОИДОГЕННЫХ БЕЛКОВ
Мини обзор
© 2022
В.И. Муронец1,2*, Д.В. Поздышев1, М.В. Медведева2, И.А. Севостьянова1
1 НИИ физико химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: vimuronets@belozersky.msu.ru
2 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
Поступила в редакцию 25.11.2021
После доработки 12.01.2022
Принята к публикации 12.01.2022
В обзоре рассмотрены причины и следствия посттранскрипционных замен тирозиновых остатков на цистеи
новые. Основное внимание уделено заменам Tyr Cys, которые возникают при экспрессии генов в бактери
альных системах на стадии трансляции белков в результате неправильного узнавания сходных кодонов
мРНК. Отмечено, что если в целом ошибки трансляции возникают относительно редко, от 10-3 до 10-4 оши
бок на кодон для E. coli, то в некоторых случаях частота ошибок существенно возрастает. Например, это ха
рактерно для определенных пар кодонов при изменении условий культивирования или в присутствии анти
биотиков. Так, при суперпродукции рекомбинантного альфа синуклеина человека в клетках E. coli содер
жание мутантой формы с заменой 136 го тирозинового остатка (кодон UAС) на цистеиновый (кодон UGC)
может достигать 50%. Рассмотрены возможные причины повышенной продукции альфа синуклеина с за
менами Tyr136Cys, а также последствия присутствия мутантных форм в препаратах амилоидогенных белков
при изучении их патологической трансформации in vitro. Отдельный раздел посвящен заменам Tyr Cys, ас
социированным с редактированием мРНК аденозиндезаминазами, характерным для эукариотических ор
ганизмов, и возможной роли этого процесса в амилоидной трансформации белков, связанных с нейродеге
неративными заболеваниями.
КЛЮЧЕВЫЕ СЛОВА: амилоидогенные белки, ошибки трансляции, замены Tyr Cys, синуклеин, продук
ция белков в бактериях, амилоидогенез.
DOI: 10.31857/S0320972522020051
ВВЕДЕНИЕ
между полипептидными цепями, стабилизиро
вать агрегаты и влиять на амилоидную транс
На пути передачи информации от молекулы
формацию белков. Нельзя также исключать воз
ДНК до синтезируемой полипептидной цепи
можность появления дополнительных активнос
белка возможно появление ошибок, которые
тей у белков из за возникновения сульфгидриль
могут существенно изменять свойства белковой
ных групп, способных участвовать в различных
молекулы. В обзоре мы остановимся только на
реакциях, прежде всего связанных с окислитель
механизмах замены остатков тирозина на остат
но восстановительными процессами.
ки цистеина, поскольку такая замена кардиналь
Существуют два основных механизма воз
но влияет на физико химические свойства бел
никновения ошибок при передаче информации
ка. Особое влияние такие замены оказывают на
от молекулы ДНК до полипептидной цепи - ре
способность белков формировать агрегаты, в
дактирование матричной РНК или «неточное»
том числе и амилоидные. Появление дополни
функционирование рибосомного аппарата. Ре
тельных остатков цистеина может не только соз
дактирование мРНК может происходить в ре
давать препятствия для правильного формиро
зультате сплайсинга или под действием адено
вания пространственной структуры белка, но и
зиндезаминаз или цитозиндезаминаз. Мы рас
приводить к образованию дисульфидных связей
смотрим только редактирование мРНК адено
зиндезаминазами, поскольку именно воздей
* Адресат для корреспонденции.
ствие этих ферментов может вызывать точечные
205
206
МУРОНЕЦ и др.
замены аминокислотных остатков, которые яв
рые могут приводить к точечным заменам ами
ляются темой данного обзора. Дезаминирова
нокислотных остатков, прежде всего, остатков
ние мРНК аденозиндезаминазами приводит к
тирозина на остатки цистеина, а также о воз
превращению аденозина в инозин, «узнавае
можной взаимосвязи этих процессов с нейроде
мый» в процессе трансляции белка как гуано
генеративными заболеваниями. Отдельно будет
зин. Остатки тирозина кодируются в ДНК двумя
рассмотрена проблема, связанная с получением
кодонами, ТАТ и ТАС, а в мРНК, соответствен
рекомбинантных белков, продуцируемых в бак
но, UAU и UAС. Следовательно, при дезамини
териальных системах, в которых происходит за
ровании аденозина мРНК они распознаются
мена остатков тирозина на остатки цистеина.
как цистеиновые кодоны UGU и UGC, что и
Такая замена у части белковых молекул может
приводит к замене остатков тирозина на остатки
существенно изменять физико химические ха
цистеина в полипептидной цепи.
рактеристики белков и приводить к неверной
Редактирование мРНК, приводящее к заме
интерпретации полученных результатов.
не аденозина на инозин - широко распростра
ненное для эукариот явление, однако его функ
циональная роль до конца не изучена. Дезами
ОШИБКИ ТРАНСЛЯЦИИ У ПРОКАРИОТ
нирование аденозина осуществляется группой
ферментов из семейства ADAR. Так, у человека
У прокариотических организмов ошибки
семейство представлено тремя белками
-
при передаче информации от ДНК к белку воз
ADAR1, ADAR2 и ADAR3 [1]. Ферментативная
никают в процессе трансляции из за неточного
активность для ADAR3 на сегодняшний день не
узнавания кодонов мРНК некоторыми амино
продемонстрирована; предполагают, что он
ацил тРНК. Известно, что в целом частота таких
выступает в качестве регулятора процесса ре
ошибок при трансляции невелика и составляет
дактирования [2]. Для замены аденозина на
для Е. сoli при использовании разных способов
инозин необходимо взаимодействие ADAR1
оценки от 10-3 до 10-4 ошибок на кодон [7-9].
или ADAR2 с двуцепочечной РНК. Показано
Однако вероятность ошибки зависит от многих
участие белков ADAR в регуляции процессов
факторов, прежде всего от условий культивиро
врожденного иммунитета, циркадных ритмов,
вания и сходства между кодонами. Более под
развития нервной системы [3]. Существуют сви
робно особенности неправильного считывания
детельства в пользу того, что нарушения в рабо
разных кодонов были исследованы на примере
те аденозиндезаминаз ассоциированы с разви
люциферазы светлячков, продуцируемой в
тием аутоиммунных [4] и онкологических забо
Е. сoli [10]. Замена важного для катализа остатка
леваний [5]. Следует также отметить, что редак
лизина (Lys529) в люциферазе должна приво
тирование мРНК аденозиндезаминазами в клет
дить к исчезновению ферментативной актив
ках нервных тканей протекает особенно интен
ности. Тем не менее в препаратах рекомбинант
сивно. В связи с этим накапливается все больше
ных мутантных форм люциферазы, содержащих
данных о важности роли аденозиндезаминаз в
разные замены по 529 му остатку, сохранялась
регуляции функционирования нервных клеток
ферментативная активность. Было высказано
и о взаимосвязи активности этих ферментов и
предположение, что сохранение люциферазной
развития нейродегенеративных заболеваний [6].
активности происходит из за синтеза некоторо
Сходство кодонов, кодирующих остатки ти
го количества белка дикого типа, обусловленно
розина и цистеина, может приводить к соответ
го неправильным считыванием кодонов в 529 м
ствующим заменам в полипептидных цепях и по
положении из за конкуренции между тРНКLysUUU
другой причине. Такие ошибки при считывании
и другими тРНК. Было показано, что частота
информации в процессе трансляции могут быть
ошибок у E. coli зависит от конкуренции между
связаны с неточным узнаванием кодонов неко
родственными тРНК за сходные кодоны. На
торыми аминоацил тРНК. При этом, если ре
пример, замены на остатки лизина остатков ар
дактирование мРНК интенсивно протекает в
гинина (кодоны AGA и AGG) происходят в
эукариотических организмах, то ошибки, воз
10 раз чаще, чем замены других аминокислот
никающие в процессе трансляции, характерны
ных остатков у мутантных форм белка. Об этом
для прокариот. Интересно, что для дрожжей, от
свидетельствует более высокая ферментативная
носящихся к эукариотам, были также обнаруже
активность мутантных форм, содержащих оста
ны ошибки, возникающие при трансляции, что
ток аргинина в 529 м положении. Важно также
может указывать на определенные особенности
отметить, что в присутствии некоторых антиби
аппарата трансляции у этих организмов.
отиков в несколько раз увеличивается частота
В обзоре будут суммированы данные о редак
ошибок в процессе трансляции, причем величи
тировании мРНК аденозиндезаминазами, кото
на наблюдаемого эффекта зависит также от типа
БИОХИМИЯ том 87 вып. 2 2022
ЗАМЕНЫ ТИРОЗИНОВЫХ ОСТАТКОВ В АМИЛОИДОГЕННЫХ БЕЛКАХ
207
тРНК. Аминогликозидные антибиотики суще
Однако нельзя исключить, что ошибки в про
ственно увеличивают частоту ошибок для сход
цессе трансляции из за конкуренции между
ных кодонов, но практически не изменяют чис
тРНК все таки происходят и у других эукарио
ло ошибок по кодонам в целом. Так, для кодона
тических организмов, хотя и с меньшей часто
AAU, кодирующего аспарагин, частота ошибок
той. К сожалению, пока не получено экспери
в присутствии паромомицина увеличивается
ментальных данных, подтверждающих или оп
почти в 10 раз и достигает 1,3 × 10-2 [10]. Сниже
ровергающих такое предположение.
ние точности трансляции в присутствии ами
ногликозидных антибиотиков, а также при до
бавлении ионов магния было подтверждено и в
ОШИБКИ ТРАНСЛЯЦИИ, ПРИВОДЯЩИЕ
других работах [11, 12].
К ЗАМЕНЕ ТИРОЗИНОВЫХ ОСТАТКОВ
С развитием методов масс спектрометрии
НА ЦИСТЕИНОВЫЕ
накапливается все больше данных о заменах
аминокислотных остатков в рекомбинантных
Тирозиновые остатки кодируются в матрич
эукариотических белках, продуцируемых в бак
ной РНК двумя кодонами - UAU и UAC, а цис
териальных системах [13-15]. Как правило, та
теиновые остатки сходными кодонами - UGU и
кие замены характерны для редких в бактери
UGC. Как было отмечено во введении, редакти
альных системах кодонов [14-17]. Например,
рование мРНК аденозиндезаминазами может
при использовании редкого кодона GGA в про
приводить к заменам тирозиновых остатков на
дуцируемых в E. coli белках происходила замена
цистеиновые у эукариот. Однако для прокариот
остатков глутаминовой кислоты на остатки гли
из за отсутствия аденозиндезаминаз характерен
цина [16]. Наблюдались также замены лизино
другой механизм - появление ошибок в процес
вых остатков (ААА) на аргининовые (AGA) [17]
се трансляции из за неправильного узнавания
и аргининовых на лизиновые [15], а также арги
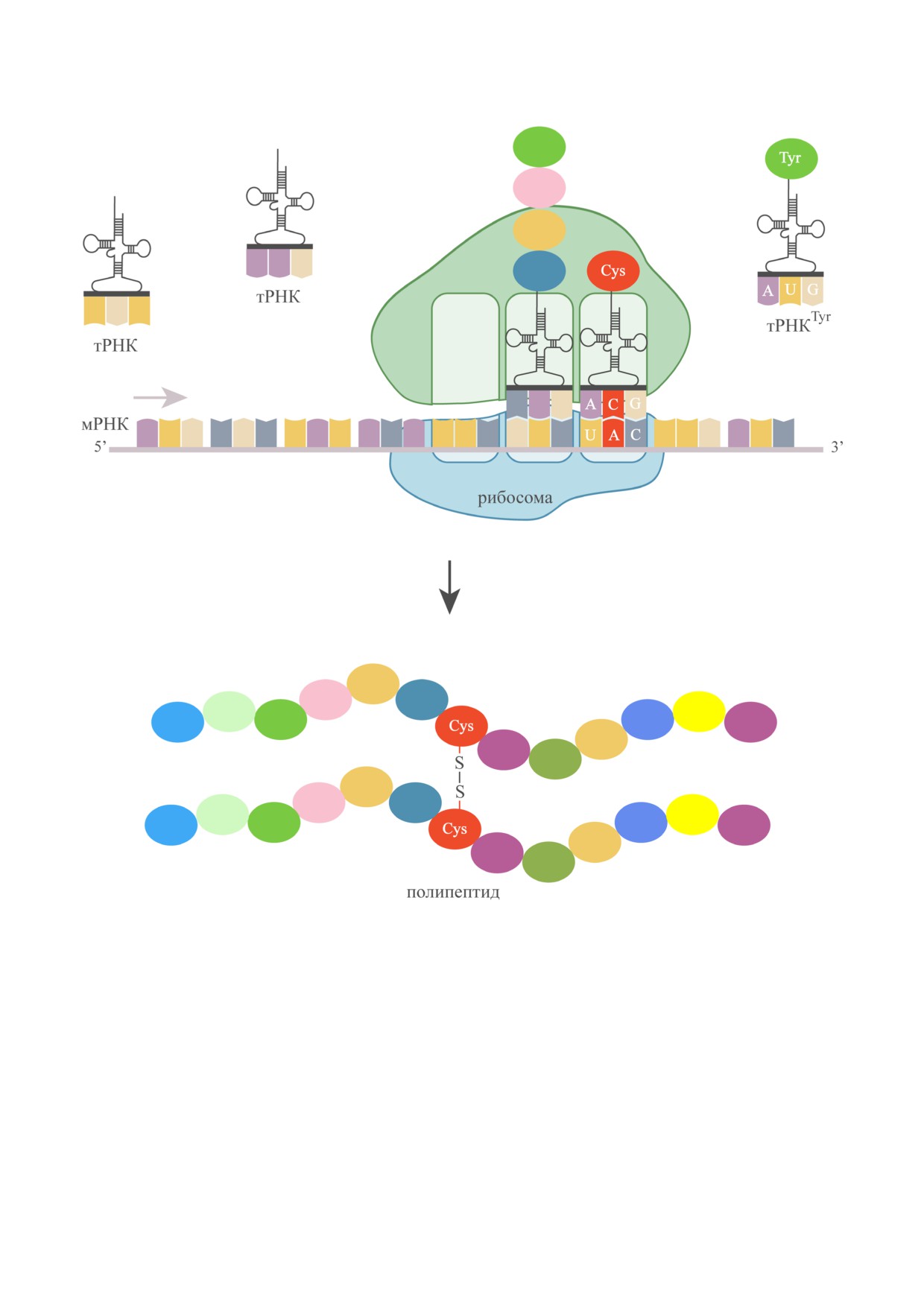
кодонов. Механизм такой замены схематически
ниновых (CGG) на глутаминовые (CAG) [14]. В
представлен на рис. 1. В верхней части рисунка
полученных препаратах содержание белков с
продемонстрирована конкуренция за связыва
возникшими в процессе трансляции заменами
ние между разными аминоацил тРНК с
может достигать 10-40% [14, 15, 17].
UAC кодоном мРНК в А сайте рибосомы. Вслед
ствие неточной работы трансляционного аппа
рата происходит неверное считывание кодона и
ОШИБКИ ТРАНСЛЯЦИИ В ДРОЖЖАХ
появление в полипептидной цепи цистеинового
остатка вместо тирозинового. Цистеиновые ос
Принято считать, как уже отмечалось выше,
татки могут образовывать дисульфидные связи,
что неправильное считывание информации на
соединяющие полипептидные цепи.
пути от ДНК к белкам для прокариот обусловле
Первые указания на возможность замены
но ошибками в процессе трансляции, а для
тирозиновых остатков на цистеиновые были по
эукариот - редактированием мРНК дезамина
лучены в середине 80 х годов. Было показано,
зами. Однако достаточно высокий уровень оши
что при синтезе in vivo белка Ocr бактериофа
бок при трансляции был обнаружен и у некото
га T7 происходит включение остатков цистеина
рых эукариот, а именно у пекарских дрожжей
в положение, обычно занимаемое тирозиновым
Saccharomyces cerevisiae [18, 19]. Так, с использо
остатком [20]. В дальнейшем избирательно за
ванием описанной выше системы детекции с
мены именно тирозиновых остатков на цистеи
люциферазой было показано, что частота оши
новые не исследовали, хотя исходя из характер
бок варьирует от 4 × 10-5 до 6,9 × 10-4 на кодон,
ной для E. coli частоты ошибок, можно было
т.е. в среднем в 3 раза ниже, чем для бактериаль
ожидать, что она должна быть не слишком вы
ной системы [19]. При этом для дрожжей харак
сокой и составлять от 10-3 до 10-4 ошибок на ко
терно более избирательное действие аминогли
дон. Однако при экспрессии человеческого
козидных антибиотиков. Так, для одних кодо
альфа синуклеина в клетках E. coli было обнару
нов добавление паромомицина не влияет на
жено, что у значительной части синтезирован
частоту ошибок, а для других - увеличивает ко
ного белка Tyr136 (кодон UAC) заменен на оста
личество ошибок в несколько раз. Авторы пред
ток цистеина [21, 22]. При этом замен других ос
полагают, что в пекарских дрожжах существуют
татков тирозина, кодируемых триплетом UАU,
дополнительные механизмы, предотвращаю
обнаружено не было. Замена одного из нуклео
щие неточную трансляцию, в отличие от E. сoli.
тидов в кодирующем 136 й тирозиновый оста
Возможно, именно более точная работа эукарио
ток кодоне (UАU) полностью предотвращала
тических рибосом может снижать вероятность
возникновение мутантного белка c такими за
возникновения ошибок в процессе трансляции.
менами [21]. Оказалось также, что эффектив
БИОХИМИЯ том 87 вып. 2 2022
208
МУРОНЕЦ и др.
Рис. 1. Ошибки считывания кодонов в процессе трансляции белков у прокариот. Конкуренция за связывание между раз
ными аминоацил тРНК с UAC кодоном мРНК в А сайте рибосомы. Неточная работы трансляционного аппарата приво
дит к неверному считыванию кодона и к появлению в полипептидной цепи цистеинового аминокислотного остатка вмес
то тирозинового. Сшивка полипептидных цепей дисульфидными связями через цистеиновые остатки
ность замены 136 го тирозинового остатка на
было довольно просто, т.к. содержащие цистеи
остаток цистеина зависит от рН клеточной сре
новый остаток молекулы альфа синуклеина об
ды для культивирования клеток: при закисле
разовывали соединенные дисульфидной связью
нии среды до рН 6,6 содержание мутантного
димеры. Такие димеры можно было обнаружить
альфа синуклеина, содержащего в 136 м поло
при проведении электрофореза в денатурирую
жении остаток цистеина, достигало 50% [22].
щих условиях без добавления бета меркаптоэта
Идентифицировать появление мутантных форм
нола. Вероятно, частота ошибок в процессе
БИОХИМИЯ том 87 вып. 2 2022
ЗАМЕНЫ ТИРОЗИНОВЫХ ОСТАТКОВ В АМИЛОИДОГЕННЫХ БЕЛКАХ
209
трансляции альфа синуклеина возрастала из за
смесь исходного и мутантного белка, из за мо
использования аминогликозидного антибиоти
дификаций цистеиновых остатков, особеннос
ка канамицина при культивировании клеток,
тей экстракции цистеин содержащих полипеп
как это было показано ранее для других реком
тидов из гелей и ряда других причин. Следова
бинантных белков. Кроме того, содержание му
тельно, следует внимательно отслеживать воз
тантного белка может увеличиваться из за не
можные ошибки трансляции при получении ре
достатка тирозина в условиях суперпродукции
комбинантных белков в бактериальных систе
рекомбинантного белка.
мах. С особой осторожностью надо относиться к
результатам, полученным с рекомбинантными
естественно развернутыми белками, поскольку
ВОЗМОЖНЫЕ ПОСЛЕДСТВИЯ ОШИБОК,
в них может происходить значительное накоп
ПРИВОДЯЩИХ К ЗАМЕНЕ ТИРОЗИНОВЫХ
ление мутантных форм, как это было показано
ОСТАТКОВ НА ЦИСТЕИНОВЫЕ
для альфа синуклеина. Как минимум, следует
выявлять возможные замены тирозиновых ос
При получении рекомбинантных белков в
татков на цистеиновые. Обнаружить их доста
бактериальных системах обычно не обращают
точно просто по появлению олигомерных форм
внимания на возможные замены аминокислот
белка при проведении электрофореза в отсут
ных остатков из за ошибок, возникающих в
ствие восстанавливающих дисульфидные связи
процессе трансляции. Прежде всего, это связа
соединений. Очевидно, что именно возникно
но с невысокой частотой возникновения таких
вение «поперечных сшивок», нехарактерных
ошибок. Кроме того, часто замены аминокис
для белков дикого типа, может существенно
лотных остатков приводят к неправильному
влиять на процессы амилоидной трансформа
сворачиванию белковой глобулы и такие белки,
ции, к которой склонны многие естественно
формирующие ненативные структуры, подвер
развернутые белки, участвующие в возникнове
гаются протеолитическому расщеплению. Од
нии и развитии нейродегенеративных заболева
нако, как показывают приведенные в предыду
ний амилоидной природы. Таким образом, при
щем разделе примеры [21, 22], в некоторых слу
моделировании in vitro амилоидной трансфор
чаях образуются значительные количества мутант
мации белков следует обязательно учитывать
ных белков, содержащих замены аминокислот
возможность присутствия в препаратах мутант
ных остатков. Возможно, накопление мутантно
ных форм, содержащих замены аминокислот
го альфа синуклеина в описанных примерах об
ных остатков из за ошибок, появляющихся на
легчается тем, что он относится к так называе
стадии трансляции.
мым «естественно развернутым белкам», и его
деградация не регулируется характерными для
глобулярных белков механизмами.
РЕДАКТИРОВАНИЕ МАТРИЧНОЙ РНК
При исследовании рекомбинантного мутант
АДЕНОЗИНДЕЗАМИНАЗАМИ У ЭУКАРИОТ
ного альфа синуклеина, содержащего цистеи
новый остаток в 136 м положении, было пока
Редактирование матричной РНК аденозин
зано, что для такого белка не характерна амило
дезаминами было обнаружено у различных
идная трансформация. Более того, мутантный
эукариотических организмов более 20 лет на
альфа синуклеин препятствовал формирова
зад [23-25]. Этот фермент, а точнее несколько
нию амилоидных фибрилл нативными формами
ферментов, отличающихся по субстратной спе
альфа синуклеина [22]. Вполне возможно, что
цифичности, дезаминируют остатки аденозина
некоторые результаты, полученные на препара
с образованием инозина. В процессе трансля
тах рекомбинантного альфа синуклеина, содер
ции инозиновый остаток опознается как гуано
жащего примеси мутантной формы с заменами
зиновый, что приводит к изменению информа
Tyr136Cys, некорректны из за воздействия му
ционного значения триплета. Редактированию
тантной формы на трансформацию альфа си
матричной РНК аденозиндезаминазами посвя
нуклеина дикого типа. К сожалению, принятые
щено много экспериментальных статей, в том
процедуры оценки гомогенности препаратов ре
числе обзорных [26, 27], включая подробный
комбинантных белков, включающие только
анализ проблемы в статье Ключниковой и со
проведение электрофореза в денатурирующих
авт. [28]. По этой причине мы не будем останав
условиях в присутствии бета меркаптоэтанола,
ливаться на редактировании матричной РНК
не позволяют выявить примесь соединенных
аденозиндезаминазами в целом, а рассмотрим
дисульфидными связями полипептидных це
только те аспекты, которые связаны c редакти
пей. Более того, при масс спектрометрии не
рованием, вызывающим замены тирозиновых
всегда легко обнаружить такие замены, исследуя
остатков на цистеиновые в амилоидогенных
БИОХИМИЯ том 87 вып. 2 2022
210
МУРОНЕЦ и др.
белках, связанных с нейродегенеративными за
мен тирозиновых остатков на цистеиновые в
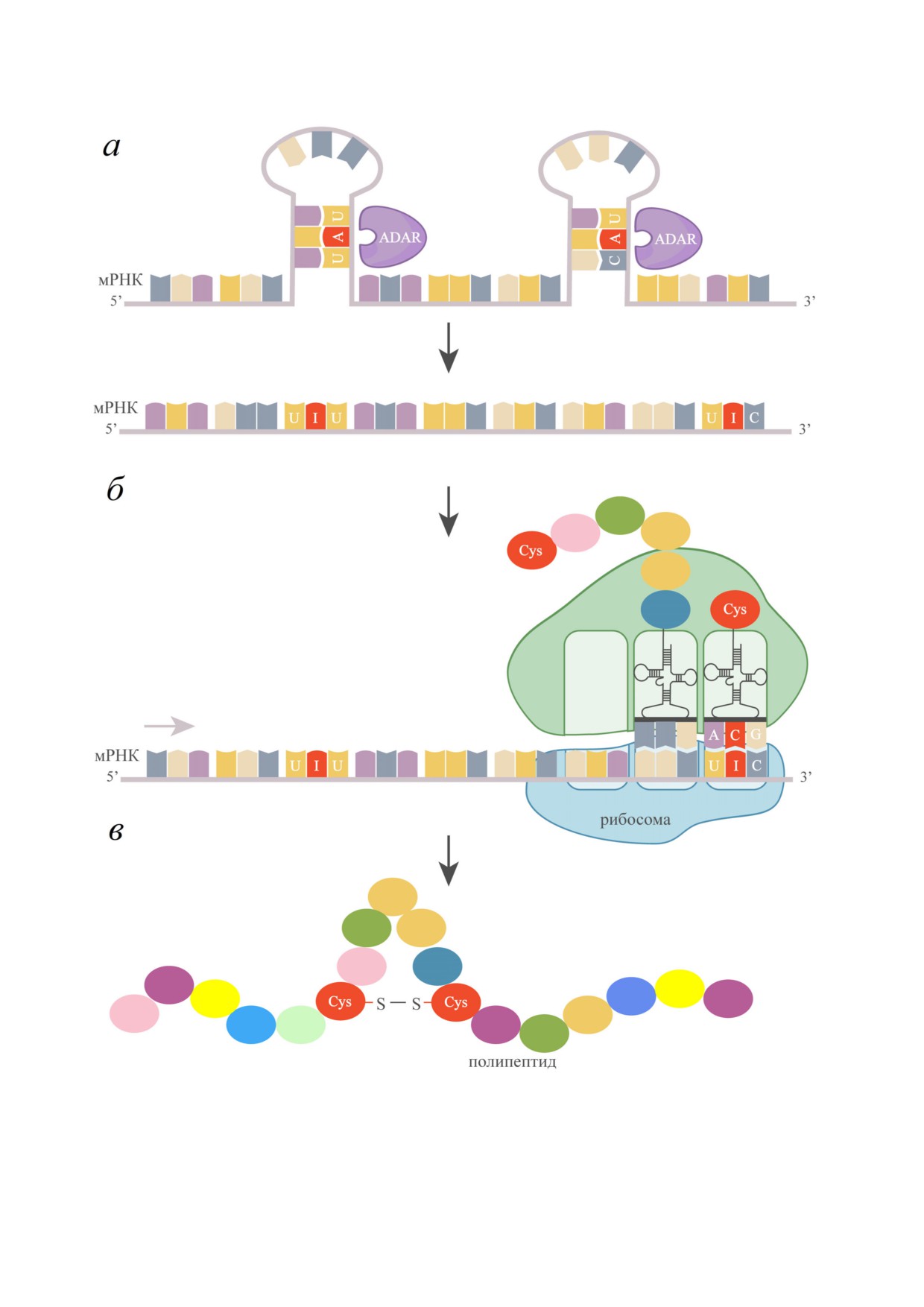
болеваниями. Схема замены тирозиновых ос
амилоидогенных белках на нейродегенератив
татков на цистеиновые в результате редактиро
ные процессы.
вания мРНК аденозиндезаминазами представ
Развитие методов секвенирования нового
лена на рис. 2. Тирозиновые остатки в мРНК ко
поколения резко ускорило выявление сайтов за
дируются двумя триплетами (UAU и UAС) и,
мены аденозина на инозин: так, в существую
следовательно, при дезаминировании аденози
щих базах данных зарегистрированы миллионы
на в любом из них возможна замена остатков ти
таких потенциальных сайтов редактирования,
розина на остатки цистеина, кодируемого трип
предсказанных на основе данных RNA seq. Од
летами UGU и UGC. На первом этапе в резуль
на из таких баз данных, REDIportal [35], собра
тате редактирования ADAR происходит замена
на из позиций, для которых секвенированием
аденозинового остатка на инозиновый. Затем
была выявлена замена A на G, при условии, что
инозиновый остаток считывается тРНКCys как
ранее в геномных данных не была показана та
гуанозиновый, что приводит к появлению в по
кая однонуклеотидная вариация. На наш
липептидной цепи цистеинового аминокислот
взгляд, пристальное внимание следует обратить
ного остатка вместо тирозинового. Такая замена
на сайты редактирования в генах, кодирующих
может приводить к образованию новых дисуль
естественно развернутые белки. Во первых,
фидных связей в продукте трансляции, причем
именно такие белки склонны к амилоидной
как внутриполипептидных (рис. 2, в), так и меж
трансформации и связаны с нейродегенератив
полипептидных.
ными процессами, а, во вторых, они в меньшей
Как показывают эксперименты на рекомби
степени будут подвержены деградации в клетке,
нантных белках, описанные в предыдущих раз
чем глобулярные белки, не способные свернуть
делах, замены тирозиновых остатков на цистеи
ся в правильную конформацию из за замены
новые в процессе трансляции могут кардиналь
тирозиновых остатков на цистеиновые. С уче
но изменять амилоидную трансформацию есте
том специфичного взаимодействия редактиру
ственно развернутых белков. Следовательно,
ющих ферментов ADAR1 и ADAR2 с двуцепо
такое изменение их трансформации может про
чечной РНК, с помощью алгоритма поиска по
исходить в результате редактирования мРНК
тенциальных шпилек в структуре мРНК генов
аденозиндезаминазами из за появления мутант
человека было выявлено более тысячи тирози
ных форм белков с дополнительным остатком
новых кодонов UAC, которые могут представ
цистеина.
лять потенциальную мишень для аденозиндеза
Анализ литературных данных указывает, что
миназ. Среди генов, содержащих такие кодоны,
аденозиндезаминазы ADAR1, ADAR2 и ADAR3
оказалось 19 тех, что кодируют белки с неструк
вовлечены в патогенез неврологических и ней
турированными участками, зарегистрирован
родегенеративных заболеваний [29]. В частнос
ными в базе данных DisProt [36]. При этом два
ти, изменения в профилях редактирования
из найденных генов ассоциированы с нейроге
мРНК показаны при болезнях, для которых ха
незом: белок Protein numb homolog (h Numb,
рактерно образование телец включения, таких
идентификатор UniProt P49757) и белок Paired
как болезнь Альцгеймера и Гентингтона [30, 31].
box protein Pax 6 (идентификатор UniProt
Для большинства случаев неврологических за
P26367). Важно отметить, что в состав белка
болеваний показано общее снижение числа за
h Numb исходно входит четное число цистеино
мен аденозина на инозин. Для образцов мозга
вых остатков, что позволяет предполагать, что
пациентов с диагнозом болезнь Альцгеймера
редактирование мРНК в данном случае может
или Гентингтона зарегистрировано уменьшение
приводить к появлению нечетного числа цисте
редактирования в позиции, приводящее к заме
иновых остатков и формированию димеров за
не 607 остатка глутамина на аргинин в субъеди
счет образования межполипептидных дисуль
нице GluA2 ионотропного рецептора глутамата,
фидных связей. Возникновение таких «попереч
что, как полагают, приводит к гибели мотоней
ных сшивок» может быть вовлечено в формиро
ронов [32]. Число генов, для мРНК которых по
вание прочных белковых агрегатов, характер
казано значимое снижение числа замен адено
ных для амилоидных заболеваний. Если же су
зина на инозин в процессе развития упомянутых
зить поиск и обратиться к базе данных RADAR
нейродегенеративных заболеваний, растет [33],
[37], содержащей установленные ранее сайты
причем описаны позиции, приводящие к замене
редактирования РНК, то количество потенци
тирозина на цистеин, как, например, Tyr571Cys
альных кандидатов станет еще меньше. Среди
в субъединице GluR6 ионотропного рецептора
белков, для которых было установлено редакти
глутамата [34]. Однако пока отсутствуют пря
рование UAC кодона, лишь один можно отнес
мые экспериментальные данные о влиянии за
ти к естественно развернутым белкам, связан
БИОХИМИЯ том 87 вып. 2 2022
ЗАМЕНЫ ТИРОЗИНОВЫХ ОСТАТКОВ В АМИЛОИДОГЕННЫХ БЕЛКАХ
211
Рис. 2. Дезаминирование остатков аденозина мРНК аденозиндезаминазами (ADAR) у эукариот. а - Замена аденозиново
го остатка на инозиновый в результате редактирования ADAR. б - Считывание инозинового остатка тРНКCys как гуано
зинового и появление в полипептидной цепи цистеинового аминокислотного остатка вместо тирозинового. в - Образо
вание дисульфидных связей в продукте трансляции
БИОХИМИЯ том 87 вып. 2 2022
212
МУРОНЕЦ и др.
ным с нейродегенерацией - белок септин 4
цессе их патологической трансформации. Такие
(идентификатор UniProt O43236). Однако экс
изменения возникают из за необычных свойств
периментальные данные о том, что септин 4
цистеиновых остатков, а именно их способнос
действительно может синтезироваться в мутант
ти подвергаться окислению и другим модифика
ной форме, есть только на уровне транскрипто
циям (нитрозилирование, алкилирование и др.),
ма [38]. Можно было предположить, что обнару
а также образовывать дисульфидные связи. При
женные при продукции альфа синуклеина в
этом формирование дисульфидных связей мо
E. coli замены Tyr Cys могут возникнуть и в эука
жет как стабилизировать амилоидные агрегаты
риотических организмах в результате редактиро
за счет «поперечной сшивки» полипептидных
вания мРНК. Тем не менее наши попытки найти
цепей, так и препятствовать их амилоидной
замены Tyr136Cys в альфа синуклеине при его
трансформации из за образования димерных и
продукции в эукариотических клетках (нейро
олигомерных форм, не склонных к такому типу
бластомы) оказались безрезультатными [39].
агрегации.
Для изучения последствий редактирования
Единичные наблюдения о замене тирозино
РНК на белковом уровне оптимальным подхо
вых остатков на цистеиновые в амилоидогенных
дом является масс спектрометрическая протео
белках при их продукции в бактериальных сис
мика, преимущества которой подробно описа
темах требуют, на наш взгляд, особого внима
ны в специальном обзоре [28]. Однако именно
ния. Так как в препаратах рекомбинантных бел
при изучении замен Tyr Cys в белках могут воз
ков содержание мутантных форм с дополни
никнуть определенные сложности, а именно,
тельными цистеиновыми остатками может дос
при проведении таких исследований следует
тигать 50%, то процесс их амилоидной транс
учитывать все возможные посттрансляционные
формации может существенно изменяться. Сле
модификации цистеиновых остатков (окисле
довательно, требуется проведение дополнитель
ние различной степени, образование дисуль
ного анализа, позволяющего выявить мутант
фидных связей, нитрозилирование, алкилиро
ные белки, содержащие остатки цистеина, и,
вание). Предотвратить возникновение разнооб
при необходимости, очистить от них рекомби
разных продуктов модификации можно с по
нантные белки дикого типа. Только после про
мощью предварительной обработки белков
ведения таких процедур можно избавиться от
йодацетатом для получения карбоксиметилиро
возможных артефактов, возникающих при изу
ваннных форм. Таким образом, при проведении
чении патологической трансформации амилои
масс спектрометрических исследований необ
догенных белков из за присутствия в них мутант
ходимо прицельно искать предполагаемые заме
ных форм.
ны Tyr Cys, а не проводить стандартный анализ.
Изучение роли посттранскрипционных за
Вероятно, оптимальным был бы подход с пред
мен тирозиновых остатков на цистеиновые в
варительным биоинформатическим анализом
амилоидогенных белках, происходящих в ре
для выявления потенциальных белков кандида
зультате дезаминирования мРНК специальными
тов. Такой анализ позволил бы оценить, в каких
ферментами, находится на начальной стадии.
белках, связанных с процессами нейродегенера
Хотя о роли редактирования мРНК, особенно в
ции, могут происходить замены Tyr Cys вслед
функционировании нервных тканей, в целом из
ствие редактирования мРНК аденозиндезами
вестно достаточно много, информация о влия
назами. Это позволило бы затем отобрать наи
нии такого типа замен (Tyr Cys) в амилоидоген
более перспективные кандидаты для последую
ных белках на нейродегенеративные процессы
щей экспериментальной проверки как с по
отсутствует. При этом известно, что появление в
мощью масс спектрометрического анализа, так
составе амилоидных белков дополнительных
и других подходов, включая работу с клеточны
цистеиновых остатков существенно изменяет их
ми культурами и анализ особенностей патологи
способность к патологической трансформа
ческой трансформации амилоидогенных белков
ции [40, 41]. В целом, дисульфидные связи ста
с выявленными заменами.
билизируют амилоидные фибриллы, а в случае
прионных белков их образование является од
ним из механизмов трансформации белка в ин
ЗАКЛЮЧЕНИЕ
фекционную форму [42-46]. В бета амилоидном
пептиде, альфа синуклеине, тау белке и хантинг
В обзоре мы обсудили в основном механиз
тине дикого типа нет цистеиновых остатков. Од
мы посттранскрипционных замен тирозиновых
нако введение в эти белки цистеиновых остат
остатков на цистеиновые в амилоидогенных
ков, вызывающих образование межполипептид
белках, поскольку именно такие замены могут
ных и/или внутриполипептидных связей, при
приводить к существенным изменениям в про
водит к кардинальному изменению процесса их
БИОХИМИЯ том 87 вып. 2 2022
ЗАМЕНЫ ТИРОЗИНОВЫХ ОСТАТКОВ В АМИЛОИДОГЕННЫХ БЕЛКАХ
213
амилоидной трансформации. Эффекты, возни
представляется важным для понимания меха
кающие при введении остатков цистеина, зави
низмов возникновения и развития нейродегене
сят как от количества замен, так и от их локали
ративных заболеваний.
зации. Некоторые замены ускоряют амилоидои
зацию, например, за счет образования димер
Финансирование. Работа выполнена при фи
ных форм альфа синуклеина [47, 48] или дрож
нансовой поддержке Российского фонда фунда
жевого приона Sup35 [49]. Другие препятствуют
ментальных исследований (проект № 19 04
формированию амилоидных структур: напри
00421).
мер, альфа синуклеин с заменой Tyr136Cys [22],
Конфликт интересов. Авторы заявляют об от
альфа синуклеин с тремя дисульфидными свя
сутствии конфликта интересов.
зями [50]. Таким образом, хотя точно предска
Соблюдение этических норм. Настоящий об
зать эффекты от замены Tyr Cys сложно, но изу
зор не содержит описания каких либо исследо
чение роли редактирования мРНК, приводящее
ваний с участием людей или животных в качест
к таким заменам в амилоидогенных белках, ве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Nishikura, K. (2010) Functions and regulation of RNA
11.
Wohlgemuth, I., Garofalo, R., Samatova, E., Günenç,
editing by ADAR deaminases, Annu. Rev. Biochem., 79,
A. N., Lenz, C., et al. (2021) Translation error clusters
321 349, doi:
10.1146/annurev biochem 060208
induced by aminoglycoside antibiotics, Nat. Commun., 12,
105251.
1830, doi: 10.1038/s41467 021 21942 6.
2.
Chen, C. X., Cho, D. S., Wang, Q., Lai, F., Carter, K. C.,
12.
Zhang, J., Pavlov, M. Y., and Ehrenberg, M. (2018)
et al. (2000) A third member of the RNA specific adeno
Accuracy of genetic code translation and its orthogonal
sine deaminase gene family, ADAR3, contains both single
corruption by aminoglycosides and Mg2+ ions, Nucleic
and double stranded RNA binding domains, RNA, 6, 755
Acids Res., 46, 1362 1374, doi: 10.1093/nar/gkx1256.
767, doi: 10.1017/s1355838200000170.
13.
Garofalo, R., Wohlgemuth, I., Pearson, M., Lenz, C.,
3.
Sinigaglia, K., Wiatrek, D., Khan, A., Michalik, D.,
Urlaub, H., et al. (2019) Broad range of missense error fre
Sambrani, N., et al. (2019) ADAR RNA editing in innate
quencies in cellular proteins, Nucleic Acids Res., 47, 2932
immune response phasing, in circadian clocks and in sleep,
2945, doi: 10.1093/nar/gky1319.
Biochim. Biophys. Acta, 1862, 356 369, doi: 10.1016/j.bbagrm.
14.
McNulty, D. E., Claffee, B. A., Huddleston, M. J., Porter,
2018.10.011.
M. L., Cavnar, K. M., et al. (2003) Mistranslational errors
4.
Roth, S. H., Danan Gotthold, M., Ben Izhak, M.,
associated with the rare arginine codon CGG in
Rechavi, G., Cohen, C. J., et al. (2018) Increased RNA
Escherichia coli, Protein Express. Purif., 27, 365 374,
editing may provide a source for autoantigens in systemic
doi: 10.1016/s1046 5928(02)00610 1.
lupus erythematosus, Cell Rep., 23, 50 57, doi: 10.1016/
15.
Calderone, T. L., Stevens, R. D., and Oas, T. G. (1996)
j.celrep.2018.03.036.
High level misincorporation of lysine for arginine at AGA
5.
Silvestris, D. A., Picardi, E., Cesarini, V., Fosso, B.,
codons in a fusion protein expressed in Escherichia coli,
Mangraviti, N., et al. (2019) Dynamic inosinome profiles
J. Mol. Biol., 262, 407 412, doi: 10.1006/jmbi.1996.0524.
reveal novel patient stratification and gender specific dif
16.
Huang, Y., O’Mara, B., Conover, M., Ludwig, R., Fu, J.,
ferences in glioblastoma, Genome Biol.,
20,
33,
et al. (2012) Glycine to glutamic acid misincorporation
doi: 10.1186/s13059 019 1647 x.
observed in a recombinant protein expressed by Escherichia
6.
Costa Cruz, P. H., and Kawahara, Y. (2021) RNA Editing
coli cells, Protein Sci., 21, 625 632, doi: 10.1002/pro.2046.
in Neurological and Neurodegenerative Disorders, in RNA
17.
Liu, Y., Sharp, J. S., Do, D. H. T., Kahn, R. A.,
Editing (Picardi, E., and Pesole, G., eds.) Springer US,
Schwalbe, H., et al. (2017) Mistakes in translation:
New York, NY, pp. 309 330, doi: 10.1007/978 1 0716
Reflections on mechanism, PLoS One, 12, e0180566,
0787 9_18.
doi: 10.1371/journal.pone.0180566.
7.
Parker, J. (1989) Errors and alternatives in reading the uni
18.
Zimmerman, S. M., Kon, Y., Hauke, A. C., Ruiz, B. Y.,
versal genetic code, Microbiol. Rev.,
53,
273298,
Fields, S., et al. (2018) Conditional accumulation of toxic
doi: 10.1128/mr.53.3.273 298.
tRNAs to cause amino acid misincorporation, Nucleic
8.
Loftfield, R. B., and Vanderjagt, D. (1972) The frequency
Acids Res., 46, 7831 7843, doi: 10.1093/nar/gky623.
of errors in protein biosynthesis, Biochem. J., 128, 1353
19.
Kramer, E. B., Vallabhaneni, H., Mayer, L. M., and
1356, doi: 10.1042/bj1281353.
Farabaugh, P. J. (2010) A comprehensive analysis of trans
9.
Khazaie, K., Buchanan, J. H., and Rosenberger, R. F.
lational missense errors in the yeast Saccharomyces cere
(1984) The accuracy of Qbeta RNA translation. 1. Errors
visiae, RNA, 16, 1797 1808, doi: 10.1261/rna.2201210.
during the synthesis of Qbeta proteins by intact Escherichia
20.
Rice, J. B., Seyer, J. J., and Reeve, J. N.
(1986)
coli cells, Eur. J. Biochem., 144, 485 489, doi: 10.1111/
Identification of sites of cysteine misincorporation during
j.1432 1033.1984.tb08491.x.
in vivo synthesis of bacteriophage T7 0.3 protein, Biochim.
10.
Kramer, E. B., and Farabaugh, P. J. (2007) The frequency
Biophys. Acta,
867,
5766, doi:
10.1016/0167
of translational misreading errors in E. coli is largely deter
4781(86)90029 1.
mined by tRNA competition, RNA, 13, 87 96, doi: 10.1261/
21.
Masuda, M., Dohmae, N., Nonaka, T., Oikawa, T.,
rna.294907.
Hisanaga, S., et al. (2006) Cysteine misincorporation in
БИОХИМИЯ том 87 вып. 2 2022
214
МУРОНЕЦ и др.
bacterially expressed human α synuclein, FEBS Lett., 580,
iments, Nucleic Acids Res., 49, D1012 9, doi: 10.1093/
1775 1779, doi: 10.1016/j.febslet.2006.02.032.
nar/gkaa916.
22.
Barinova, K. V., Kuravsky, M. L., Arutyunyan, A. M.,
36.
Hatos, A., Hajdu Soltész, B., Monzon, A. M.,
Serebryakova, M. V., Schmalhausen, E. V., et al. (2017)
Palopoli, N., Álvarez, L., et al. (2019) DisProt: Intrinsic
Dimerization of Tyr136Cys alpha synuclein prevents amy
protein disorder annotation in 2020, Nucleic Acids Res.,
loid transformation of wild type alpha synuclein,
gkz975, doi: 10.1093/nar/gkz975.
Int. J. Biological Macromol., 96, 35 43, doi: 10.1016/
37.
Ramaswami, G., and Li, J. B. (2014) RADAR: A rigorous
j.ijbiomac.2016.12.011.
ly annotated database of A to I RNA editing, Nucleic Acids
23.
Kim, U., Wang, Y., Sanford, T., Zeng, Y., and
Res., 42, D109 13, doi: 10.1093/nar/gkt996.
Nishikura, K. (1994) Molecular cloning of cDNA for dou
38.
Picardi, E., D’Erchia, A. M., Lo Giudice, C., and
ble stranded RNA adenosine deaminase, a candidate
Pesole, G. (2017) REDIportal: A comprehensive database
enzyme for nuclear RNA editing, Proc. Natl. Acad. Sci.
of A to I RNA editing events in humans, Nucleic Acids
USA, 91, 11457 11461, doi: 10.1073/pnas.91.24.11457.
Res., 45, D750 7, doi: 10.1093/nar/gkw767.
24.
Kim, U., and Nishikura, K. (1993) Double stranded RNA
39.
Pozdyshev, D. V., Melnikova, A. K., Barinova, K. V.,
adenosine deaminase as a potential mammalian RNA edit
Schmalhausen, E. V., and Muronetz, V. I.
(2020)
ing factor, Semin. Cell Biol., 4, 285 293, doi: 10.1006/
Differences in the synthesis of recombinant α synuclein in
scel.1993.1034.
pro and eukaryotic organisms: Possibility of Tyr136Cys
25.
Maas, S., Melcher, T., and Seeburg, P. H.
(1997)
substitution, Curr. Top. Peptide Prot. Res., 21, 75 81.
Mammalian RNA dependent deaminases and edited
40.
Feughelman, M., andWillis, B. K. (2000) Thiol disulfide
mRNAs, Curr. Opin. Cell Biol., 9, 343 349, doi: 10.1016/
interchange a potential key to conformational change asso
S0955 0674(97)80006 3.
ciated with amyloid fibril formation, J. Theor. Biol., 206,
26.
Yuting, K., Ding, D., and Iizasa, H. (2021) Adenosine to
313 315, doi: 10.1006/jtbi.2000.2112.
Inosine RNA Editing Enzyme ADAR and microRNAs,
41.
Li, Y., Yan, J., Zhang, X., and Huang, K. (2013) Disulfide
Methods Mol. Biol., 2181, 83 95, doi: 10.1007/978 1 0716
bonds in amyloidogenesis diseases related proteins,
0787 9_6.
Proteins, 81, 1862 1873, doi: 10.1002/prot.24338.
27.
Mallela, A., and Nishikura, K. (2012) A to I editing of
42.
Maiti, N. R., and Surewicz, W. K. (2001) The role of disul
protein coding and noncoding RNAs, Crit. Rev. Biochem.
fide bridge in the folding and stability of the recombinant
Mol. Biol., 47, 493 501, doi: 10.3109/10409238.2012.
human prion protein, J. Biol. Chem., 276, 2427 2431,
714350.
doi: 10.1074/jbc.M007862200.
28.
Kliuchnikova, A. A., Kuznetsova, K. G., and Moshkovskii,
43.
Lee, S., and Eisenberg, D. (2003) Seeded conversion of
S. A. (2016) ADAR mediated messenger RNA editing:
recombinant prion protein to a disulfide bonded oligomer
Analysis at the proteome level, Biochemistry (Moscow),
by a reduction oxidation process, Nat. Struct. Biol., 10,
Suppl. Series B Biomed. Chem., 11, 32 42, doi: 10.18097/
725 730, doi: 10.1038/nsb961.
PBMC20166205510.
44.
Hosszu, L. L. P., Trevitt, C. R., Jones, S., Batchelor, M.,
29.
Maas, S., Kawahara, Y., Tamburro, K. M., and
Scott, D. J., et al. (2009) Conformational properties of
Nishikura, K. (2006) A to I RNA editing and human dis
beta PrP, J. Biol. Chem., 284, 21981 21990, doi: 10.1074/
ease, RNA Biol., 3, 1 9, doi: 10.4161/rna.3.1.2495.
jbc.M809173200.
30.
Gaisler Salomon, I., Kravitz, E., Feiler, Y., Safran, M.,
45.
Welker, E., Wedemeyer, W. J., and Scheraga, H. A. (2001)
Biegon, A., et al. (2014) Hippocampus specific deficiency
A role for intermolecular disulfide bonds in prion diseases?
in RNA editing of GluA2 in Alzheimer’s disease,
Proc. Natl. Acad. Sci. USA,
98,
43344336,
Neurobiol. Aging, 35, 1785 1791, doi: 10.1016/j.neurobio
doi: 10.1073/pnas.071066598.
laging.2014.02.018.
46.
Mehlhorn, I., Groth, D., Stöckel, J., Moffat, B.,
31.
Akbarian, S., Smith, M. A., and Jones, E. G. (1995)
Reilly, D., et al. (1996) High level expression and charac
Editing for an AMPA receptor subunit RNA in prefrontal
terization of a purified 142 residue polypeptide of the prion
cortex and striatum in Alzheimer’s disease, Huntington’s
protein, Biochemistry, 35, 55285537, doi: 10.1021/
disease and schizophrenia, Brain Res., 699, 297 304,
bi952965e.
doi: 10.1016/0006 8993(95)00922 D.
47.
Suk, J. E., Lokappa, S. B., and Ulmer, T. S. (2010) The
32.
Hosaka, T., Tsuji, H., and Kwak, S. (2021) RNA editing: A
clustering and spatial arrangement of beta sheet sequence,
new therapeutic target in amyotrophic lateral sclerosis and
but not order, govern alpha synuclein fibrillogenesis,
other neurological diseases, Int. J. Mol. Sci., 22, 10958,
Biochemistry, 49, 1533 1540, doi: 10.1021/bi901753h.
doi: 10.3390/ijms222010958.
48.
Zhou W., and Freed, C. R. (2004) Tyrosine to cysteine
33.
Khermesh, K., D’Erchia, A. M., Barak, M., Annese, A.,
modification of human alpha synuclein enhances protein
Wachtel, C., et al. (2016) Reduced levels of protein recod
aggregation and cellular toxicity, J. Biol. Chem., 279,
ing by A to I RNA editing in Alzheimer’s disease, RNA,
10128 10135, doi: 10.1074/jbc.M307563200.
22, 290 302, doi: 10.1261/rna.054627.115.
49.
Krishnan, R., and Lindquist, S. L. (2005) Structural
34.
Lo Giudice, C., Tangaro, M. A., Pesole, G., and
insights into a yeast prion illuminate nucleation and strain
Picardi, E. (2020) Investigating RNA editing in deep
diversity, Nature,
435,
765 772, doi:
10.1038/
transcriptome datasets with REDItools and REDIportal,
nature03679.
Nat. Protocols, 15, 1098 1131, doi: 10.1038/s41596 019
50.
Hong, D. P., Xiong, W., Chang, J. Y., and Jiang, C. (2011)
0279 7.
The role of the C terminus of human α synuclein: Intra
35.
Mansi, L., Tangaro, M. A., Lo Giudice, C., Flati, T.,
disulfide bonds between the C terminus and other regions
Kopel, E., et al. (2021) REDIportal: Millions of novel A
stabilize non fibrillar monomeric isomers, FEBS Lett.,
to I RNA editing events from thousands of RNAseq exper
585, 561 566, doi: 10.1016/j.febslet.2011.01.009.
БИОХИМИЯ том 87 вып. 2 2022
ЗАМЕНЫ ТИРОЗИНОВЫХ ОСТАТКОВ В АМИЛОИДОГЕННЫХ БЕЛКАХ
215
POST TRANSCRIPTIONAL TYROSINE SUBSTITUTIONS
FOR CYSTEINE IN AMYLOIDOGENIC PROTEINS
Mini Review
V. I. Muronetz1,2*, D. V. Pozdyshev1, M. V. Medvedeva2, and I. A. Sevostyanova1
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e mail: vimuronets@belozersky.msu.ru
2 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119991 Moscow, Russia
The review considers the reasons and consequences of post transcriptional tyrosine substitutions for cysteine residues.
The main attention is paid to Tyr Cys substitutions that arise during gene expression in bacterial systems at the stage
of protein translation as a result of similar mRNA codons misrecognition. Notably, if translation errors generally
occur relatively rarely - from 10-3 to 10-4 errors per codon for E. coli, then in some cases the error rate increases sig
nificantly. For example, for certain pairs of codons, when the culture conditions change or in the presence of antibi
otics. Thus, with the overproduction of recombinant human alpha synuclein in E. coli cells, the content of the mutant
form with the replacement of 136 tyrosine residue (UAC codon) with a cysteine residue (UGC codon) can reach 50%.
Possible reasons for the increased production of alpha synuclein with Tyr136Cys substitutions are considered, as well
as the consequences of the presence of mutant forms in preparations of amyloidogenic proteins when studying their
pathological transformation in vitro. A separate section is devoted to Tyr Cys substitutions occurring due to adenosine
deaminases mRNA editing, typical for eukaryotic organisms, and the possible role of this process in the amyloid trans
formation of proteins associated with neurodegenerative diseases.
Keywords: amyloidogenic proteins, translation errors, Tyr Cys substitutions
БИОХИМИЯ том 87 вып. 2 2022