БИОХИМИЯ, 2022, том 87, вып. 2, с. 289 - 304
УДК 577.24;577.217;577.25
В ФОКУСЕ МОЛЕКУЛЯРНЫЕ ФУНКЦИИ
АНТИВОЗРАСТНОЙ ДЕАЦЕТИЛАЗЫ SIRT3
© 2022
Jarmila Nahálková
Biochemistry, Molecular, and Cell Biology Unit, Biochemworld Co., 74394 Skyttorp,
Uppsala County, Sweden; e mail: jarmila.nahalkova@biochemworld.net
Поступила в редакцию 11.11.2021
После доработки 20.12.2021
Принята к публикации 22.12.2021
Белок сиртуин 3 (SIRT3) представляет собой лизиндеацетилазу, играющую важную роль в поддержании це
лостности митохондрий, являющихся уязвимой мишенью при многих заболеваниях. Интересно, что кле
точное старение может быть обращено только лишь путём суперэкспрессии SIRT3, что вызывает много
вопросов о роли SIRT3 в молекулярных механизмах борьбы со старением. Анализ функционирования
SIRT3 мы провели на основе имеющихся данных по взаимодействию 407 субстратов этого белка. Результа
ты изучения многообразия путей и прогнозирования функций генов подтвердили роль SIRT3 в первичном
метаболизме и производстве ATP митохондриями. Кроме того, SIRT3, предположительно, задействован в
термогенезе, при развитии дегенеративных заболеваний головного мозга, таких как болезнь Альцгеймера,
болезнь Паркинсона, болезнь Хантингтона, а также неалкогольной жировой болезни печени. Приоритиза
ция белков в узлах исследуемого пути продемонстрировала, что субъединицы комплекса I дыхательной цепи
митохондрий (MRC) являются основными регуляторными точками во всей сети взаимодействий. Дополни
тельными приоритетными узлами оказались субъединица сукцинатдегидрогеназы B (SDHB) комплекса II и
ATP5F1 комплекса V MRC. Проведенный анализ подтверждает существование NADH/NAD+ зависимой
регуляторной петли обратной связи между SIRT3, комплексом I MRC и ацетил КоА синтетазами, а также
наличие ядерных субстратов SIRT3. Малоисследованные функции субстратов SIRT3, таких как LMNA и
LMNB, HIF 1α, p53, DNA PK и PARK7, отмечены как перспективные для дальнейших научных исследо
ваний. SIRT3 действует как репрессор BACE1 через SIRT3 LKB1 AMPK CREB PGC1A PPARG BACE1
(SIRT3 BACE1), функции которого наилучшим образом соответствуют механизмам циркадного ритма.
Формируется новая рабочая гипотеза терапевтической мишени для лечения болезни Альцгеймера. Также
обозначены другие важные пути терапевтических вмешательств, ассоциированные с активностью SIRT3.
КЛЮЧЕВЫЕ СЛОВА: SIRT3, NAD+ зависимая деацетилаза, сеть белковых взаимодействий, анализ обога
щения путей, старение, дыхательная цепь транспорта электронов, митохондрии, возрастные заболевания.
DOI: 10.31857/S0320972522020105
ВВЕДЕНИЕ
Семейство белков сиртуинов известно бла
годаря его функциональной связи со старением
Обращение вспять процесса старения или,
и возрастными заболеваниями, а также особым
по крайней мере, его отсрочка - очень амбици
свойствам сиртуина 3 (SIRT3), NAD+ зависи
озная задача для многих поколений ученых. С
мой лизиндеацетилазы, играющей важную роль
точки зрения общественного здравоохранения,
в защите целостности митохондрий. Экспери
желаемым результатом была бы не возможность
менты на SIRT3 нокаутных (SIRT3 KO) мышах
продления общей продолжительности жизни
продемонстрировали гиперацетилирование
человека, а сохранение здоровья людей пожило
большинства митохондриальных белков этих
го возраста.
мышей, тем самым подтверждая роль SIRT3 как
основной митохондриальной деацетилазы [1].
Нокаутные по SIRT3 мыши демонстрируют по
Принятые сокращения: БА - болезнь Альцгеймера;
БП - болезнь Паркинсона; БХ - болезнь Хантингтона; тенциальную активность этого белка в контекс
НАЖБП - неалкогольная жировая болезнь печени; те возрастных заболеваний, поскольку у этих
ТБЖ - ткань бурого жира; цикл TCA - цикл трикарбоно
животных развивается целый ряд болезней,
вых кислот; АРР
- предшественник бета амилоида;
BACE1 - бета секретаза 1; СС - циркадные часы (circadi
включая рак, нейродегенеративные и сердечно
an clock); CR - ограничение калорий (calorie restriction);
сосудистые заболевания, а также нарушения ме
LMNA - ламин A/C; MRC - дыхательная цепь митохонд таболизма [2]. Такие мыши демонстрируют из
рий; NHEJ
- негомологичное соединение концов;
менения энергетики митохондрий и синтеза
OXPHOS - окислительное фосфорилирование; PDH - пи
руватдегидрогеназа; ROS - активные формы кислорода;
ATP, сопровождающиеся повышенным ацети
wt - дикий тип.
лированием митохондриальных белков, вклю
289
290
NAHÁLKOVÁ
чая Mn зависимую супероксиддисмутазу, кото
МАТЕРИАЛЫ И МЕТОДЫ
рая в таком состоянии теряет способность защи
щать от возросшего количества активных форм
Список субстратов SIRT3. Субстраты SIRT3
кислорода (ROS). Этот процесс в конечном сче
были подобраны из литературных источников
те приводит к канцерогенезу, и, таким образом,
[4, 9-29], которые, в частности, включали круп
SIRT3 действует как опухолевый супрессор, по
номасштабные протеомные исследования
скольку его отсутствие запускает онкогенез [3].
[30-32] (табл. S1 и S2 в Приложении). В одном
SIRT3 играет решающую роль в регулировании
из исследований были выявлены дифференци
биоэнергетики митохондрий, которая активиру
ально ацетилированные митохондриальные
ется питательными веществами и физическими
белки, выделенные из печени мышей дикого ти
упражнениями [4]. Уровень экспрессии сиртуи
па (wt) и нокаутных по SIRT3 мышей
на 3 снижается в сенесцентных стволовых клет
(SIRT3 KO) с помощью жидкостной хромато
ках человека (HSC s) [5], в клетках лобных до
графии и масс спектрометрии (ЖХ/МС). Для
лей и гиппокампе старых крыс [6]. Интересно,
анализа были отобраны субстраты SIRT3 с дву
что старение клеток HSC может быть обращено
кратным повышением уровня ацетилирования у
только лишь путем сверхэкспрессии SIRT3, что
мышей SIRT3 KO по сравнению с мышами ди
свидетельствует о важной роли этого белка в
кого типа (p = 0,01) [30]. Затем была использова
клеточных механизмах борьбы со старением [5].
на наносистема ЖХ/МС с обращенной фазой
SIRT3 также действует как нейропротектор, за
для идентификации субстратов SIRT3 из мито
щищая митохондрии путем подавления продук
хондриального ацетилома печени мышей дико
ции ROS, предотвращая снижение мембранного
го типа и SIRT3 KO. Для дальнейшего анализа
потенциала в митохондриях, а также выступая в
были выбраны белки с минимум 2 кратным по
роли сенсора нейротоксических воздействий в
вышением уровня ацетилирования в SIRT3 KO
моделях болезни Альцгеймера (БА) на крысах и
мышах по сравнению с мышами дикого типа
в тканях головного мозга при БА [7].
(t критерий Уэлча с поправкой Стори < 0,01)
Для изучения молекулярного механизма
[31]. Наконец, были включены субстраты из ис
действия SIRT3 в процессе старения в настоя
следований SILAC по дифференциальному аце
щей работе исследуются взаимодействия SIRT3
тилированию белков SIRT3 KO мышей и эмбри
с его субстратами. При анализе мы использова
ональных фибробластов wt мышей, а также
ли предположение, что прямые взаимодействия
клетки U2OS с ретровирусной гиперэкспресси
белок белок говорят об их участии в одних и тех
ей SIRT3 в сравнении с клетками с сайленсин
же заболеваниях, и что взаимодействующие
гом SIRT3 с использованием shRNA (короткие
белки с высокой степенью достоверности участ
шпилечные РНК). Дифференциальным поро
вуют в идентичных клеточных и молекулярных
гом было установлено 2 кратное изменение
реакциях [8]. В работе мы использовали анализ
уровня ацетилирования для отношений
обогащения молекулярных путей с использова
SIRT3 KO/wt и SIRT3 KO/SIRT3 [32]. В оконча
нием сервиса GeneMania, работающего в среде
тельный список субстратов SIRT3, использо
Cytoscape, который был дополнен онлайн ана
ванных для анализа, вошли 407 белков (табл. S2
лизом STRING. С помощью приложений
в Приложении).
CytoHubba и CODE мы определили высокопри
Анализ GeneMania. Названия белков
оритетные белковые комплексы (узлы пути) и
субстратов SIRT3 были заменены на совмести
кластеры с основными регуляторными функци
мые с GeneMania идентификаторы с использо
ями. Результаты анализа обсуждаются в рамках
ванием баз данных UniprotKB [33] и OMIM®
антивозрастных функций фермента и его роли в
(Online Mendelian Inheritance in Man®) [34].
работе митохондрий при возрастных заболева
Анализ с использованием GeneMania (3.5.2)
ниях. Активность SIRT3 в качестве репрессора
[35-37] был выполнен в среде Cytoscape (3.7.2)
бета секретазы 1 (BACE1) посредством пути
[38] при помощи преобразованного списка
SIRT3 LKB1 AMPK CREB PGC1A PPARG
идентификаторов субстратов SIRT3, в качестве
BACE1 (SIRT3 BACE1) позволила сформиро
запроса был введен SIRT3 (табл. S2 в Приложе
вать новую рабочую гипотезу касательно регуля
нии). В анализе использовали базу данных для
ции BACE1, которая является одной из основ
H. sapiens (обновление 13 07 2017) с включени
ных терапевтических мишеней при БА. Наибо
ем всех типов взаимодействий. Целью поиска
лее важные сигнальные и метаболические пути,
было выявление 20 основных ассоциированных
связанные с активностью SIRT3, выделены в
генов и максимум 20 характерных признаков с
настоящей работе с целью дальнейших исследо
использованием GO Molecular function weight
ваний способов регулирования ее активности и
ing. Этот метод был выбран на основе высокой
разработки терапевтических вмешательств.
вероятности совпадения молекулярных функ
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
291
ций у субстратов SIRT3, поскольку в сети
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
408 белков (включая SIRT3) было выявлено 1230
белок белковых взаимодействий [8]. Категория
В настоящей работе мы исследовали анти
результатов «Consolidated pathways» («Консоли
возрастные функции основного митохондри
дированные пути») представляет собой резуль
ального белка, деацетилазы SIRT3, в контексте
тат анализа обогащения путей, который в даль
потенциальных терапевтических вмешательств.
нейшем будет использован в обсуждении.
Основная цель состояла в разработке рабочей
STRING'анализ (v. 11) [39] был выполнен он
гипотезы, основанной на анализе больших дан
лайн с использованием списка субстратов
ных, которая в дальнейшем может быть исполь
SIRT3 (табл. S2 в Приложении) в качестве зап
зована в экспериментальных исследованиях,
роса по множеству белков в базе данных H. sapi
связанных со старением.
ens. Использовались следующие настройки: ис
Антивозрастная функция SIRT3 была проде
точники поиска активных взаимодействий -
монстрирована на HSC s, в которых указанный
текстовый анализ, эксперименты и базы дан
белок способствует выживанию клеток в усло
ных; минимальный уровень оценки взаимодей
виях окислительного стресса и омоложению фе
ствия - наивысшая вероятность (0,9); макси
нотипа [5]. В молодых клетках уровень экспрес
мальное число взаимодействий, определяющих
сии SIRT3 является высоким, однако он снижа
1 ю и 2 ю границы - нет. Результаты анализа
ется со старением клеток и тканей, что приводит
функционального обогащения были экспорти
к повышению уровня ROS и окислительным
рованы со значением False Discovery Rate
повреждениям [6, 44]. Мыши SIRT3 KO демон
(FDR), меньшим или равным 0,05. Сеть взаимо
стрируют значительный спектр заболеваний,
действия была сгруппирована по методу класте
ассоциированных со старением [2]. Ввиду упо
ризации Markov Cluster Algorithm (MCL) [40] с
мянутого антивозрастного эффекта SIRT3 [5],
инфляционным значением, равным 10.
фармакологическая активация его экспрессии и
Приоритизация белковых узлов. Высокопри
регуляция функционально связанных путей яв
оритетные белковые узлы и пути в сети
ляются очень востребованными в контексте раз
субстратных взаимодействий SIRT3, построен
работки антивозрастной терапии.
ной GeneMania, были предсказаны с использо
В настоящей работе исследуются взаимодей
ванием CytoHubba (0.1) [41]. Приложение было
ствия в сети белковых субстратов SIRT3, для чего
создано для использования топологического
был применен анализ функционального обога
метода Maximum click centrality (MCC), кото
щения, предсказание функции белка, приорити
рый, по мнению разработчиков, обеспечивает
зация белковых узлов и методы кластеризации
наивысшую точность в предсказании комплек
(рис. 1 и 2, табл. 1). Анализ сети взаимодействий
сов с максимальным приоритетом [41]. Соглас
применяется для выявления наиболее важных
но выбранным настройкам, проводился поиск
молекулярных функций, ассоциированных с де
комплексов первой ступени и демонстрация
ацетилирующей активностью SIRT3. Использова
кратчайшего пути. Комплексы первой ступени
ние искусственного интеллекта особенно полез
представляют собой белковые узлы, взаимодей
но для извлечения информации из ограниченных
ствующие непосредственно с искомыми белка
литературных источников, которая может ус
ми.
кользнуть от внимания при рутинном анализе
Кластерный анализ. Кластеры белковых
данных. На основе полученной информации мо
комплексов, демонстрирующие высокую сте
гут быть выдвинуты новые гипотезы и сделаны
пень взаимодействия, и которые с большой ве
выводы, потенциально имеющие значение в
роятностью представляют собой функциональ
дальнейших экспериментальных исследованиях.
ные комплексы, были определены с помощью
Приоритизация белковых узлов проводится
приложения MCODE к Cytoscape (v. 1.6) [42].
с целью выявления белковых узлов и кластеров
Для анализа были использованы следующие
в сети взаимодействия, имеющих важные регу
программные настройки: Network scoring -
ляторные роли. Внимание также уделяется
Degree Cutoff: 2; Cluster finding - Haircut; Node
субклеточной локализации субстратов SIRT3,
score cutoff: 0.2; K Core: 2; Max. Depth: 100.
что важно при интерпретации функционала
Визуализация путей. Визуализация путей бы
SIRT3 в различных клеточных компартментах.
ла осуществлена с помощью базы знаний при
Также была построена модель регуляции уровня
ложения WikiPathways [43], работающего в среде
BACE1 путем активации SIRT3, которая может
Cytoscape (3.9.0) [38], а также с использованием
быть использована при исследовании потенци
ссылок на литературу, упомянутых в тексте. Ри
альной терапии при БА.
сунок был создан с помощью Adobe Illustrator
Система взаимодействия SIRT3-субстрат. В
2020 (24.2.1).
настоящей работе используется приложение
БИОХИМИЯ том 87 вып. 2 2022
292
NAHÁLKOVÁ
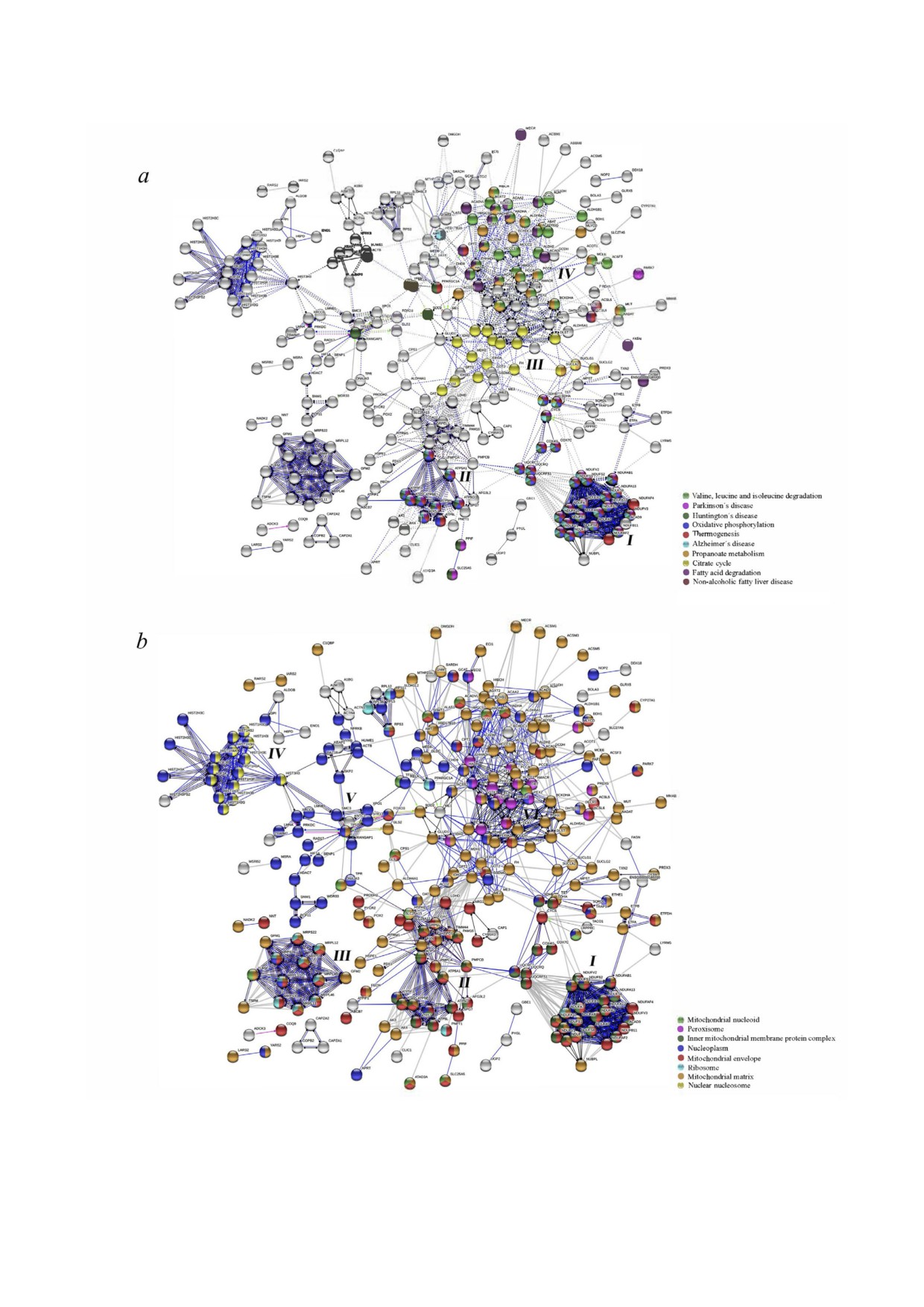
Рис. 1. Анализ обогащения путей в сети взаимодействия субстратов SIRT3, выполненный с использованием приложения
STRING. а - Пути KEGG; b - GO категория «клеточные компоненты». Анализ был выполнен с использованием списка
субстратов SIRT3 в качестве множественного запроса по базе данных H. sapiens
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
293
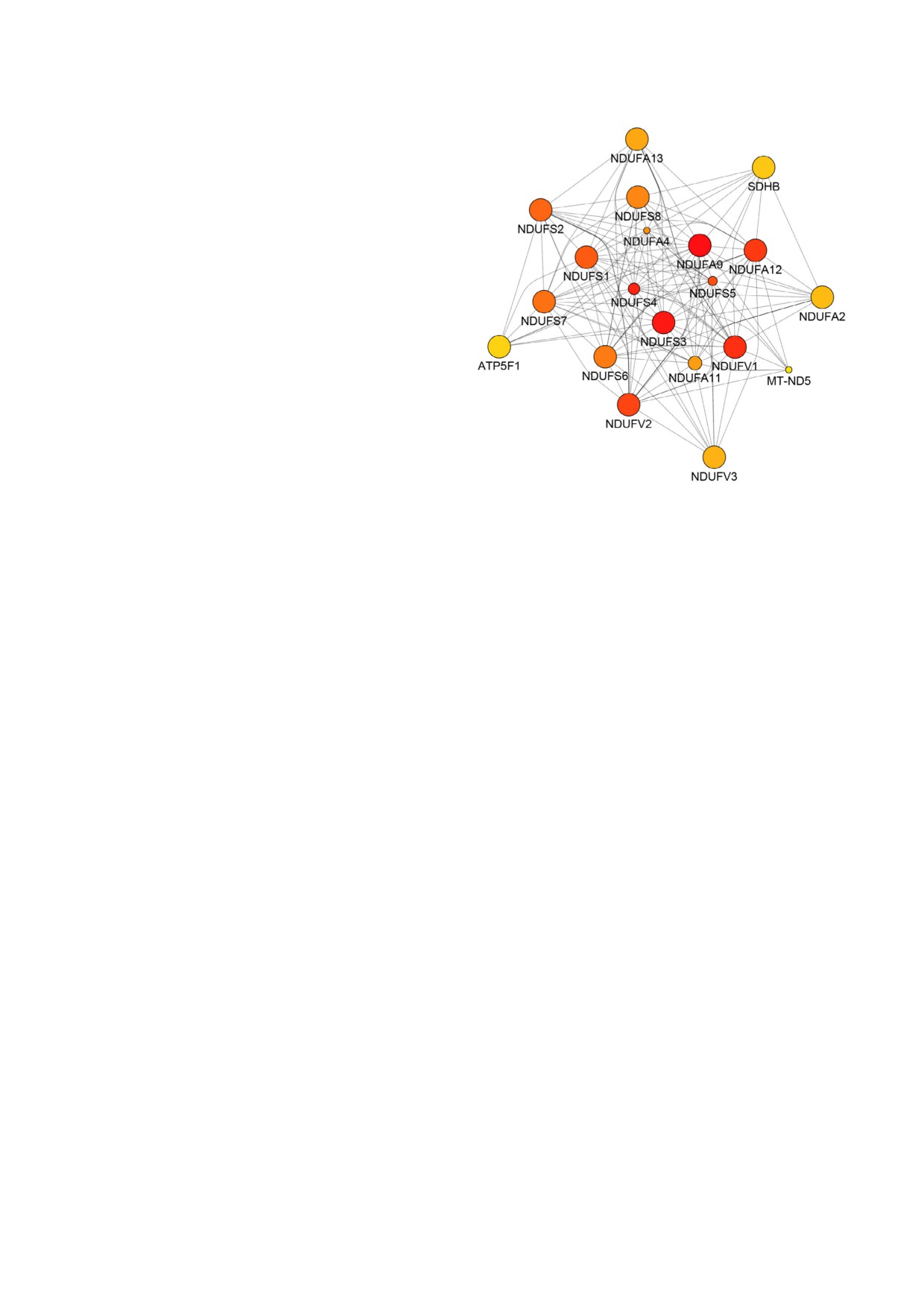
GeneMania в среде Cytoscape, аналитический
имела более низкий ранг (табл. 1). Дополни
инструмент для исследования обогащения и
тельно была проведена приоритизация белко
прогнозирования функций генов, основанный
вых узлов с помощью CytoHubba. Субъединицы
на объединенных геномных и протеомных дан
NADH:убихинон оксидоредуктазы, представля
ных, а также данных по экспрессии мРНК
ющие комплекс I дыхательной цепи митохонд
[35, 36, 45].
рий (MRC), были определены как узлы с наи
Программа позволяет провести сопоставле
высшим рангом (рис. 2). Это говорит о крити
ние проверяемых субстратов с предсказанными
ческой важности их роли в регулировании взаи
и экспериментально подтвержденными физи
модействий SIRT3 и его субстратов (табл. 1).
ческими белок белковыми взаимодействиями,
Также высокий ранг был присвоен субъедини
генетическими взаимодействиями, результата
це B сукцинатдегидрогеназы (SDHB) комплек
ми исследований по колокализации и коэкс
са II, а также ATPF1, кодирующему субъедини
прессии. Наконец, она подходит для известных
цу B ATP синтазы F0 в комплексе V MRC. Клас
сигнальных и метаболических сетей. Одним из
терный анализ с применением MCODE выявил
преимуществ приложения GeneMania является
среди наиболее важных групп приоритетную
его интеграция со средой Cytoscape, которая
подсистему из 70 узлов, участвующих в окисли
позволяет эффективно конструировать сети вза
тельном фосфорилировании (OXPHOS), в дыха
имодействий. База данных GeneMania постоян
тельной цепи переноса электронов, а также ас
но обновляется и пополняется новой информа
социированную с развитием БА и болезни Хан
цией [37], что не всегда происходит с другими
тингтона (БХ) (данные не показаны); указанная
типами платформ по анализу взаимодействий в
подсистема определяет основные регуляторные
путях.
узлы в общей системе взаимодействий пути.
Результаты GeneMania соответствовали из
Анализ GeneMania был в дальнейшем до
вестным наиболее важным функциям системы
полнен при использовании анализа функцио
взаимодействия субстратов с SIRT3, которые
нального обогащения с применением онлайн
связаны с дыхательной цепью переноса элект
базы данных STRING, что привело к получению
ронов; основными метаболическими путями;
прочно связанной сети белок белковых взаимо
метаболизмом жирных кислот, триацилглице
действия субстратов SIRT3 (рис. 1). Алгоритм
ридов и кетоновых тел; в то же время ассоциа
дополняет базу данных о белках субстратах
ция с болезнью Альцгеймера и Хантингтона
SIRT3, используя данные об известных взаимо
Таблица 1. Результат анализа обогащения путей и прогнозирования функции гена в сети взаимодействия субстратов
SIRT3 с использованием приложения GeneMania в среде Cytoscape (3.7.2). Анализ был проведен с использованием базы
данных H. sapiens (обновление 13 07 2017) с включением всех типов взаимодействий
Консолидированный путь
Ранг*
Описание базы данных
Дыхательная цепь переноса электронов
19,38
Reactome React 22393.2 дыхательная цепь переноса электронов
Метаболические пути
7,56
KEGG hsa01100 метаболические пути
Метаболизм жирных кислот, триацилглице
5,56
Reactome React 22279.2 метаболизм жирных кислот, триацил
ридов и кетоновых тел
глицеридов и кетоновых тел
Окислительное фосфорилирование
4,93
KEGG hsa00190 окислительное фосфорилирование
Метаболизм
2,54
Reactome React 111217.2 метаболизм
Метаболизм жирных кислот
2,33
KEGG hsa00071 метаболизм жирных кислот
Болезнь Альцгеймера
1,23
KEGG hsa05010 болезнь Альцгеймера
Метаболизм аминокислот и их производных
0,44
Reactome React 13.4 метаболизм аминокислот и их производных
Болезнь Хантингтона
0,13
KEGG hsa05016 болезнь Хантингтона
Примечание. Анализ был проведен с использованием базы данных H. sapiens (обновление 13 07 2017) и включением всех
типов взаимодействий.
* Ранг (вес) показывает прогностическую ценность, присвоенную GeneMania в отношении того, насколько указанные пу
ти соответствуют набору данных, указанных в запросе, по сравнению другими данными (вне запроса).
БИОХИМИЯ том 87 вып. 2 2022
294
NAHÁLKOVÁ
действиях, полученные из открытых источни
ков и с помощью вычислительных прогнозов.
Система также выполняет дополнительную
классификацию на основе Gene Ontology,
KEGG, высокопроизводительного поиска в
текстовых данных и иерархической кластериза
ции системы [39, 46, 47], что может быть полез
но в контексте исследований по разным биоло
гическим вопросам.
Кластеризуя данные с использованием мето
да MCL мы дополнили результаты STRING с
учетом классификации путей KEGG и продемон
стрировали связь субстратов SIRT3 с болезнью
Паркинсона (БП), БХ, БА и неалкогольной жи
ровой болезнью печени (НАЖБП) (рис. 1, а)
[40, 48]. Высокий уровень экспрессии SIRT3 в
метаболически активных тканях, таких как мозг,
печень, сердце и ткань бурого жира (ТБЖ), кор
релирует с его функциональной ролью в разви
тии нейродегенеративных заболеваний,
НАЖБП и в процессе термогенеза (рис. 1, а) [1].
Рис. 2. Приоритизация белковых узлов в сети взаимодей
Система взаимодействий на основе класси
ствия субстратов SIRT3, предсказанная с использованием
фикации путей KEGG и их кластеризации при
CytoHubba (0.1). Сеть была создана с применением прило
использовании MCL (рис. 1, а) демонстрирова
жения GeneMania (3.5.2) в среде Cytoscape (3.7.2) с исполь
зованием базы данных H. sapiens (обновление 13 07 2017) с
ла разделение на 5 кластеров, коррелирующих
включением только физических взаимодействий. Ранги
с субклеточной локализацией субстратов
узлов обозначены цветом от самого высокого (красный) до
SIRT3 (рис. 1, b). Кластер I содержит субстраты
низкого (желтый)
SIRT3, связанные с OXPHOS, БА, БП, БХ и
НАЖБП (рис.1, а). Он состоит из субъединиц
NADH:убихинон оксидоредуктазы (комп
вируется деацетилазой SIRT3 и создает регули
лекс I), фермента, который осуществляет пере
руемый цикл обратной связи [49]. Примечатель
нос электронов от NADH к убихинону, части
но, что SIRT3 и другие сиртуины также активи
дыхательной цепи переноса электронов
руют путем деацетилирования ряд ацетил КоА
(рис. 1, а). Активность комплекса I ингибирует
синтетаз [10] (табл. S2 в Приложении, колонки
ся у мышей SIRT3 KO, в то время как влияние
24-32), которые являются донорами ацетила для
SIRT3 может восстанавливать его активность,
ацетилирования белка, включая комплексы I, II
что обусловлено деацетилазной активностью
и V MRC и поставщиков ацетил КоА. Что каса
SIRT3. Нарушение продукции ATP составляет
ется этой функции, SIRT3 превосходит другие
более 50% у мышей SIRT3 KO и ~30% - в выде
сиртуины по деацетилированию ACSS2 [10] и
ленных клетках эмбриональных фибробластов
индуцирует дополнительную выработку энергии
мыши (MEF) [49]. Указанные результаты согла
митохондриями, контролируя синтез аце
суются с данными настоящей работы: SIRT3 де
тил КоА. Один из субстратов ACSS2 превращает
ацетилирует различные субъединицы комплек
ацетат и жирные кислоты в ацетил КоА, в ос
сов I, II и даже комплекса V MRC (кластер I и II,
новном используемый для окисления в цикле
рис. 1, а), которые совпадают с приоритетными
трикарбоновых кислот (TCA, цикл Кребса), и,
субстратами системы, построенной при помощи
таким образом, вносит значительный вклад в
GeneMania (рис. 2). Однако, по видимому, регу
производство NADH и ATP [50]. NADH допол
ляция митохондриальной активности SIRT3
нительно используется комплексом I MRC для
лишь частично обусловлена деацетилазной ак
создания протонного градиента для ATP синта
тивностью этого фермента, поскольку его нокаут
зы и NAD+, который замыкает регуляторный
не снижает уровень клеточного ATP до нуля.
цикл. Анализ приоритизации в системе взаимо
Настоящий анализ подтверждает существование
действий подтвердил в высшей степени значи
регулируемой NADH/NAD+ петли обратной
мую роль механизмов, связанных с активностью
связи между SIRT3, комплексом I MRC и аце
деацетилазы SIRT3, оказывающей наибольшее
тил КоА синтетазами [49]. SIRT3 требует для
влияние на клеточную энергетику.
своей активности NAD+, генерируемого комп
Кластер также включает субъединицы комп
лексом I MRC, который, в свою очередь, акти
лекса сукцинатдегидрогеназы, субъединицу A
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
295
(SDHA) и субъединицу B (SDHB), комплекс II
но не в клетках SIRT3 KO [54]. Субъединица
MRC. Результаты настоящей работы согласуют
ATP5F1 является одним из приоритетных узлов
ся с результатом процессирования сиртуином 3
в системе взаимодействия SIRT3 субстрат
субъединиц комплекса II, предложенным неко
(рис. 2), которая, параллельно с деацетилирова
торыми авторами [51]. Физическое взаимодей
нием других субъединиц комплекса V MRC, де
ствие SIRT3 и SDHB было также продемонстри
монстрирует важнейшую роль в биоэнергетике
ровано в двух других независимых эксперимен
митохондрий.
тах, однако без обнаружения специфических
Кластер III состоит из ферментов, участвую
сайтов ацетилирования [52]. В другой работе со
щих в цикле трикарбоновых кислот, не связан
общается, что деацетилирование SDHA SIRT3
ных в сети через STRING ни с одной из основ
оказывает лишь ограниченное стимулирующее
ных болезней (рис. 1, а), однако имеющих боль
действие на активность всего комплекса II [53],
шое значение в развитии онкологических забо
либо оно вообще отсутствует [49]. Упомянутая
леваний и БА. Метаболизм глюкозы в мозге
ограниченность в регуляция путем ацетилиро
сильно нарушается при БА, причем ферменты
вания все же имеет смысл, потому что комплекс
цикла TCA с максимальным снижением уровня
II MRC является важным ферментативным
стоят выше (upstream) от сукцинил КоА в мета
комплексом, и полная его инактивация являет
болическом пути [55]. PDHX, PDHB, PDHA1
ся летальной [53].
(рис. 1, а, кластер III) являются субъединицами
Кластер II включает субстраты, ассоцииро
ферментативного комплекса пируватдегидроге
ванные с БА, БП и БХ, которые также играют
назы (PDHC), который участвует в первой и не
роль в процессах термогенеза и OXPHOS
обратимой ферментативной реакции на стадии,
(рис. 1, а). Кластер состоит из субъединиц
соединяющей гликолитический цикл и TCA,
ATP синтазы (комплекс V), последнего фер
превращая пируват в ацетил КоА. SIRT3 акти
мента в цепи окислительного фосфорилирова
вирует субъединицу фермента PDHA1 путем ее
ния митохондрий, который производит клеточ
деацетилирования, что имеет важное значение
ную энергию в форме ATP путем хемиосмоти
для регуляции эффекта Варбурга в раковых
ческого выброса протонов. Повышенное ацети
клетках [56, 57]. Отложения бета амилоида (Aβ)
лирование субъединиц фермента происходит в
в мозге при БА вызывают повышенное фосфо
митохондриях печени и мышц SIRT3 KO мы
рилирование PDHC, приводящее к снижению
шей, когда у животных наблюдается недоста
продукции энергии из за смены режима метабо
точная выработка митохондриального ATP [4].
лизма, а именно, перехода от OXPHOS к глико
Это указывает на то, что SIRT3 деацетилирует и
лизу. В связи с этим ограничением в метаболиз
фактически регулирует активность комплек
ме альтернативная энергия вырабатывается пу
са V MRC. С другой стороны, SIRT3, стимули
тем обратной ферментативной реакции, превра
руемый питательными веществами, ограниче
щающей оксалоацетат в сукцинат, и с помощью
нием калорий (CR) и физическими упражнени
цепи переноса электронов в комплексе I [58].
ями, деацетилирует субъединицы ATP синта
Ассоциированная с возрастом стимуляция ки
зы a, b, c, d и OSCP, что приводит к увеличению
назы пируватдегидрогеназы (PDK) инактивиру
энергоснабжения митохондрий и антивозраст
ет PDHC посредством ее фосфорилирования, и
ным эффектам [4]. Поразительно, что SIRT3 не
возникающий в результате дефицит продукции
обходим для поддержания мембранного потен
АТР приводит к повреждению митохондрий и
циала здоровых митохондрий, где он связан с
ухудшению функции синапсов [59]. Поскольку
ATP синтазой через уровень pH и стресса [54].
экспрессия SIRT3 имеет тенденцию к сниже
Связь между SIRT3 и ATP5O может быть нару
нию в стареющих клетках и тканях [5, 6], то ста
шена при изменении потенциала внутренней
рение связано со снижением выработки митохон
митохондриальной мембраны, но не при инги
дриальной АТР из за снижения активности
бировании активности ATP синтазы при синте
OXPHOS.
зе ATP. Вместо этого ATP5O является одним из
Кластер IV образован субстратами SIRT3,
субстратов SIRT3 (табл. S2 в Приложении) и,
участвующими в распаде жирных кислот и в ме
как и в случае других субъединиц ATP синтазы
таболизме аминокислот с разветвленной цепью
(табл. 2, строки 59-68), его активность регули
(рис. 1, а). Повышенное ацетилирование пиру
руется посредством деацетилирования SIRT3,
ватдегидрогеназы у мышей SIRT3 KO приводит
что позволяет предположить, что связывание
к метаболическому переключению за счет повы
опосредовано взаимодействиями фермент
шенного окисления жирных кислот и накопле
субстрат. Мембранный потенциал митохондрий
ния лактата в мышцах [24]. Это также вызывает
зависит от SIRT3, поскольку после его падения
гиперацетилирование длинноцепочечной ацил
он быстро восстанавливается в клетках wt HeLa,
КоА дегидрогеназы, что приводит к накопле
БИОХИМИЯ том 87 вып. 2 2022
296
NAHÁLKOVÁ
нию длинноцепочечных жирных кислот как
митохондриальном матриксе (рис. 1, b). PNPT1
промежуточных продуктов метаболизма [20].
участвует в производстве митохондриальной
Это говорит о том, что активность деацетилиро
мРНК, а полиаденилирование проходит в мито
вания SIRT3 оказывает более широкое регули
хондриальных рибосомах и митохондриальной
рующее действие, включая не только метабо
оболочке [63]. SLC25A13, митохондриальный
лизм глюкозы, но и метаболизм жирных кислот
переносчик кальция, локализующийся в мито
и разветвленных аминокислот.
хондриальном матриксе и митохондриальном
Субклеточная локализация SIRT3 и его
нуклеоиде, транспортирует цитоплазматичес
субстратов. При том, что в основном деацетила
кий глутамат через внутреннюю митохондри
за описывается как митохондриальный белок,
альную мембрану для создания источника мито
существуют разногласия по поводу субклеточ
хондриального аспартата [64] (рис. 1, b).
ного расположения SIRT3 в других компарт
Кластер III включает митохондриальные
ментах. Согласно некоторым сообщениям,
белки, кодируемые в ядре и локализованные в
SIRT3 перемещается между ядром и митохон
различных митохондриальных компартментах
дриями при воздействии клеточного стресса или
(рис. 1, b). Субстраты SIRT3 GFM1, GFM2 и
сверхэкспрессии. Прежде чем он будет экспор
TSFM, включенные в эти кластеры, являются
тирован в митохондрии, SIRT3 подвергается
митохондриальными факторами элонгации,
N концевому отщеплению 142 аминокислотных
важными для трансляции белка в митохондри
остатков [60]. Ядерная локализация SIRT3, од
ях, и они локализованы в митохондриальном
нако, ранее подвергалась сомнению некоторы
матриксе. Их мутации являются причиной мито
ми авторами, поскольку деацетилаза, согласно
хондриальных заболеваний, вызванных дефи
их экспериментам, является исключительно ми
цитом MRC [65-67]. Другой фактор элонгации
тохондриальным ферментом [61, 62].
трансляции, TUFM, локализован как в матрик
Чтобы оценить локализацию внутриклеточ
се, так и в нуклеоидах митохондрий (рис. 1, b)
ной активности SIRT3, данные STRING о сети
[68]. Было продемонстрировано, что SIRT3 ре
взаимодействия субстратов SIRT3 классифици
гулирует трансляционную активность митохон
ровали с помощью GO категории «клеточный
дриальных рибосом [19]. Митохондриальные
компартмент». Результаты продемонстрировали
рибосомные белки MRPL10, MRPL11,
четыре основных субклеточных компартмента в
MRPL12, MRPL45, MRPL46, MRPS22,
качестве мест расположения субстратов SIRT3.
MRPS26, MRPS30 и MRPS9, входящие в этот
Ими были ядро, митохондрии, цитоплазма и пе
кластер, кодируются ядерной ДНК.
роксисомы (рис. 1, b). Большинство субстратов
Кластер IV содержит ядерные гистоновые
SIRT3 были также локализованы в цитоплазме
белки и несколько белков нуклеоплазмы
(данные не показаны), за исключением гисто
(рис. 1, b). Ферментативно активный SIRT3 вы
новых белков. Субстраты SIRT3, используемые
полняет функцию сайленсинга путем деацети
для анализа данных, были получены в результа
лирования H4K16Ac, H3K9Ac [60] и H3K56Ac
те анализа митохондриальных фракций [30, 31],
[69], что также свидетельствует в пользу наличия
где, соответственно, митохондриальные белки
активного SIRT3 в ядре. Интересно, что совме
представлены в больших количествах. Исклю
стная экспрессия SIRT3 и SIRT5 приводит к его
чением является исследование SILAC
[32]
перемещению из митохондрий в ядро [70]. Сре
(табл. S1 в Приложении), в котором лизировали
ди сиртуинов SIRT3 обладает наилучшей спо
цельные клетки и исследовали методами
собностью к освобождению β гидроксибутири
ЖХ/МС. Список субстратов SIRT3, получен
ла (bhb) от ядерного субстрата H3K9bhb [63], а
ный в результате этого исследования, содержит
также деацетилированию ядерного субстрата
множество гистоновых белков (рис. 1, b), в то
H3K56 [64].
время как их присутствие в списках субстратов
Кластер V включает несколько значимых
из других источников [30, 31] ограничено.
субстратов SIRT3 с интересными молекулярны
Интересно, что кластеры I и II (рис. 1, b) со
ми функциями, которые локализованы в нуклео
держат как митохондриальные, так и ядерные
плазме: в частности, LMNA, LMNB и HIF 1α,
субстраты SIRT3. Субъединицы дыхательной
p53 и PRKDC, на которых остановимся далее.
цепи переноса электронов комплекса I
LMNA как субстрат SIRT3 был выявлен при по
(NDUFS1-3, NDUFS6), субъединица 9 ацил
мощи метода SILAC в клетках U2OS, сверхэкс
КоА дегидрогеназы (ACAD9) и NDUFAB1 рас
прессирующих SIRT3 в отличие от нокаутных
положены как в митохондриях, так и в нуклео
клеток, в то время как LMNB был обнаружен
плазме. Субъединица B периферической мембра
идентичной методикой в SIRT3 KO MEF при
ны АТР синтазы (ATP5F1) также локализована
сравнении с клетками wt (табл. S1 в Приложе
в нуклеоплазме, митохондриальной мембране и
нии) [32]. Интересно, что, подобно связанным
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
297
со старением функциям SIRT3, мутации его
DNA PK приводит к снижению биоэнергетики
субстрата LMNA вызывают синдром прежде
митохондрий и физической формы мышц
временного старения, синдром прогерии Хат
[80, 81]. Схожим с SIRT3 является эффект диеты
чинсона-Гилфорда [71]. Интересно, что ацети
с ограничением калорий (CR, calorie restriction)
лирование K134 LMNB1 опосредует стабиль
и аэробных упражнений, которые могут сни
ность ядра и клеточного цикла. Оно индуцирует
жать активность пируваткиназы в процессе ста
стойкую активацию контрольной точки по
рения [80]. С другой стороны, SIRT3 стимулиру
вреждения ДНК в фазе G1/S, остановку клеточ
ется питательными веществами, ограничением
ного цикла в фазе G1, отрицательно регулирует
калорий и физическими упражнениями, что
аномальное каноническое негомологичное со
приводит к функциональной активации мито
единение концов (cNHEJ) и вызывает актива
хондрий и антивозрастным эффектам [4]. Функ
цию связывания LMNB1 с периферическими
циональные последствия деацетилирования
белками ядра [72]. Клетки с делетированным
SIRT3 DNA PK в производстве энергии мито
LMNA/C также демонстрируют аберрации в ре
хондриями и механизмах репарации ДНК неиз
парации удаленных оснований ДНК (BER) [73],
вестны, хотя и могут быть частично предсказа
репарации двунитевого разрыва ДНК (DSB) и
ны по основным функциям. Это могло бы стать
гомологичной рекомбинации (HR) [71]. В связи
интересным предметом для дальнейших науч
с широким спектром интересных функций ла
ных исследований.
минов и практически отсутствием информации
Деацетилирование PARK7 также может быть
об их деацетилировании соответствующие ис
потенциально интересным для дальнейшего
следования SIRT3 заслуживают внимания.
экспериментального изучения. Мутации в гене
Еще одним важным субстратом, включен
PARK7 являются причиной БП с ранним нача
ным в этот кластер, является HIF 1α (табл. S1 в
лом [82], заболеванием, тесно ассоциирован
Приложении) [32], который также деацетилиру
ным с сетью взаимодействий SIRT3 с субстрата
ется SIRT1 в позиции K674 [74]. SIRT3 является
ми (рис. 1, а).
важнейшим регулятором метаболизма раковых
Кластер VI характеризуется молекулярными
клеток, поскольку он опосредует переход мета
функциями, ассоциированными с инактиваци
болизма на гликолиз путем дестабилизации
ей ROS и β окислением жирных кислот, а также
HIF 1α посредством его деацетилирования. Но
уникальной пероксисомной локализацией, тре
каут приводит к росту уровня ROS, стабилизи
бующей экспериментальной
проверки.
рует HIF 1α и усиливает эффект Варбурга, в то
Субстраты могут сначала быть обработаны в ми
время как сверхэкспрессия действует как суп
тохондриях и ядрах, а затем перемещаться в пе
рессор опухоли путем ингибирования гликолиза
роксисомы. Это наблюдение подтверждается
и пролиферации раковых клеток [13, 75].
существованием участков мембранного контак
Другим важным субстратом, входящим в
та пероксисом с другими органеллами, включая
этот кластер, является р53, классический суп
митохондрии и ядра [83].
рессор опухолей, который уже был идентифи
Наконец, отобранные субстраты SIRT3 были
цирован как субстрат SIRT3 в раковых клетках с
отсортированы по отдельным кластерам на ос
дефицитом PTEN [76]. Удивительно, но весь био
нове их субклеточной локализации в митохон
логический процесс нейродегенерации может
дриальных, ядерных и пероксисомных компарт
быть обращен вспять лишь за счет увеличения
ментах. Помимо группы исключительно ядер
экспрессии SIRT3, поскольку при коэкспрессии
ных субстратов, гистонов, другие кодируемые в
с p53 сиртуин 3 предотвращает повреждение ми
ядре белки с важными митохондриальными
тохондрий нейронов [77]. Активация SIRT3 мо
функциями деацетилируются SIRT3. Настоящая
жет приводить к эффективному снижению
работа подтверждает экспериментальные наб
уровня повреждений при нейродегенерации,
людения о том, что SIRT3 взаимодействует так
вызванной повышением р53, что является перс
же с субстратами в ядре, а не исключительно в
пективным в контексте разработки терапии.
митохондриях. Несколько новых ядерных
Еще один важный субстрат, ДНК зависимая
субстратов SIRT3 с потенциально интересными
протеинкиназа (PRKDC, DNA PK) [30, 32] яв
биологическими функциями, включая LMNА,
ляется ядерным ферментом, участвующим в со
LMNВ, HIF 1α, DNA PK и PARK7, отобраны
единении концов при репарации двунитевого
для дальнейших экспериментальных исследова
разрыва ДНК (NHEJ) [78, 79]. DNA PK также
ний. Слияние пероксисомной мембраны с дру
участвует в сохранении длины теломер и их за
гими органеллами может быть возможным объ
щите, что имеет большое значение как при раке,
яснением появления субстратов SIRT3 в перок
так и при старении. В процессе старения, когда
сисомах, однако для подтверждения потребуется
накапливаются разрывы ДНК, активация
дальнейшее экспериментальное исследование.
10 БИОХИМИЯ том 87 вып. 2 2022
298
NAHÁLKOVÁ
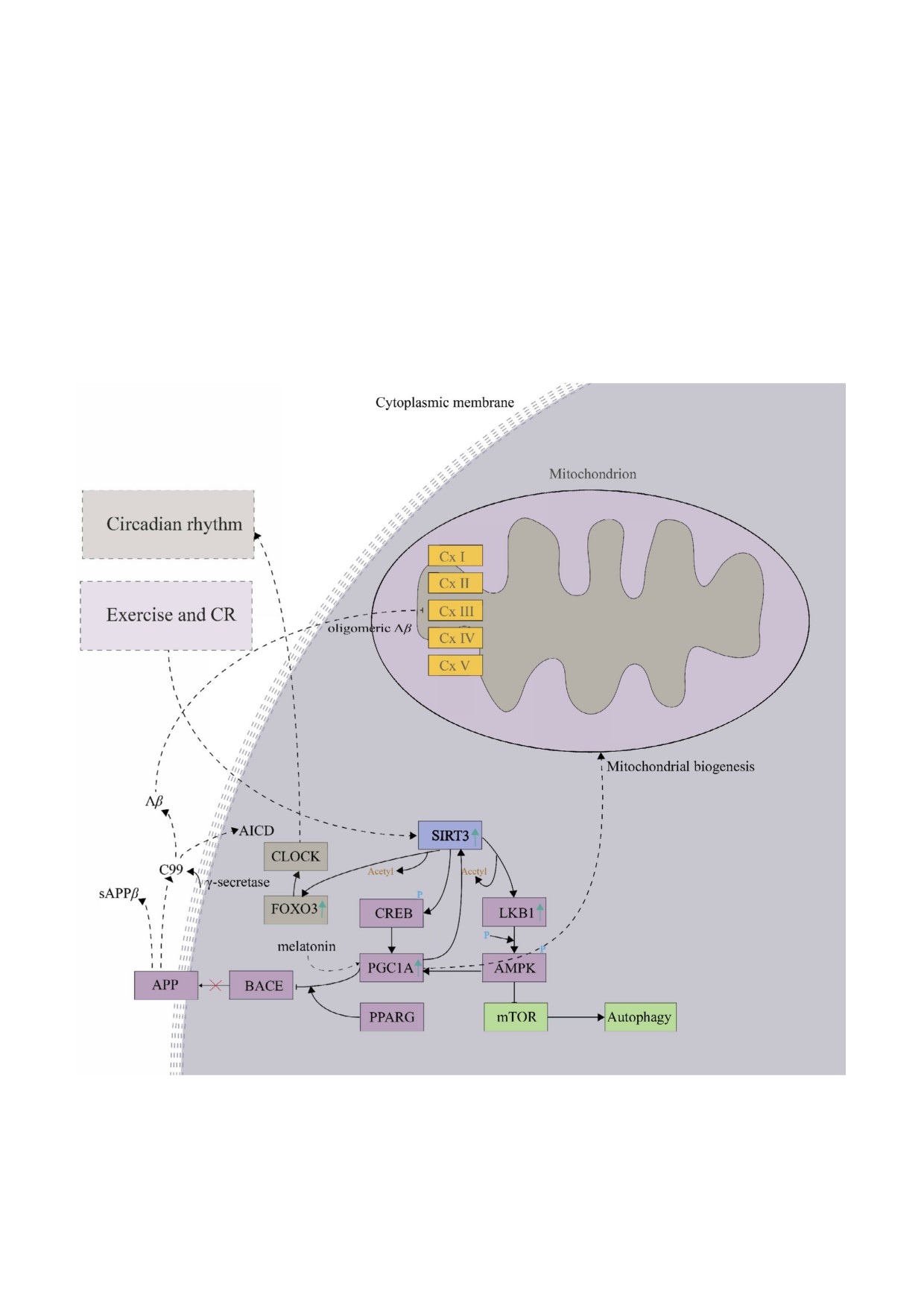
Регуляция BACE1. Что касается молекуляр
литературы. Была создана рабочая модель меха
ной функции при БА (табл. 1), активация фер
низма ингибирования выработки Aβ в голов
ментативной активности SIRT3 значительно
ном мозге (рис. 3).
ингибирует выработку Aβ в головном мозге
В качестве первого шага SIRT3, активиро
посредством ингибирования β секретазы
ванный физическими упражнениям и/или огра
(BACE1) [84], фермента первой и скорость ли
ничением калорий, деацетилирует и активирует
митирующей стадии воздействия на предшест
серин/треонин протеинкиназу 11 (LKB1, STK11;
венник бета амилоида (APP). Путь, способ
табл. S2 в Приложении), за которым следует
ствующий регуляторному воздействию SIRT3
фосфорилирование AMPK и активация пути
на активность BACE1, был построен с исполь
SIRT3 LKB1 AMPK
[18]. Это приводит к
зованием базы знаний WikiPathways с приложе
активации PGC 1α [84], репрессора BACE1, ко
нием GeneMania и дополнительным анализом
торый подавляет выработку Aβ в головном моз
Рис. 3. Рабочая гипотеза механизма ингибирования синтеза Aβ в головном мозге. Показана регуляция β секретазы
(BACE1, BACE) на основе сконструированного пути SIRT3 LKB1 AMPK CREB PGC1A PPARG BACE1. Изображение
пути было создано при использовании базы знаний приложения WikiPathways в среде Cytoscape (3.7.2) и данных литера
туры [18, 84-87]
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
299
Таблица 2. Анализ обогащения пути с помощью приложения GeneMania в среде Cytoscape (3.7.2); все белки пути SIRT3
LKB1 AMPK CREB PGC1A PPARG BACE1 использовались в качестве запроса
Консолидированный путь
Ранг
Описание базы данных
Циркадные часы (CC)
10,55
Reactome React 24941.3
Болезнь Хантингтона
9,07
KEGG hsa05016
Сигнальные события, опосредованные HDAC класса I
7,85
Взаимодействие путей Database NCI Nature Curated Data
Биология развития
7,83
Reactome React 111045.1
Метаболизм жирных кислот, триацилглицеридов
5,02
Reactome React 22279.2
и кетоновых тел
LKB1 регулирование
3,98
Взаимодействие путей Database NCI Nature Curated Data
p38 α и p38 β регулирование
3,57
Взаимодействие путей Database NCI Nature Curated Data
Сеть факторов транскрипции ATF 2
2,57
Взаимодействие путей Database NCI Nature Curated Data
Регуляция активности AMPK с помощью LKB1
1,91
Reactome React 21285.1
FSH
1,90
Netpath
Сигнальные события, опосредованные HDAC класса III
1,85
Взаимодействие путей Database NCI Nature Curated Data
mTOR сигнальный путь
1,77
KEGG hsa04150
Сигнальный путь адипоцитокина
1,75
KEGG hsa04920
BDNF
0,96
IOB
PI3K каскад
0,69
Reactome React 976.2
AMPK ингибирует активацию транскрипции
0,15
Reactome React 1988.3
посредством chREBP
Примечание. Анализ проводился с использованием базы данных H. sapiens (обновление 13 07 2017) и включал все типы
взаимодействий. Путь циркадных часов получил в анализе самый высокий ранг.
* Ранг (вес) показывает прогностическую ценность, присвоенную GeneMania в отношении того, насколько указанные пу
ти соответствуют набору данных, указанных в запросе, по сравнению другими данными (вне запроса).
ге [85] (рис. 3). Альтернативно, SIRT3 также акти
зывает ингибирующее действие на активность
вирует CREB, который непосредственно стиму
BACE1. PGC 1α также является ключевым регу
лирует промотор PGC 1α [86]. PGC 1α допол
лятором колебаний в циркадном цикле BMAL1
нительно требует присутствия PPARG для регу
и CLOCK, координирует функции молекуляр
лирования экспрессии BACE1. В соответствии с
ных часов и энергетического метаболизма у
этой моделью уровень экспрессии PGC 1α сни
млекопитающих [87].
жается в гиппокампе пациентов с БА по сравне
Интересно, что регулятор циркадного ритма
нию с контрольной группой соответствующего
мелатонин также активирует PGC 1α, который
возраста [87], что подтверждает актуальность ги
далее взаимодействует с эстроген зависимым
потетического пути SIRT3 LKB1 AMPK
рецептором α (ERRA), непосредственно связан
CREB PGC1A PPARG BACE1 (рис. 3).
ным с промотором SIRT3, и усиливает его тран
Молекулярные функции пути SIRT3 LKB1
скрипционную активность [88]. Более того, CC
AMPK CREB PGC1A PPARG BACE1 (рис. 3)
регулируют ритм NAD+ зависимого SIRT3 че
[18, 84-87] были исследованы с помощью ана
рез путь никотинамидрибозида (NR), который
лиза обогащения пути, выполненного с исполь
активируется доступностью питательных ве
зованием приложения GeneMania. Интересно,
ществ в период кормления [89]. Нарушение CC
что наивысший ранг (вес) получили циркадные
может быть причиной заболеваний, связанных с
часы (circadian clock, CC) (табл. 2). Это может
системой взаимодействия субстратов SIRT3
быть связано с функцией PGC 1α, который ока
(рис. 1, а) при БА, БП и БХ [90].
БИОХИМИЯ том 87 вып. 2 2022
10*
300
NAHÁLKOVÁ
Интересно, что ацетилирование клеточных
этом деацетилирование комплекса I является
белков также демонстрирует суточные законо
основным регуляторным звеном во всей сети
мерности, при этом большинство ядерных и ци
взаимодействия анализируемых субстратов.
топлазматических белков ацетилируются
Анализ подтверждает существование регулятор
ночью, а митохондриальные белки модифици
ной петли обратной связи, управляемой
руются в течение дня. Ритмическое ацетилиро
NADH/NAD+, включающей SIRT3, комплекс I
вание функционально связано с ритмическим
MRC и ацетил КоА синтетазу. SIRT3 также де
деацетилированием, в то время как SIRT3 явля
ацетилирует и активирует ключевые ферменты
ется основной митохондриальной деацетилазой
цикла ТКК, такие как PDHA1, ответственную за
белка [89]. Следовательно, SIRT3 может функ
переход от OXPHOS к гликолизу. Подавление
ционировать как ритмическая циркадная деаце
экспрессии SIRT3 при старении приводит к
тилаза ядерных и митохондриальных белков с
снижению выработки энергии и в конечном
потенциальным влиянием на развитие нейроде
итоге - к снижению уровня энергии в клетке. И,
генеративных заболеваний, которые могут быть
наконец, деацетилирование субъединиц комп
ассоциированы с узлами пути SIRT3 BACE1.
лексов II и V способствует регуляции продукции
Регулирование CC также происходит через
АТР митохондриями. По видимому, другие
путь SIRT3 FOXO3 CLOCK (рис. 3), где FOXO3
факторы также играют роль в такой регуляции,
является основным регулятором. В условиях
поскольку нокаут SIRT3 не приводит к тоталь
низкого уровня инсулина, характерного для
ному нарушению митохондриальной биоэнер
стареющего мозга [91], он связывается непосред
гетики, что также было бы интересно исследо
ственно с промотором гена CLOCK и регулирует
вать в дальнейшем.
его транскрипцию [92]. Активация SIRT3 уве
Интересно, что в настоящей работе было вы
личивает экспрессию FOXO3 за счет их прямого
явлено несколько недостаточно изученных
физического взаимодействия, которое, однако,
ядерных субстратов, которые играют роль в под
не зависит от активности деацетилазы SIRT3
держании структуры ядра и целостности генома,
[93, 94].
стабильности клеточного цикла и репарации
В заключение следует отметить, что функция
ДНК. Деацетилирование LMNA и LMNB
SIRT3 LKB1 AMPK CREB PGC1A PPARG
(синдром Хатчинсона-Гилфорда); HIF 1α (эф
BACE1 тесно связана с путем CC, который нару
фект Варбурга), p53 (нейропротекция), DNA
шается при БА, БП и БХ и, по видимому, явля
PK (NHEJ) и PARK7 (семейная форма БП)
ется одной из причин развития этих заболева
вместе с другими субстратами, задействованны
ний. Путь SIRT3 FOXO3 CLOCK, связанный с
ми в митохондриальной биоэнергетике, воз
нарушением обмена веществ, продукцией ROS и
можно, способствуют антивозрастной актив
аутофагией, также имеет отношение к патогене
ности SIRT3.
зу БА. Для узловых белков этих путей характерно
В тканях головного мозга SIRT3 действует
взаимное регулирование, что является перспек
как репрессор BACE1, фермента, который ката
тивным для разработки многоцелевой терапии.
лизирует решающий этап производства Aβ, од
ного из маркеров БА. Сконструированный регу
ляторный путь SIRT3 LKB1 AMPK CREB
ЗАКЛЮЧЕНИЕ
PGC1A PPARG BACE1 создает модель ингиби
рующего воздействия SIRT3 на ферментатив
Настоящий анализ сети взаимодействия
ную активность BACE1 и предлагает ряд альтер
субстратов основной митохондриальной деаце
нативных узлов для мультитаргетного примене
тилазы, SIRT3, позволил выделить БА, БП, БХ и
ния фармацевтических препаратов. Этот путь
НАЖБП как заболевания, наиболее тесно ассо
тесно связан с функцией CC, которая также
циированные с деацетилирующей активностью
ухудшается при развитии БА и является прямой
указанного фермента. Молекулярные функции,
причиной патологических нейродегенератив
связанные с субстратами SIRT3, включают ра
ных изменений. Ряд дополнительных функций,
боту дыхательной цепи переноса электронов,
ассоциированных с БА и CC, также осуществля
цикл трикарбоновых кислот, метаболизм жир
ются при участии пути SIRT3 FOXO3 CLOCK.
ных кислот, триацилглицеридов и кетоновых
SIRT3 обладает несколькими механизмами
тел. Деацетилирование SIRT3 в основном про
протективного действия в головном мозге и пе
ходит в ткани бурого жира, где оно способствует
чени, включая предотвращение повреждений
адаптивному термогенезу, что также было про
митохондрий как последствий нарушения в ды
демонстрировано в ходе настоящего анализа.
хательной цепи переноса электронов, подавле
SIRT3 деацетилирует множество субъединиц
ние ROS, ингибирование снижения мембранно
комплекса I, II и даже комплекса V MRC, при
го потенциала митохондрий и регуляцию мито
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
301
фагии. Повышение экспрессии и активности
Благодарности. Исследование было выпол
SIRT3 в головном мозге и печени представляет
нено при поддержке Biochemworld co., округ Уп
ся особенно полезным для уравновешивания
псала, Швеция.
негативных последствий старения. Контроль
Конфликт интересов. Авторы заявляют об от
функций комплекса I и II MRC в печени также
сутствии конфликта интересов.
полезен для лечения НАЖБП.
Соблюдение этических норм. Настоящая
Фармакологическая активация SIRT3 в соче
статья не содержит описания каких либо иссле
тании со стимулирующим эффектом регулярных
дований с участием людей или животных в каче
физических упражнений видится привлекатель
стве объектов.
ным вариантом для снижения негативных по
Дополнительные материалы. Приложение к
следствий старения. Активации продукции энер
статье на английском языке опубликовано на
гии митохондриями на основе регуляции прио
сайте журнала «Biochemistry» (Moscow) (http://
ритетных узлов в сети взаимодействия SIRT3 с
protein.bio.msu.ru/biokhimiya/) и на сайте изда
субстратами также является потенциальной
стратегией борьбы с возрастными изменениями.
10541), том 87, вып. 1, 2022.
СПИСОК ЛИТЕРАТУРЫ
1.
Lombard, D. B., Alt, F. W., Cheng, H. L., Bunkenborg, J.,
regulates long chain acyl CoA dehydrogenase by deacety
Streeper, R. S., et al. (2007) Mammalian Sir2 homolog
lating conserved lysines near the active site, J. Biol. Chem.,
SIRT3 regulates global mitochondrial lysine acetylation,
288, 33837 33847, doi: 10.1074/jbc.M113.510354.
Mol. Cell. Biol., 27, 8807 8814, doi: 10.1128/mcb.01636 07.
13.
Finley, L. W. S. S., Carracedo, A., Lee, J., Souza, A.,
2.
McDonnell, E., Peterson, B. S., Bomze, H. M., and
Egia, A., et al. (2011) SIRT3 opposes reprogramming of
Hirschey, M. D. (2015) SIRT3 regulates progression and
cancer cell metabolism through HIF1α destabilization,
development of diseases of aging, Trends Endocrinol.
Cancer Cell, 19, 416 428, doi: 10.1016/j.ccr.2011.02.014.
Metab., 26, 486 492, doi: 10.1016/j.tem.2015.06.001.
14.
Sundaresan, N. R., Samant, S. A., Pillai, V. B.,
3.
Zhu, Y., Yan, Y., Principe, D. R., Zou, X.,
Rajamohan, S. B., and Gupta, M. P. (2008) SIRT3 is a
Vassilopoulos, A., et al. (2014) SIRT3 and SIRT4 are mito
stress responsive deacetylase in cardiomyocytes that pro
chondrial tumor suppressor proteins that connect mito
tects cells from stress mediated cell death by deacetylation
chondrial metabolism and carcinogenesis, Cancer Metab.,
of Ku70, Mol. Cell. Biol., 28, 6384 6401, doi: 10.1128/
2, 15, doi: 10.1186/2049 3002 2 15.
mcb.00426 08.
4.
Vassilopoulos, A., Pennington, J. D., Andresson, T., Rees,
15.
Qiu, X., Brown, K., Hirschey, M. D., Verdin, E., and
D. M., Bosley, A. D., et al. (2013) SIRT3 deacetylates ATP
Chen, D. (2010) Calorie restriction reduces oxidative stress
synthase F1 complex proteins in response to nutrient and
by SIRT3 mediated SOD2 activation, Cell Metab., 12,
exercise induced stress, Antioxid. Redox Signal., 21, 551
662 667, doi: 10.1016/j.cmet.2010.11.015.
564, doi: 10.1089/ars.2013.5420.
16.
Yu, W., Dittenhafer Reed, K. E., and Denu, J. M. (2012)
5.
Brown, K., Xie, S., Qiu, X., Mohrin, M., Shin, J., et al.
SIRT3 protein deacetylates isocitrate dehydrogenase
2
(2013) SIRT3 reverses aging associated degeneration, Cell
(IDH2) and regulates mitochondrial redox status, J. Biol.
Rep., 3, 319 327, doi: 10.1016/j.celrep.2013.01.005.
Chem., 287, 14078 14086, doi: 10.1074/jbc.M112.355206.
6.
Braidy, N., Poljak, A., Grant, R., Jayasena, T.,
17.
Schlicker, C., Gertz, M., Papatheodorou, P.,
Mansour, H., et al. (2015) Differential expression of sirtu
Kachholz, B., Becker, C. F. W., et al. (2008) Substrates and
ins in the aging rat brain, Front Cell Neurosci., 9, 167,
regulation mechanisms for the human mitochondrial sirtu
doi: 10.3389/fncel.2015.00167.
ins Sirt3 and Sirt5, J. Mol. Biol.,
382,
790801,
7.
Weir, H. J. M., Murray, T. K., Kehoe, P. G., Love, S.,
doi: 10.1016/j.jmb.2008.07.048.
Verdin, E. M., et al. (2012) CNS SIRT3 expression is
18.
Pillai, V. B., Sundaresan, N. R., Kim, G., Gupta,
altered by reactive oxygen species and in Alzheimer’s dis
M. M. P., Rajamohan, S. B., et al. (2010) Exogenous NAD
ease, PLoS One, 7, 3 9, doi: 10.1371/journal.pone.
blocks cardiac hypertrophic response via activation of the
0048225.
SIRT3 LKB1 AMP activated kinase pathway, J. Biol.
8.
Oti, M. (2006) Predicting disease genes using protein-pro
Chem., 285, 3133 3144, doi: 10.1074/jbc.M109.077271.
tein interactions, J. Med. Genet.,
43,
691698,
19.
Yang, Y., Cimen, H., Han, M. J., Shi, T., Deng, J. H., et al.
doi: 10.1136/jmg.2006.041376.
(2010) NAD+ dependent deacetylase SIRT3 regulates
9.
Poulose, N., and Raju, R. (2015) Sirtuin regulation in
mitochondrial protein synthesis by deacetylation of the
aging and injury, Biochim. Biophys. Acta, 1852, 2442 2455,
ribosomal protein MRPL10, J. Biol. Chem., 285, 7417
doi: 10.1016/j.bbadis.2015.08.017.
7429, doi: 10.1074/jbc.M109.053421.
10.
Hallows, W. C., Lee S., and Denu, J. M. (2006) Sirtuins
20.
Hirschey, M. D., Shimazu, T., Goetzman, E., Jing, E.,
deacetylate and activate mammalian acetyl CoA syn
Schwer, B., et al. (2010) SIRT3 regulates mitochondrial
thetases, Proc. Natl. Acad. Sci. USA, 103, 10230 10235,
fatty acid oxidation by reversible enzyme deacetylation,
doi: 10.1073/pnas.0604392103.
Nature, 464, 121 125, doi: 10.1038/nature08778.
11.
Shimazu, T., Hirschey, M. D., Hua, L., Dittenhafer Reed,
21.
Xue, L., Xu, F., Meng, L., Wei, S., Wang, J., et al. (2012)
K. E., Schwer, B., et al. (2010) SIRT3 deacetylates mito
Acetylation dependent regulation of mitochondrial
chondrial 3 hydroxy 3 methylglutaryl CoA synthase 2 and
ALDH2 activation by SIRT3 mediates acute ethanol
regulates ketone body production, Cell Metab., 12, 654
induced eNOS activation, FEBS Lett., 586, 137 142,
661, doi: 10.1016/j.cmet.2010.11.003.
doi: 10.1016/j.febslet.2011.11.031.
12.
Bharathi, S. S., Zhang, Y., Mohsen, A. W., Uppala, R.,
22.
Wang, Z., Inuzuka, H., Zhong, J., Liu, P., Sarkar, F. H., et al.
Balasubramani, M., et al. (2013) Sirtuin 3 (SIRT3) protein
(2012) Identification of acetylation dependent regulatory
БИОХИМИЯ том 87 вып. 2 2022
302
NAHÁLKOVÁ
mechanisms that govern the oncogenic functions of Skp2,
37.
Franz, M., Rodriguez, H., Lopes, C., Zuberi, K.,
Oncotarget, 3, 1294 1300, doi: 10.18632/oncotarget.740.
Montojo, J., et al. (2018) GeneMANIA update 2018,
23.
Tseng, A. H. H., Shieh, S. S., and Wang, D. L. (2013)
Nucleic Acids Res., 46, W60 W64, doi: 10.1093/nar/
SIRT3 deacetylates FOXO3 to protect mitochondria
gky311.
against oxidative damage, Free Radic. Biol. Med., 63, 222
38.
Lopes, C. T., Franz, M., Kazi, F., Donaldson, S. L.,
234, doi: 10.1016/j.freeradbiomed.2013.05.002.
Morris, Q., et al. (2010) Cytoscape Web: An interactive
24.
Jing, E., O’Neill, B. T., Rardin, M. J., Kleinridders, A.,
web based network browser, Bioinformatics, 26, 2347 2348,
Ilkeyeva, O. R., et al. (2013) Sirt3 regulates metabolic flex
doi: 10.1093/bioinformatics/btq430.
ibility of skeletal muscle through reversible enzymatic
39.
Szklarczyk, D., Gable, A. L., Lyon, D., Junge, A.,
deacetylation, Diabetes, 62, 3404 3417, doi: 10.2337/
Wyder, S., et al. (2019) STRING v11: Protein-protein
db12 1650.
association networks with increased coverage, supporting
25.
Cheng, Y., Ren, X., Gowda, A. S. P., Shan, Y., Zhang, L.,
functional discovery in genome wide experimental
et al. (2013) Interaction of Sirt3 with OGG1 contributes to
datasets, Nucleic Acids Res., 47, D607 D613, doi: 10.1093/
repair of mitochondrial DNA and protects from apoptotic
nar/gky1131.
cell death under oxidative stress, Cell Death Dis., 4, 1 11,
40.
Enright, A. J., Van Dongen, S., and Ouzounis, C. A. (2002)
doi: 10.1038/cddis.2013.254.
An efficient algorithm for large scale detection of protein
26.
Samant, S. A., Zhang, H. J., Hong, Z., Pillai, V. B.,
families, Nucleic Acids Res.,
30,
15751584,
Sundaresan, N. R., et al. (2014) SIRT3 deacetylates and
doi: 10.1093/nar/30.7.1575.
activates OPA1 to regulate mitochondrial dynamics during
41.
Chin, C. H. H., Chen, S. H. H., Wu, H. H. H., Ho, C.
stress, Mol. Cell. Biol., 3, 807 819, doi: 10.1128/mcb.
W. W., Ko, M. T. T., et al. (2014) CytoHubba: Identifying
01483 13.
hub objects and sub networks from complex interactome,
27.
Lu, Z., Chen, Y., Aponte, A. M., Battaglia, V., Gucek, M.,
BMC Syst. Biol., 8, 1 7, doi: 10.1186/1752 0509 8 S4 S11.
et al. (2015) Prolonged fasting identifies heat shock pro
42.
Bader, G. D., and Hogue, C. W. V. (2003) An automated
tein 10 as a sirtuin 3 substrate: Elucidating a new mecha
method for finding molecular complexes in large protein
nism linking mitochondrial protein acetylation to fatty acid
interaction networks, BMC Bioinformatics,
4,
1 27,
oxidation enzyme folding and function, J. Biol. Chem.,
doi: 10.1186/1471 2105 4 2.
290, 2466 2476, doi: 10.1074/jbc.M114.606228.
43.
Kutmon, M., Lotia, S., Evelo, C. T., and Pico, A. R.
28.
Rauh, D., Fischer, F., Gertz, M., Lakshminarasimhan, M.,
(2014) WikiPathways App for Cytoscape: Making biologi
Bergbrede, T., et al. (2013) An acetylome peptide microar
cal pathways amenable to network analysis and visualiza
ray reveals specificities and deacetylation substrates for all
tion, F1000Res., 3, 152, doi: 10.12688/f1000research.
human sirtuin isoforms, Nat. Commun., 4, 2327 2337,
4254.2.
doi: 10.1038/ncomms3327.
44.
Liu, L., Peritore, C., Ginsberg, J., Kayhan, M., and
29.
Yang, H., Zhou, L., Shi, Q., Zhao, Y., Lin, H., et al. (2015)
Donmez, G. (2015) SIRT3 attenuates MPTP induced
SIRT 3 dependent GOT2 acetylation status affects the
nigrostriatal degeneration via enhancing mitochondrial
malate aspartate NADH shuttle activity and pancreatic
antioxidant capacity, Neurochem. Res., 40, 600608,
tumor growth, EMBO J., 34, 1110 1125, doi: 10.15252/
doi: 10.1007/s11064 014 1507 8.
embj.201591041.
45.
Bader, J. S., Chaudhuri, A., Rothberg, J. M., and Chant, J.
30.
Rardin, M. J., Newman, J. C., Held, J. M., Cusack, M. P.,
(2004) Gaining confidence in high throughput protein
Sorensen, D. J., et al. (2013) Label free quantitative pro
interaction networks, Nat. Biotechnol.,
22,
7885,
teomics of the lysine acetylome in mitochondria identifies
doi: 10.1038/nbt924.
substrates of SIRT3 in metabolic pathways, Proc. Natl.
46.
Franceschini, A., Szklarczyk, D., Frankild, S., Kuhn, M.,
Acad. Sci. USA, 110, 66016606, doi: 10.1073/pnas.
Simonovic, M., et al. (2013) STRING v9.1: Protein-pro
1302961110.
tein interaction networks, with increased coverage and
31.
Hebert, A. S., Dittenhafer Reed, K. E., Yu, W., Bailey,
integration, Nucleic Acids Res., 41, 808 815, doi: 10.1093/
D. J., Selen, E. S., et al. (2013) Calorie restriction and
nar/gks1094.
SIRT3 trigger global reprogramming of the mitochondrial
47.
Szklarczyk, D., Morris, J. H., Cook, H., Kuhn, M.,
protein acetylome, Mol. Cell., 49, 186 199, doi: 10.1016/
Wyder, S., et al. (2017) The STRING database in 2017:
j.molcel.2012.10.024.
Quality controlled protein-protein association networks,
32.
Sol, E. M., Wagner, S. A., Weinert, B. T., Kumar, A., Kim,
made broadly accessible, Nucleic Acids Res., 45, D362
H. S., et al. (2012) Proteomic investigations of lysine acety
D368, doi: 10.1093/nar/gkw937.
lation identify diverse substrates of mitochondrial deacety
48.
Van Dongen, S. M. (2000) Graph Clustering by Flow
lase Sirt3, PLoS One, 7, 1 9, doi: 10.1371/journal.pone.
Simulation, Utrecht University Repository. Dissertation
0050545.
[English]. Utrecht University, Utrecht.
33.
Consortium, T. U. (2021) UniProt: The universal protein
49.
Ahn, B. H., Kim, H. S., Song, S., In, H. L., Liu, J., et al.
knowledgebase in 2021, Nucleic Acids Res., 49, D480
(2008) A role for the mitochondrial deacetylase Sirt3 in
D489, doi: 10.1093/nar/gkaa1100.
regulating energy homeostasis. Proc. Natl. Acad. Sci. USA,
34.
Amberger, J. S., Bocchini, C. A., Scott A. F., and
105, 14447 14452, doi: 10.1073/pnas.0803790105.
Hamosh, A. (2019) OMIM. org: Leveraging knowledge
50.
Fujino, T., Kondo, J., Ishikawa, M., Morikawa, K., and
across phenotype gene relationships, Nucleic Acids Res.,
Yamamoto, T. T. (2001) Acetyl CoA Synthetase 2, a mito
47, D1038 D1043, doi: 10.1093/nar/gky1151.
chondrial matrix enzyme involved in the oxidation of
35.
Zuberi, K., Franz, M., Rodriguez, H., Montojo, J., Lopes,
acetate, J. Biol. Chem., 276, 11420 11426, doi: 10.1074/
C. T., et al. (2013) GeneMANIA prediction server 2013
jbc.M008782200
update, Nucleic Acids Res., 41, 115 122, doi: 10.1093/
51.
Bao, J., Scott, I., Lu, Z., Pang, L., Dimond, C. C., et al.
nar/gkt533.
(2010) SIRT3 is regulated by nutrient excess and modu
36.
Warde Farley, D., Donaldson, S. L., Comes, O.,
lates hepatic susceptibility to lipotoxicity, Free Radic. Biol.
Zuberi, K., Badrawi, R., et al. (2010) The GeneMANIA
Med., 49, 1230 1237, doi: 10.1016/j.freeradbiomed.2010.
prediction server: Biological network integration for gene
07.009.
prioritization and predicting gene function, Nucleic Acids
52.
Finley, L. W. S., Haas, W., Desquiret Dumas, V., Wallace,
Res., 38, 214 220, doi: 10.1093/nar/gkq537.
D. C., Procaccio, V., et al. (2011) Succinate dehydroge
БИОХИМИЯ том 87 вып. 2 2022
ДЕАЦЕТИЛИРУЮЩАЯ ФУНКЦИЯ SIRT3
303
nase is a direct target of sirtuin 3 deacetylase activity, PLoS
replacement, Sci. Rep., 9, 1 13, doi: 10.1038/s41598 019
One, 6, 4 9, doi: 10.1371/journal.pone.0023295.
41483 9.
53.
Cimen, H., Han, M. J., Yang, Y., Tong, Q., Koc, H., et al.
68.
Shi, H., Hayes, M., Kirana, C., Miller, R., Keating, J.,
(2010) Regulation of succinate dehydrogenase activity by
et al. (2012) TUFM is a potential new prognostic indicator
SIRT3 in mammalian mitochondria, Biochemistry, 49,
for colorectal carcinoma, Pathology,
44,
506512,
304 311, doi: 10.1021/bi901627u.
doi: 10.1097/PAT.0b013e3283559cbe.
54.
Yang, W., Nagasawa, K., Münch, C., Xu, Y.,
69.
Sengupta, A., and Haldar, D. (2018) Human sirtuin 3
Satterstrom, K., et al. (2016) Mitochondrial sirtuin net
(SIRT3) deacetylates histone H3 lysine 56 to promote
work reveals dynamic SIRT3 dependent deacetylation in
nonhomologous end joining repair, DNA Repair (Amst).
response to membrane depolarization, Cell, 167, 985 1000,
61, 1 16, doi: 10.1016/j.dnarep.2017.11.003.
e21, doi: 10.1016/j.cell.2016.10.016.
70.
Nakamura, Y., Ogura, M., Tanaka, D., and Inagaki, N.
55.
Bubber, P., Haroutunian, V., Fisch, G., Blass, J. P., and
(2008) Localization of mouse mitochondrial SIRT pro
Gibson, G. E. (2005) Mitochondrial abnormalities in
teins: Shift of SIRT3 to the nucleus by co expression with
Alzheimer brain: Mechanistic implications, Ann. Neurol.,
SIRT5, Biochem. Biophys. Res. Commun., 366, 174 179,
57, 695 703, doi: 10.1002/ana.20474.
doi: 10.1016/j.bbrc.2007.11.122.
56.
Ozden, O., Park, S. H., Wagner, B. A., Song, H. Y.,
71.
Redwood, A. B., Perkins, S. M., Vanderwaal, R. P.,
Zhu, Y., et al. (2014) SIRT3 deacetylates and increases
Feng, Z., Biehl, K. J., et al. (2011) A dual role for A type
pyruvate dehydrogenase activity in cancer cells, Free Radic.
lamins in DNA double strand break repair, Cell Cycle, 10,
Biol. Med.,
76,
163172, doi:
10.1016/j.freeradbio
2549 2560, doi: 10.4161/cc.10.15.16531.
med.2014.08.001.
72.
Murray Nerger, L. A., Justice, J. L., Rekapalli, P., Hutton,
57.
Warburg, O., Wind, F., Negelein, E., and Shirlaw, J. T.
J. E., and Cristea, I. M. M. (2021) Lamin B1 acetylation
(1927) The metabolism of tumors in the body, J. Gen.
slows the G1 to S cell cycle transition through inhibition of
Physiol., 8, 519 530, doi: 10.1085/jgp.8.6.519.
DNA repair, Nucleic Acids Res.,
49,
20442064,
58.
Stacpoole, P. W. (2012) The pyruvate dehydrogenase com
doi: 10.1093/nar/gkab019.
plex as a therapeutic target for age related diseases, Aging
73.
Maynard, S., Keijzers, G., Akbari, M., Ezra, M. B.,
Cell, 11, 371 377, doi: 10.1111/j.1474 9726.2012.00805.x.
Hall, A., et al. (2019) Lamin A/C promotes DNA base
59.
Zhou, Q., Lam, P. Y., Han, D., and Cadenas, E. (2009)
excision repair, Nucleic Acids Res., 47, 1170911728,
Activation of c Jun N terminal kinase and decline of
doi: 10.1093/nar/gkz912.
mitochondrial pyruvate dehydrogenase activity during
74.
Laemmle, A., Lechleiter, A., Roh, V., Schwarz, C.,
brain aging, FEBS Lett., 583, 1132 1140, doi: 10.1016/
Portmann, S., et al. (2012) Inhibition of SIRT1 impairs the
j.febslet.2009.02.043.
accumulation and transcriptional activity of HIF 1α pro
60.
Scher, M. B., Vaquero, A., and Reinberg, D. (2007) SirT3
tein under hypoxic conditions, PLoS One, 7, e33433,
is a nuclear NAD+ dependent histone deacetylase that
doi: 10.1371/journal.pone.0033433.
translocates to the mitochondria upon cellular stress, Genes
75.
Joo, H. Y., Yun, M., Jeong, J., Park, E. R., Shin, H. J.,
Dev., 21, 920 928, doi: 10.1101/gad.1527307.
et al. (2015) SIRT1 deacetylates and stabilizes hypoxia
61.
Cooper, H. M., and Spelbrink, J. N. (2008) The human
inducible factor 1α (HIF 1α) via direct interactions dur
SIRT3 protein deacetylase is exclusively mitochondrial,
ing hypoxia, Biochem. Biophys. Res. Commun., 462, 294
Biochem. J., 411, 279 285, doi: 10.1042/BJ20071624.
300, doi: 10.1016/j.bbrc.2015.04.119.
62.
Gurd, B. J., Holloway, G. P., Yoshida, Y., and Bonen, A.
76.
Xiong, Y., Wang, L., Wang, S., Wang, M., Zhao, J., et al.
(2012) In mammalian muscle, SIRT3 is present in mito
(2018) SIRT3 deacetylates and promotes degradation of
chondria and not in the nucleus; and SIRT3 is upregulated
P53 in PTEN defective non small cell lung cancer,
by chronic muscle contraction in an adenosine monophos
J. Cancer Res. Clin. Oncol., 144, 189 198, doi: 10.1007/
phate activated protein kinase independent manner,
s00432 017 2537 9.
Metabolism, 61, 733 741, doi: 10.1016/j.metabol.2011.09.
77.
Lee, J., Kim, Y., Liu, T., Hwang, Y. J., Hyeon, S. J., et al.
016.
(2018) SIRT3 deregulation is linked to mitochondrial dys
63.
Vedrenne, V., Gowher, A., De Lonlay, P., Nitschke, P.,
function in Alzheimer’s disease, Aging Cell, 17, 1 12,
Serre, V., et al. (2012) Mutation in PNPT1, which encodes
doi: 10.1111/acel.12679.
a Polyribonucleotide Nucleotidyltransferase, impairs RNA
78.
Polischouk, A. G., Cedervall, B., Ljungquist, S.,
import into mitochondria and causes respiratory chain
Flygare, J., Hellgren, D., et al. (1999) DNA double strand
deficiency, Am. J. Hum. Genet.,
91,
912918,
break repair, DNA PK, and DNA ligases in two human
doi: 10.1016/j.ajhg.2012.09.001.
squamous carcinoma cell lines with different radiosensitiv
64.
Palmieri, L., Pardo, B., Lasorsa, F. M., del Arco, A.,
ity, Int. J. Radiat. Oncol., 43, 191 198, doi: 10.1016/S0360
Kobayashi, K., et al. (2001) Citrin and aralar1 are Ca2+
3016(98)00362 9.
stimulated aspartate/glutamate transporters in mitochon
79.
Chaplin, A. K., Hardwick, S. W., Liang, S., Kefala
dria, EMBO J., 20, 50605069, doi: 10.1093/emboj/
Stavridi, A., Hnizda, A., et al. (2021) Dimers of DNA PK
20.18.5060.
create a stage for DNA double strand break repair, Nat.
65.
Galmiche, L., Serre, V., Beinat, M., Zossou, R.,
Struct. Mol. Biol., 28, 13 19, doi: 10.1038/s41594 020
Assouline, Z., et al. (2012) Toward genotype phenotype
00517 x.
correlations in GFM1 mutations, Mitochondrion, 12, 242
80.
Park, S. J., Gavrilova, O., Brown, A. L., Soto, J. E.,
247.
Bremner, S., et al. (2017) DNA PK promotes the mito
66.
Fukumura, S., Ohba, C., Watanabe, T., Minagawa, K.,
chondrial, metabolic, and physical decline that occurs dur
Shimura, M., et al. (2015) Compound heterozygous
ing aging, Cell Metab., 25, 1135 1146.e7, doi: 10.1016/
GFM2 mutations with Leigh syndrome complicated by
j.cmet.2017.04.008.
arthrogryposis multiplex congenita, J. Hum. Genet., 60,
81.
Sui, J., Zhang, S., and Chen, B. P. C. (2020) DNA depen
509 513, doi: 10.1038/jhg.2015.57.
dent protein kinase in telomere maintenance and protec
67.
Perli, E., Pisano, A., Glasgow, R. I. C., Carbo, M., Hardy,
tion, Cell. Mol. Biol. Lett., 25, 1 14, doi: 10.1186/s11658
S. A., et al. (2019) Novel compound mutations in the mito
020 0199 0.
chondrial translation elongation factor (TSFM) gene cause
82.
Schrader, M., Kamoshita, M., and Islinger, M. (2020)
severe cardiomyopathy with myocardial fibro adipose
Organelle interplay peroxisome interactions in health and
БИОХИМИЯ том 87 вып. 2 2022
304
NAHÁLKOVÁ
disease, J. Inherit. Metab. Dis., 43, 71 89, doi: 10.1002/
um fluoride induced hepatotoxicity and salvage by mela
jimd.12083.
tonin, BioRxiv, doi: 10.1101/107813.
83.
Palacios, O. M., Carmona, J. J., Michan, S., Chen, K. Y.,
89. Mauvoisin, D., Atger, F., Dayon, L., Núñez Galindo, A.,
Manabe, Y., et al. (2009) Diet and exercise signals regulate
Wang, J., et al. (2017) Circadian and feeding rhythms
SIRT3 and activate AMPK and PGC 1alpha in skeletal
orchestrate the diurnal liver acetylome, Cell Rep., 20, 1729
muscle, Aging (Albany NY), 1, 771 783, doi: 10.18632/
1743, doi: 10.1016/j.celrep.2017.07.065.
aging.100075.
90. Kondratova, A. A., and Kondratov R. V. (2012) The circa
84.
Ramesh, S., Govindarajulu, M., Lynd, T., Briggs, G.,
dian clock and pathology of the ageing brain, Nat. Rev.
Adamek, D., et al. (2018) SIRT3 activator Honokiol atten
Neurosci., 13, 325 335, doi: 10.1038/nrn3208.
uates β amyloid by modulating amyloidogenic pathway,
91. Tomita, T. (2017) Aberrant proteolytic processing and ther
PLoS One, 13, 1, doi: 10.1371/journal.pone.0190350.
apeutic strategies in Alzheimer’s disease, Adv. Biol. Regul.,
85.
Shi, T., Wang, F., Stieren, E., and Tong, Q. (2005) SIRT3,
64, 33 38, doi: 10.1016/j.jbior.2017.01.001.
a mitochondrial sirtuin deacetylase, regulates mitochondr
92. Chaves, I., van der Horst, G. T. J., Schellevis, R., Nijman,
ial function and thermogenesis in brown adipocytes,
R. M., Koerkamp, M. G., et al. (2014) Insulin FOXO3 sig
J. Biol. Chem., 280, 1356013567, doi: 10.1074/jbc.
naling modulates circadian rhythms via regulation of clock
M414670200.
transcription, Curr. Biol., 24, 1248 1255, doi: 10.1016/
86.
Katsouri, L., Parr, C., Bogdanovic, N., Willem, M., and
j.cub.2014.04.018.
Sastre, M. (2011) PPARγ co activator 1α (PGC 1α)
93. Tong, W., Ju, L., Qiu, M., Xie, Q., Chen, Y., et al. (2016)
reduces amyloid β generation through a PPARγ depen
Liraglutide ameliorates non alcoholic fatty liver disease by
dent mechanism, J. Alzheimer’s Dis.,
25,
151162,
enhancing mitochondrial architecture and promoting
doi: 10.3233/JAD 2011 101356.
autophagy through the SIRT1/SIRT3 FOXO3a pathway,
87.
Liu, C., Li, S., Liu, T., Borjigin, J., and Lin, J. D. (2007)
Hepatol. Res., 46, 933 943, doi: 10.1111/hepr.12634.
Transcriptional coactivator PGC 1α integrates the mam
94. Jacobs, K. M., Pennington, J. D., Bisht, K. S., Aykin
malian clock and energy metabolism, Nature, 447, 477
Burns, N., Kim, H. S., et al. (2008) SIRT3 interacts with
481, doi: 10.1038/nature05767.
the daf 16 homolog FOXO3a in the mitochondria, as well
88.
Song, C., Zhao, J., Zhang, J., Mao, T., Fu, B., et al. (2017)
as increases FOXO3a dependent gene expression,
SIRT3 dependent mitochondrial oxidative stress in sodi
Int. J. Biol. Sci., 4, 4291 4299, doi: 10.7150/ijbs.4.291.
FOCUS ON MOLECULAR FUNCTIONS
OF ANTI'AGING DEACETYLASE SIRT3
Jarmila Nahálková
Biochemistry, Molecular, and Cell Biology Unit, Biochemworld Co., 74394 Skyttorp,
Uppsala County, Sweden; e mail: jarmila.nahalkova@biochemworld.net
SIRT3 is a protein lysine deacetylase with a prominent role in the maintenance of mitochondrial integrity, which is a
vulnerable target in many diseases. Intriguingly, cellular aging is reversible just by SIRT3 overexpression, which rais
es many questions about the role of SIRT3 in the molecular anti aging mechanisms. Therefore, functions of SIRT3
were analyzed through the interaction network of 407 substrates collected by data mining. Results of the pathway
enrichment and gene function prediction confirmed functions in the primary metabolism and mitochondrial ATP
production. However, it also suggested involvement in thermogenesis, brain related neurodegenerative diseases
Alzheimer’s (AD), Parkinson’s, Huntington’s disease (HD), and non alcoholic fatty liver disease. The protein node
prioritization analysis identified subunits of the complex I of the mitochondrial respiratory chain (MRC) as the nodes
with the main regulatory effect within the entire interaction network. Additional high ranked nodes were succinate
dehydrogenase subunit B (SDHB), complex II, and ATP5F1, complex V of MRC. The analysis supports existence of
the NADH/NAD+ driven regulatory feedback loop between SIRT3, complex I (MRC), and acetyl CoA synthetases,
and existence of the nuclear substrates of SIRT3. Unexplored functions of SIRT3 substrates such as LMNA and
LMNB; HIF 1a, p53, DNA PK, and PARK7 are highlighted for further scientific advances. SIRT3 acts as a repres
sor of BACE1 through the SIRT3 LKB1 AMPK CREB PGC1A PPARG BACE1 (SIRT3 BACE1), which func
tions are fitted the best by the Circadian Clock pathway. It forms a new working hypothesis as the therapeutical target
for AD treatment. Other important pathways linked to SIRT3 activity are highlighted for therapeutical interventions.
Keywords: SIRT3, NAD+ dependent protein deacetylase, protein interaction network, pathway enrichment analysis,
aging, respiratory electron transport chain, mitochondria, age related disease
БИОХИМИЯ том 87 вып. 2 2022