БИОХИМИЯ, 2022, том 87, вып. 3, с. 356 - 375
УДК 577.29
РОЛЬ ГЛИКОПРОТЕИНА МУЦИН 2 И L ФУКОЗЫ
ВО ВЗАИМОДЕЙСТВИИ ИММУНИТЕТА И МИКРОФЛОРЫ
НА ПРИМЕРЕ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ
ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА
© 2022
В.Д. Бец1, К.М. Ачасова2,3, М.А. Борисова4,
Е.Н. Кожевникова1,2,3, Е.А. Литвинова2*
1 Новосибирский государственный аграрный университет, 630039 Новосибирск, Россия
2 Научно"исследовательский институт нейронаук и медицины,
630117 Новосибирск, Россия; электронная почта: litvinovaea@physiol.ru
3 Институт молекулярной и клеточной биологии СО РАН, 630090 Новосибирск, Россия
4 Федеральный исследовательский центр Институт цитологии и генетики СО РАН,
630090 Новосибирск, Россия
Поступила в редакцию 10.11.2021
После доработки 24.02.2022
Принята к публикации 24.02.2022
В основе развития воспалительных заболеваний кишечника у человека лежит множество факторов. В том
числе огромную роль играют дисбаланс микробиоты и истончение мукозального слоя в толстом кишечни"
ке. Патогенные микроорганизмы также усугубляют протекание заболеваний. Было выполнено исследова"
ние роли дефицита муцина 2 в формировании микрофлоры кишечника на экспериментальной модели мы"
шей с нокаутом гена Muc2 в присутствии инфекции Helicobacter spp. А также проведена оценка восстанав"
ливающего и противовоспалительного эффекта пищевой L"фукозы у мышей Muc2-/- на микрофлору и им"
мунитет. С этой целью у животных исследовали бактериальное разнообразие в фекалиях до и после приме"
нения антибактериальной терапии и оценивали роль пищевой L"фукозы в её восстановлении. Для опреде"
ления влияния бактериального дисбаланса и роли фукозы на иммунную систему определяли уровни мРНК
генов провоспалительных цитокинов (Tnf, Il1a, Il1b, Il6) и транскрипционных факторов T"кле"
ток (Foxp3 - Treg, Rorc - Th17, Tbx21 - Th1) в ткани толстой кишки у мышей Muc2-/-. Значительная элими"
нация бактерий на фоне применения антибиотиков вызывала снижение фукозы в кишечнике, а также про"
воцировала снижение транскрипционного фактора Т"регуляторных клеток (Foxp3). При добавлении к ан"
тибиотикам пищевой L"фукозы уровень бактериальной ДНК Bacteroides spp. в фекалиях мышей Muc2-/-
частично восстанавливался. В регуляции воспаления у мышей Muc2-/- участвуют Т"регуляторные клетки.
Антибиотики снижали их количество, что не позволило уменьшить воспалительный ответ на инфекцию.
Фукоза, как компонент муцина 2, при антибактериальной терапии мышей Muc2-/- помогает сохранить
Bacteroides spp. и восстановить биохимические показатели, но не влияет на воспалительный ответ.
КЛЮЧЕВЫЕ СЛОВА: ВЗК, макрофаги, патогены, микробиота, антибиотики, L"фукоза, муцин 2.
DOI: 10.31857/S0320972522030046
ВВЕДЕНИЕ
показатели, по опубликованным данным,
со"
ставляют 4,1 на 100 тыс. населения для ЯК и 0,8
Во всём мире стремительно набирает темпы
на 100 тыс. - для БК. Ежегодный прирост забо"
распространение воспалительных заболеваний
леваемости составляет 5-20 случаев на 100 тыс.
кишечника (ВЗК), в том числе в США и странах
населения, и этот показатель продолжает увели"
Западной Европы отмечаются более высокие
чиваться [1].
показатели заболеваемости язвенным колитом
В этиологии ВЗК лежат полифакторные
(ЯК) и болезнью Крона (БК), чем в других стра"
компоненты, среди которых отмечают: генети"
нах мира. По последним данным, в США и Ев"
ческую предрасположенность, изменение со"
ропе более 3 млн больных ВЗК. В России же эти
става микробиоты кишечника, применение раз"
личного рода лекарственных препаратов (в том
Принятые сокращения: БК
- болезнь Крона; числе и антибиотиков), дисбаланс механизмов
ВЗК - воспалительные заболевания кишечника; ЖКТ -
адаптивной и врождённой иммунных систем, а
желудочно"кишечный тракт; ЯК - язвенный колит;
DSS - декстран сульфат натрия; Treg - Т"регуляторные
также влияние диет и факторов окружающей
клетки.
среды [2]. Особую роль в развитии ВЗК играет
* Адресат для корреспонденции.
рацион питания. Диета способна оказывать
356
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
357
сильное влияние на состав микрофлоры кишеч"
H. mastomyrinus, H. rappini, H rodentium и
ника, вызывая дисбиоз, повреждая слизистый
H. typhlonius. Видами Helicobacter, связанными с
слой, что, в свою очередь, повышает проницае"
клиническими заболеваниями у крыс и мышей,
мость тканей кишечника и создаёт благоприят"
в первую очередь являются H. bilis и
ные условия для адгезии и развития патогенной
H. Hepaticus [13]. При этом H. pylori, характер"
и условно"патогенной микрофлоры [3]. Суще"
ный для человека, у заражённых мышей FVB/N"
ствуют данные о росте показателей БК и ЯК в
Tg (Ins1"GAS)1Sbr/J нарушал состав микробиты
некоторых районах Азии в связи с вестерниза"
желудка [14]. Кроме того, есть предположение,
цией рациона, характеризующейся преоблада"
что вызванная H. pylori патология желудка у мы"
нием пищи с высоким содержанием жиров, жи"
шей линии C57BL/6 может быть ослаблена со"
вотного белка, сахара и снижением потребления
четанной инфекцией H. bilis или H. muridarum
клетчатки [4].
или стимулироваться сочетанной инфекцией
Поскольку микробиом кишечника является
H. hepaticus, все они являются энтерогепатичес"
уникальной экосистемой, вовлечённой практи"
кими хеликобактерами, преимущественно ко"
чески во все процессы жизнедеятельности мак"
лонизирующими толстую кишку [15, 16]. Недав"
роорганизма, важно учитывать особо тесное
нее исследование продемонстрировало, что ин"
взаимодействие бактериального сообщества с
фекция H. pylori у мышей C57BL/6 изменяет как
иммунной системой хозяина, которое начинает"
желудочный, так и кишечный микробный со"
ся на ранних стадиях онтогенеза и сопровожда"
став, а также модулирует иммунные ответы хо"
ет всю жизнь [5, 6]. По последним данным, мик"
зяина как в желудке, так и в лёгких [14].
робиом кишечника человека формируется до
Что касается энтерогепатических видов
5"летнего возраста [7].
Helicobacter (Enterohepatic Helicobacter, EHH), то
Ещё одной причиной развития ВЗК считают
на животных моделях было показано, что
иммунную реакцию на одного или нескольких
H. hepaticus и H. bilis вызывают стойкое воспале"
представителей микрофлоры кишечника [8].
ние в толстой и слепой кишках у иммунодефи"
Бактериальные агенты в составе кишечной мик"
цитных грызунов [15, 16]. H. hepaticus вызывает
робиоты способны запускать как воспалитель"
колит у мышей с дефицитом интерлейки"
ные, так и противовоспалительные процессы в
на 10 (IL"10), свободных от других патогенов,
организме хозяина [9]. Так, например на без"
посредством механизма, зависимого от интер"
микробных мышах (germ"free) было показано,
лейкина 12 (IL"12) и интерферона"гамма (IFN"
что животные с отсутствием бактерий в просве"
gamma) [15]. H. muridarum усиливает воспаление
те кишечника имеют менее развитую иммунную
в модели острого колита [17] и провоцирует БК"
систему по сравнению с животными, выращен"
подобное воспаление у мышей с тяжёлым ком"
ными в обычных условиях [6]. У безмикробных
бинированным иммунодефицитом при получе"
мышей регистрировали меньшее количество
нии Т"клеток [18].
Пейеровых бляшек и брыжеечных лимфатичес"
Применение пробиотиков и пребиотиков в
ких узлов, а также у некоторых мышей в желу"
качестве поддерживающей терапии показало
дочно"кишечном тракте (ЖКТ) отсутствуют
хорошие результаты при синдроме раздражён"
подтипы Т"хелперов [10].
ного кишечника (СРК) и у пациентов с C. diffi"
Терапия ВЗК на данный момент ориентиро"
cile [19], однако не столь эффективно при сред"
вана на снижение патогенной нагрузки и умень"
ней и высокой степени тяжести ВЗК и не всегда
шение альтерации тканей кишечника с по"
способствуя восстановлению деятельности ки"
мощью стероидных противовоспалительных
шечной микрофлоры и снижению воспалитель"
препаратов и антибиотиков [11]. Антибактери"
ного процесса в тканях кишечника [20].
альная терапия влияет на изменение микроби"
Для коррекции микробиомных отклонений
омного состава, что способствует разрастанию
у пациентов с ЯК была предпринята попытка
патогенной микрофлоры. Побочными эффекта"
применения заместительной терапии в форме
ми могут быть диарея, вызванная инфекцион"
трансплантации кала от здоровых пациентов.
ными бактериями Clostridium difficile и Salmonella
Однако наряду с положительными результатами
typhimurium, а также различные аутоиммунные
исследований, остаётся не раскрытым до конца
заболевания [9]. Helicobacter pylori - широко
вопрос побочных действий данной методики и
распространённый возбудитель инфекции же"
вопросы контроля исследований [21]. Недавние
лудка среди людей, другие виды Helicobacter так"
исследования на эту тему дают основание пола"
же являются серьёзной проблемой для лабора"
гать, что этот подход способен работать и в об"
торных грызунов [12]. На сегодняшний день у
ратную (негативную для здоровья пациента)
мышей описаны следующие виды Helicobacter:
сторону. Показано, что микроорганизмы, вызы"
H. bilis, H. ganmani, H. hepaticus, H. muridarum,
вающие воспаление кишечника, но не проявля"
БИОХИМИЯ том 87 вып. 3 2022
358
БЕЦ и др.
ющиеся у донора, могут негативно влиять на ре"
субпопуляций Т"клеток и развивающиеся спон"
ципиента с ВЗК [20].
танно у генетически модифицированных мы"
Помимо медикаментозной и диетической
шей (например, мыши Il10-/-) [31].
поддержки пациента с ВЗК, существуют также
Химически"индуцированный колит вызыва"
хирургические методы лечения, применение ко"
ют добавлением отрицательно заряженного
торых определяется степенью тяжести пораже"
сульфатированного полисахарида, декстрана
ния тканей, площадью поражения и проявлени"
сульфата натрия (DSS), который повреждает
ем внекишечных симптомов. Здесь также суще"
эпителиальные клетки. Врождённые иммунные
ствуют факторы риска послеоперационных ос"
клетки в ответ на альтерацию тканей выделяют
ложнений, в частности резервуарит, как частое
цитокины, вызывая воспаление в толстой киш"
осложнение при ИАРА (илеоанальный резерву"
ке, которое характеризуется язвами и инфильт"
арный анастомоз), а также воспаление слизис"
рацией гранулоцитов [32]. Ещё одна химически"
той оболочки прямой кишки, сохраняемое при
индуцированная модель - это использование
наложении аппаратного анастомоза [11].
тринитробензолсульфокислоты (TNBS) для
Таким образом, на сегодняшний день нет
изучения иммунологических аспектов БК, так
эффективного способа лечения ВЗК, и эти па"
как кислота вызывает Th1"опосредованный им"
тологии остаются объектом пристального вни"
мунный ответ, характеризующийся инфильтра"
мания исследователей. В связи с этим актуаль"
цией клеток Т"хелперов, нейтрофилов и макро"
ными являются поиски способов облегчения
фагов в окружающие ткани [32]. Все модели мы"
состояние пациентов с ВЗК и увеличения пери"
шей с ВЗК, которые индуцируются химическим
ода ремиссии.
путём, имеют общую тенденцию повреждения
На всех этапах изучения острого и хроничес"
тканей кишечника, что вызывает воспалитель"
кого воспаления кишечника использовали раз"
ную реакцию. Важно отметить, что поражения
личные модели на животных - от беспозвоноч"
кишечника, наблюдаемые у людей с ВЗК, не
ных (нематод, дрозофил, кишечнополост"
идентичны повреждениям, наблюдаемым у мы"
ных) [22], используемых для изучения механиз"
шей после воздействия химических агентов.
мов врождённого иммунитета, до свиней, как
Например, введение DSS мышам вызывает хи"
альтернативной модели млекопитающих с мор"
мическое повреждение эпителиальной выстил"
фофункциональной схожестью ЖКТ челове"
ки, которое имитирует повреждение слизистой
ка [23]. Также используют модели на приматах,
оболочки, наблюдаемое у людей с ЯК, тяжесть
которые обеспечивают более сопоставимые
повреждений не всегда является репрезентатив"
данные из"за их высокой степени генетического
ной для людей с ЯК [30, 33].
и физиологического родства с человеком. Одна"
Существует модель воспаления кишечника с
ко существуют проблемы этического характера
переносом адоптивных Т"клеток, которая спо"
и опасность переноса высоковирулентных зоо"
собствует развитию хронического воспаления
нозных агентов [24, 25]. Есть модели воспаления
тонкой и толстой кишок. Для создания такой
кишечника на кроликах, морских свинках [26]
модели Т"клетки CD4+CD45RBhight (которые яв"
и, в меньшей степени, жвачных животных. На"
ляются CD25-) сортируются и выделяются из
пример, овца (как биологическая модель) ис"
донорских спленоцитов мышей линии BALB/c;
пользовалась для исследований кишечника, но,
при переносе клеток сингенному иммунодефи"
в отличие от моногастричных видов (Homo sapi"
цитному реципиенту PrkdcSCID или Rag2-/- соз"
ens, грызуны и свиньи), большая часть бактери"
даётся модель первичного воспаления в толстой
альной ферментации углеводов у овец, как пра"
кишке. Это воспаление объясняется отсутстви"
вило, происходит в рубце, а не в толстом кишеч"
ем Т"регуляторных клеток (Treg) в популяции
нике [27]. Есть модели ВЗК на собаках, так как у
наивных Т"клеток у реципиента. Поэтому мо"
них проявляется дисфункция генов, аналогич"
дель адаптивного переноса Т"клеток использу"
ная людям с БК [28]. Несмотря на огромный вы"
ется для изучения роли патогенных Т"клеток в
бор моделей, оптимальными являются лабора"
воспалении слизистой оболочки, и на этой мо"
торные грызуны, среди которых мыши играют
дели было выполнено множество исследований
значимую роль, поскольку морфофункциональ"
Treg и других популяций Т"клеток [33].
ное развитие их кишечника относительно похо"
Также существует более 74 видов генетически
же на развитие кишечника человека и у них есть
модифицированных линий мышей. Некоторые
многие из тех же иммунных ответов и ге"
из них несут гены восприимчивости, идентифи"
нов [29, 30].
цированные при ВЗК человека, и функции неко"
Модели мышей с ВЗК можно разделить
торых других генов восприимчивости к ВЗК [34].
на 3 категории: индуцируемые химическим пу"
Основная концепция генетически спроектиро"
тём, полученные путём адоптивного переноса
ванных моделей воспаления заключается в нока"
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
359
уте гена, определяющего морфофункциональ"
ния на примере экспериментальной модели
ные особенности строения кишечника и особен"
ВЗК мышей Muc2-/-. Мы продемонстрировали,
ности иммунного ответа. Так, на примере моде"
как пищевая L"фукоза оказывает восстанавли"
лей мышей с конститутивным нокаутом Il10-/-
вающий эффект на микрофлору кишечника и
показано спонтанное развитие колита, посколь"
оказывает противовоспалительное действие у
ку Treg этих животных неспособны продуциро"
мышей Muc2-/-.
вать IL"10. В частности, наблюдается воспаление
толстой кишки, характеризующееся воспали"
тельным инфильтратом лимфоцитов, макрофа"
МАТЕРИАЛЫ И МЕТОДЫ
гов и нейтрофилов [34]. Другая трансгенная мо"
дель - это мыши с нуль"мутацией гена Muc2, ко"
Животные, условия содержания. Исследова"
дирующего белок муцин 2, который участвует в
ние проводилось в Центре генетических ресур"
формировании защитного муцинового слоя в
сов ИЦиГ СО РАН (уникальный идентификатор
тонкой и толстой кишке [35, 36]. Таким образом,
проекта RFMEFI62117X0015). Все манипуляции
различные методы воспроизведения воспаления
с животными были одобрены межинститутской
на мышах используются при определённо по"
комиссией по биоэтике СО РАН (номер 18.6 от
ставленных задачах исследования. Однако стоит
14.10.2013). В исследовании использовали жи"
отметить, что модели с генетическим нокаутом
вотных SPF"статуса - свободных от специфи"
точно определяют фено" и генотипические осо"
ческих патогенов, которые входят в расширен"
бенности с рождения, что может играть важную
ный список, рекомендованный FELASA в 2014 г.
роль при решении определённых задач, в то вре"
[47]. Исключением был Helicobacter spp., кото"
мя как все остальные модели с повреждением и
рый детектировали у животных на протяжении
переносом Т"клеток - приобретённые, что мо"
всего эксперимента.
жет накладывать отпечаток на результаты иссле"
Для эксперимента использовали мы"
дования и их последующий анализ.
шей Muc2-/- инбредного скрещивания, которые
Известно, что признаком всех моделей ВЗК
поступили в ЦКП «Центр генетических ресур"
является истончение мукозального слоя кишеч"
сов лабораторных животных, “SPF"виварий”»
ника и изменение кишечной микрофло"
ИЦиГ СО РАН из ФИЦ «Фундаментальные ос"
ры [37, 38]. Основным компонентом слизистой
новы биотехнологий» РАН, г. Москва. В целях
оболочки кишечника является гликозилирован"
обеспечения максимально различимой микро"
ный белок (муцин 2) с терминальными молеку"
флоры между линиями и оценки её роли в раз"
лами фукозы и сиаловой кислоты. Моносахари"
витии воспаления в качестве контроля исполь"
ды служат не просто источником энергии, но и
зовали мышей линии C57BL/6, а не сибсов от
фактором вирулентности для кишечных бакте"
гетерозиготного скрещивания.
рий [39"41]. Несмотря на активное изучение
Животных содержали однополыми группа"
взаимного влияния друг на друга иммунитета и
ми по 3-5 особей в индивидуальных вентилиру"
кишечной микрофлоры, механизм развития
емых клетках («Optimice», США). Световой ре"
воспаления при ВЗК до сих пор остаётся не
жим искусственный: 14 ч освещения и 10 ч тем"
раскрытым. Ранее было показано, что L"фукоза
ноты; температура - 20-22 °С; влажность -
влияет на репродуктивную функцию у мы"
36%; давление - 38 Па. Для подстила использо"
шей Muc2+/-. В этом исследовании было обнару"
вали обеспыленную березовую стружку. Живот"
жено, что пищевая фукоза может действовать
ные получали корм ssniff® R/M"H auto"
как дифференциальный регулятор поляризации
clavable V1534"3 («Ssniff», Германия) ad libitum.
макрофагов во время имплантации в зависимос"
В качестве питьевой воды животным предостав"
ти от иммунного статуса хозяина [42]. Также бы"
ляли стерильную деионизированную воду с до"
ло установлено, что L"фукоза помогает элими"
бавлением минералов K+, Mg2+ («Северянка»,
нировать протозойную инфекцию у мы"
Санкт"Петербург, Россия) ad libitum.
шей Muc2-/- и способна восстанавливать трип"
Антибактериальная терапия. В целях экспе"
тофан"продуцируемые бактерии в кишечнике
римента группе животных обеих линий (n = 10)
при DSS"индуцируемом колите [36, 43-46].
с питьевой водой добавляли три антибиотика:
В представленной работе мы показали, что
амоксицилин, метронидазол и кларитромицин.
отсутствие муцина 2 и входящих в его состав мо"
Расчёт антибиотиков в 1 мл воды был проведён
носахаридов влияют на разнообразие микро"
из количества потребляемой воды одним живот"
флоры кишечника в присутствии инфекции
ным в день (в среднем 4 мл):
Helicobacter spp., а также что обеднение симбио"
• амоксициллин в концентрации 0,75 мг/мл,
тической и патогенной микрофлоры на фоне
суточная доза для одного животного состави"
приёма антибиотиков меняет характер воспале"
ла 3 мг;
БИОХИМИЯ том 87 вып. 3 2022
360
БЕЦ и др.
• метронидазол в концентрации 0,25 мг/мл,
центрацию РНК в образцах определяли при по"
суточная доза для одного животного состави"
мощи NanoDrop 2000 («Thermo Scientific»).
ла 1 мг;
кДНК получали путём проведения реакции
• кларитромицин в концентрации 0,25 мг/мл,
обратной транскрипции с матрицы РНК, реак"
суточная доза для одного животного состави"
цию проводили с обратной транскрипта"
ла 1 мг.
зой MulV («СибЭнзим», Россия), согласно реко"
Соответствующей группе мышей (по 10 жи"
мендациям производителя. Смесь РНК
вотных в каждой группе) в питьевую воду добав"
(3-7
мкг), праймерных олигонуклеотидов
ляли три антибиотика вместе с 0,1%"ной L"фу"
(oligo dT и Random, 600 нг каждого) («БИОС"
козой.
СЕТ», Россия) и нуклеотидов (концентрация
Концентрации антибиотиков и фукозы бра"
1 мМ каждого) нагревали до 65 °С в течение
ли из ранее опубликованных работ [35, 44, 46,
5 мин и охлаждали в течение 5 мин на льду. За"
48]. Расчёт дозы антибиотиков проводили со"
тем в реакционную смесь добавляли обратную
гласно стандартной схемы лечения мышей
транскриптазу (100 Ед.а.) и реакционный буфер.
Helicobacter spp. [49]. Ранее в нашей лаборатории
Реакцию проводили при 37 °С в течение часа, а
было показано, что такие дозы антибиотиков
затем инактивировали фермент нагреванием до
только при добавлении в корм наиболее эффек"
70 °С в течение 5 мин. Полученные образцы
тивны в борьбе с хеликобактерной инфекци"
кДНК хранили при -20 °С.
ей [36, 50].
Количество мРНК генов оценивали по ко"
Гистологический анализ толстой кишки. Для
личеству кДНК в образце при помощи количе"
гистологического анализа образцы проксималь"
ственной ПЦР в реальном времени. Последова"
ного отдела толстой кишки мышей дли"
тельности праймерных олигонуклеотидов под"
ной ~5 мм фиксировали в 10%"ном формалине,
бирали самостоятельно (табл. 1).
далее обезвоживали в спиртах восходящей кон"
Правильность полученного продукта оцени"
центрации и последовательно проводили через
вали по длине бэнда полученного продукта ме"
бутанол и ксилол с последующим заключением
тодом электрофореза в агарозном геле. Реакци"
в парафин. Далее выполняли срезы толщи"
онная смесь (20 мкл) содержала БиоМастер HS"
ной 3 мкм и окрашивали с помощью двух окра"
qPCR SYBR Blue 1x («БиоЛабМикс», Россия),
шиваний: на ШИК"реакцию и гематоксилин"
соответствующие праймеры (0,3 мкМ каждого)
эозином («БиоВитрум», Россия). Перед окрас"
и 40-200 нг кДНК. ПЦР проводили в детекти"
кой образцы помещали в толуол для удаления
рующем амплификаторе CFX96 TouchTM Deep
парафина, затем проводили по спиртам нисхо"
Well Real"Time PCR Detection System («BioRad
дящей концентрации и доводили до воды. Далее
Laboratories», США). ДНК денатурировали
выполняли окрашивание, согласно инструкции
5 мин при 95 °С; далее 40 циклов: денатурация -
производителя.
95 °С, 15 с; отжиг праймеров - 62 °С, 25 с; элон"
Анализ экспрессии генов в толстой кишке.
гация - 72 °С, 25 с. Каждый эксперимент повто"
Экспрессию генов в ткани толстой кишки оце"
ряли 3 раза и в качестве результата брали сред"
нивали по количеству мРНК соответствующего
нее значение по трём показателям. Не было ни
гена методом ПЦР в реальном времени. Образец
одного случая повтора, который отличался от
ткани дистального отдела толстой киш"
двух других более чем на 5%. Количество мРНК
ки
(~5
мм) гомогенизировали в
500
мкл
целевого гена нормировали на количество
TriReagent («Invitrogen», США), затем добавляли
мРНК гена бета"тубулина (Tubb) по формуле:
100
мкл хлороформа и центрифугировали
2^ (Ct целевого гена - Ct гена Tubb), где Сt -
10 мин, 12 000 g, 4 °С. Водную фазу, содержащую
цикл, соответствующий пороговому уровню
РНК, отбирали в чистую пробирку и осаждали
светимости продукта ПЦР.
изопропанолом (на льду в течение 10 мин),
Определение количества фукозы в толстой
центрифугировали 15 мин, 12 000 g, 4 °С, а затем
кишке. Образец ткани толстой кишки гомогени"
промывали 75%"ным этанолом. Образец высу"
зировали в жидком азоте, для анализа брали
шивали и растворяли РНК в ультрачистой деио"
5 мг образца и добавляли 1 мл 96%"ного этано"
низированной воде (Milli"Q). Затем образцы
ла, затем перемешивали 5 мин и центрифугиро"
РНК обрабатывали ДНКазой I
(«Thermo
вали 10 мин при 3000 g и 4 °С. Далее переносили
Scientific», США), согласно рекомендациям
по 30 мкл супернатанта в две чистые пробирки и
производителя. Обработанную РНК осаждали
оставляли на льду для определения количества
96%"ным этанолом при 20 °С в течение 2 ч, а за"
свободной фукозы (в одной пробирке определя"
тем центрифугировали (15 мин, 12 000 g, 4 °С),
ли фукозу, а во второй - фон образца). К остав"
далее промывали 70%"ным этанолом, высуши"
шемуся образцу ткани добавляли ещё 1 мл
вали от спирта и растворяли в воде Milli"Q. Кон"
96%"ного этанола, и после повторения описан"
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
361
ной выше процедуры удаляли супернатант, что"
Таблица 1. Последовательности олигонуклеотидов, ис"
пользуемых для определения уровня экспрессии генов
бы избавиться от следовых остатков свободной
мРНК
фукозы. Затем помещали пробирку с тканью на
лёд и растворяли осадок в 200 мкл 0,1N NaOH,
Название
Последовательность 5′→3′
Мишень
после растворения переносили по 20 мкл образ"
праймера
ца в две чистые пробирки для определения свя"
занной с белками фукозы (в одной пробирке оп"
Tnf"F
CCCTCACACTCAGATCATCTTCT
мРНК
Tnf"R
GGCACCACTAGTTGGTTGTCTTT
Tnf
ределяли фукозу, а во второй - фон образца). Во
(кДНК)
все пробирки с образцами добавляли по 150 мкл
реактива серной кислоты (концентрированная
Il1b"F
AAGGAGAACCAAGCAACGACAA
мРНК
H2SO4 : H2O = 6 : 1), охлаждённого до 0 °С. Да"
Il1b"R
AACTCTGCAGACTCAAACTCCA
Il1b
(кДНК)
лее содержимое пробирок перемешивали и ин"
кубировали в термостате при температуре 100 °С
Il6"F
GCTACCAAACTGGATATAATCAGGA
мРНК
в течение 5 мин, а затем охлаждали под проточ"
Il6"R
CCAGGTAGCTATGGTACTCCAGAA
Il6
ной водой. Ко всем пробам, кроме тех, которые
(кДНК)
служили для определения фона, добавляли по
Rorc"F
ACTACGGGGTTATCACCTGT
мРНК
10
мкл
3%"ного гидрохлорид L"цистина
Rorc"R
GTGCAGGAGTAGGCCACATT
Rorc
(CysHCl) и инкубировали 90 мин при комнат"
(кДНК)
ной температуре. Далее определяли поглощение
при 405/450 нм. Для построения калибровочных
Foxp3"F
AGGAGACATCCATCAGGGCT
мРНК
Foxp3"R
TGCTGCTTTAGGTGGAGTGG
Foxp3
кривых использовали растворы L"фукозы, ана"
(кДНК)
лиз калибровочных образцов проводили парал"
лельно с экспериментальными образцами ана"
Il1a"F
CCCGTCCTTAAAGCTGTCTG
мРНК
логичным образом (с шага добавления реактива
Il1a"R
AATTGGAATCCAGGGGAAAC
Il1a
серной кислоты). Количество фукозы в образ"
(кДНК)
цах нормировали на количество белка, опреде"
Tubb5"F
TGAAGCCACAGGTGGCAAGTAT
мРНК
ленное методом Брэдфорда [51], и выражали как
Tubb5"R
CCAGACTGACCGAAAACGAAGT
Tubb5
мкг фукозы на мг белка.
(кДНК)
Определение концентрации цитокинов в крови
Tbet"F
CCAGGGAACCGCTTATATG
мРНК
методом мультиплексного анализа. Для измере"
Tbet"R
CGATCATCTGGGTCACATTGT
Tbx21
ния уровня цитокинов 200 мкл образца крови
(кДНК)
(n = 6 - для контроля, n = 3 - для Muc2-/-)
центрифугировали при 3 000 g в течение 15 мин
при 4 °С, затем отбирали в чистую пробирку по
150 мкл сыворотки. Концентрацию цитокинов
праймеры к консервативному участку бактери"
в сыворотке измеряли с помощью 6"плексной
ального гена 16S рРНК. Количество ДНК ге"
панели MILLIPLEX MAP Mouse Cytokine
на 28S рРНК M. musculus определяли при помо"
Magnetic Bead Panel («Merck», Германия) в соот"
щи праймерных олигонуклеотидов («БИОС"
ветствии с рекомендациями производителя. Де"
СЕТ»), которые подбирали самостоятель"
текцию проводили с помощью системы
но (табл. 2).
Luminex 200 («Merck»), используя программное
Все праймерные последовательности подби"
обеспечение xPONENT 3.1. Концентрацию ци"
рали при помощи программ Primer"BLAST [52]
токинов (IL"1a, IL"17, IL"12p40, IL"12p70, IL"
и Unipro UGENE [53]. Реакционная смесь (20
22, INF"gamma) представляли как пг цитокина
мкл) содержала БиоМастер HS"qPCR SYBR
в мл крови.
Blue
1x
(«БиоЛабМикс»), соответствующие
Определение бактериальной ДНК в фекалиях
праймеры (300 нМ каждого) и ДНК, выделен"
и ткани толстой кишки методом количественной
ную из фекалий. ПЦР проводили в детектирую"
ПЦР в реальном времени. Количество бактерий в
щем амплификаторе CFX96 TouchTM Deep Well
фекалиях оценивали по количеству бактериаль"
Real"Time PCR Detection System. ДНК денату"
ной ДНК гена 16S рибосомной РНК (рРНК),
рировали 5 мин при температуре 95 °С; далее
нормированному на ДНК гена 28S рРНК Mus
проводили 40 циклов: денатурация - 95 °С, 15 с;
musculus. ДНК"консервативный участок ге"
отжиг праймеров - 62 °С, 25 с; элонгация -
на
16S рРНК, а также Helicobacter spp.,
72 °С, 25 с.
Bacteroides spp., Lactobacillus spp. определяли при
Нормирование бактериальной ДНК на ДНК
помощи праймеров к участку гена 16S рРНК со"
мыши (M. musculus) выполняли по формуле:
ответствующей группы бактерий. Для определе"
2^ (Ct гена 28S рРНК M. musculus - Ct гена
ния общего количества бактерий использовали
16S рРНК Bacteria), для специфических бакте"
БИОХИМИЯ том 87 вып. 3 2022
362
БЕЦ и др.
Таблица 2. Последовательности олигонуклеотидов, используемых для определения количества ДНК бактерий
Название праймера
Последовательность 5′→3′
Мишень
Mus28S"F
CCTGGCGCTAAACCATTCGT
28S рRNA M. musculus
Mus28S"R
AAAGCCCGCAGAGACAAACC
16S"F
TCCTACGGGAGGCAGCAG
16S рRNA Bacteria
16S"R
ATTACCGCGGCTGCTGG
Bac.spp"F
GAGAGGAAGGTCCCCCAC
16S рRNA Bacteroides spp.
Bac.spp"R
CGCTACTTGGCTGGTTCAG
Lac.spp"F
ATCTTCCACAATGGRCGC
16S рRNA Lactobacillus spp.
Lac.spp"R
GGCTGCTGGCACGTAGTTAG
Hel.spp"F
CGGAGGGTGCAAGCGTTACT
16S рRNA Helicobacter spp.
Hel.spp"R
ATTCCACCTGCCTCTCCCAC
E. coli"F
GGCAGGCCTAACACATGCAA
16S рRNA Escherichia coli
E. coli"R
CCCCTCTTTGGTCTTGCGAC
Staphyl"F
ATGCAAGTCGAGCGAACG(A)GA
16S рRNA Staphylococcus spp.
Staphyl"R
TGTCTCAGTTCCAGTGTGGC
Str.spp"F
GTACAGTTGCTTCAGGACGTATC
16S рRNA Streptococcus spp.
Str.spp"R
ACGTTCGATTTCATCACGTTG
CCOC"F
GACGCCGCGTGAAGGA
16S рRNA Blautia spp.
CCOC"R
AGCCCCAGCCTTTCACATC
рий - по формуле: 2^ (Ct гена 16S рРНК
женную Schwieger и Tebbe [54] в 1998 г. Выделен"
Bacteria - Ct гена 16S рРНК специфическая для
ную из фекалий ДНК объединяли по группам и
определенного сообщества бактерий), где Сt -
проводили ПЦР, используя рекомбинантную
цикл, соответствующий пороговому уровню
ДНК"полимеразу Phusion High"Fidelity DNA
светимости продукта ПЦР. Уровень бактериаль"
Polymerase («Thermo Scientific») и праймеры
ной ДНК у мышей дикого типа C57BL/6 и у мы"
(«БИОССЕТ»), комплементарные вариабельно"
шей Muc2-/- выражали в условных единицах.
му региону 4 (V4) гена 16S рРНК, обратный
Определение разнообразия бактериального
праймер был фосфорилирован на
5′"кон"
состава. Разнообразие бактериальной микро"
це (табл. 3).
флоры определяли методом одноцепочечного
В реакционную смесь (High"Fidelity"буфер
конформационного полиморфизма (Single"
для полимеразы;
3% диметилсульфоксида;
strand conformation polymorphism, SSCP) гена
200 мкМ нуклеотиды; 1 мкМ праймеры; ДНК"
16S рРНК, за основу брали методику, предло"
полимераза) добавляли 25 нг ДНК (общий объ"
Таблица 3. Последовательность олигонуклеотидов, используемых в методе SSCP
Название праймера
Последовательность 5′→3′
Краткое обозначение
Источник
Com"F
CAGCAGCCGCGGTAATAC
V4 16S рRNA Bacteria
[54]
Com"R
P"CCGTCAATTCCTTTGAGTTT
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
363
ём реакции 50 мкл). Реакцию проводили в амп"
генизировали лимфатические узлы при помощи
лификаторе T100TM Thermal Cycler («BioRad
пестикового ручного гомогенизатора («Sovtech»,
Laboratories»). ДНК денатурировали при 98 °С
Россия), затем фильтровали суспензию через
3 мин; затем проводили 35 циклов: денатура"
фильтр для клеток с диаметром пор
ция - 98 °С, 15 с; отжиг праймеров - 50 °С, 20 с;
70 мкм («BD Falcon», США), объём суспензии
элонгация - 72 °С, 20 с. Наличие продукта ПЦР
клеток доводили до 1 мл натрий"фосфатным бу"
проверяли при помощи электрофореза в 1,5%"ном
фером, отбирали 50 мкл для подсчёта количест"
агарозном геле с добавлением бромистого эти"
ва клеток в камере Горяева. Далее промывали
дия. Электрофорез проводили в 0,5"кратном
суспензию 2 раза 2%"ным бычьим сывороточ"
Tris"боратном буфере
(44,5
мМ Tris;
ным альбумином (БСА) в том же натрий"фос"
44,5 мМ борная кислота; 1 мМ ЭДТА; pH 8) в те"
фатном буфере и затем центрифугировали при
чение 40 мин при напряжении 130 В. Продук"
1500 g, 7 мин при 4 °С. Разбавляли лимфоциты
ты ПЦР вычищали из реакционной смеси с по"
буфером для окрашивания (1% БСА, 0,1% NaN3
мощью набора GeneJET PCR Purification
в натрий"фосфатном буфере).
Kit («Thermo Scientific»), согласно протоколу
Определение количества CD25+Foxp3+СD4+
производителя. С очищенной пробой ставили
клеток методом проточной цитометрии. Полу"
реакцию с экзонуклеазой фага лямбда (Lambda
ченную суспензию клеток разбавляли натрий"
Exonuclease, «Thermo Scientific»), согласно реко"
фосфатном буфером (1,8 мМ KH2PO4, 10 мM
мендациям производителя. Данный фермент
Na2HPO4, 2,7 мМ KCl, 137 мМ NaCl; pH 7,4) до
обладает экзонуклеазой активностью по отно"
концентрации 3000-5000 клеток/мкл и прово"
шению к двуцепочечным ДНК при наличии в
дили окрашивание клеток. Для этого 250 мкл
них фосфатных групп на 5′"конце, с его по"
суспензии инкубировали с антителами PE/Cy7"
мощью получали одноцепочечные ДНК. Полу"
anti"CD4 и APC"anti"CD25
(«BioLegend»,
ченные ДНК (10 мкл) денатурировали 5 мин при
США) 60 мин при +4 °С. Затем образцы фикси"
температуре 95 °С в 15 мкл денатурирующего бу"
ровали при помощи однократного реактива
фера (95%"ный формамид; 10 мМ KOH) и ох"
True"Nuclear™ Fix («BioLegend») 50 мин в тем"
лаждали реакционную смесь на льду. К получен"
ноте при комнатной температуре. Далее пермо"
ным образцам добавляли краску (0,1% бромфе"
билизировали клеточную мембрану при помо"
нолового синего; 0,1% ксиленцианола) в соот"
щи однократного True"Nuclear™ Perm Buffer
ношении 1/100, наносили ДНК на 12%"ный по"
(«BioLegend»), центрифугировали 10 мин при
лиакриламидный гель и проводили электрофо"
2100 g и 20 °С. Затем разбавляли клетки 100 мкл
рез в
1"кратном Tris"боратном буфере
буфера для пермобилизации True"Nuclear™ Perm
(89 мМ Tris; 89 мМ борная кислота; 2 мМ ЭДТА;
(«BioLegend») и инкубировали с антителами
pH 8) в течение 20 ч при напряжении 220 В.
AlexaFluor488"anti"Foxp3 («BioLegend») 90 мин в
После электрофореза гель красили сереб"
темноте при комнатной температуре. Затем об"
ром [55]. Гель промывали ультрачистой деиони"
разцы промывали буфером для пермобилизации
зированной водой (Milli"Q) и фиксировали
True"Nuclear™ Perm и буфером для окрашива"
20 мин в 10%"ном растворе уксусной кислоты.
ния. После промывки клетки разбавляли буфе"
Затем отмывали гель от кислоты водой Milli"Q
ром для окрашивания до концентрации
3 раза по 2 мин и оставляли в растворе серебра
1500-3000 клеток/мкл и хранили в темноте при
(0,1% AgNO3, 0,15%"ный параформальдегид) на
температуре 4 °С до анализа (1-2 дня). Анализ
30 мин. Раствор серебра удаляли и промывали
клеток проводили на проточном цитофлуори"
гель водой Milli"Q 20 с. Гель проявляли холод"
метре Guava easyCyte
8HT Flow Cytometer
ным проявочным раствором
(3% Na2CO3;
(«Merk»), в каждом образце анализировали 50 000
0,3% параформальдегида; 0,0002% Na2S2O3),
лимфоцитов. В популяции лимфоцитов выделя"
после проявки окрашивание останавливали хо"
ли одиночные клетки (синглеты), затем выделя"
лодным 10%"ным раствором уксусной кислоты.
ли одиночные CD4+"лимфоциты. Процент
Гель фотографировали при помощи гель"доку"
CD25+Foxp3+"клеток определяли среди CD4+"
ментирующей системы Gel DocTM XR+ System
лимфоцитов, количество CD4+CD25+Foxp3+"
(«Bio Rad», США).
клеток вычисляли из клеточности и выражали
Получение лимфоцитов из мезентериальных
как
106
клеток. Процент CD4+CD25+ и
лимфатических узлов. Мезентериальные лимфа"
CD4+Foxp3+ определяли среди лимфоцитов.
тические узлы вырезали из брыжейки и поме"
Биохимический анализ крови. Биохимичес"
щали в пробирку на 1,5 мл, содержащую 500 мкл
кий анализ крови проводили на анализаторе
натрий"фосфатного буфера (1,8 мМ KH2PO4,
Dimension RxL Max («Dade Bexring Inc.», США).
10 мM Na2HPO4, 2,7 мМ KCl, 137 мМ NaCl;
Использовали картриджи с реагентами для оп"
pH 7,4), далее пробирку держали на льду. Гомо"
ределения креатинина, креатинкиназы, аланин"
БИОХИМИЯ том 87 вып. 3 2022
364
БЕЦ и др.
аминотрансферазы (АЛТ), аспартатамино"
Для сравнения групп, в которых детектировался
трансферазы (ACT) (Dimension Clinical Kit,
или нет признак, использовали точный тест Фи"
«Siemens Healthcare Diagnostics, Inc.», США).
шера. Обработку данных по биохимическим по"
Статистическая обработка. Все данные
казателям проводили методом MANOVA.
представлены как среднее ± стандартное откло"
нение. Статистическую обработку полученных
данных проводили при помощи программного
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
обеспечения IBM@SPSS@Statistic (версия 23).
Для анализа выборок, не описывающихся нор"
Мыши Muc2-/- являются наиболее подходя"
мальным распределением, использовали непа"
щей моделью для изучения ВЗК, поскольку на"
раметрические методы статистической обработ"
рушение синтеза муцина 2 связано с сокраще"
ки. Сравнение между двумя группами для выбо"
нием количества бокаловидных клеток у людей,
рок с нормальным распределением проводили
которые страдают ЯК [56]. В данной работе у
при помощи t"критерия Стьюдента, а для выбо"
мышей линии С57BL/6 наблюдали ярко"розо"
рок при отсутствии нормального распределе"
вые гранулы с гликопротеинами (ШИК"реак"
ния - при помощи критерия Манна-Уитни.
ция) в бокаловидных клетках толстой кишки,
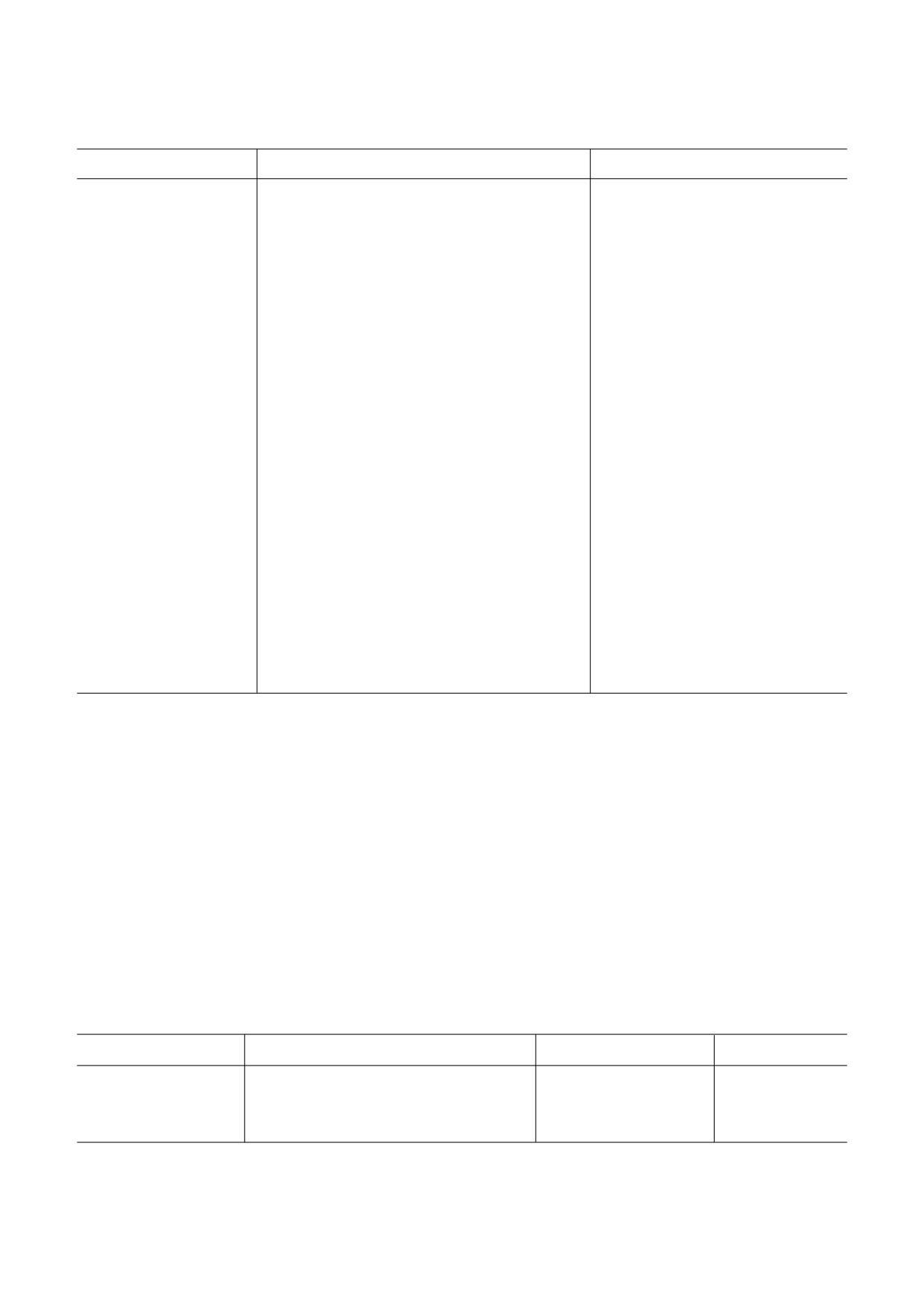
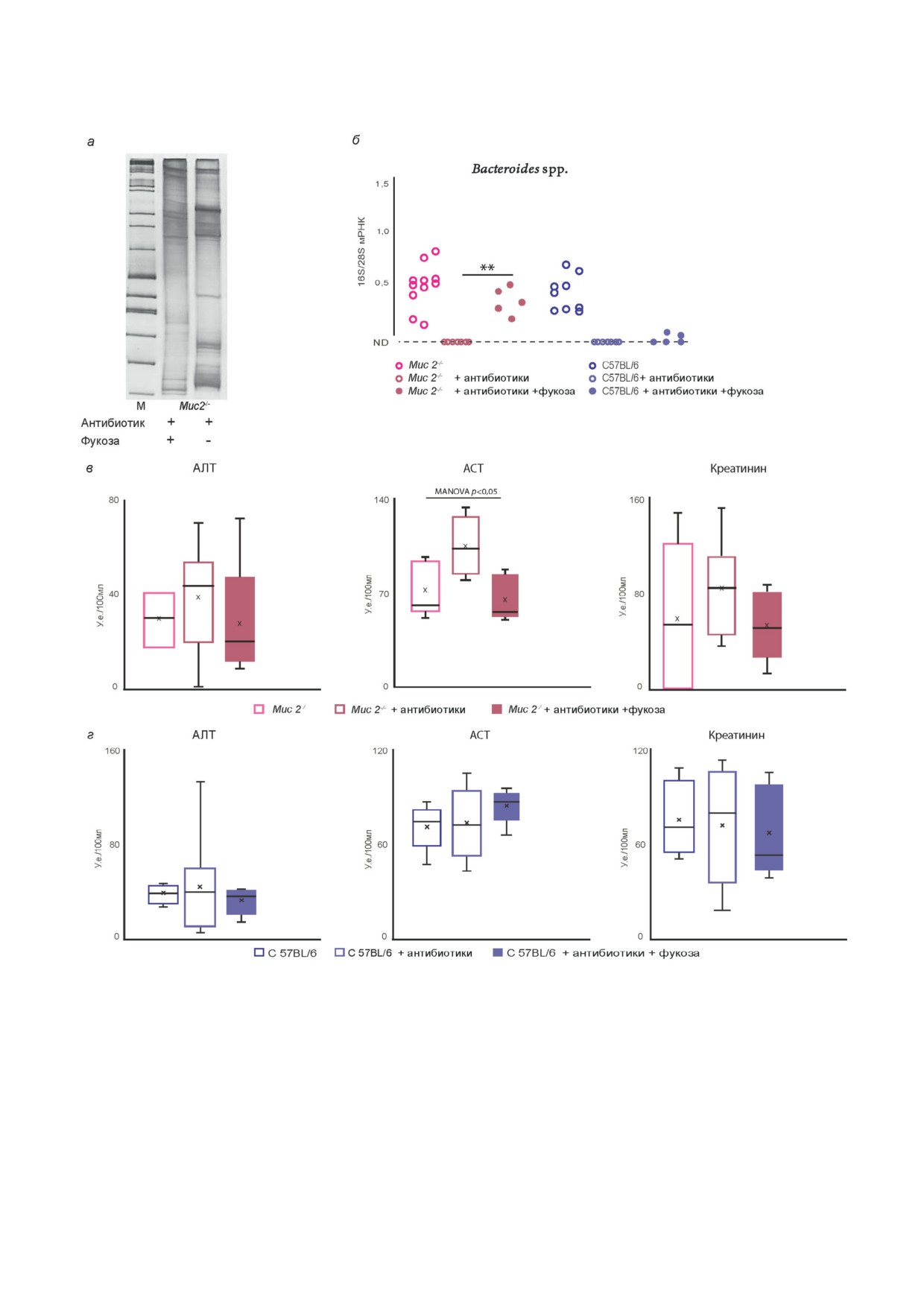
Рис. 1. Муцины на гистологических срезах толстой кишки и концентрация фукозы в толстой кишке, качественный и ко"
личественный бактериальный состав фекалий мышей Muc2-/- и дикого типа С57BL/6. а - Гистологический срез толстой
кишки (проксимальный отдел) мышей Muc2-/- и дикого типа С57BL/6. Стрелка указывает на бокаловидную клетку с
окрашенным (ШИК"реакция) муцином. б - Фукоза, связанная с белком в ткани толстой кишки мышей Muc2-/- (n = 10)
и дикого типа С57BL/6 (n = 10). в - Качественный состав кишечной микрофлоры у мышей Muc2-/- и дикого ти"
па С57BL/6, оценённый методом одноцепочечного конформационного полиморфизма (SSCP) вариабельного (V4) участ"
ка 16s рРНК. г - Количество бактериальной ДНК (16S рРНК Bacteria, n = 12; Bacteroides spp., n = 20; Enterococcus spp.,
n = 20; Lactobacillus spp., n = 20; Streptococcus spp., n = 13; Staphylococcus spp., n = 13; Blautia spp., n = 13; E. coli, n = 13) в фе"
калиях у мышей Muc2-/- и дикого типа С57BL/6. *** p < 0,001, t"тест Стьюдента. * p < 0,05, ** p < 0,01 - Манн-Уитни
u"тест. p = 0,06 точный тест Фишера. ND - ниже порога чувствительности метода детекции
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
365
тогда как у мышей линии Muc2-/- гранулы с гли"
жания в процессе выполнения возвратного
копротеинами отсутствовали (рис. 1, а). Извест"
скрещивания мышей Muc2-/- на дикий
но, что муцин 2 - основной гликопротеин, ко"
тип C57BL/6, и дальнейшее получение живот"
торый вырабатывают бокаловидные клетки как
ных через гетерозиготное скрещивание родите"
толстой, так и тонкой кишок [57]. Именно по"
лей Muc2+/-. Но все же некоторые бактериаль"
этому у мышей Muc2-/- отсутствуют гранулы с
ные сообщества кишечника мышей Muc2-/- от"
муцином 2 в бокаловидных клетках.
личались от мышей дикого типа C57BL/6, что,
Также известно, что у людей с БК нарушает"
скорее всего, обусловлено отсутствием муцина 2
ся фукозилирование муцина 2, т.е. процесс
в просвете кишки.
прикрепления терминального моносахарида
Истончение муцинового слоя кишечника,
фукозы [58]. На рис. 1, б мы наблюдали сниже"
основным компонентом которого является му"
ние количества связанной с белком фукозы у
цин 2, приводит к снижению фукозы в кишеч"
мышей линии Muc2-/- по сравнению с мышами
нике и, как следствие, к качественным измене"
дикого типа С57BL/6. Надо отметить, что у мы"
ниям кишечного микробиома [36, 45, 46]. Как
шей, используемых в экспериментах, присут"
известно, из"за постоянного взаимодействия
ствовала инфекция Helicobacter spp. Известно,
кишечной микрофлоры и иммунных клеток ки"
что она способна провоцировать колит у мы"
шечника отсутствие муцина 2 в сочетании с из"
шей Il10-/- [15].
менением состава бактериальных представите"
Мы предположили, что подобный дефицит
лей, особенно в присутствии инфекции
связанной фукозы может приводить к сниже"
Helicobacter spp., должны вызывать воспалитель"
нию фукозилированных протеогликанов в
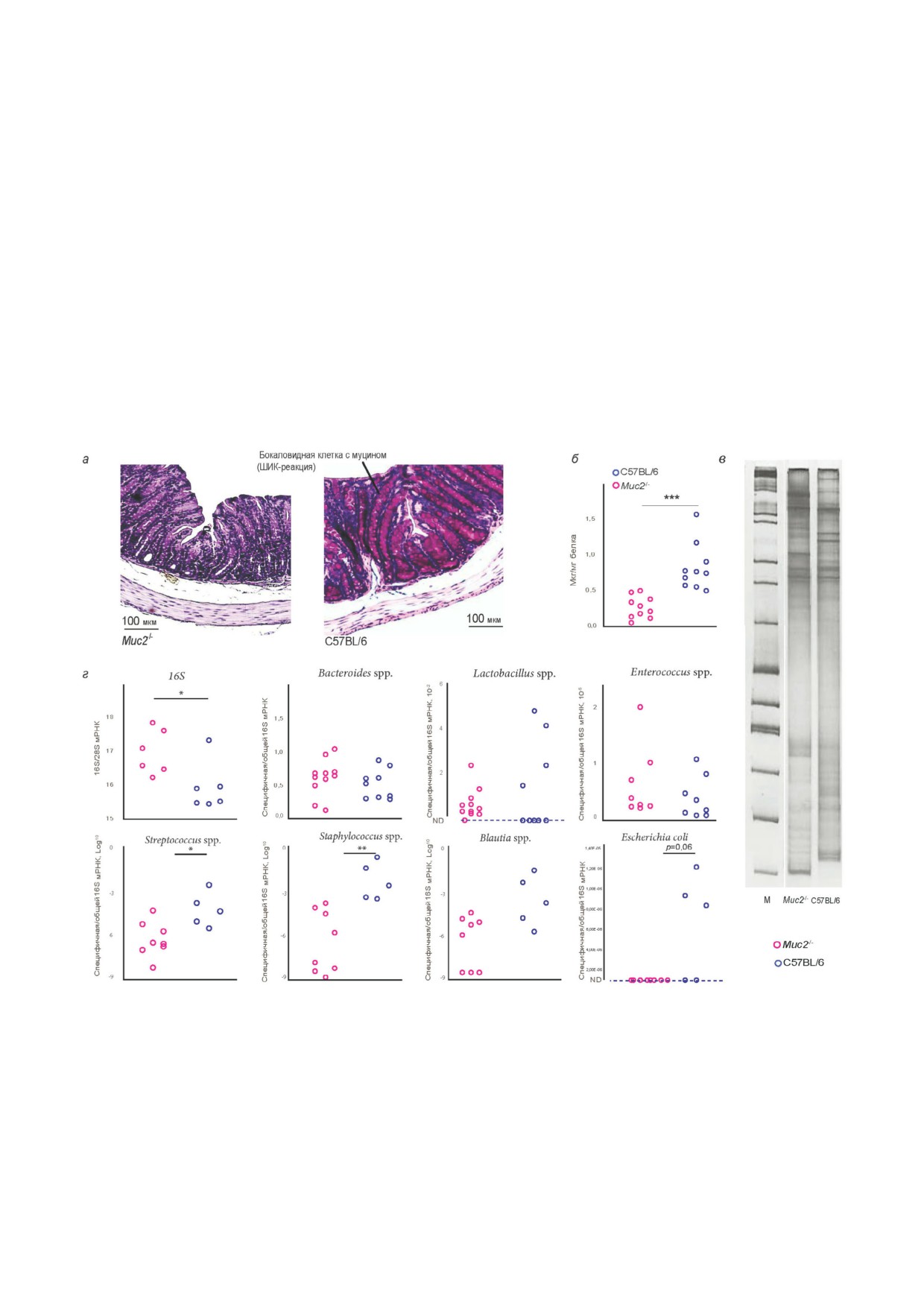
ные реакции. Однако на гистологических срезах
просвете толстой кишки. А фукоза в составе
у мышей Muc2-/- не было выявлено признаков
гликанов может отщепляться фукозидазами
острой воспалительной реакции: инфильтрация
бактерий [59]. Тем самым отсутствие фукозы в
нейтрофилов, отёк и разрушение крипт
составе гликанов или отсутствие самих глика"
(рис. 2, а). Ранее было показано, что на хими"
нов может влиять на разнообразие кишечных
чески"индуцированной модели ВЗК признаки
симбиотических бактерий, так как фукоза явля"
острого воспаления ярко выражены в виде отё"
ется для многих бактерий фактором вирулент"
ка, разрушения крипт и инфильтратов иммун"
ности и источником энергии [41]. Действитель"
ных клеток [43]. На гистологических срезах
но, у мышей Muc2-/- обнаружили качественные
проксимального отдела толстой кишки у мы"
изменения состава кишечной микрофлоры по
шей Muc2-/- было выявлено только удлинение
сравнению с мышами дикого типа С57BL/6, ко"
крипт более чем в 2 раза по сравнению с мыша"
торые оценивали методом одноцепочечного
ми линии C57BL/6 (рис. 2, а). Количество кле"
конформационного полиморфизма (SSCP) ва"
ток в крипте достоверно больше у мышей ли"
риабельного (V4) участка 16s рРНК (рис. 1. в).
нии Muc2-/- по сравнению с мышами дикого ти"
Одна дорожка на рис. 1. в - это определенный
па C57BL/6 (рис. 2, б). Применение антибиоти"
штамм бактерий.
ков и в сочетании с фукозой не повлияло на вы"
Количественный анализ отдельных видов
соту крипт (рис. 2, в и д), так, различий по коли"
бактерий, который был оценён методом ПЦР в
честву клеток в пределах одного генотипа не
реальном времени, показал изменение количе"
наблюдалось, а разница количества клеток в
ства ДНК 16S рРНК Bacteria (Манн"Уитни
крипте между мышами Muc2-/- и C57BL/6 со"
u"тест: Z = 2,24, p > 0,05) и некоторых семейств
хранилась такой же, как и у нативных живот"
бактерий между линиями мышей. Мы"
ных (рис. 2, г и е). Удлинение крипт не было свя"
ши Muc2-/- с инфекцией Helicobacter spp. не от"
зано и с наличием инфекции Helicobacter spp.,
личались от мышей дикого типа C57BL/6 по ко"
так как в другом исследовании также было пока"
личеству ДНК
16S рРНК Bacteroides spp.
зано удлинение крипт у мышей Muc2-/-, кото"
(Z = 0,95, p > 0,05), Enterococcus spp. (Z = 1,05,
рые не имели Helicobacter spp. [43]. Мы предпо"
p > 0,05), Lactobacillus spp. (Z = 0,57, p > 0,05),
лагаем, что в связи с отсутствием кишечного
Blautia spp. (Z = 1,54, p > 0,05). Однако предста"
гликопротеина, эпителиальные клетки и микро"
вители
семейств
Streptococcus
spp.,
организмы тесно взаимодействуют, а удлинение
Staphylococcus spp. и E. coli были достоверно ни"
крипт может иметь адаптивный характер и обес"
же у мышей Muc2-/- по сравнению с мышами
печивать более эффективное выведение бакте"
дикого типа C57BL/6 (Z = 2,2, p > 0,05; Z = 2,8,
рий из просвета кишечника вместо подвижного
p < 0,01 и точный тест Фишера - p = 0,06;
жидкого слоя муцина.
рис. 1, г). Схожесть по некоторым таксономи"
Анализ уровня экспрессии генов в восходя"
ческим группам, возможно, связана с тем, что
щем отделе ткани толстой кишки показал уве"
животные проходили этап совместного содер"
личение количества мРНК генов провоспали"
БИОХИМИЯ том 87 вып. 3 2022
366
БЕЦ и др.
Рис. 2. Высота крипт на гистологических срезах толстой кишки интактных мышей Muc2-/- и дикого типа С57BL/6 до и
после применения антибиотиков или антибиотиков в сочетании с фукозой. а - Гистологический срез толстой кишки
(проксимальный отдел) мышей, сравнение высоты крипт между мышами Muc2-/- и диким типом С57BL/6. Окраска ге"
матоксилин"эозином. б - Количество клеток в крипте проксимального отдела толстой кишки мышей Muc2-/- (n = 6)
и С57BL/6 (n = 11). в - Гистологический срез толстой кишки (проксимальный отдел) мышей Muc2-/- и дикого ти"
па С57BL/6 после применения антибиотиков. Окраска - ШИК"реакция. г - Количество клеток в крипте проксимально"
го отдела толстой кишки мышей Muc2-/- (n = 5) и С57BL/6 (n = 5) после применения антибиотиков. д - Гистологический
срез толстой кишки (проксимальный отдел) мышей Muc2-/- и дикого типа С57BL/6 после применения антибиотиков в
сочетании с фукозой. Окраска - ШИК"реакция. е - Количество клеток в крипте проксимального отдела толстой кишки
мышей Muc2-/- (n = 5) и С57BL/6 (n = 5) после применения антибиотиков в сочетании с фукозой. *** p < 0,001, t"тест
Стьюдента
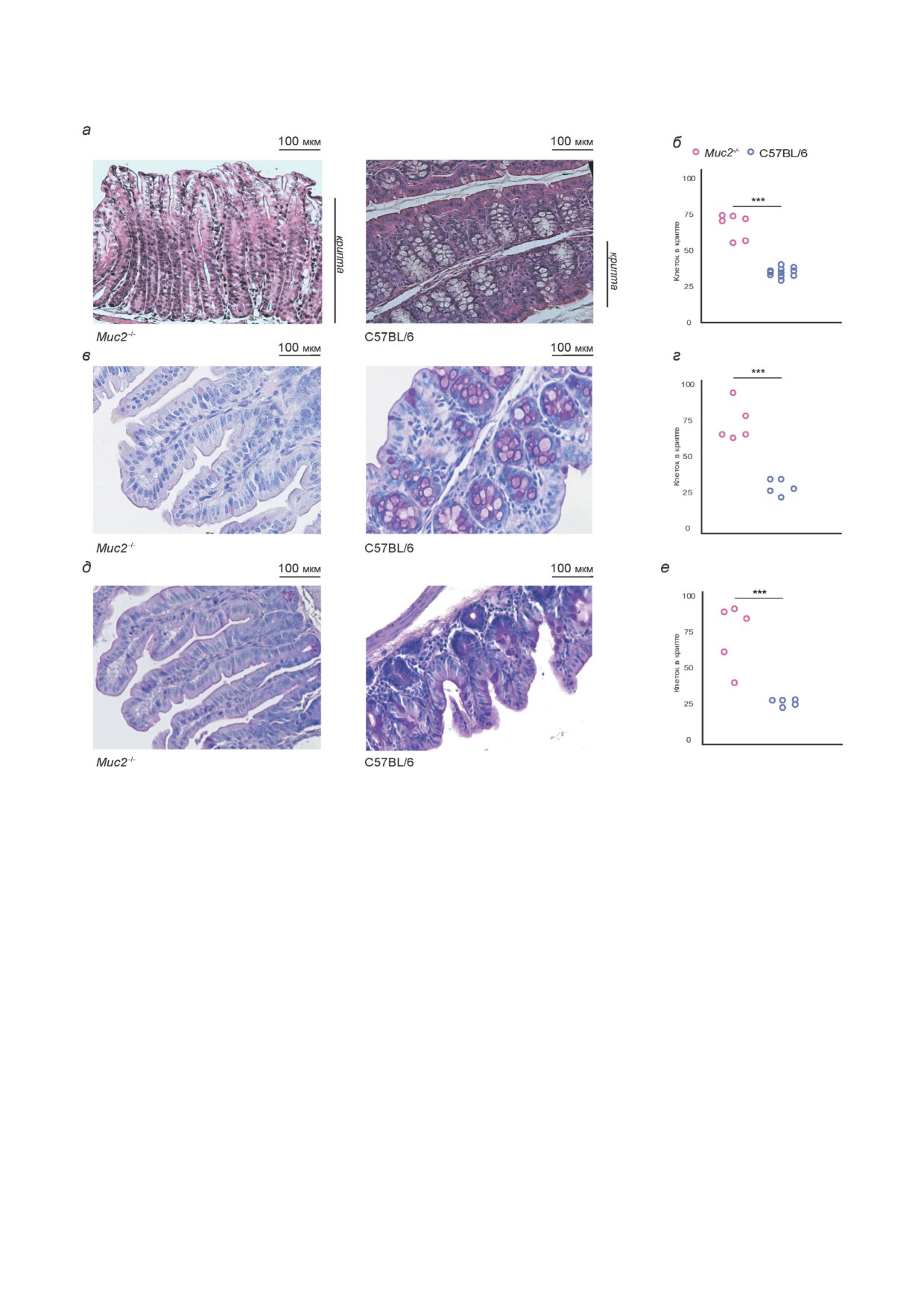
тельных цитокинов. Количество мРНК ге"
диким типом C57BL/6 (Z = 2,1, p < 0,05). Коли"
нов Tnf и l1a было значительно выше у мы"
чество IFN"gamma в ткани толстой кишки не
шей Muc2-/- по сравнению с мышами дикого
отличалось между мышами Muc2-/- и диким ти"
типа C57BL/6 (рис. 2, в). Уровень мРНК ге"
пом C57BL/6 (Z = 1,3, p > 0,05; рис. 3, б).
нов Il1b и Il6 не отличался между мыша"
Известно, что в ответ на длительное воспале"
ми Muc2-/- и диким типом C57BL/6 (t = 1,8,
ние организм запускает противовоспалитель"
p > 0,05; рис. 3, а). Уровень экспрессии белка IL"
ный ответ с помощью активации Т"регулятор"
1a в ткани толстой кишки тоже демонстрирует
ных клеток [33, 60]. В связи с этим определение
повышение у мышей Muc2-/- по сравнению с
экспрессии различных транскрипционных фак"
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
367
торов, запускающих активацию Т"клеток по
Т"регуляторных клеток действительно стано"
разным путям, поможет понять, какие пулы Т"
вится больше у мышей линии Muc2-/-, но толь"
клеток преобладают в ткани толстой кишки мы"
ко в случае присутствия инфекции Helicobacter
шей Muc2-/-. Количество мРНК гена тран"
spp. [44]. В ряде работ показано, что бактерии
скрипционного фактора Т"регуляторных кле"
рода Helicobacter могут запускать толерагенный
ток (Foxp3) было достоверно выше у мы"
ответ, чтобы обеспечить себе благоприятную
шей Muc2-/- по сравнению с мышами дикого
среду для развития [17, 36, 44], но требуются до"
типа C57BL/6 (рис. 3, в). Подобный эффект был
полнительные исследования, чтобы понять
показан нами ранее на клетках, участниках Т"
роль хеликобактерной инфекции в этом фено"
регуляторного иммунного ответа. В мезентери"
мене.
альных лимфатических узлах количество
Для уменьшения бактериальной нагрузки и
СD4+CD25+Foxp3+"клеток было выше у мы"
воспаления у пациентов с ВЗК часто применяют
шей Muc2-/- по сравнению с мышами дикого
антибактериальную терапию. Было показано,
типа C57BL/6 при наличии Helicobacter spp. [41].
что антибиотики для лечения Helicobacter spp. у
Уровень мРНК генов транскрипционных фак"
мышей Muc2-/- были не только малоэффектив"
торов Th1"клеток (Tbх21) и Th17"клеток (Rorс)
ными, но и также приводили к гибели животно"
не отличался между мышами Muc2-/- и C57BL/6
го из"за сопутствующего разрастания протозой"
(t = 0,9, p > 0,05 и t = 1,1, p > 0,05 соответствен"
ной инфекции [49]. Но антибиотики влияют на
но; рис. 3, в). Также не было различий между ге"
представленность бактерий в кишечнике. При"
нотипами мышей по уровню цитокинов IL"
менение антибиотиков широкого спектра сни"
22 (Z = 0,8, p > 0,05), IL"17 (Z = 0,5, p > 0,05), IL"
жало количество ДНК 16S рРНК Bacteria как у
12p40 (Z = 1,8, p > 0,05), IL"12p70 (Z = 1,5,
мышей Muc2-/- (с 3298,7 ± 3427,7 до 12,5 ± 4,7;
p > 0,05), которые участвуют в развитии Th1" и
Z = 2,2; p < 0,05; n = 6), так и у C57BL/6
Th17"иммунных ответов.
(c 2567,8 ± 719,7 до 44,8 ± 81,3; Z = 2,8; p < 0,01;
По всей видимости, запуск не только воспа"
n = 11). На фоне этого применение антибиоти"
лительных, но и регуляторных механизмов
ков у мышей Muc2-/- и C57BL/6 вызывало более
обеспечивают стабильность гомеостаза имму"
чем в 2 раза снижение связанной с белком фуко"
нитета в толстой кишке у мышей Muc2-/-. В бо"
зы в толстой кишке (рис. 4, а). Такое снижение
лее ранних наших работах мы показали, что в
фукозы может быть связано с уменьшением ко"
региональных лимфатических узлах количество
личества бактерий, так как фукозидазы бакте"
Рис. 3. Провоспалительные цитокины и транскрипционные факторы в толстой кишке мышей Muc2-/- и дикого ти"
па С57BL/6. а - Количество мРНК генов провоспалительных цитокинов (Tnf, Il1a, Il1b, Il6) в восходящем отделе ткани
толстой кишки у мышей Muc2-/- (n = 11) и С57BL/6 (n = 4). б - Количество белка провоспалительных цитокинов (IL"1a,
IFN"gamma) в ткани восходящего отдела толстой кишки у мышей Muc2-/- (n = 3) и С57BL/6 (n = 6). в - Количество мРНК
генов в восходящем отделе транскрипционных факторов T"клеток (Foxp3 - Treg, Rorc - Th17, Tbx21 - Th1) в ткани толс"
той кишки у мышей Muc2-/- (n = 11) и С57BL/6 (n = 4-8). г - Количество белка цитокинов (IL"22, IL"17, IL"12p40, IL"
12p70), участников Th1" и Th17"ответа в ткани восходящего отдела толстой кишки у мышей Muc2-/- (n = 3) и С57BL/6
(n = 6). *** p < 0,001; ** p < 0,01 - t"тест Стьюдента. * p < 0,05 - Манн-Уитни u"тест. ND - ниже порога чувствительнос"
ти метода детекции
БИОХИМИЯ том 87 вып. 3 2022
368
БЕЦ и др.
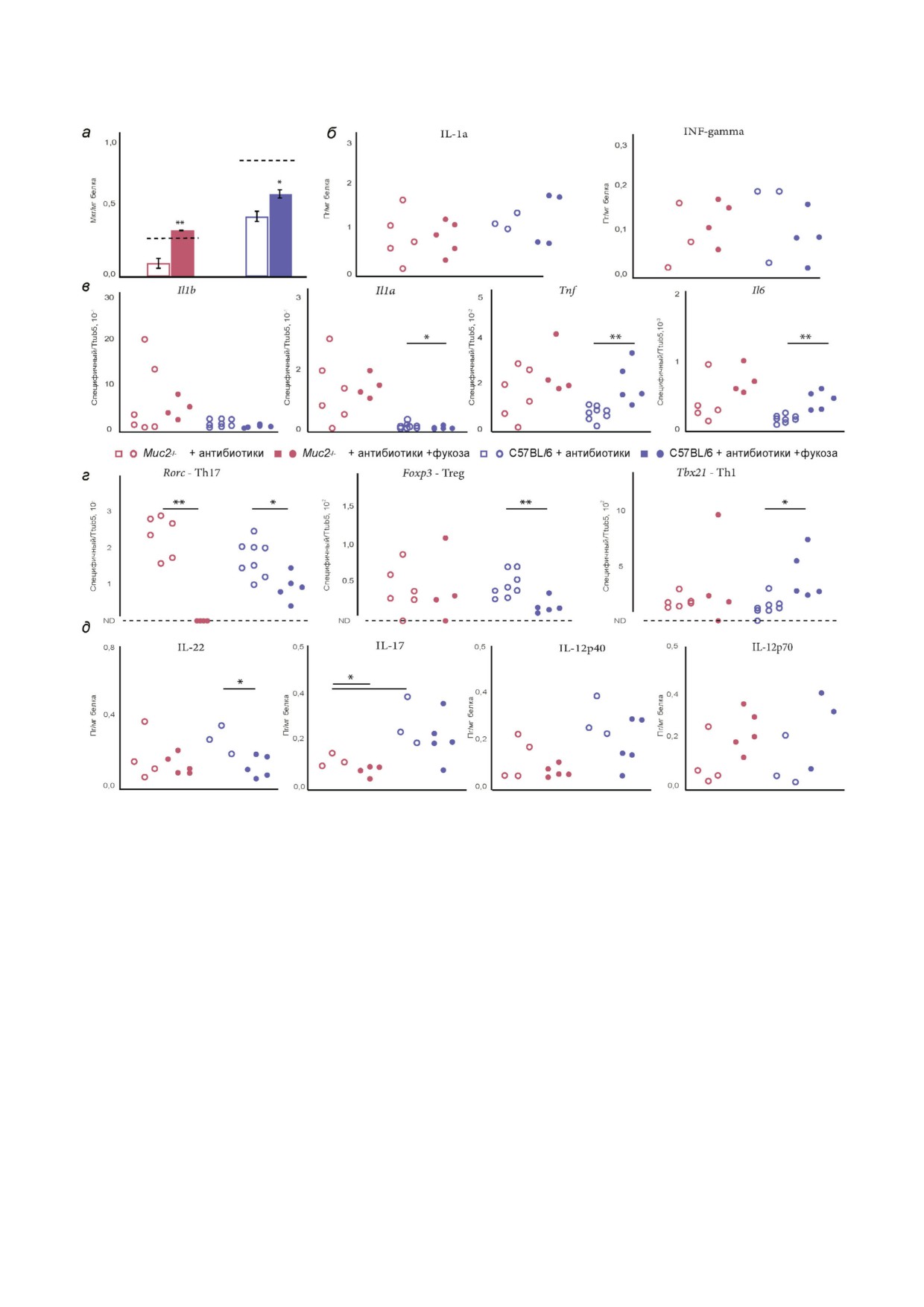
Рис. 4. Фукоза, провоспалительные цитокины и транскрипционные факторы в толстой кишке мышей Muc2-/- и дикого
типа С57BL/6 после применения антибиотиков или антибиотиков в сочетании с фукозой. а - Фукоза, связанная с белком
в проксимальном отделе толстой кишки мышей Muc2-/- (n = 7) и С57BL/6 (n = 10) на фоне применения антибиотиков и
антибиотиков в сочетании с фукозой. Пунктирная линия: базальный уровень фукозы у каждой линии мышей, не прини"
мавших антибиотики. б - Количество белка провоспалительных цитокинов (IL"1a, INF"gamma) в восходящем отделе тка"
ни толстой кишки у мышей Muc2-/- (n = 10) и С57BL/6 (n = 8) на фоне применения антибиотиков и антибиотиков в со"
четании с фукозой. в - Количество мРНК генов провоспалительных цитокинов (Il1b, Il1a, Tnf, Il6) в восходящем отделе
ткани толстой кишки у мышей Muc2-/- (n = 10) и С57BL/6 (n = 13) на фоне применения антибиотиков и антибиотиков в
сочетании с фукозой. г - Количество транскрипционных факторов T"клеток (Foxp3 - Treg, Rorc - Th1, Tbx21 - Th17) в
восходящем отделе ткани толстой кишки у мышей Muc2-/- (n = 10) и С57BL/6 (n = 13) на фоне применения антибиоти"
ков и антибиотиков в сочетании с фукозой. д - Количество белка цитокинов (IL"22, IL"17, IL"12p40, IL"12p70), участни"
ков Th1" и Th17"ответа в ткани восходящего отдела толстой кишки у мышей Muc2-/- (n = 10) и С57BL/6 (n = 8) на фоне
применения антибиотиков и антибиотиков в сочетании с фукозой. * p < 0,05, ** p < 0,01; t"тест Стьюдента. ND - ниже по"
рога чувствительности метода детекции
рий могут отщеплять фукозу из гликанов как са"
менение количества представителей разных ро"
мих хозяев, так и клеточных стенок бактерий.
дов бактерий после применения антибиотиков.
Известно, что представители рода Bacteroides
Нам не удалось детектировать ДНК Bactero"
могут экспрессировать подобные фермен"
ides spp., Enterococcus spp. и Lactobacillus spp. как
ты [61]. В связи с этим мы решили оценить из"
у мышей Muc2-/- (11 из 11 позитивных без анти"
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
369
биотиков к 6 из 6 негативных после терапии,
нение микрофлоры вызывало снижение Т"регу"
точный критерий Фишера, p < 0,001), так и у ди"
ляторных клеток в мезентериальных лимфати"
кого типа C57BL/6 на фоне приёма антибиоти"
ческих узлах.
ков (9 из 9 позитивных без антибиотиков к 6
Транскрипционные факторы Th1" и Th17"
из 6 негативных после терапии, точный крите"
ответа не изменились на фоне терапии антибио"
рий Фишера, p < 0,001).
тиками у мышей Muc2-/-: Tbex с 0,0008 ± 0,0004
Известно, что у пациентов с ВЗК примене"
до 0,0012 ± 0,0006 (Z = 1,1; p > 0,05; n = 17) и Rorc
ние антибиотиков может уменьшать воспаление
c 0,20 ± 0,07 до 0,17 ± 0,05 (Z = 1,7; p > 0,05;
в силу снижения бактериальной нагрузки [19].
n = 16). Аналогично, у мышей Muc2-/- не было
На фоне приёма антибиотиков у мышей Muc2-/-
эффекта антибиотиков на количество цитоки"
не было достоверного изменения количества
нов IL"22 (с 0,35± 0,36 до 0,17 ± 0,12; Z = 0,1;
мРНК генов провоспалительных цитоки"
p > 0,05; n = 8), IL"17 (с 0,08 ± 0,001 до
нов Tnf (c
0,024
± 0,011 до
0,019
± 0,009;
0,09 ± 0,02; Z = 0,6; p > 0,05; n = 8), IL"12p40
Z = 0,9; p > 0,05; n = 16), Il1a (c 0,097 ± 0,04 до
(с 0,06 ± 0,01 до 0,10 ± 0,06; Z = 0,7; p > 0,05; n = 8),
0,14 ± 0,11; Z = 0,6; p > 0,05; n = 17), Il1b
IL"12p70 (с 0,12 ± 0,02 до 0,08 ± 0,07; Z = 1,1;
(c 0,096 ± 0,12 до 0,07 ± 0,08; Z = 0,4; p > 0,05;
p > 0,05; n = 8), которые участвуют в развитии
n = 17) и Il6 (c 0,002 ± 0,001 до 0,004 ± 0,003;
Th17" и Th1"иммунных ответов. У мышей дико"
Z = 1,9; p > 0,05; n = 14; рис. 3, б). Также не бы"
го типа C57BL/6 антибиотики привели не толь"
ло эффекта от антибиотиков у мышей Muc2-/-
ко к повышению экспрессии гена Tnf с
на количество белка провоспалительных цито"
0,004 ± 0,002 до 0,008 ± 0,003 (Z = 2,0; p < 0,05;
кинов IL"1a (c 0,69 ± 0,09 до 0,94 ± 0,52; Z = 0,7;
n = 12), но и к активации гена Tbex21 (тран"
p > 0,05; n = 8) и IFN"gamma (c 0,02 ± 0,02 до
скрипционного
фактора
Th1"клеток)
0,07 ± 0,06; Z = 1,5; p > 0,05; n = 8). При этом у
с 0,00006 ± 0,00007 до 0,00082 ± 0,00071 (Z = 2,7;
мышей линии C57BL/6 был эффект антибиоти"
p < 0,01; n = 11). Остальные транскрипционные
ков на уровень мРНК генов провоспалительных
факторы не изменились на фоне терапии анти"
цитокинов. Количество мРНК гена Tnf возрас"
биотиками у C57BL/6 мышей, так же как и у
тало c 0,004 ± 0,002 до 0,008 ± 0,009; Z = 2,1
мышей Muc2-/-: Foxp3 с
0,011
±
0,008 до
(p < 0,05; n = 12), а Il6 снижалось в 3 раза c
0,005 ± 0,002 (Z = 1,3; p > 0,05; n = 12) и Rorc c
0,003 ± 0,0005 до 0,001 ± 0,0005; Z = 2,6 (p < 0,01;
0,16 ± 0,05 до 0,17 ± 0,05 (Z = 0,5; p > 0,05; n = 12).
n = 12). Экспрессия остальных генов не измени"
Однако уровень IL"17, который вовлечён в
лась: Il1a (c 0,022 ± 0,025 до 0,018 ± 0,009; Z = 0,3;
Th17"ответ, вырос в 2 раза на фоне приёма анти"
p > 0,05; n = 12) и Il1b (c 0,006 ± 0,005 до
биотиков (с 0,09 ± 0,02 до 0,21 ± 0,08; Z = 2,3;
0,016 ± 0,008; Z = 1,9; p > 0,05; n = 12). Количе"
p < 0,05; n = 9). Антибиотики не повлияли на
ство провоспалительного цитокина IL"1a в тка"
другие цитокины, участвующие в Th17" и Th1"
ни толстой у мышей линии C57BL/6 увеличи"
иммунных ответах: IL"22 (с 0,18 ± 0,18 до
лось в 5 раз на фоне применения антибиотиков
0,26 ± 0,08; Z = 0,8; p > 0,05; n = 9), IL"12p40
(c 0,18 ± 0,22 до 1,23 ± 0,16; Z = 2,3; p < 0,05;
(с 0,09 ± 0,03 до 0,16 ± 0,15; Z = 0,8; p > 0,05;
n = 9), тогда как INF"gamma не изменился (c
n = 9) и IL"12p70 (с 0,08 ± 0,04 до 0,06 ± 0,08;
0,004 ± 0,004 до 0,06 ± 0,08; Z = 1,1; p > 0,05;
Z = 0,8; p > 0,05; n = 9). Антибиотики нивелиро"
n = 9). Несмотря на применение антибиотиков
вали различия между линиями мышей (рис 4, г).
разница между линиями сохранилась (рис. 4, в).
Таким образом, снижение экспрессии Т"регуля"
Таким образом, при наличии Helicobacter spp. у
торного фактора у мышей Muc2-/- на фоне при"
мышей Muc2-/-приём антибиотиков снижает
ёма антибиотиков не способно сдерживать вос"
количество бактерий основных таксономичес"
паление в кишке даже при снижении бактери"
ких групп, но не вызывает уменьшения провос"
альной нагрузки.
палительного ответа.
Ранее был показан эффект добавления пи"
Известно, что для переключения воспаления
щевой L"фукозы на активацию макрофагов,
на противовоспалительный ответ необходимо
элиминацию протозойной инфекции и увеличе"
активировать Т"регуляторные клетки. Действи"
ние триптофан"производящих бактерий [42, 43,
тельно, уровень экспрессии гена Foxp3 у мы"
49]. При терапии антибиотиками уровень фуко"
шей Muc2-/- на фоне приёма антибиотиков дра"
зы снижался у мышей Muc2-/-, а добавленная к
матически снижался с 0,17 ± 0,06 до 0,005 ± 0,002
антибиотикам L"фукоза восстанавливала уро"
(Z = 3,1; p < 0,01; n = 15). У мышей Muc2-/-, по"
вень связанной фукозы до исходного уровня в
лучавших только антибиотики, количество
толстой кишке как мышей Muc2-/-, так и
CD4+CD25+Foxp3+"клеток достоверно снижа"
C57BL/6 (рис 4, а). Повышение уровня фукозы
лось (с (171,0 ± 86,9) × 103 до (33,9 ± 23,2) × 103;
в кишке может быть ассоциировано с восста"
Z = 3,18; p < 0,01; n = 15). Таким образом, обед"
новлением бактериального сообщества. Анализ
5 БИОХИМИЯ том 87 вып. 3 2022
370
БЕЦ и др.
качественного разнообразия бактерий в фека"
менением общего метаболизма в результате дис"
лиях мышей Muc2-/- показал изменение при до"
биоза. Ранее у мышей Muc2-/-Kaisoy/- было по"
бавлении фукозы к антибиотикам по сравнению
казано, что лечение Helicobacter spp. антибиоти"
с монотерапией антибиотиками (рис. 5, а). И
ками приводило к гибели животных [35]. У мы"
действительно, добавление фукозы к антибио"
шей при отсутствии муцина 2 повышается про"
тикам частично восстанавливало количество
ницаемость кишечника [36, 37], таким образом,
ДНК 16S рРНК Bacteria только у мышей Muc2-/-
бактериальные паттерны могут попадать в кровь
(с 12,5 ± 4,7 до 81,6 ± 61,6; Z = 2,2; p < 0,05; n = 6),
и вызывать цитотоксичность, которая сопро"
тогда как у C57BL/6 достоверного восстановле"
вождается увеличением АСТ и даже гибелью
ния не было (с 44,6 ± 81,2 до 0,7 ± 0,7; Z = 0,5;
животных, как было показано ранее [36, 50]. До"
p > 0,05; n = 11). Фукоза с антибиотиками час"
бавление L"фукозы к данной схеме приёма ан"
тично восстанавливала только количество ДНК
тибиотиков снижает концентрацию данного
Bacteroides spp. у мышей Muc2-/- (6 из 6 негатив"
фермента в крови до нормы, что является приз"
ных на фоне антибиотикотерапии против 5
наком уменьшения количества негативного
из 5 позитивных при добавлении фукозы, точ"
действия антибиотиков (рис. 5, в). Добавление
ный критерий Фишера, p < 0,01), чего не наблю"
фукозы полностью не восстанавливало уровень
далось у мышей линии C57BL/6 (6 из 6 негатив"
креатинина, в связи с чем можно предположить,
ных на фоне антибиотикотерапии против 2
что метаболизм Muc2-/- не может восстановить"
из 5 позитивных при добавлении фукозы, точ"
ся до исходного уровня (рис. 5, в).
ный критерий Фишера, p > 0,05; рис. 5, б). Вос"
Приём фукозы с антибиотиками восстанав"
становленный добавлением фукозы уровень
ливал связанную с белком фукозу в толстой киш"
Bacteroides spp. не отличался от исходно"
ке, частично поднимал количество ДНК
го (рис. 5, б). При этом Enterococcus spp. и
Bacteroides spp. и нормализовал биохимические
Lactobacillus spp. не восстанавливались даже час"
показатели у мышей Muc2-/-, однако это не сни"
тично у мышей обоих генотипов. Можно пред"
жало уровень воспалительных факторов. Умень"
положить, что фукоза в толстой кишке мы"
шение экспрессии гена Foxp3 также может усугу"
шей Muc2-/- является источником энергии в
бить состояние иммунной системы мы"
большей степени для бактерий рода Bacteroides,
шей Muc2-/-. В связи с этим можно полагать, что
что обусловливает частичное восстановление их
восстановление микрофлоры при добавлении
популяции на фоне приёма пищевой L"фукозы.
фукозы к антибиотикам может повлиять на уро"
Однако Enterococcus spp. и Lactobacillus spp. не
вень воспалительных цитокинов и транскрипци"
восстанавливались у обоих генотипов мышей,
онные факторы. У мышей Muc2-/- фукоза не вос"
что даёт возможность предположить о более
станавливала уровень экспрессии генов провос"
сложной метаболической роли фукозы для бак"
палительных цитокинов (рис. 4, в). Не восстано"
териального сообщества кишечника.
вила фукоза и количество провоспалительных
Так как интоксикация бактериальными пат"
цитокинов в ткани толстой кишки у мы"
тернами и самими антибиотиками может при"
шей Muc2-/- (рис. 4, б). Уровень мРНК генов
водить к нарушению биохимических показате"
транскрипционных факторов Th1 и Treg также не
лей крови, были оценены ферменты в крови:
изменился под действием фукозы, кроме ге"
аланинаминотрансфераза (АЛТ), аспартатами"
на Rorc (Th17), который вообще переставал де"
нотрансферазы (АСТ), креатинин до и после
тектироваться (рис. 4, г). Несмотря на отсутствие
применения антибиотиков и в сочетании с фу"
действия фукозы на количество мРНК ге"
козой у мышей Muc2-/-. MANOVA показала дос"
на Foxp3, мы обнаружили, что при добавлении
товерный эффект группы только для АСТ
фукозы восстанавливается количество регуля"
(рис. 5, в). У мышей дикого типа C57BL/6 не
торных Т"клеток в мезентериальных лимфати"
наблюдали достоверных отличий между биохи"
ческих узлах у мышей Muc2-/- (с (33,9 ± 23,2) × 103
мическими показателями на фоне приёма анти"
до (89,0 ± 54,3) × 103; Z = 1,97; p < 0,05; n = 13). Та"
биотиков и в сочетании с фукозой (рис. 5, г).
ким образом, добавление L"фукозы корригиро"
Можно предположить, что применение антибио"
вало эффект антибиотиков на снижение количе"
тиков не влияет на гомеостаз мышей дикого ти"
ства регуляторных Т"клеток. Снижение же
па, поскольку у них присутствует естественный
экспрессии гена Rorc в ответ на добавление фуко"
барьер в виде муцинов, и это препятствует ин"
зы согласовывалось и с уменьшением количества
токсикации погибающими патогенами в кишеч"
IL"17 у мышей Muc2-/- (рис. 4, д).
нике.
Стоит отметить, что фукоза приводила к по"
Антибиотики вызывали увеличение количе"
вышению экспрессии генов Tnf и Il6 и сниже"
ства фермента АСТ в крови у мышей Muc2-/-,
нию Ila C57BL/6"мышей (рис. 4, в). Однако фу"
что может быть связано с интоксикацией и из"
коза не повлияла на количество провоспали"
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
371
Рис. 5. Качественный и количественный бактериальный состав фекалий, биохимические показатели крови мы"
шей Muc2-/- и дикого типа С57BL/6 после применения антибиотиков или антибиотиков в сочетании с фукозой. а - Ка"
чественный состав кишечной микрофлоры у мышей Muc2-/- после применения антибиотиков и фукозы, оценённый ме"
тодом одноцепочечного конформационного полиморфизма (SSCP) вариабельного (V4) участка 16s рРНК. б - Количест"
во бактериальной ДНК Bacteroides spp. в фекалиях у интактных мышей Muc2-/- (n = 22) и дикого типа С57BL/6 (n = 21)
после применения антибиотиков или антибиотиков в сочетании с фукозой. в - Биохимические показатели крови мышей
линии Muc2-/- (n = 26) до применения антибиотиков, на фоне приёма антибиотиков и антибиотиков с совокупности с фу"
козой. г - Биохимические показатели крови мышей линии C57BL/6 (n = 17) до применения антибиотиков, на фоне при"
ёма антибиотиков и антибиотиков с совокупности с фукозой. ** p < 0,01 - точный критерий Фишера. ND - ниже порога
чувствительности метода детекции
БИОХИМИЯ том 87 вып. 3 2022
5*
372
БЕЦ и др.
тельных цитокинов в ткани толстой кишки у
ние двух линий мышей, одна из кото"
C57BL/6"мышей (рис. 4, б). Достоверно снизи"
рых (Muc2-/-) имеет дефицит муцина 2 в кишеч"
лось на фоне приёма антибиотиков с фукозой
нике. При этом отличий по основным таксоно"
количество мРНК транскрипционных факто"
мическим группам бактерий у мышей обоих ли"
ров, участвующих в Th17" и Th1"иммунных от"
ний нет, а также у животных на протяжении все"
ветах, и повысился Tbx21 у C57BL/6"мы"
го эксперимента детектировали Helicobacter spp.
шей (рис. 4, г). Но только количество IL"22,
Удлинение крипт, как анатомо"физиологичес"
участвовавшего в Th17"ответе, точно также сни"
кая особенность мышей Muc2-/-, вероятно,
зилось при добавлении фукозы к антибиотикам
имеет адаптивный механизм элиминации мик"
у мышей дикого типа (рис. 4, д). Фукоза повли"
рофлоры из кишечника.
яла на экспрессию и уровень белка отдельных
Применение пребиотиков при ВЗК может
иммунных факторов.
иметь огромную перспективу. Так, в настоящем
Таким образом, добавление фукозы, компо"
исследовании было показано, что пищевая L"
нента муцина 2, при антибактериальной тера"
фукоза частично восстанавливала Bacteroides
пии мышей Muc2-/- помогает сохранить
spp. и помогала сохранить связанную с белком
Bacteroides spp., ослабить негативное действие
фукозу в ткани кишечника. Это сочеталось с
антибиотиков и восстановить количество регу"
восстановление уровня АСТ. Но фукоза не пока"
ляторных Т"клеток в мезентериальных лимфа"
зала эффективного снижения воспалительного
тических узлах, но не влияет на другие иммун"
процесса в ткани толстой кишки на фоне приё"
ные показатели. Для понимания механизма
ма антибиотиков. Отсутствие эффекта на воспа"
действия фукозы необходимо в дальнейшем
ление может быть связано с негативным
протестировать её на животных без сопутствую"
действием антибиотиков на количество Т"регу"
щих патогенов, а также проверить её эффект на
ляторных клеток, повышение которых является
отдельных пулах иммунных клеток, таких как
характерной особенностью для мышей Muc2-/-,
макрофаги, дендритные клетки и лимфоциты
у которых воспаление, по всей видимости, на"
как в экспериментах in vivo, так и in vitro. Важно
чинается с раннего возраста. Необходимо в
ещё оценить возможность утилизации L"фукозы
дальнейшем исследовать возрастные особен"
различными бактериями, обитающими в ЖКТ и
ности развития воспаления у мышей Muc2-/-.
возможность её воздействия на запуск фукози"
Исследования эффектов пищевой фукозы,
лирования клеточных стенок бактерий. Если по"
как компонента муцина 2, необходимо продол"
добные гликаны клеточных стенок бактерий бу"
жать в том числе на моделях без сопутствующих
дут способны запускать толерагенность, то они
инфекций, а также более подробно рассмотреть
станут перспективными компонентами для под"
её на культурах иммунных клеток, макрофагов и
держивающей терапии при ВЗК.
дендритных клеток, которые имеют рецептор,
способный распознавать фукозу в составах гли"
канов бактерий. Также следует понять, может ли
ЗАКЛЮЧЕНИЕ
пищевая фукоза встраиваться в клеточные стен"
ки бактерий, которые имеют различные фуко"
Применение антибиотиков, глюкокортико"
зилтрансферазы. Все это подтверждает актуаль"
стероидов и иммуносупрессоров является клю"
ность изучения фукозы и фукозилированных
чевым звеном в медикаментозной терапии вос"
гликанов как потенциальных активаторов Т"ре"
палительных заболеваний кишечника, при этом
гуляторной функции.
очевидно, что, в целом, это отрицательно влия"
ет на симбиотическую микрофлору ЖКТ и в
связи с угнетением иммунной системы и изме"
Финансирование. Работа выполнена за счёт
нением метаболических процессов организма
средств федерального бюджета на проведение
может способствовать укреплению колоний ус"
фундаментальных научных исследований (тема
ловно"патогенной и патогенной микрофлоры за
№ АААА"А21"121011990039"2 - приобретение и
счёт освобождения адгезивной поверхности и
содержание лабораторных животных) и при
увеличения количества нутриентов, характер"
поддержке Российского научного фонда (грант
ных для питания данных микроорганизмов [19].
№ 20"64"47020 - анализ бактерий, экспрессия
Также известно, что признаком всех моде"
иммунных показателей).
лей ВЗК является истончение мукозального
Конфликт интересов. Авторы заявляют об от"
слоя кишечника и, как следствие, дисбаланс
сутствии конфликта интересов.
нормофлоры [37, 38]. Таким образом, для оцен"
Соблюдение этических норм. Все процедуры,
ки состояния кишечной микробиоты и иммун"
выполненные в исследованиях с участием жи"
ного ответа организма было проведено сравне"
вотных, соответствовали этическим стандартам
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
373
учреждения, в котором проводились исследова"
с животными были одобрены межинститутской
ния, и утверждённым правовым актам РФ и
комиссией по биоэтике СО РАН (номер
международных организаций. Все манипуляции
18.6 от 14.10.2013).
СПИСОК ЛИТЕРАТУРЫ
1.
Князев О. В., Шкурко Т. В., Каграманова А. В., Весе"
tion affects local and distant microbial populations and
лов А. В., Никонов Е. Л. (2020) Эпидемиология воспа"
host responses, Cell Rep., 14, 1395"1407, doi: 10.1016/
лительных заболеваний кишечника. Современное
j.celrep.2016.01.017.
состояние проблемы (обзор литературы), Доказа"
15.
Kullberg, M. C., Ward, J. M., Gorelick, P. L., Caspar, P.,
тельная гастроэнтерология, 9, 66"73, doi: 10.17116/
Hieny, S., et al. (1998) Helicobacter hepaticus triggers coli"
dokgastro2020902166.
tis in specific"pathogen"free interleukin"10 (IL"10)"defi"
2.
Long, M. D., Hutfless, S., Kappelman, M. D., Khalili, H.,
cient mice through an IL"12" and gamma interferon"
Kaplan, G. G., et al. (2014) Challenges in designing a
dependent mechanism, Infect. Immun., 66, 5157"5166,
national surveillance program for inflammatory bowel dis"
doi: 10.1128/iai.66.11.5157"5166.1998.
ease in the United States, Inflamm. Bowel Dis., 20, 398"
16.
Shomer, N. H., Dangler, C. A., Schrenzel, M. D., and
415, doi: 10.1097/01.MIB.0000435441.30107.8b.
Fox, J. G. (1997) Helicobacter bilis"induced inflammatory
3.
Камалова А. А., Сафина Э. Р., Низамова Р. А., Зайнет"
bowel disease in scid mice with defined flora, Infect.
динова М. Ш., Квитко, Э. М. (2020) Питание при вос"
Immun., 65, 4858"4864, doi: 10.1128/iai.65.11.4858"
палительных заболеваниях кишечника у детей, Рос"
4864.1997.
сийский вестник перинатологии и педиатрии, 65, 145"
17.
Christopher, P., Monceaux, T. L. T., Boktor, M.,
151, doi: 10.21508/1027"4065"2020"65"5"145"151.
Jordan, P., Adegboyega, P., et al. (July 2013) Helicobacter
4.
Ananthakrishnan, A. N. (2013) Environmental risk factors
infection decreases basal colon inflammation, but increas"
for inflammatory bowel disease, Gastroenterol Hepatol
es disease activity in experimental IBD, Open
(N Y), 9, 367"374.
J. Gastroenterol., 177"189, doi: 10.4236/ojgas.2013.33029.
5.
Wikoff, W. R., Anfora, A. T., Liu, J., Schultz, P. G., Lesley,
18.
Jiang, H. Q., Kushnir, N., Thurnheer, M. C., Bos, N. A.,
S. A., et al. (2009) Metabolomics analysis reveals large
and Cebra, J. J. (2002) Monoassociation of SCID mice
effects of gut microflora on mammalian blood metabolites,
with Helicobacter muridarum, but not four other enterics,
Proc. Natl. Acad. Sci. USA, 106, 3698"3703, doi: 10.1073/
provokes IBD upon receipt of T cells, Gastroenterology,
pnas.0812874106.
122, 1346"1354, doi: 10.1053/gast.2002.32959.
6.
Abrams, G. D., Bauer, H., and Sprinz, H. (1963) Influence
19.
Ивашкин К. В., Решетова М. С., Зольникова О. Ю.,
of the normal flora on mucosal morphology and cellular
Корнеева В. Р., и др. (2020) Место пробиотиков в
renewal in the ileum. A comparison of germ"free and con"
комплексной терапии различных заболеваний желу"
ventional mice, Lab. Invest. J. Tech. Methods Pathol., 12,
дочно"кишечного тракта, Российский журнал гастро"
355"364.
энтерологии, гепатологии, колопроктологии, 30, 42"48,
7.
Roswall, J., Olsson, L. M., Kovatcheva"Datchary, P.,
doi: 10.22416/1382"4376"2020"30"1"42"48.
Nilsson, S., Tremaroli, V., et al. (2021) Developmental tra"
20.
Weingarden, A. R., and Vaughn, B. P. (2017) Intestinal
jectory of the healthy human gut microbiota during the first
microbiota, fecal microbiota transplantation, and inflam"
5 years of life, Cell Host Microbe, 29, 765"776.e763,
matory bowel disease, Gut Microbes,
8,
238"252,
doi: 10.1016/j.chom.2021.02.021.
doi: 10.1080/19490976.2017.1290757.
8.
Franke, A., McGovern, D. P. B., Barrett, J. C., Wang, K.,
21.
Щербаков П. Л., Белова Н. Д., Генерозов Э. В., Жгун
Radford"Smith, G. L., et al. (2010) Genome"wide meta"
Е. С., и др. (2019) Применение фекальной трансплан"
analysis increases to 71 the number of confirmed Crohn’s
тации в лечении заболеваний пищеварительного
disease susceptibility loci, Nat. Genet., 42, 1118"1125,
тракта (первый клинический опыт), Доктор.Ру., 3, 40"
doi: 10.1038/ng.717.
46, doi: 10.31550/1727"2378"2019"158"3"40"46.
9.
Hooper, L. V., Littman, D. R., and Macpherson, A. J.
22.
Lin, J., and Hackam, D. J. (2011) Worms, flies and four"
(2012) Interactions between the microbiota and the
legged friends: the applicability of biological models to the
immune system, Science, 336, 1268"1273, doi: 10.1126/
understanding of intestinal inflammatory diseases, Disease
science.1223490.
Models Mech., 4, 447"456, doi: 10.1242/dmm.007252.
10.
Ivanov, I. I., Atarashi, K., Manel, N., Brodie, E. L.,
23.
Walters, E. M., Wolf, E., Whyte, J. J., Mao, J., Renner, S.,
Shima, T., et al. (2009) Induction of intestinal Th17 cells
et al. (2012) Completion of the swine genome will simplify
by segmented filamentous bacteria, Cell, 139, 485"498,
the production of swine as a large animal biomedical model,
doi: 10.1016/j.cell.2009.09.033.
BMC Med. Genom., 5, 55, doi: 10.1186/1755"8794"5"55.
11.
Ивашкин В. Т., Шелыгин Ю. А., Абдулганиева Д. И.,
24.
Coors, M. E., Glover, J. J., Juengst, E. T., and Sikela, J. M.
Абдулхаков Р. А., Алексеева О. П., и др. (2015) Реко"
(2010) The ethics of using transgenic non"human primates
мендации Российской гастроэнтерологической ассо"
to study what makes us human, Nat. Rev. Genet., 11, 658"
циации и Ассоциации колопроктологов России по ди"
662, doi: 10.1038/nrg2864.
агностике и лечению взрослых больных язвенным ко"
25.
Ideland, M. (2009) Different views on ethics: How animal
литом, Российский журнал гастроэнтерологии, гепато"
ethics is situated in a committee culture, J. Med. Ethics, 35,
логии, колопроктологии, 1, 48"65.
258"261, doi: 10.1136/jme.2008.026989.
12.
Fox, J. G., and Lee, A. (1997) The role of Helicobacter
26.
Robinson, A. M., Sakkal, S., Park, A., Jovanovska, V.,
species in newly recognized gastrointestinal tract diseases
Payne, N., et al. (2014) Mesenchymal stem cells and con"
of animals, Lab. Anim. Sci., 47, 222"255.
ditioned medium avert enteric neuropathy and colon dys"
13.
Goldman, C. G., and Mitchell, H. M. (2010) Helicobacter
function in guinea pig TNBS"induced colitis, Am. J.
spp. other than Helicobacter pylori, Helicobacter, 15, 69"75,
Physiol. Gastrointest. Liver Physiol., 307, G1115"G1129,
doi: 10.1111/j.1523"5378.2010.00780.x.
doi: 10.1152/ajpgi.00174.2014.
14.
Kienesberger, S., Cox, L. M., Livanos, A., Zhang, X. S.,
27.
Hungate, R.E. (1966) The Rumen and Its Microbes,
Chung, J., et al. (2016) Gastric Helicobacter pylori infec"
1st Edn., Academic Press/New York and London.
БИОХИМИЯ том 87 вып. 3 2022
374
БЕЦ и др.
28.
Kathrani, A., Lee, H., White, C., Catchpole, B., Murphy, A.,
44.
Ачасова К. М., Гвоздева О. В., Кожевникова Е. Н.,
et al. (2014) Association between nucleotide oligomerisation
Литвинова Е. А. (2021) Регкляторные Т"клетки лим"
domain two (Nod2) gene polymorphisms and canine inflam"
фатических узлов у Muc2-/- мышей с Helicobacter spp.,
matory bowel disease, Vet. Immunol. Immunopathol., 161, 32"
Медицинская иммунология, 23, 629"634, doi: 10.15789/
41, doi: 10.1016/j.vetimm.2014.06.003.
1563"0625"LNR"2268.
29.
Waterston, R. H., Lindblad"Toh, K., Birney, E., Rogers, J.,
45.
Ачасова К. М., Литвинова Е. А. (2019) Мыши с нокау"
Abril, J. F., et al. (2002) Initial sequencing and comparative
том гена Muc2 - модель для оценки способов воздей"
analysis of the mouse genome, Nature, 420, 520"562,
ствия на микрофлору кишечника, Российский иммуно"
doi: 10.1038/nature01262.
логический журнал,
13,
713"715, doi:
10.31857/
30.
Jiminez, J. A., Uwiera, T. C., Douglas Inglis, G., and
S102872210006753"3.
Uwiera, R. R. E. (2015) Animal models to study acute and
46.
Ачасова К. М., Литвинова Н. А., Кожевникова Е. Н.,
chronic intestinal inflammation in mammals, Gut Pathog.,
Литвинова Е. А. (2020) Вляние L"фукозы на макрофа"
7, 29, doi: 10.1186/s13099"015"0076"y.
ги и Т"клетки при нарушении микрофлоры кишечни"
31.
Westbrook, A. M., Szakmary, A., and Schiestl, R. H.
ка на экспериментальной модели ВЗК, Медико"биоло"
(2016) Mouse models of intestinal inflammation and can"
гические и нутрициологические аспекты здоровьесбере"
cer, Arch. Toxicol., 90, 2109"2130, doi: 10.1007/s00204"
гающих технологий/материалы I Международной науч"
016"1747"2.
но"практической конференции, 21"25.
32.
Wirtz, S., Popp, V., Kindermann, M., Gerlach, K.,
47.
Mähler Convenor, M., Berard, M., Feinstein, R.,
Weigmann, B., et al. (2017) Chemically induced mouse
Gallagher, A., Illgen"Wilcke, B., et al. (2014) FELASA
models of acute and chronic intestinal inflammation, Nat.
recommendations for the health monitoring of mouse, rat,
Protocols, 12, 1295"1309, doi: 10.1038/nprot.2017.044.
hamster, guinea pig and rabbit colonies in breeding and
33.
Cano"Gamez, E., Soskic, B., Roumeliotis, T. I., So, E.,
experimental units, Lab. Animals,
48,
178"192,
Smyth, D. J., et al. (2020) Single"cell transcriptomics
doi: 10.1177/0023677213516312.
identifies an effectorness gradient shaping the response of
48.
Borisova, M. A., Achasova, K. M., Morozova, K. N.,
CD4+ T cells to cytokines, Nat. Commun., 11, 1801,
Andreyeva, E. N., Litvinova, E. A., et al. (2020) Mucin"2
doi: 10.1038/s41467"020"15543"y.
knockout is a model of intercellular junction defects, mito"
34.
Mizoguchi, A., Takeuchi, T., Himuro, H., Okada, T., and
chondrial damage and ATP depletion in the intestinal
Mizoguchi, E. (2016) Genetically engineered mouse mod"
epithelium, Sci. Rep., 10, 21135, doi: 10.1038/s41598"020"
els for studying inflammatory bowel disease, J. Pathol.,
78141"4.
238, 205"219, doi: 10.1002/path.4640.
49.
Achasova, K. M., Kozhevnikova, E. N., Borisova, M. A.,
35.
Литвинова Е. А., Ачасова К. М., Борисова М. А., Же"
and Litvinova, E. A.
(2021) Fucose ameliorates
нило С. В., Прохорчук Е. Б., и др. (2018) Роль гена
Tritrichomonas sp."associated illness in antibiotic"treated
Kaiso в развитии воспаления у мышей с дефицитом
Muc2-/- mice, Int. J. Mol. Sci., 22, 10699, doi: 10.3390/
Муцина"2, Вавиловский журнал генетики и селекции,
ijms221910699.
22, 1078"1083, doi: 10.18699/VJ18.453.
50.
Litvinova, E. A., Kozhevnikova, E. N., Achasova, K. M.,
36.
Литвинова Е. А., Беляев М. Д., Прохорчук А. В., Ко"
Kontsevaya, G. V., and Moshkin, M. P. (2017) Eradication
ростина В. С., Прохорчук Е. Б., и др. (2015) Вклад ки"
of Helicobacter spp. in mucin2"deficient mice, Lab. Animals,
шечного муцина"2 в эффективность антибактериаль"
51, 311"314, doi: 10.1177/0023677216670687.
ной терапии Helicobacter spp. у лабораторных мышей,
51.
Bradford, M. M. (1976) A rapid and sensitive method for
Вавиловский журнал генетики и селекции, 19, 494"498,
the quantitation of microgram quantities of protein utiliz"
doi: 10.18699/VJ15.066
ing the principle of protein"dye binding, Anal. Biochem.,
37.
Kawashima, H. (2012) Roles of the gel"forming MUC2
72, 248"254, doi: 10.1006/abio.1976.9999.
mucin and its O"glycosylation in the protection against
52.
Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I.,
colitis and colorectal cancer, Biol. Pharm. Bull., 35, 1637"
Rozen, S., and Madden, T. L. (2012) Primer"BLAST:
1641, doi: 10.1248/bpb.b12"00412.
a tool to design target"specific primers for polymerase
38.
Tailford, L. E., Crost, E. H., Kavanaugh, D., and Juge, N.
chain reaction, BMC Bioinformatics,
13,
134,
(2015) Mucin glycan foraging in the human gut microbio"
doi: 10.1186/1471"2105"13"134.
me, Front. Genet., 6, 81, doi: 10.3389/fgene.2015.00081.
53.
Okonechnikov, K., Golosova, O., and Fursov, M. (2012)
39.
Martens, E. C., Roth, R., Heuser, J. E., and Gordon, J. I.
Unipro UGENE: a unified bioinformatics toolkit,
(2009) Coordinate regulation of glycan degradation and
Bioinformatics, 28, 1166"1167, doi: 10.1093/bioinformatics/
polysaccharide capsule biosynthesis by a prominent human
bts091.
gut symbiont, J. Biol. Chem.,
284,
18445"18457,
54.
Schwieger, F., and Tebbe, C. (1999) A new approach to uti"
doi: 10.1074/jbc.M109.008094.
lize PCR"Single"Strand"Conformation Polymorphism for
40.
Morgan, X. C., Tickle, T. L., Sokol, H., Gevers, D.,
16S rRNA Gene"Based Microbial Community Analysis,
Devaney, K. L., et al.(2012) Dysfunction of the intestinal
Appl. Environ. Microbiol., 64, 4870"4876, doi: 10.1128/
microbiome in inflammatory bowel disease and treatment,
AEM.64.12.4870"4876.1998.
Genome Biol., 13, R79, doi: 10.1186/gb"2012"13"9"r79.
55.
Bassam, B. J., Caetano"Anollés, G., and Gresshoff, P. M.
41.
Pickard, J. M., and Chervonsky, A. V. (2015) Intestinal
(1991) Fast and sensitive silver staining of DNA in poly"
fucose as a mediator of host"microbe symbiosis, J. Immunol.,
acrylamide gels, Anal. Biochem., 196, 80"83, doi: 10.1016/
194, 5588"5593, doi: 10.4049/jimmunol.1500395.
0003"2697(91)90120"i.
42.
Litvinova, E. A., Bets, V. D., Feofanova, N. A., Gvozdeva,
56.
Heazlewood, C. K., Cook, M. C., Eri, R., Price, G. R.,
O. V., Achasova, K. M., et al. (2021) Dietary fucose affects
Tauro, S. B., et al. (2008) Aberrant mucin assembly in mice
macrophage polarization and reproductive performance in
causes endoplasmic reticulum stress and spontaneous
mice, Nutrients, 13, 855, doi: 10.3390/nu13030855.
inflammation resembling ulcerative colitis, PLoS Med., 5,
43.
Borisova, M. A., Snytnikova, O. A., Litvinova, E. A.,
e54, doi: 10.1371/journal.pmed.0050054.
Achasova, K. M., Babochkina, T. I., et al. (2020) Fucose
57.
Allen, A., Hutton, D. A., and Pearson, J. P.
(1998)
ameliorates tryptophan metabolism and behavioral abnor"
The MUC2 gene product: a human intestinal mucin,
malities in a mouse model of chronic colitis, Nutrients, 12,
Int. J. Biochem. Cell Biol., 30, 797"801, doi: 10.1016/
445, doi: 10.3390/nu12020445.
s1357"2725(98)00028"4.
БИОХИМИЯ том 87 вып. 3 2022
МУЦИН 2 И L"ФУКОЗА РЕГУЛИРУЮТ ИММУНИТЕТ И МИКРОФЛОРУ ПРИ ВЗК
375
58. McGovern, D. P., Jones, M. R., Taylor, K. D.,
60. Tadesse, S., Corner, G., Dhima, E., Houston, M.,
Marciante, K., Yan, X., et al. (2010) Fucosyltransferase 2
Guha, C., et al. (2017) MUC2 mucin deficiency alters
(FUT2) non"secretor status is associated with Crohn’s dis"
inflammatory and metabolic pathways in the mouse intesti"
ease, Hum. Mol. Genet., 19, 3468"3476, doi: 10.1093/
nal mucosa, Oncotarget, 8, 71456"71470, doi: 10.18632/
hmg/ddq248.
oncotarget.16886.
59. Crouch, L. I., Liberato, M. V., Urbanowicz, P. A.,
61. Luijkx, Y., Bleumink, N. M. C., Jiang, J., Overkleeft,
Baslé, A., Lamb, C. A., et al. (2020) Prominent members
H. S., Wösten, M., et al. (2020) Bacteroides fragilis fucosi"
of the human gut microbiota express endo"acting O"gly"
dases facilitate growth and invasion of Campylobacter jeju"
canases to initiate mucin breakdown, Nat. Commun., 11,
ni in the presence of mucins, Cell. Microbiol., 22, e13252,
4017, doi: 10.1038/s41467"020"17847"5.
doi: 10.1111/cmi.13252.
THE ROLE OF GLYCOPROTEIN MUCIN 2 AND L FUСOSУ
IN THE INTERACTION OF IMMUNITY AND MICROFLORA
OF EXPERIMENTAL MODEL OF INFLAMMATORY BOWEL DISEASES
V. D. Betz1, K. M. Achasova2,3, M. A. Borisova4, E. N. Kozhevnikova1,2,3, and E. A. Litvinova2*
1 Novosibirsk State Agrarian University, 630039 Novosibirsk, Russia
2 Research Institute of Neurosciences and Medicine, 630117 Novosibirsk, Russia; e"mail: litvinovaea@physiol.ru
3 Institute of Molecular and Cellular Biology, Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia
4 Federal Research Center Institute of Cytology and Genetics, Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia
Many factors underlie the development of inflammatory bowel diseases in humans. In particular, an imbalance in the
microbiota and a thinning of the mucosal layer in the large intestine play a huge role. Pathogenic agents exacerbate
disease progression. In view of this role, a study was carried out on the effect of mucin 2 deficiency on the diversity of
intestinal microflora in an experimental model of Muc2 knockout mice in the presence of Helicobacter spp. We also
evaluated the regenerative and anti"inflammatory effect of dietary L"fucose in Muc2-/- mice. For this purpose, the
bacterial diversity in feces was studied in animals before and after the application of antibacterial therapy and the role
of dietary L"fucose in its recovery was assessed. To determine the effect of bacterial imbalance and the role of fucose
on the immune system, the mRNA levels of the genes of proinflammatory cytokines (Tnf, Il1a, Il1b, Il6) and tran"
scription factors of T cells (Foxp3 - Treg, Rorc - Th17, Tbx21 - Th1) were determined in the colon tissue of Muc2-/-
mice. A significant elimination of bacteria against the background of antibiotic use caused a decrease in fucose in the
intestine, and also provoked a decrease in the transcription factor T of regulatory cells (Foxp3). When food L"fucose
is added to antibiotics, the level of bacterial DNA of Bacteroides spp. in the feces of mice, Muc2-/- was partially
restored. T regulatory cells are involved in the regulation of inflammation in Muc2-/- mice. Antibiotics reduced their
number, which did not reduce the inflammatory response to infection. Fucose, as a component of mucin2, helps pre"
serve Bacteroides spp. During antibiotic therapy in Muc2-/- mice and restore biochemical parameters, but does not
affect the inflammatory response.
Keywords: IBD, macrophages, pathogens, microbiota, antibiotics, L"fucose, mucin 2
БИОХИМИЯ том 87 вып. 3 2022