БИОХИМИЯ, 2022, том 87, вып. 3, с. 387 - 399
УДК 577.2
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ И ОЧИСТКА РЕКОМБИНАНТНОГО
ЦИКЛОФИЛИНА А ЧЕЛОВЕКА
© 2022
А.А. Калинина1, А.В. Колесников2, А.В. Козырь2, Н.Л. Куликова3,
М.А. Замкова1, Д.Б. Казанский1, Л.М. Хромых1*
1 Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр
онкологии имени Н.Н. Блохина» Министерства здравоохранения России, 115478 Москва, Россия;
электронная почта: lkhromykh@list.ru
2 Федеральное бюджетное учреждение науки «Государственный научный центр
прикладной микробиологии и биотехнологии»,142279 п. Оболенск, Московская обл., Россия
3 Открытое акционерное общество «Институт инженерной иммунологии»,
142380 п. Любучаны, Московская обл., Россия
Поступила в редакцию 26.01.2022
После доработки 15.02.2022
Принята к публикации 15.02.2022
Данное исследование посвящено разработке метода получения препаративного количества рекомбинант
ного циклофилина А человека (рчЦфА) из Escherichia coli. С тотальной мРНК Т клеточной лимфомы чело
века Jurkat методом ПЦР с обратной транскрипцией амплифицировали полноразмерную кДНК, кодирую
щую ген ЦфА человека (CYPA). Далее провели оптимизацию нуклеотидной последовательности гена CYPA
для обеспечения его высокоэффективной трансляции в E. coli. Рекомбинантную ДНК CYPA клонировали в
вектор pET22b(+) и полученную экспрессионную плазмиду использовали для трансформации бактерий
E. coli штамма BL21(DE3)Gold. Рекомбинантный клон продуцент E. coli обеспечивал синтез рчЦфА в раст
воримом состоянии в цитоплазме бактерий. Эффективность синтеза рчЦфА составляла до 50% суммарно
го белка клетки, что позволяло получать рчЦфА в количестве до 1 г с литра культуры. Был отработан метод
очистки рчЦфА, состоящий из одноэтапной тандемной анионообменной хроматографии на колонках
DEAE и Q Sepharose. Чистота полученного белка составляла 95% по данным электрофореза (SDS PAGE),
а его контаминация эндотоксином не превышала 0,05 нг на 1 мг белка, что соответствует требованиям Ев
ропейской фармакопеи к инъекционным препаратам. Полученный рекомбинантный белок сохранял функ
циональные свойства нативного ЦфА, такие как изомеразная активность и хемокиновая активность, выяв
ленная по усилению миграции стволовых кроветворных клеток костного мозга мыши in vivo. Полученный
штамм E. coli является суперпродуцентом и может быть использован при проведении масштабных лабора
торных исследований рчЦфА, а также для доклинических и клинических испытаний данного белка как ле
карственного средства.
КЛЮЧЕВЫЕ СЛОВА: циклофилин А, оптимизация гена, штамм продуцент, изомеразная активность,
хемокиновая активность.
DOI: 10.31857/S032097252203006X
ВВЕДЕНИЕ
часто сталкиваются с проблемой наработки пре
паративного количества целевого белка и, как
В настоящее время большой спектр рекомби
следствие, поиска методических подходов, обес
нантных белков, полученных с использованием
печивающих высокий уровень его очистки при
Escherichia coli (E. coli) в качестве штамма проду
минимальном содержании бактериального ли
цента, имеет широкое применение в исследова
пополисахарида (ЛПС, эндотоксин) в качестве
тельской и медицинской практике, и такие бел
примеси. Для этой цели проводят разработку
ки часто служат лекарственными средствами при
препаративного или промышленного способа
различных патологиях. При проведении масш
получения, отвечающего требованиям, обеспе
табных лабораторных исследований, доклини
чивающим необходимое количество и качество
ческих и клинических испытаний исследователи
целевого белка. Данная работа посвящена разра
ботке метода масштабного получения и очистки
Принятые сокращения: чЦфА - циклофилин А че
рекомбинантного циклофилина А человека
ловека; рчЦфА - рекомбинантный циклофилин А челове
(рчЦфА) для его дальнейшего использования в
ка; CYPA - ген ЦфА; ЛПС - липополисахарид; ЦсА - цик
лоспорин А; ИПТГ - изопропил β d 1 тиогалактопира
доклинических и клинических испытаниях.
нозид; PMSF - фенилметилсульфонил фторид.
Циклофилин А (ЦфА, 18 кДа) является цис
* Адресат для корреспонденции.
транс изомеразой, существует во внутриклеточ
387
6*
388
КАЛИНИНА и др.
ной и секреторной формах [1] и обладает широ
па [15], что также потенциально может быть ис
ким диапазоном различных функций. Внутри
пользовано в борьбе с данной инфекцией.
клеточный ЦфА участвует в фолдинге, транс
Кроме того, ЦфА является одним из основ
порте и сборке белков [2], регуляции клеточной
ных факторов патогенности при аутоиммунных
пролиферации [2], является лигандом для цик
заболеваниях (ревматоидный артрит), диабете и
лоспорина А (ЦсА), обусловливающим его им
др., для лечения которых данный белок может
муносупрессивное действие [3], обеспечивает
выступать в качестве мишени.
передачу сигнала от Т клеточного рецептора [4]
Выявленное многообразие свойств ЦфА по
и участвует в контроле баланса между Т хелпе
казывает, что данный белок требует самого
рами первого и второго типов, подавляя актив
пристального изучения в процессах, имеющих
ность Т хелперов типа 2 [4]. Секреторный ЦфА
место как в норме, так и при патологиях, и в
является провоспалительным фактором, обла
перспективе может найти применение в клини
дает хемоаттрактивными свойствами, привле
ческой практике либо в качестве лекарственно
кая макрофаги [5], гранулоциты и активирован
го средства, либо в качестве мишени воздей
ные Т лимфоциты [6] и формируя очаг воспале
ствия. Тем не менее для всестороннего изучения
ния. ЦфА, с одной стороны, участвует в иммун
биологических свойств данного белка, для про
ной защите организма [5], включая противора
ведения масштабных лабораторных исследова
ковую защиту [7, 8], а с другой стороны, являет
ний in vivo, производства лекарственной суб
ся фактором патогенеза таких заболеваний, как
станции для доклинических и клинических ис
ревматоидный артрит, диабет, онкологические
пытаний или иммунизации животных для полу
заболевания и др. [1].
чения антител к ЦфА требуются значительные
Многогранные свойства ЦфА лежат в основе
количества (граммы) высокоочищенного апи
возможности разработки различных лекар
рогенного белка.
ственных средств на его основе для дальнейше
Решению этой проблемы посвящена данная
го клинического использования. В норме секре
работа, в результате которой получен рекомби
торный ЦфА присутствует в крови, молоке и
нантный штамм E. coli, являющийся высокоэф
тканевых жидкостях человека [9, 10] и является
фективным продуцентом рчЦфА. Разработана
хемоаттрактантом для костномозговых предше
уникальная система очистки, позволяющая по
ственников различных ростков иммуногенеза и
лучить качественные характеристики рчЦфА на
кроветворения (незрелых дендритных клеток,
уровне европейских стандартов [16, 17]. Предла
Т и В лимфоцитов, моноцитов и гранулоци
гаемый способ наработки рчЦфА обеспечивает
тов) [11], участвуя в регенеративных процессах.
сохранение функциональных свойств, характер
ЦфА способствует привлечению стволовых кле
ных для природного ЦфА, - изомеразную ак
ток в очаг ишемии и может рассматриваться в
тивность и хемоаттрактивное действие, направ
качестве терапевтического средства при ише
ленное на усиление миграции клеток костного
мии конечностей [12]. Способность ЦфА связы
мозга, а также гранулоцитов и активированных
ваться с ЦсА предполагает его клиническое ис
Т лимфоцитов.
пользование для устранения побочных эффек
тов, вызванных действием данного иммуносуп
рессанта. Нефротоксичность - один из самых
МАТЕРИАЛЫ И МЕТОДЫ
серьезных побочных эффектов применения
ЦсА. Было показано, что гиперэкспрессия ЦфА
Конструирование оптимизированной последо7
защищает от ЦсА индуцированной нефроток
вательности гена CYPA. Для обеспечения высо
сичности in vivo [3]. ЦфА может применяться
коэффективной трансляции чЦфА в E. coli про
при трансплантации аллогенных миобластов
вели оптимизацию последовательности гена
для предотвращения их апоптоза и блокировки
CYPA, кодирующей данный белок. На основе
дифференцировки, вызванной ЦсА [13]. Пос
имеющихся баз данных по анализу вторичных
ледний снижает минеральную плотность костей
структур мРНК и других особенностей последо
и способствует развитию остеопороза. ЦфА сти
вательностей, модулирующих прокариотичес
мулирует дифференцировку остеобластов и по
кую трансляцию (программный пакет GeneBee
давляет активность остеокластов, что приводит
к анаболическому эффекту, поэтому этот белок
genebee.msu.ru/services/rna2_reduced.html))
может найти перспективное применение как
[18-20], в нативной последовательности гена
при нейтрализации эффектов ЦсА, так и при
CYPA были выявлены факторы, лимитирующие
разработке новых лекарственных препаратов
эффективность трансляции в E. coli: редкие,
для лечения остеопороза [14]. Гиперэкспрессия
повторяющиеся и субоптимальные кодоны;
ЦфА ингибирует репликацию вируса грип
большое число AG богатых участков и вторич
БИОХИМИЯ том 87 вып. 3 2022
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ рчЦфА
389
ные сайты инициации трансляции. Удаление
ацетата калия. Полученный продукт первой
этих участков ДНК проводили вручную путём
амплификации использовали во втором раунде
подбора и замены на наиболее часто использую
ПЦР с праймерами CPF2 и CPR2 (таблица).
щиеся в E. coli кодоны.
Аналогичным образом, последовательно ис
Выделение тотальной РНК и синтез кДНК
пользуя пары перекрывающихся праймеров и
клеток Jurkat. Клетки линии Jurkat (TIB 152,
продукт предшествующей ПЦР в качестве мат
ATCC, США), представляющей собой Т кле
рицы, амплифицировали полную последова
точную лимфому человека, поддерживали в
тельность гена CYPA. Корректность синтеза пос
культуре in vitro. Клетки помещали в TRI
ледовательности рекомбинантной ДНК CYPA
Reagent («MRC», США) и выделяли тотальную
верифицировали методом капиллярного секве
РНК согласно протоколу производителя. Перед
нирования (ЗАО «Евроген», Россия).
синтезом кДНК проводили обработку выделен
Получение штамма E. coli BL21(DE3)Gold/
ной РНК ферментом ДНКаза I («Invitrogen»,
pETCYPopti. По завершении синтеза рекомби
США) для предотвращения контаминации об
нантный ген CYPA (rCYPA) очищали с использо
разцов геномной ДНК. Затем проводили синтез
ванием набора для очистки ПЦР продуктов
кДНК с помощью коммерческого набора
(PCR Purification Kit, «Qiagen», Германия), обра
RevertAid First Strand cDNA Synthesis Kit
батывали эндонуклеазами NdeI и XhoI («Thermo
(«Thermo Fisher Scientific», США) согласно про
Fisher Scientific») и лигировали с вектором
токолу производителя. Полученную кДНК кле
pET22b(+) («Novagen», США), предварительно
ток Jurkat использовали в качестве матрицы при
линеаризованным этими же ферментами
синтезе оптимизированного гена CYPA методом
(рис.
1). Полученным лигатом pETCYPopti
ПЦР.
трансформировали электрокомпетентные клет
Синтез оптимизированного гена CYPA. Опти
ки E. coli штамма BL21(DE3)Gold («Agilent»,
мизированную последовательность гена CYPA
США), подготовленные в соответствии с прото
синтезировали при помощи серии ПЦР с ис
колом производителя. Для электротрансформа
пользованием набора перекрывающихся прай
ции использовали прибор BTX ECM
600
меров, расположенных в порядке от централь
(«Artisan Technology Group», США) в режиме
ной части гена CYPA к его 5′ и 3′ концам (таб
129 Ом, 2,5 кB. Трансформанты высевали на ага
лица). Набор олигонуклеотидов для синтеза
ризованную (1% агара) среду 2хYT («Difco»,
конструировали при помощи программных па
США), содержащую 50 мкг/мл ампициллина и
кетов «Oligo», «Vector NTI» и «GeneBee». Темпе
2% глюкозы, и выращивали в течение 18 ч при
ратуру ренатурации комплементарных участков
37 °C. Выросшие колонии анализировали при
олигонуклеотидов подбирали в диапазоне
помощи ПЦР с использованием праймеров
58-60 °С для достижения оптимальной эффек
CPF3 и CPR3 (таблица) на наличие фрагмента
тивности ПЦР амплификации. В состав конце
гена rCYPA. Бактериальные колонии, содержав
вого прямого праймера (CPF5Nde) и концевого
шие нужный ген, выращивали в течение ночи в
обратного праймера (CPR5Xho) (таблица) были
жидкой среде
2XYT. Плазмидную ДНК
введены сайты рестрикции NdeI и XhoI соответ
pETCYPopti выделяли при помощи коммерчес
ственно для обеспечения встраивания
кого набора QIAfilter Plasmid MidiKit («Qiagen»,
конструкта в векторные системы семейства pET
США) согласно протоколу производителя. Вы
[21]. ПЦР проводили с использованием смеси
деленную плазмидную ДНК секвенировали
Taq и Pfu полимераз («Promega», США). Под
(ЗАО «Евроген») для анализа точности встраи
бор оптимальных условий амплификации осу
вания фрагмента ДНК, кодирующего рчЦфА.
ществляли при помощи градиентной функции
Трансформанты, содержащие корректно соб
амплификатора Mastercycler Nexus Gradient
ранные варианты вставки, использовали для
(«Eppendorf», США). Используя кДНК клеток
дальнейшей работы.
Jurkat, проводили первую амплификацию с
Наработка аналитического количества
праймерами CPF1 и CPR1 (таблица). Для этого
рчЦфА. Для продукции рчЦфА в аналитическом
ПЦР ставили параллельно при температурах от
количестве (до 4 л) единичную колонию транс
жига 57-64 °С, после чего аликвоты реакцион
форманта E. coli BL21(DE3)Gold/pETCYPopti
ной смеси наносили на агарозный или акрила
помещали в 10 мл среды 2xYT, содержащей
мидный гель (фрагменты длиной до 250 п.н.) и
2% глюкозы и 50 мкг/мл ампициллина, и выра
анализировали электрофоретически. Наиболее
щивали 18 ч при 37 °С. По истечении времени
чистые продукты реакции нужной длины отби
инкубации 10 мл культуры переносили в 1 л сре
рали для дальнейшей стадии синтеза гена. ДНК
ды 2xYT, содержащей 0,1% глюкозы и 50 мкг/мл
частично экстрагировали из геля при нагрева
ампициллина, разносили среду на 4 колбы (по
нии до 55 °С в течение 30 мин в присутствии 1М
250 мл) и выращивали на термостатируемом
БИОХИМИЯ том 87 вып. 3 2022
390
КАЛИНИНА и др.
Последовательности олигонуклеотидов, использованные для синтеза оптимизированного гена CYPA
Название
Последовательность (5′→3′)
Прямой праймер 1
TCATTCCGGGCTTCATGTGTCAGGGCGGTGACTTCACCCGCCACAATGGCACCGGTG
(CPF1)
GCAAGAGCATCTACGGTGAGAAGTTCGAAGAT
Обратный праймер 1
CCATTGGTGTTCGGACCCGCGTTCGCCATGCTCAGGATGCCCGGACCGGTAT
(CPR1)
GCTTCAGGATGAAGTTCTCATCTTCGAACTTCTCACC
Прямой праймер 2
TGAGCACCGGTGAGAAAGGCTTTGGTTACAAGGGCAGCTGCTTTCACCGCATCATTC
(CPF2)
CGGGCTTCATGT
Обратный праймер 2
TGCTTGCCATCCAGCCACTCGGTCTTCGCGGTGCAGATGAAAAACTGGCTACCATTGGT
(CPR2)
GTTCGGACCC
Прямой праймер 3
GAGCTGTTCGCGGACAAGGTGCCGAAGACCGCCGAGAACTTTCGTGCCCTGAGCACCG
(CPF3)
GTGAGAAAG
Обратный праймер 3
CATGGCCTCCACAATGTTCATGCCTTCCTTCACTTTGCCAAACACGACATGCTTGC
(CPR3)
CATCCAGCCAC
Прямой праймер 4
GTTCTTTGATATCGCGGTGGACGGCGAGCCGCTGGGCCGTGTCAGCTTTGAGCT
(CPF4)
GTTCGCGGACAAG
Обратный праймер 4
CAATGGTGATTTTCTTGCTGGTCTTGCCATTGCGGCTGCCAAAGCGCTCCATGGCCTCCA
(CPR4)
CAATGTTC
Прямой праймер 5
TTTCTCTATATTCATATGGTCAACCCGACCGTGTTCTTTGATATCGCGGT
(CPF5Nde)
Обратный праймер 5
CGTTATTCTCGAGTTACAGCTGGCCACAGTCCGCAATGGTGATTTTCTTGC
(CPR5Xho)
Примечание. Сайты рестрикции NdeI и XhoI выделены полужирным начертанием.
шейкере при 37 °С c перемешиванием при
де 2xYT, содержащей 5% глицерина, 5% глюко
220 об./мин до оптической плотности (OD600)
зы, 80 мМ K2HPO4 и 3 мМ MgCl2. Начальная
1,5 ОЕ. Выросшую культуру охлаждали до 28 °С,
концентрация ампициллина составляла
добавляли изопропил β d 1 тиогалактопирано
100 мкг/мл. Инокулят выращивали с использо
зид (ИПТГ) («Thermo Fisher Scientific») до кон
ванием 100 мл первичной культуры, приготов
центрации 0,5 мМ и продуцировали белок в те
ленной в среде SOB («Difco») с добавлением
чение 4 ч. Биомассу продуцента собирали цент
5% глюкозы. Первичную культуру готовили на
рифугированием (Centritech VP Pilot,
основе единичной колонии продуцента, нара
«BioTechno Group», Россия) при 5000 об./мин в
щивая биомассу в течение 7 ч при концентрации
течение 10 мин и хранили в виде замороженных
ампициллина 100 мкг/мл. Значение pH среды
осадков при температуре -80 °С при добавлении
при инокуляции составляло 7,6. В дальнейшем
15% глицерина в качестве криопротектора.
уровень рН поддерживали в диапазоне 7,0-7,2
Наработка препаративного количества
титрованием 1 М раствором NaOH. Температура
рчЦфА. Получение биомассы продуцента E. coli
роста первичной культуры и инокулята состав
BL21(DE3)Gold/pETCYPopti проводили мето
ляла 37 °С. Инокулят вводили в предварительно
дом ферментации в 50 литровом биореакторе
разогретую до 37 °С культуральную среду в ос
(«Infors», Швейцария) с электромагнитным им
новном ферментёре и растили культуру в тече
пеллером и контроллером, обеспечивающим
ние 8 ч при значениях pH в диапазоне от 7,0 до
мониторинг уровня растворенного кислорода,
7,2 и содержании растворенного кислорода
значения pH, содержания определённых ионов,
28-30%. При достижении оптической плотнос
концентрации глюкозы и уровня пенообразова
ти культуры (OD600) 1,5-2 ОЕ температуру в
ния. Объём единичной ферментации составлял
ферментере снижали до 28 °С и добавляли
30 л. Ферментацию проводили в среде 2хYT, со
ИПТГ до конечной концентрации 0,5 мМ. Пос
держащей 1% глюкозы, 50 мМ K2HPO4 и 0,5 мМ
ле индукции экспрессии белка контролировали
MgCl2. Инокулят в количестве 2 л готовили в
параметры культуры и при истощении добавля
5 литровом ферментёре LabFors («Infors») в сре
ли смесь, содержащую 800 г/л глюкозы и 2 г/л
БИОХИМИЯ том 87 вып. 3 2022
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ рчЦфА
391
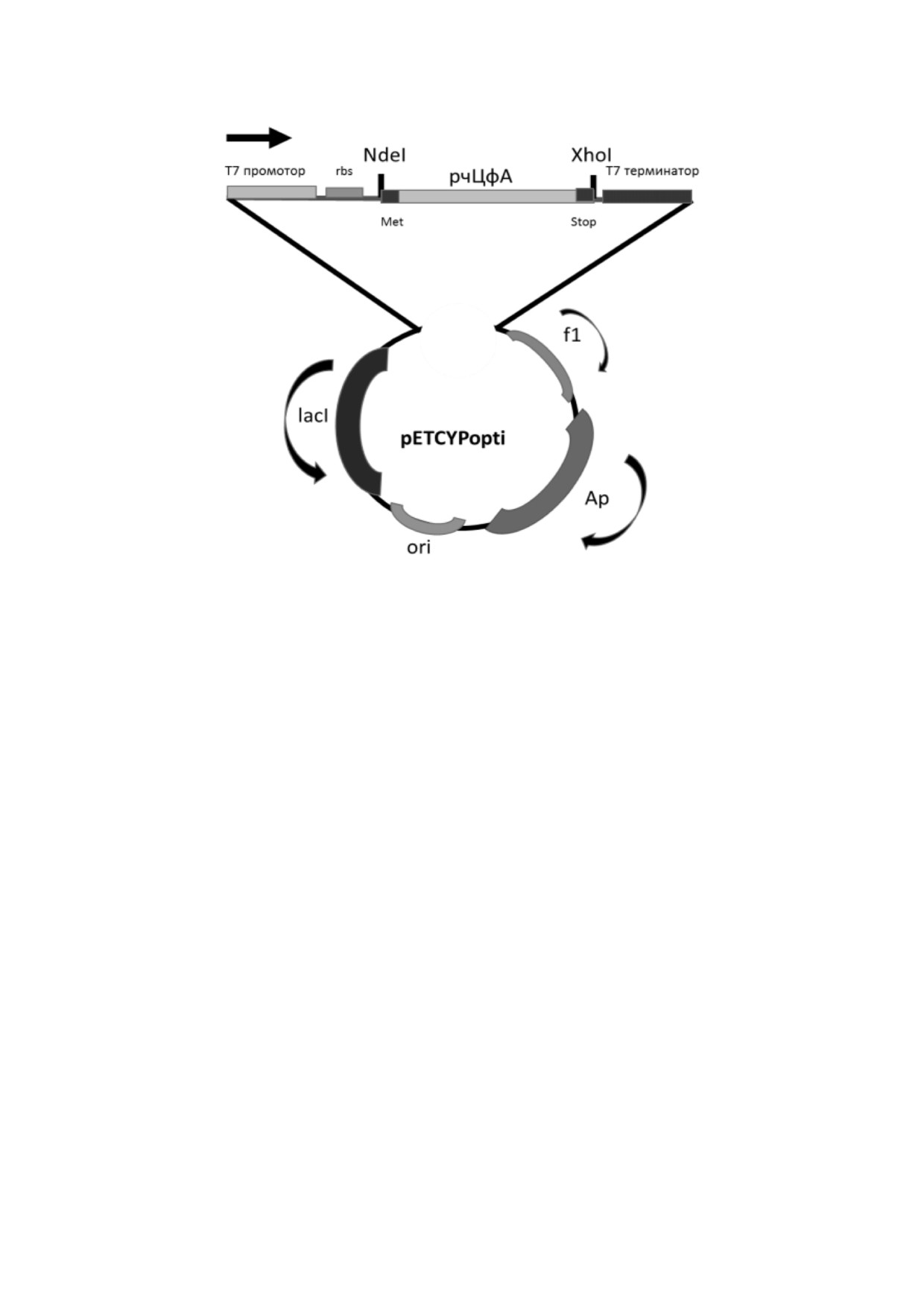
Рис. 1. Структура рекомбинантной плазмиды pETCYPopti. Рекомбинантная плазмида pETCYPopti имеет размер 5858 п.н.
и содержит фрагмент XhoI NdeI вектора pET22b(+), несущий ген устойчивости к ампициллину ampR, промотор и тер
минатор РНК полимеразы фага Т7 и полилинкер, в котором по сайтам XhoI и NdeI клонирован ген CYPA размером
498 п.н.
ампициллина. Через 1 ч после индукции иниции
щенного раствора сульфата аммония на один
ровали систему пеногашения. Продукцию белка
объем лизата. Осажденный лизат (25% сульфата
проводили в течение 12 ч. Далее отделяли био
аммония) инкубировали при 4 °С в течение 1 ч
массу с использованием проточной центрифуги,
для формирования осадка. Осадок удаляли
как описано выше, и хранили при -80 °С с до
центрифугированием в течение 15 мин при
бавлением 15% глицерина.
18 000 g. Для осаждения целевого белка из су
Выделение pчЦфА. Для выделения рчЦфА
пернатанта использовали насыщенный сульфат
100 г бактериальной биомассы суспендировали
аммония из расчета 3 объема раствора сульфата
в 300 мл буфера, содержащего 20 мМ Tris HСl
аммония на 1 объем супернатанта, смесь инку
(pH 8), 100 мМ NaCl и дополненного ингибито
бировали при 4 °С в течение ночи. Образовав
ром cериновых протеаз PMSF (в конечной кон
шийся осадок собирали центрифугированием в
центрации 1 мМ) («Thermo Fisher Scientific»), и
течение 60 мин при 18 000 g и растворяли в буфе
обрабатывали лизоцимом (20 мкг/мл) («PanReac
ре, содержащем 30 мМ Na3PO4 (pH 8). Получен
Applichem», Испания) при 4 °C в течение 30 мин.
ный раствор центрифугировали в течение
Лизис клеток проводили добавлением детерген
30 мин при 18 000 g для удаления нерастворен
та Triton X 100 («Sigma Aldrich», США) до кон
ных частиц и примесей и диализовали трижды
центрации 0,5%. К лизату добавляли MgCl2 до
по 4 ч при 4 °С против раствора 30 мМ Na3PO4 в
концентрации 1 мМ и разрушали геномную
соотношении 1 : 10. После диализа раствор це
ДНК E. coli ДНКазой (10 мкг/мл, «Sigma
левого белка центрифугировали в течение
Aldrich») в течение 15 мин при 20 °С, затем до
30 мин при 18 000 g для удаления частиц и агре
бавляли ЭДТА до концентрации 5 мМ. Полу
гатов.
ченный лизат центрифугировали (Centritech VP
Очистка рчЦфА. Одноэтапную очистку
Pilot, «BioTechno Group», Россия) в течение
рчЦфА проводили методом тандемной анионо
20 мин при 18 000 g и супернатант, содержащий
обменной хроматографии на колонках DEAE
целевой белок, порционно высаливали сульфа
сефароза и Q сефароза
(«GE Healthcare»,
том аммония из расчета половина объема насы
США). В препаративном варианте использова
БИОХИМИЯ том 87 вып. 3 2022
392
КАЛИНИНА и др.
ли колонку HiScale 50/40 («GE Healthcare»),
натрий фосфатном буфере (pH 7,8) [24]. Для
упакованную 300 мл DEAE сефарозы, и HiScale
постановки теста к 1 мл очищенного рчЦфА
50/20 («GE Healthcare»), упакованную 200 мл
(100 нМ) в 50 мМ буфере Tris HCL, pH 7,8 (ра
Q сефарозы. Перед нанесением белка колонки
бочий буфер), добавляли субстрат химотрипси
уравновешивали буфером, содержащим 30 мМ
на до конечной концентрации 0,1 мМ. Субстрат
Na3PO4 (pH 8). Нанесение белка вели при ско
предварительно растворяли в диметилсульфок
рости потока 5 мл/мин и собирали фракцию
сиде (сток 2 мг/мл) («Sigma Aldrich»). Реакцию
после прохождения обеих колонок. Собранный
проводили при 10 °С. Смесь инкубировали
раствор рчЦфА стерилизовали фильтрацией че
15 мин, затем добавляли 2 мкл химотрипсина
рез стерильный фильтр с диаметром пор
(сток 2 мг/мл) («Sigma Aldrich»), растворенного
0,22 мкм («Millipore», «Merck», США), обладаю
в рабочем буфере, и перемешивали. Интенсив
щий низкой сорбцией белка, и хранили при
ность окраски измеряли на спектрофотометре
4 °С.
UV300 («Amersham», Великобритания) при дли
Электрофорез в полиакриламидном геле
не волны 390 нм. Измерения вели с периодич
(SDS7PAGE). Для выявления наиболее эффек
ностью в 2 с в течение 200 с. В качестве отрица
тивного штамма продуцента рчЦфА уровень
тельного контроля использовали рабочий бу
продукции рчЦфА определяли с помощью SDS
фер. Блокирующее влияние ЦсА
(«Sigma
PAGE в денатурирующих условиях в 12% поли
Aldrich») на изомеразную активность рчЦфА
акриламидном геле по методу Лэммли [22].
оценивали, добавляя к исходной реакционной
Аликвоты жидкой культуры продуцента центри
смеси 10 мкл раствора ЦсА (сток 10 мкМ в эта
фугировали (Centritech VP Pilot) при
ноле) до конечной концентрации 100 нМ.
5000 об./мин в течение 5 мин; осажденные клет
Животные. Самок мышей C57BL/6 (14-16
ки растворяли в 100 мкл лизирующего буфера с
недель) получали из экспериментально биоло
добавлением красителя бромфенолового синего
гической лаборатории НИИ эксперименталь
(«VWR Life Science AMRESCO», Австрия), обра
ной диагностики и терапии опухолей Федераль
батывали 20 с ультразвуком, нагревали 3 мин
ного государственного бюджетного учреждения
при 100 °С и наносили на гель. После проведе
«Национальный медицинский исследовательс
ния электрофореза гель окрашивали Кумасси
кий центр онкологии имени Н.Н. Блохина»
R 250 («Thermo Fisher Scientific») по стандарт
(ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»)
ной методике и сканировали с помощью денси
Минздрава России. Экспериментальные груп
тометра Shimadzu CS 930 («DMS», Франция). В
пы состояли из 10 животных. Мышей содержали
качестве калибровочных значений использова
при 12 часовом световом цикле при температу
ли данные денситограмм очищенного рчЦфА,
ре 20-24 °С и 40% относительной влажности.
концентрация которого была предварительно
Работу с животными проводили в соответствии
определена по методу Бредфорда [23]. При оп
с протоколом этической комиссии ФГБУ
ределении стабильности рчЦфА в качестве мар
«НМИЦ онкологии им. Н.Н. Блохина»
кера дополнительно использовали бычий сыво
Минздрава России.
роточный альбумин (БСА, «Amresco», Англия) и
Облучение мышей в сублетальной дозе 4,5 Гр
маркер молекулярной массы белков («Thermo
осуществляли на гамма терапевтической уста
Fisher Scientific», кат. № 26619).
новке Co 60 «Агат Р» (Россия) с начальной
Определение содержания эндотоксина. Оцен
мощностью 1,9 × 1014 Бк.
ку содержания бактериальных эндотоксинов в
Оценка биологической активности рчЦфА
очищенных образцах рчЦфА проводили с по
in vivo. Оценку хемоаттрактивной активности
мощью ЛАЛ теста, используя количественный
рчЦфА по отношению к стволовым кроветвор
гель тромб тест, основанный на способности
ным клеткам костного мозга проводили посред
лизата амебоцитов мечехвоста Limulus polyphe=
ством определения числа селезеночных эндоко
mus специфически реагировать с эндотоксина
лоний после сублетального облучения мышей по
ми грамотрицательных бактерий (ЛПС). Анали
методу Till & McCullough [25]. Через 24 ч после
зы проводили на базе ООО «НПО «ЛАЛ центр»
облучения опытным мышам в хвостовую вену
(Москва, Россия) в соответствии с инструкцией
вводили очищенный рчЦфА в дозе
производителя («Charles River Endosafe», США).
100 мкг/мышь. Одной группе контрольных жи
Определение пептидил7пролил цис7транс7изо7
вотных вводили адекватный объем натрий фос
меразной активности рчЦфА. Изомеразную ак
фатного буфера, в котором был растворен
тивность рчЦфА измеряли в сравнительном
рчЦфА. Второй группе контрольных животных
анализе с химотрипсином. В качестве субстрата
вводили раствор липополисахарида (ЛПС,
использовали N сукцинил Ala Ala Pro Phe p
«Sigma Aldrich») в том же буфере в концентра
нитроанилид (20 M, «Sigma Aldrich») в 100 мM
ции, адекватной количеству ЛПС, содержащему
БИОХИМИЯ том 87 вып. 3 2022
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ рчЦфА
393
ся в растворе 100 мкг рчЦфА (4 пг/мышь). Через
кодоны (TGA), особенно если они представле
семь дней после введения рчЦфА мышей умер
ны в единственном числе.
щвляли методом цервикальной дислокации, се
Анализ последовательности нативного гена
лезенки извлекали и помещали в фиксирующую
CYPA выявил достаточно многочисленные эле
жидкость, состоящую из ледяной уксусной кис
менты, негативно влияющие на эффективность
лоты и абсолютного спирта в соотношении 1 : 3.
транскрипции и трансляции гена чЦфА в E. coli.
Через 4 ч проводили визуальный подсчет эндо
В последовательности CYPA обнаружено нес
генных колоний в каждой селезенке.
колько кодонов, тРНК для которых весьма сла
Статистический анализ. Данные представле
бо представлены в E. coli (рис. 2, а, выделены се
ны как среднее ± стандартная ошибка среднего
рым), и «субоптимальных» кодонов, для кото
(M ± SEM). Статистический анализ проводили
рых частота встречаемости тРНК относительно
с использованием программного обеспечения
невысока (рис. 2, а, подчеркнуты). Кроме того,
Statistica for Windows 6.0 («StatSoft», США). Для
выявлено несколько пар повторяющихся друг за
сравнения внутри группы использовали парный
другом кодонов (рис. 2, а, выделены курсивом и
выборочный t критерий Стьюдента, а для меж
подчеркнуты), что также может вызывать паузы
группового сравнения - независимый t крите
в трансляции. В нативной последовательности
рий Стьюдента. Различия признавали значимы
гена CYPA был обнаружен участок «упрощённой
ми при p ≤ 0,05.
структуры» ДНК (GAGAGA, рис. 2, б), который
мог стать фактором нестабильности РНК и в ко
тором возможно присутствие сайтов внутренне
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
го связывания с рибосомой [18], потенциально
обусловливающих трансляционные паузы
Оптимизация последовательности гена CYPA и
[19, 20]. Кроме того, нативная последователь
создание штамма7продуцента рчЦфА. Ранее при
ность гена CYPA содержала относительно боль
создании штамма продуцента E. coli для получе
шое число AG богатых участков, которые могли
ния рчЦфА использовали оригинальную после
распознаваться рибосомами и вызывать паузы в
довательность гена CYPA, которая содержит
трансляции (рис. 2, б).
спектр кодонов, характерных для транскрипции
Анализ вторичной структуры исходной по
генов в организме человека [26]. Этот спектр су
следовательности показал её значительную нес
щественно отличается от спектра кодонов, ис
табильность: в наиболее энергетически выгод
пользуемых для продукции активно экспресси
ной конформации присутствует протяжённая
рующихся белков в E. coli. В результате тРНК,
петля, не содержащая комплементарных пар ос
содержащая редкие для E. coli антикодоны, тит
нований (рис. 2, г). Присутствие данной петли
ровалась высоким уровнем транскрипции гете
могло способствовать ускоренной деградации
рологичного белка, затрудняя работу аппарата
мРНК и снижению уровня трансляции.
трансляции, продукцию целевого белка и об
При дизайне из последовательности гена
щий рост клеточной массы.
CYPA удалили гомополимерные и AG богатые
Современные методы повышения продук
участки (рис. 2, б), а также провели замену ред
ции рекомбинантных белков основываются не
ко встречающихся и повторяющихся кодонов
только на подборе адекватной системы тран
(рис. 2, а). Кроме того, были удалены участки,
скрипции трансляции и условий культивирова
потенциально способные к вторичной инициа
ния, но и на адаптации последовательности
ции трансляции (рис. 2, в), и создан новый сайт
ДНК, кодирующей целевой белок, - «кодонной
терминации трансляции, состоящий из двух
оптимизации» [27, 28] для продукции в конкрет
последовательных кодонов TAA, являющихся
ном организме хозяине [29]. Для этого в данной
наиболее «сильными». Также были удалены сай
работе был проведен дизайн последовательнос
ты для узнавания гексануклеотидными эндо
ти гена CYPA, который включал в себя замены
нуклеазами рестрикции для облегчения перено
некоторых кодонов нативного гена на кодоны,
са синтетического гена в различные экспресси
наиболее часто встречающиеся в генах белков с
онные системы. В результате анализа и оптими
высоким уровнем продукции у E. cоli. При этом
зации была создана рекомбинантная последова
учитывали перспективы стабильности конечной
тельность гена CYPA (rCYPA), оптимизированная
мРНК, отсутствие препятствий трансляции в
для транскрипции и трансляции в E. coli
виде чрезмерной структурированности мРНК,
(рис. 2, д). Анализ вторичной структуры rCYPA
отсутствие гомополимерных участков [18, 19] и
показал, что оптимизированная ДНК этого гена
особенности проведения высокоэффективной
лишена указанных выше недостатков (рис. 2, г).
терминации трансляции, поскольку рибосомы
Сравнение природной и оптимизированной
могут «проскакивать» «слабые» терминирующие
последовательностей гена CYPA показало, что
БИОХИМИЯ том 87 вып. 3 2022
394
КАЛИНИНА и др.
Рис. 2. Особенности нативной последовательности гена CYPA, ограничивающие эффективность продукции чЦфА в E. coli.
а - Нативная последовательность гена CYPA с указанием факторов, лимитирующих эффективность трансляции: редкие
кодоны выделены серым, повторяющиеся - курсивом и подчеркнуты, субоптимальные - подчеркнуты. б - Гомополи
мерные и AG богатые участки в составе нативной последовательности (выделены серым). в - Участки, потенциально
способные к вторичной инициации трансляции (выделены серым). г - Вторичная структура РНК гена CYPA до (сверху) и
после (снизу) оптимизации. д - Оптимизированная последовательность гена CYPA
степень их идентичности составила ~ 80%. Раз
Оценка продуктивности штамма7продуцента
работанную последовательность ДНК CYPA
рчЦфА. На первом этапе проводили подбор оп
синтезировали при помощи серии ПЦР с пере
тимальных условий для максимальной продук
крывающимися праймерами (таблица). В пос
ции рчЦфА штаммом продуцентом. Для этой
леднюю пару праймеров были введены сайты
цели была использована стандартная методика
эндонуклеаз рестрикции NdeI и XhoI (CPF5Nde
анализа зависимости продукции белка от уров
и CPR5Xho, таблица) для последующего клони
ня индуктора и температуры, при которой про
рования полноразмерной ДНК оптимизиро
водится индукция [30]. Продукцию рчЦфА ин
ванного гена CYPA в плазмидный вектор
дуцировали добавлением ИПТГ в конечной
pET22b(+) («Novagen», США). В результате бы
концентрации от 50 до 1000 мкМ при темпера
ла получена экспрессионная плазмида
турах 22, 25, 28, 30, 32 и 37 °С. Результаты срав
pETCYPopti размером 5858 п.н., которая содер
нительного анализа показали, что добавление
жала клонированный ген CYPA размером
ИПТГ в конечной концентрации более
498 п.н. (рис. 1). Этой плазмидой трансформи
250 мкМ не увеличивало продукцию рчЦфА
ровали штамм E. coli BL21(DE3)Gold, в резуль
(данные не представлены). При температуре
тате чего был получен штамм продуцент
25 °С удельный выход растворимого белка был
рчЦфА E. coli BL21(DE3)Gold/pETCYPopti [17].
максимальным в пересчёте на грамм биомассы,
БИОХИМИЯ том 87 вып. 3 2022
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ рчЦфА
395
однако при 28 °С общий выход биомассы был
держащего данные примеси, демонстрирует
существенно выше, что приводило к накопле
смещение максимума поглощения с длины вол
нию большего количества растворимого белка в
ны 275-280 нм, характерной для препаратов
пересчёте на литр культуральной среды, чем при
белка, к длине волны 260 нм (данные не пред
25 °С (данные не представлены). Таким образом,
ставлены).
была сформирована программа роста клеток
Известно, что анионообменные смолы об
продуцентов рчЦфА, включающая стартовые
ладают высокой способностью к связыванию
условия для масштабирования роста в фермен
липополисахаридов и бактериального эндоток
тёре: наращивание биомассы при 37 °С, индук
сина. В то же время ЦфА, обладающий высокой
цию продукции белка при 28 °С путём добавле
изоэлектрической точкой (pI 9,6) [31], не связы
ния ИПТГ до конечной концентрации 0,5 мМ.
вается с данными носителями. Концентрация
Электрофоретический анализ лизата бактери
рчЦфА при таком способе очистки составляла
альной биомассы штамма продуцента показал,
не менее 10 мг/мл при суммарном выходе очи
что при подобранных условиях выращивания и
щенного белкового продукта не менее 0,5 г с
индукции рчЦфА является доминирующим бел
литра культуры без ферментации и не менее 1 г
ком (рис. 3, а). Аналогичные результаты были
с литра культуры, выращенной в ферментёре,
получены при продукции рчЦфА в препаратив
что более чем в 5 раз превосходило уровень про
ном количестве (рис. 3, б, дорожка 2). По ре
дукции в аналогичных условиях для неоптими
зультатам денситометрических измерений ко
зированного гена [32].
личество рчЦфА составило 50% от общего коли
Чистота полученного рчЦфА стандартно
чества клеточного белка бактерий.
составляла
95% по данным денситометрии
Оптимизация способа очистки рчЦфА. Хро
(рис. 3, б, дорожки 3-7). Анализ количества эн
матографическую очистку рчЦфА проводили
дотоксина в образцах рчЦфА показал, что при
одноэтапно с использованием тандема колонок
разработанном способе очистки его содержание
DEAE Sepharose и Q Sepharose в буфере, содер
не превышало 0,04 нг на 1 мг белка, что соответ
жащем 30 мМ фосфата натрия (pH 8). Было по
ствует требованиям Европейской фармакопеи к
казано, что существенным моментом эффектив
инъекционным препаратам [16].
ности такой очистки рчЦфА является объем об
Оценка активности рчЦфА. ЦфА, обладая
разца, наносимого на колонку. В случае нанесе
пептидил пролил цис транс изомеразной ак
ния объемов образца, двукратно и более превы
тивностью, играет важную роль в формирова
шающих объем колонки DEAE Sepharose, воз
нии пространственной структуры белков [3].
можна контаминация очищенного белка приме
Кроме того, ЦфА является лигандом для ЦсА, и
сями, слабо удерживаемыми носителем, кото
их связывание подавляет ферментативную и био
рые медленно мигрируют вдоль колонки и вы
логическую активность ЦфА. Для подтвержде
ходят после окончания элюции целевого белка.
ния функционального соответствия полученно
Спектр поглощения белкового препарата, со
го рекомбинантного белка природному ЦфА мы
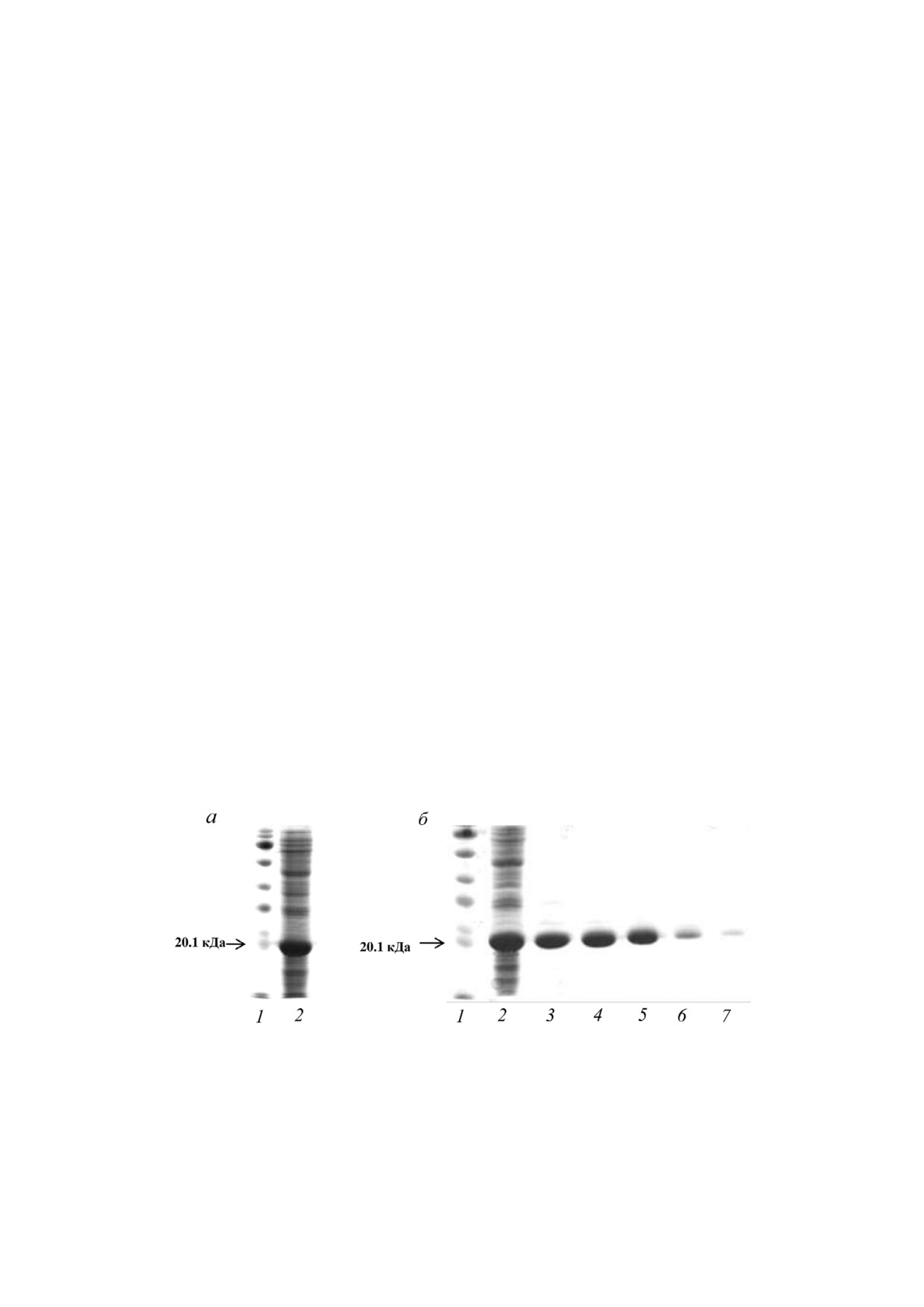
Рис. 3. Электрофоретический анализ чистоты рчЦфА. а - Аналитическая продукция рчЦфА в клетках BL21(DE3)Gold/
pETCYPopti: 1 - маркер молекулярной массы Page Ruler Plus («Thermo Fisher Scientific», США); 2 - лизат бактериальной
биомассы после продукции рчЦфА. б - Препаративная продукция рчЦфА в клетках BL21(DE3)Gold/pETCYPopti; SDS
PAGE электрофоретический анализ после очистки рчЦфА методом тандемной анионообменной хроматографии на ко
лонках DEAE Sepharose и Q Sepharose: 1 - маркер молекулярной массы Page Ruler Plus; 2 - лизат бактериальной биомас
сы после осаждения сульфатом аммония и диализа; 3-7 - различные количества рчЦфА, очищенные при помощи тан
демной анионообменной хроматографии (5,0; 3,0; 2,0; 0,5; 0,2 мкг соответственно)
БИОХИМИЯ том 87 вып. 3 2022
396
КАЛИНИНА и др.
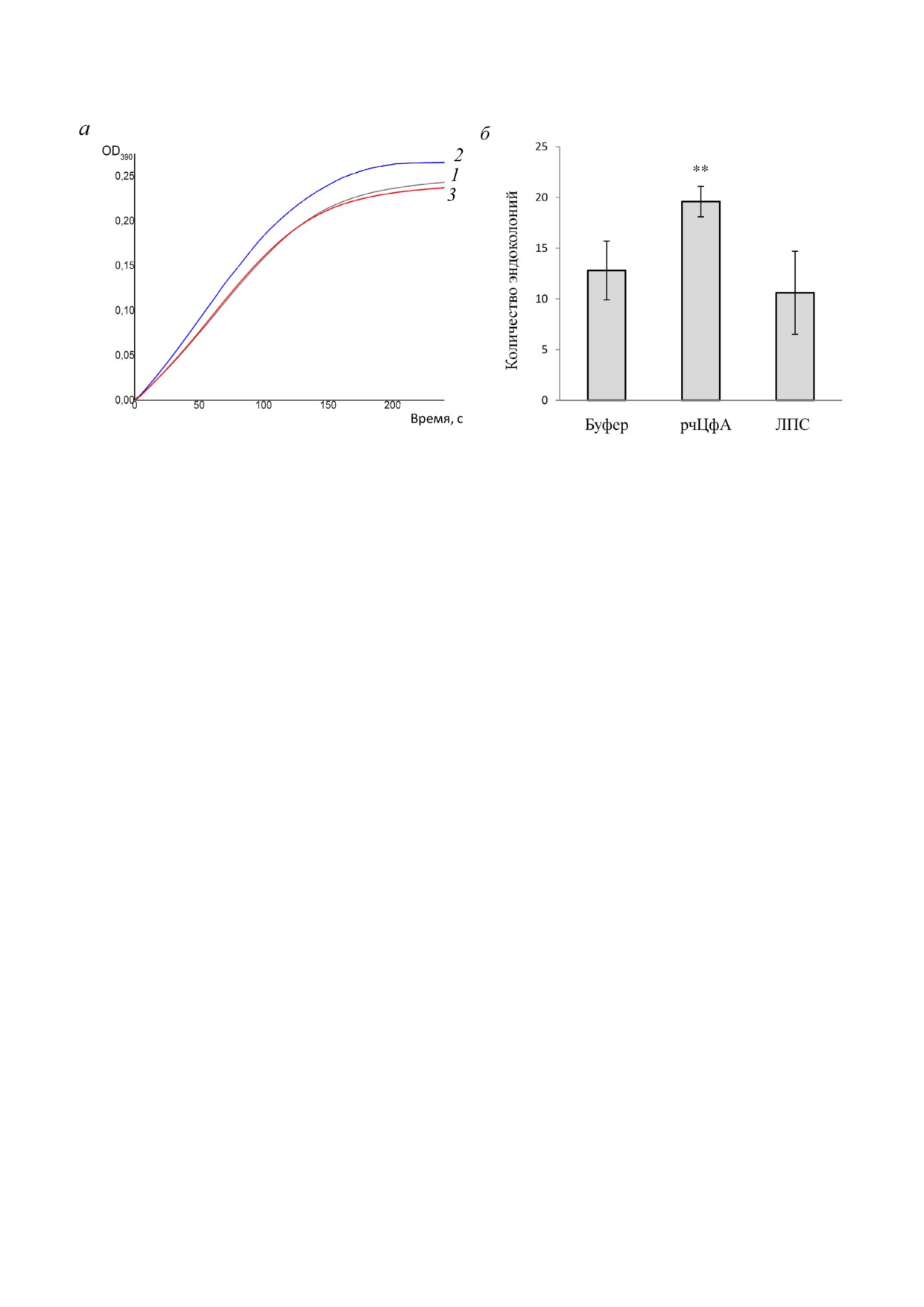
Рис. 4. Оценка активности рчЦфА. а - Анализ изомеразной активности рчЦфА: 1 - химотрипсин; 2 - рчЦфА + химо
трипсин; 3 - рчЦфА + ЦсА + химотрипсин. б - Влияние рчЦфА на формирование эндоколоний стволовых клеток в се
лезенке сублетально облученных мышей линии C57BL/6. Представлены данные одного из двух репрезентативных экспе
риментов (M ± SEM), по 10 мышей в группе. ** р ≤ 0,01
оценили способность рекомбинантного белка
(100 мкг/мышь), вводимом опытной группе жи
проявлять изомеразную активность и влияние
вотных.
ЦсА на эту активность.
Исследование показало, что после введения
Было показано, что добавление рчЦфА в ре
рчЦфА число образованных эндоколоний уве
акционную смесь химотрипсина и N нитроани
личивалось в 1,5 раза по сравнению с контроль
лида приводило к увеличению скорости образо
ной группой животных, которым вводили бу
вания изомерной формы р нитроанилида
фер, использованный для хроматографического
(рис. 4, а, кривая 2), что свидетельствовало о на
выделения рчЦфА (рис. 4, б). ЛПС в используе
личии изомеразной активности рчЦфА. Добав
мой дозе не оказал влияния на миграцию клеток
ление ЦсА в реакционную систему приводило к
костного мозга мыши (рис. 4, б).
нейтрализации данной активности (рис. 4, а,
Таким образом, было показано, что рчЦфА
кривая 3). Таким образом, было показано, что
обладает всеми функциональными свойствами
рчЦфА обладает функциональными свойствами
природного белка, сохраняя изомеразную и хе
природного ЦфА: проявляет изомеразную ак
моаттрактивную активности.
тивность и является лигандом для ЦсА, сохра
Оценка стабильности рчЦфА. Стерильные
няя способность с ним связываться.
образцы полученного рчЦфА в различных кон
Известно, что природный ЦфА является хе
центрациях (2,5, 5 и 13 мг/мл) были заложены
моаттрактантом не только для нейтрофилов,
на хранение в холодильник при температуре
эозинофилов, моноцитов и активированных
4 °С. По истечении трех лет хранения было от
Т лимфоцитов [5-7], но и для незрелых клеток
мечено, что полученный рчЦфА проявлял боль
предшественников гемопоэза из костного моз
шую стабильность, поскольку даже при высоких
га [11]. Чтобы оценить хемотаксическую актив
концентрациях (13 мг/мл) раствор белка не те
ность рчЦфА в отношении клеток костного моз
рял прозрачность, белок сохранял раствори
га, белок вводили сублетально облученным мы
мость, молекулярную стабильность (по резуль
шам и через 7 дней после облучения производи
татам SDS PAAG, рис. 5) и изомеразную актив
ли подсчет эндоколоний, которые образовали
ность, аналогичную показанной на рис. 4, а
гемопоэтические стволовые клетки костного
(данные не представлены). Было подтверждено,
мозга в селезенке мыши [11, 25]. Поскольку
что такой белок сохраняет биологическую ак
ЛПС также обладает способностью усиливать
тивность, являясь хемоаттрактантом для грану
миграцию клеток костного мозга, в качестве до
лоцитов и активированных Т лимфоцитов [7].
полнительного контроля отдельной группе жи
Однако лучшую сохранность обеспечивает хра
вотных вводили ЛПС в дозе 4 пг/мышь, что со
нение данного белка в более низких концентра
ответствовало его количеству в растворе рчЦфА
циях (3-5 мг/мл), т.к. в дальнейшем при хране
БИОХИМИЯ том 87 вып. 3 2022
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ рчЦфА
397
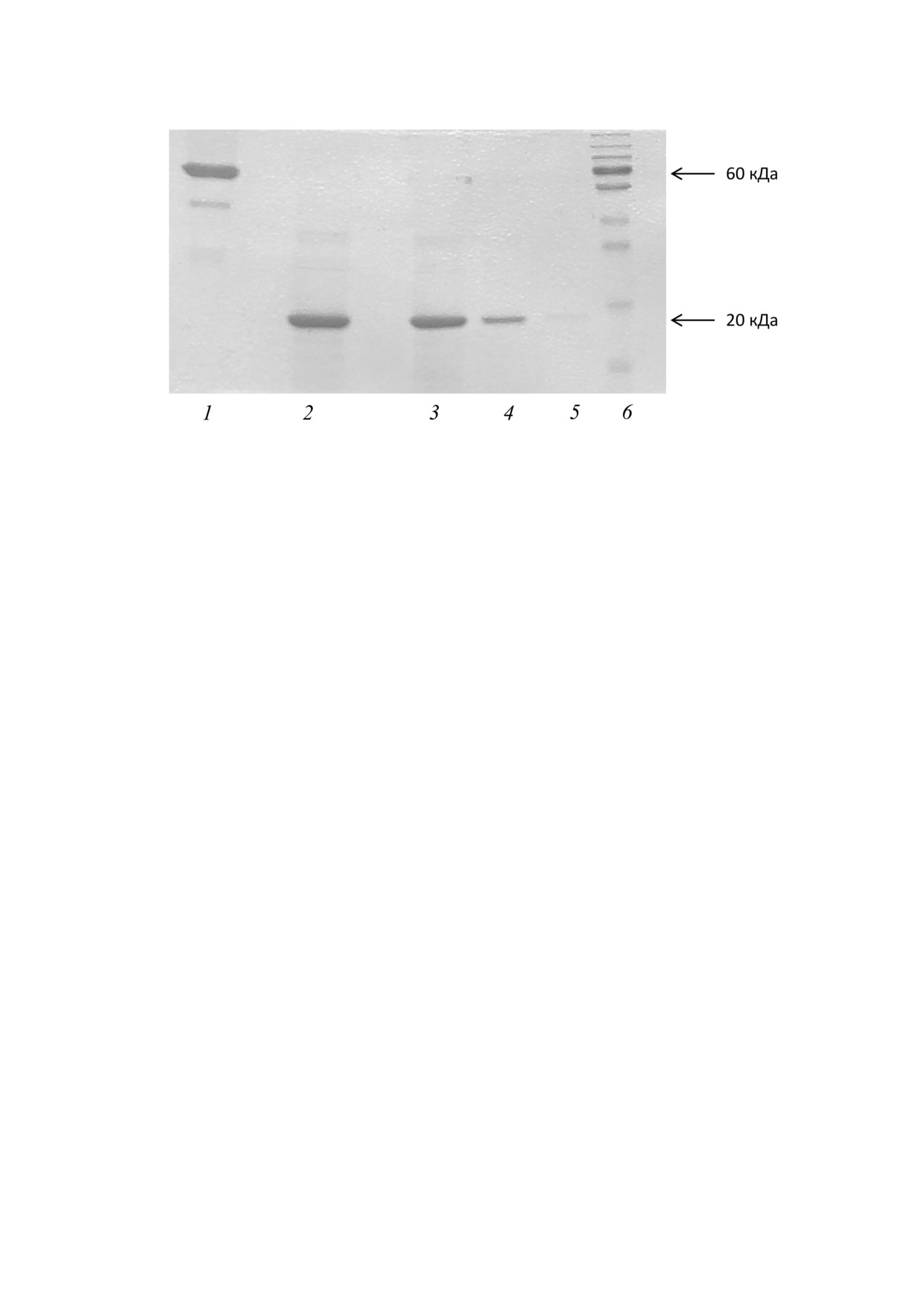
Рис. 5. Оценка молекулярной стабильности рчЦфА через 3 года после получения. 1 - БСА (10 мкг); 2-5 - рчЦфА в коли
честве 10, 5, 1 и 0,1 мкг соответственно; 6 - маркер молекулярной массы Page Ruler Plus («Thermo Fisher Scientific», США)
нии образцов более трех лет раствор белка в вы
ния молекула рчЦфА обладает высокой ста
соких концентрациях может мутнеть и выпадать
бильностью при хранении.
в осадок.
Таким образом, все перечисленные качества
позволяют считать полученный рчЦфА пер
спективным для его использования при прове
ЗАКЛЮЧЕНИЕ
дении фундаментальных исследований, для
всестороннего изучения данного белка в качест
В настоящем исследовании мы разработали
ве мишени при поиске подходов лечения раз
и синтезировали последовательность ДНК
личных заболеваний, а также для изучения воз
CYPA, оптимизированную для особенностей
можности его медицинского применения как
белковой продукции в E. coli. Это позволило
лекарственного средства [33].
значительно увеличить продуктивность полу
ченного штамма по сравнению с уже известны
Финансирование. Работа выполнена при фи
ми продуцентами рчЦфА [26, 32]. Существен
нансовой поддержке Министерства промыш
ным преимуществом разработанной технологии
ленности и торговли Российской Федерации
является простая и эффективная процедура
(грант № 12411.1008799.13.004).
очистки рчЦфА, позволяющая в значительной
Конфликт интересов. Авторы заявляют об от
мере избавиться от примесей бактериального
сутствии конфликта интересов.
ЛПС. Оценка биологической активности
Соблюдение этических норм. Все примени
рчЦфА показала, что полученный белок вос
мые международные, национальные и/или инс
производит функциональные свойства природ
титуциональные принципы ухода и использова
ного ЦфА [7]. При описанном способе получе ния животных были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1.
Nigro, P., Pompilio, G., and Capogrossi, M. C. (2013)
Biophys. Res. Commun., 316, 1073 1080, doi: 10.1016/
Cyclophilin A is a key player for human disease, Cell Death
j.bbrc.2004.02.160.
Dis., 4, e888, doi: 10.1038/cddis.2013.410.
4.
Colgan, J., Asmal, M., Neagu, M., Yu, B.,
2.
Wang, P., and Heitman, J. (2005) Cyclophilins, Genome
Schneidkraut, J., et al. (2004) Cyclophilin A regulates TCR
Biol., 6, 226, doi: 10.1186/gb 2005 6 7 226
signal strength in CD4+ T cells via a proline directed con
3.
Honga, F., Leeb, J., Piaoa, Y. J., Jae, Y. K., Kim, Y. J.,
formational switch in Itk, Immunity,
21,
189201,
et al. (2004) Transgenic mice overexpressing cyclophilin A
doi: 10.1016/j.immuni.2004.07.005.
are resistant to cyclosporin A induced nephrotoxicity via
5.
Arora, K., Gwinn, W. M., Bower, M. A., Watson, A.,
peptidyl prolyl cis-trans isomerase activity, Biochem.
Okwumabua, I., et al. (2005) Extracellular cyclophilins
БИОХИМИЯ том 87 вып. 3 2022
398
КАЛИНИНА и др.
contribute to the regulation of inflammatory responses,
19.
Li, G. W., Oh, E., and Weissman, J. S. (2012) The anti
J. Immunol., 175, 517522, doi: 10.4049/jimmunol.
Shine-Dalgarno sequence drives translational pausing and
175.1.517.
codon choice in bacteria, Nature,
484,
538541,
6.
Dawar, F. U., Wu, J., Zhao, L., Khattak, M. N. K, Mei, J.,
doi: 10.1038/nature10965.
et al. (2017) Updates in understanding the role of
20.
Jin, H., Zhao, Q., Gonzalez de Valdivia, E. I., Ardell, D. H.,
cyclophilin A in leukocyte chemotaxis, J. Leukoc Biol.,
Stenström, M., et al. (2006) Influences on gene expression
101, 823 826, doi: 10.1189/jlb.3RU1116 477R.
in vivo by a Shine-Dalgarno sequence, Mol. Microbiol., 60,
7.
Kalinina, A. A., Silaeva, Yu. Yu., Kazansky, D. B., and
480 492, doi: 10.1111/j.1365 2958.2006.05110.x.
Khromykh, L. M. (2019) The role of recombinant human
21.
Studier, F. W., and Moffattm, B. A. (1986) Use of bacterio
cyclophilin A in the antitumor immune response, Acta
phage T7 RNA polymerase to direct selective high level
Naturae, 11, 63 67, doi: 10.32607/20758251 2019 11 2
expression of cloned genes, J. Mol. Biol., 189, 113 130,
63 67.
doi: 10.1016/0022 2836(86)90385 2.
8.
Ramachandran, S., Venugopal, A., Kutty, V., Vinitha, A.,
22.
Laemmli, U. K. (1970) Cleavage of structural proteins dur
Divya, G., et al. (2014) Plasma level of cyclophilin A is
ing the assembly of the head of bacteriophage T4, Nature,
increased in patients with type 2 diabetes mellitus and sug
227, 680 685, doi: 10.1038/227680a0.
gests presence of vascular disease, Cardiovasc. Diabetol.,
23.
Bradford, M. M. (1976) A rapid and sensitive method for
13, 38, doi: 10.1186/1475 2840 13 38.
the quantitation of microgram quantities of protein utiliz
9.
Kalinina, A., Golubeva, I., Kudryavtsev, I., Khromova, N.,
ing the principle of protein dye binding, Anal. Biochem.,
Antoshina, E., et al. (2021) Cyclophilin A is a factor of
72, 248 254, doi: 10.1006/abio.1976.9999.
antitumor defense in the early stages of tumor develop
24.
Kumawat, M., Karuna, I., Ahlawat, N., and Ahlawat, S.
ment, Int. Immunopharmacol., 94, 107470, doi: 10.1016/
(2020) Identification of Salmonella typhimurium peptidyl
j.intimp.2021.107470.
prolyl cis trans isomerase B (PPIase B) and assessment of
10.
Spik, G., Haendler, B., Delmas, O., Mariller, C.,
their role in the protein folding protein, Pept. Lett., 27,
Chamoux, M., et al. (1991) A novel secreted cyclophilin
744 750, doi: 10.2174/0929866527666200225124104.
like protein (SCYLP), J. Biol. Chem., 266, 10735 10738.
25.
Till, J. E., and McCullough, E. A. (1961) A direct mea
11.
Khromykh, L. M., Kulikova, N. L., Anfalova, T. V.,
surement of the radiation sensitivity of normal mouse bone
Muranova, T. A., Abramov, V. M., et al.
(2007)
marrow cells, Radiat. Res., 14, 213 222, doi: 10.1667/
Cyclophilin A produced by thymocytes regulates the
rrav01.1.
migration of murine bone marrow cells, Cell Immunol.,
26.
Liu, J., Albers, M. W., Chen, C. M., Schreiber, S. L., and
249, 46 53, doi: 10.1016/j.cellimm.2007.11.002.
Walsh, C. T. (1990) Cloning, expression, and purification
12.
Perrucci, G., Straino, S., Corliano, M., Scopece, A.,
of human cyclophilin in Escherichia coli and assessment of
Napolitano, M., et al. (2016) Cyclophilin A modulates
the catalytic role of cysteines by site directed mutagenesis,
bone marrow derived CD117(+) cells and enhances
Proc. Natl. Acad. Sci. USA, 87, 2304 2308, doi: 10.1073/
ischemia induced angiogenesis via the SDF 1/CXCR4
pnas.87.6.2304.
axis, Int. J. Cardiol., 212,324 335, doi: 10.1016/j.ijcard.
27.
Grosjean, H., and Fiers, W. (1982) Preferential codon
2016.03.082.
usage in prokaryotic genes: the optimal codon-anticodon
13.
Hong, F., Lee, J., Song, J., Lee, S., Ahn, H., et al. (2002)
interaction energy and the selective codon usage in effi
Cyclosporin A blocks muscle differentiation by inducing
ciently expressed genes, Gene,
18,
199209,
oxidative stress and inhibiting the peptidyl prolyl cis trans
doi: 10.1016/0378 1119(82)90157 3.
isomerase activity of cyclophilin A: cyclophilin A protects
28.
Hatfield, G. W., and Roth, D. A. (2007) Optimizing scale
myoblasts from cyclosporin A induced cytotoxicity,
up yield for protein production: computationally opti
FASEB J., 16, 1633 1635, doi: 10.1096/fj.02 0060fje.
mized DNA assembly (CODA) and translation engineer
14.
Guo, M., James, A., Kwak, J., Shen, J., Yokoyama, K.,
ing, Biotechnol. Annu. Rev., 13, 27 42, doi: 10.1016/S1387
et al. (2016) Cyclophilin A (CypA) plays dual roles in reg
2656(07)13002 7.
ulation of bone anabolism and resorption, Sci. Rep., 6,
29.
Jestin, J. L., and Kempf, A. (2009) Optimization models
22378, doi: 10.1038/srep22378.
and the structure of the genetic code, J. Mol. Evol., 69,
15.
Liu, X., Zhao, Z., Xu, C., Sun, L., Chen, J., et al. (2012)
452 457, doi: 10.1007/s00239 009 9287 5.
Cyclophilin A restricts influenza A virus replication
30.
Sambrook, J., and Russell, D. W. (2001) Molecular Cloning:
through degradation of the M1 protein, PLoS One, 7,
A Laboratory Manual, Cold Spring Harbor, Cold Spring
e31063, doi: 10.1371/journal.pone.0031063.
Harbor Laboratory Press, N. Y.
16.
Malyala, P., and Singh, M. (2008) Endotoxin limits in for
31.
Handschumacher, R. E., Harding, M. W., Rice, J.,
mulations for preclinical research, J. Pharm. Sci., 97,
Drugge, R. J., and Speicher, D. W. (1984) Cyclophilin: A
2041 2044, doi: 10.1002/jps.21152.
specific cytosolic binding protein for cyclosporin A,
17.
Khromykh, L. M., Kalinina, A. A., Kozyr, A. V.,
Science, 226, 544 547, doi: 10.1126/science.6238408.
Kolesnikov, A. V., Silaeva, Yu. Yu., et al. (2016) The strain
32.
Khromykh, L. M., Lazarev, V. N., Manuvera, V. A.,
of Escherichia coli BL21(DE3)GoldpETCYPopti is the
Kalinina, A. A., Silaeva, Yu. Yu., et al. (2015) The strain of
producer of recombinant human cyclophilin A. Patent
Escherichia coli BL21(DE3)Gold/pETmin CypA is the
# 2603283, Russian Federation.
producer of recombinant human cyclophilin A. Patent
18.
Wu, X., Jörnvall, H., Berndt, K. D., and Oppermann, U.
#2557305, Russian Federation.
(2004) Codon optimization reveals critical factors for high
33.
Kalinina, A., Zamkova, M., Antoshina, E.,
level expression of two rare codon genes in Escherichia coli:
Trukhanova, L., Gorkova, T., et al. (2019) Analyses of the
RNA stability and secondary structure but not tRNA abun
toxic properties of recombinant human cyclophilin A in
dance, Biochem. Biophys. Res. Commun., 313, 89 96,
mice, J. Immunotoxicol., 16, 182190, doi: 10.1080/
doi: 10.1016/j.bbrc.2003.11.091.
1547691X.2019.1665597.
БИОХИМИЯ том 87 вып. 3 2022
ПРЕПАРАТИВНОЕ ПОЛУЧЕНИЕ рчЦфА
399
PREPARATIVE PRODUCTION AND PURIFICATION
OF RECOMBINANT HUMAN CYCLOPHILIN A
A. A. Kalinina1, A. V. Kolesnikov2, A. V. Kozyr2, N. L. Kulikova3,
M. A. Zamkova1, D. B. Kazansky1, and L. M. Khromykh1*
1 Federal State Budgetary Institution “N.N. Blokhin National Medical Research Center of Oncology”
of the Ministry of Health of the Russian Federation, 115478 Moscow, Russia; e=mail: lkhromykh@list.ru
2 Federal Budgetary Scientific Institution “State Research Center of Applied Microbiology and Biotechnology”,
142279 Obolensk, Moscow Region, Russia
3 Open Join=Stock Company “Institute of Immunological Engineering”, 142380 Lyubuchany, Moscow Region, Russia
In this work, we developed a method of preparative production of recombinant human cyclophilin A (rhCypA)
in Escherichia coli. The full length cDNA encoded the gene of human CypA (CYPA) was amplified by RT PCR from
the total RNA of human T cell lymphoma Jurkat. The nucleotide sequence of CYPA was optimized to provide highly
effective translation in E. coli. Recombinant CYPA DNA was cloned into the pET22b(+) vector, and the resulted
expression plasmid was used to transform E. coli strain BL21(DE3)Gold. The recombinant producer strain of E. coli
produced soluble rhCypA in the cytoplasm of the bacteria. The synthesis efficiency of rhCypA was up to 50% of the
total cell protein allowing to produce rhCypA in the amount of 1 g per liter of the culture. We also developed the
method for rhCypA purification, consisting of single step tandem anion exchange chromatography on DEAE and
Q Sepharose columns. The protein purity was 95% according to electrophoresis (SDS PAGE), and its contamina
tion with the endotoxin did not exceed 0,05 ng per 1 mg of the protein that met the requirements of European
Pharmacopoeia to injectable preparations. The produced recombinant protein exhibited functional features of native
CypA, i.e., isomerase activity and chemokine activity as assessed by stimulation of migration of mouse bone marrow
hematopoietic stem cells in vivo. The generated producer strain of E. coli is a super producer and could be used for
large scale experimental studies of rhCypA and its preclinical and clinical trials as a drug.
Keywords: cyclophilin A, gene optimization, producer strain, isomerase activity, chemokine activity
БИОХИМИЯ том 87 вып. 3 2022