БИОХИМИЯ, 2022, том 87, вып. 3, с. 400 - 418
УДК 577.112.7;617.741
АГРЕГАЦИЯ БЕЛКОВ ПРИ КАТАРАКТЕ:
РОЛЬ ВОЗРАСТНЫХ МОДИФИКАЦИЙ
И МУТАЦИЙ α КРИСТАЛЛИНОВ*
Обзор
© 2022
P. Budnar, R. Tangirala, R. Bakthisaran, Ch. M. Rao**
Centre for Cellular and Molecular Biology (CCMB), Council of Scientific and Industrial Research (CSIR),
Uppal Road, Hyderabad 500007, India; e mail: mohan@ccmb.res.in; mohan.ccmb@gmail.com
Поступила в редакцию 05.10.2021
После доработки 02.02.2022
Принята к публикации 02.02.2022
Катаракта является основной причиной слепоты. Из за нарушения процесса обновления белков в хруста
лике глаза накапливаются возрастные и экологические модификации белков, которые изменяют их натив
ную конформацию, что приводит к образованию склонных к агрегации промежуточных продуктов, а также
нерастворимых и светорассеивающих агрегатов, снижающих прозрачность хрусталика. Белок хрусталика,
α кристаллин, является молекулярным шапероном, который предотвращает агрегацию белка, тем самым
поддерживая прозрачность хрусталика. Однако мутации или посттрансляционные модификации, такие как
окисление, деамидирование, усечение и перекрёстные сшивки, могут сделать α кристаллины неэффектив
ными и привести к обострению болезни. В настоящей работе нами описаны такие мутации и изменения, а
также их последствия. Возрастные модификации α кристаллинов влияют на их структуру, олигомеризацию
и шаперонную функцию. Мутации α кристаллинов могут привести к агрегации/внутриклеточным включе
ниям, связанным с нарушением структуры и сборки олигомеров, что приводит к перестройке областей,
склонных к агрегации. Такие структурные перестройки могут привести к обнажению до сих пор скрытых
участков, склонных к агрегации, тем самым заполняя склонное к агрегации состояние ( я) и облегчая
аморфную/амилоидную агрегацию и/или несоответствующие взаимодействия с клеточными компонента
ми. Изучение вызванных мутациями изменений в структуре, сборке олигомеров, механизмах агрегации и
интерактомах α кристаллинов будут полезны в борьбе с заболеваниями, связанными с агрегацией белков.
КЛЮЧЕВЫЕ СЛОВА: катаракта, агрегация, α кристаллин.
DOI: 10.31857/S0320972522030071
ВВЕДЕНИЕ
может вызвать ассоциированные с неправиль
ным сворачиванием белков болезни, такие как
Неправильное сворачивание белков из за
нейродегенеративные заболевания (болезни
мутаций, ковалентных модификаций или фак
Альцгеймера, Паркинсона, Хантингтона), боко
торов окружающей среды приводит к потере
вой амиотрофический склероз, муковисцидоз,
функций и агрегации белков, которые губитель
болезнь Гоше и катаракта.
ны для клеток. Поэтому в клетках развились
различные механизмы контроля качества для
предотвращения агрегации (шапероны) или
КАТАРАКТА И АГРЕГАЦИЯ БЕЛКОВ
удаления белковых агрегатов (протеасомы и ау
тофагосомы). Однако нарушение нормальной
Катаракта является одной из основных при
работы механизмов контроля качества в связи
чин слепоты [1]. Она возникает в результате па
со старением или мутациями приводит к прог
тологического помутнения хрусталика, вызван
рессивному накоплению белковых агрегатов и
ного изменением его прозрачности и показателя
преломления. Хрусталик глаза вместе с рогови
цей фокусируют падающий на сетчатку свет для
Принятые сокращения: ACD - α кристаллиновый
формирования изображения. Для получения
домен; CTE - C концевое удлинение; NTD - N концевой
домен; sHsp - малый белок теплового шока.
изображения без аберраций хрусталик должен
быть прозрачным, с высоким показателем пре
* Статья опубликована в рамках специального выпуска
«Неправильный фолдинг и агрегация белков при ката
ломления и соответствующим градиентом пока
ракте» (том 87, № 2, 2022).
зателя преломления. Чтобы соответствовать
** Адресат для корреспонденции.
этим требованиям, хрусталик имеет уникальную
400
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
401
структуру и состав. Он не содержит сосудов.
распределение лежит в основе молекулярных
Кроме того, волокнистые клетки, находящиеся
механизмов развития катаракты. При высоких
в центральной части хрусталика (ядро), теряют
концентрациях кристаллины и другие белки
органеллы, такие как ядра, митохондрии, эн
подвергаются самопроизвольному фазовому
доплазматический ретикулум и рибосомы. Бо
разделению на сосуществующие богатые и бед
лее того, плотная организация волокнистых
ные белком фазы. Разделение фаз также зависит
клеток уменьшает межклеточное пространство.
от изменений температуры, поэтому оно может
Эти стратегии удаляют или уменьшают содер
быть индуцировано в интактных хрусталиках
жание светорассеивающих структур и обеспечи
путём понижения температуры, что приводит к
вают прозрачность хрусталика [2].
возникновению холодных катаракт [2]. Окисли
Хрусталик состоит в основном из белков.
тельное повреждение, индуцируемое множест
Волокнистые клетки хрусталика характеризуют
вом факторов, включая воздействие УФ излуче
ся очень высоким содержанием белка (более
ния, может вызывать образование ненативных
70% w/v). Во время дифференцировки волок
дисульфидных связей между белковыми субъ
нистых клеток происходит резкое повышение
единицами, что приводит к образованию круп
уровня экспрессии кристаллинов, и они состав
ных необратимых агрегатов и в дальнейшем -
ляют ∼90% от всех белков клетки. Хрусталики
катаракты [5]. В течение жизни кристаллины
позвоночных животных содержат три группы
претерпевают различные необратимые ковалент
кристаллинов, а именно: α, β и γ [2]. Принято
ные модификации, вызванные, например, УФ
считать, что кристаллины являются структур
облучением, дезамидированием, окислением,
ными белками. Однако α кристаллин является
протеолизом и реакцией Майяра [6]. Эти кова
не только структурным белком. Он также обла
лентные модификации приводят к дестабилиза
дает активностью молекулярного шаперона.
ции нативной структуры кристаллинов, снижая
Прозрачность хрусталика и высокий показатель
шаперонную активность α кристаллина и спо
преломления достигаются за счёт плотной и
собствуя частичному разворачиванию βγ крис
ближней систематической упаковки кристалли
таллинов, что обусловливает развитие возраст
нов в высоких концентрациях с градиентом
ной катаракты [5, 6]. Имеются также данные об
концентрации белка ~250-400 мг/мл от внеш
агрегации амилоидного типа в хрусталиках при
ней коры к ядру [2, 3]. Показатель преломления
катаракте [7-9].
высок в области ядра и снижается на перифе
рии, в среднем до значения ∼1,4 [2]. Разделение
белкового матрикса на обогащенную и бедную
α КРИСТАЛЛИН: ФУНКЦИЯ ШАПЕРОНА
белками фазы может вызвать рассеяние света.
И СТРУКТУРНЫЕ ОСОБЕННОСТИ
Этого можно избежать благодаря присутствию в
хрусталике глаза белка - кристаллина, который
Кристаллины известны уже более 100 лет.
образует контакты ближнего действия с другими
Mörner в 1984 г. показал, что хрусталики глаза
кристаллинами [2]. Вероятность кристаллиза
содержат четыре белковые фракции - нераство
ции белков среди компонентов кристаллинов
римую форму, которую он назвал альбуминои
также снижается из за высокой полидисперс
дом, и три водорастворимые фракции, а имен
ности α кристаллинов [2]. Поскольку в хруста
но: α , β и γ кристаллины [10]. α Кристаллин
лике нет обновления белков, кристаллины, син
был выделен из хрусталика глаза в виде крупно
тезированные внутриутробно, сохраняются на
го полидисперсного олигомера, образованного
всю жизнь. Следовательно, существует потреб
двумя близкородственными белками (αA и αB
ность в системе шаперонов для сохранения бел
кристаллины). Roy и Spector [11] обнаружили,
ков хрусталика в их нативной конформации и
что при старении низкомолекулярная фракция
для предотвращения разделения фаз/осажде
α кристаллина исчезает из ядерного региона,
ния. α Кристаллины служат в качестве молеку
хотя она присутствует в более молодых хруста
лярных шаперонов, которые связываются с час
ликах. Последующие исследования показали,
тично развернутыми белками и предотвращают
что такие нерастворимые в воде фракции состо
их неправильное сворачивание и агрегацию.
ят из комплексов α кристаллина с другими
Для объяснения образования катаракты бы
кристаллинами [12]. Ретроспективно, эти наб
ло предложено множество теорий. С точки зре
людения можно рассматривать как указание на
ния физической химии, пространственные раз
взаимодействие α кристаллинов с другими бел
личия плотности белка, которые вызывают по
ками и, вероятно, роль в возрастных изменени
мутнение хрусталика, могут быть связаны с эф
ях, включая потерю прозрачности хрусталика.
фектами осмотического давления на клеточном
В клетках млекопитающих α кристаллин суще
уровне. Benedek [4] предположил, что фазовое
ствует в виде больших олигомеров, образован
7 БИОХИМИЯ том 87 вып. 3 2022
402
BUDNAR и др.
ных двумя генными продуктами: αA и αB
ле изменением четвертичной структуры, увели
кристаллинами. В хрусталиках большинства ви
чением содержания или реорганизацией гидро
дов позвоночных соотношение этих белков рав
фобных поверхностей, повышением скорости
но 3 : 1. Однако это соотношение не постоянно
субъединичного обмена [18, 20]. Исследования
и зависит от вида и возраста [2, 12]. α Кристал
нашей лаборатории также показали, что α
лин является членом семейства малых белков
кристаллин связывается с расплавленными гло
теплового шока (sHsp). Он имеет характерный
булами белков мишеней [19] и способствует ре
α кристаллиновый доменом (ACD, ∼80-100
фолдингу ранних интермедиатов [23].
консервативных а.о.), окружённый вариабель
Гомоолигомеры αA и αB кристаллинов по
ным N концевым доменом (NTD) и С конце
казали различия в температурно зависимой ак
вым расширением (CTE) [13, 14]. αA и αB
тивности, так как структура αB кристаллина бо
кристаллины имеют ∼58% гомологии последо
лее чувствительна к температуре, чем структуры
вательности друг с другом и ∼45% гомологии с
αA кристаллина или гетероолигомера α крис
другими sHsp человека, такими как HspB6
таллина, выделенного из хрусталика [21]. Меха
[13, 14].
низм шаперонной активности α кристаллина в
α Кристаллины были впервые признаны в
отношении белков мишеней интенсивно изуча
качестве членов семейства белков sHsp в начале
ется в нашей лаборатории и в других исследова
1980 гг., когда была выявлена гомология их по
тельских группах. Наши исследования показа
следовательности с белками sHsp Drosophila [15].
ли, что αA и αB кристаллины взаимодействуют
Удивительно, но за следующее десятилетие не
с индуцированными нагреванием интермедиа
было получено экспериментальных подтверж
тами разворачивания цитратсинтазы двумя спо
дений этого наблюдения. Первые эксперимен
собами: 1) слабо с ранним разворачиванием ин
тальные доказательства того, что α кристаллин
термедиатов, что облегчает рефолдинг фермента
функционирует как sHsp/молекулярный шапе
в его активное состояние, и 2) сильно и необра
рон, были получены в 1992 г. в исследованиях
тимо с более поздним разворачиванием интер
in vitro Horwitz [16], который показал, что α
медиата с образованием растворимых комплек
кристаллин предотвращает термическую агрега
сов, предотвращающих агрегацию белков [22].
цию βγ кристаллинов и алкогольдегидрогеназы.
αA и αB кристаллины связываются с низкой
Исследования в нашей лаборатории показали,
аффинностью с компактными близкими к на
что α кристаллин хрусталика глаза предотвра
тивному состояниями и с большей аффин
щает фотоагрегацию γ кристаллина [17], а также
ностью с более развернутыми состояниями бел
индуцированную нагреванием агрегацию ζ
ка мишени. Результаты, полученные в других
кристаллина и карбоангидразы [18], индуциро
лабораториях с использованием модели агрега
ванную дитиотрейтолом (DTT) агрегацию α
ции белков, таких как α кристаллин, лизоцим
лактальбумина [19] и индуцированную рефол
T4 и его мутанты, позволили предположить, что
дингом агрегацию β кристаллина [20]. Было по
αA и αB кристаллины связываются с субстра
казано, что гомоолигомеры αA и αB кристал
тами как с низким, так и с высоким срод
линов проявляют шаперонную активность в от
ством [24, 25]. Переход в высокоаффинный ре
ношении различных белков мишеней, хотя и в
жим может быть вызван температурой, pH или
разной степени [21, 22]. В нашей лаборатории
фосфорилированием белка [26]. Было также по
было впервые показано, что шаперонная актив
казано, что α кристаллин предотвращает ами
ность α кристаллина зависит от температуры,
лоидную агрегацию аполипопротеина C II и
поскольку она очень низка при температурах
серпина, взаимодействуя с частично структури
ниже 30 °C и резко возрастает при температурах
рованными интермедиатами, что позволяет
выше 30 °C [17]. По видимому, такая зависи
предположить ингибирование α кристаллином
мость активности от температуры является об
стадии образования ядра при амилоидогене
щей чертой среди Hsps, поскольку этим белкам
зе [27, 28]. Нами было показано, что αB крис
необходимо функционировать при недопусти
таллин предотвращает образование фибрилл
мых температурах. Растворимость гидрофобно
Aβ40 и Aβ42, взаимодействуя с центрами образо
го красителя пирена увеличивалась в присут
вания фибрилл Aβ40 [29]. С помощью методов
ствии α кристаллина в зависимости от темпера
кварцевого кристаллического микробаланса,
туры, что указывает на то что повышение темпе
аналитического ультрацентрифугирования и
ратуры способствует экспонированию гидро
систем обнаружения одиночных молекул, таких
фобных поверхностей α кристаллина [17]. Вы
как конфокальная двухцветная детекция совпа
званное подъёмом температуры повышение ша
дений и микроскопия полного внутреннего от
пероноподобной активности α кристаллина
ражения, было показано, что αB кристаллин
обусловлено различными факторами, в том чис
предотвращает фибрилляцию Aβ за счёт связы
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
403
ваясь с олигомерным и фибриллярным ядром
ность sHsps зависят от последовательности и
Aβ [30, 31]. Нами и в других лабораториях также
длины CTE, NTD и консервативных моти
было показано, что αB кристаллин также пре
вов [36, 38].
дотвращает фибрилляцию α синуклеина [13].
Основываясь на результатах ЯМР твердого
Полидисперсная природа α кристаллинов
тела, малоуглового рентгеновского рассея
затруднила их кристаллизацию и структурные
ния (SAXS) и электронной микроскопии (EM)
исследования. Однако можно получить крис
была предложена модель полноразмерного αB
таллы домена ACD и изучить его структуру с
кристаллина в виде симметричного мультимера
помощью методов рентгеновской дифракции.
из 24 субъединиц, связанных через иерархию
Было обнаружено, что домены ACD (∼80 а.о.) в
взаимодействий с участием ACD, CTE и NTD.
обоих кристаллинах характеризуются наличием
Сначала два ACD связываются, образуя димер.
β цепей. В общей сложности семь β цепей
Три димера связываются друг с другом с образо
(β3-β9) расположены в виде иммуноглобули
ванием гексамера за счёт взаимодействия кон
ноподобного β сэндвича, в котором три цепи
сервативного мотива IXI С конца в одном диме
(β3-β9-β8) расположены антипараллельно ос
ре с гидрофобными карманами (цепи β4 и β8)
тальным четырём β цепям (β4-β5-β6-β7), со
другого димера [32, 39]. Гексамеры связываются
единённым короткой петлёй [13, 32]. С по
в мультимеры более высокого порядка посред
мощью биохимических методов было показано,
ством различных взаимодействий с участием
что экспрессия ACD αA или αB кристаллинов
NTD [35, 39]. Эта модель согласуется со струк
приводит к образованию димеров и потере вы
турными данными. Однако предстоит ещё со
сокомолекулярных олигомеров [13, 32]. Домен
гласовать полидисперсность, которая часто упо
NTD у αA и αB кристаллинов образован
минается в случае αB кристаллина, с существо
~65 а.о., обогащён гидрофобными а.о. и неупо
ванием симметричного 24 мера.
рядочен. Усечение NTD или делеция консерва
В хрусталике человека αA кристаллин суще
тивных мотивов SRLFDQFFG и FLRAPSWF
ствует как в окисленной, так и в восстановлен
оказывали влияние на сборку олигомеров αB
ной форме благодаря наличию двух остатков
кристаллина, приводя к превращению димеров
цистеина. Kaiser et al. [40] исследовали структуру
в гексамеры или меньшие олигомеры [33, 34].
олигомеров αA кристаллина в окисленном и
Исследования с использованием ЯМР твёрдого
восстановленном состояниях, использовав на
тела позволили понять структуру N концевого
бор различных методов, таких как крио EM, пе
участка. Было показано, что он содержит две ко
рекрёстные сшивки/масс спектрометрия, ЯМР
роткие α спирали (а.о. 14-17 и 27-31) и двухце
спектроскопия, молекулярное моделирование.
почечную антипараллельную β складчатую
Они показали, что олигомеры αA кристаллина
структуру (а.о. 48-50 и 61-63), соединённые
в основном существуют в виде 12 , 16 и 20 мер
длинной петлёй [35]. Домен CTE в αA и αB
ных структур, которые можно преобразовать
кристаллинах содержит примерно 20 а.о. и явля
друг в друга путём добавления или вычитания
ется гибким и полярным участком. Он содержит
тетрамеров. Процесс сборки происходит через
высококонсервативный мотив IXI, который об
образование тетрамеров, в которых два димера
легчает образование олигомеров, действуя как
β7 интерфейса связываются друг с другом через
«якорная точка», тем самым способствуя поли
N концевые фрагменты. Тетрамерные звенья
дисперсности α кристаллина [13]. Несколько
связываются далее через N концевые взаимо
исследований показали, что делеция домена
действия с образованием ансамблей более высо
CTE из αA и αB кристаллинов влияет на чет
кого порядка. Усиленная динамика домена CTE
вертичную структуру и распределение олигоме
приводит к обмену доменами между димерами и
ров. Делеции или мутации в CTE αB кристал
определяет гетерогенность олигомеров. Хотя
лине уменьшают размер олигомеров и влияют
αA и αB кристаллины обладают высокой гомо
на солюбилизацию субстратов [36, 37]. По
логией и сходной длиной последовательности,
скольку было показано, что потеря шаперонной
они образуют разные олигомерные сборки, ис
активности ассоциирована с патологиями, нами
пользуя сходный тип взаимодействий. Димери
была предпринята попытка увеличить его ак
зация происходит с участием β7 интерфейса, в
тивность, руководствуясь нашим наблюдением,
то время как олигомеризация опосредована N
что она может активироваться температурно за
концевыми взаимодействиями и связыванием
висимыми структурными возмущениями. Нами
IXI с близлежащим промотором. Однако CTE
получены генно инженерные химерные белки
αB кристаллина участвует в формировании гек
со значительно более высокой шаперонной ак
самерных частиц, тогда как CTE αA кристалли
тивностью, что свидетельствует о том, что
на участвует в сборке олигомеров более высоко
структурная организация и шаперонная актив
го порядка в трёхмерной форме с обменом доме
БИОХИМИЯ том 87 вып. 3 2022
7*
404
BUDNAR и др.
нов. Следовательно, N концевые взаимодей
дят к недисульфидной ковалентной сшивке и
ствия важны для образования олигомеров αA
олигомеризации [48, 49]. Воздействие УФ излу
кристаллина [40].
чения вызывает существенные изменения вто
ричной и третичной структуры и нарушает ша
пероноподобную активность α кристалли
ВОЗРАСТНЫЕ МОДИФИКАЦИИ
на [50].
α КРИСТАЛЛИНА И КАТАРАКТА
Окисление является одной из наиболее час
тых причин посттрансляционной модифика
Кристаллины, включая α кристаллин, явля
ции, наблюдаемой в хрусталике, где оно обычно
ются долгоживущими белками хрусталика и по
влияет на остатки метионина, триптофана, ти
этому подвержены возрастным модификациям.
розина, цистеина и гистидина в α кристалли
Эпидемиологические исследования показали,
не (табл. 1). При воздействии УФ излучения в
что экологические и профессиональные факто
хрусталике глаза быка окислению подверглись
ры повышают риск возникновения возрастных
остатки M1 и M168 в αA кристаллине и остатки
катаракт [41]. В большом числе исследований
M1, W9, W60 и M68 - в αB кристаллине [48].
было показано, что нерастворимая в воде фрак
В исследованиях in vitro было показано, что
ция увеличивается в хрусталике с возрастом и
окисление αA и αB кристаллинов вызывает
при развитии катаракты [42, 43]. В αA и αB
значительные изменения их вторичной и чет
кристаллинах из хрусталиков пожилых людей и
вертичной структур и образование низкомоле
при наличии катаракты были обнаружены мно
кулярных частиц, не обладающих шаперонной
гочисленные посттрансляционные модифика
активностью [51].
ции, такие как деамидирование, окисление,
Деамидирование представляет собой другой
ацетидирование, метилирование, изомериза
типичный пример посттрансляционной моди
ция, карбамоилирование и фосфорилирова
фикации, которая чаще наблюдается в нераст
ние (табл. 1).
воримой в воде фракции нормального хрустали
УФ облучение способствует развитию воз
ка и хрусталика при катаракте. Деамидирование
растной катаракты [47]. Хрусталик имеет УФ
превращает амид в боковой цепи остатков аспа
фильтры на основе триптофана, такие как кину
рагина и глутамина в остаток карбоновой кис
ренин, 3 гидроксикинуренин и глюкозид 3 гид
лоты и внедряет отрицательный заряд в молеку
роксикинуренин, которые поглощают УФ излу
лу белка, тем самым дестабилизируя его струк
чение. Однако УФ индуцированное фотовоз
туру. Масс спектрометрические исследования
буждение приводит к образованию свободных
показали, что деамидирование происходит в ос
радикалов и активных форм кислорода, которые
татках Q6, Q50, Q90, N101, Q104, N123 и Q147 в
окисляют метиониновые, триптофановые и
αA кристаллине и остатках N78, Q108, N146 - в
цистеиновые остатки α кристаллина и приво
αB кристаллине (табл. 1). Было обнаружено,
Таблица 1. Посттрансляционные/возрастные изменения в α кристаллинах
Посттрансляционная модификация
Затронутые аминокислотные остатки
Ссылки
Деамидирование
Q6, Q50, Q90, N101, Q104, N123, Q147 в αA кристаллине;
[44, 45]
N78, Q108, N146 в αB кристаллине
Окисление
M1, W9, Y18, Y34, M138, C142 в αA кристаллине;
[44, 45]
M1, H7, W9, Y48, W60, M68 в αB кристаллине
Ацетилирование
M1, K70, K78, K88, K145 в αA кристаллине;
[44, 45]
M1, K92 в αB кристаллине
Метилирование
R21, K88 в αA кристаллине
[44, 45]
R22, R50 в αB кристаллине
Изомеризация/эпимеризация
S20, D58, S59, S62, D151, S162 в αA кристаллине;
[45]
S19, S21, S53, S59, D62, S85, D109 в αB кристаллине
Фосфорилирование
T13, S45, S122, T140 в αA кристаллине;
[44, 45]
S19, S21, S43, S45, S53, S59, S76 в αB кристаллине
Карбамоилирование
K92 в αB кристаллине
[45, 46]
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
405
что α кристаллин хрусталика при катаракте
гиперфосфорилирование по двум остаткам (S45
сильно деамидирован по сравнению с белками
и S59) увеличивает его долю в нерастворимой
нормального хрусталика. Влияние возрастного
фракции [58]. Мутантная форма αB кристалли
деамидирования на структурно функциональ
на R120G подвергается гиперфосфорилирова
ные свойства α кристаллина изучали с исполь
нию и переходит в нерастворимые фрак
зованием различных имитирующих дезамиди
ции [61, 62]. Более раннее исследование в нашей
рование мутантов αA кристаллина (N101D,
лаборатории с использованием мутантов, ими
N123D и N101D/N123D) и αB кристаллина
тирующих фосфорилирование, показало, что
(N78D, N146D и N78D/N146D) [52]. Мутант
гиперфосфорилирование αB кристаллина R120G
ные формы αA кристаллина показали изменён
(S19D/S45D/S59D R120G αB кристаллин или
ную вторичную структуру и микроокружение;
3D R120G αB кристаллин) увеличивает его
гомомеры с дезамидированием по остатку N123
склонность к агрегации [58].
показали значительное снижение шаперонной
Другой часто наблюдаемой посттрансляци
активности [52, 53]. Деамидирование остат
онной модификацией в стареющих хрусталиках
ка N146 повлияло на структуру и функции αB
является рацемизация/изомеризация, при ко
кристаллина [54].
торой L формы серина и аспарагиновой кисло
Другой посттрансляционной модификаци
ты переходят в их D формы. В табл. 1 перечис
ей, которая возникает при старении хрусталика
лены аминокислотные остатки, повергающиеся
и при катаракте, является фосфорилирование
изомеризации в αA и αB кристаллинах. αA
α кристаллина (табл. 1). Исследования α крис
Кристаллин более подвержен изомеризации,
таллина хрусталика человека и его модифика
чем αB кристаллин, из за высокого содержа
ций с возрастом и при развитии катаракты с по
ния остатков аспарагиновой кислоты [63]. При
мощью метода MALDI MS выявили повышен
старении в αA кристаллине подвергаются изо
ное количество фосфорилированного αB крис
меризации остатки D58 и S59/62, и их D изо
таллина в кортикальных участках хрусталика
форма чаще встречается в хрусталиках с ката
пожилых людей [55]. Протеомный анализ хрус
рактой, чем в нормальных хрусталиках [64, 65].
талика при врождённой катаракте показал, что
Изомеризация вызывает изменения структуры
фосфорилирование αA кристаллина происхо
α кристаллина. Так, изомеризация остатков
дит по остаткам T13, S45, S122 и T140, а αB
D58, D84 и D151 αA кристаллина, наблюдае
кристаллина - по остаткам S19, S21, S43, S45,
мая в состарившемся хрусталике, приводит к
S53, S59 и S76 [56]. Фосфопротеомная характе
нарушению его гетерополимерной структуры
ристика нормального хрусталика и хрусталика
высокого порядка и снижению растворимости
при катаракте и последующий количественный
белка, что в конечном итоге вызывает развитие
анализ выявил более высокие уровни фосфори
катаракты [64]. В αB кристаллине изомериза
лирования α кристаллина (T153 - в αA крис
ция остатка D109 разрушает важный для белка
таллине и S19, S76 - в αB кристаллине) в хрус
солевой мостик с остатком R120 на поверхнос
талике при катаракте [57]. Фосфорилирование
ти димера, что приводит к аберрантной олиго
αB кристаллина с возрастом усиливается. Ему
меризации. Остатки S59 и D62 участвуют в обра
также способствуют стресс и болезни [58]. В ря
зовании интерфейса, образуя кластер солевого
де работ было проведено определение уровня
мостика с R163 и E165 соседнего мономера [66].
фосфорилирования αB кристаллина. Уровень
Изомеризация остатка D62 влияет на фосфори
фосфорилирования αB кристаллина в культи
лирование остатка S59, тем самым нарушая
вированных тканях хрусталика крыс составил
формирование солевого мостика и разрушая
~0,25 моль фосфата на моль белка [59]. Уровень
поверхность раздела, что изменяет динамику
фосфорилирования αB кристаллина в хруста
олигомеризации [66]. Эпимеризация остат
лике быка в первые три года жизни увеличивал
ка S162 существенно ослабляет межсубъеди
ся до 0,25 моль фосфата на моль белка и далее
ничное связывание [66]. При диабете гипергли
оставался без изменений [59, 60]. αA Кристал
кемия способствует протеканию нефермента
лин, напротив, может фосфорилироваться до
тивных реакций, таких как гликирование и
уровня 0,5 моль фосфата на моль белка [59, 60].
окисление, что приводит к образованию конеч
Обычно фосфорилирование αB кристаллина
ных продуктов гликирования (AGE) и ускоряет
происходит по остаткам S19, S45 и S59. Фосфо
реакции Майяра в кристаллинах хрусталика,
рилирование αB кристаллина может быть как
приводя к развитию возрастной катарак
полезным, так и вредным в зависимости от его
ты [67, 68].
уровня. Фосфорилирование лишь одного остат
Исследования хрусталиков быка и крысы
ка (это либо S45, либо S59) увеличивает шапе
in vitro показали, что гликирование по остаткам
ронную активность этого белка, в то время как
лизина повышает восприимчивость кристалли
БИОХИМИЯ том 87 вып. 3 2022
406
BUDNAR и др.
нов к сульфгидрильному окислению и приводит
карбамоилирование остатков лизина (табл. 1).
к образованию высокомолекулярных агрегатов
В хрусталике человека ацетилирование проис
с дисульфидными поперечными связями [69].
ходит по остаткам K70 и K99 в αA кристаллине
Хотя гликирование не вызывает заметных изме
и K92 и K166 - в αB кристаллине [44]. Опреде
нений структуры α кристаллина, тем не менее
ление шаперонной активности мутантной фор
оно способствует значительному снижению его
мы K70Q α кристаллина, имитирующей ацети
шаперонной активности [70]. Усечение белка
лированную форму белка, выявило изменения
является одним из наиболее распространённых
структуры белка и различную шаперонную ак
в хрусталиках видов модификации, когда удале
тивность этого белка в зависимости от белка
ние части аминокислотной последовательности
клиента [79]. Было обнаружено, что карбамои
как с N , так и с C концов приводит к образова
лирование белков хрусталика, которое считает
нию нескольких пептидных фрагментов. Моди
ся возрастным процессом, повышено в ядре
фикации, такие как деамидирование и изомери
хрусталика по сравнению с областью коры [71].
зация, увеличивают вероятность усечения бел
При катаракте наблюдалось карбамоилирова
ковой молекулы. α Кристаллины подвергаются
ние остатка K92 в αB кристаллине [46].
нескольким усечениям в основном на C конце:
С процессом агрегации белков, происходя
участки усечения включают остатки S172, S162,
щим во время развития катаракты, ассоцииро
N101, D58 и L40 в αA кристаллине и K174,
ваны белок белковые перекрёстные сшивки.
T170, T40 и E34 - в αB кристаллине (см. [43, 55]
Усечение и посттрансляционные модификации,
и обзор [71]). Было обнаружено, что в состарив
такие как окисление, деамидирование, и изоме
шихся хрусталиках N концевой участок αA
ризация, запускают процесс белок белковых пе
кристаллина укорочен на 3 остатка, в то время
рекрёстных сшивок кристаллинов, в основе ко
как N концевой участок αB кристаллина может
торых лежат различные механизмы (через де
быть укорочен на 1 или 6 остатков [72]. В нашей
гидроаланин (DHA), промежуточное образова
лаборатории при сотрудничестве с группой
ние сукцинимида аспарагина и усечение или C
Garland в хрусталике человека с катарактой вы
концевой промежуточный продукт янтарного
явили усечённую форму αB кристаллина, у ко
ангидрида) [71]. Протеомные исследования по
торой отсутствовал C концевой остаток лизи
казали, что α кристаллин подвергается белок
на [73]. Эта укороченная форма, обозначаемая
белковому сшиванию, которое включает реак
как αBg, обладала более кислыми свойствами и
цию остатков лизина неферментативно усечён
мигрировала немного ниже, чем полноразмер
ного белка с С концевыми остатками аспарта
ный белок в SDS PAGE. Количество αBg варьи
та [71, 80]. Этот двухфазный механизм включает
ровало от 10 до 90% от общего количества αB
в себя два спонтанных события - расщепление
кристаллина. Исследования in vitro показали,
белка и перекрёстное сшивание. Расщепление
что шаперонная активность αBg была сравнима
белка может происходить при pH 5-7,4 и вклю
с активностью нормального αB кристалли
чает отщепление пептида на C концевой сторо
на [73]. Удаление C концевых остатков в реком
не остатка аспарагиновой кислоты, который за
бинантном укороченном (151 а.о.) αA кристал
тем подвергается спонтанной циклизации с об
лине влияло на его олигомеризацию и обмен
разованием C концевого промежуточного про
субъединицами [44]. Мутантные формы αA и
дукта в виде ангидрида аспартата. Следующим
αB кристаллинов, у которых на C конце были
этапом является сшивание, когда С концевой
удалены 16 а.о., демонстрировали пониженную
промежуточный ангидрид Asp реагирует либо с
шаперонную активность [74]. Усечение α крис
водой с образованием аспартата, либо с нуклео
таллина также приводит к образованию низко
филом, таким как ε аминогруппа лизина или N
молекулярных пептидов, которые обнаружива
концевая аминогруппа, с образованием ковалент
ются в состарившихся хрусталиках человека и
ной белок белковой перекрёстной сшивки [80].
ассоциируются с помутнением хрусталика и ка
Протеомный анализ хрусталика при катаракте
тарактой [75, 76]. Было показано, что пептид
позволил выявить различные перекрёстные
αA66 80 из αA кристаллина связывается с рас
сшивки в αA кристаллине, αB кристаллине,
творимым α кристаллином, ослабляет его ша
γC/D кристаллине и γS кристаллине. Были
перонную активность и вызывает его агрега
идентифицированы следующие перекрёстные
цию [77]. Пептид αA66 80 также образовывал
сшивки: αA кристаллин К78-αA кристал
амилоидные фибриллы, способствовал появле
лин D58, αA кристаллин D151-αB кристал
нию перекиси водорода и индуцировал апоптоз
лин K82, αA кристаллин D151-αB кристал
клеток [78].
лин K150, αB кристаллин D129-αB кристал
Среди других видов модификации α крис
лин K82, αB кристаллин D129-αB кристал
таллина следует отметить ацетилирование и
лин K90, αB кристаллин D129-αB кристал
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
407
лин K121, αA кристаллин D151-γC/γD крис
МУТАЦИИ α КРИСТАЛЛИНА И КАТАРАКТА
таллин G2 [71, 80]. Большинство сшивок пред
ставляли амидные связи между боковой цепью
Мутации в αA и αB кристаллинах могут
лизина пептида и C концевым остатком аспара
приводить к развитию аутосомальных врождён
гиновой кислоты другого пептида. Интересно,
ных катаракт различного фенотипа (табл. 2 и 3).
что перекрёстная сшивка αA кристаллин
Связанные с катарактой мутации α кристаллина
D151-γC/γD кристаллин G2 включала амид
могут быть миссенс мутациями, сдвигом рамки
ную связь, образованную N концевой группой
считывания или нонсенс мутациями. Большин
γC/D кристаллина с C концевым аспарта
ство этих мутаций являются аутосомально до
том (D151) αA кристаллина [71, 80].
минантными и вызывают врождённые катарак
Таким образом, при старении белки хруста
ты, тогда как некоторые мутации являются ре
лика, в том числе α кристаллин, претерпевают
цессивными (табл. 2 и 3). Первой зарегистриро
множественные ковалентные модификации,
ванной мутацией α кристаллина, вызывающей
усечения и сшивки. Эти модификации могут
развитие катаракты, была одиночная миссенс
происходить одновременно или независимо
мутация R116C αA кристаллина, которая инду
друг от друга, и они могут влиять на структуру,
цировала развитие аутосомально доминантной
олигомеризацию и шаперонную функцию α
катаракты [81]. Vicart et al. сообщил о втором
кристаллина, вызывая снижение растворимости
случае, в котором катаракта и десмин ассоци
и усиливая агрегацию белка, и делая хрусталик
ированная миопатия были вызваны миссенс му
склонным к развитию возрастной катаракты.
тацией R120G в αB кристаллине (табл. 3).
Таблица 2. Мутации αA кристаллина, вызывающие катаракту (CRYAA)
Домен
Мутация
Болезнь
Морфология катаракты
Ссылки
NTD
W9X
CC (AR)
ядерная
[82]
R12C
CC (AD)
задняя, полярная, ядерная и пластинчатая
[83, 84]
R12L
CC(AD)
ядерная
[85]
R21L
CC (AD)
центральная задняя
[83, 86]
R21W
CC (AD)
пластинчатая ядерная, полярная, передняя полярная
[83, 84, 87]
R21Q
CC (AD)
пластинчатая
[88]
R49C
CC (AD)
ядерная, пластинчатая
[89]
R54C
CC (AR/AD)
полная, ядерная
[84, 90]
R54P
CC (AD)
помутнение Y образного шва с вовлечением ядра
[91]
R54L
CC (AD)
ядерная
[92]
R65Q
ARC
неизвестно
[93]
F71L
ARC (AR)
неизвестно
[94]
G98R
PC (AD)
периферическая, кольцевидное помутнение
[95]
ACD
R116C
CC (AD)
поясничная центральная ядерная, ядерная
[81, 96, 97]
R116H
CC (AD)
точечная, ядерная, полная
[83, 98, 99]
p.116_118del
CC (AD)
неизвестно
[100]
R117H/Y118del
CC (AD)
неизвестно
[101]
R117del
CC (AD)
неизвестно
[102]
R119H
ARC
неизвестно
[93]
CTE
A152del
CC
неизвестно
[103]
Примечание. Принятые сокращения: NTD - N концевой домен; ACD - α кристаллиновый домен; CTE - С концевое
удлинение; CC - врождённая катаракта; ARC - возрастная катаракта; PC - пресенильная (ранняя) катаракта (AD -
аутосомально доминантная; AR - аутосомально рецессивная).
БИОХИМИЯ том 87 вып. 3 2022
408
BUDNAR и др.
Таблица 3. Мутации αB кристаллина, вызывающие заболевания (CRYAB)
Домен
Мутация
Болезнь
Морфология катаракты
Ссылки
NTD
R11H
CC (AD)
ядерная
[104]
R11C
CC (AR)
ядерная
[105]
R12C
CC (AR)
ядерная
[105]
P20S
CC (AD)
задняя полярная
[106]
P20R
CC (AD)
задняя полярная
[107]
60delC (S21AfsX24)
MFM (AR)
неприменимо
[108]
R56W
CC (AR)
плотная полная белая
[109]
ACD
R69C
CC (AD)
неизвестно
[101]
D109A
CC, MFM(AD)
неизвестно
[110]
D109G
AxM/RCM (AD)
неизвестно
[111]
D109H
CC, MFM (AD)
задняя полярная
[112]
R120G
DRM, CC (AD)
неизвестно
[113]
D140N
CC (AD)
пластинчатая
[114]
CTE
Q151X
MFM (AD)
неприменимо
[115]
G154S
DM
неприменимо
[116]
R157H
DCM (AD)
неприменимо
[117]
A171T
CC (AD)
пластинчатая
[84]
450delA (K150NfsX35)
CC (AD)
задняя полярная
[118]
464delCT (P155Rfs9)
MFM (AD)
неприменимо
[115]
343delT (S115fs129X)
MFM (AR; infantile onset)
неприменимо
[119]
514delG (Ala172ProfsTer14)
CC, MFM (AD)
неприменимо
[120]
X176Wfs19
DCM, CC (AD)
неизвестно
[121]
X176Yfs19
CC (AD)
задняя полярная
[122]
Примечание. Принятые сокращения: ACD - α кристаллиновый домен; AxM/DM/MFM, axial/distal/myofibrillar myopa
thy - аксиальная/дистальная/миофибриллярная миопатия; CTE - С концевое удлинение; CC - врождённая катаракта;
DCM - дилатационная кардиомиопатия; DRM - миопатия, ассоциированная с десмином; NTD - N концевой домен;
RCM - рестриктивная кардиомиопатия (AD - аутосомально доминантная; AR - аутосомально рецессивная).
Большинство мутаций в домене NTD αA
зует более мелкие олигомеры, тогда как мутан
кристаллина, вызывающих катаракту, являются
ты P20S и R56W образуют более крупные олиго
доминантными миссенс мутациями консерва
меры, чем олигомеры, генерируемые αB крис
тивного остатка аргинина. Одна нонсенс мута
таллином дикого типа. Мутант P20S показал
ция (W9X) вызывает появление укороченной
более низкую термостабильность, чем белок
формы αA кристаллина, дающей начало рецес
дикого типа. Мутанты P20S и R56W проявляли
сивной врождённой катаракте (табл. 2). Анало
более низкую шаперонную активность, чем αB
гично, мутации в домене NTD αB кристаллина
кристаллин дикого типа, при тестировании
также являются миссенс мутациями консерва
против УФ облученного βL кристаллина, ис
тивных остатков аргинина (R11H, R12C, R56W)
пользуемого в качестве субстрата [123]. В αA и
и пролина (P20R), что приводит к доминантной
αB кристаллинах домен ACD участвует в про
или рецессивной врождённым катарактам. Био
цессе образования димера. Этот домен состоит
физические исследования мутаций в N конце
из консервативных аминокислотных остатков,
вых участках, вызывающих катаракту (R11H,
образующих β сэндвич домен. Мутации, вызы
P20S R56W), показали, что мутант R11H обра
вающие катаракту в ACD αA кристаллина, за
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
409
трагивают консервативные остатки глицина и
ного домена типа β сэндвич [112, 130]. Анало
аргинина (G98R и R116C соответственно;
гичным образом, остаток D140, располагаю
табл. 2). Рекомбинантный αA кристаллин с му
щийся на шпилечной петле, соединяющей
тацией R116C демонстрирует структурные из
β8-β9, образует солевой мостик с остат
менения, приводящие к увеличению полидис
ком H83, расположенным на дуге β3/β4 в β
персности и снижению обмена субъединиц и
сэндвич домене
[114,
130]. Следовательно,
активности шаперонов
[124,
125]. Мута
можно было ожидать, что все три мутации по
ция G98R в αA кристаллине вызывает пресе
влияют на ионно парные взаимодействия, про
нильную (раннюю) катаракту с дебютом в воз
исходящие в петле и дуге и связанные с формой
расте ~18 лет [95]. Исследования, проведённые
расширенного нижнего листа димера.
в нашей лаборатории, показали, что му
C Концевой участок α кристаллина важен
тант G98R претерпевает нарушение фолдинга, в
для гибкости белковой молекулы и её раствори
результате чего происходит образование телец
мости. Доминантные мутации G154S и R157H в
включения [126]. При солюбилизации и рефол
этом участке вызывают лёгкую кардиомиопа
динге мутантный белок демонстрировал изме
тию без развития катаракты, тогда как мута
нения вторичной, третичной и четвертичной
ция A171T вызывает врождённую пластинчатую
структур и образовывал более крупные олиго
катаракту (табл. 3). Исследование мутантных по
меры, лишённые шаперонной активнос
C концу форм (G154S, R157H и A171T) показа
ти [126]. Мутации в αB кристаллине, ассоци
ло, что мутантная форма R157H образует более
ированные с развитием катаракты и/или мио
мелкие олигомеры, чем αB кристаллин дикого
патии, происходят в домене ACD, затрагивая
типа. Мутанты проявляли более низкую термо
остатков аргинина и аспарагиновой кислоты
стабильность и образовывали агрегаты при бо
(R69C, D109H, R120G и D140N; табл. 3). Био
лее низкой температуре, чем белок дикого типа.
физические и биохимические исследования му
Они также различались по образованию гетеро
тантной формы R120G αВ кристаллина выяви
олигомерных комплексов с HspB4 и HspB6. Ша
ли изменения во вторичной и четвертичной
перонная активность мутантных форм G154S
структурах этого белка и пониженную шапе
и A171T была ниже, чем αB кристаллина дико
ронную активность [125, 127]. Мутантная фор
го типа [131]. Однако нонсенс мутация A152del
ма R120G αB кристаллина аномально взаимо
в αA кристаллине [103] и мутации со сдвигом
действовала с компонентами клетки (напри
рамки считывания Ala172ProfsTer14, X176Wfs19
мер, с десмином), в результате чего происходи
и X176Yfs19 в αB кристаллине [121, 122] оказа
ло образование белковых агрегатов, токсичных
лись связаны с аутосомально доминантными
для клетки
[128]. Изучение мутантных
врождёнными катарактами. Недавно была
форм R69C и D109H выявило изменения в их
идентифицирована новая доминантная мутация
структуре (вторичной, третичной и четвертич
со сдвигом рамки считывания - c.514delG
ной), повышенную склонность к амилоидоге
(p.Ala172ProfsTer14), которая вызывает мульти
незу и снижение шапероноподобной активнос
системное заболевание, характеризующееся
ти [129]. Мутация D140N оказывала влияние на
врождёнными катарактами, гипотонией, мио
третичную/четвертичную структуру αB крис
патией, нарушением дыхания и дисфаги
таллина, что приводило к более крупным агре
ей [120]. Эта новая мутация приводит к сдвигу
гатам и снижению термостабильности [114].
рамки считывания в позиции Ala172, приводя к
Мутант D140N лишён шапероноподобной ак
добавлению 12 новых а.о. и удлинению молеку
тивности и ингибирует шаперонную функцию
лы белка до 184 а.о. Биоинформационный ана
αB кристаллина дикого типа, проявляя себя
лиз показал повышенную гидрофобность и сни
как доминантно негативный мутант
[114].
жение гибкости С концевого домена мутантно
Аминокислотные остатки D109, R120 и D140
го белка, что в конечном итоге влияет на его
являются высококонсервативными и образуют
растворимость и шаперонную активность [120].
ключевую структуру домена типа β сэндвич:
Мутация p.X176Y приводит к потере стоп кодо
поверхность димера образует основу общей бо
на, приводя к добавлению 19 а.о. к αB кристал
роздки с остатками R120, присутствующими на
лину дикого типа [122]. Биоинформатический
обоих концах, взаимодействующими с D109 с
анализ предсказал, что добавление 19 а.о. вызы
образованием солевого мостика, который по
вает образование новых вторичных структур (α
могает для создания общей интерфейсной бо
спираль и случайный клубок) и образует удли
роздки в αB кристаллине [130]. Доминантные
нённую цепь в третичной структуре, что делает
мутации, такие как R120G или D109G, разру
мутантный белок патогенным для клетки из за
шают этот солевой мостик, тем самым нарушая
повышения его гидрофобности и снижения его
структуру бороздки и конформацию расширен
стабильности [122].
БИОХИМИЯ том 87 вып. 3 2022
410
BUDNAR и др.
МУТАЦИИ α КРИСТАЛЛИНА
что мутантные формы D109H, R120G, D140N
И ИХ ВЛИЯНИЕ НА АГРЕГАЦИЮ БЕЛКА
и R157H образуют больше агрегатов, чем другие
мутантные белки [135]. Однако следует отме
Большинство мутаций α кристаллинов,
тить, что для мечения мутантных белков авторы
представленных в табл. 2 и 3, являются аутосом
использовали в своей работе жёлтый флуоресцент
но доминантными негативными мутациями.
ный белок (YFP). Поэтому нельзя исключить,
Мутации α кристаллинов могут индуцировать
что этот флуоресцентный белок, слитый с мутант
разворачивание белков и образование гомо и
ным белком, мог бы влиять на его агрегацию.
гетероагрегатов, которые могут быть токсичны
В различных экспериментах in vitro, ex vivo или
ми для клетки. Различные мутантные формы
in vivo (на трансгенных мышах) была показана
αA и αB кристаллинов при экспрессии в бак
агрегация и образование телец включения мутант
териях/клетках образуют агрегаты/тельца вклю
ной формой R120G αB кристаллина, взаимо
чения (табл. 4).
действующей с десмином [128, 137, 146].
Как показано в табл. 4, различные ассоци
Существует два типа агрегации белка -
ированные с катарактой мутантные формы αA
аморфная и хорошо упорядоченная амилоидно
кристаллина образуют тельца включения/агре
фибриллярная агрегация. Как было отмечено
гаты. Отдельные мутантные формы αA крис
выше, амилоидные агрегаты были обнаружены
таллинов (например, R49C и R54C) образуют
в хрусталике глаза при катаракте. В исследова
агрегаты в ядре. Исследования на мышиной мо
ниях in vitro было показано, что кристаллины,
дели с нокаутом показали, что мутация R49C
включая α кристаллин, образуют амилоидные
приводит к снижению растворимости и повы
агрегаты в денатурирующих условиях [147]. Воз
шению гидрофобности белка. Мутантный белок
никает вопрос о том, могут ли при катаракте,
агрегирует с образованием катаракты, вероятно,
кроме аморфной агрегации, также образовы
за счёт повышенной гидрофобности и связыва
ваться амилоиды? При агрегации белков
ния с β и γ кристаллинами [141].
действительно наблюдается конкуренция между
Различные исследования, включая наши не
аморфной и упорядоченной амилоидной агрега
давние результаты, показывают, что в мутантной
цией [148]. Изучение катаракт у мышей показа
форме R54C наблюдаются лишь небольшие
ло, что рекомбинантный мышиный мутантный
структурные изменения, и её шаперонная ак
белок γBnop (усечённый белок, образованный в
тивность сравнима с активностью белка дикого
результате делеции 11 п.н. в третьем экзоне в по
типа [133, 142]. Мы обнаружили, что, в отличие
зиции Ser138 и последующей вставки 4 п.н.) об
от диффузной локализации αA кристаллина ди
разовывал амилоидные фибриллы in vitro (в от
кого типа в цитоплазме клеток эпителия хруста
личие от белка дикого типа) [149]. Анализ хрус
лика SRA01/04, мутантная форма R54C αA
таликов методом 2D инфракрасной спектро
кристаллина образует спеклы в цитоплазме и в
скопии (2DIR) выявил амилоидные β складча
ядре. Она также сильнее связывалась с нуклео
тые структуры в хрусталиках свиньи, облучён
сомными гистонами, чем белок дикого типа, и
ных УФ излучением [7]. Аналогичные исследо
вызывала стрессоподобный ответ и апоптоз
вания хрусталиков человека при катаракте и без
[133]. Изучение вызывающих врождённую ката
неё выявили присутствие амилоидной β склад
ракту мутаций остатка R54 (R54C, R54L, R54P)
чатой вторичной структуры в зрелых хрустали
показало, что эти замены приводят к структур
ках и при катаракте, в то время как в хрустали
ным изменениям, понижают термостабильность
ках несовершеннолетних амилоидная структура
белка, снижают шаперонную активность и по
отсутствовала [8]. Мутантная форма R120G αB
вышают склонности к амилоидогенезу [143].
кристаллина in vitro образует амилоидные фиб
Ранее нами было показано, что мутантная
риллы более высокого порядка, чем белок дико
форма G98R αA кристаллина, при её экспрессии
го типа [150]. Недавнее исследование с исполь
в бактериальных клетках, образует агрегаты и
зованием 2DIR спектроскопии показало нали
тельца включения [126]. Она также проявляет из
чие амилоидоподобной структуры в хрусталиках
менённую шапероноподобную активность, кото
мышей с нокаутом Cryab R120G, что указывает
рая модулируется ионами Cu2+ [126, 144, 145].
на возможность образования α кристаллином
Аналогично, различные вызывающие болез
амилоидных агрегатов в условиях in vivo [9]. Бы
ни мутации αB кристаллина приводят к образо
ло показано, что антитела против амилоидных
ванию телец включения/агрегатов (табл. 4). Ис
олигомеров распознают агрегаты R120G αB
следование Raju и Abraham [135], посвящённое
кристаллина в модели трансгенных мы
изучению различных мутаций αB кристаллина,
шей [137]. Эти исследования показывают, что
вызывающих врождённую катаракту и кардио
как образование амилоида, так и аморфная аг
миопатию в клетках млекопитающих, показало,
регация могут иметь место во время развития
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
411
Таблица 4. Агрегаты, образуемые различными мутантными формами αA и αB кристаллинов
Мутантная форма
Морфология агрегатов (экспрессированы в бактериях/клеточных линиях)
Ссылки
R12L αA кристаллин
большие цитоплазматические агрегаты и агресомы (клетки HeLa)
[132]
R12C αA кристаллин
цитоплазматические агрегаты и агресомы (клетки HeLa)
[132]
R21L αA кристаллин
цитоплазматические агрегаты и агресомы (клетки HeLa)
[132]
R21W αA кристаллин
цитоплазматические агрегаты и агресомы (клетки HeLa)
[132]
R49C αA кристаллин
цитоплазматические агрегаты и агресомы (клетки HeLa)
[132]
ядерные спеклы в эпителиальных клетках хрусталика человека (HLE B3)
[89]
R54C αA кристаллин
ядерные спеклы в эпителиальных клетках хрусталика человека (HLE B3)
[132]
ядерные агрегаты в эпителиальных клетках хрусталика человека (SRA 01/04)
[133]
G98R αA кристаллин
тельца включения при экспрессии в бактериальных клетках
[126]
агрегаты в ЭР при экспрессии в эпителиальных клетках хрусталика человека (HLE B3)
[134]
R116C αA кристаллин
цитоплазматические агрегаты и агресомы (клетки HeLa)
[132]
R116H αA кристаллин
цитоплазматические агрегаты и агресомы (клетки HeLa)
[100]
p.116_118del αA кристаллин
агрегаты в ядерной периферической мембране и ядре в эпителиальных клетках
[100]
хрусталика человека (HLEpiCs)
R11H αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
P20S αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
D109G αB кристаллин
цитоплазматические агрегаты в скелетных и сердечных миоцитах
[111]
D109H αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
R120G αB кристаллин
тельца включения (агресомы) в клетках PTK2, NIH BT3 и CCL39
[136]
агрегаты агресомы в неонатальных кардиомиоцитах крысы
[137]
цитоплазматические агрегаты в кардиомиоцитах и клетках COS 7
[62]
цитоплазматические агрегаты в клетках HeLa
[135]
D140N αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
Q151X αB кристаллин
цитоплазматические агрегаты в кардиомиоцитах и клетках COS 7
[62]
цитоплазматические агрегаты в клетках MCF7
[138]
G154S αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
R157H αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
A171T αB кристаллин
цитоплазматические агрегаты в клетках HeLa
[135]
343delT αB кристаллин
тельца включения при экспрессии в бактериальных клетках
[135]
цитоплазматические агрегаты в мышечных и не мышечных клетках
[139]
450delA αB кристаллин
цитоплазматические агрегаты в клетках H9c2
[140]
464delCT αB кристаллин
цитоплазматические агрегаты в кардиомиоцитах и клетках COS 7
[62]
цитоплазматические агрегаты в клетках H9c2
[140]
цитоплазматические агрегаты в клетках MCF7
[138]
катаракты. Поэтому было бы интересно понять
Необходимы дальнейшие исследования,
механизмы агрегации α кристаллинов per se и
чтобы проанализировать механизмы агрегации
влияние вызывающих болезни мутаций на
α кристаллина, индуцированные мутациями,
склонность кристаллинов к агрегации и на ме
способствующими возникновению болезней.
ханизмы этого процесса.
Возможно, нарушение нативной структуры в
БИОХИМИЯ том 87 вып. 3 2022
412
BUDNAR и др.
Роль возрастных модификаций и мутаций α кристаллина в развитии катаракты
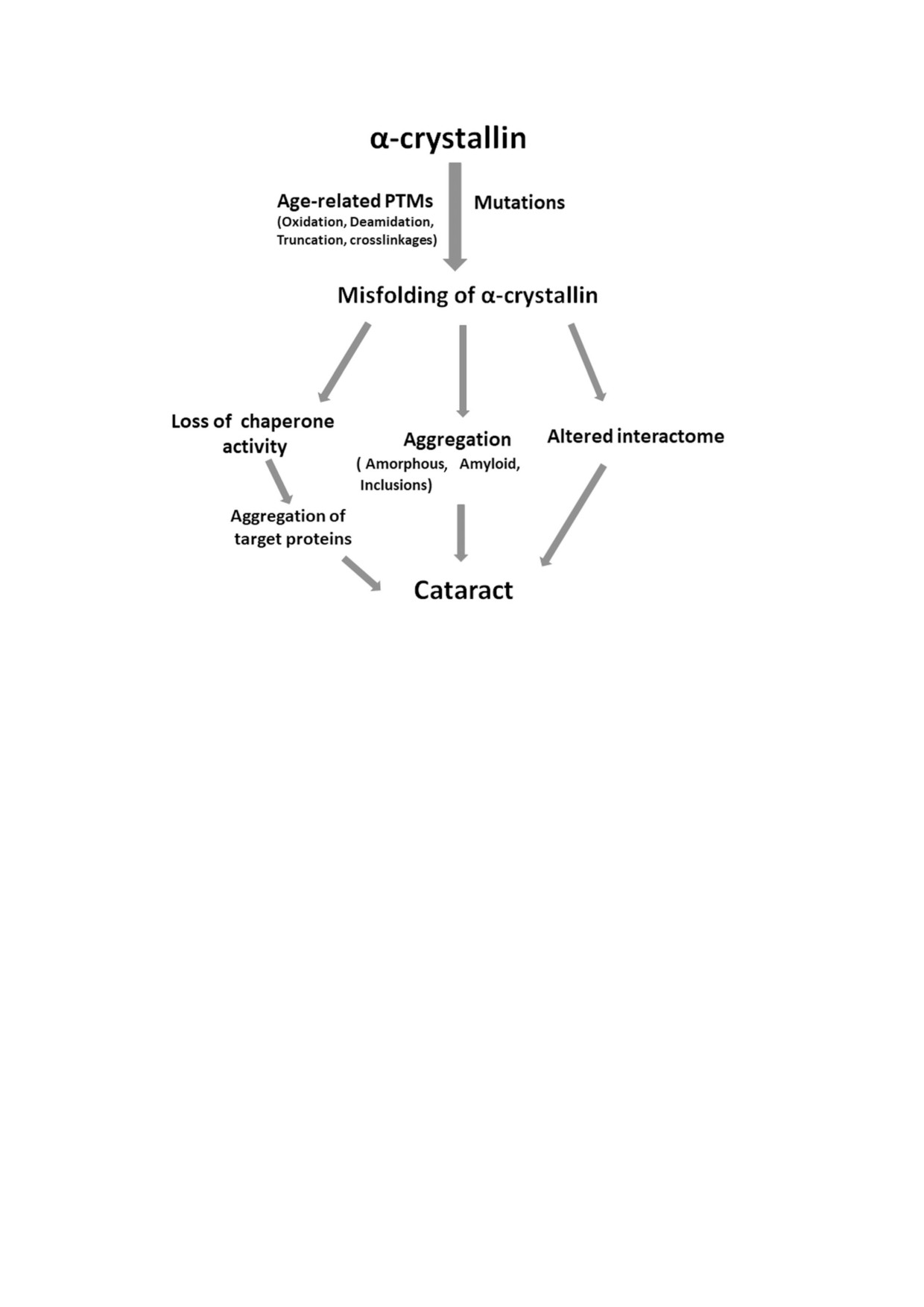
результате мутаций приводит к обнажению уже
и предотвращая их агрегацию. На рисунке пока
существующих областей, склонных к агрегации,
зано как посттрансляционные модификации и
которые в противном случае скрыты или замас
мутации могут привести к развитию катаракты.
кированы в складчатой структуре, поскольку
Различные возрастные модификации и мутации
эти области являются важными факторами,
α кристаллина или нарушают структуру этих
способствующими не только агрегации, но и не
белков, или снижают их шаперонную функцию,
адекватным взаимодействиям α кристаллина с
что приводит к агрегации белков мишеней, об
компонентами клетки. Таким образом, исследо
разованию агрегатов (амилоиды, аморфные
вания, включающие экспериментальные пере
структуры, включения) и изменению интеракто
крёстные сшивки для выявления белковых сег
ма. Эти процессы могут протекать одновремен
ментов, участвующих в межмолекулярных взаи
но или независимо друг от друга, приводя к ток
модействиях, изучение их изменений в резуль
сичности для клеток и развитию катаракты (ри
тате мутаций, выявление нативных последова
сунок). Мутации в αA кристаллине часто приво
тельностей/участков интерфейсов олигомеров и
дят к развитию врождённых катаракт. Поскольку
белковых фрагментов, образующихся в ходе
экспрессия αB кристаллина происходит повсе
процесса агрегации, будут способствовать на
местно, мутации αB кристаллина могут привес
шему пониманию механизма агрегации α крис
ти не только к катаракте, но к и другим заболева
таллина при формировании катаракты.
ниям, таким как миопатии. Поэтому разработка
стратегий предотвращения агрегации или обра
зования включений из за возрастных модифика
ЗАКЛЮЧЕНИЕ
ций или мутаций имеет значение для лечения и
профилактики катаракты и болезней, ассоци
Исследования, проведённые в последние го
ированных с агрегацией белков. Некоторые сте
ды, показали, что α кристаллин сохраняет крис
ролы показали многообещающие эффекты в ле
таллическую природу и прозрачность хрустали
чении катаракты у экспериментальных живот
ков глаза, участвуя в упаковке βγ кристаллинов
ных [151, 152]. Интересно, что пептиды, полу
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
413
ченные из шаперонных участков αA и αB крис
подходов к предотвращению возникновения
таллинов (так называемые мини шапероны)
и/или прогрессирования катаракты.
проявляют терапевтический потенциал в отно
шении катаракты и других болезней, связанных
с агрегацией белков [153]. Идентификация сег
Конфликт интересов. Авторы заявляют об от
ментов, которые участвуют в межмолекулярных
сутствии конфликта интересов.
взаимодействиях (как нативные интерфейсы
Соблюдение этических норм. Настоящая
олигомеров, так и области, опосредующие агре
статья не содержит описания каких либо иссле
гацию), и выяснение эффектов мутаций на эти
дований с участием людей или животных в каче
взаимодействия будут полезны при разработке стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Chou, C. F., Cotch, M. F., Vitale, S., Zhang, X., Klein, R.,
14.
Kappe, G., Franck, E., Verschuure, P., Boelens, W. C.,
et al. (2013) Age related eye diseases and visual impair
Leunissen, J. A., et al. (2003) The human genome encodes
ment among U.S. adults, Am. J. Prev. Med., 45, 29 35,
10 alpha crystallin related small heat shock proteins:
doi: 10.1016/j.amepre.2013.02.018.
HspB1 10, Cell Stress Chaperones,
8,
5361,
2.
Bloemendal, H., de Jong, W., Jaenicke, R., Lubsen, N. H.,
doi: 10.1379/1466 1268(2003)8<53:thgecs>2.0.co;2.
Slingsby, C., et al. (2004) Ageing and vision: structure, sta
15.
Ingolia, T. D., and Craig, E. A. (1982) Four small
bility and function of lens crystallins, Prog. Biophys. Mol.
Drosophila heat shock proteins are related to each other
Biol., 86, 407 485, doi: 10.1016/j.pbiomolbio.2003.11.012.
and to mammalian alpha crystallin, Proc. Natl. Acad. Sci.
3.
Delaye, M., and Tardieu, A. (1983) Short range order of
USA, 79, 2360 2364, doi: 10.1073/pnas.79.7.2360.
crystallin proteins accounts for eye lens transparency,
16.
Horwitz, J. (1992) Alpha crystallin can function as a mol
Nature, 302, 415 417, doi: 10.1038/302415a0.
ecular chaperone, Proc. Natl. Acad. Sci. USA, 89, 10449
4.
Benedek, G. B. (1971) Theory of transparency of the eye,
10453, doi: 10.1073/pnas.89.21.10449.
Appl. Opt., 10, 459 473, doi: 10.1364/AO.10.000459.
17.
Raman, B., and Rao, C. M. (1994) Chaperone like activi
5.
Hanson, S. R., Hasan, A., Smith, D. L., and Smith, J. B.
ty and quaternary structure of alpha crystallin, J. Biol.
(2000) The major in vivo modifications of the human
Chem., 269, 27264 27268.
water insoluble lens crystallins are disulfide bonds, deami
18.
Raman, B., Ramakrishna, T., and Rao, C. M. (1995)
dation, methionine oxidation and backbone cleavage, Exp.
Temperature dependent chaperone like activity of alpha
Eye Res., 71, 195 207, doi: 10.1006/exer.2000.0868.
crystallin, FEBS Lett., 365, 133 136, doi: 10.1016/0014
6.
Harding, J. J. (2002) Viewing molecular mechanisms of
5793(95)00440 k.
ageing through a lens, Ageing Res. Rev., 1, 465 479,
19.
Rajaraman, K., Raman, B., Ramakrishna, T., and Rao,
doi: 10.1016/s1568 1637(02)00012 0.
C. M. (1998) The chaperone like alpha crystallin forms a
7.
Zhang, T. O., Alperstein, A. M., and Zanni, M. T. (2017)
complex only with the aggregation prone molten globule
Amyloid beta sheet secondary structure identified in UV
state of alpha lactalbumin, Biochem. Biophys. Res.
induced cataracts of porcine lenses using 2D IR spec
Commun., 249, 917 921, doi: 10.1006/bbrc.1998.9242.
troscopy, J. Mol. Biol., 429, 1705 1721, doi: 10.1016/
20.
Raman, B., and Rao, C. M. (1997) Chaperone like activi
j.jmb.2017.04.014.
ty and temperature induced structural changes of alpha
8.
Alperstein, A. M., Ostrander, J. S., Zhang, T. O., and
crystallin, J. Biol. Chem., 272, 23559 23564, doi: 10.1074/
Zanni, M. T. (2019) Amyloid found in human cataracts
jbc.272.38.23559.
with two dimensional infrared spectroscopy, Proc. Natl.
21.
Datta, S. A., and Rao, C. M. (1999) Differential tempera
Acad. Sci. USA, 116, 66026607, doi: 10.1073/pnas.
ture dependent chaperone like activity of alphaA and
1821534116.
alphaB crystallin homoaggregates, J. Biol. Chem., 274,
9.
Alperstein, A. M., Molnar, K. S., Dicke, S. S., Farrell,
34773 34778, doi: 10.1074/jbc.274.49.34773.
K. M., Makley, L. N., et al. (2021) Analysis of amyloid like
22.
Rajaraman, K., Raman, B., Ramakrishna, T., and Rao,
secondary structure in the Cryab R120G knock in mouse
C. M. (2001) Interaction of human recombinant alphaA
model of hereditary cataracts by two dimensional infrared
and alphaB crystallins with early and late unfolding inter
spectroscopy, PLoS One, 16, e0257098, doi: 10.1371/journal.
mediates of citrate synthase on its thermal denaturation,
pone.0257098.
FEBS Lett.,
497,
118123, doi:
10.1016/s0014
10.
Mörner, C. T. (1894) Untersuchung der Proteїnsubstanzen
5793(01)02451 6.
in den leichtbrechenden Medien des Auges I [in German],
23.
Goenka, S., Raman, B., Ramakrishna, T., and Rao, C. M.
bchm, 18, 61 106, doi: 10.1515/bchm1.1894.18.1.61.
(2001) Unfolding and refolding of a quinone oxidoreduc
11.
Roy, D., and Spector, A. (1976) Absence of low molecu
tase: alpha crystallin, a molecular chaperone, assists its
lar weight alpha crystallin in nuclear region of old human
reactivation, Biochem. J., 359, 547 556, doi: 10.1042/
lenses, Proc. Natl. Acad. Sci. USA, 73, 34843487,
0264 6021:3590547.
doi: 10.1073/pnas.73.10.3484.
24.
Sathish, H. A., Koteiche, H. A., and McHaourab, H. S.
12.
Horwitz, J., Bova, M. P., Ding, L. L., Haley, D. A., and
(2004) Binding of destabilized betaB2 crystallin mutants to
Stewart, P. L. (1999) Lens alpha crystallin: Function and
alpha crystallin: the role of a folding intermediate, J. Biol.
structure, Eye (Lond), 13 (Pt. 3b), 403 408, doi: 10.1038/
Chem., 279, 16425 16432, doi: 10.1074/jbc.M313402200.
eye.1999.114.
25.
McHaourab, H. S., Dodson, E. K., and Koteiche, H. A.
13.
Bakthisaran, R., Tangirala, R., and Rao, Ch. M. (2015)
(2002) Mechanism of chaperone function in small heat
Small heat shock proteins: Role in cellular functions and
shock proteins. Two mode binding of the excited states of
pathology, Biochim. Biophys. Acta,
1854,
291319,
T4 lysozyme mutants by alphaA crystallin, J. Biol. Chem.,
doi: 10.1016/j.bbapap.2014.12.019.
277, 40557 40566, doi: 10.1074/jbc.M206250200.
БИОХИМИЯ том 87 вып. 3 2022
414
BUDNAR и др.
26.
Koteiche, H. A., and McHaourab, H. S.
(2003)
40.
Kaiser, C. J. O., Peters, C., Schmid, P. W. N.,
Mechanism of chaperone function in small heat shock
Stavropoulou, M., Zou, J., et al. (2019) The structure and
proteins. Phosphorylation induced activation of two mode
oxidation of the eye lens chaperone alphaA crystallin, Nat.
binding in alphaB crystallin, J. Biol. Chem., 278, 10361
Struct. Mol. Biol., 26, 1141 1150, doi: 10.1038/s41594
10367, doi: 10.1074/jbc.M211851200.
019 0332 9.
27.
Hatters, D. M., Lindner, R. A., Carver, J. A., and Howlett,
41.
McCarty, C. A., and Taylor, H. R. (2002) A review of the
G. J. (2001) The molecular chaperone, alpha crystallin,
epidemiologic evidence linking ultraviolet radiation and
inhibits amyloid formation by apolipoprotein C II, J. Biol.
cataracts, Dev. Ophthalmol., 35, 21 31, doi: 10.1159/
Chem., 276, 33755 33761, doi: 10.1074/jbc.M105285200.
000060807.
28.
Devlin, G. L., Carver, J. A., and Bottomley, S. P. (2003)
42.
Kamei, A. (1990) Characterization of water insoluble pro
The selective inhibition of serpin aggregation by the mole
teins in normal and cataractous human lens,
cular chaperone, alpha crystallin, indicates a nucleation
Jpn. J. Ophthalmol., 34, 216 224.
dependent specificity, J. Biol. Chem., 278, 48644 48650,
43.
Harrington, V., McCall, S., Huynh, S., Srivastava, K., and
doi: 10.1074/jbc.M308376200.
Srivastava, O. P. (2004) Crystallins in water soluble high
29.
Raman, B., Ban, T., Sakai, M., Pasta, S. Y.,
molecular weight protein fractions and water insoluble pro
Ramakrishna, T., et al. (2005) AlphaB crystallin, a small
tein fractions in aging and cataractous human lenses, Mol.
heat shock protein, prevents the amyloid fibril growth of
Vis., 10, 476 489.
an amyloid beta peptide and beta2 microglobulin,
44.
Sharma, K. K., and Santhoshkumar, P. (2009) Lens aging:
Biochem. J., 392, 573 581, doi: 10.1042/BJ20050339.
Effects of crystallins, Biochim. Biophys. Acta, 1790, 1095
30.
Shammas, S. L., Waudby, C. A., Wang, S., Buell, A. K.,
1108, doi: 10.1016/j.bbagen.2009.05.008.
Knowles, T. P., et al. (2011) Binding of the molecular chap
45.
Wilmarth, P. A., Tanner, S., Dasari, S., Nagalla, S. R.,
erone alphaB crystallin to Abeta amyloid fibrils inhibits
Riviere, M. A., et al. (2006) Age related changes in human
fibril
elongation, Biophys. J.,
101,
16811689,
crystallins determined from comparative analysis of post
doi: 10.1016/j.bpj.2011.07.056.
translational modifications in young and aged lens: Does
31.
Narayan, P., Meehan, S., Carver, J. A., Wilson, M. R.,
deamidation contribute to crystallin insolubility?
Dobson, C. M., et al. (2012) Amyloid beta oligomers are
J. Proteome Res., 5, 2554 2566, doi: 10.1021/pr050473a.
sequestered by both intracellular and extracellular chaper
46.
Lapko, V. N., Smith, D. L., and Smith, J. B. (2001) In vivo
ones, Biochemistry,
51,
92709276, doi:
10.1021/
carbamylation and acetylation of water soluble human lens
bi301277k.
alphaB crystallin lysine 92, Protein Sci., 10, 1130 1136,
32.
Haslbeck, M., Peschek, J., Buchner, J., and Weinkauf, S.
doi: 10.1110/ps.40901.
(2016) Structure and function of alpha crystallins:
47.
Taylor, H. R., West, S. K., Rosenthal, F. S., Munoz, B.,
Traversing from in vitro to in vivo, Biochim. Biophys. Acta,
Newland, H. S., et al. (1988) Effect of ultraviolet radiation
1860, 149 166, doi: 10.1016/j. bbagen. 2015.06.008.
on cataract formation, N. Engl. J. Med., 319, 1429 1433,
33.
Santhoshkumar, P., Murugesan, R., and Sharma, K. K.
doi: 10.1056/NEJM198812013192201.
(2009) Deletion of (54)FLRAPSWF(61) residues decreas
48.
Korlimbinis, A., Hains, P. G., Truscott, R. J., and
es the oligomeric size and enhances the chaperone function
Aquilina, J. A.
(2006)
3 Hydroxykynurenine oxidizes
of alphaB crystallin, Biochemistry,
48,
50665073,
alpha crystallin: Potential role in cataractogenesis,
doi: 10.1021/bi900085v.
Biochemistry, 45, 1852 1860, doi: 10.1021/bi051737+.
34.
Pasta, S. Y., Raman, B., Ramakrishna, T., and Rao, Ch. M.
49.
Anbaraki, A., Ghahramani, M., Muranov, K. O.,
(2003) Role of the conserved SRLFDQFFG region of
Kurganov, B. I., and Yousefi, R. (2018) Structural and
alpha crystallin, a small heat shock protein. Effect on
functional alteration of human alphaA crystallin after
oligomeric size, subunit exchange, and chaperone like
exposure to full spectrum solar radiation and preventive
activity, J. Biol. Chem., 278, 51159 51166, doi: 10.1074/
role of lens antioxidants, Int. J. Biol. Macromol., 118, 1120
jbc.M307523200.
1130, doi: 10.1016/j.ijbiomac.2018.06.136.
35.
Jehle, S., Vollmar, B. S., Bardiaux, B., Dove, K. K.,
50.
Lin, S. Y., Ho, C. J., and Li, M. J. (1999) UV B induced
Rajagopal, P., et al. (2011) N terminal domain of alphaB
secondary conformational changes in lens alpha crystallin,
crystallin provides a conformational switch for multimer
J. Photochem. Photobiol. B, 49, 29 34, doi: 10.1016/S1011
ization and structural heterogeneity, Proc. Natl. Acad. Sci.
1344(99)00010 X.
USA, 108, 6409 6414, doi: 10.1073/pnas.1014656108.
51.
Rajan, S., Horn, C., and Abraham, E. C. (2006) Effect of
36.
Pasta, S. Y., Raman, B., Ramakrishna, T., and
oxidation of alphaA and alphaB crystallins on their struc
Rao, Ch., M. (2002) Role of the C terminal extensions of
ture, oligomerization and chaperone function, Mol. Cell.
alpha crystallins. Swapping the C terminal extension of
Biochem., 288, 125 134, doi: 10.1007/s11010 006 9128 4.
alpha crystallin to alphaB crystallin results in enhanced
52.
Chaves, J. M., Srivastava, K., Gupta, R., and Srivastava,
chaperone activity, J. Biol. Chem., 277, 45821 45828,
O. P. (2008) Structural and functional roles of deamidation
doi: 10.1074/jbc.M206499200.
and/or truncation of N or C termini in human alpha A
37.
Treweek, T. M., Ecroyd, H., Williams, D. M., Meehan, S.,
crystallin, Biochemistry, 47, 10069 10083, doi: 10.1021/
Carver, J. A., and Walker, M. J. (2007) Site directed muta
bi8001902.
tions in the C terminal extension of human alphaB crys
53.
Gupta, R., and Srivastava, O. P. (2004) Deamidation
tallin affect chaperone function and block amyloid fibril
affects structural and functional properties of human
formation, PLoS One, 2, e1046, doi: 10.1371/journal.
alphaA crystallin and its oligomerization with alphaB
pone.0001046.
crystallin, J. Biol. Chem., 279, 44258 44269, doi: 10.1074/
38.
Kumar, L. V., and Rao, C. M. (2000) Domain swapping in
jbc.M405648200.
human alpha A and alpha B crystallins affects oligomeriza
54.
Gupta, R., and Srivastava, O. P. (2004) Effect of deamida
tion and enhances chaperone like activity, J. Biol. Chem.,
tion of asparagine 146 on functional and structural proper
275, 22009 22013, doi: 10.1074/jbc.M003307200.
ties of human lens alphaB crystallin, Invest. Ophthalmol.
39.
Peschek, J., Braun, N., Franzmann, T. M., Georgalis, Y.,
Vis. Sci., 45, 206 214, doi: 10.1167/iovs.03 0720.
Haslbeck, M., et al. (2009) The eye lens chaperone alpha
55.
Grey, A. C., and Schey, K. L. (2009) Age related changes
crystallin forms defined globular assemblies, Proc. Natl. Acad.
in the spatial distribution of human lens alpha crystallin
Sci. USA, 106, 13272 13277, doi: 10.1073/pnas.0902651106.
products by MALDI imaging mass spectrometry, Invest.
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
415
Ophthalmol. Vis. Sci., 50, 4319 4329, doi: 10.1167/iovs.09
71.
Schey, K. L., Wang, Z., Friedrich, M. G., Garland, D. L.,
3522.
and Truscott, R. J. W. (2020) Spatiotemporal changes in
56.
MacCoss, M. J., McDonald, W. H., Saraf, A., Sadygov, R.,
the human lens proteome: Critical insights into long lived
Clark, J. M., et al. (2002) Shotgun identification of protein
proteins, Prog. Retin. Eye Res., 76, 100802, doi: 10.1016/
modifications from protein complexes and lens tissue,
j.preteyeres.2019.100802.
Proc. Natl. Acad. Sci. USA, 99, 7900 7905, doi: 10.1073/
72.
Kamei, A., Iwase, H., and Masuda, K. (1997) Cleavage of
pnas.122231399.
amino acid residue(s) from the N terminal region of alpha
57.
Huang, C. H., Wang, Y. T., Tsai, C. F., Chen, Y. J., Lee,
A and alpha B crystallins in human crystalline lens during
J. S., et al. (2011) Phosphoproteomics characterization of
aging, Biochem. Biophys. Res. Commun., 231, 373 378,
novel phosphorylated sites of lens proteins from normal
doi: 10.1006/bbrc.1997.6105.
and cataractous human eye lenses, Mol. Vis., 17, 186 198.
73.
Jimenez Asensio, J., Colvis, C. M., Kowalak, J. A.,
58.
Bakthisaran, R., Akula, K. K., Tangirala, R., and
Duglas Tabor, Y., Datiles, M. B., et al. (1999) An atypical
Rao, Ch., M. (2016) Phosphorylation of alphaB crystallin:
form of alphaB crystallin is present in high concentration
Role in stress, aging and patho physiological conditions,
in some human cataractous lenses. Identification and char
Biochim. Biophys. Acta, 1860, 167 182, doi: 10.1016/
acterization of aberrant N and C terminal processing,
j.bbagen.2015.09.017.
J. Biol. Chem., 274, 32287 32294, doi: 10.1074/jbc.274.
59.
Muranova, L. K., Sudnitsyna, M. V., and Gusev, N. B.
45.32287.
(2018) AlphaB crystallin phosphorylation: advances and
74.
Takemoto, L., Emmons, T., and Horwitz, J. (1993) The C
problems, Biochemistry (Moscow),
83,
11961206,
terminal region of alpha crystallin: involvement in protec
doi: 10.1134/S000629791810005X.
tion against heat induced denaturation, Biochem. J., 294
60.
Carver, J. A., Nicholls, K. A., Aquilina, J. A., and Truscott,
(Pt. 2), 435 438, doi: 10.1042/bj2940435.
R. J. (1996) Age related changes in bovine alpha crystallin
75.
Santhoshkumar, P., Udupa, P., Murugesan, R., and
and high molecular weight protein, Exp. Eye Res., 63,
Sharma, K. K. (2008) Significance of interactions of low
639 647, doi: 10.1006/exer.1996.0158.
molecular weight crystallin fragments in lens aging and
61.
Den Engelsman, J., Gerrits, D., de Jong, W. W.,
cataract formation, J. Biol. Chem., 283, 84778485,
Robbins, J., Kato, K., et al. (2005) Nuclear import of
doi: 10.1074/jbc.M705876200.
{alpha}B crystallin is phosphorylation dependent and
76.
Su, S. P., McArthur, J. D., and Andrew Aquilina, J. (2010)
hampered by hyperphosphorylation of the myopathy relat
Localization of low molecular weight crystallin peptides in
ed mutant R120G, J. Biol. Chem., 280, 37139 37148,
the aging human lens using a MALDI mass spectrometry
doi: 10.1074/jbc.M504106200.
imaging approach, Exp. Eye Res.,
91,
97103,
62.
Simon, S., Fontaine, J. M., Martin, J. L., Sun, X., Hoppe,
doi: 10.1016/j.exer.2010.04.010.
A. D., et al. (2007) Myopathy associated alphaB crystallin
77.
Kannan, R., Santhoshkumar, P., Mooney, B. P., and
mutants: Abnormal phosphorylation, intracellular loca
Sharma, K. K. (2013) The alphaA66 80 peptide interacts
tion, and interactions with other small heat shock proteins,
with soluble alpha crystallin and induces its aggregation
J. Biol. Chem., 282, 3427634287, doi: 10.1074/jbc.
and precipitation: a contribution to age related cataract
M703267200.
formation, Biochemistry, 52, 3638 3650, doi: 10.1021/
63.
Lyon, Y. A., Sabbah, G. M., and Julian, R. R. (2018)
bi301662w.
Differences in alpha Crystallin isomerization reveal the
78.
Raju, M., Santhoshkumar, P., and Sharma, K. K. (2017)
activity of protein isoaspartyl methyltransferase (PIMT) in
Lens endogenous peptide alphaA66 80 generates hydrogen
the nucleus and cortex of human lenses, Exp. Eye Res.,
peroxide and induces cell apoptosis, Aging Dis., 8, 57 70,
171, 131 141, doi: 10.1016/j.exer.2018.03.018.
doi: 10.14336/AD.2016.0805.
64.
Takata, T., and Fujii, N. (2016) Isomerization of Asp
79.
Nagaraj, R. H., Nahomi, R. B., Shanthakumar, S.,
residues plays an important role in alphaA crystallin disso
Linetsky, M., Padmanabha, S., et al. (2012) Acetylation of
ciation, FEBS J., 283, 850 859, doi: 10.1111/febs.13635.
alphaA crystallin in the human lens: effects on structure
65.
Hooi, M. Y., Raftery, M. J., and Truscott, R. J. (2013) Age
and chaperone function, Biochim. Biophys. Acta, 1822,
dependent racemization of serine residues in a human
120 129, doi: 10.1016/j.bbadis.2011.11.011.
chaperone protein, Protein Sci., 22, 93 100, doi: 10.1002/
80.
Wang, Z., Friedrich, M. G., Truscott, R. J. W., and Schey,
pro.2191.
K. L. (2019) Cleavage C terminal to Asp leads to covalent
66.
Lyon, Y. A., Collier, M. P., Riggs, D. L., Degiacomi, M. T.,
crosslinking of long lived human proteins, Biochim Biophys
Benesch, J. L. P., et al. (2019) Structural and functional
Acta Proteins Proteom., 1867, 831 839, doi: 10.1016/j.bba
consequences of age related isomerization in alpha crys
pap.2019.06.009.
tallins, J. Biol. Chem., 294, 7546 7555, doi: 10.1074/jbc.
81.
Litt, M., Kramer, P., LaMorticella, D. M., Murphey, W.,
RA118.007052.
Lovrien, E. W., and et al. (1998) Autosomal dominant con
67.
Lyons, T. J., Silvestri, G., Dunn, J. A., Dyer, D. G., and
genital cataract associated with a missense mutation in the
Baynes, J. W. (1991) Role of glycation in modification of
human alpha crystallin gene CRYAA, Hum. Mol. Genet., 7,
lens crystallins in diabetic and nondiabetic senile cataracts,
471 474, doi: 10.1093/hmg/7.3.471.
Diabetes, 40, 1010 1015, doi: 10.2337/diab.40.8.1010.
82.
Pras, E., Frydman, M., Levy Nissenbaum, E., Bakhan, T.,
68.
Thorpe, S. R., and Baynes, J. W. (1996) Role of the
Raz, J., et al. (2000) A nonsense mutation (W9X) in CRYAA
Maillard reaction in diabetes mellitus and diseases of aging,
causes autosomal recessive cataract in an inbred Jewish
Drugs Aging, 9, 69 77, doi: 10.2165/00002512 199609020
Persian family, Invest. Ophthalmol. Vis. Sci., 41, 3511 3515.
00001.
83.
Hansen, L., Yao, W., Eiberg, H., Kjaer, K. W.,
69.
Stevens, V. J., Rouzer, C. A., Monnier, V. M., and
Baggesen, K., et al. (2007) Genetic heterogeneity in
Cerami, A. (1978) Diabetic cataract formation: Potential
microcornea cataract: five novel mutations in CRYAA,
role of glycosylation of lens crystallins, Proc. Natl. Acad.
CRYGD, and GJA8, Invest. Ophthalmol. Vis. Sci., 48,
Sci. USA, 75, 2918 2922, doi: 10.1073/pnas.75.6.2918.
3937 3944, doi: 10.1167/iovs.07 0013.
70.
Kumar, P. A., Kumar, M. S., and Reddy, G. B. (2007)
84.
Devi, R. R., Yao, W., Vijayalakshmi, P., Sergeev, Y. V.,
Effect of glycation on alpha crystallin structure and chap
Sundaresan, P., et al. (2008) Crystallin gene mutations in
erone like function, Biochem. J.,
408,
251258,
Indian families with inherited pediatric cataract, Mol. Vis.,
doi: 10.1042/BJ20070989.
14, 1157 1170.
БИОХИМИЯ том 87 вып. 3 2022
416
BUDNAR и др.
85.
Song, Z., Si, N., and Xiao, W. (2018) A novel mutation in
(CRYAA), Am. J. Med. Genet. A,
146A,
833842,
the CRYAA gene associated with congenital cataract and
doi: 10.1002/ajmg.a.32236.
microphthalmia in a Chinese family, BMC Med. Genet., 19,
100. Li, L., Fan, D. B., Zhao, Y. T., Li, Y., Kong, D. Q., et al.
190, doi: 10.1186/s12881 018 0695 5.
(2017) Two novel mutations identified in ADCC families
86.
Graw, J., Klopp, N., Illig, T., Preising, M. N., and
impair crystallin protein distribution and induce apoptosis
Lorenz, B. (2006) Congenital cataract and macular
in human lens epithelial cells, Sci. Rep., 7, 17848,
hypoplasia in humans associated with a de novo mutation
doi: 10.1038/s41598 017 18222 z.
in CRYAA and compound heterozygous mutations in P,
101. Sun, W., Xiao, X., Li, S., Guo, X., and Zhang, Q. (2011)
Graefes Arch. Clin. Exp. Ophthalmol., 244, 912919,
Mutation analysis of 12 genes in Chinese families with con
doi: 10.1007/s00417 005 0234 x.
genital cataracts, Mol. Vis., 17, 2197 2206.
87.
Hansen, L., Mikkelsen, A., Nurnberg, P., Nurnberg, G.,
102. Kong, X. D., Liu, N., Shi, H. R., Dong, J. M., Zhao,
Anjum, I., et al. (2009) Comprehensive mutational screen
Z. H., et al. (2015) A novel 3 base pair deletion of the
ing in a cohort of Danish families with hereditary congen
CRYAA gene identified in a large Chinese pedigree featur
ital cataract, Invest. Ophthalmol. Vis. Sci., 50, 3291 3303,
ing autosomal dominant congenital perinuclear cataract,
doi: 10.1167/iovs.08 3149.
Genet. Mol. Res., 14, 426 432, doi: 10.4238/2015.
88.
Laurie, K. J., Dave, A., Straga, T., Souzeau, E.,
103. Berry, V., Ionides, A., Pontikos, N., Georgiou, M., Yu, J.,
Chataway, T., et al. (2013) Identification of a novel
et al. (2020) The genetic landscape of crystallins in con
oligomerization disrupting mutation in CRYAlphaA asso
genital cataract, Orphanet. J. Rare Dis.,
15,
333,
ciated with congenital cataract in a South Australian fami
doi: 10.1186/s13023 020 01613 3.
ly, Hum. Mutat., 34, 435 438, doi: 10.1002/humu.22260.
104. Chen, Q., Ma, J., Yan, M., Mothobi, M. E., Liu, Y., et al.
89.
Mackay, D. S., Andley, U. P., and Shiels, A. (2003) Cell
(2009) A novel mutation in CRYAB associated with auto
death triggered by a novel mutation in the alphaA crys
somal dominant congenital nuclear cataract in a Chinese
tallin gene underlies autosomal dominant cataract linked to
family, Mol. Vis., 15, 1359 1365.
chromosome 21q, Eur. J. Hum. Genet., 11, 784 793,
105. Jiao, X., Khan, S. Y., Irum, B., Khan, A. O., Wang, Q.,
doi: 10.1038/sj.ejhg.5201046.
et al. (2015) Missense mutations in CRYAB are liable for
90.
Khan, A. O., Aldahmesh, M. A., and Meyer, B. (2007)
recessive congenital cataracts, PLoS One, 10, e0137973,
Recessive congenital total cataract with microcornea and
doi: 10.1371/journal.pone.0137973.
heterozygote carrier signs caused by a novel missense
106. Liu, M., Ke, T., Wang, Z., Yang, Q., Chang, W., et al.
CRYAA mutation (R54C), Am. J. Ophthalmol., 144, 949
(2006) Identification of a CRYAB mutation associated
952, doi: 10.1016/j.ajo.2007.08.005.
with autosomal dominant posterior polar cataract in a
91.
Su, D., Guo, Y., Li, Q., Guan, L., Zhu, S., et al. (2012)
Chinese family, Invest. Ophthalmol. Vis. Sci., 47, 3461
A novel mutation in CRYAA is associated with autosomal
3466, doi: 10.1167/iovs.05 1438.
dominant suture cataracts in a Chinese family, Mol. Vis.,
107. Xia, X. Y., Wu, Q. Y., An, L. M., Li, W. W., Li, N., et al.
18, 3057 3063.
(2014) A novel P20R mutation in the alpha B crystallin
92.
Yang, Z., Su, D., Li, Q., Ma, Z., Yang, F., et al. (2013)
gene causes autosomal dominant congenital posterior polar
A R54L mutation of CRYAA associated with autosomal
cataracts in a Chinese family, BMC Ophthalmol., 14, 108,
dominant nuclear cataracts in a Chinese family, Curr. Eye
doi: 10.1186/1471 2415 14 108.
Res., 38, 1221 1228, doi: 10.3109/02713683.2013.811260.
108. Del Bigio, M. R., Chudley, A. E., Sarnat, H. B.,
93.
Patel, R., Zenith, R. K., Chandra, A., and Ali, A. (2017)
Campbell, C., Goobie, S., et al. (2011) Infantile muscular
Novel mutations in the crystallin gene in age related
dystrophy in Canadian aboriginals is an alphaB crys
cataract patients from a North Indian population, Mol.
tallinopathy, Ann. Neurol., 69, 866 871, doi: 10.1002/
Syndromol., 8, 179 186, doi: 10.1159/000471992.
ana.22331.
94.
Bhagyalaxmi, S. G., Srinivas, P., Barton, K. A., Kumar,
109. Khan, A. O., Abu Safieh, L., and Alkuraya, F. S. (2010)
K. R., Vidyavathi, M., et al. (2009) A novel mutation
Later retinal degeneration following childhood surgical
(F71L) in alphaA crystallin with defective chaperone like
aphakia in a family with recessive CRYAB mutation
function associated with age related cataract, Biochim.
(p.R56W), Ophthalmic Genet., 31, 30 36, doi: 10.3109/
Biophys. Acta, 1792, 974981, doi: 10.1016/j.bbadis.
13816810903452047.
2009.06.011.
110. Fichna, J. P., Potulska Chromik, A., Miszta, P., Redowicz,
95.
Santhiya, S. T., Soker, T., Klopp, N., Illig, T., Prakash,
M. J., Kaminska, A. M., et al. (2017) A novel dominant
M. V., et al. (2006) Identification of a novel, putative
D109A CRYAB mutation in a family with myofibrillar
cataract causing allele in CRYAA (G98R) in an Indian
myopathy affects alphaB crystallin structure, BBA Clin., 7,
family, Mol. Vis., 12, 768 773.
1 7, doi: 10.1016/j.bbacli.2016.11.004.
96.
Vanita, V., Singh, J. R., Hejtmancik, J. F., Nuernberg, P.,
111.
Brodehl, A., Gaertner Rommel, A., Klauke, B., Grewe,
Hennies, H. C., et al. (2006) A novel fan shaped cataract
S. A., Schirmer, I., et al. (2017) The novel alphaB crys
microcornea syndrome caused by a mutation of CRYAA in
tallin (CRYAB) mutation p.D109G causes restrictive car
an Indian family, Mol. Vis., 12, 518 522.
diomyopathy, Hum. Mutat., 38, 947 952, doi: 10.1002/
97.
Li, F. F., Yang, M., Ma, X., Zhang, Q., Zhang, M., et al.
humu.23248.
(2010) Autosomal dominant congenital nuclear cataracts
112. Sacconi, S., Feasson, L., Antoine, J. C., Pecheux, C.,
caused by a CRYAA gene mutation, Curr. Eye Res., 35,
Bernard, R., et al. (2012) A novel CRYAB mutation result
492 498, doi: 10.3109/02713681003624901.
ing in multisystemic disease, Neuromuscul. Disord., 22, 66
98.
Gu, F., Luo, W., Li, X., Wang, Z., Lu, S., et al. (2008)
72, doi: 10.1016/j.nmd.2011.07.004.
A novel mutation in AlphaA crystallin (CRYAA) caused
113. Vicart, P., Caron, A., Guicheney, P., Li, Z., Prevost, M. C.,
autosomal dominant congenital cataract in a large
et al. (1998) A missense mutation in the alphaB crystallin
Chinese family, Hum. Mutat., 29, 769, doi: 10.1002/
chaperone gene causes a desmin related myopathy,
humu.20724.
Nat. Genet., 20, 92 95, doi: 10.1038/1765.
99.
Richter, L., Flodman, P., Barria von Bischhoffshausen, F.,
114. Liu, Y., Zhang, X., Luo, L., Wu, M., Zeng, R., et al. (2006)
Burch, D., Brown, S., et al. (2008) Clinical variability of
A novel alphaB crystallin mutation associated with autosomal
autosomal dominant cataract, microcornea and corneal
dominant congenital lamellar cataract, Invest. Ophthalmol.
opacity and novel mutation in the alpha A crystallin gene
Vis. Sci., 47, 1069 1075, doi: 10.1167/iovs.05 1004.
БИОХИМИЯ том 87 вып. 3 2022
СВЯЗАННЫЕ С КАТАРАКТОЙ МОДИФИКАЦИИ И МУТАЦИИ α КРИСТАЛЛИНА
417
115. Selcen, D., and Engel, A. G. (2003) Myofibrillar myopathy
human alphaB crystallin: The biochemical pathomech
caused by novel dominant negative alpha B crystallin
anism underlying cataract and myopathy development,
mutations, Ann. Neurol., 54, 804810, doi: 10.1002/
Int. J. Biol. Macromol., 146, 1142 1160, doi: 10.1016/
ana.10767.
j.ijbiomac.2019.09.239.
116. Reilich, P., Schoser, B., Schramm, N., Krause, S.,
130. Clark, A. R., Lubsen, N. H., and Slingsby, C. (2012) sHSP
Schessl, J., et al. (2010) The p. G154S mutation of the
in the eye lens: crystallin mutations, cataract and pro
alpha B crystallin gene (CRYAB) causes late onset distal
teostasis, Int. J. Biochem. Cell Biol., 44, 16871697,
myopathy, Neuromuscul. Disord.,
20,
255259,
doi: 10.1016/j.biocel.2012.02.015.
doi: 10.1016/j.nmd.2010.01.012.
131. Gerasimovich, E. S., Strelkov, S. V., and Gusev, N. B.
117. Inagaki, N., Hayashi, T., Arimura, T., Koga, Y.,
(2017) Some properties of three alphaB crystallin mutants
Takahashi, M., et al. (2006) Alpha B crystallin mutation in
carrying point substitutions in the C terminal domain and
dilated cardiomyopathy, Biochem. Biophys. Res. Commun.,
associated with congenital diseases, Biochimie, 142, 168
342, 379 386, doi: 10.1016/j.bbrc.2006.01.154.
178, doi: 10.1016/j.biochi.2017.09.008.
118. Berry, V., Francis, P., Reddy, M. A., Collyer, D.,
132. Raju, I., and Abraham, E. C. (2011) Congenital cataract
Vithana, E., et al. (2001) Alpha B crystallin gene (CRYAB)
causing mutants of alphaA crystallin/sHSP form aggre
mutation causes dominant congenital posterior polar
gates and aggresomes degraded through ubiquitin-protea
cataract in humans, Am. J. Hum. Genet., 69, 1141 1145,
some pathway, PLoS One, 6, e28085, doi: 10.1371/journal.
doi: 10.1086/324158.
pone.0028085.
119. Forrest, K. M., Al Sarraj, S., Sewry, C., Buk, S., Tan, S. V.,
133. Ahsan, S. M., Bakthisaran, R., Tangirala, R., and Rao,
et al. (2011) Infantile onset myofibrillar myopathy due to
C. M. (2021) Nucleosomal association and altered interac
recessive CRYAB mutations, Neuromuscul. Disord., 21, 37
tome underlie the mechanism of cataract caused by the
40, doi: 10.1016/j.nmd.2010.11.003.
R54C mutation of alphaA crystallin, Biochim. Biophys.
120. Marcos, A. T., Amoros, D., Munoz Cabello, B., Galan, F.,
Acta Gen. Subj., 1865, 129846, doi: 10.1016/j.bbagen.2021.
Rivas Infante, E., et al. (2020) A novel dominant mutation
129846.
in CRYAB gene leading to a severe phenotype with child
134. Gong, B., Zhang, L. Y., Pang, C. P., Lam, D. S., and Yam,
hood onset, Mol. Genet. Genomic Med.,
8, e1290,
G. H. (2009) Trimethylamine N oxide alleviates the severe
doi: 10.1002/mgg3.1290.
aggregation and ER stress caused by G98R alphaA crys
121. Van der Smagt, J. J., Vink, A., Kirkels, J. H., Nelen, M.,
tallin, Mol. Vis., 15, 2829 2840.
ter Heide, H., et al. (2014) Congenital posterior pole
135. Raju, I., and Abraham, E. C. (2013) Mutants of human
cataract and adult onset dilating cardiomyopathy:
alphaB crystallin cause enhanced protein aggregation and
Expanding the phenotype of alphaB crystallinopathies,
apoptosis in mammalian cells: Influence of co expression
Clin. Genet., 85, 381 385, doi: 10.1111/cge.12169.
of HspB1, Biochem. Biophys. Res. Commun., 430, 107 112,
122. Yu, Y., Xu, J., Qiao, Y., Li, J., and Yao, K. (2021) A new
doi: 10.1016/j.bbrc.2012.11.051.
heterozygous mutation in the stop codon of CRYAB
136. Chavez Zobel, A. T., Loranger, A., Marceau, N., Theriault,
(p. X176Y) is liable for congenital posterior pole cataract in
J. R., Lambert, H., et al. (2003) Distinct chaperone mech
a Chinese family, Ophthalmic Genet.,
42,
139143,
anisms can delay the formation of aggresomes by the
doi: 10.1080/13816810.2020.1855665.
myopathy causing R120G alphaB crystallin mutant,
123. Muranova, L. K., Strelkov, S. V., and Gusev, N. B. (2020)
Hum. Mol. Genet.,
12,
16091620, doi:
10.1093/
Effect of cataract associated mutations in the N terminal
hmg/ddg173.
domain of alphaB crystallin (HspB5), Exp. Eye Res., 197,
137. Sanbe, A., Osinska, H., Saffitz, J. E., Glabe, C. G.,
108091, doi: 10.1016/j.exer.2020.108091.
Kayed, R., et al. (2004) Desmin related cardiomyopathy in
124. Cobb, B. A., and Petrash, J. M. (2000) Structural and func
transgenic mice: a cardiac amyloidosis, Proc. Natl. Acad.
tional changes in the alpha A crystallin R116C mutant in
Sci. USA,
101,
1013210136, doi:
10.1073/pnas.
hereditary cataracts, Biochemistry, 39, 1579115798,
0401900101.
doi: 10.1021/bi001453j.
138. Hayes, V. H., Devlin, G., and Quinlan, R. A. (2008)
125. Kumar, L. V., Ramakrishna, T., and Rao, C. M. (1999)
Truncation of alphaB crystallin by the myopathy causing
Structural and functional consequences of the mutation of
Q151X mutation significantly destabilizes the protein lead
a conserved arginine residue in alphaA and alphaB crys
ing to aggregate formation in transfected cells, J. Biol.
tallins, J. Biol. Chem., 274, 24137 24141, doi: 10.1074/
Chem., 283, 10500 10512, doi: 10.1074/jbc.M706453200.
jbc.274.34.24137.
139. Mitzelfelt, K. A., Limphong, P., Choi, M. J., Kondrat,
126. Singh, D., Raman, B., Ramakrishna, T., and Rao, Ch. M.
F. D., Lai, S., et al. (2016) The human 343delT HSPB5
(2006) The cataract causing mutation G98R in human
chaperone associated with early onset skeletal myopathy
alphaA crystallin leads to folding defects and loss of chap
causes defects in protein solubility, J. Biol. Chem., 291,
erone activity, Mol. Vis., 12, 1372 1379.
14939 14953, doi: 10.1074/jbc.M116.730481.
127. Bova, M. P., Yaron, O., Huang, Q., Ding, L., Haley, D. A.,
140. Zhang, H., Rajasekaran, N. S., Orosz, A., Xiao, X.,
et al. (1999) Mutation R120G in alphaB crystallin, which
Rechsteiner, M., et al. (2010) Selective degradation of
is linked to a desmin related myopathy, results in an irreg
aggregate prone CryAB mutants by HSPB1 is mediated by
ular structure and defective chaperone like function, Proc.
ubiquitin proteasome pathways, J. Mol. Cell. Cardiol., 49,
Natl. Acad. Sci. USA, 96, 6137 6142, doi: 10.1073/pnas.
918 930, doi: 10.1016/j.yjmcc.2010.09.004.
96.11.6137.
141. Andley, U. P., Hamilton, P. D., and Ravi, N. (2008)
128. Perng, M. D., Wen, S. F., van IJssel, P., Prescott, A. R., and
Mechanism of insolubilization by a single point mutation
Quinlan, R. A. (2004) Desmin aggregate formation by
in alphaA crystallin linked with hereditary human
R120G alphaB crystallin is caused by altered filament
cataracts, Biochemistry, 47, 96979706, doi: 10.1021/
interactions and is dependent upon network status in cells,
bi800594t.
Mol. Biol. Cell, 15, 2335 2346, doi: 10.1091/mbc.e03 12
142. Kore, R., Hedges, R. A., Oonthonpan, L.,
0893.
Santhoshkumar, P., Sharma, K. K., et al.
(2012)
129. Ghahramani, M., Yousefi, R., Krivandin, A., Muranov, K.,
Quaternary structural parameters of the congenital cataract
Kurganov, B., et al. (2020) Structural and functional char
causing mutants of alphaA crystallin, Mol. Cell Biochem.,
acterization of D109H and R69C mutant versions of
362, 93 102, doi: 10.1007/s11010 011 1131 8.
8 БИОХИМИЯ том 87 вып. 3 2022
418
BUDNAR и др.
143. Khoshaman, K., Yousefi, R., Tamaddon, A. M.,
148. Lee, C. F. (2009) Self assembly of protein amyloids: a
Abolmaali, S. S., Oryan, A., et al. (2017) The impact of dif
competition between amorphous and ordered aggregation,
ferent mutations at Arg54 on structure, chaperone like
Phys. Rev. E Stat. Nonlin. Soft Matter Phys., 80, 031922,
activity and oligomerization state of human alphaA crys
doi: 10.1103/PhysRevE.80.031922.
tallin: the pathomechanism underlying congenital
149. Sandilands, A., Hutcheson, A. M., Long, H. A., Prescott,
cataract causing mutations R54L, R54P and R54C,
A. R., Vrensen, G., et al. (2002) Altered aggregation prop
Biochim. Biophys. Acta Proteins Proteom., 1865, 604 618,
erties of mutant gamma crystallins cause inherited
doi: 10.1016/j.bbapap.2017.02.003.
cataract, EMBO J.,
21,
60056014, doi:
10.1093/
144. Murugesan, R., Santhoshkumar, P., and Sharma, K. K.
emboj/cdf609.
(2007) Cataract causing alphaAG98R mutant shows sub
150. Meehan, S., Knowles, T. P., Baldwin, A. J., Smith, J. F.,
strate dependent chaperone activity, Mol. Vis., 13, 2301
Squires, A. M., et al. (2007) Characterisation of amyloid
2309,
fibril formation by small heat shock chaperone proteins
145. Singh, D., Tangirala, R., Bakthisaran, R., and
human alphaA , alphaB and R120G alphaB crystallins,
Chintalagiri, M. R. (2009) Synergistic effects of metal ion
J. Mol. Biol., 372, 470484, doi: 10.1016/j.jmb.2007.
and the pre senile cataract causing G98R alphaA crys
06.060.
tallin: Self aggregation propensities and chaperone activi
151. Makley, L. N., McMenimen, K. A., DeVree, B. T.,
ty, Mol. Vis., 15, 2050 2060.
Goldman, J. W., McGlasson, B. N., et al.
(2015)
146. Wang, X., Osinska, H., Klevitsky, R., Gerdes, A. M.,
Pharmacological chaperone for alpha crystallin partially
Nieman, M., et al. (2001) Expression of R120G alphaB
restores transparency in cataract models, Science, 350,
crystallin causes aberrant desmin and alphaB crystallin
674 677, doi: 10.1126/science.aac9145.
aggregation and cardiomyopathy in mice, Circ. Res., 89,
152. Zhao, L., Chen, X. J., Zhu, J., Xi, Y. B., Yang, X., et al.
84 91, doi: 10.1161/hh1301.092688.
(2015) Lanosterol reverses protein aggregation in cataracts,
147. Meehan, S., Berry, Y., Luisi, B., Dobson, C. M., Carver,
Nature, 523, 607 611, doi: 10.1038/nature14650.
J. A., et al. (2004) Amyloid fibril formation by lens crys
153. Raju, M., Santhoshkumar, P., and Sharma, K. (2016)
tallin proteins and its implications for cataract formation,
Alpha crystallin derived peptides as therapeutic chaper
J. Biol. Chem.,
279,
34133419, doi:
10.1074/jbc.
ones, Biochim. Biophys. Acta, 1860, 246 251, doi: 10.1016/
M308203200.
j.bbagen.2015.06.010.
PROTEIN AGGREGATION AND CATARACT:
ROLE OF AGE RELATED MODIFICATIONS
AND MUTATIONS IN α CRYSTALLINS*
Review
P. Budnar, R. Tangirala, R. Bakthisaran, and Ch. M. Rao**
Centre for Cellular and Molecular Biology (CCMB), Council of Scientific and Industrial Research (CSIR),
Uppal Road, Hyderabad 500007, India; e mail: mohan@ccmb.res.in; mohan.ccmb@gmail.com
Cataract is a major cause of blindness. Due to the lack of protein turnover, lens proteins accumulate age related and
environmental modifications that alter their native conformation, leading to the formation of aggregation prone
intermediates, as well as insoluble and light scattering aggregates, thus compromising lens transparency. The lens pro
tein, α crystallin, is a molecular chaperone that prevents protein aggregation, thereby maintaining lens transparency.
However, mutations or post translational modifications, such as oxidation, deamidation, truncation and crosslinking,
can render α crystallins ineffective and lead to the disease exacerbation. Here, we describe such mutations and alter
ations, as well as their consequences. Age related modifications in α crystallins affect their structure, oligomeriza
tion, and chaperone function. Mutations in α crystallins can lead to the aggregation/intracellular inclusions attribut
able to the perturbation of structure and oligomeric assembly and resulting in the rearrangement of aggregation prone
regions. Such rearrangements can lead to the exposure of hitherto buried aggregation prone regions, thereby popu
lating aggregation prone state(s) and facilitating amorphous/amyloid aggregation and/or inappropriate interactions
with cellular components. Investigations of the mutation induced changes in the structure, oligomer assembly, aggre
gation mechanisms, and interactomes of α crystallins will be useful in fighting protein aggregation related diseases.
Keywords: cataract, aggregation, α crystallin
БИОХИМИЯ том 87 вып. 3 2022