БИОХИМИЯ, 2022, том 87, вып. 3, с. 419 - 429
УДК 577.112.7;617.741
ВЛИЯНИЕ СОРБИТОЛА НА СТРУКТУРУ
И ФУНКЦИЮ АЛЬФА КРИСТАЛЛИНА
© 2022
Ch.U. Kumar1, U. Suryavanshi1, V. Sontake1, P.Y. Reddy1,
R.S. Sankhala2, M.J. Swamy2, G.B. Reddy1*
1 Biochemistry Division, National Institute of Nutrition, Hyderabad 500007, India;
e mail: reddyg.bp@icmr.gov.in; geereddy@yahoo.com
2 School of Chemistry, University of Hyderabad, Hyderabad 500046, India
Поступила в редакцию 21.09.2021
После доработки 13.01.2022
Принята к публикации 29.01.2022
Потеря прозрачности хрусталика глаза вследствие катаракты является основной причиной слепоты во
всем мире. В то время как агрегация кристаллинов хрусталика является самой распространенной конечной
точкой развития различных типов катаракты, шапероноподобная активность («chaperone like activity»,
CLA) α кристаллина, предотвращающая агрегацию белков, считается важной для поддержания прозрач
ности хрусталика глаза. Полагают, что осмотический стресс является одним из механизмов развития диа
бетической катаракты вследствие повышенного накопления сорбитола в условиях гипергликемии. Кроме
того, сообщалось о нарушении CLA α кристаллина при диабетической катаракте. Однако влияние сорби
тола на структуру и функцию α кристаллина еще не исследовано. Поэтому в настоящем пилотном иссле
довании мы описали влияние различных концентраций сорбитола на структуру и функцию α кристалли
на. Очищенный α кристаллин, полученный из хрусталика крысы, инкубировали с различными концент
рациями сорбитола в темноте в стерильных условиях до 5 дней. В конце инкубации оценивали структур
ные свойства и CLA с помощью спектроскопических методов анализа. Стоит отметить, что разные концен
трации сорбитола показали различные результаты: при низких концентрациях (5 и 50 мМ) наблюдалось
снижение CLA и незначительные изменения вторичной и третичной структуры, а при более высоких кон
центрациях (500 мМ) таких эффектов отмечено не было. Полученные результаты проливают свет на влия
ние сорбитола в контексте структуры и функций α кристаллина, тем не менее необходимы дальнейшие
исследования, чтобы понять механизм наблюдаемых эффектов и их влияние на катарактогенез.
КЛЮЧЕВЫЕ СЛОВА: альфа кристаллин, катаракта, шапероноподобная активность, сорбитол, структура.
DOI: 10.31857/S0320972522030083
ВВЕДЕНИЕ
кивается весь мир. Сейчас около 470 млн взрос
лых во всем мире страдают диабетом, при этом
Катаракта (помутнение хрусталика глаза) яв
ожидается, что к 2045 г. их число возрастет до
ляется основной причиной слепоты во всем ми
700 млн [5]. С ростом заболеваемости сахарным
ре [1, 2]. Несмотря на значительный прогресс,
диабетом пропорционально увеличилась и час
достигнутый в области хирургии катаракты, эта
тота его осложнений, в том числе диабетической
болезнь продолжает оставаться проблемой об
катаракты, которые вносят весомый вклад в ста
щественного здравоохранения и главной причи
тистику заболеваемости и смертности во всем
ной ухудшения зрения [3]. Среди многих факто
мире.
ров риска, ускоряющих развитие катаракты, ос
Кристаллины являются основными струк
новными остаются диабет и старение [4]. Сооб
турными белками хрусталика глаза; структура
щалось, что степень гипергликемии и продол
кристаллинов, их стабильность и короткодей
жительность диабета ассоциированы с повыше
ствующие взаимодействия чрезвычайно важны
нием риска развития катаракты [2, 4]. В настоя
для обеспечения прозрачности хрусталика [6, 7].
щее время сахарный диабет - одна из самых
Примерно 90% всех растворимых белков хруста
сложных проблем со здоровьем, с которой стал
лика состоят из трех различных кристаллинов:
α , β и γ кристаллинов [6, 8]. α Кристаллин,
член семейства малых белков теплового шока,
Принятые сокращения: АР - альдозоредуктаза;
КД - круговой дихроизм; ДСК - дифференциальная
составляет основную часть цитоплазмы хруста
сканирующая калориметрия; CLA - шапероноподобная
лика глаза и существует в виде гетероолигомера
активность.
с двумя субъединицами, αA и αB [7, 9]. Несмот
* Адресат для корреспонденции.
ря на то что α кристаллин первоначально счита
419
8*
420
KUMAR и др.
ли структурным белком, подобно другим крис
ем о влиянии сорбитола на структуру и функции
таллинам, во многих последующих исследова
α кристаллина.
ниях сообщалось, что он также действует как
шаперон, предотвращая в различных условиях
агрегацию многочисленных белков клиентов,
МАТЕРИАЛЫ И МЕТОДЫ
включая другие кристаллины хрусталика [7, 10].
Считается, что шапероноподобная активность
Материалы. Акриламид, бис акриламид,
(CLA) α кристаллина играет незаменимую роль
персульфат аммония, 2 меркаптоэтанол, SDS,
в поддержании прозрачности хрусталика глаза
BSA и сорбитол были приобретены у компании
[7, 10]. В поддержку этого предположения мож
«Sigma Aldrich» (США). Набор для анализа бел
но привести результаты исследований, показы
ка BCA (бицинхониновой кислоты) был приоб
вающие, что катаракта может быть результатом
ретен в компании «Thermo Scientific» (США).
снижения CLA α кристаллина [11-15].
Sephacryl S 300HR, Superose 6 10/30 и маркеры
С возрастом белки хрусталика, в том числе
SDS/PAGE были приобретены в
«GE
α кристаллин, претерпевают различные пост
Healthcare» (США). Все другие используемые
трансляционные модификации, большинство
химические реагенты обладали самой высокой
из которых приводит к их агрегации [10, 16, 17].
степенью чистоты и были получены от местных
Многие из этих модификаций, которые, как бы
поставщиков.
ло показано, зависимы от возраста, ускоряются
Выделение кристаллинов из хрусталиков крыс.
в условиях гипергликемии вследствие диабета.
Двухмесячных самцов крыс линии Wistar
Среди них неферментативное гликирование
(WNIN) получили из вивария института, работа
считается одним из механизмов, ответственных
с ними проводилась согласно соответствующим
как за возрастную, так и за диабетическую ката
правилам ухода за животными и протоколам,
ракту [18, 19]. Ранее мы описали влияние глики
одобренным Институциональным комитетом по
рования на структуру и CLA α кристаллина и
работе с лабораторными животными. Хрустали
его вклад в формирование диабетической ката
ки выделяли из глазных яблок с помощью задне
ракты [10, 16, 20]. Окислительное повреждение,
го доступа. Из
6-8 хрусталиков готовили
осмотический стресс и накопление конечных
10% ный гомогенат в 0,025 М Tris буфере, рН
продуктов гликирования являются среди мно
8,0, содержащем 0,1 М NaCl, 0,5 мМ ЭДТА и
гих других основными механизмами, которые
0,01% NaN3, и центрифугировали при 10 000 g в
влияют на прозрачность хрусталика, что в ко
течение 30 мин при 4 °C для получения суперна
нечном итоге приводит к формированию ката
танта. Супернатант наносили на колонку для
ракты [21]. Аномальная или избыточная глюко
гель фильтрации Sephacryl S 300 HR (100 см ×
за при диабете преобразуется в ее спиртовую
× 1,5 см), соединенную с системой очистки «Duo
форму, сорбитол, под действием фермента аль
Flow» («Bio Rad Laboratories», США). Колонку
дозоредуктазы (АР) в полиольном пути [22].
уравновешивали вышеуказанным буфером, элюи
Поскольку сорбитол не проникает через клеточ
ровали кристаллины тем же буфером со ско
ные мембраны, его накопление внутри клеток
ростью потока 0,25 мл/мин и раздельно собира
приводит к нарушению метаболического гомео
ли фракции, соответствующие α , βL и γ крис
стаза, что приводит к изменению осмотического
таллинам [16]. Объединенные фракции кристал
давления и окислительно восстановительного
линов подвергали экстенсивному диализу про
состояния [22]. Следовательно, накопление
тив 20 мМ натрий фосфатного буфера (pH 7,4),
сорбитола связано с развитием диабетической
чистоту анализировали с помощью SDS PAGE.
катаракты [22, 23]. Стоит отметить, что было по
Концентрацию белка оценивали с использова
казано снижение CLA α кристаллина из хруста
нием BCA; образцы белка хранили при темпера
ликов крысы и человека, больных диабетом;
туре -80 °C до использования.
данный факт указывает на то, что пониженная
Инкубация α кристаллина с сорбитолом.
CLA α кристаллина может быть вовлечена в
Очищенный α кристаллин (полученный, как
формирование диабетических катаракт [14, 24,
описано выше, из хрусталика крысы) инкубиро
25]. Хотя ранее сообщалось о влиянии различ
вали с различными концентрациями сорбитола
ных катарактогенных повреждений, таких как
(5-500 мМ) или без него в 50 мМ натрий фос
окислительный стресс, конечные продукты гли
фатном буфере, рН 7,4, содержащем 100 мМ
кирования и многие другие посттрансляцион
NaCl, при 37 °С в темноте в стерильных услови
ные модификации, на структуру и функцию
ях в течение 5 дней. По окончании инкубации
α кристаллина, прямое влияние сорбитола на
образцы тщательно диализовали против 20 мМ
α кристаллин не изучалось. Таким образом, в
натрий фосфатного буфера (рН 7,4) и оценива
настоящем пилотном исследовании мы сообща
ли содержание белка.
БИОХИМИЯ том 87 вып. 3 2022
ВЛИЯНИЕ СОРБИТОЛА НА АЛЬФА КРИСТАЛЛИН
421
Шапероноподобная активность. Шапероно
Гель фильтрационная хроматография. Моле
подобную активность нативного α кристаллина
кулярную массу α кристаллина, инкубирован
или α кристаллина, инкубированного с сорби
ного с сорбитолом или без него, определяли с
толом, измеряли по способности этих белков
использованием колонки для гель фильтрации
предотвращать индуцированную нагреванием
«Superose 6 10/30», соединенной с системой
агрегацию белков субстратов, как описано ра
очистки белков
«Duo Flow»
(«Bio Rad
нее [14]. Вкратце, 0,25 мг/мл βL кристаллина или
Laboratories») при скорости потока 0,5 мл/мин.
γ кристаллина (очищенных из хрусталика кры
Дифференциальная сканирующая калоримет
сы, как описано выше) в 50 мМ натрий фосфат
рия. Термическую стабильность α кристаллина
ном буфере, рН 7,4, содержащем 100 мМ NaCl, в
исследовали методом дифференциальной ска
отсутствие или в присутствии
0,025
мг/мл
нирующей калориметрии (ДСК) на приборе
α кристаллина (нативного или инкубированно
«VP DSC» («MicroCal LLC», США), как описа
го с сорбитолом) подвергали нагреванию при
но ранее [26]. α Кристаллин инкубировали с
62 °С в течение 60 мин. С помощью спектрофо
различными концентрациями сорбитола
тометра «Lambda 35» («Perkin Elmer», США)
(5-500 мМ) или без него, как описано выше.
проводили контроль рассеяния света вследствие
Образцы инкубированного белка подвергали
агрегации βL кристаллина при тепловой денату
интенсивному диализу против 20 мМ калий
рации, измеряя видимое поглощение при длине
фосфатного буфера (рН
7,4), содержащего
волны 360 нм в зависимости от времени. Отно
100 мМ хлорида калия и 1 мМ ДТТ. И диализат,
сительную шаперонную активность нативного
и белковые растворы перед сканированием тща
α кристаллина или α кристаллина, инкубиро
тельно дегазировали в вакууме при комнатной
ванного с сорбитолом, рассчитывали как про
температуре. Термограммы ДСК образцов белка
цент защищенного от агрегации по формуле:
(1 мг/мл) регистрировали при температуре от 10
% защиты = ((Ао - А)/Ао) × 100, где Ао и А пред
до 100 °С при скорости сканирования 60°С/ч
ставляют собой кажущееся поглощение насыще
[26]. Также были получены термограммы при
ния (обычно через 50-60 мин) в отсутствие и в
скорости сканирования 30 и 90 °C/ч для провер
присутствии α кристаллина соответственно.
ки зависимости скорости сканирования от теп
Вторичная и третичная структура. Для оценки
лового развертывания. Данные анализировали с
вторичных и третичных структурных изменений
использованием программного обеспечения для
α кристаллина, вызванных воздействием сор
анализа ДСК «Origin 7.0 DSC», предоставленно
битола, спектры кругового дихроизма (КД) в
го производителем.
дальнем и ближнем УФ диапазоне регистриро
Статистический анализ. Если не указано
вали при 25 °C на спектрополяриметре «Jasco
иное, данные представлены как среднее значе
J 810» («Jasco», Япония) [16]. Все спектры были
ние трех экспериментов. Данные были проана
получены усреднением 6 измерений и зарегист
лизированы с использованием программного
рированы с использованием ячеек с длиной оп
обеспечения «SPSS» версии 19.0. Для количест
тического пути 0,1 и 0,5 см для КД дальнего и
венной оценки шаперонной активности данные
ближнего УФ соответственно. Концентрация
представлены как среднее значение ± стандарт
белка, используемая для измерений КД в даль
ное отклонение. Статистическую значимость
нем и ближнем УФ, составляла 0,15 и 1,0 мг/мл
различия между контролем и кристаллином, об
соответственно. Собственную флуоресценцию
работанным сорбитолом, определяли с по
триптофана контролировали с использованием
мощью t критерия Стьюдента. Значения, харак
0,15 мг/мл белка в 20 мМ натрий фосфатном бу
теризуемые p < 0,05, определены как значимые.
фере, рН 7,4, на спектрофлуориметре «Jasco
FP 6500» с возбуждением при 280 нм, регистри
руя эмиссию флуоресценции в диапазоне
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
300-400 нм.
Гидрофобность α кристаллина. Для оценки
Повышенная активность АР и повышенная
поверхностной гидрофобности α кристаллина
выработка сорбитола вовлечены в катарактоге
(нативного или инкубированного с сорбитолом)
нез у людей с диабетом и экспериментальных
белок (0,1 мг/мл) инкубировали с
50
мкМ
моделях диабета [22, 27]. Исследования in vitro и
8 анилинонафталин 1 сульфокислоты (АНС) в
in vivo в целом подчеркнули значение α крис
течение 30 мин при комнатной температуре в
таллина в биологии хрусталика глаза и, в част
темноте; флуоресценцию связанного с белком
ности, указали на то, что его CLA предотвраща
красителя измеряли при возбуждении на 390 нм,
ет агрегацию других белков в хрусталике и, как
а эмиссию в диапазоне 450-550 нм на спектро
следствие, образование катаракты [10]. Следует
флуориметре «Jasco FP 6500» [16].
также отметить нарушение шаперонной функ
БИОХИМИЯ том 87 вып. 3 2022
422
KUMAR и др.
ции α кристаллина у крыс и людей, больных диа
нием агрегацию βL кристаллина зависело от
бетом [14, 24, 25]. Данные наблюдения предпо
концентрации сорбитола и оценивалось в срав
лагают наличие связи между снижением CLA
нении с немодифицированным α кристалли
α кристаллина и диабетической катарактой.
ном (рис. 1). α Кристаллин, инкубированный с
Кроме того, ряд исследований на эксперимен
сорбитолом в концентрации 5 и 50 мМ, показал
тальных животных показывает, что соединения,
снижение CLA, в то время как α кристаллин,
ингибирующие АР, могут быть эффективны для
инкубированный с 500 мМ сорбитола, показал
предотвращения диабетических осложнений,
такое же или немного более высокое значение
включая диабетическую катаракту [28-30]. Сле
CLA по сравнению с α кристаллином, инкуби
дует отметить, что исследований, в которых изу
рованным без сорбитола в тех же условиях. Та
чалось бы прямое влияние сорбитола на α крис
ким образом, оказалось, что влияние сорбитола
таллин, пока не опубликовано. Поэтому в нас
на активность шаперона может варьировать в
тоящей работе мы изучили прямое влияние сор
зависимости от концентрации, что, вероятно,
битола на CLA α кристаллина и связанные с
связано с тонкими структурными изменениями
этим структурные изменения при инкубации с
в белке шапероне, о чем свидетельствуют наб
сорбитолом.
людаемые изменения вторичной и третичной
Влияние шапероноподобной активности
структуры. Аналогичные результаты мы наблю
α кристаллина, инкубированного с сорбитолом
дали при агрегации γ кристаллина под воздей
в течение 5 дней, на индуцированную нагрева
ствием тепла (данные не показаны).
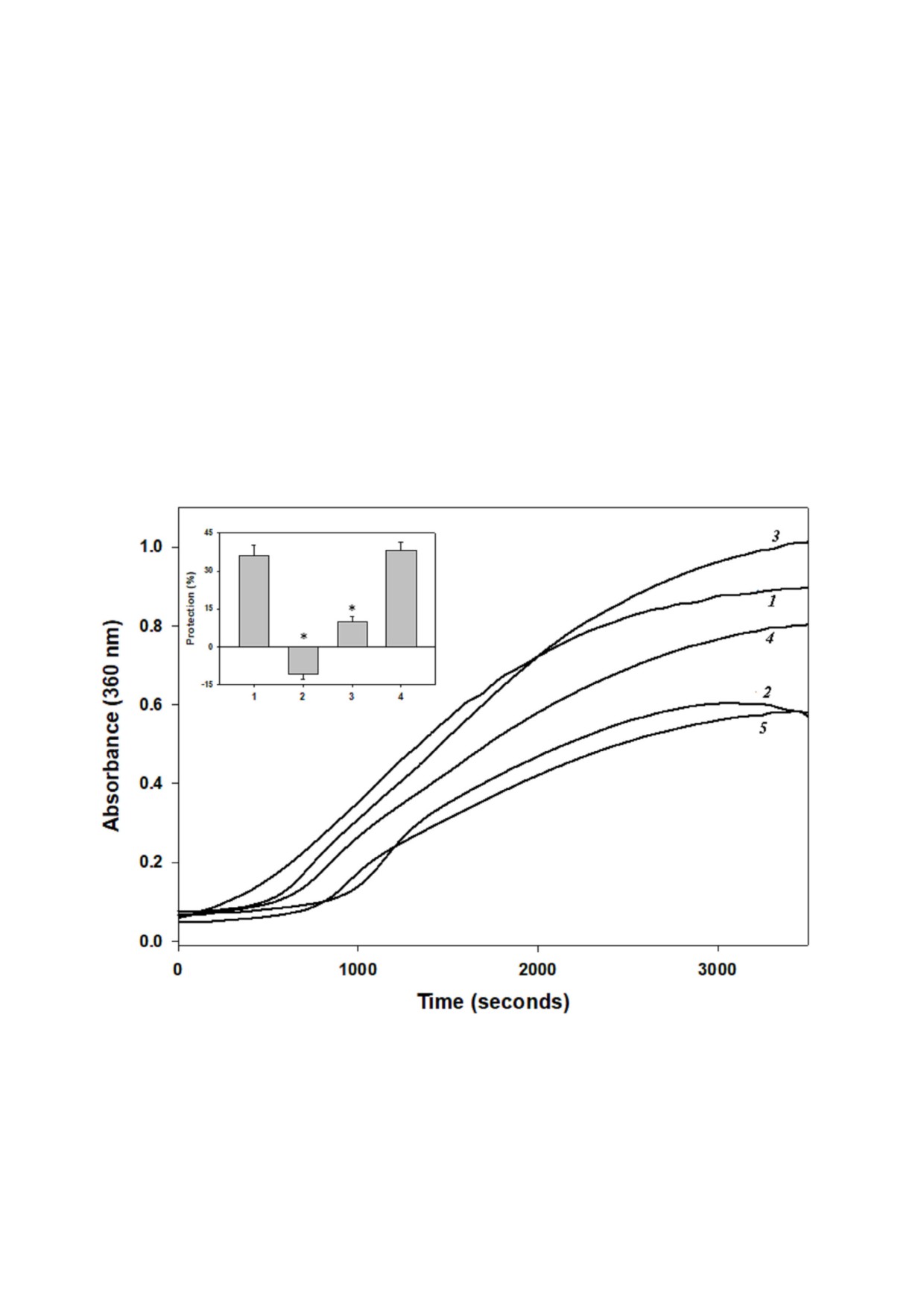
Рис. 1. Шапероноподобная активность α кристаллина. Индуцированную нагреванием агрегацию βL кристаллина при
62 °С контролировали спектрофотометрически при 360 нм в отсутствие (1) или в присутствии 0,05 мг/мл нативного
α кристаллина (2) или α кристаллина, инкубированного с 5 мМ (3), 50 мМ (4) и 500 мМ сорбитола (5). Врезка: относи
тельная шаперонная активность α кристаллина. Относительную шаперонную активность (процент защиты) определяли,
принимая за 100% агрегацию βL кристаллинов в отсутствие α кристаллинов. Столбцы: 1) нативный α кристаллин,
2) α кристаллин, инкубированный с 5 мМ сорбитола, 3) α кристаллин, инкубированный с 50 мМ сорбитола, 4) α крис
таллин, инкубированный с 500 мМ сорбитола. Данные представлены как среднее значение ± стандартное отклонение
(n = 3). Звездочка над столбцами указывает на достоверное различие (p < 0,05) по сравнению с нативным α кристаллином
БИОХИМИЯ том 87 вып. 3 2022
ВЛИЯНИЕ СОРБИТОЛА НА АЛЬФА КРИСТАЛЛИН
423
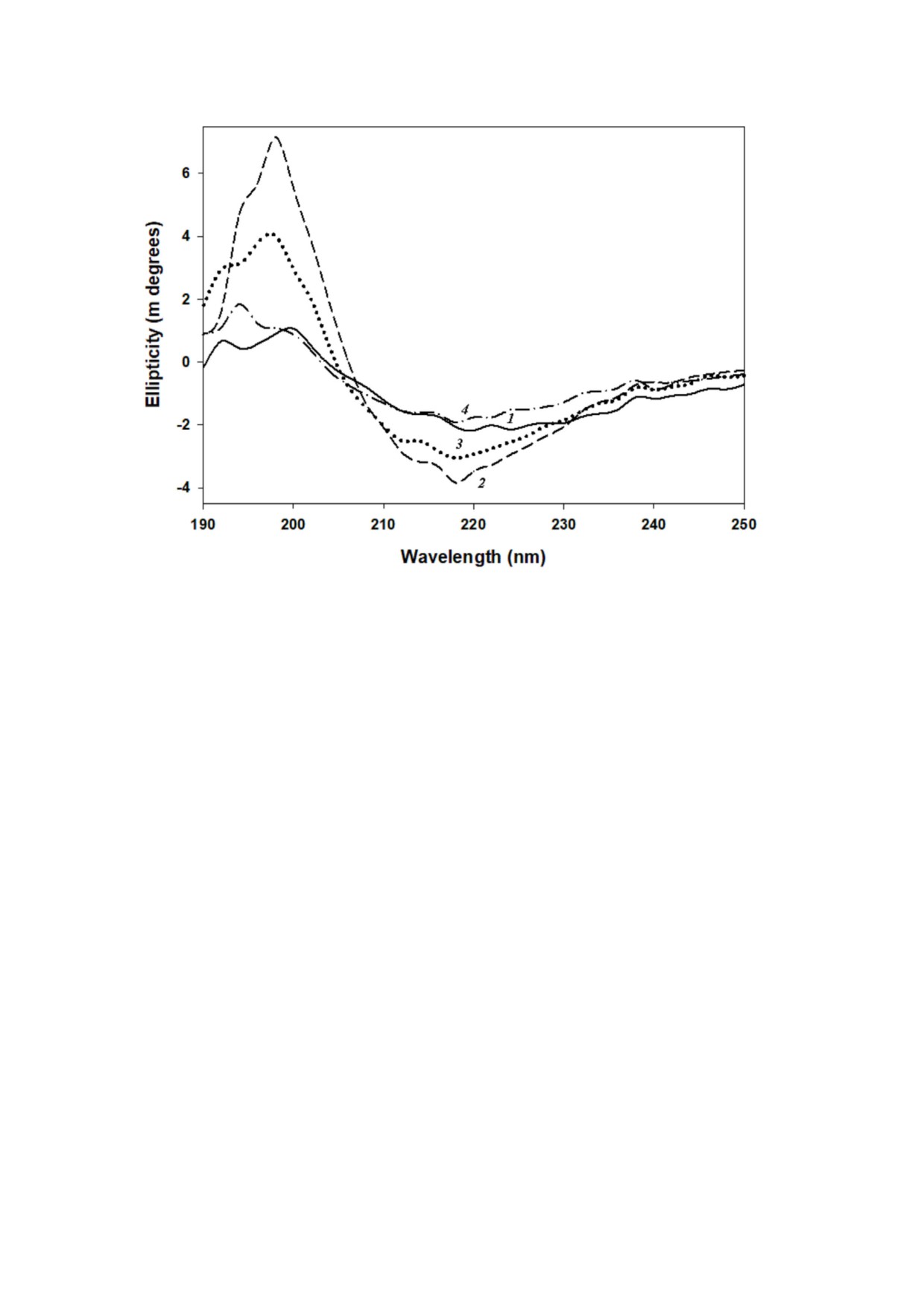
Рис. 2. Вторичная структура α кристаллина, полученная с помощью кругового дихроизма в дальнем УФ. Кривые: 1 - на
тивный α кристаллин; 2-4 - α кристаллин, инкубированный с 5, 50 и 500 мМ сорбитолом соответственно. Данные
представлены как среднее значение трех измерений
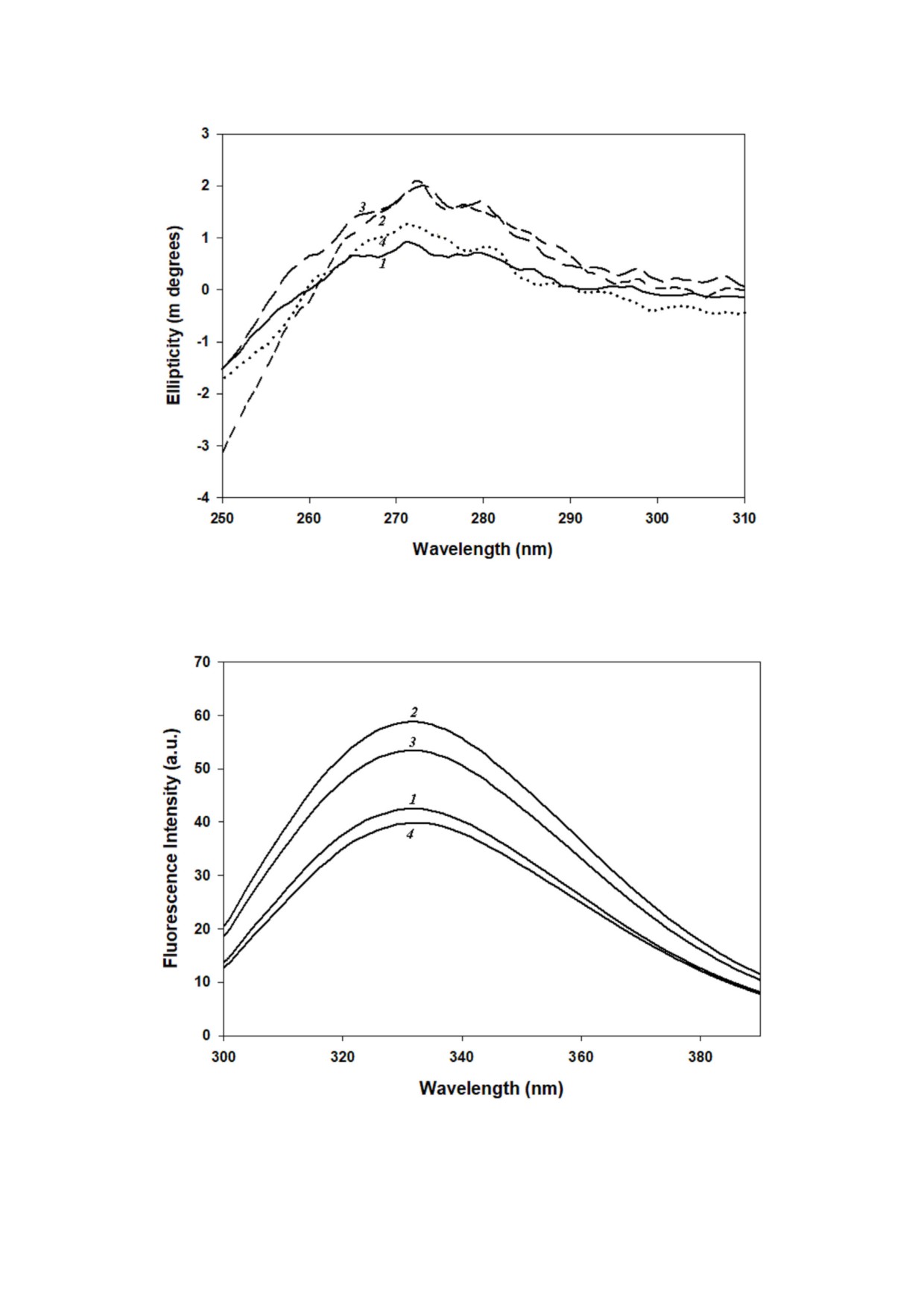
Чтобы получить представление о влиянии
ции 5 мМ, затем - при 50 мМ, а минимальные
разных концентраций сорбитола на CLA
изменения наблюдались при концентрации сор
α кристаллина мы оценили, есть ли какие либо
битола 500 мМ (рис. 3). Самые значительные из
изменения во вторичной и третичной структуре,
менения в третичной структуре были отмечены
используя КД и флуоресцентную спектроско
в ароматической области, что свидетельствует о
пию. Как сообщалось ранее [14, 16], нативный
конформационных изменениях на третичном
α кристаллин имел типичную структуру β листа
структурном уровне за счет участия ароматичес
с максимальной отрицательной эллиптич
ких остатков. Аналогичный характер изменения
ностью в диапазоне 215-218 нм (рис. 2). Следу
флуоресценции триптофана при разных концен
ет отметить, что α кристаллин, инкубирован
трациях сорбитола (рис. 4) дополнительно подт
ный с сорбитолом, демонстрировал изменения
верждает характер изменений в третичной
во вторичной структуре, такие как увеличение
структуре после воздействия сорбитола.
отрицательной эллиптичности при 215-218 нм
В дополнение к другим определяющим фак
и усиление положительного сигнала около
торам, CLA α кристаллина в подавлении агрега
200 нм; при этом максимальные изменения бы
ции белков клиентов, как полагают, опосредует
ли зарегистрированы при концентрации 5 мМ,
ся взаимодействием между гидрофобными
меньшие - при 50 мМ, и минимальные измене
участками на его поверхности и экспонирован
ния или их отсутствие наблюдались для образ
ными гидрофобными участками частично раз
цов, инкубированных с
500
мМ сорбитола
вернутого белка субстрата [7, 31, 32]. Поэтому
(рис. 2). Эти изменения вторичной структуры
мы также оценили гидрофобность α кристалли
отражаются в уменьшении CLA α кристаллина
на с точки зрения его связывания с АНС, гидро
при более низкой концентрации сорбитола в от
фобным зондом. Интенсивность флуоресценции
личие от более высокой концентрации.
АНС, связанного с α кристаллином, была почти
Такие изменения были характерны и для
одинаковой для нативного белка и белка, инку
третичной структуры, анализируемой с по
бированного с 5-500 мМ сорбитола (данные не
мощью КД в диапазоне 250-300 нм; самые серь
представлены). Эти наблюдения свидетельствуют
езные изменения происходили при концентра
о том, что сорбитол не влияет на гидрофобную
БИОХИМИЯ том 87 вып. 3 2022
424
KUMAR и др.
Рис. 3. Третичная структура α кристаллина, полученная с помощью кругового дихроизма в ближнем УФ. Кривые: 1 - на
тивный α кристаллин; 2-4 - α кристаллин, инкубированный с 5, 50 и 500 мМ сорбитола соответственно. Данные пред
ставлены как среднее значение трех измерений
Рис. 4. Спектры флуоресценции триптофана в α кристаллине. Кривые: 1 - нативный α кристаллин; 2-4 - α кристаллин,
инкубированный с 5, 50 и 500 мМ сорбитолом соответственно. Данные представлены как среднее значение трех измерений
БИОХИМИЯ том 87 вып. 3 2022
ВЛИЯНИЕ СОРБИТОЛА НА АЛЬФА КРИСТАЛЛИН
425
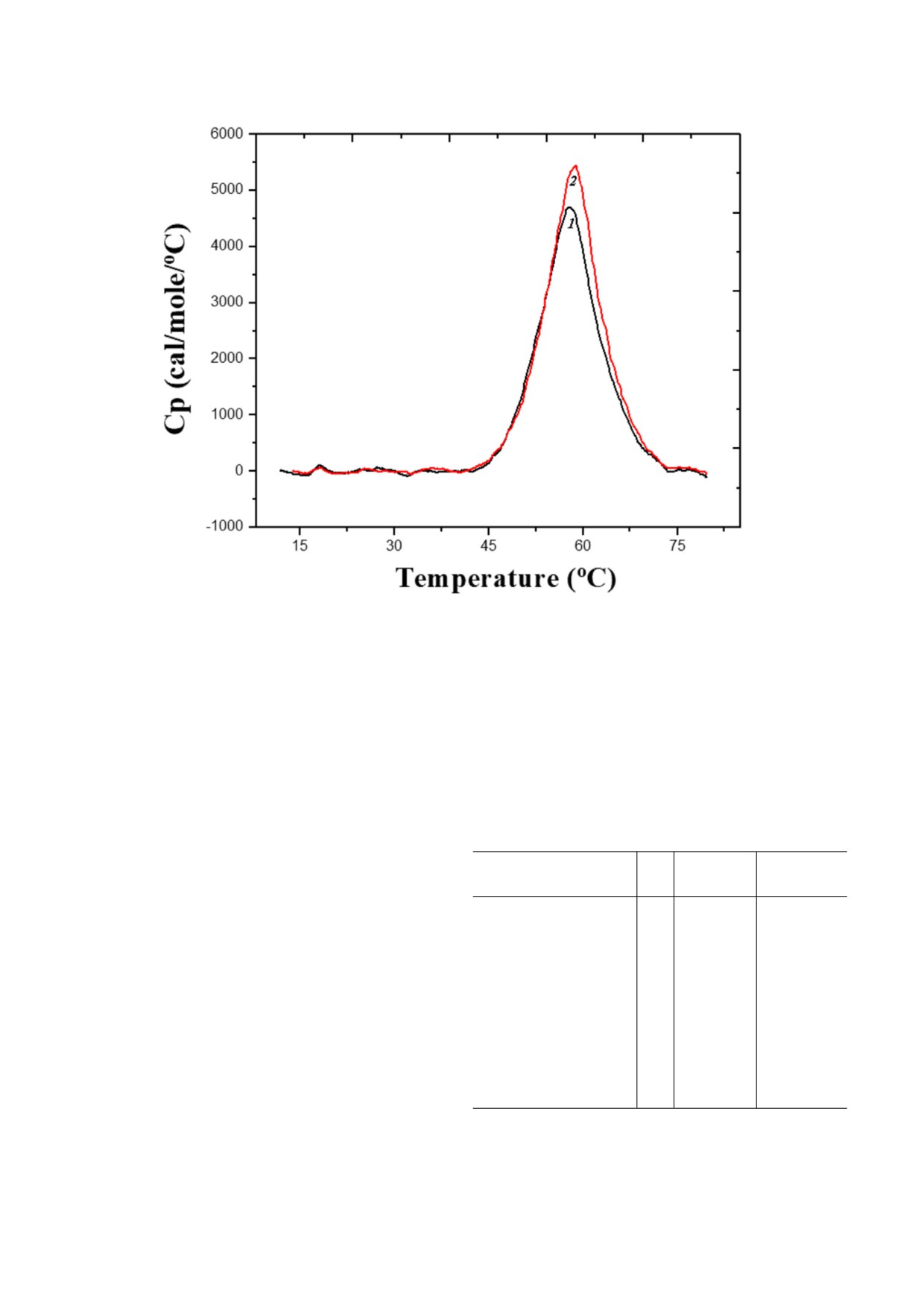
поверхность α кристаллина ни при более низ
90 °C/ч, что указывает на то, что результаты не
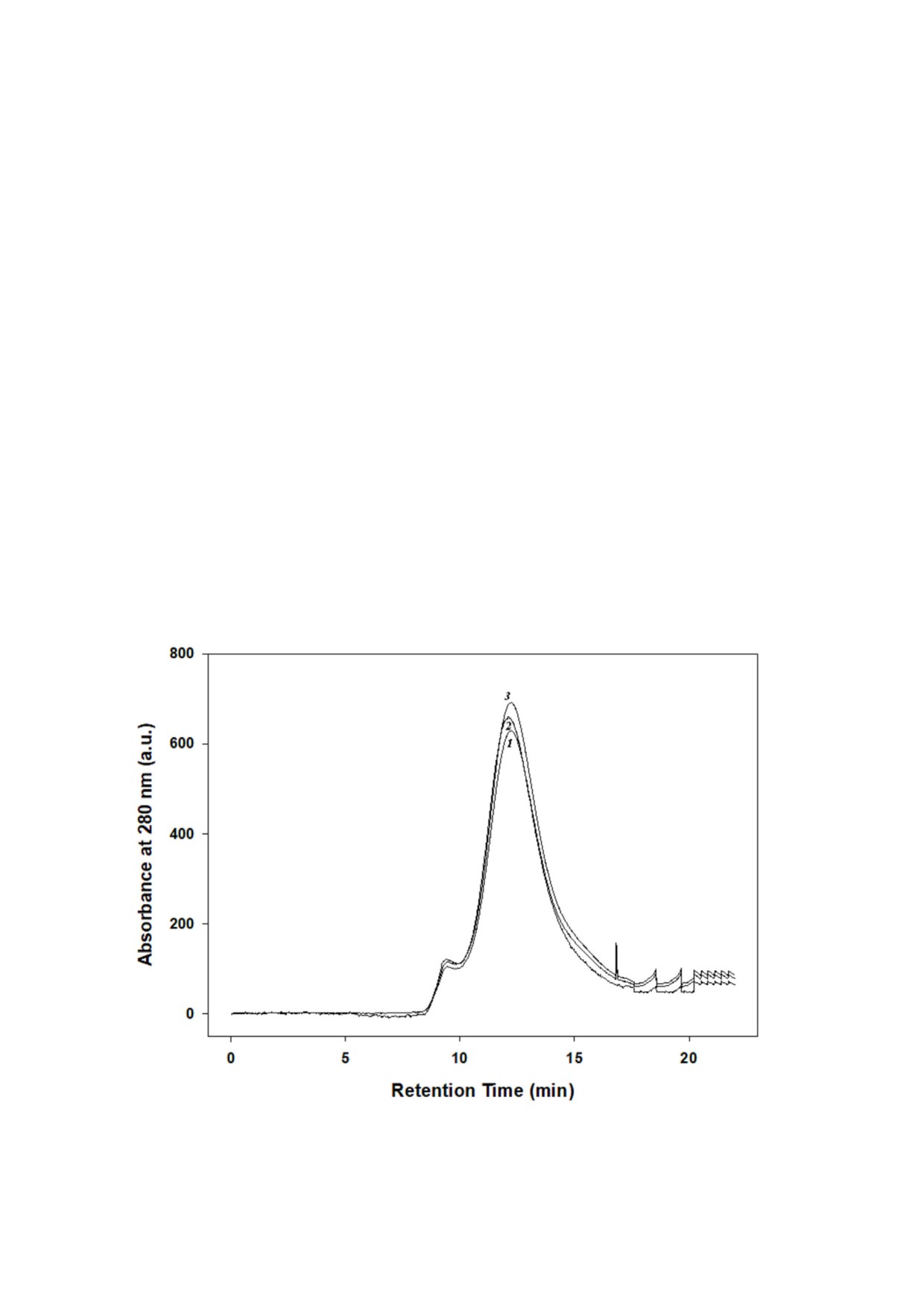
ких, ни при более высоких концентрациях. Пос
зависели от скорости сканирования (данные не
кольку сообщалось, что размер олигомеров
показаны).
α кристаллина влияет на его CLA [7, 16, 20], мы
В совокупности эти результаты указывают на
также определили молекулярную массу (размер
то, что α кристаллин, инкубированный с раз
олигомеров) α кристаллина методом эксклюзи
личными концентрациями сорбитола, демон
онной хроматографии. Инкубация α кристалли
стрировал едва различимые друг от друга, но
на с сорбитолом (5-500 мМ) не приводила к из
все таки разные результаты. В частности, инку
менению размера его олигомеров (рис. 5).
бация с более низкими концентрациями (5 и
Стабильность α кристаллина также имеет
50 мМ) сорбитола приводила к потере CLA и из
решающее значение для его CLA при исследова
менениям вторичной и третичной структур.
нии агрегации. При использовании ДСК мы
Напротив, не наблюдалось существенного влия
анализировали термостабильность α кристал
ния ни на CLA, ни на структуру, ни на стабиль
лина, инкубированного с сорбитолом. Анализ
ность образцов, инкубированных с более высо
термограмм ДСК показал лишь незначительные
кими концентрациями (500 мМ) сорбитола.
изменения термостабильности α кристаллина,
Скорее наблюдался мягкий стабилизирующий
инкубированного с различными концентрация
эффект при концентрации сорбитола 500 мМ в
ми (5-500 мМ) сорбитола. Несмотря на то что
отношении термического разворачивания. Сле
для образцов, инкубированных с низкими кон
дует отметить, что в то время как концентрация
центрациями сорбитола, не наблюдалось значи
сорбитола в хрусталике глаза крыс с нормогли
тельных изменений термодинамических пара
кемией находится в диапазоне 0,1-0,2 мМ, у
метров, для образца, инкубированного с
крыс с диабетом его уровень может повышаться
500 мМ, все же наблюдалось небольшое увели
до 0,5-10 мМ в зависимости от степени гипер
чение Tm (∼1 °C) и примерно 10% ное увеличе
гликемии [29, 33, 34]. Следовательно, эффекты,
ние энтальпии и энтропии перехода (рис. 6 и
наблюдаемые при 5 или 50 мМ сорбитола в нас
таблица). Кроме того, не наблюдалось сущест
тоящем исследовании, могут быть связаны с ги
венных различий при проведении ДСК при 30 и
пергликемическими состояниями в хрусталике
Рис. 5. Молекулярная масса α кристаллина. Время удерживания при ВЭЖХ нативного (1) или α кристаллина, инкуби
рованного с 5 (2) и 500 мМ сорбитола (3)
БИОХИМИЯ том 87 вып. 3 2022
426
KUMAR и др.
Рис. 6. Влияние обработки сорбитолом на термостабильность α кристаллина. Дифференциальная сканирующая калори
метрическая термограмма нативного α кристаллина (1) и после воздействия 500 мМ сорбитола (2)
диабетических крыс, тогда как супрафизиологи
ляет диабетические осложнения, включая диа
ческая концентрация 500 мМ связана с концен
бетическую катаракту, которая, как полагают, в
трациями типичных осмолитов (0,5-1,0 М), ис
основном связана с осмотическим стрессом (на
пользуемых в качестве агентов, стабилизирую
копление сорбитола внутри клеток) через поли
щих белок, или в качестве консервирующих
оловый путь и связанный с ним окислительный
агентов.
Известно, что низкомолекулярные осмоли
Термодинамические параметры, полученные при исследо
ты, в том числе сахарные спирты, такие как сор
вании α кристаллина методом ДСК до и после инкубации
битол, стабилизируют трехмерную структуру
с сорбитолом
многих белков в нестабильных или жестких ус
ловиях за счет изменения структуры белка и
Образец
Tm
ΔHt
ΔSt
(°C)
(ккал/моль)
(кал/моль/К)
движения молекул воды, что приводит к боль
шей стабильности [35, 36]. Помимо применения
α кристаллин
57,9
55,2 ± 0,1
167 ± 1,8
в промышленности и фармацевтике, осмолиты
накапливаются in vivo в условиях стресса и влия
α кристаллин,
58,2
58,5 ± 0,2
174 ± 1,8
ют на стабильность белков в живых клетках [37].
инкубированный
с 5 мМ сорбитолом
Осмолиты контролируют стабильность белка,
влияя на стерические, ван дер ваальсовые, гид
α кристаллин,
58,4
60,1 ± 0,3
180 ± 2,1
рофобные и электростатические взаимодей
инкубированный
ствия белка с самим собой и со всеми компо
с 50 мМ сорбитолом
нентами раствора [38]. Напротив, накопление
α кристаллин,
58,7
61,3 ± 0,2
185 ± 2,2
сорбитола в хрусталике глаза связано с развити
инкубированный
ем катаракты, которая является преимуще
с 500 мМ сорбитолом
ственно нарушением агрегации белков. Было
показано, что гипергликемия, вызванная хро
Примечание. Данные представлены как среднее значе
ническим неконтролируемым диабетом, усугуб ние ± стандартное отклонение (n = 3).
БИОХИМИЯ том 87 вып. 3 2022
ВЛИЯНИЕ СОРБИТОЛА НА АЛЬФА КРИСТАЛЛИН
427
стресс [39, 40]. В дополнение к полиоловому пу
мы также исследовали структурно функцио
ти и связанному с ним окислительному стрессу
нальные свойства α кристаллина в прямом при
преобладающим биохимическим механизмом,
сутствии различных концентраций сорбитола
приписываемым диабетической катаракте, яв
(без диализа), но результаты были практически
ляется неферментативное гликирование. Ис
аналогичны результатам, полученным после
следования, проведенные в нашей и других ла
удаления сорбитола с помощью диализа. Это
бораториях, показали, что неферментативное
очень интригующе, потому что теоретически
гликирование α кристаллина in vitro приводит к
после диализа эффекты низких и высоких кон
снижению CLA [16, 20, 41, 42]. Также было по
центраций сорбитола не должны различаться.
казано, что окислительный стресс приводит к
Однако даже после анализа данных, получен
снижению CLA α кристаллина [41, 43, 44]. Од
ных в настоящем исследовании, не ясно, каким
нако исследований, в которых изучалось прямое
образом более низкие концентрации сорбитола
влияние сорбитола на α кристаллин, до сих пор
оказывают некоторое влияние на α кристаллин,
не проводилось.
а высокие концентрации сорбитола - не оказы
Количество сорбитола, накапливающегося в
вают даже после диализа. Поэтому необходимы
диабетическом хрусталике глаза, в частности,
дополнительные углубленные исследования для
крысы, не превышает 5-10 мМ, что значитель
определения вероятного механизма наблюдае
но ниже концентраций (100-1000 мМ) осмоли
мых эффектов.
тов, используемых в качестве стабилизаторов
Что еще более важно, необходимо изучить
белка. Поэтому в этом исследовании мы изуча
влияние осмолитов, включая сорбитол, на агре
ли влияние различных концентраций сорбитола
гацию β и γ кристаллинов, которые использу
(0,5-500 мМ) на α кристаллин. Интересно, что
ются не только в качестве белков субстратов
лишь при относительно низких концентрациях
при исследовании CLA, но также являются ос
(5 и 50 мМ) сорбитола наблюдалось снижение
новными мишенями защитного действия
CLA по сравнению с более высокими (500 мМ)
α кристаллина в хрусталике. В этом контексте
концентрациями. Фактически в концентраци
следует отметить, что индуцированная теплом и
ях, которые обычно используются для стабили
УФ излучением агрегация растворимой фрак
зации белка или в качестве консерванта, сорби
ции (всех трех основных кристаллинов) из хрус
тол не влиял на CLA α кристаллина. Одновре
талика глаза крысы со спонтанным ожирением
менно со снижением CLA наблюдались незна
была выше по сравнению с их стройными со
чительные, но воспроизводимые изменения
братьями [47], что было в основном связано с ги
вторичной и третичной структуры после инку
пераккумуляцией сорбитола в хрусталике глаза у
бации с 5 мМ и 50 мМ сорбитола, тогда как пос
крыс с ожирением по сравнению с контрольной
ле инкубации с 500 мМ сорбитола изменения во
группой, состоящей из худых особей [33]. Одна
вторичной и третичной структуре отсутствовали
ко мало что известно о влиянии сорбитола на
или были минимальны. Кроме того, ни при ка
кристаллины в отдельности, исследования в
ких концентрациях сорбитола (5-500 мМ) за
этом направлении ведутся в настоящее время.
метных различий в молекулярной массе, разме
Несмотря на обширные исследования касатель
ре олигомеров и стабильности α кристаллина
но вклада сорбитола в развитие диабетической
продемонстрировано не было.
катаракты, не было предпринято никаких по
Хотя известно, что осмолиты стабилизируют
пыток проанализировать влияние сорбитола на
нативную конформацию глобулярных белков,
структурные и функциональные аспекты крис
их влияние на стабильность и агрегацию внут
таллинов. Предварительные результаты, пред
ренне неупорядоченных белков находится в ста
ставленные в настоящем исследовании, позво
дии тщательного изучения [45, 46]. Стабилизи
ляют с большой долей уверенности предполо
рующий эффект осмолитов на белки при высо
жить, что хроническое воздействие сорбитола
ких концентрациях объясняется гидратацией
на белки хрусталика, включая α кристаллин,
(исключением осмолита из белка), как правило,
при диабете делает их более восприимчивыми к
без изменения структуры нативного белка или в
агрегации и снижению CLA, тем самым пред
пользу естественно неупорядоченной структуры
располагая хрусталик к образованию катаракты
по сравнению с нативной структурой, в то время
наряду с осмотическим стрессом.
как при более низких концентрациях предпоч
тительными могут быть взаимодействия с бел
Благодарности. Работа GBR поддерживается
ками, приводящие к изменению структурных и
грантами Индийского совета медицинских ис
функциональных свойств [36]. Тем не менее
следований, Департамента биотехнологии и Со
действие осмолита может быть реализовано
вета по научным и инженерным исследованиям
только в присутствии самого осмолита. Поэтому
правительства Индии. Исследования, проведен
БИОХИМИЯ том 87 вып. 3 2022
428
KUMAR и др.
ные в Университете Хайдарабада, были поддер
пендией Совета научных и промышленных ис
жаны Комиссией по университетским грантам
следований правительства Индии.
(Индия) в рамках программ UPE II и CAS, а
Конфликт интересов. Авторы заявляют об от
также Министерством науки и технологий (Ин
сутствии конфликта интересов.
дия) в рамках программ PURSE и FIST. Работа
Соблюдение этических норм. Соблюдались
CUK и US поддерживается исследовательской
все применимые международные, националь
стипендией Индийского совета медицинских
ные и/или институциональные рекомендации
исследований, а VS - исследовательской сти
по уходу и использованию животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Pascolini, D., and Mariotti, S. P. (2012) Global estimates
16.
Kumar, P. A., Kumar, M. S., and Reddy, G. B. (2007)
of visual impairment: 2010, Br. J. Ophthalmol., 96, 614
Effect of glycation on alpha crystallin structure and chap
618, doi: 10.1136/bjophthalmol 2011 300539.
erone like function, Biochem. J.,
408,
251258,
2.
Congdon, N. G., Friedman, D. S., and Lietman, T. (2003)
doi: 10.1042/BJ20070989.
Important causes of visual impairment in the world today,
17.
Bloemendal, H., de Jong, W., Jaenicke, R., Lubsen, N. H.,
JAMA, 290, 2057 2060, doi: 10.1001/jama.290.15.2057.
Slingsby, C., et al. (2004) Ageing and vision: Structure, sta
3.
Asbell, P. A., Dualan, I., Mindel, J., Brocks, D.,
bility and function of lens crystallins, Progr. Biophys. Mol.
Ahmad, M., et al. (2005) Age related cataract, Lancet,
Biol., 86, 407 485, doi: 10.1016/j.pbiomolbio.2003.11.012.
365, 599 609, doi: 10.1016/S0140 6736(05)17911 2.
18.
Abraham, E. C., Swamy, M. S., and Perry, R. E. (1989)
4.
Drinkwater, J. J., Davis, W. A., and Davis, T. M. E. (2019)
Nonenzymatic glycosylation (glycation) of lens crystallins
A systematic review of risk factors for cataract in type 2 dia
in diabetes and aging, Progr. Clin. Biol. Res., 304, 123 139.
betes, Diabetes Metab. Res. Rev., 35, e3073, doi: 10.1002/
19.
Brownlee, M., Vlassara, H., and Cerami, A.
(1984)
dmrr.3073.
Nonenzymatic glycosylation and the pathogenesis of dia
5.
International Diabetes Federation (2019) IDF Diabetes
betic complications, Ann. Int. Med., 101, 527537,
Atlas 2019, 9th Edn., World Health Organisation, URL:
doi: 10.7326/0003 4819 101 4 527.
20.
Kumar, M. S., Reddy, P. Y., Kumar, P. A., Surolia, I., and
20200302_133351_IDFATLAS9e final web.pdf.
Reddy, G. B. (2004) Effect of dicarbonyl induced brown
6.
Wistow, G. J., and Piatigorsky, J. (1988) Lens crystallins:
ing on alpha crystallin chaperone like activity:
The evolution and expression of proteins for a highly spe
Physiological significance and caveats of in vitro aggrega
cialized tissue, Annu. Rev. Biochem.,
57,
479504,
tion assays, Biochem. J., 379, 273 282, doi: 10.1042/
doi: 10.1146/annurev.bi.57.070188.002403.
BJ20031633.
7.
Reddy, G. B., Kumar, P. A., and Kumar, M. S. (2006)
21.
Chitra, P. S., Chaki, D., Boiroju, N. K., Mokalla, T. R.,
Chaperone like activity and hydrophobicity of alpha crys
Gadde, A. K., et al. (2020) Status of oxidative stress mark
tallin, IUBMB Life,
58,
632641, doi:
10.1080/
ers, advanced glycation index, and polyol pathway in age
15216540601010096.
related cataract subjects with and without diabetes, Exp.
8.
Reddy, V. S., and Reddy, G. B. (2016) Role of crystallins in
Eye Res., 200, 108230, doi: 10.1016/j.exer.2020.108230.
diabetic complications, Biochim. Biophys. Acta, 1860, 269
22.
Kumar, P. A., and Reddy, G. B. (2007) Focus on mole
277, doi: 10.1016/j.bbagen.2015.05.009.
cules: Aldose reductase, Exp. Eye Res., 85, 739 740,
9.
Srinivas, P. N., Reddy, P. Y., and Reddy, G. B. (2008)
doi: 10.1016/j.exer.2006.08.002.
Significance of alpha crystallin heteropolymer with a 3 : 1
23.
Varma, S. D., Kumar, S., and Richards, R. D. (1979)
alphaA/alphaB ratio: Chaperone like activity, structure
Light induced damage to ocular lens cation pump:
and hydrophobicity, Biochem. J.,
414,
453460,
Prevention by vitamin C, Proc. Natl. Acad. Sci. USA, 76,
doi: 10.1042/BJ20080544.
3504 3506, doi: 10.1073/pnas.76.7.3504.
10.
Kumar, P. A., and Reddy, G. B. (2009) Modulation of
24.
Thampi, P., Zarina, S., and Abraham, E. C. (2002) alpha
alpha crystallin chaperone activity: A target to prevent or
Crystallin chaperone function in diabetic rat and human
delay cataract? IUBMB life, 61, 485 495, doi: 10.1002/
lenses, Mol. Cell. Biochem., 229, 113 118, doi: 10.1023/
iub.176.
a:1017980713089.
11.
Horwitz, J. (2003) Alpha crystallin, Exp. Eye Res., 76,
25.
Cherian, M., and Abraham, E. C. (1995) Diabetes affects
145 153, doi: 10.1016/s0014 4835(02)00278 6.
alpha crystallin chaperone function, Biochem. Biophys.
12.
Yan, H., Harding, J. J., Hui, Y. N., and Li, M. Y. (2003)
Res. Commun., 212, 184 189, doi: 10.1006/bbrc.1995.1954.
Decreased chaperone activity of alpha crystallin in selenite
26.
Srinivas, P., Narahari, A., Petrash, J. M., Swamy, M. J.,
cataract may result from selenite induced aggregation,
and Reddy, G. B. (2010) Importance of eye lens alpha
Eye, 17, 637 645, doi: 10.1038/sj.eye.6700419.
crystallin heteropolymer with 3:1 alphaA to alphaB ratio:
13.
Kelley, M. J., David, L. L., Iwasaki, N., Wright, J., and
Stability, aggregation, and modifications, IUBMB Life, 62,
Shearer, T. R. (1993) alpha Crystallin chaperone activity is
693 702, doi: 10.1002/iub.373.
reduced by calpain II in vitro and in selenite cataract,
27.
Snow, A., Shieh, B., Chang, K. C., Pal, A., Lenhart, P.,
J. Biol. Chem., 268, 18844 18849.
et al. (2015) Aldose reductase expression as a risk factor for
14.
Kumar, P. A., Suryanarayana, P., Reddy, P. Y., and Reddy,
cataract, Chem. Biol. Interact., 234, 247 253, doi: 10.1016/
G. B. (2005) Modulation of alpha crystallin chaperone
j.cbi.2014.12.017.
activity in diabetic rat lens by curcumin, Mol. Vis., 11, 561
28.
Pfeifer, M. A., Schumer, M. P., and Gelber, D. A. (1997)
568.
Aldose reductase inhibitors: the end of an era or the need
15.
Huang, F. Y., Ho, Y., Shaw, T. S., and Chuang, S. A. (2000)
for different trial designs? Diabetes, 46 Suppl. 2, S82 S89,
Functional and structural studies of alpha crystallin from
doi: 10.2337/diab.46.2.s82.
galactosemic rat lenses, Biochem. Biophys. Res. Commun.,
29.
Suryanarayana, P., Saraswat, M., Petrash, J. M., and
273, 197 202, doi: 10.1006/bbrc.2000.2924.
Reddy, G. B. (2007) Emblica officinalis and its enriched
БИОХИМИЯ том 87 вып. 3 2022
ВЛИЯНИЕ СОРБИТОЛА НА АЛЬФА КРИСТАЛЛИН
429
tannoids delay streptozotocin induced diabetic cataract in
induced by macromolecular agents and osmolytes, Mol.
rats, Mol. Vis., 13, 1291 1297.
bioSystems, 13, 2551 2563, doi: 10.1039/c7mb00436b.
30.
Akileshwari, C., Raghu, G., Muthenna, P., Mueller, N. H.,
39. Beeley, L. (1983) Assessing new drugs, Practitioner, 227,
Suryanaryana, P., et al. (2014) Bioflavonoid ellagic acid
1527 1534.
inhibits aldose reductase: Implications for prevention of
40. Williamson, J. (2012) Linking diabetic complications to
diabetic complications, J. Funct. Foods, 6, 374383,
sorbitol oxidation, oxidative stress and metabolic suppres
doi: 10.1016/j.jff.2013.11.004.
sion, J. Diab. Metab.,
3,
219, doi:
10.4172/2155
31.
Kumar, M. S., Kapoor, M., Sinha, S., and Reddy, G. B.
6156.1000219.
(2005) Insights into hydrophobicity and the chaperone
41. Cherian, M., and Abraham, E. C. (1995) Decreased mole
like function of alphaA and alphaB crystallins: An
cular chaperone property of alpha crystallins due to post
isothermal titration calorimetric study, J. Biol. Chem., 280,
translational modifications, Biochem. Biophys. Res.
21726 21730, doi: 10.1074/jbc.M500405200.
Commun., 208, 675 679, doi: 10.1006/bbrc.1995.1391.
32.
Das, K. P., and Surewicz, W. K. (1995) Temperature
42. Plater, M. L., Goode, D., and Crabbe, M. J. (1997)
induced exposure of hydrophobic surfaces and its effect on
Ibuprofen protects alpha crystallin against posttranslation
the chaperone activity of alpha crystallin, FEBS Lett., 369,
al modification by preventing protein cross linking,
321 325, doi: 10.1016/0014 5793(95)00775 5.
Ophthalm. Res., 29, 421 428, doi: 10.1159/000268043.
33.
Reddy, P. Y., Giridharan, N. V., and Reddy, G. B. (2012)
43. Peluso, G., Petillo, O., Barbarisi, A., Melone, M. A.,
Activation of sorbitol pathway in metabolic syndrome and
Reda, E., et al. (2001) Carnitine protects the molecular
increased susceptibility to cataract in Wistar Obese rats,
chaperone activity of lens alpha crystallin and decreases
Mol. Vis., 18, 495 503.
the post translational protein modifications induced by
34.
Randazzo, J., Zhang, P., Makita, J., Blessing, K., and
oxidative stress, FASEB J., 15, 1604 1606, doi: 10.1096/
Kador, P. F. (2011) Orally active multi functional antioxi
fj.00 0727fje.
dants delay cataract formation in streptozotocin (type 1)
44. Rajan, S., Horn, C., and Abraham, E. C. (2006) Effect of
diabetic and gamma irradiated rats, PLoS One, 6, e18980,
oxidation of alphaA and alphaB crystallins on their struc
doi: 10.1371/journal.pone.0018980.
ture, oligomerization and chaperone function, Mol. Cell.
35.
Haque, I., Singh, R., Moosavi Movahedi, A. A., and
Biochem., 288, 125 134, doi: 10.1007/s11010 006 9128 4.
Ahmad, F.
(2005) Effect of polyol osmolytes on
45. Verma, G., Singh, P., and Bhat, R. (2020) Disorder under
DeltaG(D), the Gibbs energy of stabilisation of proteins at
stress: Role of polyol osmolytes in modulating fibrillation
different pH values, Biophys. Chem.,
117,
1 12,
and aggregation of intrinsically disordered proteins,
doi: 10.1016/j.bpc.2005.04.004.
Biophys. Chem., 264, 106422, doi: 10.1016/j.bpc.2020.
36.
Xie, G., and Timasheff, S. N. (1997) Mechanism of the
106422.
stabilization of ribonuclease A by sorbitol: Preferential
46. Aravindan, S., Chen, S., Choudhry, H., Molfetta, C.,
hydration is greater for the denatured then for the native
Chen, K. Y., et al. (2020) Osmolytes dynamically regulate
protein, Protein Sci., 6, 211221, doi: 10.1002/pro.
mutant Huntingtin aggregation and CREB function in
5560060123.
Huntington’s disease cell models, Sci. Rep., 10, 15511,
37.
Khan, S. H., Ahmad, N., Ahmad, F., and Kumar, R.
doi: 10.1038/s41598 020 72613 3.
(2010) Naturally occurring organic osmolytes: From cell
47. Reddy, P. Y., Giridharan, N. V., Balakrishna, N.,
physiology to disease prevention, IUBMB Life, 62, 891
Validandi, V., Pullakhandam, R., et al. (2013) Increased
895, doi: 10.1002/iub.406.
risk of cataract development in WNIN obese rats due to
38.
Ferreira, L. A., Uversky, V. N., and Zaslavsky, B. Y. (2017)
accumulation of intralenticular sorbitol, IUBMB Life, 65,
Role of solvent properties of water in crowding effects
472 478, doi: 10.1002/iub.1163.
EFFECT OF SORBITOL ON ALPHA CRYSTALLIN
STRUCTURE AND FUNCTION
Ch. U. Kumar1, U. Suryavanshi1, V. Sontake1, P. Y. Reddy1,
R. S. Sankhala2, M. J. Swamy2, and G. B. Reddy1*
1 Biochemistry Division, National Institute of Nutrition, Hyderabad 500007, India;
e mail: reddyg.bp@icmr.gov.in; geereddy@yahoo.com
2 School of Chemistry, University of Hyderabad, Hyderabad 500046, India
Loss of eye lens transparency due to cataract is the leading cause of blindness all over the world. While aggregation of
lens crystallins is the most common endpoint in various types of cataracts, chaperone like activity (CLA) of α crys
tallin preventing protein aggregation is considered to be important for maintaining the eye lens transparency. Osmotic
stress due to increased accumulation of sorbitol under hyperglycemic conditions is believed to be one of the mecha
nisms for diabetic cataract. In addition, compromised CLA of α crystallin in diabetic cataract has been reported.
However, the effect of sorbitol on the structure and function of α crystallin has not been elucidated yet. Hence, in the
present exploratory study, we described the effect of varying concentrations of sorbitol on the structure and function
of α crystallin. Alpha crystallin purified from the rat lens was incubated with varying concentrations of sorbitol in the
dark under sterile conditions for up to 5 days. At the end of incubation, structural properties and CLA were evaluat
ed by spectroscopic methods. Interestingly, different concentrations of sorbitol showed contrasting results: at lower
concentrations (5 and 50 mM) there was a decrease in CLA and subtle alterations in secondary and tertiary structure
but not at higher concentrations (500 mM). Though, these results shed a light on the effect of sorbitol on α crystallin
structure-function, further studies are required to understand the mechanism of the observed effects and their impli
cation to cataractogenesis.
Keywords: alpha crystallin, cataract, chaperone like activity, sorbitol, structure
БИОХИМИЯ том 87 вып. 3 2022