БИОХИМИЯ, 2022, том 87, вып. 3, с. 430 - 441
УДК 615;616 05
ХИМЕРНЫЙ АГОНИСТ РЕЦЕПТОРА ГАЛАНИНА GALR2
УМЕНЬШАЕТ ПОВРЕЖДЕНИЕ СЕРДЦА КРЫС
ПРИ СТРЕПТОЗОТОЦИН ИНДУЦИРОВАННОМ ДИАБЕТЕ
© 2022
И.М. Студнева, О.М. Веселова, И.В. Доброхотов, Л.И. Серебрякова,
М.Е. Палькеева, А.C. Молокоедов, А.А. Азьмуко, М.В. Овчинников,
М.В. Сидорова, О.И. Писаренко*
ФГБУ «НМИЦ кардиологии» Минздрава РФ, 121552 Москва, Россия; электронная почта: olpi@live.ru
Поступила в редакцию 15.02.2022
После доработки 28.02.22
Принята к публикации 28.02.2022
Нейропептид галанин и его N концевые фрагменты снижают образование активных форм кислорода и нор
мализуют метаболическое и антиоксидантное состояния миокарда при экспериментальной кардиомиопа
тии и ишемическом/реперфузионном повреждении. Целью настоящего исследования было выяснение влия
ния фармакологического агониста WTLNSAGYLLGPβAH OH (G) рецептора галанина GalR2 на повреж
дение сердца, вызванные введением стрептозотоцина (STZ) крысам. Пептид G получали твердофазным
пептидным синтезом с использованием Fmoc стратегии и очищали препаративной ВЭЖХ. Его структура
была определена с помощью 1H ЯМР спектроскопии и MALDI TOF масс спектрометрии. Животные бы
ли рандомизированы в пять групп: К
- контроль; S, SG10 и SG50, которым вводили STZ,
STZ + G (10 нмоль/кг/сут.) и STZ + G (50 нмоль/кг/сут.); и G - здоровые животные, получав
шие G (50 нмоль/кг/сут.) Введение G предотвращало гипергликемию у крыс группы SG50. К окончанию
эксперимента содержание АТP, общего фонда адениннуклеотидов, фосфокреатина и отношение PCr/ATP в
миокарде животных группы SG50 было достоверно выше этих показателей в группе S. Одновременно в
группах SG50 и SG10 содержание лактата и отношение лактат/пируват в миокарде крыс было снижено, а
глюкозы - увеличено по сравнению с этими показателями в группе S. Обе дозы G снижали повышенную
активность креатинкиназы МВ и лактатдегидрогеназы и уменьшали концентрацию тиобарбитуратных кис
лотно активных продуктов в плазме крови крыс, получавших STZ, до значений не отличающихся от конт
роля. Полученные результаты свидетельствуют о том, что G обладает кардиопротекторными свойствами
при сахарном диабете 1 го типа. Обсуждены возможные механизмы действия пептида G при STZ индуци
рованном диабете.
КЛЮЧЕВЫЕ СЛОВА: галанин, сердце, стрептозотоцин, метаболизм миокарда, перекисное окисление
липидов, мембраны кардиомиоцитов.
DOI: 10.31857/S0320972522030095
ВВЕДЕНИЕ
ция и потеря β клеток приводят к дефициту ин
сулина и гипергликемии. Несмотря на примене
Сахарный диабет (СД) 1 го типа - хроничес
ние препаратов, снижающих сахар, СД и сопут
кое аутоиммунное заболевание, связанное с из
ствующие осложнения остаются серьёзной
бирательной деструкцией инсулин продуцирую
проблемой здравоохранения во всём мире [1].
щих β клеток поджелудочной железы. Дисфунк
СД, вызванный стрептозотоцином (STZ), явля
ется общепризнанной экспериментальной мо
Принятые сокращения: АФК - активные формы
делью, которая используется для изучения но
кислорода; ПОЛ - перекисное окисление липидов; СД -
вых терапевтических методов [2]. Одной из осо
сахарный диабет; βAH OH - карнозин; СК МВ - креа
бенностей STZ является то, что это соединение
тинкиназа МВ; Сr - креатин; GLUT4 - переносчик глю
может быть токсичным для других органов,
козы 4; LDH - лактатдегидрогеназа; STZ - стрептозото
цин; PCr - фосфокреатин; TBARS - тиобарбитуратные
включая сердце. Результаты исследования диа
кислотно активные продукты (2 tiobarbituric acid reacting
бета у пациентов и на лабораторных животных
substances); WTLNSAGYLL NH2 - N концевой фрагмент свидетельствуют о том, что нарушения энерге
галанина (2-11); WTLNSAGYLLGPHA ОН - N концевой тического обмена в кардиомиоцитах способ
фрагмент галанина (2-15); WTLNSAGYLLGPβAH OH
ствуют развитию дисфункции сердца [3, 4].
(G) - модифицированный аналог галанина (2-15); ΣAN -
общий фонд адениннуклеотидов (ATP + ADP + AMP);
Окислительный стресс также участвует в патоге
ΣCr - общий креатин (PCr + Cr).
незе СД. Увеличение образования активных
* Адресат для корреспонденции.
форм кислорода (АФК) при СД обусловлено ау
430
МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ГАЛАНИНА И ДИАБЕТ
431
тоокислением глюкозы, неферментативным
па [14]. Предполагается, что этот эндогенный
гликированием белков и последующей окисли
пептид может регулировать чувствительность к
тельной деградацией гликозилированных бел
инсулину, увеличивая экспрессию переносчика
ков [5]. Избыточное образование АФК, пере
глюкозы 4 (GLUT4) и способствуя транслока
кисное окисление липидов мембран и недоста
ции GLUT4 к плазматической мембране кардио
точная антиоксидантная защита хорошо доку
миоцитов для увеличения поглощения глюко
ментированы у пациентов с диабетом и в экспе
зы [15]. Животные с нарушением метаболизма
рименте [6]. В связи с этим стратегии, улучшаю
галанина особенно склонны к развитию СД 2 го
щие образование энергии в митохондриях серд
типа, сопровождающегося инсулинорезистент
ца и снижающие окислительный стресс, могут
ностью [16]. Хотя эти экспериментальные фак
быть перспективными для защиты миокарда от
ты указывают на терапевтический потенциал га
повреждающего действия СД.
ланина при СД, влияние его экзогенных N кон
Нейропептид галанин, состоящий из 29 а.о.
цевых фрагментов при этой патологии остаётся
(30 а.о. - у человека), широко распространён в
неизученным. Целью данной работы было изу
центральной и периферической нервных систе
чение эффективности пептида G, представляю
мах и экспрессируется в различных тканях и ор
щего последовательность галанина (2-13), до
ганах [7]. Галанин проявляет свою биоактивность
полненную дипептидом карнозин (βAH OH),
через три различных рецептора, связанных с G
для снижения метаболических нарушений мио
белками, GalR1, GalR2 и GalR3, все они находят
карда на модели STZ диабета у крыс. Мы сосре
ся в сердце. Ранее мы показали, что экзогенный
доточились на влиянии этого пептида на уро
галанин и его N концевые фрагменты ослабляют
вень глюкозы в крови и ткани сердца, показате
повреждение сердца при доксорубицин индуци
лях энергетического состояния миокарда и пов
рованной кардиомиопатии и ишемическом/ре
реждениях мембран кардиомиоцитов. Наши ре
перфузионном стрессе. В частности, N концевые
зультаты показывают, что введение G может
фрагменты галанина
(2-11) и
(2-15),
значительно уменьшать развитие метаболичес
WTLNSAGYLL NH2 и WTLNSAGYLLGPHA OH
ких нарушений и повреждений мембран кардио
соответственно, обладающие высоким срод
миоцитов, вызванных STZ.
ством к подтипу рецептора GalR2, повышают
жизнеспособность клеток, ингибируют апоптоз
и образование супероксида и пероксида водоро
МАТЕРИАЛЫ И МЕТОДЫ
да в митохондриях кардиомиобластов крыс ли
нии H9c2 при гипоксии/реоксигенации [8, 9].
Модифицированный фрагмент галанина G.
Внутривенное введение этих пептидов крысам
Пептид G WTLNSAGYLLGPβAH OH был по
после регионарной ишемии миокарда уменьша
лучен путём ступенчатого твердофазного синте
ет размер инфаркта и активность маркёров нек
за с использованием Fmoc методологии [17]. Он
роза в плазме крови при реперфузии [10]. Эти
был очищен методом высокоэффективной жид
эффекты сопровождаются снижением образо
костной хроматографии (ВЭЖХ) на обращён
вания аддуктов гидроксильных радикалов в ин
ной фазе, его структура охарактеризована с по
терстиции зоны риска при реперфузии и мень
мощью 1Н ЯМР спектроскопии и времяпролёт
шим образованием продуктов перекисного
ной масс спектрометрии с матрично ассоции
окисления липидов (ПОЛ) в реперфузирован
рованной лазерной десорбцией/ионизаци
ном миокарде [11]. Химически модифициро
ей (MALDI TOFF). Характеристика G пред
ванный аналог N концевого фрагмента галани
ставлена в табл. 1.
на (2-15) - химерный агонист рецептора GalR2
Животные. В работе использовали крыс сам
WTLNSAGYLLGPβAH OH (G) - также умень
цов линии Вистар массой 290-310 г. Крыс содер
шает дисфункцию левого желудочка и улучшает
жали в индивидуальных клетках при температу
энергетическое состояние и функции митохон
ре 20-25 °С с естественным циклом свет темно
дрий в сердце крыс с доксорубициновой кардио
та; они имели свободный доступ к стандартному
миопатией [12]. Кроме того, введение G предот
гранулированному корму
(«Aller Petfood»,
вращает ПОЛ в повреждённом сердце за счёт
Санкт Петербург, Россия) и воде.
повышения активности Cu,Zn супероксиддис
Дизайн исследования. Перед исследованием
мутазы (Cu,Zn СОД) и глутатионпероксида
всех крыс взвешивали и после 24 часового голо
зы (GSH Px) [13].
дания у пяти животных брали кровь из хвосто
Известно, что галанин играет важную роль в
вой вены для определения исходной концентра
поддержании чувствительности к инсулину и
ции глюкозы, активности креатинкиназы
ингибировании секреции инсулина для умень
МВ (СК МВ), лактатдегидрогеназы (LDH) и
шения гиперинсулинемии при СД 2 го ти
тиобарбитуратных кислотно активных продук
9 БИОХИМИЯ том 87 вып. 3 2022
432
СТУДНЕВА и др.
Таблица 1. Характеристика пептида G
ВЭЖХ **
Последовательность
Мол. масса,
Выход*,
MALDI TOF, m/z
Растворимость
г/моль
%
в воде, мг/мл
Rt, мин
Чистота, %
WTLNSAGYLLGP βAH OH
1499,67
46,3
1499,76 [М + H]+,
> 20
14,66
98,2
1521,73 [М + Na]+
1537,72 [M + K]+
Примечание. Замена аминокислот показана жирным шрифтом. Rt - время удерживания.
* Выход пептида приведён в расчёте на стартовую аминокислоту, присоединённую к полимерному носителю.
** Аналитическую ВЭЖХ проводили на хроматографе Knauer («Wissenschaftlich Technische Werkstatten GmbH», Германия)
на колонке (4,6 × 250 мм) Kromasil 100 5 C18 («AkzoNobel», Швеция), размер частиц сорбента - 5 мкм, размер пор - 100 Å.
В качестве элюентов использовали: буфер А - 0,1% ная трифторуксусная кислота, буфер Б - 80% ацетонитрила в буфе
ре А, элюцию проводили со скоростью 1 мл/мин в градиенте концентрации буфера Б в буфере А от 20 до 80% за 30 мин,
детекцию осуществляли при 220 нм.
тов (ТBARS) в плазме. У пяти крыс, анестезиро
вой вены для определения активности СК МВ,
ванных
2,2,2 трибромэтанолом (авертин,
LDH и содержания TBARS в плазме. У пяти
1 мг/кг внутрибрюшинно (в/б); «Acros Organic»,
крыс каждой группы, наркотизированных 2,2,2
Бельгия), извлекали сердце и замораживали в
трибромэтанолом (1 мг/кг в/б, «Acros Organic»),
жидком азоте с помощью зажима Волленбергера
извлекали сердце и замораживали в жидком азо
для оценки содержания метаболитов в миокар
те с помощью зажима Волленбергера для анали
де (исходное состояние). Остальные крысы бы
за метаболитов.
ли рандомизированы в пять групп по 10 крыс в
Обработка ткани миокарда и анализ метаболи
каждой: контрольная (К), STZ (S), STZ + G10
тов. Замороженные сердца гомогенизировали в
(SG10), STZ + G50 (SG50) и галаниновая (G).
охлаждённой 6% ной HClO4 (1/10, w/v) с ис
Крысы получали одну в/б инъекцию STZ
пользованием гомогенизатора Ultra Turrax T 25
(«Sigma Aldrich», США) в дозе 35 мг/кг. STZ
(«Janke & Kunkel IKA labortechnik», Германия).
растворяли в 0,1 М цитратном буфере (рН 4,5)
Гомогенаты центрифугировали при 2000 g в те
перед использованием. Умеренная доза STZ бы
чение 20 мин при 4 °С на центрифуге Sorvall RT1
ла выбрана для того, чтобы исключить гибель
(«Thermo Scientific», США). Супернатанты
животных и ежедневные инъекции инсули
нейтрализовали раствором 5 М K2CO3 до pH 7,4;
на [18]. Животным контрольной группы (К) в
после охлаждения экстракты центрифугировали
первый день вводили в/б такой же объём 0,1 М
для удаления осадка KClO4. Массу сухой ткани
цитратного буфера (рН 4,5), а в последующие
определяли путём взвешивания тканевого осад
дни в течение 4 недель в/б вводили физиологи
ка после экстракции 6% ной HClO4 и сушки в
ческий раствор. Животные группы SG10 полу
течение ночи при 110 °С. Концентрации АТP,
чали одну в/б инъекцию SТZ (35 мг/кг) и в/б
АDP, АMP, фосфокреатина (PCr), креатина (Cr),
инъекции G в дозе 10 нмоль/кг/сут. в течение
лактата, пирувата и глюкозы в нейтрализован
4 недель. Животные группы SG50 получали од
ных безбелковых тканевых экстрактах опреде
ну в/б инъекцию SТZ (35 мг/кг) и в/б инъек
ляли модифицированными ферментативными
ции G в дозе 50 нмоль/кг/сут. в течение 4 недель.
методами на спектрофотометре UV 1800
Первую инъекцию G делали через 2 ч после вве
(«Shimadzu», Япония) [19]. Концентрацию глю
дения STZ. Животным группы галанина (G)
козы в крови натощак измеряли глюкометром
ежедневно вводили в/б G в дозе 50 нмоль/кг/сут.
Accu Check Instant («Boehringer Mannheim»,
в течение 4 недель. Пептид G растворяли в фи
Германия). Набор «TBARS Assay Kit» («Cayman
зиологическом растворе непосредственно перед
Chemicals», США) использовали для спектро
использованием. Дозы G были выбраны на ос
фотометрического измерения продуктов ПОЛ
новании доступных в литературе данных [15] и
TBARS в плазме крови.
собственных пилотных исследований. У крыс
Оценка повреждения клеточных мембран.
всех групп еженедельно определяли массу тела и
Плазму образцов крови, собранных в исходном
концентрацию глюкозы в крови после 24 часо
состоянии и в конце эксперимента, получали
вого голодания. После 4 недельного исследова
центрифугированием при 4 °С и 1500 g в течение
ния у всех животных забирали кровь из хвосто
10 мин в гепаринизированных пробирках и да
БИОХИМИЯ том 87 вып. 3 2022
МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ГАЛАНИНА И ДИАБЕТ
433
лее хранили при -80 °С. Активность LDH в плаз
и G в дозе 10 или 50 нмоль/кг/сут. в течение
ме определяли ферментативно с пируватом в ка
4 недель достоверно увеличивало прирост мас
честве субстрата на спектрофотометре Shimadzu
сы тела по сравнению с диабетической груп
UV 1800 при λ = 340 нм [20]. Активность CK MB
пой S к концу эксперимента. При этом досто
в плазме оценивали методом иммуноингибиро
верных различий между группой SG50 и кон
вания с использованием стандартных наборов
тролем после 4 недельного эксперимента не
«Creatine kinase MB» («BioSystems S.A.», Испа
наблюдалось. На протяжении всего периода
ния).
наблюдения прирост массы тела здоровых
Статистическая обработка данных. Исполь
крыс, получавших G в дозе 50 нмоль/кг/сут. в
зован пакет программ SigmaPlot 11.2 («SysStat»,
течение 4 недель, был таким же, как и у кон
США). Данные представлены в виде среднего
трольных животных.
значения
± стандартная ошибка среднего
Введение STZ значительно повышало уро
(M ± SEM). При сравнении нескольких групп с
вень глюкозы в крови, отобранной натощак, по
контролем использовали t критерий Стьюдента
сравнению с этим показателем в контрольной
с поправкой Бонферрони. Статистически зна
группе в течение всего эксперимента (табл. 2).
чимыми отличия считали при p < 0,05.
После 4 недельного исследования концентра
ция глюкозы в крови у животных группы S со
ставила 12,9 ± 2,6 мМ по сравнению с исходным
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
уровнем 5,3 ± 0,2 мМ (р < 0,001). Совместное
введение STZ и обеих доз пептида G заметно
Масса тела крыс и уровень глюкозы в крови.
снижало уровень глюкозы в крови по сравне
Достоверных различий в исходной массе тела
нию с группой S. Разница в концентрации глю
животных между группами не было (табл. 2).
козы в крови между группами S и SG50 была
В контроле наблюдалось прогрессирующее уве
статистически значимой с первой недели иссле
личение массы тела в течение периода наблю
дования. К концу 4 недели концентрация глю
дения. Напротив, у животных группы S отмече
козы в крови в группе SG50 была в 1,8 раза ни
но выраженное нарушение прироста массы на
же, чем в группе S (р < 0,05), и достоверно не от
протяжении всего исследования. В конце экс
личалась от значения в контроле. Достоверных
перимента средняя масса тела в этой группе бы
различий в уровне глюкозы в группе G по срав
ла на 20% ниже, чем у животных контрольной
нению с контролем в ходе всего эксперимента
группы (р < 0,001). Совместное введение STZ
не наблюдалось.
Таблица 2. Изменения массы тела крыс и концентрации глюкозы в крови в исследуемых группах в течение 4 недельного
эксперимента
Группа
Исходное состояние
Первая неделя
Четвёртая неделя
Масса тела, г
К
299,0 ± 4,9
318,6 ± 6,0#
397,6 ± 5,1#
S
294,8 ± 6,5
295,6 ± 6,4*
323,1 ± 11,2*,#
SG10
298,4 ± 4,3
293,2 ± 5,2*
355,6 ± 8,0#,+
SG50
299,0 ± 4,0
305,6 ± 8,3
370,6 ± 12,3#,+
#,+
G
302,2 ± 3,8
325,3 ± 5,6
411,5 ± 7,4#,+
Концентрация глюкозы, мМ
K
5,6 ± 0,3
6,8 ± 0,7
6,7 ± 0,5
S
5,3 ± 0,2
11,6 ± 1,8*,#
12,9 ± 2,6*,#
SG10
4,9 ± 0,9
8,4 ± 0,9#
8,0 ± 0,6#
SG50
4,9 ± 0,6
7,6 ± 0,2#,+
7,3 ± 0,5#,+
G
5,7 ± 0,6
6,4 ± 0,4
6,9 ± 0,6
Примечание. Данные представлены как M ± SEM для групп из 10 животных. Достоверное отличие р < 0,05 от: * (контро
ля), # (исходного состояния), + (группы S).
9 БИОХИМИЯ том 87 вып. 3 2022
434
СТУДНЕВА и др.
Маркёры окислительного стресса и поврежде
кой интенсивности ПОЛ при STZ индуциро
ния мембран. Измерение в плазме TBARS (низ
ванном диабете [21]. Через 4 недели исследова
комолекулярных конечных продуктов окисли
ния концентрация TBARS в плазме крови крыс
тельного повреждения) является удобной оцен
контрольной группы не изменялась по сравне
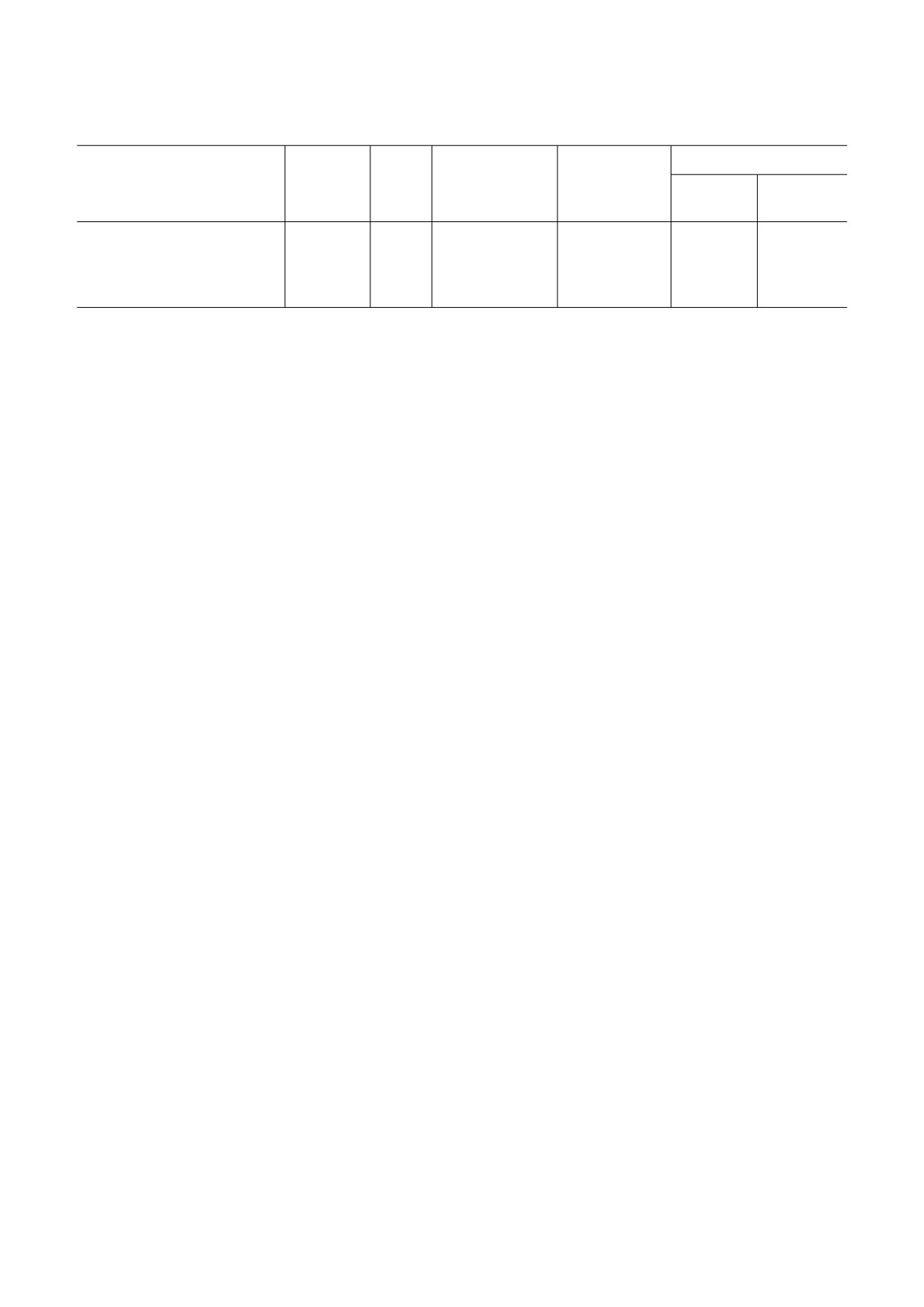
Рис. 1. Влияние пептида G на содержание тиобарбитуратных кислотно активных продуктов (TBARS) (а) и активнос
ти СК MB (б) и LDH (в) в плазме крови крыс после 4 недельного эксперимента. ИС - исходное состояние, К - контроль,
S - STZ, SG10 - STZ + G (10 нмоль/кг/cут.), SG50 - STZ + G (50 нмоль/кг/cут.), G - пептид G в дозе 50 нмоль/кг/cут.
Данные представлены как M ± SEM для групп из 5 животных. Достоверное отличие (p < 0,05) от: * К, # S, ^ ИС
БИОХИМИЯ том 87 вып. 3 2022
МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ГАЛАНИНА И ДИАБЕТ
435
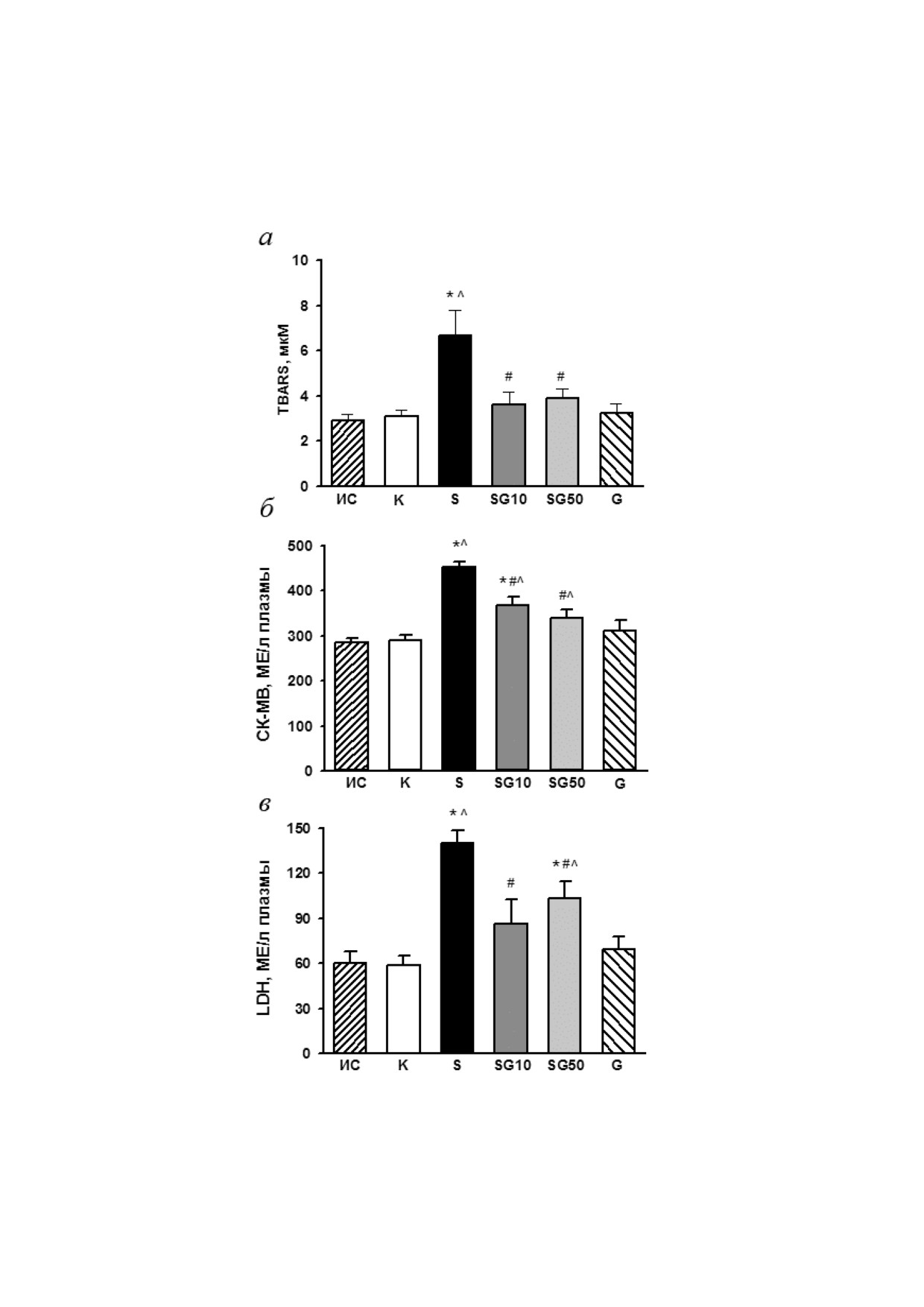
Рис. 2. Влияние пептида G на содержание АТP (а), ΣAN (б), PCr (в) и ΣCr (г) в миокарде крыс в конце 4 недельного экс
перимента. К - контроль, S - STZ, SG10 - STZ + G (10 нмоль/кг/cут.), SG50 - STZ + G (50 нмоль/кг/cут.), G - пеп
тид G (50 нмоль/кг/cут.). Данные представлены как M ± SEM для групп из 5 животных. Достоверное отличие (p < 0,05)
от: * К, # S
нию с исходным значением (рис. 1, а). Напро
пе S. Ежедневное введение G (50 нмоль/кг/сут. в
тив, у крыс группы S этот показатель увеличил
течение 4 недель) не влияло на активность LDH
ся более чем в 2 раза, что свидетельствовало об
и СК МВ в плазме по сравнению с контролем и
активации ПОЛ. STZ индуцированное увеличе
исходными значениями.
ние образования TBARS снижалось под воздей
Метаболическое состояние миокарда. Для
ствием пептида G. К концу 4 недельного иссле
оценки влияния G на метаболизм миокарда, пов
дования уровень TBARS в группах SG10 и SG50
реждённого STZ, мы сравнили содержание мета
не отличался от исходного, а разница между
болитов энергетического обмена и гликолити
обеими пептидными группами (SG10 и SG50) и
ческих интермедиатов (глюкозы, лактата и пиру
диабетической группой S была статистически
вата) в исследуемых группах (рис. 2 и 3). После
значимой. Введение животным G в дозе
4 недельного эксперимента содержание этих ме
50 нмоль/кг/сут. в течение 4 недель не влияло на
таболитов в миокарде контрольной группы дос
уровень TBARS в плазме по сравнению с исход
товерно не отличалось от исходных значений.
ным значением.
Под действием STZ наблюдали снижение содер
Активность LDH и CK MB в плазме крыс,
жания АТP и общего фонда адениннуклеоти
получавших STZ, была значительно увеличена
дов (ΣAN) (в среднем до 20% от исходного) при
после 4 недельного исследования по сравнению
практически неизменном cуммарном содержа
с исходными и контрольными значения
нии ADP и AMP и потерю общего креатина
ми (рис. 1, б и в). Совместное введение обеих
(ΣCr = PCr + Cr), вызванную главным образом
доз G и STZ уменьшало повреждение клеточных
значительным снижением содержания PCr. От
мембран, о чём свидетельствовало достоверное
ношение PCr/АТP, характеризующее энергообес
снижение активности обоих ферментов в плаз
печение сердца, было достоверно ниже в груп
ме по сравнению с этими показателями в груп
пе S по сравнению с этим показателем в контро
БИОХИМИЯ том 87 вып. 3 2022
9*
436
СТУДНЕВА и др.
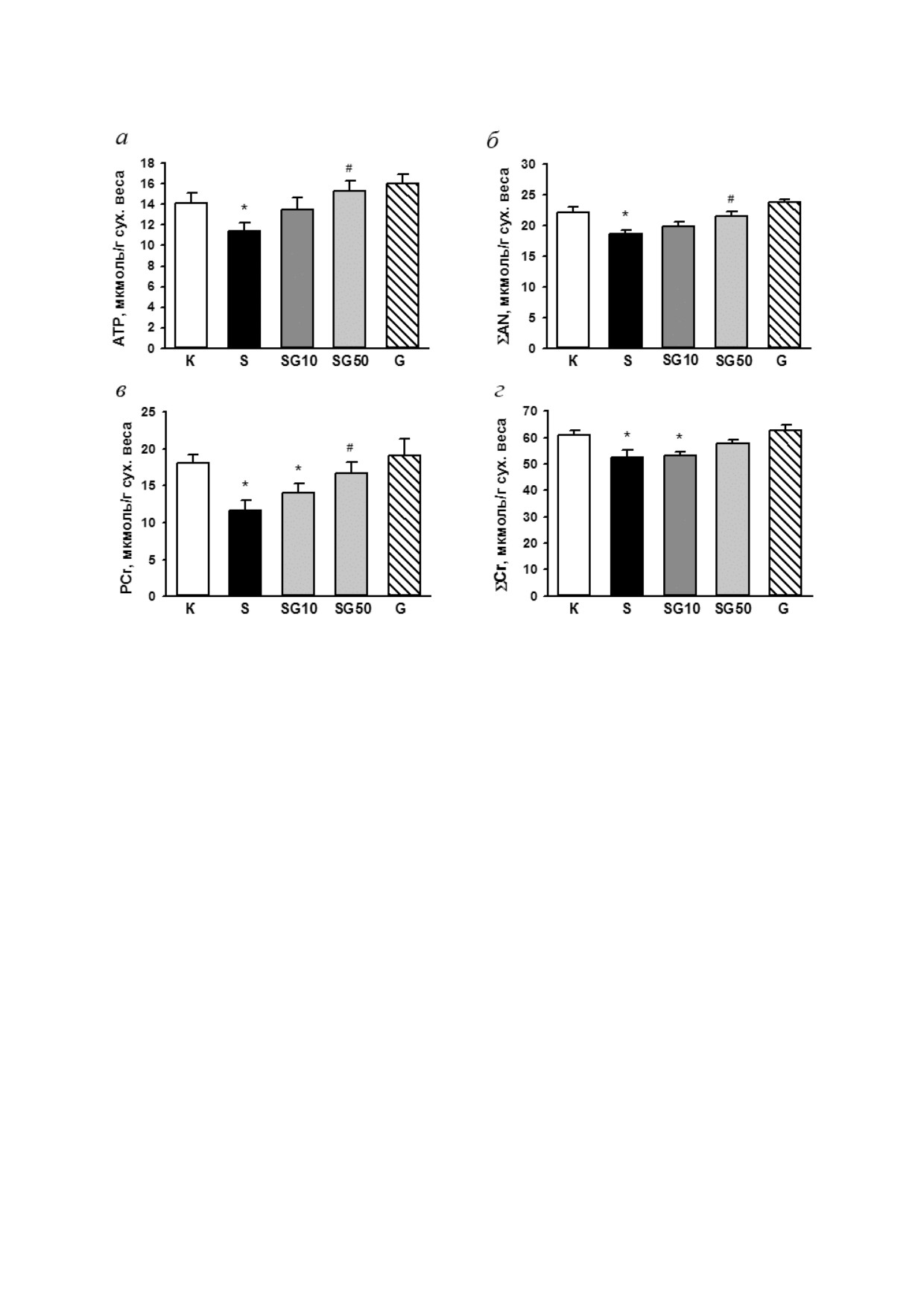
Рис. 3. Влияние пептида G на отношение PCr/АТP (а), содержание лактата (б), глюкозы (в) и отношение лактат/пиру
ват (г) в миокарде крыс в конце 4 недельного эксперимента. К - контроль, S - STZ, SG10 - STZ + G (10 нмоль/кг/cут.),
SG50 - STZ + G (50 нмоль/кг/cут.), G - пептид G (50 нмоль/кг/cут.). Данные представлены как M ± SEM для групп из
5 животных. Достоверное отличие (p < 0,05) от: * К, # S
ле (рис. 3, а). Содержание лактата в миокарде
цитах и в крови. Однако, несмотря на суще
крыс, получавших STZ, было в 2,5 раза выше,
ственное снижение уровня глюкозы в крови
чем в контроле (p = 0,015), глюкозы - повышено
крыс групп SG10 и SG50 по сравнению с груп
в 1,5 раза (p = 0,143), а отношение лактат/пируват
пой S (табл. 2), содержание глюкозы в сердце
было почти в 5 раз выше, чем в контроле. Эти
крыс групп SG10 и SG50 было выше, чем у диа
сдвиги соответствовали снижению аэробного об
бетических животных. Этот факт предполагает
разования энергии, ингибированию гликолити
её повышенное поглощение кардиомиоцитами
ческого потока и пируватдегидрогеназы [22].
под действием пептида G. В группах SG10
Введение крысам G в дозе 50 нмоль/кг/сут. в
и SG50 отношение лактат/пируват в сердце бы
течение 4 недель после введения STZ достовер
ло достоверно ниже, чем в диабетической груп
но повышало содержание АТP, ΣAN и PCr, пре
пе S (рис. 3, г), указывая на снижение отноше
дотвращало потерю ΣCr и восстанавливало от
ния NADH/NAD+ в цитозоле. Ежедневное вве
ношение PCr/АТP до значения, не отличающе
дение G (50 нмоль/кг/сут. в течение 4 недель) не
гося от контрольного. Сходный, но недостовер
оказывало достоверного влияния на содержание
ный эффект на эти показатели оказывало введе
указанных метаболитов в сердце по сравнению с
ние G в дозе 10 нмоль/кг/сут. Одновременно в
этими показателями в контрольной возрастной
группе SG50 отмечено достоверное снижение
группе.
накопление лактата до значений в контроле.
В группе SG10 уровень глюкозы в миокарде был
достоверно выше, чем у животных, получавших
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
только STZ. Отметим, что измеренное в наших
опытах содержание глюкозы в ткани сердца от
Действие G при STZ индицированном СД у
ражает её суммарное содержание в кардиомио крыс. В настоящей работе впервые показано за
БИОХИМИЯ том 87 вып. 3 2022
МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ГАЛАНИНА И ДИАБЕТ
437
щитное действие модифицированного N конце
тельные параметры митохондрий в пермеабили
вого фрагмента галанина WTLNSAGYLLGPβAH
зованных сапонином волокнах миокарда крыс,
на модели СД 1 го типа, вызванного введени
получавших STZ, используя в качестве субстра
ем STZ крысам. Поскольку STZ вызывает разру
тов глутамат и малат [32]. Оказалось, что у диабе
шение β клеток в островках поджелудочной же
тических крыс максимальное АDP стимулиро
лезы, приводящее к дефициту биосинтеза и сек
ванное дыхание и дыхательный контроль вдвое
реции инсулина, глюкоза крови становится не
снижены. Эти изменения митохондриального
доступной в качестве метаболического топлива
дыхания соответствовали снижению продукции
для тканей, чувствительных к инсулину [23].
АТP и ухудшению энергетического состояния
В этих условиях гипергликемия и низкая при
кардиомиоцитов. Напротив, крысы, получав
бавка массы тела являются типичными призна
шие STZ и галанин, обнаруживали отсутствие
ками животных, получавших STZ. Соответ
снижения дыхательного контроля за счёт увели
ственно, в наших опытах у крыс группы S наб
чения дыхания в состоянии 3, увеличениe содер
людалось снижение увеличения массы тела и
жания АТP и PCr в миокарде и предотвращение
стойкая гипергликемия в течение 4 недельного
потери внутриклеточного ΣCr. Принципиально
исследования. Совместное введение G и STZ
сходные метаболические эффекты, связанные со
увеличивало прибавку массы тела крыс в обеих
снижением нарушений энергетического обмена
пептидных группах SG10 и SG50 и снижало уро
в сердце, показаны в настоящей работе для хи
вень глюкозы в крови в группе SG50 к концу
мерного агониста рецепторов галанина G. Они
эксперимента практически до значений в конт
проявлялись в достоверно более высоком содер
роле. Улучшение гликемического контроля под
жании ATP, ΣAN, PCr и отношении PCr/ATP в
действием G свидетельствует о большей утили
сердце диабетических животных, защищённых
зации глюкозы клетками инсулин чувствитель
ежедневным введением высокой дозы G
ных тканей (преимущественно жировой и мы
(50 нмоль/кг/cут.) в течение 4 недель. В дополне
шечной ткани), которые играют важную роль в
ние, в группе SG50 наблюдалось снижение по
поддержании гомеостаза глюкозы.
терь ΣCr, отражающее меньшие повреждения
Гипергликемия, приводящая к избыточной
сарколеммы [33]: к окончанию эксперимента
продукции АФК и окислительному стрессу, яв
этот показатель достоверно не отличался от та
ляется ведущей причиной осложнений, связан
кового в контроле. Эти данные указывают на
ных с работой сердца, при СД [24, 25]. В частнос
способность фармакологического агониста ре
ти, показано, что снижение эффективности
цептора GalR2 воспроизводить влияние полно
окислительного фосфорилирования, происходя
размерного галанина, связывающегося со всеми
щее в ответ на гликирование и окислительный
тремя подтипами рецепторов GalR1-3, на энер
стресс, может предшествовать развитию диабе
гетику миокарда, повреждённого STZ.
тической кардиомиопатии [26, 27]. Несмотря на
Известно, что карбонильный стресс, выз
то что нарушения энергетики в диабетическом
ванный гипергликемией, приводит к усиле
сердце изучаются давно [26, 28], при СД 1 го ти
нию ПОЛ и окислительного повреждения из за
па они полностью не охарактеризованы и разли
увеличения образования перокси и гидрок
чаются в зависимости от модели [29], а действие
сильных радикалов [27, 34]. Участие ПОЛ в па
пептидов галанина практически не изучено. Не
тогенезе природного и индуцированного диабе
давнее исследование метаболомики в сердце
та хорошо подтверждено в многочисленных ра
крыс с диабетом, вызванным STZ, проведённое
ботах, а образование TBARS используется как
с помощью 1H ЯМР, показало, что, наряду с ин
наиболее распространённый индикатор ПОЛ
гибированием гликолиза, цикла трикарбоновых
при моделировании СД [21, 35]. В настоящем
кислот и усилением липидного обмена, проис
исследовании у крыс группы S наблюдалось
ходит снижение пулов АТP и Сr [30]. Результаты
значительное повышение уровня TBARS в плаз
настоящей работы указывают, что STZ индуци
ме. Однако введение G снижало этот показатель
рованный диабет у крыс вызывает также значи
в группах SG10 и SG50 до значений, не отлича
тельное снижение ΣAN, PCr и ΣCr и уменьшение
ющихся от исходного. Эти данные предполага
отношения PCr/ATP в сердце. Согласно данным
ют, что G может оказывать защитный эффект,
Нью Йоркской кардиологической ассоциации
ослабляя окислительный стресс, вызванный ги
(NYHA) по взаимосвязи между показателями
пергликемией. В настоящей работе о поврежде
биоэнергетики сердца и классами хронической
нии мембран кардиомиоцитов при STZ инду
сердечной недостаточности, низкое отноше
цированном диабете свидетельствовали не толь
ние PCr/АТP в миокарде человека может быть
ко потери ΣCr, но и повышение активности
предиктором смертности от сердечно сосудис
CK MB - специфического сердечного биомар
тых заболеваний [31]. Ранее мы оценили дыха
кёра - в плазме крови. Ежедневное введение G
БИОХИМИЯ том 87 вып. 3 2022
438
СТУДНЕВА и др.
в дозе 10 и 50 нмоль/кг/сут. поддерживало цело
агонистом M1145 снижает резистентность к ин
стность мембран кардиомиоцитов у диабетичес
сулину и способствует поглощению и метабо
ких животных, вероятно, за счёт улучшения
лизму глюкозы в скелетных мышцах, сердце и
энергетического состояния миокарда и сниже
адипоцитах посредством активации сигнально
ния ПОЛ, что подтверждает кардиопротектор
го пути PGC 1α/GLUT4 [38, 43]. Учитывая
ную эффективность этого пептида в использо
принципиально сходный характер действия га
ванной модели. В целом ряде работ показано,
ланина на модели диабета, вызванного STZ, у
что активности циркулирующих в крови CK MB
крыс [32], можно предположить, что перечис
и LDH повышены в моделях STZ индуцирован
ленные механизмы могут быть приложимы к
ной диабетической кардиомиопатии [36] и у па
эффектам пептида G - фармакологического
циентов с диабетом и могут служить маркёрами
агониста рецептора галанина GalR2, наблюдав
сердечно сосудистого риска и повреждения сер
шимся в настоящей работе.
дечной мышцы [37]. В конце 4 недельного экс
Важным свойством пептидов галанина яв
перимента мы обнаружили значительное повы
ляется их влияние на окислительный стресс.
шение активности LDH в плазме крови крыс,
В последние годы антиоксидантные свойства
получавших STZ, по сравнению с нормальными
галанина и его N концевых фрагментов наблю
животными. Это свидетельствовало о цитоток
дались в различных экспериментальных моде
сическом действии STZ не только на сердце, но
лях in vitro и in vivo. Фрагменты галанина (2-11)
и на другие органы и ткани крыс. Важно, что под
WTLNSAGYLL NH2 и (2-15) WTLNSAGYLL
действием пептида G активность обоих маркё
GPHA OH ингибировали апоптоз и избыточ
ров в плазме крови снижалась, что соответство
ное образование АФК в митохондриях в ответ
вало уменьшению уровня TBARS и, следова
на окислительный стресс в кардиомиобластах
тельно, интенсивности окислительного стресса.
крыс H9c2 [8, 9]. Внутривенное введение гала
Возможные механизмы действия G при СД.
нина, фрагмента галанина WTLNSAGYLL
Имеются данные о том, что галанин участвует в
GPHA OH или фармакологического агониста
регуляции чувствительности к инсулину и усвое
WTLNSAGYLLGPβAH OH (G) крысам после
нии глюкозы при СД 2 го типа [14-16]. Мыши
окклюзии коронарной артерии снижало образо
с нокаутом гена галанина характеризуются на
вание спиновых аддуктов гидроксильных ради
рушением утилизации глюкозы из за снижен
калов и TBARS в зоне риска левого желудочка
ного ответа на инсулин и независимой от инсу
сердца при реперфузии [44]. Этот эффект соче
лина элиминации глюкозы [38]. У здоровых
тался с ограничением размера инфаркта и мень
добровольцев и пациентов с диабетом наблюда
шим повреждением мембран кардиомиоци
ется положительная корреляция секреции гала
тов [10]. Кроме того, галанин, его природный N
нина с уровнем глюкозы в крови, что тесно свя
концевой фрагмент WTLNSAGYLLGPHA OH и
зано с чувствительностью к инсулину [39]. Бо
синтетический агонист G ингибировали Cu2+
лее того, галанин способен повышать чувстви
индуцированное свободнорадикальное окисле
тельность к инсулину за счёт увеличения
ние липопротеинов низкой плотности человека
экспрессии переносчика GLUT4 в кардиомио
in vitro [11]. Введение пептида G крысам с доксо
цитах и адипоцитах животных с диабетом 2 го
рубицин индуцированной кардиомиопатией
типа [15, 38]. Это способствует смещению
ослабляло ПОЛ в повреждённом миокарде за
GLUT4 в сарколемму, стимулируя поглощение
счёт повышения активности Cu,Zn супероксид
глюкозы клетками. Увеличение содержания
дисмутазы и глутатионпероксидазы, уменьшало
глюкозы в миокарде диабетических крыс, выз
дисфункцию митохондрий сердца и улучшало
ванное введением пептида G в наших опытах,
энергетическое состояние кардиомиоци
косвенно подтверждает эту возможность. За
тов [12, 13]. Вполне вероятно, что антиоксидант
пуск этого механизма критически важен, по
ная активность G могла быть причиной сниже
скольку экспрессия GLUT4 в сердце животных
ния окислительного повреждения у крыс, полу
с диабетом и диабетических пациентов сниже
чавших STZ, в наших экспериментах.
на [40]. Следовательно, поддержание концент
Наконец, активация путей передачи сигнала
рации белка GLUT4 должно способствовать
при связывании пептида G с рецептора
нормализации метаболизма и функций серд
ми GalR1-3 также могла способствовать умень
ца [41]. Хорошо известно, что коактиватор γ ре
шению повреждения клеток при СД [45]. Акти
цептора, активируемого пролифератором пе
вация рецепторов GalR1 и GalR2 стимулирует
роксисом 1α (PGC 1α), является важным регу
сигнальные пути, инициируемые митоген акти
лятором метаболизма глюкозы и экспрес
вируемыми протеинкиназами (MEK1/2 и
сии GLUT4 [42]. Недавние исследования пока
ERK1/2), что приводит к ингибированию от
зали, что активация рецепторов галанина GalR2
крытия митохондриальной поры временной
БИОХИМИЯ том 87 вып. 3 2022
МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ГАЛАНИНА И ДИАБЕТ
439
проницаемости (mPTP) и, таким образом, спо
ланина GalR2 WTLNSAGYLLGPβAH (G) обла
собствует выживанию клеток [46]. В дополне
дает рядом противодиабетических свойств у
ние, фосфорилирование ERK способствует по
крыс, получавших STZ. Введение G снижает ги
вышенной экспрессии рецепторов, активируе
пергликемию и окислительный стресс, умень
мых пероксисомными пролифераторами
шает метаболические нарушения миокарда и
(PPAR), контролирующими энергетический ме
повреждение мембран кардиомиоцитов. Мы
таболизм, включая и экспрессию PPARγ, стиму
считаем, что использование протеолитически
лирующего поглощение и окисление глюкозы
устойчивых модифицированных агонистов ре
кардиомиоцитами [47]. Связывание рецепто
цепторов галанина может быть многообещаю
ра GalR2 с белком Gq/11 активирует фосфоли
щей фармакологической стратегией защиты
пазу С и посредством гидролиза фосфатидили
сердца при диабете.
нозитолдифосфата регулирует гомеостаз Са2+,
что улучшает инотропное состояние сердца.
Нижние звенья этого сигнального пути вызыва
Финансирование. Работа выполнена при фи
ют фосфорилирование протеинкиназы B (Akt) и
нансовой поддержке Российского фонда фунда
ингибирование проапоптотических белков
ментальных исследований (гранты №№ 18 015
BAD/BAX, каспазы 3 и каспазы 9 [45]. Хотя
0008 а и 18 015 0009 а) и Министерства здраво
cигналинг, инициируемый G в клетках сердца,
охранения РФ (рег. № НИОКТР 121031700143 1).
остаётся неизученным, эти гипотетические ме
Конфликт интересов. Авторы заявляют об от
ханизмы способны усиливать адаптационную
сутствии конфликта интересов.
защиту диабетического миокарда.
Соблюдение этических норм. Исследование
выполнено в соответствии с международными
Это исследование предоставляет доказатель
и/или институциональными принципами ухода
ства того, что химерный агонист рецепторов га и использования животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Varma, U., Koutsifeli, P., Benson, V. L., Mellor, K. M.,
9. Pisarenko, O., Timotin, A., Sidorova, M., Studneva, I.,
and Delbridge, L. M. D. (2018) Molecular mechanisms of
Shulzhenko, V., et al. (2017) Cardioprotective properties of
cardiac pathology in diabetes - experimental insights,
N terminal galanin fragment (215) in experimental
Biochim. Biophys. Acta, 1864, 1949 1959, doi: 10.1016/
ischemia/reperfusion injury, Oncotarget,
8,
101659
j.bbadis.2017.10.035.
101671, doi: 10.18632/oncotarget.21503.
2.
Boudina, S., and Dale Abel, E. (2007) Diabetic car
10. Serebryakova, L., Pal’keeva, M., Studneva, I.,
diomyopathy revisited, Circulation,
115,
32133223,
Molokoedov, A., Veselova, O., et al. (2019) Galanin and its N
doi: 10.1161/CIRCULATIONAHA.106.679597.
terminal fragments reduce acute myocardial infarction in rats,
3.
Verma, S. K., Garikipati, V. N. S., and Kishore, R. (2017)
Peptides, 111, 127 131, doi: 10.1016/j.peptides.2018.05.001.
Mitochondrial dysfunction and its impact on diabetic
11. Pisarenko, O. I., Studneva, I. M., Serebryakova, L. I.,
heart, Biochim. Biophys. Acta, 1863, 1098 1105, doi.org/
Timoshin, A. A., Konovalova, G. G., et al.
(2021)
10.1016/j.bbadis.2016.08.021.
Antioxidant properties of galanin and its N terminal frag
4.
Maritim, A. C., Sanders, R. A., and Watkins, J. B. (2003)
ments in in vitro and in vivo oxidative stress modeling,
Diabetes, oxidative stress and antioxidants. A Review,
Biochemistry (Moscow),
86,
496505, doi:
10.1134/
J. Biochem. Mol. Toxicol., 17, 2438, doi: 10.1002/
S0006297921040106.
jbt.10058.
12. Studneva, I., Palkeeva, M., Veselova, O., Molokoedov, A.,
5.
Ullah, A., Khan, A., and Khan, I. (2016) Diabetes mellitus
Ovchinnikov, M., et al. (2019) Protective effects of a novel
and oxidative stress - a concise review, Saudi Pharmaceut. J.,
agonist of galanin receptors against doxorubicin induced
24, 547 553, doi: 10.1016/j.jsps.2015.03.013.
cardiotoxicity in rats, Cardiovasc. Toxicol., 19, 136 146,
6.
Raza, H., Prabu, S. K., John, A., and Avadhani, N. G.
doi: 10.1007/s12012 018 9483 x.
(2011) Impaired mitochondrial respiratory functions and
13. Studneva, I. M., Veselova, О. М., Bahtin, A. A.,
oxidative stress in streptozotocin induced diabetic rats,
Konovalova, G. G., Lankin, V. Z., et al. (2020) The mech
Internat. J. Mol. Sci., 12, 31333147, doi: 10.3390/
anisms of cardiac protection using a synthetic agonist of
ijms12053133.
galanin receptors during chronic administration of doxoru
7.
Webling, K. E. B., Runesson, J., Bartfai, T., and Langel, Ü.
bicin, Acta Naturae, 12, 20 29, doi: 10.32607/20758251
(2012) Galanin receptors and ligands, Front. Endocrinol.,
2020 12 1 89 98.
3, 146, doi: 10.3389/fendo.2012.00146.
14. Fang, P., Sun, J., Wang. X., Zhang, Z., Bo, P., et al. (2013)
8.
Timotin, A., Pisarenko, O., Sidorova, M., Studneva, I.,
Galanin participates in the functional regulation of the dia
Shulzhenko, V., et al. (2017) Myocardial protection from
betic heart, Life Sci., 92, 628 632, doi: 10.1016/j.lfs.2013.
ischemia/reperfusion injury by exogenous galanin frag
01.024.
ment, Oncotarget, 8, 21241 21252, doi: 10.18632/oncotarget.
15. He, B., Shi, M., Zhang, L., Li, G., Fang, P., et al. (2011)
15071.
Beneficial effect of galanin on insulin sensitivity in muscle
БИОХИМИЯ том 87 вып. 3 2022
440
СТУДНЕВА и др.
of type 2 diabetic rats, Physiol. Behav., 103, 284 289,
tozotocin induced diabetes mellitus rat model. 36th
doi: 10.1016/j.physbeh.2011.02.023.
Annual Meeting of the International Society for Heart
16.
Legakis, I. N. (2005) The role of galanin in metabolic dis
Research - European Section. Turin, Italy, Frontiers
orders leading to type 2 diabetes mellitus, Drug News Pers.,
Event Abstracts, pp. 129 130, doi: 10.3389/978 2 88971
18, 173 177, doi: 10.1358/dnp.2005.18.3.892762.
002 7.
17.
Азьмуко А. А., Веселова О. М., Молокоедов А. С., Ов
33.
Zervou, S., Whittington, H. J., Russell, A. J., and Lygate,
чинников М. В., Палькеева M. E. и др. (2018) Тетраде
C. A. (2016) Augmentation of creatine in the heart, Mini
капептиды, улучшающие восстановительную функ
Rev. Med. Chem.,
16,
1928, doi:
10.2174/
цию сердечно сосудистой системы при ишемии, Па
1389557515666150722102151.
тент № 2648846.
34.
Maritim, A. C., Sanders, R. A., and Watkins, J. B. (2003)
18.
Reaven, G. M., and Ho, H. (1991) Low dose streptozo
Diabetes, oxidative stress and antioxidants. A Review,
tocin induced diabetes in the spontaneously hypertensive
J. Biochem. Mol. Toxicol., 17, 24 38, doi: 10.1002/jbt.10058.
rat, Metabolism,
40,
335337, doi:
10.1016/0026
35.
Bayanes, J. W., and Thrope, S. R. (1999) Role of oxidative
0495(91)90141 i.
stress in diabetic complications: a new perspective on an old
19.
Bergmeyer, H. U. (1974) Methods of Enzymatic Analysis.
paradigm, Diabetes, 48, 1 9, doi: 10.2337/diabetes.48.1.1.
New York, Academic Press, pp. 1196 1200, 1475 1478,
36.
Hall, R. L. (1991) Clinical pathology of laboratory ani
1772 1776, 1777 1781, 2101 2110.
mals, in Animal Models in Toxicology (Gad, S. C., and
20.
Vanderlinde, R. E. (1985) Measurement of total lactate
Chengelis, C. P., eds.) New York, Marcel Dekker Inc.,
dehydrogenase activity, Ann. Clin. Lab. Sci., 15, 13 31.
pp. 765 811.
21.
Gulen, S., and Dincer, S. (2007) Effects of leptin on oxida
37.
Huang, E., Kuo, W., Chen, Y., Chen, T., Chang, M., et al.
tive stress in healthy and streptozotocin induced diabetic
(2006) Homocysteine and other biochemical parameters in
rats, Mol. Cell. Biochem., 302, 59 65, doi: 10.1007/s11010
type 2 diabetes mellitus with different diabetic duration or
007 9426 5.
diabetic retinopathy, Clin. Chim. Acta, 366, 293298,
22.
Stanley, W. C., Lopaschuk, G. D., James, G., and
doi: 10.1016/j.cca.2005.10.025.
McCormack, J. G. (1997) Regulation of energy substrate
38.
Fang, P., He, B., Yu, M., Shi, M., Zhu, Y., et al. (2018)
metabolism in the diabetic heart, Cardiovasc. Res., 34, 25 33.
Central galanin receptor 2 mediates galanin action to pro
23.
Saltiel, A. R., and Kahan, C. R. (2001) Insulin signaling
mote systemic glucose metabolism of type 2 diabetic rats,
and the regulation of glucose and lipid metabolism, Nature,
Biochem. Pharmacol., 156, 241 247, doi: 10.1016/j.bcp.
414, 799 806, doi: 10.1038/414799a.
2018.08.036.
24.
Dos Santos J. M., Tewari S., and Mendes R. H. (2019)
39.
Legalkis, I. N., Mantzouridis, T., and Mountokalakis, T.
The role of oxidative stress in the development of diabetes
(2007) Positive correlation of galanin with glucose in
mellitus and its complications, J. Diabetes Res., 2019,
healthy volunteers during an oral glucose tolerance test,
4189813, doi: 10.1155/2019/4189813.
Horm. Metab. Res., 39, 5355, doi: 10.1055/s 2006
25.
Varma, U., Koutsifeli, P., Benson, V. L., Mellor, K. M.,
957346.
and Delbridge, L. M. D. (2018) Molecular mechanisms of
40.
Gray, S., and Kim, J. K. (2011) New insights into insulin
cardiac pathology in diabetes - experimental insights,
resistance in the diabetic heart, Trends Endocrinol.
Biochim. Biophys. Acta Mol. Basis Dis., 1864, 1949 1959,
Metabol., 22, 394 403, doi: 10.1016/j.tem.2011.05.001.
doi: 10.1016/j.bbadis.2017.10.035.
41.
Tian, R., and Abel, E. D. (2001) Responses of GLUT4
26.
Verma, S. K., Garikipati, V. N. S., and Kishore, R. (2017)
deficient hearts to ischemia underscore the importance of
Mitochondrial dysfunction and its impact on diabetic
glycolysis, Circulation, 103, 29612966, doi: 10.1161/
heart, Biochim. Biophys. Acta Mol. Basis Dis., 1863, 1098
01.CIR.103.24.2961.
1105, doi: 10.1016/j.bbadis.2016.08.021.
42.
Wu, H., Deng, X., Shi, Y., Su, Ye, Wie, J., et al. (2016)
27.
Raza, H., Prabu, S.K., John, A., and Avadhani, N. G.
PGC 1α, glucose metabolism and type 2 diabetes mellitus,
(2011) Impaired mitochondrial respiratory functions and
J. Endocrinol., 229, R99 R115, doi: 10.1530/JOE 16
oxidative stress in streptozotocin induced diabetic rats,
0021.
Int. J. Mol. Sci.,
12,
31333147, doi:
10.3390/
43.
Fang, P., Shib, M., Guo, L., He, B., Wang, Q., et al. (2014)
ijms12053133.
Effect of endogenous galanin on glucose transporter 4
28.
Ferreira, F.M., Palmeira, C. M., Seica, R., Moreno, A. J.,
expression in cardiac muscle of type 2 diabetic rats,
and Santos, M. S. (2003) Diabetes and mitochondrial
Peptides, 62, 159 163, doi: 10.1016/j.peptides.2014.10.001.
bioenergetics: alterations with age, J. Biochem. Mol.
44.
Serebryakova, L., Studneva, I., Timoshin, A., Veselova, O.,
Toxicol., 17, 214 222, doi: 10.1002/jbt.10081.
Pal’keeva, M., et al. (2021) Galanin peptides alleviate
29.
Marciniak, C., Marechal, X., Montaigne, D., Neviere, M.,
myocardial ischemia/reperfusion injury by reducing reac
and Lancel, S. (2014) Cardiac contractile function and
tive oxygen species form, Inter. J. Peptide Res. Ther., 27,
mitochondrial respiration in diabetes related mouse mod
2039 2048, doi: 10.1007/s10989 021 10231 x.
els, Cardiovasc. Diabetol., 13, 118, doi: 10.1186/s12933
45.
Lang, R., Gundlach, A. L., Holmes, F. E., Hobson, S. A.,
014 0118 7.
Wynick, D., et al. (2015) Physiology, signaling, and phar
30.
Zhao, L., Dong, M., Xu, C., Zheng, H., Wei, T., et al.
macology of galanin peptides and receptors: three decades
(2018) Identification of energy metabolism changes in dia
of emerging diversity, Pharmacol. Rev., 67, 118175,
betic cardiomyopathy rats using a metabonomic approach,
doi: 10.1124/pr.112.006536.
Cell. Physiol. Biochem., 48, 934946, doi: 10.1159/
46.
Hausenloy, D. J., and Yellon, D. M. (2013) Myocardial
000491960.
ischemia reperfusion injury: a neglected therapeutic target,
31.
Lygate, C. A., and Neubauer, S. (2014) Metabolic flux as a
J. Clin. Invest., 123, 92 100, doi: 10.1172/JCI62874.
predictor of heart failure prognosis, Circ. Res., 114, 1228
47.
Jay, M. A., and Ren, J. (2007) Peroxisome proliferator
1230, doi: 10.1161/CIRCRESAHA.114.303551.
activated receptor (PPAR) in metabolic syndrome and
32.
Gataulin, R., Veselova, O., Studneva, I., Dobrokhotov, I.,
type 2 diabetes mellitus, Curr. Diab. Rev., 3, 3339,
et al. (2021) Cardioprotective effects of galanin in a strep
doi: 10.2174/157339907779802067.
БИОХИМИЯ том 87 вып. 3 2022
МОДИФИЦИРОВАННЫЙ ФРАГМЕНТ ГАЛАНИНА И ДИАБЕТ
441
CHIMERIC AGONIST OF GALANIN RECEPTOR GALR2 REDUCES HEART
DAMAGE IN RATS WITH STREPTOZOTOCIN INDUCED DIABETES
I. M. Studneva, O. M. Veselova, I. V. Dobrokhotov, L. I. Serebryakova, M. E. Palkeeva,
A. S. Molokoedov, A. A. Azmuko, M. V. Ovchinnikov, M. V. Sidorova, and O. I. Pisarenko*
National Medical Research Center for Cardiology, 121552 Moscow, Russia; e mail: olpi@live.ru
The neuropeptide galanin and its N terminal fragments reduce the formation of reactive oxygen species and normal
ize the metabolic and antioxidant state of the myocardium in experimental cardiomyopathy and ischemia/reperfusion
injury. This study aims to elucidate effect of WTLNSAGYLLGPβAH OH (G), a pharmacological agonist of galanin
receptor GalR2, on cardiac injury induced by administration of streptozotocin (STZ) to rats. Peptide G was prepared
by solid phase peptide synthesis using the Fmoc strategy and purified by preparative HPLC. Its structure was deter
mined using 1H NMR spectroscopy and MALDI TOF mass spectrometry. Animals were randomized into five
groups: C, control; S, SG10 and SG50 treated with STZ, STZ + G (10 nmol/kg/day) and STZ + G (50 nmol/kg/day)
and G healthy animals treated with G (50 nmol/kg/day). Administration of G prevented hyperglycemia in SG50 rats.
By the end of the experiment, the content of ATP, the total adenine nucleotide pool, phosphocreatine (PCr) and the
ratio of PCr/ATP in the myocardium of animals of the SG50 group were significantly higher than these values in the
S group. Simultaneously, in the SG50 and SG10 groups, the content of lactate and lactate/pyruvate ratio in rat
myocardium were reduced, while glucose content increased compared with those in group S. Both doses of G reduced
increased activity of creatine kinase MB and lactate dehydrogenase and reduced the concentration of thiobarbiturate
acid active products in the blood plasma of rats treated with STZ up to values not different from control. Taken
together, these results suggest that G has cardioprotective properties in type 1 diabetes mellitus. Possible mechanisms
of action of peptide G in STZ induced diabetes are discussed.
Keywords: galanin, heart, streptozotocin, myocardial metabolism, lipid peroxidation, cardiomyocyte membranes
БИОХИМИЯ том 87 вып. 3 2022