БИОХИМИЯ, 2022, том 87, вып. 4, с. 459 - 473
УДК 577.12
ОКИСЛИТЕЛЬНЫЙ СТРЕСС И РЕДОКС ЗАВИСИМЫЙ
СИГНАЛИНГ ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Обзор
© 2022
Е.В. Калинина1*, Л.А. Гаврилюк1, В.С. Покровский2
1 Российский университет дружбы народов, 117198 Москва, Россия; электронная почта: kalinina#ev@rudn.ru
2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, 115478 Москва, Россия
Поступила в редакцию 24.01.2022
После доработки 20.03.2022
Принята к публикации 20.03.2022
Возникновение и прогрессирование опухоли осложняется двойственной ролью активных форм кислоро
да (АФК) в этих процессах. Низкий уровень АФК необходим для многих внутриклеточных процессов мета
болизма и пролиферации клеток, тогда как значительный рост уровня АФК может нарушать механизмы их
регуляции, приводя к повреждению и гибели клеток. Длительный дисбаланс соотношения АФК/антиокси
данты и значительный рост уровня АФК на фоне снижения эффективности системы антиоксидантной за
щиты приводит к хроническому окислительному стрессу, вызывающему изменение редокс зависимой регу
ляции и потенцированию опухолевой прогрессии. Многочисленные данные демонстрируют развитие окис
лительного стресса при раке простаты, который является одним из наиболее распространенных онкологи
ческих заболеваний. Однако причины его возникновения, изменения редокс зависимого сигналинга и кле
точного редокстаза всё ещё остаются малоизученными. В обзоре рассматривается состояние прооксидант
ных и антиоксидантных ферментных систем, дисбаланс которых приводит к развитию окислительного
стресса при раке предстательной железы, оценивается изменение ключевых звеньев редокс зависимого
сигналинга и роль микроРНК в модуляции редокс статуса опухолевых клеток.
КЛЮЧЕВЫЕ СЛОВА: рак предстательной железы, окислительный стресс, антиоксидантные и прооксидант
ные ферменты, транскрипционные факторы Nrf2, NF κB, редокс зависимый сигналинг, микроРНК.
DOI: 10.31857/S0320972522040017, EDN: AQDUTG
ВВЕДЕНИЕ
развитие злокачественных новообразований
двойственное действие - либо инициируя онко
Согласно статистическим данным ВОЗ, за
генез и поддерживая пролиферацию опухолевых
болевания предстательной железы в последние
клеток, либо вызывая их гибель. Генетические
десятилетия представляют серьёзную проблему
изменения обеспечивают выживание опухоле
во многих странах. Рак предстательной желе
вых клеток в присутствии высоких уров
зы (РПЖ) является наиболее распространён
ней АФК вследствие роста активности редокс
ным онкологическим заболеванием, и по часто
зависимых факторов транскрипции или увели
те встречаемости он занимает второе место в
чения содержания NADPH благодаря актива
структуре онкологической смертности после ра
ции пентозофосфатного пути окисления глюко
ка лёгкого [1]. Окислительный стресс, воспале
зы [2]. Многочисленные публикации подтверж
ние и передача сигналов андрогеновыми рецеп
дают взаимосвязь между окислительным стрес
торами (AR) играют ключевую роль в инициа
сом и воспалением, указывая на роль дефицита
ции, развитии и прогрессировании РПЖ. Ак
антиоксидантов при развитии процессов воспа
тивные формы кислорода (АФК) оказывают на
ления и РПЖ [3, 4].
В клетках РПЖ обнаружен высокий уровень
окислительного стресса, который развивается в
Принятые сокращения: АФК - активные формы
кислорода; РПЖ - рак предстательной железы; AR - анд
результате дисбаланса между прооксидантами и
рогеновый рецептор; COX - циклооксигеназа; EGF - эпи
антиоксидантами и играет критическую роль в
дермальный фактор роста; EGFR - рецептор эпидермаль
развитии и прогрессировании РПЖ [5, 6]. Уста
ного фактора роста; JNK - c Jun N терминальная киназа; новлено, что на ранней стадии развития рака
LOX - липоксигеназа; NOX - NADPH оксидаза; NF κB -
опухолевые клетки подвергаются высокому
ядерный фактор κB; Nrf2 - NF E2 зависимый фактор 2;
STAT3 - сигнальный белок и активатор транскрипции 3;
окислительному стрессу (вследствие подавле
TRAMP - трансгенная аденокарцинома простаты.
ния активности антиоксидантных ферментов),
* Адресат для корреспонденции.
который может приводить в последующем к ус
459
460
КАЛИНИНА и др.
тановлению более высокого по сравнению с ис
состояние окислительного стресса, что приво
ходным уровнем соотношения АФК/антиокси
дит к адаптивной активации защитных анти
данты [7].
окислительных механизмов, позволяющих вер
Развитие РПЖ связано с изменением внут
нуть нарушенный баланс [10]. Длительный дис
риклеточного сигналинга, в том числе МАРК ,
баланс соотношения АФК/антиоксиданты и
Nrf2 , NF κB и AR зависимых сигнальных пу
значительный рост уровня АФК (на фоне сни
тей, контролирующих значительное число сиг
жения эффективности системы антиоксидант
нальных каскадов в опухолевой клетке и свя
ной защиты) приводит к хроническому окисли
занных с уровнем АФК [3, 6]. Однако характер
тельному стрессу, вызывающему повреждение
их взаимосвязи с клеточным редокс статусом
структуры белков, липидов, ДНК и развитие па
всё ещё остаётся малоизученным. Редокс зави
тологии клетки, включая злокачественные но
симая регуляция клеточных процессов в насто
вообразования [11-13].
ящее время рассматривается как многоуровне
Развитие окислительного стресса при РПЖ
вая система, включающая не только белки и
связано с дефицитом антиоксидантной защиты,
комплексы ферментов, но и некодирующие
обусловленным рядом причин (сопутствующие
РНК, среди которых значительную роль играют
хронические воспалительные процессы, дефи
многочисленные микроРНК, выполняющие
цит антиоксидантной диеты и др.), среди кото
роль онкогенов или онкосупрессоров, в том
рых лидирующая роль принадлежит старению
числе и посредством регуляции соотношения
организма. Статистически показано, что риск
прооксиданты/антиоксиданты в опухолевых
развития РПЖ значительно повышается у муж
клетках [8, 9]. Такая функция микроРНК вызы
чин старше 65 лет и связан со снижением уров
вает большой интерес в области исследования
ня антиоксидантной системы [7, 10]. Согласно
изменений клеточного редокс статуса при раз
свободно радикальной теории старения, с воз
витии РПЖ.
растом изменение прооксидантно/антиоксидант
В настоящем обзоре анализируется возник
ного баланса в сторону окислительного состоя
новение дисбаланса активности прооксидант
ния происходит во многих тканях [14], что по
ных и антиоксидантных ферментных систем,
вышает вероятность онкогенеза [15].
приводящее к развитию окислительного стрес
При старении организма наблюдается сни
са, оценивается состояние ключевых звеньев ре
жение экспрессии гена GSTP1, изоформы глута
докс зависимого сигналинга и роль мик
тионтрансферазы, обладающей высокой актив
роРНК в модуляции редокс статуса опухолевых
ностью по отношению к продуктам окислитель
клеток при РПЖ.
ного повреждения ДНК и перекисного окисле
ния липидов, что связано с повышением мети
лирования ДНК [16]. Установлено, что бога
АНТИОКСИДАНТНЫЕ,
тая CpG промоторная область гена pi класса
ПРООКСИДАНТНЫЕ ФЕРМЕНТЫ
GSTP1 метилирована по единичным сайтам
И РАЗВИТИЕ ОКИСЛИТЕЛЬНОГО СТРЕССА
рестрикции в большинстве клеток РПЖ в срав
В ОПУХОЛЕВЫХ КЛЕТКАХ РАКА
нении с нормальными клетками [17]. Потеря
ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
экспрессии GSTP1 из за гиперметилирования
промотора является наиболее частым эпигене
АФК образуются в процессах клеточного ме
тическим изменением, наблюдаемым при РПЖ
таболизма, играют важную роль в передаче сиг
человека. Снижение экспрессии GSTP1 может
налов клетками, участвуют в процессах регуля
способствовать повышению образования АФК
ции дифференцировки, пролиферации, био
и повреждению ДНК.
энергетики клеток. Среди основных источников
Злокачественная трансформация приводит к
генерации АФК выделяют «утечку» электронов
изменению соотношения оксиданты/антиокси
в дыхательной цепи митохондрий и электрон
данты благодаря адаптивной активации редокс
транспортной системе эндоплазматического ре
зависимых факторов транскрипции и соответ
тикулума с участием цитохромов Р450 и b5, ак
ствующему росту экспрессии антиоксидантных
тивность прооксидантных ферментов (NADPH
ферментов, нейтрализующих АФК до уровня,
оксидазы, ксантиноксидазы, L оксидаз амино
позволяющего опухолевым клеткам поддержи
кислот, моноаминооксидазы, липоксигеназы
вать высокую пролиферативную активность.
и др.), аэробные окислительно восстановитель
В опухолевых клетках РПЖ отмечается рост
ные реакции с ионами металлов (реакция Фен
экспрессии генов и активности ключевых анти
тона). В случае нарушения баланса АФК/анти
оксидантных ферментов. Прогрессирова
оксиданты, сопровождающегося ростом внут
ние РПЖ делает раковые клетки более зависи
риклеточного уровня АФК, в клетке возникает
мыми от антиоксидантных ферментов, в част
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
461
ности, таких как SOD, которая катализирует
При исследовании трансгенной аденокарцино
дисмутацию супероксид аниона до H2O2 [18].
мы простаты мышей (TRAMP) установлена бо
На основании данных, полученных in vivo, сде
лее высокая экспрессия гена NOX1 при интра
лан вывод, что p53 может регулировать экспрес
эпителиальной неоплазии предстательной же
сию SOD2 между ранней и поздней стадия
лезы с высокой степенью злокачественности по
ми РПЖ [19].
сравнению с опухолями с низкой степенью зло
Важным источником АФК в клетках РПЖ
качественности и нормальными эпителиальны
является активность изоформ NOX, принадле
ми клетками простаты [22]. Показано, что ак
жащих к семейству NADPH оксидазы [20]. Се
тивность изоформы NOX1 связана с инициаци
мейство NOX состоит из семи изоферментов
ей ангиогенеза путём активации VEGF в клетках
(NOX1-NOX5, DUOX1 и DUOX2), перенося
ксенотрансплантата РПЖ человека DU145 [21].
щих электроны от NADPH через мембраны на
В моделях на животных была установлена связь
молекулярный кислород с образованием супер
активности NOX1 с онкогенезом и развитием
оксид аниона.
злокачественной опухоли простаты [23]. Пока
Многочисленные данные указывают не
зано участие изоформы NOX1 в метастазирова
только на значимую роль NADPH оксидазы в
нии рака простаты [24]. Имеются сведения о ги
развитии РПЖ (табл. 1), но и на существование
перэкспрессии гена NOX1 в клетках РПЖ чело
противоречивых оценок роли отдельных изо
века в отличие от нормальной ткани проста
форм. Так, на ксенографтах у иммунодефицит
ты [24]. Однако в ряде работ не обнаружено су
ных мышей Balb/c nude показано, что сверх
щественных различий в уровнях мРНК NOX1 в
экспрессия гена NOX1 коррелировала с ростом
доброкачественных и злокачественных клетках
опухоли рака простаты человека DU145 [21].
простаты [25, 26].
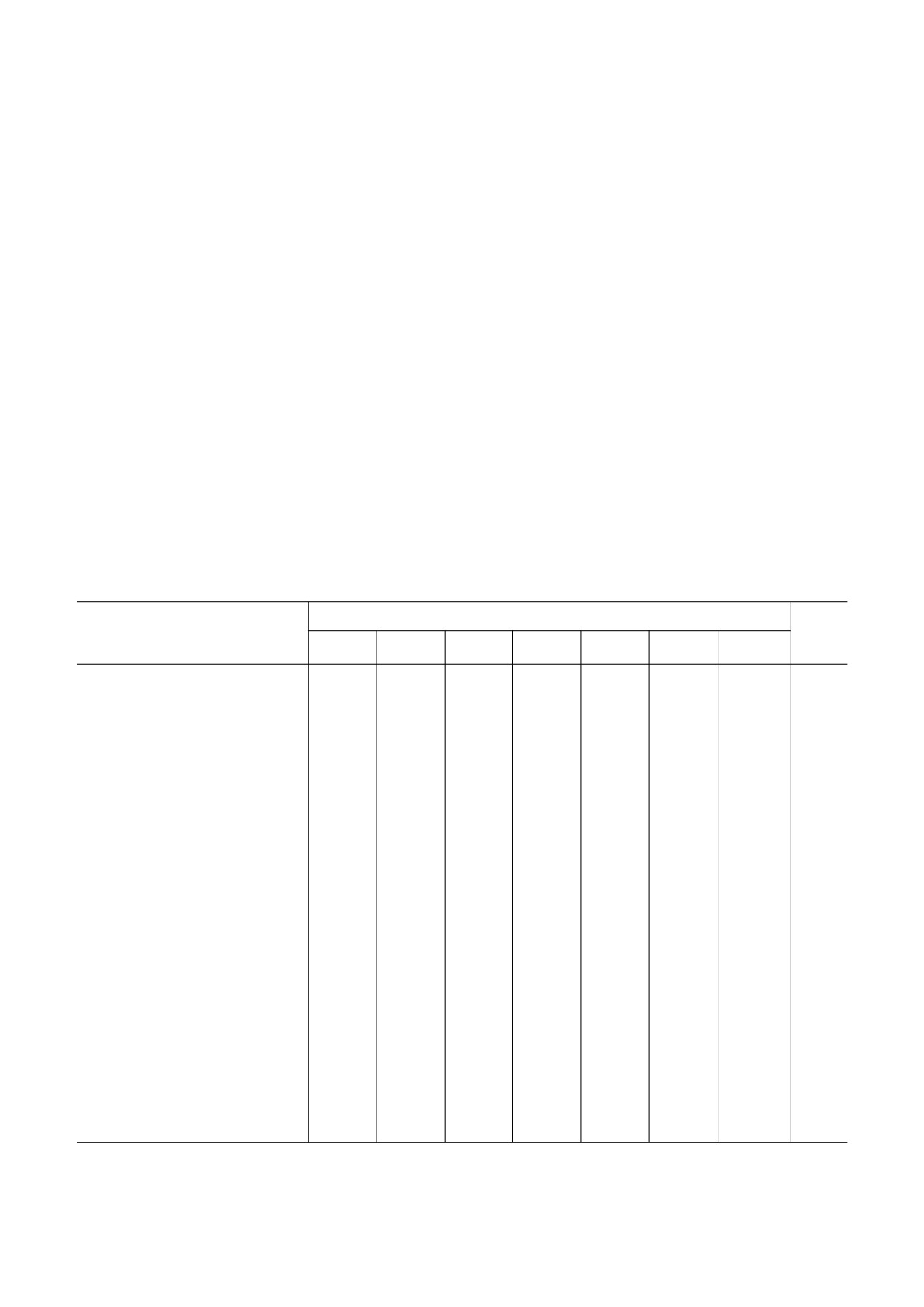
Таблица 1. Экспрессия изоформ NADPH оксидазы (NOX, DUOX) в линиях клеток и опухолевой ткани рака предстатель
ной железы
ИЗОФОРМЫ
Линия клеток/ткань опухоли
Ссылки
NOX1
NOX2
NOX3
NOX4
NOX5
DUOX1
DUOX2
PC 3
↑
↑
↑
↑
↑
↑
[2-29,
93, 94]
DU145
↑
↑
↑
↑
↑
↑
[27-29,
94, 95]
DU145, ксенографты у мышей
↑
[21]
VCaP
↑
↑
↑
[27-29]
U251
↑
[93]
LNCaP
↑
↑
↑
↑
[24, 27,
28, 94]
C4 2
↑
[96]
RWPE1, линия доброкачественных
↑
↑
↑
[28, 29]
эпителиальных клеток простаты
человека
EP156T, линия доброкачественных
↑
↑
↑
[29]
эпителиальных клеток простаты
человека
Аденокарцинома предстательной
↑
↑
↑
↑
[20, 24,
железы человека
28]
TRAMP, трансгенная аденокарци
↑
[22]
нома простаты, мыши C57BL/6
БИОХИМИЯ том 87 вып. 4 2022
462
КАЛИНИНА и др.
При исследовании пациентов со средней
и gp91phox NADPH оксидазы и генерацию
степенью пролиферации аденокарциномы
АФК изоформами NOX2 и NOX4 в андроген
простаты обнаружен низкий уровень экспрес
чувствительной линии клеток 22Rv1 [30]. По
сии гена NOX2 [25]. Также установлено, что
добно андрогенам, адипонектин вызывает су
экспрессия гена NOX2 в злокачественных тканях
щественное повышение экспрессии генов NOX2
простаты практически не отличается от уровня
и NOX4 в клетках РПЖ человека DU145 и
его экспрессии в доброкачественных тка
22Rv1 [31].
нях [26]. Таким образом, хотя в отдельных рабо
Определенный вклад в развитие окислитель
тах отмечается повышенная экспрессия ге
ного стресса вносят циклооксигеназа (COX) и
на NOX2 в клетках рака простаты по сравнению
липоксигеназа (LOX), благодаря активности ко
с неопухолевыми тканями, результаты многих
торых образуются гидроперекиси полиненасы
исследований in vivo указывают на отсутствие
щенных высших жирных кислот с последую
роли изоформы NOX2, как и NOX3, в разви
щим превращением в высокореакционноспо
тии РПЖ.
собные бифункциональные электрофилы - 4
Напротив, в клетках РПЖ отмечается повы
гидроксиноненали и 4 оксононенали, образую
шенная экспрессия гена NOX4. Так, обнаруже
щие сшивки в белках и ДНК [32]. Получены
но, что ген NOX4 гиперэкспрессируется в клет
убедительные доказательства, подтверждающие
ках РПЖ (DU145, PC 3 и LNCaP) в отличие от
роль катализируемого LOX метаболизма арахи
нормальной клеточной линии простаты [27].
доновой и линолевой кислот в развитии злока
Отмечается, что уровень мРНК NOX4 в клет
чественных новообразований [33-35]. Образу
ках РПЖ значительно выше, чем в клетках доб
ющийся уровень гидроперекисей жирных кис
рокачественных опухолей предстательной желе
лот в процессе метаболизма арахидоновой или
зы [26].
линолевой кислот влияет на регуляцию роста и
На основании отсутствия различий между
выживаемость клеток, ангиогенез, клеточную
экспрессией мРНК NOX5 в нормальных тканях
инвазию, метастазирование и иммуномодуля
предстательной железы человека и в тканях
цию.
РПЖ сделан вывод, что экспрессия мРНК
На основании данных, полученных с ис
NOX5 не является маркёром злокачественной
пользованием экспериментальных моде
трансформации [28]. Аналогичные результаты
лей РПЖ, предложено использовать изоформы
были получены в результате сравнения экспрес
5 LOX и 12 LOX, ингибиторы которых проявля
сии гена NOX5 в нормальных тканях предста
ют антипролиферативную активность, в качест
тельной железы человека и ткани РПЖ, что поз
ве биомаркёров этого типа злокачественных но
волило сделать вывод об отсутствии существен
вообразований [36, 37]. 12 LOX способствует
ного различия в уровнях экспрессии этого гена в
прогрессированию и метастазированию РПЖ.
злокачественных и доброкачественных тка
Обнаружено, что образующаяся в результате
нях [26].
действия 12 LOX на арахидоновую кислоту
Высокий уровень экспрессии гена DUOX1
12(S) гидроксиэйкозатетраеновая кислота вы
(изоформа NADPH оксидазы DUOX1 - двой
зывает активацию сигнального пути PI3K/AKT/
ная оксидаза, один из основных источников об
mTOR c последующим повышением экспрессии
разования Н2О2) наблюдается как в нормальной
гена транскрипционного фактора HIF 1α, что
ткани, так и в опухоли предстательной железы
приводит к усилению экспрессии гена фактора
человека. Однако у некоторых пациентов с
роста эндотелия сосудов VEGF, способствуя ак
РПЖ установлен рост экспрессии DUOX1 в клет
тивации его ангиогенного действия [36].
ках опухоли по сравнению с нормальными клет
Активность изоформы 5 LOX также играет
ками [25]. Высокий уровень экспрессии ге
важную роль в выживании и пролиферации кле
на DUOX2 обнаружен и в опухолевых клетках
ток РПЖ, поддерживая высокую экспрессию
DU145 [26]. Несмотря на то что роль DUOX
гена c#MYC. Ингибирование этой изофор
при РПЖ до конца не ясна, тем не менее отме
мы LOX резко подавляет экспрессию онкогена
чается, что уровень АФК при РПЖ в клет
c Myc в клетках опухоли [37].
ках PC 3 в значительной степени поддерживает
Опухоли РПЖ имеют более высокую экс
ся за счёт активности изоформ DUOX1 и
прессию гена изоформы 15 LOX 1 по сравне
DUOX2, при этом генерация АФК может приво
нию с нормальной тканью, и уровень экспрес
дить к появлению устойчивости клеток опухоли
сии совпадает с оценкой по шкале Глисона, тог
к апоптозу за счёт позитивной регуляции пере
да как экспрессия гена изоформы 15 LOX 2 по
дачи сигналов киназой AKT [29].
давлена в отличие от нормальной ткани [38].
Действие андрогенов при РПЖ вызывает по
Исследование влияния 15 LOX 1, 15 LOX 2 и их
вышение экспрессии генов субъединиц p22phox
метаболитов на зависимый от эпидермального
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
463
фактора роста (EGF) сигналинг в клетках PC 3
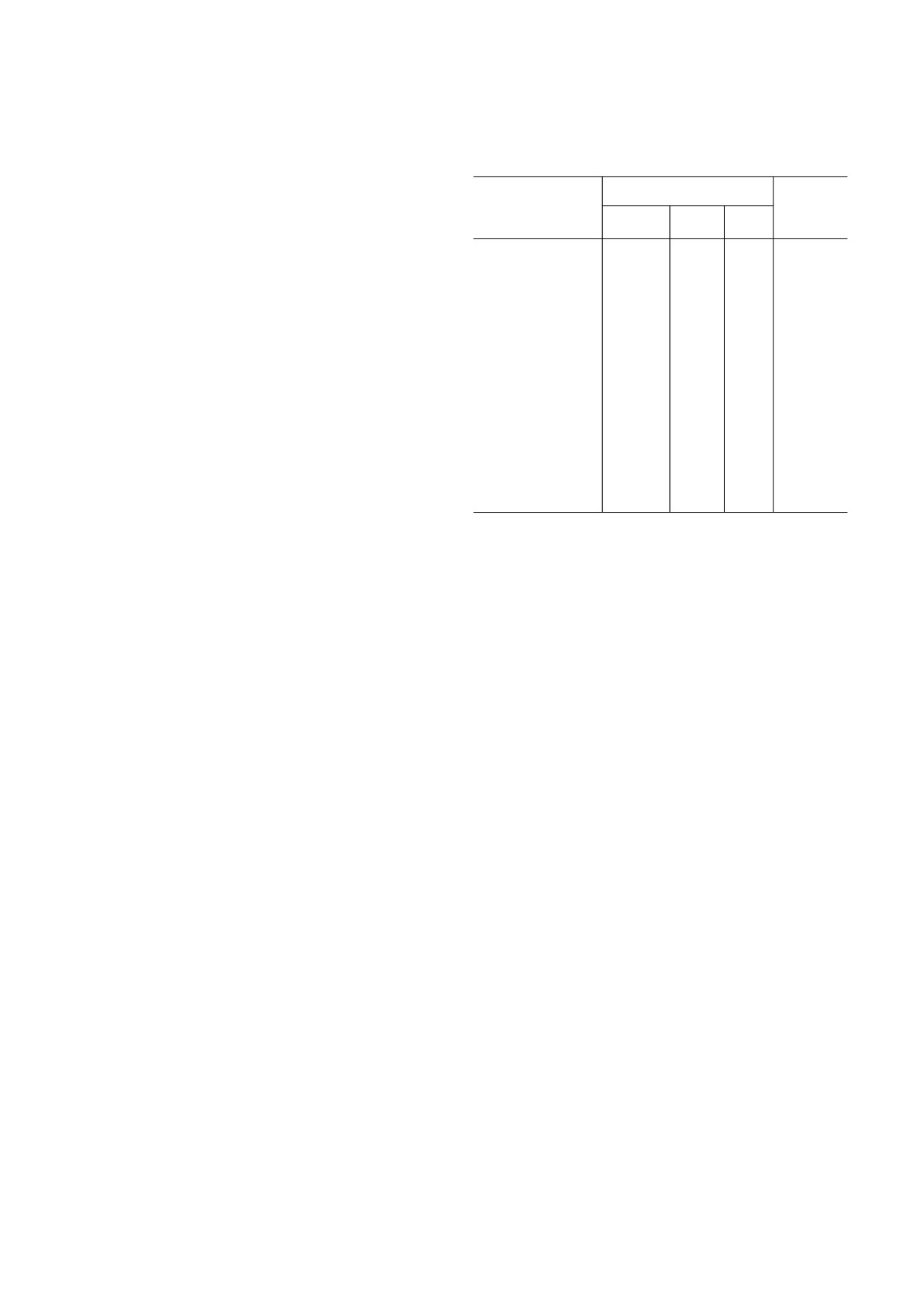
Таблица 2. Экспрессия изоформ липоксигеназы (LOX) в
линиях клеток и опухолевой ткани рака предстательной
позволило установить, что метаболит 15 LOX 1
железы человека
(13 (S) гидроксиоктадекадиеновая кислота) вы
зывает активацию киназы MAP, в то время как
ИЗОФОРМЫ
метаболит 15 LOX 2 (15 (S) гидроксиэйкоза
Линия клеток/
Ссылки
тетраеновая кислота) подавляет активность
ткань опухоли
15 LOX 1
12 LOX
5 LOX
MAPK, приводя к активации и подавлению
фосфорилирования PPARγ соответственно [38].
PC 3
↑
↑
↑
[34,
Авторами сделан вывод о разных, если не про
41-43]
тивоположных, биологических функциях изо
форм 15 LOX 1 и 15 LOX 2 в простате.
DU145
↑
↑
↑
[34, 41,
43]
Роль изоформ LOX в развитии опухолей
РПЖ человека в настоящее время установлена,
LNCaP
↑
[37]
несмотря на некоторые различия в механизме
их действия (табл. 2). Так, изоформа 12 LOX
РПЖ, ткань
↑
[40]
опухоли
рассматривается как прогностический мар
кёр РПЖ [39]. При оценке экспрессии гена
CD133+, стволовые
↑
[97]
12#LOX в опухолевой ткани пациентов с РПЖ
клетки РПЖ
обнаружен значительный её рост, который кор
релировал со степенью злокачественного роста,
CD44+, стволовые
↑
[97]
клетки РПЖ
что позволило сделать вывод об изоформе
12 LOX, как о маркёре агрессивного феноти
па РПЖ и плохого прогноза [40]. Повышенный
уровень экспрессии генов 5#LOX и 12#LOX обна
ружен в клеточных линиях PC 3 и DU145 [41].
генов как антиоксидантных ферментов, так и
Как в опухолевой ткани РПЖ человека, так и в
ферментов системы детоксикации и является
клетках РС 3 обнаружена повышенная экс
наиболее жизненно важным сигнальным путём,
прессия гена 15#LOX#1, уровень которой корре
используемым клетками для защиты от окисли
лирует со степенью злокачественности опухоли
тельного стресса [46].
[34, 42, 43].
При физиологических условиях Nrf2 связы
вается в цитоплазме с репрессорным бел
ком Keap1 (Kelch like ECH associated protein 1),
РЕДОКС ЗАВИСИМЫЙ СИГНАЛИНГ
который способствует его деградации с по
В ОПУХОЛЕВЫХ КЛЕТКАХ РАКА
мощью убиквитин протеасомного пути. Стрес
ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ. РОЛЬ
совые условия вызывают окисление остатков
Nrf , NF κB , JNK И AR ЗАВИСИМЫХ
цистеина Keap1, что приводит к предотвраще
СИГНАЛЬНЫХ ПУТЕЙ
нию убиквитинирования Nrf2 [47], способствуя
транслокации Nrf2 в ядро, где он вместе с не
Nrf2 сигнальный путь. Развитие хроническо
большими белками Maf связывается с антиок
го окислительного стресса при РПЖ, определя
сидант респонсивным элементом (ARE) или
емого в первую очередь высоким уровнем АФК,
MARE (MAF recognition elements) в промотор
приводит к определённому адаптивному изме
ной области более 250 генов мишеней. Среди
нению клеточного сигналинга, что сопровожда
установленных в настоящее время ARE содер
ется появлением так называемого «агрессивно
жащих генов, регулируемых Nrf2, находятся ге
го» фенотипа опухолевых клеток. Транскрипци
ны антиоксидантных ферментов Mn SOD
онный фактор Nrf2 (NF E2 зависимый фак
(SOD2), каталазы (CAT), гемоксигеназы 1 (HO1);
тор 2) является наиболее значимым в регуляции
гены ферментов, обеспечивающих поддержание
экспрессии генов ферментов как антиоксидант
внутриклеточного уровня низкомолекулярного
ной системы, так и системы детоксикации для
антиоксиданта GSH за счёт его синтеза de novo и
нормальных и опухолевых клеток
[44-46].
восстановления GSSG - H и L субъединицы γ
Nrf2 кодируется геном NFE2L2 и входит в се
глутамилцистеинсинтетазы (γ#GCSH, γ#GCSL),
мейство транскрипционных факторов CNC (се
γ глутамилтрансферазы (γ#Gt), глутатионредук
мейство факторов транскрипции со структурой
тазы (GSR); гены редоксинов - белков, участву
Cap «n» Collar, обладающих лейциновой «зас
ющих в редокс зависимой регуляции - тиоре
тежкой молнией»), включающее помимо Nrf2
доксина
1
(TRX1), тиоредоксинредуктазы
1
транскрипционные факторы NF E2, Nrf1, Nrf3,
(TRXRD1), пероксиредоксина 1 (PRDX1), перок
BACH1 и ACH2. Nrf2 контролирует экспрессию
сиредоксина 2 (PRDX2); гены других ферментов,
БИОХИМИЯ том 87 вып. 4 2022
464
КАЛИНИНА и др.
участвующих в детоксикации продуктов окис
Семейство транскрипционных факто
лительного стресса, в частности, изоформ глута
ров NF κB включает белки, образующиеся пу
тион S трансферазы
- GSTP1 1 (GSTP1),
тём гомодимерных или гетеродимерных комби
GSTA4 4 (GSTA4), гены NADPH:хиноноксидо
наций субъединиц p50, p52, p65/RelA, RelB и
редуктазы 1 (NQO1), H и L субъединиц ферри
c Rel. Для связывания с ДНК в белках служит
тина (H#Ferritin, L#Ferritin). Активация Nrf2, на
N концевой домен Rel, включающий около
ряду с другими редокс чувствительными тран
300 аминокислотных остатков. NF κB присут
скрипционными факторами, в частности АР 1
ствует в цитоплазме в комплексе с ингибито
и NF κB, может приводить к редокс зависимо
ром - белком IκB. Активация IκB киназного
му изменению их экспрессии, обеспечивая раз
комплекса (IKK), который состоит из субъеди
витие скоординированного ответа клетки на
ниц IKK α и IKK β, приводит к фосфорилиро
окислительный стресс. Согласно «реостатной»
ванию IκB. Фосфорилированные субъединицы
модели развития ответа на окислительный
ингибитора IκB в последующем подвергаются
стресс, первый уровень защитного ответа на
протеолизу, тогда как димеры NF κB переносят
действие умеренных концентраций АФК обес
ся из цитоплазмы в ядро клетки. NF κB контро
печивает активация Nrf2, более высокий уро
лирует экспрессию генов не только цитокинов,
вень АФК вызывает «включение» транскрипци
хемокинов, матриксных металлопротеиназ,
онных факторов AP 1 и NF κB, дальнейшее по
провоспалительных ферментов (таких как цик
вышение уровня АФК активирует механизмы
лооксигеназа 2, COX2), циклинов, антиапопто
апоптоза [2]. Предполагается, что транскрипци
тических и проангиогенных белков, но и генов
онный фактор 53 (p53), контролирующий кле
антиоксидантных (SOD1, SOD2, HO1) и проок
точный цикл, старение и апоптоз, осуществляет
сидантных ферментов (CYP2E1, NOX2, XOR,
финальный ответ на крайне высокие уров
NOS2, COX2, ALOX5 и ALOX12) [53], что может
ни АФК. Следует отметить, что при чрезмерном
способствовать развитию редокс зависимых пу
окислительном стрессе накопившийся в ядре
тей адаптации [2].
избыточный Nrf2 может связываться с регуля
Активация NF κB происходит при разных
торной областью промотора гена Klf9 (кодирую
типах злокачественных новообразований,
щего Kruppel подобный фактор 9) и активиро
включая рак простаты, и коррелирует с его прог
вать его экспрессию, что приводит к подавле
рессированием, химиорезистентностью и ме
нию экспрессии генов антиоксидантных фер
тастазированием [54]. Во многих случаях акти
ментов путём связывания Klf9 с их репрессив
вация гена мишени димерами NF κB посред
ными сайтами и вызывает клеточное поврежде
ством связывания со специфическими участка
ние в результате роста уровня АФК [48].
ми ДНК требует участия других факторов тран
NF κB сигнальный путь. Во многих случаях
скрипции, включая STAT, AP1, IRF и киназ сиг
развитие РПЖ сопровождается подавлением ак
нальных путей - mTOR, ERK1/2, JNK, p38,
тивности Nrf2. Так, снижение содержания Nrf2
PI3K, AKT, WNT [53].
обнаружено в процессе прогрессии трансгенной
Транскрипционные факторы NF κB и
аденокарциномы простаты мышей [49]. Сниже
STAT3 (сигнальный белок и активатор тран
ние экспрессии гена NFE2L2 в клетках опухо
скрипции 3) могут взаимодействовать как пози
ли РПЖ сопровождается высоким уровнем
тивно, так и негативно, регулируя, в частности,
окислительного стресса и повреждением
экспрессию генов пропролиферативных
ДНК [50]. Низкий уровень Nrf2 может способ
(cyclin D1, MYC) и антиапоптотических бел
ствовать процессу онкогенеза за счёт нарушения
ков (BCL XL, BCL 2), индуцибельной синтазы
защитных механизмов клетки, что связано с
оксида азота (Nos2)
[55]. Белки семейства
развитием воспаления. В определённой степени
STAT - транскрипционные факторы, которые
это обусловлено тем, что снижение активности
активируются при действии цитокинов и факто
Nrf2 может вызывать активацию транскрипци
ров роста, выполняя затем роль активаторов
онного фактора NF κB, способствующего раз
транскрипции генов. Установлено, что сниже
витию воспаления. Наличие трансрегулятор
ние экспрессии гена STAT3 связано с уменьше
ной («cross talking») связи Nrf2 с NF κB являет
нием объёма опухоли РПЖ и подавлением её ре
ся критическим звеном в интеграции окисли
цидива [56]. В опухолевых клетках предстатель
тельного стресса и воспаления [51]. Подавление
ной железы PC 3 ингибирование сигнального
экспрессии гена NFE2L2 увеличивает актив
пути сигналов Jak 1/STAT3 приводит к сниже
ность NF κB и продукцию цитокинов, тогда как
нию пролиферации и активации апоптоза [57].
NF κB может регулировать транскрипционную
В то же время обнаружено, что такой медиа
активность Nrf2 как положительно, так и отри
тор воспаления, как интерлейкин 8 (IL 8),
цательно [51, 52].
экспрессия которого значительно повышена в
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
465
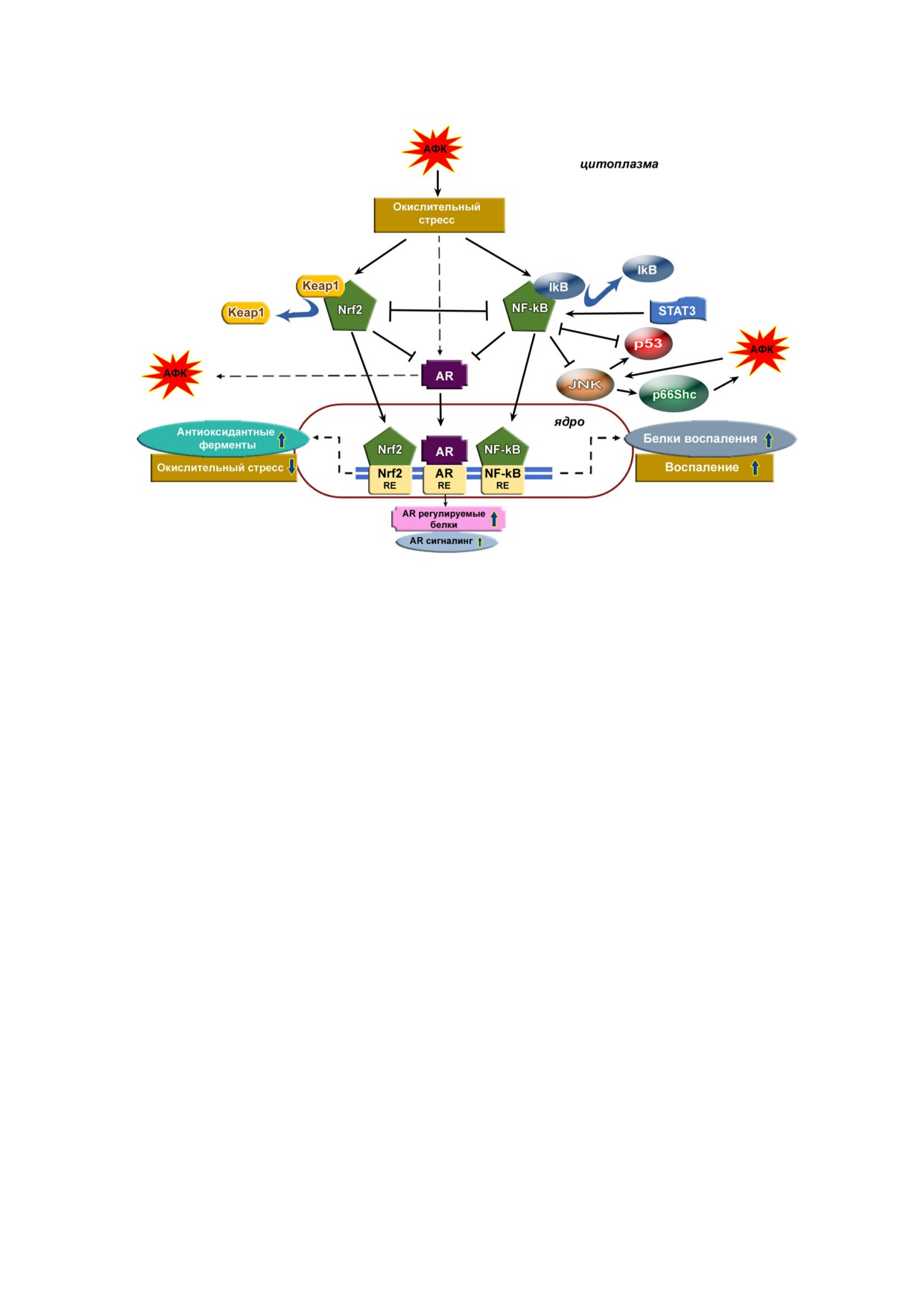
Редокс зависимая регуляция с участием Nrf2, NF κB, AR в опухолевых клетках при РПЖ. Тип редокс зависимой переда
чи сигналов при раке простаты зависит от уровня АФК и развития окислительного стресса. Действие средних концентра
ций АФК обеспечивает активацию Nrf2, тогда как более высокий уровень АФК вызывает «включение» транскрипцион
ного фактора NF κB и снижение экспрессии гена NFE2L2. Прогрессирование РПЖ связано с активацией сигнального
белка и активатора транскрипции 3 (STAT3) при повышении уровня АФК. NF κB и p53 могут взаимно подавлять тран
сактивацию друг друга. Инактивация p53 и активация NF κB способствуют устойчивости к запрограммированной гибе
ли клеток. Рост активности NF κB вызывает снижение активации c Jun N терминальной киназы (JNK), активирую
щей р53. Однако АФК могут активировать JNK путём фосфорилирования. В свою очередь, активация JNK, усиливая фос
форилирование белка p66Shc, вызывает повышение генерации АФК. Активация JNK и подавление Nrf2 усиливают акти
вацию AR. Активированный ростом АФК, NF κB может напрямую связываться с сайтом AR, снижая его связывание
с ДНК и влияние на транскрипцию регулируемых генов
клетках РПЖ и который может оказывать кан
приводить к повышенной генерации АФК, ак
церогенное и проангиогенное действие, стиму
тивации стресса эндоплазматического ретику
лирует пролиферацию клеток рака простаты и
лума и в конечном итоге апоптозу клеток рака
подавляет апоптоз за счёт активации сигнально
простаты [59].
го пути STAT3/AKT/NF κB [58]. IL 8 вызывает
Во многих видах опухолей транскрипцион
активацию фосфорилирования киназы AKT, ко
ные факторы NF κB и p53 могут антагонисти
торая активирует канонический путь NF κB,
чески регулировать активность друг друга [60].
усиливая фосфорилирование ингибиторной
Как p53, так и NF κB могут взаимно подавлять
субъединицы IκBα с её последующим отделени
трансактивацию друг друга и способность сти
ем от комплекса p50-p65-IκBα и транслокаци
мулировать экспрессию генов. Инактивация p53
ей p50-p65 в ядро.
связана с подавлением апоптоза, тогда как акти
Активность STAT3 может оказывать влияние
вация NF κB способствует устойчивости к за
на уровень АФК в опухолевых клетках. Так, ус
программированной гибели клеток [61]. Данные
тановлено, что эпидермальный фактор рос
клинических исследований указывают на высо
та (EGF) способствует прогрессированию РПЖ
кую экспрессию NF κB/p65/RelA, NF κB/p50/
через сигнальный каскад АФК/STAT3/HIF 1α/
RelB и cRel наряду со снижением активнос
TWIST1/N кадгерин, что связано с активаци
ти p53 в образцах первичных и метастатических
ей STAT3 и повышением уровня АФК, и, как
опухолей РПЖ [62]. Несмотря на то что мута
полагают авторы, указывает на новые биомаркё
ции p53 обнаруживаются на ранней стадии рака
ры и терапевтические мишени. В то же время
простаты, установлено, что более высокая час
показано, что ингибирование STAT3 может
тота мутации p53 наблюдается при метастати
БИОХИМИЯ том 87 вып. 4 2022
466
КАЛИНИНА и др.
ческом раке простаты поздних стадий по срав
подавление АФК зависимого пролиферативно
нению с локализованными опухолями [63]. Му
го эффекта в опухолевых клетках простаты PC 3.
тации p53 приводят к нарушению регуляции
Подобный эффект вызывал ингибитор JNK1
клеточного цикла, вызывая аномальную проли
SP600125, который оказывал сильное антипро
ферацию и злокачественную трансформацию
лиферативное действие на культуре клеток PC 3
[64]. Также следует отметить, что высокий уро
[26]. В то же время обнаружено, что С подоб
вень белка р53 в клетках РПЖ тесно связан с
ный белок LanCL1 (lanthionine synthase C like
пролиферацией, миграцией и способностью к
protein 1), член семейства LanCL, защищает
адгезии. В клетках рака простаты DU145 p53 вы
клетки РПЖ LNCaP и PC 3 от окислительного
зывает активацию пути FAK/Src и повышение
стресса и способствует пролиферации клеток,
уровней фосфорилирования JNK и ERK [65]. В
снижая гибель клеток за счёт подавления сиг
то же время обнаружено, что полифенол ресве
нального пути JNK [73].
ратрол индуцирует апоптоз посредством переда
Регулируя антипролиферативную актив
чи сигналов по пути HIF 1α/АФК/p53 в клет
ность, JNK1 может подавлять РПЖ. Так, пока
ках РПЖ TRAMP, что связано с повышенным
зано, что нокдаун серин/треониновой протеин
уровнем p53 и АФК [66].
фосфатазы 5 может способствовать фосфорили
JNK сигнальный путь. Рост активности NF
рованию JNK1, что приводит к ингибированию
κB вызывает снижение активации киназы JNK
пролиферации опухолевых клеток PC 3, DU145
за счёт активации белков GADD45β, XIAP,
и 22Rv1 [74]. Однако, с другой стороны, кина
A20 [67]. Активность JNK, как одного из сиг
зы JNK могут напрямую перемещаться в мито
нальных путей MAPK, является необходимым
хондрии при различных стрессовых условиях и
фактором для роста карциномы простаты как
активировать генерацию АФК и гибель кле
in vitro, так и in vivo, что делает её новой ми
ток [75]. Обнаружено, что действие ригосертиба
шенью в терапии РПЖ [68]. Среди киназ семей
(также известного как ON01910 или Estybon,
ства JNK, также известного как стресс активи
синтетический бензилстирилсульфон) приво
руемые MAP киназы (SAPK) и включающего
дит к активации JNK1/2, которая, в свою оче
три киназы - JNK1, JNK2, JNK3, в клетках
редь, активирует белок p66Shc и вызывает повы
предстательной железы JNK1 и JNK2 экспрес
шение генерации АФК в митохондриях опухо
сируются на низком и среднем уровне, и их
левых клеток простаты PC 3 и DU145 [76]. Фос
экспрессия значительно увеличивается при
форилирование p66Shc, прооксидантной изо
РПЖ [68, 69].
формы семейства адаптерных белков ShcA,
JNK участвует в контроле широкого спектра
по Ser36 с помощью JNK1/2 приводит к усиле
клеточных процессов, включая апоптоз, проли
нию переноса электронов от цитохрома c на мо
ферацию, миграцию, выживание, дифференци
лекулярный кислород, тем самым активируя об
ровку, воспаление. АФК, наряду с другими фак
разование АФК [77]. Действие p66Shc может
торами, включая цитокины, патогены, факторы
также усиливать генерацию АФК за счёт роста
роста, могут активировать JNK путём фосфори
содержания NOX и/или нарушения соотноше
лирования [70]. Две расположенные выше MKK
ния внутриклеточных уровней антиоксидант
протеинкиназы (МKK4 и MKK7) активируют
ных ферментов в результате подавления актив
фосфорилирование JNK по Thr183 и Tyr185 [71]
ности фактора транскрипции FOXO [78].
и, в свою очередь, активируются серин/треони
AR сигнальный путь. Активация JNK сиг
новыми протеинкиназами, включая груп
нального пути приводит к усилению фосфори
пу MEKK, группу протеинкиназ смешанного
лирования андрогенового рецептора по остат
происхождения - MLK, семейство киназ, регу
ку Ser650 в клетках LNCaP, что способствует
лирующих сигнал апоптоза - ASK, киназы
экспорту AR в цитоплазму, однако снижает его
TAK1 и TPL2 [72]. Среди белков мишеней, ко
транслокацию в ядро [68]. Активность AR как
торые активирует JNK, обнаружены транскрип
транскрипционного фактора важна для прог
ционные факторы STAT1 и STAT3, p53, c Myc,
рессии РПЖ. Связывание андрогенов с AR при
Elk1, ATF 2, NFAT, а также контролирующие
водит к активации опухолевого роста, метаста
апоптоз белки митохондриального семейства
зированию и подавлению апоптоза опухолевых
Bcl 2 (Bcl 2, Bad, Bim, Bax) [68].
клеток. Связь активности AR с уровнем АФК в
Роль JNK зависимой передачи сигналов при
опухолевых клетках РПЖ имеет двойственный
раке простаты неоднозначна и, по видимому,
характер: с одной стороны, АФК могут стимули
зависит от уровня АФК и развития окислитель
ровать ядерную транслокацию AR и его тран
ного стресса. Обнаружено, что снижение внут
скрипционную активность, с другой стороны,
риклеточного уровня NOX5 вызывало снижение
активируемый AR, внутриклеточный сигналинг
фосфорилирования JNK1/3 и, как следствие,
может приводить к активации прооксидантных
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
467
ферментных систем [79]. Между AR респонсив
зу (SOD2), глутатионпероксидазу 2 (Gpx2) и тио
ными элементами и сайтами связывания NF κB
редоксинредуктазу 2 (TrxR2), составляют пер
в промоторной области гена существует пере
вичную систему антиоксидантной защиты в ми
крывание, поэтому активированный ростом
тохондриях, внося существенный вклад в под
АФК транскрипционный фактор NF κB может
держание редокс баланса, необходимого для
напрямую связываться с сайтом AR, изменяя
функциональной активности митохондрий.
его связывание с ДНК и влияние на транскрип
В клетках РПЖ установлена способность miR
цию регулируемого гена [80]. Рост АФК поло
17 3р подавлять активность всех трёх фермен
жительно влияет на содержание AR, усиливая
тов: SOD2, Gpx2 и TrxR2. Трансфекция miR 17
экспрессию гена AR, повышая стабилизацию
3р в клетках PC 3 (агрессивный тип РПЖ) вы
мРНК и Prx1 опосредованную стабилизацию
зывала значительное снижение содержания всех
белка [81]. Значительное повышение содержа
трёх ферментов и повышала чувствительность
ния Nrf2 приводит к подавлению экспрессии ге
клеток РПЖ РС 3 к действию ионизирующего
на и функции AR в клетках РПЖ за счёт сниже
излучения [85]. Кроме того, авторами отмечает
ния уровня АФК [82].
ся, что повышение экспрессии гена miR#17#3p
может приводить к подавлению отдалённого
эффекта индуцирующего действия ионизирую
РОЛЬ микроРНК В РЕГУЛЯЦИИ
щей радиации на экспрессию генов SOD2, GPX2,
КЛЕТОЧНОГО РЕДОКСТАЗА
TXNRD2 и, как следствие, сопровождаться сни
ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
жением пролиферации опухолевых клеток за
счёт значительного роста уровня АФК и сниже
В настоящее время особый интерес вызыва
ния митохондриального дыхания [85]. Одним из
ет роль микроРНК в патогенезе различных забо
механизмов терапии опухолей является актива
леваний. МикроРНК представляют собой класс
ция генерации АФК при воздействии облучения
коротких одноцепочечных некодирующих
или химиотерапии. Применение препарата
РНК, подавляющих экспрессию генов на пост
LQB 118 (птерокарпанхинона), индуцирующего
транскрипционном уровне посредством комп
образование АФК и обладающего противоопу
лементарного спаривания оснований с 30 нетранс
холевой активностью, на линиях клеток РПЖ -
лируемыми областями (UTR) мРНК мишеней,
PC 3, LNCaP и LAPC4, и подкожных опухолях
ингибируя их трансляцию и/или вызывая их
ксенографтах РС 3, привитых самцам Balb/c
деградацию [83]. Учитывая тот факт, что мик
nude, приводило к адаптивному повышению ак
роРНК участвуют в регуляции важных для жиз
тивности SOD1. В исследуемых клетках РПЖ
неспособности клеток процессов, включая про
действие трёх микроРНК - miR 206, miR 1 и
лиферацию, дифференцировку и запрограмми
miR 101 - вызывало снижение внутриклеточ
рованную гибель клеток, становится необходи
ного содержания SOD1 [86]. Однако эффектив
мым исследование их роли в механизме разви
ность каждой микроРНК в снижении активнос
тия многих заболеваний, включая злокачествен
ти SOD1 и повышении чувствительности к ци
ные новообразования [83]. Всё большее число
тотоксическому действию LQB 118 значительно
данных свидетельствует в пользу значимого
варьировала между линиями клеток РПЖ.
вклада микроРНК в механизм регуляции кле
Мишенью miR 193a 5p при РПЖ может
точного редокс гомеостаза в опухолевых клет
быть гемоксигеназа (HO 1), играющая важную
ках и модуляцию злокачественного роста на раз
роль в системе антиоксидантной защиты и ре
ных стадиях онкогенеза [84]. Вопросы взаимо
докс зависимом сигналинге. В опухолевых тка
связи микроРНК и внутриклеточных редокс
нях РПЖ обнаружено значительное повышение
систем при РПЖ становятся актуальными и для
содержания miR 193a 5p, которое коррелирова
исследований, касающихся поиска мишеней
ло с активностью HO 1 [87]. В клетках РПЖ че
для терапевтического воздействия на опухоле
ловека (LNCap, PC 3 и DU145) установлено,
вые клетки особенно при агрессивном, устойчи
что повышение экспрессии гена miR#193a#5p
вом к лечению РПЖ (табл. 3).
сопровождается ростом содержания HO 1 по
Высокая скорость метаболизма быстро про
сравнению с нормальными эпителиальными
лиферирующих раковых клеток характерна для
клетками предстательной железы RWPE 1, тог
повышенного внутриклеточного уровня генера
да как использование ингибитора miR 193a 5p
ции АФК прооксидантными ферментными сис
приводило к снижению содержания HO 1. При
темами, среди которых лидирующая роль при
исследовании действия противоопухолевого
надлежит дыхательным комплексам митохонд
препарата доцетаксела, используемого в тера
рий I и III. Митохондриальные ферменты,
пии пациентов с метастазами РПЖ, на клетки
включая Mn зависимую супероксиддисмута
РС 3 ксенографта РПЖ, привитых подкожно
БИОХИМИЯ том 87 вып. 4 2022
468
КАЛИНИНА и др.
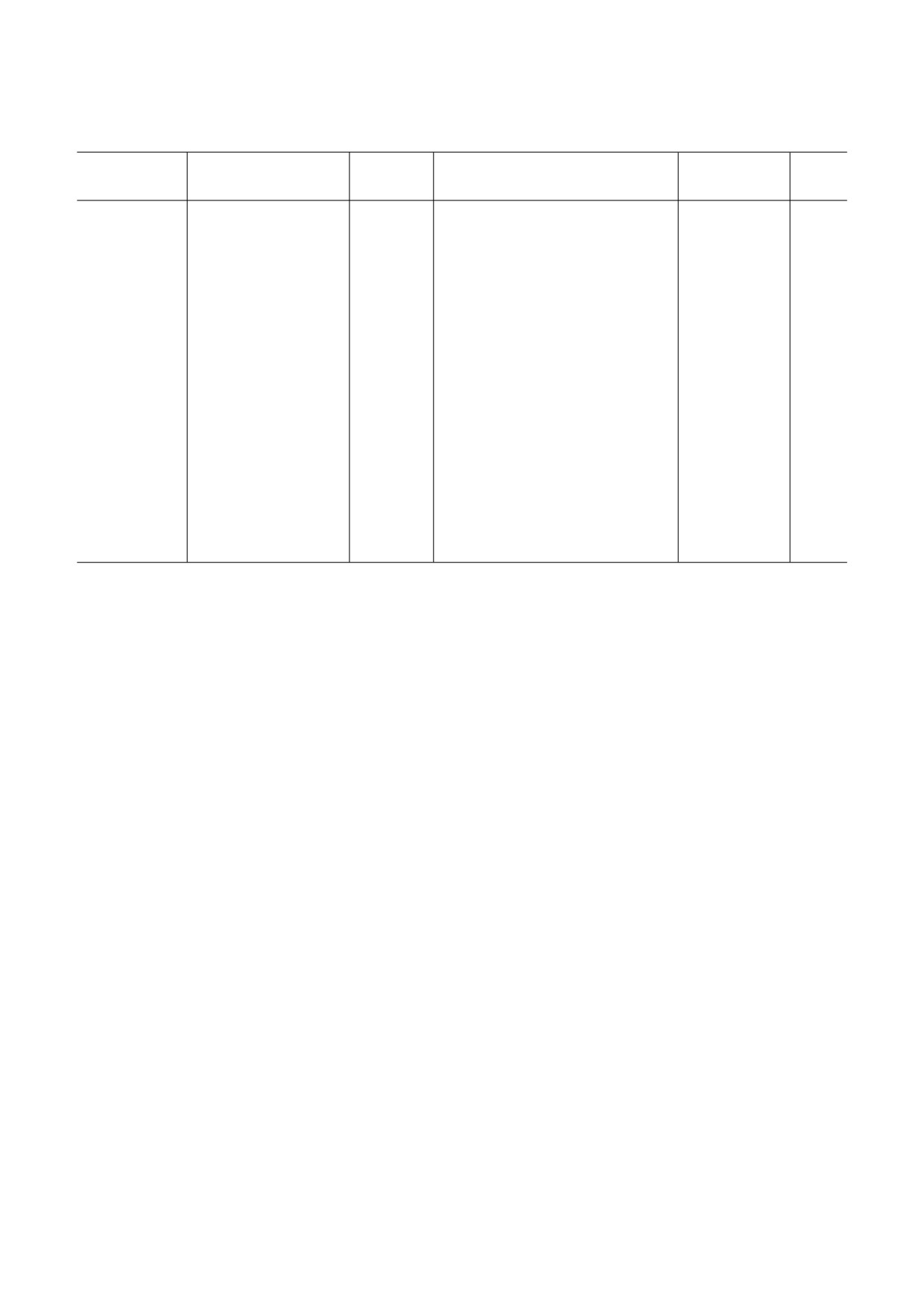
Таблица 3. МикроРНК, участвующие в регуляции редокс статуса опухолевых клеток рака предстательной железы
МикроРНК
Мишень
Активность
Клетки/опухолевая ткань
Эффект
Ссылки
фермента
miR 17 3р
GPх2
↓
РС 3
проонкогенный
[85]
TrxR2
↓
SOD2
↓
miR 521
SOD2
↓
LNCaP
проонкогенный
[98]
miR 206,
SOD1
↓
PC 3, LNCaP, LAPC4
проонкогенный
[86]
miR 1,
РС 3, ксенографт мыши
miR 101
miR 193a 5p
НО 1
↑
РС 3
проонкогенный
[87]
РПЖ ткань опухоли человека
РС 3, ксенографт мыши
miR 101
COX 2
↑
LNCaP, РС 3
проонкогенный
[91]
miR 205
COX 2
↑
РПЖ ткань опухоли человека, РС 3
проонкогенный
[99]
miR 21
NADPH оксидаза (р47)
↑
PC 3M MM2
проонкогенный
[88]
miR 137
NOX4
↑
РС 3
проонкогенный
[100]
miR 23b
NOX4
↑
LNCaP
проонкогенный
[90]
мышам Balb/c nude, установлено, что препарат
Низкий уровень экспрессии гена miR#137 и,
вызывает развитие окислительного стресса, при
напротив, высокий уровень содержания изо
котором рост экспрессии гена miR#193a#5p соп
формы NADPH оксидазы NOX4 обнаружены в
ровождается повышением содержания HO 1,
опухолевых клетках РС 3, что является важной
вызванного снижением содержания репрессора
особенностью для прогрессии РПЖ [89]. Повы
гена HO1 в результате связывания miR 193a 5p с
шение уровня miR 137 способствует снижению
3′ UTR областью мРНК Bach2 [87].
содержания NOX4 и Bcl 2 в клетках РС 3 и при
К онкогенным микроРНК, способствую
водит к повышению содержания каспаз 3, 8 и 9,
щим инвазивному росту опухоли, относится
белков PARP и Bax, подавлению пролиферации
miR 21, обнаруженная в процессе канцерогене
и активации апоптоза опухолевых клеток [89].
за при РПЖ. В опухолевых тканях пациентов с
NOX4 может быть мишенью также для miR 23b
метастатическим РПЖ обнаружены высокие
при РПЖ. Так, в клетках РС 3 снижение содер
уровни miR 21, p47 (phox) и АФК при снижении
жания miR 23b приводит к повышению внут
содержания белка программируемой клеточной
риклеточного уровня NOX4 [90].
смерти 4 (PDCD4, programmed cell death 4) [88].
Хроническое воспаление связано с окисли
В андроген независимых клетках РПЖ (PC
тельным стрессом и онкогенезом и часто может
3M MM2) выявлена высокая экспрессия ге
ему предшествовать. COX 2, ключевой регуля
нов miR#21 и p47 (цитозольная субъединица
тор уровня простагландинов, способствует про
NADPH оксидазы). Трансфекция клеток с ан
лиферации и росту клеток, и повышение
ти miR 21 и p47 приводила к снижению экс
экспрессии гена COX#2 часто обнаруживается в
прессии генов miR#21 и p47 с одновременным
опухолевых тканях РПЖ. Установлено, что miR
повышением содержания PDCD4 и уменьшени
101 подавляет образование COX 2 путём связы
ем инвазивности клеток РПЖ. Кроме того, но
вания с 3′ нетранслируемой областью (3′ UTR)
каут гена p22phox (мембранносвязанная субъ
мРНК COX 2 [91]. Между уровнем miR 101 и
единица NADPH оксидазы) также приводил к
уровнем белка СОХ 2 в линиях клеток РПЖ
снижению уровня miR 21 и подавлению метас
(BPHCAFTD, LNCap, PC 3) наблюдалась обрат
тазирования клеток РПЖ. Использование как
ная корреляция. MiR 101 не только может сни
хлорида дифенилениодония
- ингибитора
жать содержание белка COX 2, но одновремен
NADPH оксидазы, так и антиоксиданта N аце
но понижает уровень EGFR, рецептора эпидер
тилцистеина вызывало снижение экспрессии
мального фактора роста, в культивируемых
гена miR#21 [88].
клетках BPH1CmiR101 и тканях ксенографтах этих
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
469
клеток [91]. EGFR, который находится на поверх
дуляции редокс зависимого баланса принадле
ности клетки и активируется лигандом, ини
жит микроРНК. Рост уровня АФК приводит к
циирует EGFR зависимый синтез ДНК и про
изменению редокс зависимой регуляция с учас
лиферацию клеток. Высокий уровень экспрес
тием Nrf2 , NF κB , JNK , AR сигналинга в
сии гена EGFR наблюдается при многих видах
опухолевых клетках, что связано с прогрессией
злокачественных новообразований, включая
опухолевого роста. Тем не менее механизм и
РПЖ. Повышенная экспрессия гена COX#2
факторы контроля путей редокс зависимого
приводит к EGFR стимулированной пролифе
сигналинга в доброкачественных и злокачест
рации клеток, а продукт COX 2 - PGE2 активи
венных опухолях всё ещё остаются малоизучен
рует сигнальные пути EGFR, способствуя раз
ными. Дальнейшее исследование их роли и по
витию опухоли. Так, на андроген независимых
иск эффективных модуляторов активности про
клетках РПЖ РС 3 была установлена EGFR за
оксидантных ферментных систем, ферментов
висимая активация COX 2, запускаемая внут
антиоксидантной защиты и ключевых фермен
риклеточным PGE2, обладающим проонкоген
тов переноса редокс зависимого сигнала может
ным эффектом [92]. Представленные данные
быть перспективным направлением в разработ
позволяют говорить о существовании тесной
ке новых подходов химиотерапии для подавле
связи между miR 101 и COX 2, PGE2, EGFR,
ния опухолевого роста при РПЖ.
которая отвечает за пролиферацию клеток
РПЖ.
Финансирование. Работа выполнена при под
Таким образом, многочисленные данные
держке Программы стратегического академи
свидетельствуют о значимости развития окис
ческого лидерства РУДН.
лительного стресса и изменения редокс зависи
Конфликт интересов. Авторы заявляют об от
мой регуляции в процессах злокачественного
сутствии конфликта интересов.
роста при РПЖ, что связано с дисбалансом в ре
Соблюдение этических норм. Настоящая
гуляции уровня АФК в результате активации ря
статья не содержит описания каких либо иссле
да прооксидантных систем и снижением анти
дований с участием людей или животных в каче
оксидантной защиты. Значительная роль в мо
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Rawla, P. (2019) Epidemiology of prostate cancer, World
9. Kalinina, E. V., Ivanova Radkevich, V. I., and Chernov,
J. Oncol., 10, 63 89, doi: 10.14740/wjon1191.
N. N. (2019) Role of MicroRNAs in the regulation of
2.
Hayes, J. D., Dinkova Kostova, A. T., and Tew, K. D.
redox dependent processes, Biochemistry (Moscow), 84,
(2020) Oxidative stress in cancer, Cancer Cell, 38, 167 197,
1233 1246, doi: 10.1134/S0006297919110026.
doi: 10.1016/j.ccell.2020.06.001.
10. Snezhkina, A. V., Kudryavtseva, A. V., Kardymon, O. L.,
3.
Staal, J., and Beyaert, R. (2018) Inflammation and NF κB
Savvateeva, M. V., Melnikova, N. V., et al. (2019) ROS
signaling in prostate cancer: mechanisms and clinical
generation and antioxidant defense systems in normal and
implications, Cells, 7, 122, doi: 10.3390/cells7090122.
malignant cells, Oxid. Med. Cell Longev., 2019, 6175804,
4.
Tan, B. L., and Norhaizan, M. E. (2021) Oxidative stress,
doi: 10.1155/2019/6175804.
diet and prostate cancer, World J. Mens Health, 39, 195
11. Sajjaboontawee,
N.,
Supasitthumrong,
T.,
207, doi: 10.5534/wjmh.200014.
Tunvirachaisakul, C., Nantachai, K., Snabboon, T., et al.
5.
Shukla, S., Srivastava, J. K., Shankar, E., Kanwal, R.,
(2020) Lower thiol, glutathione, and glutathione peroxi
Nawab, A., et al. (2020) Oxidative stress and antioxidant
dase levels in prostate cancer: a meta analysis study, Aging
status in high risk prostate cancer subjects, Diagnostics
Male,
23,
15331544, doi:
10.1080/13685538.2020.
(Basel), 10, 126, doi: 10.3390/diagnostics10030126.
1858048.
6.
Fahmy, O., Alhakamy, N. A., Rizg, W. Y., Bagalagel, A.,
12. Martignano, F., Gurioli, G., Salvi, S., Calistri, D.,
Alamoudi, A. J., et al. (2021) Updates on molecular and
Costantini, M., et al. (2016) GSTP1 methylation and pro
biochemical development and progression of prostate can
tein expression in prostate cancer: diagnostic implications,
cer, J. Clin. Med., 10, 5127, doi: 10.3390/jcm10215127.
Dis. Markers, 2016, 4358292, doi: 10.1155/2016/4358292.
7.
Szewczyk Golec, K., Tyloch, J., and Czuczejko, J. (2015)
13. Debelec Butuner, B., Bostanc , A., Ozcan, F., Singin, O.,
Antioxidant defense system in prostate adenocarcinoma
Karamil, S., et al. (2019) Oxidative DNA damage mediat
and benign prostate hyperplasia of elderly patients,
ed genomic heterogeneity is regulated by NKX3.1 in
Neoplasma, 62, 119 123, doi: 10.4149/neo_2015_015.
prostate cancer, Cancer Invest., 37, 113 126, doi: 10.1080/
8.
D’Souza, L. C., Mishra, S., Chakraborty, A., Shekher, A.,
07357907.2019.1576192.
Sharma, A., et al. (2020) Oxidative stress and cancer devel
14. Liguori, I., Russo, G., Curcio, F., Bulli, G., Aran, L., et al.
opment: are noncoding RNAs the missing links? Antioxid.
(2018) Oxidative stress, aging, and diseases, Clin. Interv.
Redox. Signal, 33, 1209 1229, doi: 10.1089/ars.2019.7987.
Aging, 13, 757 772, doi: 10.2147/CIA.S158513.
БИОХИМИЯ том 87 вып. 4 2022
470
КАЛИНИНА и др.
15.
Zhang, L., Wang, X., Cueto, R., Effi, C., Zhang, Y., et al.
cells, Am. J. Physiol. Cell Physiol.,
285,
353369,
(2019) Biochemical basis and metabolic interplay of redox
doi: 10.1152/ajpcell.00525.2002.
regulation, Redox Biol., 26, 101284, doi: 10.1016/j.redox.
29.
Pettigrew, C. A., Clerkin, J. S., and Cotter, T. G. (2012)
2019.101284.
DUOX enzyme activity promotes AKT signalling in
16.
Mohammadi, M., Irani, S., Salahshourifar, I.,
prostate cancer cells, Anticancer Res., 32, 5175 5181.
Hosseini, J., Moradi, A., et al. (2020) Investigation of
30.
Lu, J. P., Monardo, L., Bryskin, I., Hou, Z. F.,
GSTP1 and epigenetic regulators expression pattern in a
Trachtenberg, J., et al. (2010) Androgens induce oxidative
population of Iranian patients with prostate cancer, Hum.
stress and radiation resistance in prostate cancer cells
Antibodies, 28, 327 334, doi: 10.3233/HAB 200424.
though NADPH oxidase, Prostate Cancer Prostatic Dis.,
17.
Yang, Y., Fuentes, F., Shu, L., Wang, C., Pung, D., et al.
13, 39 46, doi: 10.1038/pcan.2009.24.
(2017) Epigenetic CpG methylation of the promoter and
31.
Lu, J. P., Hou, Z. F., Duivenvoorden, W. C., Whelan, K.,
reactivation of the expression of GSTP1 by astaxanthin in
Honig, A., et al. (2012) Adiponectin inhibits oxidative
human prostate LNCaP cells, AAPS J., 19, 421 430,
stress in human prostate carcinoma cells, Prostate Cancer
doi: 10.1208/s12248 016 0016 x.
Prostatic Dis., 15, 28 35, doi: 10.1038/pcan.2011.53.
18.
Fukai, T., and Ushio Fukai, M. (2011) Superoxide dismu
32.
Speed, N., and Blair, I. A. (2011) Cyclooxygenase and
tases: role in redox signaling, vascular function, and dis
lipoxygenase mediated DNA damage, Cancer Metastasis
eases, Antioxid. Redox Signal, 15, 1583 1606, doi: 10.1089/
Rev., 30, 437 447, doi: 10.1007/s10555 011 9298 8.
ars.2011.3999.
33.
Pidgeon, G. P., Lysaght, J., Krishnamoorthy, S., Reynolds,
19.
Dhar, S. K., Tangpong, J., Chaiswing, L., Oberley, T. D.,
J. V., O’Byrne, K., et al. (2007) Lipoxygenase metabolism:
and Clair, D. K. (2011) Manganese superoxide dismutase is
roles in tumor progression and survival, Cancer Metastasis
a p53 regulated gene that switches cancers between early
Rev., 26, 503 524, doi: 10.1007/s10555 007 9098 3.
and advanced stages, Cancer Res.,
71,
66846695,
34.
Saboormaleki, S., Sadeghian, H., Bahrami, A. R., Orafaie,
doi: 10.1158/0008 5472.CAN 11 1233.
A., and Matin, M. M. (2018) 7 Farnesyloxycoumarin
20.
Roy, K., Wu, Y., Meitzler, J. L., Juhasz, A., Liu, H., et al.
exerts anti cancer effects on a prostate cancer cell line by
(2015) NADPH oxidases and cancer, Clin. Sci. (Lond),
15 LOX 1 inhibition, Arch. Iran Med., 21, 251 259.
128, 863 875, doi: 10.1042/CS20140542.
35.
Iranpour, S., Al Mosawi, A. K. M., Bahrami, A. R.,
21.
Arbiser, J. L., Petros, J., Klafter, R., Govindajaran, B.,
Sadeghian, H., and Matin, M. M. (2021) Investigating the
McLaughlin, E. R., et al. (2002) Reactive oxygen generat
effects of two novel 4 MMPB analogs as potent lipoxyge
ed by Nox1 triggers the angiogenic switch, Proc. Natl.
nase inhibitors for prostate cancer treatment, J. Biol. Res.
Acad. Sci. USA,
99,
715720, doi:
10.1073/pnas.
(Thessalon), 28, 10, doi: 10.1186/s40709 021 00141 w.
022630199.
36.
Krishnamoorthy, S., Jin, R., Cai, Y., Maddipati, K. R., Nie,
22.
Deep, G., Kumar, R., Jain, A. K., Dhar, D., Panigrahi,
D., et al. (2010) 12 Lipoxygenase and the regulation of
G. K., et al. (2016) Graviola inhibits hypoxia induced
hypoxia inducible factor in prostate cancer cells, Exp. Cell
NADPH oxidase activity in prostate cancer cells reducing
Res., 316, 1706 1715, doi: 10.1016/j.yexcr.2010.03.005.
their proliferation and clonogenicity, Sci. Rep., 6, 23135,
37.
Sarveswaran, S., Chakraborty, D., Chitale, D., Sears, R.,
doi: 10.1038/srep23135.
and Ghosh, J. (2015) Inhibition of 5 lipoxygenase selec
23.
Tamura, R. E., Hunger, A., Fernandes, D. C., Laurindo,
tively triggers disruption of c Myc signaling in prostate
F. R., Costanzi Strauss, E., et al. (2017) Induction of oxi
cancer cells, J. Biol. Chem., 290, 4994 5006, doi: 10.1074/
dants distinguishes susceptibility of prostate carcinoma cell
jbc.M114.599035.
lines to p53 gene transfer mediated by an improved aden
38.
Hsi, L. C., Wilson, L. C., and Eling, T. E. (2002) Opposing
oviral vector, Hum. Gene Ther.,
28,
639653,
effects of 15 lipoxygenase 1 and 2 metabolites on MAPK
doi: 10.1089/hum.2016.139.
signaling in prostate. Alteration in peroxisome proliferator
24.
Lim, S. D., Sun, C. Q., Lambeth, J. D., Marshall, F.,
activated receptor gamma, J. Biol. Chem., 277, 40549
Amin, M., et al. (2005) Increased Nox1 and hydrogen per
40556, doi: 10.1074/jbc.M203522200.
oxide in prostate cancer, Prostate,
62,
200207,
39.
Gondek, T., Szajewski, M., Szefel, J., Aleksandrowicz
doi: 10.1002/pros.20137.
Wrona, E., Skrzypczak Jankun, E., et al.
(2014)
25.
Juhasz, A., Ge, Y., Markel, S., Chiu, A., Matsumoto, L.,
Evaluation of 12 lipoxygenase (12 LOX) and plasminogen
et al. (2009) Expression of NADPH oxidase homologues
activator inhibitor 1 (PAI 1) as prognostic markers in
and accessory genes in human cancer cell lines, tumours
prostate cancer, Biomed. Res. Int.,
2014,
102478,
and adjacent normal tissues, Free Radic. Res., 43, 523 532,
doi: 10.1155/2014/102478.
doi: 10.1080/10715760902918683.
40.
Gao, X., Porter, A. T., and Honn, K. V. (1997) Involvement
26.
Höll, M., Koziel, R., Schäfer, G., Pircher, H., Pauck, A.,
of the multiple tumor suppressor genes and 12 lipoxyge
et al. (2016) ROS signaling by NADPH oxidase 5 modu
nase in human prostate cancer. Therapeutic implications,
lates the proliferation and survival of prostate carcinoma
Adv. Exp. Med. Biol., 407, 41 53, doi: 10.1007/978 1
cells, Mol. Carcinog., 55, 27 39, doi: 10.1002/mc.22255.
4899 1813 0_7.
27.
Kumar, B., Koul, S., Khandrika, L., Meacham, R. B., and
41.
Matsuyama, M., Yoshimura, R., Mitsuhashi, M., Hase, T.,
Koul, H. K. (2008) Oxidative stress in inherent in prostate
Tsuchida, K., et al. (2004) Expression of lipoxygenase in
cancer cells and is required for aggressive phenotype,
human prostate cancer and growth reduction by its
Cancer Res.,
68,
17771785, doi:
10.1158/0008
inhibitors, Int. J. Oncol., 24, 821 827, doi: 10.3892/ijo.24.
5472.CAN 07 5259.
4.821.
28.
Brar, S. S., Corbib, Z., Kennedy, T. P., Hemendinger, R.,
42.
Goftari, S. N., Sadeghian, H., Bahrami, A. R., Maleki, F.,
Thornton, L., et al. (2003) NOX5 NAD(P)H oxidase reg
and Matin, M. M. (2019) Stylosin and some of its synthet
ulates growth and apoptosis in DU145 prostate cancer
ic derivatives induce apoptosis in prostate cancer cells as
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
471
15 lipoxygenase enzyme inhibitors, Naunyn Schmiedebergs
58.
Guo, Y., Zang, Y., Lv, L., Cai, F., Qian, T., et al. (2017)
Arch. Pharmacol., 392, 1491 1502, doi: 10.1007/s00210
IL 8 promotes proliferation and inhibition of apoptosis via
019 01689 0.
STAT3/AKT/NF κB pathway in prostate cancer, Mol.
43.
Hosseinymehr, M., Matin, M. M., Sadeghian, H.,
Med. Rep., 16, 9035 9042, doi: 10.3892/mmr.2017.7747.
Bahrami, A. R., and Kaseb Mojaver, N.
(2016)
8
59.
Chen, W., Li, P., Liu, Y., Yang, Y., Ye, X., et al. (2018)
Farnesyloxycoumarin induces apoptosis in PC 3 prostate
Isoalantolactone induces apoptosis through ROS mediat
cancer cells by inhibition of 15 lipoxygenase 1 enzymatic
ed ER stress and inhibition of STAT3 in prostate cancer
activity, Anticancer Drugs, 27, 854 862, doi: 10.1097/
cells, J. Exp. Clin. Cancer Res., 37, 309, doi: 10.1186/
CAD.0000000000000399.
s13046 018 0987 9.
44.
Robertson, H., Dinkova Kostova, A. T., and Hayes, J. D.
60.
Gudkov, A. V., and Komarova, E. A. (2016) p53 and the
(2020) NRF2 and the ambiguous consequences of its acti
carcinogenicity of chronic inflammation, Cold Spring Harb.
vation during initiation and the subsequent stages of
Perspect. Med., 6, a026161, doi: 10.1101/cshperspect.a026161.
tumourigenesis cancers, Cancers, 12, 3609, doi: 10.3390/
61.
Schneider, G., Henrich, A., Greiner, G., Wolf, V., Lovas,
cancers12123609.
A., et al. (2010) Crosstalk between stimulated NF kappaB
45.
Zimta, A. A., Cenariu, D., Irimie, A., Magdo, L., Nabavi,
and the tumor suppressor p53, Oncogene, 29, 2795 2806,
S. M., et al. (2019) The role of Nrf2 activity in cancer
doi: 10.1038/onc.2010.46.
development and progression, Cancers,
11,
1755,
62.
Shankar, E., Zhang, A., Franco, D., and Gupta, S. (2017)
doi: 10.3390/cancers11111755.
Betulinic acid mediated apoptosis in human prostate can
46.
Sekine, H., Motohashi, H. (2021) Roles of CNC tran
cer cells involves p53 and nuclear factor kappa B (NF κB)
scription factors NRF1 and NRF2 in cancer, Cancers
pathways, Molecules,
22,
264, doi:
10.3390/
(Basel), 13, 541, doi: 10.3390/cancers13030541.
molecules22020264.
47.
Taguchi, K., and Yamamoto, M. (2021) The KEAP1
63.
Dong, J. T. (2006) Prevalent mutations in prostate cancer,
NRF2 system as a molecular target of cancer treatment,
J. Cell Biochem., 97, 433 447, doi: 10.1002/jcb.20696.
Cancers (Basel), 13, 46, doi: 10.3390/cancers13010046.
64.
Meek, D. W. (2015) Regulation of the p53 response and its
48.
Zucker, S. N., Fink, E. E., Bagati, A., Mannava, S.,
relationship to cancer, Biochem. J.,
469,
325346,
Bianchi Smiraglia, A., et al. (2014) Nrf2 amplifies oxida
doi: 10.1042/BJ20150517.
tive stress via induction of Klf9, Mol Cell, 53, 916 928,
65.
Wan, J., Zhang, J., and Zhang, J. (2018) Expression of p53
doi: 10.1016/j.molcel.2014.01.033.
and its mechanism in prostate cancer, Oncol. Lett., 16, 378
49.
Barve, A., Khor, T. O., Nair, S., Reuhl, K., Suh, N., et al.
382, doi: 10.3892/ol.2018.8680.
(2009) Tocopherol enriched mixed tocopherol diet inhibits
66.
Wang, D., Gao, Z., and Zhang, X. (2018) Resveratrol
prostate carcinogenesis in TRAMP mice, Int. J. Cancer,
induces apoptosis in murine prostate cancer cells via
124, 1693 1699, doi: 10.1002/ijc.24106.
hypoxia inducible factor 1 alpha (HIF 1α)/reactive oxy
50.
Frohlich, D. A., McCabe, M. T., Arnold, R. S., and Day,
gen species (ROS)/P53 signaling, Med. Sci. Monit., 24,
M. L. (2008) The role of Nrf2 in increased reactive oxygen
8970 8976, doi: 10.12659/MSM.913290.
species and DNA damage in prostate tumorigenesis,
67.
Papa, S., Zazzeroni, F., Pham, C. G., Bubici, C., and
Oncogene, 27, 4353 4362, doi: 10.1038/onc.2008.79.
Franzoso, G. (2004) Linking JNK signaling to NF κB: a key
51.
Wardyn, J. D., Ponsford, A. H., and Sanderson, C. M.
to survival, J. Cell Sci., 117, 5197 5208, doi: 10.1242/jcs.01483.
(2015) Dissecting molecular cross talk between Nrf2 and
68.
Xu, R., and Hu, J. (2020) The role of JNK in prostate can
NF κB response pathways, Biochem. Soc. Trans., 43, 621
cer progression and therapeutic strategies, Biomed.
626, doi: 10.1042/BST20150014.
Pharmacother.,
121,
109679, doi:
10.1016/j.biopha.
52.
Buelna Chontal, M., and Zazueta, C. (2013) Redox acti
2019.109679.
vation of Nrf2 and NF κB: a double end sword? Cell
69.
Nikoloudaki, G., Brooks, S., Peidl, A. P., Tinney, D., and
Signal, 25, 2548 2557, doi: 10.1016/j.cellsig.2013.08.007.
Hamilton, D. W. (2020) JNK signaling as a key modulator
53.
Taniguchi, K., and Karin, M. (2018) NF κB, inflamma
of soft connective tissue physiology, pathology, and healing,
tion, immunity and cancer: coming of age, Nat. Rev.
Int. J. Mol. Sci., 21, 1015, doi: 10.3390/ijms21031015.
Immunol., 18, 309 324, doi: 10.1038/nri.2017.142.
70.
Takata, T., Araki, S., Tsuchiya, Y., and Watanabe, Y. (2020)
54.
Jin, R., Yi, Y., Yull, F. E., Blackwell, T. S., Clark, P. E.,
Oxidative stress orchestrates MAPK and nitric oxide syn
et al. (2014) NF κB gene signature predicts prostate cancer
thase signal, Int. J. Mol. Sci., 21, 8750, doi: 10.3390/
progression, Cancer Res., 74, 2763 2772, doi: 10.1158/
ijms21228750.
0008 5472.CAN 13 2543.
71.
Dou, Y., Jiang, X., Xie, H., He, J., and Xiao, S. (2019)
55.
Grivennikov, S. I., and Karin, M. (2010) Dangerous
The Jun N terminal kinases signaling pathway plays a
liaisons: STAT3 and NF κB collaboration and crosstalk in
“seesaw” role in ovarian carcinoma: a molecular aspect,
cancer, Cytokine Growth Factor Rev.,
21,
1119,
J. Ovarian Res., 12, 99, doi: 10.1186/s13048 019 0573 6.
doi: 10.1016/j.cytogfr.2009.11.005.
72.
Acosta, A. M., and Kadko, S. S. (2016) Mitogen activated
56.
Jiang, L. H., Hao, Y. L., and Zhu, J. W. (2019) Expression
protein kinase signaling pathway in cutaneous melanoma:
and prognostic value of HER 2/neu, STAT3 and SOCS3 in
an updated review, Arch. Pathol. Lab. Med., 140, 1290
hepatocellular carcinoma, Clin. Res. Hepatol. Gastroenterol.,
1296, doi: 10.5858/arpa.2015 0475 RS.
43, 282 291, doi: 10.1016/j.clinre.2018.09.011.
73.
Wang, J., Xiao, Q., Chen, X., Tong, S., Sun, J., et al.
57.
Wang, X., Wang, B., Zhou, L., Wang, X., Veeraraghavan,
(2018) LanCL1 protects prostate cancer cells from oxida
V. P., et al. (2020) Ganoderma lucidum put forth anti tumor
tive stress via suppression of JNK pathway, Cell Death. Dis.,
activity against PC 3 prostate cancer cells via inhibition of
9, 197, doi: 10.1038/s41419 017 0207 0.
Jak 1/STAT 3 activity, Saudi. J. Biol. Sci., 27, 2632 2637,
74.
Lv, J. M., Chen, L., Gao, Y., Huang, H., Pan, X. W., et al.
doi: 10.1016/j.sjbs.2020.05.044.
(2018) PPP5C promotes cell proliferation and survival in
БИОХИМИЯ том 87 вып. 4 2022
472
КАЛИНИНА и др.
human prostate cancer by regulating of the JNK and
88.
Jajoo, S., Mukherjea, D., Kaur, T., Sheehan, K. E.,
ERK1/2 phosphorylation, Onco. Ther., 11, 5797 5809,
Sheth, S., et al. (2013) Essential role of NADPH oxidase
doi: 10.2147/OTT.S161280.
dependent reactive oxygen species generation in regulating
75.
Chambers, J., Pachori, A., Howard, S., Iqbal, S., and
microRNA 21 expression and function in prostate cancer,
LoGrasso, P. (2012) Inhibition of JNK mitochondrial
Antioxid. Redox Signal., 19, 1863 1876, doi: 10.1089/ars.
localization and signaling is protective against
2012.4820.
ischemia/reperfusion injury in rats, J. Boil. Chem., 288,
89.
Wu, Q. Q., Zheng, B., Weng, G. B., Yang, H. M., Ren, Y.,
4000 4011, doi: 10.1074/jbc.M112.406777.
et al. (2019) Downregulated NOX4 underlies a novel
76.
Günther, J. K., Nikolajevic, A., Ebner, S., Troppmair, J.,
inhibitory role of microRNA 137 in prostate cancer, J. Cell
and Khalid, S. (2020) Rigosertib activated JNK1/2 elimi
Biochem., 120, 10215 10227, doi: 10.1002/jcb.28306.
nate tumor cells through p66Shc activation, Biology
90.
Kim, H. K., Lee, H. Y., Riaz, T. A., Bhattarai, K. R.,
(Basel), 9, 99, doi: 10.3390/biology9050099.
Chaudhary, M., et al. (2021) Chalcone suppresses tumor
77.
Galimov, E. R. (2010) The role of p66shc in oxidative stress
growth through NOX4 IRE1α sulfonation RIDD miR
and apoptosis, Acta Naturae, 2, 44 51, doi: 10.32607/
23b axis, Redox Biol., 40, 101853, doi: 10.1016/j.redox.
20758251 2010 2 4 44 51.
2021.101853.
78.
Eid, R. A., Zaki, M. S. A., Eldeen, M. A., Alshehri, M. M.,
91.
Hao, Y., Gu, X., Zhao, Y., Greene, S., Sha, W., et al.
Shati, A. A., et al. (2020) Exendin 4 protects the hearts of
(2011) Enforced expression of miR 101 inhibits prostate
rats from ischaemia/reperfusion injury by boosting antiox
cancer cell growth by modulating the COX 2 pathway
idant levels and inhibition of JNK/p66Shc/NADPH axis,
in vivo, Cancer Prev. Res. (Phila),
4,
10731083,
Clin. Exper. Pharmacol. Physiol.,
47,
12401253,
doi: 10.1158/1940 6207.CAPR 10 0333.
doi: 10.1111/1440 1681.13299.
92. Madrigal Mart nez, A., Constâncio, V., Lucio Cazaña,
79.
Han, C., Wang, Z., Xu, Y., Chen, S., Han, Y., et al. (2020)
F. J., and Fernández Mart nez, A. B. (2019) Prostaglan
Roles of reactive oxygen species in biological behaviors of
dine2 stimulates cancer related phenotypes in prostate
prostate cancer, Biomed. Res. Int.,
2020,
1269624,
cancer PC3 cells through cyclooxygenase 2, J. Cell
doi: 10.1155/2020/1269624.
Physiol., 234, 7548 7559, doi: 10.1002/jcp.27515.
80.
Khurana, N., and Sikka, S. C. (2018) Targeting crosstalk
93. Josson, S., Sung, S. Y., Lao, K., Chung, L. W. K., and
between Nrf 2, NF κB and androgen receptor signaling in
Johnstone, P. A. S. (2008) Radiation modulation of
prostate cancer, Cancers,
10,
352, doi:
10.3390/
microRNA in prostate cancer cell lines, Prostate, 68, 1599
cancers10100352.
1606, doi: 10.1002/pros.20827.
81.
Yu, J., Zhou, P., Du, W., Xu, R., Yan, G., et al. (2020)
94. Gandellini, P., Giannoni, E., Casamichele, A., Taddei, M.
Metabolically stable diphenylamine derivatives suppress
L., Callari, M., et al. (2014) miR 205 hinders the malig
androgen receptor and BET protein in prostate cancer,
nant interplay between prostate cancer cells and associated
Biochem. Pharmacol., 177, 113946, doi: 10.1016/j.bcp.
fibroblasts, Antioxid. Redox Signal.,
20,
10451059,
2020.113946.
doi: 10.1089/ars.2013.5292.
82.
Schultz, M. A., Hagan, S. S., Datta, A., Zhang, Y.,
95. Zang, Y., Zhu, J., Li, Q., Tu, J., Li, X., et al. (2020) miR
Freeman, M. L., et al. (2014) Nrf1 and Nrf2 transcription
137 3p modulates the progression of prostate cancer by
factors regulate androgen receptor transactivation in
regulating the JNK3/EZH2 axis, Onco. Targets Ther., 13,
prostate cancer cells, PLoS One, 9, e87204, doi: 10.1371/
7921 7932, doi: 10.2147/OTT.S256161.
journal.pone.0087204.
96. Meitzler, J. L., Antony, S., Wu, Y., Juhasz, A., Liu, H.,
83.
Uzuner, E., Ulu, G. T., Gürler, S. B., and Baran, Y. (2022)
et al. (2014) NADPH oxidases: a perspective on reactive
The role of miRNA in cancer: pathogenesis, diagnosis, and
oxygen species production in tumor biology, Antioxid.
treatment, Methods Mol. Biol.,
2257,
375422,
Redox Signal., 20, 2873 2889, doi: 10.1089/ars.2013.5603.
doi: 10.1007/978 1 0716 1170 8_18.
97. Kumar, S., Singh, R. K., and Meena, R. (2016) Emerging
84.
Ali Syeda, Z., Langden, S. S., Munkhzul, C., Lee, M., and
targets for radioprotection and radiosensitization in radio
Song, S. (2020) Regulatory mechanism of microRNA
therapy, Tumour Biol., 37, 11589 11609, doi: 10.1007/
expression in cancer, J. Int. J Mol. Sci., 21, 1723,
s13277 016 5117 8.
doi: 10.3390/ijms21051723.
98. Sarveswaran, S., Varma, N. R. S., Morisetty, S., and
85.
Xu, Z., Zhang, Y., Ding, J., Hu, W., Tan, C., et al. (2018)
Ghosh, J. (2019) Inhibition of 5 lipoxygenase downregu
miR 17 3p downregulates mitochondrial antioxidant
lates stemness and kills prostate cancer stem cells by trig
enzymes and enhances the radiosensitivity of prostate can
gering apoptosis via activation of c Jun N terminal kinase,
cer cells, Mol. Ther. Nucleic Acids,
13,
6477,
Oncotarget, 10, 424 436, doi: 10.18632/oncotarget.13422.
doi: 10.1016/j.omtn.2018.08.009.
99. Wartenberg, M., Hoffmann, E., Schwindt, H., Grünheck,
86.
Martino, T., Kudrolli, T. A., Kumar, B., Salviano, I.,
F., Petros, J., et al. (2005) Reactive oxygen species linked
Mencalha, A., et al. (2018) The orally active pterocarpan
regulation of the multidrug resistance transporter P glyco
quinone LQB 118 exhibits cytotoxicity in prostate cancer
protein in Nox 1 overexpressing prostate tumor spheroids,
cell and tumor models through cellular redox stress,
FEBS Lett.,
579,
45414549, doi:
10.1016/j.febslet.
Prostate, 78, 140 151, doi: 10.1002/pros.23455.
2005.06.078.
87.
Yang, Z., Chen, J S., Wen, J. K., Gao, H T., Zheng, B.,
100. Jones, K. J., Chetram, M. A., Bethea, D. A., Bryant, L. K.,
et al. (2017) Silencing of miR 193a 5p increases the
Odero Marah, V., et al. (2013) Cysteine (C) X C Receptor
chemosensitivity of prostate cancer cells to docetaxel,
4 regulates NADPH Oxidase 2 during oxidative stress in
J. Exp. Clin. Cancer Res., 36, 178, doi: 10.1186/s13046
prostate cancer cells, Cancer Microenvironment, 6, 277
017 0649 3.
288, doi: 10.1007/s12307 013 0136 0.
БИОХИМИЯ том 87 вып. 4 2022
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
473
OXIDATIVE STRESS AND REDOX DEPENDENT
SIGNALING IN PROSTATE CANCER
Review
E. V. Kalinina1*, L. A. Gavriliuk1, and V. S. Pokrovsky2
1 Peoples’s Friendship University of Russia (RUDN University), 117198 Moscow, Russia; e#mail: kalinina#ev@rudn.ru
2 Federal State Budgetary Institution «National Medical Research Center of Oncology named after N.N. Blokhin»
of the Ministry of Health of Russia, 115478 Moscow, Russia
The rise and progression of a tumor is complicated by the dual role of ROS. A low ROS level is necessary for many
intracellular metabolic processes and cell proliferation, while a significant increase in the ROS level causes disruption
of the mechanisms of their Cancerinactivation, leading to the damage and cell death. A long term imbalance in the
ROS/antioxidant ratio and a significant increase of the ROS level due to the decrease in the effectiveness of the
antioxidant defense system leads to chronic oxidative stress, which causes the damage of proteins, lipids, DNA and
the development of cancer growth. Numerous data demonstrate the development of oxidative stress in prostate can
cer, which is the most common cancer among men. However, the reasons for its occurrence, changes in redox signal
ing and cellular redox homeostasis are still poorly understood. The review examines the state of prooxidant and
antioxidant enzyme systems, the imbalance of activity of which leads to the development of oxidative stress in prostate
cancer, evaluates the change in the key links of the redox signaling and the role of the contribution of microRNAs in
modulating the redox status of cancer cells.
Keywords: prostate cancer, oxidative stress, antioxidant and prooxidant enzymes, transcription factors Nrf2, NF κB,
redox dependent signaling, microRNA
2 БИОХИМИЯ том 87 вып. 4 2022