БИОХИМИЯ, 2022, том 87, вып. 5, с. 587 - 602
УДК 577.112.7
СТРУКТУРА И ПОЛИМОРФИЗМ АМИЛОИДНЫХ
И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
Обзор
© 2022
А.Б. Матиив1, Н.П. Трубицина1, А.Г. Матвеенко1,
Ю.А. Барбитов1,2, Г.А. Журавлева1,3, С.А. Бондарев1,3*
1 Санкт Петербургский государственный университет, кафедра генетики и биотехнологии,
199034 Санкт Петербург, Россия; электронная почта: stanislavspbgu@gmail.com
2 Институт биоинформатики, 197342 Санкт Петербург, Россия
3 Санкт Петербургский государственный университет, научная лаборатория биологии амилоидов,
199034 Санкт Петербург, Россия
Поступила в редакцию 28.09.2021
После доработки 08.04.2022
Принята к публикации 09.04.2022
Амилоиды - это белковые агрегаты с кросс β структурой. Интерес к изучению амилоидов, с одной сторо
ны, связан с их ролью в развитии ряда социально значимых нейродегенеративных заболеваний человека, а
с другой - с обнаружением функциональных амилоидов, образование которых является неотъемлемой
частью некоторых клеточных процессов. На сегодняшний день известно более сотни белков с амилоидны
ми свойствами. Активные исследования структурной организации агрегатов выявляют самые разнообраз
ные варианты конформации белков в их составе. В обзоре мы собрали примеры этого разнообразия, рас
смотрев укладку белка в амилоидоподобных агрегатах. Существенная часть статьи посвящена характерным
особенностям структуры этих белковых комплексов, которые определяют необычные свойства амилоидов,
в том числе их взаимодействие с амилоид специфическими красителями и стабильность. В обзоре также
описаны многочисленные примеры разнообразия амилоидных агрегатов и его значения для живых
организмов.
КЛЮЧЕВЫЕ СЛОВА: кросс β структура, амилоиды, амилоидоподобные агрегаты, полиморфизм амилоидов.
DOI: 10.31857/S0320972522050013, EDN: ASQTGJ
ВВЕДЕНИЕ. КРОСС+β+СТРУКТУРА
говорить только об амилоидоподобных агрега
тах [1-4].
Амилоиды - это белковые агрегаты с кросс
Амилоидные агрегаты имеют фибриллярную
β структурой, которые могут обладать рядом не
морфологию, при этом отдельные фибриллы
обычных свойств, таких как устойчивость к об
могут включать несколько протофибрилл, кото
работке детергентами, протеазами, а также взаи
рые закручены друг относительно друга [5].
модействие с амилоид специфическими краси
В протофибриллах белковые молекулы собраны
телями [1-4]. Согласно рекомендациям номен
в «стопки» и формируют так называемую кросс
клатуры ISA (International Society of
β структуру. В её составе β тяжи ориентированы
Amyloidosis) [1], именно наличие доказанной
перпендикулярно оси протофибриллы и распо
кросс β структуры является наиболее убеди
ложены на характерном расстоянии друг от дру
тельным параметром, который позволяет назы
га (рис. 1, a). Просвет между β тяжами в составе
вать белковый агрегат амилоидом. Демонстра
одного β слоя (β листа) составляет 4,7-4,8 Å,
ция других перечисленных свойств позволяет
при этом в протофибрилле присутствует мини
мум два β слоя, расстояние между которыми
Принятые сокращения: крио ЭМ- метод криоэлек
порядка 10 Å (рис. 1, a). Такие повторяющиеся
тронной микроскопии; Aβ - β амилоид; LARKS - струк
элементы, расположенные на фиксированных
туры типа изогнутых β листов, в составе которых преобла
расстояниях друг от друга (4,7-4,8 и 10 Å), соз
дают ароматические аминокислотные остатки (от англ.
дают регулярную структуру. В экспериментах по
low complexity aromatic rich kinked segments); PHF - пар
ные спиральные филаменты; PrP - прионный белок; SF -
дифракции электронов или рентгеновских лу
прямые филаменты; TTR - транстиретин.
чей она обладает характерной картиной с двумя
* Адресат для корреспонденции.
меридиональными и двумя экваториальными
587
588
МАТИИВ и др.
отражениями, которые соответствуют просве
вдоль оси фибрилл [8, 9]. Две основные гипоте
там между β тяжами и β листами [6].
зы сходятся на том, что красители встраивают
Структурные особенности амилоидов также
ся в бороздки вдоль амилоидных фибрилл, но
определяют их способность взаимодействовать
отличаются с точки зрения расположения этих
с амилоид специфическими красителями (на
сайтов связывания. Согласно наиболее попу
пример, тиофлавином Т и Конго красным), хо
лярной точке зрения, эти бороздки образованы
тя точные данные о локализации и организации
боковыми группами аминокислот (рис. 1, б, мо
сайтов связывания этих красителей отсутству
дель 1) [8]. Эта гипотеза согласуется с данными
ют [6, 7]. Известно, что молекулы этих красите
о взаимодействии тиофлавина Т с химерным
лей в комплексе с агрегатами ориентированы
белком PSAM (от англ. peptide self assembly
Рис. 1. Структурные основы амилоидных свойств. Расстояния между β тяжами и β листами в амилоидных агрегатах с
кросс β структурой и соответствующая схема дифракционной картины (а). Цветами здесь и далее обозначены разные мо
лекулы белка, чередующиеся в составе фибриллы. Две модели взаимодействия амилоид специфических красителей с
фибриллами на примере тиофлавина Т (б). Сайт связывания может располагаться в бороздке на стыке соседних β листов
(модель 2) либо между боковыми цепями аминокислот в составе одного β листа (модель 1). Схема расположения водо
родных связей (жёлтые пунктирные линии) внутри межмолекулярных β листов, обеспечивающих стабильность всей
структуры (в). Соседние β листы на схеме антипараллельны друг другу с точки зрения ориентации водородных связей
между одинаковыми аминокислотами в пептидах, которые отмечены «*». Пунктирные стрелки обозначают условные на
правления β листов. Пример плотной упаковки аминокислотных остатков внутри амилоидной структуры, наличие таких
стерических застёжек между β листами увеличивает стабильность всей структуры (г). PDB ID структур, использованных
при подготовке рисунка: 2BEG (а и б) и 2M5N (в и г). Оптимальное расположение молекулы тиофлавина Т было рассчи
тано в программе AutoDock Vina [34]
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
589
mimic), в структуре которого присутствует β
сравнению с мономерным белком или другими
лист, имитирующий внешнюю поверхность
видами агрегатов при различных воздействиях:
амилоидной фибриллы [10]. Стоит отметить,
нагревании, обработке детергентами или проте
что в этой модели повторяющиеся β тяжи в
азами. Высокая стабильность амилоидных агре
составе β листа антипараллельны друг другу,
гатов основана на двух особенностях. Во пер
что не характерно для большинства амилоид
вых, это большое количество межмолекулярных
ных агрегатов с известной структурой (более
водородных связей между пептидными цепя
подробно это будет освещено далее). Согласно
ми (рис. 1, в). Взаимодействия между остатками
другой гипотезе, аналогичные сайты для связы
полярных аминокислот, таких как аспарагин и
вания красителей могут быть расположены на
глутамин, дополнительно стабилизируют струк
стыке двух β листов (рис. 1, б, модель 2) (в част
туру [5]. Во вторых, соседние β листы в составе
ности, такой способ взаимодействия был пред
амилоидов тесно взаимодействуют друг с другом
ложен для красителя Конго красный [11]). Мо
по всей длине благодаря «стерическим застёж
лекулярный докинг (рис. 1, б, модель 2) свиде
кам» (steric zipper) - плотно прилегающим друг к
тельствует о том, что эта гипотеза применима и
другу поверхностям, образованным боковыми
для тиофлавина Т. Кроме этого, существует
радикалами аминокислот (рис. 1, г), которые за
предположение, что молекулы красителей мо
полняют всё пространство между белковыми це
гут взаимодействовать с амилоидными фибрил
пями. В результате между β листами практичес
лами в местах латеральных контактов между
ки не остаётся «пустого» пространства и каких
протофибриллами [12]. В совокупности суще
либо молекул, в том числе воды, поэтому внут
ствующие экспериментальные данные не поз
реннюю сторону β листов в кросс β структуре
воляют сделать однозначных выводов в пользу
иногда называют «сухой» [5, 25, 26]. Кроме это
одной из перечисленных моделей. Для некото
го, в стабилизации амилоидной структуры могут
рых амилоидов было предположено наличие
играть роль ионные взаимодействия между ами
разных сайтов связывания тиофлавина Т [13,
нокислотными остатками с различными заряда
14]. Более того, агрегаты одного и того же белка
ми, расположенными «внутри» фибриллы [5].
могут отличаться по способности связывать
С другой стороны, описаны примеры термо
этот краситель. Так, например, агрегаты
лабильных агрегатов с кросс β структурой (на
Sup35(1-61) GFP, полученные in vitro с исполь
пример, FUS и hnRNPA1 человека). Они прин
зованием лизатов дрожжей с разными вариан
ципиально отличаются организацией стеричес
тами приона [PSI+], отличаются по аффинности
кой застёжки. Такие агрегаты сформированы
к тиофлавину Т [15]. Тем не менее очевидно,
неупорядоченными доменами с низким амино
что именно особая структура амилоидных агре
кислотным разнообразием (low complexity
гатов даёт им возможность связывать такие кра
domains, LC домен), а ключевую роль в их обра
сители вне зависимости от последовательности
тимой агрегации играют остатки тирозина [27].
конкретного белка. Однако существуют приме
Трёхмерная структура термолабильных агре
ры амилоидных фибрилл, не связывающих ти
гатов, формируемых отдельными пептида
офлавин Т, например, агрегаты белка Sup35
ми FUS, была независимо расшифрована в
Yarrowia lipolytica [16].
2018 г. [28, 29]. В отличие от стерической застёж
Несмотря на широкое использование ами
ки, пептиды FUS и hnRNPA1 формируют струк
лоид связывающих красителей, вопрос об их
туры типа изогнутых β листов, в составе кото
специфичности все ещё актуален. Например,
рых преобладают ароматические аминокислот
тиофлавин Т имеет сродство к фибриллярным
ные остатки. Такие изогнутые структуры полу
агрегатам PSMα3, которые не обладают кросс
чили название LARKS (от англ. low complexity
β структурой [17]. Также флуоресценция этого
aromatic rich kinked segments). В фибриллах,
красителя возрастает при связывании с дву и
сформированных LARKS, взаимодействия меж
однонитевой ДНК, а также РНК [18, 19]. В на
ду листами в составе фибриллы происходят за
стоящее время тиофлавин Т используется также
счёт полярных остатков серина и тирозина. В то
в качестве сенсора различных структур нуклеи
же время изгибы в таких структурах предотвра
новых кислот: G триплексов и квадруплексов,
щают плотные взаимодействия между цепями
гуанидин обогащённых участков и др. [20].
по всей длине, сокращая длину контактной по
Конго красный называют «золотым стандар
верхности между соседними белковыми цепя
том» для детекции амилоидов [1-4, 21], однако
ми. Присутствие изгибов также позволяет иным
и для него есть примеры связывания с неамило
молекулам взаимодействовать с белковыми це
идными белками [22-24].
пями в непосредственной близости от контакт
Важным свойством структуры ряда амилои
ной поверхности, что нехарактерно для класси
дов является её повышенная стабильность по
ческой структуры типа стерической застёжки.
БИОХИМИЯ том 87 вып. 5 2022
590
МАТИИВ и др.
Пептиды FUS и hnRNPA1, соответствую
представлен на рис. 1, а. Подобные структурные
щие LARKS, формируют амилоидные агрегаты
элементы также часто встречаются среди β со
с характерной кросс β структурой, которые
леноидов [33].
растворяются при нагревании [29, 30]. В составе
одного из таких обратимых амилоидных коров,
FUS RAC2, присутствует молекула воды, фор
ПОЛИМОРФИЗМ АМИЛОИДНЫХ
мирующая водородные связи с гидроксильными
АГРЕГАТОВ
группами остатков тирозина [29]. Наличие воды
непосредственно на контактной поверхности
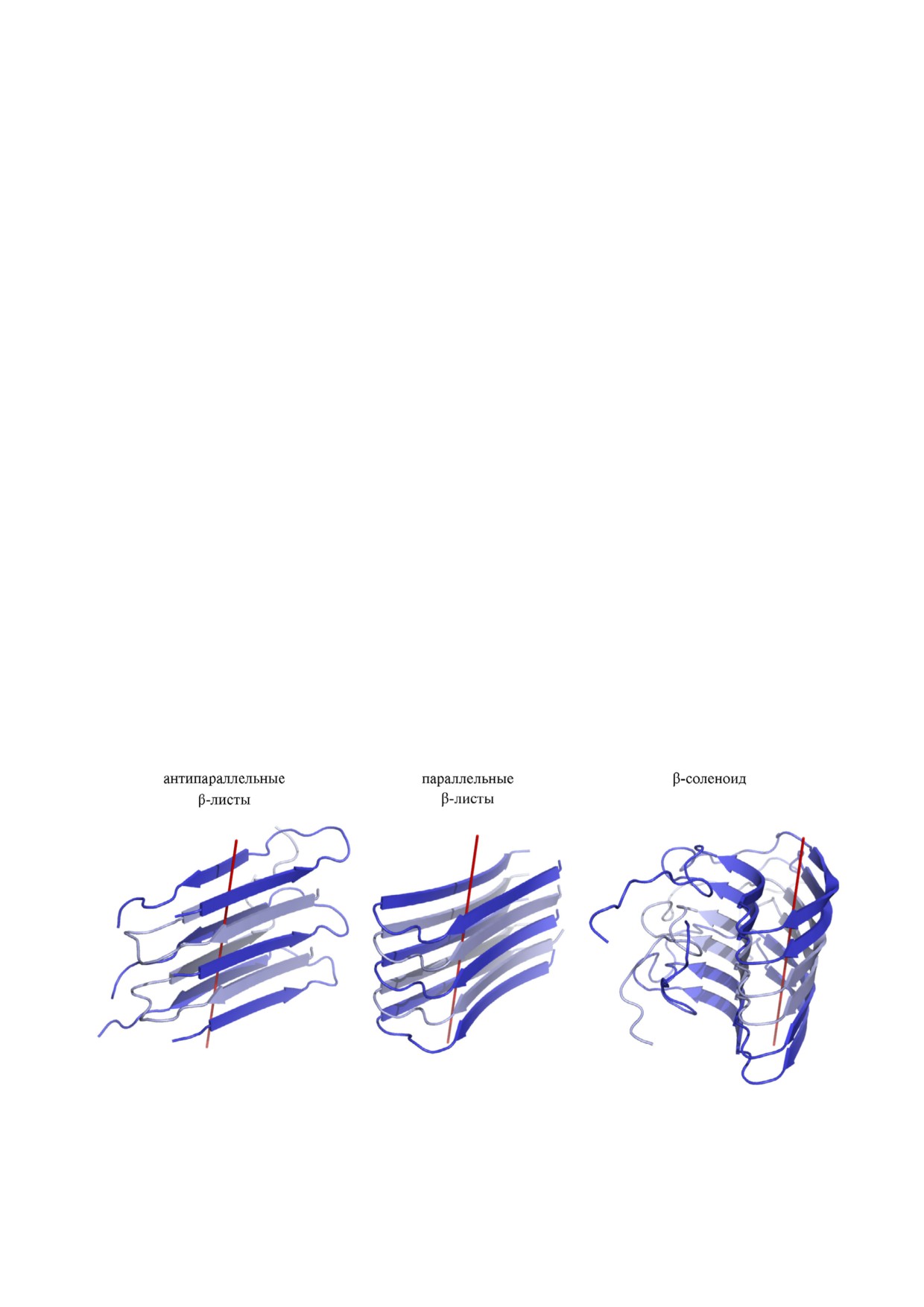
Разнообразие моделей структуры протофиб+
подчёркивает значительное отличие структуры
рилл. Существуют три основные модели, описы
фибрилл, сформированных LARKS, от класси
вающие различные варианты кросс β структу
ческой структуры амилоидной фибриллы, кон
ры (рис. 2). Примеры белков, агрегаты которых
тактная поверхность которой является «сухой».
характеризуются различными типами структу
LARKS обнаружены в большом количестве
ры, представлены в таблице. Отличия между ни
белков у различных организмов, причём их
ми касаются ориентации β тяжей в β листах:
представленность в протеомах варьирует
они могут быть параллельными и антипарал
[28, 31]. В протеоме человека наибольшее коли
лельными. Кроме этого, в отдельную группу вы
чество LARKS в составе LC доменов наблюда
деляют структуры β соленоидов или β спира
ется в белках, входящих в состав немембранных
лей: β тяжи в них параллельны друг другу и
органелл и способных к фазовым переходам
«закручены» вокруг оси фибриллы. Благодаря
(например, белки стресс гранул, телец Кахаля
этому могут образовываться не только меж , но
и др.) [31]. Такие белки обычно содержат не
и внутримолекулярные β листы. В результате в
сколько LARKS (9 - в случае hnRNPA2, 11 - в
одном β листе рядом друг с другом могут быть
случае FUS). За счёт большого количества таких
расположены пептиды как из одной молекулы,
сегментов эти белки способны к мультивалент
так и из разных. В случае параллельной и анти
ным межмолекулярным взаимодействиям, кри
параллельной кросс β структуры все β листы
тичным для формирования гидрогелей.
межмолекулярные (рис. 2) [5, 35].
Стерические застёжки и LARKS являются
Отдельно хотелось бы отметить, что сущест
широко известными, но не единственными
вует целый ряд белков, которые формируют β
структурными элементами амилоидных фиб
соленоиды сами по себе, т.е. для этого не требу
рилл. Существует также концепция, согласно
ется их агрегация [64]. Белок TSP бактериофа
которой большинство амилоидных агрегатов
га P22 является одним из таких примеров [65].
состоит из мотивов β тяж-поворот-β тяж, наз
Полноразмерный белок может формировать
ванных β арками [32]. Пример стопки из β арок
тримеры, которые устойчивы к детергентам
Рис. 2. Примеры моделей кросс β структуры амилоидов. Цветами выделены чередующиеся молекулы белка. Красной ли
нией отмечена условная ось фибриллы. Идентификаторы структур, использованных при подготовке рисунка, в базе дан
ных PDB ID: 2LNQ, 2BEG и 2KJ3
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
591
Примеры белков и различных типов структур
Белок
Вариант структуры
PDB ID трёхмерной структуры
(при наличии) и ссылка
β амилоид (Aβ)
антипараллельные β листы
2KJ3 [36]
Aβ
параллельные β листы
5OQV, 2BEG [37]
Aβ
смешанная (антипараллельные и параллельные β листы)
[38]
CfAFP 501
β соленоид
[39]
Прионный белок (PrP)
β соленоид
[40]
PrP
параллельные β листы
[41]
HET s (218-289)
β соленоид
2RNM, 2KJ3 [40, 42]
Пектат лиаза С (118-285)
β соленоид
2PEC [40]
Тау
β соленоид
[43]
Тау
параллельные β листы
5O3L [40]
Pmel17
β соленоид
[44]
TDP 43
параллельные β листы
[45]
Ure2
параллельные β листы
[46]
α синуклеин
параллельные β листы
2N0A [47]
α синуклеин
антипараллельные β листы
[47]
CRES (Cystatin Related
антипараллельные β листы
[48]
Epididymal Spermatogenic)
Кальцитонин
антипараллельные β листы
[49]
Амилин
смешанная (антипараллельные и параллельные β листы)
[50]
Легкая цепь иммуноглобулина
параллельные β листы
[51]
Sup35
параллельные β листы
[52]
Sup35
β соленоид
[53]
Rnq1
параллельные β листы
[54]
Orb2
параллельные β листы
[55]
IAPP
параллельные β листы
[56]
Хвостовый шип P22
β соленоид
[57]
CA150
параллельные β листы
[58]
β2 микроглобулин
ядро фибриллы из β листов
[59]
β2 микроглобулин (20-41)
параллельные β листы
[58]
Транстиретин (TTR)
параллельные β листы
2M5N, 2M5K, 2M5M, 3ZPK [60]
SOD1(28-38)
β штопор
5IIW [61]
PSM α3
кросс α структура
6GQC [62]
MAVS
состыкованные глобулярные молекулы
3J6C [63]
[66], а его домен Bhx, который формирует β со
жей в составе одного β листа (рис. 2) [68]. Тем не
леноид, способен образовывать фибриллы, ок
менее этот же термин можно встретить для обоз
рашивающиеся Конго красным и демонстриру
начения «направления» смежных β слоёв, если
ющие яблочно зелёное двулучепреломление
водородные связи в них ориентированы в про
[67], что является характерным свойством ами
тивоположные стороны (рис. 1, в) [5].
лоидных агрегатов [3].
Кроме трёх рассмотренных примеров струк
В литературе термин «антипараллельная
турной организации амилоидов, существуют и
кросс β структура», к сожалению, используется
другие модели, которые скорее характерны для
в разных значениях. Наиболее популярный ва
амилоидоподобных агрегатов. Мы также рас
риант описывает взаимную ориентацию β тя
сматриваем их, поскольку эти фибриллы обла
БИОХИМИЯ том 87 вып. 5 2022
592
МАТИИВ и др.
Рис. 3. Модель фибрилл β2 микроглобулина. Цветами выделены чередующиеся молекулы белка. Идентификаторы струк
тур, использованных при подготовке рисунка, в базе PDB ID: 1LDS, 3LOW и 3LOZ
дают некоторыми общими с амилоидами свой
Для некоторых белковых агрегатов, облада
ствами, хотя не являются ими с точки зрения
ющих рядом амилоидных свойств, эксперимен
традиционного определения. В частности, су
тально показаны принципиально другие вари
ществует гипотеза, что мономеры β2 микрогло
анты укладки белка, которые отличаются от
булина «стыкуются» друг с другом в составе аг
описанной выше кросс β структуры. В частнос
регата, сохраняя структуру, характерную для
ти, пептиды белка SOD1 формируют структуру,
мономеров и димеров этого белка (рис. 3). Рас
которая получила название β штопора. Она об
шифровка этих структур показала, что при взаи
разована антипараллельными β тяжами, кото
модействии белки «обмениваются» фрагмента
рые расположены под углом примерно 45° к оси
ми, т.е. участок одной молекулы встраивается в
фибриллы (рис. 4, а). Несмотря на то что ато
структуру другой и наоборот. Такой механизм
марная модель была получена на агрегатах ко
взаимодействия не обязательно ограничивается
роткого пептида, компьютерные симуляции по
двумя молекулами и может лежать в основе
казали, что полноразмерный белок может фор
формирования более протяжённых фибрилл.
мировать аналогичные агрегаты [61]. По другим
Любопытно, что такие агрегаты полноразмер
данным для агрегатов SOD1 показаны практи
ного белка демонстрируют дифракционную
чески все амилоидные свойства: устойчивость к
картину, характерную для кросс β структуры.
протеазам, образование фибрилл, взаимодей
Однако в данном случае высокая стабильность
ствие с тиофлавином Т [71-73].
таких полимеров обеспечивается не водород
Отдельно необходимо отметить кросс α
ными, а дисульфидными связями в участках
структуру. Такие агрегаты обогащены α спира
«обмена» доменами [69]. Отдельно стоит отме
лями, которые ориентированы перпендикуляр
тить, что для β2 микроглобулина было убеди
но оси фибриллы. Эта структура была показана
тельно продемонстрировано взаимодействие с
для фибриллярных агрегатов PSMα3, которые
амилоид специфическими красителями (тио
могут связывать тиофлавин Т (рис. 4, б) [17].
флавином Т и Конго красным) [70]. Аналогич
Другим примером агрегатов с кросс α структу
ная структура была предложена и для ряда дру
рой стали фибриллы из пептидов аполипопро
гих белков [35], однако споры о её роли именно
теина А I [74], хотя для других фрагментов это
в образовании амилоидных агрегатов продол
го белка была показана традиционная кросс β
жаются.
структура [75]. Белок MAVS образует агрегаты с
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
593
амилоидными свойствами и большим количест
разницу в укладке белка в составе протофила
вом α спиралей, но в этом случае такие фибрил
мента (полиморфизм протофиламентов), вклю
лы состоят из состыкованных глобулярных мо
чая различия в областях, образующих β лист
лекул (рис. 4, в). Формирование филамен
(сегментный полиморфизм), структуру укладки
тов MAVS основано на совместном взаимодей
кора (полиморфизм упаковки) и наличие неко
ствии четырёх поверхностей каждой субъедини
валентных кофакторов [78-80]. Сюда также
цы. В результате образуется компактная и плот
можно отнести гетероамилоиды, возникающие
ная упаковка доменов CARD в филаменты. Ве
в результате чередования мономеров с разной
роятно, благодаря сильным электростатическим
последовательностью, например, фибриллы
взаимодействиям такие агрегаты обладают ус
RIP1/RIP3 [81]. В третьих, к разнообразию ами
тойчивостью к детергентам [76, 77].
лоидных агрегатов могут привести отличия в
В этом подразделе мы представили разные
составе фибрилл. Так, фибриллы могут вклю
модели, описывающие укладку белка в составе
чать одинаковые или разные протофиламенты,
амилоидных и амилоидоподобных протофиб
их количество также может варьировать. К тому
рилл, и в заключение хотим также отметить, что
же фибриллы могут отличаться расположением
внутри каждой из этих моделей может сущест
протофибрилл относительно друг друга (ультра
вовать множество разных вариантов даже для
структурный полиморфизм)
[80]. Наконец,
одного белка [5, 78].
структурный полиморфизм может возникать в
Полиморфизм структуры фибрилл. Помимо
результате различий направления поворота, ша
рассмотренного выше многообразия вариантов
га спирали, позиции оси спирали и длины фиб
организации кросс β структур амилоидные
риллы [79].
фибриллы также характеризуются полиморфиз
Впервые детально наличие полиморфизма
мом на молекулярном уровне. Во первых, раз
было продемонстрировано для фибрилл, выде
ные амилоидные структуры могут возникать в
ленных посмертно из мозга пациентов с бо
результате таких изменений в первичной ами
лезнью Альцгеймера, которая была гистологи
нокислотной последовательности, как точечные
чески подтверждена наличием большого коли
мутации или делеции [78, 79]. Во вторых, поли
чества белковых бляшек в лобной и височной
пептидные цепи с идентичной аминокислотной
коре [82]. Эти отложения преимущественно сос
последовательностью могут демонстрировать
тояли из парных спиральных филаментов
Рис. 4. Модели белковых агрегатов SOD1 (a), PSMα3 (б) и MAVS (в), обладающих некоторыми амилоидными свойства
ми. Красной линией отмечена условная ось фибриллы. Цветами выделены чередующиеся молекулы белка. Идентифика
торы структур, использованных при подготовке рисунка, в базе данных PDB ID: 5IIW, 6GQC и 3J6C
БИОХИМИЯ том 87 вып. 5 2022
594
МАТИИВ и др.
или PHF (от англ. paired helical filament). Их ши
белка. Здесь стоит отметить, что филаменты Aβ,
рина варьировала от 8 до 20 нм, а шаг спирали
выделенные из мозга, состояли из Aβ (1-40), в то
составлял 80 нм. Другой тип агрегатов, обнару
время как белки, полученные in vitro, состояли
женный в отложениях, получил название пря
из Aβ (1-42) [90, 91]. Подробно полиморфизм
мых филаментов или SF (от англ. straight fila
фибрилл Aβ освещён в обзоре Lau et al. [92].
ment). Их ширина составила около 15 нм и фак
Среди амилоидных агрегатов человеческого
тически не отличалась для разных филаментов в
α синуклеина в одних случаях наблюдают гомо
отличие от PHF. Описанные варианты имели
генные закрученные фибриллы [93], а в дру
общие поверхностные эпитопы, в сечении фиб
гих - смесь скрученных и прямых фибрилл [94].
рилл в обоих случаях белок формировал сход
Фибриллы α синуклеина из разных организмов
ные С образные структуры, относительное рас
также могут отличаться между собой, что явля
положение которых у PHF и SF различалось.
ется примером полиморфизма, вызванного пос
Также PHF и SF могли образовывать гибридные
ледовательностью белка. Например, спонтан
филаменты, сочетающие обе морфологии. Та
ная агрегация in vitro α синуклеина человека и
ким образом, было выдвинуто предположение,
мыши приводит к образованию фибрилл с отли
что фибриллы PHF и SF отличаются расположе
чающимися морфологическими и биохимичес
нием протофибрилл с одинаковой структурой.
кими характеристиками: α синуклеин человека
Дальнейшие исследования показали, что PHF и
формирует преимущественно закрученные фиб
SF состоят из аномально гиперфосфорилиро
риллы, в то время как фибриллы белка мыши -
ванного белка тау [83]. Впоследствии с исполь
прямые [93]. Кроме этого, фибриллы мышиного
зованием метода криоэлектронной микроско
α синуклеина более чувствительны к обработке
пии (крио ЭМ) были получены модели PHF и
протеиназой К [93, 95]. Также морфология фиб
SF с атомарным разрешением, которые под
рилл α синуклеина человека зависит от амино
твердили высказанную гипотезу. В PHF два про
кислотных замен. Как правило, белок с замена
тофиламента образуют идентичные структуры
ми S87N, L100M и N122S формирует преимуще
со спиральной симметрией, а поверхность раз
ственно скрученный тип фибрилл, с заме
дела образована антипараллельной укладкой ос
ной A53T - прямой тип фибрилл, а мутантные
татков 332PGGGQ336. В SF два протофиламента
варианты с заменами N103G, A107Y и D121G
упаковываются асимметрично.
образуют как скрученные фибриллы, так и пуч
Структуры филаментов белка тау были также
ки прямых фибрилл [93]. Варианты α синукле
определены с помощью крио ЭМ в нескольких
ина дикого типа могут отличаться структурой
последующих работах с использованием посмерт
протофиламентов, их взаимным расположени
ных препаратов мозга людей с диагностирован
ем и вариантом взаимодействия [79]. Например,
ной болезнью Альцгеймера [84], болезнью Пи
интерфейсы двух протофиламентов могут быть
ка [85], хронической травматической энцефало
образованы гидрофобными стерическими зас
патией [86] и кортикобазальной дегенераци
тёжками либо межмолекулярными солевыми
ей [87]. Примечательно, что структуры фила
мостиками [96].
ментов тау для этих заболеваний отличаются
Фрагменты белка TDP 43 способны образо
между собой. Было также проведено крио ЭМ
вывать различные агрегаты. Для сегмента SegA
исследование структуры филаментов двух ре
(аминокислотные остатки 311-360) можно вы
комбинантных изоформ белка тау, полученных
делить три типа фибриллярных структур, обоз
in vitro, в присутствии гепарина. Оказалось, что
начаемые SegA sym, SegA asym и SegA slow. При
их структура отличается от агрегатов, выделен
этом сегмент SegB (аминокислотные остат
ных из мозга (в частности, уменьшенным разме
ки 286-331) образует иной тип фибрилл [97].
ром складок), и для одной из изоформ представ
Все варианты агрегатов SegA312-346 имеют специ
ляет собой смесь из четырёх конформаций [88].
фическую укладку белка. Этот фрагмент в соста
При этом показано, что амилоиды белка тау,
ве фибрилл образует вытянутую β арку, напоми
экстрагированные из тканей, более эффективно
нающую кинжал (dagger shape). Разнообразие
индуцируют агрегацию мономерного белка по
агрегатов сводится к отличиям в количестве
сравнению с препаратами, полученными in vitro.
протофиламентов и в их симметрии. Фибриллы
По всей видимости, за это отвечают конформа
SegA sym содержат два одинаковых протофила
ционные различия между такими агрегата
мента, тогда как фибриллы SegA asym содержат
ми [89].
два протофиламента с различными конформа
Структуры филаментов Aβ, выделенных
циями. Фибриллы SegA slow содержат четыре
посмертно из мозга пациентов с болезнью Альц
протофиламента: два протофиламента, включа
геймера, также отличаются от структур фила
ющие по 50 остатков, окружённые двумя други
ментов, собранных in vitro из рекомбинантного
ми протофиламентами из 10 остатков в составе
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
595
фибриллярной структуры. SegB (с заменой
риллы, а находятся под углом ~ 50° [104]. В обо
A315E) образует протофибриллы с одинаковой
их вариантах β слои состоят из антипараллель
R образной укладкой белка в поперечном сече
ных тяжей. Полноразмерный белок, в свою оче
нии, а каждая фибрилла состоит из четырёх про
редь, собирается в кросс α фибриллы. Мутанты
тофиламентов [97].
полноразмерного PSMα3 также способны обра
При получении фибрилл β2 микроглобули
зовывать различные кросс α фибриллы [62].
на in vitro в одном образце могут образовываться
Морфологически отличные структуры были
амилоидные агрегаты с широким спектром мор
отмечены для фибрилл амилина. Так, они могут
фологий, характеризующихся разным количест
состоять из одного, двух, трёх или пяти прото
вом протофиламентов, а также отличающихся
филаментов [105]. Кроме того, отличаются мор
шагом спирали скрученной фибриллы [98, 99].
фологии фибрилл полноразмерного белка и его
Наиболее часто встречающийся тип фибрилл
фрагментов [106]. Амилоидные агрегаты амили
имеет явную скрученность и сформирован дву
на, состоящие из двух протофиламентов, могут,
мя протофиламентами. Субъединицы в таких
в свою очередь, отличаться их структурой и вза
фибриллах имеют упорядоченное L образное
имным расположением [107]. К тому же к изме
поперечное сечение [98, 99]. Детальный анализ
нению морфологических особенностей фиб
при помощи крио ЭМ позволяет наблюдать
рилл амилина может приводить наличие амино
различные морфологии: более тонкие фибрил
кислотных замен [108].
лы, состоящие из одного протофиламента, и бо
Необычные структуры могут образовывать
лее толстые, сформированные четырьмя прото
фрагменты транстиретина (TTR) in vitro. Фиб
филаментами [99]. Кроме того, β2 микроглобу
риллы TTR образованы переплетением двух
лин может образовывать фибриллы с разной
протофиламентов и могут быть представлены
структурой в зависимости от эксперименталь
тремя разными вариантами, а именно: дуплет
ных условий. Например, при различных концен
ными, триплетными и квадруплетными. В попе
трациях 2,2,2 трифторэтанола формируются
речном сечении видно, что такие фибриллы вме
амилоидные агрегаты со схожей «игольчатой»
щают пары из двух, трёх и четырёх взаимо
морфологией, различающиеся по интервалу
связанных протофиламентов соответствен
между витками фибриллы, интенсивности флуо
но [60]. Принципиально другая картина наблю
ресценции тиофлавина Т и спектрам флуорес
дается для фибрилл, полученных из образцов
ценции триптофана даже в одинаковых раство
больных с транстиретиновым амилоидозом.
рителях, что указывает на формирование раз
В этом случае фибрилла состоит из одного про
личных структур [100].
тофиламента, который образован N концевым и
Инсулин способен формировать большой
С концевым фрагментами транстиретина [109].
спектр морфологически различных амилоидных
Среди фибрилл белка сывороточного амило
агрегатов. Его фибриллы могут состоять из пары
ида А (SAA) наблюдаются различные варианты
протофиламентов, закручивающихся друг вок
структур как в образцах из тканей мыши, так и в
руг друга, четырёх протофиламентов в компакт
препаратах, полученных in vitro. В первом случае
ной фибрилле, шести протофиламентов, закру
фибриллы отличаются количеством протофила
ченных лент, а также плоских лент параллель
ментов (двух или трёх) в своём составе. Вырав
ных протофиламентов [101]. При низких концен
нивание структур белков, входящих в состав
трациях инсулина отмечают образование более
фибрилл с разной морфологией, показывает
мелких, отделённых друг от друга фибрилл, не
лишь небольшие конформационные различия в
жели при высоких концентрациях [102]. На об
их укладке. В случае агрегатов in vitro фибриллы
разование различных типов фибрилл инсулина
могут состоять из двух или четырёх протофиб
также могут влиять соли и температура инкуба
рилл. Фибриллы ex vivo и in vitro также отлича
ции [103].
ются между собой укладкой белка в составе про
Фрагменты белка PSMα3 могут формиро
тофиламентов и чувствительностью к протеоли
вать агрегаты, обогащённые β листами, но от
зу [110].
личающиеся от «традиционной» кросс β струк
Большинство описанных примеров относят
туры. Для них также показан полиморфизм
ся к патологическим амилоидам. В связи с этим
структуры фибрилл [104]. Один вариант прин
может возникнуть вопрос, почему разнообразие
ципиально отличается отсутствием сухой поверх
возможных амилоидных конформаций для од
ности между парами β листов. Вместо этого гек
ного белка гораздо больше по сравнению с гло
самеры β листов образуют цилиндрические ка
булярными вариантами укладки. В литературе
налы, идущие вдоль агрегата. Второй вариант
было выдвинуто предположение, что вариабель
состоит из β листов «вне регистра». Это означа
ность структур, наблюдаемая в амилоидных
ет, что β тяжи не перпендикулярны оси фиб
фибриллах, возникает из за отсутствия эволю
БИОХИМИЯ том 87 вып. 5 2022
596
МАТИИВ и др.
ционного давления, которому подвержены бел
ми структуры приводят к разным по силе изме
ки, конформация которых важна для выполне
нениям клеточных процессов. Например, при
ния конкретных функций [97].
он [PSI+] приводит к нонсенс супрессии (рас
познаванию преждевременных стоп кодонов
как значащих), а его варианты отличаются эф
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
фективностью этого процесса [126, 127]. Хотя
СТРУКТУРНЫХ ВАРИАЦИЙ
некоторые авторы выделяют множество вариан
АМИЛОИДНЫХ ФИБРИЛЛ
тов [PSI+] [128], детальный анализ показывает,
что основными являются два варианта, сильный
Наиболее ярким примером взаимосвязи
и слабый, в то время как другие варианты явля
между структурой агрегатов и их биологической
ются более редкими [129]. Показано, что NM
ролью являются прионы, которые зачастую яв
домен Sup35, ответственный за образование
ляются инфекционными амилоидами. В случае
приона [PSI+], в случае сильных и слабых вари
первого описанного приона, PrP, его варианты
антов [PSI+] характеризуется различной кон
приводят к развитию разных заболеваний, кото
формацией. При этом фибриллы, полученные
рые отличаются по зонам поражения головного
на основе лизатов штамма с сильным [PSI+], бо
мозга, скорости развития, патологической кар
лее тонкие по сравнению с фибриллами из
тине, возможности передачи другим видам и т.д.
штамма со слабым [PSI+] [130]. Тот факт, что
Важно отметить, что первичная структура бел
именно структура фибрилл определяет фенотип
ка PrP остаётся неизменной, а наблюдаемые
приона, а не наоборот, был впервые наглядно
различия определяются трёхмерной структурой
продемонстрирован с помощью метода белко
агрегатов этого белка [111-114]. В то же время
вой трансформации дрожжей. Фибриллы
небольшие вариации в последовательности,
Sup35NM, полученные in vitro при различных
связанные с аминокислотными заменами, а так
температурах и отличающиеся по структуре,
же вариации в посттрансляционных модифика
приводили к возникновению различных по силе
циях могут приводить к появлению новых
фенотипа вариантов приона in vivo [131]. Позд
структурных вариантов [41, 115, 116].
нее эти результаты получили независимое под
Похожий феномен описан и для других ами
тверждение [132, 133].
лоидов, прионные свойства которых остаются
Значительной проблемой, обнаруженной в
под вопросом. Например, разные по форме аг
последние годы, является существование струк
регаты α синуклеина (олигомеры, фибриллы и
турных различий между белками, полученными
ленточные агрегаты) приводят к различной гис
in vitro (т.е. белками, наработанными в клетках
топатологической картине после инъекции в
бактерий или синтезированными химически), и
мозг животных [117]. Показано, что в случае та
белками, выделенными из тканей. Например, с
ких синуклеинопатий, как болезнь Паркинсона,
помощью крио ЭМ и атомно силовой микро
множественная системная атрофия (МСА) и де
скопии (АСМ) показано, что неинфекционные
менция с тельцами Леви, структуры филаментов
рекомбинантные фибриллы PrP, выделенные из
α синуклеина из мозга больных людей различа
клеток Escherichia coli, по своей структуре отли
ются [118-121].
чаются от инфекционных фибрилл, выделен
Фибриллы и олигомеры Aβ (1-40) значи
ных из мозга больных мышей [134]. Авторы объ
тельно различались по токсичности в нейро
ясняют эти различия гликозилированием PrP,
нальных культурах клеток. В частности, фиб
присутствующим в его нормальном клеточном
риллы, полученные in vitro без перемешивания,
окружении и отсутствующим в клетках бакте
более токсичны, чем фибриллы, полученные
рий. Похожий феномен описан для α синуклеи
при перемешивании [122]. Несмотря на поли
на, при наработке которого в клетках бактерий
морфную природу агрегации Aβ (1-40), фиб
значительная часть рекомбинантного белка
риллярные структуры у конкретного пациента с
(до 50%) может содержать замену Y136С. Мутант
болезнью Альцгеймера однородны по всей коре
ный белок образуется за счёт ошибок трансля
головного мозга и отличаются от таковых у дру
ции эукариотической мРНК в клетках бакте
гих пациентов [91, 123]. Для агрегированного
рий, и, в отличие от белка дикого типа, характе
белка тау также описано существование различ
ризуется низкой способностью к агрегации и от
ных конформаций, определяющих разнообра
сутствием амилоидных свойств [135]. Также по
зие клинических проявлений многочисленных
казано, что структуры филаментов α синуклеи
подтипов таупатии [124].
на из головного мозга больных МСА отличают
Аналогичные примеры описаны и для прио
ся от структур, образованных рекомбинантны
нов дрожжей: [PSI+], [PIN+] и [URE3] [125].
ми белками, выделенными из бактерий; основ
В этих случаях агрегаты с различными варианта
ные отличия заключаются в протяжённых
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
597
складках протофиламентов, их асимметричной
вышенную стабильность агрегатов по сравне
упаковке и наличии небелковых молекул между
нию с мономерным белком при различных воз
протофиламентами [121]. Аналогично, фибрил
действиях. Однако существуют примеры и тер
лы Aβ (1-40), изолированные из тканей голов
молабильных амилоидов с кросс β структурой,
ного мозга пациентов, умерших от болезни
таких как FUS и hnRNPA1. Амилоиды и амило
Альцгеймера, по своей структуре отличались от
идоподобные агрегаты характеризуются различ
тех, которые были охарактеризованы в случае
ными конформациями белков в составе прото
химически синтезированного пептида Aβ (1-40)
филаментов, такими как параллельные и анти
[91]. Авторы объясняют эти различия тем, что
параллельные β листы, β соленоиды, а также
использованные условия образования фибрилл
другими, более редкими вариантами. Помимо
in vitro не совсем соответствуют условиям обра
многообразия вариантов кросс β структуры,
зования фибрилл in vivo. Для приона дрож
амилоидные комплексы также характеризуются
жей [PSI+] также получены сходные результаты,
полиморфизмом на различных уровнях органи
согласно которым данные, полученные с ис
зации фибрилл. Дальнейшее изучение структу
пользованием фибрилл Sup35, спонтанно обра
ры амилоидов, а также систематизация данных
зующихся in vitro, могут значительно отличаться
об их разнообразии может помочь связать вари
от данных, полученных с вариантами прио
анты их укладки с молекулярными механизма
на [PSI+] in vivo [129].
ми развития патологий при амилоидозах.
ЗАКЛЮЧЕНИЕ
Финансирование. Исследование выполнено
при финансовой поддержке Российского фонда
Амилоиды являются уникальными белковы
фундаментальных исследований (научный про
ми комплексами с кросс β структурой и рядом
ект № 20 34 90117).
необычных свойств. В рамках этой статьи мы
Конфликт интересов. Авторы заявляют об от
рассмотрели возможные модели связывания тио
сутствии конфликта интересов.
флавина Т и Конго красного с амилоидными
Соблюдение этических норм. Настоящая
комплексами, а также то, что подобное взаимо
статья не содержит описания каких либо иссле
действие не всегда является специфическим.
дований с участием людей или животных в каче
Необычная структура амилоидов объясняет по
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Sipe, J. D., Benson, M. D., Buxbaum, J. N., Ikeda, S.,
7. Howie, A. J., and Brewer, D. B. (2009) Optical properties
Merlini, G., et al. (2012) Amyloid fibril protein nomencla
of amyloid stained by Congo red: History and mechanisms,
ture: 2012 recommendations from the Nomenclature
Micron, 40, 285 301, doi: 10.1016/j.micron.2008.10.002.
Committee of the International Society of Amyloidosis,
8. Krebs, M. R. H., Bromley, E. H. C., and Donald, A. M.
Amyloid,
19,
167170, doi:
10.3109/13506129.2012.
(2005) The binding of thioflavin T to amyloid fibrils:
734345.
Localisation and implications, J. Struct. Biol., 149, 30 37,
2.
Sergeeva, A. V., and Galkin, A. P. (2020) Functional amy
doi: 10.1016/j.jsb.2004.08.002.
loids of eukaryotes: criteria, classification, and biological
9. Howie, A. J., Brewer, D. B., Howell, D., and Jones, A. P.
significance, Curr. Genet., 66, 849 866, doi: 10.1007/
(2008) Physical basis of colors seen in Congo red stained
s00294 020 01079 7.
amyloid in polarized light, Lab. Invest., 88, 232 242,
3.
Matiiv, A. B., Trubitsina, N. P., Matveenko, A. G.,
doi: 10.1038/labinvest.3700714.
Barbitoff, Y. A., Zhouravleva, G. A., et al. (2020) Amyloid
10. Biancalana, M., Makabe, K., Koide, A., and Koide, S.
and amyloid like aggregates: diversity and the term crisis,
(2009) Molecular mechanism of thioflavin T binding to
Biochemistry. (Moscow), 85, 1011 1034, doi: 10.1134/
the surface of beta rich peptide self assemblies, J. Mol.
S0006297920090035.
Biol., 385, 1052 1063, doi: 10.1016/j.jmb.2008.11.006.
4.
Rubel, M. S., Fedotov, S. A., Grizel, A. V., Sopova, J. V.,
11. Kajava, A. V., Baxa, U., Wickner, R. B., and Steven, A. C.
Malikova, O. A., et al. (2020) Functional mammalian
(2004) A model for Ure2p prion filaments and other amy
amyloids and amyloid like proteins, Life (Basel), 10, 156,
loids: the parallel superpleated β structure, Proc. Natl.
doi: 10.3390/life10090156.
Acad. Sci. USA, 101, 78857890, doi: 10.1073/pnas.
5.
Iadanza, M. G., Jackson, M. P., Hewitt, E. W., Ranson, N.
0402427101.
A., and Radford, S. E. (2018) A new era for understanding
12. Groenning, M., Norrman, M., Flink, J. M., van de Weert,
amyloid structures and disease, Nat. Rev. Mol. Cell Biol.,
M., Bukrinsky, J. T., et al. (2007) Binding mode of
19, 755 773, doi: 10.1038/s41580 018 0060 8.
Thioflavin T in insulin amyloid fibrils, J. Struct. Biol., 159,
6.
Groenning, M. (2010) Binding mode of Thioflavin T and
483 497, doi: 10.1016/j.jsb.2007.06.004.
other molecular probes in the context of amyloid fibrils
13. Kuznetsova, I. M., Sulatskaya, A. I., Uversky, V. N., and
current status, J. Chem. Biol., 3, 1 18, doi: 10.1007/
Turoverov, K. K. (2012) A new trend in the experimental
s12154 009 0027 5.
methodology for the analysis of the thioflavin T binding to
БИОХИМИЯ том 87 вып. 5 2022
598
МАТИИВ и др.
amyloid fibrils, Mol. Neurobiol., 45, 488 498, doi: 10.1007/
assemble networks, Science, 359, 698 701, doi: 10.1126/
s12035 012 8272 y.
science.aan6398.
14.
Sulatskaya, A. I., Kuznetsova, I. M., Belousov, M. V.,
29.
Luo, F., Gui, X., Zhou, H., Gu, J., Li, Y., et al. (2018)
Bondarev, S. A., Zhouravleva, G. A., et al.
(2016)
Atomic structures of FUS LC domain segments reveal
Stoichiometry and affinity of thioflavin T binding to
bases for reversible amyloid fibril formation, Nat. Struct.
Sup35p amyloid fibrils, PLoS One,
11, e0156314,
Mol. Biol., 25, 341 346, doi: 10.1038/s41594 018 0050 8.
doi: 10.1371/journal.pone.0156314.
30.
Gui, X., Luo, F., Li, Y., Zhou, H., Qin, Z., et al. (2019)
15.
Chang, H. Y., Lin, J. Y., Lee, H. C., Wang, H. L., and
Structural basis for reversible amyloids of hnRNPA1 eluci
King, C. Y. (2008) Strain specific sequences required for
dates their role in stress granule assembly, Nat. Commun.,
yeast [PSI+] prion propagation, Proc. Natl. Acad. Sci. USA,
10, 2006, doi: 10.1038/s41467 019 09902 7.
105, 13345 13350, doi: 10.1073/pnas.0802215105.
31.
Hughes, M. P., Goldschmidt, L., and Eisenberg, D. S.
16.
Kabani, M., and Melki, R. (2020) The Yarrowia lipolytica
(2021) Prevalence and species distribution of the low com
orthologs of Sup35p assemble into thioflavin T negative
plexity, amyloid like, reversible, kinked segment structural
amyloid fibrils, Biochem. Biophys. Res. Commun., 529, 533
motif in amyloid like fibrils, J. Biol. Chem., 297, 101194,
539, doi: 10.1016/j.bbrc.2020.06.024.
doi: 10.1016/j.jbc.2021.101194.
17.
Tayeb Fligelman, E., Tabachnikov, O., Moshe, A.,
32.
Kajava, A. V., Baxa, U., and Steven, A. C. (2010) Beta
Goldshmidt Tran, O., Sawaya, M. R., et al.
(2017)
arcades: Recurring motifs in naturally occurring and dis
The cytotoxic Staphylococcus aureus PSMα3 reveals a
ease related amyloid fibrils, FASEB J., 24, 1311 1319,
cross α amyloid like fibril, Science,
355,
831833,
doi: 10.1096/fj.09 145979.
doi: 10.1126/science.aaf4901.
33.
Hennetin, J., Jullian, B., Steven, A. C., and Kajava, A. V.
18.
Parker, C. A., and Joyce, T. A. (1973) Prompt and delayed
(2006) Standard conformations of beta arches in beta
fluorescence of some DNA adsorbates, Photochem.
solenoid proteins, J. Mol. Biol.,
358,
10941105,
Photobiol., 18, 467 474, doi: 10.1111/j.1751 1097.1973.
doi: 10.1016/j.jmb.2006.02.039.
tb06451.x.
34.
Trott, O., and Olson, A. J. (2010) AutoDock Vina:
19.
Cundall, R. B., Davies, A. K., Morris, P. G., and
Improving the speed and accuracy of docking with a new
Williams, J. (1981) Factors influencing the photosensitiz
scoring function, efficient optimization, and multithread
ing properties and photoluminescence of thioflavin T,
ing, J. Comput. Chem., 31, 455 461, doi: 10.1002/jcc.21334.
J. Photochem.,
17,
369376, doi:
10.1016/0047
35.
Shewmaker, F., McGlinchey, R. P., and Wickner, R. B.
2670(81)85379 8.
(2011) Structural insights into functional and pathological
20.
Verma, S., Ravichandiran, V., and Ranjan, N. (2021)
amyloid, J. Biol. Chem., 286, 16533 16540, doi: 10.1074/
Beyond amyloid proteins: Thioflavin T in nucleic acid
jbc.R111.227108.
recognition, Biochimie, 190, 111123, doi: 10.1016/
36.
Qiang, W., Yau, W. M., Luo, Y., Mattson, M. P., and
j.biochi.2021.06.003.
Tycko, R. (2012) Antiparallel β sheet architecture in Iowa
21.
Sipe, J. D., Benson, M. D., Buxbaum, J. N., Ikeda, S. I.,
mutant β amyloid fibrils, Proc. Natl. Acad. Sci. USA, 109,
Merlini, G., et al. (2016) Amyloid fibril proteins and amy
4443 4448, doi: 10.1073/pnas.1111305109.
loidosis: Chemical identification and clinical classification
37.
Antzutkin, O. N., Balbach, J. J., Leapman, R. D., Rizzo,
International Society of Amyloidosis 2016 Nomenclature
N. W., Reed, J., et al. (2000) Multiple quantum solid state
Guidelines, Amyloid, 23, 209 213, doi: 10.1080/13506129.
NMR indicates a parallel, not antiparallel, organization of
2016.1257986.
beta sheets in Alzheimer’s beta amyloid fibrils, Proc. Natl.
22.
Khurana, R., Uversky, V. N., Nielsen, L., and Fink, A. L.
Acad. Sci. USA, 97, 13045 13050, doi: 10.1073/pnas.
(2001) Is Congo red an amyloid specific dye? J. Biol.
230315097.
Chem., 276, 22715 22721, doi: 10.1074/jbc.M011499200.
38.
Gao, Y., Guo, C., Watzlawik, J. O., Randolph, P. S., Lee,
23.
Bousset, L., Redeker, V., Decottignies, P., Dubois, S., Le
E. J., et al. (2020) Out of register parallel β sheets and
Maréchal, P., et al. (2004) Structural characterization of
antiparallel β sheets coexist in 150 kDa oligomers formed
the fibrillar form of the yeast Saccharomyces cerevisiae
by amyloid β (1 42), J. Mol. Biol., 432, 43884407,
prion Ure2p, Biochemistry, 43, 5022 5032, doi: 10.1021/
doi: 10.1016/j.jmb.2020.05.018.
bi049828e.
39.
Leinala, E. K., Davies, P. L., Doucet, D., Tyshenko, M.
24.
Yakupova, E. I., Bobyleva, L. G., Vikhlyantsev, I. M., and
G., Walker, V. K., et al. (2002) A β helical antifreeze pro
Bobylev, A. G. (2019) Congo red and amyloids: history and
tein isoform with increased activity, J. Biol. Chem., 277,
relationship, Biosci. Rep., 39, BSR20181415, doi: 10.1042/
33349 33352, doi: 10.1074/jbc.M205575200.
BSR20181415.
40.
Flores Fernández, J., Rathod, V., and Wille, H. (2018)
25.
Nelson, R., Sawaya, M. R., Balbirnie, M., Madsen, A. Ø.,
Comparing the folds of prions and other pathogenic amy
Riekel, C., et al. (2005) Structure of the cross beta spine of
loids, Pathogens, 7, 50, doi: 10.3390/pathogens7020050.
amyloid like fibrils, Nature, 435, 773 778, doi: 10.1038/
41.
Kraus, A., Hoyt, F., Schwartz, C. L., Hansen, B.,
nature03680.
Artikis, E., et al. (2021) High resolution structure and
26.
Sawaya, M. R., Sambashivan, S., Nelson, R., Ivanova,
strain comparison of infectious mammalian prions, Mol.
M. I., Sievers, S. A., et al. (2007) Atomic structures of amy
Cell, 81, 4540 4551.e6, doi: 10.1016/j.molcel.2021.08.011.
loid cross beta spines reveal varied steric zippers, Nature,
42.
Van Melckebeke, H., Wasmer, C., Lange, A., Ab, E.,
447, 453 457, doi: 10.1038/nature05695.
Loquet, A., et al. (2010) Atomic resolution three dimen
27.
Kato, M., Han, T. W., Xie, S., Shi, K., Du, X., et al. (2012)
sional structure of HET s(218 289) amyloid fibrils by
Cell free formation of RNA granules: Low complexity
solid state NMR spectroscopy, J. Am. Chem. Soc., 132,
sequence domains form dynamic fibers within hydrogels,
13765 13775, doi: 10.1021/ja104213j.
Cell, 149, 753 767, doi: 10.1016/j.cell.2012.04.017.
43.
Fitzpatrick, A. W. P., Falcon, B., He, S., Murzin, A. G.,
28.
Hughes, M. P., Sawaya, M. R., Boyer, D. R., Goldschmidt,
Murshudov, G., et al. (2017) Cryo EM structures of tau fil
L., Rodriguez, J. A., et al. (2018) Atomic structures of low
aments from Alzheimer’s disease, Nature, 547, 185 190,
complexity protein segments reveal kinked β sheets that
doi: 10.1038/nature23002.
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
599
44.
Louros, N. N., Baltoumas, F. A., Hamodrakas, S. J., and
58.
Maji, S. K., Wang, L., Greenwald, J., and Riek, R. (2009)
Iconomidou, V. A. (2016) A β solenoid model of the
Structure activity relationship of amyloid fibrils, FEBS
Pmel17 repeat domain: Insights to the formation of func
Lett., 583, 26102617, doi: 10.1016/j.febslet.2009.07.
tional amyloid fibrils, J. Comput. Aided Mol. Des., 30, 153
003.
164, doi: 10.1007/s10822 015 9892 x.
59.
Hoshino, M., Katou, H., Hagihara, Y., Hasegawa, K.,
45.
Liu, W., Li, C., Shan, J., Wang, Y., and Chen, G. (2021)
Naiki, H., and Goto, Y. (2002) Mapping the core of the
Insights into the aggregation mechanism of RNA recogni
β2 microglobulin amyloid fibril by H/D exchange, Nat.
tion motif domains in TDP 43: a theoretical exploration,
Struct. Biol., 9, 332 336, doi: 10.1038/nsb792.
R. Soc. Open Sci., 8, 210160, doi: 10.1098/rsos.210160.
60.
Fitzpatrick, A. W. P., Debelouchina, G. T., Bayro, M. J.,
46.
Baxa, U., Wickner, R. B., Steven, A. C., Anderson, D. E.,
Clare, D. K., Caporini, M. A., et al. (2013) Atomic struc
Marekov, L. N., et al. (2007) Characterization of beta
ture and hierarchical assembly of a cross β amyloid fibril,
sheet structure in Ure2p1 89 yeast prion fibrils by solid
Proc. Natl. Acad. Sci. USA, 110, 5468 5473, doi: 10.1073/
state nuclear magnetic resonance, Biochemistry, 46, 13149
pnas.1219476110.
13162, doi: 10.1021/bi700826b.
61.
Sangwan, S., Zhao, A., Adams, K. L., Jayson, C. K.,
47.
Camino, J. D., Gracia, P., Chen, S. W., Sot, J., de la
Sawaya, M. R., et al. (2017) Atomic structure of a toxic,
Arada, I., et al. (2020) The extent of protein hydration dic
oligomeric segment of SOD1 linked to amyotrophic lateral
tates the preference for heterogeneous or homogeneous
sclerosis (ALS), Proc. Natl. Acad. Sci. USA, 114, 8770
nucleation generating either parallel or antiparallel β sheet
8775, doi: 10.1073/pnas.1705091114.
α synuclein aggregates, Chem. Sci., 11, 11902 11914,
62.
Tayeb Fligelman, E., Salinas, N., Tabachnikov, O., and
doi: 10.1039/D0SC05297C.
Landau, M. (2020) Staphylococcus aureus PSMα3 cross α
48.
Do, H. Q., Hewetson, A., Myers, C., Khan, N. H.,
fibril polymorphism and determinants of cytotoxicity,
Hastert, M. C., et al. (2019) The functional mammalian
Structure, 28, 301 313.e6, doi: 10.1016/j.str.2019.12.006.
CRES (Cystatin Related Epididymal Spermatogenic)
63.
Xu, H., He, X., Zheng, H., Huang, L. J., Hou, F., et al.
amyloid is antiparallel β sheet rich and forms a metastable
(2014) Structural basis for the prion like MAVS filaments
oligomer during assembly, Sci. Rep.,
9,
9210,
in antiviral innate immunity, Elife,
3, e01489,
doi: 10.1038/s41598 019 45545 w.
doi: 10.7554/eLife.01489.
49.
Rigoldi, F., Metrangolo, P., Redaelli, A., and Gautieri, A.
64.
Kajava, A. V., and Steven, A. C. (2006) Beta rolls, beta
(2017) Nanostructure and stability of calcitonin amyloids,
helices, and other beta solenoid proteins, Adv. Protein
J. Biol. Chem., 292, 7348 7357, doi: 10.1074/jbc.M116.
Chem., 73, 55 96, doi: 10.1016/S0065 3233(06)73003 0.
770271.
65.
Steinbacher, S., Seckler, R., Miller, S., Steipe, B., Huber,
50.
Khatun, S., Singh, A., Pawar, N., and Gupta, A. N. (2019)
R., et al. (1994) Crystal structure of P22 tailspike protein:
Aggregation of amylin: spectroscopic investigation, Int. J.
interdigitated subunits in a thermostable trimer, Science,
Biol. Macromol., 133, 1242 1248, doi: 10.1016/j.ijbiomac.
265, 383 386, doi: 10.1126/science.8023158.
2019.04.167.
66.
Simkovsky, R., and King, J. (2006) An elongated spine of
51.
Lecoq, L., Wiegand, T., Rodriguez Alvarez, F. J.,
buried core residues necessary for in vivo folding of the par
Cadalbert, R., Herrera, G. A., et al. (2019) A substantial
allel beta helix of P22 tailspike adhesin, Proc. Natl. Acad.
structural conversion of the native monomer leads to in
Sci. USA, 103, 3575 3580, doi: 10.1073/pnas.0509087103.
register parallel amyloid fibril formation in Light chain
67.
Schuler, B., Rachel, R., and Seckler, R. (1999) Formation
amyloidosis, Chembiochem, 20, 1027 1031, doi: 10.1002/
of fibrous aggregates from a non native intermediate: the
cbic.201800732.
isolated P22 tailspike beta helix domain, J. Biol. Chem.,
52.
Son, M., and Wickner, R. B. (2018) Nonsense mediated
274, 18589 18596, doi: 10.1074/jbc.274.26.18589.
mRNA decay factors cure most [PSI+] prion variants, Proc.
68.
Tycko, R., and Wickner, R. B. (2013) Molecular structures
Natl. Acad. Sci. USA, 115, E1184 E1193, doi: 10.1073/
of amyloid and prion fibrils: consensus versus controversy,
pnas.1717495115.
Acc. Chem. Res., 46, 1487 1496, doi: 10.1021/ar300282r.
53.
Kishimoto, A., Hasegawa, K., Suzuki, H., Taguchi, H.,
69.
Liu, C., Sawaya, M. R., and Eisenberg, D.
(2011)
Namba, K., et al. (2004) β helix is a likely core structure
β microglobulin forms three dimensional domain
of yeast prion Sup35 amyloid fibers, Biochem. Biophys.
swapped amyloid fibrils with disulfide linkages, Nat. Struct.
Res. Commun., 315, 739 745, doi: 10.1016/j.bbrc.2004.
Mol. Biol., 18, 49 55, doi: 10.1038/nsmb.1948.
01.117.
70.
McParland, V. J., Kad, N. M., Kalverda, A. P., Brown, A.,
54.
Wickner, R. B., Dyda, F., and Tycko, R. (2008) Amyloid of
Kirwin Jones, P., et al. (2000) Partially unfolded states of
Rnq1p, the basis of the [PIN+] prion, has a parallel in reg
beta(2) microglobulin and amyloid formation in vitro,
ister beta sheet structure, Proc. Natl. Acad. Sci. USA, 105,
Biochemistry, 39, 8735 8746, doi: 10.1021/bi000276j.
2403 2408, doi: 10.1073/pnas.0712032105.
71.
Mateju, D., Franzmann, T. M., Patel, A., Kopach, A.,
55.
Cervantes, S. A., Bajakian, T. H., Soria, M. A., Falk, A. S.,
Boczek, E. E., et al. (2017) An aberrant phase transition of
Service, R. J., et al. (2016) Identification and structural
stress granules triggered by misfolded protein and prevent
characterization of the N terminal amyloid core of Orb2
ed by chaperone function, EMBO J., 36, 1669 1687,
isoform A, Sci. Rep., 6, 38265, doi: 10.1038/srep38265.
doi: 10.15252/embj.201695957.
56.
Jayasinghe, S. A., and Langen, R. (2004) Identifying struc
72.
Ida, M., Ando, M., Adachi, M., Tanaka, A., Machida, K.,
tural features of fibrillar islet amyloid polypeptide using
et al. (2016) Structural basis of Cu, Zn superoxide dismu
site directed spin labeling, J. Biol. Chem., 279, 48420
tase amyloid fibril formation involves interaction of multi
48425, doi: 10.1074/jbc.M406853200.
ple peptide core regions, J. Biochem., 159, 247 260,
57.
Reich, L., Becker, M., Seckler, R., and Weikl, T. R. (2009)
doi: 10.1093/jb/mvv091.
In vivo folding efficiencies for mutants of the P22 tailspike
73.
Baumer, K. M., Koone, J. C., and Shaw, B. F. (2020)
β helix protein correlate with predicted stability changes,
Kinetic variability in seeded formation of ALS linked sod1
Biophys. Chem., 141, 186 192, doi: 10.1016/j.bpc.2009.
fibrils across multiple generations, ACS Chem. Neurosci.,
01.015.
11, 304 313, doi: 10.1021/acschemneuro.9b00464.
БИОХИМИЯ том 87 вып. 5 2022
600
МАТИИВ и др.
74.
Lazar, K. L., Miller Auer, H., Getz, G. S., Orgel,
90. Gremer, L., Schölzel, D., Schenk, C., Reinartz, E.,
J. P. R. O., and Meredith, S. C. (2005) Helix turn helix
Labahn, J., et al. (2017) Fibril structure of amyloid β (1
peptides that form alpha helical fibrils: turn sequences
42) by cryo electron microscopy, Science, 358, 116 119,
drive fibril structure, Biochemistry, 44, 1268112689,
doi: 10.1126/science.aao2825.
doi: 10.1021/bi0509705.
91. Kollmer, M., Close, W., Funk, L., Rasmussen, J.,
75.
Sunde, M., Serpell, L. C., Bartlam, M., Fraser, P. E.,
Bsoul, A., et al. (2019) Cryo EM structure and polymor
Pepys, M. B., et al. (1997) Common core structure of amy
phism of Aβ amyloid fibrils purified from Alzheimer’s brain
loid fibrils by synchrotron X ray diffraction, J. Mol. Biol.,
tissue, Nat. Commun., 10, 4760, doi: 10.1038/s41467 019
273, 729 739, doi: 10.1006/jmbi.1997.1348.
12683 8.
76.
Wu, B., Peisley, A., Tetrault, D., Li, Z., Egelman, E. H.,
92. Lau, H. H. C., Ingelsson, M., and Watts, J. C. (2021) The
et al. (2014) Molecular imprinting as a signal activation
existence of Aβ strains and their potential for driving phe
mechanism of the viral RNA sensor RIG I, Mol. Cell, 55,
notypic heterogeneity in Alzheimer’s disease, Acta
511 523, doi: 10.1016/j.molcel.2014.06.010.
Neuropathol., 142, 17 39, doi: 10.1007/s00401 020 02201 2.
77.
Xu, H., He, X., Zheng, H., Huang, L. J., Hou, F., et al.
93. Tanaka, G., Yamanaka, T., Furukawa, Y., Kajimura, N.,
(2015) Correction: Structural basis for the prion like
Mitsuoka, K., et al. (2019) Sequence and seed structure
MAVS filaments in antiviral innate immunity, Elife, 4,
dependent polymorphic fibrils of alpha synuclein,
e07546, doi: 10.7554/eLife.07546.
Biochim. Biophys. Acta. Mol. Basis Dis., 1865, 1410 1420,
78.
Gallardo, R., Ranson, N. A., and Radford, S. E. (2020)
doi: 10.1016/j.bbadis.2019.02.013.
Amyloid structures: much more than just a cross β fold,
94. Li, B., Ge, P., Murray, K. A., Sheth, P., Zhang, M., et al.
Curr. Opin. Struct. Biol., 60, 7 16, doi: 10.1016/j.sbi.2019.
(2018) Cryo EM of full length α synuclein reveals fibril
09.001.
polymorphs with a common structural kernel, Nat.
79.
Lutter, L., Aubrey, L. D., and Xue, W. F. (2021) On the
Commun., 9, 3609, doi: 10.1038/s41467 018 05971 2.
structural diversity and individuality of polymorphic amy
95. Luk, K. C., Covell, D. J., Kehm, V. M., Zhang, B., Song,
loid protein assemblies, J. Mol. Biol., 433, 167124,
I. Y., et al. (2016) Molecular and biological compatibility
doi: 10.1016/j.jmb.2021.167124.
with host alpha synuclein influences fibril pathogenicity,
80.
Zielinski, M., Röder, C., and Schröder, G. F. (2021)
Cell Rep., 16, 33733387, doi: 10.1016/j.celrep.2016.
Challenges in sample preparation and structure determina
08.053.
tion of amyloids by Cryo EM, J. Biol. Chem., 297, 100938,
96. Guerrero Ferreira, R., Taylor, N. M., Arteni, A. A.,
doi: 10.1016/j.jbc.2021.100938.
Kumari, P., Mona, D., et al. (2019) Two new polymorphic
81.
Li, J., McQuade, T., Siemer, A. B., Napetschnig, J.,
structures of human full length alpha synuclein fibrils
Moriwaki, K., et al. (2012) The RIP1/RIP3 necrosome
solved by cryo electron microscopy, Elife, 8, e48907,
forms a functional amyloid signaling complex required for
doi: 10.7554/eLife.48907.
programmed necrosis, Cell, 150, 339 350, doi: 10.1016/
97. Cao, Q., Boyer, D. R., Sawaya, M. R., Ge, P., and
j.cell.2012.06.019.
Eisenberg, D. S. (2019) Cryo EM structures of four poly
82.
Crowther, R. A. (1991) Straight and paired helical fila
morphic TDP 43 amyloid cores, Nat. Struct. Mol. Biol.,
ments in Alzheimer’s disease have a common structural
26, 619 627, doi: 10.1038/s41594 019 0248 4.
unit, Proc. Natl. Acad. Sci. USA,
88,
22882292,
98. White, H. E., Hodgkinson, J. L., Jahn, T. R., Cohen
doi: 10.1073/pnas.88.6.2288.
Krausz, S., Gosal, W. S., et al. (2009) Globular tetramers of
83.
Lee, V. M., Goedert, M., and Trojanowski, J. Q. (2001)
beta(2) microglobulin assemble into elaborate amyloid
Neurodegenerative tauopathies, Annu. Rev. Neurosci., 24,
fibrils, J. Mol. Biol., 389, 48 57, doi: 10.1016/j.jmb.2009.
1121 1159, doi: 10.1146/annurev.neuro.24.1.1121.
03.066.
84.
Falcon, B., Zhang, W., Schweighauser, M., Murzin, A. G.,
99. Iadanza, M. G., Silvers, R., Boardman, J., Smith, H. I.,
Vidal, R., et al. (2018) Tau filaments from multiple cases of
Karamanos, T. K., et al. (2018) The structure of a β2
sporadic and inherited Alzheimer’s disease adopt a com
microglobulin fibril suggests a molecular basis for its amy
mon fold, Acta Neuropathol., 136, 699 708, doi: 10.1007/
loid polymorphism, Nat. Commun., 9, 4517, doi: 10.1038/
s00401 018 1914 z.
s41467 018 06761 6.
85.
Falcon, B., Zhang, W., Murzin, A. G., Murshudov, G.,
100. Chatani, E., Yagi, H., Naiki, H., and Goto, Y. (2012)
Garringer, H. J., et al. (2018) Structures of filaments from
Polymorphism of β2 microglobulin amyloid fibrils mani
Pick’s disease reveal a novel tau protein fold, Nature, 561,
fested by ultrasonication enhanced fibril formation in tri
137 140, doi: 10.1038/s41586 018 0454 y.
fluoroethanol, J. Biol. Chem.,
287,
2282722837,
86.
Falcon, B., Zivanov, J., Zhang, W., Murzin, A. G.,
doi: 10.1074/jbc.M111.333310.
Garringer, H. J., et al. (2019) Novel tau filament fold in
101. Groenning, M., Frokjaer, S., and Vestergaard, B. (2009)
chronic traumatic encephalopathy encloses hydrophobic
Formation mechanism of insulin fibrils and structural
molecules, Nature, 568, 420 423, doi: 10.1038/s41586
aspects of the insulin fibrillation process, Curr. Prot. Pept.
019 1026 5.
Sci., 10, 509 528, doi: 10.2174/138920309789352038.
87.
Zhang, W., Tarutani, A., Newell, K. L., Murzin, A. G.,
102. Sakalauskas, A., Ziaunys, M., and Smirnovas, V. (2019)
Matsubara, T., et al. (2020) Novel tau filament fold in cor
Concentration dependent polymorphism of insulin amy
ticobasal degeneration, Nature,
580,
283287,
loid fibrils, PeerJ, 7, e8208, doi: 10.7717/peerj.8208.
doi: 10.1038/s41586 020 2043 0.
103. Ishigaki, M., Morimoto, K., Chatani, E., and Ozaki, Y.
88.
Zhang, W., Falcon, B., Murzin, A. G., Fan, J., Crowther,
(2020) Exploration of insulin amyloid polymorphism using
R. A., et al. (2019) Heparin induced tau filaments are
raman spectroscopy and imaging, Biophys. J., 118, 2997
polymorphic and differ from those in Alzheimer’s and
3007, doi: 10.1016/j.bpj.2020.04.031.
Pick’s diseases, Elife, 8, e43584, doi: 10.7554/eLife.43584.
104. Salinas, N., Colletier, J. P., Moshe, A., and Landau, M.
89.
Eisenberg, D., and Jucker, M. (2012) The amyloid state of
(2018) Extreme amyloid polymorphism in Staphylococcus
proteins in human diseases, Cell,
148,
11881203,
aureus virulent PSMα peptides, Nat. Commun., 9, 3512,
doi: 10.1016/j.cell.2012.02.022.
doi: 10.1038/s41467 018 05490 0.
БИОХИМИЯ том 87 вып. 5 2022
СТРУКТУРА АМИЛОИДНЫХ И АМИЛОИДОПОДОБНЫХ АГРЕГАТОВ
601
105. Goldsbury, C. S., Cooper, G. J., Goldie, K. N., Müller, S.
120. Shahnawaz, M., Mukherjee, A., Pritzkow, S., Mendez, N.,
A., Saafi, E. L., et al. (1997) Polymorphic fibrillar assem
Rabadia, P., et al. (2020) Discriminating α synuclein
bly of human amylin, J. Struct. Biol., 119, 1727,
strains in Parkinson’s disease and multiple system atrophy,
doi: 10.1006/jsbi.1997.3858.
Nature, 578, 273 277, doi: 10.1038/s41586 020 1984 7.
106. Goldsbury, C., Goldie, K., Pellaud, J., Seelig, J., Frey, P.,
121. Lövestam, S., Schweighauser, M., Matsubara, T.,
et al. (2000) Amyloid fibril formation from full length and
Murayama, S., Tomita, T., et al. (2021) Seeded assembly
fragments of amylin, J. Struct. Biol., 130, 352362,
in vitro does not replicate the structures of α synuclein fil
doi: 10.1006/jsbi.2000.4268.
aments from multiple system atrophy, FEBS Open Bio, 11,
107. Röder, C., Kupreichyk, T., Gremer, L., Schäfer, L. U.,
999 1013, doi: 10.1002/2211 5463.13110.
Pothula, K. R., et al. (2020) Cryo EM structure of islet
122. Petkova, A. T., Leapman, R. D., Guo, Z., Yau, W. M.,
amyloid polypeptide fibrils reveals similarities with amy
Mattson, M. P., et al. (2005) Self propagating, molecular
loid β fibrils, Nat. Struct. Mol. Biol., 27, 660667,
level polymorphism in Alzheimer’s beta amyloid fibrils,
doi: 10.1038/s41594 020 0442 4.
Science, 307, 262 265, doi: 10.1126/science.1105850.
108. Gallardo, R., Iadanza, M. G., Xu, Y., Heath, G. R.,
123. Ghosh, U., Thurber, K. R., Yau, W. M., and Tycko, R.
Foster, R., et al. (2020) Fibril structures of diabetes related
(2021) Molecular structure of a prevalent amyloid β fibril
amylin variants reveal a basis for surface templated assem
polymorph from Alzheimer’s disease brain tissue, Proc.
bly, Nat. Struct. Mol. Biol., 27, 1048 1056, doi: 10.1038/
Natl. Acad. Sci. USA, 118, e2023089118, doi: 10.1073/
s41594 020 0496 3.
pnas.2023089118.
109. Schmidt, M., Wiese, S., Adak, V., Engler, J., Agarwal, S., et al.
124. Kang, S. G., Eskandari Sedighi, G., Hromadkova, L.,
(2019) Cryo EM structure of a transthyretin derived amyloid
Safar, J. G., and Westaway, D. (2020) Cellular biology of
fibril from a patient with hereditary ATTR amyloidosis, Nat.
tau diversity and pathogenic conformers, Front. Neurol.,
Commun., 10, 5008, doi: 10.1038/s41467 019 13038 z.
11, 590199, doi: 10.3389/fneur.2020.590199.
110. Bansal, A., Schmidt, M., Rennegarbe, M., Haupt, C.,
125. Liebman, S. W., and Chernoff, Y. O. (2012) Prions in yeast,
Liberta, F., et al. (2021) AA amyloid fibrils from diseased
Genetics, 191, 10411072, doi: 10.1534/genetics.111.
tissue are structurally different from in vitro formed SAA
137760.
fibrils, Nat. Commun., 12, 1013, doi: 10.1038/s41467 021
126. Derkatch, I. L., Bradley, M. E., Zhou, P., and Liebman,
21129 z.
S. W. (1999) The PNM2 mutation in the prion protein
111.
Baskakov, I. V., Katorcha, E., and Makarava, N. (2018)
domain of SUP35 has distinct effects on different variants
Prion strain specific structure and pathology: a view from
of the [PSI+] prion in yeast, Curr. Genet., 35, 59 67,
the perspective of glycobiology, Viruses,
10,
723,
doi: 10.1007/s002940050433.
doi: 10.3390/v10120723.
127. King, C. Y. (2001) Supporting the structural basis of prion
112. Vorberg, I. M. (2019) All the same? The secret life of prion
strains: induction and identification of [PSI] variants,
strains within their target cells, Viruses,
11,
334,
J. Mol. Biol., 307, 1247 1260, doi: 10.1006/jmbi.2001.
doi: 10.3390/v11040334.
4542.
113. Bartz, J. C. (2016) Prion strain diversity, Cold Spring Harb.
128. Huang, Y. W., and King, C. Y. (2020) A complete catalog
Perspect. Med., 6, a024349, doi: 10.1101/cshperspect.
of wild type Sup35 prion variants and their protein only
a024349.
propagation, Curr. Genet., 66, 97122, doi: 10.1007/
114. Carta, M., and Aguzzi, A. (2021) Molecular foundations of
s00294 019 01003 8.
prion strain diversity, Curr. Opin. Neurobiol., 72, 22 31,
129. Dergalev, A. A., Alexandrov, A. I., Ivannikov, R. I., Ter
doi: 10.1016/j.conb.2021.07.010.
Avanesyan, M. D., and Kushnirov, V. V. (2019) Yeast Sup35
115. Glynn, C., Sawaya, M. R., Ge, P., Gallagher Jones, M.,
prion structure: two types, four parts, many variants, Int. J.
Short, C. W., et al. (2020) Cryo EM structure of a human
Mol. Sci., 20, 2633, doi: 10.3390/ijms20112633.
prion fibril with a hydrophobic, protease resistant core,
130. Ghosh, R., Dong, J., Wall, J., and Frederick, K. K. (2018)
Nat. Struct. Mol. Biol., 27, 417 423, doi: 10.1038/s41594
Amyloid fibrils embodying distinctive yeast prion pheno
020 0403 y.
types exhibit diverse morphologies, FEMS Yeast Res., 18,
116. Cortez, L. M., Nemani, S. K., Duque Velásquez, C.,
foy059, doi: 10.1093/femsyr/foy059.
Sriraman, A., Wang, Y., et al. (2021) Asymmetric flow
131. Tanaka, M., Chien, P., Naber, N., Cooke, R., and
field flow fractionation of prions reveals a strain specific
Weissman, J. S. (2004) Conformational variations in an
continuum of quaternary structures with protease resis
infectious protein determine prion strain differences,
tance developing at a hydrodynamic radius of 15 nm, PLoS
Nature, 428, 323 328, doi: 10.1038/nature02392.
Pathog., 17, e1009703, doi: 10.1371/journal.ppat.1009703.
132. King, C. Y., Wang, H. L., and Chang, H. Y. (2006)
117. Peelaerts, W., Bousset, L., Van der Perren, A.,
Transformation of yeast by infectious prion particles,
Moskalyuk, A., Pulizzi, R., et al. (2015) α synuclein
Methods, 39, 68 71, doi: 10.1016/j.ymeth.2006.04.003.
strains cause distinct synucleinopathies after local and sys
133. Krishnan, R., and Lindquist, S. L. (2005) Structural
temic administration, Nature, 522, 340 344, doi: 10.1038/
insights into a yeast prion illuminate nucleation and strain
nature14547.
diversity, Nature, 435, 765 772, doi: 10.1038/nature03679.
118. Van der Perren, A., Gelders, G., Fenyi, A., Bousset, L.,
134. Terry, C., Harniman, R. L., Sells, J., Wenborn, A.,
Brito, F., et al. (2020) The structural differences between
Joiner, S., et al. (2019) Structural features distinguishing
patient derived α synuclein strains dictate characteristics
infectious ex vivo mammalian prions from non infectious
of Parkinson’s disease, multiple system atrophy and
fibrillar assemblies generated in vitro, Sci. Rep., 9, 376,
dementia with Lewy bodies, Acta Neuropathol., 139, 977
doi: 10.1038/s41598 018 36700 w.
1000, doi: 10.1007/s00401 020 02157 3.
135. Barinova, K. V., Kuravsky, M. L., Arutyunyan, A. M.,
119. Schweighauser, M., Shi, Y., Tarutani, A., Kametani, F.,
Serebryakova, M. V., Schmalhausen, E. V., et al. (2017)
Murzin, A. G., et al. (2020) Structures of α synuclein fila
Dimerization of Tyr136Cys alpha synuclein prevents amy
ments from multiple system atrophy, Nature, 585, 464 469,
loid transformation of wild type alpha synuclein, Int. J. Biol.
doi: 10.1038/s41586 020 2317 6.
Macromol., 96, 35 43, doi: 10.1016/j.ijbiomac.2016.12.011.
2 БИОХИМИЯ том 87 вып. 5 2022
602
МАТИИВ и др.
STRUCTURE AND POLYMORPHISM OF AMYLOID
AND AMYLOID+LIKE AGGREGATES
Review
A. B. Matiiv1, N. P. Trubitsina1, A. G. Matveenko1,
Y. A. Barbitoff1,2, G. A. Zhouravleva1,3, and S. A. Bondarev1,3*
1 Department of Genetics and Biotechnology, Saint Petersburg State University,
199034 Saint Petersburg, Russia; E mail: stanislavspbgu@gmail.com
2 Bioinformatics Institute, 197342 Saint Petersburg, Russia
3 Laboratory of Amyloid Biology, Saint Petersburg State University, 199034 Saint Petersburg, Russia
Amyloids are protein aggregates with a cross β structure. Interest in the study of amyloids, on the one hand, is asso
ciated with their role in the development of a number of socially significant neurodegenerative diseases in humans,
and on the other hand, with the discovery of functional amyloids, the formation of which is an integral part of some
cellular processes. To date, more than a hundred proteins with amyloid or amyloid like properties are known. Active
studies of the structural organization of aggregates reveal a wide variety of protein conformations in their composition.
In the review, we collected examples of this diversity, also considering protein conformation in amyloid like aggre
gates. An important part of the article is devoted to the characteristic features of the structure of these protein com
plexes, which determine the unusual properties of amyloids, including their interaction with amyloid specific dyes
and stability. The review also describes numerous examples of the diversity of amyloid aggregates and its significance
for living organisms.
Keywords: cross β structure, amyloids, amyloid like aggregates, amyloid polymorphis
БИОХИМИЯ том 87 вып. 5 2022