БИОХИМИЯ, 2022, том 87, вып. 5, с. 627 - 641
УДК 539.26
ФОРМИРОВАНИЕ НАНОЧАСТИЦ ОКСИДА ЖЕЛЕЗА
ВО ВНУТРЕННЕЙ ПОЛОСТИ ФЕРРИТИН ПОДОБНОГО
БЕЛКА Dps. ИССЛЕДОВАНИЕ С ПОМОЩЬЮ АНОМАЛЬНОЙ
ДИСПЕРСИИ РЕНТГЕНОВСКИХ ЛУЧЕЙ
© 2022
Э.В. Штыкова1*, М.В. Петухов1,2, А.А. Можаев1,3,4,5
1 Институт кристаллографии им. А.В. Шубникова, ФНИЦ «Кристаллография и фотоника» РАН,
119333 Москва, Россия; электронная почта: shtykova@ns.crys.ras.ru
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН, 119071 Москва, Россия
3 Институт биоорганической химии им. академиков М.М. Шемякина
и Ю.А. Овчинникова РАН, 117997 Москва, Россия
4 Российский национальный исследовательский медицинский
университет им. Н.И. Пирогова, 117997 Москва, Россия
5 Национальный исследовательский университет «Высшая школа экономики», 101000 Москва, Россия
Поступила в редакцию 12.04.2022
После доработки 26.04.2022
Принята к публикации 26.04.2022
Особое место среди додекамерных мини ферритинов занимает белок Dps, важнейшей функцией которого
является защита генома бактерий от различных видов разрушительного внешнего воздействия путем in cel?
lulo Dps-ДНК сокристаллизации. Следствием такой защитной реакции является возникновение бактери
альной резистентности к антибиотикам и другим лекарственным средствам. Поэтому исследованию геном
защитных свойств Dps уделяется огромное внимание. Однако не менее важна другая сторона функциональ
ных особенностей Dps. Будучи ферритин подобным, этот белок выступает в качестве депо для резервного
хранения железа и защищает бактериальные клетки от окислительного повреждения, инициируемого его
избытком. Исследование этого явления также является весьма актуальным, и данная работа посвящена изу
чению процессов формирования наночастиц оксида железа во внутренней полости додекамера Dps. В ка
честве основного метода исследования был выбран метод аномального малоуглового рассеяния, который
позволяет изучать структуру металлсодержащих биологических макромолекул и определять распределение
по размерам образовавшихся в них металлических наночастиц. Вклады белковой и металлической состав
ляющих в общее рассеяние разделяются путём вариации энергии падающего рентгеновского излучения
вблизи края полосы поглощения атомами металла, в данном случае K полосы поглощения железа. Были ис
следованы образцы Dps, содержащие 50, 500 и 2000 атомов железа на додекамер белка. Анализ полученных
распределений по размерам показал, что в зависимости от содержания железа в растворе внутри белковой
молекулы формируются наночастицы с размерами 2-4 нм и рост металлических наночастиц ограничен раз
мером центральной полости белка. Было также показано, что некоторое количество ионов железа содер
жится в поверхностном слое Dps. Этот слой очень важен для выполнения белком своих защитных функций,
поскольку находящиеся здесь N концевые домены определяют характер взаимодействия Dps с ДНК. В це
лом, полученные в данной работе результаты могут быть полезными в качестве очередного шага в изучении
феномена Dps, а также с практической точки зрения при создании биосовместимых и стабилизированных
в растворе металлических наночастиц.
КЛЮЧЕВЫЕ СЛОВА: ферритин подобные белки, белок Dps, оксид железа, аномальное малоугловое рент
геновское рассеяние, распределение по размерам.
DOI: 10.31857/S0320972522050049, EDN: ATBBAO
ВВЕДЕНИЕ
торые уже были изучены, содержат от одного до
нескольких ионов различных металлов [1, 2].
Известно, что приблизительно одна треть
Среди них железо является одним из наиболее
белков и почти половина ферментов из тех, ко жизненно важных и распространённых хими
ческих элементов. Чаще всего этот металл обна
руживается в белках в составе гема или железо
Принятые сокращения: АМУРР - аномальное ма
лоугловое рентгеновское рассеяние; ММ - молекулярная
серных простетических групп [2, 3]. Биологи
масса; МУРР - малоугловое рентгеновское рассеяние.
ческое значение железа определяется его спо
* Адресат для корреспонденции.
собностью обратимо окисляться и восстанавли
627
628
ШТЫКОВА и др.
ваться. В виде двухвалентных или трёхвалент
обнаруженным у эукариот. Бактериальный фер
ных ионов железо необходимо для жизненных
ритин и бактериоферритин так же, как ферри
процессов всех эукариот и большинства прока
тин млекопитающих, представляют собой
риот. Оно участвует в таких метаболических
структуру, состоящую из 24 субъединиц с цент
процессах, как транспорт кислорода, синтез
ральной полостью, которая может содержать
ДНК, транспорт электронов для производства
~2500 атомов железа в случае бактериального
энергии и является универсальным микроэле
ферритина [10] и ~1800 атомов железа - для
ментом, который обеспечивает нормальное
бактериоферритина [10, 11]. Существенное от
функционирование всех систем организма на
личие бактериоферритина от других форм фер
клеточном уровне.
ритина состоит в наличии в его структуре гема
С другой стороны, избыток этого металла
(протопорфирина IX железа), расположенного
катализирует повреждение ДНК, белков и ли
между каждыми двумя субъединицами белка и
пидов, приводя к нарушению клеточного гоме
соединённого с метионином каждой из этих
остаза. Существующие эволюционные механиз
субъединиц. Таким образом, одна молекула бак
мы детоксикации и удаления железа из цитозо
териоферритина содержит 12 групп гема, роль
ля включают окисление избыточных ионов
которых, однако, до конца неясна [12-14].
двухвалентного железа до трёхвалентного состо
Среди додекамерных мини ферритинов осо
яния в соответствии с реакцией Фентона [4]:
бое место занимает белок Dps (DNA binding
protein from starved cells), одной из наиболее зна
Fe2+ + H2O2 → Fe3+ + OH + OH-.
(1)
чимых функций которого является защита гено
ма от таких пагубных факторов, как голодание,
Накопление образовавшихся ионов трёхва
термическое воздействие, УФ и γ облучение,
лентного железа происходит в живых организ
токсины, химический шок и окислительный
мах в ферритин подобных белках. Ферритины,
стресс. Dps связывается с ДНК, в результате че
как белковое суперсемейство, эволюционно
го формируется устойчивый кристаллический
развилось для секвестрации железа в раствори
комплекс Dps-ДНК, защищающий дезоксири
мой, нетоксичной и биодоступной форме [5].
бонуклеиновую кислоту от повреждений
В составе этих белков неиспользованное железо
[15-17]. Важным следствием такой защитной
выступает в качестве резервного и хранится в
реакции является возникновение бактериаль
нереакционноспособном месте отдельно от кле
ной резистентности к антибиотикам и другим
точных процессов, и, соответственно, клетки
лекарственным средствам. Именно поэтому в
оказываются защищёнными от окислительного
течение последних двух десятилетий формиро
повреждения, инициированного этим метал
вание защитных комплексов Dps-ДНК в
лом [6, 7]. Ферритин - это сложный белковый
стресс индуцированных бактериальных клетках
комплекс, выполняющий роль основного внут
привлекает внимание многих научных групп.
риклеточного депо железа у человека и живот
Среди публикаций на эту тему наиболее извест
ных и содержащийся практически во всех орга
ными являются работы А. Минского и соавто
нах и тканях. Апоферритин млекопитающих
ров, которые впервые представили эксперимен
(т.е. макромолекула, не содержащая железа)
тальные доказательства этого явления [18-20].
представляет собой тетракозамерный белок с
В бактериальной клетке Dps обычно содер
общей молекулярной массой (ММ) ~450 кДа.
жится в незначительных количествах, а его син
Каждая из 24 полипептидных субъединиц имеет
тез индуцируется во время стационарной фазы
ММ ~20 кДа. Структурно, ферритин - это гло
роста бактерии, голодания или окислительного
булярный белок с центральной полостью, в ко
стресса [21]. Известно, что додекамер Dps не со
торой хранится примерно 4500 ионов гидрати
держит каких либо модулей в своей структуре,
рованного оксида трёхвалентного железа
предназначенных для распознавания конкрет
(Fe2O3 • H2O) вместе с переменным количест
ных нуклеотидных последовательностей. Взаи
вом фосфатов. Внешний диаметр белка состав
модействие с отрицательно заряженным сахаро
ляет 12-13 нм, а диаметр внутренней полости -
фосфатным остовом ДНК предположительно
7-8 нм [7, 8]. Белковая оболочка ферритина
осуществляется за счёт электростатических свя
имеет многочисленные поры, через которые
зей с богатыми лизином N концевыми домена
осуществляется транспорт железа [9].
ми мономеров Dps [15, 22-24]. Однако точный
Существуют также по крайней мере три типа
механизм, с помощью которого происходит свя
ферритин подобных прокариотических белков:
зывание белка с ДНК, неизвестен [25].
бактериальный ферритин, бактериоферритин и
Первичная структура мономера Dps пред
додекамерный ферритин (мини ферритин). Эти
ставляет собой полипептидную цепь из 167 ами
бактериальные белки родственны ферритинам,
нокислотных остатков с ММ 18,7 кДа и содер
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
629
жит высоко консервативную последователь
достаточном количестве ионов металла во внут
ность, состоящую из четырёх α спиралей [26].
ренней полости Dps предполагает наличие маг
Додекамер имеет ММ 224,4 кДа, обладает сим
нитных свойств, и эти белковые молекулы мож
метрией типа 23, внешний диаметр белка равен
но рассматривать как естественные биосенсоры
8-9 нм, а диаметр внутренней полости -
электромагнитного излучения. Dps способен
4-5 нм. Будучи ферритин подобным белком,
передавать полученный сигнал на ДНК и, сле
каждый мономер которого может связать до
довательно, является чрезвычайно перспектив
40 атомов железа, Dps способен накапливать
ным в качестве основы для создания логических
приблизительно 500 ионов Fe+3 в своей цент
элементов нового поколения. Таким образом,
ральной полости [27].
изучение процессов формирования наночастиц
Таким образом, Dps выполняет одновремен
железа в стабилизирующей белковой оболоч
но две важнейших для жизнедеятельности бакте
ке Dps имеет не только научный, но и практи
риальных клеток функции: (1) - формируя крис
ческий интерес.
таллический комплекс с ДНК, он сохраняет ге
Для того чтобы методом малоуглового рас
нетический материал бактерии от воздействия
сеяния исследовать структуру металлсодержа
внешних неблагоприятных факторов; (2) - слу
щих образцов и распределение по размерам об
жит депо для резервного хранения железа и за
разовавшихся в них металлических наночас
щищает клетки от окислительного повреждения,
тиц, вклады этих двух составляющих в общее
инициированного его избытком. Обе эти функ
рассеяние следует разделить. Для изучения
ции тесно связаны между собой. Так, анализируя
структуры исходного образца до формирования
повреждения ДНК in vitro, Zhao et al. [27] показа
в нём частиц металла, т.е. матрицы, использует
ли, что ДНК Escherichia coli расщепляется при
ся традиционное малоугловое рентгеновское
воздействии сочетания FeSO4 и H2O2, но не по
рассеяние (МУРР) [32]. Стандартный метод
вреждается в присутствии Dps. То есть образова
вычитания рассеяния исходной матрицей из
ние комплекса белка с ДНК и способность
общего рассеяния от металлсодержащего об
обезвреживать перекись водорода во время взаи
разца возможен только в тех случаях, когда мат
модействия с железом приводит к сохранению
рица не меняет свою структуру в процессе фор
генома E. coli в условиях стресса [28].
мирования в ней частиц металла. В том же слу
Несмотря на то что Dps E. coli не содержит
чае, когда структурные изменения в исходном
канонических ферроксидазных сайтов, присут
образце, предположительно, имеют место, ис
ствующих в бактериоферритине E. coli или бак
пользуется метод аномального малоуглового
териальном ферритине, Fe2+ может окисляться в
рассеяния (АМУРР) [33-36]. В этом методе
некоторых областях белковой макромолекулы и
экспериментальные кривые МУРР от метал
затем накапливаться в виде Fe3+ в центральной
лсодержащего образца измеряются при разных
полости белка [27]. Предположительно, фер
энергиях рентгеновского пучка: вблизи края
роксидазные участки Dps состоят из железо
полосы поглощения атомами данного металла,
связывающих аминокислот, включая аспартат,
т.е. регистрируется рассеяние только от матри
глутамат и гистидин [28, 29]. Например, N кон
цы, и вдали от него, когда снимается общее
цевой домен экспрессированного из бактерии
рассеяние. Полученная разность относится к
Deinococcus radiodurans Dps (DrDps1) содержит
рассеянию только от наночастиц, содержащих
область (остатки 30-55), в которой находится
атомы данного металла. Анализ вклада каждой
сайт связывания с металлами (с моти
из составляющих позволяет, таким образом,
вом Asp36x2His39x10His50x4Glu55), расположенный
рассчитать распределение по размерам нано
на внешней поверхности додекамера. Разруше
частиц металла и исследовать структуру метал
ние этого сайта влияет на самосборку белка, а
лсодержащего образца в процессе его взаимо
также снижает его способность связывания
действия с металлом.
с ДНК, т.е. снижает его защитные функции [30].
В настоящей работе процесс накопления ок
В отличие от Dps, далеко не все бактериаль
сида железа во внутренней полости ферритин
ные додекамерные мини ферритины могут од
подобного белка Dps изучался с помощью ано
новременно защищать организм от окислитель
мальной дисперсии рентгеновских лучей, т.е. ме
ного стресса, образуя кристаллический комп
тодом аномального малоуглового рассеяния.
лекс с ДНК, и в то же время быть источником
железа при его дефиците [31]. Именно поэтому
уникальные особенности Dps привлекают такое
МАТЕРИАЛЫ И МЕТОДЫ
внимание. Кроме того, в необходимости и важ
ности исследования свойств этого белка присут
Подготовка образцов Dps, содержащих желе
ствует и технологический аспект. Накопление в
зо. Экспрессия и очистка белка Dps проводи
БИОХИМИЯ том 87 вып. 5 2022
630
ШТЫКОВА и др.
лись по ранее разработанной методике [37, 38].
циональна молекулярной массе рассеивающей
Очищенный белок концентрировали на центри
объекта, и радиус инерции Rg.
фужном концентраторе Amicon
(«Merck
Молекулярные массы рассчитывали по дан
Millipore», США) с порогом молекулярной мас
ным МУРР двумя методами: с помощью подхо
сы 10 кДа до концентрации 3 мг/мл, а затем под
да Байеса (MMBayesian) [43] и из значения исклю
вергали диализу в буфере
50
мМ NaCl,
ченного объёма Vp (породовского объема), не
0,5 мМ ЭДТА, 50 мМ Tris HCl (рН 8,0). Чистоту
доступного растворителю [44], используя эмпи
анализировали методом электрофореза в 15%
рическое соотношение между Vp и ММp, которое
ном полиакриламидном геле, а концентрацию
для белков равно 1,65 [45].
белка определяли спектрофотометрически при
Для построения функции распределения по
A280 с использованием молярного коэффици
расстояниям p(r), которая необходима для вос
ента абсорбции [39].
становления формы белка Dps в растворе по
К раствору очищенного Dps с концентраци
данным МУРР, использовалась компьютерная
ей 3 мг/мл в буфере 50 мМ NaCl, 0,5 мМ ЭДТА,
программа GNOM [46]. Функции распределе
50 мМ Tris HCl (рН 8,0) добавляли свежеприго
ния по расстояниям p(r) определялись с по
товленный раствор FeSO4 ⋅ 7H2O в количестве,
мощью косвенного Фурье преобразования ин
соответствующем 50, 500 и 2000 атомам железа
тенсивности рассеяния в соответствии с интег
на додекамер. Инкубацию проводили при ком
ральным уравнением:
натной температуре в течение 30 мин. Получен
ные таким образом железосодержащие образцы
(3)
далее обозначены в тексте как Dps Fe50, Dps
Fe500 и Dps Fe2000 соответственно.
где I(s) - интенсивность рассеяния. При этом
Эксперимент и анализ данных малоуглового
максимальный размер частицы (Dmax) находится
рассеяния. Традиционное малоугловое рассеяние.
из условия p(r) = 0 при r > Dmax.
Исследования структуры белка Dps с помощью
Ab initio метод восстановления формы низко
традиционного малоуглового рентгеновского
го разрешения белка Dps основан на алгоритме
рассеяния были проведены на синхротроне
имитации отжига и реализован в программе
Petra III (DESY, Германия) на линии P12 [40].
DAMMIN [47], с помощью которой происходит
Линия P12 оснащена оборудованием для авто
построение структурных моделей с минимиза
матической смены образцов и двумерным де
цией невязки χ2 между экспериментальным дан
тектором Pilatus 2M («DECTRIS», Швейцария).
ными и рассеянием, полученным от моделей:
Интенсивность рассеяния I(s) была измерена в
области значений волновых векторов
(4)
0,08 < s < 3 нм-1, где s = (4πsinθ)/λ - вектор рас
сеяния, 2θ - угол рассеяния, и λ = 0,124 нм -
длина волны излучения. Для каждого образца
где N - число экспериментальных точек, Iexp(sj)
было снято по 50 экспериментальных кривых
и σ(sj) - экспериментальные интенсивности и
рассеяния для контроля возможных радиацион
их ошибки, Icalc(sj) - интенсивность, вычислен
ных повреждений. Радиационного повреждения
ная от модели, c - шкалирующий множитель.
обнаружено не было.
Для определения структуры белка, содержа
Первичная обработка кривых рассеяния бы
щего атомы железа, был использован метод
ла проведена с использованием программы
мультифазного моделирования ab initio, что поз
PRIMUS [41]. Анализ, интерпретация получен
волило определить не только структуру низкого
ных данных и структурное моделирование про
разрешения белковой составляющей комплек
водили с использованием программного комп
са, но и расположение атомов железа в белковой
лекса ATSAS [42].
матрице. Построение двухкомпонентной (двух
Радиусы инерции (Rg) рассеивающих частиц
фазной) модели проводилось с использованием
определялись по начальному участку кривой
программы MONSA [47]. В программе учитыва
рассеяния в области самых малых значений s с
ется различие электронных плотностей белко
помощью формулы:
вой и металлической составляющих комплекса,
а также соотношение их объёмов. Для получе
(2)
ния двухфазной модели белок-металл были ис
пользованы кривые малоуглового рассеяния от
которая справедлива в области (sRg) < 1,3. Из
исходного белка и белка, содержащего атомы
наклона прямолинейного участка графика
железа. Теоретическая интенсивность рассея
Гинье - ln I(s) от s2 - определяли интенсивность
ния построенных моделей рассчитывалась прог
рассеяния в нулевой угол I(0), которая пропор
раммой CRYSOL [48].
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
631
Рис. 1. Изменение действительной и мнимой компонент аномального рассеяния рентгеновского излучения f ′(E) (синяя
сплошная линия) и f ′′(E) (красная пунктирная кривая) в зависимости от энергий фотонов Е вблизи K - полосы поглоще
ния атомами Fe - E = 7,125 кэВ. Вертикальными пунктирными линиями обозначены энергии излучения, при которых
проводились измерения аномального рассеяния. Расчетные данные дисперсионных поправок для атомов железа были
Аномальное малоугловое рассеяние. Экспери
поглощения резонансного атома. В данном слу
менты по аномальному рассеянию также прово
чае измерения проводились вблизи K - полосы
дились на синхротроне Petra III на линии P12 и
поглощения атомами Fe, т.е. при энергии фото
заключались в измерении кривых рассеяния
нов E = 7,125 кэВ (λ = 0,174 нм). На рис. 1 при
рентгеновского излучения при разных длинах
ведена кривая изменения дисперсионных по
волн λ, т.е. при разных энергиях падающего пуч
правок f ′(E) и f ′′(E) в зависимости от энергий
ка E. Измерения были проведены для исходного
фотонов Е, используемых в данной работе.
белка Dps и образцов Dps, содержащих 50 (Dps
Для каждого образца были измерены кривые
Fe50), 500 (Dps Fe500) и 2000 (Dps Fe2000) ато
рассеяния I(s, Ek) при 7 различных энергиях па
мов железа на додекамер. Данные рассеяния ре
дающего излучения E17: 7,100, 7,110, 7,118,
гистрировали при нескольких различных энер
7,125, 7,128, 7,130 и 7,133 кэВ в районе края K -
гиях фотонов Ek, при этом энергия E0
полосы поглощения атомами Fe (E = 7,125 кэВ).
(10 000 кэВ, λ = 0,124 нм) находится достаточно
Аномальные поправки для E = 7,125 кэВ соста
далеко от края поглощения Fe, и поэтому она
вили -8,13 и 0,48 соответственно. Разность
была выбрана для изучения структуры исходной
между кривыми рассеяния, полученными при
макромолекулы Dps, т.е. в этом случае исполь
разных энергиях Δk(s) = I(s, E0) - I(s, Ek), про
зовался традиционный метод МУРР, как описа
порциональна рассеянию резонансными атома
но выше. Полученные данные МУРР и АМУРР
ми [33-36]. Эти разностные кривые были ис
были скорректированы на фоновое рассеяние,
пользованы при вычислении объёмных функ
флуоресценцию и обработаны с помощью прог
ций распределения по размерам DV(R). Интег
раммного комплекса ATSAS [42] и недавно раз
ральное уравнение
работанной стратегии сбора данных и обработ
ки аномального малоуглового рассеяния [49].
(6)
Рассеивающий фактор атома определяется
следующим образом:
было решено относительно DV(R) с помощью
компьютерной программы GNOM [46] в пред
f(E) = f0 + f ′(E) + if ′′(E),
(5)
положении сферичности образованных нано
частиц. В этом уравнении R - радиус сферы,
где дисперсионные поправки f ′(E) и f ′′(E) ста
Rmin и Rmax - минимальный и максимальный
новятся существенными вблизи края полосы
размеры, i0(x)
= {[sin(x)
? x cos(x)]/x3}2 и
БИОХИМИЯ том 87 вып. 5 2022
632
ШТЫКОВА и др.
m(R) = (4π/3)R3 - соответственно форм фактор
шумящей в интервале угловых векторов
сферы и её объём. Плотность рассеивающей
0,25 < s < 3,0 нм-1 с хорошо выраженным форм
длины аномальных атомов определяется как
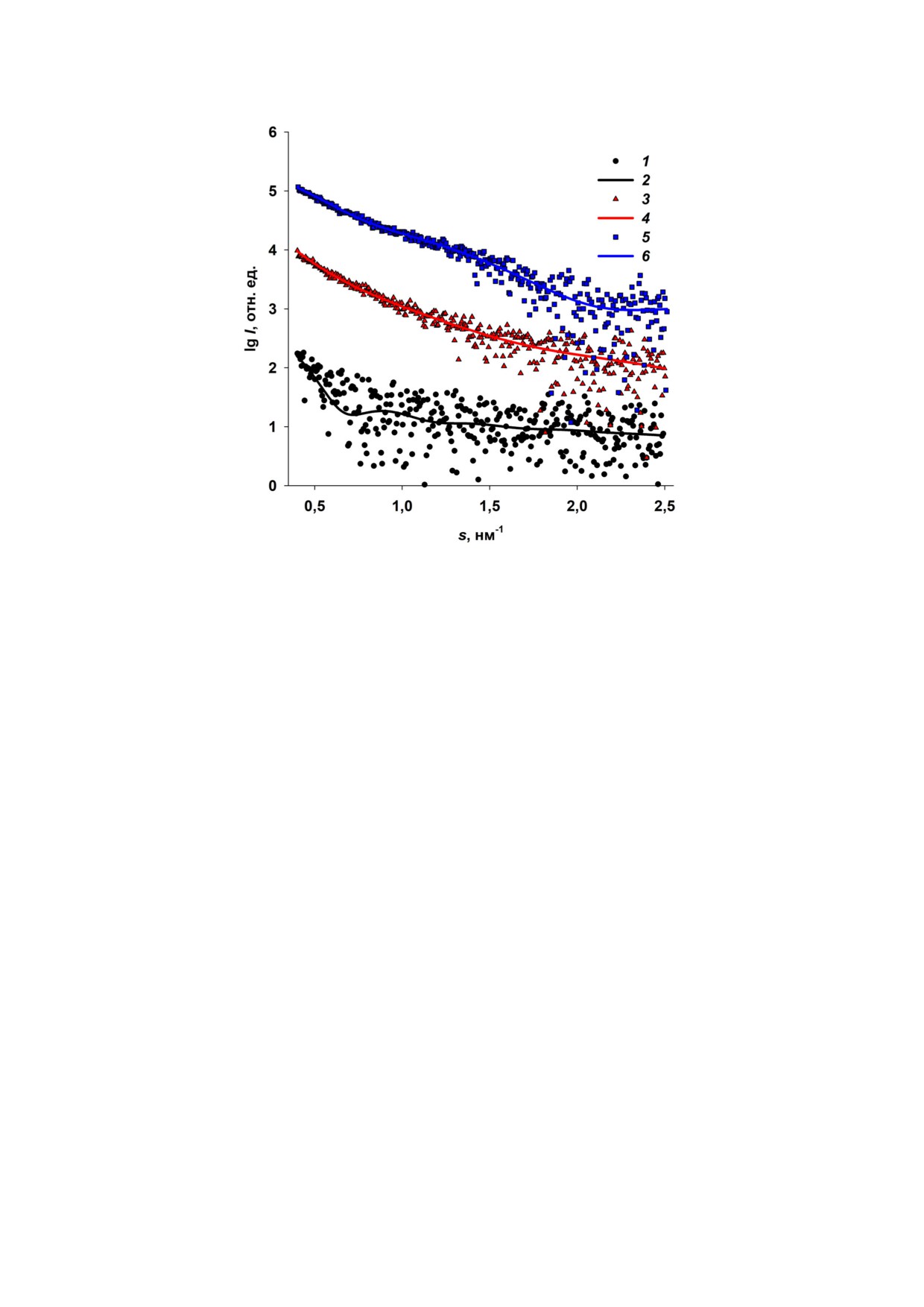
фактором (рис. 2, кривая 1).
Δρ = (N02 - Nk2)e/vat, где N0 и Nk - число элект
Кривая МУРР от белка Dps, представленная
ронов, вносящих вклад в рассеяние вдали от ре
на рис. 2, характерна для раствора монодисперс
зонанса и при E = Ek, e - заряд электрона и vat -
ного белка сферической формы. О сферичности
атомный объём.
белка свидетельствует также рассчитанная с по
Был также использован альтернативный ме
мощью программы GNOM [46] функция рас
тод анализа распределений по размерам нано
пределения по расстояниям p(r) (рис. 2, встав
частиц Fe, образующихся в белке Dps, реализо
ка), которая описывает форму рассеивающего
ванный в программе MIXTURE [41]. В этом
объекта
[32] и используется в программе
подходе интенсивность рассеяния I(s) от смеси k
DAMMIN для восстановления структуры низ
разных компонентов разного размера представ
кого разрешения по данным МУРР [47]. Из про
лена в виде линейной комбинации:
филя функции p(r) можно также сделать вывод о
том, что в данном случае сферическое тело яв
(7)
ляется полым - функция распределения по раз
мерам ассиметрична, и её максимум смещён
где νk - объёмная доля компонента k, Ik - интен
вправо. Кроме того, поскольку амплитуда функ
сивность рассеяния этого компонента, K - ко
ции p(r) пропорциональна электронной плот
личество компонентов. Программа MIXTURE
ности отдельных частей рассеивающего объек
моделирует рассеяние от смесей, содержащих
та, можно предположить, что в белке имеется
K - число разных по форме и размерам рассеи
более разреженный поверхностный слой, так
вающих объектов, при этом используется теоре
как на профиле p(r) в интервале размеров
тическое рассеяние от простых тел (сфер, полых
~8-9,6 нм присутствует слабо рассеивающий
сфер, эллипсоидов, цилиндров и т.д.), каждое из
«хвост». Из литературных данных и наших пре
которых характеризуется своей объёмной долей,
дыдущих исследований следует, что это рассея
средним размером, шириной полидисперсного
ние соответствует рассеянию гибкими N конце
распределения, контрастом и, опционально,
выми доменами белка [24, 50, 51].
возможностью межчастичных взаимодействий.
Структура низкого разрешения Dps (шари
Экспериментальная картина рассеяния аппрок
ковая модель) была восстановлена по кривой ма
симируется взвешенной комбинацией расчёт
лоуглового рассеяния с использованием прог
ных индивидуальных (парциальных) кривых от
раммы DAMMIN [47]. Восстановление формы
компонентов для минимизации невязки χ2 меж
основано на алгоритме имитации отжига в пре
ду экспериментальными и модельными данны
делах сферы, диаметр которой равен максималь
ми.
ному размеру макромолекулы белка Dmax, кото
рый, в свою очередь, определялся из функции
распределения по расстояниям и был равен
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
9,6 нм. Результаты восстановления представле
ны на рис. 2, б серыми шариками. Коэффициент
Исследование структуры белка Dps методом
невязки χ2 с экспериментальными данными ра
традиционного малоуглового рентгеновского рас
вен 1,9, что свидетельствует о хорошем соответ
сеяния. Исследование структуры белка Dps в
ствии экспериментальной кривой МУРР и кри
растворе и определение таких инвариантов ма
вой рассеяния от полученной формы низкого
лоуглового рассеяния, как радиус инерции Rg,
разрешения (рис. 2, а, кривая 2). Шариковая мо
породовской объём Vp, функция распределения
дель структуры Dps имеет центральную полость
по расстояниям p(r) и максимальный размер
и соответствует известной кристаллической
Dmax, а также молекулярная масса MM, было
структуре белка (PDB ID: 1DPS) (рис. 2, б), хотя
проведено с помощью традиционного МУРР.
шариковая модель несколько больше по разме
Предварительными измерениями было показа
ру за счёт рассеяния N концевыми доменами,
но, что в растворе в интервале концентраций
которые отсутствуют в структуре атомного раз
Dps от 1,0 мг/мл до 3,0 мг/мл не наблюдалось
решения 1DPS из за гибкости и невозможности
концентрационной зависимости и образования
их кристаллизации [26].
агрегатов. Поэтому для измерений и дальней
Основные структурные характеристики Dps,
шей обработки и интерпретации данных МУРР
полученные непосредственно по кривой мало
был выбран образец с концентрацией 3,0 мг/мл,
углового рассеяния без применения моделиро
в результате чего кривая малоуглового рассея
вания (инварианты МУРР), представлены
ния была достаточно информативной и мало
в табл. 1.
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
633
Рис. 2. Восстановление формы низкого разрешения белка Dps. а - Экспериментальная кривая малоуглового рентгеновс
кого рассеяния (1); теоретическая кривая рассеяния, рассчитанная от шариковой модели, полученной с помощью прог
раммы DAMMIN (2); теоретическая кривая рассеяния, рассчитанная от функции распределения по расстояниям p(r) (3).
Вставка: функция распределения по расстояниям p(r). б - Наложение кристаллической структуры Dps (цветные спирали)
на шариковую модель, полученную с помощью программы DAMMIN (серые шарики)
Данные табл. 1 вместе с восстановленной
явить следующие особенности процесса взаи
формой низкого разрешения белка свидетель
модействия белка Dps с ионами железа.
ствуют о нативном состоянии Dps, соответству
1. Кривые рассеяния при энергии E0 вдали от
ют характеристикам этого белка, известным из
полосы поглощения железа
(10
000
кэВ,
литературы [26, 50, 51] и дают возможность его
λ = 0,124 нм) и при энергиях E1, 2
(7,100
дальнейшего использования в исследовании
и 7,110 кэВ) практически совпадают для всех Fe
процессов накопления атомов железа во внут
содержащих образцов. По этой причине кри
ренней полости белкового додекамера.
вые МУРР, измеренные при E0, не показаны
Использование аномального малоуглового
на рис. 3, чтобы не перегружать его.
рассеяния для изучения формирования наночас
2. Низкое содержание железа (50 атомов на
тиц железа в Dps. Экспериментальные кривые
молекулу Dps) не влияет на общие структурные
аномального малоуглового рассеяния, измерен
характеристики белка при энергиях относитель
ные при разных энергиях излучения, приведены
но далеких от K полосы поглощения железа.
на рис. 3.
Важно ещё раз подчеркнуть, что предваритель
Анализ кривых рассеяния от образцов с раз
ный структурный анализ исходного белка Dps
ным содержанием ионов Fe3+, измеренных при
при энергии E0 показал, что белок находится в
разных энергиях излучения E17, позволяет вы
состоянии, пригодном для использования его в
качестве матрицы для формирования наночас
тиц железа.
Таблица 1. Основные структурные характеристики белка
3. В отличие от образца с низким содержани
Dps
ем железа (Dps Fe50), образцы Dps Fe500 и
Dps Fe2000 демонстрируют значительное уве
Образец
Rg, нм
VP, нм3
Dmax, нм
MMPorod,
MMBayesian,
личение интенсивности рассеяния в самых ма
кДа
кДа
лых углах, т.е. проявляют высокую полидисперс
Dps
3,9 ± 0,2
330 ± 30
9,6
190 ± 20
210
ность за счёт способности железа, как переход
ного металла, образовывать устойчивые ком
4 БИОХИМИЯ том 87 вып. 5 2022
634
ШТЫКОВА и др.
плексы, например с азотом аминогрупп белка,
5. Кривые рассеяния, измеренные при раз
стягивая между собой белковые цепи соседних
ных энергиях фотонов E17, показывают опреде
макромолекул. Таким образом, белковая матри
лённую зависимость от энергии падающего пуч
ца существенно меняется при взаимодействии с
ка в интервале угловых векторов
0,5
< s
соединением железа, и применение в данном
< 1,3 нм-1 с минимумом при s = 0,95 нм-1
случае аномального малоуглового рассеяния яв
(рис. 3). Хотя эта зависимость наиболее заметна
ляется сугубо необходимым.
для образца Dps Fe2000, тем не менее для всех
4. В образцах с высоким содержанием ионов
железосодержащих образцов появляется воз
железа (Fe500 и Dps Fe2000) следует ожидать
можность вычислить разность между кривыми
наличия крупных металлических наночастиц за
рассеяния, полученными при различных энер
счёт образования белковых агрегатов, содержа
гиях Δk(s) = I(s, E1) - I(s, Ek), которая пропорцио
щих металл.
нальна рассеянию резонансными атомами Fe и
Рис. 3. Экспериментальные кривые рассеяния от трёх Fe содержащих образцов белка Dps, измеренные при различных
энергиях фотонов: Dps Fe50 (а); Dps Fe500 (б); Dps Fe2000 (в). Номера кривых рассеяния соответствуют номерам энер
гий излучения Е1-7: 7,100; 7,110; 7,118; 7,125; 7,128; 7,130 и 7,133 кэВ
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
635
может быть использована для анализа распреде
500 атомов на молекулу белка также появляются
лений по размерам образованных в белковой
наночастицы размером 4-5 нм (плечо на графи
матрице наночастиц металла.
ке функции DV(R)) и более крупные формирова
6. Максимум аномального сигнала для всех
ния размером до 20 нм, относящиеся к наночас
Fe содержащих образцов зарегистрирован при
тицам оксида железа в белковых агрегатах. По
энергии фотонов E5 = 7,128 кэВ, т.е. вблизи K
следних, однако, при таком содержании ионов
полосы поглощения Fe (рис. 1). Соответствен
железа формируется совсем немного. И, нако
но, кривая рассеяния при этой энергии исполь
нец, при концентрации железа 2000 атомов на
зовалась для получения резонансного сигнала
додекамер исчезают частицы размером 2 нм и
Δ5(s) = I(s, E1) - I(s, E5) только от наночастиц
преимущественно образуются частицы разме
железа, образующихся во внутреннем простран
ром 4-5 нм, а также крупные Fe содержащие
стве белка Dps. Критерием того, что разностный
структуры. То есть при высоких концентрациях
сигнал действительно вызван исключительно
железа внутренние полости белка практически
рассеянием частицами Fe, является отсутствие
полностью заполняются наночастицами ионов
на полученных кривых аномального сигнала
металла. Их размер ограничивается и определя
рассеяния от белковой матрицы, т.е. от форм
ется размером внутренней полости додекаме
фактора Dps. Этому критерию удовлетворяли
ра Dps и концентрацией железа в растворе, что
все Fe содержащие образцы (рис. 4, a).
имеет значение с точки зрения возможного ис
Полученные кривые аномального сигнала
пользования матрицы этого белка для формиро
использовались затем для расчёта объёмных
вания стабилизированных в растворе металли
функций распределения по размерам DV(R) на
ческих наночастиц.
ночастиц оксида железа, образующихся во внут
Похожие результаты были получены альтер
ренних полостях додекамера Dps (рис. 4, б).
нативным методом определения фракционного
Важно отметить, что кривые аномального рассе
состава наночастиц железа в додекамере белка с
яния достаточно хорошо выражены для образ
помощью программы MIXTURE в предположе
цов Dps Fe500 и Dps Fe2000, в то время как для
нии сферичности образованных наночастиц.
образца Dps Fe50 этот сигнал слабый и зашум
Для каждого образца были заданы по три фрак
лённый. Поэтому функцию распределения по
ции с достаточно широким интервалом разме
размерам, рассчитанную по этой кривой, следу
ров Dmin - Dmax. Для каждой фракции программа
ет рассматривать только как оценочную.
MIXTURE рассчитала средний размер частиц и
Анализируя полученные объёмные распре
объёмную долю фракций (табл. 2).
деления по размерам (рис. 4, б), можно отсле
Как и в случае определения объёмных рас
дить следующие закономерности. При малом
пределений по размерам DV(R) с помощью интер
содержании ионов железа формируются преи
активной программы GNOM, в случае исполь
мущественно мелкие наночастицы с размерами
зования программы MIXTURE во всех образцах
~2 нм. При увеличении содержания железа до
доминирующей фракцией оказываются нано
частицы с размерами 2-4 нм и присутствует не
большое количество более крупных образова
Таблица 2. Фракционный состав наночастиц железа в бел
ке Dps
ний. Поскольку в обоих методах определяются
объёмные доли наночастиц, то в количествен
Образец
Интервал
Dresult, нм
Объёмная доля,
ном выражении число крупных частиц невелико
Dmin - Dmax
, нм
%
даже для высокой концентрации атомов железа
в исходном растворе, но из за своего размера та
Dps Fe50
1,8-3,0
1,3
94
кие большие частицы вносят существенный
4,0-6,0
4,6
1,0
вклад в рассеяние в самых малых углах, что хо
8,0-15,0
12,6
5,0
рошо видно на рис. 3, б и в.
Кривые малоуглового рассеяния, рассчитан
ные по указанным в табл. 2 фракционным сос
Dps Fe500
1,8-3,0
2,0
44
тавам каждого образца, хорошо соответствуют
4,0-6,0
4,0
43
полученным аномальным сигналам (рис. 5).
8,0-15,0
8,0
13
Мультифазное ab initiо моделировние по дан
ным МУРР. Из анализа литературных данных
известно, что сайты связывания ионов железа
Dps Fe2000
1,8-3,0
1,5
44
находятся не только во внутренней полости бел
4,0-6,0
4,0
40
ка, но также и на поверхности додекамера
8,0-15,0
9,0
16
Dps [28-30, 52]. В этом случае наночастицы не
образуются, но поскольку на каждый мономер
БИОХИМИЯ том 87 вып. 5 2022
4*
636
ШТЫКОВА и др.
Рис. 4. Определение распределений по размерам наночастиц оксида железа по данным аномального малоуглового рассе
яния. а - Разностные кривые (аномальный сигнал) Δ5(s) = I(s, E1) - I(s, E5) и соответствующие расчётные кривые рассе
яния от распределений по размерам наночастиц железа для образцов Dps Fe50 (1 и 2); Dps Fe500 (3 и 4) и Dps Fe2000 (5
и 6). б - Объёмные распределения по размерам DV(R) наночастиц железа в образцах Dps Fe50 (1), Dps Fe500 (2) и
Dps Fe2000 (3), рассчитанные по кривым аномального сигнала программой GNOM
может приходиться до четырёх аминокислот,
существует метод, позволяющий использовать
присоединяющих ионы металла в области N
различие в электронных плотностях отдельных
концевых доменов белка, то в сумме эти атомы
частей рассеивающих объектов, чтобы локализо
железа, благодаря своей высокой электронной
вать те или иные особенности структуры, связан
плотности, вносят свой вклад в рассеяние всей
ные с этим различием. Таким методом является
макромолекулы в целом и в распределения по
ab initio метод мультифазного моделирования,
размерам в частности. В малоугловом рассеянии
который реализован в программе MONSA [47].
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
637
Рис. 5. Сравнение разностных кривых (аномальных сигналов) Δ5(s) = I(s, E1) - I(s, E5) и соответствующих расчётных кри
вых рассеяния от распределений по размерам наночастиц, содержащих железо, для образцов Dps Fe50 (1 и 2);
Dps Fe500 (3 и 4) и Dps Fe2000 (5 и 6), полученных с помощью программы MIXTURE
Для решения структурной задачи в этом подхо
имеющем также функцию защиты генетическо
де необходимо учитывать различие электрон
го материала бактерий.
ных плотностей белковой и металлической сос
тавляющих комплекса, а также соотношение их
объёмов. Для получения двухфазной модели бе
ЗАКЛЮЧЕНИЕ
лок-металл были использованы кривые малоуг
лового рассеяния от исходного белка и белка,
Хорошо известно, что не все мини феррити
содержащего атомы железа. Был выбран обра
ны могут выполнять функцию защиты бактери
зец Dps Fe500 со средним содержанием железа,
ального генома при окислительном стрессе и
когда можно надежно детектировать сформиро
отнюдь не все нуклеоид ассоциированные бел
ванные наночастицы во внутренней полости
ки способны к детоксикации и накапливанию
белка, но в то же время на фоне сильного рассе
атомов железа. Поэтому многофункциональ
яния от этих наночастиц можно будет опреде
ность ферритин подобного белка Dps уникаль
лить локализацию значительно более мелких
на, и её следствием является устойчивая резис
металлсодержащих групп на поверхности доде
тентность бактерий к лекарственным препара
камера. Результаты моделирования представле
там и антибиотикам. Безусловно, основное вни
ны на рис. 6.
мание исследователей привлекает способность
Мультифазное моделирование позволило
Dps к in cellulo биокристаллизации с ДНК. Обра
впервые визуализировать локализацию атомов
зовавшиеся таким образом персистирующие
железа в поверхностном слое белка и в то же
клетки микроорганизмов толерантны ко мно
время подтвердить расположение основной
гим внешним воздействиям и могут сохранять
массы металла в центральной полости додека
жизнеспособность в течение очень долгого вре
мера. При этом получено хорошее соответствие
мени, а при наступлении благоприятных усло
между экспериментальными данными и расчёт
вий дают начало новой популяции, сохраняю
ными кривыми от шариковых моделей с
щей свои патогенные свойства [53]. Поэтому ар
χ2 = 2,1. Такая обобщённая модель даёт наибо
хивация ДНК в процессе in cellulo сокристалли
лее полную картину формирования наночастиц
зации с Dps требует внимания и глубокого изу
оксида железа в ферритин подобном белке,
чения. Однако не менее важно исследовать спо
БИОХИМИЯ том 87 вып. 5 2022
638
ШТЫКОВА и др.
Рис. 6. Мультифазное моделирование комплекса Dps с железом с помощью программы MONSA. а - Экспериментальная
кривая малоуглового рассеяния от исходного Dps (1); рассеяние от белковой части мультифазной модели (2); эксперимен
тальные данные от комплекса Dps Fe500 (3); рассеяние от полной мультифазной модели (4). б - Мультифазная модель.
Серые шарики обозначают белок, желтые - кластеры железа. Модель показана в разрезе для лучшей визуализации
собность Dps к детоксикации и переработке Fe2+
N концевые домены ответственны за взаимодей
в нетоксичную Fe3+ форму с последующим на
ствие с отрицательно заряженным сахарофос
коплением ионов трёхвалентного железа во
фатным остовом дезоксирибонуклеиновой кис
внутреннем пространстве белка, т.е. также в за
лоты [15, 22-24]. Соответственно, N концевые
щищённом от внешних воздействий состоянии.
домены белка должны быть доступны для связи
Обе функции Dps тесно связаны между со
с ДНК [50, 51, 53]. Однако атомы железа могут
бой [30]. В наших предыдущих работах мы ис
связываться с отрицательно заряженными ами
следовали закономерности образования
нокислотами Asp и Glu в тех же самых N конце
Dps-ДНК сокристаллов, в том числе при взаи
вых областях Dps. Железо относится к переход
модействии с двухвалентными ионами метал
ным металлам и образует прочные комплексы,
лов [37, 38, 50]. В данной работе мы изучали вто
например с азотом (N), входящим в состав ами
рую особенность функциональных свойств Dps,
ногрупп аминокислот. Поэтому двухвалентные
а именно: процесс накопления ионов железа во
атомы железа могут образовывать связи с сосед
внутренней полости этого мини ферритина.
ними белковыми цепями, притягивая их друг к
Применяя метод аномального малоуглового
другу и стабилизируя поверхностные участки
рассеяния, нам удалось показать, что в основ
додекамера. В этом случае N концевые домены
ном внутри белковой молекулы формируются
оказываются прижатыми к поверхности белка и
наночастицы с размерами 2-4 нм, т.е. рост ме
образование кристаллического комплекса
таллических наночастиц ограничен простран
Dps-ДНК не происходит [50, 54]. Однако при
ственными характеристиками внутренней по
сутствие в растворе хелатирующего агента, на
лости белка. Однако некоторое количество
пример ЭДТА, может разрушить эти связи желе
ионов железа содержится также в поверхностном
за с аминокислотами на поверхности додекаме
слое Dps. Этот слой очень важен для выполне
ра, и это может стать способом восстановления
ния белком своих защитных функций, посколь
взаимодействия Dps с ДНК, не затрагивая внут
ку находящиеся здесь N концевые домены оп
ренних областей белка и сформированных там
ределяют характер взаимодействия Dps с ДНК в
наночастиц. Таким образом, зарядовое состоя
растворе, и именно гибкие, богатые лизином
ние ионов железа в составе Dps (на поверхности
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
639
и в ядре) имеет большое значение и нуждается в
мер, кобальта и, возможно, других, представля
глубоком изучении.
ет определённый практический интерес. Поэто
Структурные исследования с помощью ма
му проведённые в данной работе исследования
лоуглового рентгеновского рассеяния не позво
могут быть полезными не только в плане изуче
ляют определить валентное состояние железа.
ния уникальных свойств Dps, но также могут
По определению, функция белков, подобных
быть вкладом в разработку стабилизированных
ферритину (в том числе Dps), состоит в окисле
в растворе биосовместимых нанокапсул, обла
нии Fe2+ до трёхвалентного состояния с после
дающих магнитными свойствами. Пластич
дующим накоплением этой нетоксичной формы
ность и структурная устойчивость белковой мат
в центральной полости белка. Однако имеются
рицы Dps может служить определенным гаран
работы, показывающие, что механизм удаления
том возможности разработки таких техноло
двухвалентного железа из раствора и окисления
гий [56].
его в соответствующих сайтах белка носит более
сложный характер. Так, при использовании ме
Финансирование. Работа выполнена при под
тода Мёссбауэровской спектроскопии для опре
держке Российского научного фонда (грант
деления зарядового состояния ионов железа бы
№ 18 74 10071).
ла показана неоднородность неорганической
Благодарности. Авторы благодарят А. Грузи
составляющей Dps. Оказалось, что железо в бел
нова, сотрудника Европейской лаборатории мо
ке находится в форме магнетита FeO · Fe2O3,
лекулярной биологии (EMBL), за проведение
т.е. представляет собой смесь ионов двухвалент
экспериментов по аномальному малоугловому
ного и трёхвалентного железа [55]. При этом ав
рассеянию и ценную дискуссию.
торами был сделан вывод, что именно такой
Конфликт интересов. Авторы заявляют об от
состав неорганических ядер Dps способствует
сутствии конфликта интересов.
поддержанию додекамерной структуры белка.
Соблюдение этических норм. Настоящая
В целом, процесс формирования внутри бел
статья не содержит описания каких либо иссле
ковой полости Dps наночастиц, содержащих
дований с участием людей или животных в каче
атомы металлов, и не только железа, но, напри стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Waldron, K. J., Rutherford, J. C., Ford, D., and Robinson,
zation of the bacterioferritin of Escherichia coli, Biochem.
N. J. (2009) Metalloproteins and metal sensing, Nature,
Soc. Trans., 18, 658 659.
460, 823 830.
12. Cheesman, M. R., Le Brun, N. E., Kadir, F. H. A.,
2. Andreini, C., Bertini, I., Cavallaro, G., Holliday, G. L.,
Thomson, A. J., Moore, G. R., et al. (1993) Haem and
and Thornton, J. M. (2008) Metal ions in biological catal
non haem iron sites in Escherichia coli bacterioferritin:
ysis: from enzyme databases to general principles, J. Biol.
Spectroscopic and model building studies, Biochem. J.,
Inorg. Chem., 13, 1205 1218.
292, 47 56.
3. Beinert, H., Holm, R. H., and Munck, E. (1997) Iron sul
13. Chasteen, N. D. (1998) Ferritin. Uptake, storage, and
fur clusters: nature’s modular, multipurpose structures,
release of iron, Met. Ions Biol. Syst., 35, 479 514.
Science, 277, 653 659.
14. Romao, C. V., Louro, R., Timkovich, R., Lёubben, M.,
4. Fenton, H. J. H. (1894) Oxidation of tartaric acid in pres
Liu, M. Y., et al. (2000) Iron coproporphyrin III is a nat
ence of iron, J. Chem. Soc. Trans., 65, 899 910.
ural cofactor in bacterioferritin from the anaerobic bacteri
5. Briat, J. F. (1992) Iron assimilation and storage in prokary
um Desulfovibrio desulfuricans, FEBS Lett., 480, 213 216.
otes, J. Gen. Microbiol., 138, 2475 2483.
15. Almiron, M., Link, A. J., Furlong, D., and Kolter, R.
6. Andrews, S. C. (1998) Iron storage in bacteria, Adv.
(1992) A novel DNA binding protein with regulatory and
Microbial. Physiol., 40, 281 351.
protective roles in starved Escherichia coli, Genes Dev., 6,
7. Harrison, P. M., and Arosio, P. (1996) The ferritins:
2646 2654.
Molecular properties, iron storage function and cellular
16. Nair, S., and Finkel, S. E. (2004) Dps protects cells against
regulation, Biochim. Biophys. Acta, 1275, 161 203.
multiple stresses during stationary phase, J. Bacteriol., 186,
8. Theil, E. C. (1987) Ferritin, structure, gene regulation, and
4192 4198.
cellular function in animals, plants, and microorganisms,
17. Frenkiel Krispin, D., and Minsky, A. (2006) Nucleoid orga
Annu. Rev. Biochem., 56, 289 315.
nization and the maintenance of DNA integrity in E. coli,
9. Levi, S., Salfeld, J., Franceschinelli, F., Cozzi, A., Dorner,
B. subtilis and D. radiodurans, J. Struct. Biol., 156, 311 319.
M. H., et al. (1989) Expression and structural and func
18. Frenkiel Krispin, D., Ben Avraham, I., Englander, J.,
tional properties of human ferritin L chain from
Shimoni, E., Wolf, S. G., et al. (2004) Nucleoid restructur
Escherichia coli, Biochemistry, 28, 5179 5184.
ing in stationary state bacteria, Mol. Microbiol., 51, 395 405.
10. Hudson, A. J., Andrews, S. C., Hawkins, C., Williams,
19. Reich, Z., Wachtel, E. J., and Minsky, A. (1994) Liquid
J. M., Izuhara, M., et al. (1993) Overproduction, purifica
crystalline mesophases of plasmid DNA in bacteria,
tion and characterization of the Escherichia coli ferritin,
Science, 264, 1460 1463.
Eur. J. Biochem., 218, 985 995.
20. Wolf, S. G., Frenkiel, D., Arad, T., Finkel, S. E.,
11. Andrews, S. C., Smith, J. M. A., Guest, J. R., and
Kolter, R., et al. (1999) DNA protection by biocrystalliza
Harrison, P. M. (1990) Genetic and structural characteri
tion, Nature, 400, 83 85.
БИОХИМИЯ том 87 вып. 5 2022
640
ШТЫКОВА и др.
21.
Stephani, K., Weichart, D., and Hengge, R.
(2003)
40.
Blanchet, C. E., Spilotros, A., Schwemmer, F., Graewert,
Dynamic control of Dps protein levels by ClpXP and
M. A., Kikhney, A., et al. (2015) Versatile sample environ
ClpAP proteases in Escherichia coli, Mol. Microbiol., 49,
ments and automation for biological solution X ray scat
1605 1614.
tering experiments at the P12 beamline (PETRA III,
22.
Azam, T. A., and Ishihama, A. (1999) Twelve species of the
DESY), J. Appl. Crystallogr., 48, 431 443.
nucleoid associated protein from Escherichia coli, J. Biol.
41.
Konarev, P. V., Volkov, V. V., Sokolova, A. V., Koch,
Chem., 274, 33105 33113.
M. H. J., and Svergun, D. I. (2003) PRIMUS: A Windows
23.
Azam, T. A., Iwata, A., Nishimura, A., Ueda, S., and
PC based system for small angle scattering data analysis,
Ishihama, A. (1999) Growth phase dependent variation in
J. Appl. Cryst., 36, 1277 1282.
protein composition of the Escherichia coli nucleoid,
42.
Manalastas Cantos, K., Konarev, P. V., Hajizadeh, N. R.,
J. Bacteriol., 181, 6361 6370.
Kikhney, A. G., Petoukhov, M. V., et al. (2021) ATSAS 3.0:
24.
Ceci, P., Cellai, S., Falvo, E., Rivetti, C., Rossi, G. L.,
Expanded functionality and new tools for small angle scat
et al. (2004) DNA condensation and self aggregation of
tering data analysis, J. Appl. Cryst., 54, 343 355.
Escherichia coli Dps are coupled phenomena related to the
43.
Hajizadeh, N. R., Franke, D., Jeffries, C. M., and
properties of the N terminus, Nucleic Acids Res., 32, 5935
Svergun, D. I. (2018) Consensus Bayesian assessment of
5944.
protein molecular mass from solution X ray scattering
25.
Gupta, S., and Chatterji, D. (2003) Bimodal protection of
data, Sci. Rep., 8, 7204.
DNA by Mycobacterium smegmatis DNA binding protein
44.
Porod, G. (1982) Small Angle X?Ray Scattering, Academic
from stationary phase cells, J. Biol. Chem., 278, 5235 5241.
Press, London.
26.
Grant, R. A., Filman, D. J., Finkel, S. E., Kolter, R., and
45.
Franke, D., Petoukhov, M. V., Konarev, P. V.,
Hogle, J. M. (1998) The crystal structure of Dps, a ferritin
Panjkovich, A., Tuukkanen, A., et al. (2017) ATSAS 2.8:
homolog that binds and protects DNA, Nat. Struct. Biol., 5,
A comprehensive data analysis suite for small angle scat
294 303.
tering from macromolecular solutions, J. Appl. Cryst., 50,
27.
Zhao, G., Ceci, P., Ilari, A., Giangiacomo, L., Laue, T.
1212 1225.
M., et al. (2002) Iron and hydrogen peroxide detoxification
46.
Svergun, D. I. (1992) Determination of the regularization
properties of DNA binding protein from starved cells.
parameter in indirect transform methods using perceptual
A ferritin like DNA binding protein of Escherichia coli,
criteria, J. Appl. Cryst., 25, 495 503.
J. Biol. Chem., 277, 27689 27696.
47.
Svergun, D. I. (1999) Restoring low resolution structure of
28.
Ilari, A., Ceci, P., Ferrari, D., Rossi, G. L., and
biological macromolecules from solution scattering using
Chiancone, E. (2002) Iron incorporation into Escherichia
simulated annealing, Biophys. J., 76, 2879 2886.
coli Dps gives rise to a ferritin like microcrystalline core,
48.
Svergun, D., Barberato, C., and Koch, M. H. J. (1995)
J. Biol. Chem., 277, 37619 37623.
CRYSOL - a program to evaluate X ray solution scattering
29.
Ilari, A., Stefanini, S., Chiancone, E., and Tsernoglou, D.
of biological macromolecules from atomic coordinates,
(2000) The dodecameric ferritin from Listeria innocua
J. Appl. Cryst., 28, 768 773.
contains a novel intersubunit iron binding site, Nat. Struct.
49.
Gruzinov, A. Y., Schroer, M. A., Manalastas Cantos, K.,
Biol., 7, 38 43.
Kikhney, A. G., Hajizadeh, N. R., et al. (2021) Anomalous
30.
Nguyen, K. H., and Grove, A. (2012) Metal binding at the
SAXS at P12 beamline EMBL Hamburg: Instrumentation
Deinococcus radiodurans Dps 1N terminal metal site con
and applications, J. Synch. Rad., 28, 812 823.
trols dodecameric assembly and DNA binding,
50.
Сошинская Е. Ю., Дадинова Л. А., Можаев А. А.,
Biochemistry, 51, 6679 6689.
Штыкова Э. В. (2020) Влияние состава буфера на кон
31.
Smith, J. L. (2004) The physiological role of ferritin like
формационную подвижность N концевых фрагмен
compounds in bacteria, Crit. Rev. Microbiol., 30, 173 185.
тов Dps и характер взаимодействия с ДНК. Исследо
32.
Feigin, L. A., and Svergun, D. I. (1987) Structure Analysis
вание методом малоуголового рентгеновского рассея
by Small?Angle x?Ray and Neutron Scattering, Plenum
ния, Кристаллография, 65, 886 895.
Press, New York.
51.
Dubrovin, E. V., Dadinova, L. A., Petoukhov, M. V.,
33.
Stuhrmann, H. B. (1980) Anomalous dispersion of small
Soshinskaya, E. Yu., Mozhaev, A. A., et al. (2021) Spatial
angle scattering of horse spleen ferritin at the Iron K
organization of Dps and DNA-Dps complexes, J. Mol.
absorption edge, Acta Crystallogr. A, 36, 996 1001.
Biol., 433, 166930.
34.
Stuhrmann, H. B., and Notbohm, H.
(1981)
52.
Minato, T., Teramoto, T., Kakuta, Y., Ogo, S., and Yoon,
Configuration of the four iron atoms in dissolved human
K. S. (2020) Biochemical and structural characterization
hemoglobin as studied by anomalous dispersion, Proc.
of a thermostable Dps protein with His type ferroxidase
Natl. Acad. Sci. USA, 78, 6216 6220.
centers and outer metal binding sites, FEBS Open Bio, 10,
35.
Stuhrmann, H. B. (1985) Resonant scattering in macro
1219 1229.
molecular structure research, Adv. Polym. Sci., 67, 123 163.
53.
Harms, A., Maisonneuve, E., and Gerdes, K. (2016)
36.
Stuhrmann, H. B., Goerigk, G, and Munk, B. (1994)
Mechanisms of bacterial persistence during stress and
Anomalous X?ray Scattering, Elsevier, Amsterdam.
antibiotic exposure, Science, 354, aaf4268.
37.
Dadinova, L. A., Chesnokov, Y. M., Kamyshinsky, R. A.,
54.
Dadinova, L., Kamyshinsky, R., Chesnokov, Yu.,
Orlov, I. A., Petoukhov, M. V., et al. (2019) Protective
Mozhaev, A., Matveev, V., et al. (2021) Structural
Dps-DNA co crystallization in stressed cells: An in vitro
rearrangement of Dps-DNA complex caused by divalent
structural study by small angle X ray scattering and cryo
Mg and Fe cations, Int. J. Mol. Sci., 22, 6056.
electron tomography, FEBS Lett., 593, 1360 1371.
55.
Antipov, S., Turishchev, S., Purtov, Yu., Shvyreva, U.,
38.
Kamyshinsky, R., Chesnokov, Y., Dadinova, L.,
Sinelnikov, A., et al. (2017) The oligomeric form of the
Mozhaev, A., Orlov, I., et al. (2020) Polymorphic protec
Escherichia coli Dps protein depends on the availability of
tive Dps-DNA co crystals by cryo electron tomography
iron ions, Molecules, 22, 1904.
and small angle X ray scattering, Biomolecules, 10, 39.
56.
Zeth, K., Sancho Vaello, E., and Okuda, M. (2019) Metal
39.
Grimsley, G. R., and Pace, C. N. (2004) Spectrophoto
positions and translocation pathways of the dodeca
metric determination of protein concentration, Curr.
meric ferritin like protein Dps, Inorg. Chem., 58, 11351
Protoc Protein Sci., 3, doi: 10.1002/0471140864.ps0301s33.
11363.
БИОХИМИЯ том 87 вып. 5 2022
ФОРМИРОВАНИЕ ЧАСТИЦ ОКСИДА ЖЕЛЕЗА В БЕЛКЕ Dps
641
FORMATION OF IRON OXIDE NANOPARTICLES
IN INTERNAL CAVITY OF FERRITIN LIKE Dps PROTEIN.
INVESTIGATION WITH ANOMALOUS DISPERSION OF X RAYS
E. V. Shtykova1*, M. V. Petoukhov1,2, and A. A. Mozhaev1,3,4,5
1 Shubnikov Institute of Crystallography of Federal Scientific Research Centre “Crystallography and Photonics”,
Russian Academy of Sciences, 119333 Moscow, Russia; e?mail: shtykova@ns.crys.ras.ru
2 Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences, 119071 Moscow, Russia
3 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences, 117997 Moscow, Russia
4 Pirogov Russian National Research Medical University, 117997 Moscow, Russia
5 National Research University Higher School of Economics, 101000 Moscow, Russia
DNA binding protein of starvation (Dps) plays a special role among dodecamer miniferritins. Its most important
function is to protect the bacterial genome from various types of destructive external influences by means of in cellu?
lo Dps DNA co crystallization. The consequence of such a protective reaction is the emergence of bacterial resis
tance to antibiotics and other drugs. Therefore, great attention is paid to the study of the genome protective proper
ties of Dps. However, the other side of Dps functionality is equally important. Being ferritin like, this protein acts as
an iron storage depot and protects bacterial cells from oxidative damage initiated by its excess. The study of this phe
nomenon is also very relevant, and this work is devoted to the study of the formation of iron oxide nanoparticles in the
internal cavity of the Dps dodecamer. The method of anomalous small angle scattering was chosen as the main
research method, which makes it possible to study the structure of metal containing biological macromolecules and
determine the size distribution of metal nanoparticles formed in them. The contributions of the protein and metal
components to the total scattering are separated by varying the energy of the incident X ray radiation near the edge of
the absorption band by metal atoms, in this case the K absorption band of iron. Dps samples containing 50, 500, and
2000 iron atoms per protein dodecamer were examined. An analysis of the obtained size distributions showed that,
depending on the iron content in the solution, nanoparticles with sizes of 2 4 nm are formed inside the protein mol
ecule, and the growth of metal nanoparticles is limited by the size of the central cavity of the protein. It was also shown
that some amount of iron ions is contained in the surface layer of Dps. This layer is very important for the protein to
perform its protective functions, since the N terminal domains located here determine the nature of the interaction
between Dps and DNA. In general, the results obtained in this work can be useful as the next step in the study of the
Dps phenomenon, as well as from a practical point of view, in the creation of biocompatible and solution stabilized
metal nanoparticles.
Keywords: ferritin like proteins, Dps, iron oxide, anomalous SAXS, size distribution
БИОХИМИЯ том 87 вып. 5 2022