БИОХИМИЯ, 2022, том 87, вып. 5, с. 642 - 659
УДК 57.017.82
ПОЛИЭКСТРЕМОФИЛЬНЫЕ ЭУКАРИОТЫ CYANIDIALES
Обзор
© 2022
И.Н. Стадничук1*, И.В. Тропин2
1 Институт физиологии растений имени К.А. Тимирязева РАН, 127726 Москва,
Россия; электронная почта: stadnichuk@mail.ru
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 29.12.2021
После доработки 28.03.2022
Принята к публикации 24.04.2022
Красные микроводоросли Cyanidiales благодаря полиэкстремофилии, считавшейся невозможной для эука!
риот, получили название «водорослей!загадок». Cyanidiales обитают преимущественно в геотермальных
серных источниках с pH 0-4, температурами до 56 °С, в присутствии растворенных тяжелых металлов, со!
четая эукариотное строение клеток с особенностями, присущими лишь экстремофильным видам прокариот.
Благодаря исключительности свойств и минимальным для эукариот размерам генома Cyanidiales стали од!
ним из важнейших объектов исследований в клеточной физиологии, биохимии, молекулярной биологии,
филогеномике и эволюционной биологии. Они играют важную роль в исследовании многих сторон окси!
генного фотосинтеза и вопросов его происхождения. Свойства полиэкстремофилии и соответствующие пу!
ти метаболизма были унаследованы Cyanidiales от архей и бактерий с помощью горизонтального переноса
генов. Тем самым была открыта возможность передачи генов от прокариот к эукариотам, что стало новым
этапом в понимании становления эукариотной организации клетки.
КЛЮЧЕВЫЕ СЛОВА: термоацидофилия, микроводоросли, Cyanidiales, Cyanidium caldarium, Cyanidioschyzon
merolae, Galdieria sulphuraria.
DOI: 10.31857/S0320972522050050, EDN: ATHDHC
Посвящается памяти О.Ю. Сенцовой
ВВЕДЕНИЕ
также не встречается у других оксигенных фото!
синтетиков. Длительное время Cyanidiales слу!
Микроводоросли Cyanidiales являются высо!
жили лишь объектами исследований в области
коспецифичной группой эукариотных фотосин!
альгологии и экофизиологии [1]. К началу 90!х
тетиков в составе отдела Rhodophyta. Основные
годов прошлого века было открыто несколько
представители группы обитают в геотермальных
новых представителей этой группы, в чем нема!
серных источниках, ранее считавшихся недос!
лую роль сыграли работы О.Ю. Сенцовой, рас!
тупными для эукариот, и являются полиэкстре!
ширившие видовой состав и биогеографию вул!
мофилами, растущими при крайне низких зна!
канических зон обитания этих уникальных мик!
чениях pH (0-4) и высокой температуре, вплоть
роорганизмов [2, 3]. Начавшиеся затем генети!
до 56 °С, в присутствии токсичных ионов тяже!
ческие, биохимические и молекулярно!биоло!
лых металлов. Способность существовать при
гические исследования Cyanidiales и иных крас!
сочетании подобных условий известна лишь для
ных водорослей пролили свет на ранние этапы
ряда архей и бактерий, но не описана для каких!
происхождения оксигенного фотосинтеза,
либо иных эукариотных организмов. Кроме то!
включая эндосимбиотическое происхождение
го, виды, принадлежащие роду Galdieria в соста!
хлоропластов и формирование супергруппы ар!
ве порядка Cyanidiales, способны наряду с авто!
хепластид - красных, зеленых и глаукофитовых
трофией к гетеротрофному росту с использова!
водорослей, имеющих двумембранные хлоро!
нием десятков органических субстратов, что
пласты [4]. Изучение архепластид позволяет
проследить последующее распространение ок!
Принятые сокращения: ГПГ - горизонтальный пе!
сигенного фотосинтеза среди остальных водо!
ренос генов.
рослевых фил и наземных растений. Секвениро!
* Адресат для корреспонденции.
вание геномов у ряда видов Cyanidiales и других
642
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
643
красных водорослей показало, что их эволюция
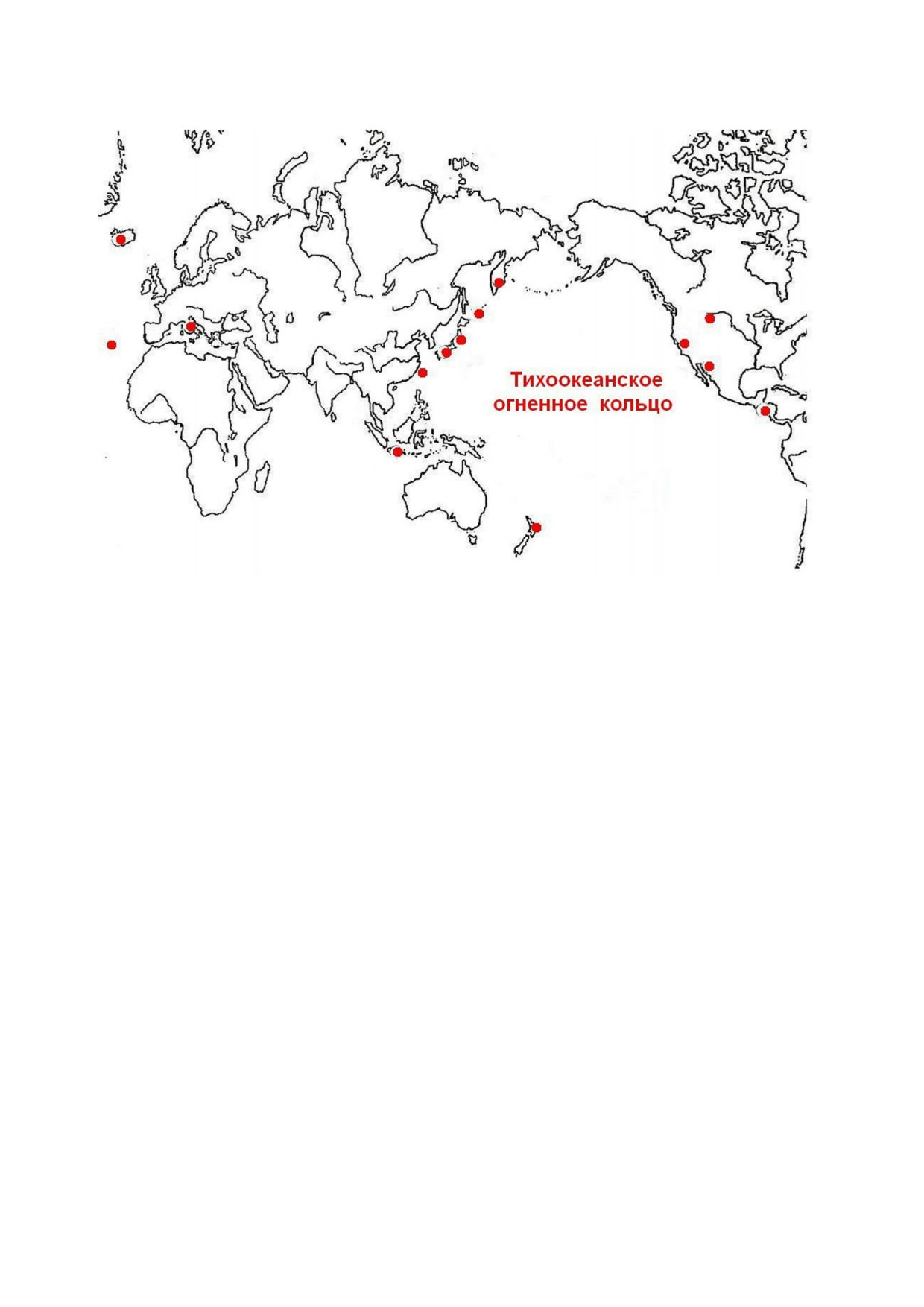
ненного кольца (рис. 1). В Европе термоацидо!
сопровождалась утратой значительной доли ге!
филы, кроме Италии, были найдены в Исландии
нов, присутствовавших у общего фотосинтези!
и на Азорских островах ([1, 6, 7] и рис. 1).
рующего эукариотного предка [5]. Оказалось,
Эндолитные мезофильные разновидности
что эволюционный прогресс может быть связан
Galdieria были найдены в разломах и расселинах
не только с увеличением разнообразия генов, но
скал, в порах рыхлых каменистых пород и в фо!
и с их элиминацией, ведущей к сокращению
тической зоне пещер, где они защищены от вы!
энергозатрат клетки на содержание генетичес!
сыхания, перепадов температуры и действия
кого аппарата [4, 5]. Филогеномный анализ в со!
ультрафиолета. Клетки водорослей образуют
поставлении с исследованием метаболических
налеты!пленки, имеющие цвет от сине!зелено!
путей за последние годы позволили установить,
го до почти черного там, где возникает кислая
что устойчивость к жестким стрессовым услови!
среда обитания. Разновидности Galdieria, мор!
ям унаследована представителями Cyanidiales от
фологически сходные с G. sulphuraria, обнаруже!
экстремофильных прокариот, благодаря чему
ны также при слабокислых и нейтральных
был открыт горизонтальный перенос генов
pH (5-7) в карстовых пещерах Чили, Израиля,
(ГПГ) между про! и эукариотами, известный ра!
Турции и Франции
[1,
6]. Еще один вид
нее только для коэволюции архей и бактерий [5].
Galdieria, названный Galdieria phlegrea, найден в
Эти полиэкстремофилы можно культивировать
кислой, но не термальной среде обитания [1], а
как в лабораторных условиях, так и в открытых
нахождение Galdieria в разогревающихся отвалах
водоемах, где любые иные микроводоросли
добычи каменного угля означает появление
подвергаются риску бактериального заражения.
приспособленности к антропогенному ланд!
В настоящее время изучение видов, принадле!
шафту [11]. Классификация большого количе!
жащих к Cyanidiales, с полностью секвениро!
ства эндолитных штаммов остается неопреде!
ванными геномами является междисциплинар!
ленной. Среди Cyanidiales имеются виды!кос!
ной областью биологии, имеющей прекрасные
мополиты (G. maxima, G. partita, G. sulphuraria и
биотехнологические перспективы и позволяю!
C. caldarium) и эндемики ряда районов. Филоге!
щей очертить адаптационные границы, в кото!
номные данные свидетельствуют, что наиболее
рых способны существовать эукариоты [6].
ранними по происхождению стали не мезофи!
лы, а геотермальные виды Cyanidiales, причем
первой возникшей подгруппой этих микроводо!
ИСТОРИЯ, СИСТЕМАТИКА,
рослей является род Galdieria [7].
БИОГЕОГРАФИЯ
В настоящее время общепризнанными явля!
ются семь видов Cyanidiales: Cyanidioschyzon
Микроорганизм синеватой окраски с неяс!
merolae De Luca, Cyanidium caldarium Geitler,
ной систематической принадлежностью был об!
Galdieria sulphuraria Merola, Galdieria maxima
наружен в кислых термальных источниках Ита!
Sentsova, Galdieria partita Sentsova, Galdieria
лии в первой половине XIX века (см. работу [7] и
daedala Sentsova и Galdieria phlegrea Pinto [7, 11].
ссылки в ней). После уточнения особенностей
В отделе красных водорослей, или Rhodophyta,
морфологии и ряда переименований вид был в
они образуют филу Cyanidiophytina, класс
итоге идентифицирован как красная микрово!
Cyanidiophyceae, порядок Cyanidiales и два се!
доросль и получил название Cyanidium caldarium
мейства: Cyanidiaceae c родами Cyanidium (1 вид)
(см. [8] и ссылки). Многие годы C. caldarium счи!
и Cyanidioschyzon (1 вид) и Galdieraceae c одним
тался уникальным видом, пока в 1981 г., также в
родом Galdieria, содержащим 5 видов. В 2020 г.
Италии, не была найдена морфологически сход!
найден еще один вид, принадлежащий к
ная с C. caldarium геотермальная микроводо!
Cyanidiales, для которого предложено название
росль Galdieria sulphuraria [9], а несколькими го!
Cyanidiococcus yangmingshanensis [12]. По размеру
дами ранее - еще один представитель этой груп!
клеток и ряду других морфологических призна!
пы, Cyanidioschyzon merolae [10]. В начале 90!х го!
ков этот вид наиболее близок к C. merolae [12].
дов О.Ю. Сенцовой [2, 3] род Galdieria был по!
полнен сразу тремя новыми видами: G. partita,
G. daedala и G. maxima, найденными на Камчатке
ЭВОЛЮЦИОННОЕ ПРОИСХОЖДЕНИЕ
и Курильских островах. В дальнейшем эти фото!
синтетики были обнаружены в гейзерах, фума!
Родоначальниками оксигенного фотосинте!
ролах, серных источниках, сольфатарных участ!
за являются, как известно, возникшие
ках и в сопровождающих горячие источники
2,6-2,5 млрд лет назад цианобактерии. Около
грязевых альго!бактериальных матах в различ!
1,9 млрд лет тому назад в результате эндосимби!
ных районах Тихоокеанского вулканического ог!
онтного поглощения цианобактерии, родствен!
БИОХИМИЯ том 87 вып. 5 2022
644
СТАДНИЧУК, ТРОПИН
Рис. 1. Геотермальные области обнаружения Cyanidiales (обозначены кружками по данным обзорных вулканологических
карт)
ной нынешнему примитивному роду Gloeomar=
В совокупности с тремя архепластидными
garita [11], неким эукариотным гетеротрофом
таксонами в альгологической систематике на!
сформировались хлоропласты и возник общий
считывается около 10 наиболее крупных водо!
автотрофный эукариотный предок [10, 11]. Этот
рослевых отделов. Среди них - отдел красные
несохранившийся предковый ствол фотосинте!
водоросли (багрянки, Rhodophyta) образован
тиков, не получивший определенного названия
семью классами одно! и многоклеточных, в ос!
(возможное - Protoarchaeplastida), подвергся
новном морских водорослей [15]. Cyanidiales об!
разновременной дивергенции на три эукариот!
разуют монофилетическую группу, отделившу!
ные ветви (см. [11, 12] и ссылки). Согласно фило!
юся 1,4 млрд лет назад от остальных красных во!
геномным данным, сначала, 1,7 млрд лет тому
дорослей. Поэтому наряду с глаукофитами
назад, от единого ствола отделились глаукофиты
Cyanidiales являются наиболее древними эука!
(синяя ветвь), спустя 100-200 млн лет от оста!
риотами!фотосинтетиками. Экстремофилия и
вавшегося общим для красных и зеленых водо!
раннее обособление стали причинами их отли!
рослей предка возникли одноклеточные багрян!
чия от других Rhodophyta [15].
ки (красная ветвь) и, наконец, 1,1 млрд лет на!
зад появились зеленые водоросли [11]. Три груп!
пы эукариот, названных архепластидами, имеют
ЦИТОЛОГИЯ И КАРИОЛОГИЯ
хлоропласты с двойной мембраной и вместе с
цианобактериями сохраняются по настоящее
Клетки Cyanidiales имеют характерный си!
время (рис. 2). В ходе последовавших событий
не!зеленый цвет и иногда могут быть собраны в
вторичного и третичного эндосимбиоза зеленые
гомогенный слизистый матрикс. В клетках при!
и красные микроводоросли (но не Cyanidiales)
сутствуют микротельца, есть один беспиреноид!
дали начало водорослям с четырехмембранным
ный стенкоположный хлоропласт с параллельно
и редуцированными трехмембранными хлоро!
идущими тилакоидами. Митохондрия един!
пластами, в результате чего появились новые во!
ственная, обычно вогнутой формы; толщина
дорослевые филы [13]. Высшие растения уна!
клеточной стенки не менее 40 нм, но у C. merolae
следовали от зеленых водорослей архепластид!
стенка не сформирована. У всех, кроме
ный тип хлоропластов [14].
Galdieria, отсутствует вакуоля. Общим свой!
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
645
Рис. 2. Происхождение трех фил архепластидных фотосинтетиков (Glaucophyta, Viridiplantae и Rhodophyta). Длина отрез!
ков, последовательно (слева направо) соединяющих группы организмов, условно пропорциональна срокам их появления.
Фила Rhodophyta [15] состоит из рано обособившейся субфилы Cyanidiophytina (один класс Cyanidiophyceae с одним по!
рядком Cyanidiales) и субфилы Rhodophytina, содержащей группы Bangiophyceae, Compsopogonophyceae, Floridiophyceae,
Porphyridiophyceae, Rhodellophyceae, Stygnematophyceae
ством является использование аммония в каче!
ОСОБЕННОСТИ ГЕНОМА
стве источника минерального азота.
Клетки C. caldarium и видов рода Galdieria об!
Особенности генома Cyanidiales определя!
ладают округлой формой. Их обычные разме!
ются историей происхождения Rhodophyta,
ры составляют 2-5 мкм. Самым крупными явля!
ранним отделением ветви Cyanidiales от основ!
ются клетки G. maxima (штамм IPPAS!P507), диа!
ного эволюционного ствола красных водорос!
метр которых равен 4,0-16,5 мкм [2, 3]. C. mero=
лей, горизонтальным переносом генов (ГПГ) от
lae отличается от других водорослей наименьши!
прокариот, обусловливающим экстремофилию,
ми размерами (≤ 1,5-2,0 мкм) и овально!груше!
и микроэволюцией видов внутри группы. Ге!
видной формой клеток
[16]. Размножение
номные проекты осуществлены для C. merolae и
Cyanidiales бесполое, с помощью округлых или
G. sulphuraria.
тетраэдрических эндоспор. Как правило, образу!
Транскриптомные и геномные данные для
ются 4 эндоспоры, но возможно уменьшение их
представителей 14 родов красных водорослей
числа до 2 или увеличение до 8 и даже до 32.
показали, что их клетки содержат не более
У C. merolae размножение, при отсутствии кле!
10 000 генов. Становление багрянок сопровож!
точной стенки, происходит перетяжкой клетки
далось сокращением примерно 25% генома, ко!
надвое, но в геноме сохраняются гены белков,
торый имелся у их общего с зелеными водорос!
обслуживающих мейотическое деление [16, 17].
лями эукариотного предка [20, 21]. Были утра!
C. caldarium и G. sulphuraria нередко обитают
чены гены жгутиков, базальных телец, фито!
совместно и морфологически очень сходны.
хромной системы, уреазы (гидролиз мочевины),
Многие годы их наиболее ясным различием слу!
специфичного для растений миозина, гены ре!
жила возможность гетеротрофии у G. sulphuraria.
гуляции автофагии, часть генов сократительных
Определение хромосомных чисел вносит яс!
белков цитокинеза и гены контактных белков
ность в альгологическую систематику, особенно
плазмалеммы и мембранных ферментов [20, 21].
в случае подобных затруднений [18]. Водоросли
Альгологическая обособленность красных водо!
семейства Galdieraceae (G. sulphuraria, G. partita и
рослей, включая Cyanidiales, проявляется также
G. maxima) имеют минимальный для эукариот
в общем с грибами кинурениновом, но не ас!
набор из двух хромосом, в то время как в ядре
партатном пути катаболизма триптофана с его
C. caldarium хромосомы меньше по размерам и их
участием в de novo биосинтезе NAD+ [22].
насчитывается пять, или, возможно, семь [19].
Дальнейшее сокращение генома произошло
Для С. merolae разрешение хромосомных изобра!
при отхождении ветви Cyanidiales от общего
жений в микроскопических препаратах оказа!
ствола красных водорослей. У Cyanidiales отсут!
лось недостаточным. Геномные исследования
ствуют мейоз и часть связанных с мейозом ге!
позволили установить, что ядро клеток С. merolae
нов. По сравнению с другими фотосинтетиками
содержит 20 хромосом [20], чьи изображения в
понижена доля генов, регулирующих образова!
световом микроскопе накладываются друг на
ние вторичных метаболитов. У C. merolae утраче!
друга. Таким образом, все роды Cyanidiales име!
ны гены клеточной стенки и гены транспорта
ют достоверные кариологические различия.
многих углеводов. Ядерный геном содержит
БИОХИМИЯ том 87 вып. 5 2022
646
СТАДНИЧУК, ТРОПИН
5331 ген, в том числе 4474 белок!кодирующих
теризуются эндоплазматической передачей ге!
генов, и является наименьшим из всех извест!
нов в клеточное ядро. Пластомы G. sulphuraria и
ных у фотосинтезирующих эукариот [20]. Гены
C. merolae сокращаются соответственно до 207 и
имеют малое число повторов и минимум интро!
158 белок!кодирующих генов, которые имеют
нов (26 на весь геном), а удобство генетических
большое число межгенных петель. Отмечена
трансформаций делает C. merolae модельным
компактность пластома C. merolae с перекрыва!
объектом геномики [6, 23].
нием 40% имеющихся генов. В пластоме найден
В секвенированном геноме G. sulphuraria
ген субъединицы сульфатного транспортера,
найдено 6623 гена. Сохраняются интроны и аль!
что, очевидно, коррелирует с обитанием этого
тернативный сплайсинг, что необходимо для
организма в серных источниках. Набор митохон!
сложного аппарата построения клеточной стен!
дриальных генов, а именно, 18 у G. sulphuraria и
ки, а также транспорта и усвоения десятков ор!
34 у C. merolae, является еще меньшим, и коль!
ганических субстратов при гетеротрофном и
цевые геномы, как и в родопластах, не содержат
миксотрофном росте, возможном для Galdieria
интронов. В целом влияние экстремофилии на
[21]. Появляющиеся адаптационные возмож!
геномы органелл исследовано еще недостаточно
ности, обеспечиваемые более широким набо!
(см. [28] и ссылки).
ром генов и интронами [24], могут превалиро!
вать над выигрышем от сокращения энергозат!
рат на содержание генома, как в случае
ТЕРМОФИЛИЯ
G. sulphuraria, либо отступать на второй план пе!
ред экономией энергорасходов клетки, как у
Верхняя температурная граница роста
C. merolae. Не менее 30% генов G. sulphuraria не
Cyanidiales находится на 50-56 °С, что является
имеют ортологов в геноме C. merolae и наоборот,
недостижимым пределом для иных микроводо!
что указывает, согласно известному принципу
рослей (см. [29] и ссылки). У других эукариот!
конкурентного исключения, на занятие двумя
ных термофилов (немногие простейшие и
видами различных микрониш в термально!аци!
грибы) лимит может находиться выше, в облас!
дофильных биотопах.
ти 62-63 °С. Способность жить при температу!
Согласно филогеномному анализу, Cyanidiales
рах выше 80 °С считается гипертермофилией,
благодаря ГПГ приобрели 5% своих белок!ко!
возможной для архей и бактерий (рис. 3, а). Сле!
дирующих генов от архей и бактерий. У G. sul=
дует упомянуть, что максимальная температура
phuraria идентифицировано по крайней мере
роста, равная 122 °С, зафиксирована для мета!
75 заимствований генов от экстремофильных
ногенной археи Methanopyrus kandleri [29].
прокариот [25]. От архей получены ATPазы, свя!
Общим свойством термофилов является по!
занные с толерантностью клеток к повышен!
явление в цитоплазме протекторных соедине!
ным температурам [20, 25], и гены биометили!
ний, например полиаминов. Также показано
рования мышьяковистых производных [26].
уменьшение числа двойных связей в составе
Среди трансмембранных транспортных протеи!
жирных кислот и увеличение гидрофобности
нов в плазмалемме преобладают белки, полу!
белков. В составе ДНК отмечается рост доли гу!
ченные благодаря ГПГ. Многочисленные саха!
анина и цитозина, пара оснований которых бо!
рокиназы G. sulphuraria проявляют большее
лее стабильна, чем пара аденин!урацил, и воз!
сходство с ферментами прокариот, чем с белка!
растание гидрофобности белков [29, 30].
ми растений [27]. О некоторых белках, напри!
Наиболее исследованным в этом плане у
мер, ферментах пути синтеза сахарозы у G. sul=
Cyanidiales является фотосинтетический белок
phuraria, нельзя сказать с определенностью, по!
С!фикоцианин, в молекуле которого дополни!
лучены ли они с помощью ГПГ или унаследова!
тельные солевые мостики ведут к повышению
ны напрямую от общего предка зеленых и крас!
температуры денатурации до 83 °С, что заведомо
ных водорослей [20, 22, 25]. В совокупности
выше, чем для С!фикоцианина мезофилов
белки, приобретенные с помощью ГПГ, необхо!
[30, 31]. Показано, что у G. phlegrea переход от
димы для выработки устойчивости к температу!
автотрофного к гетеротрофному типу питания
ре, тяжелым металлам, ацидофилии и для усво!
ведет к увеличению термостабильности клеток
ения разнообразной органики. ГПГ!гены могут
[32]. В автотрофных клетках содержание С!фи!
приобретаться не только de novo из!за их отсут!
коцианина снижается при подъеме температуры
ствия у эукариот, но и для замены уже имевших!
выше 30 °С, а гетеротрофные клетки, наоборот,
ся на более успешные в условиях экстремофи!
имеют максимальное количество С!фикоциа!
лии.
нина при 40-50 °С [32].
Пластом и митохондриальный геном у
С понижением температуры до 40 °С при
Cyanidiales, как и у всех фотосинтетиков, харак!
увеличении поверхности растекающихся сер!
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
647
ных источников Cyanidiales могут вытесняться
образной экологией и более низкими темпера!
умеренно термофильными и мезофильными,
турами, например, в случае обитания в сфагно!
например, зелеными, микроводорослями [33].
вых болотах. Цианобактерии, имеющие сход!
При температуре 25-28 °С у G. sulphuraria и
ный с Cyanidiales фотосинтетический аппарат,
C. merolae падает активность фотосинтеза, рас!
не способны выживать при pH ниже 4. Разли!
ходуются запасы крахмала и изменяется
чие, вероятно, связано с появлением предковых
экспрессия ядерных генов [34, 35]. Таким обра!
цианобактерий в ходе эволюции в щелочных во!
зом, обычный для мезофилов температурный
доемах. С другой стороны, среди Cyanidiales нет
режим вызывает у термофилов холодовой
алкалофильных видов, обычных среди циано!
стресс. Сведения о проявлениях термофилии у
бактерий.
клеток Cyanidiales остаются во многом феноме!
Функционирование макромолекул, особен!
нологическими.
но белков, подразумевает нейтральные величи!
ны pH внутри клетки. При кислых pH фермен!
ты теряют активность, а хлорофилл в тилакои!
АЦИДОФИЛИЯ
дах превращается в феофитин. Внутриклеточ!
ный pH у Cyanidiales, как и у других ацидофи!
Высокая кислотность водных источников в
лов, равен 6,6-6,7 [36]. При pH среды обитания
зонах вулканической активности вызвана геохи!
1-4 это означает, что концентрация протонов
мическим образованием серной кислоты при
внутри и снаружи клетки разнится в 103-106
атмосферном окислении выделяемого из каль!
раз; таким образом, способность клеток к аци!
дер гидротермального сероводорода, а также де!
дофилии связана с поддержанием градиента
ятельностью серобактерий. Уровень кислотнос!
протонов на плазмалемме [37]. Роль клеточной
ти в 0,1-1,0 ед. pH является границей для суще!
стенки как протонного барьера из!за наличия в
ствующей земной жизни [33]. Ацидофилы, жи!
ней водных пор вторична в качестве протонно!
вущие при pH 1,0, хорошо известны и представ!
го барьера по отношению к плазмалемме, т.к.
лены хемолитотрофными и органотрофными
клетки С. merolae и подвижных ацидофилов у
археями и бактериями, но в местах своего оби!
ряда других групп водорослей вообще не имеют
тания Cyanidiales являются доминирующими
стенки.
видами при pH ≥ 2,5. У эукариот ацидофилы,
Имеющийся градиент концентрации создает
наряду с Cyanidiales, встречаются среди одно!
постоянную диффузию протонов внутрь клетки,
клеточных грибов, а также у эвгленовых, диато!
несмотря на то что число белковых каналов
мовых, золотистых и зеленых нитчатых водо!
плазмалеммы, которые позволяли бы протонам
рослей (рис. 3, б). От Cyanidiales другие микро!
проникать внутрь, минимизируется [25]. Нейт!
водоросли!ацидофилы отличаются более разно!
ральность pH в клетках Cyanidiales обеспечива!
Рис. 3. Верхние пределы температуры (а) и нижние пределы кислотности (б), при которых возможен рост микроорганиз!
мов и нитчатых водорослей ([29, 33] и ссылки в них)
БИОХИМИЯ том 87 вып. 5 2022
648
СТАДНИЧУК, ТРОПИН
ется активным обратным транспортом Н+ во
ция ртути происходит благодаря биосинтезу ди!
внешнюю среду протонной мембранной пом!
сульфидов. Клетки Galdieria, образуя β!HgS, мо!
пой, что сопровождается удалением анионов с
гут связать до 1000 ppb ртути, что в 20 раз превы!
помощью ATPазы Р!типа, работа которой регу!
шает уровень растворенного металла в вулкани!
лируется на уровне транскрипции
[37].
ческих источниках. Hg!редуктаза, ген которой
Действие помпы дополняется связыванием про!
был получен от протеобактерий, переводит ионы
никающих протонов в буферной системе клетки
Hg2+ в менее токсичную металлическую ртуть.
и обменом протонов цитоплазмы на К+ и Na+
Образование нерастворимых сульфидов отмече!
клеточной вакуоли [37, 38]. Буферная емкость
но также для Cd в клетках C. merolae [42, 43] при
протоплазмы и изоляция внутри вакуоли играют
извлечении серы из цистеина под действием де!
меньшую роль в сравнении с обратным мемб!
сульфогидразы. Мышьяк в клетках C. merolae пе!
ранным транспортом. Согласно расчетам, на ра!
реводится в малотоксичную биометильную фор!
боту протонной ATPазы из!за активной диффу!
му благодаря метилтрансферазам (ArsM). Кроме
зии протонов внутрь клетки расходуется до 50%
того, найдены два гена управляемой мембран!
всей клеточной ATP [37]. При этом положитель!
ной мышьяковой помпы ArsB, ведущие проис!
ный потенциал +10 мВ на плазмалемме, созда!
хождение от термоацидофильных бактерий [26].
ваемый выкачиваемыми протонами, служит
Cyanidiales способны расти в присутствии
препятствием для проникания внутрь катионов
200 мМ алюминия [44]. Анализ генома G. sulphu=
металлов [39].
raria показал [25], что в плазмалемме должны на!
ходиться ионные каналы, обеспечивающие се!
лективный транспорт необходимых клетке кати!
УСТОЙЧИВОСТЬ К ТЯЖЕЛЫМ МЕТАЛЛАМ
онов (рис. 4), благодаря чему Cyanidiales в своих
местах обитания участвуют в биогеохимических
Условия в районах вулканической активнос!
циклах металлов.
ти гибельны для большинства организмов. Низ!
кие значения pH геотермальных вод способ!
ствуют растворению горных пород и переводу
УСВОЕНИЕ НЕОРГАНИЧЕСКОГО
металлов из минеральной кристаллической и
УГЛЕРОДА
гидратированной формы в ионную, наиболее
токсичную. As, Cd, Cr, Hg, Pb как элементы, не
Фиксация молекул углекислого газа у
участвующие в метаболизме, инактивируют
Cyanidiales, как у большинства фотосинтетиков,
белки, соединяясь с сульфгидрильными группа!
происходит по С3!пути с помощью рибулозо!
ми аминокислотных остатков, а также способ!
бисфосфаткарбоксилазы (РБФК)
[45]. При
ствуют перекисному окислению липидов и об!
pH 1-4 буферное равновесие СО2 ↔ НСО− ↔
разованию активных форм кислорода (АФК),
↔ СО2- в серных источниках полностью смеще!
участвующих в цикле Габера-Вейса, реакции
но в сторону СО2, но из!за повышенной темпе!
Фентона, окислении пула глутатиона и др. В от!
ратуры растворимость углекислоты является
вет в клетке активируется система антиоксидант!
очень низкой. Тем не менее выраженное срод!
ной защиты, в результате чего ионы металлов
ство к липидам ускоряет диффузию растворен!
связываются с хелатирующими агентами (фито!
ного СО2 сквозь клеточную мембрану. Вероят!
хелатины, металлотионеины) и изолируются в
но, поэтому акваглицеропорины плазмалеммы
вакуолях или удаляются наружу в виде металло!
и резус!протеин Rh1 пластидных мембран, ко!
органических производных цитратов, малатов и
торые облегчают проникание СО2 сквозь липид!
полифосфатов [40].
ный барьер у растений, у C. merolae не обнаруже!
Cu, Fe, Mn необходимы при фотосинтезе;
ны [46].
гемовое и негемовое железо входит в состав
Уровень СО2 в воздухе составляет 0,04%, что
многих белков; соединения Zn, Mo, Co и Ni в
у многих фотосинтетиков оказывается недоста!
малых количествах также нужны клеткам, но с
точным для карбоксилазной активности РБФК
увеличением концентрации становятся токсич!
как ключевого фермента цикла Кальвина, воз!
ными. Устойчивость к металлам у клеток
никшего в обогащенной углекислым газом ран!
C. caldarium уменьшается в ряду Al > Cu >
ней биосфере. СО2!Концентрирующий меха!
> Cr > Mn > Ni > Zn > Cd [41].
низм (ССМ) с помощью карбоангидразы позво!
-
Избыточное железо в клетках Galdieria депо!
ляет вовлекать в усвоение углерода ионы НСО3
нируется в виде фосфатов, образующих в цито!
благодаря их диссоциации на ОН- с защелачи!
плазме электронноплотные тельца размером
ванием внешней или внутренней среды клетки
100-200 нм; формирование полифосфатов пока!
и на используемый клетками СО2. У цианобак!
зано также для Al (III) и Mn (II) [41]. Инактива!
терий фермент локализован в карбоксисомах, у
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
649
Рис. 4. Общепринятая схема поступления и распределения металлов (Ме+ и их комплексы) в растительной клетке.
1 - Диффузия по градиенту концентрации; 2 - активный внутриклеточный транспорт с помощью переносчиков; 3 - ак!
тивное удаление из клетки; 4 - образование комплексов металлов с органическими и неорганическими субстратами цито!
плазмы; 5 - изоляция внутри вакуоли в виде свободных катионов и металлокомплексов
водорослей - в пиреноидах, хотя их наличие в
появлению токсичных активных форм кислоро!
хлоропластах не является однозначным свиде!
да (АФК). В этих условиях возрастает конкуре!
тельством ССМ, и ряд зеленых, красных и хри!
нтная по отношению к углекислому газу РБФК!
зофитовых водорослей могут обходиться только
фиксация О2, что нейтрализует избыточный
усвоением СО2 [47]. У С. caldarium признаков
кислород, но приводит затем к появлению
ССМ не обнаружено; у C. merolae ингибиторы
3!фосфоглицеринового альдегида (3!ФГА) и
карбоангидразы не влияют на выделение О2,
2!фосфогликолата (2ФГ), ингибирующего ряд
указывая, наряду с беспиреноидными хлоро!
клеточных ферментов. Поэтому 2ФГ утилизиру!
пластами, на требующее ряда дополнительных
ется в реакциях фотодыхания, называемых так!
доказательств отсутствие ССМ [48], которое со!
же гликолатным циклом [50]. Цепь реакций
ответствует гидрохимически обусловленному
последовательно осуществляется в трех орга!
отсутствию ионов НСО3- в кислой среде [48].
неллах: митохондриях, пероксисомах и хлороп!
Для улучшения фиксации СО2 Cyanidiales ис!
ластах. Согласно BLAST!анализу (генома),
пользуют форму РБФК, обладающую макси!
клетки C. merolae содержат ген каталазы и гены
мальной карбоксилазной активностью. Из че!
всех остальных белков, участвующих в фотоды!
тырех известных форм, IA, IB, IC, и ID, у
хании у высших растений, указывая, что у
Cyanidiales, как и у всех красных водорослей,
C. merolae возможно фотодыхание [51]. Об этом,
присутствует форма ID, отличающаяся самым
в частности, говорит и зависимость выделения
большим сродством к СО2 [47]. Содержание уг!
О2 у C. merolae от изменений углекислотного
лекислого газа в горячих источниках составляет
компенсационного пункта [48].
10 мкМ, а РБФК из C. caldarium и G. sulphuraria
фиксирует СО2, начиная с концентрации
6-7 мкМ, которая является наименьшей извест!
ГЕТЕРОТРОФИЯ И МИКСОТРОФИЯ
ной для эукариот [49].
В активном центре РБФК возможно связы!
Виды рода Galdieria обладают способностью
вание как СО2, так и О2. Повышение освещен!
к темновой гетеротрофии. Выявлено 27 усвояе!
ности приводит к дополнительному фотосинте!
мых углеводов и полиолов, и с учетом амино!
тическому образованию О2 и, соответственно, к
кислот и интермедиатов цикла Кребса - до
5 БИОХИМИЯ том 87 вып. 5 2022
650
СТАДНИЧУК, ТРОПИН
50 органических веществ, которые могут ис!
козы и др. гексоз; 2) группа пентоз и 3) группа
пользоваться Galdieria для построения собствен!
полиолов [27]. G. sulphuraria может расти, ис!
ных органических соединений и как источник
пользуя лишь чистый глицерин.
энергии [6, 7, 52]. При переходе от авто! к гете!
Превращение усвояемых полиолов в углево!
ротрофии размеры клеток Galdieria увеличива!
ды происходит с помощью дегидрогеназ. «Все!
ются [52, 53], утончается клеточная стенка, об!
ядностью» G. sulphuraria обязана наличию раз!
легчая поступление органики, возрастает число
нообразных ферментов. У G. sulphuraria обнару!
митохондрий, крупный хлоропласт разбивается
жены гены галактокиназы, глицерокиназы,
на несколько мелких пропластид, теряются хло!
глюкокиназы, ксилокиназы, рибокиназы,
рофилл и фикобилины, утрачиваются многие
фруктокиназы и др. [57]. Манноза в форме ман!
ферменты фотосинтеза, в клетке увеличивается
ноза!6!фосфата токсична для высших растений,
содержание гликогена, стеариновой и малеино!
а у G. sulphuraria под действием глюкокиназы и
вой кислот, мононенасыщенных жирных кислот
изомеразы превращается в фруктозо!6!фосфат,
и эргостерола [54].
что устраняет клеточный токсикоз [58]. Анало!
Возможности культурального роста гетеро!
гичным образом метаболизируется токсичная
трофных клеток G. sulphuraria составляют
галактоза. Пути использования углеводов и дру!
50-100 г/л в виде сухой биомассы, что сопоста!
гие основные метаболические процессы в клет!
вимо с высокопродуктивными одноклеточными
ках Galdieria подробно рассмотрены в [57]. Веро!
грибами, гетеротрофными бактериями и еди!
ятным источником усвояемой органики служат
ничными видами микроводорослей других так!
отмирающие собственные клетки и находящие!
сонов [55]. Лаг!фаза после добавления органики
ся в той же среде обитания нефотосинтезирую!
в ростовую среду может занимать от 1 до 45 су!
щие бактерии.
ток [6, 52]. Наиболее быстро усваиваются глю!
C. merolae обладает значительно меньшим
коза и другие гексозы (рис. 5).
числом белков для транспорта аминокислот и
В геноме G. sulphuraria выявлено 28 потенци!
углеводов по сравнению с G. sulphuraria [59, 60].
альных мембранных переносчиков различных
При содержании глицерина во внешней среде,
углеводов [27, 56]. Доля мембранных транспор!
равном 200 мкМ, преодолевается концентраци!
теров в протеоме составляет 5,2%, что значи!
онный клеточный барьер, делая возможным ге!
тельно больше, чем у фотоавтотрофных микро!
теротрофный рост, хотя и более медленный, чем
водорослей [25]. Все переносчики карбогидра!
при автотрофии. Гетеротрофия не возникает, од!
тов разбиваются на три группы: 1) группа глю!
нако, при добавке в среду глюкозы, янтарной
Рис. 5. Влияние добавления 1%!ной глюкозы на рост культуры и размеры клеток G. partita. а - Ростовые кривые клеток
при фотоавтотрофном (1), хемогетеротрофном (2) и фотогетеротрофном (3) росте. Присутствие глюкозы в ростовой среде
(2 и 3) приводит к многократному увеличению числа клеток; б - рефрактограмма размеров клеток G. partita, выращенных
в течение семи дней в фотоавтотрофных (1), хемогетеротрофных (2) и фотогетеротрофных (3) условиях [53]. Небольшое
увеличение доли гетеротрофных клеток размером 3 мкм объясняется повышенным образованием микроспор, меньших
по размеру, чем вегетативные клетки
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
651
или молочной кислот [60]. С экофизиологичес!
raria содержит ген, кодирующий гликогенсин!
кой точки, зрения C. merolae остается фотоав!
тазу с дополнительным активным центром по!
тотрофом, но встраивание одного из генов - пе!
явления разветвлений, что приводит к больше!
реносчиков глюкозы из G. sulphuraria в геном
му числу боковых α!1,6 ковалентных связей.
C. merolae позволило и в этом случае осущест!
К настоящему времени не известен ни один ор!
вить гетеротрофный рост [56].
ганизм среди про! или эукариот с подобными
Виды рода Galdieria наряду с темновой гете!
свойствами. Представители Galdieria синтезиру!
ротрофией способны к миксотрофному (фото!
ют наиболее разветвленный из полиглюканов,
гетеротрофному) росту, который в разных био!
который по частоте образования боковых цепей
химических вариантах метаболизма является ус!
превосходит амилопектин высших растений,
пешной эволюционной стратегией, увеличива!
гликоген дрожжей, фитогликоген цианобакте!
ющей физиологическую активность ряда фото!
рий и крахмалы мезофильных красных водорос!
синтетиков [61]. Взаимоотношение дыхательно!
лей [68]. Средняя длина неразветвленных участ!
го и фотосинтетического процессов еще остав!
ков полиглюкана у G. maxima составляет 6-7 ос!
ляет много неясных вопросов, которые подразу!
татков глюкозы [62], у G. sulphuraria их число
мевают исследование миксотрофов, подобных
равняется 9-10 [68]. Высокоразветвленные по!
Galdieria.
лисахариды быстрее других полиглюканов ути!
За C. caldarium сохраняется характеристика
лизируются как углеводный резерв.
строгого фотоавтотрофа.
Кроме багрянкового крахмала, красные во!
доросли синтезируют низкомолекулярные саха!
риды: флоридозид и, в меньшем количестве,
ЗАПАСНЫЕ ПОЛИСАХАРИДЫ
изофлоридозид [69]. У Cyanidiales, если горячий
источник является гипергалинным, эти соеди!
Багрянковый, или флоридный, крахмал
нения, наряду с быстрорастворимым крахма!
Cyanidiales, как и у всех красных водорослей,
лом, выполняют роль осмопротекторов (в экс!
накапливается в цитозоле, в отличие от биосин!
перименте до 1,2 M NaCl) [69]. Аналогичным
теза крахмала в хлоропластах у зеленых водорос!
образом эти два сахарида, вероятно, могут за!
лей и высших растений. Содержание запасных
щищать от пересыхания эндолитные виды
углеводов в клетках Cyanidiales невелико, их
Galdieria [69].
значительные количества синтезируются лишь
при концентрации СО2 в среде не ниже 1%, и у
представителей Galdieria - при переходе к гете!
КЛЕТОЧНАЯ СТЕНКА
ротрофии. У гетеротрофно растущей G. maxima
количество глюкана может возрастать с 5 до 80%
Клеточная стенка служит водорослям и на!
сухого веса клетки [62]. В миксотрофных усло!
земным растениям защитой от проникания ин!
виях накопление полисахаридов за счет суммар!
фекционных агентов и агрессивных веществ,
ного поступления СО2 и органики идет более
от поедания гетеротрофами, а также является
интенсивно, чем при темновой гетеротрофии
опорной структурой [70, 71]. В термоацидо!
[62, 63]. В условиях гетеротрофии углеводы сре!
фильной среде обитания опасность поедания
ди запасных веществ составляют до 65%, бел!
или инфекционного заражения для Cyanidiales
ки - 25%, а липиды - лишь 10% [64]. У C. merolae,
минимальна, но клеточный каркас и защита
как и у других фотоавтотрофов, содержание за!
от химических воздействий необходимы.
пасных углеводов увеличивается при деграда!
У C. caldarium и G. sulphuraria стенки прочны
ции белков, вызванной дефицитом азота
настолько, что затрудняют механическое разру!
[65, 66].
шение. Клетки C. merolae при малых размерах
Ферменты синтеза глюканов у красных и зе!
(2 мкм) обходятся без клеточной стенки, демон!
леных водорослей имеют общее происхожде!
стрируя некоторую способность к фототакси!
ние, что указывает на появление крахмала до
су [72].
эволюционного разделения этих двух ветвей ар!
С учетом внутреннего или наружного поло!
хепластид [67]. Сборку полисахаридных цепей у
жения относительно плазмалеммы и других осо!
глюканов ведут два фермента. Гликогенсинтаза
бенностей различают пять (типы I-V) базовых
увеличивает длину молекул глюкана за счет
типов клеточной стенки [71]. Красные водорос!
α!1,4!гликозидных связей между молекулами
ли, включая Cyanidiales, вместе с высшими рас!
D!глюкозы, и одновременно ветвящий фермент
тениями и зелеными водорослями относятся к
создает боковые ответвления с помощью
типу III с внутренним расположением клеточ!
α!1,6!связей. Для фотосинтетиков характерны
ной мембраны [70]. Сходство целлюлозных и
по!разному разветвленные глюканы. G. sulphu=
других полимерных волокон у разных по срокам
БИОХИМИЯ том 87 вып. 5 2022
5*
652
СТАДНИЧУК, ТРОПИН
происхождения групп водорослей является
ющей две двойные связи и входящей в состав
следствием очень раннего параллельного пере!
фосфатидилхолина, полностью осуществляется
носа генов их биосинтеза от бактерий к эукарио!
в цитоплазме. Обычные для других эукариот по!
там [73]. У красных водорослей мономерами
лиеновые жирные кислоты с тремя двойными
фибриллярных цепей полисахаридов служат
связями, за исключением линоленовой, у
(1!3)(1!4)!β!D!глюканы; скреплять волокна
Cyanidiales отсутствуют. Десатурация жирных
стенки могут агар, каррагинан и лигнин [71].
кислот в составе липидов ведет к увеличению
Клеточная стенка C. caldarium, имея толщину
текучести мембран, необходимой при низких и
50 нм, содержит 12-14% гемицеллюлозы, 3-4%
средних температурах, в чем не нуждаются орга!
целлюлозы и 2% липидов; 55% массы стенки
низмы!термофилы. По!видимому, по этой при!
составляют кислотоустойчивые белки [74]. Пути
чине, как следует из геномного анализа, C. merolae
биосинтеза компонентов стенки у красных во!
не содержит десатураз цианобактериального
дорослей остаются неясными, но в геноме
(пластидного) происхождения, которые катали!
G. sulphuraria идентифицированы гены фукозил!,
зируют образование двойных связей в жирных
галактозил!, маннозил! и гликозилтрансфераз
кислотах растений [78]. При образовании моно!
[75]. Средствами защиты клеточной стенки и
галактозилдиацилглицерола используется соче!
клетки в целом от АФК служат пероксидазы.
танный биосинтез с использованием пальмити!
Из десяти генов пероксидаз, найденных у
новой кислоты, поступающей из хлоропласта, и
G. sulphuraria, три кодируют пероксидазы клас!
линолевой кислоты, синтезируемой в ЭПР [78].
са III, которые участвуют в формировании лиг!
Тонкая биохимическая регулировка состава
нина, сшивающего микрофибриллы гемицел!
мембранных липидов достигается образованием
люлоз [75]. Предполагается, что способность
изомеров имеющихся в них жирных кислот в за!
Galdieria выживать месяцами в полной темноте
висимости от изменений pH среды [79]. При
при отсутствии органики связана с лигнизацией
кислых значениях pH в серных источниках фос!
и закупоркой на этот период стеночных пор для
фаты очень плохо растворимы, отчего фосфор!
разобщения с внешней средой [75].
ное голодание привело у Cyanidiales к замене
При переходе от автотрофии к гетеротроф!
фосфолипидов на бетаинлипиды. Десятки вы!
ному питанию клеточная стенка G. sulphuraria,
явленных у G. sulphuraria разновидностей бета!
как упоминалось, заметно истончается [54]. От!
инлипидов разделяются на 14 классов [79]. Дан!
сутствие стенки у C. merolae, непроницаемость
ные сравнительной геномики в сопоставлении
стенки у C. caldarium для органических веществ
со схемами метаболических путей показывают,
и изменение толщины стенки у G. sulphuraria
что в геноме C. merolae активность 121 гена свя!
служат указанием на лабильность и эволюцион!
зана с участием в биосинтезе жирных кислот и
ные изменения этой структуры у эукариот.
липидов [58, 78].
При переходе от автотрофного к гетеротроф!
ному росту у G. sulphuraria содержание липидов в
ЛИПИДНЫЙ СОСТАВ МЕМБРАН
пересчете на сухой вес клеток меняется незна!
чительно, т.к. основным запасаемым полиме!
К основным мембранным липидам C. merolae
ром служит багрянковый крахмал, а не масла
и G. sulphuraria относятся моно! и дигалактози!
[64]. Имеются данные о наличии у G. sulphuraria
лглицеролы, сульфолипиды, фосфатидилглице!
генов синтеза липида А, который является со!
рол, фосфатидилхолин, фосфатидилэтанола!
ставной частью липополисахаридов у грамотри!
мин, фосфатидилинозитол, хотя разнообразие
цательных бактерий, где они обеспечивают
жирных кислот в липидах невелико: их пред!
структурную целостность и защиту клеточной
ставляют пальмитиновая, олеиновая, линолено!
мембраны от агрессивных воздействий окружа!
вая и линолевая. Липиды Cyanidiales, согласно
ющей среды [58], что полностью соответствует
биохимическому анализу, сходны с липидами
условиям существования Cyanidiales.
растений и других групп водорослей [76, 77].
Ацилированные липиды пластидных мемб!
ран у растений и водорослей содержат полиено!
ПИГМЕНТНЫЙ АППАРАТ ФОТОСИНТЕЗА
вые жирные кислоты, в биосинтезе которых ис!
пользуются прокариотный и эукариотный пути,
Монофилетическое происхождение хлоро!
локализованные соответственно в хлоропластах
пластов от цианобактерий позволяет сопостав!
и эндоплазматическом ретикулуме (ЭПР). Кис!
лять результаты, полученные при исследовании
лоты 16 : 0 и 18 : 0 синтезируются в пластидах, а
фотосинтеза у представителей разных расти!
их элонгация и десатурация происходят в ци!
тельных таксонов. Пигментный аппарат окси!
топлазме. Биосинтез линолевой кислоты, име!
генного фотосинтеза универсален и состоит из
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
653
макрокомплексов фотосистем 1 и 2 (ФС 1 и
леных водорослей и растений. Содержание
ФС 2), которые отличаются консерватив!
ФС 1 у красных водорослей, как и у цианобакте!
ностью, и дополняющей светосбор вариабель!
рий, в несколько раз превышает содержание
ной светособирающей антенны. Фикобилисом!
ФС 2, отличаясь от соотношения 1 : 1 у расте!
ная антенна цианобактерий сохранилась у всех
ний, что, очевидно, связано с разными долями
красных и глаукофитовых водорослей, в то вре!
линейного и циклического электронного транс!
мя как в зеленой линии архепластид она смени!
порта. Донором электрона для ФС
1 у
лась хлорофилл a/b!содержащей антенной, а у
Cyanidiales и, вероятно, у других красных водо!
хромофит была заменена на хлорофилл а/с!со!
рослей, служит цитохром с6, в то время как у
держащие протеины [80].
растений донором является пластоцианин, а у
Коровые комплексы цианобактериальной
цианобактерий имеются оба донора [82, 83].
ФС 2 состоят из 3 гидрофильных и 17 трансмем!
В фикобилисомах макрофитных красных во!
бранных полипептидов, образуя в тилакоид!
дорослей присутствует красный пигмент фико!
ной мембране димеры общей массой 700 кДа.
эритрин (B! или R!), цвет которого определяет
Выявленные различия ФС 2 в хлоропластах раз!
окраску клеток. У Cyanidiales, рано обособив!
ных таксонов касаются водоокисляющего
шихся от остальных багрянок, фикоэритрина
Mn4CaO5!содержащего кластера. У цианобакте!
нет, а С!фикоцианин и аллофикоцианин, нахо!
рий кластер состоит из трех белковых субъеди!
дящиеся в полудисковидных фикобилисомах
ниц, PsbO, PsbU и PsbV. Для C. caldarium в 2016 г.
[84], в сочетании с хлорофиллом придают клет!
был получен первый среди эукариотных фото!
кам сине!зеленую окраску, подобную окраске
синтетиков кристаллический препарат ФС 2
цианобактерий. Как у всех оксигенных фото!
[81]. Как оказалось, к трем перечисленным по!
синтетиков, у Cyanidiales имеется молекуляр!
липептидам для стабилизации формы кластера
ный механизм светового баланса двух фотосис!
добавляется полипептид PsbQ′, имеющий участ!
тем, называемый обратимым переходом из Со!
ки гомологии с подобным ему полипептидом
стояния 1 в Состояние 2 [85], но отсутствует ци!
PsbQ зеленых водорослей и растений [81].
анобактериальный механизм нефотохимичес!
Коровый комплекс ФС 1 у цианобактерий
кого тушения фикобилисом за счет светозащит!
содержит 12 полипептидов и образует в тилако!
ного оранжевого каротиноид!протеина [86].
идной мембране мономеры и тримеры; у расте!
ний число полипептидов ФС 1 возрастает до 15,
и комплекс находится в тилакоидах только в ви!
СИГНАЛЬНЫЕ И РЕГУЛЯТОРНЫЕ
де мономеров массой 600 кДа. Кристаллические
МЕХАНИЗМЫ
структуры комплексов ФС 1, полученных из
C. merolae, из цианобактерии Synechocystis sp.
Регуляторами и сенсорами биохимических и
PCC 6803 и из растений (Pisum sativum), характе!
физиологических процессов у растений служат
ризуются совпадением в размещении молекул
фитогормоны, фоторецепторные белки, глюко!
антенного хлорофилла в апопротеинах [82].
зо!гексокиназная система, активные формы
У C. merolae сохранилась имеющаяся у циано!
кислорода, ионы Са2+, различные липиды и
бактерий PsaM субъединица комплекса ФС 1,
жирные кислоты, сахароза, мелатонин, метил!
утраченная растениями [83]. Поэтому не исклю!
глиоксаль, олигопептиды и другие соединения.
чено, что полипептид PsaM участвует в контакте
Например, трипептид глютатион, как показано
ФС 1 с фикобилисомной антенной. У C. merolae,
для C. merolae [87], является сенсором измене!
как и у растений, в составе ФС 1 появляется
ний редокс!состояния клеток. Глюкоза, остава!
PsaO!полипептид, но отсутствуют приобретен!
ясь основой энергетического обмена, выполня!
ные растениями PsaG и PsaH полипептиды.
ет у Galdieria регуляторные функции, связанные
PsaL!полипептид у C. merolae утратил α!спи!
с координацией фотосинтеза и дыхательных
ральный сегмент, необходимый для тримериза!
процессов [88]. В частности, глюкоза ингибиру!
ции ФС 1 у цианобактерий [83], что коррелиру!
ет биосинтез фотосинтетических пигментов
ет с отсутствием тримеров ФС 1 у красных водо!
(рис. 6).
рослей и появлением у них антенных Lhcr!по!
Важнейшими являются механизмы световой
липептидов, содержащих по 13-15 хлорофилль!
и гормональной регуляции клеток, наиболее
ных молекул. Lhcr!полипептиды, от трех у
полно исследованные у цветковых растений.
C. merolae до 5-9 - y G. sulphuraria, полупоясом
К белкам!фоторецепторам относятся крипто!
охватывают в плоскости мембраны мономер
хром/фотолиазы, фитохромы, фототропины,
ФС 1, увеличивая его светопоглощение [82]. Та!
белки семейства ZEITLUPE и рецептор УФ!В
кое строение аналогично присутствию LHC!ан!
света [89]. В частности, у Arabidopsis thaliana из!
тенны, примыкающей к мономерам ФС 1 у зе!
вестно 14 фоторецепторов: пять фитохромов,
БИОХИМИЯ том 87 вып. 5 2022
654
СТАДНИЧУК, ТРОПИН
три криптохрома, два фототропина, три белка
ZEITLUPE и один УФ!В рецептор UVR8. Фото!
рецепцию водорослей исследуют, прежде всего
используя сравнение их геномных данных с дан!
ными для A. thaliana. В геноме C. merolae не най!
дено иных фоторецепторных генов, кроме пяти
генов криптохром/фотолиазной системы
[90, 91], что делает клетки C. merolae прекрас!
ным объектом изучения криптохромной рецеп!
ции. Как показывает транскриптомный анализ,
синий и красный свет влияют на активность
35% генома у данного вида. Синий свет регули!
рует транскрипцию генов белкового синтеза,
красный - генов управления фотосинтезом и
генов репарации ДНК. Совместно под контро!
лем синего и красного участков спектра нахо!
дятся реакции углеродного метаболизма и био!
синтеза фотосинтетических пигментов. По!
скольку криптохромы поглощают лишь синий
свет, для объяснения эффекта в красном свето!
вом диапазоне предложена небесспорная в этом
случае гипотеза ретроградного сигналинга меж!
ду хлоропластом, функционирующим при крас!
ном свете, и ядром клетки [91, 92]. Синхрониза!
ция деления клеток C. merolae чередованием бе!
лого света и темноты [93] также подразумевает
наличие клеточных сигналов от образующихся
продуктов фотосинтеза.
У цветковых растений, для которых гормо!
нальная регуляция исследована наиболее полно,
известно шесть групп фитогормонов: абсцизовая
кислота (АБК), ауксины, брассиностероиды,
гиббереллины, цитокинины и этилен. Список
может быть расширен за счет соединений, про!
Рис. 6. Ингибирование биосинтеза пигментов фотосинте!
являющих сходную с гормонами активность, та!
за, хлорофилла и фикоцианобилина при гетеротрофном
росте G. partita. Добавление 1%!ной глюкозы в ростовую
ких как жасмоновая и салициловая кислоты,
среду приводит к подавлению образования протопорфи!
олигопептиды глютатион и мелатонин и др. [94].
риногена IX с удалением кислоторастворимого предшест!
Многообразная система гормонов, как и обилие
венника, копропорфириногена III, в ростовую среду [88]
фоторецепторов, по!видимому, не нужны в столь
полном объеме микроводорослям как однокле!
точным организмам. В геноме C. merolae иденти!
ти от светового режима, модификаций генома и
фицированы лишь гены синтеза АБК с рецеп!
химического состава культивационной среды в
торным протеином RCAR/PYR. Такие гормоны,
более широких пределах, чем возможно для
как АБК являются универсальными, появляясь в
высших растений. Использование микроводо!
эволюции уже у цианобактерий. Содержание
рослей регламентируется доходностью производ!
АБК в клетках C. merolae уступает цветковым рас!
ства, стоимостью фотобиореакторов, переходом
тениям и возрастает в ответ на солевой стресс.
от лабораторных разработок к промышленному
АБК у C. merolae замедляет репликацию ДНК и
внедрению патентов и возможностями открыто!
увеличивает время клеточного цикла, подобно
го культивирования. Биотехнологическими
тому, как это наблюдается у A. thaliana [95].
направлениями использования Cyanidiales явля!
ются: 1) получение ценных водорослевых мета!
болитов; 2) генноинженерные модификации
ИСПОЛЬЗОВАНИЕ В БИОТЕХНОЛОГИИ
клеток; 3) биоремедиация; 4) извлечение редко!
земельных элементов из промышленных отхо!
У микроводорослей метаболические пути,
дов; 5) наработка биодизельного топлива.
скорость нарастания биомассы и выработка
К возможным перспективным метаболитам
клеточных продуктов изменяются в зависимос!
Galdieria относится С!фикоцианин, синий пиг!
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
655
мент фикобилисом, который получают из циа!
CmGPAT1 и CmGPAT2, при которой в клетках
нобактерии Arthrospira platensis для нужд фарма!
мутанта C. merolae 10D аккумулируется в 50 раз
цевтики, косметологии и в качестве пищевого
большее количество триацилглицеридов, чем в
красителя [96]. Меньшее в сравнении с циано!
диком штамме [100].
бактериями содержание С!фикоцианина в гете!
ротрофной культуре G. sulphuraria 074G может
компенсироваться более высокой суточной про!
ЗАКЛЮЧЕНИЕ
дуктивностью биомассы и большей термоустой!
чивостью. Немаловажным является также ис!
Экстремофилией называется обитание в ус!
пользование дешевых ферментеров вместо до!
ловиях внешней среды, угнетающих жизнедея!
рогих фотобиореакторов. Разнообразие видов
тельность большинства земных организмов и
Galdieria и модификации штаммов предполага!
приводящих к стрессовым состояниям вплоть до
ют создание дополнительной конкуренции про!
гибели. Cyanidiales подвергаются различным
дукту A. platensis [97].
экстремальным физико!химическим воздей!
C. merolae как вид с полностью расшифро!
ствиям, к которым относятся высокая темпера!
ванным геномом относится к лучшим возмож!
тура и выраженная кислотность среды, биоцид!
ным объектам «зеленой» биотехнологии. Мини!
ное действие растворенных тяжелых металлов и
мальный гаплоидный ядерный геном, почти
необходимость длительного выживания фото!
полная утрата интронов, отсутствие клеточной
синтезирующих клеток в отсутствие освещения
стенки, облегчающее выделение ДНК и РНК, и
(гетеротрофия у Galdieria). Экстремофилия до!
знание, наряду с ядерным, хлоропластного и
статочно широко распространена у прокариот,
митохондриального геномов делают C. merolae
как у архей, так и у бактерий, но у эукариот
заманчивым генноинженерным объектом.
встречается относительно редко. Она известна у
Перспективной для наработки определенных
немногих видов из различных эукариотных си!
ферментов является возможность пластомной
стематических групп, но, как правило, ограни!
трансформации C. merolae [98]. Ведутся успеш!
чивается приспособлением к какому!либо одно!
ные работы по включению в ДНК C. merolae ге!
му ограничивающему фактору. Особенностью
нов транспортных белков из G. sulphuraria, что,
Cyanidiales является полиэкстремофилия. В ус!
по имеющимся оценкам [99], позволит создава!
ловиях одновременного воздействия нескольких
емым штаммам C. merolae усваивать и нарабаты!
отрицательных абиотических факторов, сово!
вать десятки органических соединений, созда!
купность которых является гибельной для подав!
вая потенциал для их дальнейшего использова!
ляющего числа эукариотных (микро)организ!
ния [99].
мов, в случае Cyanidiales создалась возможность
Биоремедиация при повышенных темпера!
использования биотопов, где произошло высво!
турах бытовых и промышленных сточных вод,
бождение из!под пресса иной биоты. Для этих
содержащих токсичную органику, служит одним
микроводорослей отсутствует прямая конкурен!
из направлений работ с Cyanidiales, где эти мик!
ция с другими микро! и макрофотосинтетиками,
роорганизмы используются для извлечения азо!
они избавлены от опасности поедания хищника!
та и фосфора. Формирование водорослевых ма!
ми и воздействия инфекционных агентов. Отсут!
тов G. sulphuraria в горячих источниках указыва!
ствие нежелательных биологических воздей!
ет на возможность иммобилизации культуры
ствий превысило отрицательную роль агрессив!
для этих целей в очистных сооружениях [99].
ных физико!химических факторов и стало усло!
Выживание в природе в присутствии раство!
вием успеха в геотермальной среде обитания и
ренных тяжелых металлов и способность роста
затем, для части видов - в мезофильных средах.
Cyanidiales в агрессивной кислой среде подразу!
мевают еще одно технологическое направление:
Финансирование. Работа выполнена в рамках
извлечение сохраняющих высокую ценность
государственного задания Министерства науки
редкоземельных элементов из отвалов горно!
и высшего образования Российской Федерации
рудных пород [99].
(тема № 121040800153!1).
Глицерин, на котором в качестве органичес!
Конфликт интересов. Авторы заявляют об от!
кого субстрата растет Galdieria, является значи!
сутствии конфликта интересов.
тельным продуктом отхода в производстве био!
Соблюдение этических норм. Настоящая
дизельного топлива из других растений. Перс!
статья не содержит описания исследований, вы!
пективной в дальнейшем является сверхэк!
полненных авторами с использованием людей и
спрессия двух глицерол!3!фосфаттрансфераз,
животных в качестве объектов.
БИОХИМИЯ том 87 вып. 5 2022
656
СТАДНИЧУК, ТРОПИН
СПИСОК ЛИТЕРАТУРЫ
1.
Seckbach, J. (2010) Overview of Cyanidian Biology, in Red
DNA contents in the red microalgae Cyanidium caldarium
Algae in the Genomic Age (Seckbach, J., and
and three Galdieria species, Eur. J. Phycol., 36, 227!232.
Chapman, D. J. eds.) Springer, N.Y., pp. 345!356.
20.
Nozaki, H., Takano, H., Misumi, O., Terasawa, K.,
2.
Sentsova, O. Yu. (1991) On the diversity of acido!ther!
Matsuzaki, M., et al. (2007) A 100%!complete sequence
mophilic unicellular algae of the genus Galdieria
reveals unusually simple genomic features in the hot!spring
(Rhodophyta, Cyanidiophyceae), Botanichesky J., 76, 69!
red alga Cyanidioschyzon merolae, BMC Biol., 5, 28,
79.
doi: 10.1186/1741!7007!5!28.
3.
Sentsova, O. Yu. (1994) The Study of Cyanidiophyceae in
21.
Qiu, H., Price, D. C., Yang, E. C., Yoon, H. S., and
Russia. Algae of Genus Galdieria: Diversity, Characteriza!
Bhattacharya, D. (2015) Evidence of ancient genome
tion and Occurrence in Mixed Populations with Cyanidium
reduction in red algae (Rhodophyta), J. Phycol., 51, 624!
caldarium, in Evolutionary Pathways and Enigmatic Algae:
636.
Cyanidium caldarium (Rhodophyta) and Related Cells
22.
Ternes, C. M., and Schönknecht, G. (2014) Gene transfers
(Seckbach, J., ed.) Kluwer, Dordrecht, pp. 167!174.
shaped the evolution of de novo NAD+ biosynthesis in
4.
Стадничук И. Н., Кузнецов В. В. (2021) Эндосимбио!
eukaryotes, Genome Biol. Evol., 6, 2335!2349.
тическое происхождждение хлоропластов в эволюции
23.
Ohnuma, M., Misumi, O., Fujiwara, T., Watanabe, S.,
растительной клетки, Физиол. Раст., 68, 3!19.
Tanaka, K., et al. (2009) Transient gene suppression in a
5.
Bhattacharya, D., Qiu, H., Lee, J. M., Yoon, H. S., Weber,
red alga, Cyanidioschyzon merolae 10D, Protoplasma, 236,
A. P. N., et al. (2018) When less is more: Red algae as mod!
107!112.
els for studying gene loss and genome evolution in eukary!
24.
Поверенная И. В., Ройтберг М. А. (2020) Сплайсосом!
otes, Crit. Rev. Plant Sci., 37, 81!99.
ные интроны: свойства, функции и эволюция, Биохи=
6.
Miyagishima, S., and Tanaka, K. (2021) The unicellular
мия, 85, 851!862.
red alga Cyanidioschyzon merolae - the simplest model of a
25.
Schönknecht, G., Weber, A. P. M., and Lercher, M. J.
photosynthetic eukaryote, Plant Cell Physiol., 62, 926!941.
(2014) Horizontal gene acquisition by eukaryotes as drives
7.
Pinto, G., Ciniglia, C., Cascone, C., and Pollio, A. (2007)
of adaptive evolution, BioEsssays, 36, 9!20.
Species Composition of Cyanidiales Assemblages in
26.
Ye, J., Rensing, C., Rosen, B. P., and Zhu, Y.!G. (2017)
Pisciarelli (Campi Flegrei, Italy) and Description of
Arsenic biomethylation by photosynthetic organisms,
Galdieria phlegrea sp. nov., in Algae and Cyanobacteria in
Trends Plant Sci., 17, 155!161.
Extreme Environments (Seckbach, J., ed.) pp. 488!501.
27.
Barbier, G., Oesterhelt, C., Larson, M. D., Halgren,
8.
Allen, M. A. (1959) Studies with Cyanidium caldarium, an
R. G., Wilkerson, C., et al. (2005) Comparative genomics
anomalously pigmented chlorophyte, Arch. Mikrobiol., 32,
of two closely related unicellular thermo!acidophilic red
270!277.
algae, Galdieria sulphuraria and Cyanidioschyzon merolae,
9.
Merola, A., Castaldo, R., De Luca, P., Gambardella, R.,
reveals the molecular basis of the metabolic flexibility of
Musachio, A., et al. (1981) Revision of Cyanidium caldari=
Galdieria sulphuraria and significant differences in carbo!
um. Three species of acidophilic algae, Giorn. Bot. Ital.,
hydrate metabolism of both algae, Plant Physiol., 137, 460!
115, 189!195.
474.
10.
De Luca, P., Taddei, R., and Varano, L.
(1978)
28.
Jain, K., Krause, K., Grewe, F., Gaven, F., Nelson, G. F.,
‘Cyanidioschyzon merolae’: A new alga of thermal acidic
et al. (2015) Extreme features of the Galdieria sulphuraria
environments, Webbia, 33, 37!44.
organellar genomes: A consequence of polyextremophily?
11.
Barcytė, D., Nedbalová, L., Culka, A., Košek, F., and
Genome Biol. Evol., 7, 367!380.
Jehlička, J. (2018) Burning coal spoil heaps as a new habi!
29.
Takai, K., Nakamura, K., Toki, T., Tsunogai, U.,
tat for the extremophilic red alga Galdieria sulphuraria,
Miyazaki, M., et al. (2008) Cell proliferation at 122 °C and
Fottea (Olomouc), 18, 19!29.
isotopically heavy methane under high!pressure cultiva!
12.
Liu, S.!L., Chiang, Y.!R., Yoon, H. S., and Fu, H.!Y.
tion, Proc. Natl. Acad. Sci. USA, 105, 10949!10954.
(2020)
Comparative genome analysis reveals
30.
Rahman, D. Y., Sarian, F. D., van Wijk, A., Martinez!
Cyanidiococcus gen. nov., a new extremophilic red algal
Garcia, M., van der Maarel, M. J. E. C.
(2016)
genus sister to Cyanidioschyzon (Cyanidioschyzonaceae,
Thermostable phycocyanin from the red microalga
Rhodophyta), J. Phycol., 56, 1428!1442.
Cyanidioschyzon merolae, a new natural blue food colorant,
13.
Sánchez!Baracaldo, P., Raven, J. A., Pisani, D., Knoll,
J. Appl. Phycol., 29, 1233!1239.
A. H. (2017) Early photosynthetic eukaryotes inhabited
31.
Ferraro, G., Imbimbo, P., Marseglia, A., Lucignano, R.,
low!salinity habitats, Proc. Natl. Acad. Sci. USA, 114,
Monti, D. M., et al. (2020) X!ray structure of C!phyco!
e7737.
cyanin from Galdieria phlegrea: Determinants of ther!
14.
Donoghue, P., and Paps, J. (2020) Plant evolution:
mostability and comparison with a C!phycocyanin in the
Assembling land plants, Curr. Biol., 30, R81!R83.
entire phycobilisome, Biochim. Biophys. Acta, 1861,
15.
Yoon, H. S., Müller, K. M., Sheath, R. G., Ott, F. D., and
148236, doi: 10.1016/j.bbabio.2020.148236.
Bhattacharya, D. (2006) Defining the major lineages of red
32.
Carfagna, S., Landi, V., Coraggio, F., Salbitani, G.,
algae (Rhodophyta), J. Phycol., 42, 482!492.
Vona, V., et al. (2018) Different characteristics of C!phyco!
16.
Jong, L. W., Fujiwara, T., Hirooka, S., and Miyagishima,
cyanin (C!PC) in two strains of the extremophilic Galdieria
S. Y. (2021) Cell size for commitment to cell division and
phlegrea, Algal Res., 31, 406!412.
number of successive cell divisions in cyanidialean red
33.
Ferris, M. J., Sheehan, B., Kühl, M., Cooksey, K.,
algae, Protoplasma, doi: 10.1007/s00709!021!01628!y.
Wigglesworth!Cooksey, B., et al. (2005) Algal species and
17.
Guo, L., and Yang, G. (2015) Predicting the reproduction
light microenvironment in a low!pH, geothermal micro!
strategies of several microalgae through their genome
bial mat community, Appl. Environ. Microbiol., 71, 7164!
sequences, J. Ocean Univ. China, 14, 491!502.
7171.
18.
Седова Т. В. (1996) Кариология водорослей, Наука,
34.
Nikolova, D., Weber, D., Scholz, M., Bald, T.,
СПб., 386 c.
Scharsack, J. P., et al. (2017) Temperature induced remod!
19.
Muravenko, O., Selyakh, I., Kononenko, N., and
eling of the photosynthetic machinery tunes photosynthe!
Stadnichuk, I. (2001) Chromosome numbers and nuclear
sis in a thermophyllic alga, Plant Physiol., 174, 35!46.
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
657
35.
Rossoni, A. W., Schönknecht, G., Lee, H. J., and Lupp,
52.
Gross, W., and Schnarrenberger, C. (1995) Heterotrophic
R. L. (2019) Cold acclimation of the thermoacidophilic
growth of two strains of the acido!thermophilic red alga
red alga Galdieria sulphuraria - changes in gene expression
Galdieria sulphuraria, Plant Cell Physiol., 36, 633!648.
and involvement of horizontally acquired genes, Plant Cell
53.
Стадничук И. Н., Семенова Л. Р., Рахимбердиева М. Г.,
Physiol., 60, 702!712.
Тропин И. В., Усов А. И. (2006) Регуляторная роль
36.
Beardal, J., and Entwisle, L. (1984) Internal pH of the
глюкозы и света в гетеротрофном росте термоацидо!
obligate acidophile Cyanidium caldarium Geitler
фильной красной микроводоросли Galdieria. II между!
(Rhodophyta?), Phycologia, 23, 397!399.
народный симпозиум «Сигнальные системы клеток
37.
Bethmann, B., Schönknecht, G. (2009) pH regulation in
растений: роль в адаптации и иммунитете», Казань,
an acidophilic green alga - a quantitative analysis, New
стр. 113!114.
Phytologist, 183, 327!339.
54.
Tischendorf, G., Oesterhelt, C., Hoffmann, S., Girnus, J.,
38.
Raven, J. A., and Beardall, J. (2020) Energizing the plas!
Schnarrenberger, C., et al. (2007) Ultrastructure and
malemma of marine photosynthetic organisms: the role of
enzyme complement of proplastids from heterotrophically
primary active transport, J. Mar. Biol. Ass.UK, 100, 333!
grown cells of the red alga Galdieria sulphuraria, Eur. J.
346.
Phycol., 42, 243!251.
39.
Gimmler H. (2001) Acidophilic and Acidotolerant Algae,
55.
Graverholt, O. S., Eriksen, N. T. (2007) Heterotrophic
in Algal adaptation to Environmental Stresses (Rai, L. C.,
high!cell!density fed!batch and continuous!flow cultures
et al., eds.) Springer!Verlag, Berlin Heidelberg, pp. 259!
of Galdieria sulphuraria and production of phycocyanin,
290.
Appl Microbiol. Biotechnol., 77, 69!75.
40.
Kaplan, D. (2013) Absorption and Adsorption of Heavy
56.
Fujiwara, T., Hirooka, S., Mukai, M., Ohbayashi, R.,
Metals by Microalgae, in Handbook of Microalgal Culture:
Kanesaki, Yu, et al. (2019) Integration of a Galdieria plas!
Applied Phycology and Biotechnology (Richmond, A., and
ma membrane sugar transporter enables heterotrophic
Hu, Q., eds.) Blackwell Publishing Ltd, Second Edn.,
growth of the obligate photoautotrophic red alga
pp. 602!611.
Cynanidioschyzon merolae, Plant Direct,
3, e00134,
41.
Nagasaka, S., Nishizawa, N. K., Watanabe, T., Mori, S.,
doi: 10.1002/pld3.134.
and Yoshimura, E. (2004) Metal metabolism in the red alga
57.
Ternes, C. M. (2015) Metabolic evolution in Galdieria sul=
Cyanidium caldarium and its relationship to metal toler!
phuraria, Dissertation for the Degree of Dr. Philosophy.
ance, Biometals, 17, 177!181.
Oklahoma Univ. USA.
42.
Edwards, C. D., Beatty, J. C., Loiselle, J. B., Vlassov, K. A.,
58.
Weber, A. P. M., Oesterhelt, C., Gross, W., Bräutigam, A.,
and Lefebvre, D. D. (2013) Aerobic transformation of cad!
Imboden, L. A., et al. (2004) EST!analysis of the thermo!
mium through metal sulfide biosynthesis in photosynthetic
acidophilic red microalga Galdieria sulphuraria reveals
microorganisms,
BMC Microbiol.,
13,
161,
potential for lipid A biosynthesis and unveils the pathway of
doi: 10.1186/1471!2180!13!161.
carbon export from rhodoplasts, Plant Mol. Biol., 55, 17!32.
43.
Wang, C., Maratukulam, P., Lum, A., Clark, D., and
59.
Lee, J., Ghosh, S., and Saier, Jr, M. H.
(2017)
Keasling, J. (2000) Metabolic engineering of an aerobic
Comparative genomic analyses of transport proteins
sulfate reduction pathway and its application to precipita!
encoded within the red algae Chondrus crispus, Galdieria
tion of cadmium on the cell surface, Appl. Environ.
sulphuraria and Cyanidioschyzon merolae, J. Phycol., 53,
Microbiol., 66, 4497!4502.
503!521.
44.
Yoshimura, E., Nagasaka, S., Satake, K., and Mori, S.
60.
Moriyama, T., Mori, N., and Sato, N. (2015) Activation of
(2000) Mechanism of aluminium tolerance in Cyanidium
oxidative carbon metabolism by nutritional enrichment by
caldarium, Hydrobiologia, 433, 57!60.
photosynthesis and exogenous organic compounds in the
45.
Padisák, J., and Naselli!Flores, L. (2021) Phytoplankton in
red alga Cyanidioschyzon merolae: Evidence for het!
extreme environments: importance and consequences of
erotrophic growth, SpringerPlus, 4, 559, doi: 10.1186/
habitat permanency, Hydrobiologia, 848, 157!176.
s40064!015!1365!0.
46.
Matsuzaki, M., Misumi, O., Shin!I, T., Maruyama, S.,
61.
Selosse, M.!A., Charpin, M., and Not, F.
(2017)
Takahara, M., et al., (2004) Genome sequence of the ultra!
Mixotrophy everywhere on land and in water: the grand
small unicellular red alga Cyanidioschyzon merolae 10D,
йcart hypothesis, Ecol. Lett., 20, 246!263.
Nature, 428, 653!657.
62.
Стадничук И. Н., Семенова Л. Р., Смирнова Г. П., Усов
47.
Raven, J. A., Ball, L. A., Beardall, J., Giordano, M., and
А. И. (2007) Высокоразветвленный запасной полиг!
Maberly, S. C. (2005) Algae lacking carbon!concentrating
люкан в клетках термоацидофильной красной микро!
mechanisms, Can. J. Bot., 83, 879!890.
водоросли Galdieria maxima, Прикл. Биохим. Микроби=
48.
Parys, E., Krupnik, T., Kułak, I., Kania, K., and
ол., 43, 88!93.
Romanowska, E.
(2021) Photosynthesis of the
63.
Sakurai, T., Aoki, M., Ju, X., Ueda, T., Nakamura, Y., et al.
Cyanidioschyzon merolae cells in blue, red, and white light,
(2016) Profiling of lipid and glycogen accumulations under
Photosynth. Res., 147, 61!73.
different growth conditions in the sulfothermophilic red
49.
Uemura, K., Anwaruzzaman, Miyachi, S., and Yokota, A.
alga Galdieria sulphuraria, Biores. Technol., 200, 861!866.
(1997) Ribulose!1,5!bisphosphate carboxylase/oxygenase
64.
Graziani, G., Schiavo, S., and Nicolai, M. A. (2013)
from thermophilic red algae with a strong specificity for
Microalgae as human food: Chemical and nutritional char!
CO2 fixation, Biochem. Biophys. Res. Commun., 233, 568!
acteristics of the thermo!acidophilic microalga Galdieria
571.
sulphuraria, Food Funct., 1, 144!152.
50.
Eisenhut, M., Hocken, N., and Weber, A. P. M. (2015)
65.
Sinetova, M. P., Markelova, A. G., and Los, A. D. (2006)
Plastidial metabolite transporters integrate photorespira!
The effect of nitrogen starvation on the ultrastructure and
tion with carbon, nitrogen, and sulfur metabolism, Cell
pigment composition of chloroplasts in the acidother!
Calcium, 58, 98!104.
mophilic microalga Galdieria sulphuraria, Rus. J. Plant
51.
Rademacher, N., Kern, R., Fujiwara, T., Mettler!
Physiol., 53, 153!162.
Altmann, T., Miyagishima, S.!Ya., et al.
(2016)
66.
Takusagawa, M., Nakajima, Y., Saito, T., and Misumi, O.
Photorespiratory glycolate oxidase is essential for the sur!
(2016) Primitive red alga Cyanidioschyzon merolae accu!
vival of the red alga Cyanidioschyzon merolae under ambi!
mulates storage glucan and triacylglycerol under nitrogen
ent CO2 conditions, J. Exp. Bot., 67, 3165!3175.
depletion, J. Gen. Appl. Microbiol., 62, 111!117.
БИОХИМИЯ том 87 вып. 5 2022
658
СТАДНИЧУК, ТРОПИН
67.
Patron, N. J., Keeling, P. J. (2005) Common evolutionary
красных микроводорослей и цианобактерий, Биохи=
origin of starch biosynthetic enzymes in green and red
мия, 86, 1055!1066.
algae, J. Phycol., 41, 1131!1141.
86. Stadnichuk, I. N., Bulychev, A. A., Lukashev, E. P.,
68.
Martinez!Garcia, M., Stuart, M. C. A., and Van der
Sinetova, M. P., Khristin, M. S., et al. (2011) Far!red light!
Maarel, M. J. E. C. (2016) Characterization of the highly
regulated efficient energy transfer from phycobilisomes to
branched glycogen from the thermoacidophilic red
photosystem I in the red microalga Galdieria sulphuraria
microalga Galdieria sulphuraria and comparison with other
and photosystems!related heterogeneity of phycobilisome
glycogens, Int. J. Biol. Macromol., 89, 12!18.
population, Biochim. Biophys. Acta, 1807, 227!235.
69.
Pade, N., Linka, N., Ruth, W., Weber, A. P., and
87. Salbitani, G., Bottone, C., and Carfagna, C.
(2017)
Hagemann, M. (2015) Floridoside and isofloridoside are
Determination of reduced and total glutathione content in
synthesized by trehalose
6!phosphate synthase!like
extremophilic microalga Galdieria phlegrea, Bioprotocol, 7,
enzymes in the red alga Galdieria sulphuraria, New Phytol.,
e2372, doi: 10.21769/BioProtoc.2372.
205, 1227!1238.
88. Stadnichuk, I. N., Rakhimberdieva, M. G., Bolychevtseva,
70.
Горшкова Т. А. (2007) Растительная клеточная стенка
Yu. V., Yurina, N. P., Karapetyan, N. V., et al. (1998)
как динамичная система, Наука, Москва, 426 c.
Inhibition by glucose of chlorophyll a and phycocyanobilin
71.
Popper, Z. A., Michel, G., Herve, C., Domozych, D. S.,
biosynthesis in the unicellular red alga Galdieria partita at
Willats, W. G. T., et al. (2011) Evolution and diversity of
the stage of coproporphyrinogen III formation, Plant Sci.,
plant cell walls: from algae to flowering plants, Ann. Rev.
136, 11!23.
Plant Biol., 62, 567!590.
89. Войцеховская О. В. (2019) Фитохромы и другие (фо!
72.
Ohnuma, M., Misumi, O., and Kuroiwa, T. (2011)
то)рецепторы информации у растений, Физиол. Раст.,
Phototaxis in the unicellular red algae Cyanidioschyzon
66, 163!177.
merolae and Cyanidium caldarium, Cytologia, 76, 295!300.
90. Asimgil, H., and Kavakli, I. (2012) Purification and char!
73.
Niklas, K. J. (2004) The cell walls that bind the tree of life,
acterization of five members of photolyase/cryptochrome
BioScience, 54, 831!841.
family from Cyanidioschyzon merolae, Plant Sci., 185G186,
74.
Bailey, R. W. (1968) The chemical composition of isolated
190!198, doi: 10.1016/j.plantsci.2011.10.005.
cell walls of Cyanidium caldarium, J. Gen. Microbiol., 54,
91. Tardu, M., Dikbas, U. M., Baris, I., and Kavakli, I. H.
269!276.
(2016) RNA!seq analysis of the transcriptional response to
75.
Oesterhelt, C., Vogelbein, S., Shrestha, R. P., Stanke, M.,
blue and red light in the extremophilic red alga,
and Weber, A. P. M. (2008) The genome of the ther!
Cyanidioschyzon merolae, Funct. Integr. Genomics, 16, 657!
moacidophilic red microalga Galdieria sulphuraria
669.
encodes a small family of secreted class III peroxidases
92. Mishra, S., and Khurana, J. P. (2017) Emerging roles and
that might be involved in cell wall modification, Planta,
new paradigms in signaling mechanisms of plant cryp!
227, 353!362.
tochromes, Crit. Rev. Plant Sci., 36, 1!27.
76.
Allen, C. F., Good, P., and Holton, R. W. (1970) Lipid
93. Nishida, K., Yagisawa, F., Kuroiwa, H., Nagata, T., and
composition of Cyanidium, Plant Physiol., 46, 748!751.
Kuroiwa, T. (2005) Cell cycle!regulated, microtubule!
77.
Lang, I., Hodac, L., Friedl, T., and Feussner, I. (2011)
independent organelle division in Cyanidioschyzon
Fatty acid profiles and their distribution patterns in
merolae, Mol. Biol. Cell, 16, 2493!2502.
microalgae: a comprehensive analysis of more than 2000
94. Дорошенко А. С., Данилова М. Н., Медведева А. С.,
strains from the SAG culture collection, BMC Plant Biol.,
Кузнецов В. В. (2019) Участие компонентов сигналин!
11, 124, doi: 10.1186/1471!2229!11!124.
га синего света в регуляции цитокинин!зависимого
78.
Sato, N., and Moriyama, T. (2007) Genomic and bio!
зеленения проростков Arabidopsis thaliana, Физиол.
chemical analysis of lipid biosynthesis in the unicellular
Раст., 66, 403!411.
rhodophyte Cyanidioschyzon merolae: lack of a plastidic
95. Kobayashi, Y., Ando, H., Hanaoka, M., and Tanaka, K.
desaturation pathway results in the coupled pathway of
(2016) Abscisic acid participates in the control of cell cycle
galactolipid synthesis, Eukaryotic Cell, 6, 1006!1017.
initiation through heme homeostasis in the unicellular red
79.
Vitová, M., Goecke, F., Sigler, R., and Řezanka, T. (2016)
alga Cyanidioschyzon merolae, Plant Cell Physiol., 57, 953!
Lipidomic analysis of the extremophilic red alga Galdieria
960.
sulphuraria in response to changes in pH, Algal Res., 13,
96. Stadnichuk, I. N., and Tropin, I. V.
(2017)
218!226.
Phycobiliproteins: Structure, functions and biotechnologi!
80.
Bendall, D. S., Howe, C. J., Nisbet, E. G., and Nisbet,
cal applications, Appl. Biochem. Microbiol., 53, 1!10.
R. E. (2008) Photosynthetic and atmospheric evolution,
97. Sørensen, L., Hantke, A., and Eriksen, N. T.
(2013)
Philos. Trans. R. Soc. Lond. B Biol. Sci., 363, 2625!2628.
Purification of the photosynthetic pigment C!phycocyanin
81.
Ago, H., Adachi, H., Umena, Y., Tashiro, T.,
from heterotrophic Galdieria sulphuraria, J. Sci. Food
Kewakami, K., et al. (2016) Novel features of eukaryotic
Agric., 93, 2933!2938.
photosystem II revealed by its crystal structure analysis
98. Zienkiewicz, M., Krupnik, T., Drożak, A., Golke, A., and
from a red alga, J. Biol. Chem., 291, 5676!5687.
Romanowska, E.
(2017) Transformation of the
82.
Antoshvili, M., Caspy, I., Hippler, M., and Nelson, N.
Cyanidioschyzon merolae chloroplast genome: Prospects for
(2019) Structure and function of photosystem I in
understanding chloroplast function in extreme environ!
Cyanidioschyzon merolae, Photosynth. Res., 139, 499!508.
ments, Plant Mol. Biol., 93, 171!183.
83.
Vanselow, C., and Weber, A. P. M., Krause, K., and
99. Lang, I., Bashir, S., Lorenz, M., Rader, S., and Weber, G.
Fromme, P. (2009) Genetic analysis of the photosystem I
(2020) Exploiting the potential of Cyanidiales as a valuable
subunits from the red alga, Galdieria sulphuraria, Biochim.
resource for biotechnological applications, Appl. Phycol.,
Biophys. Acta, 1787, 46!59.
doi: 10.1080/26388081.2020.1765702.
84.
Marquardt, J. (1998) Effects of carotenoid!depletion on
100. Fukuda, S., Hirasawa, E., Takemura, T., Takahashi, S.,
the photosynthetic apparatus of a Galdieria sulphuraria
Chokshi, K., et al. (2018) Accelerated triacylglycerol pro!
(Rhodophyta) strain that retains its photosynthetic appara!
duction without growth inhibition by overexpression of a
tus in the dark, J. Plant Physiol., 152, 372!380.
glycerol!3!phosphate acyltransferase in the unicellular red
85.
Болычевцева Ю. В., Тропин И. В., Стадничук И. Н.
alga Cyanidioschyzon merolae, Sci. Rep.,
8,
12410,
(2021) Состояния 1 и 2 в фотосинтетическом аппарате
doi: 10.1038/s41598!018!30809!8.
БИОХИМИЯ том 87 вып. 5 2022
ПОЛИЭКСТРЕМОФИЛЫ CYANIDIALES
659
POLYEXTREMOPHILIC EUCARYOTES CYANIDIALES
Review
I. N. Stadnichuk1* and I. V. Tropin2
1 Timiryazev Institute of Plant Physiology of the Russian Academy of Sciences,
127726 Moscow, Russia; e=mail: stadnichuk@mail.ru
2 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia
The red microalgae Cyanidiales were named “enigmatic algae” due to their polyextremophilic features, which were
thought to be impossible for eukaryotes. Cyanidiales inhabiting hot sulfur springs in volcanic areas with pH 0!4, tem!
peratures up to 56 °C, and high concentrations of dissolved heavy metals, integrate eukaryotic cell organization with
characteristics unsurpassed by any other algal group and typical only for extremophilic species of living prokaryotes.
Owing to their exceptional properties and minimal genome size, Cyanidiales have become one of the most perspec!
tive objects of research in plant cell physiology, biochemistry, molecular biology, phylogenomics, algology and evolu!
tionary biology. They play an important role in the study of many features of oxygenic photosynthesis and chloroplast
origin. The unique properties were acquired by Cyanidiales from archaea and bacteria through multiple acts of hori!
zontal gene transfer. Thanks to this, the possibility of gene transfer between the superkingdoms of archaea, bacteria,
and eukaryotes was discovered, being a milestone in the understanding of the origin of cell domains of life and the
endosymbiotic origin of chloroplasts. At present, the study of these organisms with fully sequenced genomes of some
their representatives is an interdisciplinary field of biology with excellent biotechnological perspectives and deline!
ation the limits of adaptive changes compatible with the origin of life.
Keywords: acido!thermophily, microalgae, Cyanidiales, Cyanidium caldarium, Cyanidioschyzon merolae, Galdieria sul=
phuraria
БИОХИМИЯ том 87 вып. 5 2022