БИОХИМИЯ, 2022, том 87, вып. 6, с. 707 - 726
УДК 577
ПОМОГУТ ЛИ ПЕПТИДЫ ОСТАНОВИТЬ COVID-19?
Обзор
© 2022 В.Г. Круть1, С.А. Чувпило1, И.В. Астраханцева1, Л.И. Козловская2,3,
Г.А. Ефимов4, А.А. Круглов5,6,7, М.С. Друцкая1,8, С.А. Недоспасов1,5,6,8*
1 АНО ВО Научно-технологический университет Сириус,
354340 Федеральная территория Сириус/Сочи, Россия; электронная почта: sergei.nedospasov@gmail.com
2 ФГАНУ «ФНЦИРИП им. М.П. Чумакова РАН», 108819 Москва, Россия
3 Первый Московский государственный медицинский университет имени И. М. Сеченова,
Институт трансляционной медицины и биотехнологий, 119991 Москва, Россия
4 Национальный медицинский исследовательский центр гематологии Минздрава России,
125167 Москва, Россия
5 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова, 119234 Москва, Россия
6 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия
7 Немецкий исследовательский центр ревматизма (DRFZ), Институт Лейбница, 10117 Берлин, Германия
8 Институт молекулярной биологии имени В.А. Энгельгардта РАН, 119991 Москва, Россия
Поступила в редакцию 31.12.2021
После доработки 24.04.2022
Принята к публикации 11.05.2022
Пептиды широко применяются в диагностике, профилактике и терапии некоторых заболеваний
человека. Насколько они могут быть полезны при болезни, вызываемой коронавирусом SARS-CoV-2?
В настоящем обзоре мы обсуждаем возможность применения синтетических и рекомбинантных
пептидов и полипептидов для профилактики COVID-19, основанной на блокировке взаимодействия
вируса со своим главным рецептором - АСЕ2, а также использование синтетических пептидов в
противовирусных вакцинах с учётом возникающих новых вариантов вируса.
КЛЮЧЕВЫЕ СЛОВА: SARS-CoV-2, АСЕ2, вакцина, Т-клеточные эпитопы.
DOI: 10.31857/S0320972522060021, EDN: ATTVXB
ВВЕДЕНИЕ
зуются острым респираторным дистресс-син-
дромом, а также значительным повреждением
За последние двадцать лет β-коронавирусы
лёгких, иногда приводящим к дыхательной не-
(SARS-CoV, MERS-CoV и SARS-CoV-2) пере-
достаточности и смерти [1]. В декабре 2019 г.
стали быть патогенами животных и приобре-
в г. Ухань, провинции Хубэй (Китай), были
ли способность инфицировать человеческую
зарегистрированы первые случаи загадочной
популяцию. Все они вызывают респираторные
пневмонии неизвестной этиологии, кото-
заболевания, некоторые из которых характери- рые привлекли внимание всего мира. Метаге-
номное секвенирование РНК от заболевших
Принятые сокращения: ACE2 - ангиотензин-превра-
выявило новый вариант вируса из семейства
щающий фермент 2; Ang - ангиотензин; Е - мембран-
Coronaviridae, который был обозначен как ко-
ный гликопротеин; FP - гидрофобный пептид слияния;
НА - гемагглютинины; HR1 и HR2 - α-спиральные гидро-
ронавирус «Wuhan-Hu-1» или «WH-Human 1»,
фобные домены; M - матриксный белок; МНС - главный
также он упоминается и как
«2019-nCoV».
комплекс гистосовместимости; N - структурный белок
Всей его последовательности генома был при-
нуклеокапсида; RAS - ренин-ангиотензиновая система;
RBD - рецептор-связывающий домен; S - гликопротеин
своен регистрационный номер
- GenBank
наружной мембраны.
MN908947. Коронавирусы - это оболочечные
* Адресат для корреспонденции.
вирусы, несущие геном в виде одноцепочеч-
2*
707
708
КРУТЬ и др.
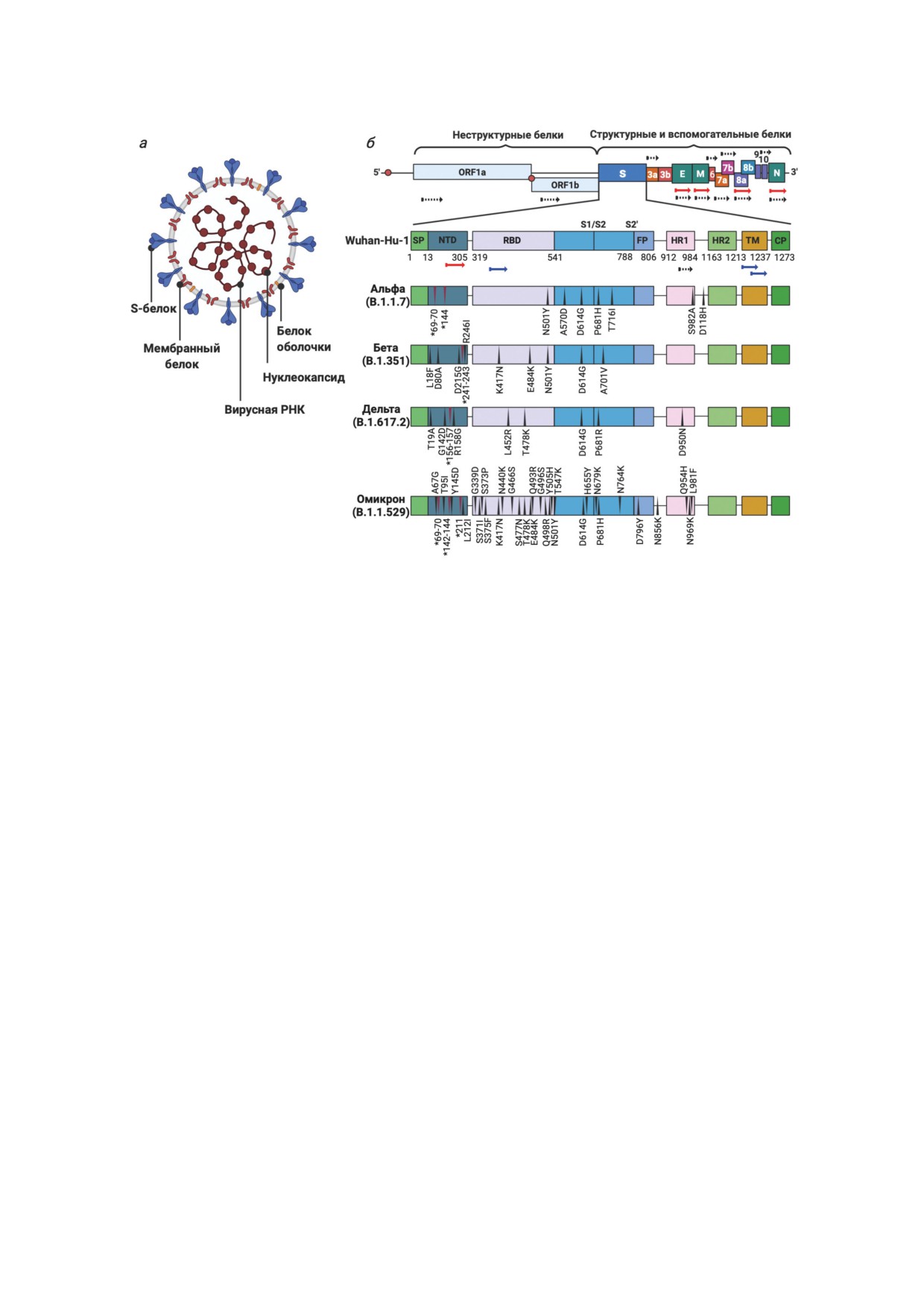
Таблица 1. Характеристика «вариантов озабоченности» вируса SARS-CoV-2
Аминокислотные
Вариант
Номер
Происхождение
Аминокислотные замены в S-белке
делеции в S-белке
Альфа
B.1.1.7
Великобритания
N501Y, A570D, D614G, P681H, T716I, S982A,
H69/V70, Y144
D1118H
Бета
B.1.351
Южная Африка
L18F, D80A, D215G, R246I, K417N, E484K,
L241, L242, A243
N501Y, D164G, A701V
Дельта
B.1.617.2
Индия
T19R, G142D, R158G, L452R, T478K, D614G,
E156, F157
P681R, D950N
Омикрон
B.1.1.529
Южная Африка
A67V, T95I, Y145D, L212I, G339D, S371L,
H69/V70, G142/
S373P, S375F, K417N, N440K, G446S, S477N,
V143/Y144, N211
T478K, E484A, Q493R, G496S, Q498R, N501Y,
Y505H, T547K, D614G, H655Y, N679K,
P681H, N764K, D796Y, N856K, Q954H,
N969K, L981F
ной РНК положительной полярности разме-
зин-превращающему ферменту 2 (ACE2) по
ром ~27-32 т.н. (размер генома SARS-CoV-2 -
сравнению с вирусом Bat-CoV [5, 6]. Умерен-
29,9 т.н.), который кодирует структурные и
ная частота геномных мутаций SARS-CoV-2
неструктурные белки. Порядок генов в геноме
оценивается в 1,25 × 10-6 нуклеотидов за цикл
вируса SARS-CoV-2 выглядит следующим об-
репликации [7], поэтому регулярно появляют-
разом: в 5′-концевых ORF1a/1b закодирова-
ся новые варианты SARS-CoV-2 с повышенной
но 16 неструктурных белков (nsp1-16), функ-
инфекционностью и способностью избегать
ции части которых до сих пор неизвестны, но
иммунную защиту хозяина [8-10]. Некоторые
большинство участвует в репликации генома
мутации, возникшие в последовательности
и регуляции ранней транскрипции. На 3′-кон-
S-белка, увеличили сродство SARS-CoV-2 к
цевых участках закодированы гены структур-
клеточному рецептору ACE2, что, по-видимо-
ных белков: гликопротеина наружной мем-
му, дало возможность новым вариантам виру-
браны (S), мембранного гликопротеина (E),
са распространяться с очень высокой скоро-
матриксного белка (M) и структурного белка
стью [11-19] (рисунок, б). Чтобы определить
нуклеокапсида (N), а также несколько малых
приоритетность мониторинга и исследования
неструктурных вспомогательных белков (рису-
этих вариантов, ВОЗ разделила их на три ка-
нок, а и б). S-белок (от англ. - spike) встроен
тегории, среди которых особенно выделяются
в мембрану вириона и формирует корону на
«варианты озабоченности» (табл. 1).
поверхности вирусной частицы [2]. Этот белок
Распространение вируса SARS-CoV-2 до
опосредует прикрепление, слияние и проник-
недавнего времени не удавалось остановить, а
новение вируса внутрь клетки и представляет
ущерб от вызываемой им болезни, COVID-19,
собой одну из главных мишеней для выработ-
уже вызвал глобальные проблемы как в систе-
ки нейтрализующих антител в ответ на забо-
мах здравоохранения, так и в экономиках даже
левание, разработки пептидных ингибиторов
развитых стран [20]. В связи с отсутствием эф-
проникновения в клетки, биоинженерных
фективных лекарств, специфичных конкрет-
антител и возможных вакцин для терапии [3].
но к этому коронавирусу, центральную роль
Гомологичность последовательности генома
в сдерживании пандемии отводят профилак-
SARS-CoV-2 с геномом вируса, который вы-
тическим мерам, таким как массовая вакци-
звал первую вспышку «атипичной пневмонии»
нация, дистанцирование и ношение масок.
у людей более двадцати лет назад (SARS-CoV),
Вакцинация необходима для создания нейтра-
составляет 80%, при этом идентичность после-
лизующих антител для защиты организма от
довательности с геномом коронавируса лету-
инфекции SARS-CoV-2, а также для активации
чих мышей (CoV RaTG13) составляет 96,2% [4].
клеточного защитного ответа, в котором цен-
Хотя S-белки обоих вирусов имеют очень высо-
тральную роль играют Т-лимфоциты.
кую идентичность аминокислотной последо-
На сегодняшний день в борьбе с вирусом
вательности, S-белок SARS-CoV-2 имеет более
SARS-CoV-2 в мире участвуют 5 различных ти-
высокое сродство к человеческому ангиотен-
пов вакцин.
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
709
Схематическое изображение вируса SARS-CoV-2: а - структура вириона; б - строение S-белка вируса и местоположение
мутаций у разных вариантов. Стрелками обозначено расположение кодирующих последовательностей для пептидов,
выбранных для разработки вакцины с преимущественным Т-клеточным ответом [30] - черные стрелки с пунктиром; для
вакцины CoVac-1 [31] - красные стрелки; для вакцины ЭпиВакКорона [32, 33] - синие стрелки
1. Цельновирионные вакцины, в которых ис-
инфекционного агента и произведены в больших
пользуется химически инактивированный вирус
количествах быстрее, чем при использовании
SARS-CoV-2, не способный к репликации [21].
других технологий.
Хотя аттенуация живого вируса является класси-
3. Векторные вакцины, суть которых за-
ческим подходом к разработке эффективных вак-
ключается в использовании рекомбинантных
цин, для вируса SARS-CoV-2 об аттенуированных
вирусов для доставки гена S-белка в клетку [24,
живых вакцинах пока не сообщалось. Живые атте-
25]. Аденовирусные векторы являются наиболее
нуированные вакцины, как правило, сопряжены с
изученными, поэтому они в основном и исполь-
риском реверсии, что делает этот подход неблаго-
зуются для создания вакцин против различных
приятным для высокопатогенных вирусов. С дру-
инфекционных заболеваний.
гой стороны, химическая инактивация может не
4. Белковые вакцины против SARS-CoV-2
вызывать полноценной защитной реакции, как в
с использованием рекомбинантного S-белка,
случае с вирусом Эбола, или приводить к неже-
полученного в разных системах экспрессии [26,
лательным эффектам, которые наблюдались для
27]. При этом экспрессируемая полноразмерная
инактивированного формалином респираторно-
форма S-белка может содержать замены в сайте
синцитиального вируса в 1960-х гг. [22].
расщепления фурином [28].
2. Вакцины на основе модифицирован-
5. Наиболее близкие к теме настоящего
ной мРНК, упакованной в липидные частицы,
обзора пептидные вакцины, в которых синте-
разработаны для эффективной доставки матри-
тические пептиды, соответствующие выбран-
цы для синтеза S-белка в клетку, что ведёт к ин-
ным участкам вирусных белков, используются в
дукции мощного иммунного ответа [23]. Данный
различных форматах для индукции защитного
тип вакцин изучается и применяется уже на про-
иммунного ответа [29]. Сюда относятся как вак-
тяжении десятилений, в основном для иммуно-
цины, индуцирующие защитные антитела, так
терапии опухолей. Такие инновационные вак-
и вакцины, направленные на активацию Т-кле-
цины могут быть адаптированы для конкретного
точного ответа [30-33].
БИОХИМИЯ том 87 вып. 6 2022
710
КРУТЬ и др.
Различные платформы для создания вак-
Проникновение SARS-CoV-2 в клет-
цин позволяют достигать разных вариантов
ки-мишени включает несколько этапов. Пер-
гуморальной и клеточной защиты. Пандемия
воначальное расщепление вирусного S-бел-
показала, что решающее значение имеют ин-
ка происходит c помощью протеазы фурин в
новационные вакцинные технологии, которые
многоосновном участке (RRAR) - S1/S2, этот
могут быть быстро адаптированы к конкретно-
процесс можно называть «затравкой», он при-
му вирусу и позволяют в кратчайшие сроки пе-
водит к образованию нековалентно связан-
рейти к крупномасштабному производству.
ных S1- и S2-субъединиц [46]. Протомеры S1/
S2 после воздействия протеазы появляются на
вирусной мембране в виде грибовидных три-
МЕХАНИЗМ ВЗАИМОДЕЙСТВИЯ ВИРУСА
меров. Каждый из протомеров, относящихся к
SARS-CoV-2 С КЛЕТКОЙ
рецептор-связывающим доменам (RBD), мо-
жет принимать конформацию «открыто/вверх»
S-белок вирусов SARS-CoV и SARS-CoV-2
или «закрыто/вниз» для связывания с рецепто-
представляет
собой
сильно
гликози-
ром [47]. Субъединица S1 опосредует началь-
лированный [34] трансмембранный белок сли-
ное связывание с ACE2, тогда как область S2
яния I-го типа размером примерно 180-200 кДа
содержит компоненты, необходимые для сли-
с N-концом, расположенным на внешней по-
яния мембран, состоящие из доменов гидро-
верхности вируса, и коротким C-концом во
фобного пептида слияния (FP) и α-спиральных
внутримембранном пространстве [35]. В каче-
гидрофобных доменов гептад-1 (HR1) и геп-
стве рецептора для входа в клетку этот белок
тад-2 (HR2), которые объединяются во время
использует заякоренный на мембране ангио-
связывания с рецептором, формируя структуру
тензин-превращающий фермент 2 [36-38], а
в форме свернутой спирали [48]. После связы-
клеточные сериновые протеазы TMPRSS2 и
вания RBD S1-субъединицы с АСЕ2-рецепто-
катепсин L - для инициации перестроек своей
ром в присутствии TMPRSS2 на поверхности
структуры [39-40]. Рецептор ACE2 представ-
клетки происходит расщепление S2′-сайта.
ляет собой трансмембранный фермент-гли-
Расщепление сайта S2′ открывает пептид слия-
копротеин I-го типа, который функциониру-
ния - FP [49], а диссоциация S1 от S2 вызывает
ет как монокарбоксипептидаза. Его основная
резкие конформационные изменения в субъ-
физиологическая функция заключается в пре-
единице S2, особенно в HR1, продвигая пептид
образовании биологически активного сосу-
слияния ближе к мембране. Пара гептадных
досуживающего и воспалительного пептида
доменов создаёт α-спиральный антипарал-
ангиотензина-2 (Ang2)
(8 аминокислотных
лельный комплекс между HR1 и HR2, который
остатков) в ангиотензин путём отщепления
сближает вирусную и клеточную мембраны [50,
С-концевой аминокислоты [41]. АСЕ2 экспрес-
51]. Эта конформация очень устойчива и, как
сируется во многих органах и типах клеток, но
считается, помогает преодолеть большой энер-
особенно высокая экспрессия была отмечена в
гетический барьер, связанный сo слиянием
эпителиальных клетках альвеол лёгких и энте-
мембран [52]. Само слияние мембран иниции-
роцитах кишечника [42] - двух важных участках
руется, когда гидрофобные остатки FP инкор-
воздействия SARS-CoV-2. Более того, большин-
порируются в мембрану клетки-хозяина [53].
ство клеток лёгких, экспрессирующих ACE2,
Впоследствии участки HR1 и HR2 тримерно-
представляют собой клетки альвеолярного
го вирусного трансмембранного белка взаи-
эпителия типа II, которые более уязвимы для
модействуют с образованием пучка из шести
вирусной инфекции из-за высокой экспрессии
спиралей, который стягивает вирусную и кле-
генов, связанных с вирусной репликацией [43].
точную мембраны вместе для образования
В структуре S-белка различают S1- и S2-субъ-
поры слияния, через которую вирусная РНК
единицы, которые имеют 2 сайта расщепления:
высвобождается в цитоплазму клетки-мише-
многоосновный фуриновый сайт - S1/S2, а
ни для дальнейшего удаления нуклеокапсида
также сайт в области S2-субъединицы - S2′ [44,
и начала цикла репликации. Если клетка-ми-
45]. Расщепление S1/S2 является необходимым
шень экспрессирует недостаточное количество
условием для активации S-белка и последую-
TMPRSS2 или если комплекс вирус-ACE2 не
щего разрезания участка S2′, оба события необ-
встречается с TMPRSS2, то такой комплекс
ходимы для инициации процесса слияния мем-
интернализуется внутрь клетки посредством
бран при проникновении вируса в клетку.
эндоцитоза, опосредованного клатрином, в
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
711
эндолизосомы, где расщепление S2′-участка
мацию, необходимую для выбора оптималь-
осуществляется катепсинами, которым для ак-
ных последовательностей для производства
тивности требуется кислая среда. Далее по вы-
пептидно-направленных антител. Базы данных
шеописанному механизму с помощью пептида
UniprotKB/Swiss-Prot, PAComplex, ORION,
слияния образуется пора, после чего вирусная
SPARKS-X и PEPstrMOD, с помощью кото-
РНК доставляется в цитоплазму и начинается
рых можно получить информацию о структуре,
цикл репликации.
функциях и свойствах белков, также помогают
Все эти этапы - расщепление S1/S2 и S2′,
выбрать аминокислотные последовательности
прикрепление к клеточным рецепторам, кон-
для синтеза. Для определения сайта связыва-
формационные изменения S1 и S2, экспониро-
ния между белком и его рецептором исполь-
вание FP - имеют решающее значение для ин-
зуют данные рентгеноструктурного анализа,
фекции SARS-CoV-2 и могут рассматриваться
который помимо данных о структуре может
как мишени для ингибиторов.
помочь и в оптимизации связывания с белко-
Строение SARS-CoV и SARS-CoV-2 прак-
вой мишенью [57]. Ещё одним вариантом для
тически идентично, поэтому предполагалось,
поиска и отбора пептидов является технология
что механизмы их проникновения аналогич-
фагового дисплея, которая позволяет выбирать
ны, но при этом молекулярное моделирование
высокоаффинные пептиды, связывающие ми-
выявило более сильное взаимодействие RBD
шень, из пула сложных смесей с использова-
SARS-CoV-2 с рецептором ACE2. В частности,
нием фаговых комбинаторных библиотек. По-
характерная петля с гибкими остатками гли-
скольку пептиды отображены на поверхности
цина в структуре S-белка SARS-CoV-2 в случае
нитевидного бактериофага, можно провести
SARS-CoV содержит жёсткие остатки пролина
отбор тех из них, которые обладают наиболь-
и отличается по структуре соответствующего
шим сродством к мишени [58, 59].
домена. Фенилаланин - F486, расположенный
Технологии химического синтеза и очистки
в гибкой петле, вероятно, играет главную роль
пептидов хорошо отработаны, однако их сто-
во взаимодействии с рецептором [54]. Ещё
имость превышает таковую для многих вари-
примечательно, что домены HR2 SARS-CoV-2
антов, использующих рекомбинантную ДНК.
и SARS-CoV идентичны, в то время как доме-
Наработка целевого полипептида с помощью
ны HR1 демонстрируют вариабельность [55].
бактериальной или эукариотической культур
Возможно, это влияет на взаимодействие меж-
может быть чревата загрязнениями продуктами
ду HR1 и HR2, и, следовательно, может объяс-
жизнедеятельности клеток. Пептиды обладают
нить улучшенную способность SARS-CoV-2 к
рядом свойств, которые делают их ценными
слиянию с плазматической мембраной [56].
в качестве терапевтических средств: высокая
специфичность, низкая токсичность, невысо-
кая иммуногенность и долгосрочная стабиль-
ИСПОЛЬЗОВАНИЕ ПЕПТИДОВ
ность при хранении [60].
ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ
Одним из важных факторов, влияющих
ВИРУСНЫХ ЗАБОЛЕВАНИЙ
на функциональность пептидов является их
трёхмерная структура. При синтезе коротких
Поиск и идентификация функциональных
пептидных последовательностей велик риск
доменов в белковых компонентах возбудите-
потери или нарушения третичной структу-
лей инфекций служат основой для возможного
ры соответствующего домена белка-мише-
использования пептидов, так как эти домены
ни, что может привести к утрате активности.
можно имитировать с помощью коротких це-
Кроме того, линейные немодифицированные
пей аминокислот. Процедура подбора амино-
пептиды обладают низкой устойчивостью в
кислотной последовательности пептидов для
кровотоке - их быстро расщепляют протеа-
синтеза представляет собой сложный процесс,
зы сыворотки крови. Способ обойти такую
включающий различные варианты анализа
деградацию - включение в аминокислотную
экспериментальных данных. Традиционно ис-
последовательность неприродных D-амино-
пользуются вычислительные методы и биоин-
кислот, которые более устойчивы к протеаз-
форматические ресурсы, для которых в насто-
ному воздействию. Поиск терапевтических
ящее время есть большое количество удобных
пептидов, изготовленных из D-аминокислот,
платформ. Например, платформа NHLBI-Ab
является сложной задачей, для решения кото-
Designer позволяет визуализировать инфор-
рой используют технологию зеркального фаго-
БИОХИМИЯ том 87 вып. 6 2022
712
КРУТЬ и др.
вого дисплея, при которой D-аминокислотная
ются с образованием поры [64]. Синтетический
версия целевого белка подвергается скринингу
пептид T20 (также известный как Энфувиртид
против библиотеки на фаге с L-аминокислота-
или Фузеон), содержащий 36 аминокислот (YT
ми. Несмотря на сложности в синтезе D-ами-
SLIHSLIEESQNQQEKNEQELLELDKWASL
нокислотных белков, была разработана плат-
WNWF), что соответствует а.о. 638-673 gp41,
форма для скрининга пептидов, устойчивых
одобрен для лечения ВИЧ-1 [65] и является
к протеазной активности, против крупных
первым из класса антиретровирусных препа-
сложных белковых мишеней, таких как вирус-
ратов, используемых в комбинированной тера-
ные гликопротеины [61]. Для этого на основе
пии для лечения инфекции. Клиническое при-
вируса везикулярного стоматита была получена
менение пептида Т20 против ВИЧ-инфекции
вирусная частица, псевдотипированная гли-
продемонстрировало, что пептидные противо-
копротеином заирского штамма вируса Эбола
вирусные препараты могут быть безопасной и
(rVSV-ZEBOV). Сохранение третичной струк-
эффективной альтернативой при лечении ин-
туры гликопротеина в этой системе позволило
фекционных заболеваний.
существенно упростить анализ, в результате
Существующие в настоящее время спосо-
чего было установлено, что кателицидиновый
бы лекарственной терапии гриппа основаны
антимикробный пептид LL-37 человека (LLGD
на воздействии на два вирусных белка - M2
FFRKSKEKIGKEFKRIVQRIKDFLRNLVPRT
и нейраминидазу N. Оба эти белка важны для
ES) может подавлять инфекцию рекомбинант-
обеспечения нормального жизненного цик-
ным вирусом, предотвращая проникновение
ла вируса. Однако мутации вируса гриппа и
внутрь клетки. Ещё один вариант повышения
особенности его многокомпонентного генома
активности пептидов - их конъюгация с холе-
приводят к появлению резистентных вариан-
стерином, что повышает противовирусную ак-
тов, против которых существующие противо-
тивность, направляя ингибитор на липидные
вирусные препараты оказываются малоэф-
участки взаимодействия вирусов и клеток, где и
фективными. Эти обстоятельства указывают
происходит слияние [62]. В литературе описа-
на необходимость разработки новых способов
ны 3 пептида, конъюгированных с холестери-
борьбы с этой вирусной инфекцией. Пред-
ном, активно противодействующие заражению
полагается, что более эффективными могут
вирусом Эбола: EBOV-5 (DWTKNIKDKIDKI
оказаться стратегии, опирающиеся на приме-
IHDFVDKTLPDQS-C (PEG4-Chol)), EBOV-6
нение препаратов, молекулярной мишенью
(DWTKNIKDKIDKIIHDFVDKTLPDQS-C
которых будут белки-гемагглютинины (НА).
(PEG12-Chol)) и EBOV-7 (IEPH DWTKNIKD
Инфицирование вирусом гриппа начинается
KIDKIIHDFVDKTLPDQS-C (PEG12-Chol)).
с того, что НА вируса, представляющие собой
Их эффективность была доказана в системе
гликопротеины, взаимодействуют с сиало-
in vitro и при тестировании летальных доз ви-
выми кислотами, входящими в состав рецеп-
русной нагрузки в мышиной модели. Подоб-
тора на поверхности клетки-хозяина. После
ные пептиды представляют собой перспектив-
контакта с клеткой гемагглютинин изменяет
ные средства для специфичной терапии [63].
своё пространственное строение, фактически
Для борьбы с вирусом иммунодефицита
внедряясь в клеточную мембрану, что, в свою
человека (ВИЧ) были разработаны пептиды,
очередь, обеспечивает проникновение виру-
называемые ингибиторами слияния или входа.
са внутрь клетки, где он начинает свой цикл
Проникновение ВИЧ-1 и SARS-CoV-2 в клет-
репликации. Matsubara et al. [66] с помощью
ку хозяина имеет ряд общих черт. Инфекция
методики фагового дисплея идентифицирова-
ВИЧ-1 тоже требует слияния вирусной и кле-
ли HA-связывающий пентапептид (ARLPA),
точной мембран, которое опосредуется глико-
который взаимодействовал с рецептор-свя-
протеинами вирусной оболочки - gp120 и gp41.
зывающим участком HA вируса и оказывал
Сначала происходит связывание поверхност-
ингибирующее действие на инфекцию в кле-
ной субъединицы gp120 с клеточным рецепто-
точной культуре. Для того чтобы синтезиро-
ром CD4 и корецепторами CCR5 или CXCR4,
ванные пептиды были устойчивы к действию
что запускает каскад конформационных изме-
ферментов, они могут быть модифицированы с
нений, активирующих фузогенную функцию
помощью остатков β-аланина и диаминовале-
белка gp41. Пептид слияния на N-конце gp41
риановой кислоты (орнитина) - неприродных
встраивается в клеточную мембрану, затем
аминокислот. Циклическая структура синте-
мембраны вируса и клетки-мишени соединя-
зированных пептидов, отсутствие у них харак-
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
713
терных для линейных и разветвленных белко-
тика не предполагает.
вых молекул C- и N-концов также способствует
АСЕ2. В качестве одной из стратегий ин-
устойчивости к гидролизу [67]. Отметим, что
гибирования взаимодействия вируса SARS-
большинство обсуждаемых пептидных препа-
CoV-2 с клеткой может быть рассмотрен
ратов рассматриваются в первую очередь в ка-
вариант блокировки рецептора АСЕ2. Дей-
честве профилактических средств, так как они
ствительно, быстрое мутирование вируса и
чаще всего нарушают ранние этапы инфекци-
появление его новых вариантов являются
онного процесса [68].
ограничивающими факторами при разработке
лекарств, а структура АСЕ2 остаётся неизмен-
ной. С другой стороны, ACE2 имеет важные
ПРОФИЛАКТИКА И ТЕРАПИЯ
физиологические функции в организме, и его
ИНФЕКЦИИ SARS-CoV-2.
связывание с SARS-CoV-2 может снижать ак-
МОЛЕКУЛЯРНЫЕ МИШЕНИ
тивность, нарушая баланс ACE/ACE2 в сторо-
ну увеличения активности ACE. Гены, кодиру-
Разработка
специфичных ингибито-
ющие АСЕ и АСЕ2, схожи по своему строению,
ров ферментов (таких, как РНК-зависимая
но в организме эти белки выполняют разные
РНК-полимераза), критических для жизне-
функции. Оба белка являются незаменимыми
деятельности вируса, активно продолжается.
компонентами ренин-ангиотензиновой систе-
Лекарства, ранее разработанные против дру-
мы (RAS). С помощью ренина ангиотензино-
гих РНК-содержащих вирусов (вирусы гриппа,
ген, синтезированный в печени, преобразуется
вирус лихорадки Эбола), пока дают скромные
в ангиотензин-1 (Ang1), а затем при участии
эффекты при лечении инфекции SARS-CoV-2.
ACE - в Ang2. Ang2 - это ключевое звено RAS,
Отчасти поэтому в контексте новой корона-
он связывается с ангиотензиновым рецепто-
вирусной инфекции особое внимание уде-
ром типа I (AT1R). ACE2 выступает в качестве
ляется таким молекулярным мишеням, как
контррегулятора активности комплекса ACE-
RBD S-белка вируса, а также ACE2-рецептор
Ang2-AT1R, он гидролизует Ang2 в Ang1-7,
и TMPRSS2-протеаза хозяина, как основным
который (через Mas-рецептор) может вызывать
участникам стадий проникновения вируса в
вазодилатацию, снижение артериального дав-
клетку. Есть надежда, как это произошло в слу-
ления и индукцию апоптоза. Кроме того, ACE2
чае ВИЧ-1, что эффективным лекарством ока-
может взаимодействовать с Ang1, превращая
жется комбинация ингибиторов сразу двух или
его в Ang1-9, из которого возможен переход в
более мишеней.
Ang1-7 при участии ACE. При использовании
S-белок. Противовирусными механизма-
ингибиторов ACE и рецептора ангиотензи-
ми действия моноклональных антител (как
на можно восстановить баланс системы ACE/
профилактических, так и терапевтических)
ACE2, однако это, в свою очередь, может уси-
являются блокировка взаимодействия с кле-
лить связывание вируса SARS-CoV-2 с ACE2
точным рецептором АСЕ2 и предотвращение
и стимулировать развитие заболевания. Уве-
вирусного слияния с мембраной. Антитела, на-
личение активности ACE приводит к сужению
целенные на несколько эпитопов S-белка, осо-
лёгочных сосудов и воспалительному и окис-
бенно на его RBD, могут блокировать взаимо-
лительному повреждению органов, а это уве-
действие с ACE2 или предотвращать слияние
личивает риск острого повреждения лёгких и
мембран, так что этот механизм лежит в основе
системного воспаления [73].
действия нейтрализующих антител и при ле-
Если иммунная система не в состоянии
чении моноклональными антителами [69, 70].
справиться с SARS-CoV-2, то вирус актив-
Существует несколько вариантов монокло-
но проникает в клетку и реплицируется, а за-
нальных антител человека, которые ингибиру-
тем при выходе во внеклеточное пространство
ют проникновение вируса путём блокировки
разрушает клетку-хозяина. Как следствие, ме-
взаимодействия вируса и рецептора. В качестве
таболический путь ангиотензина не ингиби-
примера можно привести антитела anti-SARS-
руется. Это обстоятельство только усугубляет
CoVAb - 80R и S230 [71, 72]. Подчеркнём, что
инфекционный процесс и развитие воспале-
антитела, искусственно введённые в организм,
ния. Установлено, что трансгенные мыши, за-
имеют ограниченное время жизни в организме
ражённые вирусом SARS-CoV, испытывают
реципиента, а формирования клеток иммуно-
недостаток ACE2, у них повышается уровень
логической памяти такая терапия/профилак-
Ang2 и развиваются тяжёлые заболевания ор-
БИОХИМИЯ том 87 вып. 6 2022
714
КРУТЬ и др.
ганов дыхания [74]. Отсутствие ACE2, обеспе-
тор-приманка - sACE22.v2.4 (19-805 a.о.), име-
чивающего протективную функцию, ведёт к
ющий 3 аминокислотные замены (T27Y, L79T,
дисфункции RAS и острым патологическим ре-
N330Y), который является димерным, монодис-
спираторным состояниям. Интересно, что за-
персным, хорошо растворимым и стабильным.
щитная функция ACE2 при острых поражениях
Этот вариант сопоставим по активности с ней-
лёгких наблюдается не только при инфициро-
трализующими антителами и взаимодействует с
вании коронавирусом. У лабораторных мышей,
S-белком как вируса SARS-CoV-2, так и SARS-
имеющих массивный отёк лёгких, тяжёлую ги-
CoV. Благодаря своей высокой активности и
поксию и воспалительные клеточные инфиль-
технологичности sACE22.v2.4 является хоро-
траты, при введении рекомбинантного ACE2
шим кандидатом для последующих доклиниче-
наблюдалось восстановление лёгочной ткани.
ских и клинических испытаний. Рекомбинант-
Каноническая концепция лиганд-рецеп-
ные высокоаффинные рецепторы-приманки,
торного взаимодействия предполагает специ-
несмотря на сходство с природным ACE2, мо-
фичное связывание лиганда, обычно с высокой
гут нести дополнительные вариации на поверх-
аффинностью, и дальнейшую передачу внутри-
ности взаимодействия или вблизи неё. Таким
клеточного сигнала через цитоплазматическую
образом, у шипов вируса есть возможность от-
часть рецептора. Для многих классов рецепто-
личать искусственную приманку от рецептора
ров существуют природные рецепторы-при-
дикого типа [83].
манки (decoy receptors), которые действуют
Какой минимальной длины должны быть
как молекулярная ловушка для лиганда и как
фрагменты АСЕ2, чтобы эффективно кон-
ингибитор сигнальных компонентов рецепто-
курировать за связывание с S-белком? Этот
ра. Так, рецептор-приманка интерлейкина-1
важный вопрос был изучен в серии недавних
типа II (IL-1RII) был первым примером тако-
исследований, но их результаты явно противо-
го ингибирования в иммунной системе [75, 76].
речивы. Одним из первых пептидов, сконстру-
Впоследствии были идентифицированы рецеп-
ированных на основе структурного анализа
торы-приманки для представителей семейств
связывания ACE2 с RBD вирусов SARS-CoV-2
рецепторов фактора некроза опухоли [77]. Оче-
и SARS-CoV был 23-членный пептид SBP1
видно, что растворимые рецепторы-приманки
(IEEQAKTFLDKFNHEAEDLFYQS), исполь-
сами не способны передавать сигналы, но они
зованный в работе Zhang et al. [84]. Этот пептид
снижают биодоступность лигандов (в частно-
был создан на основе α1-спирали ACE2 и по-
сти, провоспалительных цитокинов) и уровни
казал связывание с RBD вируса SARS-CoV-2,
передаваемых ими молекулярных сигналов.
однако данных о тестировании пептида в опы-
Подобная стратегия может быть применена
тах по блокировке in vitro или in vivo представ-
и при разработке противовирусного пептид-
лено не было. Пептиды на основе α1-спирали
ного лекарства на основе АСЕ2-рецептора.
ACE2 использовались и Kapoyan et al. [85] для
Так, рекомбинантная форма растворимого
создания немодифицированных пептидных
ACE2 (sACE2) была использована в качестве
имитаторов ACE2 с высокой спиральностью.
приманки, которая не нарушает физиологиче-
Однако увеличение спиральности привело к
ских функций АСЕ2, а только конкурирует за
повышению гидрофобности, что сказалось на
связывание с вирусным S-белком [78]. Даже с
растворимости пептида и отсутствии нейтра-
учётом мутаций вирус обладает ограниченным
лизующего эффекта против вируса. Аминокис-
потенциалом избегать нейтрализации, опосре-
лотные замены лейцина на тирозин привели
дованной sACE2, без одновременного сниже-
к небольшому снижению спиральности, при
ния сродства к мембранному рецептору ACE2,
этом существенно повысили нейтрализующую
что сделало бы вирус менее вирулентным. Пре-
активность против SARS-CoV-2
(100%-ная
парат на основе sACE2 в настоящее время про-
эффективность при добавлении 1 мкM пепти-
ходит фазу II клинических испытаний [79], а
да Р8, Р9 и Р10 при заражении культуры клеток
параллельно несколько групп разработали свои
Calu-3) [85].
варианты sACE2 для создания высокоаффин-
Спиральные участки являются одним из
ных приманок для SARS-CoV-2 [80-82]. Так, с
основных вторичных структурных элементов
помощью глубокого мутагенеза была отобрана
в белок-белковом взаимодействии. Часто эти
растворимая форма АСЕ2, которая наиболее
элементы конформационно нестабильны и
эффективно связывалась с S-белком. В ре-
чувствительны к протеолизу пептидазами. Для
зультате был разработан растворимый рецеп-
преодоления вышеуказанных ограничений мо-
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
715
жет быть проведена пептидная оптимизация,
структуры этих пептидов было выполнено с
в частности, путём включения неприродных
помощью ковалентной химической сшивки,
боковых цепей или других химических моди-
благодаря чему была усилена стабильность
фикаций. Для усиления α-спиральной кон-
α-спирали, повышена устойчивость к протео-
формации в пептиде используют неприродные
литическому расщеплению и, таким образом,
аминокислоты, которые лежат на одной и той
увеличивалась эффективность блокировки.
же поверхности спирали. Эти неприродные
Так, пептиды NYBSP-1 (TIEEQAKT-X-LDK-
аминокислоты затем соединяются вместе с
X-NHEAEDLFYQ-X-SLA-X-WN) и NYBSP-4
помощью углеводородных боковых цепей или
(TIEEQ-Z-KTFLDK-X-NHEAEDLFYQ-X-
дисульфидных мостиков и могут быть кова-
SLA-X-WN) продемонстрировали нейтрали-
лентно связаны. «Сшитые» (stapled) пептиды
зующую активность против псевдовирусных
демонстрируют значительно улучшенную фар-
частиц на 80-90% в зависимости от концентра-
макологическую эффективность, повышенное
ции. Отметим, что нами были подтверждены
сродство к мишеням и устойчивость к протео-
результаты этой работы.
литическому расщеплению. По сравнению с
Кроме того, российской группой ис-
низкомолекулярными лекарственными сред-
следователей были сконструированы и из-
ствами, которые часто продуцируют токсич-
учены химерные пептиды Х1 и Х2 (табл. 2)
ные метаболиты, пептиды показывают лучшее
на основе двух линейных пептидов h1
связывание из-за их способности взаимодей-
(IEEQAKTFLDKFNHEAEDLFYk) и h2
ствовать с большими поверхностями белков с
(DKWSAFLKEQSTIAQNleYPLQECI), в состав
большей селективностью и меньшей токсич-
которых включены D-аминокислоты (в пептид-
ностью [86, 87]. Так, попытка химической ста-
ной последовательности выделены жирным
билизации пептидов для поддержания их спи-
шрифтом). Линейные пептиды h1 и h2 соответ-
ральной структуры была предпринята в работе
ствовали фрагментам 21-42 и 64-88 аминокис-
Morgan et al. [88]. Для определения положения
лотных последовательностей спиралей α1 и α2
углеводной скобы они ориентировались на из-
внеклеточного домена ACE2 соответственно.
гиб α1-спирали АСЕ2 относительно положения
В их последовательности были сохранены неиз-
гистидина - H34. Такие скобы были размеще-
менными большинство аминокислотных остат-
ны по обе стороны гистидина, а также поперёк
ков, участвующих во взаимодействии с RBD, но
него. Было сконструировано несколько сши-
молекулы X1 и X2 отличались друг от друга ло-
тых пептидов, среди которых пептид под но-
кализацией дисульфидных мостиков. Химерная
мером 8 (IEEQAKTFLDKFNHER8EDLFYQS5)
молекула X1 представляла собой дисульфидный
показал самый высокий уровень спирально-
димер, в котором концевые остатки цистеина
сти - 72%, но при этом даже он не блокировал
в молекулах-предшественниках h1 и h2 были
проникновение вируса SARS-CoV-2 в опыте
соединены S-S-связью. В структуре молеку-
in vitro. Эта группа также использовала сши-
лы Х2 дисульфидные мостики располагались в
тые пептиды, одним из которых был пептид
середине каждого из пептидов-предшественни-
G-link (IEEQAKTFLDKFNHEAEDLFYQSS-
ков. Однако в системе in vitro c использованием
G-LGKGDFR), который в работе других иссле-
клеток Vero и вируса SARS-CoV-2 ни один из
дователей показывал нейтрализацию корона-
этих пептидов не показал заметной нейтрали-
вируса SARS-CoV, но в работе Morgan et al. [88]
зации вируса [90]. Нашей группой было прове-
защитного эффекта не детектировалось. Неза-
дено аналогичное исследование с использова-
висимо, другая группа [89] разработала панель
нием 32-членного синтетического пептида Р1
более длинных 26-членных сшитых пептидов на
(STIEEQAKTFLDKFNHEAEDLFYQSSLAS
основе последовательности ACE2-рецептора.
WNY), полностью включающего ту же α1-спи-
Три таких пептида показали заметную нейтра-
раль, и 80-членного рекомбинантного пепти-
лизацию in vitro в системе, в которой псевдови-
да Р2 (MSTIEEQAKTFLDKFNHEAEDLFYQS
русы, несущие S-белок SARS-CoV-2 и люцифе-
SLASWNYNTNITEENVQNMNNAGDKWSAF
разную метку, взаимодействовали с клетками в
LKEQSTLAQMYPLQEIQNLTVKLQLQALQHH
культуре, на мембране которых был сверхэкс-
HHHH), включающего обе спирали α1 и α2, а
прессирован рецептор АСЕ2. Функционируя
также их производных, основанных на анали-
в качестве приманки сайта связывания ACE2
зе участков контакта домена АСЕ2, связываю-
с SARS-CoV-2, эти сшитые пептиды обладали
щего RBD S-белка [91]. Эти пептиды хорошо
блокирующим потенциалом [89]. Скрепление
связывались с S-белком вируса в иммунофер-
БИОХИМИЯ том 87 вып. 6 2022
716
КРУТЬ и др.
ментном анализе, однако в опытах по нейтра-
снижению эффективности проникновения ви-
лизации, как в псевдовирусной системе, так и с
руса, хотя это также может привести к сниже-
живым вирусом SARS-CoV-2, не препятствова-
нию расщепления эндогенных субстратов [94].
ли проникновению вируса в клетки НЕК293Т/
Для блокировки проникновения вируса в клет-
АСЕ2 и Vero, что согласуется с выводами работ
ку можно ингибировать функции TMPRSS2,
Morgan et al. [88] и Bibilashvili et al. [90], но про-
используя пептиды, содержащие аргинин [95]
тиворечит работе Curreli et al. [89].
или гидрофобные аминокислоты (в частности,
Наконец, ещё одной группой [92] были
изолейцин) для блокирования гидрофобного
синтезированы и изучены короткие пептид-
кармана на S1-субъединице S-белка, который
ные ингибиторы, потенциально блокирующие
связывается с протеазой [96]. Важно отметить,
взаимодействие S-белков коронавируса с ре-
что при генетическом нокауте TMPRSS2 у мы-
цептором ACE2. Выяснилось, что 17 из 20 а.о.
шей не наблюдается явных фенотипических
в молекуле ACE2, контактирующих с RBD ви-
отклонений, что делает эту модель удобной для
русов SARS-CoV и SARS-CoV-2, совпадают.
доклинических исследований. Стратегия инги-
Было идентифицировано два пептида - SAP1
бирования протеазы TMPRSS2 уже была испы-
(27-TFLDKFNHEAEDLFYQ-42) и SAP6
тана против заражения клеток вирусом гриппа
(37-EDLFYQ-42), которые в опытах in vitro ин-
[97], при этом в системе in vitro были исследо-
гибировали проникновение вируса в клетки.
ваны гидрофобные деканоилированные ми-
Особенно интересным является пептид SAP6,
метические пептидные ингибиторы. Так, был
который содержит минимальную консенсусную
синтезирован конъюгированный с пептидом
последовательность EDLFYQ - всего 6 амино-
фосфородиамидатный морфолиновый оли-
кислот из N-концевой α1-спирали ACE2 [92].
гомер (PPMO), действие которого приводило
С учётом отрицательных данных по блокиров-
к экспрессии неполной и неактивной формы
ке, независимо полученных разными группами
фермента TMPRSS2, что помогало избежать
(за исключением работы Curreli et al. [89]), эти
инфицирования клеток вирусом [97, 98].
результаты для таких коротких пептидов пред-
ставляются сомнительными. Кроме того, были
изучены небольшие анти-АСЕ2-пептиды, ди-
ПЕПТИДНЫЕ ВАКЦИНЫ
меризация которых усиливала нейтрализую-
щую активность против SARS-CoV-2, при этом
Первая демонстрация того, что пептиды
из 26 разработанных пептидов значительная
могут вызывать защитный иммунитет in vivo
доля оказывала влияние на биологическую ак-
в дополнение к нейтрализующей активности
тивность рекомбинантного АСЕ2 человека. Тем
in vitro, была получена в 1982 г. с использова-
не менее пептид CPS4 (NNYLWWMTEYHD) и
нием вируса ящура на животных [99], хотя эти
его димер эффективно блокировали вход ви-
разработки не получили дальнейшего приме-
руса в клетку, но при этом не влияли на функ-
нения в ветеринарии. Одной из первых была
циональную активность АСЕ2 [93]. Отметим,
разработана пептидная вакцина для собак
что ни для одного из обсуждаемых пептидов не
против собачьего парвовируса, который отно-
было представлено результатов по их активно-
сится к семейству Parvoviridae и представля-
сти in vivo (табл. 2).
ет собой небольшой непокрытый оболочкой
TMPRSS2. Слияние вирусной и клеточ-
одноцепочечный ДНК-вирус. Капсид этого
ных мембран обеспечивает сериновая протеаза
вируса состоит из трёх разных белковых субъ-
TMPRSS2 - белок на клеточной поверхности,
единиц (VP), которые именуют VP1, VP2 и VP3.
который экспрессируется в различных органах
Была идентифицирована последовательность
и тканях человека, включая дыхательные пути,
из 37 аминокислот в N-концевом участке VP2,
предстательную железу и желудочно-кишеч-
которая была идентична в пробах заражён-
ный тракт. Протеазная активность TMPRSS2
ных животных разных видов (коты, норки и
способствует активации вирусных гликопроте-
еноты). На основании этой последовательно-
инов, прогрессированию рака предстательной
сти для иммунизации были выбраны 2 пепти-
железы и расщеплению эндогенных субстратов,
да:
1L15 (MSDGAVQPDGGQPAV) и
7L15
среди которых можно выделить рецептор PAR-
(QPDGGQPAVRNERAT), их конъюгировали
2, который модулирует воспалительные ре-
с KLH (Keyhole Limpet Hemocyanin) и успешно
акции, ожирение, метаболизм и рак. Инги-
иммунизировали собак [100]. После успеха та-
бирование экспрессии TMPRSS2 приводит к
кой вакцины продолжился поиск возможности
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
717
Таблица 2. Пептиды, нацеленные на блокировку взаимодействия S-белка вируса SARS-CoV-2 с клеточным рецептором
АСЕ2
Оценка
Возможное
Название
Аминокислотная
нейтрализующей
Происхождение
применение,
Ссылка
пептида
последовательность
активности вируса
комментарий
SARS-CoV-2
in vitro нейтрализующая
активность
N-концевой
не проверена,
блокатор S
IEEQAKTFLDKFNHEAE
участок
взаимодействие с RBD
SBP1
(RBD)-ACE2-
[84]
DLFYQS
α1-спирали
вируса SARS-CoV-2 в
взаимодействия
ACE2
искусственной системе
было отмечено при
концентрации 45 нM
высокая
N-концевой
блокатор S
нейтрализующая in vitro
SALEEQLKTFLDKFMHELEDL
участок
Р8
(RBD)-ACE2-
активность (100%-ная
[85]
LYQLAL
α1-спирали
взаимодействия
эффективность при
ACE2
концентрации 1 мкM)
высокая
N-концевой
блокатор S
нейтрализующая in vitro
SALEEQYKTFLDKFMHELEDL
участок
P9
(RBD)-ACE2-
активность (100%-ная
[85]
LYQLSL
α1-спирали
взаимодействия
эффективность при
ACE2
концентрации 1 мкM)
высокая
N-концевой
блокатор S
нейтрализующая in vitro
SALEEQYKTFLDKFMHELEDL
участок
P10
(RBD)-ACE2-
активность (100%-ная
[85]
LYQLAL
α1-спирали
взаимодействия
эффективность при
ACE2
концентрации 1 мкM)
N-концевой
отсутствие in vitro
блокатор S
IEEQAKTFLDKFNHER8EDL
участок
нейтрализующей
8
(RBD)-ACE2-
[88]
FYQS5
α1-спирали
активности (от 0,1
взаимодействия
ACE2
до 1 мM)
N-концевой
отсутствие in vitro
блокатор S
IEEQAKTFLDKFNHEAEDLFY
участок
нейтрализующей
G-link
(RBD)-ACE2-
[88]
QSS-G-LGKGDFR
α1-спирали
активности (от 0,1
взаимодействия
ACE2
до 1 мM)
N-концевой
отсутствие in vitro
блокатор S
G-link
IR8EQAKTFS5DKFNHEAEDLFY
участок
нейтрализующей
(RBD)-ACE2-
[88]
«сшитый»
QSS-G-LGKGDFR
α1-спирали
активности (от 0,1
взаимодействия
ACE2
до 1 мM)
высокая
N-концевой
нейтрализующая
блокатор S
TIEEQAKT-X-LDK-X-NHE
участок
активность в
NYBSP-1
(RBD)-ACE2-
[89]
AEDLFYQ-X-SLA-X-WN
α1-спирали
псевдовирусной
взаимодействия
ACE2
системе:
IC50 = 4,1 ± 0,26 мкM
высокая
N-концевой
нейтрализующая
блокатор S
TIEEQ-Z-KTFLDK-X-NHE
участок
активность в
NYBSP-4
(RBD)-ACE2-
[89]
AEDLFYQ-X-SLA-X-WN
α1-спирали
псевдовирусной
взаимодействия
ACE2
системе:
IC50 = 1,97 ± 0,14 мкM
БИОХИМИЯ том 87 вып. 6 2022
718
КРУТЬ и др.
Окончание таблицы 2
Оценка
Возможное
Название
Аминокислотная
нейтрализующей
Происхождение
применение,
Ссылка
пептида
последовательность
активности вируса
комментарий
SARS-CoV-2
взаимодействие с RBD
cEEQAKTFLDKFNHEAEDLFYk
вируса SARS-CoV-2 в
две N-концевых
блокатор S
S-S
искусственной системе
Х1
α-спирали
(RBD)-ACE2-
[90]
DKWSAFLKEQSTIAQNleYPLQE
(1-10 мкM), отсутствие
ACE2
взаимодействия
CI
нейтрализующей
активности in vitro
взаимодействие с RBD
вируса SARS-CoV-2 в
IEEQAKTFLDKFNHQAEDLFYk
две N-концевых
блокатор S
искусственной системе
X2
CO(CH2)2S-S
α-спирали
(RBD)-ACE2-
[90]
(1-10 мкM), отсутствие
DKWSAFLKECSTIAQIYPLQEI
ACE2
взаимодействия
нейтрализующей
активности in vitro
взаимодействие с RBD
N-концевая
блокатор S
STIEEQAKTFLDKFNHEAEDL
вируса SARS-CoV-2 в
Р1
α1-спираль
(RBD)-ACE2-
[91]
FYQSSLASWNY
искусственной системе
ACE2
взаимодействия
(min 0,46 мкM)
MSTIEEQAKTFLDKFNHE
взаимодействие с RBD
AEDLFYQSSLASWNYNTNI
две N-концевых
блокатор S
вируса SARS-CoV-2 в
Р2
TEENVQNMNNAGDKWSA
α-спирали
(RBD)-ACE2-
[91]
искусственной системе
FLKEQSTLAQMYPLQEIQNLT
ACE2
взаимодействия
(min 0,064 мкM)
VKLQLQALQHHHHHH
высокая
N-концевой
нейтрализующая
блокатор S
участок
активность в
SAP1
TFLDKFNHEAEDLFYQ
(RBD)-ACE2-
[92]
α1-спирали
псевдовирусной
взаимодействия
ACE2
системе:
IC50 = 2,39 ± 0,20 мM
высокая
N-концевой
нейтрализующая
блокатор S
участок
активность в
SAP6
EDLFYQ
(RBD)-ACE2-
[92]
α1-спирали
псевдовирусной
взаимодействия
ACE2
системе:
IC50 = 1,90 ± 0,14 мM
блокировка SARS-
CPS4
CoV-2/RBD-ACE2-
NNYLWWMTEYHD
ACE2-рецептор
анти-АСЕ2
[93]
димер
взаимодействия,
IC50 = 31 нM
Примечание: для пептидов 8 и G-link «сшитый» подстрочные цифры обозначают места химических стабилизаций
спирали; X = S-2-(4-пентенил) аланин; Z = -(R)-2-(7-октенил) аланин; S-S - дисульфидная связь; для пептидов Х1 и Х2
модификации выделенные жирным шрифтом обозначают D-аминокислоты, участвующие в стабилизации пептида с по-
мощью дисульфидной связи.
получения более иммуногенного пептида из
генных эпитопов вируса были выбраны после-
N-концевого участка VP2, что привело к разви-
довательности 12 пептидов длиной не более
тию применения пептидных вакцин в будущем,
10-13 аминокислот:
в том числе и в ветеринарии [101-103].
1 - MDEFIERYKLEGY (ORF1ab),
Abduljaleel et al. [30] было проведено иссле-
2 - PYEDFQENWNTKH (ORF1a),
дование, в котором для разработки пептидной
3 - LQDVVNQNAQALN (S-белок),
вакцины против SARS-CoV-2 на основе анти-
4 - YDYCIPYNSVTSS (ORF3a),
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
719
Таблица 3. Пептиды, входящие в состав профилактических вакцин против SARS-CoV-2
Аминокислотная
Происхождение (позиции в структуре
Возможное
Название пептида
Ссылка
последовательность
вируса)
применение
Т-клеточная
домен структурного белка
P1_nuc
ASWFTALTQHGKEDL
пептидная
[31]
нуклеокапсида SARS-CoV-2 (50-64)
вакцина
Т-клеточная
домен структурного белка
P2_nuc
LLLLDRLNQLESKMS
пептидная
[31]
нуклеокапсида SARS-CoV-2 (221-235)
вакцина
Т-клеточная
P3_spi
ITRFQTLLALHRSYL
домен S-белка SARS-CoV-2 (235-249)
пептидная
[31]
вакцина
Т-клеточная
домен белка оболочки SARS-CoV-2
P4_env
FYVYSRVKNLNSSRV
пептидная
[31]
(56-70)
вакцина
Т-клеточная
домен мембранного белка SARS-CoV-2
P5_mem
LSYYKLGASQRVAGD
пептидная
[31]
(176-190)
вакцина
Т-клеточная
белок, кодируемый ORF8 вируса SARS-
P6_ORF8
SKWYIRVGARKSAPL
пептидная
[31]
CoV-2 (43-57)
вакцина
ЭпиВакКорона
RLFRKSNLKPFERD-
пептидная
участок RBD S-белка (454-477)
[32, 33]
(пептид №1)
ISTEIYQAGS
вакцина
ЭпиВакКорона
KEIDRLNEVAKNL-
трансмембранный домен S-белка (1181-
пептидная
[32, 33]
(пептид №2)
NESLIDLQE
1211)
вакцина
ЭпиВакКорона
KNLNESLIDLQEL-
трансмембранный домен S-белка (1181-
пептидная
[32, 33]
(пептид №3)
GKYEQYIK
1211)
вакцина
5 - YVYSRVKNLNSSR (E-белок),
Т-лимфоциты обладают частичной протек-
6 - NGTITVEELKKLL (М-белок),
тивной функцией даже при отсутствии анти-
7 - TENKYSQLDEEQP (ORF6),
тел и предотвращают развитие тяжёлых форм
8 - SPKLFIRQEEVQE (ORF7a),
заболевания [104]. При этом, в отличие от
9 - FSLELQDHNETCH (ORF7b),
нейтрализующих антител, цитолитические
10 - FYEDFLEYHDVRV (ORF8),
Т-лимфоциты для выполнения своей эффек-
11 - DQELIRQGTDYKH (N-белок),
торной функции могут распознавать эпитопы
12 - SRNYIAQVDVVNF (ORF10).
из любых антигенов SARS-CoV-2, а не только
Каждый пептид был соединён линкера-
из S-белка. В исследовании Heitmann et al. [31]
ми
«GPGPG», чтобы обеспечить про-
здоровых добровольцев иммунизировали
странственное разделение эпитопов и об-
смесью из
6 линейных
15-членных пепти-
легчить иммунной системе процессинг
дов: P1_nuc (ASWFTALTQHGKEDL), P2_nuc
антигенов. Пептидный адъювант был присо-
(LLLLDRLNQLESKMS), P3_spi (ITRFQTL
единен к N-концу конструкции с помощью
LALHRSYL), P4_env (FYVYSRVKNLNSSRV),
линкера «EAAAK», чтобы усилить длительный
P5_mem(LSYYKLGASQRVAGD),P6_ORF8(SKW
иммунный ответ. Конечная конструкция со-
YIRVGARKSAPL), представляющих собой
стояла из ~156 аминокислот с молекулярной
фрагменты структурных: S-, N-, M- и Е-бел-
массой ~18,72 кДа.
ков, а также одного неструктурного белка -
Недавно были опубликованы результа-
ORF8 (табл. 3). В качестве одного из компо-
ты фазы I клинических испытаний перспек-
нентов адъюванта использовали
9-членный
тивной пептидной вакцины против SARS-
пептид с липидной модификацией на N-кон-
CoV-2, которая направлена на активацию
це, который является мощным агонистом ге-
Т-клеточного иммунитета [31]. Известно, что
теродимерного рецептора врождённого имму-
БИОХИМИЯ том 87 вып. 6 2022
720
КРУТЬ и др.
нитета TLR1/TLR2 [105]. Изюминка работы
ственных вакцин от варианта вируса Дельта
состояла в выборе пептидов, основанном на
эффективность ЭпиВакКороны была постав-
предыдущих работах той же группы [106, 107],
лена под сомнение [108].
которые были подобраны таким образом, что
В ряде работ были описаны и другие пеп-
внутри аминокислотных последовательно-
тиды, представляющие собой иммуногенные
стей, презентирующихся молекулами главного
Т-клеточные эпитопы [106, 109, 110]. Так, не-
комплекса гистосовместимости (МНС) клас-
давнее систематическое исследование иммуно-
са II (DRB), содержались вложенные пепти-
генности панели пептидов, презентирующихся
ды, презентирующиеся частыми аллельными
с участием наиболее частых аллелей МНС, вы-
вариантами МНС класса I. Иммунный ответ
явило несколько десятков эпитопов, ответ на
со стороны Т-лимфоцитов был детектирован
которые после болезни или вакцинации раз-
у всех участников клинического исследования.
вивается у большинства носителей конкретно-
Кроме того, было показано, что он сохраняется
го аллельного варианта МНС [111]. Подобная
на протяжении всего исследования (3 месяца)
панель пептидов может быть использована для
и по силе превосходит ответ, развивающийся в
определения Т-клеточного иммунного ответа у
результате перенесённой инфекции.
переболевших и вакцинированных и для ана-
Известно, что для получения хорошего им-
лиза его стойкости. Интересно, что эти Т-кле-
мунного ответа на пептиды у животных или че-
точные эпитопы лишь минимально затронуты
ловека полезно конъюгировать пептиды с бел-
мутациями в распространённых вариантах ви-
ком-носителем, а также применять адъюванты.
руса, так что на основе этих эпитопов разумно
Так, разработчики отечественной пептидной
разрабатывать новые вакцины, направленные
вакцины использовали подобную стратегию
на индукцию Т-клеточного ответа.
на основе консервативных последовательно-
стей S-белка SARS-CoV-2, что, предположи-
тельно, могло повысить устойчивость вакци-
ЗАКЛЮЧЕНИЕ
ны к возможным мутациям вируса (табл. 3).
Были выбраны и химически синтезированы
Мы рассмотрели возможное использо-
семь пептидов длиной 20-31 а.о., несущих
вание синтетических пептидов для борьбы с
предполагаемые линейные B-клеточные эпи-
пандемией COVID-19. Большая часть предла-
топы S-белка. В качестве белка-носителя был
гаемых стратегий относится к диагностике и
выбран химерный рекомбинантный белок -
профилактике инфекции, вызванной вирусом
MBP-6xHis-N_nCoV-2019, содержащий зна-
SARS-CoV-2. Во-первых, это различные стра-
чительную часть N-белка вируса SARS-CoV-2
тегии, направленные на блокировку входа ви-
и белок MBP из Escherichia coli, являющийся
руса в клетку. Во-вторых, это использование
продуктом экспрессии в прокариотической
пептидов при конструировании профилакти-
системе, а в качестве адъюванта использовали
ческих вакцин. Что касается блокировки входа
гидроксид алюминия. Далее для конъюгации
вируса, мнение авторов состоит в том, что син-
были отобраны три наиболее иммуногенных
тетические пептиды при всей их привлекатель-
пептида:
RLFRKSNLKPFERDISTEIYQAGS
ности (например, в составе профилактической
(соответствует участку рецептор-связываю-
ингаляционной формы) едва ли смогут кон-
щего мотива S-белка вируса SARS-CoV-2),
курировать с моноклональными антителами и
KEIDRLNEVAKNLNESLIDLQE и KNLNES
высокоаффинными растворимыми рецепто-
LIDLQELGKYEQYIK (соответствуют участку
рами-приманками. Синтез «сшитых» пепти-
трансмембранного домена S-белка). Эти три
дов (табл. 2), которые способны блокировать
пептидо-белковых конъюгата, смешанные в
вход вируса, исключительно дорог. Таким об-
соотношении 1/1/1 и адсорбированные на гид-
разом, едва ли COVID-19 будет побеждён с по-
роксиде алюминия, и входят в состав вакцины
мощью таких пептидов. Что касается пептид-
ЭпиВакКорона [32, 33]. Отметим, что локали-
ных вакцин, то весьма высокой представляется
зация В-клеточных эпитопов, определённых в
вероятность успеха многообещающих Т-кле-
независимых исследованиях [30], не совпадает
точных вакцин, которые находятся на ранних
с положением указанных пептидов. Данные о
стадиях клинических испытаний. Хотя пока
фазе III клинических испытаний этой вакцины
нет убедительной информации об эффектив-
пока не опубликованы, но в недавнем сравни-
ности пептидных В-клеточных вакцин, это на-
тельном исследовании эффективности отече-
правление также имеет перспективу.
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
721
Финансирование. Работа выполнена при
работе, а также Р.А. Абагяна, И.В. Ямпольского
финансовой поддержке АНО ВО Научно-тех-
и Г.А. Малеева за полезные обсуждения.
нологический университет Сириус (про-
Конфликт интересов. Л.И.К. - сотрудник
ект № ИМБ-НИР-2103), Российского фон-
организации ФГАНУ
«ФНЦИРИП имени
да фундаментальных исследований (грант
М.П. Чумакова РАН», которая является разра-
№
20-04-60338) и Министерства нау-
ботчиком и производителем вакцины против
ки и высшего образования (дополнитель-
коронавирусной инфекции КовиВак.
ное соглашение
№ 075-03-2021-448/3, тема
Соблюдение этических норм. Настоящая
№ 121122300151-5).
статья не содержит экспериментальных дан-
Благодарности.
Авторы
благодарят
ных, полученных с использованием людей или
А.А. Ишмухаметова за поддержку и интерес к животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Shereen, M. A., Khan, S., Kazmi, A., Bashir, N.,
10. Tegally, H., Wilkinson, E., Giovanetti, M.,
and Siddique, R.
(2020) COVID-19 infection:
Iranzadeh, A., Fonseca, V., et al. (2021) Detection
Origin, transmission, and characteristics of
of a SARS-CoV-2 variant of concern in South Africa,
human coronaviruses, J. Adv. Res.,
24,
91-98,
Nature,
592,
438-443, doi:
10.1038/s41586-021-
doi: 10.1016/j.jare.2020.03.005.
03402-9.
2. Wang, N., Shang, J., Jiang, S., and Du, L. (2020)
11. Muik, A., Wallisch, A. K., Sänger, B., Swanson,
Subunit vaccines against emerging pathogenic
K. A., Mühl, J., et al. (2021) Neutralization of SARS-
human coronaviruses, Front. Microbiol.,
11,
298,
CoV-2 lineage B.1.1.7 pseudovirus by BNT162b2
doi: 10.3389/fmicb.2020.00298.
vaccine-elicited human sera, Science, 371, 1152-1153,
3. Du, L., He, Y., Zhou, Y., Liu, S., Zheng, B. J., and
doi: 10.1126/science.abg6105.
Jiang, S. (2009) The spike protein of SARS-CoV —
12. Davies, N. G., Abbott, S., Barnard, R. C., Jarvis,
a target for vaccine and therapeutic development,
C. I., Kucharski, A. J., et al.
(2021) Estimated
Nat. Rev. Microbiol.,
7,
226-236, doi:
10.1038/
transmissibility and impact of SARS-CoV-2 lineage
nrmicro2090.
B.1.1.7 in England, Science,
372, doi:
10.1126/
4. Zhou, P., Yang, X. L., Wang, X. G., Hu, B.,
science.abg3055.
Zhang, L., et al. (2020) A pneumonia outbreak
13. Yan, R., Zhang, Y., Li, Y., Xia, L., Guo, Y., and
associated with a new coronavirus of probable bat
Zhou, Q. (2020) Structural basis for the recognition
origin, Nature, 579, 270-273, doi: 10.1038/s41586-
of SARS-CoV-2 by full-length human ACE2, Science,
020-2012-7.
367, 1444-1448, doi: 10.1126/science.abb2762.
5. Wrapp, D., Wang, N., Corbett, K. S., Goldsmith,
14. Belouzard, S., Chu, V. C., and Whittaker, G. R.
J. A., Hsieh, C. L., et al. (2020) Cryo-EM structure of
(2009) Activation of the SARS coronavirus spike
the 2019-nCoV spike in the prefusion conformation,
protein via sequential proteolytic cleavage at two
Science, 367, 1260-1263, doi: 10.1126/science.abb2507.
distinct sites, Proc. Natl. Acad. Sci. USA, 106, 5871-
6. Ortega, J. T., Serrano, M. L., Pujol, F. H., and
5876, doi: 10.1073/pnas.0809524106.
Rangel, H. R. (2020) Role of changes in SARS-CoV-2
15. Barrett, C. T., Neal, H. E., Edmonds, K., Moncman,
spike protein in the interaction with the human ACE2
C. L., Thompson, R., et al. (2021) Effect of clinical
receptor: An in silico analysis, EXCLI J., 19, 410-417,
isolate or cleavage site mutations in the SARS-
doi: 10.17179/excli2020-1167.
CoV-2 spike protein on protein stability, cleavage,
7. Amicone, M., Borges, V., Alves, M. J., Isidro, J., Zé-
and cell-cell fusion, J. Biol. Chem., 297, 100902,
Zé, L., et al. (2021) Mutation rate of SARS-CoV-2
doi: 10.1016/j.jbc.2021.100902.
and emergence of mutators during experimental
16. Singh, J., Rahman, S. A., Ehtesham, N. Z., Hira, S.,
evolution, bioRxiv, doi: 10.1101/2021.05.19.444774.
and Hasnain, S. E. (2021) SARS-CoV-2 variants of
8. Volz, E., Mishra, S., Chand, M., Barrett, J. C.,
concern are emerging in India, Nat. Med., 27, 1131-
Johnson, R., et al. (2021) Assessing transmissibility of
1133, doi: 10.1038/s41591-021-01397-4.
SARS-CoV-2 lineage B.1.1.7 in England, Nature, 593,
17. Borisova, N. I., Kotov, I. A., Kolesnikov, A. A., Kaptelova,
266-269, doi: 10.1038/s41586-021-03470-x.
V. V., Speranskaya, A. S., et al. (2021) Monitoring
9. Wibmer, C. K., Ayres, F., Hermanus, T.,
the spread of the SARS-CoV-2 (Coronaviridae:
Madzivhandila, M., Kgagudi, P., et al. (2021) SARS-
Coronavirinae:
Betacoronavirus;
Sarbecovirus)
CoV-2 501Y. V2 escapes neutralization by South
variants in the Moscow region using targeted high-
African COVID-19 donor plasma, Nat. Med., 27, 622-
throughput sequencing [in Russia], Vopr. Virusol., 66,
625, doi: 10.1038/s41591-021-01285-x.
269-278, doi: 10.36233/0507-4088-72.
3
БИОХИМИЯ том 87 вып. 6 2022
722
КРУТЬ и др.
18. Kumar, S., Thambiraja, T. S., Karuppanan, K., and
30. Abduljaleel, Z., Al-Allaf, F. A., and Aziz, S. A.
Subramaniam, G. (2021) Omicron and Delta variant
(2021) Peptides-based vaccine against SARS-nCoV-2
of SARS-CoV-2: A comparative computational
antigenic fragmented synthetic epitopes recognized
study of spike protein, J. Med. Virol., doi: 10.1002/
by T cell and β-cell initiation of specific antibodies
jmv.27526.
to fight the infection, Biodes. Manuf., 4, 490-505,
19. Gong, S. Y., Chatterjee, D., Richard, J., Prévost, J.,
doi: 10.1007/s42242-020-00114-3.
Tauzin, A., et al.
(2021) Contribution of single
31. Heitmann, J. S., Bilich, T., Tandler, C., Nelde, A.,
mutations to selected SARS-CoV-2 emerging
Maringer, Y., et al. (2021) A COVID-19 peptide
variants spike antigenicity, Virology, 563, 134-145,
vaccine for the induction of SARS-CoV-2 T cell
doi: 10.1016/j.virol.2021.09.001.
immunity, Nature,
601,
617-622, doi:
10.1038/
20. Jhun, H., Park, H. Y., Hisham, Y., Song, C. S.,
s41586-021-04232-5.
and Kim, S. (2021) SARS-CoV-2 Delta (B. 1.617.2)
32. Ryzhikov, A. B., Ryzhikov, E. A., Bogryantseva,
Variant: A unique T478K mutation in receptor
M. P., Danilenko, E. D., Imatdinov, I. R., et al.
binding motif (RBM) of spike gene, Immune Netw.,
(2021) Immunogenicity and protectivity of the
21, e32, doi: 10.4110/in.2021.21.e32.
Peptide Vaccine against SARS-CoV-2, Ann. Russ.
21. Gao, Q., Bao, L., Mao, H., Wang, L., Xu, K.,
Acad. Med. Sci., 76, 5-19, doi: 10.15690/vramn1528.
et al. (2020) Development of an inactivated vaccine
33. Ryzhikov, A. B., Ryzhikov, E. A., Bogryantseva,
candidate for SARS-CoV-2, Science,
369,
77-81,
M. P., Usova, S. V., Danilenko, E. D., et al. (2021)
doi: 10.1126/science.abc1932.
A single blind, placebo-controlled randomized study
22. Rauch, S., Jasny, E., Schmidt, K. E., and Petsch, B.
of the safety, reactogenicity and immunogenicity
(2018) New vaccine technologies to combat outbreak
of the “EpiVacCorona” Vaccine for the prevention
situations, Front. Immunol., 9, 1963, doi: 10.3389/
of COVID-19, in volunteers aged
18-60 years
fimmu.2018.01963.
(phase I-II), Russ. J. Infect. Immun., 11, 283-296,
23. Corbett, K. S., Edwards, D. K., Leist, S. R., Abiona,
doi: 10.15789/2220-7619-ASB-1699.
O. M., Boyoglu-Barnum, S., et al. (2020) SARS-
34. Watanabe, M., Omahdi, Z., and Yamasaki, S.
CoV-2 mRNA vaccine design enabled by prototype
(2020) Direct binding analysis between C-type
pathogen preparedness, Nature,
586,
567-571,
lectins and glycans using immunoglobulin receptor
doi: 10.1038/s41586-020-2622-0.
fusion proteins, Methods Mol. Biol., 2132, 119-128,
24. Folegatti, P. M., Ewer, K. J., Aley, P. K., Angus, B.,
doi: 10.1007/978-1-0716-0430-4_12.
Becker, S., et al. (2020) Safety and immunogenicity
35. Walls, A. C., Park, Y. J., Tortorici, M. A.,
of the ChAdOx1 nCoV-19 vaccine against SARS-
Wall, A., McGuire, A. T., et al. (2020) Structure,
CoV-2: a preliminary report of a phase 1/2, single-
function, and antigenicity of the SARS-CoV-2
blind, randomised controlled trial, Lancet, 396, 467-
spike glycoprotein, Cell,
181,
281-292.e286,
478, doi: 10.1016/s0140-6736(20)31604-4.
doi: 10.1016/j.cell.2020.02.058.
25. Logunov, D. Y., Dolzhikova, I. V., Shcheblyakov,
36. Tripet, B., Howard, M. W., Jobling, M., Holmes,
D. V., Tukhvatulin, A. I., Zubkova, O. V., et al.
R. K., Holmes, K. V., et al.
(2004) Structural
(2021) Safety and efficacy of an rAd26 and rAd5
characterization of the SARS-coronavirus spike
vector-based heterologous prime-boost COVID-19
S fusion protein core, J. Biol. Chem., 279, 20836-
vaccine: an interim analysis of a randomised
20849, doi: 10.1074/jbc.M400759200.
controlled phase 3 trial in Russia, Lancet, 397, 671-
37. Li, W., Moore, M. J., Vasilieva, N., Sui, J., Wong,
681, doi: 10.1016/s0140-6736(21)00234-8.
S. K., et al. (2003) Angiotensin-converting enzyme 2
26. Yang, J., Wang, W., Chen, Z., Lu, S., Yang, F., et al.
is a functional receptor for the SARS coronavirus,
(2020) A vaccine targeting the RBD of the S protein
Nature, 426, 450-454, doi: 10.1038/nature02145.
of SARS-CoV-2 induces protective immunity, Nature,
38. Shang, J., Wan, Y., Luo, C., Ye, G., Geng, Q., et al.
586, 572-577, doi: 10.1038/s41586-020-2599-8.
(2020) Cell entry mechanisms of SARS-CoV-2, Proc.
27. Wang, J.
(2021) New strategy for COVID-19
Natl. Acad. Sci. USA, 117, 11727-11734, doi: 10.1073/
vaccination: targeting the receptor-binding domain of
pnas.2003138117.
the SARS-CoV-2 spike protein, Cell Mol. Immunol.,
39. Hussain, M., Jabeen, N., Amanullah, A., Baig, A. A.,
18, 243-244, doi: 10.1038/s41423-020-00584-6.
Aziz, B., et al. (2020) Structural basis of SARS-
28. Tian, J. H., Patel, N., Haupt, R., Zhou, H., Weston, S.,
CoV-2 spike protein priming by TMPRSS2, bioRxiv,
et al. (2021) SARS-CoV-2 spike glycoprotein vaccine
doi: 10.1101/2020.04.21.052639.
candidate NVX-CoV2373 immunogenicity in baboons
40. Hoffmann, M., Kleine-Weber, H., Schroeder, S.,
and protection in mice, Nat. Commun., 12, 372,
Krüger, N., Herrler, T., et al. (2020) SARS-CoV-2
doi: 10.1038/s41467-020-20653-8.
cell entry depends on ACE2 and TMPRSS2 and is
29. Di Natale, C., La Manna, S., De Benedictis, I.,
blocked by a clinically proven protease inhibitor, Cell,
Brandi, P., and Marasco, D. (2020) Perspectives in
181, 271-280.e278, doi: 10.1016/j.cell.2020.02.052.
peptide-based vaccination strategies for syndrome
41. VanPatten, S., He, M., Altiti, A., Cheng, K. F.,
coronavirus
2 pandemic, Front. Pharmacol.,
11,
Ghanem, M. H., et al. (2020) Evidence supporting
578382, doi: 10.3389/fphar.2020.578382.
the use of peptides and peptidomimetics as potential
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
723
SARS-CoV-2 (COVID-19) therapeutics, Future Med.
54. Chen, Y., Guo, Y., Pan, Y., and Zhao, Z. J. (2020)
Chem., 12, 1647-1656, doi: 10.4155/fmc-2020-0180.
Structure analysis of the receptor binding of 2019-
42. Hamming, I., Timens, W., Bulthuis, M. L., Lely,
nCoV, Biochem. Biophys. Res. Commun., 525, 135-
A. T., Navis, G., et al. (2004) Tissue distribution
140, doi: 10.1016/j.bbrc.2020.02.071.
of ACE2 protein, the functional receptor for SARS
55. Xia, S., Zhu, Y., Liu, M., Lan, Q., Xu, W., et al.
coronavirus. A first step in understanding SARS
(2020) Fusion mechanism of 2019-nCoV and fusion
pathogenesis, J. Pathol., 203, 631-637, doi: 10.1002/
inhibitors targeting HR1 domain in spike protein,
path.1570.
Cell. Mol. Immunol.,
17,
765-767, doi:
10.1038/
43. Zhao, Y., Zhao, Z., Wang, Y., Zhou, Y., Ma, Y.,
s41423-020-0374-2.
et al. (2020) Single-cell RNA expression profiling of
56. Xia, S., Liu, M., Wang, C., Xu, W., Lan, Q., et al.
ACE2, the receptor of SARS-CoV-2, Am. J. Respir.
(2020) Inhibition of SARS-CoV-2 (previously 2019-
Crit. Care Med.,
202,
756-759, doi:
10.1164/
nCoV) infection by a highly potent pan-coronavirus
rccm.202001-0179LE.
fusion inhibitor targeting its spike protein that harbors
44. Millet, J. K., and Whittaker, G. R. (2015) Host
a high capacity to mediate membrane fusion, Cell
cell proteases: critical determinants of coronavirus
Res., 30, 343-355, doi: 10.1038/s41422-020-0305-x.
tropism and pathogenesis, Virus Res., 202, 120-134,
57. Smyth, M. S., and Martin, J. H. (2000) X Ray crys-
doi: 10.1016/j.virusres.2014.11.021.
tallography, Mol. Pathol., 53, 8-14, doi: 10.1136/mp.53.1.8.
45. Shulla, A., Heald-Sargent, T., Subramanya, G.,
58. Smith, G. P. (1985) Filamentous fusion phage: novel
Zhao, J., Perlman, S., et al. (2011) A transmembrane
expression vectors that display cloned antigens on the
serine protease is linked to the severe acute respiratory
virion surface, Science, 228, 1315-1317, doi: 10.1126/
syndrome coronavirus receptor and activates virus
science.4001944.
entry, J. Virol., 85, 873-882, doi: 10.1128/jvi.02062-10.
59. Trier, N. H., Hansen, P. R., and Houen, G.
46. Chambers, J. P., Yu, J., Valdes, J. J., and
(2012)
Production and characterization of
Arulanandam, B. P.
(2020)
SARS-CoV-2,
peptide antibodies,
Methods,
56,
136-144,
early entry events, J. Pathog.,
2020,
9238696,
doi: 10.1016/j.ymeth.2011.12.001.
doi: 10.1155/2020/9238696.
60. Lee, A. C., Harris, J. L., Khanna, K. K., and Hong,
47. Gur, M., Taka, E., Yilmaz, S. Z., Kilinc, C.,
J. H. (2019) A comprehensive review on current
Aktas, U., et al. (2020) Conformational transition
advances in peptide drug development and design,
of SARS-CoV-2 spike glycoprotein between its
Int. J. Mol. Sci., 20, doi: 10.3390/ij ms20102383.
closed and open states, J. Chem. Phys., 153, 075101,
61. Rabinowitz, J. A., Lainson, J. C., Johnston, S. A.,
doi: 10.1063/5.0011141.
and Diehnelt, C. W.
(2018) Non-natural amino
48. Xu, C., Wang, Y., Liu, C., Zhang, C., Han, W.,
acid peptide microarrays to discover Ebola virus
et al. (2021) Conformational dynamics of SARS-
glycoprotein ligands, Chem. Commun., 54, 1417-1420,
CoV-2 trimeric spike glycoprotein in complex with
doi: 10.1039/c7cc08242h.
receptor ACE2 revealed by cryo-EM, Sci. Adv., 7,
62. Ingallinella, P., Bianchi, E., Ladwa, N. A., Wang,
doi: 10.1126/sciadv.abe5575.
Y. J., Hrin, R., et al. (2009) Addition of a cholesterol
49. Jackson, C. B., Farzan, M., Chen, B., and Choe, H.
group to an HIV-1 peptide fusion inhibitor
(2022) Mechanisms of SARS-CoV-2 entry into cells,
dramatically increases its antiviral potency, Proc.
Nat. Rev. Mol. Cell Biol., 23, 3-20, doi: 10.1038/
Natl. Acad. Sci. USA, 106, 5801-5806, doi: 10.1073/
s41580-021-00418-x.
pnas.0901007106.
50. Tang, T., Bidon, M., Jaimes, J. A., Whittaker,
63. Pessi, A., Bixler, S. L., Soloveva, V., Radoshitzky, S.,
G. R., and Daniel, S. (2020) Coronavirus membrane
Retterer, C., et al. (2019) Cholesterol-conjugated
fusion mechanism offers a potential target for
stapled peptides inhibit Ebola and Marburg viruses
antiviral development, Antiviral. Res., 178, 104792,
in vitro and in vivo, Antiviral Res., 171, 104592,
doi: 10.1016/j.antiviral.2020.104792.
doi: 10.1016/j.antiviral.2019.104592.
51. Bosch, B. J., van der Zee, R., de Haan, C. A., and
64. Chen, G., Cook, J. D., Ye, W., Lee, J. E., and Sidhu,
Rottier, P. J. (2003) The coronavirus spike protein is a
S. S. (2019) Optimization of peptidic HIV-1 fusion
class I virus fusion protein: structural and functional
inhibitor T20 by phage display, Protein Sci., 28, 1501-
characterization of the fusion core complex, J. Virol.,
1512, doi: 10.1002/pro.3669.
77, 8801-8811, doi: 10.1128/jvi.77.16.8801-8811.2003.
65. Ding, X., Zhang, X., Chong, H., Zhu, Y., Wei, H.,
52. White, J. M., Delos, S. E., Brecher, M., and
Wu, X., et al.
(2017) Enfuvirtide (T20)-based
Schornberg, K. (2008) Structures and mechanisms of
lipopeptide is a potent HIV-1 cell fusion inhibitor:
viral membrane fusion proteins: multiple variations
Implications for viral entry and inhibition, J. Virol.,
on a common theme, Crit. Rev. Biochem. Mol. Biol.,
91, doi: 10.1128/jvi.00831-17.
43, 189-219, doi: 10.1080/10409230802058320.
66. Matsubara, T., Onishi, A., Saito, T., Shimada, A.,
53. Millet, J. K., and Whittaker, G. R.
(2018)
Inoue, H., et al. (2010) Sialic acid-mimic peptides
Physiological and molecular triggers for SARS-CoV
as hemagglutinin inhibitors for anti-influenza
membrane fusion and entry into host cells, Virology,
therapy, J. Med. Chem., 53, 4441-4449, doi: 10.1021/
517, 3-8, doi: 10.1016/j.virol.2017.12.015.
jm1002183.
БИОХИМИЯ том 87 вып. 6 2022
3*
724
КРУТЬ и др.
67. Kadam, R. U., Juraszek, J., Brandenburg, B.,
Lancet Respir. Med., 8, 1154-1158, doi: 10.1016/s2213-
Buyck, C., Schepens, W. B. G., et al. (2017) Potent
2600(20)30418-5.
peptidic fusion inhibitors of influenza virus, Science,
80. Chan, K. K., Dorosky, D., Sharma, P., Abbasi, S. A.,
358, 496-502, doi: 10.1126/science.aan0516.
Dye, J. M., et al. (2020) Engineering human ACE2
68. Shilovskiy, I. P., Andreev, S. M., Kozhikhova, K. V.,
to optimize binding to the spike protein of SARS
Nikolskii, A. A., and Khaitov, M. R. (2019) Prospects
coronavirus 2, Science, 369, 1261-1265, doi: 10.1126/
for the use of peptides against respiratory syncytial
science.abc0870.
virus [in Russian], Mol. Biol. (Mosk), 53, 541-560,
81. Lu, J., and Sun, P. D.
(2020) High affinity
doi: 10.1134/s002689841904013x.
binding of SARS-CoV-2 spike protein enhances
69. Brouwer, P. J. M., Caniels, T. G., van der Straten, K.,
ACE2 carboxypeptidase
activity,
bioRxiv,
Snitselaar, J. L., Aldon, Y., et al. (2020) Potent
doi: 10.1101/2020.07.01.182659.
neutralizing antibodies from COVID-19 patients
82. Glasgow, A., Glasgow, J., Limonta, D., Solomon, P.,
define multiple targets of vulnerability, Science, 369,
Lui, I., et al. (2020) Engineered ACE2 receptor
643-650, doi: 10.1126/science.abc5902.
traps potently neutralize SARS-CoV-2, bioRxiv,
70. Wang, C., Li, W., Drabek, D., Okba, N. M. A., van
doi: 10.1101/2020.07.31.231746.
Haperen, R., Osterhaus, A., et al. (2020) A human
83. Chan, K. K., Tan, T. J. C., Narayanan, K. K., and
monoclonal antibody blocking SARS-CoV-2
Procko, E. (2020) An engineered decoy receptor
infection, Nat. Commun., 11, 2251, doi: 10.1038/
for SARS-CoV-2 broadly binds protein S sequence
s41467-020-16256-y.
variants, bioRxiv, doi: 10.1101/2020.10.18.344622.
71. Sui, J., Li, W., Murakami, A., Tamin, A., Matthews,
84. Zhang, G., Pomplun, S., Loftis, A. R., Tan, X.,
L. J., Wong, S. K., et al. (2004) Potent neutralization
Loas, A., et al.
(2020), Investigation of ACE2
of severe acute respiratory syndrome (SARS)
N-terminal fragments binding to SARS-CoV-2 Spike
coronavirus by a human mAb to S1 protein that
RBD, bioRxiv, doi: 10.1101/2020.03.19.999318.
blocks receptor association, Proc. Natl. Acad. Sci.
85. Karoyan, P., Vieillard, V., Gómez-Morales, L.,
USA, 101, 2536-2541, doi: 10.1073/pnas.0307140101.
Odile, E., Guihot, A., et al. (2021) Human ACE2
72. Walls, A. C., Xiong, X., Park, Y. J., Tortorici,
peptide-mimics block SARS-CoV-2 pulmonary
M. A., Snij der, J., et al.
(2019) Unexpected
cells infection, Commun. Biol., 4, 197, doi: 10.1038/
receptor functional mimicry elucidates activation
s42003-021-01736-8.
of coronavirus fusion, Cell, 176, 1026-1039.e1015,
86. Rezaei Araghi, R., and Keating, A. E.
(2016)
doi: 10.1016/j.cell.2018.12.028.
Designing helical peptide inhibitors of protein-
73. Khavinson, V., Linkova, N., Dyatlova, A.,
protein interactions, Curr. Opin. Struct. Biol., 39, 27-
Kuznik, B., and Umnov, R.
(2020) Peptides:
38, doi: 10.1016/j.sbi.2016.04.001.
prospects for use in the treatment of COVID-19,
87. Ali, A. M., Atmaj, J., Van Oosterwij k, N., Groves,
Molecules, 25, doi: 10.3390/molecules25194389.
M. R., and Dömling, A. (2019) Stapled peptides
74. Kuba, K., Imai, Y., Rao, S., Gao, H., Guo, F.,
inhibitors: A new window for target drug discovery,
et al. (2005) A crucial role of angiotensin converting
Comput. Struct. Biotechnol. J.,
17,
263-281,
enzyme 2 (ACE2) in SARS coronavirus-induced lung
doi: 10.1016/j.csbj.2019.01.012.
injury, Nat. Med., 11, 875-879, doi: 10.1038/nm1267.
88. Morgan, D. C., Morris, C., Mahindra, A., Blair,
75. Mantovani, A., Locati, M., Vecchi, A., Sozzani, S.,
C. M., Tejeda, G., et al. (2021) Stapled ACE2
and Allavena, P. (2001) Decoy receptors: a strategy
peptidomimetics designed to target the SARS-CoV-2
to regulate inflammatory cytokines and chemokines,
spike protein do not prevent virus internalization,
Trends Immunol., 22, 328-336, doi: 10.1016/s1471-
Pept. Sci. (Hoboken), e24217, doi: 10.1002/pep2.24217.
4906(01)01941-x.
89. Curreli, F., Victor, S. M. B., Ahmed, S., Drelich, A.,
76. Dinarello, C. A.
(1997) Interleukin-1, Cytokine
Tong, X., et al. (2020) Stapled Peptides based on
Growth Factor Rev., 8, 253-265, doi: 10.1016/s1359-
human angiotensin-converting enzyme
2 (ACE2)
6101(97)00023-3.
potently inhibit SARS-CoV-2 infection in vitro, mBio,
77. Idriss, H. T., and Naismith, J. H. (2000) TNF
11, doi: 10.1128/mBio.02451-20.
alpha and the TNF receptor superfamily: structure-
90. Bibilashvili, R. S., Sidorova, M. V., Dudkina, U. S.,
function relationship(s), Microsc Res. Tech.,
50,
Palkeeva, M. E., Molokoedov, A. S., et al. (2021)
184-195, doi:
10.1002/1097-0029(20000801)50:3
Peptide inhibitors of the interaction of the SARS-
<184::AID-JEMT2>3.0.CO;2-H.
CoV-2 receptor-binding domain with the ACE2 cell
78. Pinto, D., Park, Y. J., Beltramello, M., Walls, A. C.,
receptor, Biochem. Mosc. Suppl. B Biomed. Chem., 15,
Tortorici, M. A., et al. (2020) Cross-neutralization
274-280, doi: 10.1134/s199075082104003x.
of SARS-CoV-2 by a human monoclonal SARS-
91. Krut, V. G., Astrakhantseva, I. V., Chuvpilo, S. A.,
CoV antibody, Nature, 583, 290-295, doi: 10.1038/
Efimov, G. A., Ambaryan, S. G., et al.
(2021)
s41586-020-2349-y.
Antibodies to the N-terminal domain of angiotensin-
79. Zoufaly, A., Poglitsch, M., Aberle, J. H.,
converting enzyme (ACE2) that block its interaction
Hoepler, W., Seitz, T., et al.
(2020) Human
with SARS-CoV-2 S protein, Dokl. Biochem.
recombinant soluble ACE2 in severe COVID-19,
Biophys., 4, 1-4, doi: 10.1134/S160767292201001X.
БИОХИМИЯ том 87 вып. 6 2022
ПЕПТИДЫ И COVID-19
725
92. Larue, R. C., Xing, E., Kenney, A. D., Zhang, Y.,
102. DiMarchi, R., Brooke, G., Gale, C., Cracknell, V.,
Tuazon, J. A., et al. (2021) Rationally designed
Doel, T., et al. (1986) Protection of cattle against
ACE2-derived peptides inhibit SARS-CoV-2,
foot-and-mouth disease by a synthetic peptide,
Bioconjug. Chem.,
32,
215-223, doi:
10.1021/
Science, 232, 639-641, doi: 10.1126/science.3008333.
acs.bioconjchem.0c00664.
103. Broekhuij sen, M. P., van Rij n, J. M., Blom,
93. Adhikary, P., Kandel, S., Mamani, U. F.,
A. J., Pouwels, P. H., Enger-Valk, B. E., et al.
Mustafa, B., Hao, S., et al. (2021) Discovery of
(1987) Fusion proteins with multiple copies of the
small anti-ACE2 peptides to inhibit SARS-CoV-2
major antigenic determinant of foot-and-mouth
infectivity, Adv. Ther. (Weinh), 2100087, doi: 10.1002/
disease virus protect both the natural host and
adtp.202100087.
laboratory animals, J. Gen. Virol., 68, 3137-3143,
94. Wettstein, L., Kirchhoff, F., and Münch, J.
doi: 10.1099/0022-1317-68-12-3137.
(2022) The transmembrane protease TMPRSS2
104. Rydyznski Moderbacher, C., Ramirez, S. I., Dan,
as a therapeutic target for COVID-19 treatment,
J. M., Grifoni, A., Hastie, K. M., et al.
(2020)
Int. J. Mol. Sci., 23, 1351, doi: 10.3390/ij ms23031351.
Antigen-specific adaptive immunity to SARS-
95. Iwata-Yoshikawa, N., Okamura, T., Shimizu, Y.,
CoV-2 in acute COVID-19 and associations with
Hasegawa, H., Takeda, M., et al. (2019) TMPRSS2
age and disease severity, Cell, 183, 996-1012.e1019,
contributes to virus spread and immunopathology
doi: 10.1016/j.cell.2020.09.038.99.
in the airways of murine models after Coronavirus
105. Rammensee, H. G., Wiesmüller, K. H., Chandran,
infection, J. Virol., 93, doi: 10.1128/jvi.01815-18.
P. A., Zelba, H., Rusch, E., et al. (2019) A new synthetic
96. Lucas, J. M., Heinlein, C., Kim, T., Hernandez,
toll-like receptor 1/2 ligand is an efficient adjuvant for
S. A., Malik, M. S., et al. (2014) The androgen-
peptide vaccination in a human volunteer, J. Immunother
regulated
protease
TMPRSS2 activates a
Cancer, 7, 307, doi: 10.1186/s40425-019-0796-5.102.
proteolytic cascade involving components of the
106. Nelde, A., Bilich, T., Heitmann, J. S., Maringer, Y.,
tumor microenvironment and promotes prostate
Salih, H. R., et al.
(2021) SARS-CoV-2-derived
cancer metastasis, Cancer Discov.,
4,
1310-1325,
peptides define heterologous and COVID-19-
doi: 10.1158/2159-8290.Cd-13-1010.
induced T cell recognition, Nat. Immunol., 22, 74-85,
97. Bertram, S., Glowacka, I., Blazejewska, P.,
doi: 10.1038/s41590-020-00808-x.
Soilleux, E., Allen, P., et al. (2010) TMPRSS2 and
107. Bilich, T., Nelde, A., Heitmann, J. S., Maringer, Y.,
TMPRSS4 facilitate trypsin-independent spread of
Roerden, M., Bauer, J., et al. (2021) T cell and
influenza virus in Caco-2 cells, J. Virol., 84, 10016-
antibody kinetics delineate SARS-CoV-2 peptides
10025, doi: 10.1128/jvi.00239-10.
mediating long-term immune responses in COVID-19
98. Böttcher-Friebertshäuser, E., Freuer, C., Sielaff, F.,
convalescent individuals, Sci. Transl. Med.,
13,
Schmidt, S., et al. (2010) Cleavage of influenza
doi: 10.1126/scitranslmed.abf7517.
virus hemagglutinin by airway proteases TMPRSS2
108. Barchuk, A., Cherkashin, M., Bulina, A.,
and HAT differs in subcellular localization and
Berezina, N., Rakova, T., et al.
(2021) Vaccine
susceptibility to protease inhibitors, J. Virol., 84,
effectiveness against referral to hospital and severe
5605-5614, doi: 10.1128/jvi.00140-10.
lung injury associated with COVID-19: a population-
99. Bittle, J. L., Houghten, R. A., Alexander, H.,
based case-control study in St. Petersburg, Russia,
Shinnick, T. M., Sutcliffe, J. G., et al.
(1982)
medRxiv, doi: 10.1101/2021.08.18.21262065.
Protection against foot-and-mouth disease by
109. Shomuradova, A. S., Vagida, M. S., Sheetikov, S. A.,
immunization with a chemically synthesized peptide
Zornikova, K. V., Kiryukhin, D., et al. (2020) SARS-
predicted from the viral nucleotide sequence, Nature,
CoV-2 epitopes are recognized by a public and diverse
298, 30-33, doi: 10.1038/298030a0.
repertoire of human T cell receptors, Immunity, 53,
100. Langeveld, J. P., Casal, J. I., Osterhaus, A. D.,
1245-1257.e1245, doi: 10.1016/j.immuni.2020.11.004.
Cortés, E., de Swart, R., et al. (1994) First peptide
110. Ferretti, A. P., Kula, T., Wang, Y., Nguyen, D. M. V.,
vaccine providing protection against viral infection
Weinheimer, A., et al. (2020) Unbiased screens show
in the target animal: studies of canine parvovirus
CD8+ T cells of COVID-19 patients recognize shared
in dogs, J. Virol.,
68,
4506-4513, doi:
10.1128/
epitopes in SARS-CoV-2 that largely reside outside
JVI.68.7.4506-4513.1994.
the spike protein, Immunity, 53, 1095-1107.e1093,
101. Casal, J. I., Langeveld, J. P., Cortés, E., Schaaper,
doi: 10.1016/j.immuni.2020.10.006.
W. W., van Dij k, E., et al. (1995) Peptide vaccine
111. Titov, A., Shaykhutdinova, R., Shcherbakova,
against canine parvovirus: Identification of two
O. V., Serdyuk, Y. V., Sheetikov, S. A., et al. (2022)
neutralization subsites in the N terminus of VP2 and
Immunogenic epitope panel for accurate detection of
optimization of the amino acid sequence, J. Virol.,
non-cross-reactive T cell response to SARS-CoV-2,
69, 7274-7277, doi: 10.1128/JVI.69.11.7274-7277.1995.
JCI Insight, doi: 10.1172/jci.insight.157699.
БИОХИМИЯ том 87 вып. 6 2022
726
КРУТЬ и др.
CAN PEPTIDES HELP TO STOP COVID-19?
Review
V. G. Krut'1, S. A. Chuvpilo1, I. V. Astrakhantseva1, L. I. Kozlovskaya2,3, G. A. Efimov4,
A. A. Kruglov5,6,7, M. S. Drutskaya1,8, and S. A. Nedospasov1,5,6,8*
1 Sirius University of Science and Technology,
354340 Federal Territory Sirius/Sochi, Russia; e-mail: sergei.nedospasov@gmail.com
2 FSBSI “Chumakov FSC R&D IBP RAS”,
108819 Moscow, Russia
3 Institute of Translational Medicine and Biotechnology, Sechenov Moscow State Medical University,
119991 Moscow, Russia
4 National Medical Research Center of Hematology, Ministry of Health of the Russian Federation,
125167 Moscow, Russia
5 Belozersky Research Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119234 Moscow, Russia
6 Faculty of Biology, Lomonosov Moscow State University,
119234 Moscow, Russia
7 German Rheumatism Research Center (DRFZ), a Leibniz Institute,
10117 Berlin, Germany
8 Engelhardt Institute of Molecular Biology of the Russian Academy of Sciences,
119991 Moscow, Russia
Peptides are widely used in the diagnosis, prevention and therapy of certain human diseases. How useful can
they be for the disease caused by the SARS-CoV-2 coronavirus? In this review, we discuss the possibility of
using synthetic, recombinant peptides and polypeptides for the prevention of COVID-19, based on blocking
the interaction of the virus with its main receptor ACE2, as well as the use of synthetic peptides in antiviral
vaccines, taking into account emerging new variants of the virus.
Keywords: SARS-CoV-2, АСЕ2, vaccine, T-cell epitopes
БИОХИМИЯ том 87 вып. 6 2022