БИОХИМИЯ, 2022, том 87, вып. 6, с. 741 - 757
УДК 577.25
25-ГИДРОКСИХОЛЕСТЕРИН
КАК СИГНАЛЬНАЯ МОЛЕКУЛА В НЕРВНОЙ СИСТЕМЕ
Обзор
© 2022 Ю.Г. Одношивкина1,2#, Е.А. Кузнецова1#, А.М. Петров1,2*
1 Казанский институт биохимии и биофизики, ФИЦ КазНЦ РАН,
Лаборатория биофизики синаптических процессов,
420111 Казань, Россия; электронная почта: alexey.petrov@kazangmu.ru
2 Казанский медицинский университет, 420012 Казань, Россия
Поступила в редакцию 25.03.2022
После доработки 10.05.2022
Принята к публикации 10.05.2022
Холестерин - важный компонент плазматических мембран и предшественник ряда биологически
активных соединений, в том числе гидроксихолестеринов (ГХ). Последние контролируют ключевые
звенья клеточного гомеостаза холестерина. ГХ, проникая через мембранные и сосудистые барьеры,
могут оказывать дистанционное действие, выступая в роли пара- и эндокринных агентов. 25-ГХ в
небольших количествах образуется в эндоплазматической сети многих клеток и является мощным
локальным регулятором синтеза холестерина, его внутриклеточного транспорта и депонирования.
При запуске воспалительных реакций продукция 25-ГХ значительно возрастает в макрофагах, ден-
дритных клетках и микроглии. Также синтез 25-ГХ может повышаться при ряде неврологических
заболеваний, таких как болезнь Альцгеймера, боковой амиотрофический склероз, спастическая
параплегия 5-го типа и Х-сцепленная адренолейкодистрофия. При этом пока не известно, в каких
случаях 25-ГХ может усиливать патологию, а когда - обладать протекторными свойствами. Молеку-
лярными мишенями для действия 25-ГХ являются некоторые транскрипционные факторы (LX-ре-
цепторы, SREBP2, ROR), сопряженный с G-белком рецептор (GPR183), ионные каналы (NMDA-ре-
цепторы, SLO1), молекулы адгезии (α5β1- и αvβ3-интегрины), а также оксистерин-связывающие
белки. Такое изобилие белков, взаимодействующих с 25-ГХ, предполагает наличие у данного ГХ
способности принимать участие во многих физиологических и патологических процессах. В пред-
ставленном обзоре мы сфокусировались на регуляции продукции 25-ГХ и его универсальной роли
в контроле клеточного гомеостаза холестерина, а также на эффектах 25-ГХ как сигнальной молеку-
лы, опосредующей влияние воспаления на процессы в нервно-мышечной системе и мозге. Исходя
из накопившихся данных следует заключить, что 25-ГХ препятствует накоплению клеточного холе-
стерина и выступает в качестве мощного модулятора нейровоспаления, синаптической передачи и
миелинизации. Его усиленная продукция в ответ на широкий спектр «нарушений» может выполнять
протективную роль, ограничивая гибель нейронов. Тем не менее сверхвысокие концентрации 25-ГХ
оказывают нейротоксическое действие.
КЛЮЧЕВЫЕ СЛОВА: холестерин, 25-гидроксихолестерин, LX-рецепторы, NMDA-рецепторы, синапти-
ческая передача, нейровоспаление, микроглия.
DOI: 10.31857/S0320972522060045, EDN: AUEOFZ
ВВЕДЕНИЕ
Холестерин организует в мембране микродо-
мены, липидные рафты, в которых сосредо-
Холестерин - основной структурный ком-
точены многие рецепторы, ионные каналы и
понент плазматической мембраны, который
сигнальные ферменты. Стероидные гормоны,
контролирует текучесть и толщину мембран. желчные кислоты и нейростероиды синтези-
Принятые сокращения: ГХ - гидроксихолестерин; ИНФ - интерферон; ЛПС -липополисахарид; МКС - мембран-
ные контактные сайты; ЭПС - эндоплазматическая сеть; ЭР - эстрогеновый рецептор; CH25H - холестерин 25-гид-
роксилаза; HMGCR -3-гидрокси-3-метилглутарил коэнзим А редуктаза; LX-рецепторы - печеночные X-рецепторы;
TLR4 - толл-подобный рецептор 4.
* Адресат для корреспонденции.
# Авторы внесли равный вклад в работу.
741
742
ОДНОШИВКИНА и др.
руются из холестерина. Также холестерин вы-
воспалительную активацию микроглии
[14].
ступает предшественником многочисленных
Следовательно, под влияем ИНФ увеличива-
окисленных форм холестерина (оксистери-
ется продукция 25-ГХ, который подавляет пе-
нов), часть из которых выполняет важные сиг-
редачу сигналов через рецепторы к ИНФ, т.е.
нальные функции и контролирует синтез само-
формируется отрицательная обратная связь,
го холестерина, в том числе в мозге и сетчатке,
ограничивающая действие ИНФ. Интересно
которые в значительной степени отключены от
отметить, что повышенная экспрессия генов,
системного гомеостаза холестерина [1].
связанных с метаболизмом холестерина (в том
Холестерин может окисляться до различ-
числе CH25H) характерна для Trem2+ микрог-
ных форм оксистеринов, концентрация ко-
лии, обладающей протекторными свойствами
торых неодинакова. Один из оксистеринов,
при нейродегенеративных и демиелинизирую-
25-гидроксихолестерин (25-ГХ), вызывает осо-
щих заболеваниях [15].
бый интерес. Во-первых, он синтезируется при
Повышение уровня 25-ГХ в плазме про-
участии специфичного фермента эндоплазма-
исходит не только при вирусных, но и бакте-
тической сети (ЭПС), холестерин-25-гидрок-
риальных угрозах. Липополисахарид (ЛПС)
силазы (CH25H) [2]. Экспрессия гена CH25H в
бактериальной стенки, стимулируя толл-по-
норме низкая и увеличивается в десятки раз в
добный рецептор 4 (TLR4), увеличивает экс-
ходе воспалительных реакций [3], в том числе
прессию CH25H примерно в 35 и 65 раз в мак-
сопровождающих нейродегенеративные забо-
рофагах [21] и микроглии [4] соответственно.
левания [4, 5]. Во-вторых, главные клетки про-
Аналогично, инъекции селективного агони-
дуценты 25-ГХ - это макрофаги, дендритные
ста TLR4 повышают содержание CH25H через
клетки и микроглия [3, 4]. Особенно интен-
8-12 ч в печени (~250 раз), сердце (~50 раз),
сивно 25-ГХ могут синтезировать альвеоляр-
мозге (~30 раз), легких (~ 20 раз), мышцах, поч-
ные макрофаги [6]. В-третьих, мишенями дей-
ках и тимусе (8-12 раз), а также в 3-5 раз - в
ствия 25-ГХ являются некоторые сопряженные
коже и кишечнике, что указывает на реакцию
с G-белками рецепторы, транскрипционные
резидентных макрофагов многих тканей [22].
факторы, адгезивные молекулы и ионные ка-
Экспрессия CH25H может усиливаться под
налы [3, 7-10]. Кроме того, 25-ГХ, как ГХ с ги-
действием транскрипционного фактора KLF4,
дроксильной группой в боковой цепи, спосо-
регулирующего воспаление и апоптоз, и акти-
бен проникать не только через плазматические
вируемого при стимуляции рецепторов ряда
мембраны, но и сквозь сосудистые барьеры
цитокинов [16]. Инъекция ЛПС увеличивает
[11]. Последнее свойство создает предпосылки
образование KLF4 в микроглиальных клетках,
для дистанционного действия ГХ в качестве
где KLF4 взаимодействует с транскрипцион-
пара- и (или) эндокринного фактора [12].
ным фактором NFκB, одним из ключевых ре-
гуляторов провоспалительных генов [23]. KLF4
способствует изменению фенотипа микрог-
РЕГУЛЯЦИЯ ПРОДУКЦИИ
лии и макрофагов в направлении из провос-
25ГИДРОКСИХОЛЕСТЕРИНА
палительного М1- в противовоспалительный
М2-вариант [24, 25]. В макрофагах показано,
Образование 25-ГХ определяется в значи-
что KLF4 повышает экспрессию печеночных
тельной степени содержанием CH25H в клет-
Х-рецепторов (LX-рецепторов) [16]. Послед-
ках (рис. 1). Многочисленные исследования
ние
- важные регуляторы воспалительного
показали, что провоспалительные цитокины
ответа и метаболизма липидов, в том числе хо-
могут сильно повышать экспрессию CH25H
лестерина. Более того, 25-ГХ является лиган-
[3]. В частности, CH25H относят к семейству
дом LX-рецепторов: через их активацию 25-ГХ
интерферон-стимулируемых генов. Активация
способен усилить выработку CH25H в макро-
рецепторов к интерферону (ИНФ) приводит
фагах и, следовательно, синтез 25-ГХ [18]. Та-
к сборке комплекса (из транскрипционных
ким путем формируется положительная обрат-
факторов STAT1 и STAT2), который усилива-
ная связь, направленная на лавинообразное
ет экспрессию CH25H в макрофагах в ~ 30 раз,
увеличение уровня 25-ГХ. Причем стимуляция
в дендритных клетках - в ~ 10 раз [13]. Инте-
LX-рецепторов 25-ГХ важна для перехода мак-
ресно, что 25-ГХ может подавлять переме-
рофагов в M2-состояние [26].
щение рецептора ИНФγ в липидные рафты в
Повышенная активность CH25H наблюда-
микроглии и подавлять вызванную ИНФγ про-
ется при ряде заболеваний, сопровождаемых
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
743
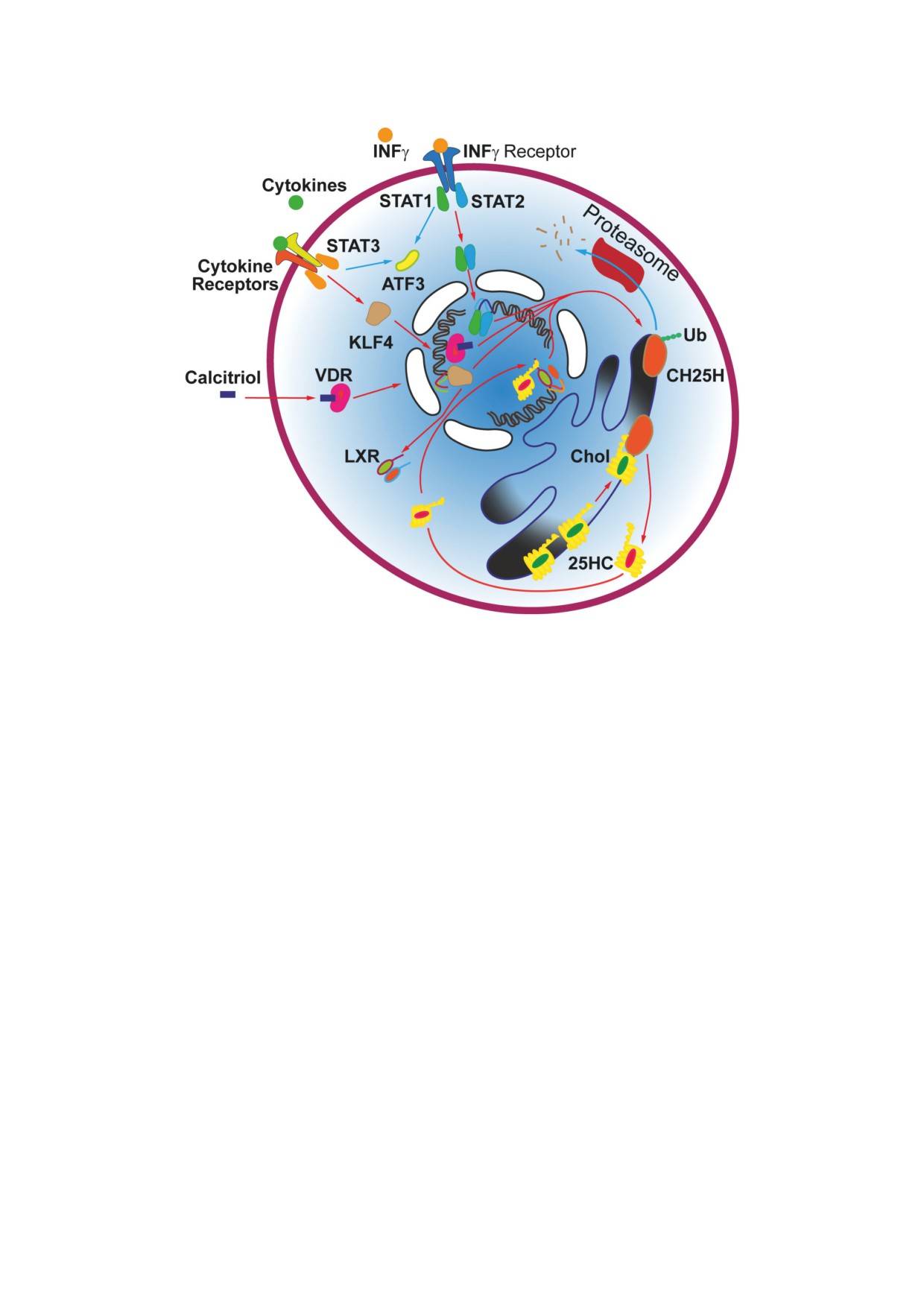
Рис. 1. Регуляция экспрессии CH25H. ИНФγ (INFγ) и ряд цитокинов через стимуляцию транскрипционных факторов
STAT и KLF4 увеличивают экспрессию CH25H [13, 16], а через активацию ATF3 могут оказывать обратный эффект [17].
Экспрессия CH25H усиливается при стимуляции рецептора витамина D (VDR) и печеночных X-рецепторов (LXR) [18,
19]. Лигандом для последних является сам 25-ГХ (25HC), таким образом, формируется положительная обратная связь
между экспрессий CH25H и продукцией 25-ГХ. Синтез 25-ГХ увеличивается при повышении содержания холестерина
(Chol) в эндоплазматической сети. Наоборот, убиквитинирование (Ub) CH25H направляет фермент на деградацию в
протеасомы, что ведет к снижению синтеза 25-ГХ [20]. Синие и красные стрелки показывают регуляцию, направлен-
ную на уменьшение и повышение уровня 25-ГХ соответственно
хронических воспалением, в том числе нейро-
этого фактора в микроглии происходит при по-
воспалением. Например, увеличение экспрес-
вреждении нервов и важна для их регенерации
сии CH25H в микроглиальных клетках было
[32]. Убиквитинирование CH25H направляет
обнаружено в моделях болезни Альцгеймера
фермент на деградацию в протеасомы. Вирус
[27], Х-сцепленной адренолейкодистрофии
репродуктивно-респираторного синдрома сви-
[28] и лейкоэнцефалопатии у взрослых с аксо-
ней, усиливая убиквитинирование и протеолиз
нальными сфероидами и пигментированной
CH25H, угнетает синтез 25-ГХ, обладающего
глией [29]. Концентрация 25-ГХ может значи-
противовирусными свойствами [20]. Уровень
тельно повышаться при боковом амиотрофи-
25-ГХ снижается у пациентов при поражении
ческом склерозе [5, 30] и спастической пара-
COVID-19, что сопровождается цитокиновым
плегии 5 типа [31] - патологиях, поражающих
штормом, который способна снизить доставка
двигательные нейроны.
25-ГХ в нановезикулах [33].
Безусловно, при воспалительных реакциях
Диета влияет на уровень СH25H и про-
существует и негативная регуляция содержа-
дукцию 25-ГХ. Образование 25-ГХ относи-
ния CH25H. Экспрессия CH25H подавляется
тельно быстро усиливается после потребления
транскрипционным фактором ATF3 [17], ко-
богатой холестерином пищи [34]. Экспрессия
торый активируется при повышении уровня
CH25H, как и продукция 25-ГХ, повышается
ряда цитокинов и интерферонов. Активация
макрофагами жировой ткани при увеличении
БИОХИМИЯ том 87 вып. 6 2022
744
ОДНОШИВКИНА и др.
индекса массы тела и диете, обогащенной жи-
гие мембраны и депонирования в виде эфиров
рами [35]. Потребление избытка арахидоновой
в липидных каплях) обеспечивает его низкий
кислоты может увеличивать уровень CH25H
уровень (3-6%) в ЭПС по сравнению с други-
в печени и мозге [36]. У пациентов с дефици-
ми мембранами [43].
том витамина D показано, что концентрация
Повышение содержания холестерина в
25-ГХ в плазме значительно повышается при
ЭПС (вследствие избыточного синтеза и (или)
употреблении витамина D (8 недель, 50 000 МЕ
снижения оттока) ведет к его 25-гидроксили-
в неделю) в сочетании с фототерапией [37].
рованию. Следовательно, накопление 25-ГХ
Вероятно, это связано с тем, что витамин D,
отражает избыток холестерина в клетках, что
мишенями которого являются ядерные рецеп-
имеет пагубные последствия, в том числе для
торы, может повышать экспрессию CH25H.
нейронов и микроглии [1, 15]. Поэтому неу-
Более того, антипролиферативное действие
дивительно, что 25-ГХ запускает механизмы,
витамина D зависит от CH25H и опосреду-
направленные на снижение клеточного уровня
ется 25-ГХ [19]. Активация рецепторов вита-
холестерина (рис. 2).
мина D может подавлять нейровоспаление и
Во-первых, 25-ГХ стимулирует связыва-
нарушение гематоэнцефалического барьера, а
ние белка INSIG1/2 с 3-гидрокси-3-метил-
также усиливать миелинизацию [38]. При этом
глутарил коэнзим А редуктазой (HMGCR) -
микроглиальные рецепторы витамина D спо-
ферментом, лимитирующим скорость синтеза
собствуют поляризации клеток в направлении
холестерина. В результате HMGCR убиквити-
М2-фенотипа [39]. Возможно, 25-ГХ играет
нируется и направляется из ЭПС на деграда-
роль в этих нейропротекторных эффектах ви-
цию в протеасомы [44]. Связываясь с INSIG,
тамина D.
25-ГХ способствует удержанию комплекса
Следует отметить, что хотя ключевым фер-
SCAP-SREBP2-INSIG в ЭПС, препятствуя тем
ментом в образовании 25-ГХ является CH25H,
самым активации транскрипционного фак-
некоторые цитохромы (CYP) в качестве «по-
тора SREBP2, усиливающего экспрессию фер-
бочного» продукта также могут генериро-
ментов биосинтетического пути холестерина
вать 25-ГХ. В частности, митохондриальный
[45, 46]. Таким образом, повышение уровня
CYP27А1, а также микросомальные CYP46A1 и
25-ГХ в ЭПС приводит к снижению содержа-
CYP3A могут синтезировать 25-ГХ [40].
ния ферментов, участвующих в синтезе хо-
лестерина за счет усиления их деградации и
снижения экспрессии. 25-ГХ в субмикромо-
ГОМЕОСТАТИЧЕСКАЯ РОЛЬ
лярной концентрации препятствует активации
25ГИДРОКСИХОЛЕСТЕРИНА КАК
SREBP2 в культивируемых нейронах, угнетая
ВНУТРИКЛЕТОЧНОГО РЕГУЛЯТОРА
экспрессию ферментов синтеза холестерина
[47]. Блокирование процессинга транскрип-
В последние годы опубликован ряд де-
ционного фактора SREBP под влиянием 25-ГХ
тальных обзоров о клеточном гомеостазе хо-
также препятствует экспрессии противовоспа-
лестерина [41, 42]. В этой главе мы хотим ак-
лительных цитокинов [48].
центировать внимание только на значение
Другой механизм, с помощью которого
эндогенной продукции 25-ГХ для контроля
25-ГХ может снижать клеточный уровень хо-
содержания холестерина в клетке. Безусловно,
лестерина, определяется его способностью ак-
многие оксистерины способны вмешиваться в
тивировать ядерные LX-рецепторы, контро-
гомеостаз холестерина. Однако 25-ГХ обладает,
лирующие гены транспорта липидов [3, 42].
вероятно, самым сильным действием, даже не-
Стимуляция LX-рецепторов увеличивает экс-
смотря на то что в физиологических условиях
прессию ABC-транспортеров (ABCA1, ABCG1,
клетки экспрессируют CH25H на низком уров-
ABCG5 и ABCG8), ответственных за ревер-
не [2]. Это связано со свойствами самого 25-ГХ
сивный транспорт холестерина из клетки на
и с расположением CH25H в ЭПС - ключевом
внеклеточные акцепторы (например, APOA-I
регионе синтеза холестерина (здесь локализу-
или APOE). Также активация LX-рецепторов
ются около 20 ферментов биосинтетическо-
способствует образованию убиквитинлигазы
го пути холестерина). Также в ЭПС находятся
IDOL, которая убиквитинирует рецептор ли-
главные компоненты механизма, управляю-
попротеина низкой плотности (LDL), способ-
щего гомеостазом холестерина, а постоянный
ствуя его деградации [49, 50]. В итоге снижа-
«отток» холестерина (за счет транспорта в дру-
ется захват внеклеточного холестерина в ходе
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
745
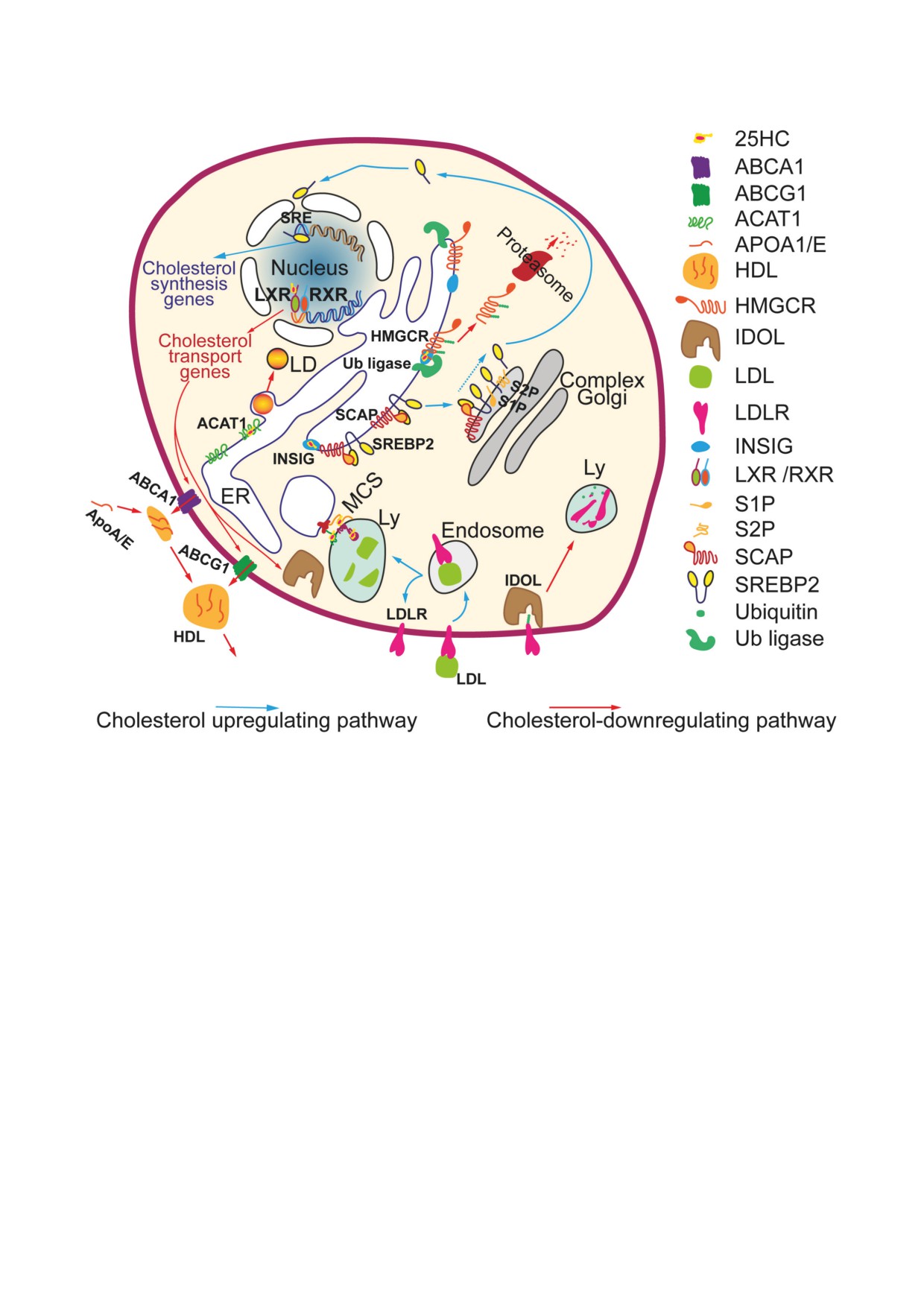
Рис. 2. Зависимая от 25-ГХ регуляция клеточного гомеостаза холестерина. Избыток холестерина превращается в 25-ГХ
(25HC) в ЭПС (ER), где 25-ГХ связывается с INSIG. (1) INSIG-25-ГХ способствует удержанию комплекса SCAP
и SREBP2 в ЭПС. В отсутствие 25-ГХ комплекс SCAP-SREBP2 перемещается в аппарат Гольджи, где SREBP2 под-
вергается протеолитическому расщеплению протеазами S1P и S2P с освобождением активного транскрипционного
фактора SREBP2. Последний связывается с регуляторными регионами генов (SRE) биосинтеза холестерина, повышая
их экспрессию [45, 46]. (2) В присутствии 25-ГХ INSIG связывается с убиквитинлигазами, что способствует убиквити-
нированию фермента HMGCR, лимитирующего скорость синтеза холестерина. Затем убиквитинированный фермент
направляется в протеасомы для деградации [44]. 25-ГХ стимулирует LX-рецепторы (LXRs) [3, 42], которые повышают
экспрессию генов ABC-транспортеров (ABCA1, ABCG1) и убиквитинлигазы IDOL [49, 50]. (3) ABC-транспортеры пе-
ремещают клеточный холестерин на APO-A/E белки, опосредуя формирование и созревание липопротеиновой части-
цы (HDL) [42]. (4) IDOL, убиквитинируя LDL-рецептор (LDLR), способствует его перемещению в лизосомы (Ly) для
протеолиза; в итоге снижается опосредуемый LDL-рецептором захват внеклеточного холестерина [49]. (5) 25-ГХ, вза-
имодействуя с белками, формирующими мембранные контактные сайты (MCS), может снижать транспорт холесте-
рина между органеллами [41, 51, 52]. (6) 25-ГХ напрямую активирует ACAT1-зависимую этерификацию холестерина в
ЭПС, способствуя депонированию избытка холестерина в липидных каплях (LD) [47, 53]. Синие и красные стрелки
обозначают регуляцию, направленную на увеличение и уменьшение уровня холестерина соответственно. HDL- ли-
попротеин высокой плотности; LDL - липопротеин низкой плотности; RXR - pетиноидный X-рецептор. Эти пути
подавляются и потенцируются 25-ГХ
рецептор-опосредованного эндоцитоза липо-
ляцию LX-рецепторов способствует выбросу
протеиновых частиц. Следовательно, повы-
холестерина из клетки и угнетает захват вне-
шение уровня 25-ГХ в цитоплазме и ядре (т.е.
клеточного холестерина. Действительно, 25-ГХ
за пределами места его синтеза) через стиму-
в субмикромолярных концентрациях увели-
БИОХИМИЯ том 87 вып. 6 2022
746
ОДНОШИВКИНА и др.
чивал экспрессию ABCA1 через активацию
25ГИДРОКСИХОЛЕСТЕРИН
LX-рецепторов в нейронах и олигодендроци-
КАК МОЛЕКУЛА
тах [47, 54]. Интересно, что в гипоталамичес-
МЕЖКЛЕТОЧНОГО ВЗАИМОДЕЙСТВИЯ
ких нейронах IDOL контролирует уровень
В НЕРВНОЙ СИСТЕМЕ
рецептора к липопротеину очень низкой плот-
ности (VLDL), влияя на потребление пищи и
Центральная нервная система ограничена
термогенез [55]. Это указывает на возможную
гематоэнцефалическим барьером от систем-
роль 25-ГХ в нейрональном контроле метабо-
ного кровотока. Этот барьер не проницаем
лических процессов.
для многих молекул, в том числе холестерина.
25-ГХ влияет на внутриклеточный транс-
Однако производные холестерина с гидрокси-
порт холестерина и его депонирование в
лированием в боковой цепи проникают через
виде эфиров. 25-ГХ напрямую усиливает ак-
сосудистые барьеры [1, 57]. Следовательно,
тивность ацетил-КоА ацетилтрансферазы
синтезируемый на периферии 25-ГХ (при си-
(ACAT1), ускоряя этерификацию холестерина
стемном воспалении) может попадать в мозг.
в ЭПС [53]. Под влиянием 25-ГХ (2,5 и 5 мкМ)
С другой стороны, 25-ГХ, образуемый in situ в
в культивируемых нейронах увеличивается
ЦНС, выводится в кровоток. Основным про-
(на ~11% и 21% соответственно) образование
дуцентом 25-ГХ в мозге является активиро-
эфиров холестерина [47]. Перемещение холе-
ванная микроглия [4, 58]. Периферические
стерина из лизосом в другие органеллы (ЭПС,
«части» нервной системы непосредственно
пероксисомы, транс-аппарат Гольджи и мито-
подвержены влиянию 25-ГХ, когда его уровень
хондрии) происходит в значительной степени
повышается как локально в ткани, так и сис-
через мембранные контактные сайты (МКС)
темно при воспалительных реакциях или по-
невезикулярным путем [41]. Одни из основных
треблении обогащенной холестерином пищи.
компонентов МКС - это оксистерин-связы-
Более того, продуценты 25-ГХ, макрофаги,
вающие белки (OSBP, ORP1L, ORP2, ORP5,
вступают в тесный контакт с периферически-
ORP6) и белки, содержащие липид-транспорти-
ми нервами при их повреждении, способствуя
рующий домен START. 25-ГХ конкурирует с
регенерации [59]. Таким образом, 25-ГХ мо-
холестерином за связывание с этими белками,
жет выступать в роли пара- и эндокринной
тем самым вмешиваясь в доставку холестерина
молекулы, которая передает сигнал о воспа-
из лизосом [51, 52].
лении, повреждении или избытке холестери-
В норме во всех клетках происходит обра-
на (рис. 3).
зование небольших количеств 25-ГХ, который
EBI2- и CXCR2-рецепторы. В настоящее
предотвращает появление избытка холестери-
время идентифицирован ряд трансмембран-
на. При этом в процессе воспалительной ре-
ных белков, которые выступают в роли высо-
акции 25-ГХ из макрофагов и микроглии мо-
коаффинных рецепторов для 25-ГХ. Миграция
жет проникать в соседние клетки и нарушать
иммунных и глиальных клеток «по градиенту»
гомеостаз холестерина, препятствуя росту и
25-ГХ и его производного 7α,25-диГХ проис-
размножению клеток, а также индуцируя апоп-
ходит при участии GPR183 (EBI2) - рецепто-
тоз. Этот механизм частично лежит в основе
ра, сопряженного c Gαi-белком. Экспрессия
антивирусного, антиракового и сенолитиче-
GPR183 глиальными клетками может усили-
ского действия 25-ГХ. Следует отметить, что
ваться в патологических условиях, а актива-
в нейронах, функционирование которых во
ция GPR183 имеет протективные эффекты.
многих аспектах тесно зависит от холестерина,
Так, экспрессия GPR183 микроглией увели-
в ЭПС наряду с 25-ГХ образуется 24-ГХ за счет
чивается в очаге эпилептической активности
активности нейрон-специфичного фермен-
[60]. Стимуляция GPR183 олигодендроцитов
та CYP46A1 [1, 56, 57]. Параллельное участие
вовлечена в ремиелинизацию при моделиро-
двух ферментов ЭПС, CH25H и CYP46A1, в
вании рассеянного склероза [61], а активация
превращении холестерина в ГХ, вероятно, не-
GPR183 астроцитов угнетает высвобожде-
обходимо для предотвращения накопления хо-
ние последними провоспалительных цитоки-
лестерина в нейронах. Это особенно важно для
нов [62].
нейронов, которые в дополнение к синтезиро-
Оксистерины могут активировать другой
ванному in situ холестерину получают большую
сопряженный с Gi-белком рецептор - CXCR2,
его часть от астроцитов в составе липопротеи-
важный для миграции клеток в очаг воспале-
новых частиц [1].
ния. В мозге экспрессия CXCR2 в микроглии,
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
747
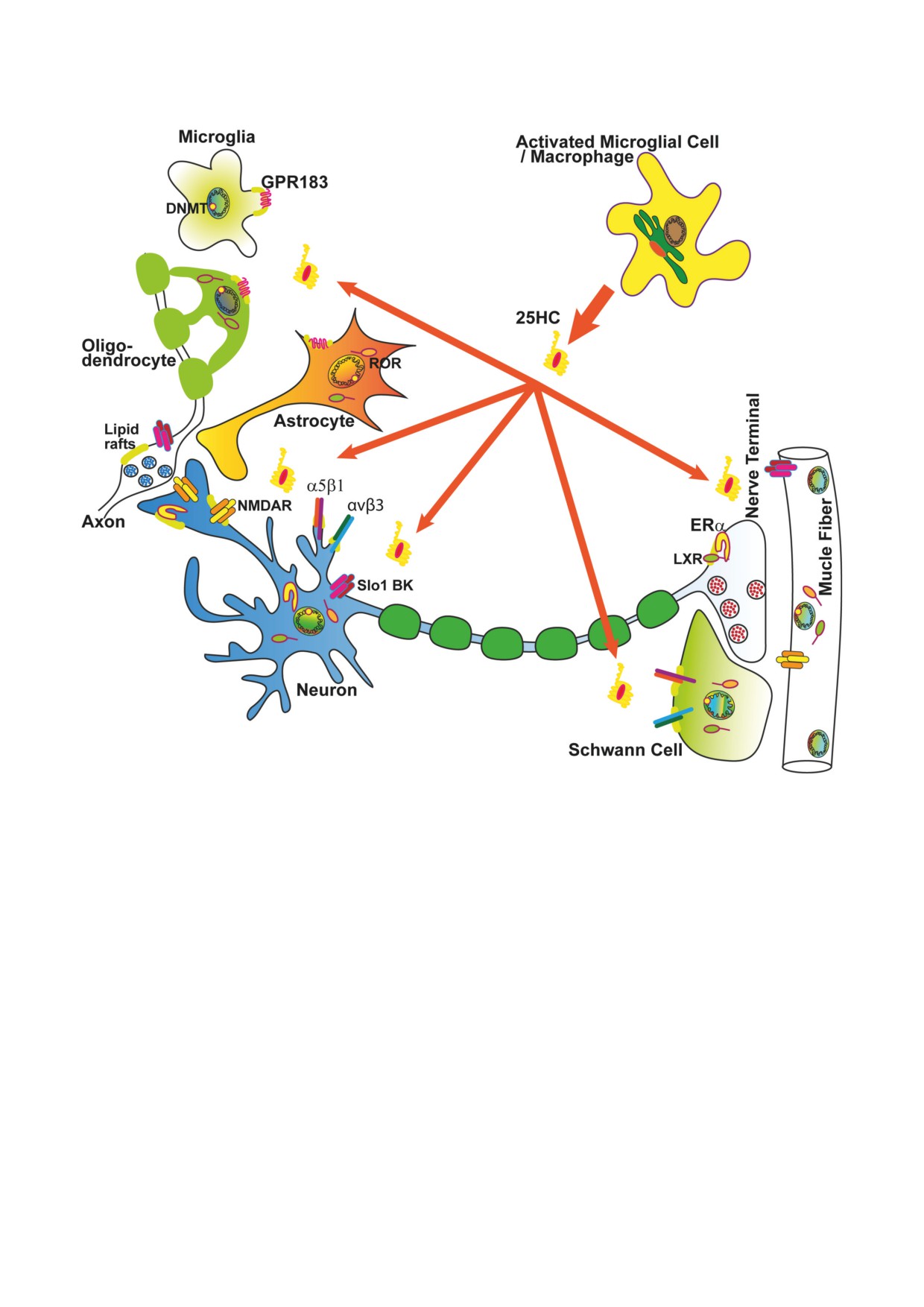
Рис. 3. Основные мишени действия 25-ГХ (25HC) в нервной системе. Главными продуцентами 25-ГХ являются акти-
вированные макрофаги и микроглиальные клетки [3, 4, 58]. Освобождаемый 25-ГХ может влиять на глиальные клетки
(микроглию, олигодендроциты, астроциты и Шванновские клетки), а также нейроны. 25-ГХ влияет на синаптическую
передачу, действуя на пресинаптические и постсинаптические рецепторы. α5β1 и αvβ3 - интегрины; DNMT - ДНК-ме-
тилтрансфераза; ERα - эстрогеновый рецептор α, GPR183 - сопряженный с G-белком рецептор 183 ; LXR - LX-ре-
цепторы; NMDAR - NMDA рецепторы; ROR - орфанный рецептор, связанный с ретиноидным X-рецептором; Slo1
BK - потенциал- и кальций-активируемые калиевые каналы большой проводимости. Подробные объяснения в тексте
олигодендроцитах и нейронах повышается при
итоге активируется киназа фокальной адгезии
повреждениях, а активация CXCR2 может от-
(FAK) и усиливается продукция цитокинов
рицательно контролировать миелинизацию
макрофагами, в частности, фактора некроза
и нарушать возбуждающую нейропередачу
опухолей (TNF) и интерлейкина 6 [8]. Следу-
[63, 64]. Однако 25-ГХ (в отличие от 22R-ГХ)
ет отметить, что активация α5β1- и αvβ3-инте-
в отношении CXCR2 является слабым агони-
гринов ускоряет рост нейрональных отростков
стом даже в высокой концентрации [65].
[66, 67], а также пролиферацию и миграцию
Интегрины. Миграция и статус иммунных
Шванновских клеток, «покрывающих» пери-
клеток могут регулироваться за счет непосред-
ферические нервы и нервно-мышечные си-
ственного связывания 25-ГХ с адгезивными
напсы [68, 69]. Потенциально, путь 25-ГХ/ин-
молекулами, α5β1- и αvβ3-интегринами. В
тегринов может быть вовлечен в реализацию
БИОХИМИЯ том 87 вып. 6 2022
748
ОДНОШИВКИНА и др.
положительного действия макрофагов на вос-
крайне высокие концентрации 25-ГХ, которые
становление поврежденных нервно-мышеч-
используются в клеточных исследованиях [77,
ных синапсов [59, 70]. При этом следует иметь
78] или формируются в условиях хронической
в виду, что избыточная продукция 25-ГХ, сни-
патологии в мозге, могут иметь и пагубное
жая синтез холестерина в Шванновских клет-
влияние. Экспрессия CH25H в головном моз-
ках [71] и экспрессию генов миелина [72],
ге повышена у пациентов с болезнью Альц-
способна ослабить миелинизацию перифери-
геймера, и 25-ГХ может усиливать зависимое
ческих нервов.
от интерлейкина-1β нейровоспаление у мо-
NMDA-рецепторы. Другой мишенью 25-ГХ
дельных APPPS1-21 мышей [4]. Сам β-ами-
являются глутаматные NMDA-рецепторы, ак-
лоид в культуре клеток ARPE-19 увеличивал
тивация которых в ЦНС представляет собой
уровень 25-ГХ, способствующего активации
ключевое событие в феноменах синаптиче-
P2X7-рецепторов и апоптозу
[79]. Схожим
ской пластичности и памяти. Также эти рецеп-
образом сверхпродукция
25-ГХ может уси-
торы модулируют нейропередачу на перифе-
ливать нейровоспаление (через активацию
рии [73]. 25-ГХ непосредственно, хотя и слабо,
NLRP3-инфламмасомы и усиленное образо-
может усиливать вызванный глутаматом ток
вание интерлейкина-1β) при Х-сцепленной
через NMDA-рецепторы, но полностью и не-
адренолейкодистрофии
- прогрессирующем
конкурентно блокирует мощный потенциру-
нейродегенеративном заболевании, связанном
ющий эффект 24(S)-ГХ на ионные токи через
с накоплением длинноцепочечных жирных
NMDA-рецепторы [7], в основном содержа-
кислот [28].
щие GluN2B субъединицы [74]. В результате
BK (slo1) каналы. Активность калиевого
25-ГХ способен снижать вызванное 24(S)-ГХ
ионного канала может быть изменена под вли-
усиление гибели нервных клеток вследствие
янием 25-ГХ. В микромолярной концентрации
гиперактивации NMDA-рецепторов, т.е. эк-
25-ГХ способен снижать токи через потенци-
сайтотоксичность. Также 25-ГХ существенно
ал- и кальций-активируемые калиевые кана-
снижает потерю нейронов, вызванную депри-
лы большой проводимости (slo1 BK). Однако
вацией глюкозы и кислорода [75].
этот эффект не специфичен только для 25-ГХ,
25-ГХ в микромолярной концентрации,
поскольку другие оксистерины с гидроксили-
как и его избыточная продукция микроглией
рованием в боковой цепи имеют тот же эф-
в ходе нейровоспаления, нарушает в гиппо-
фект [80]. Следовательно, оксистерины могут
кампе феномен долговременной потенциации,
потенциально усиливать кальций-зависимые
зависящий от NMDA-рецепторов [58]. Однако
процессы за счет ограничения активности
данное нарушение синаптической пластично-
BK-каналов. Также 25-ГХ может повышать
сти может быть отражением «глобальной» за-
возбудимость нейронов за счет ослабления
щитной функции 25-ГХ, выделяемого микро-
тормозного влияния со стороны ГАМК-В ре-
глией. Так, 25-ГХ существенно снижал гибель
цепторов. Однако этот эффект проявляет-
нейронов путем апоптоза, вызванным избы-
ся при длительном (часы) действии 25-ГХ на
точной экспрессией провоспалительного ре-
срезы мозга и характерен не для всех нейро-
гулятора STING (стимулятор генов интерфе-
нов [81].
ронов) и аутофагией после окклюзии мозговой
Печеночные X-рецепторы. LX-рецепторы,
артерии [76]. 25-ГХ быстро подавляет транс-
одним из сильных естественных активаторов
порт рецептора к ИНФγ в липидные рафты
которых является 25-ГХ [3], могут локализо-
и его последующую активацию, в результате
ваться на плазматических мембранах (в липид-
снижается продукция провоспалительных ци-
ных рафтах) некоторых клеток [82, 83]. Недав-
токинов микроглией [14].
но эти рецепторы были обнаружены в нервных
Таким образом, хотя продукция
25-ГХ
окончаниях аксонов мотонейронов, где их рас-
стимулируется в условиях нейровоспаления,
пределение зависело от целостности липидных
сам он может ограничивать его, выступая
рафтов [10]. Активация синаптических LX-ре-
ключевым компонентом петли отрицатель-
цепторов
25-ГХ усиливала вовлечение си-
ной обратной связи [48]. При этом он может
наптических везикул в экзоцитоз, что опреде-
предотвращать избыточную синаптическую
лялось выбросом кальция из ЭПС. Оказалось,
активность в глутаматергических синапсах и
что мембранные LX-рецепторы были способ-
нарушать синаптическую пластичность, за-
ны путем, зависимым от Gi-белка, стимули-
висимую от NMDA-рецепторов. Безусловно,
ровать фосфолипазу С и, как следствие, зави-
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
749
симое от инозитолтрифосфатных-рецепторов
трации, которые встречаются в условиях вос-
ЭПС повышение цитозольного Ca2+. После-
палительной реакции in vivo, имеют обратный
дующая активация Са2+- и липид-зависимой
эффект [30]. Острое воздействие 1 мкМ 25-ГХ
протеинкиназы С усиливала мобилизацию си-
способно частично восстановить нарушен-
наптических везикул. В этих условиях в ответ
ные свойства мембран нервно-мышечных со-
на действие 25-ГХ наблюдалось также Са2+-за-
единений (дезорганизацию липидных рафтов,
висимое увеличение внутри- и внеклеточно-
увеличение текучести мембран) у модельных
го уровня активных форм кислорода. Однако
SOD1G93A мышей. При этом хроническое
последние не оказывали липид-повреждаю-
введение низкой дозы 25-ГХ (0,4 мг/кг раз
щего действия, а вносили вклад в усиление
в 4 дня в течение месяца) мышам с БАС пре-
нейропередачи [10]. Интересно отметить, что
дотвращало фрагментацию нервно-мышечных
24(S)-ГХ, несмотря на структурную схожесть с
синапсов, перекисное окисление липидов их
25-ГХ, при кратковременном воздействии мо-
мембран, накопление церамида и увеличение
дулировал нервно-мышечную передачу путем,
неквантовой секреции ацетилхолина в главной
сопряженным с NMDA-рецепторами, но не
дыхательной мышце - диафрагме [88]. Это
зависимым от LX-рецепторов [73, 84].
указывает на терапевтическое действие 25-ГХ,
Следует отметить, что отсутствие LX-ре-
поскольку фрагментация нервно-мышечных
цепторов β ведет к заболеванию, напомина-
синапсов, избыточное выделение ацетилхо-
ющему боковой амиотрофический склероз
лина, а также накопление церамида происхо-
(БАС) с потерей мотонейронов и денервацией
дят при старении и миастениях, а также могут
скелетных мышц [85]. Нокаут генов LX-ре-
ускорять денервационные и, следовательно,
цепторов α и β вызывает дефекты локомоции,
атрофические изменения скелетных мышц
сопровождаемые окислительным стрессом и
[89-93]. Интересно, что гиперхолестеринемия
карбонилированием белков в двигательных
является протективным фактором при БАС,
нервах [86]. При этом также нарушается функ-
а прием статинов, подавляющих синтез холе-
ционирование Шванновских клеток и истон-
стерина, наоборот, усиливает эту патологию
чается миелин в периферических нервах [72].
[94, 95]. Это коррелирует с уровнем 25-ГХ в
Наоборот, стимуляция LX-рецепторов 25-ГХ
плазме: при гиперхолестеринемии он повы-
может усилить экспрессию генов миелина
шен, а при применении статинов - снижен
(PLP, MBP) в олигодендроцитах [54]. Инте-
[34, 96]. Возможно, 25-ГХ частично опосредует
ресно, что уровень 25-ГХ повышался в плазме
влияние гиперхолестеринемии и статинов на
у пациентов с БАС (в течение 1-го года мани-
развитие БАС, а важной точкой приложения
фестации заболевания); на досимптоматичес-
25-ГХ является нервно-мышечное соединение.
кой стадии у модельных SOD1G93A мышей
Действительно, меченый аналог 25-ГХ имеет
наблюдалось повышение экспрессии CH25H
высокую тропность к мембранам нервно-мы-
в мозге, позднее происходило повышение
шечных соединений, особенно у модельных
25-ГХ в спинном мозге [5, 30]. Однако на
животных с БАС [88]. Главные продуценты
поздних стадиях экспрессия CH25H умень-
25-ГХ, макрофаги, напрямую контактируют с
шалась в мозге у SOD1G93A мышей вместе со
нервно-мышечным синапсом при поврежде-
снижением концентрации метаболита 25-ГХ
нии нерва и патологиях, сопровождающихся
(7α, 25-диГХ) в спинномозговой жидкости па-
денервациями - и эти взаимодействия облег-
циентов с БАС [5, 87].
чают реиннервацию [59, 70]. Макрофаги так-
В целом, значение повышенной продукции
же способствуют симпатической (адренерги-
25-ГХ при БАС непонятно. С одной стороны,
ческой) иннервации периферических тканей
это может быть отражением воспалительной
[97], а β-адренергическая передача может мо-
реакции и усугублять патологию, а с другой
дулироваться ГХ [12].
- повышение 25-ГХ может быть компенса-
Недавно было показано, что 25-ГХ обла-
торным ответом, направленным на замедле-
дает сенолитическими свойствами в скелетной
ние гибели мотонейронов и денервационных
мышце, препятствуя появлению признаков
изменений в скелетных мышцах. Высокие
старения (агрегации CRYAB) и воспаления
концентрации 25-ГХ (≥ 5-30 мкM) снижают
[98]. Повышенная продукция
25-ГХ (через
выживаемость культивируемых мотонейро-
активацию LX-рецепторов) может улучшать
нов и вызывают апоптоз [5, 30], однако более
состояние в модели неалкогольной жировой
низкие субмикромолярные (≤ 1 мкM) концен-
болезни печени [99], которая сопровождается
БИОХИМИЯ том 87 вып. 6 2022
750
ОДНОШИВКИНА и др.
нарушениями нервно-мышечной системы и
их биофизические свойства и формирование
нейродегенеративными изменениями. В до-
липидных микродоменов [88, 110-112]. При-
полнение, ГХ активируют ядерные LX-рецеп-
чем структурно схожие оксистерины способ-
торы в постсинаптических областях мышеч-
ны оказывать разнонаправленный эффект на
ных волокон, что ведет к усилению экспрессии
плазматические, в том числе синаптические,
NO-синтаз (эндотелиальной и нейрональной
мембраны [110]. Исследования свойств фор-
изоформ) и синтеза NO в ходе нервно-мы-
мирующих рафты липидов в ленгмюровских
шечной передачи [100]. В свою очередь, NO
монослоях показывают, что 25-ГХ с большей
препятствует мышечной атрофии в ответ на
силой, чем холестерин, взаимодействует со
мышечную разгрузку [101, 102], которая сопро-
сфингомиелином и с чуть меньшей - с ган-
вождается ранними синаптическими измене-
глиозидом GM1. Следовательно, 25-ГХ мо-
ниями, включающими нарушения липидных
жет участвовать в формировании липидных
рафтов, увеличение текучести мембран и на-
рафтов и даже вытеснять холестерин из них
копление церамида в синаптических мембра-
[113]. Действительно, добавление 25-ГХ к ис-
нах [91, 92, 103]. Подобные события возникают
кусственной бислойной мембране (из смеси
и на ранних стадиях БАС и могут быть скор-
холестерина и 1-пальмитоил-2-олеоилфосфа-
ректированы за счет введения 25-ГХ [88].
тидилхолина) ведет к смещению холестерина
Эстрогеновые рецепторы (ЭР). Мембран-
в сторону водной поверхности и увеличению
ные LX-рецепторы могут напрямую взаимо-
его доступности для внешних акцепторов, что
действовать с ЭРα [82]. Более того, ЭРα явля-
снижает способность холестерина конденси-
ются потенциальными мишенями для 25-ГХ и,
ровать бислой [114]. При этом способность
стимулируя их, 25-ГХ проявляет эстроген-по-
25-ГХ увеличивать доступность мембранного
добную активность в ряде клеток [9]. Усиле-
холестерина зависит от липидного состава и
ние мобилизации синаптических везикул в
сильнее проявляется в мембранах, содержа-
нервных окончаниях аксонов мотонейронов
щих больше ненасыщенных липидов
[115].
под влиянием 25-ГХ также зависит от ЭРα
Сам 25-ГХ способствует формированию ми-
[10]. Интересно, что в центральных синапсах
кродоменов, обогащенных насыщенными
активация ЭРα (17β-эстрадиолом) способна
липидами, в искусственных мембранах [116],
быстро вызывать долговременную синапти-
а также увеличению упорядоченности и сни-
ческую пластичность, вследствие встраива-
жению текучести мембран нервно-мышечных
ния глутаматных AMPA-рецепторов в по-
синапсов [88]. С другой стороны, 25-ГХ, при-
стсинаптическую мембрану [104]. С другой
нимая «наклоненную» (по отношению к хво-
стороны, вызванное гиперхолестеринемией
стам фосфолипидов) ориентацию, способен
повышение 27-ГХ, способного блокировать
расширять латерально и делать тоньше искус-
ЭР, снижает экспрессию постсинаптического
ственные бислойные мембраны [117], особен-
маркера PSD-95 в гиппокампе [105].
но состоящие из ненасыщенных липидов [118].
Орфанный рецептор, связанный с ретино-
Также 25-ГХ может подавлять слияние липид-
идным X-рецептором (ROR). Кроме LX-рецеп-
ных рафтов в более крупные микродомены в
торов, 25-ГХ, наряду с другими стеринами,
микроглии [14]. Антивирусные свойства 25-ГХ
может связываться с ядерными рецепторами
частично связаны с его прямым действием
ROR (retinoid receptor-related orphan receptor),
на свойства плазматических мембран, в ре-
выступая в качестве агониста, нейтрального
зультате чего подавляется слияние вирусов, в
лиганда или обратного агониста в зависимости
том числе нейротропных, с клетками [119].
от типа ROR-рецептора [106, 107]. Активация
Учитывая важность мембранных свойств для
ROR важна для организации коры, развития
протекания множества процессов в нервной
нейронов, регуляции циркадных ритмов, а
системе [14, 56, 120], прямые эффекты 25-ГХ
также может подавлять нейровоспаление за
на стабильность липидных рафтов, текучесть
счет угнетения активности транскрипцион-
и толщину мембран, а также доступность хо-
ного фактора NFκB и продукции провоспа-
лестерина могут вносить вклад в перестройку
лительных цитокинов глиальными клетка-
нейрональной активности в условиях воспале-
ми [108, 109].
ния. Следует отметить, что эти эффекты 25-ГХ
Прямое действие
25-ГХ на мембранные
зависят от липидного состава мембран и по-
свойства. Оксистерины при взаимодействии с
этому могут отличаться в нейронах и глии, а
плазматическими мембранами могут влиять на
также различных компартментах клеток.
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
751
ЗАКЛЮЧЕНИЕ
следования должны дать ответ о направлен-
ности действия 25-ГХ in vivo в норме и пато-
Таким образом, 25-ГХ, с одной стороны,
логии, в частности, при нейродегенеративных
является важным регулятором гомеостаза хо-
заболеваниях.
лестерина в отдельной взятой клетке, а с дру-
гой - может опосредовать влияния воспале-
ния, действуя как паракринный агент или даже
Финансирование. Работа выполнена при
системно. Высокая проникающая способность
финансовой поддержке гранта РФФИ № 20-
25-ГХ, а также существование высокоаффин-
04-00077 (части 3.1-3.7), а также частично
ных к 25-ГХ рецепторов, экспрессирующихся
грантов РНФ № 22-25-00396 (части 1 и 2) и
в нейронах и глиальных клетках, делают этот
№ 21-14-00044 (часть 3.8).
оксистерин важным модулятором деятельно-
Благодарности.
Авторы
выражают
сти нервной системы, а фермент CH25H - по-
благодарность
Закирьяновой
Г.Ф.
и
тенциальной мишенью для фармакологиче-
проф. Бухараевой Э.А. за обсуждение данного
ских интервенций. Продукция 25-ГХ в ответ
обзора. Работа частично поддержана государ-
на повреждения может выполнять нейропро-
ственным заданием для ФИЦ Казанского на-
тективную роль, способствуя оптимизации
учного центра РАН.
синаптической передачи и миелинизации, а
Конфликт интересов. Авторы заявляют об
также ограничивая нейровоспаление и гибель
отсутствии конфликта интересов.
нейронов. При этом сверхвысокие концен-
Соблюдение этических норм. Настоящая
трации 25-ГХ, часто используемые в клеточ-
статья не содержит описания выполненных
ных исследованиях, могут иметь негативные
авторами исследований с участием людей
последствия для функционирования нервной
или использованием животных в качестве
системы. Следовательно, дополнительные ис-
объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Petrov, A. M., Kasimov, M. R., and Zefirov,
Cholesterol 25-hydroxylase promotes efferocytosis
A. L.
(2016) Brain cholesterol metabolism and
and resolution of lung inflammation, JCI Insight, 5,
its defects: Linkage to neurodegenerative diseases
doi: 10.1172/jci.insight.137189.
and synaptic dysfunction, Acta Naturae, 8, 58-73,
7. Linsenbardt, A. J., Taylor, A., Emnett, C. M.,
doi 10.32607/20758251-2016-8-1-58-73.
Doherty, J. J., Krishnan, K., et al. (2014) Different
2. Lund, E. G., Kerr, T. A., Sakai, J., Li, W. P., and
oxysterols have opposing actions at N-methyl-D-
Russell, D. W. (1998) cDNA cloning of mouse
aspartate receptors, Neuropharmacology, 85, 232-242,
and human cholesterol 25-hydroxylases, polytopic
doi: 10.1016/j.neuropharm.2014.05.027.
membrane proteins that synthesize a potent oxysterol
8. Pokharel, S. M., Shil, N. K., Gc, J. B., Colburn,
regulator of lipid metabolism, J. Biol. Chem., 273,
Z. T., Tsai, S. Y., et al. (2019) Integrin activation by
34316-34327, doi: 10.1074/jbc.273.51.34316.
the lipid molecule 25-hydroxycholesterol induces a
3. Cyster, J. G., Dang, E. V., Reboldi, A., and Yi, T.
proinflammatory response, Nat. Commun., 10, 1482,
(2014)
25-Hydroxycholesterols in innate and
doi: 10.1038/s41467-019-09453-x.
adaptive immunity, Nat. Rev. Immunol., 14, 731-743,
9. Lappano, R., Recchia, A. G., De Francesco, E.
doi: 10.1038/nri3755.
M., Angelone, T., Cerra, M. C., et al. (2011) The
4. Wong, M. Y., Lewis, M., Doherty, J. J., Shi, Y.,
cholesterol
metabolite
25-hydroxycholesterol
Cashikar, A. G., et al. (2020) 25-Hydroxycholesterol
activates estrogen receptor alpha-mediated signaling
amplifies microglial IL-1beta production in an apoE
in cancer cells and in cardiomyocytes, PLoS One, 6,
isoform-dependent manner, J. Neuroinflamm., 17,
e16631, doi: 10.1371/journal.pone.0016631.
192, doi: 10.1186/s12974-020-01869-3.
10. Zakyrjanova, G. F., Tsentsevitsky, A. N., Kuznetsova,
5. Kim, S. M., Noh, M. Y., Kim, H., Cheon, S. Y.,
E. A., and Petrov, A. M. (2021) Immune-related
Lee, K. M., et al. (2017) 25-Hydroxycholesterol is
oxysterol modulates neuromuscular transmission
involved in the pathogenesis of amyotrophic lateral
via non-genomic liver X receptor-dependent
sclerosis, Oncotarget, 8, 11855-11867, doi: 10.18632/
mechanism, Free Radic Biol. Med., 174, 121-134,
oncotarget.14416.
doi: 10.1016/j.freeradbiomed.2021.08.013.
6. Madenspacher, J. H., Morrell, E. D., Gowdy, K. M.,
11. Leoni, V., Masterman, T., Patel, P., Meaney, S.,
McDonald, J. G., Thompson, B. M., et al. (2020)
Diczfalusy, U., et al. (2003) Side chain oxidized
БИОХИМИЯ том 87 вып. 6 2022
752
ОДНОШИВКИНА и др.
oxysterols in cerebrospinal fluid and the integrity of
25-Hydroxycholesterol secreted by macrophages in
blood-brain and blood-cerebrospinal fluid barriers,
response to Toll-like receptor activation suppresses
J. Lipid Res., 44, 793-799, doi: 10.1194/jlr.M200434-
immunoglobulin A production, Proc. Natl.
JLR200.
Acad. Sci. USA, 106, 16764-16769, doi: 10.1073/
12.
Odnoshivkina, U. G., Sytchev, V. I., Starostin, O.,
pnas.0909142106.
and Petrov, A. M. (2019) Brain cholesterol metabolite
23.
Kaushik, D. K., Gupta, M., Das, S., and Basu, A.
24-hydroxycholesterol modulates inotropic responses
(2010) Kruppel-like factor 4, a novel transcription
to beta-adrenoceptor stimulation: The role of NO
factor regulates microglial activation and subsequent
and phosphodiesterase, Life Sci.,
220,
117-126,
neuroinflammation, J. Neuroinflamm.,
7,
68,
doi: 10.1016/j.lfs.2019.01.054.
doi: 10.1186/1742-2094-7-68.
13.
Liu, S. Y., Aliyari, R., Chikere, K., Li, G., Marsden,
24.
Liao, X., Sharma, N., Kapadia, F., Zhou, G.,
M. D., et al. (2013) Interferon-inducible cholesterol-
Lu, Y., et al. (2011) Kruppel-like factor 4 regulates
25-hydroxylase broadly inhibits viral entry by
macrophage polarization, J. Clin. Invest., 121, 2736-
production of 25-hydroxycholesterol, Immunity, 38,
2749, doi: 10.1172/JCI45444.
92-105, doi: 10.1016/j.immuni.2012.11.005.
25.
Wen, M., Ye, J., Han, Y., Huang, L., Yang, H., et al.
14.
Lee, J. H., Han, J. H., Woo, J. H., and Jou, I. (2022)
(2018) Hypertonic saline regulates microglial M2
25-Hydroxycholesterol
suppress
IFN-gamma-
polarization via miR-200b/KLF4 in cerebral edema
induced inflammation in microglia by disrupting
treatment, Biochem. Biophys. Res. Commun., 499,
lipid raft formation and caveolin-mediated signaling
345-353, doi: 10.1016/j.bbrc.2018.03.161.
endosomes, Free Radic Biol. Med., 179, 252-265,
26.
Kimura, T., Nada, S., Takegahara, N., Okuno, T.,
doi: 10.1016/j.freeradbiomed.2021.11.017.
Nojima, S., et al.
(2016) Polarization of M2
15.
Nugent, A. A., Lin, K., van Lengerich, B.,
macrophages requires Lamtor1 that integrates
Lianoglou, S., Przybyla, L., et al. (2020) TREM2
cytokine and amino-acid signals, Nat. Commun., 7,
regulates microglial cholesterol metabolism upon
13130, doi: 10.1038/ncomms13130.
chronic phagocytic challenge, Neuron, 105, 837-854
27.
Ofengeim, D., Mazzitelli, S., Ito, Y., DeWitt, J. P.,
e839, doi: 10.1016/j.neuron.2019.12.007.
Mifflin, L., et al. (2017) RIPK1 mediates a disease-
16.
Li, Z., Martin, M., Zhang, J., Huang, H. Y.,
associated microglial response in Alzheimer’s disease,
Bai, L., et al.
(2017) Kruppel-like factor
4
Proc. Natl. Acad. Sci. USA,
114, E8788-E8797,
regulation of cholesterol-25-hydroxylase and liver
doi: 10.1073/pnas.1714175114.
X receptor mitigates atherosclerosis susceptibility,
28.
Jang, J., Park, S., Jin Hur, H., Cho, H. J.,
Circulation,
136,
1315-1330, doi:
10.1161/
Hwang, I., et al.
(2016)
25-hydroxycholesterol
CIRCULATIONAHA.117.027462.
contributes to cerebral inflammation of X-linked
17.
Gold, E. S., Ramsey, S. A., Sartain, M. J., Selinummi,
adrenoleukodystrophy through activation of the
J., Podolsky, I., et al. (2012) ATF3 protects against
NLRP3 inflammasome, Nat. Commun., 7, 13129,
atherosclerosis by suppressing 25-hydroxycholesterol-
doi: 10.1038/ncomms13129.
induced lipid body formation, J. Exp. Med., 209, 807-
29.
Chitu, V., Biundo, F., Shlager, G. G. L., Park,
817, doi: 10.1084/jem.20111202.
E. S., Wang, P., et al. (2020) Microglial homeostasis
18.
Liu, Y., Wei, Z., Ma, X., Yang, X., Chen, Y., et al.
requires balanced CSF-1/CSF-2 receptor signaling,
(2018) 25-Hydroxycholesterol activates the expression
Cell Rep.,
30,
3004-3019.e3005, doi:
10.1016/
of cholesterol 25-hydroxylase in an LXR-dependent
j.celrep.2020.02.028.
mechanism, J. Lipid Res., 59, 439-451, doi: 10.1194/
30.
Dodge, J. C., Yu, J., Sardi, S. P., and Shihabuddin,
jlr.M080440.
L. S.
(2021) Sterol auto-oxidation adversely
19.
Wang, J. H., and Tuohimaa, P. (2006) Regulation of
affects human motor neuron viability and is a
cholesterol 25-hydroxylase expression by vitamin D3
neuropathological feature of amyotrophic lateral
metabolites in human prostate stromal cells, Biochem.
sclerosis, Sci. Rep., 11, 803, doi: 10.1038/s41598-020-
Biophys. Res. Commun., 345, 720-725, doi: 10.1016/
80378-y.
j.bbrc.2006.04.156.
31.
Marelli, C., Lamari, F., Rainteau, D., Lafourcade, A.,
20.
Ke, W., Fang, L., Tao, R., Li, Y., Jing, H., et al. (2019)
Banneau, G., et al.
(2018) Plasma oxysterols:
Porcine reproductive and respiratory syndrome virus
Biomarkers for diagnosis and treatment in spastic
E protein degrades porcine cholesterol 25-hydroxylase
paraplegia type 5, Brain, 141, 72-84, doi: 10.1093/
via the ubiquitin-proteasome pathway, J. Virol., 93,
brain/awx297.
doi: 10.1128/JVI.00767-19.
32.
Tanaka, T., Murakami, K., Bando, Y., Nomura,
21.
Diczfalusy, U., Olofsson, K. E., Carlsson, A. M.,
T., Isonishi, A., et al. (2017) Microglia support
Gong, M., Golenbock, D. T., et al. (2009) Marked
ATF3-positive neurons following hypoglossal nerve
upregulation of cholesterol 25-hydroxylase expression
axotomy, Neurochem. Int., 108, 332-342, doi: 10.1016/
by lipopolysaccharide, J. Lipid Res., 50, 2258-2264,
j.neuint.2017.05.007.
doi: 10.1194/jlr.M900107-JLR200.
33.
Kim, H., Lee, H. S., Ahn, J. H., Hong, K. S., Jang,
22.
Bauman, D. R., Bitmansour, A. D., McDonald,
J. G., et al.
(2021) Lung-selective
25-hydroxy-
J. G., Thompson, B. M., Liang, G., et al. (2009)
cholesterol nanotherapeutics as a suppressor of
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
753
COVID-19-associated cytokine storm, Nano Today,
binding of insig-1 to its sterol-sensing domain, Mol.
38, 101149, doi: 10.1016/j.nantod.2021.101149.
Cell, 11, 25-33, doi: 10.1016/s1097-2765(02)00822-5.
34.
Johnson, K. A., Morrow, C. J., Knight, G. D.,
45.
Brown, M. S., and Goldstein, J. L. (2009) Cholesterol
and Scallen, T. J. (1994) In vivo formation of
feedback: From Schoenheimer’s bottle to Scap’s
25-hydroxycholesterol from endogenous cholesterol
MELADL, J. Lipid Res., 50 Suppl, S15-27, doi: 10.1194/
after a single meal, dietary cholesterol challenge,
jlr.R800054-JLR200.
J. Lipid Res., 35, 2241-2253.
46.
Radhakrishnan, A., Ikeda, Y., Kwon, H. J., Brown,
35.
Russo, L., Muir, L., Geletka, L., Delproposto, J.,
M. S., and Goldstein, J. L. (2007) Sterol-regulated
Baker, N., et al. (2020) Cholesterol 25-hydroxylase
transport of SREBPs from endoplasmic reticulum
(CH25H) as a promoter of adipose tissue
to Golgi: Oxysterols block transport by binding to
inflammation in obesity and diabetes, Mol. Metab.,
Insig, Proc. Natl. Acad. Sci. USA, 104, 6511-6518,
100983, doi: 10.1016/j.molmet.2020.100983.
doi: 10.1073/pnas.0700899104.
36.
Xu, H., Sun, B., Jia, L., Wei, Y., Liao, Z., and
47.
Waltl, S., Patankar, J. V., Fauler, G., Nusshold,
Liang, M. (2020) Cloning and characterization of
C., Ullen, A., et al. (2013) 25-Hydroxycholesterol
cholesterol 25-hydroxylase (ch25h) from a Marine
regulates cholesterol homeostasis in the murine
Teleost, Chinese Tongue Sole (Cynoglossus
CATH. a neuronal cell line, Neurosci. Lett., 539, 16-
semilaevis), and its gene expressions in response
21, doi: 10.1016/j.neulet.2013.01.014.
to dietary arachidonic acid, Front. Marine Sci., 6,
48.
Reboldi, A., Dang, E. V., McDonald, J. G.,
doi: 10.3389/fmars.2019.00800.
Liang, G., Russell, D. W., et al. (2014) Inflammation.
37.
Ponda, M. P., Liang, Y., Kim, J., Hutt, R., Dowd, K.,
25-Hydroxycholesterol suppresses interleukin-1-
et al. (2017) A randomized clinical trial in vitamin
driven inflammation downstream of type I interferon,
D-deficient adults comparing replenishment with
Science, 345, 679-684, doi: 10.1126/science.1254790.
oral vitamin D3 with narrow-band UV type B light:
49.
Zelcer, N., Hong, C., Boyadjian, R., and
Effects on cholesterol and the transcriptional profiles
Tontonoz, P.
(2009) LXR regulates cholesterol
of skin and blood, Am. J. Clin. Nutr., 105, 1230-1238,
uptake through Idol-dependent ubiquitination of the
doi: 10.3945/ajcn.116.150367.
LDL receptor, Science, 325, 100-104, doi: 10.1126/
38.
De Oliveira, L. R. C., Mimura, L. A. N., Fraga-Silva,
science.1168974.
T. F. C., Ishikawa, L. L. W., Fernandes, A. A. H.,
50.
Baldan, A., Bojanic, D. D., and Edwards, P. A.
et al. (2020) Calcitriol prevents neuroinflammation
(2009) The ABCs of sterol transport, J. Lipid Res., 50
and reduces blood-brain barrier disruption and local
Suppl, S80-85, doi: 10.1194/jlr.R800044-JLR200.
macrophage/microglia activation, Front. Pharmacol.,
51.
Suchanek, M., Hynynen, R., Wohlfahrt, G.,
11, 161, doi: 10.3389/fphar.2020.00161.
Lehto, M., Johansson, M., et al.
(2007) The
39.
Cui, C., Xu, P., Li, G., Qiao, Y., Han, W., et al.
mammalian oxysterol-binding
protein-related
(2019) Vitamin D receptor activation regulates
proteins (ORPs) bind 25-hydroxycholesterol in an
microglia polarization and oxidative stress in
evolutionarily conserved pocket, Biochem. J., 405,
spontaneously hypertensive rats and angiotensin II-
473-480, doi: 10.1042/BJ20070176.
exposed microglial cells: Role of renin-angiotensin
52.
Alpy, F., and Tomasetto, C. (2005) Give lipids a
system, Redox Biol.,
26,
101295, doi:
10.1016/j.
START: The StAR-related lipid transfer (START)
redox.2019.101295.
domain in mammals, J. Cell Sci., 118, 2791-2801,
40.
Honda, A., Miyazaki, T., Ikegami, T., Iwamoto, J.,
doi: 10.1242/jcs.02485.
Maeda, T., et al. (2011) Cholesterol 25-hydroxylation
53.
Abrams, M. E., Johnson, K. A., Perelman, S. S.,
activity of CYP3A, J. Lipid Res., 52, 1509-1516,
Zhang, L. S., Endapally, S., et al. (2020) Oxysterols
doi: 10.1194/jlr.M014084.
provide innate immunity to bacterial infection
41.
Meng, Y., Heybrock, S., Neculai, D., and Saftig, P.
by mobilizing cell surface accessible cholesterol,
(2020) Cholesterol handling in lysosomes and
Nat. Microbiol., 5, 929-942, doi: 10.1038/s41564-
beyond, Trends Cell Biol., 30, 452-466, doi: 10.1016/
020-0701-5.
j.tcb.2020.02.007.
54.
Meffre, D., Shackleford, G., Hichor, M.,
42.
Luo, J., Yang, H., and Song, B. L. (2020) Mechanisms
Gorgievski, V., Tzavara, E. T., et al. (2015) Liver X
and regulation of cholesterol homeostasis, Nat. Rev.
receptors alpha and beta promote myelination and
Mol. Cell Biol., 21, 225-245, doi: 10.1038/s41580-
remyelination in the cerebellum, Proc. Natl. Acad. Sci.
019-0190-7.
USA, 112, 7587-7592, doi: 10.1073/pnas.1424951112.
43.
Ridsdale, A., Denis, M., Gougeon, P. Y., Ngsee,
55.
Lee, S. D., Priest, C., Bjursell, M., Gao, J., Arneson,
J. K., Presley, J. F., et al. (2006) Cholesterol is
D. V., et al. (2019) IDOL regulates systemic energy
required for efficient endoplasmic reticulum-to-Golgi
balance through control of neuronal VLDLR
transport of secretory membrane proteins, Mol. Biol.
expression, Nat. Metab., 1, 1089-1100, doi: 10.1038/
Cell, 17, 1593-1605, doi: 10.1091/mbc.e05-02-0100.
s42255-019-0127-7.
44.
Sever, N., Yang, T., Brown, M. S., Goldstein, J.
56.
Krivoi, I. I., and Petrov, A. M. (2019) Cholesterol
L., and DeBose-Boyd, R. A. (2003) Accelerated
and the safety factor for neuromuscular transmission,
degradation of HMG CoA reductase mediated by
Int. J. Mol. Sci., 20, doi: 10.3390/ij ms20051046.
5
БИОХИМИЯ том 87 вып. 6 2022
754
ОДНОШИВКИНА и др.
57.
Petrov, A. M., and Pikuleva, I. A. (2019) Cholesterol
Schwann cell migration by inducing alpha5 beta1
24-Hydroxylation by CYP46A1: Benefits of
integrin-ErbB2-focal adhesion kinase complex
modulation for brain diseases, Neurotherapeutics, 16,
formation, Genes Cells, 19, 66-77, doi: 10.1111/
635-648, doi: 10.1007/s13311-019-00731-6.
gtc.12108.
58.
Izumi, Y., Cashikar, A. G., Krishnan, K., Paul, S.
69.
Cheng, Z., Zhang, Y., Tian, Y., Chen, Y., Ding, F.,
M., Covey, D. F., et al. (2021) A proinflammatory
et al. (2021) Cyr61 promotes Schwann cell proli-
stimulus disrupts hippocampal plasticity and learning
feration and migration via alphavbeta3 integrin, BMC
via microglial activation and 25-hydroxycholesterol,
Mol. Cell Biol., 22, 21, doi: 10.1186/s12860-021-
J. Neurosci.,
41,
10054-10064, doi:
10.1523/
00360-y.
JNEUROSCI.1502-21.2021.
70.
Lu, C. Y., Santosa, K. B., Jablonka-Shariff, A.,
59.
Rios, R., Jablonka-Shariff, A., Broberg, C., and
Vannucci, B., Fuchs, A., et al. (2020) Macrophage-
Snyder-Warwick, A. K. (2021) Macrophage roles
derived vascular endothelial growth factor-A is
in peripheral nervous system injury and pathology:
integral to neuromuscular junction reinnervation after
Allies
in neuromuscular junction recovery,
nerve injury, J. Neurosci., 40, 9602-9616, doi: 10.1523/
Mol. Cell. Neurosci., 111, 103590, doi: 10.1016/
jneurosci.1736-20.2020.
j.mcn.2021.103590.
71.
Fu, Q., Goodrum, J. F., Hayes, C., Hostettler, J. D.,
60.
Cao, J., Gan, H., Xiao, H., Chen, H., Jian, D., et al.
Toews, A. D., et al. (1998) Control of cholesterol
(2021) Key protein-coding genes related to microglia
biosynthesis in Schwann cells, J. Neurochem., 71,
in immune regulation and inflammatory response
549-555, doi: 10.1046/j.1471-4159.1998.71020549.x.
induced by epilepsy, Math. Biosci. Eng., 18, 9563-
72.
Makoukji, J., Shackleford, G., Meffre, D.,
9578, doi: 10.3934/mbe.2021469.
Grenier, J., Liere, P., et al. (2011) Interplay between
61.
Klejbor, I., Shimshek, D. R., Klimaszewska-Lata, J.,
LXR and Wnt/beta-catenin signaling in the
Velasco-Estevez, M., Morys, J., et al. (2021) EBI2 is
negative regulation of peripheral myelin genes by
expressed in glial cells in multiple sclerosis lesions,
oxysterols, J. Neurosci., 31, 9620-9629, doi: 10.1523/
and its knock-out modulates remyelination in the
jneurosci.0761-11.2011.
cuprizone model, Eur. J. Neurosci., 54, 5173-5188,
73.
Kasimov, M. R., Fatkhrakhmanova, M. R.,
doi: 10.1111/ejn.15359.
Mukhutdinova, K. A., and Petrov, A. M. (2017)
62.
Rutkowska, A., Shimshek, D. R., Sailer, A. W., and
24S-Hydroxycholesterol enhances synaptic vesicle
Dev, K. K. (2018) EBI2 regulates pro-inflammatory
cycling in the mouse neuromuscular junction:
signalling and cytokine release in astrocytes,
Implication of glutamate NMDA receptors and nitric
Neuropharmacology,
133,
121-128, doi:
10.1016/
oxide, Neuropharmacology, 117, 61-73, doi: 10.1016/
j.neuropharm.2018.01.029.
j.neuropharm.2017.01.030.
63.
Zhang, Z. J., Jiang, B. C., and Gao, Y. J. (2017)
74.
Wei, X., Nishi, T., Kondou, S., Kimura, H., and
Chemokines in neuron-glial cell interaction and
Mody, I.
(2019) Preferential enhancement of
pathogenesis of neuropathic pain, Cell. Mol. Life Sci.,
GluN2B-containing native NMDA receptors by the
74, 3275-3291, doi: 10.1007/s00018-017-2513-1.
endogenous modulator
24S-hydroxycholesterol in
64.
Skinner, D. D., and Lane, T. E. (2020) CXCR2
hippocampal neurons, Neuropharmacology, 148, 11-
signaling and remyelination in preclinical models of
20, doi: 10.1016/j.neuropharm.2018.12.028.
demyelination, DNA Cell Biol., 39, 3-7, doi: 10.1089/
75.
Sun, M. Y., Taylor, A., Zorumski, C. F., and
dna.2019.5182.
Mennerick, S.
(2017)
24S-hydroxycholesterol
65.
Raccosta, L., Fontana, R., Maggioni, D., Lanterna, C.,
and
25-hydroxycholesterol differentially impact
Villablanca, E. J., et al. (2013) The oxysterol-CXCR2
hippocampal neuronal survival following oxygen-
axis plays a key role in the recruitment of tumor-
glucose deprivation, PLoS One,
12, e0174416,
promoting neutrophils, J. Exp. Med., 210, 1711-1728,
doi: 10.1371/journal.pone.0174416.
doi: 10.1084/jem.20130440.
76.
Lin, F., Yao, X., Kong, C., Liu, X., Zhao, Z., et al.
66.
Shida, M., Mikami, T., Tamura, J. I., and
(2021)
25-Hydroxycholesterol protecting from
Kitagawa, H. (2019) Chondroitin sulfate-D promotes
cerebral ischemia-reperfusion injury through the
neurite outgrowth by acting as an extracellular ligand
inhibition of STING activity, Aging (Albany NY), 13,
for neuronal integrin alphaVbeta3, Biochim. Biophys.
20149-20163, doi: 10.18632/aging.203337.
Acta Gen. Subj.,
1863,
1319-1331, doi:
10.1016/
77.
Ullrich, C., Pirchl, M., and Humpel, C.
(2010)
j.bbagen.2019.06.004.
Effects of cholesterol and its 24S-OH and 25-OH
67.
Gardiner, N. J., Moffatt, S., Fernyhough, P.,
oxysterols on choline acetyltransferase-positive
Humphries, M. J., Streuli, C. H., et al.
(2007)
neurons in brain slices, Pharmacology, 86, 15-21,
Preconditioning injury-induced neurite outgrowth of
doi: 10.1159/000314333.
adult rat sensory neurons on fibronectin is mediated
78.
Chang, J. Y., and Liu, L. Z. (1997) 25-Hydroxy-
by mobilisation of axonal alpha5 integrin, Mol. Cell
cholesterol causes death but does not prevent nerve
Neurosci., 35, 249-260, doi: 10.1016/j.mcn.2007.02.020.
growth factor-induced neurite outgrowth in PC12
68.
Wakatsuki, S., Araki, T., and Sehara-Fujisawa, A.
cells, Neurochem. Int., 31, 517-523, doi: 10.1016/
(2014) Neuregulin-1/glial growth factor stimulates
s0197-0186(97)00020-x.
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
755
79.
Olivier, E., Dutot, M., Regazzetti, A., Leguillier, T.,
synthase, Hum. Mol. Genet.,
24,
7390-7405,
Dargere, D., et al.
(2016) P2X7-pannexin-1
doi: 10.1093/hmg/ddv439.
and amyloid beta-induced oxysterol input in
90.
Sugita, S., Fleming, L. L., Wood, C., Vaughan, S. K.,
human retinal cell: Role in age-related macular
Gomes, M. P., et al. (2016) VAChT overexpression
degeneration? Biochimie, 127, 70-78, doi: 10.1016/
increases acetylcholine at the synaptic cleft and
j.biochi.2016.04.014.
accelerates aging of neuromuscular junctions, Skelet.
80.
Tajima, N., Xiaoyan, L., Taniguchi, M., and
Muscle, 6, 31, doi: 10.1186/s13395-016-0105-7.
Kato, N.
(2019)
24S-hydroxycholesterol alters
91.
Bryndina, I. G., Shalagina, M. N., Sekunov, A. V.,
activity of large-conductance Ca2+-dependent
Zefirov, A. L., and Petrov, A. M. (2018) Clomipramine
K+ (slo1 BK) channel through intercalation into
counteracts lipid raft disturbance due to short-term
plasma membrane, Biochim Biophys Acta Mol.
muscle disuse, Neurosci. Lett., 664, 1-6, doi: 10.1016/
Cell Biol. Lipids, 1864, 1525-1535, doi: 10.1016/
j.neulet.2017.11.009.
j.bbalip.2019.05.010.
92.
Petrov, A. M., Shalagina, M. N., Protopopov, V. A.,
81.
Phelan, K. D., and Mahler, H. R. (1997) Acute
Sergeev, V. G., Ovechkin, S. V., et al. (2019) Changes
exposure to
25-hydroxy-cholesterol selectively
in membrane ceramide pools in rat soleus muscle in
reduces GABAb and not GABAa receptor-mediated
response to short-term disuse, Int. J. Mol. Sci., 20,
synaptic inhibition, Biochem. Biophys. Res. Commun.,
doi: 10.3390/ij ms20194860.
237, 68-73, doi: 10.1006/bbrc.1997.7070.
93.
Slater, C. R. (2020) “Fragmentation” of NMJs: a
82.
Ishikawa, T., Yuhanna, I. S., Umetani, J., Lee,
sign of degeneration or regeneration? A long journey
W. R., Korach, K. S., et al. (2013) LXRbeta/estrogen
with many junctions, Neuroscience,
439,
28-40,
receptor-alpha signaling in lipid rafts preserves
doi: 10.1016/j.neuroscience.2019.05.017.
endothelial integrity, J. Clin. Invest., 123, 3488-3497,
94.
Dupuis, L., Corcia, P., Fergani, A., Gonzalez
doi: 10.1172/JCI66533.
De Aguilar, J. L., Bonnefont-Rousselot, D.,
83.
Unsworth, A. J., Flora, G. D., and Gibbins, J. M.
et al.
(2008) Dyslipidemia is a protective
(2018) Non-genomic effects of nuclear receptors:
factor
in
amyotrophic
lateral
sclerosis,
Insights from the anucleate platelet, Cardiovasc. Res.,
Neurology,
70,
1004-1009,
doi:
10.1212/
114, 645-655, doi: 10.1093/cvr/cvy044.
01.wnl.0000285080.70324.27.
84.
Mukhutdinova, K. A., Kasimov, M. R., Giniatullin,
95.
Su, X. W., Nandar, W., Neely, E. B., Simmons, Z.,
A. R., Zakyrjanova, G. F., and Petrov, A. M. (2018)
and Connor, J. R. (2016) Statins accelerate disease
24S-hydroxycholesterol suppresses neuromuscular
progression and shorten survival in SOD1(G93A)
transmission in SOD1(G93A) mice: A possible role
mice, Muscle Nerve, 54, 284-291, doi: 10.1002/
of NO and lipid rafts, Mol. Cell Neurosci., 88, 308-
mus.25048.
318, doi: 10.1016/j.mcn.2018.03.006.
96.
Dias, I. H. K., Milic, I., Lip, G. Y. H., Devitt, A.,
85.
Bigini, P., Steffensen, K. R., Ferrario, A.,
Polidori, M. C., et al. (2018) Simvastatin reduces
Diomede, L., Ferrara, G., et al.
(2010)
circulating oxysterol levels in men with hyper-
Neuropathologic and biochemical changes during
cholesterolaemia,RedoxBiol., 16, 139-145, doi: 10.1016/
disease progression in liver X receptor beta-/- mice,
j.redox.2018.02.014.
a model of adult neuron disease, J. Neuropathol.
97.
Wolf, Y., Boura-Halfon, S., Cortese, N., Haimon, Z.,
Exp. Neurol.,
69,
593-605, doi:
10.1097/
Sar Shalom, H., et al.
(2017) Brown-adipose-
NEN.0b013e3181df20e1.
tissue macrophages control tissue innervation and
86.
Hichor, M., Sundaram, V. K., Eid, S. A., Abdel-
homeostatic energy expenditure, Nat. Immunol., 18,
Rassoul, R., Petit, P. X., et al. (2018) Liver X Receptor
665-674, doi: 10.1038/ni.3746.
exerts a protective effect against the oxidative stress in
98.
Limbad, C., Doi, R., McGirr, J., Ciotlos, S.,
the peripheral nerve, Sci. Rep., 8, 2524, doi: 10.1038/
Perez, K., et al.
(2022) Senolysis induced by
s41598-018-20980-3.
25-hydroxycholesterol targets CRYAB in multiple
87.
Abdel-Khalik, J., Yutuc, E., Crick, P. J., Gustafsson,
cell types, iScience,
25,
103848, doi:
10.1016/
J. A., Warner, M., et al. (2017) Defective cholesterol
j.isci.2022.103848.
metabolism in amyotrophic lateral sclerosis, J. Lipid
99.
Dong, Z., He, F., Yan, X., Xing, Y., Lei, Y., et al. (2022)
Res., 58, 267-278, doi: 10.1194/jlr.P071639.
Hepatic reduction in cholesterol
25-hydroxylase
88.
Zakyrjanova, G. F., Giniatullin, A. R.,
aggravates diet-induced steatosis, Cell. Mol.
Mukhutdinova, K. A., Kuznetsova, E. A., and
Gastroenterol. Hepatol., 13, 1161-1179, doi: 10.1016/
Petrov, A. M. (2021) Early differences in membrane
j.jcmgh.2021.12.018.
properties at the neuromuscular junctions of ALS
100. Mukhutdinova, K. A., Kasimov, M. R., Zakyrjanova,
model mice: Effects of 25-hydroxycholesterol, Life
G. F., Gumerova, M. R., and Petrov, A. M.
Sci., 273, 119300, doi: 10.1016/j.lfs.2021.119300.
(2019) Oxysterol modulates neurotransmission
89.
Henriques, A., Croixmarie, V., Priestman, D. A.,
via
liver-X receptor/NO synthase-dependent
Rosenbohm, A., Dirrig-Grosch, S., et al.
(2015)
pathway at the mouse neuromuscular junctions,
Amyotrophic lateral sclerosis and denervation alter
Neuropharmacology,
150,
70-79, doi:
10.1016/
sphingolipids and up-regulate glucosylceramide
j.neuropharm.2019.03.018.
БИОХИМИЯ том 87 вып. 6 2022
5*
756
ОДНОШИВКИНА и др.
101. Tyganov, S. A., Mochalova, E., Belova, S.,
Similar oxysterols may lead to opposite effects on
Sharlo, K., Rozhkov, S., et al.
(2021) Plantar
synaptic transmission: Olesoxime versus
5alpha-
mechanical stimulation attenuates protein synthesis
cholestan-3-one at the frog neuromuscular junction,
decline in disused skeletal muscle via modulation of
Biochim. Biophys. Acta, 1861, 606-616, doi: 10.1016/
nitric oxide level, Sci. Rep., 11, 9806, doi: 10.1038/
j.bbalip.2016.04.010.
s41598-021-89362-6.
111. Kasimov, M. R., Giniatullin, A. R., Zefirov, A. L.,
102. Tyganov, S. A., Mochalova, E. P., Melnikov, I. Y.,
and Petrov, A. M. (2015) Effects of 5alpha-cholestan-
Vikhlyantsev, I. M., Ulanova, A. D., et al. (2021)
3-one on the synaptic vesicle cycle at the mouse
NOS-dependent effects of plantar mechanical
neuromuscular junction, Biochim. Biophys. Acta,
stimulation on mechanical characteristics and
1851, 674-685, doi: 10.1016/j.bbalip.2015.02.012.
cytoskeletal proteins in rat soleus muscle during
112. Petrov, A. M., Mast, N., Li, Y., Denker, J., and
hindlimb suspension, FASEB. J,
35, e21905,
Pikuleva, I. A. (2020) Brain sterol flux mediated by
doi: 10.1096/fj.202100783R.
cytochrome P450 46A1 affects membrane properties
103. Petrov, A. M., Kravtsova, V. V., Matchkov, V. V.,
and membrane-dependent processes, Brain
Vasiliev, A. N., Zefirov, A. L., et al. (2017) Membrane
Commun., 2, doi: 10.1093/braincomms/fcaa043.
lipid rafts are disturbed in the response of rat
113. Kobierski, J., Wnetrzak, A., Chachaj-Brekiesz, A.,
skeletal muscle to short-term disuse, Am. J. Physiol.
Filiczkowska, A., Petelska, A. D., et al.
Cell Physiol.,
312, C627-C637, doi:
10.1152/
(2021) How the replacement of cholesterol by
ajpcell.00365.2016.
25-hydroxycholesterol affects the interactions with
104. Clements, L., and Harvey, J. (2020) Activation of
sphingolipids: The Langmuir Monolayer Study
oestrogen receptor alpha induces a novel form of LTP
complemented with theoretical calculations, J. R. Soc.
at hippocampal temporoammonic-CA1 synapses,
Interface, 18, 20210050, doi: 10.1098/rsif.2021.0050.
Br. J. Pharmacol.,
177,
642-655, doi:
10.1111/
114. Olsen, B. N., Schlesinger, P. H., Ory, D. S., and
bph.14880.
Baker, N. A. (2011) 25-Hydroxycholesterol increases
105. Brooks, S. W., Dykes, A. C., and Schreurs,
the availability of cholesterol in phospholipid
B. G.
(2017) A high-cholesterol diet increases
membranes, Biophys. J., 100, 948-956, doi: 10.1016/
27-hydroxycholesterol and modifies estrogen
j.bpj.2010.12.3728.
receptor expression and neurodegeneration in rabbit
115. Bielska, A. A., Olsen, B. N., Gale, S. E., Mydock-
hippocampus, J. Alzheimer’s Dis.,
56,
185-196,
McGrane, L., Krishnan, K., et al. (2014) Side-chain
doi: 10.3233/JAD-160725.
oxysterols modulate cholesterol accessibility through
106. Jetten, A. M., Takeda, Y., Slominski, A., and Kang,
membrane remodeling, Biochemistry, 53, 3042-3051,
H. S. (2018) Retinoic acid-related Orphan Receptor
doi: 10.1021/bi5000096.
gamma (RORgamma): Connecting sterol metabolism
116. Xu, X., and London, E. (2000) The effect of sterol
to regulation of the immune system and autoimmune
structure on membrane lipid domains reveals how
disease, Curr. Opin. Toxicol., 8, 66-80, doi: 10.1016/
cholesterol can induce lipid domain formation,
j.cotox.2018.01.005.
Biochemistry, 39, 843-849, doi: 10.1021/bi992543v.
107. Solt, L. A., Griffin, P. R., and Burris, T. P. (2010)
117. Olsen, B. N., Schlesinger, P. H., and Baker, N. A.
Ligand regulation of retinoic acid receptor-related
(2009) Perturbations of membrane structure by
orphan receptors: Implications for development of
cholesterol and cholesterol derivatives are determined
novel therapeutics, Curr. Opin. Lipidol., 21, 204-211,
by sterol orientation, J. Am. Chem. Soc., 131, 4854-
doi: 10.1097/MOL.0b013e328338ca18.
4865, doi: 10.1021/ja8095224.
108. Journiac, N., Jolly, S., Jarvis, C., Gautheron, V.,
118. Domingues, M. M., Gomes, B., Hollmann, A., and
Rogard, M., et al. (2009) The nuclear receptor
Santos, N. C. (2021) 25-hydroxycholesterol effect
ROR(alpha) exerts a bi-directional regulation of
on membrane structure and mechanical properties,
IL-6 in resting and reactive astrocytes, Proc. Natl.
Int. J. Mol. Sci., 22, doi: 10.3390/ij ms22052574.
Acad. Sci. USA, 106, 21365-21370, doi: 10.1073/
119. Gomes, B., Goncalves, S., Disalvo, A.,
pnas.0911782106.
Hollmann, A., and Santos, N. C. (2018) Effect of
109. Schaeren-Wiemers, N., Andre, E., Kapfhammer,
25-hydroxycholesterol in viral membrane fusion:
J. P., and Becker-Andre, M. (1997) The expression
Insights on HIV inhibition, Biochim. Biophys.
pattern of the orphan nuclear receptor RORbeta in
Acta Biomembr.,
1860,
1171-1178, doi:
10.1016/
the developing and adult rat nervous system suggests
j.bbamem.2018.02.001.
a role in the processing of sensory information and
120. Sibarov, D. A., Poguzhelskaya, E. E., and Antonov,
in circadian rhythm, Eur. J. Neurosci., 9, 2687-2701,
S. M. (2018) Downregulation of calcium-dependent
doi: 10.1111/j.1460-9568.1997.tb01698.x.
NMDA receptor desensitization by sodium-calcium
110. Kasimov, M. R., Zakyrjanova, G. F., Giniatullin,
exchangers: A role of membrane cholesterol, BMC
A. R., Zefirov, A. L., and Petrov, A. M.
(2016)
Neurosci., 19, 73, doi: 10.1186/s12868-018-0475-3.
БИОХИМИЯ том 87 вып. 6 2022
25ГИДРОКСИХОЛЕСТЕРИН СИГНАЛЬНАЯ МОЛЕКУЛА
757
25HYDROXYCHOLESTEROL
AS A SIGNALING MOLECULE IN THE NERVE SYSTEM
Review
U. G. Odnoshivkina1,2#, E. A. Kuznetsova1#, and A. M. Petrov1,2*
1 Laboratory of Biophysics of Synaptic Processes, Kazan Institute of Biochemistry and Biophysics,
FRC “Kazan Scientific Center of RAS”, 420111 Kazan, Russia; e-mail: alexey.petrov@kazangmu.ru
2 Kazan State Medical University, 420012 Kazan, Russia
Cholesterol is an essential component of plasma membranes and precursor of biological active compounds,
including hydroxycholesterols (HCs). HCs regulate cellular homeostasis of cholesterol and they, passing across
membrane and vascular barriers, can act distantly as para- and endocrine agents. A small amount of 25-HC is
produced in endoplasmic reticulum of most cells, where it serves as a potent regulator of cholesterol synthesis,
its intracellular transport and storage. Production of 25-HC is greatly increased in macrophages, dendrite
cells and microglia during triggering inflammatory reactions. Also, a synthesis of 25-HC can be upregulated
at some neurological disorders, such as Alzheimer disease, amyotrophic lateral sclerosis, spastic paraplegia
type 5 and X-linked adrenoleukodystrophy. However, it is unclear whether 25-HC aggravates the pathologies
or has protective properties. Molecular targets for 25-HC are several transcriptional factors (LX-receptors,
SREBP2, ROR), G-protein coupled receptor (GPR183), ion channels (NMDA-receptors, SLO1), adhesive
molecules (α5β1 and αvβ3 integrins), and oxysterol-binding proteins. The diversity of 25-HC binding pro-
teins points to the ability of the HC to affect many physiological and pathological processes. In the current re-
view, we focused on the regulation of 25-HC production and its universal role in control of cellular cholesterol
homeostasis, as well as the effects of 25-HC as a signaling molecule mediating an influence of inflammation
on the processes in neuromuscular system and brain. Based on evidences collected, it can be considered that
25-HC prevents accumulation of cellular cholesterol and serves as a potent modulator of neuroinflammation,
synaptic transmission and myelinization. Its enhanced production in response to a broad range of “injuries”
can have a protective role, decreasing neuronal loss. Although, an “overdose” of 25-HC might exert neuro-
toxic effects.
Keywords: cholesterol, 25-hydroxycholesterol, liver X receptors, NMDA receptors, synaptic transmission, neuroin-
flammation, microglia
БИОХИМИЯ том 87 вып. 6 2022