БИОХИМИЯ, 2022, том 87, вып. 6, с. 758 - 779
УДК 616.8;612.017
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ:
ДВАДЦАТЬ ЛЕТ ИЗУЧЕНИЯ
Обзор
© 2022 Е.П. Киселeва1,2*, К.В. Рутто1
1 ФГБНУ «Институт экспериментальной медицины»,
197376 Санкт-Петербург, Россия; электронная почта: ekissele@yandex.ru
2 Северо-Западный государственный медицинский университет имени И.И. Мечникова,
195067 Санкт-Петербург, Россия
Поступила в редакцию 19.02.2022
После доработки 15.05.2022
Принята к публикации 17.05.2022
Семафорин 3А - секретируемый гликопротеин, который первоначально был описан в нервной систе-
ме как фактор, направляющий рост аксонов, но он также является и иммунорегуляторным фактором.
В обзоре приводится систематический анализ всех публикаций, имеющихся в доступной литературе
за последние 20 лет, в которых изучалось действие семафорина 3А на Т-лимфоциты, миелоидные ден-
дритные клетки и макрофаги. Детально описана экспрессия рецепторов семафорина 3А - нейропи-
лина-1 и плексинов А-класса - на этих клетках. Данные, полученные на клетках человека и мыши,
рассмотрены в сравнительном аспекте. Впервые представлена подробная характеристика действия
семафорина 3А на клетки мононуклеарно-фагоцитарной системы. Основной точкой приложения
действия семафорина 3А является изменение цитоскелета и морфологии клетки, посредством чего
осуществляется регуляция процессов миграции, адгезии и межклеточной кооперации клеток иммун-
ной системы. Этот фактор контролирует различные этапы иммунного ответа, включающие фазу ини-
циации иммунного ответа, презентацию антигена, функционирование эффекторных Т-клеток, фазу
воспаления, активацию и поляризацию макрофагов. В последние годы интерес к семафорину 3А
значительно возрос, поскольку было установлено, что он участвует в патогенезе многих заболеваний
человека и может быть использован для их лечения в эксперименте. Изучение иммунорегуляторного
действия семафорина 3А имеет важное значение, поскольку этот фактор и его рецепторы можно рас-
сматривать в качестве перспективных мишеней для создания новых средств терапии аутоиммунных,
аллергических и онкологических заболеваний.
КЛЮЧЕВЫЕ СЛОВА: семафорин 3А, нейропилин-1, плексин, Т-лимфоциты, дендритные клетки,
макрофаги.
DOI: 10.31857/S0320972522060057, EDN: AUERQN
ВВЕДЕНИЕ
среди так называемых иммунных семафори-
нов. За последние 10 лет интерес к этому белку
Первая работа по иммунорегуляторному
значительно возрос: по данным базы PubMed
действию семафорина 3А была опубликована
ежегодно публикуется более 60 статей по сема-
чуть более 20 лет назад - в 2001 г. [1]. С тех пор
форину 3А и более 120 - по его рецептору ней-
этот фактор прочно занял одно из главных мест ропилину-1 (Nrp-1). Повышенное внимание к
этому фактору объясняется тем, что он участву-
ет в патогенезе аутоиммунных, аллергических,
Принятые сокращения: Ig-домен - иммуноглобули-
ноподобный домен; HGF - фактор роста гепатоцитов;
а также онкологических заболеваний и может
KGF - фактор роста кератиноцитов; LPS - липополисаха-
быть успешно использован для их лечения в
рид; M-CSF - макрофагальный колониестимулирующий
эксперименте [2-4].
фактор; Nrp-1 - нейропилин-1; PlexA - плексин класса А;
Семафорин 3А - гликопротеин, секрети-
PSI-домен - плексин-семафорин-интегриновый домен;
Sema-домен - семафориновый домен; TGF-β - транс-
руемый многими клетками человеческого орга-
формирующий фактор роста β; TLR - толл-подобный
низма. С точки зрения иммунолога, это очень
рецептор.
необычный фактор. Он является одновременно
* Адресат для корреспонденции.
758
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
759
и нейрональным, и иммунорегуляторным фак-
сов и рассматривают данный фактор довольно
тором, а кроме того, проявляет ещё и анти-ан-
кратко [5-7], другие - описывают роль сема-
гиогенную активность. Одной из характерных
форина 3А в условиях патологии [2, 3], третьи -
особенностей семафорина 3А является его спо-
представляют данные только по его рецепто-
собность оказывать хеморепеллентное воздей-
ру Nrp-1 [8, 9].
ствие, при котором направленная миграция
Настоящий обзор впервые целиком посвя-
клеток происходит по отрицательному градиен-
щён одному фактору - семафорину 3А и его
ту, т.е. в противоположную сторону от фактора.
главным образом физиологической роли в им-
Строение и характер функционирования
мунной системе. Приводится систематический
семафорина 3А также заметно отличаются от
анализ всех публикаций, имеющихся в доступ-
других известных иммунорегуляторных моле-
ной литературе, в которых было изучено влия-
кул. Например, семафорин 3А имеет сходство
ние семафорина 3А на Т-лимфоциты, миелоид-
в строении со своим рецептором, плексином,
ные дендритные клетки и макрофаги. Детально
что предполагает их общее происхождение в
описана экспрессия рецепторов семафорина 3А
эволюции. Для взаимодействия с клеткой сема-
на этих клетках. Данные, полученные на клетках
форину 3А необходим не один, а два рецепто-
человека и мыши, рассмотрены в сравнитель-
ра, объединённые в единый функциональный
ном аспекте. Впервые представлена подробная
комплекс, голорецептор, в котором один из ре-
характеристика действия семафорина 3А на
цепторов - Nrp-1, связывает лиганд, а другой -
клетки мононуклеарно-фагоцитарной системы.
плексин А-класса, осуществляет проведение
сигнала.
Сигнальные пути тоже достаточно уникаль-
КЛАССИФИКАЦИЯ
ны, поскольку плексин является единственным
рецептором, содержащим GAP-домен. Он взаи-
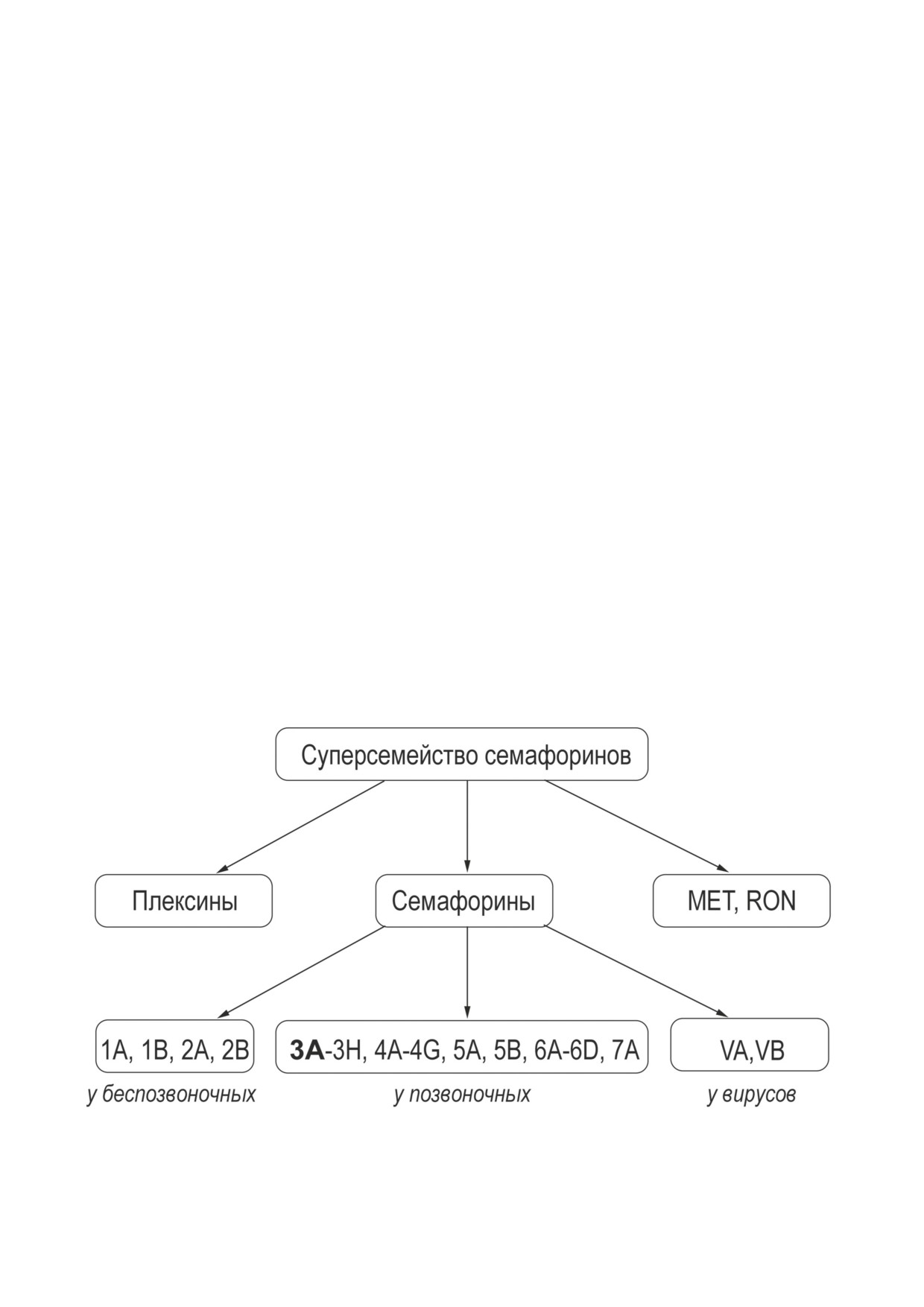
Семафорин 3А принадлежит к большому
модействует с G-белками, в результате чего осу-
семейству семафоринов (коллапсинов), состоя-
ществляется регуляция адгезии, миграции, про-
щему из 30 гликопротеинов, подразделяемых на
лиферации или выживания различных клеток.
8 классов [5]. Первые два класса (1-2) обнару-
В литературе можно найти немало обзор-
жены у беспозвоночных, классы 3-7 - у позво-
ных публикаций, касающихся иммунорегуля-
ночных (рыб, птиц, земноводных и млекопи-
торного действия семафорина 3А, однако одни
тающих), а V - представляет собой отдельный
из них посвящены семафоринам разных клас-
класс вирусных семафоринов. Семафорины не
Рис. 1. Классификация семафоринов
БИОХИМИЯ том 87 вып. 6 2022
760
КИСЕЛEВА, РУТТО
встречаются у одноклеточных эукариот и про-
Рядом с Sema-доменом расположен не-
кариот.
большой богатый цистеином плексин-сема-
Основным отличительным признаком се-
форин-интегриновый (PSI) домен, за которым
мафоринов является наличие на N-конце моле-
следует иммуноглобулиноподобный (Ig) до-
кулы высококонсервативного семафоринового
мен. На С-конце молекулы находится основ-
домена (Sema-домена), который также имеется
ный (basic) домен.
в составе плексинов (рецепторов семафори-
Sema-домен важен для передачи сигнала и
нов) и двух тирозинкиназных рецепторов MET
биологической специфичности семафорина,
и RON, являющихся рецепторами ростовых
связанные дисульфидным мостиком Ig-домены
факторов - фактора роста гепатоцитов (HGF)
физически стабилизируют гомодимерную моле-
и HGF-подобного фактора (HGFl) соответ-
кулу, а С-конец определяет сродство к рецепто-
ственно. Все три семейства белков (семафори-
ру - Nrp-1 [3, 5, 6].
ны, плексины, а также MET и RON) образуют
суперсемейство семафоринов (рис. 1).
Если N-концевая часть у всех семафоринов
РЕЦЕПТОРЫ СЕМАФОРИНА 3А
схожа по строению, то С-конец молекулы зна-
чительно различается, и от его строения зависит
Семафорин 3А взаимодействует с клетка-
возможность связывания с клеточной мембра-
ми через функцинальный рецепторный ком-
ной. Семафорины могут быть секретируемы-
плекс, состоящий из Nrp-1 и плексина клас-
ми, трансмембранными или заякоренными на
са А (PlexA).
плазматической мембране.
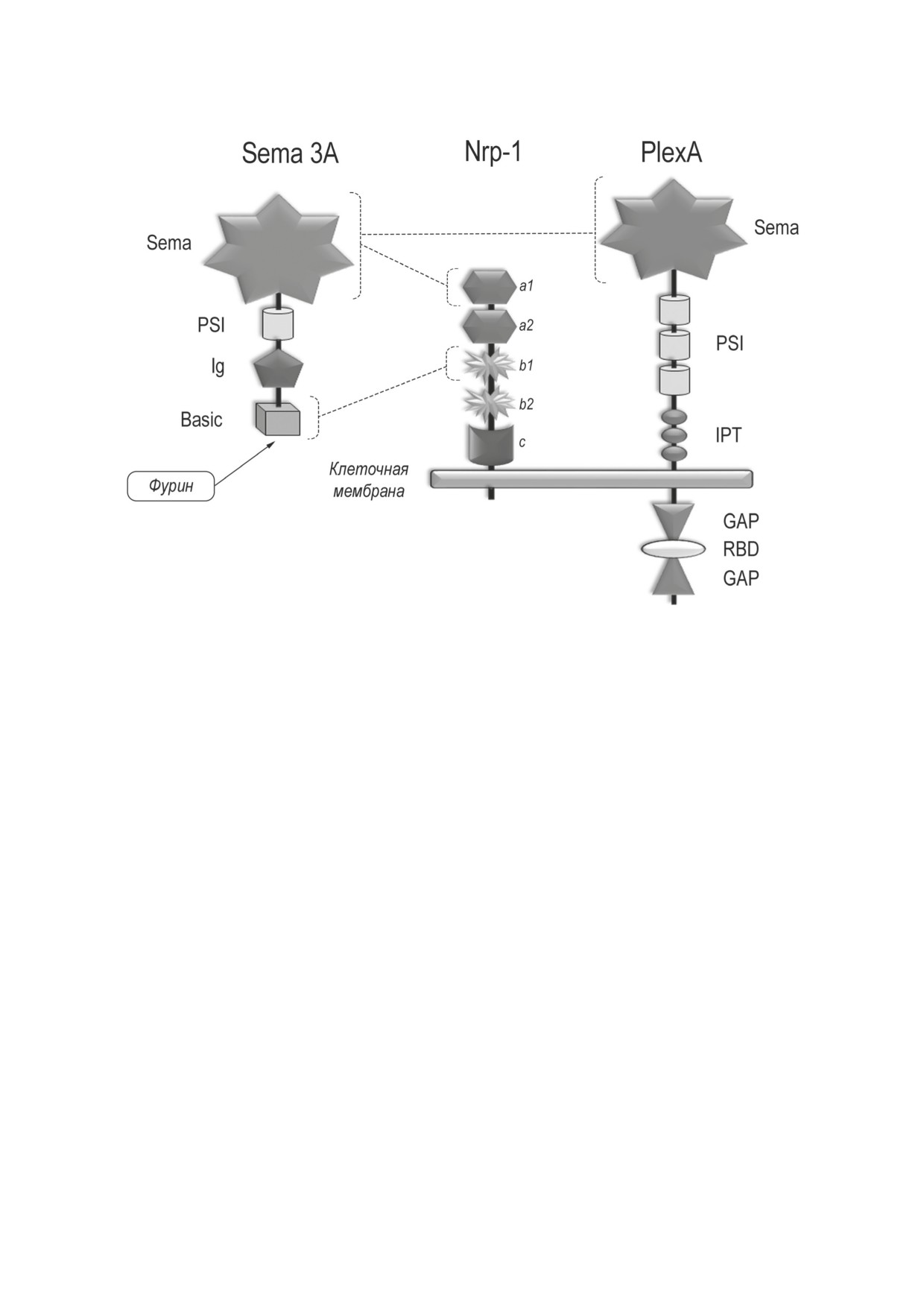
Nrp-1 (CD304) - трансмембранный белок
Семафорины 3-класса отличаются от всех
с молекулярной массой 120-130 кДа. Внекле-
других семафоринов у позвоночных тем, что
точная часть нейропилина-1 содержит два ком-
они являются секретируемыми и имеют на
плементсвязывающих домена - a1/a2 (CUB-до-
С-конце молекулы основный, положительно
мен), два домена, гомологичных факторам
заряженный, домен. Известно 7 белков 3-класса
свёртывания V/VIII - b1/b2, и с-домен (MAM,
(3A-3H), из которых наиболее хорошо изучен
меприн) (рис. 2). Nrp-1 имеет короткий цито-
семафорин 3A.
плазматический домен (около 40 аминокислот),
не имеющий явных сигнальных последователь-
ностей, поэтому для передачи сигнала необхо-
ИДЕНТИФИКАЦИЯ И СТРОЕНИЕ
димо образование комплекса Nrp-1 с плексина-
ми класса А (PlexA1-A4).
Семафорины 3-класса были первоначально
В данном комплексе Nrp-1 выступает в
описаны как факторы, регулирующие направ-
роли рецептора, связывающего семафорин 3А,
ление роста аксонов. В 1990 г. из мозга эмбриона
а плексин - передает сигнал в клетку. При про-
цыплёнка был выделен белок, который вызывал
ведении сигнала от семафорина 3А формирует-
коллапс конусов роста нейронов в культуре, он
ся голорецептор - гетеротетрамер, состоящий
получил название коллапсин-1 [10] и позднее
из двух молекул Nrp-1 и двух молекул PlexA, ко-
был переименован в семафорин 3А.
торые объединены в единый функциональный
Семафорин 3A представляет собой гомо-
комплекс с помощью гомодимерной молекулы
димер, состоящий из мономеров с молекуляр-
семафорина 3А [11]. При этом оба PlexА могут
ной массой 110 кДа, имеющих мультидоменное
быть гомологичными (например, димер плек-
строение. Каждый мономер состоит из 4 доме-
синов PlexА2) или гетерологичными (напри-
нов.
мер, PlexА1 и PlexА4) в зависимости от степе-
На N-конце молекулы семафорина 3А, как
ни их экспрессии в клетке [3]. Они даже могут
и у всех семафоринов, имеется Sema-домен. Он
заменять друг друга в рецепторном комплексе,
состоит из 500 аминокислот, имеет форму 7-ло-
проявляя при этом высокую пластичность при
пастного β-пропеллера, богат дисульфидны-
проведении сигнала в разных условиях.
ми связями. Топологическая структура в виде
Плексины класса А представляют собой
β-пропеллера широко распространена среди
большие трансмембранные гликопротеины с
различных внеклеточных и цитозольных бел-
молекулярной массой около 200 кДа, состоящие
ков, однако β-пропеллер семафоринов является
из двух частей - внеклеточной и внутриклеточ-
самой большой из известных молекул подобно-
ной. Внеклеточная часть PlexA по строению
го рода.
схожа с семафорином 3A и состоит из N-конце-
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
761
Рис. 2. Строение семафорина 3А (Sema 3A) и его рецепторов Nrp-1 и PlexA. Взаимодействия между молекулами показаны
пунктиром (пояснения в тексте)
вого Sema-домена, к которому присоединены
ПРОВЕДЕНИЕ
три PSI-домена; за ними следуют три IPT-доме-
ВНУТРИКЛЕТОЧНОГО СИГНАЛА
на (иммуноглобулин-плексин-транскрипцион-
ный фактор).
Цитоплазматический сегмент PlexA не со-
При взаимодействии семафорина 3А с Nrp-1
держит тирозинкиназного домена, характерно-
происходит дивалентное связывание Sema-до-
го для рецепторов ростовых факторов, но содер-
мена семафорина 3А с а1-доменом Nrp-1 (с низ-
жит высококонсервативный GAP-домен (белок,
кой аффинностью) и основного (basic) домена
активирующий или связывающий ГТФазу).
семафорина 3А с b1-доменом Nrp-1 (с высо-
Он относится к регуляторным белкам, которые
кой аффинностью) (рис. 2). Причём последнее
могут связываться с активированными G-бел-
осуществляется только после воздействия на
ками и стимулировать их ГТФазную актив-
семафорин 3А тканевой эндопептидазы - фу-
ность, т.е. ускорять процесс дефосфорилирова-
рина [12]. Протеолитическая обработка фер-
ния ГТФ с образованием ГДФ, в результате чего
ментом является важным этапом созревания
сигнальное событие прекращается.
молекул семафоринов 3-класса, которые син-
Цитоплазматический фрагмент плекси-
тезируются в неактивной форме. В результате
нов А обладает способностью активировать
протеолиза на С-конце семафорина высвобож-
мономерные малые ГТФазы, G-белки, принад-
дается концевой аргинин, необходимый для
лежащие двум семействам Ras и Rho. Они пред-
взаимодействия с b1-доменом Nrp-1.
ставляют собой сигнальные молекулы, регули-
Семафорин 3А не может связываться с мо-
рующие адгезию, миграцию, пролиферацию,
лекулой плексина с высокой аффинностью,
дифференцировку и выживание клеток. Про-
однако описана возможность низкоаффинного
ведение сигнала от комплекса семафорина 3А
взаимодействия Sema-доменов плексина и се-
с рецепторами наиболее подробно изучено в
мафорина 3А («голова к голове»), способствую-
нервной системе, и показано, что в нём уча-
щего димеризации и активации рецептора [12].
ствуют молекулы R-Ras, M-Ras и Rap, принад-
БИОХИМИЯ том 87 вып. 6 2022
762
КИСЕЛEВА, РУТТО
лежащие к семейству Ras, а также RhoA, Rac1 и
харида (LPS) [15] (таблица). Кроме того, через
Rnd - из семейства Rho.
RhoA-ROCK (Rho-associated coiled-coil-forming
ГТФазы Ras и Rap воздействуют на функ-
serine/threonine specific protein kinase) сигналь-
цию интегрина и контролируют клеточную ад-
ный путь под действием семафорина 3А про-
гезию, Rho-белки влияют на морфологию и
исходит усиление миграции дендритных кле-
подвижность клетки, и так же, как и Ras-белки,
ток [16] и макрофагов [17]. В том случае, если
играют важную роль в перестройке актинового
Rho-связывающие ГТФазы активируются дру-
цитоскелета [5]. Активация R-Ras и Rap1 может
гим фактором, например, макрофагальным
запускать различные ингибиторные эффекты
колониестимулирующим фактором (M-CSF),
семафорина 3А в нервной и сосудистой тка-
семафорин 3А может подавлять этот эффект и
нях [5, 12]. В иммунной системе активация Rap1
ингибировать миграцию макрофагов [18].
участвует в подавлении семафорином 3А проли-
Во всех перечисленных, а также во многих
ферации Т-лимфоцитов человека [13] (таблица).
других случаях основными мишенями действия
В неактивном состоянии два GAP-доме-
семафорина 3А являются актиновый цитоске-
на разделены RBD-доменом, который сам
лет и фокальная адгезия. Их изменения влияют
является Rho-связывающей ГТФазой (Rho-
на морфологию клеток, межклеточные взаи-
GTPase binding domain) (рис. 2). При взаимо-
модействия, адгезию и миграцию Т-лимфоци-
действии с семафорином происходит связыва-
тов [19-21] и дендритных клеток [14, 16, 22].
ние RBD-домена с Rho-ГТФазами, в результате
Кроме активации малых ГТФаз, в нервных
чего происходят конформационные изменения,
клетках описаны также и другие пути проведе-
которые позволяют разделённым частям GAP
ния сигнала, которые мало изучены в клетках
взаимодействовать и активироваться. Таким
иммунной системы. Действие семафорина 3А
образом, и RBD-, и GAP-домены взаимодей-
на клеточный цитоскелет может осуществлять-
ствуют со своими G-белками, запуская сложные
ся путём взаимодействия цитоплазматического
каскады проведения внутриклеточного сигнала,
конца PlexА с двумя группами молекул - белка-
приводящие не только к ингибиторным, но и к
ми семейства MICAL (molecules interacting with
активирующим эффектам.
CasL) и нерецепторными внутриклеточными
С участием Rho-связывающих ГТФаз осу-
тирозинкиназами Fes и Fyn [3]. Белки семей-
ществляются PlexA1-опосредованные изме-
ства MICAL являются ферментами, обладаю-
нения цитоскелета дендритных клеток, не-
щими монооксигеназной активностью, бла-
обходимые для их способности активировать
годаря чему они окисляют актин и вызывают
Т-лимфоциты [14], а также PlexA4-опосредо-
диссоциацию актиновых нитей. Кроме того,
ванная активация провоспалительной актив-
белки MICAL и тирозинкиназы Fes и Fyn могут
ности макрофагов в присутствии липополиса-
приводить к фосфорилированию сигнальной
Участие малых ГТФаз в передаче сигнала, запускаемого семафорином 3А в клетках иммунной системы
Рецептор из
комплекса
Клетка
Сигнальные молекулы
Функция
Ссылка
Nrp-1/PlexA
Т-лимфоциты
подавление пролиферации
Nrp-1
Rap1
[13]
человека
и синтеза цитокинов
дендритные
поддержание способности дендритных
PlexA1
Rho/ROCK-киназа
[14]
клетки мыши
клеток активировать Т-лимфоциты*
усиление синтеза провоспалительных
PlexA4
макрофаги мыши
Rac1
[15]
цитокинов, индуцированного LPS
дендритные
усиление трансмиграции через
Nrp-1/PlexA1
RhoA/ROCK-киназа
[16]
клетки мыши
лимфатический эндотелий
Nrp-1
макрофаги мыши
RhoA/ROCK-киназа
стимуляция миграции макрофагов
[17]
подавление RhoA-пути,
подавление миграции,
Nrp-1
макрофаги мыши
[18]
активированнного M-CSF
индуцированной M-CSF
Примечание. * Непосредственное участие семафорина 3А не показано, но предполагается.
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
763
молекулы CRMP2 (collapsin response mediator
взаимодействовать с другими семафорина-
protein 2), что вызывает деполимеризацию ту-
ми 3-класса, а именно: с семафоринами 3В и
булина и подавляет сборку микротрубочек. Тем
3С [3], а также с семафоринами 6-класса [5, 29].
самым оказывается влияние на морфологию
Некоторые плексины, независимо от при-
клетки и направление роста аксонов [5].
сутствия семафорина 3А, могут участвовать
CRMP2 присутствует в цитоплазме CD4+ и
в процессах активации и дифференцировки
CD8+ Т-лимфоцитов, а также моноцитов кро-
макрофагов. Так, по неизвестному механиз-
ви человека [23]. CRMP2 играет существенную
му PlexA4 вовлечён в проведение сигнала от
роль в биполярной реорганизации цитоскелета
толл-подобных рецепторов (TLRs) [15], а PlexA1
при спонтанной и хемокин-индуцированной
участвует в дифференцировке остеокластов под
миграции Т-лимфоцитов, однако не участвует
действием RANKL [18] (см. раздел, посвящён-
в проведении сигнала от семафорина 3А, кото-
ный макрофагам).
рый подавляет миграцию этих клеток [23].
Ещё одно уникальное свойство Nrp-1 и
Возможны и другие механизмы воздействия
плексинов А-класса - это возможность функ-
семафорина 3А на клетку, связанные, в частно-
ционирования в качестве самостоятельных
сти, с развитием апоптоза. Показано, что этот
адгезионных молекул. Nrp-1 и PlexA первона-
фактор усиливает апоптоз в Т-клеточных ли-
чально были описаны как адгезионные молеку-
ниях [24], а также в макрофагах человека [25] и
лы [30, 31]. На различных клетках, не принад-
крысы, что происходит с участием каспаз [26].
лежащих к иммунной системе, показано, что
Nrp-1 взаимодействует с интегринами (beta1,
αVβ3 и α5β1) и другими адгезионными моле-
ДРУГИЕ ФУНКЦИИ РЕЦЕПТОРОВ
кулами (например, L1-CAM, L1-cell adhesion
(НЕ СВЯЗАННЫЕ С СЕМАФОРИНОМ 3А)
molecule), находящимися латерально на мем-
бране той же клетки, и влияет на процессы ад-
Nrp-1 является многофункциональным
гезии к внеклеточному матриксу и миграции [3,
трансмембранным белком, который способен
9, 32]. В иммунной системе Nrp-1 и PlexA1, так-
взаимодействовать с большим числом струк-
же независимо от присутствия семафорина 3А,
турно неродственных лигандов. Nrp-1 через b1/
принимают участие в адгезии тимоцитов к эпи-
b2-домены может взаимодействовать со мно-
телиальным клеткам тимуса мыши [33].
гими ростовыми факторами, такими как ро-
Вызывают большой интерес сведения об
стовой фактор сосудистого эндотелия (VEGF),
участии Nrp-1 и PlexA1 в образовании иммун-
трансформирующий фактор роста β (TGF-β),
ного синапса между наивными Т-лимфоцита-
плацентарный фактор роста (PLGF), фактор
ми и антиген-презентирующими клетками. Оба
роста гепатоцитов (HGF), фактор роста кера-
рецептора выявляются в зоне контакта как со
тиноцитов (KGF), тромбоцитарный фактор ро-
стороны дендритных клеток, так и Т-лимфоци-
ста (PDGF-D) и др. При этом Nrp-1 образует
тов человека [19, 20, 34] и мыши [14, 35]. Описа-
с тирозинкиназными рецепторами этих факто-
на возможность гомофильного взаимодействия
ров функциональные комплексы (голорецеп-
между двумя молекулами Nrp-1, одна из кото-
торы) и влияет на передачу сигнала [3, 8].
рых находится на Т-лимфоците, а другая - на
Лигандами Nrp-1 также являются гепа-
дендритной клетке; блокирующие антитела
рин и гепарансульфат, галектин-1 и микроР-
к Nrp-1 подавляют образование конъюгатов
НК [7, 8]. Nrp-1 был идентифицирован в
между ними [34]. Nrp-1 пролонгирует кон-
качестве рецептора C4d, C3d и iC3b - компо-
такт между Т-регуляторными и антиген-пре-
нентов комплемента, связывание с которыми
зентирующими клетками [35], поддерживает
осуществляется через b1-домен [27]. Недавно
стабильность и функционирование Т-регуля-
было показано, что Nrp-1 взаимодействует с
торных клеток [36], а также способствует про-
S-белком вируса SARS-CoV-2 и способству-
ведению сигнала от TGF-β, являющегося клю-
ет заражению клетки [28]. Все вышесказанное
чевым фактором их индукции [37].
позволяет охарактеризовать Nrp-1, как много-
Таким образом, Nrp-1 и PlexА являются не
функциональный узловой координирующий
только рецепторами семафорина 3А, но и спо-
рецептор (scaffold receptor) [3].
собны участвовать в осуществлении межкле-
Плексины А-класса также не являются ре-
точных контактов в иммунной системе в каче-
цепторами, специфичными для проведения
стве самостоятельных молекул при отсутствии
сигнала только от семафорина 3А. Они могут
своего основного лиганда.
БИОХИМИЯ том 87 вып. 6 2022
764
КИСЕЛEВА, РУТТО
ЭКСПРЕССИЯ
отмечено среди CD4+ Т-лимфоцитов крови [38]
СЕМАФОРИНА 3А В ОРГАНИЗМЕ
и CD3+ Т-клеток синовиальной ткани у боль-
ных ревматоидным артритом [43], а также сре-
Семафорин 3А играет важную роль в эмбрио-
ди CD4+ и CD8+ Т-лимфоцитов, выделенных из
генезе и участвует в формировании жизненно
различных опухолей человека [21, 41, 42].
важных систем, таких как центральная нервная
Эти данные позволили ряду авторов вы-
система, сердечно-сосудистая, бронхолёгочная,
сказать предположение о том, что Nrp-1 явля-
выделительная, костная и иммунная.
ется активационным маркером Т-лимфоцитов
Во взрослом организме семафорин 3А уча-
человека [40, 41]. Nrp-1 коэкспрессируется на
ствует в функционировании и поддержании го-
поверхности Т-лимфоцитов с другими актива-
меостаза многих органов, принимает участие в
ционными молекулами и, в частности, с молеку-
различных регенераторных процессах. Он экс-
лой CD25, что было показано для CD4+ и CD8+
прессируется в нервной, лимфоидной, костной,
Т-клеток, выделенных из опухолей [41, 42].
жировой и соединительной тканях, сосудистом
Кроме того, экспрессия Nrp-1 повышается на
эндотелии, эпителии кишки и носоглотки чело-
Т-лимфоцитах крови при активации с помо-
века [6].
щью анти-CD3/CD28 антител in vitro [38, 40].
В иммунной системе человека семафо-
У мышей на покоящихся Т-лимфоцитах
рин 3А синтезируется активированными CD4+ и
крови, селезёнки и лимфоузлов Nrp-1 также
CD8+ Т-лимфоцитами [13, 38], Т-регуляторны-
практически не выявляется [35, 44], но присут-
ми [38, 39] и В-регуляторными CD19+CD25high
ствует на CD4+ и CD8+ Т-лимфоцитах, выде-
клетками [2], а также макрофагами [19, 25, 38]
ленных из опухолей [21, 41] и CD8+ Т-лимфо-
и дендритными клетками [19, 20]. У мышей по-
цитах, активированных пептидами [21].
казана экспрессия мРНК семафорина 3А в Т- и
Поверхностная экспрессия PlexA1 на не-
В-лимфоцитах, NK-клетках, макрофагах и ден-
активированных Т-лимфоцитах человека так-
дритных клетках [15].
же слабо выражена, рецептор локализуется в
Мишенями действия семафорина 3А в им-
основном внутриклеточно, однако при взаи-
мунной системе, экспрессирующими на своей
модействии с дендритными клетками переме-
поверхности рецепторный комплекс, состо-
щается в зону контакта и выявляется на 50%
ящий из Nrp-1 и плексинов класса А, являют-
Т-клеток, образующих конъюгаты [20]. На по-
ся Т-лимфоциты, мононуклеарные фагоциты
верхности неактивированных Т-лимфоцитов
и дендритные клетки [4].
обнаружен также и PlexA4 [20]. Экспрессия
мРНК генов, кодирующих PlexA1 и PlexA4, зна-
чительно выше в CD4+ и CD8+ Т-лимфоцитах,
Т-ЛИМФОЦИТЫ
полученных из крови больных ревматоидным
артритом, чем от здоровых доноров [38].
Основным иммунологическим эффектом
У мышей наблюдается та же закономер-
семафорина 3А считается его супрессорное дей-
ность - низкая экспрессия генов, кодирующих
ствие в отношении Т-лимфоцитов. Предпола-
PlexA1 [35, 45], PlexA2 и PlexA4 в неактивиро-
гают, что биологическая роль семафорина 3A -
ванных Т-клетках [15, 21, 46], и значительное
это осуществление негативного контроля [19],
усиление мембранной экспрессии генов, коди-
который заключается в селективном подавле-
рующих PlexA1, при активации CD8+ Т-клеток
нии функций активированных Т-лимфоцитов,
пептидами [21].
экспрессирующих в данный момент рецепторы
Таким образом, семафорин 3А не может
семафорина 3А.
взаимодействовать с покоящимися клетками,
Методом проточной цитометрии Nrp-1
но приобретает способность оказывать воздей-
практически не выявляется (0,1-0,5%) на мо-
ствие на активированные Т-лимфоциты.
нонуклеарах крови человека, а также на CD4+,
Nrp-1 и PlexA1 у человека участвуют в обра-
CD8+ или CD3+ Т-лимфоцитах крови
[20,
зовании иммунного синапса со стороны Т-лим-
40-42], но обнаруживается в небольшом коли-
фоцитов, причём и Nrp-1 [34], и PlexA1 колока-
честве на Т-лимфоцитах, полученных из вто-
лизованы с CD3 [20]. Добавление экзогенного
ричной лимфоидной ткани - периферических
семафорина 3А подавляет транслокацию CD3 в
лимфоузлов (2,6%) и миндалин (5,4%) [40].
зону контакта, вызывает кратковременную по-
Процент выявления клеток Nrp-1+ становится
терю F-актина и микроворсинок в Т-лимфоци-
значительно больше при патологии, что было
тах, снижает частоту образования конъюгатов
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
765
между ними и дендритными клетками [20], хотя
рина 3А (Sema 3A-/-), а также его рецепто-
в другом сообщении влияние семафорина 3А на
ров - плексина А4 (PlexA4-/-) или нейропили-
образование конъюгатов не подтверждено [19].
на-1 (с мутацией рецептора, не позволяющей
В Т-клетках происходит реорганизация акти-
ему взаимодействовать с семафорином
3А,
нового цитоскелета и перераспределение та-
Nrp-1Sema-) наблюдается гиперпролифератив-
лина, нарушаются поляризация Т-клеточного
ный ответ Т-лимфоцитов на антигенную или
рецептора (TCR) и передача от него сигнала,
анти-CD3 стимуляцию in vitro [46]. Т-лимфо-
подавляется форфорилирование ZAP-70 и FAK
циты от мышей с дефицитом PlexA4 проявляют
(focal adhesion kinase) киназ. Это приводит к
повышенную способность к синтезу провоспа-
ингибиции пролиферации Т-лимфоцитов, ин-
лительных цитокинов IFN-γ и IL-17 в ответ на
дуцированной контактом с дендритными клет-
стимуляцию. Авторы считают, что PlexA4 у мы-
ками [19].
шей является основным плексиновым рецепто-
Источником семафорина 3А в данном слу-
ром Т-лимфоцитов, проводящим негативный
чае являются активированные дендритные
сигнал от семафорина 3А [46].
клетки, участвующие в презентации антиге-
В литературе также имеются данные об ин-
на. В супернатантах смешанной аллогенной
гибирующем влиянии семафорина 3А на ми-
культуры дендритных клеток и Т-лимфоцитов
грацию и адгезию Т-лимфоцитов. Показано,
человека семафорин 3А появляется в неболь-
что этот фактор подавляет миграцию Т-лим-
ших количествах (5 нг/мл) уже через 1 сутки,
фоцитов крови человека, предварительно ак-
после чего его концентрация возрастает до
тивированных с помощью PHA и IL-2 [23], но
60 нг/мл на 4-6 сутки, что было показано с
при этом не влияет на скорость миграции не-
помощью ИФА [19]. В другой работе в анало-
активированных Т-лимфоцитов в присутствии
гичных условиях семафорин 3А был обнаружен
хемокинов [20]. Кроме того, семафорин 3А ин-
методом иммунопреципитации на 3 сутки [20].
гибирует адгезию Т-лимфоцитов к опухолевым
Иммуносупрессорное действие эндогенного
клеткам [13] и цитотоксическую активность
семафорина
3А (подавление пролиферации
лимфоцитов из смешанных лимфоцитарных
Т-лимфоцитов в смешанной аллогенной куль-
культур (MLC) в отношении клеток K562 [13].
туре) можно заблокировать с помощью моно-
У мышей семафорин
3А парализует CD8+
клональных антител к этому фактору [19].
Т-лимфоциты - вызывает блокаду актинового
Помимо подавления активации на началь-
цитоскелета, приводящую к подавлению их ми-
ном этапе, семафорин 3А оказывает негативное
грации, адгезии и цитотоксического действия
воздействие и на другие функции Т-лимфоци-
на опухолевые клетки [21, 41].
тов, такие как пролиферация и синтез цито-
Кроме того, данный фактор повышает
кинов. В экспериментах in vitro показано, что
чувствительность клеток к развитию Fas-опо-
семафорин 3А ингибирует пролиферативную
средованного апоптоза, что было показано на
активность Т-лимфоцитов человека, индуци-
Т-клеточных линиях лейкоза человека. При
рованную анти-CD3/CD28 антителами
[13,
этом через PlexA1 оказывается воздействие на
19], но не влияет на пролиферацию, индуциро-
белки, регулирующие активность актина, про-
ванную PHA/IL-2 [19] или форболовым эфи-
исходит перестройка цитоскелета и транслока-
ром [13]. Подавление пролиферации в Т-лим-
ция Fas в область липидных рафт [24].
фоцитах сопровождается индукцией синтеза
Помимо прямого действия на Т-лимфо-
молекулы p27kip1, являющейся негативным ре-
циты, семафорин 3А может подавлять их ак-
гулятором клеточного цикла. В мононуклеарах
тивность через Т-регуляторные клетки. Эти
крови человека, стимулированных анти-CD3/
клетки экспрессируют транскрипционный
CD28 антителами, происходит также и сниже-
фактор Foxp3 (forkhead box p3) и обладают
ние синтеза цитокинов, таких как IL-2, IL-4,
способностью ингибировать функции эффек-
IL-10 и IFN-γ [13, 38]. Действие семафорина 3А
торных Т-лимфоцитов путём продукции про-
на Т-клетки связано с ингибицией активации
тивовоспалительных цитокинов, таких как
ERK1/2-киназ и блокадой Ras/MAPK (mitogen
TGF-β и IL-10. Ряд исследователей считает,
activated protein kinase) сигнального пути через
что семафорин 3А также является супрессор-
активацию ГТФазы Rap1 [13].
ным медиатором Т-регуляторных клеток чело-
Семафорин 3А оказывает негативный эф-
века [38, 39]. Он не только ими синтезируется,
фект в отношении Т-системы лимфоцитов и
но и повышает в них экспрессию Foxp3 [39], а
у мышей. У животных с дефицитом семафо-
также продукцию IL-10, что приводит к уси-
БИОХИМИЯ том 87 вып. 6 2022
766
КИСЕЛEВА, РУТТО
лению супрессорной активности CD4+ Nrp-1+
небольшую часть клеток, несущих соответству-
T-reg-подобных клеток [38].
ющие рецепторы, в том числе и на Т-регулятор-
ПосколькуNrp-1наCD3+CD4+Foxp3+CD25+
ные лимфоциты, которые потенциируют его
T-регуляторных клетках крови практически от-
ингибирующее влияние на эффекторные клет-
сутствует, но определяется на клетках, получен-
ки. Семафорин 3А осуществляет своё подавля-
ных из вторичной лимфоидной ткани - лим-
ющее действие на активированные Т-лимфо-
фатических узлов и миндалин [40, 47], было
циты через рецепторы Nrp-1, PlexA1 и PlexA4 с
высказано предположение о том, что Nrp-1
использованием блокады ERK1/2-киназ и Ras/
маркирует особую субпопуляцию Т-регуля-
MAPK-сигнального пути.
торных клеток человека. Эти клетки обладают
Помимо клеток периферической иммун-
наиболее выраженной супрессорной способ-
ной системы, экспрессия семафорина 3А была
ностью и выявляются не в крови, а в тканях,
также обнаружена и в центральном органе им-
особенно в условиях воспалительного микроо-
муногенеза - тимусе. Этот фактор конститу-
кружения [8, 48]. Их обнаруживают в синови-
тивно синтезируется стромальными клетками
альной жидкости у больных ревматоидным ар-
тимуса человека [54] и мыши [55]. In vitro было
тритом [49], в бронхиальном лаваже пациентов
показано, что семафорин 3А оказывает ряд не-
с хроническими обструктивными заболевания-
гативных эффектов в отношении тимоцитов и
ми лёгких [50], в первичных опухолях и лимфо-
эпителиальных клеток - ингибирует адгезию
генных метастазах [42, 47, 48].
тимоцитов человека к эпителиальным клет-
В то же время у мышей экспрессия Nrp-1
кам [54], а также миграцию тимоцитов, инду-
на Т-регуляторных клетках существенным об-
цированную хемокином SDF-1/CXCL12. При
разом отличается от таковой у человека. У этих
этом нейрональный фактор снижает экспрес-
животных Nrp-1 высоко экпрессируется на
сию рецептора SDF-1 и подавляет форфори-
CD4+CD25+Foxp3+ клетках крови, а также се-
лирование FAK- и ZAP-70-киназ в мигрирую-
лезёнки, тимуса и лимфатических узлов [40] и
щих клетках, что указывает на существование
рассматривается, как важный функциональ-
функционального антагонизма между SDF-1 и
ный маркер Т-регуляторных клеток [35]. Его
семафорином 3А [56]. Кроме того, этот фактор
экспрессия тесно коррелирует с экспресси-
ингибирует пролиферативную активность ти-
ей Foxp3 и супрессорной функцией Т-регуля-
моцитов [57] и эпителиальных клеток тимуса
торных клеток у мышей [51]. Причём считает-
мыши [58]. Причём в последнем случае семафо-
ся, что экспрессия Nrp-1 является характерным
рин 3А способен отменять стимулирующий эф-
признаком тимусных, а не индуцированных на
фект ростовых факторов KGF и HGF на проли-
периферии Т-регуляторных клеток [52].
ферацию эпителиальных клеток, что позволяет
Если удалить ген, кодирующий Nrp-1 с
его рассматривать в качестве потенциального
помощью кондиционного нокаута в Т-клет-
антагониста также и этих двух факторов.
ках, то ни содержание Т-регуляторных клеток
в селезёнке мышей [44], ни экспрессия в этих
клетках Foxp3 не изменятся [53]. Однако в них
ДЕНДРИТНЫЕ КЛЕТКИ
обнаружится существенный функциональный
дефект - снижение способности подавлять про-
Дендритные клетки не только активно син-
лиферацию эффекторных CD4+ Т-клеток in vivo
тезируют семафорин 3А, но и сами являются
и in vitro. При этом CD4+ Т-клетки будут диф-
мишенью действия семафорина, продуцируе-
ференцироваться предпочтительно по Th17-пу-
мого другими клетками. В отличие от супрес-
ти иммунного ответа. Отсутствие Nrp-1 в Т-ре-
сорного действия в отношении Т-лимфоцитов,
гуляторных клетках мышей предрасполагает к
семафорин 3А стимулирует функциональную
развитию аутоиммунных заболеваний [53]. Как
активность дендритных клеток и играет важную
считают некоторые исследователи, Nrp-1 не
роль в инициации иммунного ответа. При этом
вовлечён в Т-клеточный гомеостаз в нормаль-
нейрональный фактор действует достаточно из-
ных условиях, однако его роль существенно
бирательно и влияет главным образом на мигра-
возрастает при патологии [21].
цию дендритных клеток и, возможно, на их кон-
Таким образом, семафорин 3А в настоящее
такт с Т-лимфоцитами, не затрагивая при этом
время рассматривается как эндогенный имму-
собственно процесс презентации антигена.
носупрессорный фактор для Т-лимфоцитов.
В данный обзор включены работы по изуче-
При этом он избирательно действует лишь на
нию миелоидных дендритных клеток, которые
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
767
получали из костного мозга мышей или моно-
ровать Т-лимфоциты [15]. Дефицит PlexA4 не
цитов крови человека и инкубировали в при-
влияет на экспрессию антигенов главного ком-
сутствии цитокинов GM-CSF и IL-4 (незрелые
плекса гистосовместимости MHC-II и кости-
дендритные клетки) с последующей активацией
мулирующих молекул дендритными клетками
с помощью LPS, TNF или анти-CD40 (зрелые
и даже усиливает их способность активировать
дендритные клетки).
пролиферацию аллогенных Т-лимфоцитов [46].
В незрелых дендритных клетках человека
Однако PlexA4 всё же принимает участие в регу-
экспрессия мРНК семафорина 3А слабо вы-
ляции некоторых функций дендритных клеток,
ражена, а в зрелых, активированных с помо-
в частности синтеза цитокинов. Дендритные
щью LPS, TNF-α/IL-1β или CD40L, экспрес-
клетки, полученные от мышей PlexA4-/- и ак-
сия значительно усиливается [19, 22]. У мышей
тивированные с помощью LPS, обладают сни-
дендритные клетки также экспрессируют
женной способностью синтезировать TNF-α
мРНК семафорина 3А [15].
и IL-6 [15], хотя продукция IL-12 p40 в анало-
Для взаимодействия с семафорином 3А
гичных условиях не снижалась [46].
дендритные клетки человека экспрессируют
Наиболее детально изучен вопрос о влия-
соответствующие рецепторы. Моноциты крови
нии семафорина 3А на миграцию дендритных
не экспрессируют Nrp-1 [19, 22] и очень слабо
клеток из периферических тканей в регионар-
экспрессируют PlexA1 и PlexA3 [22]. В процессе
ные лимфоузлы [16]. Оказалось, что нагружен-
дифференцировки моноцитов в незрелые ден-
ные антигеном дендритные клетки, получен-
дритные клетки экспрессия всех трёх рецепто-
ные от мышей с дефицитом PlexA1 (PlexA1-/-)
ров заметно усиливается [22, 34]. Однако при
или с функциональным дефектом Nrp-1 (Nrp-
дальнейшем созревании дендритных клеток в
1Sema-), аккумулируются в дренирующих лим-
присутствии LPS мембранная экспрессия Nrp-
фатических узлах в значительно меньшем ко-
1 и PlexA1 снижается, что происходит путём
личестве, чем клетки, полученные от мышей
эндоцитоза рецепторов. При этом экспрес-
дикого типа. Аналогичный эффект наблюдали
сия Nrp-1 на уровне мРНК также снижается,
и в том случае, если дендритные клетки от мы-
а PlexA1 - не меняется [20, 22].
шей дикого типа вводили в организм животных
На дендритных клетках мышей также об-
с дефицитом семафорина 3А. При детальном
наружен Nrp-1 [16, 44]. Из плексинов экс-
изучении механизма данного явления оказа-
прессируется главным образом мРНК PlexA1,
лось, что семафорин 3А, продуцируемый клет-
а мРНК других плексинов А-класса слабо вы-
ками лимфатического эндотелия, необходим
ражена [29]. В отличие от клеток человека, по
для трансмиграции дендритных клеток в эф-
мере созревания дендритных клеток мышей
ферентные лимфатические сосуды. Этот фак-
в присутствии LPS или TNF экспрессия обо-
тор проявляет в отношении дендритных клеток
их рецепторов - Nrp-1 [16, 44] и PlexA1, как
хеморепеллентное действие, повышает их под-
мембранная, так и на уровне мРНК, усилива-
вижность и скорость движения, что показано
ется [14, 16, 45]. При этом цитоплазматическая
in vitro в присутствии хемокинов, а также усили-
локализация PlexA1 переходит в мембранную
вает собственно процесс трансмиграции через
форму [14].
монослой лимфатического эндотелия.
Значительные межвидовые различия в экс-
Основной точкой приложения семафори-
прессии рецепторов семафорина 3А между че-
на 3А в этом случае является перестройка ак-
ловеком и мышью характерны не только для
тинового цитоскелета. Известно, что для клет-
дендритных клеток, но наблюдаются также в
ки, движущейся по хемокиновому градиенту,
тимоцитах [57, 59] и периферических Т-лимфо-
характерно состояние поляризации, при этом
цитах [40].
экспрессия рецепторов на переднем и заднем
PlexA1 является основным плексиновым
её концах может быть различной. Оказалось,
рецептором дендритных клеток. Его высокая
что семафорин 3А действует через PlexA1, нахо-
экспрессия является отличительной особенно-
дящийся на хвостовой части дендритной клет-
стью дендритных клеток по сравнению с дру-
ки, и вызывает сокращения актомиозина, что
гими антиген-презентирующими клетками, в
способствует прохождению клеток через узкие
частности макрофагами [45].
щели. При этом через форфорилирование лёг-
Другой рецептор - PlexA4, не играет суще-
ких цепей миозина происходит воздействие на
ственной роли в презентации антигена и спо-
миозин II, а в проведении сигнала участвуют
собности дендритных клеток мышей активи-
ROCK-киназа и ГТФаза RhoA [16].
БИОХИМИЯ том 87 вып. 6 2022
768
КИСЕЛEВА, РУТТО
Усиление миграции по типу хеморепеллен-
собствуя их миграции в лимфатический узел.
ции под действием семафорина 3А было показа-
В отличие от Т-лимфоцитов, у которых взаимо-
но и в отношении дендритных клеток человека в
действие с семафорином 3А реализуется через
присутствии хемокина CCL19 или без него [22].
два плексиновых рецептора, PlexA1 и PlexA4, в
При этом наблюдали реорганизацию цитоске-
дендритных клетках используется главным об-
лета и полярное перераспределение F-актина
разом PlexA1.
в фокальные зоны, совпадающие с ламеллами,
что характерно для морфологии мигрирующей
клетки.
МАКРОФАГИ
На этапе презентации антигена прямое воз-
действие семафорина 3А на дендритные клетки
В отношении макрофагов, так же как и в
не установлено, однако показано, что PlexA1 и
отношении дендритных клеток, семафорин 3А
Nrp-1 у мышей являются компонентами иммун-
известен в основном как положительный ре-
ного синапса и локализуются в зоне контакта со
гулятор. Зрелые макрофаги сами синтезируют
стороны дендритных клеток [14, 35]. Дендрит-
этот белок, а также его рецепторы, благодаря
ные клетки, полученные от мышей с дефицитом
чему являются не только источником семафо-
PlexA1 (PlexA1-/-), обладают сниженной способ-
рина 3А, но и его мишенями.
ностью активировать антиген-специфические
В моноцитах крови человека экспрессия
или аллогенные Т-клетки in vivo и in vitro [29, 45].
мРНК семафорина 3А практически не выяв-
При этом снижение экспрессии PlexA1 не влия-
ляется [19, 22, 25], однако она начинает появ-
ет на захват и процессирование антигена, экс-
ляться при созревании клеток в присутствии
прессию молекул MHC классов I и II, а также
M-CSF [25] и значительно усиливается при их
костимулирующих молекул CD40, CD80 и CD86
последующей активации LPS [38]. Аналогич-
на мембране дендритных клеток [14, 16, 29, 45].
ная картина наблюдается и у мышей - в неак-
Присутствие в них PlexA1 необходимо для пе-
тивированных перитонеальных, селезёночных
рестройки актинового цитоскелета в зоне их
и костномозговых макрофагах выявляется лишь
контакта с Т-лимфоцитами и активации в ден-
слабая экспрессия мРНК семафорина 3А, кото-
дритных клетках Rho ГТФаз; нокдаун гена, ко-
рая заметно усиливается при активации клеток
дирующего PlexA1 в дендритных клетках, пода-
с помощью LPS или других агонистов TLR [15].
вляет их способность антиген-специфически
Методами ОТ-ПЦР и проточной цитомет-
активировать Т-лимфоциты [14].
рии показано, что моноциты крови человека не
Похожие данные были также получены на
экспрессируют Nrp-1 [22, 25, 34] и слабо экс-
клетках человека. С помощью иммунофлуорес-
прессируют плексины А-класса [22, 25, 38]. Экс-
центной и сканирующей микроскопии было
прессия мРНК этих рецепторов (кроме PlexA4)
показано, что Nrp-1 и PlexA1 являются компо-
значительно усиливается при созревании мак-
нентами иммунного синапса со стороны ден-
рофагов в присутствии M-CSF [25, 38]. При
дритных клеток и у человека [20, 34]. Добав-
дальнейшей активации макрофагов человека
ление антител, блокирующих PlexA1 [20] или
в присутствии IFN-γ экспрессия мРНК Nrp-1
Nrp-1 [34], в смешанную аллогенную культу-
может снижаться, так же как и экспрессия
ру подавляло способность зрелых дендритных
мРНК PlexA1 в присутствии LPS [25].
клеток активировать пролиферативный ответ
Несколько иная картина отмечается у мы-
Т-лимфоцитов.
шей. Экспрессия Nrp-1 отмечается уже на
В чем заключается биологическое значе-
ранних костномозговых предшественниках мо-
ние присутствия рецепторов семафорина 3А на
ноцитов/макрофагов [60] и на моноцитах кро-
мембране дендритных клеток в иммунном си-
ви [61]. В этих же Nrp-1+ костномозговых пред-
напсе, пока не ясно. Предполагают, что присут-
шественниках экспрессируется мРНК PlexA1
ствие PlexA1 может влиять на процесс адгезии
и PlexA3 [60]. При созревании костномозговых
(или деадгезии), формирование дендритов и
макрофагов в присутствии M-CSF в них можно
на способность дендритных клеток взаимодей-
обнаружить мРНК PlexA1, A2, A4 (но не А3) и
ствовать с большим числом Т-лимфоцитов [14].
Nrp-1 [18, 61].
Таким образом, дендритные клетки являют-
В резидентных перитонеальных макрофа-
ся мишенью действия семафорина 3А на ранних
гах выявляется мРНК рецепторов Nrp-1 [62]
этапах иммунного ответа, и этот фактор ока-
и PlexA4, а также их присутствие на мембра-
зывает на них стимулирующее действие, спо-
не [15, 46]. С помощью проточной цитометрии
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
769
Nrp-1 обнаруживается на классически (М1) и
данного фактора в скелетную мышцу с после-
альтернативно (М2) активированных макро-
дующим количественным учётом числа моно-
фагах [63]. Экспрессия Nrp-1 и PlexA1 заметно
нуклеаров на тканевых срезах [64]. В организме
усиливается в присутствии IFN-γ in vitro и после
семафорин 3А может привлекать макрофаги в
введения LPS in vivo в микроглие - резидентных
ткани с его повышенным содержанием, напри-
макрофагах головного мозга новорождённых
мер, в опухоли [61] или патологически изменён-
крыс [26]. Таким образом, у грызунов экспрес-
ную сетчатку глаза [17].
сия рецепторов семафорина 3А выявляется не
Таким образом, можно заключить, что сам
только на зрелых, но и на незрелых мононукле-
семафорин 3А является для макрофагов хемо-
арных фагоцитах, а при активации макрофагов
аттрактантом. Однако в комбинации с другими
экспрессия рецепторов усиливается.
индукторами миграционной активности он мо-
Семафорин 3А является хемоаттрактантом для
жет вести себя по-разному. Так, в присутствии
макрофагов - повышает их спонтанную мигра-
хемокина CCL21 in vitro нейрональный фактор
цию по положительному градиенту концентрации.
стимулирует миграцию костномозговых макро-
Это показано in vitro в отношении костномозго-
фагов мышей [61], а в сочетании с ростовым
вых предшественников моноцитов [60, 64], кос-
фактором M-CSF - подавляет [18]. Этот эффект
тномозговых [61] и перитонеальных макрофагов
реализуется через Nrp-1 и связан с подавлени-
мышей [17], а также CD14+ макрофагов человека,
ем RhoA-сигнального пути, активированнного
выделенных из печени больных гепатоклеточной
M-CSF.
карциномой [65]. Усиление миграционной актив-
Другой важный аспект влияния семафори-
ности костномозговых макрофагов мышей под
на 3А на функционирование макрофагов - ре-
влиянием семафорина 3А наблюдали также на
гуляция синтеза цитокинов. Если макрофаги
модели локального повреждения монослоя в тесте
не активированы, то нейрональный фактор не
«царапина» [63].
влияет на продукцию и синтез TNF-α и IL-6
Усиление хемотаксиса под действием се-
in vitro [15], а также на экспрессию мРНК других
мафорина 3А опосредуется участием рецепто-
цитокинов (IL-1β, IL-12a, IL-10, TGF-β) и хе-
ра Nrp-1 [17, 60, 61, 64], и этот эффект можно
мокинов [63]. Однако в случае активации мак-
отменить добавлением Y-27632 - ингибитора
рофагов семафорин 3А оказывает действие на
ROCK-киназы [17]. Кроме того, в реализации
синтез цитокинов, причём разнонаправленное.
стимулирующего действия семафорина 3А на
Так, при одновременном добавлении се-
миграцию макрофагов мышей участвуют PlexA1
мафорина 3А и LPS был получен стимулирую-
и PlexA4, поскольку посттрансляционная инак-
щий эффект семафорина 3А на синтез TNF-α
тивация их генов с помощью малых интерфери-
и IL-6, усиливающий действие LPS [15]. Дей-
рующих РНК (siRNA) отменяет эффект данного
ствие семафорина 3А было опосредовано ре-
фактора [61].
цептором PlexA4 и усиливало активацию малой
Однако существует одна работа, противо-
ГТФазы Rac1. Семафорин 3А и LPS активиро-
речащая этим данным, в которой было показа-
вали Rac1 каждый в отдельности, а при их со-
но, что семафорин 3А ингибирует спонтанную
вместном добавлении происходила суммация
миграцию моноцитов крови человека in vitro [1].
эффектов. В этих экспериментах использовали
Она была выполнена в 2001 г. и является пер-
субоптимальную дозу LPS (50 нг/мл).
вой работой по изучению миграции клеток
В другой работе, где применяли полную ак-
иммунной системы в присутствии семафори-
тивацию макрофагов мышей с помощью двух
на 3А. В ней был использован не рекомбинант-
стимулов (LPS и INF-γ), добавление семафо-
ный белок, а супернатант трансфецированных
рина 3А на экспрессию мРНК TNF-α, IL-6
COS7-клеток, который мог содержать другие
и IL-12a уже не влияло [63]. Это согласуется с
факторы, кроме семафорина 3А. На это указы-
данными об отсутствии влияния нейрональ-
вают несколько фактов, в том числе и то, что
ного фактора на продукцию TNF-α в макро-
эффект, приписываемый семафорину 3А, не
фагах человека, стимулированных с помощью
был связан с Nrp-1 [1].
1 мкг/мл LPS [38].
Способность семафорина 3А привлекать
Ещё в одной работе речь идёт уже об инги-
макрофаги мышей была также подтверждена
бирующем действии семафорина 3А. С исполь-
in vivo. Это было показано путём подкожно-
зованием костномозговых макрофагов мышей
го введения Матригеля, содержащего сема-
показано, что добавление семафорина 3А вы-
форин 3А [61], или с помощью переноса гена
зывает подавление синтеза провоспалительных
6
БИОХИМИЯ том 87 вып. 6 2022
770
КИСЕЛEВА, РУТТО
цитокинов IL-1β, IL-6 и TNF-α, индуцирован-
Тем самым было показано, что PlexA4 не только
ного LPS/IFN-γ [66]. Существенное отличие
проводит сигнал от семафорина 3А, усиливаю-
данной работы заключается в том, что в ней
щий ответ на LPS, но и по неизвестному меха-
была изменена последовательность внесения
низму вовлечён в проведение сигнала от TLR
факторов - сначала макрофаги прединкубиро-
вне связи с семафорином.
вали с семафорином в течение 1 суток, а затем
Данные о том, что семафорин 3А может
уже вносили LPS/IFN-γ [66].
дополнительно активировать макрофаги при
Можно предположить, что при работе
развитии бактериальной инфекции, позволили
in vitro с комбинацией нескольких факторов,
обосновать новый подход к лечению и преду-
конкурирующих за общие сигнальные пути,
преждению развития сепсиса у эксперименталь-
важную роль играет последовательность вне-
ных животных [15], который был использован в
сения препаратов, и это во многом объясняет
дальнейшем. Внутривенное введение монокло-
описанные выше разночтения при анализе мо-
нальных антител к семафорину 3А дозозависи-
дулирующего действия семафорина 3А. При
мо снижало летальность у мышей с сепсисом,
этом существенна и концентрация вносимых
который вызывали введением LPS [67]. Не-
препаратов, от которой зависит степень акти-
сколько неожиданным оказался результат, сви-
вации клеток, а также тканевой источник полу-
детельствующий о том, что уровень содержания
чения клеток и степень их зрелости. Для уточ-
TNF-α в сыворотке крови таких животных не
нения этого вопроса необходимо использовать
снижался.
разные варианты постановки эксперимента в
Таким образом, по имеющимся в лите-
одной работе. В настоящее время оценка влия-
ратуре данным можно заключить, что сам се-
ния семафорина 3А на синтез провоспалитель-
мафорин
3А на синтез провоспалительных
ных цитокинов макрофагами in vitro крайне
цитокинов макрофагами не влияет, но может
неоднозначна, и критерием её релевантности
модулировать действие других активаторов.
могут служить результаты, полученные in vivo.
Поскольку синтез провоспалительных ци-
Одной из ключевых работ по исследованию
токинов является лишь частью активационного
влияния семафорина 3А на макрофаги является
статуса макрофагов, исследовали также вли-
работа Wen et al. [15], в которой было показано,
яние семафорина 3А и на другие показатели.
что нейрональный фактор способен стимули-
В настоящее время описано несколько вариан-
ровать синтез цитокинов также и в организме.
тов активации макрофагов, среди которых вы-
Внутрибрюшинное введение семафорина 3А
деляют М1 или классически активированные
мышам с экспериментальным полимикроб-
макрофаги (под действием LPS и IFN-γ) и М2
ным перитонитом (частичная перевязка сле-
или альтернативно активированные (под влия-
пой кишки с последующим прокалыванием)
нием IL-4, IL-13 или IL-10) [68]. М1-макрофаги
вызывало повышение содержания провоспа-
характеризуются выраженной микробицидной
лительных цитокинов и хемокинов в перитоне-
и туморицидной активностью, М2 - способ-
альном лаваже, чего не наблюдалось у живот-
ствуют ангиогенезу и репаративным процессам.
ных (PlеxA4-/-) с дефицитом рецептора. Эти же
Влияние семафорина 3А на поляризацию мак-
мыши были более резистентными к развитию
рофагов исследовано в двух работах.
сепсиса, вызываемого летальной дозой LPS, и
В работе Teng et al. [66] было показано, что
у них выявляли значительно меньшие концен-
прединкубация костномозговых макрофагов
трации провоспалительных цитокинов TNF-α и
мышей с семафорином 3А в течение 1 суток
IL-12p70 в сыворотке крови [15].
ингибирует образование М1-макрофагов, но
В этой же работе был установлен неизвест-
положительно влияет на формирование М2-фе-
ный ранее факт участия PlexA4 в проведении
нотипа макрофагов. При этом семафорин 3А
сигнала от TLR. В макрофагах, полученных
снижает индуцированное LPS фосфорилиро-
от мышей (PlеxA4-/-) с дефицитом рецептора,
вание STAT3 (signal transducer and activator of
была снижена продукция провоспалительных
transcription 3), сигнальной молекулы, имеющей
цитокинов в ответ на стимуляцию агониста-
значение для поляризации М1-макрофагов.
ми TLR или бактериями [15]. При этом в ма-
В другой работе исследовали, как уже поля-
крофагах PlеxA4-/- происходило подавление
ризованные М1- и М2-макрофаги, обработан-
активации Rac1, индуцированной TLR, с по-
ные LPS/IFN-γ или IL-4/TGF-β соответствен-
следующим снижением активации JNK (c-Jun
но, отвечают на семафорин 3А. Оказалось, что в
N-terminal kinase) и NF-κB (nuclear factor-κB).
этом случае добавление нейронального фактора
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
771
не влияет ни на экспрессию мРНК цитокинов и
их дифференцировку in vitro [66], и этот эффект
хемокинов в макрофагах мышей, ни на их ми-
реализуется через Nrp-1 и PlexA1 [18]. При этом
грацию in vitro [63]. Однако семафорин 3А суще-
семафорин
3А подавляет дифференцировку
ственным образом влияет на пролиферативную
остеокластов только в том случае, если его до-
активность макрофагов - стимулирует, если
бавляют до внесения активирующего факто-
они имеют фенотип М1, и подавляет - в слу-
ра RANKL, но не наоборот [18]. Было показано,
чае М2-клеток. При этом семафорин 3А также
что семафорин 3А и RANKL находятся в кон-
усиливает индуцированное CSF1 фосфорили-
курентных взаимоотношениях за использова-
рование Akt и MAPK в М1-макрофагах и пода-
ние PlexA1 для проведения сигнала, поскольку
вляет - в М2-клетках; данный эффект осущест-
для дифференцировки остеокластов при уча-
вляется через Nrp-1 [63].
стии RANKL необходимо формирование ком-
Таким образом, в одной работе было пока-
плекса PlexA1-TREM2-DAP12.
зано, что семафорин 3А подавляет сигнальные
Если на мембране остеокластов присутству-
пути, характерные для поляризации М1-макро-
ет Nrp-1, он конститутивно формирует ком-
фагов и способствовует формированию М2-фе-
плекс с PlexA1, и при наличии семафорина 3А
нотипа [66], в другой - наоборот [63]. Дальней-
взаимодействует с ним. Добавление RANKL
шие исследования позволят внести большую
после этого оказывается неэффективным, а об-
ясность в этот вопрос.
разование остеокластов нарушается. Если же
Семафорин 3А не влияет на фагоцитоз
сначала добавлять RANKL, то семафорин 3А не
опсонизированных эритроцитов макрофага-
будет проявлять своё ингибирующее действие,
ми человека, но стимулирует в них развитие
поскольку RANKL обладает способностью по-
Fas-независимого апоптоза [25]. Нейрональный
давлять экспрессию Nrp-1. В результате этого
фактор также способен индуцировать апоптоз в
PlexA1 будет использован для образования ком-
культуре обогащённых клеток микроглии (ре-
плекса PlexA1-TREM2-DAP12 и осуществится
зидентных макрофагов центральной нервной
дифференцировка остеокластов [18].
системы), полученных из мозга новорождённых
Описанный механизм является примером
крыс. Эффект отменяется при добавлении ан-
того, как последовательность внесённых фак-
тител, блокирующих Nrp-1, и усиливается, если
торов влияет на результат экспериментов, в том
клетки микроглии активировать с помощью
случае, если эти факторы конкурируют меж-
IFN-γ [26]. Также показано, что нейроны, нахо-
ду собой за общие рецепторы или сигнальные
дящиеся в состоянии стресса, синтезируют се-
пути, и отчасти объясняет противоречивые ре-
мафорин 3А, который вызывает апоптоз акти-
зультаты по изучению действия семафорина 3А
вированной микроглии. Авторы предполагают,
in vitro.
что при травме нервной ткани данная реакция
Ингибирующее действие семафорина 3А
может подавлять избыточное воспаление, свя-
на дифференцировку остеокластов было так-
занное с активацией макрофагов, и защищать
же продемонстрировано и в организме мышей.
нейроны от дополнительного повреждения.
У животных с дефицитом как самого фактора
Ещё одно важное направление изучения
(Sema 3a-/-), так и с функциональным дефектом
макрофагов - влияние семафорина 3А на диф-
его рецептора (Nrp-1Sema-) наблюдали увели-
ференцировку остеокластов. Эти клетки также
чение количества остеокластов и выраженную
относятся к системе мононуклеарных фагоци-
остеопению костей [18]. Локальное введение
тов. Они представляют собой макрофаги кост-
семафорина 3А мышам с экспериментальной
ной ткани, ответственные за резорбцию кости.
травмой ускоряло процесс восстановления ко-
Одним из основных факторов дифференци-
сти, а внутривенное введение мышам с удалён-
ровки остеокластов является RANKL (receptor
ными яичниками (модель остеопороза после
activator of nuclear factor-kB ligand), цитокин
менопаузы) оказывало остеопротективный
семейства факторов некроза опухоли, кото-
эффект. Это позволяет рассматривать семафо-
рый взаимодействует с клетками через рецеп-
рин 3А как перспективный препарат для лече-
тор RANK.
ния заболеваний костей [18] и суставов [66].
Дифференцировку остеокластов изучали
Таким образом, основные эффекты се-
на модели костномозговых предшественни-
мафорина 3А в отношении макрофагов - это
ков моноцитов/макрофагов, культивируемых
стимуляция миграции, модуляция синтеза ци-
в присутствии M-CSF и RANKL. Было показа-
токинов, а также влияние на поляризацию и
но, что добавление семафорина 3А подавляет
дифференцировку этих клеток.
БИОХИМИЯ том 87 вып. 6 2022
6*
772
КИСЕЛEВА, РУТТО
ОТКРЫТИЕ ХЕМОРЕПЕЛЛЕНЦИИ
Явление хеморепелленции в иммунной си-
В НЕРВНОЙ СИСТЕМЕ
стеме играет важную роль как в норме, так и при
И ЕГО ЗНАЧЕНИЕ ДЛЯ ИММУНОЛОГИИ
патологии. Предполагают, что сортировка кле-
ток на входе в различные органы может иметь
Хемотаксис - направленная миграция кле-
значение для создания иммунологически при-
ток по градиенту химического вещества - яв-
вилегированных зон в организме; хеморепел-
ляется одним из фундаментальных процессов
ленты могут регулировать выход Т-лимфоцитов
живых организмов. В настоящее время хемо-
из лимфоузлов и тимуса, а также их предше-
таксис считается двунаправленным процессом
ственников из костного мозга [74].
и может происходить как в сторону повышения
Имеются сведения об участии семафори-
градиента химического вещества (хемоаттрак-
нов 3-класса, синтезируемых стромой тимуса,
ция), так и в противоположную сторону (хемо-
в процессе сортировки лимфоидных предше-
репелленция), что регулируется балансом хемо-
ственников на входе в этот орган у мышей во
аттрактантов и хеморепеллентов в клеточном
время эмбрионального и раннего постнаталь-
микроокружении [69].
ного развития [75].
Однако в течение длительного времени
Изучался вопрос об участии семафорина 3А,
хемотаксис клеток иммунной системы рас-
как хеморепеллента, в эмиграции тимоцитов на
сматривали только с позиций хемоаттрак-
периферию при росте перевиваемой опухоли [55].
ции. Несмотря на то что ещё в ранних рабо-
Однако данных, подтверждающих это предполо-
тах (1939 г.) было описано хеморепеллентное
жение, получено не было, поскольку ни экспрес-
действие силиката алюминия на лейкоциты
сия самого фактора, ни экспрессия его рецепторов
человека и кролика [70], этот эффект практи-
в тимусе при росте гепатомы 22а не изменялись,
чески не изучался.
так же как и трансэндотелиальная миграция ти-
Открытие хеморепелленции в конце
моцитов в присутствии семафорина 3А.
1990-х гг. в нервной системе, где семафори-
Семафорин 3А, синтезируемый во многих
ны 3-класса и некоторые другие нейрональ-
опухолях, может оказывать выраженное нега-
ные факторы оказывают отталкивающее дей-
тивное действие как хеморепеллент. Он спо-
ствие на конус роста аксона, отклоняя его от
собен усиливать выход малигнизированных
прорастания в не предусмотренные для этого
клеток из опухолевого узла и повышать риск
области [71], послужило стимулом для иссле-
метастазирования [65]. Кроме того, семафо-
дований хеморепелленции клеток иммунной
рин 3А блокирует миграцию цитотоксических
системы уже на новом уровне.
Т-лимфоцитов в опухоль, чем способствует её
Первыми иммунологическими факторами,
ускользанию от иммунного надзора [21].
для которых был показан хеморепеллентный
Изучение хеморепелленции не только су-
эффект, оказались два известных хемокина -
щественным образом обогащает наши пред-
SDF-1/CXCL12 и IL-8. В повышенных кон-
ставления о процессах миграции клеток в ор-
центрациях SDF-1 проявлял свою активность
ганизме, но имеет и практическое значение.
не как хемоаттрактант, а как хеморепеллент в
Хеморепелленты различного происхождения
отношении Т-лимфоцитов [72], в то время как
можно использовать для лечения воспалитель-
IL-8 оказывал аналогичный эффект в отно-
ных заболеваний с целью предотвращения из-
шении своих клеток-мишеней - нейтрофилов
быточной миграции лейкоцитов в ткани [76], а
человека [73]. Появилось новое представление
также для подавления иммунологической атаки
о направленной миграции клеток иммунной
после трансплантации органов [74].
системы от химического вещества, для обозна-
чения которого был предложен специальный
термин - «фугетаксис» (от греческого fugere -
ЗАКЛЮЧЕНИЕ
избегать и taxis - движение), который, однако,
не получил большого распространения [74].
В начале 2000 гг. в научной литературе
Хеморепеллентный эффект самого сема-
сформировалось представление об «иммунных
форина 3А был также продемонстрирован не
семафоринах», как о группе нейрональных фак-
только в нервной, но и в иммунной системе.
торов с иммунорегуляторными свойствами [77].
Впервые это было показано на тимоцитах че-
Основное внимание было уделено семафори-
ловека [54], затем - на тимоцитах мыши [55] и
нам 4- и 7-классов, а семафорину 3А отводилось
дендритных клетках [16].
в этой категории очень скромное место. Его
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
773
рассматривали только как фактор, регулирую-
индуцированную SDF-1 [56] и миграцию мак-
щий миграцию лейкоцитов [1].
рофагов, индуцированную M-CSF [18], ин-
В 2012 г. появилась более полная харак-
гибирует пролиферацию клеток эпителия ти-
теристика семафорина 3А, которая является
муса, активированную ростовыми факторами
общепринятой и в настоящее время [3, 4, 7].
KGF и HGF [58], а также оказывает негативное
Семафорин 3А был представлен как фактор,
влияние на дифференцировку остеокластов в
осуществляющий двунаправленную регуля-
присутствии RANKL [18]. В других случаях мо-
цию иммунного ответа - подавление функций
гут возникать синергические взаимодействия -
Т-лимфоцитов и стимуляцию врождённого им-
семафорин 3А усиливает синтез провоспали-
мунитета [78]. В этой же публикации был при-
тельных цитокинов, индуцированных LPS, в
ведён анализ первых сообщений о применении
макрофагах мышей [15].
нейронального фактора для терапии иммуно-
Если проанализировать, на какие функ-
опосредованных заболеваний в эксперименте и
ции клеток иммунной системы влияет семафо-
сформулировано новое представление о сема-
рин 3А, то основным действием этого фактора
форине 3А, как о перспективном терапевтиче-
остаётся контроль миграции. Семафорин 3А
ском средстве для их лечения.
регулирует миграцию всех рассматриваемых
За последующие 10 лет изучение семафори-
клеток, включая Т-лимфоциты [21, 23, 41], ден-
на 3А происходило именно в этом направлении.
дритные клетки [16, 22] и макрофаги [17, 60, 61,
В многочисленных экспериментальных работах
63-65]. При этом, как и в нервной системе, это
нейрональный фактор, обладающий иммуноре-
может происходить в виде хемоаттракции (для
гуляторными и анти-ангиогенными свойства-
макрофагов) или в виде хеморепелленции (для
ми, стали рассматривать как средство от многих
дендритных клеток). Предполагается, что вы-
болезней человека, включающих аллергиче-
бор направления движения по положительному
ские, аутоиммунные и онкологические заболе-
или отрицательному градиенту определяется
вания [2-4]. При этом не было получено суще-
поляризацией клетки, асимметричным распо-
ственно новых данных о роли семафорина 3А
ложением рецепторов и адгезионных молекул,
в регуляции иммунного ответа при отсутствии
а также концентрацией вторичных мессендже-
патологии, единая концепция его влияния на
ров - Ca2+ и циклических нуклеотидов [69, 79].
иммунологические процессы не была сформи-
Кроме миграции, семафорин 3А влияет
рована, и наши знания об этом и сегодня имеют
также на адгезию и межклеточную кооперацию
фрагментарный характер. В настоящем обзоре
в иммунной системе. Он подавляет адгезию ти-
мы впервые попытались объединить все имею-
моцитов [80] и CD8+ T-лимфоцитов мышей [21]
щиеся сведения по иммунорегуляторному дей-
к субстрату, формирование контактов между
ствию семафорина 3А, полученные за послед-
тимоцитами и эпителиальными клетками ти-
ние 20 лет, и обсудить их с разных точек зрения.
муса [54], а также между Т-лимфоцитами и ден-
Если рассматривать основные механизмы
дритными клетками [20]. Кроме того, семафо-
действия семафорина 3А на клетки иммунной
рин 3А проявляет ингибирующую активность
системы, то основной точкой приложения яв-
при взаимодействии Т-лимфоцитов с опухоле-
ляется перестройка актинового цитоскелета и
выми клетками, которая выражается в подавле-
связанная с ней регуляция процессов мигра-
ние адгезии [13] и цитотоксической активности
ции, адгезии и межклеточной кооперации.
Т-лимфоцитов [41].
Другим важным звеном иммунорегулятор-
Издругихфункций следуетотметитьнегатив-
ного действия семафорина 3А является способ-
ное влияние семафорина 3А на пролифератив-
ность Nrp-1 и плексинов участвовать в прове-
ную активностьТ-лимфоцитов [13, 19, 38]и тимо-
дении сигналов от неродственных семафорину
цитов [57], а также усиление апоптоза в Т-кле-
факторов. Тем самым семафорин 3А может ока-
точных линиях [24] и макрофагах человека [25].
зывать модулирующее действие в отношении
Немаловажный вопрос - где и при каких
различных клеточных активаторов, включаю-
условиях в организме проявляется действие
щих ростовые факторы, хемокины или бакте-
семафорина 3А. Этот фактор конститутивно
риальные продукты.
экспрессируется в органах иммунной системы
В одних случаях между семафорином 3А и
(тимусе, селезёнке, лимфатических узлах) [18,
другими факторами возникают антагонисти-
54, 55], что предполагает его важную гомеоста-
ческие взаимодействия. Так, например, се-
тическую роль. Концентрация семафорина 3А в
мафорин 3А подавляет миграцию тимоцитов,
сыворотке крови здоровых людей колеблется в
БИОХИМИЯ том 87 вып. 6 2022
774
КИСЕЛEВА, РУТТО
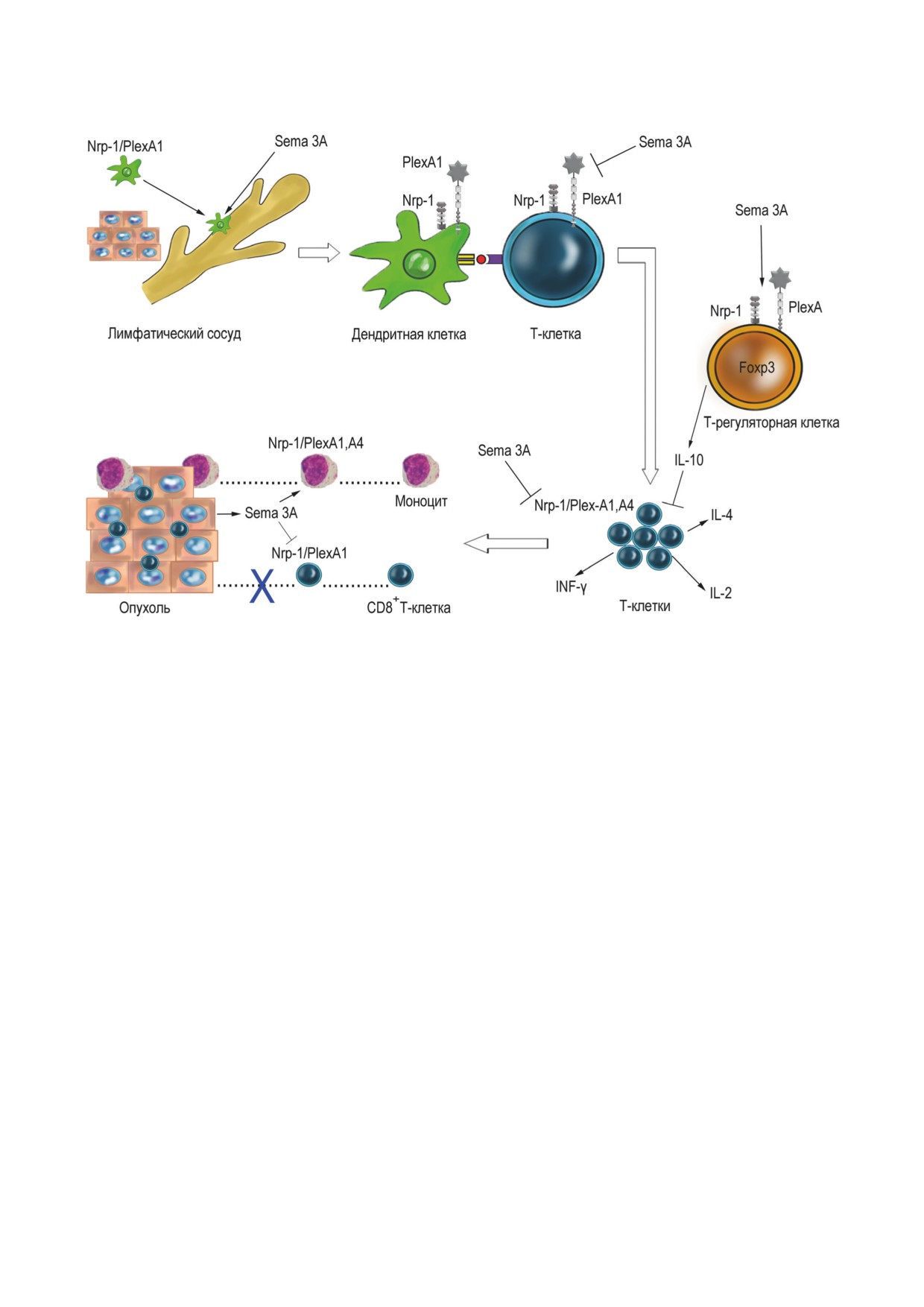
Рис. 3. Гипотетическая схема основных точек приложения действия семафорина 3А (Sema 3A) в иммунной системе
(пояснения в тексте)
широких пределах (от 10 до 90 нг/мл и более) [2].
тимусе. Этот фактор конститутивно синтези-
Приблизительно такие же концентрации (50-
руется эпителиальными клетками тимуса, а ми-
100 нг/мл) большинство авторов использует
шенями для действия семафорина 3А являются
для изучения действия семафорина 3А in vitro.
сами эпителиальные клетки и тимоциты [54,
Из этого следует, что концентрация семафори-
55, 57-59]. Он регулирует миграцию тимоци-
на 3А в циркуляции достаточна для проявления
тов, процесс адгезии/деадгезии тимоцитов и
его биологической активности. Однако находя-
эпителиальных клеток, а также пролиферацию
щиеся в периферической крови Т-лимфоциты
тимоцитов и эпителиальных клеток.
и моноциты не имеют рецепторов семафори-
В условиях патологии локальные концен-
на 3А и, следовательно, не подвергаются его
трации семафорина 3А в тканях могут суще-
действию. Рецепторы появляются при актива-
ственно меняться. В таких случаях семафо-
ции клеток, и тогда они приобретают способ-
рин 3А, наряду с хемокинами и ростовыми
ность отвечать на семафорин 3А [25, 38, 40].
факторами, может контролировать клеточный
Кроме того, рецепторы семафорина 3А об-
состав воспалительного инфильтрата, привле-
наруживаются на клетках иммунной системы,
кая одни клетки и блокируя миграцию других.
находящихся в тканях - на тканевых макрофа-
Например, при повышении содержания сема-
гах и небольшой части Т-лимфоцитов. По-ви-
форина 3А в опухолях наблюдается усиленный
димому, при отсутствии патологии этот фактор
приток туда макрофагов [60, 61, 63, 65] и пода-
главным образом регулирует внутритканевую
вление миграции CD8+ Т-лимфоцитов [21, 41].
миграцию клеток, а также выход клеток из тка-
Действие семафорина 3А, систематизиро-
ней в лимфоток, как это показано для дендрит-
ванное по фазам иммунного ответа, представ-
ных клеток [16].
лено на рис. 3.
Роль семафорина 3А как внутритканевого
На этапе инициации иммунного ответа
клеточного регулятора лучше всего изучена в семафорин 3А действует как положительный
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
775
фактор, поскольку способствует выходу ден-
В настоящий момент предположение о том, что
дритных клеток из периферических тканей в
при взаимодействии двух клеток друг с другом
лимфоток для их дальнейшей миграции в ре-
некий фактор одну из них мог бы подавлять, а
гионарные лимфатические узлы и презентации
другую - стимулировать, представляется весь-
антигена Т-лимфоцитам [16].
ма сомнительным.
На всех последующих этапах, связанных с
Отличительной особенностью семафори-
участием Т-лимфоцитов, семафорин 3А ока-
на 3А является его способность, параллельно с
зывает негативный эффект: подавляет актива-
ингибицией Т-клеточного звена иммунитета,
цию Т-лимфоцитов и передачу сигнала от TCR
оказывать стимулирующее действие на клетки
во время презентации антигена [19, 20], ин-
мононуклеарно-фагоцитарной системы. Этот
гибирует пролиферацию эффекторных CD4+
фактор, прежде всего, является хемоаттрактан-
Т-лимфоцитов и синтез цитокинов [38, 46],
том для моноцитов и макрофагов, что показано
активирует Т-регуляторные клетки, которые,
у мышей in vivo и in vitro [17, 60, 61, 63]. Одна-
в свою очередь, оказывают супрессорное дей-
ко мы не можем прямо переносить эти экспе-
ствие [38, 39]. Предполагают, что эффект сема-
риментальные данные на организм человека,
форина 3А вызывает терминацию процесса или
поскольку в экспрессии рецепторов семафори-
предотвращение гиперактивации Т-лимфоци-
на 3А существуют межвидовые различия. У че-
тов [19], однако конкретная роль этого фактора
ловека, в отличие от мышей [60, 61], рецепторы
не установлена.
семафорина 3А на моноцитах крови практиче-
В ряде случаев при развитии патологии
ски отсутствуют [22, 25, 34, 38], что указывает
иммуносупрессорное действие семафорина 3А
на потенциальную возможность взаимодей-
рассматривают как положительный фактор и
ствия данного фактора только с активирован-
предлагают использовать его экзогенное вве-
ными моноцитами.
дение для лечения аутоиммунных и аллерги-
Семафорин
3А не является стимулято-
ческих заболеваний в эксперименте [2, 4]. В то
ром таких функций макрофагов, как продук-
же время при росте опухолей, продуцирующих
ция провоспалительных цитокинов и хемоки-
этот фактор (рис. 3), его ингибирующее дей-
нов [15, 38, 63], но может модулировать ответ
ствие может играть негативную роль - пода-
макрофагов на другие активирующие стимулы
влять противоопухолевый иммунитет, вызывая
(например, на LPS и IFN-γ) [15, 63, 66]. Од-
ингибицию миграции, адгезии и цитотоксиче-
нако результаты этих работ противоречат друг
ской активности CD8+ T-лимфоцитов [13, 21,
другу и не позволяют однозначно охарактери-
41]. В этом случае применяют противополож-
зовать семафорин 3А как провоспалительный
ную тактику и разрабатывают способы бло-
или как противовоспалительный фактор. Кро-
кирования семафорина 3А и его рецепторов в
ме того, в настоящее время не представляется
организме [21, 41]. Клинические запросы обу-
возможным дать утвердительный ответ на во-
словливают необходимость проведения даль-
прос, способствует ли семафорин 3А поляри-
нейших исследований для определения зна-
зации макрофагов в направлении М1- [66] или
чимости вклада семафорина 3А в регуляцию
М2-фенотипа [63].
Т-клеточного иммунного ответа.
Между тем ответы на нерешённые вопро-
Остаётся нерешённым вопрос о биологи-
сы по влиянию семафорина 3А на макрофаги
ческой роли рецепторов семафорина 3А (Nrp-1
важны для оценки роли этого фактора в патоге-
и PlexA1) в иммунном синапсе, которые явля-
незе таких заболеваний, как ревматоидный ар-
ются его компонентами как со стороны Т-лим-
трит [66], сепсис [15] и опухолевый рост [60, 63],
фоцитов, так и дендритных клеток [14, 19, 20,
поскольку определяют стратегию применения
34, 35]. Если для Т-лимфоцитов взаимодей-
семафорина 3А в качестве лечебного средства.
ствие этих рецепторов с семафорином 3А и его
Пока здесь нет единого мнения: одни авторы
негативный эффект показаны, то лиганды, с
предлагают вводить семафорин 3А в организм
которыми взаимодействуют эти рецепторы на
как противоспалительный фактор, как, напри-
дендритных клетках, ещё не определены. Не-
мер, при ревматоидном артрите [66], другие
обходимость присутствия этих рецепторов на
считают, что с этой же целью нужно нейтрали-
дендритных клетках для проявления их способ-
зовать действие семафорина 3А, как это пока-
ности активировать Т-лимфоциты, возможно,
зано при экспериментальном сепсисе [15, 67].
и не связана с семафорином 3А, что, однако,
В настоящее время не вызывает сомнения,
требует экспериментального подтверждения.
что семафорин 3А играет важную иммуно-
БИОХИМИЯ том 87 вып. 6 2022
776
КИСЕЛEВА, РУТТО
регуляторную роль в организме в нормаль-
Финансирование. Работа выполнена в
ных и патологических условиях, что позво-
рамках плановой темы НИР ФГБНУ «ИЭМ»
ляет рассматривать этот фактор и его рецеп-
FGWG-2022-0005 (рег. № 122020300186-5).
торы как перспективные мишени для тера-
Конфликт интересов. Авторы заявляют об
певтического
воздействия.
Дальней-
отсутствии конфликта интересов.
шие исследования прольют свет на не-
Соблюдение этических стандартов. Настоя-
решённые вопросы и позволят обосно-
щая статья не содержит описания каких-либо
вать новые подходы для лечения многих
исследований с участием людей или животных
заболеваний человека.
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Delaire, S., Billard, C., Tordjman, R., Chedotal, A.,
12.
Valdembri, D., Regano, D., Maione, F., Giraudo, E.,
Elhabazi, A., et al. (2001) Biological activity of soluble
and Serini, G.
(2016) Class
3 semaphorins in
CD100. II. Soluble CD100, similarly to H-SemaIII,
cardiovascular development, Cell Adhes. Migr., 10,
inhibits immune cell migration, J. Immunol., 166,
641-651.
4348-4354.
13.
Catalano, A., Caprari, P., Moretti, S., Faronato, M.,
2.
Vadasz, Z., and Toubi, E. (2018) Semaphorin3A:
Tamagnone, L., et al.
(2006) Semaphorin-3A is
A potential therapeutic tool in immune-mediated
expressed by tumor cells and alters T-cell signal
disases, Eur. J. Rheumatol., 5, 58-61.
transduction and function, Blood, 107, 3321-3329.
3.
Toledano, S., Nir-Zvi, I., Engelman, R., Kessler, O.,
14.
Eun, S.-Y., O’Connor, B. P., Wong, A. W., van
and Neufeld, G. (2019) Class-3 semphorins and their
Deventer, H. W., Taxman, D. J., et al.
(2006)
receptors: potent multifunctional modulators of tumor
Cutting edge: Rho activation and actin polarization
progression, Int. J. Mol. Sci., 20, 556, doi: 10.3390/
are dependent on Plexin-A1 in dendritic cells,
ij ms20030556.
J. Immunol., 177, 4271-4275.
4.
Kalmarzi, R. N., Rajabinejad, M., and Lotfi, R.
15.
Wen, H., Lei, Y., Eun, S.-Y., and Ting, J. P. (2010)
(2020) Immune semaphorins: Crucial regulatory
Plexin-A4-semaphorin 3A signaling is required for
signals and novel therapeutic targets in asthma and
Toll-like receptor and sepsis-induced cytokine storm,
allergic diseases, Eur. J. Pharmacol., 881, 173209,
J. Exp. Med., 207, 2943-2957.
doi: 10.1016/j.ejphar.2020.173209.
16.
Takamatsu, H., Takegahara, N., Nakagawa, Y.,
5.
Alto, L. T., and Terman, J. R. (2017) Semaphorins and
Tomura, M., Taniguchi, M., et al. (2010) Semaphorins
their signaling mechanisms, Methods Mol. Biol., 1493,
guide the entry of dendritic cells into the lymphatics by
1-25, doi: 10.1007/978-1-4939-6448-2_1.
activating myosin II, Nat. Immunol., 11, 594-600.
6.
Chapoval, S. P. (2018) Neuroimmune semaphorins as
17.
Dejda, A., Mawambo, G., Cerani, A., Miloudi, K.,
costimulatory molecules and beyond, Mol. Med., 24,
Shao, Z., et al.
(2014) Neuropilin-1 mediates
13, doi: 10.1186/s10020-018-0014-9.
myeloid cell chemoattraction and influences retinal
7.
Nakanishi, Y., Kang, S., and Kumanogoh, A. (2021)
neuroimmune crosstalk, J. Clin. Invest., 124, 4807-
Neural guidance factors as hubs of immunometabolic
4822, doi: 10.1172/JCI76492.
cross-talk, Int. Immunol., 33, 749-754, doi: 10.1093/
18.
Hayashi, M., Nakashima, T., Taniguchi, M.,
intimm/dxab035.
Kodama, T., Kumanogoh, A., et al. (2012) Osteo-
8.
Chuckran, C. A., Liu, C., Bruno, T. C., Workman,
protection by semaphorin 3A, Nature, 485, 69-74.
C. J., and Vignali, D. A. A. (2020) Neuropilin-1:
19.
Lepelletier, Y., Moura, I. C., Hadj-Slimane, R.,
A checkpoint target with unique implications
Renand, A., Fiorentino, S., et al.
(2006)
for cancer immunology and immunotherapy,
Immunosuppressive role of semaphorin-3A on T
J. Immunother. Cancer,
8, e000967, doi:
10.1136/
cell proliferation is mediated by inhibition of actin
jitc-2020-000967.
cytoskeleton reorganization, Eur. J. Immunol., 36,
9.
Niland, S., and Eble, J. A.
(2020) Neuropilin:
1782-1793.
Handyman and power broker in the tumor
20.
Tran-Van, H., Avota, E., Bortlein, C., Mueller, N.,
microenvironment, Adv. Exp. Med. Biol., 1223, 31-67.
and Schneider-Schaulies, S.
(2011) Measles virus
10.
Raper, J. A., and Kapfhammer, J. P. (1990) The
modulates dendritic cell/T-cell communication at
enrichment of a neuronal growth cone collapsing
the level of plexinA1/neuropilin-1 recruitment and
activity from embryonic chick brain, Neuron, 4, 21-29.
activity, Eur. J. Immunol., 41, 151-163, doi: 10.1002/
11.
Janssen, B. J., Malinauskas, T., Weir, G. A., Cader,
eji.201040847.
M. Z., Siebold, C., et al. (2012) Neuropilins lock
21.
Barnkob, M., Michaels, Y. S., André, V., Macklin,
secreted semaphorins onto plexins in a ternary
P. S., Gileadi, U., et al. (2019) Semaphorin 3A induces
signaling complex, Nat. Struct. Mol. Biol., 19, 1293-
cytoskeletal paralysis in tumor-specific CD8+ T cells,
1299, doi: 10.1038/nsmb.2416.
BioRxiv, doi: 10/1101/849083.
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
777
22.
Curreli, S., Wong, B. S., Latinovic, O.,
35.
Sarris, M., Andersen, K. G., Randow, F., Mayr, L.,
Konstantopoulos, K., and Stamatos, N. M. (2016)
and Betz, A. G. (2008) Neuropilin-1 expression on
Class 3 semaphorins induce F-actin reorganization in
regulatory T cells enhances their interactions with
human dendritic cells: role in cell migration, J. Leukoc.
dendritic cells during antigen recognition, Immunity,
Biol., 100, 1323-1334.
28, 402-413.
23.
Vincent, P., Collette, Y., Marignier, R., Vuaillat, C.,
36.
Delgoffe, G. M., Woo, S.-R., Turnis, M. E., Gravano,
Rogemond, V., et al. (2005) A role for the neuronal
D. M., Guy, C., et al. (2013) Stability and function of
protein collapsin response mediator protein
2 in
regulatory T cells is maintained by a neuropilin-1-
T lymphocyte polarization and migration, J. Immunol.,
semaphorin-4a axis, Nature,
501,
252-256,
175, 7650-7660.
doi: 10.1038/nature12428.
24.
Moretti, S., Procopio, A., Lazzarini, R., Rippo,
37.
Glinka, Y., and Prud’homme, G. J.
(2008)
M. R., Testa, R., et al. (2008) Semaphorin3A signaling
Neuropilin-1 is a receptor for transforming growth
controls Fas (CD95)-mediated apoptosis by promoting
factor β-1, activates its latent form, and promotes
Fas translocation into lipid rafts, Blood, 111, 2290-
regulatory T cell activity, J. Leukoc. Biol., 84, 302-310.
2299.
38.
Catalano, A. (2010) The neuroimmune semaphorin-
25.
Ji, J. D., Park-Min, K. H., and Ivashkiv, L. B. (2009)
3A reduces inflammation and progression of
Expression and function of semaphorin 3A and its
experimental autoimmune arthritis, J. Immunol., 185,
receptors in human monocyte-derived macrophages,
6373-6383, doi: 10.4049/jimmu nol.0903527.
Hum. Immunol., 70, 211-217.
39.
Cozacov, R., Halasz, K., Haj, T., and Vadasz, Z.
26.
Majed, H. H., Chandran, S., Niclou, S. P., Nicholas,
(2017) Semaphorin
3A: Is a key player in the
R. S., Wilkins, A., et al. (2006) A novel role for
pathogenesis of asthma, Clin. Immunol., 184, 70-72,
Sema3A in neuroprotection from injury mediated
doi: 10.1016/j.clim.2017.05.011.
by activated microglia, J. Neurosci., 26, 1730-1738,
40.
Milpied, P., Renand, A., Bruneau, J., Mendes-da-
doi: 10.1523/jneurosci.0702- 05.2006.
Cruz, D. A., Jacquelin, S., et al. (2009) Neuropilin-1
27.
Battin, C., Linhares, A. D. S., Paster, W., Isenman,
is not a marker of human Foxp3+ Treg, Eur. J.
D. E., Wahrmann, M., et al. (2019) Neuropilin-1 acts
Immunol., 39, 1466-1471.
as a receptor for complement split products, Front.
41.
Leclerc, M., Voilin, E., Gros, G., Corgnac, S.,
Immunol., 10, 2209, doi: 10.3389/fimmu.2019.02209.
de Montpréville, V., et al.
(2019) Regulation of
28.
Daly, J. L., Simonetti, B., Klein, K., Chen, K. E.,
antitumour CD8 T-cell immunity and checkpoint
Williamson, M. K., et al. (2020) Neuropilin-1 is a host
blockade immunotherapy by Neuropilin-1, Nat.
factor for SARS-CoV-2 infection, Science, 370, 861-
Commun., 10, 3345, doi: 10.1038/s41467-019-11280-z.
865, doi: 10.1126/science.abd3072.
42.
Chaudhary, B., and Elkord, E.
(2015) Novel
29.
Takegahara, N., Takamatsu, H., Toyofuku, T.,
expression of Neuropilin
1 on human tumor-
Tsujimura, T., Okuno, T., et al. (2006) Plexin-A1
infiltrating lymphocytes in colorectal cancer liver
and its interaction with DAP12 in immune responses
metastases, Expert Opin. Ther. Targets, 19, 147-161.
and bone homeostasis, Nat. Cell Biol., 8, 615-622,
43.
Takagawa, S., Nakamura, F., Kumagai, K.,
doi: 10.1038/ncb1416.
Nagashima, Y., Goshima, Y., et al. (2013) Decreased
30.
Fujisawa, H., Ohta, K., Kameyama, T., and
Semaphorin3A expression correlates with disease
Murakami, Y. (1997) Function of a cell adhesion
activity and histological features of rheumatoid
molecule, plexin, in neuron network formation, Dev.
arthritis, BMC Musculoskelet. Disord.,
14,
40,
Neurosci., 9, 101-105.
doi: 10.1186/1471-2474-14-40.
31.
Takagi, S., Kasuya, Y., Shimizu, M., Matsuura, T.,
44.
Corbel, C., Lemarchandel, V., Thomas-Vaslin, V.,
Tsuboi, M., et al. (1995) Expression of a cell adhesion
Pelus, A. S., Agboton, C., et al. (2007) Neuropilin 1
molecule, neuropilin, in the developing chick nervous
and CD25 co-regulation during early murine thymic
system, Dev. Biol., 170, 207-222.
differentiation, Dev. Comp. Immunol., 31, 1082-1094.
32.
Valdembri, D., Caswell, P. T., Anderson, K. I.,
45.
Wong, A. W., Brickey, W. J., Taxman, D. J., van
Schwarz, J. P., Konig, I., et al. (2009) Neuropilin-1/
Deventer, H. W., Reed, W., et al. (2003) CIITA-
GIPC1 signaling regulates α5β1 integrin traffic and
regulated plexin-A1 affects T-cell-dendritic cell
function in endothelial cells, PLoS Biol., 7, e1000025.
interactions, Nat. Immunol., 4, 891-898.
33.
Rutto, K. V., Kudryavtsev, I. V., and Kisseleva, E. P.
46.
Yamamoto, M., Suzuki, K., Okuno, T., Ogata, T.,
(2018) Adhesion of thymocytes to the thymic epithelial
Takegahara, N., et al. (2008) Plexin-A4 negatively
cells and participation of neuropilin-1 and plexin
regulates T lymphocyte responses, Int. Immunol., 20,
A1 in the adhesion, Cell Tissue Biol., 12, 373-381,
413-420.
doi: 10.1134/S1990519X18050073.
47.
Battaglia, A., Buzzonetti, A., Monego, G., Peri, L.,
34.
Tordjman, R., Lepelletier, Y., Lemarchandel, V.,
Ferrandina, G., et al. (2008) Neuropilin-1 expression
Cambot, M., Gaulard, P., et al. (2002) A neuronal
identifies a subset of regulatory T cells in human
receptor, neuropilin-1, is essential for the initiation
lymph nodes that is modulated by preoperative
of the primary immune response, Nat. Immunol., 3,
chemoradiation therapy in cervical cancer,
477-482.
Immunology, 123, 129-138.
БИОХИМИЯ том 87 вып. 6 2022
778
КИСЕЛEВА, РУТТО
48.
Jung, K., Kim, J.-A., Kim, Y.-J., Lee, H. W.,
growth, Cancer Res., 72, 6371-6381, doi: 10.1158/
Kim, C.-H., et al. (2020) A Neuropilin-1 antagonist
0008-5472.CAN-12-0762.
exerts antitumor immunity by inhibiting the
61.
Casazza, A., Laoui, D., Wenes, M., Rizzolio, S.,
suppressive function of intratumoral regulatory
Bassani, N., et al. (2013) Impeding macrophage entry
T cells, Cancer Immunol. Res., 8, 46-56.
into hypoxic tumor areas by Sema3A/Nrp1 signaling
49.
E, X. Q., Meng, H. X., Cao, Y., Zhang, S. Q., Bi,
blockade inhibits angiogenesis and restores antitumor
Z. G., et al. (2012) Distribution of regulatory T cells
immunity, Cancer Cell, 24, 695-709.
and interaction with dendritic cells in the synovium
62.
Stepanova, O. I., Krylov, A. V., Lioudyno, V. I., and
of rheumatoid arthritis, Scand. J. Rheumatol., 41, 413-
Kisseleva, E. P. (2007) Gene expression for VEGF-A,
420, doi: 10.3109/03009742.2012.696135.
VEGF-C, and their receptors in murine lymphocytes
50.
Smyth, L. J., Starkey, C., Vestbo, J., and Singh, D.
and macrophages, Biochemistry (Moscow), 72, 1194-
(2007) CD4-regulatory cells in COPD patients, Chest,
1198.
132, 156-163, doi: 10.1378/chest.07-0083.
63.
Wallerius, M., Wallmann, T., Bartish, M., Ostling, J.,
51.
Bruder, D., Probst-Kepper, M., Westendorf, A. M.,
Mezheyeuski, A., et al. (2016) Guidance molecule
Geffers, R., Beissert, S., et al. (2004) Neuropilin-1:
SEMA3A restricts tumor growth by differentially
A surface marker of regulatory T cells, Eur. J.
regulating the proliferation of tumor-associated
Immunol., 34, 623-630.
macrophages, Cancer Res., 76, 3166-3178.
52.
Weiss, J. M., Bilate, A. M., Gobert, M., Ding, Y.,
64.
Zacchigna, S., Pattarini, L., Zentilin, L., Moimas, S.,
Curotto de Lafaille, M. A., et al. (2012) Neuropilin 1
Carrer, A., et al. (2008) Bone marrow cells recruited
is expressed on thymus-derived natural regulatory
through the neuropilin-1 receptor promote arterial
T cells, but not mucosa-generated induced Foxp3+ T
formation at the sites of adult neoangiogenesis in
reg cells, J. Exp. Med., 209, 1723-1742.
mice, J. Clin. Invest., 118, 2062-2075, doi: 10.1172/
53.
Solomon, B. D., Mueller, C., Chae, W. J., Alabanza,
JCI32832.
L. M., and Bynoe, M. S.
(2011) Neuropilin-1
65.
Hu, Z.-Q., Zhou, S.-L., Zhou, Z.-J., Luo, C.-
attenuates autoreactivity in experimental autoimmune
B., Chen, E.-B., et al. (2016) Overexpression of
encephalomyelitis, Proc. Natl. Acad. Sci. USA, 108,
semaphorin
3A promotes tumor progression and
2040-2045, doi: 10.1073/pnas.1008721108.
predicts poor prognosis in hepatocellular carcinoma
54.
Lepelletier, Y., Smaniotto, S., Hadj-Slimane, R.,
after curative resection, Oncotarget, 7, 51733-51746.
Villa-Verde, D. M., Nogueira, A. C., et al. (2007)
66.
Teng, Y., Yin, Z., Li, J., Li, K., Li, X., and Zhang, Y.
Control of human thymocyte migration by
(2017) Adenovirus-mediated delivery of Sema3A
Neuropilin-1/Semaphorin-3A-mediated interactions,
alleviates rheumatoid arthritis in a serum-transfer
Proc. Natl. Acad. Sci. USA, 104, 5545-5550.
induced mouse model, Oncotarget, 8, 66270-66280.
55.
Киселева Е. П., Лямина И. В., Цвиркун С. А.,
67.
Yamashita, N., Jitsuki-Takahashi, A., Ogawara, M.,
Рутто К. В., Кудрявцев И. В., и др.
(2013)
Ohkubo, W., Araki, T., et al.
(2015) Anti-
Изучение роли семафорина 3А в тимусе в норме и
Semaphorin 3A neutralization monoclonal antibody
при опухолевом росте, Мед. акад. журн., 13, 42-48.
prevents sepsis development in lipopolysaccharide-
56.
Garcia, F., Lepelletier, Y., Smaniotto, S., Hadj-
treated mice, Int. Immunol.,
27,
459-466,
Slimane, R., Dardenne, M., et al. (2012) Inhibitory
doi: 10.1093/intimm/dxv014.
effect of semaphorin-3A, a known axon guidance
68.
Martinez, F. O., and Gordon, S. (2014) The M1
molecule in the human thymocyte migration induced
and M2 paradigm of macrophage activation: time for
by CXCL12, J. Leukoc. Biol., 91, 7-13.
reassessment, F1000Prime Rep., 6, 13, doi: 10.12703/
57.
Rutto, K. V., Lyudyno, V. I., Kudryavtsev, I. V.,
P6-13.
and Kiseleva, E. P. (2020) Semaphorin-3A inhibits
69.
Huttenlocher, A., and Poznansky, M. C.
(2008)
proliferation, but does not affect apoptosis of mouse
Reverse leukocyte migration can be attractive or
thymocytes in vitro, Bull. Exp. Biol. Med., 168, 352-
repulsive, Trends Cell Biol., 18, 298-306, doi: 10.1016/
355, doi: 10.1007/s10517-020-04707-x.
j.tcb.2008.04.001.
58.
Rutto, K. V., Ovsyukov, K. S., Kudryavtsev, I. V.,
70.
McCutcheon, M., Coman, D. R., and Dixon, H. M.
and Kiseleva, E. P. (2019) Semaphorin 3A negatively
(1939) Negative chemotropism in leukocytes, Arch.
affects proliferation of mouse thymus epithelial
Pathol., 17, 61-68.
cell in vitro, Bull. Exp. Biol. Med., 166, 339-343,
71.
Polleux, F., Giger, R. J., Ginty, D. D., Kolodkin,
doi: 10.1007/s10517-019-04346-x.
A. L., and Ghosh, A. (1998) Patterning of cortical
59.
Mendes-da-Cruz, D. A., Lepelletier, Y., Brignier,
efferent
projections by semaphorin-neuropilin
A. C., Smaniotto, S., et al. (2009) Neuropilins,
interactions, Science, 282, 1904-1906.
semaphorins, and their role in thymocyte
72.
Poznansky, M. C., Olszak, I. T., Foxall, R., Evans,
development, Ann. N. Y. Acad. Sci., 1153, 20-28.
R. H., Luster, A. D., et al. (2000) Active movement of
60.
Carrer, A., Moimas, S., Zacchigna, S., Pattarini, L.,
T cells away from a chemokine, Nat. Med., 6, 543-548.
Zentilin, L., et al. (2012) Neuropilin-1 identifies
73.
Tharp, W. G., Yadav, R., Irimia, D., Upadhyaya, A.,
a subset of bone marrow Gr1 monocytes that can
Samadani, A., et al.
(2006)
Neutrophil
induce tumor vessel normalization and inhibit tumor
chemorepulsion in defined interleukin-8 gradients
БИОХИМИЯ том 87 вып. 6 2022
СЕМАФОРИН 3А В ИММУННОЙ СИСТЕМЕ
779
in vitro and in vivo, J. Leukoc. Biol., 79, 539-554,
J. Cell Sci., 116 (Pt 17), 3463-3470, doi: 10.1242/
doi: 10.1189/jlb.0905516.
jcs.00674.
74. Vianello, F., Olszak, I. T., and Poznansky, M. C.
78. Takamatsu, H., and Kumanogoh, A. (2012) Diverse
(2005) Fugetaxis: Active movement of leukocytes away
roles for semaphorin-plexin signaling in the immune
from chemokinetic gradient, J. Mol. Med., 83, 752-763.
system, Trends Immunol., 33, 127-135, doi: 10.1016/
75. Takahashi, K., Ishida, M., Hirokawa, K., and
j.it.2012.01.008.
Takahashi, H. (2008) Expression of the semaphorins
79. Tojima, T., Hines, J. H., Henley, J. R., and
Sema 3D and Sema 3F in the developing parathyroid
Kamiguchi, H.
(2011) Second messengers and
and thymus, Dev. Dyn., 237, 1699-1708.
membrane trafficking direct and organize growth
76. Herlihy, S. E., Brown, M. L., Pilling, D., Weeks,
cone steering, Nat. Rev. Neurosci.,
12,
191-203,
B. R., Myers, L. K., et al. (2015) Role of the
doi: 10.1038/nrn2996.
neutrophil
chemorepellent soluble
dipeptidyl
80. Lins, M. P., Silva, E. C. O., Silva, G. R., Souza, S. T.,
peptidase IV in decreasing inflammation in a murine
Medeiros, N. C., et al. (2018) Association between
model of arthritis, Arthritis Rheumatol., 67, 2634-
biomechanical alterations and migratory ability
2638, doi: 10.1002/art.39250.
of semaphorin-3A-treated thymocytes, Biochim.
77. Kumanogoh, A., and Kikutani, H. (2003) Immune
Biophys. Acta Gen. Subj., 1862, 816-824, doi: 10.1016/
semaphorins: a new area of semaphorin research,
j.bbagen.2018.01.001.
SEMAPHORIN 3A IN THE IMMUNE SYSTEM: TWENTY YEARS OF STUDY
Review
E. P. Kiseleva1,2* and K. V. Rutto1
1 Federal State Budgetary Scientific Institution “Institute of Experimental Medicine”,
197376 St. Petersburg, Russia; e-mail: ekissele@yandex.ru
2 North-Western State Medical University named after I. I. Mechnikov,
195067 St. Petersburg, Russia
Semaphorin 3А is a secreted glycoprotein, which was originally identified as axon guidance factor in the neu-
ronal system, but it also possesses immunoregulatory properties. Here, the effect of semaphorin 3A on T-lym-
phocytes, myeloid dendritic cells and macrophages is systematically analysed on the bases of all publications
available in the literature for 20 years. Expression of semaphorin 3A receptors - neuropilin-1 and plexins A - in
these cells is described in details. The data obtained on human and murine cells are considered at a comparative
aspect. Here for the first time we presented a comprehensive overview on the interaction of semaphorin 3A with
mononuclear phagocyte system. Semaphorin signaling mostly results in changes of the cytoskeletal machinery
and cellular morphology that regulate pathways involved in migration, adhesion and cell-cell cooperation of
immune cells. Accumulating evidence indicates that this factor is crucially involved in various phases of im-
mune responses, including the initiation phase, antigen presentation, effector T-cell function, inflammation
phase, macrophage activation and polarization. In recent years, the interest in this field has increased signifi-
cantly because semaphorin 3A participates in the pathogenesis of many human diseases and therefore can be
used for treatment. Its involvement in the immune responses is important to study, because semaphorin 3A
and its receptors turn to be a promising new therapeutic tools to be applied in many autoimmune, allergic and
oncology diseases.
Keywords: semaphorin 3A, neuropilin-1, plexin, T-lymphocytes, dendritic cells, macrophages
БИОХИМИЯ том 87 вып. 6 2022