БИОХИМИЯ, 2022, том 87, вып. 6, с. 804 - 815
УДК 571.27; 612.112.3.0.062;612.112.91
УЧАСТИЕ MAPK И PI3K В РЕГУЛЯЦИИ СЕКРЕЦИИ
ЦИТОКИНОВ МОНОНУКЛЕАРНЫМИ КЛЕТКАМИ
ПЕРИФЕРИЧЕСКОЙ КРОВИ В ОТВЕТ НА КОМБИНАЦИЮ
ЛПС Escherichia coli и rDer p 2
© 2022 А.А. Морозова1,2*, Н.И. Косякова1, И.Р. Прохоренко2
1 Федеральное государственное автономное учреждение здравоохранения
Больница Пущинского научного центра Российской академии наук,
142290 Пущино, Московская обл., Россия; электронная почта: honorikvudi@mail.ru
2 Институт фундаментальных проблем биологии - обособленное подразделение
Федерального государственного бюджетного учреждения науки Федеральный исследовательский центр
«Пущинский научный центр биологических исследований Российской академии наук»,
142290 Пущино, Московская обл., Россия
Поступила в редакцию 10.11.2021
После доработки 15.05.2022
Принята к публикации 18.05.2022
Поиск эффективных подходов к терапии острых воспалений, вызванных сочетанием аллергенов
и инфекционных агентов, является важной задачей мирового здравоохранения. Клещи домашней
пыли Dermatophagoides pteronyssinus - источник аллергенов групп Der p и переносчик бактери-
альных соединений, в частности, липополисахаридов (ЛПС). ЛПС и Der p 2 вызывают секрецию
провоспалительных цитокинов с участием киназ p38 MAPK, MEK 1/2 и PI3K. Участие указанных ки-
наз в регуляции ответа клеток на комбинацию ЛПС и Der p 2 недостаточно исследовано. Мы оценивали
влияние ингибирования киназ (p38 MAPK, MEK 1/2 и PI3K) на синтез цитокинов (ФНО, ИЛ-8 и
ИЛ-6) при активации мононуклеарных клеток периферической крови (PBMC) здоровых добровольцев
ЛПС E. coli и rDer p 2. Нами была выявлена зависимость вклада киназ в регуляцию ответа клеток от
природы агента (rDer p 2 и/или ЛПС). Мы обнаружили, что p38 MAPK играет ключевую роль в син-
тезе ФНО PBMC в ответ на комбинацию ЛПС и rDer p 2. MEK 1/2-зависимый сигнальный путь явля-
ется основным для синтеза ФНО и ИЛ-8 в ответ на ЛПС и rDer p 2. PI3K-зависимая передача сигна-
лов негативно регулирует продукцию ФНО во время активации клеток rDer p 2, но не участвует в
ответе на комбинацию ЛПС и rDer p 2. PI3K-зависимая передача сигналов в регуляции синтеза цито-
кинов PBMC наиболее выражена в ответ на их активацию rDer p 2. Понимание особенностей ответов
иммунных клеток на комбинации воспалительных агентов облегчит поиск новых внутриклеточных
мишеней в противовоспалительной терапии.
КЛЮЧЕВЫЕ СЛОВА: PBMC, p38 MAPK, MEK 1/2, PI3K, Der p 2, липополисахариды, цитокины.
DOI: 10.31857/S0320972522060082, EDN: AUROHZ
ВВЕДЕНИЕ
D. pteronyssinus являются источником более двух
десятков белков с аллергическими свойства-
Клещи домашней пыли являются одним из
ми, различающихся по механизму действия.
наиболее распространённых источников ал-
Основными группами белков-аллергенов кле-
лергенов. В ряде регионов аллергены клещей
щей являются протеазы и липид-связывающие
домашней пыли Dermatophagoides pteronyssinus
белки, которые могут облегчать перенос про-
приводят к возникновению ~50% зарегистри-
воспалительных агентов микробной природы
рованных случаев аллергической астмы
[1]. к иммунным клеткам [2]. Аллергены с протео-
Принятые сокращения: ИЛ - интерлейкин; ЛПС - липополисахарид; ФНО - фактор некроза опухолей; MAPK - ми-
тоген-активируемая протеинкиназа; MD-2 - фактор миелоидной дифференцировки 2; MEK1/2 - киназа мито-
ген-активируемой протеинкиназы двойной специфичности 1/2; MyD88 - фактор миелоидной дифференцировки 88;
PBMC - мононуклеарные клетки периферической крови; PI3K - фосфоинозитид-3-киназа; rDer p 2 - рекомбинантный
белок-аллерген из клеща Dermatophagoides pteronyssinus; TLR - толл-подобный рецептор.
* Адресат для корреспонденции.
804
ОТВЕТ PBMC НА ЛПС И rDer p 2 ПРИ ИНГИБИРОВАНИИ КИНАЗ
805
литической активностью вызывают воспаление
описана способность аллергена Der p 2 активи-
путём двух механизмов. Первый механизм -
ровать фосфорилирование киназ p38 MAPK,
протеолитическое нарушение целостности
MEK1/2 и PI3K в клетках легких и иммунных
эпителиального барьера альвеол, приводящее к
клетках человека [14, 16-19]. Активация даль-
усилению сенсибилизации другими аллергена-
нейших сигнальных событий приводит к син-
ми. Второй механизм - непротеолитическая ак-
тезу и высвобождению клетками про- и про-
тивация провоспалительного ответа клеток [3].
тивовоспалительных цитокинов ФНО, ИЛ-1β,
Домашняя пыль, естественная среда обитания
ИЛ-6, ИЛ-8, CXCL10 и других [14, 19]. ЛПС
указанных клещей, содержит большое количе-
также вызывает передачу сигнала по сигналь-
ство грибков и бактерий, являющихся источни-
ным путям PI3K/Akt, ERK, JNK и p38 MAPK,
ком β-глюканов и липополисахаридов (ЛПС)
регулирующих секрецию провоспалительных
соответственно. Указанные соединения спо-
цитокинов ФНО, ИЛ-1β и ИЛ-6 [20, 21].
собны активировать врожденную иммунную
Как было сказано выше, аллергены домаш-
систему. Их активность может быть усилена за
ней пыли могут включать в себя не только белки
счёт переноса белками-аллергенами [4-6]. Од-
самих клещей, но и микробные продукты, мо-
ним из ключевых аллергенов из D. pteronyssinus
дулирующие воспалительных процесс. Таким
является белок Der p 2 [7].
образом, для обеспечения адекватных подходов
Классическим механизмом сенсибилиза-
к терапии аллергии на домашнюю пыль необхо-
ции к аллергенам из D. pteronyssinus является
димо исследовать совместные эффекты аллер-
избыточная активация CD4+ Th2-лимфоцитов,
гена Der p 2 и микробных агентов, в частности,
секретирующих ИЛ-4, ИЛ-5 и ИЛ-13. Указан-
ЛПС, на активацию иммунных клеток. Кроме
ные цитокины активируют синтез IgE, запу-
того, существует проблема возникновения ин-
скают воспалительные ответы эозинофилов,
фекции на фоне аллергического воспаления,
нейтрофилов и макрофагов в лёгких [8]. Аллер-
например, при бронхиальной астме [21]. Пони-
гены из D. pteronyssinus, кроме Th2-зависимо-
мание особенностей действия агентов аллерги-
го ответа, могут вызывать TLR2/4-зависимый
ческой природы и соединений бактериальной
(толл-подобный рецептор, TLR) воспалитель-
природы позволит эффективнее купировать
ный ответ альвеолярных макрофагов [9].
последствия аллергических патологий, совме-
Активация иммунных клеток белком
щённых с инфекционными процессами. Ранее
Der p 2 может происходить по TLR4-зависимо-
мы обнаружили явление усиления ЛПС-ин-
му и TLR4-независимому механизмам [7, 10].
дуцированной секреции цитокинов клетка-
К TLR4-независимой активации можно отне-
ми крови человека в присутствии аллергенов
сти Th2-зависимый клеточный ответ на Der p 2,
из D. pteronyssinus [22]. Мы предположили, что
описанный выше [10]. В качестве альтерна-
при ответе иммунных клеток на комбинацию
тивных мишеней могут выступать TLR2 и дру-
агентов возможно изменение вкладов внутри-
гие молекулы [11]. TLR4-зависимый механизм
клеточных сигнальных молекул, например, ки-
реализуется за счёт того, что аллерген клеща
наз р38 MAPK, MEK1/2 и PI3K. При анализе
Dermatophagoides pteronyssinus (Der p 2) является
литературы мы не нашли работ, посвященных
миметиком корецептора TLR4, фактора миело-
исследованию вклада киназ в совместную акти-
идной дифференцировки 2 (MD-2) [5, 12-14].
вацию изолированных иммунных клеток ЛПС
Der p 2 способен активировать передачу сиг-
и Der p 2.
нала внутрь клетки в отсутствие ЛПС, а также
Исходя из вышесказанного, целью насто-
усиливать ЛПС-индуцированные TLR4-зави-
ящей работы была оценка вклада ключевых
симые ответы [15]. Der p 2 также способен акти-
киназ р38 MAPK, MEK1/2 и PI3K в ответ мо-
вировать экспрессию MD-2 в мононуклеарных
нонуклеарных клеток периферической крови
клетках периферической крови (PBMC), тем
человека на комбинацию аллергена клещей до-
самым усиливая провоспалительные эффекты
машней пыли Der p 2 и ЛПС. Воспалительные
ЛПС [13]. Благодаря функциональной гомоло-
реакции на ЛПС, в том числе «цитокиновый
гии с MD-2, Der p 2 обеспечивает ЛПС-опосре-
шторм», начинаются в течение первых 24 ч [23],
дованную активацию TLR4 в отсутствие MD-2
поэтому настоящее исследование было сосре-
и облегчает ее в присутствии MD-2. Помимо
доточено на относительно быстрых клеточных
активации врожденного иммунитета, Der p 2
ответах на аллерген и/или ЛПС в течение пер-
взаимодействует с В-лимфоцитами, вовлекая в
вых 16 ч активации. Полученные результаты в
ответ адаптивный иммунитет [14]. В литературе
будущем позволят выявить возможные общие
БИОХИМИЯ том 87 вып. 6 2022
806
МОРОЗОВА и др.
точки блокирования воспаления, вызванного
ную кровь центрифугировали 2 мин при 300 g
сочетанием аллергенов и микробных агентов.
и удаляли супернатант. Для осаждения эри-
Мы исследовали вклад р38 MAPK, MEK1/2 и
троцитов к клеткам добавляли 20 мл 6%-ного
PI3K в активацию синтеза провоспалительных
декстрана (500 кДа) в фосфатно-солевом буфе-
цитокинов ФНО, ИЛ-6 и ИЛ-8 PBMC, инду-
ре, перемешивали и инкубировали 30 мин при
цированного ЛПС из Escherichia coli O55:B5,
комнатной температуре. После осаждения эри-
рекомбинантным белком rDer p 2 и их комби-
троцитов плазму крови отбирали и центрифуги-
нацией.
ровали 6 мин при 275 g для удаления тромбоци-
тов. Плазму, освобожденную от тромбоцитов,
разводили в фосфатно-солевом буфере в соот-
МАТЕРИАЛЫ И МЕТОДЫ
ношении 1 : 4. Ресуспендировали клетки в 8 мл
полученной смеси, наслаивали на 3 мл перкол-
Реактивы. В исследовании были исполь-
ла (1,077 г/мл) и центрифугировали 15 мин при
зованы S-гликоформа ЛПС E. coli O55:B5
300 g. Фракция PBMC остается на градиенте
(«Sigma-Aldrich»,
США); рекомбинант-
плотности. Отбирали PBMC, трижды промыва-
ный белок-аллерген клеща домашней пыли
ли их фосфатно-солевым буфером и центрифу-
D. pteronyssinus rDer p 2, полученный в дрожже-
гировали 5 мин при 300 g. Клетки окрашивали
вой культуре с целью исключения загрязнения
трипановым синим и определяли жизнеспо-
образца ЛПС («MyBioSource», США); среда
собность с помощью автоматического счетчика
RPMI 1640 (25 мМ HEPES, NaHCO3, L-глута-
Countess® Automated Cell Counter («Invitrogen»,
мин) («Sigma-Aldrich»), SB 203580 ингибитор
США). Жизнеспособность составляла не ме-
р38 MAPK («Sigma-Aldrich»), PD 098059 ин-
нее
90%. PBMC разводили RPMI-1640 до
гибитор MAPKK (MEK1 и MEK2) («Sigma-
1 × 106 клеток/мл и разносили в 48-луночные
Aldrich»),
ингибитор PI3K вортманнин
планшеты. Инкубацию клеток с исследуемы-
(«Sigma-Aldrich»), иммуноферментные тест-
ми агентами выполняли в CO2-инкубаторе при
системы для определения ИЛ-6, ФНО, ИЛ-8
температуре 37 °С и концентрации CO2 5%. Ста-
(АО «ВЕКТОР-БЕСТ», РФ).
тистически значимых изменений жизнеспособ-
Изоляция PBMC. Эксперименты выполня-
ности PBMC после стимуляции 40 нг/мл ЛПС и
ли на венозной крови 10 условно здоровых до-
0,5 мкг/мл rDer p 2 мы не обнаружили.
бровольцев (3 женщины, 7 мужчин, возраст 18-
Активация PBMC человека к продукции ци-
30 лет). Протокол исследования соответствовал
токинов. PBMC (106 клеток/мл в каждом образ-
Хельсинкской декларации Всемирной меди-
це) инкубировали 1 ч с ингибиторами SB 203580
цинской ассоциации и был одобрен Локаль-
(10 мкМ), PD 098059 (50 мкМ), вортманнин
ным этическим комитетом Больницы научного
(100 нМ) в СО2-инкубаторе («Jouan», Франция)
центра Пущино (№ 2 от 10.04.2014). Все добро-
при температуре 37 °С и концентрации CO2 5%.
вольцы дали письменное согласие на участие
В контрольные пробы добавляли соответству-
в исследовании после того, как были проин-
ющее количество стерильного фосфатно-соле-
формированы о всех предстоящих процедурах.
вого буфера. После инкубации с ингибиторами
Всем добровольцам перед исследованием вы-
в соответствующие образцы добавляли ЛПС
полнялось тестирование на наличие аллергии к
E. coli (40 нг/мл) и/или rDer p 2 (0,5-3 мкг/мл) и
домашней пыли. Критерии включения в экспе-
инкубировали в течение 6 и 16 ч в СО2-инкуба-
риментальную группу соответствовали требо-
торе. Далее клетки осаждали центрифугирова-
ваниям к сдаче крови: отсутствие врожденных
нием при 3000 g в течение 10 мин. Полученные
нарушений, отсутствие инфекционных заболе-
супернатанты отбирали и хранили при -20 °С
ваний и контактов с инфицированными боль-
до определения содержания цитокинов. После
ными не менее двух месяцев, отсутствие кож-
6 ч инкубации оценивали концентрации ФНО,
ной реакции на аллергены домашней пыли.
после инкубации 16 ч - ИЛ-6 и ИЛ-8. Концен-
PBMC изолировали из венозной крови на
трации ЛПС были выбраны на основе литера-
градиенте плотности перколла (1,077 г/мл) со-
турных данных [25, 26]. Концентрация rDer p 2
гласно работе Haslett et al. [24]. Забор венозной
была подобрана по данным литературы [14, 27]
крови условно здоровых добровольцев выпол-
и результатам предварительных экспериментов
нялся сотрудниками Больницы Пущинского
(рис. 1). Время инкубации для каждого цитоки-
научного центра РАН. В качестве антикоагулян-
на было выбрано на основе литературных дан-
та использовали 5%-ный гепарин натрия. Цель-
ных для PBMC человека [17, 27].
БИОХИМИЯ том 87 вып. 6 2022
ОТВЕТ PBMC НА ЛПС И rDer p 2 ПРИ ИНГИБИРОВАНИИ КИНАЗ
807
Определение содержания цитокинов. Опре-
непараметрической статистики. Эксперимен-
деление концентрации цитокинов в образцах
тальные данные представляли в виде медиан и
проводили с помощью иммуноферментных на-
перцентилей 10, 25, 75 и 90%. Статистическую
боров по методике, предложенной производи-
значимость различий выборочных медианных
телем. Оптическую плотность регистрировали
значений оценивали с помощью U-критерия
с помощью иммуноферментного анализатора
Манна-Уитни.
STAT FAX 3200 («Awareness Technology, Inc»,
США) при длине волны 450 нм. Количествен-
ную оценку результатов проводили с исполь-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
зованием калибровочной кривой, отражающей
зависимость оптической плотности образца от
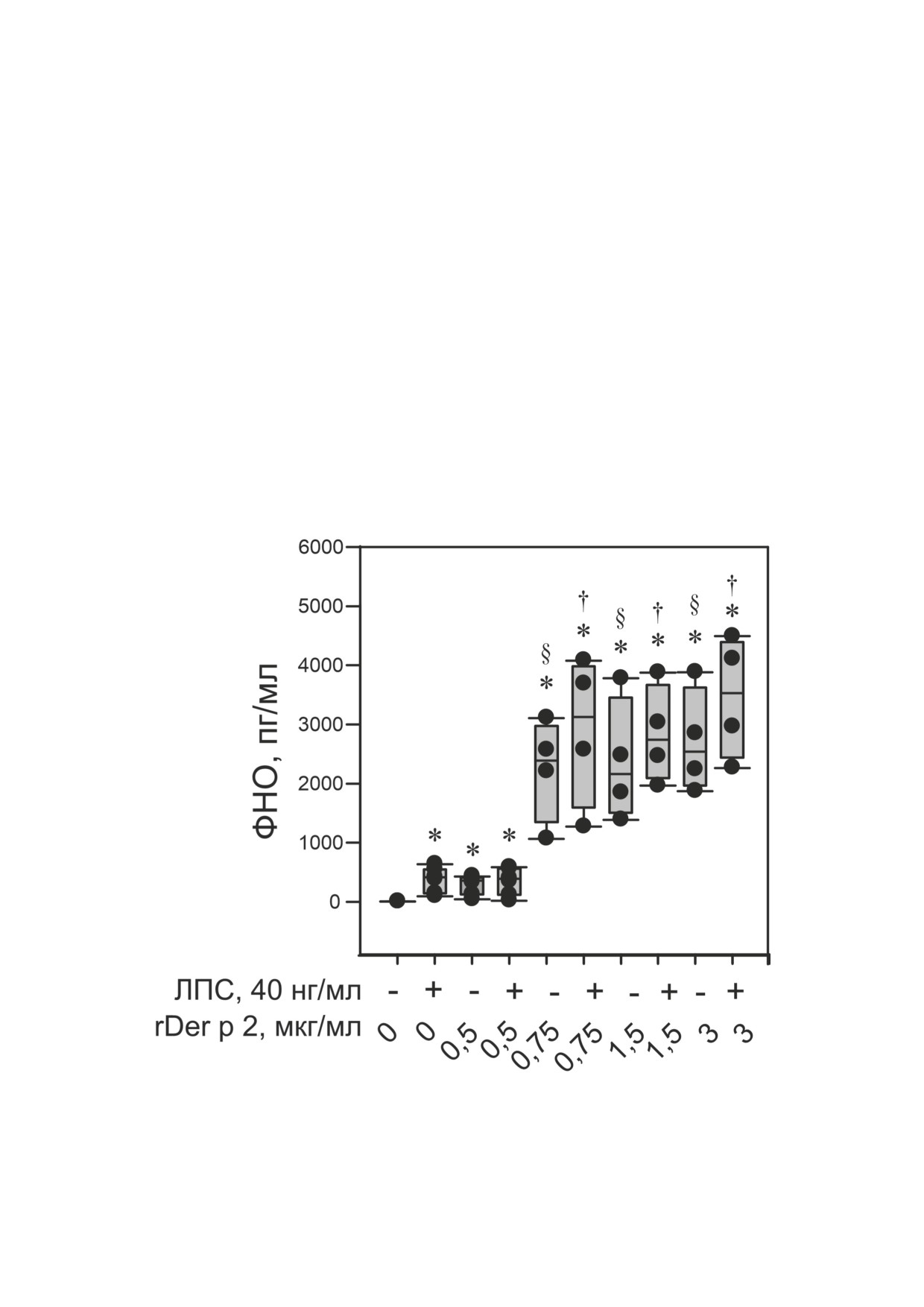
rDer p 2 дозозависимо активирует секре-
концентрации цитокина.
цию ФНО PBMC. rDer p 2 в концентрации
Статистическая обработка. Полученные ре-
0,5 мкг/мл и выше вызывал увеличение секре-
зультаты обрабатывали с использованием про-
ции ФНО PBMC человека (рис. 1).
граммного обеспечения Microsoft Office Excel
Увеличение концентрации rDer p 2 вы-
2010 (надстройка AtteStat) и SigmaPlot
12.5
зывало увеличение секреции ФНО PBMC че-
(«Systas Software», США). Гипотезу о нормаль-
ловека. Мы ожидали синергический эффект
ности распределения оценивали с помощью
между rDer p 2 и ЛПС, но не обнаружили его.
критерия Шапиро-Уилка. Выборочные рас-
Тем не менее это не исключает различия вкла-
пределения отличались от нормального рас-
дов разных сигнальных путей в ответ клеток на
пределения, поэтому мы применили методы
эти стимулы. В дальнейшем мы исследовали
Рис. 1. Концентрации ФНО, высвобождаемого PBMC человека в ответ на ЛПС, rDer p 2 или их комбинацию после
6 ч инкубации (n = 4). Данные представлены в виде медиан и перцентилей 10, 25, 75 и 90%. * p < 0,05 - статистически
достоверное различие с контролем, § < 0,05 - статистически достоверное различие с действием 0,5 мкг/мл rDer p 2,
† < 0,05 - статистически достоверное различие с действием комбинации 0,5 мкг/мл и 40 нг/мл ЛПС
БИОХИМИЯ том 87 вып. 6 2022
808
МОРОЗОВА и др.
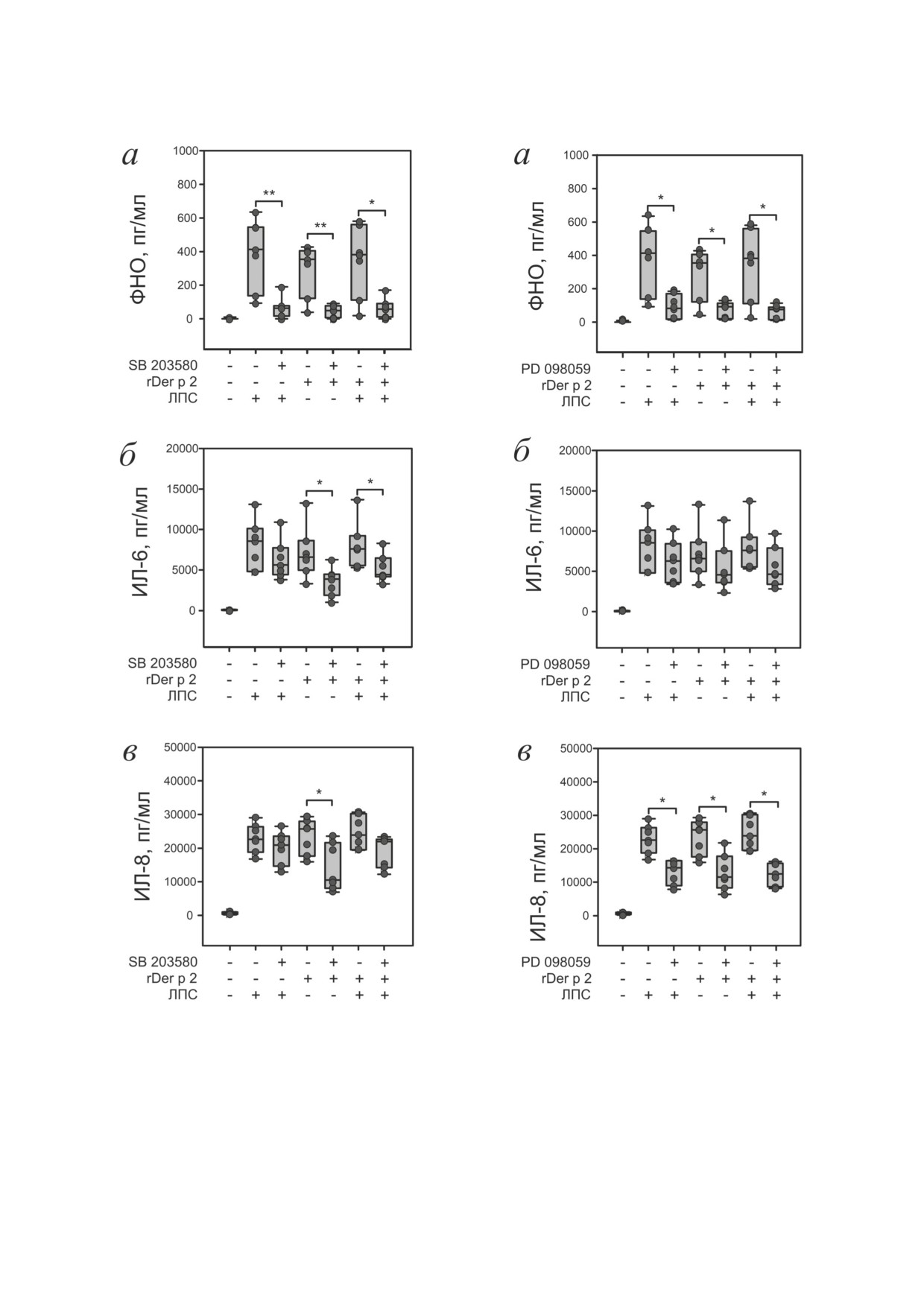
Рис.
2. Концентрации цитокинов, секретированных
Рис.
3. Концентрации цитокинов, секретированных
PBMC в ответ на ЛПС, rDer p 2 или их комбинацию при
PBMC в ответ на ЛПС, rDer p 2 или их комбинацию при
ингибировании p38 MAPK. а - Концентрация ФНО по-
ингибировании MEK1/2. а - Концентрация ФНО после
сле 6 ч инкубации, б - концентрация ИЛ-6 после 16 ч ин-
6 ч инкубации, б - концентрация ИЛ-6 после 16 ч инкуба-
кубации, в - концентрация ИЛ-8 после 16 ч инкубации.
ции, в - концентрация ИЛ-8 после 16 ч инкубации. Дан-
Концентрация SB 203580 - 10 μM. Данные представлены
ные представлены в виде медиан и перцентилей 10, 25, 75
в виде медиан и перцентилей 10, 25, 75 и 90%. * p < 0,05;
и 90%. Концентрация PD 098059 - 50 μM. * p < 0,05 - ста-
** p < 0,01 - статистически достоверное различие между
тистически достоверное различие между выборками, обо-
выборками, обозначенными скобками
значенными скобками
БИОХИМИЯ том 87 вып. 6 2022
ОТВЕТ PBMC НА ЛПС И rDer p 2 ПРИ ИНГИБИРОВАНИИ КИНАЗ
809
ответы клеток на rDer p 2 в концентрации
0,5 мкг/мл - наименьшей из достаточных для
активации PBMC.
p38 MAPK играет ключевую роль в синте-
зе ФНО PBMC в ответ на ЛПС и/или rDer p 2.
При активации PBMC при действии ЛПС и
rDer p 2 содержание ФНО, ИЛ-6 и ИЛ-8 досто-
верно увеличивалось по сравнению с контролем
(рис. 2). Их комбинация не усиливала секрецию
цитокинов по сравнению с агентами, внесен-
ными по отдельности. Ингибитор p38 MAPK
SB 203580 снижал секрецию ФНО в ответ на
ЛПС (рис. 2, а), но не влиял на ЛПС-индуци-
рованную секрецию ИЛ-6 и ИЛ-8 (рис. 2, б, в).
SB 203580 ингибировал секрецию всех исследу-
емых цитокинов в ответ на rDer p 2 (рис. 2), что
указывает на участие p38 MAPK в регуляции
синтеза ИЛ-6 и ИЛ-8 в ответ на аллерген. Инги-
бирование p38 MAPK снижало секрецию ФНО
и ИЛ-6 в ответ на комбинацию rDer p 2 и ЛПС,
что указывает на сохранение вклада p38 MAPK
в регуляцию секреции данных цитокинов при
комбинированном действии rDer p 2 и ЛПС.
Секреция ИЛ-8 в ответ на комбинацию rDer p 2
и ЛПС при ингибировании p38 MAPK не изме-
нялась. На основании полученных данных мы
предположили, что при сочетанном действии
rDer p 2 и ЛПС секреция ФНО и ИЛ-6 регули-
руется с участием p38 MAPK, а основным эф-
фектором выступает Der p 2. Секреция ИЛ-8 в
ответ на комбинацию агентов не зависит от уча-
стия p38 MAPK и обеспечивается за счёт ЛПС.
MEK1/2-зависимый путь передачи сиг-
нала является основным при синтезе ФНО и
ИЛ-8 PBMC в ответ на ЛПС и/или rDer p 2.
PD 098059, ингибитор MEK1/2, не влиял на
ЛПС- и rDer p 2-индуцированную секрецию
ИЛ-6, но уменьшал секрецию ФНО и ИЛ-8 во
всех вариантах эксперимента (рис. 3). Получен-
ные данные свидетельствуют в пользу того, что
MEK1/2 участвует в регуляции секреции ФНО
и ИЛ-8, вызванной ЛПС и аллергеном, но не
влияет на секрецию ИЛ-6. При ингибировании
MEK1/2 секреция ФНО в ответ на ЛПС, rDer p 2
и их комбинацию была снижена относительно
соответствующих образцов без ингибиторов
(рис. 3, а). Следовательно, MEK1/2 играет кри-
тическую роль в регуляции секреции ФНО при
Рис.
4. Концентрации цитокинов, секретированных
PBMC в ответ на ЛПС, rDer p 2 или их комбинацию при
сочетанном действии ЛПС и rDer p 2.
ингибировании PI3K. а - Концентрация ФНО после 6 ч
Мы предполагаем, что вклады ЛПС или
инкубации, б - концентрация ИЛ-6 после 16 ч инкубации,
rDer p 2 в индукцию ответа на их комбинацию
в - концентрация ИЛ-8 после 16 ч инкубации. Данные
представлены в виде медиан и перцентилей 10, 25, 75 и 90%.
сопоставимы. Блокирование MEK1/2 не вли-
Концентрация вортманнина - 100 нМ. * p < 0,05 - стати-
яло на секрецию ИЛ-6 PBMC человека в ответ
стически достоверное различие между выборками, обозна-
на комбинацию ЛПС и rDer p 2 и её отдельные
ченными скобками
БИОХИМИЯ том 87 вып. 6 2022
810
МОРОЗОВА и др.
компоненты (рис. 3, б). Наши данные указыва-
кинов, как нами было показано в предыдущем
ют на то, что путь регуляции секреции ИЛ-6 в
исследовании на цельной крови [23], однако в
ответ на ЛПС и Der p 2 не зависит от MEK1/2.
случае PBMC синергического эффекта не на-
Ингибирование MEK1/2 снижало секрецию
блюдалось.
ИЛ-8 на комбинацию ЛПС + rDer p 2, а также её
Стоит также отметить значительное разли-
отдельные компоненты (рис. 3, в), что указывает
чие концентраций секретируемых цитокинов
на критическую роль MEK1/2 в ответах клеток
PBMC и клетками цельной крови, что вызва-
человека на аллерген и ЛПС. Мы предположи-
но различием объектов исследования. В статье
ли, что вклады ЛПС или rDer p 2 в регуляцию се-
Radzyukevich et al. исследования выполнялись
креции ИЛ-8, как в случае ФНО, сопоставимы.
на цельной крови ex vivo: образец содержал все
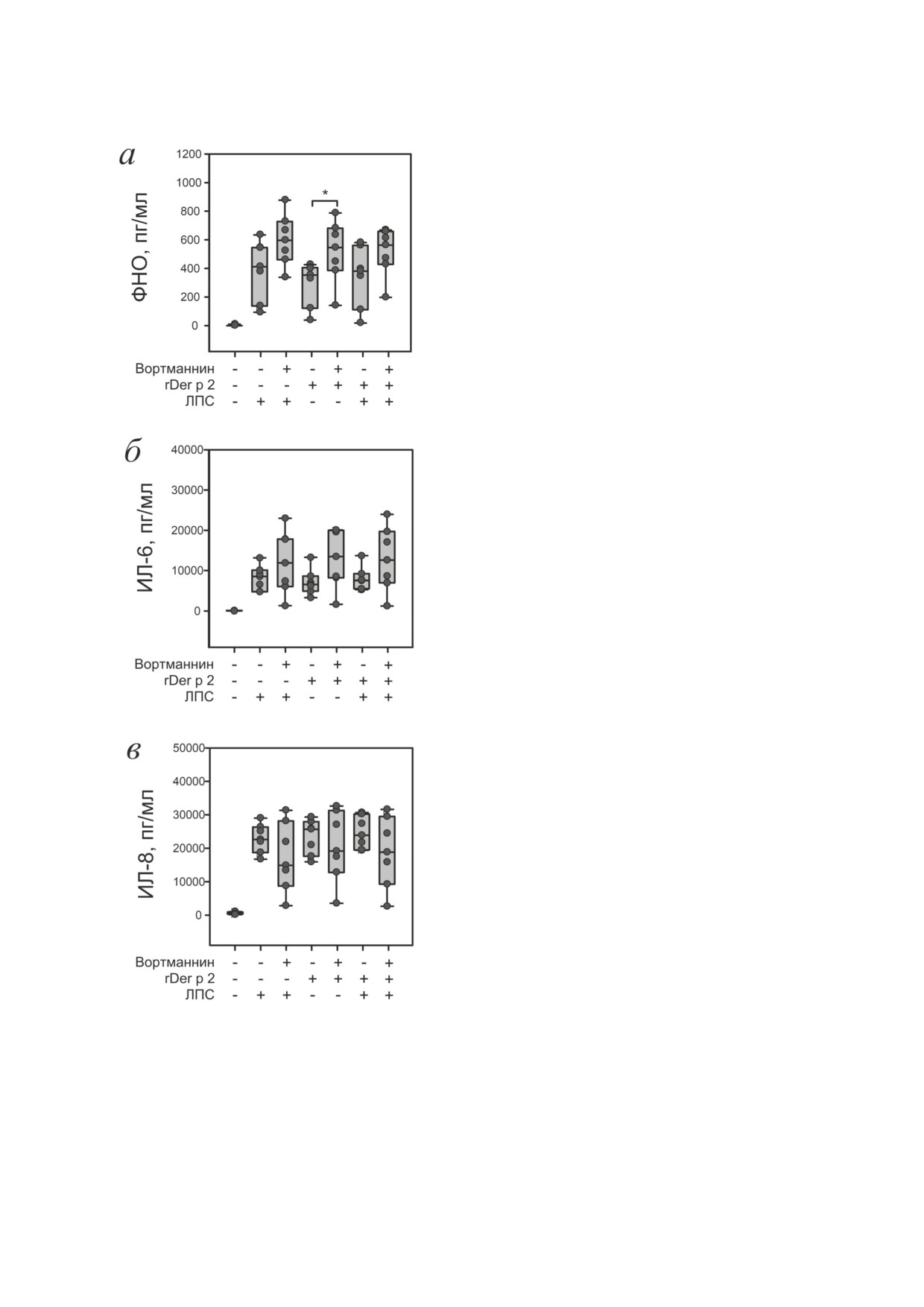
PI3K негативно регулирует продукцию ФНО
форменные элементы крови и 10%-ную сыво-
при активации клеток rDer p 2. Ингибирование
ротку донора. Такой подход позволяет полу-
PI3K не влияло на секрецию ИЛ-6 и ИЛ-8 в от-
чить приближенный к in vivo ответ клеток, но
вет на комбинацию rDer p 2 и ЛПС и отдельное
не дает возможности оценить вклад отдельных
действие веществ (рис. 4, б, в), что указывает на
элементов системы (в нашем случае, клеток
то, что секреция данных цитокинов PBMC в от-
крови). Для оценки вклада мононуклеарной
вет на rDer p 2 и/или ЛПС не зависит от PI3K.
фракции клеток крови (моноциты и лим-
Блокирование PI3K не влияло на ЛПС-инду-
фоциты) мы исследовали ответ изолирован-
цированную секрецию ФНО (рис. 4, а), но уве-
ных PBMC человека на комбинацию rDer p 2
личивало секрецию ФНО в ответ на rDer p 2.
и ЛПС.
При действии комбинацией rDer p2 и ЛПС до-
В случае исследования, выполненного на
стоверного увеличения секреции ФНО на фоне
PBMC, в образце отсутствуют форменные эле-
блокирования PI3K не наблюдалось. Следова-
менты, способные модифицировать цитокино-
тельно, PI3K регулирует секрецию ФНО по ме-
вый ответ на ЛПС и/или Der p 2: другие типы
ханизму отрицательной обратной связи в ответ
клеток (в частности, нейтрофилы) и белки сы-
на rDer p 2, но не ЛПС или их комбинацию.
воротки крови (в частности, sMD-2) [7, 31].
Для оценки вклада киназ в активацию
PBMC человека мы применяли специфические
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ингибиторы киназ: SB 203580 - ингибитор
р38 MAPK, PD 098059 - ингибитор MAPKK
В настоящей работе мы исследовали вкла-
(MEK1 и MEK2), вортманнин - ингибитор
ды MAP-киназ в регуляцию секреции про-
PI3K [32, 33]. Ингибиторы MAPK можно рас-
воспалительных цитокинов PBMC человека в
сматривать как потенциальные терапевтиче-
ответ на комбинацию rDer p 2 и ЛПС, а также
ские противовоспалительные агенты [34]. Мы
указанные агенты по отдельности. Мы обна-
оценили потенциальную противовоспали-
ружили, что низкие концентрации rDer p 2
тельную активность ингибиторов SB 203580 и
(0,5 мкг/мл) достаточны для активации клеток
PD 098059 в отношении комбинации rDer p 2
к продукции цитокинов (рис. 1). Мы не обна-
и ЛПС. Нами было обнаружено, что оба инги-
ружили статистически значимых изменений
битора могут оказывать потенциальное про-
жизнеспособности PBMC после инкубации с
тивовоспалительное действие в отношении
исследуемыми агентами (данные не представ-
секреции ФНО, ИЛ-6 и ИЛ-8 в ответ на ком-
лены). Это согласуется с литературными дан-
бинацию rDer p 2 и ЛПС, а также её отдель-
ными, полученными при стимуляции клеток
ных компонентов (рис. 1, 2). Следовательно,
при помощи ЛПС и Der p 2 в концентрациях,
ингибиторы MAPK можно рассматривать как
сопоставимых или превышающих используе-
потенциальные агенты для терапии воспа-
мые в настоящей работе [28, 29], следователь-
ления, вызванного комбинацией аллергии и
но, изменения секреции цитокинов вызваны
инфекции.
специфическим действием rDer p 2 и ЛПС, а
Нами показано, что PBMC челове-
не изменением жизнеспособности клеток.
ка синтезируют ФНО преимущественно по
Комбинация rDer p 2 и ЛПС усиливала
MAPK-зависимому пути во всех вариантах
секрецию ФНО, ИЛ-6 и ИЛ-8 PBMC челове-
эксперимента (рис. 5), что согласуется с ли-
ка, что согласуется с литературными данными
тературными данными [35]. Ингибирование
[30]. Мы предполагали наличие синергическо-
p38 MAPK в случае активации клеток rDer p 2
го эффекта rDer p 2 и ЛПС на секрецию цито-
также влияло на продукцию ИЛ-6.
БИОХИМИЯ том 87 вып. 6 2022
ОТВЕТ PBMC НА ЛПС И rDer p 2 ПРИ ИНГИБИРОВАНИИ КИНАЗ
811
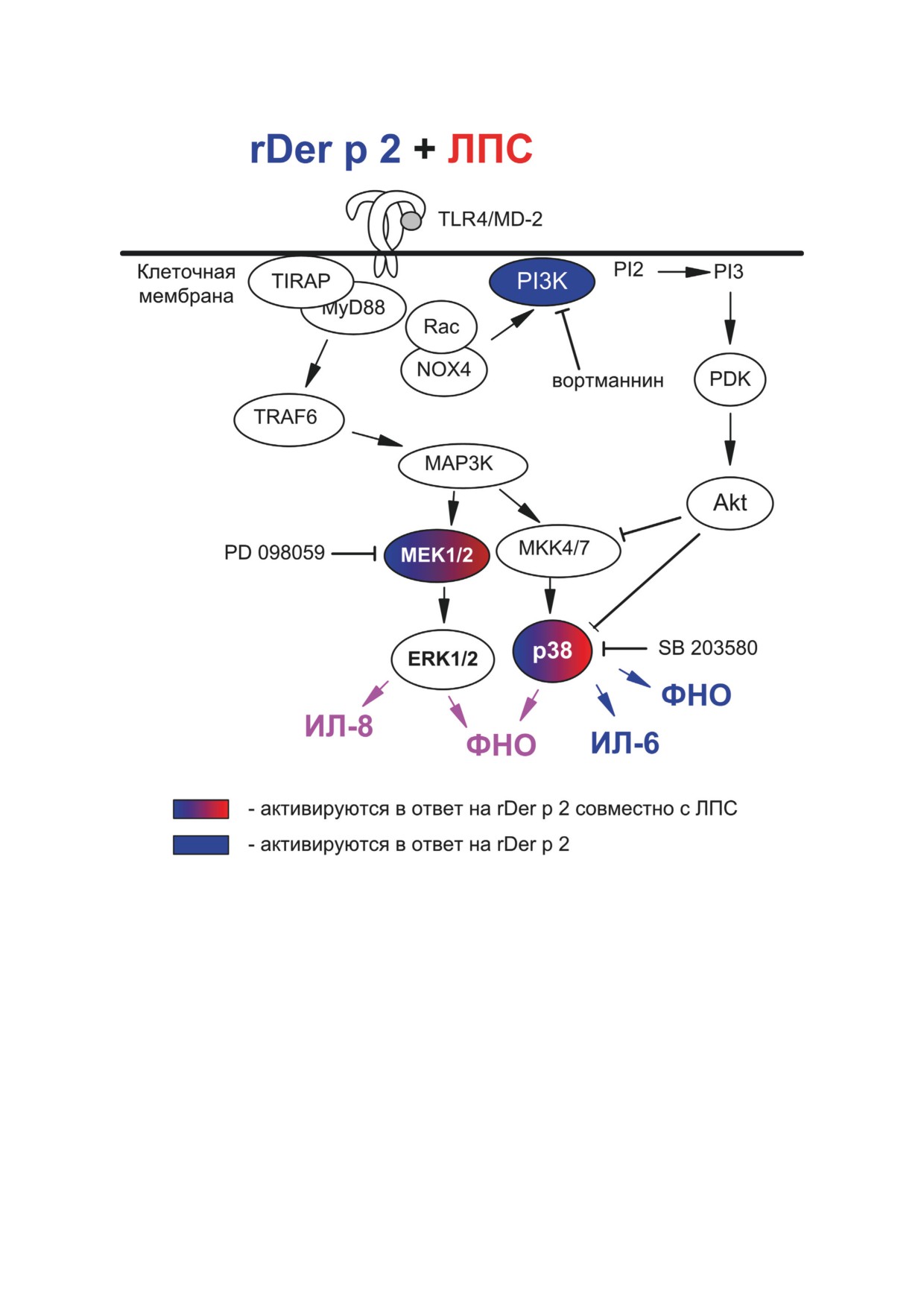
Рис. 5. Схематическое представление вклада исследуемых киназ в регуляцию секреции цитокинов человека в ответ
на комбинацию rDer p 2 + ЛПС (пояснения в тексте). Схемы сигнальных путей изображены на основе литературных
данных [35-39]
Ингибирование MEK1/2-зависимого сиг-
ЛПС, общую фракцию аллергенов домашней
нального пути имело наиболее выраженное
пыли из D. pteronyssinus и их комбинацию [40].
влияние на синтез ИЛ-8, в случае ответа на
Результаты настоящей работы согласуются
оба агента. Ингибирование PI3K не влияло
с данными, полученными на цельной крови
на продукцию этого цитокина, что указыва-
человека, и указывают на участие PBMC в
ет на значительную роль MEK1/2 в регуляции
ЛПС- и аллерген-индуцированной секреции
секреции ИЛ-8.
цитокинов.
В предыдущих работах мы показали, что
PI3K играет роль отрицательного регу-
ингибитор p38 MAPK снижал секрецию ФНО
лятора при передаче сигналов через TLR4.
клетками цельной крови человека в ответ на
Согласно литературным данным, ингиби-
БИОХИМИЯ том 87 вып. 6 2022
812
МОРОЗОВА и др.
рование PI3K вызывает активацию NFκB,
в регуляцию синтеза цитокинов PBMC наи-
ERK1/2, p38 MAPK и JNK и увеличение секре-
более выражен ответ на rDer p 2.
ции ФНО, ИЛ-6, ИЛ-10 и ИЛ-12 [20, 41-44].
Различия между внутриклеточными сиг-
На основании данных об участии PI3K-зави-
нальными путями, регулирующими секре-
симых сигнальных путей в негативной регу-
цию цитокинов в ответ на Der p 2 и ЛПС,
ляции синтеза провоспалительных цитоки-
могут быть вызваны различием рецепторов,
нов в ответ на ЛПС мы исследовали влияние
распознающих ЛПС и Der p 2. В частности,
ингибирования PI3K на наработку ФНО,
распознавание комбинации Der p 2 + ЛПС
ИЛ-6, ИЛ-8 при активации PBMC ЛПС, rDer
может происходить с участием TLR4, как это
p 2 или их комбинацией. При ингибировании
описано при аллергической астме [46, 47].
PI3K наблюдалась тенденция к увеличению
Der p 2 могут распознаваться PBMC человека
синтеза ФНО и ИЛ-6 во всех вариантах экс-
через TLR2, как это описано для других типов
перимента. Однако достоверное изменение
клеток [11, 48]. Экспериментальная проверка
уровня цитокина наблюдалось только в слу-
данного предположения является задачей бу-
чае активации клеток rDer p 2 и продукции
дущих исследований.
ФНО (рис. 2). Таким образом, PI3K участвует
в отрицательной регуляции секреции ФНО
PBMC человека в ответ на действие rDer p 2.
Благодарности. Авторы выражают свою
Насколько нам известно, указанное явление
благодарность сотрудникам БПНЦ РАН
описано впервые в настоящей работе. Отли-
Акимовой Ольге Николаевне (за забор био-
чия с известными данными литературы могут
материала для обследования) и Банниковой
быть объяснены различием в используемых
Надежде Павловне (за помощь в организации
нами и авторами других работ серотипами
исследования).
ЛПС.
Конфликт интересов. Авторы заявляют об
Нами показано, что присутствие rDer p 2
отсутствии конфликта интересов в финансо-
не усиливает экспрессию цитокинов клетка-
вой или какой-либо иной сфере.
ми в ответ на ЛПС. Наши данные указыва-
Соблюдение этических норм. Все процеду-
ют на то, что при активации PBMC rDer p 2
ры, выполненные в исследованиях с участием
проявляет в большей степени свойства холе-
людей, соответствуют этическим стандартам
стерин-связывающего белка, чем миметика
Национального комитета по исследователь-
MD-2 [45].
ской этике и Хельсинкской декларации 1964
В настоящей работе были обнаружены
года и ее последующим изменениям или со-
различия вкладов киназ ERK1/2, p38 MAPK и
поставимым нормам этики, были одобрены
PI3K в зависимости от активирующего аген-
Локальным этическим комитетом Больницы
та (белок-аллерген и/или ЛПС). Основным
научного центра Пущино (№ 2 от 10.04.2014).
регулятором синтеза ФНО при активации
От каждого из добровольцев было получе-
PBMC аллергеном являются MAPK-зависи-
но информированное согласие на участие в
мые сигнальные пути. Вклад MEK1/2 и PI3K
исследовании.
СПИСОК ЛИТЕРАТУРЫ
1. Thomas, W. R., Hales, B. J., Smith, W. A (2010)
sensitization, Thorax, 67, 488-495, doi: 10.1136/
House dust mite allergens in asthma and allergy,
thoraxjnl-2011-200606.
Trends Mol. Med., 16, 321-328, doi: 10.1016/j.
4. Reithofer, M., and Jahn-Schmid, B.
(2017)
molmed.2010.04.008.
Allergens with protease activity from house dust
2. Gregory, L. G., and Lloyd, C. M.
(2011)
mites, Int. J. Mol. Sci., 18, 1368, doi: 10.3390/
Orchestrating house dust mite-associated allergy
ij ms18071368
in the lung, Trends Immunol.,
32,
402-411,
5. Douwes, J., Zuidhof, A., Doekes, G., van der
doi: 10.1016/j.it.2011.06.006.
Zee, S. C., Wouters, I., et al. (2000) (1-->3)-beta-
3. Post, S., Nawij n, M. C., Hackett, T. L.,
D-glucan and endotoxin in house dust and peak
Baranowska, M., Gras, R., et al.
(2012) The
flow variability in children, Am. J. Respir. Crit.
composition of house dust mite is critical
Care Med., 162 (4 Pt 1), 1348-1354, doi: 10.1164/
for mucosal barrier dysfunction and allergic
ajrccm.162.4.9909118.
БИОХИМИЯ том 87 вып. 6 2022
ОТВЕТ PBMC НА ЛПС И rDer p 2 ПРИ ИНГИБИРОВАНИИ КИНАЗ
813
6.
Jacquet, A. (2013) Innate immune responses in
kinase signaling, Oncotarget,
14,
11316-11328,
house dust mite allergy, ISRN Allergy, 735031,
doi: 10.18632/oncotarget.14514.
doi: 10.1155/2013/735031.
18.
Wang, W. C., Tsai, J. J., Kuo, C. Y., Chen, H. M.,
7.
Keber, M. M., Gradisar, H., and Jerala, R.
and Kao, S. H. (2011) Non-proteolytic house dust
(2005) MD2 and Der p 2 - a tale of two cousins or
mite allergen, Der p 2, upregulated expression of
distant relatives? J. Endotoxin Res., 11, 186-192,
tight junction molecule claudin-2 associated with
doi: 10.1179/096805105X35206.
Akt/GSK-3β/β-catenin signaling pathway, J. Cell
8.
Cohn, L., Elias, J. A., and Chupp, G. L. (2004)
Biochem., 112, 1544-1551, doi: 10.1002/jcb.23067.
Asthma: Mechanisms of disease persistence and
19.
Lee, N. R., Baek, S. Y., Gu, A., Kim, D. H., Kim,
progression, Annu. Rev. Immunol., 22, 789-815,
S. Y., et al. (2016) House dust mite allergen suppresses
doi: 10.1146/annurev.immunol.22.012703.104716.
neutrophil apoptosis by cytokine release via PAR2 in
9.
Liu, C. F., Drocourt, D., Puzo, G., Wang, J. Y.,
normal and allergic lymphocytes, Immunol. Res., 64,
and Riviere, M. (2013) Innate immune response of
123-132, doi: 10.1007/s12026-015-8730-5.
alveolar macrophage to house dust mite allergen is
20.
Zhou, B., Weng, G., Huang, Z., Liu, T., and Dai, F.
mediated through TLR2/-4 co-activation, PLoS
(2018) Arctiin prevents LPS-induced acute lung
One, 8, e75983, doi: 10.1371/journal.pone.0075983.
injury via inhibition of PI3K/AKT signaling pathway
10.
Stremnitzer, C., Manzano-Szalai, K., Starkl,
in mice, Inflammation, 41, 2129-2135, doi: 10.1007/
P., Willensdorfer, A., Schrom, S., et al.
(2014)
s10753-018-0856-x.
Epicutaneously applied Der p 2 induces a strong
21.
Scherle, P. A., Jones, E. A., Favata, M. F., Daulerio,
TH 2-biased antibody response in C57BL/6 mice,
A. J., Covington, M. B., et al. (1998) Inhibition
independent of functional TLR4, Allergy, 69, 741-
of MAP kinase kinase prevents cytokine and
51, doi: 10.1111/all.12399.
prostaglandin E2 production in lipopolysaccharide-
11.
Chiou, Y. L., and Lin, C. Y. (2009) Der p 2 activates
stimulated monocytes, J. Immunol., 161, 5681-5686.
airway smooth muscle cells in a TLR2/MyD88-
22.
Earl, C. S., An, S. Q., and Ryan, R. P. (2015)
dependent manner to induce an inflammatory
The changing face of asthma and its relation with
response, J. Cell. Physiol., 220, 311-318.
microbes, Trends Microbiol., 23, 408-418.
12.
Yin, S. C., Liao, E. C., Chiu, C. L., Chang, C. Y.,
23.
Radzyukevich, Y. V., Kosyakova, N. I., and
and Tsai, J. J.
(2015) Der p 2 Internalization
Prokhorenko, I. R. (2018) Synergistic effect of
by epithelium synergistically augments toll-like
Dermatophagoides pteronyssinus allergen and
receptor-mediated proinflammatory signaling,
Escherichia coli lipopolysaccharide on human blood
Allergy Asthma Immunol. Res., 7, 393-403.
cells, PLoS One, 13, e0207311, doi: 10.1371/journal.
13.
Liao, E. C., Hsieh, C. W., Chang, C. Y., Yu,
pone.0207311.
S. J., Sheu, M. L., et al. (2015) Enhanced allergic
24.
Koch, L., Frommhold, D., Buschmann, K., Kuss, N.,
inflammation of Der p 2 affected by polymorphisms
Poeschl, J., et al. (2014) LPS- and LTA-induced
of MD2 promoter, Allergy Asthma Immunol. Res., 7,
expression of IL-6 and TNF-α in neonatal and
497-506, doi: 10.4168/aair.2015.7.5.497.
adult blood: role of MAPKs and NF-κB, Mediators
14.
Tsai, J. J., Liu, S. H., Yin, S. C., Yang, C. N.,
Inflamm., 283126, doi: 10.1155/2014/283126.
Hsu, H. S., et al. (2011) Mite allergen Der-p2
25.
Haslett, C., Guthrie, L. A., Kopaniak, M. M.,
triggers human B lymphocyte activation and Toll-
Johnston, R. B., and Henson, P. M.
(1985)
like receptor-4 induction, PLoS One, 6, e23249,
Modulation of multiple neutrophil functions by
doi: 10.1371/journal.pone.0023249.
preparative methods or trace concentrations of
15.
Trompette, A., Divanovic, S., Visintin, A.,
bacterial lipopolysaccharide, Am. J. Pathol., 119,
Blanchard, C., Hegde, R. S., et al.
(2009)
101-110.
Allergenicity resulting from functional mimicry of
26.
Wibowo, H., Harbuwono, D. S., Tahapary, D. L.,
a Toll-like receptor complex protein, Nature, 457,
Kartika, R., Pradipta, S., et al. (2021) Impact of
585-588.
sodium butyrate treatment in LPS-stimulated
16.
Kim, D. H., Choi, E., Lee, J. S., Lee, N. R., Baek,
peripheral blood mononuclear cells of poorly
S. Y., et al. (2015) House dust mite allergen regulates
controlled type 2 DM, Front. Endocrinol. (Lausanne),
constitutive apoptosis of normal and asthmatic
12, 652942, doi: 10.3389/fendo.2021.652942.
neutrophils via toll-like receptor 4, PLoS One, 10,
27.
Jansky, L., Reymanova, P., and Kopecky, J. (2003)
e0125983, doi: 10.1371/journal.pone.0125983
Dynamics of cytokine production in human
17.
Lin, C. H., Lin, H. H., Kuo, C. Y., and Kao, S. H.
peripheral blood mononuclear cells stimulated by
(2017) Aeroallergen Der p 2 promotes motility of
LPS or infected by Borrelia, Physiol. Res., 52, 593-
human non-small cell lung cancer cells via toll-like
598.
receptor-mediated up-regulation of urokinase-type
28.
Schildberger, A., Rossmanith, E., Eichhorn, T.,
plasminogen activator and integrin/focal adhesion
Strassl, K., and Weber, V.
(2013) Monocytes,
БИОХИМИЯ том 87 вып. 6 2022
814
МОРОЗОВА и др.
peripheral blood mononuclear cells, and THP-1
38.
Tong, W., Chen, X., Song, X., Chen, Y., Jia, R.,
cells exhibit different cytokine expression patterns
et al.
(2020) Resveratrol inhibits LPS-induced
following stimulation with lipopolysaccharide,
inflammation through suppressing the signaling
Mediators Inflamm., 2013, 697972, doi: 10.1155/
cascades of TLR4NF-κB/MAPKs/IRF3, Exp. Ther.
2013/697972.
Med., 19, 1824-1834, doi: 10.3892/etm.2019.8396.
29.
Park, B. S., Lee, N. R., Kim, M. J., Kim, S. Y., and
39.
Fukao, T., and Koyasu, S. (2003) PI3K and negative
Kim, I. S. (2015) Interaction of Der p 2 with Toll-
regulation of TLR signaling, Trends Immunol., 24,
like receptor 4 and its effect on cytokine secretion,
358-363.
Biomed. Sci. Lett., 21, 152-159.
40.
Косякова Н. И., Радзюкевич Я. В., Морозова
30.
Matera, G., Quirino, A., Giancotti, A., Pulicari,
А. А., Прохоренко И. Р. (2019) Активация клеток
M. C., Rametti, L., et al. (2012) Procalcitonin
крови ЛПС и DpE: роль sMD-2 и p38 MAPK в
neutralizes bacterial LPS and reduces LPS-
развитии аллергического воспаления, Росс.
induced cytokine release in human peripheral
Аллергол. Журн., 16, 81-84.
blood mononuclear cells, BMC Microbiol., 12, 68,
41.
Guha, M., and Mackman, N. (2001) LPS induction
doi: 10.1186/1471-2180-12-68.
of gene expression in human monocytes. Cell Signal.,
31.
Pei, Z., and Wang, J. (2014) Propofol attenuates
13(2), 85-94, doi: 10.1016/s0898-6568(00)00149-2.
LPS-induced tumor necrosis factor-α, interleukin-6
42.
Yin, S. C., Liao, E. C., Ye, C. X., Chang, C. Y.,
and nitric oxide expression in canine peripheral blood
and Tsai, J. J. (2018) Effect of mite allergenic
mononuclear cells possibly through down-regulation
components on innate immune response: Synergy of
of nuclear factor (NF)-κB activation, J. Vet. Med.
protease (Group 1 & 3) and non-protease (Group 2
Sci., 77, 139-145, doi: 10.1292/jvms.14-0212
& 7) allergens, Immunobiology,
223,
443-448,
32.
Kim, I. S., Lee, N. R., and Lee, J. S.
(2016)
doi: 10.1016/j.imbio.2017.10.032.
Suppressive effect of Der p 2 on constitutive
43.
Kramer, P. R., Winger, V., and Reuben, J. (2009)
neutrophil apoptosis by cytokine secretion of normal
PI3K limits TNF-alpha production in CD16-
and allergic lymphocytes, Kor. J. Clin. Lab. Sci., 48,
activated monocytes, Eur. J. Immunol., 39, 561-570,
102-108.
doi: 10.1002/eji.200838801.
33.
Kumar, S., Boehm, J., and Lee, J. C. (2003) p38
44.
Luyendyk, J. P., Schabbauer, G. A., Tencati, M.,
MAP kinases: key signalling molecules as therapeutic
Holscher, T., Pawlinski, R., et al. (2008) Genetic
targets for inflammatory diseases, Nat. Rev. Drug
analysis of the role of the PI3K-Akt pathway in
Discov., 2, 717.
lipopolysaccharide-induced cytokine and tissue
34.
Simon, C., Hicks, M. J., Nemechek, A. J., Mehta,
factor gene expression in monocytes/macrophages,
R., O’Malley, B. W. Jr., Goepfert, H., et al. (1999)
J. Immunol.,
180,
4218-4226, doi:
10.4049/
PD 098059, an inhibitor of ERK1 activation,
jimmunol.180.6.4218.
attenuates the in vivo invasiveness of head and neck
45.
Reginald, K., and Chew, F. T. (2019) The major
squamous cell carcinoma, Br. J. Cancer, 80, 1412-
allergen Der p 2 is a cholesterol binding protein, Sci.
1419, doi: 10.1038/sj.bjc.6690537.
Rep., 9, 1556, doi: 10.1038/s41598-018-38313-9.
35.
Brunn, G. J., Williams, J., Sabers, C., Wiederrecht,
46.
Marichal, T., Bedoret, D., Mesnil, C., Pichavant, M.,
G., Lawrence, J. C. Jr., et al. (1996) Direct inhibition
Goriely, S., et al. (2010) Interferon response factor
of the signaling functions of the mammalian target
3 is essential for house dust mite-induced airway
of rapamycin by the phosphoinositide 3-kinase
allergy, J. Allergy Clin. Immunol., 126, 836-844.e13,
inhibitors, wortmannin and LY294002, EMBO J.,
doi: 10.1016/j.jaci.2010.06.009.
15, 5256-5267.
47.
Ryu, J. H., Yoo, J. Y., Kim, M. J., Hwang, S. G.,
36.
Newton, R., Cambridge, L., Hart, L. A., Stevens,
Ahn, K. C., et al. (2013) Distinct TLR-mediated
D. A., Lindsay, M. A., et al. (2000) The MAP kinase
pathways regulate house dust mite-induced allergic
inhibitors, PD098059, UO126 and SB203580,
disease in the upper and lower airways, J. Allergy
inhibit IL-1beta-dependent PGE(2) release via
Clin. Immunol.,
131,
549-561, doi:
10.1016/
mechanistically distinct processes, Br. J. Pharmacol.,
j.jaci.2012.07.050.
130, 1353-1361, doi: 10.1038/sj.bjp.0703431.
48.
Tanyaratsrisakul, S., Jirapongsananuruk, O.,
37.
Fehr, S., Unger, A., Schaeffeler, E., Herrmann, S.,
Thomas, W. R., Piboonpocanun, S., Voelke, D. R.
Laufer, S., et al. (2015) Impact of p38 MAP kinase
(2012) Der p 2 stimulate inflammatory responses
inhibitors on LPS-induced release of TNF-α in
from lung epithelial cells and macrophages
whole blood and primary Cells from different
through the TLR2 and MAPK pathway, J. Allergy
species, Cell Physiol. Biochem.,
36,
2237-2249,
Clin. Immunol.,
129, AB140, doi:
10.1016/
doi: 10.1159/000430188.
j.jaci.2011.12.469.
БИОХИМИЯ том 87 вып. 6 2022
ОТВЕТ PBMC НА ЛПС И rDer p 2 ПРИ ИНГИБИРОВАНИИ КИНАЗ
815
PARTICIPATION OF MAPK AND PI3K
IN THE REGULATION OF CYTOKINE SECRETION
BY PERIPHERAL BLOOD MONONUCLEAR CELLS
IN RESPONSE TO Escherichia coli LPS AND rDer p 2 COMBINATION
A. A. Morozova1,2*, N. I. Kosyakova1, and I. R. Prokhorenko2
1 Hospital of Pushchino Scientific Center, Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia; e-mail: honorikvudi@mail.ru
2 Institute of Basic Biological Problems, Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia
Search for the effective approaches to treat acute inflammation caused by combination of allergens and
infectious agents is an important task for public health worldwide. House dust mites Dermatophagoides
pteronyssinus are the source of allergens of the Der p groups and of microbial compounds, in particular,
lipopolysaccharides (LPS). LPS and Der p 2 induce secretion of pro-inflammatory cytokines via activation
of kinases p38 MAPK, MEK 1/2, and PI3K. Participation of these kinases in the regulation of cells response
to combined exposure to LPS and Der p 2 has not been sufficiently studied. We studied the effects of kinases
(p38 MAPK, MEK 1/2, and PI3K) inhibition on secretion of cytokines (TNF, IL-8, and IL-6) by peripheral
blood mononuclear cells (PBMC) of healthy volunteers in response to E. coli LPS and rDer p 2. Contribution
of kinases to the regulation of cell response to different agents (rDer p 2 and/or LPS) was revealed. It was found
that p38 MAPK plays a key role in the regulation of secretion TNF by PBMC in response to the combination
of LPS and rDer p 2. MEK 1/2-dependent signaling is the main pathway for the synthesis of TNF and IL-8
in response to LPS and rDer p 2. PI3K-dependent signaling negatively regulates TNF production during
rDer p 2-induced cell activation, but is not involved in the response to the combination of LPS and rDer p 2.
PI3K-dependent signaling in the regulation of PBMC cytokine synthesis is most pronounced in response to
their activation by rDer p 2. Understanding the mechanisms of immune cell responses to combinations of
inflammatory agents could facilitate the search for new intracellular targets for anti-inflammatory therapy.
Keywords: PBMC, p38 MAPK, MEK 1/2, PI3K, Der p 2, lipopolysaccharides, cytokines
БИОХИМИЯ том 87 вып. 6 2022