БИОХИМИЯ, 2022, том 87, вып. 7, с. 975 - 998
УДК 612.82
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
Обзор
© 2022 Я.В. Горина1,2*, А.Б. Салмина1,2,3, А.И. Ерофеев1, Е.И. Герасимов1,
А.В. Большакова1, П.М. Балабан1,4, И.Б. Безпрозванный1,5, О.Л. Власова1
1 Санкт-Петербургский политехнический университет Петра Великого,
лаборатория молекулярной нейродегенерации, 194021 Санкт-Петербург, Россия
2 Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого,
НИИ молекулярной медицины и патобиохимии,
660022 Красноярск, Россия; электронная почта: yana_20@bk.ru
3 Научный центр неврологии, Институт мозга, лаборатория нейробиологии и тканевой инженерии,
105064 Москва, Россия
4 Институт высшей нервной деятельности, лаборатория клеточной нейробиологии обучения,
117485 Москва, Россия
5 Юго-Западный медицинский центр Техасского университета, отделение физиологии,
75390 Даллас, США
Поступила в редакцию 18.05.2022
После доработки 27.06.2022
Принята к публикации 28.06.2022
Астроциты являются наиболее распространенным типом глиальных клеток, которые обеспечивают
гомеостаз и защиту центральной нервной системы. Важной специфической характеристикой астро-
цитов является проявление морфологической неоднородности, находящейся в прямой зависимости
от локализации в той или иной области мозга. Астроциты могут интегрироваться в нейронные сети
и поддерживать активность нейронов в различных областях мозга. Более того, астроциты экспресси-
руют множество рецепторов, каналов и мембранных переносчиков, что лежит в основе их своеобраз-
ной метаболической активности, которая определяет пластичность центральной нервной системы
в процессе развития и старения. Столь сложная структурно-функциональная организация астроци-
тов обусловливает использование современных методов их идентификации и анализа. Учитывая то
важное обстоятельство, что определение наиболее подходящего маркера для полиморфных и множе-
ственных подгрупп астроцитов имеет решающее значение для исследования их многофункциональ-
ности, в этом обзоре представлены маркеры, современные методы визуализации и идентификации
астроцитов, которые представляют собой ценный ресурс для изучения структурных и функциональ-
ных свойств астроцитов, а также лучшего понимания степени вклада астроцитов в нейрональную
активность.
КЛЮЧЕВЫЕ СЛОВА: астроциты, маркеры, методы визуализации, микроРНК, оптогенетика.
DOI: 10.31857/S0320972522070119, EDN: AWCKOQ
ВВЕДЕНИЕ
вают только трофическую, метаболическую
и структурную поддержку нейронов [1]. Од-
Астроциты долгое время считались вспо-
нако за последние три десятилетия обшир-
могательными клетками, которые обеспечи- ные исследования показали, что они играют
Принятые сокращения: AQP4 - аквапорин 4; CaM - кальмодулин; CB1 - каннабиноидные рецепторы типа 1;
ChR2 - канальный родопсин 2; Сх - коннексин; EGFP - усиленный зеленый флуоресцентный белок; FACS - флуорес-
центно-активированная сортировка клеток; GFP - зеленый флуоресцентный белок; GFAP - глиальный фибриллярный
кислый белок; GPCR - рецепторы, связанные с G-белком; GPR56 - рецептор 56, связанный с G-белком; GS - глу-
таминсинтетаза; LCN2 - липокалин-2; Mfge8 - фактор роста эпидермальных клеток-8 из жировых глобул молока;
NDRG2 - ген 2, регулируемый нижестоящим N-myc; NMDAR - рецептор N-метил-D-аспартата; TRP - канал потенци-
альных переходных рецепторов.
* Адресат для корреспонденции.
975
976
ГОРИНА и др.
решающую роль в физиологических и пато-
что астроглиальные рецепторы CB1 являют-
логических функциях мозга. Так, астроциты
ся ключевыми детерминантами физиологи-
регулируют ионный гомеостаз, контролиру-
ческой консолидации памяти распознавания
ют церебральный кровоток, способствуют
новых объектов в гиппокампе. Так, делеция
образованию новых кровеносных сосудов,
гена CB1 приводит к нарушению связывания
защищают нейроны от эксайтотоксического
D-серина с синаптическими NMDAR в гиппо-
повреждения и гибели, способствуют образо-
кампе GFAP-CB1-нокаутных мышей, что со-
ванию синапсов, участвуют в энергетическом
пряжено с нарушением памяти распознавания
метаболизме головного мозга и формировании
объектов, а также снижением долговремен-
гематоэнцефалического барьера (ГЭБ) [2].
ной потенциации в синапсах гиппокампа. Это
Более этого, вместе с пре- и постсинапти-
подразумевает существование нового меха-
ческой мембранами астроциты образуют так
низма астроглиальной регуляции синаптиче-
называемый трехчастный синапс, тем самым
ской пластичности посредством D-серин-за-
обеспечивая эффективную синаптическую пе-
висимой регуляции NMDAR [10].
редачу [3]. При этом астроциты секретируют
Необходимо также отметить, что особен-
глиотрансмиттеры, цитокины, метаболиты,
ностью астроцитов является их неоднород-
которые участвуют в нейрон-астроглиальном
ность с точки зрения экспрессии генов, мор-
сопряжении и глиоваскулярном контроле [4].
фологии и функционального взаимодействия с
Интересно и то, что астроциты облада-
локальными нейронными сетями [11]. Взаимо-
ют способностью модулировать фенотип ми-
действие астроцитов с нейронами необходимо
кроглии и фагоцитоз за счет перекрестного
для реализации таких процессов, как фор-
взаимодействия астроцитов и микроглии. Это
мирование и функционирование синапсов,
подразумевает высвобождение различных
высвобождение и повторный захват нейроме-
сигнальных молекул как микроглией, так и
диаторов, синтез нейротрофических факторов
астроцитами, что позволяет устанавливать ау-
и контроль выживания нейронов. При этом
токринную обратную связь для направленной
важно отметить, что функциональная связь,
реципрокной модуляции при повреждении
существующая между астроцитами и нейро-
центральной нервной системы (ЦНС) [5].
нами, в значительной степени сохраняется как
В целом, астроциты являются крити-
во взрослом, так и стареющем головном моз-
чески важными участниками в развитии и
ге здоровых животных, но подвергается суще-
функционировании головного мозга [6]. Ак-
ственным изменениям при развитии нейроде-
тивность астроцитов кодируется динамиче-
генеративных заболеваний [12].
скими внутри- и межклеточными сигналами,
Визуализация и идентификация астроци-
которые регулируют синаптическую пластич-
тов, особенно в препаратах in situ и в головном
ность, взаимодействие в нейронных цепях,
мозге in vivo, является, безусловно, нетриви-
а также способствуют консолидации памя-
альной задачей. Трудности заключаются в зна-
ти [7]. Внутриклеточные колебания уровня
чительной морфологической гетерогенности
свободного Ca2+, представляющие собой
и в отсутствии универсального маркера, ко-
важный аспект активности астроцитов, мо-
торый может маркировать все клетки астро-
гут происходить спонтанно или в результате
глиальной природы. Существующие методы
активации нейротрансмиттерами NMDAR
включают классическое гистологическое окра-
(рецептор N-метил-D-аспартата, N-methyl-
шивание и иммуноцитохимию (выполняемую
D-aspartate receptors) и TRP (канал потен-
на фиксированных тканях), генетически кон-
циальных переходных рецепторов, Transient
тролируемую экспрессию специфичных для
receptor potential), а также рецепторов, свя-
астроцитов флуоресцентных маркеров, инку-
занных с G-белком (GPCR, G-protein-coupled
бацию с флуоресцентными зондами, а также
receptors) [8]. Такая передача сигналов астро-
внутриглиальную инъекцию флуоресцентных
цитами посредством повышения цитозоль-
красителей.
ного Ca2+ обеспечивает высвобождение
В этой статье мы рассматриваем маркеры
глиотрансмиттеров, нейроваскулярное взаи-
и современные методы визуализации и иден-
модействие и пресинаптическое структурное
тификации астроцитов, характеризующихся
ремоделирование
[9]. Недавно полученные
полиморфизмом и многофункциональностью,
данные [10] демонстрируют, что астроглиаль-
что даст возможность расширить понимание
ные каннабиноидные рецепторы типа 1 (CB1,
степени вклада астроцитов в нейрональную ак-
type-1-cannabinoid) определяют доступность
тивность, модуляцию синаптической передачи
D-серина (агонист синаптических NMDAR)
и пластичности, а также двунаправленную ком-
в синапсах гиппокампа. Это демонстрирует,
муникацию между астроцитами и нейронами.
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
977
РАЗНООБРАЗИЕ МАРКЕРОВ АСТРОЦИТОВ
астроцитах, а также важный компонент ци-
тоскелета астроцитов в период развития [14].
До настоящего времени не существу-
Важно подчеркнуть, что GFAP, как особенно
ет универсального маркера, который может
широко используемый астроцитарный маркер,
окрашивать и идентифицировать все астро-
преимущественно экспрессируется в астроци-
циты в ЦНС, что обусловлено специфической
тах белого, а не серого вещества [44]. Более
морфологической гетерогенностью астроци-
того, GFAP не может маркировать все отрост-
тов, которая, в свою очередь, сопряжена со
ки астроцитов, поскольку до 85% астроцитар-
значительным разнообразием экспрессии раз-
ных отростков его не содержат [45].
личных молекул [13] (таблица).
Примечательно, что в патофизиологиче-
Глиальный фибриллярный кислый белок
ских условиях повышенная экспрессия GFAP
(GFAP). Одним из наиболее популярных мар-
является чувствительным и надежным марке-
керов астроцитов является глиальный фибрил-
ром реактивных астроцитов, тогда как в здо-
лярный кислый белок (GFAP) - основной
ровой ткани многие астроциты не экспресси-
белок промежуточных филаментов в зрелых
руют GFAP в количествах, обнаруживаемых
Маркеры астроцитов
Экспрессия
Функциональная
Экспрессия
Изменения
Изменения
Маркер
в регионе
Ссылки
роль белка
в клетке
в онтогенезе
при патологии
мозга
высокий
кора, гип-
уровень
белок промежуточных
покамп,
экспрес-
филаментов; обеспе-
высокий
Глиальный
зрелые астроциты,
миндале-
сии после
чивает структурную
уровень
фибрилляр-
радиальная глия,
видное тело,
рождения,
стабильность клеток;
экспрессии в
[14-16]
ный кислый
нейральные стволо-
гипоталамус,
который
регулирует морфо-
реактивных
белок (GFAP)
вые клетки
обонятель-
снижается
логию и функции
астроцитах
ная лукови-
по мере
астроцитов
ца, мозжечок
старения
организма
поддержание гомеос-
астроциты, глия
таза Ca2+; регулирует
Бергмана, олигоден-
кора, гип-
уровень
пролиферацию и
дроциты, эпенди-
высокий
покамп,
экспрессии
дифференцировку
моциты, эпителий
уровень
гипоталамус,
увеличи-
S100β
клеток; участвует в
сосудистого сплете-
экспрессии в
[17-19]
миндале-
вается в
ремоделировании
ния, эндотелиаль-
реактивных
видное тело,
процессе
промежуточных фи-
ные клетки сосу-
астроцитах
мозжечок
онтогенеза
ламентов астроцитов;
дов, лимфоциты,
биомаркер апоптоза
нейроны
EAAT-1 - радиаль-
ная глия, фиброз-
ные и протоплазма-
EAAT-
тические астроциты,
1 - мозже-
глия Бергмана, глия
Транспор-
чок; EAAT-
Мюллера сетчатки;
уровень
теры
астроглиальные
2 - гип-
EAAT-2 - нейроны,
экспрессии
глутамата:
специфические пере-
покамп,
низкий уро-
глиальные клетки
увеличи-
EAAT-1
носчики глутамата;
боковая
вень экспрес-
[20, 21]
(олигодендроциты,
вается в
(GLAST),
участвуют в клиренсе
перегородка,
сии
эпендимные клетки,
процессе
EAAT-2
глутамата
кора голов-
эпителиальные
онтогенеза
(GLT-1)
ного мозга,
клетки хориоид-
полосатое
ного сплетения,
тело
сателлитные клетки
и шванновские
клетки)
радиальная глия,
высокая
глия Бергмана, глия
активность,
участвует в реакции
повсеместно
Глутамин-
Мюллера сетчатки,
которая
образования глута-
присутствует
активность
синтетаза
астроциты, эпен-
снижается
[22, 23]
мина из аммиака и
в головном
снижается
(GS)
димные клетки,
по мере
глутамата
мозге
олигоденроциты,
старения
нейроны
организма
БИОХИМИЯ том 87 вып. 7 2022
978
ГОРИНА и др.
Таблица (продолжение)
Экспрессия
Функциональная
Экспрессия
Изменения
Изменения
Маркер
в регионе
Ссылки
роль белка
в клетке
в онтогенезе
при патологии
мозга
промежуточный про-
высокий
теин филаментов, уча-
уровень
ствующий в регуляции
уровень
экспрессии
клеточной диффе-
астроциты, глия
кора голов-
экспрессии
в гипертро-
ренцировки, адгезии,
Бергмана, взрослые
ного мозга,
Виментин
снижается
фированных
[24-26]
миграции, передаче
нервные стволовые
мозжечок,
в процессе
астроцитах,
клеточных сигналов, в
клетки
гиппокамп
онтогенеза
реактивной
клеточном стрессовом
микроглии,
ответе в дифференци-
макрофагах
рующихся клетках
гетерогенно
экспресси-
белок, представитель
руется по
семейства аквапо-
всей ЦНС; в
ринов, образующих
наибольшей
уровень
водопроводящие
степени - в
экспрессии
каналы в клеточных
низкий уро-
Аквапорин 4
астроциты, эпенди-
мозжечке;
увеличи-
мембранах; контроли-
вень экспрес-
[27, 28]
(AQP4)
моциты
наименее
вается в
рует гомеостаз воды
сии
выраже-
процессе
и ионов; участвует в
но - в
онтогенеза
миграции астроцитов,
гиппокам-
проведении нервных
пе и коре
сигналов
головного
мозга
высокая
актив-
ность Cx43
как после
организуют астроци-
рожде-
тарные сети, которые
ния, так
координируют дея-
Cx30 избирательно
и по мере
тельность локальных
экспрессируется в
старения
высокий
нейронных сетей,
астроцитах серого
кора, ги-
организма;
уровень
Коннексины:
транспортируя глу-
вещества, Cx43 и
поталамус,
активность
[7, 29,
экспрессии в
Сх43, Сх30
тамат или глутамин;
Cx30 совместно
таламус и
Cx30 уве-
30]
реактивных
осуществляют трофи-
экспрессируются в
гиппокамп
личивается
астроцитах
ческую функцию для
щелевых контактах
в течение
нейронов, опосредуя
астроцитов
первых 3 не-
доставку глюкозы и
дель после
молочной кислоты
рождения
и достигает
максимума
через 4 не-
дели
широко экс-
уровень
высокий
прессируется
экспрессии
уровень
участвует в метаболиз-
астроциты, олиго-
ALDH1L1
по всему
снижается
экспрессии в
[31-33]
ме фолиевой кислоты
дендроциты
головному
в процессе
реактивных
мозгу
онтогенеза
астроцитах
высокий
фермент, участвую-
уровень
щий в гликолизе в
экспрес-
высокий уро-
астроцитах с обра-
астроциты, нейроны
сии после
мозжечок,
вень экспре-
Альдолаза C
зованием лактата,
мозжечка (клетки
рождения,
[34-36]
кора
сии в клетках
который является
Пуркинье)
который
Пуркинье
источником энергии
сохраняется
для нейронов
в процессе
онтогенеза
уровень
фактор транскрипции,
высокий
астроциты, нейро-
гиппокамп,
экспрессии
играющий важную
уровень
нальные клетки-
обонятель-
не снижает-
SOX9
роль в транскрипции
экспрессии в
[37, 38]
предшественники,
ная лукови-
ся по мере
зрелых астроцитов и
реактивных
эпендимные клетки
ца, мозжечок
старения
регуляции их функций
астроцитах
организма
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
979
Таблица (окончание)
Экспрессия
Функциональная
Экспрессия
Изменения
Изменения
Маркер
в регионе
Ссылки
роль белка
в клетке
в онтогенезе
при патологии
мозга
трансмембранный
астроциты, оли-
гликопротеин, уча-
уровень
высокий
годентроциты,
ствующий в адгезии
гиппокамп,
экспрессии
уровень
нервные стволо-
CD44
между клетками и
кора, мозже-
снижается
экспрессии в
[39-41]
вые клетки, глия
матриксом и в опосре-
чок
в процессе
реактивных
Бергмана, нейроны
дованной матриксом
онтогенеза
астроцитах
Пуркинье
передаче сигналов
опухолевый супрессор
кора, обо-
уровень
высокий
и ген, связанный с
нятельная
экспрессии
уровень
клеточным стрессом,
луковица,
NDRG2
зрелые астроциты
повышается
экспрессии в
[42, 43]
пролиферацией и
гиппокамп,
в процессе
реактивных
дифференцировкой
средний мозг
онтогенеза
астроцитах
клеток
и таламус
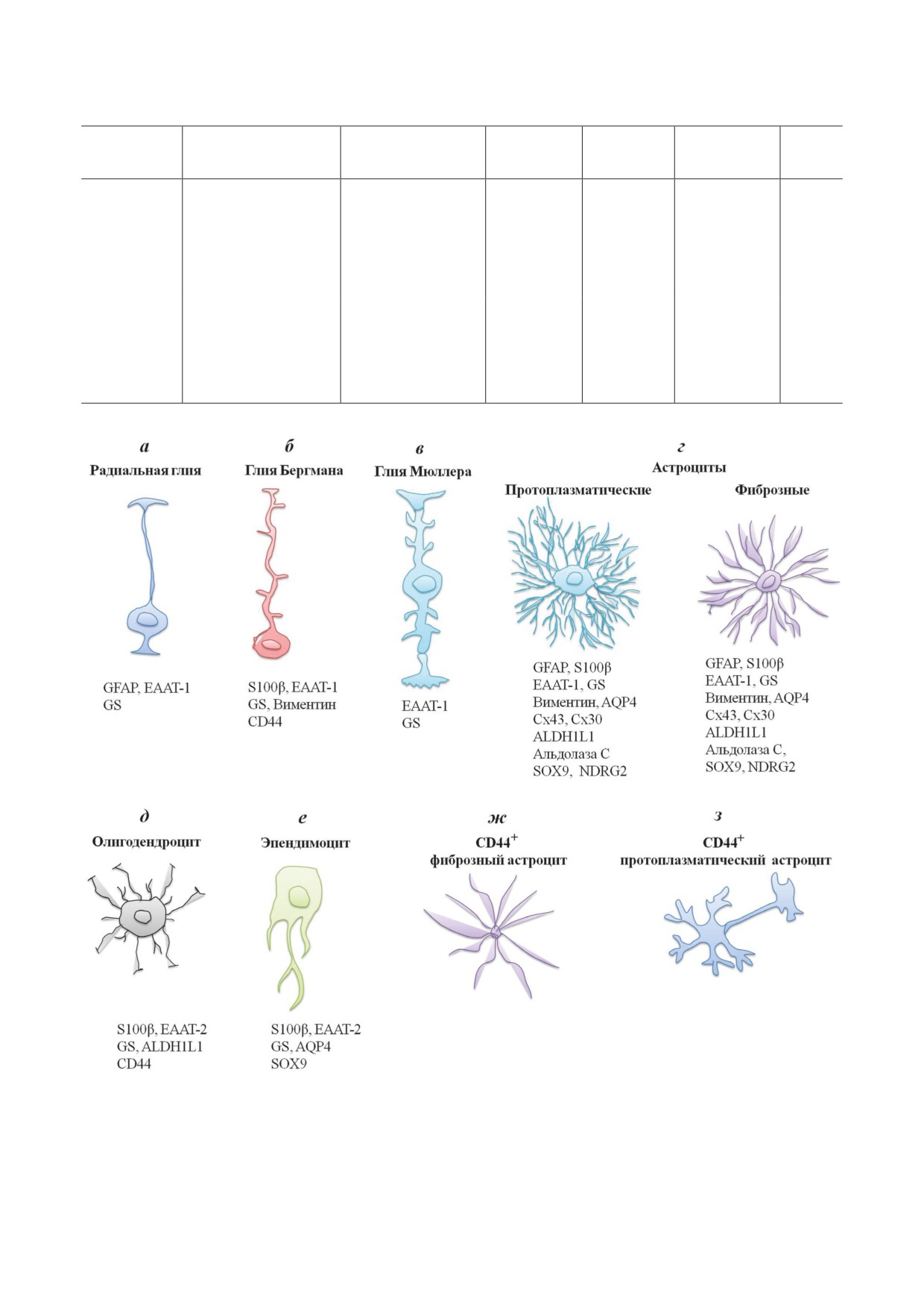
Типы глиальных клеток и маркеры для их визуализации. а - Радиальная глия - экспрессия GFAP [77], EAAT-1 [78],
GS [77]; б - Глия Бергмана - экспрессия S100β [79], EAAT-1 [80], GS [81], Виментин [82], CD44 [41]; в - глия Мюллера -
экспрессия EAAT-1 [83], GS [84]; г - Астроциты - экспрессия GFAP, S100β, EAAT-1, виментин, AQP4, ALDH1L1 [85],
GS [86], Cx43 [87], Cx30 [88], Альдолаза С [89], SOX9 [37], NDRG2 [90]; д - Олигодендроциты - экспрессия S100β [56],
EAAT-2 [91], GS [92], ALDH1L1 [93], CD44 [94]; е - Эпендимоцит - экспрессия S100β [95], EAAT-2 [96], GS [77],
AQP4 [97], SOX9 [98]; ж - СD44+ фиброзный астроцит [75]; з - СD44+ протоплазматический астроцит [75]
БИОХИМИЯ том 87 вып. 7 2022
980
ГОРИНА и др.
иммуногистохимическим методом, что, в свою
в присутствии микромолярных уровней Ca2+,
очередь, указывает на то, что отсутствие детек-
что, в свою очередь, подтверждает идею о том,
тируемого GFAP не позволяет сделать заклю-
что промежуточные филаменты астроглиаль-
чение об отсутствии астроцитов [16].
ных клеток представляют собой динамические
Интересен и тот факт, что астроциты в
структуры цитоскелета, а также о существова-
разных областях головного мозга могут де-
нии цитоплазматических факторов, участвую-
монстрировать выраженные различия в уров-
щих в регуляции процесса их сборки [50].
не экспрессии GFAP, а именно: в гиппокампе
Известно, что астроциты синтезируют и
выявлен высокий уровень экспрессии данного
экспрессируют S100β, который в зависимости
маркера, тогда как в таламусе этого не наблю-
от уровня экспрессии оказывает нейропро-
далось [14, 15].
текторный или нейротоксический эффект,
Известно, что в здоровом мозге человека
стимулирует пролиферацию астроглии, спо-
GFAP в основном экспрессируется в зрелых
собствует ее реактивности в более высоких
астроцитах [14]. Однако, согласно экспери-
концентрациях, а также регулирует активацию
ментальным данным, экспрессия GFAP на-
микроглии в участках воспаления [51]. Более
блюдалась в радиальной глии развивающегося
того, согласно экспериментальным данным,
человеческого мозга и в нейрональных ство-
S100β является глиальным модулятором ней-
ловых клетках взрослого мозга [15, 46], тем са-
рональной синаптической пластичности и
мым указывая на то, что GFAP экспрессирует-
долговременной потенциации [52].
ся также в незрелых недифференцированных
При патологических состояниях экспрес-
клетках ЦНС (рисунок).
сия S100β существенно изменяется, поэтому,
Интересным является и то, что в ходе од-
например, повышенные уровни этого белка в
ного из исследований [47], целью которого
сыворотке и спинномозговой жидкости могут
было изучение клеток соматосенсорной коры
иметь определенное диагностическое значе-
и CA1 области гиппокампа мышей путем од-
ние в контексте повреждения клеток астрогли-
ноклеточного секвенирования РНК (scRNA-
альной природы [53].
Seq), обнаружено 47 различных подклассов,
Использование S100β в качестве маркера
включающих все известные основные типы
астроцитов обусловлено его высоким уров-
клеток коры головного мозга. При этом астро-
нем экспрессии, особенно в периваскуляр-
циты принадлежали только к 2 подклассам, в
ной астроглии. Так, двойное иммунофлуо-
один из которых входили астроциты, экспрес-
ресцентное окрашивание с использованием
сирующие GFAP, а в другой - астроциты, экс-
S100β и GFAP показало, что только около 80%
прессирующие фактор роста эпидермальных
S100β-положительных клеток также были и
клеток-8 из жировых глобул молока (Mfge8,
GFAP-положительными, в то время как все
milk fat globule-EGF-factor 8), что вновь ука-
GFAP-положительные клетки также экспрес-
зывает на ограниченное присутствие GFAP в
сировали и S100β в гиппокампе мышей. При
значительной популяции астроглиальных кле-
этом уровень экспрессии S100β у астроцитов
ток. Кроме того, важно учитывать тот факт,
был значимо больше, чем GFAP. Более того,
что GFAP экспрессируется клетками ради-
GFAP-положительные клетки, экспрессиру-
альной глии (по сути, стволовыми клетка-
ющие S100β, практически не отличались от
ми ЦНС), поэтому идентификация этого мар-
GFAP-отрицательных по размеру, форме и
кера в участках нейрогенеза не соответствует
иммунореактивности к S100β [54] (рисунок).
локализации зрелых астроцитов, что делает
Более того, в ходе сравнительного анали-
необходимым применение протоколов с ис-
за распределения и экспрессии трех марке-
пользованием альтернативных маркеров.
ров астроцитов - NDRG2, GFAP и S100β - в
S100β. Гликопротеин S100β представляет
коре, гиппокампе и таламусе установлено, что
собой Ca2+-связывающий белок, который ре-
в отличие от GFAP-иммунопозитивных астро-
гулирует пролиферацию клеток и их диффе-
цитов, NDRG2- и S100β-экспрессирующие
ренцировку [48]. В астроцитах, полученных
астроциты распределены более равномерно по
от S100β-нокаутных мышей, наблюдается вы-
всему головному мозгу. При этом высокий уро-
раженное нарушение передачи сигналов Ca2+,
вень экспрессии NDRG2 и S100 β наблюдался
что указывает на важную роль S100β в поддер-
в коре и таламусе, а GFAP - в гиппокампе [55].
жании гомеостаза Ca2+ в астроцитах [49].
В дополнение к этому S100β экспресси-
Примечателен и тот факт, что S100β может
руется в астроцитах серого и белого веще-
участвовать в ремоделировании промежуточ-
ства [56], тогда как GFAP - только в белом
ных филаментов астроцитов путем предот-
веществе головного мозга [57]. Однако клеточ-
вращения избыточной полимеризации GFAP
ная специфичность S100β существенно усту-
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
981
пает таковой у GFAP. Так, помимо экспрессии
Глутаминсинтетаза (GS). В последнее вре-
S100β в астроцитах, выявлено его присутствие
мя в качестве еще одного маркера астроцитов
в олигодендроцитах [17], эпендимоцитах [18],
рассматривают глутаминсинтетазу (GS), экс-
эндотелии кровеносных сосудов, лимфоци-
прессия которой зафиксирована во многих
тах [19], а также в нейронах [58] (рисунок).
регионах головного мозга. При этом GS мар-
S100a10 - член семейства белков S100,
кирует различные типы астроцитов, включая
который экспрессируется во многих органах
радиальную глию, глию Мюллера и глию Берг-
(сердце, почки, печень, легкие, селезенка,
мана [22] (рисунок). Примечательно, что в ре-
желудочно-кишечный тракт), в том числе и
зультате двойного иммунофлуоресцентного
головном мозге, где он играет важное значе-
окрашивания гиппокампа крыс GFAP-поло-
ние в транспортировке через мембраны, се-
жительные астроглиальные клетки экспресси-
креции везикул и эндоцитозе [59]. В отличие
ровали GS, тем самым составляя GS-положи-
от S100β, экспрессия S100a10 была выявлена
тельную субпопуляцию астроцитов, однако в
не только в нейронах, эндотелиальных клет-
последней около 40% могли нести GFAP-от-
ках стенок кровеносных сосудов, астроцитах,
рицательные клетки
[63]. В дополнение к
микроглии, олигодендроцитах, эпендимных
этому, в другом исследовании двойное имму-
клетках в различных областях головного моз-
нофлуоресцентное окрашивание энториналь-
га, но и в перицитах [60]. При этом экспрес-
ной коры мышей выявило, что 10% клеток со-
сия S100a10 в нейронах даже в пределах одной
вместно экспрессировали GS и GFAP, только
области головного мозга менее выражена,
GFAP-положительные клетки составляли 12%,
тогда как астроциты и микроглия отличают-
тогда как 78% глиальных клеток экспрессиро-
ся высоким уровнем экспрессии. Кроме того,
вали исключительно GS [64].
экспрессия S100a10 выраженно усиливается в
GS имеет цитоплазматическую локализа-
реактивных астроцитах при повреждении го-
цию в астроцитах [65]. Кроме того, в исследо-
ловного мозга у мышей с моделью инсульта и
вании in vitro показано, что GS в астроцитах мо-
нейровоспаления [61].
жет быть локализована в мембране везикул [22].
EAAT-1 и EAAT-2. Установлено, что транс-
Однако стоит отметить и то, что экспрес-
портеры глутамата EAAT-1 (GLAST)
[21] и
сия GS наблюдается как в астроцитах, так и
EAAT-2 (GLT-1) [21] экспрессируются практи-
в олигодендроцитах, эпендимных клетках и в
чески исключительно в астроцитах. При этом
некоторых нейронах головного мозга челове-
EAAT-1 является наиболее распространенным
ка [23] (рисунок).
маркером, что обусловлено его достаточно ши-
Виментин. Виментин является представи-
рокой локализацией в глии Бергмана, глии Мюл-
телем семейства промежуточных филаментов,
лера, радиальной глии [62] (рисунок). В другом
который принимает участие в регуляции диф-
исследовании установлено, что GLT-1 в высоких
ференцировки и миграции клеток, а также
концентрациях экспрессируется в гиппокампе,
передаче клеточных сигналов [25]. Вимантин
боковой перегородке, коре головного мозга и по-
экспрессируется в астроцитах (рисунок), при
лосатом теле, в то время как GLAST преимуще-
этом в процессе развития уровень его экспрес-
ственно экспрессируется в мозжечке [21].
сии постепенно снижается [66].
Необходимо отметить и тот факт, что
Установлено, что у мышей, нокаутных
EAAT-1 (GLAST) и EAAT-2 (GLT-1) не облада-
по GFAP и гену, кодирующему виментин, на-
ют высокой специфичностью. Так, в результате
блюдались нарушения в образовании глиаль-
альтернативного сплайсинга был получен син-
ных рубцов в ответ на повреждение ЦНС, а
тетический пептид GLT-1, который преиму-
также изменения реактивности церебральных
щественно экспрессировался в нейронах ЦНС
кровеносных сосудов [67]. Последнее может
и периферической нервной системе (ПНС),
быть вызвано патологическим изменением
а также обнаруживался в глиальных клетках
свойств эндотелиальных или периваскулярных
(олигодендроцитах, эпендимных клетках,
клеток (как следствие отсутствия виментина в
эпителиальных клетках хориоидного спле-
данных клетках) [68] и снижением способно-
тения, сателлитных клетках и шванновских
сти окружающей ткани выдерживать расши-
клетках) (рисунок). Более того, при иммуноо-
рение кровеносных сосудов (как следствие от-
крашивании с использованием антитела про-
сутствия GFAP и виментина в астроглиальных
тив синтетического пептида GLT-1 выявлено
клетках). В целом, это демонстрирует возмож-
преимущественно цитоплазматическое окра-
ное участие виментина в активации астроци-
шивание нейронов и глиальных клеток, что
тов в результате развития нарушений в ЦНС.
позволяет предположить присутствие GLT-1 в
Аквапорин 4 (AQP4). Интересен и другой
мембранах внутриклеточных везикул [20].
маркер астроцитов - аквапорин 4 (AQP4),
БИОХИМИЯ том 87 вып. 7 2022
982
ГОРИНА и др.
представляющий собой белок семейства ак-
Фермент альдолаза C (фруктозо-1,6-бис-
вапоринов, образующих водопроводящие ка-
фосфатальдолаза) экспрессируется в большей
налы в клеточных мембранах. Данный белок
степени в астроцитах, однако ген альдолазы С
особенно сильно экспрессируется в концевых
был выявлен и в нейронах мозжечка (клет-
ножках, которые находятся в прямом контак-
ки Пуркинье) [35].
те с микрососудами головного мозга [27]. Так-
Согласно результатам исследования по
же установлено, что AQP4 в большей степени
изучению экспрессии фактора транскрип-
сконцентрирован именно в отростках астро-
ции SOX9 как в мозге мыши, так и в мозге че-
цитов [69] (рисунок).
ловека, обнаружено, что SOX9 почти исклю-
Коннексин (Сх). Стоит отметить, что экс-
чительно экспрессируется астроцитами во
прессия коннексинов (Сх) астроцитами на-
взрослом мозге за исключением эпендимных
блюдается по всему головному мозгу с преоб-
клеток и нейрогенной ниши, где SOX9 так-
ладанием Сх43 над Сх30, причем последний,
же экспрессируется нейрональными клетка-
как правило, локализован совместно с Сх43
ми-предшественниками (рисунок). Примеча-
в щелевых контактах астроцитов [70]. Кроме
тельно, что экспрессия SOX9 не снижалась во
того, Cx30 экспрессируется исключительно в
время старения, а напротив, усиливалась ре-
астроцитах серого вещества, где его распреде-
активными астроцитами при моделировании
ление весьма неоднородно [70, 71]. Экспрес-
бокового амиотрофического склероза на мы-
сия коннексинов необходима для формирова-
шах, а также при окклюзии средней мозговой
ния астроглиальной сети, способной быстро
артерии. Необходимо отметить, что SOX9 яв-
передавать из клетки в клетку некоторые низ-
ляется ядерным маркером астроцитов, что не
комолекулярные соединения (лактат, АТФ,
позволяет в полной мере выявить морфологию
НАД+) или ионы (рисунок).
астроцитов [37].
ALDH1L1, альдолаза C и SOX9. В ходе од-
Интересными являются результаты дру-
ного из исследований [33] по изучению генов,
гого исследования
[75], согласно которому
экспрессируемых изолированными астроци-
CD44 - белок плазматической мембраны и
тами, нейронами и олигодендроцитами, был
рецептор внеклеточного матрикса - позволя-
идентифицирован ALDH1L1, как новый вы-
ет детально изучить морфологию астроцитов,
сокоспецифичный астроглиальный маркер,
что, в свою очередь, невозможно сделать при
который в отличии от традиционного маркера
использовании GFAP. Так, CD44-иммунопо-
астроцитов GFAP широко экспрессируется по
зитивные астроглиальные клетки с длинными
всему головному мозгу и позволяет выявить
отростками были выявлены в гиппокампе и
сильно разветвленную морфологию астроци-
коре, а также рядом с крупными кровеносны-
тов, включая тело астроцита и его отростки,
ми сосудами, причем фенотип данных астро-
тогда как GFAP в первую очередь маркирует
цитов имел сходство с фенотипом фиброзных
отростки астроцитов (рисунок). ALDH1L1,
астроцитов белого вещества, но значительно
также известная как 10-формилтетрагидрофо-
отличался от фенотипа протоплазматических
латдегидрогеназа (FDH) [72], представляет со-
астроцитов. В то же время были обнаружены
бой фермент метаболизма фолиевой кислоты,
и CD44-экспрессирующие астроглиальные
который превращает
10-формилтетрагидро-
клетки с короткими отростками в коре, кото-
фолат (10-формил-THF) в тетрагидрофолат,
рые имели сходный фенотип как с протоплаз-
играющий важную роль во многих реакциях,
матическими, так и с фиброзными астроцита-
таких как биосинтез нуклеотидов de novo и
ми (рисунок).
регенерация метионина, таким образом ока-
В последнее время в качестве еще одного
зывая большое влияние на деление и рост
потенциального маркера астроцитов рассмат-
клеток [31]. Кроме того, существуют данные
ривают NDRG2 (N-myc downstream-regulated
о потенциальной связи аберрантной экспрес-
gene 2) - опухолевый супрессор и ген, связан-
сии ALDH1L1 с дефектами нервной трубки во
ный с клеточным стрессом, пролиферацией и
время раннего развития ЦНС [73]. Экспрессия
дифференцировкой клеток. Установлено, что
ALDH1L1 изменяется с возрастом, при этом
NDRG2 экспрессируется в различных областях
ALDH1L1 также экспрессируется в субпопуля-
головного мозга, включая кору, обонятельную
ции олигодендроцитов [32]. Кроме того, уста-
луковицу, гиппокамп, средней мозг и таламус,
новлено, что ALDH1L1 маркирует в основном
причем в двух последних областях уровень экс-
астроциты, локализованные в коре, но при
прессии наиболее высокий [42]. Что наиболее
этом отличается довольно слабым окрашива-
важно, NDRG2 специфически экспрессируется
нием астроцитов белого вещества головного
в астроцитах головного мозга [42, 76]. Кроме
мозга [74].
того, его экспрессия увеличивалась в клет-
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
983
ках глиомы, которые дифференцировались в
выявляет клеточную структуру. Более того,
астроциты, тогда как в реактивных астроцитах
сульфородамины легко проникают через ге-
экспрессия NDRG2 значительно снижена [42].
матоэнцефалический барьер, что дает возмож-
Однако в ряде других исследований убеди-
ность проводить окрашивание астроцитов с
тельно продемонстрировано усиление экс-
помощью внутривенной инъекции сульфород-
прессии NDRG2 в реактивных астроцитах при
амина B. При этом флуоресценция астроцитов
развитии нейродегенеративных заболеваний,
наблюдается уже через 40 мин после инъекции,
в частности болезни Альцгеймера и болезни
а окрашивание сохраняется до 5 ч [103]. Такое
Паркинсона [43]. NDRG2, возможно, связан
поглощение сульфородамина 101 астроцита-
с пролиферацией и дифференцировкой гли-
ми, по-видимому, опосредуется переносчика-
альных клеток и может рассматриваться как
ми органических анионов, которые экспрес-
новый астроцитарный маркер, особенно для
сируются в астроцитах в различных областях
зрелых, нереактивных астроцитов головного
головного мозга. В результате сульфорода-
мозга (рисунок).
мин 101 легко окрашивает астроциты гиппо-
кампа, однако не накапливается в астроцитах,
локализованных в вентролатеральном преоп-
ФЛУОРЕСЦЕНТНЫЕ КРАСИТЕЛИ
тическом ядре [104]. Кроме того, установлено,
И ФЛУОРЕСЦЕНТНЫЕ ЗОНДЫ
что в гиппокампе крыс на ранних постнаталь-
ных стадиях сульфородамин 101 избирательно
Флуоресцентные красители являются важ-
маркирует субпопуляцию астроцитов, которая
ными инструментами для микроскопии, по-
демонстрирует типичные изменения в разви-
скольку позволяют изучать структуру и функ-
тии и характеристики зрелых GFAP-положи-
ции нервных клеток без предварительного
тельных астроцитов [105].
повреждения или нарушения функций голов-
Несмотря на то что сульфородамин 101
ного мозга [99].
успешно маркирует астроциты в острых срезах
В частности, астроциты можно визуализи-
гиппокампа крыс [105] и в коре головного моз-
ровать с помощью флуоресцентных красите-
га мышей in vivo [103], он также окрашивает и
лей, которые можно вводить в интересующие
олигодендроциты за счет мультиспецифиче-
клетки. Для маркировки обычно использу-
ского переносчика OATP1C1 (SLCO1C1), ко-
ют такие красители, как Lucifer yellow, Alexa
торый транспортирует сульфородамин 101 из
Fluor, биоцитин, Fura-2 и другие [45, 99]. Так,
астроцитов через щелевые контакты пангли-
флуоресцентный краситель Fura-2AM (аце-
альной сети [106].
токсиметиловый эфир Fura-2) используется
Аналогичным образом дипептид кума-
для измерения внутриклеточной концентра-
рина, маркер β-Ala-Lys-Nepsilon-Coumarin,
ции Ca2+, поскольку имеет высокую чувстви-
специфически маркирует первичные астро-
тельность и специфичность, а также облада-
циты в культуре клеток, выделенных из ткани
ет способностью проникать через клеточные
головного мозга крысы. Однако при этом дан-
мембраны [100].
ный маркер окрашивает также и клетки-пред-
В качестве альтернативного вариан-
шественники олигодендроцитов [107].
та астроциты могут быть визуализированы с
Интересными являются результаты иссле-
помощью системы Helios Gene Gun для до-
дования, согласно которому использование
ставки частиц золота и вольфрама, покрытых
таких флуорофоров, как родамины, цианины
липофильными красителями, в живые или
и BODIPYs, дает уникальную возможность из-
фиксированные перфузией срезы головного
бирательно и специфично вызывать сильную
мозга [101]. Данный метод позволяет быстро
флуоресценцию астроцитов гиппокампа в го-
и дифференцированно маркировать клетки в
ловном мозге мыши и крысы, при этом не мар-
различных нервных тканях за счет возможно-
кируя нейроны, а также клетки-предшествен-
сти использования смеси красителей, тем са-
ники микроглии или олигодендроциты [108].
мым облегчая оптическое разделение соседних
клеток [102].
Большую популярность в экспериментах
ГЕНЕТИЧЕСКИ КОДИРУЕМЫЕ МАРКЕРЫ,
по визуализации астроцитов получил глио-
СПЕЦИФИЧЕСКИ ЭКСПРЕССИРУЕМЫЕ
фильный флуоресцентный зонд - катионный
АСТРОЦИТАМИ
краситель сульфородамин 101 и его аналоги,
сульфородамин B или G [103]. Сульфород-
Известно, что астроциты можно визуа-
амин избирательно поглощается астроцитами
лизировать в срезах головного мозга с по-
и благодаря цитоплазматической локализации
мощью флуоресцентных белковых зондов,
БИОХИМИЯ том 87 вып. 7 2022
984
ГОРИНА и др.
избирательно экспрессируемых в астроглии
ко раз по сравнению с его предшественником
под контролем клеточно-специфических про-
GCaMP3 [119]. Для создания красного RCaMP
моторов. Так, были получены трансгенные
был использован красный флуоресцентный
мыши, у которых астроциты были помечены
белок (FP) mRuby вместо cpEGFP, который
зеленым флуоресцентным белком (GFP, green
встраивали в каркас GCaMP3, что позволи-
fluorescent protein) или его аналогом (EGFP,
ло повысить термодинамическую стабиль-
enhanced green fluorescent protein), экспресси-
ность [116].
руемым под контролем промотора GFAP [109]
Примечательно, что визуализировать
или промотора гена, кодирующего S100β
астроциты in vivo можно флуоресцентны-
мыши [110], таким образом становясь ценным
ми маркерами с использованием аденоас-
инструментом для подробного изучения дина-
социированных вирусных векторов (AAV) и
мических изменений морфологии астроцитов
лентивирусных векторов, введение которых
во время развития, а также в патофизиологи-
позволяет вызвать появление сигналов флуо-
ческих условиях.
ресценции, специфичных для того или иного
Стоит отметить, что количество используе-
типа клеток и локализованных в ядре, что, в
мых астроглиальных промоторов постоянно
свою очередь, дает возможность легко выяв-
увеличивается, и в настоящее время применя-
лять и различать клетки различной природы.
ют несколько флуоресцентных белковых зон-
Так, с использованием метода специфиче-
дов, имеющих различные спектральные харак-
ской флуоресцентной маркировки нейроны
теристики [111, 112]. Так, была получена серия
и астроциты были разделены спектрально за
трансгенных мышей, которые экспрессируют
счет нейрональной экспрессии красного флуо-
различные флуоресцентные белки рифовых
ресцентного белка tdTomato и астроглиальной
кораллов (RCFP, Reef coral fluorescent proteins),
экспрессии EGFP [120].
характеризующиеся яркой флуоресценцией,
охватывающие широкий спектральный диапа-
зон (от голубого до красного) и управляемые
ИССЛЕДОВАНИЕ ГЕНЕТИЧЕСКОГО
различными промоторами [111].
ПРОФИЛЯ АСТРОЦИТОВ
Астроциты также можно визуализировать
посредством экспрессии генетически коди-
Уровни экспрессии мРНК генов харак-
руемых индикаторов Ca2+, таких как желтый
теризуют состояние транскрипции клетки,
Cameleon-Nano 50 (YC-Nano50) [113] или зе-
таким образом обеспечивая понимание ее
леный GCaMP, состоящего из GFP, слитого с
функции, активности и состояния развития,
кальмодулином и пептидной последователь-
а также степень патологического ремодели-
ностью киназы легкой цепи миозина [114].
рования при развитии заболевания. Транс-
Более того, согласно результатам ряда ис-
криптомный профиль астроцитов головного
следований, несколько вариантов GCaMP
мозга человека и мыши был охарактеризован
были протестированы в астроцитах, вклю-
с помощью микроматриц и технологий секве-
чая GCaMP2, GCaMP3, GCaMP5 и красные
нирования РНК в сочетании с такими метода-
RCaMP [115, 116]. Так, введение N-концевого
ми, как флуоресцентно-активированная сор-
35-членного полиHis RSET (лидерная после-
тировка клеток (FACS, Fluorescence-Activated
довательность плазмиды), связанного с каль-
Cell Sorting) и клеточный пэннинг трансгенно
модулином и миозином, приводит к повыше-
меченных астроцитов [121, 122].
нию яркости и термостабильности GCaMP2
Так, в ходе исследования
[123] тран-
при сравнении с GCaMP1 [117]. Однако зна-
скрипции астроглиальных клеток, выделен-
чительное улучшение было реализовано соз-
ных in vivo из коры головного мозга взрос-
данием GCaMP3, состоящего из циклически
лых трансгенных мышей линии FVB/N-Tg
пермутированного зеленого флуоресцентного
(GFAPGFP) 14Mes/J, с использованием FACS
белка (cpGFP), кальмодулина (CaM) и Ca2+/
астроцитов, экспрессирующих зеленый флуо-
CaM-связывающего миозина «M13», который
ресцентный белок (GFP), обнаружено, что
имел более высокую яркость, широкий дина-
значительная доля экспрессируемых астроци-
мический диапазон и большее сродство к Ca2+,
тами генов (около 34%) участвуют в клеточ-
позволяя обнаруживать увеличение уров-
ном метаболизме. Вместе с тем в ходе после-
ня Ca2+, вызванное отдельными потенциалами
дующего ПЦР-анализа выявлено, что уровень
действия in vitro [118]. GCaMP5 был получен на
экспрессии ферментов, участвующих в мета-
основе GCaMP3 с использованием направлен-
болизме гликогена, в астроцитах выше, чем
ного мутагенеза и скрининга, что позволило
в нейронах. При сравнении относительной
увеличить динамический диапазон в несколь-
экспрессии всех гликолитических ферментов,
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
985
участвующих в цепи реакций от фосфорили-
дистальных астроглиальных отростках в пе-
рования глюкозы до синтеза пирувата, в 7 из
риваскулярной, субэпендимальной и субпи-
10 стадий гликолиза наблюдалась значительно
альной областях головного мозга и содержит
более высокая экспрессия ферментов в астро-
несколько трансмембранных доменов, что
цитах по сравнению с нейронами. Более того,
предполагает выполнение данным белком
в астроцитах наблюдался активный окисли-
транспортной функции [125]. Ген LGI1/4 пред-
тельный метаболизм, обусловленный высокой
ставляет собой богатый лейцином, инакти-
относительной плотностью митохондрий, что
вированный в глиоме ген, который экспрес-
указывает на возможность астроцитов вносить
сируется в астроцитах и играет важную роль
значительный вклад в функциональную визуа-
в синаптической передаче и миелинизации.
лизацию мозга, включая сигналы МРТ, зави-
Так, LGI4 принимает участие в регуляции про-
сящие от уровня кислорода в крови [123].
лиферации глии в ПНС, а также, связываясь
В другом исследовании [33] у трансгенных
с нейронным рецептором ADAM22, способ-
мышей линии S100β-EGFP в возрасте 1-8 и
ствует миелинизации аксонов шванновски-
17-30 дней с помощью FACS были выделены
ми клетками [131]. Ген GPR56 кодирует белки
S100β/EGFP-положительные астроциты, экс-
семейства рецепторов, связанных с G-белком
прессирующие EGFP под контролем промо-
адгезии - рецептор 56, связанный с G-бел-
тора S100β. Сравнение незрелых (1-8 дней)
ком (GPR56). Данный ген экспрессируется как
и зрелых (17-30 дней) астроцитов показало,
в микроглии, олигодендроцитах и астроцитах,
что гены, высокоэкспрессируемые в незре-
так и в нейрональных клетках-предшествен-
лых астроцитах, участвуют в пролиферации и
никах и развивающихся нейронах [132, 133],
развитии клеток (например, гены клеточного
принимает участие в миелинизации, пролифе-
цикла) и не являются астроцит-специфичны-
рации [134] и синаптогенезе [135].
ми, тогда как гены, экспрессируемые зрелыми
Это дает возможность расширить понима-
астроцитами, специфичны для астроглии. Так,
ние о степени вклада астроцитов в синаптиче-
к последним относятся гены, кодирующие та-
скую регуляцию и развитие неврологических и
кие секретируемые белки, как ApoE, ApoJ/
психических заболеваний [136]. Действитель-
clusterin, Pla2g7, Sparc, Sparcl1 и Mfge, некото-
но, согласно недавно полученным данным,
рые из которых принимают участие во взаимо-
астроциты могут принимать непосредствен-
действии астроцитов с синапсами или астро-
ное участие в опосредовании элиминации
цитов с эндотелиальными клетками. Многие
синапсов в развивающемся и взрослом моз-
из этих генов высоко экспрессируются в астро-
ге, что, в свою очередь, играет важную роль в
цитах в возрасте от 1 до 17 дней, что позволя-
постоянном ремоделировании синаптической
ет предположить, что белки, которые они ко-
архитектуры головного мозга [137].
дируют, играют важную роль в развитии ЦНС
Интересным явилось исследование по из-
во время и после формирования большинства
учению профиля транскрипции реактивной
синапсов, что, в свою очередь, согласуется с
астроглии на астроцитах, выделенных с помо-
данными о способности астроцитов регулиро-
щью FACS от взрослых трансгенных мышей
вать образование синапсов [124]. Более того,
линии Aldh1l1-EGFP после моделирования
в астроцитах был выявлен ряд других генов
травмы головного мозга [61]. Обнаружено, что
(NPAS3, MLC1, LGI1/4 и GPR56), которые уча-
реактивные астроциты выраженно изменяют
ствуют в развитии психических заболеваний,
свой транскрипционный профиль, а именно:
таких как шизофрения и биполярное рас-
основные изменения выявлены в генах, ко-
стройство [125-127]. Так, NPAS3 - ген факто-
дирующих белки внеклеточного матрикса -
ра транскрипции bHLH (basic helix-loop-helix)
коллаген (Col12a1, Col6a1) и версикан (Vcan),
домена PAS (Per, Arnt, Sim), кодирующий
тромбоспондин (Thbs1) и фибулин 5 (Fbln5),
нейрональный белок 3 домена PAS (NPAS3),
CD44 и нейрофасцин (Nfasc), что указывает
экспрессируется в глии Бергмана в мозжеч-
о способности реактивных астроцитов изме-
ке [128]. Белок NPAS3 принимает участие в
нять внеклеточный матрикс при формиро-
регуляции нейрогенеза, циркадного ритма и
вании глиального рубца. Аналогично, гены,
пролиферации клеток. Мутация гена NPAS3
кодирующие белки промежуточных филамен-
является фактором риска психических рас-
тов (GFAP, виментин и нестин), высоко экс-
стройств [129]. У мышей делеция гена NPAS3
прессировались в реактивных астроцитах, тем
вызывает развитие нарушений нейрогенеза и
самым отражая морфологические изменения,
синаптической передачи в гиппокампе [130].
которые происходят при активации. Кроме
Ген MLC1, кодирующий мембранный бе-
того, выявлена группа генов, кодирующих ци-
лок MLC1, специфически экспрессируется в
токины, белки презентации антигена и пути
10
БИОХИМИЯ том 87 вып. 7 2022
986
ГОРИНА и др.
системы комплемента, экспрессия которых
галородопсин, археродопсин (Arch), археро-
значительно увеличена в реактивных астро-
допсин-Т (Arch-T)) индуцируют транслока-
цитах, что предполагает регуляторную роль
цию ионов [141-143], а другие (меланопсин) -
астроцитов при взаимодействии с клетками
активируют внутриклеточные сигнальные
иммунной системы в результате поврежде-
каскады, такие как передача сигналов, опосре-
ния [61].
дованная G-белком [144].
Важно отметить, что при сравнении тран-
Важно, что оптогенетика позволяет изби-
скриптомов нескольких популяций астроцитов,
рательно нацеливаться на определенные кле-
экспрессирующих специфические клеточные
точные популяции, в частности, астроциты,
маркеры, например, GFAP- против GLT-1-по-
и оказывать направленное воздействие, что,
ложительных астроцитов
[123], ALDH1L1-
в свою очередь, дает возможность осущест-
против GLT-1-положительных астроцитов [32]
влять более глубокий и детальный анализ их
и ALDH1L1- против GlialCAM-иммунопози-
функций в ЦНС [8]. В ходе проведения ряда
тивных астроцитов [138], не было обнаружено
исследований было продемонстрировано, что
выраженных различий между этими популя-
оптогенетическая стимуляция астроцитов по-
циями клеток, что указывает на то, что марке-
средством экспрессии светочувствительных
ры коэкспрессируются в большинстве астро-
ионных каналов и рецепторов приводит к вы-
цитов.
раженным изменениям их функциональной
Одним из способов определить моле-
пластичности [145, 146].
кулярную гетерогенность астроцитов яв-
Установлено, что стимуляция Opto-a1AR
ляется использование транскриптомного
(метаботропный опсин), экспрессируемого в
анализа одиночных клеток. В ходе проведе-
астроцитах гиппокампа, может усиливать дол-
ния нескольких исследований была собра-
говременную синаптическую пластичность у
на информация о транскриптоме отдельных
мышей, тогда как катионный мембранный ка-
астроцитов [47, 139], однако они не включали
нал ChR2 (ионотропный опсин) не дает столь
дальнейшего описания гетерогенности астро-
выраженного эффекта. Это показывает, что
цитов. Однако в результате проведения круп-
долгосрочную синаптическую пластичность
номасштабного исследования по секвенирова-
возможно модулировать оптогенетически, что
нию одноклеточной РНК клеток коры и СА1
может быть использовано для нормализации
области гиппокампа мышей, было идентифи-
синаптической передачи и коррекции наруше-
цировано два подкласса астроцитов - GFAP
ний пластичности при некоторых нейродеге-
и Mfge8. При этом астроциты, экспрессирую-
неративных заболеваниях, в частности болез-
щие GFAP, составляли пограничную глиаль-
ни Альцгеймера [147].
ную мембрану - верхний слой нервной ткани
Показано, что оптическая активация
головного мозга, лежащий непосредственно
астроцитов ChR2 может стимулировать высво-
под мягкой мозговой оболочкой, тогда как
бождение АТФ, что, в свою очередь, усили-
второй подкласс астроцитов располагался бо-
вает возбуждающую передачу сигналов в си-
лее равномерно в коре и характеризовался
напсах за счет стимуляции рецепторов P2Y1
меньшей разветвленностью отростков [47].
и A2A [148]. Однако в недавно проведенном
исследовании с использованием оригиналь-
ного приема, основанного на сочетанном
ОПТОГЕНЕТИЧЕСКАЯ
применении генетически кодируемых ин-
СТИМУЛЯЦИЯ АСТРОЦИТОВ
дикаторов Ca2+ - GCaMP6f в астроцитах и
селективной экспрессии меланопсина (фо-
Оптогенетика представляет собой цен-
топигмента, связанного с G-белком) в астро-
ный инструмент для изучения реакции астро-
цитах для запуска передачи сигналов Ca2+,
цитов на передачу сигналов, специфичных
показано, что меланопсин способен стимули-
для различных типов нейронов, с помощью
ровать инозитол-1,4,5-трифосфат (IP3)-зави-
светочувствительных белков - опсинов, ко-
симые Ca2+-сигналы в астроцитах и вызывать
торые включают микробные ионные каналы
АТФ-зависимое временное усиление возбуж-
и ионные насосы, а также сконструирован-
дающей синаптической передачи в гиппокам-
ные GPCR [140]. Поглощение света опре-
пе посредством пуринергической активации
деленной длины волны опсином вызыва-
рецепторов P2Y1 и A2A. При этом в отличие
ет конформационные изменения, которые
от меланопсина астроглиальные сигналы Ca2+,
запускают разнообразные изменения в клет-
вызванные стимуляцией ChR2, были зафик-
ках, экспрессирующих опсин. При этом неко-
сированы после более длинных световых им-
торые опсины (канальный родопсин 2 (ChR2),
пульсов (более 5 секунд). Кроме того, в усло-
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
987
виях низкочастотной световой стимуляции
шей Optoα1AR TG, у которых астроциты
астроциты, трансфицированные меланопси-
экспрессируют оптогенетически активируе-
ном, могут вызывать долговременную по-
мый Gq-GPCR Optoα1AR, фотостимуляция
тенциацию, что активирует эпизодическую
которого обеспечивает временное повыше-
память, тем самым делая меланопсин оптиче-
ние астроцитарного Ca2+, что фиксировали
ским инструментом для регуляции широкого
с помощью Rhod-2 AM [153]. Это позволи-
спектра действий астроцитов в нейронных се-
ло изучить влияние модуляции активности
тях in vivo [144].
астроцитов на активность нейронов, опосре-
В другом исследовании с использованием
дованное передачей сигналов Gq в астроцитах.
взрослых мышей (2-5 месяцев) линии tTA-
Так, оптогенетическая активация передачи
MlC1-tetO-ChR2(C128S)-EYFP (разработка
сигналов Gq в астроцитах в коре временно ин-
Tanaka et al. [149]) оценивали устойчивый от-
гибировала активность нейронов через адено-
вет Ca2+ в астроцитах при их направленной
зиновый рецептор A1. Кроме того, сенсорная
световой стимуляции в неокортексе. Данная
стимуляция в сочетании с активацией астро-
модель трансгенных мышей экспрессирует
цитов индуцировала длительную депрессию
высокочувствительный к свету мутантный ка-
сенсорно-вызванного ответа. Согласно ре-
тионный канал ChR2 (C128S) в астроцитах (с
зультатам поведенческого тестирования, ак-
промотором MlC1), который открывается в си-
тивация астроцитов приводила к улучшению
ней области спектра и закрывается - в оран-
долговременной памяти (тест «Распознавание
жевой, что позволило в данном исследовании
новых объектов»), однако не оказывала зна-
использовать комбинированный подход, ос-
чимого влияния на кратковременную память
нованный на оптогенетической стимуляции
(тест «Y-лабиринт») [153].
ChR2 в сочетании с визуализацией активно-
Учитывая тот факт, что световая актива-
сти Ca2+ в астроцитах с помощью индикатора
ция астроцитов ChR2 изменяет динамику ба-
Ca2+ - Rhod-2 AM (красная область спектра).
зального уровня Са2+ [154], использование в
Это дает возможность оценить активацию/
исследовании такого подхода, как математи-
возбудимость астроцитов и определить их роль
ческое моделирование, может иметь важное
в патогенезе некоторых заболеваний головно-
значение для прогнозирования того, как био-
го мозга, таких как эпилепсия, болезнь Альц-
физические свойства конструкции ChR2, а
геймера и болезнь Паркинсона [150].
также характеристики лазера могут влиять на
Более того, изучая влияние стимуляции
передачу сигналов Са2+ астроцитами. В этом
астроцитов на обработку информации пира-
аспекте создание математической модели даст
мидальными нейронами слоя 5 (L5PN), уста-
возможность оптимизировать схему световой
новлено, что оптогенетическая активация
стимуляции с целью достижения желаемого
астроцитов вблизи тела клетки L5PN пролон-
уровня Ca2+ в астроцитах, а также разработать
гирует их возбуждение. Выявленные эффекты
новые прикладные конструкции, специфиче-
связаны с высвобождением S100β - астроци-
ски ориентированные на детальное изучение
тарного Са2+-связывающего белка, который
роли астроглиальных клеток в головном моз-
снижает концентрацию внеклеточного Ca2+
ге [155].
при высвобождении его из клетки во внекле-
точное пространство. При этом уменьшение
концентрации внеклеточного Ca2+ вызывает
ФЕНОТИПИЧЕСКИЕ
возбуждение L5PN, опосредованное актива-
ИЗМЕНЕНИЯ АСТРОЦИТОВ
цией ионных каналов Nav1.6 [151].
В ПАТОФИЗИОЛОГИЧЕСКИХ УСЛОВИЯХ
Интересным является и недавно установ-
ленный факт того, что вызванная за счет хро-
В результате воздействия негативных сти-
нической оптогенетической активации ChR2
мулов, способствующих повреждению ней-
эксайтотоксичность глии Бергмана вызывает
ронов, астроциты претерпевают ряд фено-
снижение захвата глутамата, проявляющее-
типических и функциональных изменений,
ся удлинением возбуждающих постсинапти-
что сопровождается развитием реактивного
ческих токов в клетках Пуркинье, что со-
астроглиоза. При этом наблюдается гипертро-
гласуется с документально подтвержденным
фия и повышенная экспрессия GFAP, что и
снижением экспрессии транспортера глутама-
формирует характерный фенотип реактивных
та EAAT-1 [152].
астроцитов, которые, в свою очередь, про-
В другом исследовании для оценки роли
лиферируют, мигрируют и превращаются в
физиологической активации астроцитов
астроциты, образующие рубцы [156]. Как реак-
in vivo была создана линия трансгенных мы-
тивные астроциты, так и астроциты, образую-
БИОХИМИЯ том 87 вып. 7 2022
10*
988
ГОРИНА и др.
щие рубцы, высоко экспрессируют ряд бел-
астроцитов A1 [158]. При этом Mfge8 регули-
ков-маркеров, а именно: GFAP, β-катенин-1,
рует астроцитарную конверсию A1/A2 посред-
нестин и N-кадгерин. Однако существуют и
ством активации PI3K/Akt-пути и подавления
специфические маркерные гены, в частно-
NF-κB-пути.
сти, гены-маркеры реактивных астроцитов -
Напротив, астроциты A2 оказывают ней-
матриксная металлопротеиназа-2 (MMP-2)
ропротективное действие на нервную ткань,
(кодирует белок MMP-2), PLAUR (кодирует
секретируя несколько нейротрофических
белок-рецептор активатора плазминогена уро-
факторов. Ген S100а10, экспрессируемый
киназы (suPAR)), матричная металлопротеи-
астроцитами A2, необходим для пролифера-
наза-13 (MMP-13, кодирующая белок колла-
ции клеток, восстановления мембран и ин-
геназу 3), Axin-2 (кодирует аксиноподобный
гибирования апоптоза клеток
[158]. Более
белок-2), ген, кодирующий белок промежуточ-
того, астроциты A2 способствуют экспрессии
ных филаментов - нестин и CTNNB1 (кодиру-
противовоспалительного цитокина, транс-
ет белок β-катенин-1), тогда как к генам-мар-
формирующего фактора роста-бета (TGFβ,
керам астроцитов, образующих рубцы,
Transforming growth factor-beta), который уча-
относятся Cdh2 (кодирует белок N-кадгерин),
ствует в синаптогенезе и играет нейропротек-
SOX9 (кодирует белок фактор транскрипции
тивную роль.
SOX-9), а также гены, связанные с протеогли-
Интересными являются результаты од-
канами хондроитинсульфата - CSGALNACT1
ного из исследований по изучению несколь-
(кодирует белок хондроитинсульфат N-аце-
ких фенотипов активированных астроцитов
тилгалактозаминилтрансферазу
1), CHST11
и задействованных при этом регуляторных
(кодирует белок карбогидратсульфотранс-
механизмов [159]. Установлено, что активи-
феразу 11), ACAN (кодирует белок аггрекан
рованные астроциты in vitro и in vivo прояв-
протеогликанов) и SLIT2 (кодирует белок-го-
ляют два различных функциональных фе-
молог Slit 2) [156]. Таким образом, представ-
нотипа в отношении экспрессии про- или
ленные гены-маркеры в сочетании с морфо-
противовоспалительных генов, экспрессии
логическими характеристиками астроцитов
глиального фибриллярного кислого белка и
могут быть использованы для определения их
нейротоксической или нейропротекторной
фенотипа.
активности. Также показано, что активиро-
Известны два типа реактивных астро-
ванные астроциты высвобождают белок липо-
цитов - А1 и А2. Реактивные астроциты A1
калин-2 (LCN2), который регулирует как мор-
продуцируют провоспалительные цитокины,
фологическую трансформацию астроцитов,
которые могут вызывать гибель нейронов,
связанную с реактивным астроглиозом, так
тогда как реактивные астроциты A2 активи-
миграцию и апоптоз. Более того, LCN2 спо-
руют нейротрофические факторы, которые
собствует провоспалительной активации
способствуют выживанию и росту нейро-
астроцитов, но в то же время ингибирует пе-
нов [157]. Важно отметить, что данные типы
редачу сигналов по IL-4/STAT6-пути, участвуя
реактивных астроцитов можно идентифици-
в альтернативной противовоспалительной ак-
ровать в соответствии с их индивидуальными
тивации. Это дает возможность предполагать,
генетическими характеристиками. Так, в ходе
что секретируемый астроцитами белок LCN2
исследования посмертной ткани головно-
является аутокринным модулятором функцио-
го мозга пациентов с болезнью Альцгеймера,
нальной поляризации астроцитов при разви-
болезнью Хантингтона, болезнью Паркин-
тии нейровоспаления и может быть направлен
сона, боковым амиотрофическим склерозом
на подавление провоспалительной активации
и рассеянным склерозом выявлено, что наи-
астроцитов и связанных с этим нейродегене-
более высоко в астроцитах А1 экспрессирует-
ративных заболеваний [159, 160].
ся компонент 3 (С3). При этом в посмертной
ткани головного мозга пациентов с рассеян-
ным склерозом в астроцитах A2 экспрессиру-
МикроРНК АСТРОЦИТОВ КАК
ют единственный маркер - S100A10 [158]. Это
ПОТЕНЦИАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ
дает возможность использовать данные гены в
МИШЕНЬ ДЛЯ ТЕРАПИИ
качестве специфических маркеров астроцитов
НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ
A1 и А2 соответственно.
Активированная микроглия вызывает
МикроРНК представляют собой неболь-
трансформацию астроцитов в астроциты A1
шие регуляторные РНК длиной 21-24 нуклео-
путем высвобождения цитокинов IL-1α, TNF
тида, участвующие в посттранскрипционной
и С1q, каждый из которых важен для индукции
регуляции генов. МикроРНК связываются с ин-
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
989
формационными (матричными) РНК (мРНК)
Так, у мышей с генетической моделью болез-
на основе комплементарности, что приводит к
ни Альцгеймера (линия 3xTg-AD) выявлено
деградации последних или подавлению транс-
увеличение уровня miR-181a, которая подав-
ляции [161]. Более того, микроРНК обладают
ляет экспрессию некоторых синаптических
потенциалом для регулирования сотен различ-
белков в астроцитах, в частности, GLT-1, осу-
ных транскиптов [162]. Одной из важных осо-
ществляющего регуляцию синаптической
бенностей микроРНК является их возможность
пластичности [169]. Более того, наблюдалась
транспортироваться от одной клетки к другой
активация miR-155 и c-Jun на фоне индуциро-
через экзосомы, что позволяет микроРНК ока-
ванного бета-амилоидом увеличения активно-
зывать широкое влияние на уровне тканей и
сти микроглии и астроцитов, что способство-
организма в целом [163].
вало выработке медиаторов воспаления, таких
Известно, что практически все клетки се-
как IL-6 (интерлейкин-6) и IFN-β (интерфе-
кретируют экзосомы [164]. Так, результаты
рон-бета) [170].
недавно проведенного исследования [165] по
Показано, что у мышей с моделью болезни
изучению молекулярного состава экзосом, вы-
Альцгеймера (линия APPswe/PS1/E9) актива-
деляемых астроцитами и нейронами во вне-
ция астроглиального CEBPD (CCAAT/энхан-
клеточное пространство и обеспечивающих
сер-связывающий белок дельта - ключевой
межклеточную коммуникацию путем переноса
фактор транскрипции при воспалении в ткани
различных молекул (белков, РНК, липидов),
головного мозга) приводит к нарушению про-
показали, что как астроциты, так и нейроны
странственного обучения и запоминания за
избирательно включают в экзосомы только
счет активации miR-135a, ингибирующей ак-
часть клеточных микроРНК. При этом суще-
тивность нейротропного фактора Thbs1 (тром-
ствование различия в профилях микроРНК
боспондин 1), что, в свою очередь, подавляет
между экзосомами и соответствующими им
синаптогенез, а также снижает рост дендритов
клетками предполагают, что процесс отбора
и прорастание аксонов нейронов [171].
микроРНК в экзосомы четко регулируется и
Болезнь Паркинсона связана с различны-
может иметь клеточную специфичность.
ми патологическими факторами, включая ток-
Как острое, так и хроническое поврежде-
сичность α-синуклеина и другие механизмы.
ние ЦНС вызывает реактивные структур-
Обнаружено, что сывороточные концентрации
но-функциональные изменения в астроцитах,
miR-153 и miR-223 прогрессивно снижались у
что определяется, как реактивный астроглиоз.
мышей дикого типа (WT) и мышей с генети-
Нарушение функций астроцитов может в зна-
ческой моделью болезни Паркинсона (линия
чительной степени способствовать прогрес-
GFAP.HMOX1) [172]. Кроме того, циркули-
сированию патологического процесса за счет
рующие уровни обеих микроРНК были ниже
активации эксайтотоксичности, окислитель-
у трансгенных мышей по сравнению с кон-
ного стресса и воспалительных реакций [166].
трольными мышами WT, в то время как кон-
Нейродегенеративные заболевания, а именно:
центрации белка α-синуклеина были повыше-
болезнь Альцгеймера, болезнь Паркинсона и
ны у мышей GFAP.HMOX1 по сравнению со
боковой амиотрофический склероз характе-
значениями для мышей WT. Это дает возмож-
ризуются нейровоспалением, когнитивной и
ность предполагать, что miR-153 и miR-223 от-
двигательной дисфункцией. Это связано с не-
рицательно регулируют α-синуклеин в базаль-
обратимой дегенерацией нейронов в головном
ных ганглиях у мышей GFAP.HMOX1 [172].
и спинном мозге и апоптозом. Однако расту-
Заслуживает внимания и другое прове-
щее количество экспериментальных данных
денное исследование [173] по оценке влияния
демонстрирует важную роль астроцитов в па-
внеклеточных везикул, секретируемых астро-
тогенезе хронических нейродегенеративных
цитами, которые были выделены от пациентов
заболеваний [167].
с боковым амиотрофическим склерозом, на
Нарушение регуляции экспрессии ге-
выживаемость двигательных нейронов. Обна-
нов является характерным признаком как
ружено, что внеклеточные везикулы не только
физиологического старения, так и нейроде-
вызывают гибель двигательных нейронов, но и
генеративных заболеваний
[168]. Согласно
содержат микроРНК, которые негативно регу-
результатам ряда исследований, микроРНК
лируют экспрессию генов, в частности, miR-
принимают участие в патогенезе нейродеге-
494-3p подавляет различные гены, включая
неративных заболеваний, регулируя функцию
ген, кодирующий семафорин 3A (SEMA3A),
астроцитов за счет различных механизмов,
участвующий в росте и поддержании аксонов.
и таким образом, могут выступать в качестве
Примечательно и то, что микроРНК, выде-
потенциальных терапевтических мишеней.
ленная из поврежденных в ходе развития боко-
БИОХИМИЯ том 87 вып. 7 2022
990
ГОРИНА и др.
вого амиотрофического склероза двигательных
проявлении различных морфологических ха-
нейронов, может оказывать непосредственное
рактеристик в зависимости от локализации в
негативное влияние на структурно-функцио-
той или иной области головного мозга. В связи
нальную целостность астроцитов, что в значи-
с этим детальное изучение экспрессии генов и
тельной мере интенсифицирует дегенерацию
функциональных особенностей астроцитов в
нейронов [174]. В частности, in vitro показано,
различных областях мозга имеет первостепен-
что астроциты способны поглощать нейрональ-
ное значение. К сожалению, эта задача пол-
ную miR-218, которая, в свою очередь, ингиби-
ностью не решена до сих пор из-за отсутствия
рует активность транспортера глутамата EAAT-2
универсального маркера астроглиальных кле-
в астроцитах за счет прямого воздействия на
ток, характерных для той или иной области
3′-UTR EAAT-2, содержащего несколько сай-
мозга. Более того, не идентифицировано ни
тов связывания miR-218. Однако блокирование
одного «идеального» промотора, специфично-
miR-218 заметно увеличивает уровень EAAT-2 в
го для астроглии, обеспечивающего экспрес-
астроцитах у мышей с моделью бокового амио-
сию репортерных генов исключительно в клет-
трофического склероза, что делает данную
ках данного типа.
биомолекулу перспективной терапевтической
Поэтому изучение молекулярных механиз-
мишенью. Таким образом, дисфункция астро-
мов, лежащих в основе межклеточного взаи-
цитов и реактивный астроглиоз, как ответная
модействия между астроцитами и нейронами,
реакция на повреждение двигательных нейро-
а также открытие новых функций астрогли-
нов при развитии бокового амиотрофического
альных клеток является вескими основания-
склероза, может быть опосредована повышен-
ми для поиска новых маркеров активации
ной активностью микроРНК, высвобождаемой
астроцитов и методов их визуализации. При
из поврежденных нейронов [174].
этом комбинирование методов визуализации
В совокупности, представленные экспе-
с другими современными протоколами (ПЦР-
риментальные данные in vivo и in vitro свиде-
анализ, электрофизиология, оптогенетика)
тельствуют, что микроРНК вносят существен-
позволит более детально изучить многогран-
ный вклад в патогенез нейродегенеративных
ность функций астроцитов, что будет иметь
заболеваний, регулируя прямо или опосредо-
решающее значение для понимания биологии
ванно функции астроцитов, это находит свое
астроглии в здоровой и проврежденной ткани
отражение в активации провоспалительных
центральной нервной системы.
цитокинов, подавлении синаптогенеза, гибели
нейронов и митохондриальной дисфункции.
Финансирование. Работа выполнена при
поддержке Российского научного фонда (грант
ЗАКЛЮЧЕНИЕ
№ 20-65-46004).
Конфликт интересов. Авторы декларируют
Астроциты служат фундаментальными ре-
отсутствие явных и потенциальных конфлик-
гуляторами в развитии и гомеостазе головного
тов интересов, связанных с публикацией дан-
мозга, а также при возникновении и прогрес-
ной статьи.
сировании нейродегенеративных заболева-
Соблюдение этических норм. Статья не со-
ний. Важной особенностью и одновременно
держит описания каких-либо исследований
сложностью для исследователей является гете-
с участием людей или животных в качестве
рогенность астроцитов, которая заключается в
объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Montgomery, D. L.
(1994) Astrocytes: form,
of synchronous bursting in cortical cultures: from
functions, and roles in disease, Vet. Pathol., 31, 145-
local to global, Cerebral Cortex Commun., 1, tgaa053,
167, doi: 10.1177/030098589403100201.
doi: 10.1093/texcom/tgaa053.
2. Montana, V., Flint, D., Waagepetersen, H. S.,
4. Honoré, E., Khlaifia, A., Bosson, A., and Lacaille, J.-
Schousboe, A., and Parpura, V. (2021) Two metabolic
C. (2021) Hippocampal somatostatin interneurons,
fuels, glucose and lactate, differentially modulate
long-term synaptic plasticity
and memory,
exocytotic glutamate release from cultured astrocytes,
Front. Neural. Circuits, 15, 687558, doi: 10.3389/
Neurochem. Res.,
46,
2551-2579, doi:
10.1007/
fncir.2021.687558.
s11064-021-03340-y.
5. Welser-Alves, J. V., Crocker, S. J., and Milner, R.
3. Kumar, R., Huang, Y.-T., Chen, C.-C., Tzeng, S.-
(2011) A dual role for microglia in promoting tissue
F., and Chan, C.-K. (2020) Astrocytic regulation
inhibitor of metalloproteinase (TIMP) expression in
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
991
glial cells in response to neuroinflammatory stimuli,
18. Steiner, J., Bernstein, H.-G., Bielau, H., Berndt, A.,
J. Neuroinflamm., 8, 61, doi: 10.1186/1742-2094-8-61.
Brisch, R., et al. (2007) Evidence for a wide extra-
6. Stackhouse, T. L., and Mishra, A.
(2021)
astrocytic distribution of S100β in human brain, BMC
Neurovascular coupling in development and disease:
Neurosci., 8, 2, doi: 10.1186/1471-2202-8-2.
focus on astrocytes, Front. Cell Dev. Biol., 9, 702832,
19. Marichal, N., García, G., Radmilovich, M., Trujillo-
doi: 10.3389/fcell.2021.702832.
Cenóz, O., and Russo, R. E. (2012) Spatial domains
7. Santello, M., Toni, N., and Volterra, A.
(2019)
of progenitor-like cells and functional complexity of
Astrocyte function from information processing to
a stem cell niche in the neonatal rat spinal cord, Stem
cognition and cognitive impairment, Nat. Neurosci.,
Cells, 30, 2020-2031, doi: 10.1002/stem.1175.
22, 154-166, doi: 10.1038/s41593-018-0325-8.
20. Schmitt, A., Asan, E., Lesch, K.-P., and Kugler, P.
8. McNeill, J., Rudyk, C., Hildebrand, M. E.,
(2002) A splice variant of glutamate transporter
and Salmaso, N.
(2021) Ion channels and
GLT1/EAAT2 expressed in neurons: cloning and
electrophysiological
properties
of
astrocytes:
localization in rat nervous system, Neuroscience, 109,
implications for emergent stimulation technologies,
45-61, doi: 10.1016/S0306-4522(01)00451-1.
Front. Cell. Neurosci.,
15,
644126, doi:
10.3389/
21. Lehre, K., Levy, L., Ottersen, O., Storm-
fncel.2021.644126.
Mathisen, J., and Danbolt, N. (1995) Differential
9. Gómez-Gonzalo, M., Zehnder, T., Requie, L. M.,
expression of two glial glutamate transporters in the
Bezz, I. P., and Carmignoto, G. (2018) Insights
rat brain: quantitative and immunocytochemical
into the release mechanism of astrocytic glutamate
observations,
J.
Neurosci.,
15,
1835-1853,
evoking in neurons NMDA receptor-mediated slow
doi: 10.1523/JNEUROSCI.15-03-01835.1995.
depolarizing inward currents, Glia, 66, 2188-2199,
22. Anlauf, E., and Derouiche, A. (2013) Glutamine
doi: 10.1002/glia.23473.
synthetase as an astrocytic marker: its cell type
10. Robin, L. M., Oliveira da Cruz, J. F., Langlais,
and vesicle localization, Front. Endocrinol., 4, 144,
V. C., Martin-Fernandez, M., Metna-Laurent, M.,
doi: 10.3389/fendo.2013.00144.
et al.
(2018) Astroglial CB1 receptors determine
23. Bernstein, H.-G., Bannier, J., Meyer-Lotz, G.,
synaptic D-serine availability to enable recognition
Steiner, J., Keilhoff, G., et al. (2014) Distribution of
memory, Neuron,
98,
935-944, doi:
10.1016/
immunoreactive glutamine synthetase in the adult
j.neuron.2018.04.034.
human and mouse brain. Qualitative and quantitative
11. Sardar, D., Lozzi, B., Woo, J., Huang, T.-W.,
observations with special emphasis on extra-astroglial
Cvetkovic, C., et al.
(2021) Mapping astrocyte
protein localization, J. Chem. Neuroanatomy, 61-62,
transcriptional signatures in response to neuroactive
33-50, doi: 10.1016/j.jchemneu.2014.07.003.
compounds, Int. J. Mol. Sci., 22, 3975, doi: 10.3390/
24. Morrow, C. S., Porter, T. J., Xu, N., Arndt, Z. P.,
ij ms22083975.
Ako-Asare, K., et al. (2020) Vimentin coordinates
12. Gómez-Gonzalo, M., Martin-Fernandez, M.,
protein turnover at the aggresome during neural stem
Martínez-Murillo, R., Mederos, S., Hernández-
Cell quiescence exit, Cell Stem Cell, 26, 558-568,
Vivanco, A., et al.
(2017) Neuron-astrocyte
doi: 10.1016/j.stem.2020.01.018.
signaling is preserved in the aging brain: neuron-
25. Battaglia, R. A., Delic, S., Herrmann, H., and
astrocyte signaling in aging brain, Glia, 65, 569-580,
Snider, N. T. (2018) Vimentin on the move: new
doi: 10.1002/glia.23112.
developments in cell migration, F1000Res., 7, 1796,
13. Verkhratsky, A., and Nedergaard, M.
(2018)
doi: 10.12688/f1000research.15967.1.
Physiology of astroglia, Physiol. Rev., 98, 239-389,
26. Pattabiraman, S., Azad, G. K., Amen, T., Brielle, S.,
doi: 10.1152/physrev.00042.2016.
Park, J. E., et al.
(2020) Vimentin protects
14. Middeldorp, J., and Hol, E. M. (2011) GFAP in
differentiating stem cells from stress, Sci. Rep., 10,
health and disease, Progr. Neurobiol., 93, 421-443,
19525, doi: 10.1038/s41598-020-76076-4.
doi: 10.1016/j.pneurobio.2011.01.005.
27. Lisjak, M., Potokar, M., Zorec, R., and
15. Nichols, N. R., Day, J. R., Laping, N. J.,
Jorgačevski, J. (2020) Indirect role of AQP4b and
Johnson, S. A., and Finch, C. E. (1993) GFAP
AQP4d isoforms in dynamics of astrocyte volume
mRNA increases with age in rat and human
and orthogonal arrays of particles, Cells, 9, 735,
brain, Neurobiol. Aging, 14, 421-429, doi: 10.1016/
doi: 10.3390/cells9030735.
0197-4580(93)90100-P.
28. Wen, H., Nagelhus, E. A., Amiry-Moghaddam, M.,
16. Garcia, A. D. R., Doan, N. B., Imura, T., Bush,
Agre, P., Ottersen, O. P., et al. (1999) Ontogeny of
T. G., and Sofroniew, M. V. (2004) GFAP-expressing
water transport in rat brain: postnatal expression of
progenitors are the principal source of constitutive
the aquaporin-4 water channel: Aquaporin-4 and
neurogenesis in adult mouse forebrain, Nat. Neurosci.,
brain development, Eur. J. Neurosci., 11, 935-945,
7, 1233-1241, doi: 10.1038/nn1340.
doi: 10.1046/j.1460-9568.1999.00502.x.
17. Steiner, J., Bernstein, H.-G., Bogerts, B.,
29. Giaume, C., Naus, C. C., Sáez, J. C., and
Gos, T., Richter-Landsberg, C., et al.
(2008)
Leybaert, L. (2021) Glial connexins and pannexins in
S100β is expressed in, and released from, OLN-
the healthy and diseased brain, Physiol. Rev., 101, 93-
93 oligodendrocytes: influence of serum and
145, doi: 10.1152/physrev.00043.2018.
glucose deprivation, Neuroscience,
154,
496-503,
30. Griemsmann, S., Höft, S. P., Bedner, P., Zhang, J.,
doi: 10.1016/j.neuroscience.2008.03.060.
von Staden, E., et al. (2015) Characterization of
БИОХИМИЯ том 87 вып. 7 2022
992
ГОРИНА и др.
Panglial gap junction networks in the thalamus,
43. Tao, L., Zhu, Y., Wang, R., Han, J., Ma, Y.,
neocortex, and hippocampus reveals a unique
et al.
(2020) N-myc downstream-regulated gene
population of glial cells, Cereb. Cortex, 25, 3420-3433,
2 deficiency aggravates memory impairment in
doi: 10.1093/cercor/bhu157.
Alzheimer’s disease, Behavioural Brain Res., 379,
31. Krupenko, S. A.
(2009) FDH: an aldehyde
112384, doi: 10.1016/j.bbr.2019.112384.
dehydrogenase fusion enzyme in folate metabolism,
44. Pekny, M., Eliasson, C., Chien, C.-L., Kindblom,
Chem. Biol. Interact.,
178,
84-93, doi:
10.1016/
L. G., Liem, R., et al.
(1998) GFAP-deficient
j.cbi.2008.09.007.
astrocytes are capable of stellation in vitro when
32. Yang, Y., Vidensky, S., Jin, L., Jie, C., Lorenzini, I.,
cocultured with neurons and exhibit a reduced
et al. (2011) Molecular comparison of GLT1+ and
amount of intermediate filaments and an increased
ALDH1L1+ astrocytes in vivo in astroglial reporter
cell saturation density, Exp. Cell Res., 239, 332-343,
mice, Glia, 59, 200-207, doi: 10.1002/glia.21089.
doi: 10.1006/excr.1997.3922.
33. Cahoy, J. D., Emery, B., Kaushal, A., Foo, L. C.,
45. Bushong, E. A., Martone, M. E., Jones, Y. Z., and
Zamanian, J. L., et al. (2008) A Transcriptome data-
Ellisman, M. H. (2002) Protoplasmic astrocytes in
base for astrocytes, neurons, and oligodendrocytes: a
CA1 stratum radiatum occupy separate anatomical
new resource for understanding brain development
domains, J. Neurosci., 22, 183-192, doi: 10.1523/
and function, J. Neurosci., 28, 264-278, doi: 10.1523/
JNEUROSCI.22-01-00183.2002.
JNEUROSCI.4178-07.2008.
46. Van Den Berge, S. A., Middeldorp, J., Zhang,
34. Shiokawa, K., Kajita, E., Hara, H., Yatsuki, H., and
C. E., Curtis, M. A., Leonard, B. W., et al.
Hori, K. (2002) A developmental biological study of
(2010) Longterm quiescent cells in the aged hu-
aldolase gene expression in Xenopus laevis, Cell Res.,
man subventricular neurogenic system specifical-
12, 85-96, doi: 10.1038/sj.cr.7290114.
ly express GFAP-δ: GFAP-δ in aged human SVZ
35. Walther, E. U., Dichgans, M., Maricich, S. M.,
stem cells, Aging Cell,
9,
313-326, doi:
10.1111/
Romito, R. R., Yang, F., et al. (1998) Genomic
j.1474-9726.2010.00556.x.
sequences of aldolase C (Zebrin II) direct lacZ
47. Zeisel, A., Muñoz-Manchado, A. B., Codeluppi, S.,
expression exclusively in non-neuronal cells of
Lönnerberg, P., La Manno, G., et al. (2015) Cell
transgenic mice, Proc. Natl. Acad. Sci. USA, 95, 2615-
types in the mouse cortex and hippocampus revealed
2620, doi: 10.1073/pnas.95.5.2615.
by single-cell RNA-seq, Science,
347,
1138-1142,
36. Thompson, R. J., Kynoch, P. A. M., and Willson,
doi: 10.1126/science.aaa1934.
V. J. C. (1982) Cellular localization of aldolase C
48. Hu, J., and Van Eldik, L. J. (1996) S100 β induc-
subunits in human brain, Brain Res., 232, 489-493,
es apoptotic cell death in cultured astrocytes via a
doi: 10.1016/0006-8993(82)90294-3.
nitric oxide-dependent pathway, Biochim. Biophys.
37. Sun, W., Cornwell, A., Li, J., Peng, S., Osorio, M. J.,
Acta Mol. Cell Res., 1313, 239-245, doi: 10.1016/
et al. (2017) SOX9 is an astrocyte-specific nuclear
0167-4889(96)00095-X.
marker in the adult brain outside the neurogenic
49. Xiong, Z., O’Hanlon, D., Becker, L. E., Roder, J.,
regions, J Neurosci., 37, 4493-4507, doi: 10.1523/
MacDonald, J. F., et al. (2000) Enhanced calcium
JNEUROSCI.3199-16.2017.
transients in glial cells in neonatal cerebellar cultures
38. Neyrinck, K., Van Den Daele, J., Vervliet, T., De
derived from S100β null mice, Exp. Cell Res., 257,
Smedt, J., Wierda, K., et al. (2021) SOX9-induced
281-289, doi: 10.1006/excr.2000.4902.
generation of functional astrocytes supporting
50. Bianchi, R., Verzini, M., Garbuglia, M.,
neuronal maturation in an all-human system, Stem
Giambanco, I., and Donato, R. (1994) Mechanism
Cell Rev. Rep., 17, 1855-1873, doi: 10.1007/s12015-
of S100 protein-dependent inhibition of glial
021-10179-x.
fibrillary acidic protein (GFAP) polymerization,
39. Moretto, G., Xu, R. Y., and Kim, S. U. (1993) CD44
Biochim. Biophys. Acta Mol. Cell Res., 1223, 354-360,
expression in human astrocytes and oligodendrocytes
doi: 10.1016/0167-4889(94)90095-7.
in culture, J. Neuropathol. Exp. Neurol., 52, 419-423,
51. Villarreal, A., Seoane, R., González Torres, A.,
doi: 10.1097/00005072-199307000-00009.
Rosciszewski, G., Angelo, M. F., et al. (2014) S100B
40. Dzwonek, J., and Wilczynski, G. M. (2015) CD44:
protein activates a RAGE-dependent autocrine
molecular interactions, signaling and functions in
loop in astrocytes: implications for its role in the
the nervous system, Front. Cell. Neurosci., 9, 175,
propagation of reactive gliosis, J. Neurochem., 131,
doi: 10.3389/fncel.2015.00175.
190-205, doi: 10.1111/jnc.12790.
41. Naruse, M., Shibasaki, K. Yokoyama, S.,
52. Nishiyama, H., Knöpfel, T., Endo, S., and Itohara, S.
Kurachi, M., and Ishizaki, Y.
(2013) Dynamic
(2002) Glial protein S100B modulates long-term
changes of CD44 expression from progenitors
neuronal synaptic plasticity, Proc. Natl. Acad. Sci.
to subpopulations of astrocytes and neurons in
USA, 99, 4037-4042, doi: 10.1073/pnas.052020999.
developing cerebellum, PLoS One,
8, e53109,
53. Heizmann, C. W. (2019) S100 proteins: Diagnostic
doi: 10.1371/journal.pone.0053109.
and prognostic biomarkers in laboratory medicine,
42. Shen, L., Zhao, Z.-Y., Wang, Y.-Z., Ji, S.-P., Liu, X.-
Biochim. Biophys. Acta Mol. Cell Res., 1866, 1197-
P., et al. (2008) Immunohistochemical detection of
1206, doi: 10.1016/j.bbamcr.2018.10.015.
Ndrg2 in the mouse nervous system, NeuroReport.,
54. Ogata, K., and Kosaka, T. (2002) Structural and
19, 927-931, doi: 10.1097/WNR.0b013e32830163d0.
quantitative analysis of astrocytes in the mouse hip-
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
993
pocampus, Neuroscience, 113, 221-233, doi: 10.1016/
reaction to central nervous system injury in mice
S0306-4522(02)00041-6.
lacking glial fibrillary acidic protein and vimentin,
55. Zhang, Z., Ma, Z., Zou, W., Guo, H., Liu, M., et al.
J. Cell Biol., 145, 503-514, doi: 10.1083/jcb.145.3.503.
(2019) The appropriate marker for astrocytes: compar-
68. Gabbiani,
G., Schmid, E., Winter, S.,
ing the distribution and expression of three astrocytic
Chaponnier, C., de Ckhastonay, C., et al. (1981) Vas-
markers in different mouse cerebral regions, Biomed.
cular smooth muscle cells differ from other smooth
Res. Int., 9605265, doi: 10.1155/2019/9605265.
muscle cells: predominance of vimentin filaments and
56. Hachem, S., Aguirre, A., Vives, V., Marks, A.,
a specific alpha-type actin, Proc. Natl. Acad. Sci. USA,
Gallo, V., et al.
(2005) Spatial and temporal
78, 298-302, doi: 10.1073/pnas.78.1.298.
expression of S100B in cells of oligodendrocyte
69. Nagelhus, E. A., Veruki, M. L., Torp, R.,
lineage, Glia, 51, 81-97, doi: 10.1002/glia.20184.
Haug, F.-M., Laake, J. H., et al. (1998) Aquaporin-4
57. Savchenko, V. L., McKanna, J. A., Nikonenko, I. R.,
water channel protein in the rat retina and optic nerve:
and Skibo, G. G. (2000) Microglia and astrocytes in
polarized expression in müller cells and fibrous as-
the adult rat brain: comparative immunocytochemical
trocytes, J. Neurosci., 18, 2506-2519, doi: 10.1523/
analysis demonstrates the efficacy of lipocortin
1
JNEUROSCI.18-07-02506.1998.
immunoreactivity, Neuroscience,
96,
195-203,
70. Nagy, J. I., Patel, D., Ochalski, P. A. Y., and
doi: 10.1016/S0306-4522(99)00538-2.
Stelmack, G. L. (1999) Connexin30 in rodent, cat
58. Rickmann, M., and Wolff, J. R. (1995) S100 pro-
and human brain: selective expression in gray mat-
tein expression in subpopulations of neurons of rat
ter astrocytes, co-localization with connexin43 at
brain, Neuroscience, 67, 977-991, doi: 10.1016/0306-
gap junctions and late developmental appearance,
4522(94)00615-C.
Neuroscience,
88,
447-468, doi:
10.1016/S0306-
59. Zimmer, D. B., Chaplin, J., Baldwin, A., and
4522(98)00191-2.
Rast, M. (2005) S100-mediated signal transduction
71. Theis, M., and Giaume, C.
(2012) Connexin-
in the nervous system and neurological diseases, Cell
based intercellular communication and astrocyte
Mol. Biol., 51, 201-214.
heterogeneity, Brain Res., 1487, 88-98, doi: 10.1016/j.
60. Milosevic, A., Liebmann, T., Knudsen, M.,
brainres.2012.06.045.
Schintu, N., Svenningsson, P., et al. (2017) Cell-
72. Neymeyer, V., Tephly, T. R., and Miller, M. W. (1997)
and region-specific expression of depression-related
Folate and 10-formyltetrahydrofolate dehydrogenase
protein p11 (S100a10) in the brain, J. Comp. Neurol.,
(FDH) expression in the central nervous system of
525, 955-975, doi: 10.1002/cne.24113.
the mature rat, Brain Res., 766, 195-204, doi: 10.1016/
61. Zamanian, J. L., Xu, L., Foo, L. C., Nouri, N.,
S0006-8993(97)00528-3.
Zhou, L., et al. (2012) Genomic analysis of reactive
73. Anthony, T. E., and Heintz, N. (2007) The folate
astrogliosis, J. Neurosci., 32, 6391-6410, doi: 10.1523/
metabolic enzyme ALDH1L1 is restricted to the
JNEUROSCI. 6221-11.2012.
midline of the early CNS, suggesting a role in human
62. Furuta, A., Rothstein, J. D., and Martin, L. J.
neural tube defects, J. Comp. Neurol., 500, 368-383,
(1997) Glutamate transporter protein subtypes are
doi: 10.1002/cne.21179.
expressed differentially during rat CNS develop-
74. Waller, R., Woodroofe, M. N., Wharton, S. B., Ince,
ment, J. Neurosci.,
17,
8363-8375, doi:
10.1523/
P. G., Francese, S., et al. (2016) Gene expression
JNEUROSCI.17-21-08363.1997.
profiling of the astrocyte transcriptome in multiple
63. Walz,
W., and Lang, M. K.
(1998)
sclerosis normal appearing white matter reveals a
Immunocytochemical evidence for a distinct GFAP-
neuroprotective role, J. Neuroimmunol., 299, 139-146,
negative subpopulation of astrocytes in the adult
doi: 10.1016/j.jneuroim.2016.09.010.
rat hippocampus, Neurosci. Lett.,
257,
127-130,
75. Sosunov, A. A., Wu, X., Tsankova, N. M.,
doi: 10.1016/S0304-3940(98)00813-1.
Guilfoyle, E., McKhann, G. M., et al.
(2014)
64. Yeh, C.-Y., Verkhratsky, A., Terzieva, S., and
Phenotypic heterogeneity and plasticity of
Rodríguez, J. J.
(2013) Glutamine synthetase in
isocortical and hippocampal astrocytes in the human
astrocytes from entorhinal cortex of the triple
brain, J. Neurosci.,
34,
2285-2298, doi:10.1523/
transgenic animal model of Alzheimer’s disease is not
JNEUROSCI.4037-13.2014.
affected by pathological progression, Biogerontology,
76. Nichols, N. R. (2003) Ndrg2, a novel gene regulated
14, 777-787, doi: 10.1007/s10522-013-9456-1.
by adrenal steroids and antidepressants, is highly
65. Norenberg, M. D., and Martinez-Hernandez, A.
expressed in astrocytes, Ann. NY Acad. Sci., 1007,
(1979) Fine structural localization of glutamine
349-356, doi: 10.1196/annals.1286.034.
synthetase in astrocytes of rat brain, Brain Res., 161,
77. Docampo-Seara, A., Santos-Durán, G. N.,
303-310, doi: 10.1016/0006-8993(79)90071-4.
Candal, E., Ángel, M., and Díaz, R.
(2019)
66. Sancho-Tello, M., Vallés, S., Montoliu, C., Renau-
Expression of radial glial markers (GFAP, BLBP and
Piqueras, J., and Guerri, C. (1995) Developmental
GS) during telencephalic development in the catshark
pattern of GFAP and vimentin gene expression in rat
(Scyliorhinus canicula), Brain Struct. Funct., 224, 33-
brain and in radial glial cultures, Glia, 15, 157-166,
56, doi: 10.1007/s00429-018-1758-2.
doi: 10.1002/glia.440150208.
78. Shibata, T., Yamada, K., Watanabe, M., Ikenaka, K.,
67. Pekny, M., Johansson, C. B., Eliasson, C.,
Wada, K., et al. (1997) Glutamate transporter GLAST
Stakeberg, J., Wallén, Å., et al. (1999) Abnormal
is expressed in the radial glia-astrocyte lineage of
БИОХИМИЯ том 87 вып. 7 2022
994
ГОРИНА и др.
developing mouse spinal cord, J. Neurosci., 17, 9212-
90. Flügge, G, Araya-Callis, C, Garea-Rodriguez, E,
9219, doi: 10.1523/JNEUROSCI.17-23-09212.1997.
Stadelmann-Nessler, C, and Fuchs, E. (2014) NDRG2
79. Belozor, O. S., Yakovleva, D. A., Potapenko, I. V.,
as a marker protein for brain astrocytes, Cell Tissue
Shuvaev, A. N., Smolnikova, M. V., et al. (2019)
Res., 357, 31-41, doi: 10.1007/s00441-014-1837-5.
Extracellular S100 disrupts Bergman glia morphology
91. Desilva, T. M., Billiards, S. S., Borenstein,
and synaptic transmission in cerebellar Purkinje cells,
N. S., Trachtenberg, F. L., Volpe, J. J., et al.
Brain Sci., 9, 80, doi: 10.3390/brainsci9040080.
(2008) Glutamate transporter EAAT2 expression
80. Miyazaki, T., Yamasaki, M., Hashimoto, K.,
is up-regulated in reactive astrocytes in human
Kohda, K., Yuzaki, M., et al. (2017) Glutamate
periventricular leukomalacia, J. Comp. Neurol., 508,
transporter GLAST controls synaptic wrapping by
238-248, doi: 10.1002/cne.21667.
Bergmann glia and ensures proper wiring of Purkinje
92. Xin, W., Mironova, Y. A., Shen, H., Marino,
cells, Proc. Natl. Acad. Sci. USA, 114, 7438-7443,
R. A. M., Waisman, A., et al. (2019) Oligodendrocytes
doi: 10.1073/pnas.1617330114.
support neuronal glutamatergic transmission via
81. Tiburcio-Félix, R., Escalante-López, M., López-Bay-
expression of glutamine synthetase, Cell Rep., 27,
ghen, B., Martínez, D., Hernández-Kelly, L. C.,
2262-2271.e5, doi: 10.1016/j.celrep.2019.04.094.
et al.
(2018) Glutamate-dependent translation-
93. Winchenbach, J., Düking, T., Berghoff, S. A.,
al control of glutamine synthetase in bergmann glia
Stumpf, S. K., Hülsmann, S., et al. (2016) Inducible
cells, Mol. Neurobiol., 55, 5202-5209, doi: 10.1007/
targeting of CNS astrocytes in Aldh1l1-CreERT2
s12035-017-0756-3.
BAC transgenic mice, F1000Res.,
5,
2934,
82. Kommata, V., and Dermon, C. R. (2018) Transient vi-
doi: 10.12688/f1000research.10509.1.
mentin expression during the embryonic development
94. Tuohy, T. M. F., Wallingford, N., Liu, Y., Chan,
of the chicken cerebellum, Int. J. Dev. Neurosci., 65,
F. H., Rizvi, T., et al. (2004) CD44 overexpression by
11-20, doi: 10.1016/j.ij devneu.2017.10.003.
oligodendrocytes: a novel mouse model of inflamma-
83. Pow, D. V., and Barnett, N. L. (1999) Changing
tion-independent demyelination and dysmyelination,
patterns of spatial buffering of glutamate in developing
Glia, 47, 335-345, doi: 10.1002/glia.20042.
rat retinae are mediated by the Müller cell glutamate
95. Porlan, E., Martí-Prado, B., Morante-Redolat, J. M.,
transporter GLAST, Cell Tissue Res., 297, 57-66,
Consiglio, A., Delgado, A. C., et al. (2014) MT5-
doi: 10.1007/s004410051333.
MMP regulates adult neural stem cell functional
84. Yu, J., Zhong, Y., Cheng, Y., Shen, X., Wang, J.,
quiescence through the cleavage of N-cadherin, Nat.
et al. (2011) Effect of high hydrostatic pressure on
Cell. Biol., 16, 629-638, doi: 10.1038/ncb2993.
the expression of glutamine synthetase in rat retinal
96. Akanuma, S., Sakurai, T., Tachikawa, M., Kubo, Y.,
Müller cells cultured in vitro, Exp. Ther. Med., 2, 513-
and Hosoya, K.
(2015) Transporter-mediated
516, doi: 10.3892/etm.2011.239.
L-glutamate elimination from cerebrospinal fluid:
85. Voulgaris, D., Nikolakopoulou, P., and Herland, A.
possible involvement of excitatory amino acid
(2022)
Generation of human iPSC-derived
transporters expressed in ependymal cells and choroid
astrocytes with a mature star-shaped phenotype for
plexus epithelial cells, Fluids Barriers CNS, 12, 11,
CNS modeling, Stem Cell Rev. Rep., doi: 10.1007/
doi: 10.1186/s12987-015-0006-x.
s12015-022-10376-2.
97. Trillo-Contreras, J. L., Toledo-Aral, J. J.,
86. Verkhratsky, A., Marutle, A., Rodríguez-Arella-
Echevarría, M., and Villadiego, J. (2019) AQP1 and
no, J. J., and Nordberg, A. (2015) Glial asthenia and
AQP4 contribution to cerebrospinal fluid homeostasis,
functional paralysis: a new perspective on neurode-
Cells, 8, 197, doi: 10.3390/cells8020197.
generation and Alzheimer’s disease, Neuroscientist,
98. Ren, Y., Ao, Y., O’Shea, T. M., Burda, J. E.,
21, 552-568, doi: 10.1177/1073858414547132.
Bernstein, A. M., et al.
(2017) Ependymal cell
87. Choi, S. R., Roh, D. H., Yoon, S. Y., Kwon,
contribution to scar formation after spinal cord injury
S. G., Choi, H. S., et al. (2016) Astrocyte sig-
is minimal, local and dependent on direct ependymal
ma-1 receptors modulate connexin
43 expres-
injury, Sci. Rep., 7, 41122, doi: 10.1038/srep41122.
sion leading to the induction of below-level me-
99. Garaschuk, O., Milos, R. I., and Konnerth, A. (2006)
chanical allodynia in spinal cord injured mice,
Targeted bulk-loading of fluorescent indicators for
Neuropharmacology,
111,
34-46, doi:
10.1016/
two-photon brain imaging in vivo, Nat. Protoc., 1,
j.neuropharm.2016.08.027.
380-386, doi: 10.1038/nprot.2006.58.
88. Çavdar, S., Köse, B., Sur-Erdem, İ., and Özkan, M.
100. Hideharu, H., and Haruo, M. (1994) Fluorescence im-
(2021) Comparing astrocytic gap junction of
aging of intracellular Ca2+, J. Pharmacol. Toxicol. Meth-
genetic absence epileptic rats with control rats: an
ods, 31, 1-10, doi: 10.1016/1056-8719(94)90023-X.
experimental study, Brain Struct. Funct., 226, 2113-
101. Benediktsson, A. M., Schachtele, S. J., Green,
2123, doi: 10.1007/s00429-021-02310-y.
S. H., and Dailey, M. E. (2005) Ballistic labeling
89. Sandoval, M., Luarte, A., Herrera-Molina, R.,
and dynamic imaging of astrocytes in organotypic
Varas-Godoy, M., Santibáñez, M., et al.
(2013)
hippocampal slice cultures, J. Neurosci. Methods, 141,
The glycolytic enzyme aldolase C is up-regulated in
41-53, doi: 10.1016/j.jneumeth.2004.05.013.
rat forebrain microsomes and in the cerebrospinal
102. Gan, W.-B., Grutzendler, J., Wong, W. T., Wong,
fluid after repetitive fluoxetine treatment, Brain Res.,
R. O. L., and Lichtman, J. W. (2000) Multicolor
1520, 1-14, doi: 10.1016/j.brainres.2013.04.049.
“DiOlistic” labeling of the nervous system using
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
995
lipophilic dye combinations, Neuron, 27, 219-225,
115. Akerboom, J, Chen, T.-W., Wardill, T. J., Tian, L.,
doi: 10.1016/S0896-6273(00)00031-3.
Marvin, J. S., et al.
(2012) Optimization of a
103. Nimmerjahn, A., and Helmchen, F. (2012) In vivo
GCaMP calcium indicator for neural activity im-
labeling of cortical astrocytes with sulforhodamine 101
aging, J. Neurosci., 32, 13819-13840, doi: 10.1523/
(SR101), Cold Spring Harb. Protoc., 2012, 326-334,
JNEUROSCI.2601-12.2012.
doi: 10.1101/pdb.prot068155.
116. Akerboom, J., Carreras Calderón, N., Tian, L.,
104. Schnell, C., Hagos, Y., and Hülsmann, S.
(2012)
Wabnig, S., Prigge, M., et al. (2013) Genetically
Active sulforhodamine 101 uptake into hippocampal
encoded calcium indicators for multi-color
astrocytes, PLoS One, 7, e49398, doi: 10.1371/journal.
neural activity imaging and combination with
pone.0049398.
optogenetics, Front. Mol. Neurosci., 6, 2, doi: 10.3389/
105. Kafitz, K. W., Meier, S. D., Stephan, J., and Rose,
fnmol.2013.00002.
C. R. (2008) Developmental profile and properties of
117. Tallin, Y. N. (2006) Imaging cellular signals in the
sulforhodamine 101 - labeled glial cells in acute brain
heart in vivo: cardiac expression of the high-signal
slices of rat hippocampus, J. Neurosci. Methods, 169,
Ca2+ indicator GCaMP2, Proc. Natl. Acad. Sci. USA,
84-92, doi: 10.1016/j.jneumeth.2007.11.022.
103, 4753-4758, doi: 10.1073/pnas.0509378103.
106. Hagos, L., and Hülsmann, S.
(2016) Unspecific
118. Tian, L., Hires, S. A., Mao, T., Huber, D., Chiappe,
labelling of oligodendrocytes by sulforhodamine 101
M. E., et al. (2009) Imaging neural activity in worms,
depends on astrocytic uptake via the thyroid hormone
flies and mice with improved GCaMP calcium
transporter OATP1C1 (SLCO1C1), Neurosci. Lett.,
indicators, Nat. Methods, 6, 875-881, doi: 10.1038/
631, 13-18, doi: 10.1016/j.neulet.2016.08.010.
nmeth.1398.
107. Dieck, S. T., Heuer, H., Ehrchen, J., Otto, C., and
119. Akerboom, J.
(2012) Optimization of a GCaMP
Bauer, K. (1999) The peptide transporter PepT2 is
calcium indicator for neural activity imag-
expressed in rat brain and mediates the accumu-
ing, J. Neurosci.,
32,
13819-13840, doi:
10.1523/
lation of the fluorescent dipeptide derivative be-
JNEUROSCI.2601-12.2012.
ta-Ala-Lys-Nepsilon-AMCA in astrocytes, Glia, 25,
120. Schulze, W., Hayata-Takano, A., Kamo, T.,
10-20, doi: 10.1002/(sici)1098-1136(19990101)25:1
Nakazawa, T., Nagayasu, K., et al.
(2015)
<10::aid-glia2>3.0.co;2-y.
Simultaneous neuron- and astrocyte-specific
108. Preston, A. N., Farr, J. D., O’Neill, B. K., Thomp-
fluorescent marking, Biochem. Biophys. Res. Commun.,
son, K. K., Tsirka, S. E., et al. (2018) Visualizing
459, 81-86, doi: 10.1016/j.bbrc.2015.02.073
the brain’s astrocytes with diverse chemical scaf-
121. John Lin, C.-C., Yu, K., Hatcher, A., Huang, T.-
folds, ACS Chem. Biol., 13, 1493-1498, doi: 10.1021/
W., Lee, H. K., et al.
(2017) Identification of
acschembio.8b00391.
diverse astrocyte populations and their malignant
109. Suzuki, R., Watanabe, J., Arata, S., Funahashi, H.,
analogs, Nat. Neurosci., 20, 396-405, doi: 10.1038/
Kikuyama, S., et al. (2003) A transgenic mouse
nn.4493.
model for the detailed morphological study of
122. Batiuk, M. Y., Martirosyan, A., Wahis, J., de Vin, F.,
astrocytes, Neurosci. Res., 47, 451-454, doi: 10.1016/
Marneffe, C., et al.
(2020) Identification of re-
j.neures.2003.08.008.
gion-specific astrocyte subtypes at single cell res-
110. Vives, V., Alonso, G., Solal, A. C., Joubert, D., and
olution, Nat. Commun.,
11,
1220, doi:
10.1038/
Legraverend, C.
(2003) Visualization of S100B-
s41467-019-14198-8.
positive neurons and glia in the central nervous system
123. Lovatt, D., Sonnewald, U., Waagepetersen,
of EGFP transgenic mice, J. Comp. Neurol., 457, 404-
H. S., Schousboe, A., He, W., et al.
(2007)
419, doi: 10.1002/cne.10552.
The transcriptome and metabolic gene signature of
111. Hirrlinger, P. G., Scheller, A., Braun, C., Quintela-
protoplasmic astrocytes in the adult murine cortex,
Schneider, M., Fuss, B., et al. (2005) Expression of
J. Neuroscience,
27,
12255-12266, doi:
10.1523/
reef coral fluorescent proteins in the central nervous
JNEUROSCI.3404-07.2007.
system of transgenic mice, Mol. Cell. Neurosci., 30,
124. Christopherson, K. S., Ullian, E. M., Stokes,
291-303, doi: 10.1016/j.mcn.2005.08.011.
C. C. A., Mullowney, C. E., Hell, J. W., et al. (2005)
112. Nowotschin, S., Eakin, G. S., and Hadjantonakis, A.-
Thrombospondins are astrocyte-secreted proteins that
K.
(2009) Live-imaging fluorescent proteins in
promote CNS synaptogenesis, Cell, 120, 421-433,
mouse embryos: multi-dimensional, multi-spectral
doi: 10.1016/j.cell.2004.12.020.
perspectives, Trends Biotechnol.,
27,
266-276,
125. Ilja Boor, P. K., de Groot, K., Waisfisz, Q.,
doi: 10.1016/j.tibtech.2009.02.006.
Kamphorst, W., Oudejans, C. B. M., et al.
113. Kanemaru, K.
(2016) Visualization of astrocytic
(2005) MLC1: a novel protein in distal astroglial
calcium signals in fine process using an ultrasensitive
processes, J. Neuropathol. Exp. Neurol., 64, 412-419,
calcium indicator YC-Nano50, Folia Pharmacol.
doi: 10.1093/jnen/64.5.412.
Japonica, 147, 190-193, doi: 10.1254/fpj.147.190.
126. Kinboshi, M., Shimizu, S., Mashimo, T.,
114. Miyawaki, A., Llopis, J., Heim, R., McCaffery,
Serikawa, T., Ito, H., et al. (2019) Down-regulation
J. M., Adams, J. A., et al.
(1997) Fluorescent
of astrocytic Kir4.1 Channels during the audiogenic
indicators for Ca2+ based on green fluorescent
epileptogenesis in leucine-rich glioma-inactivated
proteins and calmodulin, Nature,
388,
882-887,
1 (Lgi1) mutant rats, IJMS, 20, 1013, doi: 10.3390/
doi: 10.1038/42264.
ij ms20051013.
БИОХИМИЯ том 87 вып. 7 2022
996
ГОРИНА и др.
127. Chiou, B., Gao, C., Giera, S., Folts, C. J.,
taxonomy revealed by single cell transcriptomics, Nat.
Kishore, P., et al. (2021) Cell type-specific evaluation
Neurosci., 19, 335-346, doi: 10.1038/nn.4216.
of ADGRG1/GPR56 function in developmental
140. Bang, J., Kim, H. Y., and Lee, H. (2016) Optogenetic
central nervous system myelination, Glia, 69, 413-423,
and chemogenetic approaches for studying astrocytes
doi: 10.1002/glia.23906.
and gliotransmitters, Exp. Neurobiol., 25, 205-221,
128. Gould, P., and Kamnasaran, D.
(2011)
doi: 10.5607/en.2016.25.5.205.
Immunohistochemical analyses of NPAS3 expression
141. Nagel, G., Szellas, T., Huhn, W., Kateriya, S.,
in the developing human fetal brain, Anat. Histol.
Adeishvili, N., et al. (2003) Channelrhodopsin-2, a
Embryol.,
40,
196-203, doi:
10.1111/j.1439-
directly light-gated cation-selective membrane chan-
0264.2010.01059.x.
nel, Proc. Natl. Acad. Sci. USA, 100, 13940-13945,
129. Kamnasaran, D., Muir, W. J., Ferguson-Smith,
doi: 10.1073/pnas.1936192100.
M. A., and Cox, D. W. (2003) Disruption of the
142. Bekar, L. K., and Walz, W. (1999) Evidence for
neuronal PAS3 gene in a family affected with
chloride ions as intracellular messenger substances in
schizophrenia, J. Med. Genet.,
40,
325-332,
astrocytes, J. Neurophysiol., 82, 248-254, doi: 10.1152/
doi: 10.1136/jmg.40.5.325.
jn.1999.82.1.248.
130. Pieper, A. A., Wu, X., Han, T. W., Estill, S. J.,
143. El-Gaby, M., Zhang, Y., Wolf, K., Schwiening, C. J.,
Dang, Q., et al. (2005) The neuronal PAS domain
Paulsen, O., et al. (2016) Archaerhodopsin selectively
protein 3 transcription factor controls FGF-mediated
and reversibly silences synaptic transmission through
adult hippocampal neurogenesis in mice, Proc. Natl.
altered pH, Cell Rep.,
16,
2259, doi:
10.1016/
Acad. Sci. USA, 102, 14052-14057, doi: 10.1073/
j.celrep.2016.07.057,
pnas.0506713102.
144. Mederos, S., Hernández-Vivanco, A., Ramírez-
131. Linde, K., Aunin, E., Meij er, D., and Bermingham,
Franco, J., Martín-Fernández, M., Navarrete, M.,
J. R. (2013) LGI proteins in the nervous system, ASN
et al.
(2019) Melanopsin for precise optogenetic
Neuro, 5, 167-181, doi: 10.1042/AN20120095.
activation of astrocyte-neuron networks, Glia, 67,
132. Bai, Y., Du, L., Shen, L., Zhang, Y., and Zhang, L.
915-934, doi: 10.1002/glia.23580.
(2009) GPR56 is highly expressed in neural stem cells
145. Van Den Herrewegen, Y., Sanderson, T. M., Sahu, S.,
but downregulated during differentiation, Neuroreport,
De Bundel, D., Bortolotto, Z. A., et al.
(2021)
20, 918-922, doi: 10.1097/WNR. 0b013e32832c92d7.
Side-by-side comparison of the effects of Gq- and
133. Zhang, Y., Chen, K., Sloan, S. A., Bennett,
Gi-DREADD-mediated astrocyte modulation on
M. L., Scholze, A R., et al.
(2014) An RNA-
intracellular calcium dynamics and synaptic plasticity
sequencing transcriptome and
splicing database
in the hippocampal CA1, Mol Brain.,
14,
144,
of glia, neurons, and vascular cells of the cerebral
doi: 10.1186/s13041-021-00856-w.
cortex, J. Neurosci., 34, 11929-11947, doi: 10.1523/
146. Nam, M. H., Won, W., Han, K. S., and Lee, C. J.
JNEUROSCI.1860-14.2014.
(2021) Signaling mechanisms of μ-opioid receptor
134. Giera, S., Luo, R., Ying, Y., Ackerman, S. D., Jeong,
(MOR) in the hippocampus: disinhibition versus
S. J., et al. (2018) Microglial transglutaminase-2
astrocytic glutamate regulation, Cell. Mol. Life Sci.,
drives myelination and myelin repair via GPR56/
78, 415-426, doi: 10.1007/s00018-020-03595-8.
ADGRG1 in oligodendrocyte precursor cells, ELife,
147. Gerasimov, E., Erofeev, A., Borodinova, A.,
7, e33385, doi: 10.7554/eLife.33385.
Bolshakova, A., Balaban, P., et al. (2021) Optogenetic
135. Li, T., Chiou, B., Gilman, C. K., Luo, R., Koshi, T.,
activation of astrocytes-effects on neuronal network
et al. (2020) A splicing isoform of GPR56 mediates
function, Int. J. Mol. Sci., 22, 9613, doi: 10.3390/
microglial synaptic refinement via phosphatidylserine
ij ms22179613.
binding, EMBO J.,
39, e104136, doi:
10.15252/
148. Shen, W., Nikolic, L., Meunier, C., Pfrieger, F.,
embj.2019104136.
and Audinat, E.
(2017) An autocrine puriner-
136. Chung, W.-S., Welsh, C. A., Barres, B. A., and
gic signaling controls astrocyte-induced neuro-
Stevens, B. (2015) Do glia drive synaptic and cognitive
nal excitation, Sci Rep.,
7,
11280, doi:
10.1038/
impairment in disease? Nat. Neurosci., 18, 1539-1545,
s41598-017-11793-x.
doi: 10.1038/nn.4142.
149. Tanaka, K. F., Matsui, K., Sasaki, T., Sano, H.,
137. Chung, W.-S., Clarke, L. E., Wang, G. X., Stafford,
Sugio, S., et al. (2012) Expanding the repertoire
B. K., Sher, A., et al. (2013) Astrocytes mediate
of optogenetically targeted cells with an enhanced
synapse elimination through MEGF10 and MERTK
gene expression system, Cell Rep.,
2,
397-406,
pathways, Nature,
504,
394-400, doi:
10.1038/
doi: 10.1016/j.celrep.2012.06.011.
nature12776.
150. Balachandar, L., Montejo, K. A., Castano, E.,
138. Zhang, Y., Sloan, S. A., Clarke, L. E., Caneda, C.,
Perez, M., Moncion, C., et al. (2020) Simultaneous
Plaza, C. A., et al.
(2016) Purification and
Ca2+ imaging and optogenetic stimulation of cortical
characterization of progenitor and mature human
astrocytes in adult murine brain slices, Curr. Protoc.
astrocytes reveals transcriptional and functional
Neurosci., 94, e110, doi: 10.1002/cpns.110.
differences with mouse, Neuron,
89,
37-53,
151. Ryczko, D., Hanini-Daoud, M., Condamine, S.,
doi: 10.1016/j.neuron.2015.11.013.
Bréant, B. J. B., Fougère, M., et al. (2021) S100β-
139. Tasic, B., Menon, V., Nguyen, T. N., Kim, T. K.,
mediated astroglial control of firing and input
Jarsky, T., et al. (2016) Adult mouse cortical cell
processing in layer 5 pyramidal neurons of the mouse
БИОХИМИЯ том 87 вып. 7 2022
МАРКЕРЫ АКТИВАЦИИ АСТРОЦИТОВ
997
visual cortex, J. Physiol., 599, 677-707, doi: 10.1113/
exosomes: a novel biomarker in cancer detection, Cell
JP280501.
Res., 24, 766-769, doi: 10.1038/cr.2014.44.
152. Shuvaev, A. N., Belozor, O. S., Mozhei, O.,
164. Frühbeis, C., Fröhlich, D., Kuo, W. P.,
Yakovleva D. A., Potapenko, I. V., et al.
(2021)
Amphornrat, J., Thilemann, S., et al.
(2013)
Chronic optogenetic stimulation of Bergman glia
Neurotransmitter-triggered transfer of exosomes
leads to dysfunction of EAAT1 and Purkinje cell
mediates oligodendrocyte-neuron communication,
death, mimicking the events caused by expression of
PLoS Biol.,
11, e1001604, doi:
10.1371/journal.
pathogenic ataxin-1, Neurobiol. Dis., 154, 105340,
pbio.1001604.
doi: 10.1016/j.nbd.2021.105340.
165. Luo, X., Jean-Toussaint, R., Sacan, A., and Ajit,
153. Iwai, Y., Ozawa, K., Yahagi, K., Mishima, T.,
S. K.
(2021) Differential RNA packaging into
Akther, S., et al. (2021) Transient astrocytic Gq
small extracellular vesicles by neurons and astro-
signaling underlies remote memory enhancement,
cytes, Cell. Commun. Signal., 19, 75, doi: 10.1186/
Front. Neural Circuits, 15, 658343, doi: 10.3389/
s12964-021-00757-4.
fncir.2021.658343.
166. Escartin, C., Galea, E., Lakatos, A., O’Callaghan,
154. Takata, N., Sugiura, Y., Yoshida, K., Koizumi, M.,
J. P., Petzold, G. C., et al. (2021) Reactive astrocyte
Hiroshi, N., et al.
(2018) Optogenetic astrocyte
nomenclature, definitions, and future directions, Nat.
activation evokes BOLD fMRI response with oxygen
Neurosci.,
24,
312-325, doi:
10.1038/s41593-020-
consumption without neuronal activity modulation,
00783-4.
Glia, 66, 2013-2023, doi: 10.1002/glia.23454.
167. Pekny, M., and Pekna, M. (2016) Reactive gliosis
155. Moshkforoush, A., Lakshmini B., Moncion C.,
in the pathogenesis of CNS diseases, Biochim.
Montejo K. A., and Riera, J. (2021) Unraveling
Biophys. Acta,
1862,
483-491, doi:
10.1016/
ChR2-driven stochastic Ca2+ dynamics in astrocytes:
j.bbadis.2015.11.014.
a call for new interventional paradigms, PLoS
168. Gangisetty, O, Cabrera, M. A., and Murugan, S.
Comput. Biol., 17, e1008648, doi: 10.1371/journal.
(2018) Impact of epigenetics in aging and age related
pcbi.1008648.
neurodegenerative diseases, Front. Biosci. (Landmark
156. Hara, M., Kobayakawa, K., Ohkawa, Y.,
Ed), 23, 1445-1464, doi: 10.2741/4654.
Kumamaru, H., Yokota, K., et al. (2017) Interaction
169. Zumkehr, J., Rodriguez-Ortiz, C. J., Medeiros, R,
of reactive astrocytes with type I collagen induces
and Kitazawa, M. (2018) Inflammatory cytokine,
astrocytic scar formation through the integrin-N-
IL-1β, regulates glial glutamate transporter via
cadherin pathway after spinal cord injury, Nat. Med.,
microRNA-181a in vitro, J. Alzheimer’s Dis., 63, 965-
23, 818-828, doi: 10.1038/nm.4354.
975, doi: 10.3233/JAD-170828.
157. Li, T., Chen, X., Zhang, C., Zhang, Y., and Yao, W.
170. Guedes, J. R., Custódia, C. M., Silva, R. J., de
(2019) An update on reactive astrocytes in chronic
Almeida, L. P., Pedroso de Lima, M. C., et al.
pain, J. Neuroinflammation, 16, 140, doi: 10.1186/
(2014) Early miR-155 upregulation contributes to
s12974-019-1524-2.
neuroinflammation in Alzheimer’s disease triple
158. Liddelow, S. A., Guttenplan, K. A., Clarke, L. E.,
transgenic mouse model, Hum. Mol. Genet., 23, 6286-
Bennett, F. C., Bohlen, C. J., et al. (2017) Neurotoxic
6301, doi: 10.1093/hmg/ddu348.
reactive astrocytes are induced by activated microglia,
171. Chu, Y. Y., Ko, C. Y., Wang, W. J., Wang, S. M.,
Nature, 541, 481-487, doi: 10.1038/nature21029.
Gean, P. W., et al. (2016) Astrocytic CCAAT/en-
159. Jang, E., Kim, J.-H., Lee, S., Kim, J.-H., Seo, J.-
hancer binding protein δ regulates neuronal viability
W., et al. (2013) Phenotypic Polarization of activated
and spatial learning ability via miR-135a, Mol. Neuro-
astrocytes: the critical role of lipocalin-2 in the
biol., 53, 4173-4188, doi: 10.1007/s12035-015-9359-z.
classical inflammatory activation of astrocytes,
172. Cressatti, M., Song, W., Turk, A. Z., Garabed,
J. Immunol.,
191,
5204-5219, doi:
10.4049/
L. R., Benchaya, J. A., et al. (2019) Glial HMOX1
jimmunol.1301637.
expression promotes central and peripheral
160. Lee, S., Jha, M. K., and Suk, K. (2015) Lipocalin-2
α-synuclein dysregulation and pathogenicity in
in THE Inflammatory activation of brain astrocytes,
parkinsonian mice, Glia, 67, 1730-1744, doi: 10.1002/
Crit. Rev. Immunol.,
35,
77-84, doi:
10.1615/
glia.23645.
CritRevImmunol.2015012127.
173. Varcianna, A., Myszczynska, M. A., Castelli, L. M.,
161. Jonas, S., and Izaurralde, E.
(2015) Towards a
O’Neill, B., Kim, Y., et al. (2019) Micro-RNAs
molecular understanding of microRNA-mediated
secreted through astrocyte-derived extracellular
gene silencing, Nat. Rev. Genet.,
16,
421-433,
vesicles cause neuronal network degeneration
doi: 10.1038/nrg3965.
in C9orf72 ALS, EBioMedicine,
40,
626-635,
162. Bartel, D. P., and Chen, C.-Z. (2004) Micromanagers
doi: 10.1016/j.ebiom.2018.11.067.
of gene expression: the potentially widespread
174. Hoye, M. L., Regan, M. R., Jensen, L. A., Lake,
influence of metazoan microRNAs, Nat. Rev. Genet.,
A. M., Reddy, L. V., et al. (2018) Motor neuron-
5, 396-400, doi: 10.1038/nrg1328.
derived microRNAs cause astrocyte dysfunction in
163. Thakur, B. K., Zhang, H., Becker, A., Matei, I.,
amyotrophic lateral sclerosis, Brain, 141, 2561-2575,
Huang, Y., et al. (2014) Double-stranded DNA in
doi: 10.1093/brain/awy182.
БИОХИМИЯ том 87 вып. 7 2022
998
ГОРИНА и др.
ASTROCYTE ACTIVATION MARKERS
Review
Y. V. Gorina1,2*, A. B. Salmina1,2,3, A. I. Erofeev1, E. I. Gerasimov1, A. V. Bolshakova1,
P. M. Balaban1,4, I. B. Bezprozvanny1,5, and O. L. Vlasova1
1 Laboratory of Molecular Neurodegeneration, Peter the Great St. Petersburg Polytechnic University,
194021 St. Petersburg, Russia
2 Research Institute of Molecular Medicine and Pathobiochemistry,
Krasnoyarsk State Medical University named after Professor V.F. Voino-Yasenetsky,
660022 Krasnoyarsk, Russia; e-mail: yana_20@bk.ru
3 Laboratory of Neurobiology and Tissue Engineering,
Brain Institute, Research Center of Neurology, 105064 Moscow, Russia
4 Laboratory of Cellular Neurobiology of Learning, Institute of Higher Nervous Activity,
117485 Moscow, Russia
5 Department of Physiology, University of Texas Southwestern Medical Center,
75390 Dallas, USA
Astrocytes are the most common type of glial cells that provide homeostasis and protection of the central nervous
system. Important specific characteristic of astrocytes is the manifestation of morphological heterogeneity,
which is directly dependent on the localization in a particular area of the brain. Astrocytes can integrate into
neural networks and keep neurons active in various areas of the brain. Moreover, astrocytes express a variety
of receptors, channels, and membrane transporters, which underlie their peculiar metabolic activity, which
determines the plasticity of the central nervous system during development and aging. Such a complex structural
and functional organization of astrocytes determines the use of modern methods for their identification and
analysis. Considering the important fact that determining the most appropriate marker for polymorphic and
multiple subgroups of astrocytes is of decisive importance for the study of their multifunctionality, this review
presents markers, modern imaging techniques and identification of astrocytes. It represents a valuable resource
for studying the structural and functional properties of astrocytes, as well as better understanding the extent to
which astrocytes contribute to neuronal activity.
Keywords: astrocytes, markers, imaging methods, miRNA, optogenetics
БИОХИМИЯ том 87 вып. 7 2022