БИОХИМИЯ, 2022, том 87, вып. 8, с. 1064 - 1076
УДК 577.151
МЕХАНИЗМ ТРАНСЛОКАЦИИ ИОНОВ Na+-РОДОПСИНОМ
Обзор
© 2022 А.В. Богачев*, А.А. Байков, Ю.В. Берцова, М.Д. Мамедов
НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119234 Москва, Россия; электронная почта: bogachev@belozersky.msu.ru
Поступила в редакцию 03.04.2022
После доработки 10.05.2022
Принята к публикации 20.05.2022
В обзоре дано краткое описание структуры и транспортной функции недавно открытого семей-
ства ретиналь-содержащих белков - Na+-транслоцирующих родопсинов. Особое внимание уделе-
но кинетике генерации разности трансмембранных электрических потенциалов в ходе фотоцикла
Na+-родопсина. Рассматриваемый механизм транспорта предполагает, что движущей силой для пе-
ремещения Na+ из цитоплазмы внутрь белка служит локальное электрическое поле, создаваемое пе-
ремещением протона от основания Шиффа.
КЛЮЧЕВЫЕ СЛОВА: Na+-транслоцирующий родопсин, преобразование энергии света, ретиналь, ион-
ная помпа, катионный транспорт.
DOI: 10.31857/S0320972522080061, EDN: AXNDCH
ВВЕДЕНИЕ
териородопсина (bR)
- трансмембранного
белка из галофильной археи Halobacterium
Солнечный свет является основным источ-
salinarum [2, 3]. bR образован тремя одинако-
ником энергии для биосферы Земли. В живой
выми полипептидами с молекулярной массой
клетке энергия света преобразуется на первых
26 кДа. Каждая субъединица построена из семи
этапах в разность окислительно-восстанови-
трансмембранных α-спиралей [4] и содержит
тельных потенциалов (ΔEh) и/или протон-дви-
единственную простетическую группу - оста-
жущую силу (Δp). Поглощение света хлоро-
ток ретиналя, образующий основание Шиффа
филл-содержащими фотосинтетическими реак-
с ε-аминогруппой остатка K216 (рис. 1) и рабо-
ционными центрами [1] сопровождается раз-
тающий как «молекулярный рычаг». Благодаря
делением зарядов и генерацией Δp по механиз-
системе сопряжённых двойных связей остаток
му Митчеловой редокс-петли. Принципиально
ретиналя способен поглощать свет видимого
иной способ преобразования световой энер-
диапазона. Поглощение кванта света вызывает
гии основан на использовании в качестве хро-
цис-транс-изомеризацию ретиналя и создаёт
мофора остатка ретиналя, способного к цис-
конформационное напряжение в соседних с
транс-изомеризации под действием света.
ним участках белка. Затем происходит релак-
Поглощение фотона этим хромофором не
сация в исходное состояние с совершением
приводит к протеканию окислительно-восста-
полезной работы, например транспорта иона.
новительных реакций, и для трансмембранно-
В цикле работы родопсинов-транспортёров
го переноса H+ используется механизм ионной
обратимая изомеризация транс- в цис-фор-
помпы, а не редокс-петли.
му происходит по двойной связи С13=С14, все
Впервые ретиналь-зависимое преобра-
остальные связи сохраняют транс-конфор-
зование энергии света было открыто у бак- мацию. Таким образом, реализуются две кон-
формации ретиналя: (а) полностью транс и
Принятые сокращения: bR
- бактериородопсин;
(б) цис - по связи С13=С14 и транс - по осталь-
hR - галородопсин; NaR - Na+-транслоцирующий ро-
допсин; SB - основание Шиффа; Δψ - трансмембранный
ным двойным связям. Мы будем для краткости
электрический потенциал; Δp - протон-движущая сила.
обозначать переходы между этими конформа-
* Адресат для корреспонденции.
циями как транс → цис и цис → транс.
1064
Na+-РОДОПСИН
1065
Ключевые элементы структуры bR, уча-
а также остатки E194 и R82 (для краткости на
ствующие в светозависимой генерации Δp,
рис. 2, а и далее в тексте весь кластер обозна-
показаны на рис. 2, а. Поглощение фотона
чен как E204). Затем рКа SB повышается до
остатком ретиналя вызывает его транс → цис-
исходного значения, и SB снова протонирует-
изомеризацию, что приводит к понижению рКа
ся, причём для этой цели используется ион Н+,
альдиминной группы (основания Шиффа, SB),
поступающий из цитоплазмы через промежу-
которая протонирована в темновой форме bR.
точный донор протона - остаток D96. Далее
В результате SB депротонируется, и высвобож-
ретиналь возвращается в исходную полностью
дающийся протон переносится на D85, являю-
транс-конформацию, что сопровождается пе-
щийся основным противоионом для положи-
реносом протона от D85 к E204. Циклическое
тельно заряженного SB в темновой форме. Этот
превращение bR обеспечивает, таким образом,
перенос вызывает высвобождение протона в
перенос протона через мембрану [5].
водную фазу снаружи клетки с поверхностно
В галофильных археях был обнаружен ещё
расположенного кластера аминокислотных
один ретиналь-содержащий белок - галоро-
остатков, включающего в свой состав E204,
допсин (hR) [6], являющийся светозависимой
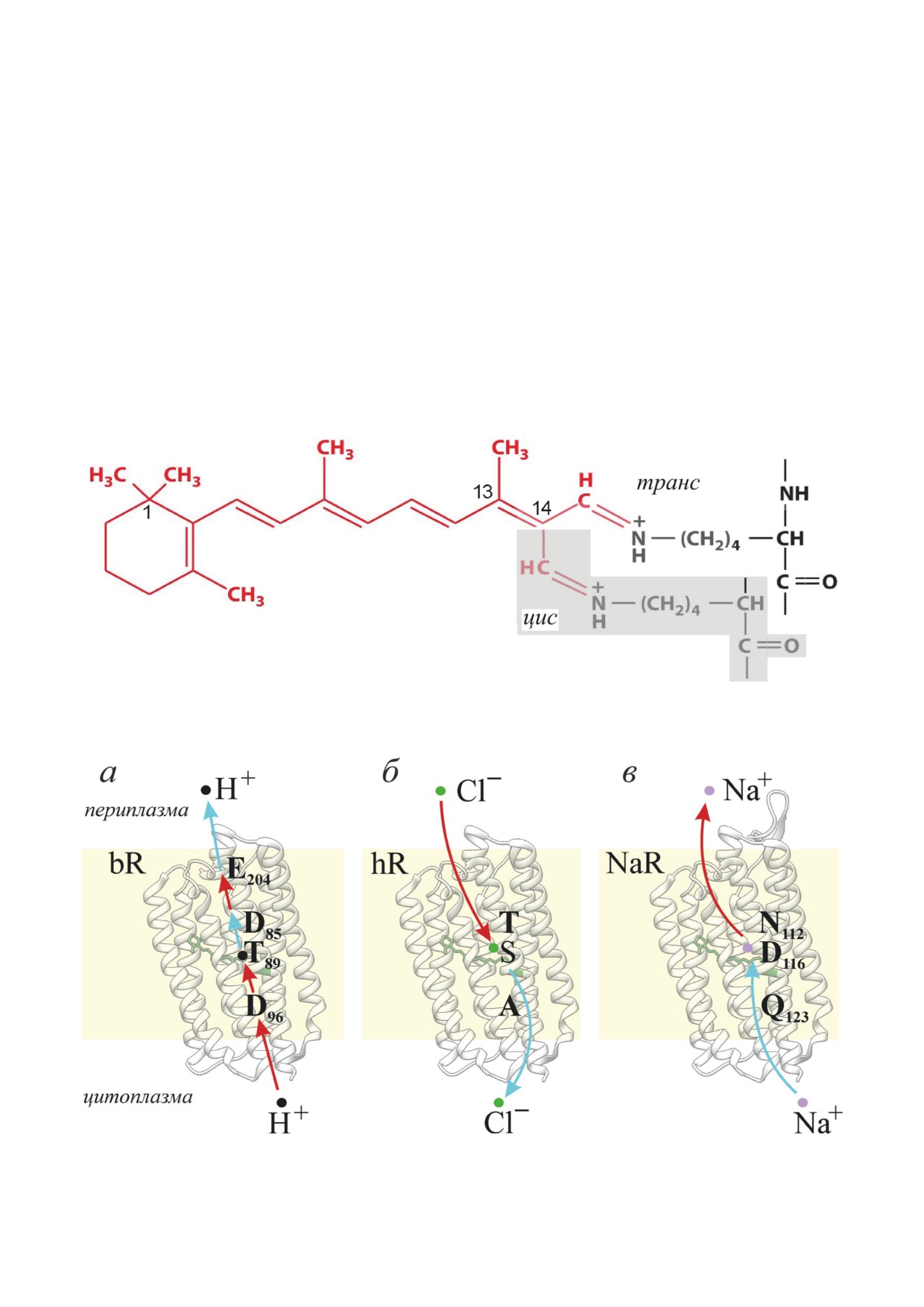
Рис. 1. Структура хромофора бактериородопсина. На белом фоне показан остаток ретиналя, ковалентно присоединён-
ный к остатку лизина, в полностью транс-форме. На сером фоне показан фрагмент структуры в цис-конформации по
связи С13=С14. Нумерация атомов начинается с диметилированного атома углерода β-иононового кольца
Рис. 2. Ионные потоки через цитоплазматическую мембрану прокариот, создаваемые различными родопсинами. Пока-
заны ключевые аминокислотные остатки для bR (а), hR (б) и NaR (в). Пути светозависимого переноса ионов обозначены
стрелками. Синие стрелки указывают движения ионов на ранних стадиях фотоцикла, красные - на завершающих стадиях
5
БИОХИМИЯ том 87 вып. 8 2022
1066
БОГАЧЕВ и др.
Cl--помпой [7]. hR тоже состоит из семи транс-
ве лишь одну простетическую группу. Скорее
мембранных α-спиралей и содержит ковалент-
всего, именно низкая «стоимость» синтеза и
но-связанный остаток ретиналя, находящийся
поддержания этих белков служит причиной их
в полностью транс-конформации и в протони-
частого применения организмами, функцио-
рованном состоянии в темновой форме бел-
нирующими в условиях недостатка каких-либо
ка [8]. Однако при поглощении света hR пе-
нутриентов, например, морскими микроорга-
реносит через мембрану не протон, а ион Cl-,
низмами. Таким образом, ретиналь-зависимые
причём в противоположном направлении - из
генераторы мембранного потенциала играют
внешней среды в цитоплазму (рис. 2, б). Клю-
хотя и подчинённую, но существенную роль в
чевая особенность галородопсина состоит в
преобразовании энергии света в современной
том, что в нём на месте D85 бактериородопсина
биосфере Земли [11].
расположен остаток незаряженной аминокис-
Анализ аминокислотных последователь-
лоты (T или N). Как следствие, hR в темновом
ностей большого количества bR-подобных
состоянии содержит вблизи ретиналя ион Cl-,
белков позволил идентифицировать среди них
выступающий вместо D85 в качестве проти-
группу, типичным представителем которой яв-
воиона протонированному SB [8]. Транс → цис-
ляется белок KR2 из морской флавобактерии
изомеризация ретиналя hR при поглоще-
Krokinobacter eikastus. Отличительной особен-
нии кванта света приводит к высвобождению
ностью этой группы является мотив NDQ, на-
связанного Cl- внутрь клетки. Последующая
званный так по остаткам N112, D116 и Q123 (ну-
цис → транс-реизомеризация сопровождается
мерация KR2), заменяющим, соответственно,
захватом Cl-, но уже с внешней стороны мем-
критически важные для протонного транспор-
браны (рис. 2, б) [9]. Считается, что в hR осно-
та остатки D85, T89 и D96 bR (мотив DTD/E).
вание Шиффа находится в протонированном
Такая замена не могла не сказаться на транс-
состоянии в течение всего фотоцикла. Меха-
портной специфичности, и, действительно,
низмы ионного транспорта у bR и hR довольно
Inoue et al. [12] показали, что KR2, в отличие от
схожи, что подтверждается превращением bR
bR и hR, является светозависимой Na+-помпой
из выкачивающей наружу H+-помпы в дей-
(рис. 2, в). Позже Na+-транслоцирующие ро-
ствующую в обратном направлении Cl--помпу
допсины (NaR) были описаны и у других мор-
в результате одной аминокислотной замены
ских бактерий [13-17]. Из-за потенциальной
D85T [10].
возможности оптогенетического применения
bR и hR менее эффективно преобразуют
этого нового класса белков в паре с хорошо из-
энергию света по сравнению с хлорофилл-со-
вестными ретиналь-зависимыми катионными
держащими фотосинтетическими элек-
каналами в последние годы проводились ин-
трон-транспортными цепями. Так, отношение
тенсивные исследования Na+-родопсинов.
H+↑/hv равно 1 в случае bR и 1,5-2 - для фото-
В данном обзоре мы суммируем имеющие-
синтетических электрон-транспортных цепей.
ся сведения о NaR с акцентом на анализ ки-
Кроме того, у фотосинтетических реакционных
нетики генерации разности трансмембранных
центров выше квантовый выход светоиндуци-
электрических потенциалов в ходе фотоцикла
руемых реакций и, за счёт развитых светосо-
Na+-родопсина. На основе полученных дан-
бирающих антенн, лучше свето-поглощающие
ных предлагается существенно модифициро-
свойства. Поэтому долгое время считалось, что
ванный механизм действия этой уникальной
ретиналь-зависимые генераторы мембранного
натриевой помпы.
потенциала проиграли в ходе эволюционного
отбора хлорофилл-содержащим реакционным
центрам и сохранились лишь в виде реликтов
ТРЁХМЕРНАЯ СТРУКТУРА
в некоторых редких нишах с экстремальными
Na+-ТРАНСЛОЦИРУЮЩЕГО РОДОПСИНА
условиями (например, у галофильных архей).
Однако развитие метагеномных технологий
Вскоре после открытия Na+-транслоци-
позволило установить, что гены подобных бак-
рующих родопсинов была получена серия
териородопсину белков присутствуют у мно-
трёхмерных структур различных форм NaR
гих, прежде всего морских, микроорганизмов.
из K. eikastus с атомным разрешением [18, 19].
Это, по-видимому, связано с удивительной
Оказалось, что они довольно похожи на струк-
простотой устройства и высокой стабильно-
туры bR (RMSD для Cα-атомов - около 1,8 Å).
стью ретиналь-зависимых генераторов транс-
Как и bR, NaR состоит из семи трансмембран-
мембранного потенциала. Эти белки состоят
ных α-спиралей и содержит в качестве хромо-
всего из одного небольшого полипептида и в
фора остаток ретиналя, ковалентно связанный
большинстве случаев содержат в своём соста-
с остатком K255. Однако, в отличие от bR, NaR
БИОХИМИЯ том 87 вып. 8 2022
Na+-РОДОПСИН
1067
образует пентамер, а не тример [18, 20]. Ещё
подготовлена к прохождению цитоплазматиче-
одной отличительной особенностью Na+-ро-
ских ионов в область SB.
допсинов является наличие дополнительной
В области SB наблюдаются и другие важ-
короткой N-концевой α-спирали (N-helix),
ные различия между NaR и bR. Основным про-
экспонированной в периплазму, и видоизме-
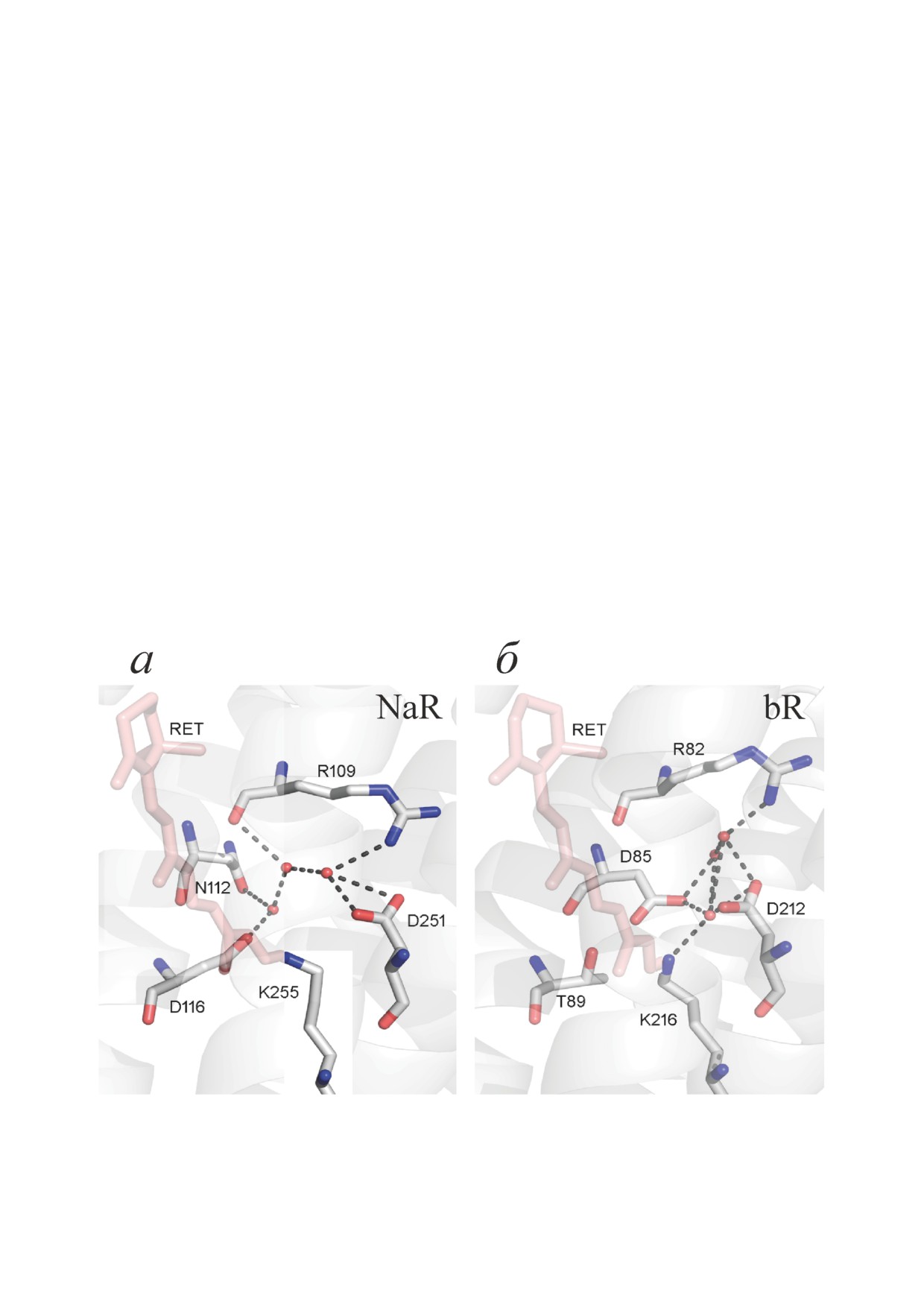
тивоионом SB+ в bR является D85 (рис. 3, б),
нённой периплазматической петли, соеди-
связанный водородной связью с T89 [4]. По-
няющей вторую и третью трансмембранные
скольку в NaR эти остатки заменены на N112
спирали. Эти элементы участвуют в образо-
и D116 [24], положение противоиона для SB+ в
вании периплазматических межсубъединич-
NaR смещено на один виток α-спирали в сто-
ных контактов и важного для олигомеризации
рону цитоплазмы. В bR противоион располага-
Na+/K+-связывающего центра между субъеди-
ется «над» SB, а в NaR - «сбоку» от SB (рис. 3).
ницами [18, 21]. Модификация этих элементов
Смещение противоиона в Na+-родопсине вы-
сайт-направленным мутагенезом влияет на
зывает искривление остатка ретиналя в об-
олигомеризацию и термостабильность NaR, но
ласти SB, который смещается из плоскости
не приводит к существенному изменению его
своего π-сопряжения в противоположном на-
Na+-помпирующей функции [12, 19].
правлении по сравнению со всеми другими ис-
Кроме того, темновая форма NaR отлича-
следованными родопсинами [19, 25].
ется от bR наличием гидрофильной полости,
При близких к нейтральным значениях pH
ведущей от ориентированной в цитоплазму по-
D116 связан в NaR цепью водородных связей
верхности белка к остатку Q123, соответству-
с расположенным «над» SB остатком D251
ющему первичному донору протонов D96 для
(рис. 3, а), являющимся аналогом D212 bR
репротонирования SB в bR. В фотоцикле bR
(рис. 3, б). Аминокислотные остатки, образую-
открытие щели, соединяющей SB с цитоплаз-
щие сеть водородных связей в области SB
мой и, соответственно, обеспечивающей до-
(S70, R109, N112, D116, D251), необходимы для
ступ к остатку D96, происходит кратковремен-
транспорта Na+, мутагенез этих остатков приво-
но, при образовании интермедиата M [22, 23].
дит к существенному замедлению или полному
Таким образом, темновая форма NaR более
прекращению Na+-транспорта [12, 14, 18, 19].
Рис. 3. Фрагменты структур NaR (а) и bR (б) в области основания Шиффа. Остаток ретиналя (RET) показан в виде
стержневой модели розового цвета, молекулы воды обозначены красными сферами, водородные связи, образуемые тре-
мя молекулами воды, - штриховыми линиями. Остатки лизина (K255 или K216) образуют альдиминную связь с остат-
ком ретиналя. Коды PDB соответствующих полных структур NaR и bR - 4XTN (цепь А) и 1C3W. Рисунок создан с
помощью программы Pymol (The PyMOL Molecular Graphics System, Version 2.0, Schrödinger, LLC)
БИОХИМИЯ том 87 вып. 8 2022
5*
1068
БОГАЧЕВ и др.
Важно, что структуры темновой формы NaR не
ФОТОЦИКЛ Na+-ТРАНСЛОЦИРУЮЩИХ
выявили в области SB связанного иона натрия.
РОДОПСИНОВ
Обнаруженный периферический (периплазма-
тический) сайт связывания Na+ (см. выше) не
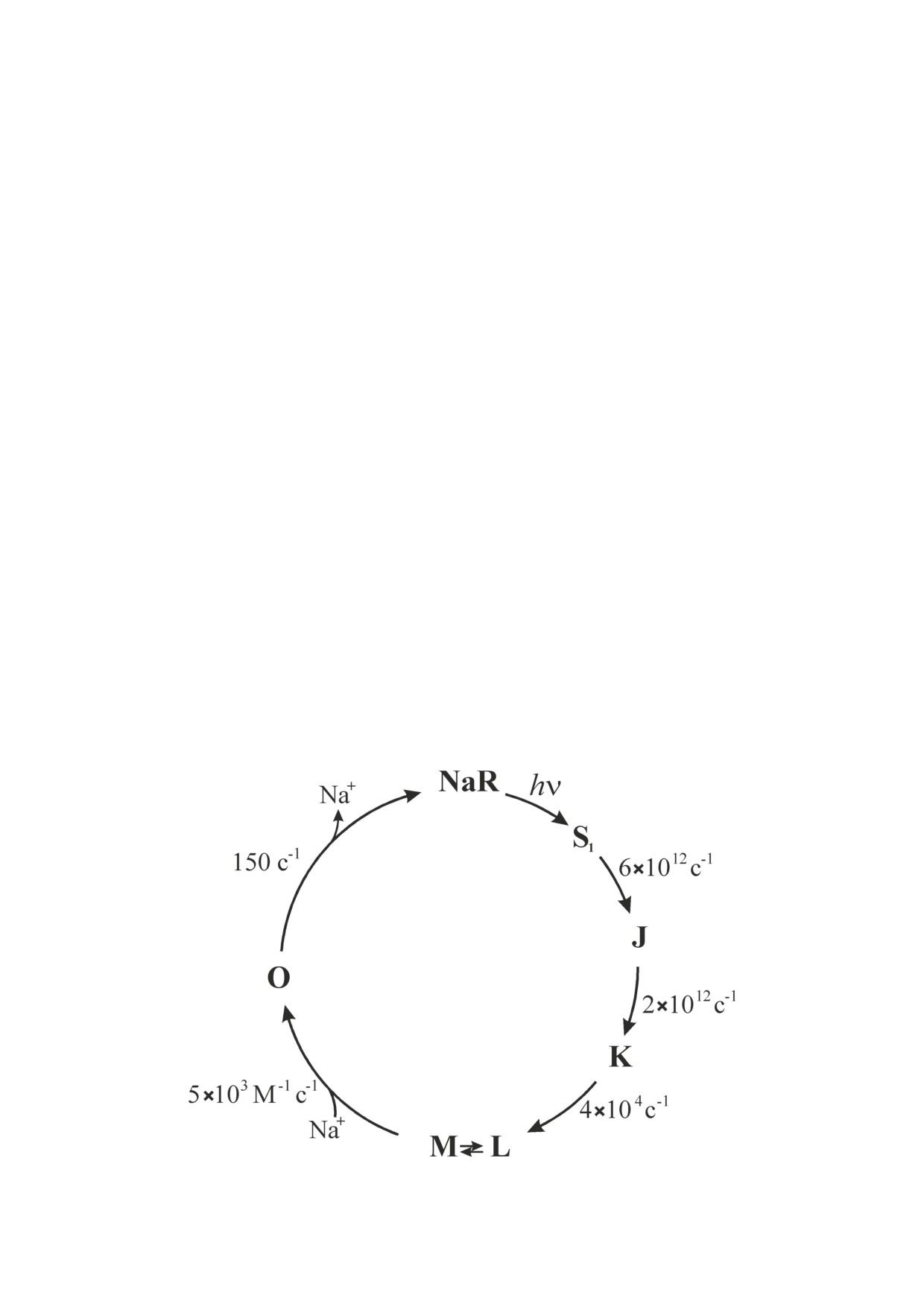
В темновом состоянии остаток ретиналя
участвует в его транслокации, а служит лишь
NaR находится в полностью транс-конфор-
для олигомеризации NaR. На основании этих
мации, и его SB протонирован. Поглощение
данных можно заключить, что связывание
кванта света (максимум поглощения различ-
помпируемого иона Na+ с NaR (в отличие от
ных NaR находится при ~525 нм) приводит к
связывания H+ и Cl- с bR и hR соответствен-
образованию возбуждённого состояния (S1)
но) не наблюдается в темновой форме ро-
и последующей транс
→ цис-изомеризации
допсина, а происходит лишь в ходе фотоцикла
остатка ретиналя с τ = 180 фс (образование
(рис. 2, в) [14, 18, 19].
интермедиата J). Диссипация избыточной
По первичной и третичной структурам
колебательной энергии J приводит к образо-
Na+-родопсины ближе всего к ксантородопси-
ванию первого устойчивого интермедиата K
нам, способным, наряду с ретиналем, связывать
(τ = 500 фс, рис. 4). Эти стадии фотоцикла оди-
дополнительный хромофор (кето-каротино-
наковы для NaR и bR, однако в случае NaR пе-
ид) [26], выступающий в роли светособираю-
реходы S1 → J и J → K происходят, соответствен-
щей антенны [27]. Интересно, что на поверх-
но, в 3 и 6 раз быстрее [30].
ности NaR обнаружена гидрофобная полость,
Далее в фотоцикле NaR происходит депро-
похожая на полость для связывания сали-
тонирование SB и образуется интермедиат М.
никсантина в ксантородопсине из Salinibacter
Регистрируемое количество этого интермедиа-
ruber [18, 19]. Это позволило предположить,
та у NaR (и многих H+-транслоцирующих про-
что in vivo NaR также содержит каротиноидную
теородопсинов [31]) существенно ниже, чем
антенну. Однако дальнейшие исследования не
у bR. Это, возможно, связано с высокой ско-
обнаружили у Na+-родопсина способность свя-
ростью распада M по сравнению со скоростью
зывать антенные каротиноиды [28]. Оказалось,
его образования у протеородопсинов из-за
что этому связыванию препятствует наличие в
образования части цепи водородных связей
NaR объёмного остатка T216 в позиции остатка
между SB и первичным донором протона уже
G201 ксантородопсина S. ruber [29]. Обратная
в темновом состоянии [26, 32]. Однако в слу-
замена T216G сайт-направленным мутагенезом
чае NaR малый выход M, скорее, связан с на-
возвратила NaR из Dokdonia sp. PRO95 утрачен-
личием равновесия между интермедиатами L
ную в ходе эволюции способность связывать
и M (рис. 4) [12]. Скорость образования M в
кето-каротиноид (кантаксантин или эхиненон)
фотоцикле NaR (τ ≈ 25 мкс - два параллель-
и использовать его в качестве антенны [29].
ных процесса с τ1 = 7 мкс и τ2 = 40 мкс) заметно
Рис. 4. Фотоцикл натрий-транслоцирующего родопсина
БИОХИМИЯ том 87 вып. 8 2022
Na+-РОДОПСИН
1069
выше, чем у bR [12, 14, 33]. Это, по-видимому,
СТРУКТУРНЫЕ ОСНОВЫ ПЕРЕНОСА Na+
связано с наличием облегчающей перенос H+
В ХОДЕ ФОТОЦИКЛА NaR
водородной связи между SB+ и первичным ак-
цептором протона (D116) уже в темновом со-
Недавно Skopintsev et al. [41] получили с
стоянии NaR [18, 19]; в случае bR цепь водо-
помощью рентгеновского лазера на свободных
родных связей между SB и D85 формируется
электронах серию структур NaR из K. eikastus
лишь в ходе фотоцикла [34].
на разных стадиях его фотоцикла. Было пока-
Распад M приводит к образованию ин-
зано, что светозависимая транс → цис-изоме-
термедиата O. Это единственная стадия фото-
ризация остатка ретиналя NaR, так же, как и
цикла NaR, скорость которой зависит от кон-
в bR, происходит менее, чем за 2 пс. Однако в
центрации Na+ в среде измерения [12, 14, 33].
NaR ретиналь сдвигается при изомеризации
Отсюда следует, что именно на этой стадии про-
не к цитоплазматической стороне мембраны,
исходит захват этого иона белком. В экспери-
как у bR, а «вбок», к α-спирали 3. Это хорошо
ментах на непроницаемых для Na+ липосомах
согласуется с описанным выше искривлением
было показано, что переход M → O ускоряется
ретиналя в темновой форме NaR в противопо-
лишь под действием ионов Na+, находящих-
ложном направлении по отношению ко всем
ся с «цитоплазматической» стороны мембра-
известным на сегодняшний день родопси-
ны [33]. Зависимость скорости образования
нам [19, 25].
интермедиата O от концентрации Na+ имеет
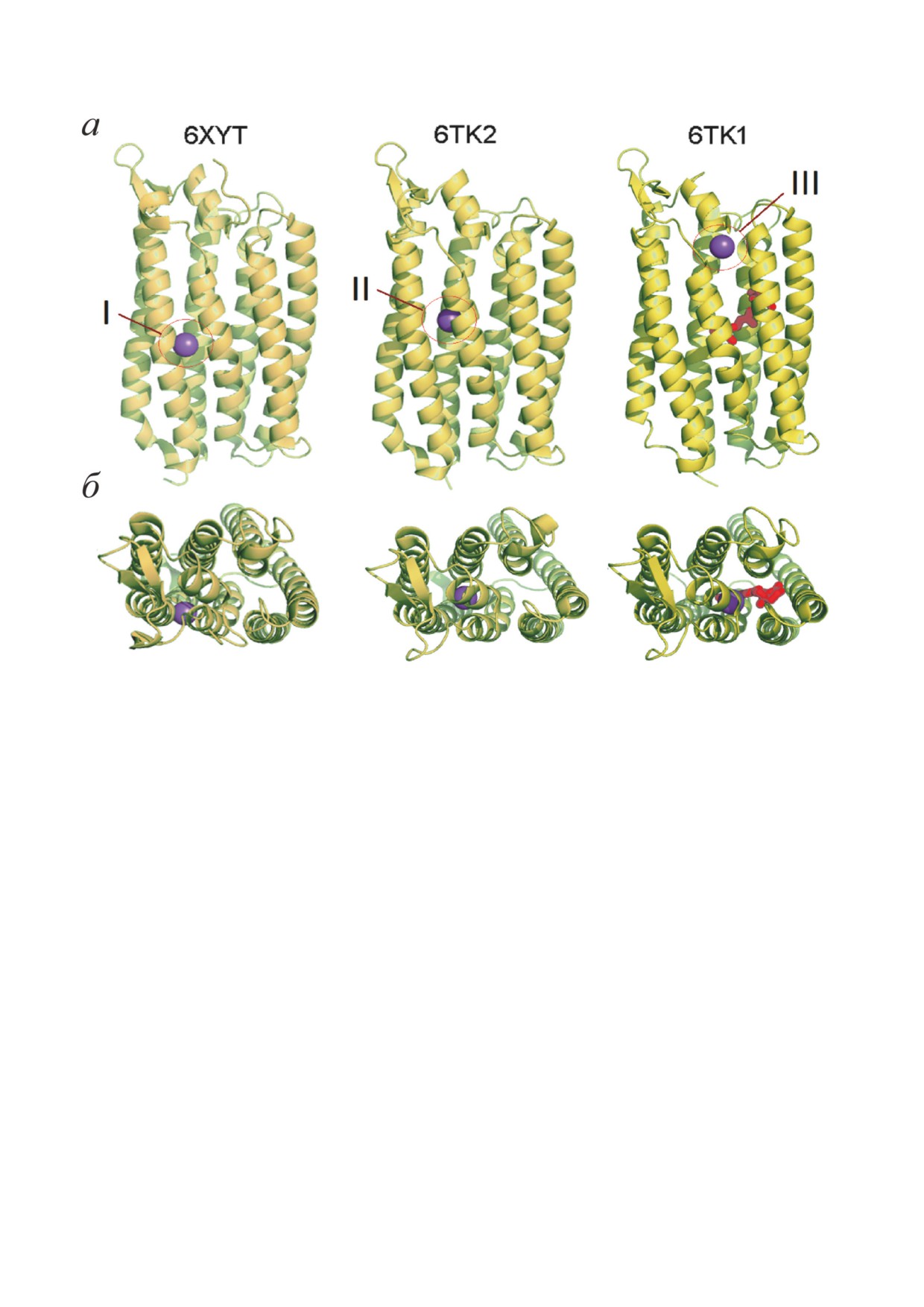
Дальнейшие существенные структур-
строго линейный характер вплоть до 1 M [14,
ные изменения происходят при образова-
33]. Этот факт указывает на отсутствие предре-
нии интермедиата (интермедиатов) O. Через
акционного комплекса с Na+ и лимитирование
1 мс после инициации фотоцикла в структу-
его связывания диффузией катиона к месту
ре NaR обнаруживается ион Na+, связанный
связывания. Бимолекулярная константа ско-
над SB с боковыми группами остатков D251
рости присоединения Na+ (образование интер-
и N112 (рис. 5, центр II). Увеличение времени
медиата О) к NaR из Dokdonia sp. PRO95 (kNa+)
задержки до 20 мс приводило к исчезновению
составляет примерно 5 × 103 M-1 с-1 [33], что
Na+ из центра II и его появлению в новом месте
на 4-6 порядков ниже, чем для диффузион-
связывания вблизи периплазматической по-
но-контролируемой реакции, например, свя-
верхности белка (рис. 5, центр III). В центре III
зывания Na+ на поверхности белка [35-37].
Na+ взаимодействует с боковыми группами
Отсюда следует, что доступ катиона к месту его
остатков E11, N106 и E160. Для связывания Na+
связывания затруднён, вероятно, из-за того,
в обоих центрах важен сдвиг остатков аргинина
что оно расположено внутри NaR.
(R109 - в центре II и R243 - в центре III) [41].
Наблюдение за изомеризацией остатка ре-
Практически одновременно 3D-структура
тиналя в фотоцикле NaR с помощью инфра-
интермедиата O фотоцикла NaR была получе-
красной Фурье- и твердотельной ЯМР-спек-
на с помощью альтернативного метода шоко-
троскопии [14, 38], а также прямые определения
вой заморозки [39]. Этот подход также выявил
3D-структур интермедиатов [39] показали, что
связывание Na+ с NaR в состоянии O. Однако
в интермедиате O этот хромофор находится в
место связывания катиона (центр I на рис. 5)
искажённой полностью транс-конформации.
не совпало с центрами II и III, описанными
Таким образом, реизомеризация ретиналя NaR
Skopintsev et al. [41]. Центр I расположен в не-
происходит на стадии M → O фотоцикла.
посредственной близости от SB, и Na+ в нём
Распад интермедиата O приводит к реге-
координирован боковыми группами S70, N112
нерации исходного темнового состояния NaR,
и D116, а также атомом кислорода пептидной
скорость этой стадии не зависит от концен-
группы остатка V67 [39].
трации Na+ [33]. Так как темновая форма NaR
Различие данных, полученных двумя
не содержит связанного иона натрия [18, 19],
группами
[39,
41], можно объяснить толь-
считается, что переход O → NaR сопряжён с
ко тем, что эти структуры соответствуют
выбросом Na+ с периплазматической сторо-
разным промежуточным состояниям в про-
ны мембраны. Недавно это предположение
цессе переноса Na+. Скорее всего, все три
было подтверждено прямыми эксперимента-
центра связывания Na+ являются функцио-
ми: с помощью Na+-селективной мембраны
нально значимыми, и последовательность
и прямой электрометрии было показано, что
переноса этого иона в NaR такова: цитоплаз-
переход M → O в NaR сопровождается захва-
ма → центр I → центр II → центр III → периплаз-
том Na+ из среды измерения, тогда как переход
ма.Различнаякинетическаяустойчивостьинтер-
O → NaR сопряжён с выбросом иона натрия из
медиатов этого переноса может определяться
белка [40].
разным олигомерным строением NaR в ис-
БИОХИМИЯ том 87 вып. 8 2022
1070
БОГАЧЕВ и др.
Рис. 5. Положения иона Na+ (фиолетовая сфера) в различных структурах NaR из K. eikastus, соответствующих различ-
ным стадиям фотоцикла. а - Вид сбоку; б -вид сверху (с периплазматической стороны мембраны). Различные центры
связывания Na+ указаны римскими цифрами. В правой структуре красным цветом изображен остаток ретиналя. Сверху
приведены коды структур в базе данных PDB [39, 41]
пользованных кристаллах. Skopintsev et al. [41]
белка к области SB [42]. Если это так, то увели-
работали с мономерной формой NaR, тогда
чение входных ворот этого канала на цитоплаз-
как в работе Kovalev et al. [39] этот белок закри-
матической поверхности белка может привести
сталлизовали в виде пентамера. С этим объ-
к появлению способности NaR помпировать
яснением согласуется существенное различие
и бóльшие моновалентные катионы. И дей-
темновых структур NaR в области SB для мо-
ствительно, размер ворот и катионную специ-
номерной и пентамерной форм белка [18].
фичность этого белка удалось изменить заме-
ной N61 и/или G263, находящихся на разных
трансмембранных спиралях, но соседствую-
КАТИОННАЯ СПЕЦИФИЧНОСТЬ
щих на цитоплазматической поверхности NaR,
Na+-РОДОПСИНА
на остатки большего объёма. Замены G263F
и N61P/G263W привели к появлению у NaR
NaR может транспортировать не только
K+-переносящей активности [18, 19], а замена
Na+, но и Li+, а в отсутствие этих катионов -
N61L/G263F придала NaR способность перено-
становится способным к помпированию про-
сить даже такой большой катион, как Cs+ [42].
тонов, хоть и с очень медленным оборотом
Исходя из описанной выше селективно-
фотоцикла [12]. Исходя из такой катионной
сти NaR, можно предположить, что опти-
специфичности, было предположено, что вну-
мальным помпируемым катионом для этого
три белка катионы переносятся в дегидрати-
белка должен быть протон, так как он имеет
рованном виде, и поэтому селективность NaR
наименьший ионный радиус. Действительно,
определяется сечением формирующегося в
в отсутствие Na+ и Li+ NaR проявляет H+-пе-
ходе фотоцикла катион-проводящего канала,
реносящую активность, величина которой
ведущего от цитоплазматической поверхности
зависит от источника Na+-родопсина [12, 14, 17,
БИОХИМИЯ том 87 вып. 8 2022
Na+-РОДОПСИН
1071
43]. Анализ кинетики распада интермедиата M
тив электрического поля. В ферментах дыха-
при различных концентрациях Na+ и значени-
тельной цепи (наиболее подробно это описано
ях pH показал, что переключение с H+-зависи-
для цитохром c-оксидазы) захват помпируемого
мого на Na+-зависимый фотоцикл происходит
катиона может происходить за счёт транспорта
в NaR при концентрациях натрия в десятки
электрона на редокс-активную простетическую
или сотни мкМ и концентрации протонов
группу, находящуюся в мембранной части ка-
меньше 1 мкМ [14, 40, 44]. Таким образом, при
тионной помпы [48-50]. Компенсация заряда
равных концентрациях H+ и Na+ перенос про-
образованного таким образом аниона за счёт
тона более эффективен, а натриевая селектив-
захвата катиона с цитоплазматической стороны
ность NaR in vivo определяется тем, что соот-
мембраны энергетически выгодна, а локальное
ношение концентраций Na+ и H+ в цитоплазме
электрическое поле вокруг аниона может слу-
морских бактерий составляет 3,5 × 106 [44, 45].
жить движущей силой для этого захвата. В ро-
допсинах транспорта электронов не происхо-
дит, что, однако, не исключает возможности
МЕХАНИЗМ ТРАНСМЕМБРАННОГО
использования принципа локальной электро-
ПЕРЕНОСА ИОНА НАТРИЯ
нейтральности стабильных интермедиатов [48].
РОДОПСИНОМ - НОВЫЙ ВЗГЛЯД
И это подтверждается данными, полученными
методом прямой электрометрии.
Ион Na+ помпируется в результате трёх пе-
Этот метод весьма информативен при из-
реходов между разными интермедиатами фо-
учении кинетики трансмембранного переме-
тоцикла NaR. Считается [41, 46], что на первой
щения заряда в ходе каталитического оборота
стадии протон переносится внутри ионной
генераторов мембранного потенциала, в част-
пары, образованной протонированным ос-
ности ферментов фотосинтетических элек-
нованием Шиффа и карбоксилатом D116, что
трон-транспортных цепей, терминальных ок-
нейтрализует взаимодействовавшие заряды и
сидаз и родопсинов [51-54]. В приложении к
увеличивает расстояние между SB и D116. Это
NaR он показал наличие трёх фаз генерации
открывает доступ Na+ из цитоплазмы в про-
электрического потенциала при однократном
межуточный центр связывания внутри белка.
обороте Na+-родопсина из Dokdonia sp. PRO95
Связывание Na+ (при переходе M → O) вызы-
(рис. 6) [33]. Первая фаза (в первом прибли-
вает обратный перенос протона от D116 к SB
с образованием ионной пары, что перекры-
вает канал, связывающий область SB с цито-
плазматической стороной мембраны. Переход
O → NaR уменьшает сродство белка к Na+, что
вызывает его выход в периплазму.
Новые данные позволяют существенно де-
тализировать и дополнить этот механизм, со-
храняя его основу. Прежде всего они позволяют
объяснить способ доставки Na+ из цитоплазмы
внутрь NaR. Исходя из катионной селективно-
сти NaR, считается, что Na+ движется внутрь
белка в дегидратированном виде [42]. Известно,
что дегидратация катионов и их перенос в сре-
ду с низкой диэлектрической проницаемостью
требует затраты очень большого количества
энергии [47]. Более того, при функционирова-
нии NaR in vivo движение Na+ из цитоплазмы к
центру белка происходит при высокой (поряд-
ка 200 мВ) противодействующей трансмембран-
ной разности электрических потенциалов (Δψ).
Этой разности соответствует напряженность
электрического поля внутри мембраны око-
ло 500 кВ/см, что должно сильно затруднить
движение катиона. Таким образом, при функ-
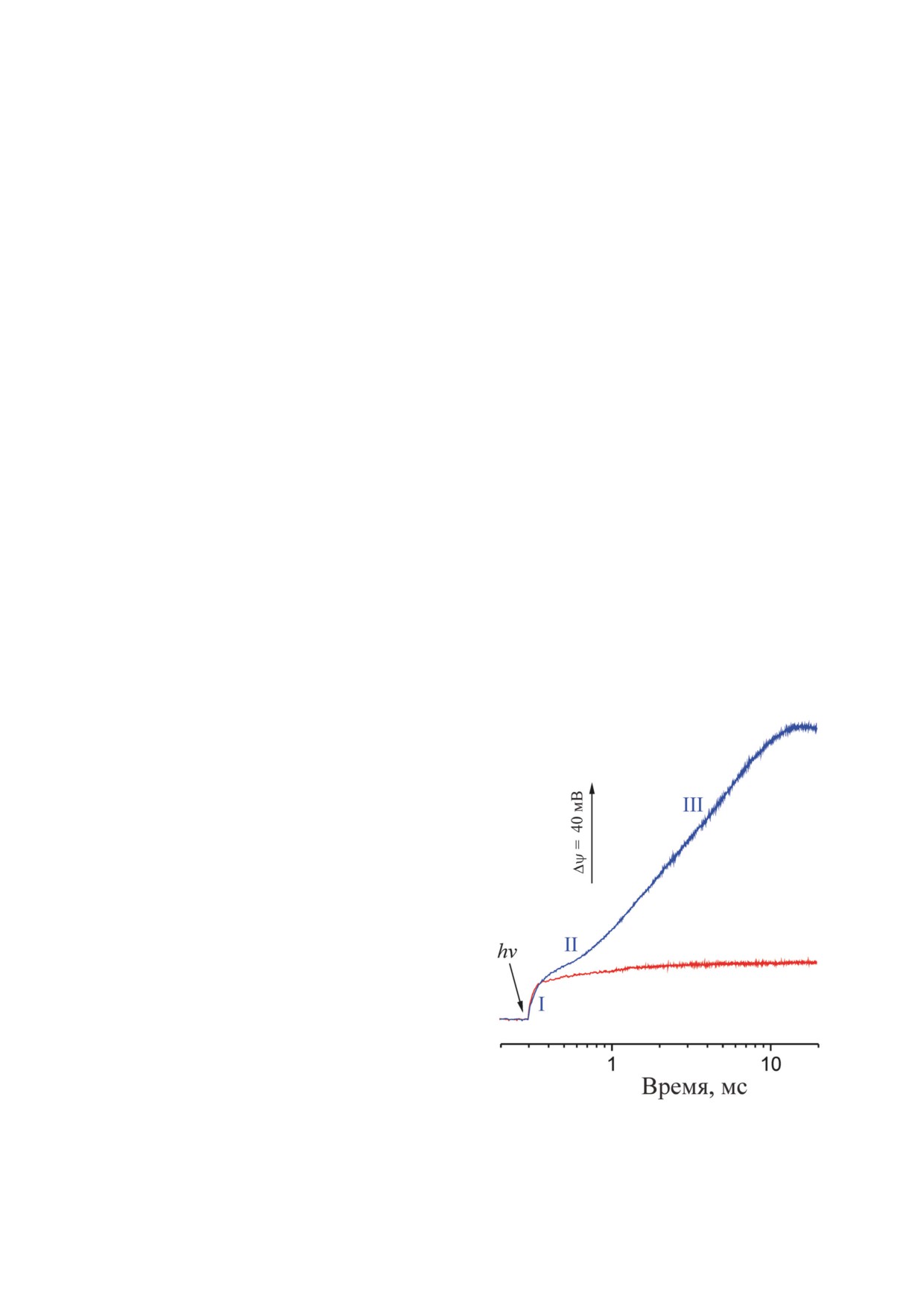
Рис. 6. Генерация Δψ NaR-содержащими протеолипосо-
мами. Показана кинетика генерации Δψ в ответ на ла-
ционировании NaR должна быть какая-то дви-
зерную вспышку (hv) в среде, содержавшей 200 мМ NaCl
жущая сила, обеспечивающая компенсацию
(синяя кривая) или KCl (красная кривая) [33]. Три фазы
энергии дегидратации Na+ и его движения про-
генерации Δψ помечены римскими цифрами
БИОХИМИЯ том 87 вып. 8 2022
1072
БОГАЧЕВ и др.
жении, перенос заряда на ~0,15 толщины мем-
нескомпенсированного отрицательного заряда
браны) соответствовала переходу K → (L ↔ M)
внутри мембраны на остатке D116. Это состо-
фотоцикла NaR. Следует отметить, что оцен-
яние аналогично возникающему в редокс-за-
ка 0,15 является минимальной, так как неиз-
висимой катионной помпе при появлении от-
вестно, насколько равновесие L ⇆ M в NaR
рицательного заряда на электрон-акцепторной
смещено в сторону М. Скорость первой фазы
простетической группе. В электрогенез первой
генерации Δψ не зависела от концентрации Na+
фазы генерации Δψ может вносить вклад и вы-
в среде измерения, однако она замедлялась в
брос протона во внешнюю среду с какой-то
1,4 раза при замене H2O на D2O. На основании
поверхностной группы белка, так как образо-
этих данных был сделан вывод, что первая фаза
вание интермедиата M в NaR из Gillisia limnaea
генерации Δψ связана с перемещением протона
сопровождается закислением среды [14].
внутри белка в сторону периплазмы [33]. Так как
Вторая фаза генерации Δψ (также перенос
SB и первичный акцептор протона D116 распо-
заряда на ~0,15 толщины мембраны) соответ-
ложены практически параллельно поверхности
ствовала образованию интермедиата O [33].
мембраны, то перенос H+ между этими группа-
Эта фаза не наблюдалась при отсутствии Na+ и,
ми не может объяснить высокой электрогенно-
по-видимому, связана с захватом этого иона из
сти перехода K → M. Вероятно, при образова-
цитоплазмы и его связыванием в центре белка.
нии интермедиата M протон не задерживается
Однако низкая амплитуда этого процесса ука-
на D116, а переносится на D251 (рис. 7). Эти
зывает на компенсирующий электрогенный
две группы связаны между собой цепью водо-
процесс, которым может быть обратный транс-
родных связей (рис. 3) [18, 19], поэтому дан-
порт протона от D251 к SB, и это предположе-
ный перенос может протекать быстро по эста-
ние хорошо согласуется с протонированием SB
фетному механизму. Перемещение протона
при распаде интермедиата M. Третья фаза ге-
внутри NaR должно приводить к образованию
нерации Δψ (перенос заряда на ~0,7 толщины
ярко выраженного диполя, то есть практически
мембраны) соответствовала распаду интерме-
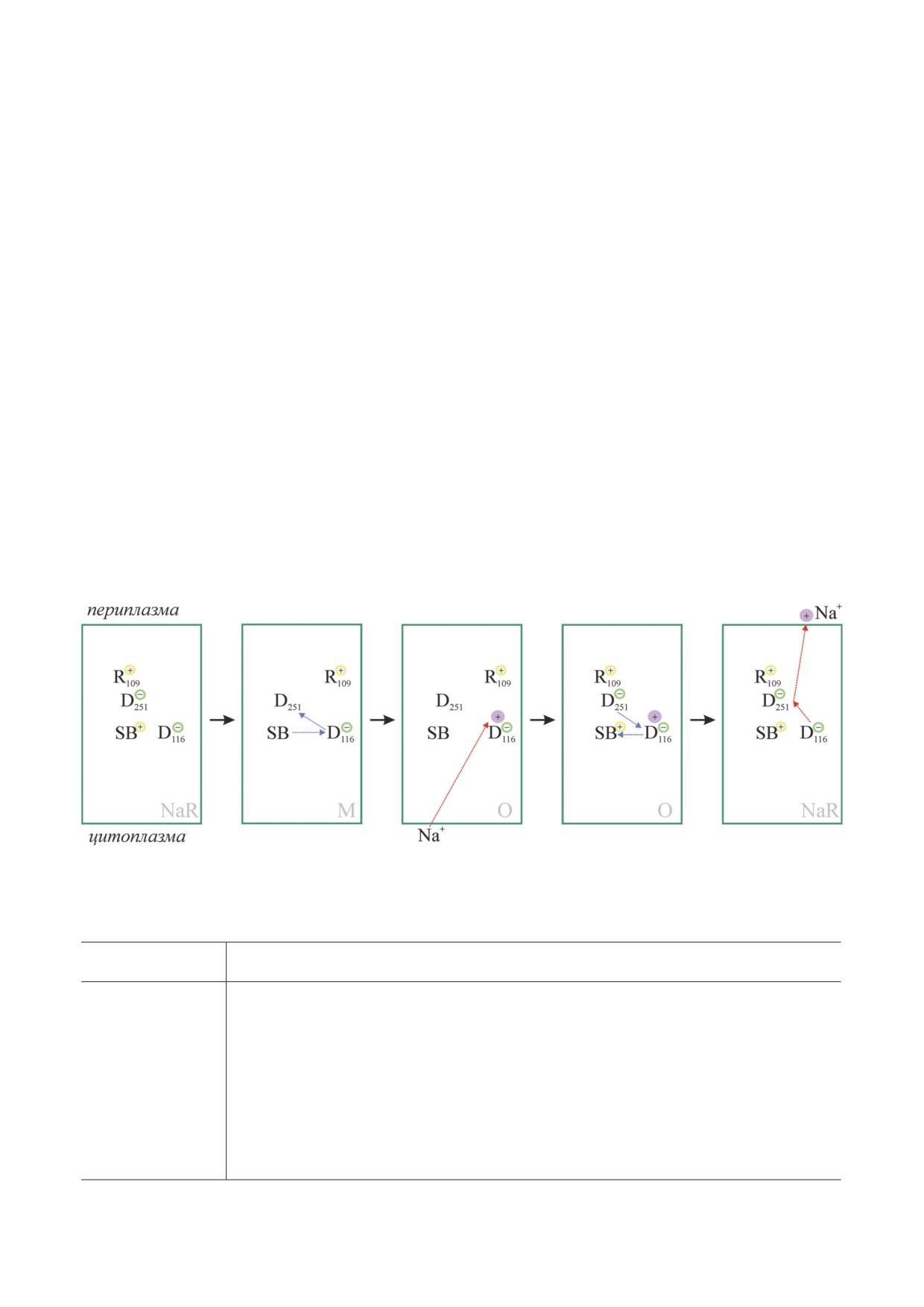
Рис. 7. Механизм работы Na+-родопсина в схематическом виде. Перенос протона показан синими стрелками, перенос
Na+ - красными. Интермедиаты фотоцикла NaR обозначены серым цветом. Указаны также заряды боковых групп клю-
чевых аминокислотных остатков и основания Шиффа (SB)
Описание структурных изменений на трёх стадиях фотоцикла NaR
Стадия фотоцикла
Сопутствующие структурные изменения
основания Шиффа и перенос его протона на D116 и далее -
изомеризация ретиналя, сдвиг рКа
NaR → K → M
на D251; в результате возникает нескомпенсированный отрицательный заряд в области D116 и
открывается канал для входа Na+ из цитоплазмы
под действием электрического поля отрицательного заряда на D116 Na+ проникает в центр свя-
M → O
зывания I внутри белка; обратный транспорт протона от D251 к основанию Шиффа перекры-
вает цитоплазматический канал и вызывает реизомеризацию ретиналя
возврат протона к основанию Шиффа устраняет локальное электрическое поле, что делает на-
хождение Na+ в середине мембраны энергетически невыгодным; Na+ выбрасывается по меха-
O → NaR
низму Кулоновской помпы [49] во внешнюю среду через центры II и III; этому способствует
движение боковых групп R109 и R243 [41], открывающее выходные ворота
БИОХИМИЯ том 87 вып. 8 2022
Na+-РОДОПСИН
1073
диата O [33]. Измеряемая скорость этой фазы
зание уже было экспериментально подтверж-
снижалась практически до нуля при пониже-
дено - одиночная замена Q123E действительно
нии [Na+] или [Li+], на основании чего был сде-
превратила NaR в H+-помпу [55].
лан вывод, что эта фаза связана с выбросом Na+
из белка во внеклеточную среду. Существенно,
что для принятого в настоящее время механиз-
ЗАКЛЮЧЕНИЕ
ма помпирования Na+ [41, 46] следует ожидать
только две сопоставимые по амплитуде фазы
Открытие Na+-транслоцирующего ро-
генерации Δψ, сопряжённые с образованием и
допсина [12] опровергло долго существовав-
распадом интермедиата O и соответствующие
шую догму, что ретиналь-содержащие белки
захвату и выбросу Na+.
могут транспортировать анионы, а из катио-
Уточнённая на основании этих данных схе-
нов - только протон из-за невозможности свя-
ма работы NaR суммирована на рис. 7 и в до-
зывания иного катиона в области положитель-
полняющей его таблице. В предлагаемом ме-
но заряженного SB. Это, а также потенциально
ханизме анион D116 (центр I связывания Na+)
важная роль NaR в оптогенетике [56, 57] вы-
выполняет роль загрузочного центра помпы
звали большой интерес к новому натриевому
(«pump loading site»), пара SB-D116 - роль
переносчику и, как следствие, быстрый про-
регулируемых входных ворот («input gate»), а
гресс в его изучении. NaR представляет собой
R109 и/или R243 - роль регулируемых выход-
одну из простейших ионных помп, поэтому ис-
ных ворот («output gate»). Движущей силой для
следование этого белка вносит существенный
захвата Na+ из цитоплазмы и его перемеще-
вклад в понимание молекулярного механизма
ния в центр I служит локальное электрическое
работы не только ретиналь-зависимых гене-
поле, создаваемое депротонированным остат-
раторов мембранного потенциала, но также и
ком D116, передающим протон от SB на D251.
многих других ионных помп.
Предлагаемый механизм помпирования
NaR хорошо согласуется с описанной выше ка-
тионной селективностью этого белка, так как
Вклад авторов. А.В. Богачев и А.А. Байков
именно электростатические взаимодействия
написали статью. Ю.В. Берцова и М.Д. Маме-
обладают слабой селективностью по отноше-
дов подготовили рисунки и участвовали в об-
нию к взаимодействующим ионам. Также пред-
суждении и редактировании. Все авторы проч-
лагаемый механизм подразумевает, что началь-
ли и одобрили окончательный вариант статьи.
ные этапы работы Na+-транслоцирующего и
Финансирование. Работа выполнена при
H+-транслоцирующего родопсинов очень похо-
финансовой поддержке Министерства науки
жи и заключаются в переносе H+ от SB в направ-
и высшего образования Российской Федера-
лении к периплазматической стороне мембраны.
ции в рамках Соглашения № 075-15-2021-1354
Это указывает на возможность преобразования
от 07.10.2021.
Na+-родопсина в H+-родопсин введением про-
Конфликт интересов. Авторы заявляют об
тонируемой группы (аналога D96 bR) в область
отсутствии конфликта интересов.
катион-переносящего цитоплазматического ка-
Соблюдение этических норм. Настоящая
нала. Такая модификация должна повысить ло-
статья не содержит описания каких-либо ис-
кальную концентрацию протонов в этом канале
следований с участием людей или животных в
и переключить NaR на транспорт протонов даже
качестве объектов.
при высокой концентрации Na+. И это предска-
СПИСОК ЛИТЕРАТУРЫ
1. Blankenship, R. E. (2014) Molecular Mechanisms of
2.3 angstrom resolution, Science, 280, 1934-1937,
Photosynthesis, 2nd Edn., Wiley-Blackwell, Oxford.
doi: 10.1126/science.280.5371.1934.
2. Oesterhelt, D., and Stoeckenius, W.
(1971)
5. Ernst, O. P., Lodowski, D. T., Elstner, M., Hegemann, P.,
Rhodopsin-like protein from the purple membrane
Brown, L. S., et al. (2014) Microbial and animal rhodop-
of Halobacterium halobium, Nat. New Biol., 233, 149-
sins: structures, functions, and molecular mechanisms,
152, doi: 10.1038/newbio233149a0.
Chem. Rev., 114, 126-163, doi: 10.1021/cr4003769.
3. Oesterhelt, D., and Stoeckenius, W. (1973) Functions
6. Matsuno-Yagi, A., and Mukohata, Y. (1977) Two
of a new photoreceptor membrane, Proc. Natl. Acad.
possible roles of bacteriorhodopsin; a comparative
Sci. USA, 70, 2853-2857, doi: 10.1073/pnas.70.10.2853.
study of strains of Halobacterium halobium differing in
4. Luecke, H., Richter, H. T., and Lanyi, J. K. (1998)
pigmentation, Biochem. Biophys. Res. Commun., 78,
Proton transfer pathways in bacteriorhodopsin at
237-243, doi: 10.1016/0006-291x(77)91245-1.
БИОХИМИЯ том 87 вып. 8 2022
1074
БОГАЧЕВ и др.
7.
Schobert, B., and Lanyi, J. K. (1982) Halorhodopsin
21.
Otomo, A., Mizuno, M., Inoue, K., Kandori, H., and
is a light-driven chloride pump, J. Biol. Chem., 257,
Mizutani, Y. (2020) Allosteric communication with
10306-10313, doi: 10.1016/S0021-9258(18)34020-1.
the retinal chromophore upon ion binding in a light-
8.
Kolbe, M., Besir, H., Essen, L. O., and Oesterhelt,
driven sodium ion-pumping rhodopsin, Biochemistry,
D. (2000) Structure of the light-driven chloride pump
59, 520-529, doi: 10.1021/acs.biochem.9b01062.
halorhodopsin at 1.8 Å resolution, Science, 288, 1390-
22.
Skulachev, V. P. (1993) Interrelations of bioenergetic
1396, doi: 10.1126/science.288.5470.1390.
and sensory functions of the retinal proteins,
9.
Kalaidzidis, I. V., Kalaidzidis, Y. L., and Kaulen,
Q. Rev. Biophys.,
26,
177-199, doi:
10.1017/
A. D.
(1998) Flash-induced voltage changes in
s0033583500004066.
halorhodopsin from Natronobacterium pharaonis,
23.
Weinert, T.,
Skopintsev,
P.,
James, D.,
FEBS Lett.,
427,
59-63, doi:
10.1016/s0014-
Dworkowski, F., Panepucci, E., et al. (2019) Proton
5793(98)00394-9.
uptake mechanism in bacteriorhodopsin captured by
10.
Sasaki, J., Brown, L. S., Chon, Y. S., Kandori, H.,
serial synchrotron crystallography, Science, 365, 61-
Maeda, A., et al.
(1995)
Conversion of
65, doi: 10.1126/science.aaw8634.
bacteriorhodopsin into a chloride ion pump, Science,
24.
Inoue, K., Nomura, Y., Kandori, H.
(2016)
269, 73-75, doi: 10.1126/science.7604281.
Asymmetric functional conversion of eubacterial
11.
Béjà, O., Spudich, E. N., Spudich, J. L.,
light-driven ion pumps, J. Biol. Chem., 291, 9883-
Leclerc, M., DeLong, E. F. (2001) Proteorhodopsin
9893, doi: 10.1074/jbc.M116.716498.
phototrophy in the ocean, Nature, 411, 786-789,
25.
Matsuo, J., Kikukawa, T., Fujisawa, T., Hoff, W. D.,
doi: 10.1038/35081051.
Unno, M. (2020) “Watching” a molecular twist in
12.
Inoue, K., Ono, H., Abe-Yoshizumi, R.,
a protein by Raman optical activity, J. Phys. Chem.
Yoshizawa, S., Ito, H., et al. (2013) A light-driven
Lett., 11, 8579-8584, doi: 10.1021/acs.jpclett.0c02448.
sodium ion pump in marine bacteria, Nat. Commun.,
26.
Luecke, H., Schobert, B., Stagno, J., Imasheva, E. S.,
4, 1678, doi: 10.1038/ncomms2689.
Wang, J. M., et al. (2008) Crystallographic structure
13.
Kwon, S. K., Kim, B. K., Song, J. Y., Kwak, M. J.,
of xanthorhodopsin, the light-driven proton pump
Lee, C. H., et al. (2013) Genomic makeup of the
with a dual chromophore, Proc. Natl. Acad. Sci. USA,
marine flavobacterium Nonlabens (Donghaeana)
105, 16561-16565, doi: 10.1073/pnas.0807162105.
dokdonensis and identification of a novel class
27.
Balashov, S. P., Imasheva, E. S., Wang, J. M., and
of rhodopsins, Genome Biol. Evol.,
5,
187-199,
Lanyi, J. K. (2008) Excitation energy-transfer and
doi: 10.1093/gbe/evs134.
the relative orientation of retinal and carotenoid
14.
Balashov, S. P., Imasheva, E. S., Dioumaev, A. K.,
in xanthorhodopsin, Biophys. J.,
95,
2402-2414,
Wang, J. M., Jung, K. H., et al. (2014) Light-driven
doi: 10.1529/biophysj.108.132175.
Na+ pump from Gillisia limnaea: a high-affinity Na+
28.
Bertsova, Y. V., Arutyunyan, A. M., and Bogachev,
binding site is formed transiently in the photocycle,
A. V.
(2016) Na+-translocating rhodopsin from
Biochemistry, 53, 7549-7561, doi: 10.1021/bi501064n.
Dokdonia sp. PRO95 does not contain carotenoid
15.
Bertsova, Y. V., Bogachev, A. V., and Skulachev, V. P.
antenna, Biochemistry (Moscow),
81,
414-419,
(2015) Proteorhodopsin from Dokdonia sp. PRO95 is
doi: 10.1134/S000629791604012X.
a light-driven Na+-pump, Biochemistry (Moscow), 80,
29.
Anashkin, V. A., Bertsova, Y. V., Mamedov, A. M.,
449-454, doi: 10.1134/S0006297915040082.
Mamedov, M. D., Arutyunyan, A. M., et al.
16.
Li, H., Sineshchekov, O. A., da Silva, G. F., and
(2018) Engineering a carotenoid-binding site in
Spudich, J. L.
(2015) In vitro demonstration of
Dokdonia sp. PRO95 Na+-translocating rhodopsin
dual light-driven Na+/H+ pumping by a microbial
by a single amino acid substitution, Photosynth. Res.,
rhodopsin, Biophys. J., 109, 1446-1453, doi: 10.1016/j.
136, 161-169, doi: 10.1007/s11120-017-0453-0.
bpj.2015.08.018.
30.
Tahara, S., Takeuchi, S., Abe-Yoshizumi, R.,
17.
Tsunoda, S. P., Prigge, M., Abe-Yoshizumi, R.,
Inoue, K., Ohtani, H., et al.
(2015) Ultrafast
Inoue, K., Kozaki, Y., et al.
(2017) Functional
photoreaction dynamics of a light-driven sodium-ion-
characterization of sodium-pumping rhodopsins
pumping retinal protein from Krokinobacter eikastus
with different pumping properties, PLoS One, 12,
revealed by femtosecond time-resolved absorption
e0179232, doi: 10.1371/journal.pone.0179232.
spectroscopy, J. Phys. Chem. Lett., 6, 4481-4486,
18.
Gushchin, I., Shevchenko, V., Polovinkin, V.,
doi: 10.1021/acs.jpclett.5b01994.
Kovalev, K., Alekseev, A., et al.
(2015) Crystal
31.
Miranda, M. R., Choi, A. R., Shi, L., Bezerra,
structure of a light-driven sodium pump, Nat. Struct.
A. G. Jr., Jung, K. H., et al. (2009) The photocycle
Mol. Biol., 22, 390-395, doi: 10.1038/nsmb.3002.
and proton translocation pathway in a cyanobacterial
19.
Kato, H. E., Inoue, K., Abe-Yoshizumi, R., Kato, Y.,
ion-pumping rhodopsin, Biophys. J., 96, 1471-1481,
Ono, H., et al.
(2015) Structural basis for Na+
doi: 10.1016/j.bpj.2008.11.026.
transport mechanism by a light-driven Na+ pump,
32.
Morizumi, T., Ou, W. L., Van Eps, N., Inoue, K.,
Nature, 521, 48-53, doi: 10.1038/nature14322.
Kandori, H., et al. (2019) X-ray crystallographic
20.
Shibata, M., Inoue, K., Ikeda, K., Konno, M.,
structure and oligomerization of Gloeobacter
Singh, M., et al. (2018) Oligomeric states of microbial
rhodopsin, Sci. Rep., 9, 11283, doi: 10.1038/s41598-
rhodopsins determined by high-speed atomic force
019-47445-5.
microscopy and circular dichroic spectroscopy, Sci.
33.
Bogachev, A. V., Bertsova, Y. V., Verkhovskaya,
Rep., 8, 8262, doi: 10.1038/s41598-018-26606-y.
M. L., Mamedov, M. D., and Skulachev, V. P. (2016)
БИОХИМИЯ том 87 вып. 8 2022
Na+-РОДОПСИН
1075
Real-time kinetics of electrogenic Na+ transport
46.
Kandori, H., Inoue, K., and Tsunoda, S. P. (2018)
by rhodopsin from the marine flavobacterium
Light-driven sodium-pumping rhodopsin: a new
Dokdonia sp. PRO95, Sci. Rep., 6, 21397, doi: 10.1038/
concept of active transport, Chem. Rev., 118, 10646-
srep21397.
10658, doi: 10.1021/acs.chemrev.7b00548.
34.
Nango, E., Royant, A., Kubo, M., Nakane, T.,
47.
Parsegian, A. (1969) Energy of an ion crossing a
Wickstrand, C., et al. (2016) A three-dimensional
low dielectric membrane: solutions to four relevant
movie of structural changes in bacteriorhodopsin,
electrostatic problems, Nature,
221,
844-846,
Science, 354, 1552-1557, doi: 10.1126/science.aah3497.
doi: 10.1038/221844a0.
35.
Grandjean, J., Laszlo, P., and Gerday, C.
(1977)
48.
Mitchell, R., Mitchell, P., and Rich, P. R. (1992)
Sodium complexation by the calcium binding
Protonation states of the catalytic intermediates of
site of parvalbumin, FEBS Lett.,
81,
376-380,
cytochrome c oxidase, Biochim. Biophys. Acta, 1101,
doi: 10.1016/0014-5793(77)80558-9.
188-191, doi: 10.1016/0005-2728(92)90221-M.
36.
Monoi, H.
(1985) Nuclear magnetic resonance
49.
Popović, D. M., and Stuchebrukhov, A. A. (2004)
of
23Na ions interacting with the gramicidin
Proton pumping mechanism and catalytic cycle
channel, Biophys. J.,
48,
643-662, doi:
10.1016/
of cytochrome c oxidase: coulomb pump model
S0006-3495(85)83820-0.
with kinetic gating, FEBS Lett.,
566,
126-130,
37.
Bogachev, A. V., Bertsova, Y. V., Aitio, O.,
doi: 10.1016/j.febslet.2004.04.016.
Permi, P., and Verkhovsky, M. I. (2007) Redox-
50.
Bogachev, A. V., and Verkhovsky, M. I. (2005) Na+-
dependent sodium binding by the Na+-translocating
translocating
NADH:quinone oxidoreductase:
NADH:quinone oxidoreductase from Vibrio harveyi,
progress achieved and prospects of investigations,
Biochemistry,
46,
10186-10191, doi:
10.1021/
Biochemistry (Moscow), 70, 143-149, doi: 10.1007/
bi700440w.
s10541-005-0093-4.
38.
Jakdetchai, O., Eberhardt, P., Asido, M.,
51.
Dracheva, S. M., Drachev, L. A., Konstantinov,
Kaur, J., Kriebel, C. N., et al. (2021) Probing the
A. A., Semenov, A. Yu., Skulachev, V. P., et al. (1988)
photointermediates of light-driven sodium ion pump
Electrogenic steps in the redox reactions catalyzed
Kr2 by DNP-enhanced solid-state NMR, Sci. Adv., 7,
by photosynthetic reaction-centre complex from
eabf4213, doi: 10.1126/sciadv.abf4213.
Rhodopseudomonas viridis, Eur. J. Biochem., 171, 253-
39.
Kovalev, K., Astashkin, R., Gushchin, I.,
264, doi: 10.1111/j.1432-1033.
Orekhov, P., Volkov, D., et al. (2020) Molecular
52.
Konstantinov, A. A., Siletsky, S., Mitchell, D.,
mechanism of light-driven sodium pumping, Nat. Com-
Kaulen, A., and Gennis, R. B. (1997) The roles
mun., 11, 2137, doi: 10.1038/s41467-020-16032-y.
of the two proton input channels in cytochrome c
40.
Murabe, K., Tsukamoto, T., Aizawa, T., Demura, M.,
oxidase from Rhodobacter sphaeroides probed by the
and Kikukawa, T. (2020) Direct detection of the
effects of site-directed mutations on time-resolved
substrate uptake and release reactions of the light-
electrogenic intraprotein proton transfer, Proc.
driven sodium-pump rhodopsin, J. Am. Chem. Soc.,
Natl. Acad. Sci. USA, 94, 9085-9090, doi: 10.1073/
142, 16023-16030, doi: 10.1021/jacs.0c07264.
pnas.94.17.9085.
41.
Skopintsev, P., Ehrenberg, D., Weinert, T., James, D.,
53.
Kaulen, A. D. (2000) Electrogenic processes and
Kar, R. K., et al. (2020) Femtosecond-to-millisecond
protein conformational changes accompanying the
structural changes in a light-driven sodium pump,
bacteriorhodopsin photocycle, Biochim. Biophys. Acta,
Nature, 583, 314-318, doi: 10.1038/s41586-020-2307-8.
1460, 204-219, doi: 10.1016/s0005-2728(00)00140-7.
42.
Konno, M., Kato, Y., Kato, H. E., Inoue, K.,
54.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P.,
Nureki, O., Kandori, H. (2016) Mutant of a light-
Balashov, S. P., Dolgikh, D. A., et al.
(2016)
driven sodium ion pump can transport cesium
Electrogenic steps of light-driven proton transport
ions, J. Phys. Chem. Lett., 7, 51-55, doi: 10.1021/
in ESR, a retinal protein from Exiguobacterium
acs.jpclett.5b02385.
sibiricum, Biochim. Biophys. Acta, 1857, 1741-1750,
43.
Mamedov, A. M., Bertsova, Y. V., Anashkin, V. A.,
doi: 10.1016/j.bbabio.2016.08.004.
Mamedov, M. D., Baykov, A. A., et al.
(2018)
55.
Mamedov, M. D., Mamedov, A. M., Bertsova,
Identification of the key determinant of the transport
Y. V., and Bogachev, A. V. (2016) A single mutation
promiscuity in Na+-translocating rhodopsins,
converts bacterial Na+-transporting rhodopsin into
Biochem. Biophys. Res. Commun.,
499,
600-604,
an H+ transporter, FEBS Lett.,
590,
2827-2835,
doi: 10.1016/j.bbrc.2018.03.196.
doi: 10.1002/1873-3468.12324.
44.
Kato, Y., Inoue, K., and Kandori, H. (2015b) Kinetic
56.
Grimm, C., Silapetere, A., Vogt, A., Bernal Sierra,
analysis of H+-Na+ selectivity in a light-driven Na+-
Y. A., and Hegemann, P. (2018) Electrical properties,
pumping rhodopsin, J. Phys. Chem. Lett., 6, 5111-
substrate specificity and optogenetic potential of the
5115, doi: 10.1021/acs.jpclett.5b02371.
engineered light-driven sodium pump eKR2, Sci.
45.
Nakamura, T., Kawasaki, S., and Unemoto, T.
Rep., 8, 9316, doi: 10.1038/s41598-018-27690-w.
(1992) Roles of K+ and Na+ in pH homeostasis and
57.
Inoue, K.
(2021) Diversity, mechanism, and
growth of the marine bacterium Vibrio alginolyticus,
optogenetic application of light-driven ion pump
J. Gen. Microbiol., 138, 1271-1276, doi: 10.1099/
rhodopsins, Adv. Exp. Med. Biol.,
1293,
89-126,
00221287-138-6-1271.
doi: 10.1007/978-981-15-8763-4_6.
БИОХИМИЯ том 87 вып. 8 2022
1076
БОГАЧЕВ и др.
MECHANISM OF ION TRANSLOCATION BY Na+-RHODOPSIN
Review
A. V. Bogachev*, A. A. Baykov, Y. V. Bertsova, and M. D. Mamedov
Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; E-mail: bogachev@belozersky.msu.ru
This review provides a brief description of the structure and transport function of the recently discovered
family of retinal-containing Na+-translocating rhodopsins. The main emphasis is put on the kinetics of electric
potential difference generation in the membrane during a single transporter turnover. The proposed transport
mechanism of Na+-rhodopsin posits the local electric field created by the H+ movement from the Schiff base as
the driving force for Na+ capture from the cytoplasm.
Keywords: Na+-translocating rhodopsin, light energy conversion, retinal, ionic pump, cationic transport
БИОХИМИЯ том 87 вып. 8 2022