БИОХИМИЯ, 2022, том 87, вып. 8, с. 1088 - 1099
УДК 577.151
СТРУКТУРНЫЙ ПОДХОД К ПОНИМАНИЮ ЭВОЛЮЦИИ
САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
Обзор
© 2022 Е. Маклашина
University of California, Department of Biochemistry and Biophysics,
San Francisco, CA 94143, USA; e-mail: elena.maklashina@ucsf.edu
Поступила в редакцию 06.05.2022
После доработки 09.06.2022
Принята к публикации 10.06.2022
Семейство комплекса II включает мембраносвязанные сукцинат:хинонредуктазы и хинол:фумарат-
редуктазы, которые катализируют взаимопревращение сукцината и фумарата, сопряжённое с вос-
становлением и окислением хинона. Эти ферменты встречаются во всех типах биологических про-
цессов и имеют сборную структуру, в которой высококонсервативный растворимый домен связан с
прикреплённым к мембране доменом, представленным в различных вариациях. В настоящее время
классификация членов семейства комплекса II основана на числе субъединиц и кофакторов, заяко-
ренных в мембране (типы A-F). Эта классификация также дает представление о возможных путях
эволюции, позволяя предполагать, что некоторые из ферментов комплекса II (типы A-C) эволюцио-
нировали как единое целое. Происхождение типов D и F комплекса II, возможно, было результатом
независимых событий в объединении de novo консервативного растворимого домена с новым мем-
бранным якорем. В настоящей работе мы анализируем последние данные по структуре Mycobacterium
smegmatis Sdh2, фермента комплекса II с двумя трансмембранными субъединицами и двумя молеку-
лами гема b. Этот анализ подтверждает более раннюю гипотезу, согласно которой митохондриаль-
ный комплекс II (тип C) с единственным гемом b, возможно, передался как единое целое от предка,
подобного Sdh2 M. smegmatis.
КЛЮЧЕВЫЕ СЛОВА: сукцинат:убихинонредуктаза, хинол:фумаратредуктаза, комплекс II, сайт связы-
вания хинона, цитохром b.
DOI: 10.31857/S0320972522080085, EDN: AYLBRZ
ВВЕДЕНИЕ
гидрофильные домены содержат дикарбокси-
латный активный центр, представленный в
Семейство ферментов комплекса II пред-
бактериальной цитоплазме или в митохон-
ставляет собой мембраносвязанный белковый
дриальном матриксе. Ферменты комплекса II
комплекс, который катализирует обратимую
участвуют во всевозможных процессах и, в
реакцию окисления сукцината хиноном и вос-
зависимости от предпочтительного направле-
становления фумарата хинолом [1, 2]:
ния катализа, их можно классифицировать как
сукцинат:хинонредуктазы (SQR) или хинол:
сукцинат + Q ↔ фумарат + QH2
фумаратоксидоредуктазы (QFR). SQR жиз-
ненно важны для эукариот и непосредствен-
Ферменты находятся в бактериальных или
но объединяют два основных метаболических
внутренних митохондриальных мембранах, а их пути, а именно цикл Кребса и аэробную ды-
хательную цепь. QFR, напротив, функциони-
руют в анаэробных условиях, когда фумарат
Принятые сокращения: CII - комплекс II; SQR -
может быть использован в качестве конечного
сукцинат:хинонредуктаза; QFR
- хинол:фумаратре-
акцептора электронов. В целом, эти белковые
дуктаза; QP
- проксимальный сайт связывания хи-
комплексы демонстрируют высокую эволю-
нона; QD
- дистальный сайт связывания хинона;
гем bP - проксимальный гем b; гем bD - дистальный гем b;
ционную адаптацию к различным внешним
крио-ЭМ - криоэлектронная микроскопия.
условиям.
1088
ЭВОЛЮЦИЯ САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
1089
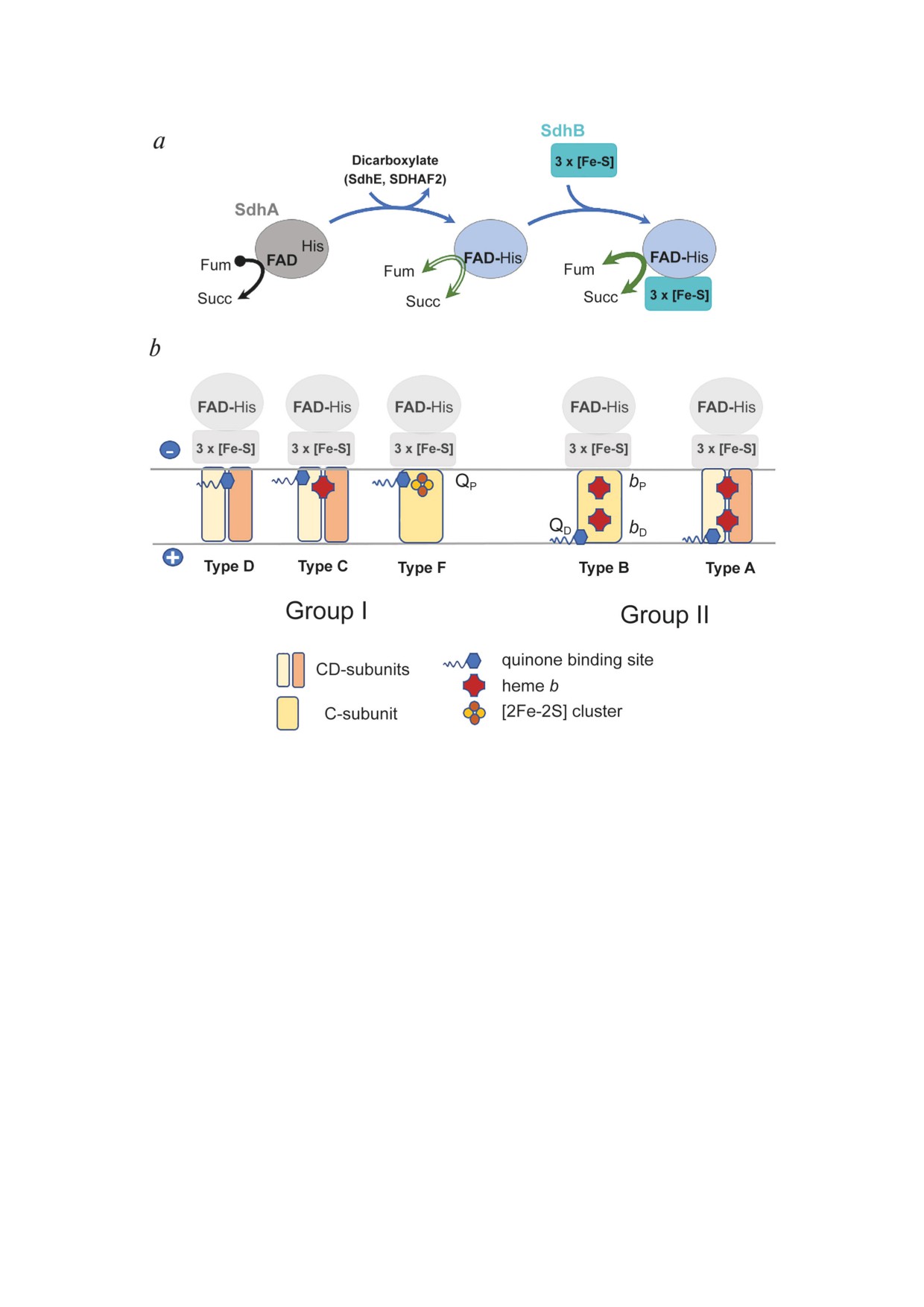
Рис. 1. Сборка растворимого AB-домена и варианты гидрофобных доменов в ферментах комплекса II. a - Ковалент-
ное присоединение FAD к связанному остатку гистидина в A-субъединице требует присутствия дикарбоксилатного
лиганда и, в некоторых случаях, помощи фактора сборки. Соединение со сформированной B-субъединицей образует
стабильный AB-каталитический домен. b - AB-домены сохраняются в семействе комплекса II и окрашены в серый цвет.
Группа I представляет собой гидрофобный домен с проксимальным QP-сайтом, связывающим хинон, а группа 2 демон-
стрирует мембранный домен с двумя гемами b и дистальным QD-сайтом. Классификация ферментов комплекса II (типы
A-F) основана на количестве субъединиц (одна или две) и количестве кофакторов (гем b и кластер [2Fe-2S]) в мембран-
ном якоре, как показано на рисунке. SdhA - A-субъединица сукцинатдегидрогеназного комплекса, SdhB - В-субъеди-
ница сукцинатдегидрогеназного комплекса
СБОРКА КОМПЛЕКСА II
комплекса II [3-5]. Включение центров Fe-S
в субъединицу B происходит с использовани-
Ферменты комплекса II имеют значи-
ем комплекса сборки железосерных кластеров
тельную структурную гомологию и состоят из
[6, 7]. Ковалентное присоединение флавина
гидрофильных и мембранных доменов. Наи-
к субъединице А у большого числа бактерий
больший растворимый домен является гете-
является автокаталитической реакцией, ини-
родимером и состоит из субъединицы фла-
циируемой дикарбоксилатным лигандом, свя-
вопротеина (SdhA, FrdА или A), содержащей
занным в каталитически активном сайте [8]
ковалентно связанный FAD и сайт связыва-
(рис. 1, а). У эукариотов и многих прокариотов
ния дикарбоксилата. Вторая, меньшая субъ-
эта реакция требует дополнительного фактора
единица (SdhB, FrdB или B), содержит три
сборки (называемого SdhE в Escherichia coli и
отдельных железосерных кластера: [2Fe-2S],
SDHAF2 в митохондриях млекопитающих) [9-
[4Fe-4S] и [3Fe-4S]. Кофакторы AB-субъеди-
11]. До сих пор были описаны четыре фактора
ниц, составляющих каталитический домен,
(SDHAF1-4), участвующие в сборке митохон-
формируются независимо в процессе сборки
дриального домена SDHAB [11, 12].
БИОХИМИЯ том 87 вып. 8 2022
1
090
МАКЛАШИНА
Возможно, важнейшим эволюционным
сайта связывания хинона (рис. 1, b). Груп-
событием, которое привело к формирова-
па I включает белки, у которых сайт связыва-
нию комплекса II, является ковалентное при-
ния Q расположен проксимально к [3Fe-4S] в
соединение FAD. Существует ряд гомологов
растворимом домене (QP-сайт). Внутри этой
отдельных субъединиц комплекса II (таких
группы тип D представлен QFR E. coli, для
как флавоцитохром с3 фумаратредуктаза у
которого была получена самая первая рентге-
Shewanella sp. и L-аспартатоксидаза у E. coli),
новская структура среди белков комплекса II
которые могут использовать фумарат для
[19]. Гидрофобный домен FrdCD не имеет
окисления флавина, но не способны окис-
простетических групп, а QP-сайт расположен
лять сукцинат [13, 14]. Примечательно, что
в центре во взаимодействии с FrdB. Тип C
эти ферменты содержат нековалентно свя-
представляет собой классический митохон-
занный FAD, окислительно-восстановитель-
дриальный комплекс II с двумя гидрофобны-
ный потенциал которого существенно не от-
ми субъединицами и одним гемом b. Для него
личается от потенциала свободного флавина
получено большое количество рентгеновских
(Em = -219 мВ). Это делает окисление сукци-
структур, которые включают SQR E. coli [20],
ната (Em = +30 mV) термодинамически невы-
митохондриальные SQR (птиц [21] и свиней
годным. Около 10% всех известных флавопро-
[22]), а также родохинол:фумаратредуктазу
теинов ковалентно связаны с флавином [8].
из нематоды Ascaris suum [23]. Недавно опи-
В целом, ковалентное присоединение флавина
санным примером F-типа является Sdh1 из
происходит с помощью изоаллоксазинового
Mycobacterium smegmatis. Первоначально этот
кольца, и эта модификация значительно повы-
фермент был описан как комплекс II, содер-
шает окислительно-восстановительный потен-
жащий единственную гидрофобную субъеди-
циал флавинов. В случае CII-флавопротеинов
ницу без дополнительных кофакторов [24].
средний потенциал ковалентно присоеди-
Однако структура, полученная недавно с по-
ненного FAD повышается примерно на 100-
мощью криоэлектронной микроскопии, по-
150 мВ в отдельных субъединицах [15] и мем-
казала, что этот комплекс имеет кофактор -
брановязанных комплексах [16]. Обратимое
встроенный в мембрану кластер Риске-типа
превращение сукцината в фумарат в раствори-
[2Fe-2S], расположенный вблизи раствори-
мых каталитических доментах является след-
мого домена [25].
ствием ковалентного присоединения флавина
Группа 2 представляет собой ферменты
к CII-флавопротеинам (рис. 1, а).
комплекса II, содержащие две молекулы гема b
и Q-связывающий сайт, расположенный в дис-
тальном положении (QD-сайт), у положитель-
РАЗНООБРАЗИЕ МЕМБРАННЫХ ЯКОРЕЙ
но заряженной стороны мембраны (рис. 1, b).
В КОМПЛЕКСЕ II
Эта группа включает в себя два типа. Тип В
содержит одиночную трансмембранную субъ-
У различных видов субъединицы A и B де-
единицу и представлен структурами QFRs из
монстрируют высокую степень гомологии по-
Wolinella succinogenes [26] и Desulfovibrio gigas
следовательности и структуры, в то время как
[27]. И, наконец, крио-ЭМ-структура Sdh2
в составе и функциях мембранных доменов
M. smegmatis представляет собой фермент
существуют значительные различия. Роль гид-
типа А, в котором мембранный домен состоит
рофобного домена в ферментах комплекса II
из двух гидрофобных субъединиц [28]. Струк-
заключается в заякоривании AB-димера и об-
тура Sdh2 также содержит дополнительную
разовании каталитического сайта(ов) для вто-
расположенную в мембране небольшую субъ-
рого субстрата - хинона/хинола. Как правило,
единицу SdhF, которую ранее не связывали с
мембранный якорь состоит из одной субъеди-
этим ферментом. В соответствии с их поло-
ницы (SdhC, FrdC или C) или двух меньших
жением два гема b называют проксимальным
полипептидов (SdhCD, FrdCD или CD). Мем-
гемом bP и дистальным гемом bD. Общим свой-
бранный домен часто содержит простетиче-
ством этих дигемовых комплексов II являет-
ские группы, такие как гем b или, в некоторых
ся то, что окислительно-восстановительный
случаях, железосерный кластер.
потенциал гема b (от -45 до +75 мВ) выше,
Разнообразие гидрофобных доменов ста-
чем гема bD (от -175 до -65 мВ) [18]. Посколь-
ло основой для классификации ферментов
ку прямым донором-акцептором электронов
комплекса II [17, 18]. В этой статье мы исполь-
для субстрата является гем bD, эти белки ра-
зуем ту же терминологию, что широко при-
ботают с низкопотенциальными менахинона-
меняется для типов A-F, однако группируем
ми - как менахинол:фумаратредуктазы или
ферменты комплекса II на основе положения
сукцинат:менахинонредуктазы.
БИОХИМИЯ том 87 вып. 8 2022
ЭВОЛЮЦИЯ САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
1091
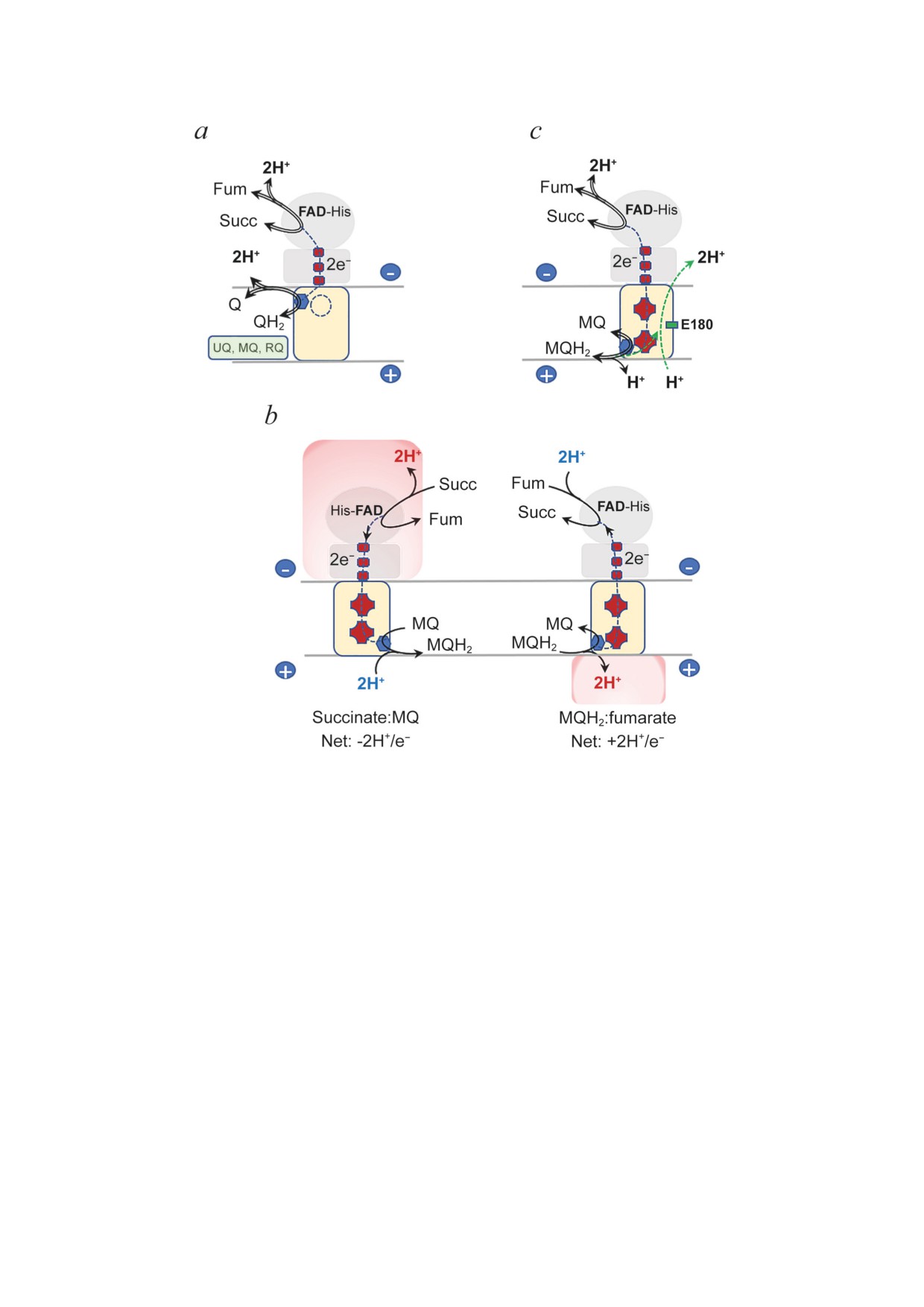
Рис. 2. Поток электронов и протонов в ферментах комплекса II. Перенос двух электронов между активными центрами
в комплексе II связан с высвобождением или расходованием 2H+ в процессе взаимопревращения сукцината/фумарата
и восстановления или окисления хинона/хинола. а - В ферментах из группы I (рис. 1, b) перенос электронов не связан
с электрохимическим мембранным потенциалом (Δp), поскольку все протоны реакции происходят из одного и того же
клеточного компартмента. Пунктирный круг представляет редокс-кофактор, если он присутствует в этой группе ком-
плекса II. В качестве субстрата выступают различные хиноны: убихинон (UQ), менахинон (MQ) и родохинон (RQ).
b - В ферментах двугемового комплекса II, таких как SQR B. subtilis, активные центры разделены мембраной. Реакции
сукцинат:менахинонредуктаза способствует генерации Δp (слева). Обратная реакция окисления менахинола генери-
рует Δp, высвобождая 2H+ в периплазму и поглощая 2H+ в цитоплазме (справа). c - «Гипотеза E-пути», предложенная
для двугемового комплекса II с консервативным остатком глутамата в центре мембранного домена (показано зеленым
квадратом), такого как Glu-C180 в QFR W. succinogenes. Такой механизм обеспечивает компенсаторный перенос двух
протонов (зеленые стрелки) из периплазмы в цитоплазму и уравновешивает дегидрогеназную реакцию в дикарбокси-
латном сайте
В семействе существует еще один тип ком-
СВЯЗЬ ПОТОКА
плекса II, обозначаемый как тип E, который не
ЭЛЕКТРОНОВ И ПРОТОНОВ
обсуждается в настоящей статье. Этот доволь-
В ФЕРМЕНТАХ КОМПЛЕКСА II
но необычный тип (называемый неклассиче-
ским SQR) обнаружен в эпсилон-протеобак-
В ферментах комплекса II перенос элек-
терии W. succinogenes. Этот белок с одиночным
тронов между каталитическими центрами осу-
якорным белком SdhC выходит в периплазма-
ществляется линейно по простетическим груп-
тическое пространство своим растворимым
пам и сопряжен с переносом двух протонов в
доменом, содержащим нековалентно связан-
дикарбоксилатном и хинон-связывающем сай-
ный FAD. Структура этой однонаправленной
тах. Все члены семейства работают по одному и
фумаратредуктазы пока неизвестна [29].
тому же каталитическому механизму в пределах
БИОХИМИЯ том 87 вып. 8 2022
1092
МАКЛАШИНА
растворимого фрагмента AB-дегидрогеназы.
потенциалом. Более того, 2H+/e- будут накап-
Два электрона переносятся в форме гидрида
ливаться с отрицательно заряженной сторо-
между дикарбоксилатным субстратом и FAD
ны цитоплазмы, дополнительно уменьшая Δp.
в субъединице A с последующим ступенчатым
Этот механизм был экспериментально под-
переносом электронов к [Fe-S] центрам в субъ-
твержден исследованиями с использованием
единице B с семихиноном FAD в качестве про-
грамположительных бактерий B. subtilis [32] и
межуточного компонента. В комплексах II из
B. licheniformis [33]. К неожиданности иссле-
группы I восстановление/окисление хинона
дователей, реакция менахинол:фумаратредук-
происходит в QP-сайте, следовательно, потре-
таза, катализируемая другим представителем
бление/высвобождение протонов в каталити-
QFR типа В W. succinogenes, оказалась элек-
ческих центрах происходит в пределах одного
тронейтральной [34]. Рентгеновская структура
и того же компартмента, и результат реакции
этого белка выявила остаток Glu-C180, погру-
оказывается нейтральным (рис. 2, a). Внутри
жённый в центр мембраны и ориентированный
этой группы QFR E. coli (фермент с мембран-
на пропионат C-кольца гема bD в гидрофобной
ным якорем, свободным от кофакторов) свя-
субъединице. Исследования по мутагенезу,
занный хинон непосредственно обменивает-
подтверждающие важность этого остатка для
ся электронами с соседним центром [3Fe-4S].
механизма, привели к появлению так называе-
Присутствие дополнительных редокс-групп в
мой «гипотезы Е-пути». Согласно ей, Glu-C180
мембранном якоре, одиночного гема b (тип C)
как часть менахинол:фумаратредуктазного ме-
или центра Риске (тип F) не нарушает баланс
ханизма облегчает компенсаторный параллель-
протонов. По-видимому, роль этих дополни-
ный обмен протона на электрон из периплазмы
тельных кофакторов в основном структурная.
в цитоплазму (рис. 2, с). Этот остаток сохраня-
Например, каталитически активный SQR E. coli
ется в некоторых ферментах комплекса II, дей-
может быть собран без гема b, когда связанные
ствующих как менахинол:фумаратредуктазы,
с цитохромом гистидины (His) заменяются на
включая недавно полученную рентгенострук-
тирозины (Tyr) [30]. Та же структурная роль
туру другого QFR типа B из анаэробных восста-
центра Риске [2Fe-2S], вероятно, также наблю-
навливающих сульфат бактерий D. gigas [27].
дается у Sdh1 M. smegmatis, однако замены ами-
нокислотных остатков, дестабилизирующих
[2Fe-2S] центр, негативно влияют на сборку
ЭВОЛЮЦИЯ КОМПЛЕКСА II
мембраносвязанного комплекса. Это остав-
ляет открытым вопрос о том, является ли этот
Эволюция комплекса II ставит вопрос,
кластер необходимым для восстановления/
как сохранение растворимого домена в семей-
окисления хинона в этом типе комплекса II.
стве комплекса II соответствует разнообразию
Ферменты комплекса II с QP-сайтом характер-
трансмембранных якорей? Предшествующий
ны для широкого круга организмов, которые
филогенетический анализ предполагал коэво-
зависят от активности комплекса II в аэробных
люцию A и B субъединиц дегидрогеназного мо-
и анаэробных условиях. Поэтому было выска-
дуля [35]. Эволюционная модель, предложенная
зано предположение, а затем эксперименталь-
Хагерхалл и Хедерстедтом, предполагает, что
но подтверждено, что один и тот же сайт может
мембраносвязанные ферменты комплекса II,
содержать и работать с различными типами хи-
возможно, произошли от первичного предка
нонов (UQ, MQ или RQ) [23, 31].
с двумя трансмембранными субъединицами и
В ферментах комплекса II с двумя гемами
двумя цитохромами [2, 17]. Такая архитектура
оба гема b включены в цепь переноса электро-
позволила бы исходному ферменту функци-
нов к QD-сайту, работающему с менахинонами
онировать в качестве переносчика протонов,
с низким потенциалом (рис. 2, b). В этом случае
позволяя сайту передачи энергии работать в
высвобожденные или потреблённые протоны
направлении фумаратредуктазы, а также под-
в местах окисления или восстановления суб-
держивать окисление сукцината хинонами с
стратов разделяются сопрягающей мембраной,
низким потенциалом. Действительно, сходство
и поэтому реакция менахинол:фумаратредук-
в общей топологии гидрофобного якоря в типах
таза генерирует электрохимический градиент
A, B и C членов семейства комплекса II предпо-
протонов (Δp) с накоплением 2H+/e- в пери-
лагает, что они, возможно, эволюционировали
плазматическом пространстве. Во время об-
путем утраты различных функционально важ-
ратной реакции сукцинат:менахинонредуктаза
ных элементов (рис. 3, a). Например, слияние
перенос электронов от [3Fe-4S] центра через
двух небольших гидрофобных субъединиц с
мембрану к MQ в QD-сайте обусловлен обра-
более крупным белком, содержащим два гема b,
зовавшимся электрохимическим мембранным
привело бы к образованию комплекса II типа В.
БИОХИМИЯ том 87 вып. 8 2022
ЭВОЛЮЦИЯ САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
1093
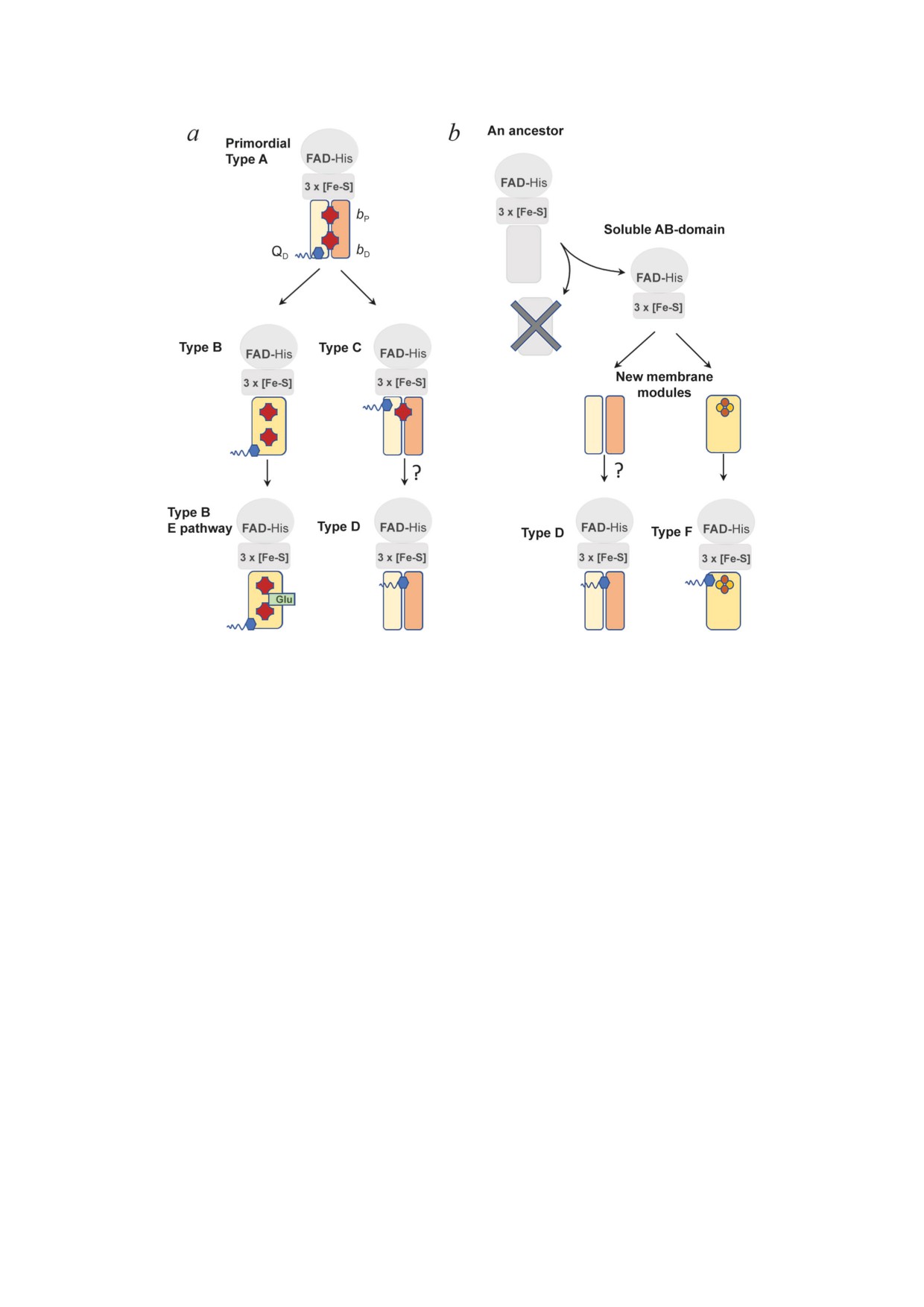
Рис. 3. Схема эволюции ферментов комплекса II. a - Эволюционная модель для цитохром-содержащих ферментов
комплекса II. Гипотетическим предком был комплекс из четырех субъединиц с двумя гемами b и дистальным сайтом
связывания хинона для менахинонов с низким потенциалом, напоминающий современный комплекс II типа A. Тип В
сформировался в результате слияния генов двух гидрофобных субъединиц. Предковый тип В, возможно, эволюциони-
ровал дальше и утратил свои способности к связыванию энергии, развив компенсаторный механизм переноса протонов
(E-путь). Тип C отделился от изначального типа A путем образования участка QP и потери дистального гема b и участка
QD. Этот переход, возможно, был вызван увеличением содержания кислорода в атмосфере и наличием хинонов с высо-
ким потенциалом. Дальнейшая эволюция фермента типа D произошла, вполне возможно, из-за потери проксимально-
го гема b. b - Ферменты комплекса II без гема b, возможно, возникли в результате сборки de novo. Из-за потери связи
с мембранным якорем стабильный растворимый AB-домен мог взаимодействовать с другим мембранным модулем и
образовывать комплексы типа F и, возможно, типа D
Подгруппа типа B с особым «E-путём», вероят-
опровергнуть вышеупомянутое предположе-
но, ответвилась от QFR типа B, участвующего
ние. Якорь в одиночной субъединице типа F с
в энергосопряжении. Структурное различие
[2Fe-2S] центром является еще одной уникаль-
между ферментами типов D и F и членами ти-
ной конфигурацией в семействе комплекса II.
пов A, B и C в мембранном домене комплек-
Растворимые домены SdhAB или FrdAB E. coli
са II делает стратегию эволюции комплекса II
стабильны и могут накапливаться в цитоплаз-
как единого целого более сложной. Возмож-
ме клеток, где соответствующие им якоря были
но, тип D произошел от исконного фермен-
удалены или нарушены при мутагенезе. Это
та типа C в результате потери гема b. Эта воз-
создало бы гипотетическую возможность ассо-
можность была проверена экспериментально.
циации фрагмента дегидрогеназы с другим гид-
В SQR E. coli замена цитохром лигирующих ги-
рофобным участком. Разумно предположить,
стидинов в любой из гидрофобных субъединиц
что образование комплекса II с гидрофобными
на тирозин предотвращала включение гема b в
доменами типов D и F может быть результатом
мембранный домен каталитически активного
таких de novo эволюционных событий (рис. 3, b).
SQR [30]. Более того, такие гомологи типа C без
Недавно полученная структура Sdh2
гема, вероятно, существуют, как обнаружено
M. smegmatis является первой структурой ком-
для комплекса II из Saccharomyces cerevisiae [36],
плекса II типа A, которая напоминает ранние
однако отсутствие структурного сходства меж-
формы фермента и может дать представление
ду сайтами QP в ферментах типа C и D может
об эволюции линий типов B и C.
БИОХИМИЯ том 87 вып. 8 2022
1094
МАКЛАШИНА
КРАТКИЙ ОБЗОР
Sdh2 M. smegmatis и дигемовые QFRs. В на-
СТРУКТУРЫ Sdh2 M. smegmatis
стоящее время получены две рентгеновские
структуры, демонстрирующие комплекс типа
Структура Sdh2 M. smegmatis является пер-
с так называемым «механизмом Е-пути». Пять
вой среди семейства комплекса II, которая была
из шести трансмембранных спиралей, обна-
определена методом крио-ЭМ с общим разре-
руженных в гидрофобных субъединицах Sdh2
шением 2,8 Å [28]. Структура аналогична SQR
M. smegmatis, наложены на пять спиралей QFR
E. coli [20], образует тример и демонстрирует от-
W. succinogenes [37] с некоторой разницей в уг-
четливые взаимодействия между протомерами
лах спиралей в положительно заряженном
тримера. Каждая мономерная единица в ансам-
участке мембраны. Плоскости двух молекул
бле состоит из четырех известных субъединиц
гема b в структуре Sdh2 почти перпендикуляр-
комплекса II SdhABCD. Два гема b расположе-
ны и аналогичны положениям гема b в QFR
ны внутри гидрофобного трансмембранного
W. succinogenes. Аксиальное связывание бис-
якоря. Внутри каждой мономерной единицы
гистидина и ориентация пропионатных групп
была также идентифицирована дополнительная
гема bP вблизи цитоплазматической поверхно-
плотность, соответствующая одной трансмем-
сти сохраняются во всех цитохром-содержащих
бранной спирали. Ее наличие было обусловлено
комплексах II. Положение гема bD в Sdh2, од-
присутствием ранее не описанной субъединицы
нако, отличается от структуры W. succinogenes.
Sdh2, получившей название SdhF. Эта новая
Различия в расположении спиралей, вероятно,
субъединица представляет собой небольшой бе-
способствовали наклону плоскости гема. Гем bD
лок из 32 а.о., присутствие которого в выделен-
в Sdh2 также имеет заметно отличающуюся
ном белке не может быть выявлено с помощью
ориентацию пропионатных групп гема, таким
SDS-PAGE, хотя было подтверждено при помо-
образом, что пропионаты C-кольца ориенти-
щи масс-спектрометрии [28]. Геномный анализ
рованы в направлении, противоположном на-
показал, что гомологи последовательностей
правлению, описанному в QFR W. succinogenes
SdhF обнаружены в основном у микобактерий.
(рис. 4, a). В QFR ориентация пропионатов
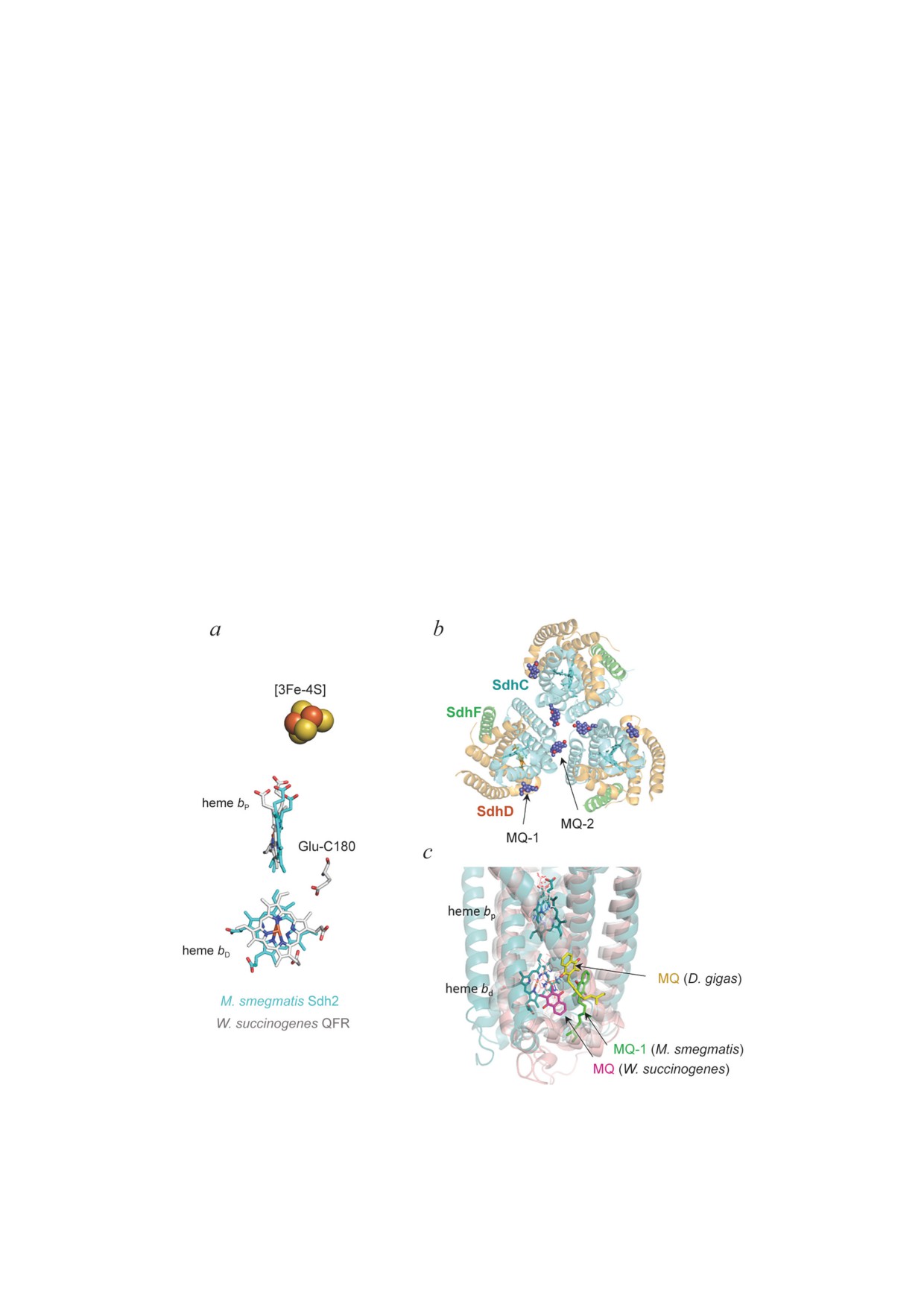
Рис. 4. Сравнение структуры Sdh2 M. smegmatis со структурами дигемовых QFRs из W. succinogenes и D. gigas. a - Нало-
женные структуры Sdh2 M. smegmatis (PDB: 6LUM, в бирюзовом цвете) и QFR W. succinogenes (PDB: 1E7P, в сером цвете)
демонстрируют в QFR гемы b, [3Fe-4S] кластер и Glu-C180. b - В трёхмерной структуре Sdh2 M. smegmatis связаны две
молекулы менахинона с одним мономером. c - Выравнивание структур Sdh2 M. smegmatis (в бирюзовом цвете), QFR
W. succinogenes (в розовом цвете) и QFR D. gigas (PDB: 5XMJ, в жёлтом цвете). Показаны молекулы менахинона в каждой
структуре
БИОХИМИЯ том 87 вып. 8 2022
ЭВОЛЮЦИЯ САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
1095
гема в сторону консервативного Glu-C180 в се-
ние, в котором связывается хинон со структур-
редине мембраны подчеркивает существование
но консервативными остатками в комплексе II
механизма протонного сопряжения в «E-пути».
типа C, который действует как SQR (у E. coli,
Отсутствие зарядов в мембранной части гидро-
свиньи, птиц) и QFR (A. suum). Сравнение
фобных остатков в Sdh2 предполагает наличие
структур Sdh2 M. smegmatis и SQR E. coli показы-
механизма генерации Δp в реакции менахинол:
вает, что три консервативных остатка Asp-D118,
фумарат в этом ферменте (рис. 2, b). Было бы
Tyr-D119 и Arg-C34 обнаружены в Sdh2 в тех же
интересно выяснить, согласуется ли ориента-
положениях, что и в SQR E. coli (рис. 5, b), что
ция пропионатов гема bD с механизмом сопря-
является весьма примечательным сходством.
жения и коррелирует ли она в двух подгруппах
Путём мутирования четырех ключевых остат-
ферментов комплекса II В-типа (рис. 3, a).
ков в SQR E. coli, Ser-C27, Arg-C31, Asp-D82 и
Структура Sdh2 M. smegmatis содержит две
Tyr-D83, было показано, что они играют важ-
эндогенные молекулы MQ на каждую мономер-
ную роль в функционировании фермента [38-
ную единицу (рис. 4, b). Эти молекулы MQ про-
40]. Эти остатки обеспечивают многочисленные
странственно разделены и расположены почти
полярные контакты с молекулой убихинона, в
напротив друг друга внутри мономера в дис-
частности, Tyr-D83 и Ser-C27 с наибольшей ве-
тальной части гидрофобного домена. Внутри
роятностью либо непосредственно, либо опо-
тримера одна молекула MQ (именуемая MQ-1)
средованно через молекулы воды работают как
обращена за пределы тримера. Вторая моле-
сайты для протонирования/депротонирования
кула MQ (называемая MQ-2) также связана с
хинона [38]. Arg-C31 связан с пропионатной
поверхностью гидрофобного домена, но яв-
группой гема и образует солевой мостик с кон-
ляется встроенной в тример между соседними
сервативным Asp-D82, обеспечивая, таким об-
мономерами. Способы связывания этих двух
разом, прочную связь между спиралью I SdhC и
молекул MQ, однако, не удовлетворяют основ-
спиралью II SdhD; эти спирали содержат гисти-
ным требованиям к каталитическим сайтам
дины, связывающиеся с гемом bP, и каталитиче-
связывания хинонов; менахиноны, по-видимо-
ские остатки Tyr-D83 и Ser-C27 (рис. 5, b). При
му, расположены на поверхности в отсутствие
помощи мутагенеза было показано, что замена
полярных аминокислот, необходимых для ка-
Arg-C31 или Asp-D82 на лейцин (Leu) не влияет
тализа. Наиболее явно сайт связывания MQ с
на стабильность мутантных ферментов или на
ферментами дигемового комплекса II проде-
средний потенциал гема b, но серьезно наруша-
монстрирован в структуре QFR W. succinogenes,
ет катализ с уби- и менахинонами [40]. Таким
где MQ погружён в белок и расположен близ-
образом, это указывает на их роль в сложной
ко к гему bD (4,5 Å) и каталитически важному
сети водородных связей, необходимых для про-
Glu-C66 (6,6 Å) [37]. В структуре QFR D. gigas
тонирования хинона.
место прикрепления к поверхности молекулы
В SQR E. coli замена Ser-C27 на аланин
менахинона довольно схоже с расположением
вызывала
25-кратное снижение активности
Sdh2 MQ-1 (рис. 4, c). Для проверки функцио-
UQ-редуктазы, подчёркивая её роль в прото-
нальности этих первичных сайтов связывания в
нировании убихинона [40]. В Sdh2 M. smegmatis
Sdh2 M. smegmatis были получены две подгруп-
объемный Trp-C30 находится в том же положе-
пы мутаций. В каждой подгруппе было пять
нии, что и остаток Ser-C27 в SQR E. coli, и он не
остатков, которые были замещены аланином,
только влияет на способность протонирования
однако кинетический анализ этих мутантов
QP-сайта, но также ограничивает доступ UQ
был проведен с помощью неадекватного мето-
или MQ к месту связывания хинона (рис. 5, b).
да, который определял Km сукцината, а не хино-
Сравнение последовательностей субъединиц
на. Таким образом, проблема идентификации
SdhC и SdhD E. coli с ферментами комплекса II
функционального сайта QP в Sdh2 M. smegmatis
типа A показывает, что остатки, образующие
остается открытой.
солевой мостик (гомологичные Arg-C31 или
Сайт связывания хинона в Sdh2 M. smegmatis
Asp-D82), сохраняются, в то время как остатки,
и SQR E. coli. SQR E. coli сыграл важную роль
участвующие в протонном обмене с хинонами,
в понимании механизма катализа в единствен-
не сохраняются (рис. 5, c). Сравнение последо-
ном сайте связывания хинона и роли гема b в
вательностей выделяет другой консервативный
комплексе II типа C [38]. В Sdh2 M. smegmatis
остаток внутри этих спиралей: His-C33 в Sdh2
общая структура четырех установленных субъ-
M. smegmatis и эквивалентный His-C30 в SQR
единиц комплекса II очень похожа на таковую в
E. coli. Было обнаружено, что этот остаток ги-
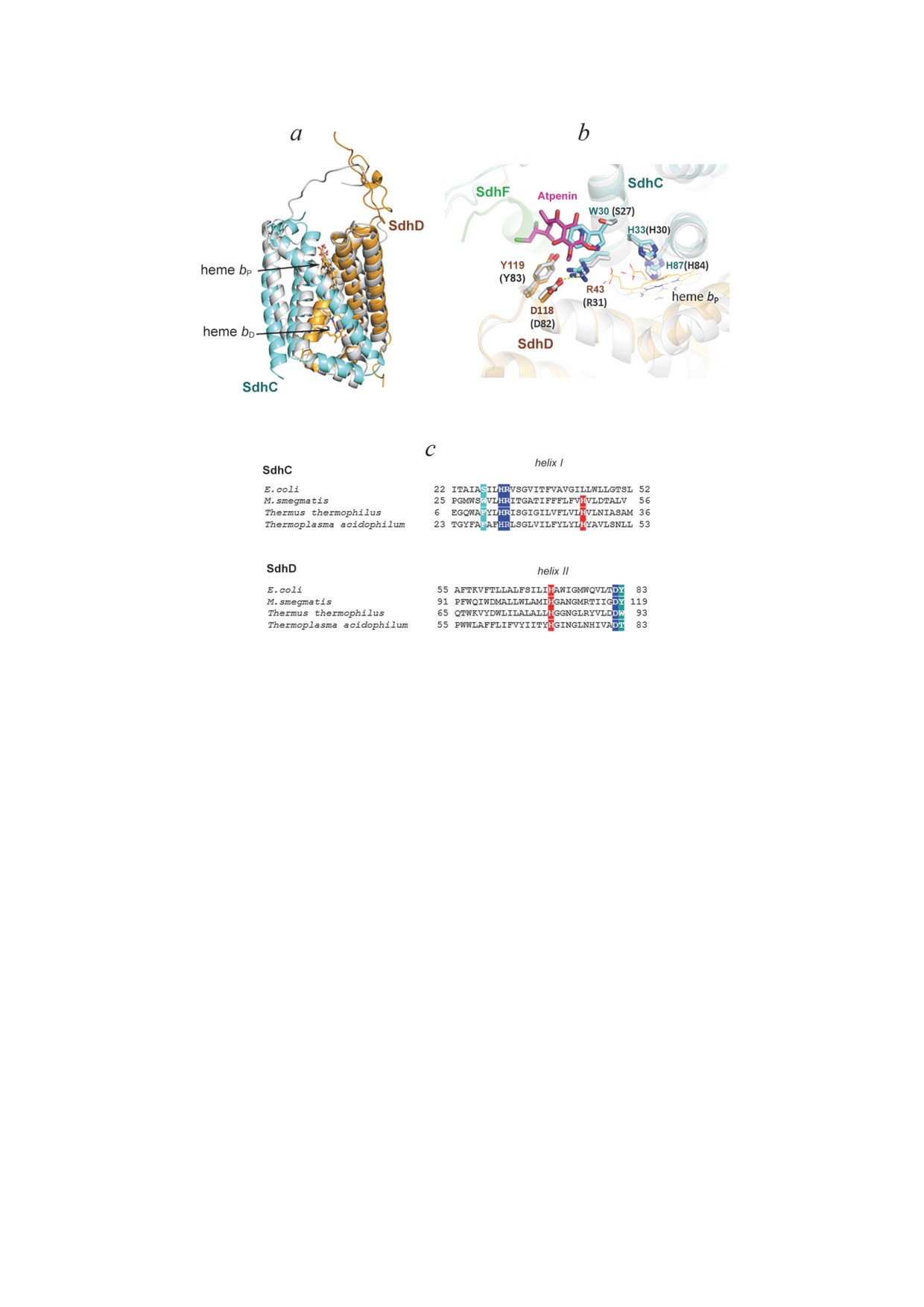
SQR E. coli, включая топологию домена SdhCD
стидина не является критичным для стабильно-
(рис. 5, a). Единственный функциональный
сти или активности SQR E. coli [41], однако по-
сайт QP в SQR E. coli описывается как углубле-
ложение и ориентация боковой цепи гистидина
БИОХИМИЯ том 87 вып. 8 2022
1096
МАКЛАШИНА
Рис. 5. Сайт QP в Sdh2 M. smegmatis и в SQR E. coli. a - Структурная суперпозиция гидрофобных субъединиц Sdh2
M. smegmatis (PDB: 6LUM): SdhC (бирюзовый), SdhD (желтый) с SQR E. coli (PDB: 2ACZ, серый). b - Сравнение сайтов
QP в SQR E. coli со связанным ингибитором, атпенином А5, с Sdh2 M. smegmatis. Остатки в Sdh2 помечены в соответствии
с цветом их субъединиц. Гомологичные остатки в SQR E. coli помечены и изображены серым цветом. Взаимодействие че-
рез солевые мостики показано желтой пунктирной линией. Субъединица SdhF в структуре Sdh2 показана зеленым цве-
том. c - Сравнение последовательностей в структуре выровненных спиралей SdhC I и SdhD II из Sdh2 M. smegmatis и SQR
E. coli. На рисунке также приведены соответствующие последовательности SQR из Thermus thermophilus и Thermoplasma
acidophilum. Выделены консервативные положения гистидинов, связывающихся с цитохромами (красный), и QP-актив-
ный сайт (синий). Голубым цветом обозначены остатки, участвующие в обмене протонов с хиноном/хинолом
подходили для координации гема b при мутиро-
вероятно, связано с наличием убихинона в
вании аксиального остатка His-C84 [42].
биоэнергетических мембранах и с переходом к
Вопрос, который необходимо решить, за-
насыщенной кислородом атмосфере, который
ключается в том, является ли предположи-
произошел более 2 миллиардов лет назад.
тельный QP-сайт в современных ферментах
Недавно обнаруженный в структуре Sdh2
комплекса II типа A остатком прежнего катали-
M. smegmatis белок SdhF блокирует вход в этот
тического сайта, который, возможно, существо-
предположительный QP-сайт и делает его недо-
вал у древнего предка, или это пример нового
ступным для субстрата [28]. Это единственная
QP-сайта. Характерной особенностью QP-сай-
роль, предполагаемая до сих пор для этого бел-
тов в митохондриальном и бактериальном ком-
ка, и этот механизм, по-видимому, не является
плексе II типа C является то, что он специфичен
необходимым, учитывая, что предположитель-
для распознавания метоксигрупп убихинона.
ный QP-сайт в Sdh2 M. smegmatis нефункцио-
Например, среди высокопотенциальных анало-
нален из-за присутствия SdhC-W30 (рис. 5, b).
гов бензохинона пластохинон, лишенный обе-
Белок SdhF контактирует с субъединицами
их метоксигрупп, не может быть восстановлен
SdhC, SdhD и SdhB, однако можно предполо-
митохондриальным комплексом II [43]. Сле-
жить, что этот вспомогательный белок вряд ли
довательно, можно предположить, что функ-
будет способствовать сборке и/или стабильно-
циональный сайт QP, по крайней мере, в его
сти Sdh2 M. smegmatis (рис. 4, b). Если это так, то
нынешней архитектуре, вряд ли существовал
при удалении SdhF для Sdh2 M. smegmatis может
в предполагаемом древнем ферменте предков.
появиться возможность формирования катали-
Происхождение классического комплекса II,
тически активного QP-сайта.
БИОХИМИЯ том 87 вып. 8 2022
ЭВОЛЮЦИЯ САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
1097
Благодарности. Я посвящаю этот обзор мое-
Конфликт интересов. Автор заявляет об
му учителю Андрею Дмитриевичу Виноградову.
отсутствии конфликта интересов в финансо-
Он посвятил большую часть своей научной
вой или иной сфере.
жизни изучению митохондриального комплек-
Соблюдение этических норм. Настоящая
са II, который он часто называл «моей первой
статья не содержит описания каких-либо ис-
любовью в науке». Я также хотела бы поблаго-
следований с участием людей или животных в
дарить Gary Cecchini за прочтение рукописи.
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Cecchini, G.
(2003) Function and structure of
12.
Moosavi, B., Berry, E. A., Zhu, X. L., Yang, W. C., and
complex II of the respiratory chain, Annu. Rev.
Yang, G. F. (2019) The assembly of succinate dehydro-
Biochem., 72, 77-109, doi: 10.1146/annurev.biochem.
genase: a key enzyme in bioenergetics, Cell. Mol. Life
72.121801.161700.
Sci., 76, 4023-4042, doi: 10.1007/s00018-019-03200-7.
2.
Hagerhall,
C.
(1997)
Succinate:
quinone
13.
Tedeschi, G., Negri, A., Mortarino, M., Ceciliani,
oxidoreductases. Variations on a conserved theme,
F., Simonic, T., et al. (1996) L-aspartate oxidase from
Biochim. Biophys. Acta, 1320, 107-141, doi: 10.1016/
Escherichia coli. II. Interaction with C4 dicarboxylic
s0005-2728(97)00019-4.
acids and identification of a novel L-aspartate:
3.
Sharma, P., Maklashina, E., Cecchini, G., and
fumarate oxidoreductase activity, Eur. J. Biochem.,
Iverson, T. M. (2019) Maturation of the respiratory
239, 427-433, doi: 10.1111/j.1432-1033.1996.0427u.x.
complex II flavoprotein, Curr. Opin. Struct. Biol., 59,
14.
Taylor, P., Pealing, S. L., Reid, G. A., Chapman, S.
38-46, doi: 10.1016/j.sbi.2019.01.027.
K., and Walkinshaw, M. D. (1999) Structural and
4.
Sharma, P., Maklashina, E., Cecchini, G., and
mechanistic mapping of a unique fumarate reductase,
Iverson, T. M.
(2018) Crystal structure of an
Nat. Struct. Biol., 6, 1108-1112, doi: 10.1038/70045.
assembly intermediate of respiratory Complex II, Nat.
15.
Maklashina, E., Rajagukguk, S., Iverson, T. M., and
Commun., 9, 274, doi: 10.1038/s41467-017-02713-8.
Cecchini, G. (2018) The unassembled flavoprotein
5.
Kounosu, A. (2014) Analysis of covalent flavinylation
subunits of human and bacterial complex II have
using thermostable succinate dehydrogenase from
impaired catalytic activity and generate only minor
Thermus thermophilus and Sulfolobus tokodaii
amounts of ROS, J. Biol. Chem., 293, 7754-7765,
lacking SdhE homologs, FEBS Lett., 588, 1058-1063,
doi: 10.1074/jbc.RA118.001977.
doi: 10.1016/j.febslet.2014.02.022.
16.
Maklashina, E., Iverson, T. M., Sher, Y., Kotlyar, V.,
6.
Lill, R., and Freibert, S. A. (2020) Mechanisms of
Andrell, J., et al. (2006) Fumarate reductase and
Mitochondrial Iron-Sulfur Protein Biogenesis, Annu.
succinate oxidase activity of Escherichia coli complex
Rev. Biochem., 89, 471-499, doi: 10.1146/annurev-
II homologs are perturbed differently by mutation
biochem-013118-111540.
of the flavin binding domain, J. Biol. Chem., 281,
7.
Bai, Y., Chen, T., Happe, T., Lu, Y., and Sawyer, A.
11357-11365, doi: 10.1074/jbc.M512544200.
(2018) Iron-sulphur cluster biogenesis via the SUF
17.
Hägerhäll, C., and Hederstedt, L. (1996) A structural
pathway, Metallomics, 10, 1038-1052, doi: 10.1039/
model for the membrane-integral domain of
c8mt00150b.
succinate: quinone oxidoreductases, FEBS Lett., 389,
8.
Heuts, D. P., Scrutton, N. S., McIntire, W. S.,
25-31, doi: 10.1016/0014-5793(96)00529-7.
and Fraaij e, M. W. (2009) What’s in a covalent
18.
Lancaster, C. R.
(2013) The di-heme family
bond? On the role and formation of covalently
of respiratory complex II enzymes, Biochim.
bound flavin cofactors, FEBS J., 276, 3405-3427,
Biophys. Acta,
1827,
679-687, doi:
10.1016/
doi: 10.1111/j.1742-4658.2009.07053.x.
j.bbabio.2013.02.012.
9.
Hao, H. X., Khalimonchuk, O., Schraders, M.,
19.
Iverson, T. M., Luna-Chavez, C., Cecchini, G., and
Dephoure, N., Bayley, J. P., et al. (2009) SDH5,
Rees, D. C. (1999) Structure of the Escherichia coli
a gene required for flavination of succinate
fumarate reductase respiratory complex, Science, 284,
dehydrogenase, is mutated in paraganglioma, Science,
1961-1966, doi: 10.1126/science.284.5422.1961.
325, 1139-1142, doi: 10.1126/science.1175689.
20.
Yankovskaya, V., Horsefield, R., Tornroth, S., Luna-
10.
McNeil, M. B., Clulow, J. S., Wilf, N. M., Salmond,
Chavez, C., Miyoshi, H., et al. (2003) Architecture of
G. P., and Fineran, P. C. (2012) SdhE is a conserved
succinate dehydrogenase and reactive oxygen species
protein required for flavinylation of succinate
generation, Science,
299,
700-704, doi:
10.1126/
dehydrogenase in bacteria, J. Biol. Chem.,
287,
science.1079605
18418-18428, doi: 10.1074/jbc.M111.293803.
21.
Huang, L. S., Shen, J. T., Wang, A. C., and Berry,
11.
Van Vranken, J. G., Na, U., Winge, D. R., and
E. A. (2006) Crystallographic studies of the binding
Rutter, J.
(2015) Protein-mediated assembly of
of ligands to the dicarboxylate site of Complex II,
succinate dehydrogenase and its cofactors, Crit.
and the identity of the ligand in the “oxaloacetate-
Rev. Biochem. Mol. Biol., 50, 168-180, doi: 10.3109/
inhibited” state, Biochim. Biophys. Acta, 1757, 1073-
10409238.2014.990556.
1083, doi: 10.1016/j.bbabio.2006.06.015.
7
БИОХИМИЯ том 87 вып. 8 2022
1098
МАКЛАШИНА
22.
Sun, F., Huo, X., Zhai, Y., Wang, A., Xu, J., et al.
evidence for proton motive force-dependent catalysis
(2005) Crystal structure of mitochondrial respiratory
by the diheme-containing succinate:menaquinone
membrane protein complex II, Cell, 121, 1043-1057,
oxidoreductase from the Gram-positive bacterium
doi: 10.1016/j.cell.2005.05.025.
Bacillus licheniformis, Biochemistry, 45, 15049-15055,
23.
Inaoka, D. K., Shiba, T., Sato, D., Balogun, E. O.,
doi: 10.1021/bi0618161.
Sasaki, T., et al. (2015) Structural insights into the
34.
Madej, M. G., Nasiri, H. R., Hilgendorff, N. S.,
molecular design of flutolanil derivatives targeted
Schwalbe, H., and Lancaster, C. R. (2006) Evidence
for fumarate respiration of parasite mitochondria,
for transmembrane proton transfer in a dihaem-con-
Int. J. Mol. Sci., 16, 15287-15308, doi: 10.3390/
taining membrane protein complex, EMBO J., 25,
ij ms160715287.
4963-4970, doi: 10.1038/sj.emboj.7601361.
24.
Hards, K., Rodriguez, S. M., Cairns, C., and Cook,
35.
Schafer, G., Anemuller, S., and Moll, R.
(2002)
G. M. (2019) Alternate quinone coupling in a new
Archaeal complex II: “classical” and “non-classical”
class of succinate dehydrogenase may potentiate
succinate:quinone reductases with unusual features,
mycobacterial respiratory control, FEBS Lett., 593,
Biochim. Biophys. Acta, 1553, 57-73, doi: 10.1016/
475-486, doi: 10.1002/1873-3468.13330.
s0005-2728(01)00232-8.
25.
Zhou, X., Gao, Y., Wang, W., Yang, X., Yang, X.,
36.
Maklashina, E., Rajagukguk, S., McIntire,
et al.
(2021) Architecture of the mycobacterial
W. S., and Cecchini, G. (2010) Mutation of the
succinate dehydrogenase with a membrane-embedded
heme axial ligand of Escherichia coli succinate-
Rieske FeS cluster, Proc. Natl. Acad. Sci. USA, 118,
quinone reductase: implications for heme ligation
e2022308118, doi: 10.1073/pnas.2022308118.
in mitochondrial complex II from yeast, Biochim.
26.
Lancaster, C. R., Kroger, A., Auer, M., and
Biophys. Acta,
1797,
747-754, doi:
10.1016/
Michel, H. (1999) Structure of fumarate reductase
j.bbabio.2010.01.019.
from Wolinella succinogenes at 2.2 A resolution,
37.
Lancaster, C. R., Gorss, R., Haas, A., Ritter, M.,
Nature, 402, 377-385, doi: 10.1038/46483.
Mantele, W., et al. (2000) Essential role of Glu-C66
27.
Guan, H. H., Hsieh, Y. C., Lin, P. J., Huang, Y.
for menaquinol oxidation indicates transmembrane
C., Yoshimura, M., et al. (2018) Structural insights
electrochemical potential generation by Wolinella
into the electron/proton transfer pathways in the
succinogenes fumarate reductase, Proc. Natl.
quinol:fumarate reductase from Desulfovibrio gigas,
Acad. Sci. USA,
97,
13051-13056, doi:
10.1073/
Sci. Rep., 8, 14935, doi: 10.1038/s41598-018-33193-5.
pnas.220425797.
28.
Gong, H., Gao, Y., Zhou, X., Xiao, Y., Wang, W.,
38.
Maklashina, E., and Cecchini, G.
(2010) The
et al.
(2020) Cryo-EM structure of trimeric
quinone-binding and catalytic site of complex II,
Mycobacterium smegmatis succinate dehydrogenase
Biochim. Biophys. Acta, 1797, 1877-1882, doi: 10.1016/
with a membrane-anchor SdhF, Nat. Commun., 11,
j.bbabio.2010.02.015.
4245, doi: 10.1038/s41467-020-18011-9.
39.
Silkin, Y., Oyedotun, K. S., and Lemire, B. D. (2007)
29.
Juhnke, H. D., Hiltscher, H., Nasiri, H. R.,
The role of Sdh4p Tyr-89 in ubiquinone reduction by
Schwalbe, H., and Lancaster, C. R. (2009) Pro-
the Saccharomyces cerevisiae succinate dehydrogenase,
duction,
characterization
and
determina-
Biochim. Biophys. Acta, 1767, 143-150, doi: 10.1016/
tion of the real catalytic properties of the puta-
j.bbabio.2006.11.017.
tive
“succinate dehydrogenase” from Wolinella
40.
Tran, Q. M., Rothery, R. A., Maklashina, E.,
succinogenes, Mol. Microbiol., 71, 1088-1101, doi:
Cecchini, G., and Weiner, J. H.
(2006) The
10.1111/j.1365-2958.2008.06581.x.
quinone binding site in Escherichia coli succinate
30.
Tran, Q. M., Rothery, R. A., Maklashina, E.,
dehydrogenase is required for electron transfer
Cecchini, G., and Weiner, J. H. (2007) Escherichia
to the heme b, J. Biol. Chem., 281, 32310-32317,
coli succinate dehydrogenase variant lacking the
doi: 10.1074/jbc.M607476200.
heme b, Proc. Natl. Acad. Sci. USA, 104, 18007-18012,
41.
Tran, Q. M., Fong, C., Rothery, R. A., Maklashina,
doi: 10.1073/pnas.0707732104.
E., Cecchini, G., and Weiner, J. H. (2012) Out of
31.
Maklashina, E., Hellwig, P., Rothery, R. A.,
plane distortions of the heme b of Escherichia coli
Kotlyar, V., Sher, Y., et al.
(2006) Differenc-
succinate dehydrogenase, PLoS One,
7, e32641,
es in protonation of ubiquinone and menaqui-
doi: 10.1371/journal.pone.0032641.
none in fumarate reductase from Escherichia coli,
42.
Maklashina, E., Rothery, R. A., Weiner, J. H., and
J. Biol. Chem.,
281,
26655-26664, doi:
10.1074/
Cecchini, G. (2001) Retention of heme in axial ligand
jbc.M602938200.
mutants of succinate-ubiquinone xxidoreductase
32.
Schirawski, J., and Unden, G. (1998) Menaquinone-
(complex II) from Escherichia coli, J. Biol. Chem.,
dependent succinate dehydrogenase of bacteria
276, 18968-18976, doi: 10.1074/jbc.M011270200.
catalyzes reversed electron transport driven by the
43.
Gu, L. Q., Yu, L., and Yu, C. A. (1990) Effect of
proton potential, Eur. J. Biochem,
257,
210-215,
substituents of the benzoquinone ring on electron-
doi: 10.1046/j.1432-1327.1998.2570210.x.
transfer
activities
of ubiquinone derivatives,
33.
Madej, M. G., Nasiri, H. R., Hilgendorff, N. S.,
Biochim. Biophys. Acta, 1015, 482-492, doi: 10.1016/
Schwalbe, H., Unden, G., et al. (2006) Experimental
0005-2728(90)90082-f.
БИОХИМИЯ том 87 вып. 8 2022
ЭВОЛЮЦИЯ САЙТА СВЯЗЫВАНИЯ ХИНОНА В КОМПЛЕКСЕ II
1099
STRUCTURAL INSIGHT INTO EVOLUTION
OF THE QUINONE BINDING SITE IN COMPLEX II
Review
Elena Maklashina
Department of Biochemistry and Biophysics, University of California,
San Francisco, CA 94143, USA; e-mail: elena.maklashina@ucsf.edu
The Complex II family encompasses membrane bound succinate:quinones reductases and quinol:fumarate
reductases that catalyze interconversion of succinate and fumarate coupled with reduction and oxidation
of quinone. These enzymes are found in all biological genres and share a modular structure where a highly
conserved soluble domain is bound to a membrane-spanning domain that is represented by distinct variations.
The current classification of the complex II family members is based on the number of subunits and co-factors
in the membrane anchor (types A-F). This classification also provides insights into possible evolutionary paths
and suggests that some of the complex II enzymes (types A-C) co-evolved as the whole assembly. Origin of
complex II types D and F may have arisen from independent events of de novo association of the conserved
soluble domain with a new anchor. Here we analyze a recent structure of Mycobacterium smegmatis Sdh2,
a complex II enzyme with two transmembrane subunits and two heme b molecules. This analysis supports an
earlier hypothesis suggesting that mitochondrial complex II (type C) with a single heme b may have evolved
as an assembled unit from an ancestor similar to M. smegmatis Sdh2.
Keywords: succinate:ubiquinone reductase, quinol:fumarate reductase, complex II, quinone binding site,
cytochrome b
БИОХИМИЯ том 87 вып. 8 2022
7*