БИОХИМИЯ, 2022, том 87, вып. 8, с. 1145 - 1159
УДК 577.112.4
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИНОВЫЕ ФИЛАМЕНТЫ
Обзор
© 2022 Л.К. Муранова, В.М. Шатов, Н.Б. Гусев*
Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119991 Москва, Россия; электронная почта: NBGusev@mail.ru
Поступила в редакцию 14.03.2022
После доработки 28.04.2022
Принята к публикации 28.04.2022
Малые белки теплового шока (small heat shock proteins, sHsp) играют важную роль в поддержании
стабильного состояния протеома, в частности цитоскелета и сократительного аппарата клеток.
Различные стрессорные воздействия зачастую сопровождаются перемещением sHsp на актиновые
филаменты, и поэтому в литературе бытует мнение, что малые белки теплового шока являются ак-
тин-связывающими белками. Исследования последних лет показали неполноту и неточность этого
предположения. Вызванное стрессом перемещение sHsp на актиновый филамент, скорее всего, не яв-
ляется следствием прямого взаимодействия этих белков с интактным актином, а обусловлено шапе-
роноподобной активностью и взаимодействием sHsp с различными актин-связывающими белками.
HspB1 и HspB5 взаимодействуют с гигантскими эластичными белками титином и филамином и тем
самым обеспечивают целостность сократительного аппарата и его правильную локализацию в клетке.
HspB6 взаимодействует с универсальным адаптерными белком 14-3-3 и таким образом лишь опосре-
дованно может влиять на структуру актиновых филаментов. HspB7 взаимодействует с филамином С
и контролирует сборку актиновых филаментов. HspB8 образует прочный комплекс с универсаль-
ным адаптерным белком Bag3 и участвует в процессе шаперон-зависимой избирательной аутофагии
(CASA) различных актин-связывающих белков (в частности, филаминов), а также в зависимых от
актина процессах, происходящих при митозе. Таким образом, механизмы участия sHsp в поддержа-
нии нормального функционирования сократительного аппарата и цитоскелета намного сложнее и
разнообразнее, чем это виделось ранее. Представленный анализ данных литературы указывает на
необходимость пересмотра старых гипотез о прямом взаимодействии малых белков теплового шока
с интактным актином и требует более подробного исследования влияния sHsp на многочисленные
белки, участвующие в формировании и ремоделировании актинового филамента.
КЛЮЧЕВЫЕ СЛОВА: малые белки теплового шока, актин, белок-белковые взаимодействия, шапероно-
подобная активность, фосфорилирование.
DOI: 10.31857/S0320972522080127, EDN: AZHJIW
ВВЕДЕНИЕ
рых (HspB1, HspB5, HspB6, HspB8) экспресси-
руется повсеместно, а другие (HspB2, HspB3,
Малые белки теплового шока (small heat
HspB4, HspB7, HspB9, HspB10) представлены
shock proteins, sHsp) образуют большое семей-
преимущественно в определенных органах и
ство белков, объединённых наличием в своем
тканях [5-7]. Эти белки играют важную роль
составе консервативного α-кристаллинового
в поддержании протеостаза, связывают ча-
домена (α-crystallin domain, ACD) (80-100 а.о.)
стично денатурированные или неправильно
и относительно небольшой молекулярной мас-
свернутые белки, предотвращая их агрегацию
сой мономеров, колеблющейся в интервале от
и перенося их на АТР-зависимые шапероны
12 до 43 кДа [1, 2]. Эти белки обнаружены во
или способствуя их протеолитической дегра-
всех царствах живых существ (вирусы, археи,
дации [4, 8], могут участвовать в поддержании
бактерии, растения, животные) [3, 4]. В гено-
нормального редокс-состояния клеток [9], во-
ме человека обнаружено 10 генов, кодирующих
влечены в регуляцию процессов апоптоза [10],
малые белки теплового шока, часть из кото-
а также участвуют в регуляции и защите со-
кратительного аппарата и цитоскелета клеток
* Адресат для корреспонденции.
[11, 12]. В литературе достаточно много про-
10
1145
1
146
МУРАНОВА и др.
тиворечивых данных о влиянии малых белков
Пытаясь воспроизвести эти результаты, мы
теплового шока на промежуточные филамен-
получили рекомбинантный препарат Hsp25 ку-
ты, микротрубочки и микрофиламенты, обра-
рицы, а также фосфоимитирующие мутантные
зованные актином [11, 12]. В этом миниобзоре
формы этого белка, в которых три фосфорили-
мы ограничимся рассмотрением влияния раз-
руемых остатка серина были заменены на остат-
личных малых белков теплового шока только
ки аспарагиновой кислоты [18]. В наших руках
на актиновые микрофиламенты.
Hsp25 практически не влиял на скорость по-
лимеризации актина, но эффективно препят-
ствовал агрегации частично денатурированного
ВЛИЯНИЕ МАЛОГО БЕЛКА
актина. При этом наибольшей шаперонной ак-
ТЕПЛОВОГО ШОКА HspB1 (Hsp27)
тивностью обладала мутантная форма, в кото-
НА ФОРМИРОВАНИЕ, СТРУКТУРУ И
рой все три остатка серина (Ser15, Ser77, Ser81),
СВОЙСТВА АКТИНОВЫХ ФИЛАМЕНТОВ
подвергающиеся фосфорилированию, были
заменены на остатки аспарагиновой кислоты
В конце 80-х и начале 90-х годов прошлого
[18]. Аналогичные результаты были получены
века было установлено, что белок с молекуляр-
при исследовании как рекомбинантного Hsp25
ной массой 25 кДа, выделяемый из мускульного
курицы, так и рекомбинантного гомолога Hsp27
желудка индюка, способен ингибировать про-
(HspB1) человека [19, 20]. Оказалось, что нагре-
цесс полимеризации актина [13, 14]. Позднее
вание фибриллярного актина сопровождается
было установлено, что этот белок гомологичен
диссоциацией частично денатурированного
малому белку теплового шока HspB1 (Hsp27) и
мономерного актина. HspB1 (и особенно его
похож по своей структуре на αВ-кристаллин [14]
псевдофосфорилированная мутантная форма)
(таблица). Немного позднее было установлено,
связывает этот частично денатурированный ак-
что схожий белок с кажущейся молекулярной
тин и препятствует агрегации, индуцированной
массой 25 кДа, выделяемый из асцитной опу-
повышением температуры. Большинство экс-
холи Эрлиха мышей, также способен ингиби-
периментов, в которых исследовалось влияние
ровать полимеризацию актина [15]. При этом
HspB1 на полимеризацию актина, проводили с
было показано, что ингибирующей активно-
использованием актина, меченого пиренилма-
стью обладают только нефосфорилированные
леимидом. Эта модификация осуществляется
мономеры этого белка, а фосфорилированные
в довольно жестких условиях, в ходе которых
мономеры или олигомеры не обладают ингиби-
достаточно трудно избежать частичной денату-
рующей активностью. Этот факт вызывал опре-
рации актина. Можно предположить, что опи-
деленное недоумение, потому что фосфорили-
санный ранее эффект Hsp25 из мускульного же-
рование обычно сопровождается диссоциацией
лудка индюка и его гомолога HspB1 человека на
крупных олигомеров HspB1 [16], и в этой связи
полимеризацию актина был отчасти обусловлен
представляется довольно затруднительным по-
связыванием малого белка теплового шока с ча-
лучить как нефосфорилированные мономеры,
стично денатурированным актином.
так и фосфорилированные олигомеры HspB1.
Параллельно с экспериментами по влия-
Кроме того, оказалось, что ингибирующей ак-
нию HspB1 на полимеризацию актина были
тивностью обладает только белок, выделенный
проведены подробные опыты по внутриклеточ-
из опухоли, в то время как рекомбинантный
ной локализации HspB1 в скелетных мышцах и
белок лишен этой активности [16]. Тем не ме-
в сердце млекопитающих. Было установлено,
нее исследования в этом направлении продол-
что в состоянии покоя HspB1 (как и некоторые
жались, и была предпринята попытка выделить
другие малые белки теплового шока, такие как
пептиды Hsp25, способные ингибировать по-
HspB2, HspB5, HspB6, HspB7) преимуществен-
лимеризацию актина [17]. Было установлено,
но локализованы диффузно в цитозоле, а после
что пептиды, ограниченные остатками 43-57
различного рода стрессов (ишемия/реперфу-
и 92-106 Hsp25, способны затруднять полиме-
зия, повышение температуры и др.) эти белки
ризацию актина, и при этом их ингибирующая
перемещаются на сократительный аппарат [21].
активность сопоставима или даже выше актив-
Более того, в клетках яичников китайского хо-
ности соответствующих ингибиторных пепти-
мячка (CHO) оверэкспрессия HspB1 приводила
дов кофилина или филамина [17]. Однако даже
к заметной стабилизации нитей актина и уве-
в этом случае существенное ингибирование по-
личивала устойчивость актинового цитоскеле-
лимеризации актина наблюдалось только при
та к действию цитохалазина D [22, 23]. В этих
добавлении эквимолярных концентраций ин-
экспериментах указанный эффект наблюдался
тактного Hsp25 и/или при 4-кратном избытке
только в случае фосфорилированного HspB1 и
пептидов этого белка [16, 17].
отсутствовал в случае нефосфорилированно-
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1147
го белка. Перемещение HspB1 из цитозоля на
[11, 12]. Однако, как нам кажется, даже такое
актиновый филамент и повышение стабильно-
объяснение не было достаточно убедительным,
сти актиновых филаментов наблюдалось как
так как концентрация нефосфорилированных
в случае различных скелетных мышц, так и в
форм Hsp27 a priori должна быть крайне низкой
случае кардиомиоцитов [24]. Таким образом,
(потому что именно фосфорилирование вызы-
возникло своеобразное противоречие. С од-
вает диссоциацию крупных олигомеров), а все
ной стороны, исследования, выполненные на
описанные ранее эффекты наблюдались при
изолированных белках, свидетельствовали о
концентрациях Hsp27, сопоставимых с кон-
том, что HspB1 якобы ингибирует процесс по-
центрацией актина. Скорее всего, этот факт
лимеризации актина, а с другой стороны, экс-
косвенно свидетельствовал о том, что влия-
перименты, выполненные на изолированных
ние Hsp27 на актиновый филамент было опо-
клетках и мышцах, свидетельствовали о том,
средованным и обусловлено взаимодействием
что HspB1 стабилизирует актиновые фила-
малого белка теплового шока не с актином, а
менты и препятствует их повреждению в ходе
с какими-то минорными белками, связанны-
различных стрессовых воздействий. Для того
ми с актиновым филаментом. Сократительный
чтобы каким-то образом обойти это противо-
аппарат скелетных и сердечных мышц постро-
речие, было высказано предположение о том,
ен достаточно сложно и, помимо актина и ми-
что нефосфорилированные мономеры кэпиру-
озина, содержит большое количество вспо-
ют плюс-конец и ингибируют полимеризацию
могательных и регуляторных белков (рис. 1).
актина, а фосфорилированные мономеры (и,
Косвенным подтверждением того, что HspB1
возможно, небольшие олигомеры) каким-то
связывается не с актином, а с другими белка-
образом стабилизируют актиновые филаменты
ми явилось то, что обработка сократительно-
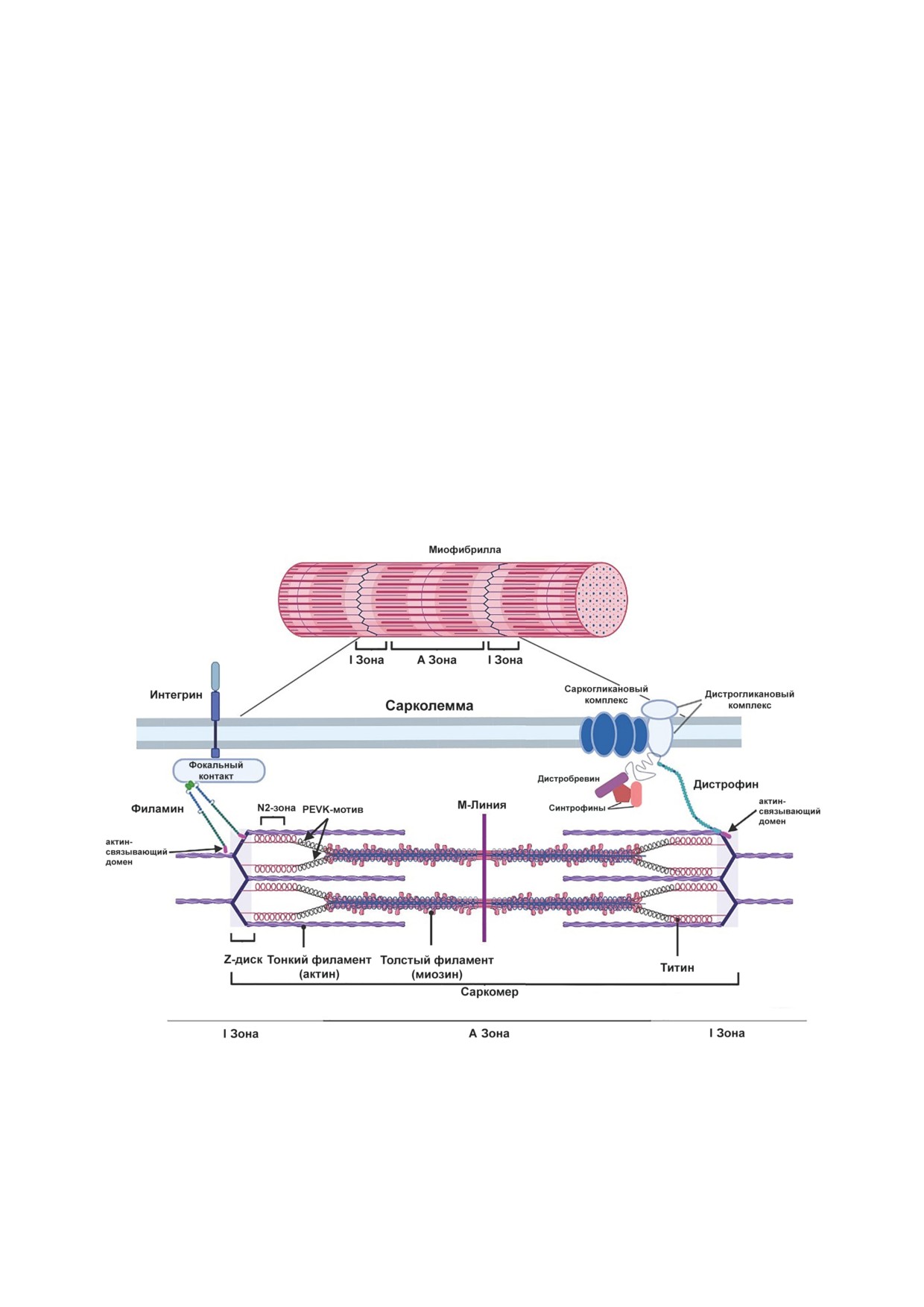
Рис. 1. Схема строения сократительного аппарата мышцы. Саркомер состоит из тонких (актиновых) филаментов, свя-
занных с Z-диском, и толстых (миозиновых) филаментов с центром в М-линии. Титин выполняет важную роль в под-
держании целостности саркомера, контактируя как с тонкими, так и с толстыми филаментами. В первичной структуре
титина выделяют N2-зону и PEVK-мотивы, необходимые для функционирования этого белка. Связь миофибриллы с
сарколеммой осуществляется благодаря белку дистрофину, чей актин-связывающий домен взаимодействует с саркоме-
ром. Дистробревин, саркогликаны, дистрогликаны, а также вспомогательные белки синтрофины также играют роль в
этом процессе (правая сторона рисунка). Кроме того, саркомер может взаимодействовать с интегриновыми комплексами
на поверхности мембраны за счет белка филамина и таким образом осуществлять связь миофибриллы с сарколеммой
(левая сторона рисунка)
БИОХИМИЯ том 87 вып. 8 2022
10*
1148
МУРАНОВА и др.
Малые белки теплового шока, их тканевое распределение и белки-партнеры, участвующие в формировании
и ремоделировании актиновых филаментов
Принятые обозначения
Белки-партнеры и/или
Молекулярная
Тканевое
и ранее использованные
процессы, влияющие на
Ссылки
масса мономера, Да
распределение
обозначения
актиновые филаменты
титин
[25, 26]
тропонин I
[27, 28]
HspB1 (Hsp25, Hsp27,
22 783
повсеместно
Hsp28)
тропонин T
[27, 28]
филамин С
[29]
миогенез,
[34]
нейроны, скелетные
HspB2 (MDPK)
20 233
и сердечные мышцы
энергетический протеостаз
[35-38]
нейроны,
HspB3
16 966
скелетные и сердеч-
миогененез
[34]
ные мышцы
HspB4 (αА-кристаллин)
19 909
хрусталик глаза
не описано
нет
HspB5 (αВ-кристаллин)
20 159
повсеместно
титин
[25, 43, 44]
α-актинин
[54, 55]
HspB6 (Hsp20)
17 136
повсеместно
14-3-3
[62, 63]
Bag3
[82, 83]
сердечные
филамин С
[69]
HspB7 (cvHsp)
18 611
и скелетные мышцы,
адипоциты
титин
[74]
HspB8 (Hsp22, H11)
21 604
повсеместно
Bag3
[79-81]
HspB9
17 486
семенники
не описаны
нет
HspB10 (ODF)
28 366
семенники
не описаны
нет
го аппарата 1М NaSCN (тиоцианат натрия),
вращает агрегацию молекул титина и уменьшает
приводящая к полной экстракции актина, не
жесткость мышц, возрастающую при агрегации
сопровождалась экстрагированием малых бел-
титина [25]. Растяжение и повышенная темпе-
ков теплового шока HspB1, HspB5 и HspB7 [21].
ратура приводят к перемещению HspB1 и на
Этот факт свидетельствовал о том, что HspB1
участки титина, расположенные вблизи акти-
связывается не непосредственно с актином, а с
новых филаментов кардиомиоцитов Danio rerio
какими-то актин-связывающими белками или
[26]. Авторы подчеркивают, что HspB1 не свя-
с белками, расположенными в непосредствен-
зывается ни с десмином, ни с α-актинином, ни
ной близости от нитей актина. Дальнейшие ис-
с фибриллярным актином - и единственным
следования показали, что HspB1 действитель-
партнером белка теплового шока после стрес-
но связывается с областью N2В титина (рис. 1,
совых воздействий является титин.
таблица), которая располагается в удаленной
В определенной степени продолжением
от Z-диска части актинового филамента. При
этих работ стало исследование внутриклеточ-
этом связывание HspB1 усиливается при растя-
ного распределения HspB1 в кардиомиоцитах
жении, и это взаимодействие обеспечивается за
крыс после оверэкспрессии этого белка, инду-
счет контактов иммуноглобулиновых доменов
цированной введением аденовируса, содержа-
титина с иммуноглобулиновым доменом кри-
щего ген HspB1. Было установлено, что HspB1
сталлинового домена HspB1 [25]. Такое взаи-
связывается с тропонином I и тропонином Т,
модействие, происходящее в миоцитах, предот-
регуляторными белками, расположенными на
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1149
актиновом филаменте. При этом участки свя-
Myotonic Dystrophy Protein Kinase, MDPK),
зывания HspB1 располагаются в N-концевой
недостаточная активность которой ведет к
части тропонина Т и в C-концевой части тро-
миотонической дистрофии
[31]. HspB2 мо-
понина I [27]. Вызванное ишемией/реперфузи-
жет локализоваться в различных клеточных
ей перемещение HspB1 из цитозоля на сокра-
компартментах, таких как цитозоль, ядро, со-
тительный аппарат приводит к стабилизации
кратительный аппарат и митохондрии. HspB2
компонентов тропонинового комплекса, что,
может образовывать так называемые безмем-
вероятно, может быть обусловлено тем, что ма-
бранные жидкие капли, которые могут рас-
лый белок теплового шока защищает компо-
полагаться как в цитозоле, так и ядре. Такие
ненты тропонина от протеолиза под действием
капли, локализованные в ядре, могут взаимо-
Са-зависимой протеазы, кальпаина [28].
действовать с ламином А/С и таким образом
Наконец, в последнее время появились
влиять на взаимодействие ДНК с ядерной мем-
данные о том, что HspB1 способен взаимодей-
браной, что регулирует экспрессию определен-
ствовать с С-концевыми повторами d18-d21
ных генов [32]. HspB3 взаимодействует с HspB2
филамина С [29]. Димерный актин-связыва-
и влияет на его способность образовывать без-
ющий белок филамин располагается вбли-
мембранные капли и таким образом влияет
зи Z-диска и обеспечивает связывание нитей
на функционирование генов. В свою очередь,
актина и взаимодействие с белками проме-
HspB3 участвует в замене рецептора ламина В
жуточных филаментов (рис. 1, таблица). Им-
на рецептор ламина А/С, что приводит к специ-
муноглобулиновые домены, расположенные
фической активации генов, обеспечивающих
в С-концевой части, обеспечивают димери-
дифференцировку миобластов
[33]. Таким
зацию филамина, и высказывается предполо-
образом, эти два взаимодействующих между
жение, что связывание HspB1 может препят-
собой белка играют важную роль в ходе миоге-
ствовать избыточному растяжению молекулы
неза и экспрессируются в строго определенные
филамина С [29]. К сожалению, это в высшей
промежутки времени развития мышцы [34]. В
степени интересное исследование, проведен-
опытах, выполненных на линии мышей с двой-
ное с использованием широкого набора са-
ным нокаутом генов αВ-кристаллина (HspB5)
мых современных методов, было выполнено на
и HspB2, было установлено, что в нормальных
сравнительно коротких фрагментах обоих бел-
условиях двойной нокаут не приводит к суще-
ков, и поэтому остается не вполне понятным,
ственному изменению морфологии и свойств
реализуются ли такие взаимодействия в случае
сердечной мышцы. Однако после ишемии/ре-
полноразмерных белков.
перфузии сердца мутантных мышей содержали
Завершая этот раздел, можно заключить,
больше некротических участков и восстанав-
что после различного рода стрессов HspB1 пере-
ливали сократительную активность медленнее,
мещается из цитозоля на актиновый филамент,
чем сердца мышей дикого типа [35]. В том слу-
где он взаимодействует не непосредственно с
чае, если путем скрещивания удавалось полу-
интактным актином, а с минорными белками,
чить линию мышей с нокаутом гена HspB2 и
связанными с актином или расположенными
оверэкспрессией HspB5, то после ишемии/ре-
в непосредственной близости от нитей актина
перфузии происходило медленное восстанов-
(титином, филамином С, компонентами тро-
ление уровня АТР и фосфокреатина, но при
понина). Такого рода взаимодействие защища-
этом происходило практически полное вос-
ет эти белки от избыточного растяжения или
становление сократительной активности [36].
протеолитической деградации и тем самым
На основе этих результатов был сделан вывод о
обеспечивает защиту сократительного аппара-
том, что HspB2 участвует в поддержании энер-
та от неблагоприятных воздействий.
гетического протеостаза, а HspB5 защищает и
стабилизирует сократительный аппарат. Как и
в случае других малых белков теплового шока,
HspB2 и HspB3, ТКАНЕСПЕЦИФИЧНЫЕ
ишемия/реперфузия сопровождается переме-
ПРЕДСТАВИТЕЛИ СЕМЕЙСТВА МАЛЫХ
щением HspB2 на сократительный аппарат [37,
БЕЛКОВ ТЕПЛОВОГО ШОКА
38]. Ингибирование протеасомной системы
также сопровождается транслокацией HspB2
HspB2 и HspB3 экспрессируются в мыш-
и HspB3 на сократительный аппарат [39]. Ско-
цах, сенсорных и моторных нейронах и склон-
рее всего, такие перемещения нельзя считать
ны образовывать гетероолигомерные комплек-
специфическими, и HspB2, как и HspB3 напря-
сы со стехиометрией HspB2/HspB3, равной
мую не участвуют в регуляции сократительной
3/1 (таблица) [30]. HspB2 способен активиро-
активности и лишь неспецифически связыва-
вать Ser/Thr-протеинкиназу (так называемую
ются с сократительным аппаратом.
БИОХИМИЯ том 87 вып. 8 2022
1150
МУРАНОВА и др.
α-КРИСТАЛЛИНЫ
лин-подобными доменами I26 и I27 титина, а не
И АКТИНОВЫЕ МИКРОФИЛАМЕНТЫ
с разупорядоченными PEVK-участками этого
белка (рис. 1, таблица) [25, 44]. При дистрофии
αА-кристаллин (HspB4) и αВ-кристаллин
Лейдена (дистрофия и слабость проксимальных
(HspB5) получили свое название вследствие
групп скелетных мышц) и при дилятационной
того, что являются одними из основных белков
кардиомиопатии HspB5 оказывается способ-
хрусталика глаза и обеспечивают его прозрач-
ным связываться и с PEVK-участками титина
ность, предотвращая агрегацию других белков
[25]. Тот факт, что в кардиомиоцитах при дли-
хрусталика (таблица). HspB4 экспрессируется
тельной гипоксии HspB5 связывается вдоль
только в хрусталике глаза, в то время как HspB5
всего актинового филамента (аналогичная ло-
экспрессируется практически повсеместно [5-
кализация характерна для миофибрилл скелет-
7]. В ранних работах было показано, что нефрак-
ных мышц) [21], может свидетельствовать о том,
ционированный α-кристаллин глаза, так же как
что этот малый белок теплового шока, по-ви-
αА- и αВ-кристаллины, способен ингибировать
димому, может связываться с различными им-
агрегацию фибриллярного актина, индуциро-
муноглобулин-подобными доменами титина.
ванную нагреванием. Помимо этого, оказалось,
Связывание HspB5 предотвращает чрезмерное
что кристаллины способны предотвращать де-
растяжение и происходящую вследствие этого
полимеризацию фибриллярного актина, вы-
агрегацию титина. Вероятно, именно вслед-
званную цитохалазином D [40]. При этом было
ствие этого HspB5 способен предотвращать
высказано предположение, что защитное дей-
тяжелые повреждения сократительного аппа-
ствие кристаллина связано с тем, что первичная
рата кардиомиоцитов, вызываемые ишемией/
структура пептида актина, ограниченного остат-
реперфузией [36]. Завершая этот раздел, можно
ками 63-70 (GILTLKYP), похожа на первичную
заключить, что взаимодействие HspB5 и HspB1
структуру пептида, ограниченного остатками
с актиновыми филаментами во многом похоже.
141-148 в αВ-кристаллине (GVLTVMGP), из-за
Оба малых белка теплового шока обеспечива-
чего эти белки могут взаимодействовать друг с
ют стабилизацию тонких филаментов за счет
другом [40]. В исследованиях на кардиомиобла-
взаимодействия с регуляторными минорными
стах крысы Н9С2 было установлено, что в со-
белками актинового филамента (титином, фи-
стоянии покоя большая часть HspB5 находится
ламином, компонентами тропонина) или бел-
в цитозоле и лишь около 23% этого белка связа-
ками, взаимодействующими с актиновыми фи-
но с сократительным аппаратом, в то время как
ламентами (например, белками промежуточных
прогревание сопровождается перемещением
филаментов) [38].
83% HspB5 на сократительный аппарат [41]. Эти
результаты хорошо согласуются с ранее опу-
бликованными данными, свидетельствующи-
МАЛЫЙ БЕЛОК
ми о том, что различные стрессорные воздей-
ТЕПЛОВОГО ШОКА HspB6 (Hsp20)
ствия сопровождаются транслокацией HspB5
И ЕГО ВЗАИМОДЕЙСТВИЕ
из цитозоля на сократительный аппарат, и при
С АКТИНОВЫМИ ФИЛАМЕНТАМИ
этом эффективность перемещения тем выше,
чем тяжелее условия, вызывающие стресс [21,
В отличие от трёх ранее описанных белков
42]. В случае миофибрилл сердца в мягких ус-
(HspB1, HspB4, HspB5), которые представле-
ловиях гипоксии HspB5 сначала связывается с
ны в виде очень крупных олигомеров, вклю-
тонкими филаментами вблизи Z-диска, а в бо-
чающих в свой состав 24 и более субъединиц
лее жестких условиях гипоксии локализуется
[16, 45], малый белок теплового шока HspB6
почти по всей длине тонкого филамента [42].
преимущественно представлен в виде димеров
Более подробный анализ локализации HspB5
(таблица) [46, 47]. Этот белок склонен образо-
на актиновом филаменте привел к выводу о
вывать гетероолигомерные комплексы с HspB1
том, что в ходе гипоксии HspB5 перемещает-
и HspB5 [48, 49] и преимущественно локали-
ся на N2-линию тонкого филамента (рис. 1) и
зуется в цитозоле гладких и сердечных мышц
остается связанным даже после полной экс-
[50, 51]. HspB6 может подвергаться фосфори-
тракции актина 1M NaSCN или 1М мочевиной.
лированию под действием сАМР- и cGMP-
Эти факты свидетельствовали о том, что HspB5
зависимых протеинкиназ по остатку Ser16, и
преимущественно связывается с титином, кото-
этот процесс оказывает существенное влияние
рый располагается вдоль актинового филамента
на функциональную активность этого белка.
[43]. Изучение взаимодействия HspB5 с тити-
В случае кардиомиоцитов фосфорилирование
ном показало, что малый белок теплового шока
HspB6 или введение короткого N-концевого
преимущественно связывается с иммуноглобу-
пептида, содержащего фосфорилированный
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1151
остаток серина, ускоряет процесс расслабления
филаментами, ни с миофибриллами [59]. Это
[50, 52]. Принято считать, что индуцированное
ставило под сомнение обе гипотезы. К тому же
катехоламинами повышение концентрации
оказалось, что короткий пептид, содержащий
сАМР приводит к фосфорилированию HspB6,
фосфорилированный остаток Ser16 HspB6 и не
который вместе с фосфорилированным инги-
способный напрямую связываться с актином,
битором фосфатазы I типа ингибирует актив-
может вызывать расслабление различных ти-
ность фосфатазы. Это приводит к увеличению
пов гладких мышц [60, 61]. Подробный анализ
степени фосфорилирования фосфоламбана,
этого эффекта позволил установить, что этот
активирующего Са-АТРазу саркоплазматиче-
фосфорилированный пептид так же, как и пол-
ского ретикулума, и тем самым ускоряет рас-
норазмерный фосфорилированный HspB6, взаи-
слабление сердечной мышцы [50, 52]. Таким
модействует со всеми семью изоформами уни-
образом, в этом случае фосфорилирование
версального адаптерного белка 14-3-3 [62, 63].
HspB6 сопровождается изменением одной из
Было высказано предположение, что фосфори-
важных транспортных АТРаз, отвечающих за
лированный HspB6 прочно связывается с 14-3-3
регуляцию сократительной активности сердца.
и при этом вытесняет фосфорилированный
Нитровазодилятаторы, такие как нитро-
кофилин, находившийся в комплексе с 14-3-3.
глицерин, вызывали расслабление гладких
Освободившийся фосфорилированный кофи-
мышц без существенного изменения уровня
лин быстро подвергается дефосфорилированию
фосфорилирования легких цепей миозина, и
под действием фосфатаз и вызывает деполиме-
этот эффект сопровождался фосфорилирова-
ризацию актина, следствием чего является рас-
нием HspB6 [53]. При этом было обнаружено,
слабление гладких мышц [61]. Проверка этой
что в структуре HspB6 есть пептид, первичная
привлекательной гипотезы показала ее несостоя-
структура которого похожа на соответствующий
тельность. Оказалось, что фосфорилирован-
пептид в структуре тропонина I [53]. Поэтому
ный кофилин не способен взаимодействовать с
было высказано предположение, что фосфо-
14-3-3, и поэтому расслабление гладких мышц,
рилирование может влиять на ингибирующую
вызываемое фосфорилированным HspB6, не
активность этого участка HspB6. Параллельно
может быть связано с вытеснением кофилина
с этим были получены данные, свидетельствую-
из его комплекса с 14-3-3 [64]. Более вероятным
щие в пользу того, что HspB6 может напрямую
представляется предположение о том, что фос-
взаимодействовать с актином и α-актинином и
форилированный HspB6 вытесняет из комплек-
что фосфорилирование HspB6 ослабляет взаи-
са с 14-3-3 не идентифицированные на сегод-
модействие этого малого белка теплового шока
няшний день белки или ферменты (например,
с актином и компонентами актинового фила-
протеинкиназы или фосфатазы), которые тем
мента [54, 55]. Были высказаны две противоре-
или иным образом влияют либо на кофилин,
чащих друг другу гипотезы, пытающиеся объ-
либо на какие-то другие актин-связывающие
яснить эффект фосфорилирования HspB6 на
белки [64]. Высказанное в последнее время
расслабление гладких мышц. Согласно первой
предположение о том, что в сердечной мышце
гипотезе, располагающийся на актиновом фи-
фосфорилированный HspB6 может участвовать
ламенте HspB6 может ингибировать взаимодей-
в ремоделировании актиновых филаментов пу-
ствие миозина с актином, и фосфорилирование
тем вытеснения фосфорилированного кофили-
усиливает ингибирующий эффект HspB6, что
на из его комплекса с 14-3-3 [65], представляет-
приводит к расслаблению [56, 57]. Согласно вто-
ся необоснованным и крайне маловероятным
рой гипотезе, в нефосфорилированном состоя-
по причинам, описанным выше.
нии HspB6 стабилизирует актиновые филамен-
Завершая этот раздел, можно заключить, что
ты и их взаимодействие с актин-связывающими
HspB6 не является истинным актин-связываю-
белками, а фосфорилирование HspB6 приво-
щим белком, и его влияние на актиновый цито-
дит к дестабилизации актиновых филаментов,
скелет может быть опосредовано взаимодействи-
их частичной деполимеризации и в конечном
ем с универсальным адаптерным белком 14-3-3.
итоге приводит к расслаблению гладких мышц
[54, 55, 58]. Несмотря на различный механизм,
предлагаемый этими гипотезами, они обе бази-
РОЛЬ HspB7 (cvHsp) В ПОДДЕРЖАНИИ
ровались на предположении, что HspB6 являет-
СТРУКТУРЫ И ЛОКАЛИЗАЦИИ
ся актин-связывающим белком. Мы пытались
АКТИНОВЫХ ФИЛАМЕНТОВ
проверить это предположение и при этом оказа-
лось, что HspB6 ни в фосфорилированном, ни в
HspB7 был описан сравнительно недав-
нефосфорилированном состоянии не способен
но [66] и поэтому охарактеризован в меньшей
прочно взаимодействовать ни с актиновыми
степени по сравнению с другими представите-
БИОХИМИЯ том 87 вып. 8 2022
1152
МУРАНОВА и др.
лями семейства малых белков теплового шока
вать с титином [74]. Уменьшение синтеза HspB7
(таблица). Этот белок преимущественно синте-
сопровождается компенсаторным увеличением
зируется в сердце, скелетных мышцах и жиро-
синтеза HspB5 и усилением аутофагии, а инги-
вой ткани [5, 66]. В условиях in vitro рекомби-
бирование аутофагии приводит к накоплению
нантный HspB7 представлен как в виде малых
агрегатов филамина С [74]. Учитывая тот факт,
олигомеров (вероятно, димеров), так и очень
что HspB7 способен взаимодействовать как с
крупных олигомеров [67]. Как и большинство
титином, так и с филамином С, высказывается
других малых белков теплового шока, в нор-
предположение, что при большом растяжении
мальных условиях HspB7 в основном локализу-
филамин переходит из Z-диска на наиболее де-
ется диффузно в цитозоле, а после различных
формированные и растянутые участки титина,
стрессорных воздействий перемещается на
и HspB7 каким-то образом может участвовать в
сократительный аппарат [21]. Некоторые экс-
этом процессе [69]. Считается, что HspB7 игра-
периментальные данные [68] свидетельствуют
ет важную роль в сборке актиновых филамен-
о том, что рекомбинантный HspB7, несущий
тов в ходе развития сердца [68]. При анализе
His-метку, способен связываться как G-, так
белкового состава мышц икроножной мышцы
и с F-актином и влиять на скорость полиме-
молодых (3 мес.) и старых (30 мес.) крыс было
ризации актина [68]. Нам кажется, что пред-
выявлено, что в ходе саркопении (возрастного
ставленные данные, полученные только с ис-
изменения мышц) происходит значительное
пользованием метода дот-блота, недостаточно
увеличение синтеза HspB7 [75]. Таким образом,
убедительны, и требуются дополнительные ис-
можно заключить, что HspB7 взаимодействует
следования для подтверждения прямого взаи-
с большим количеством различных актин-свя-
модействия HspB7 с актином. В то же время
зывающих белков, может участвовать в сбор-
нет сомнений в том, что этот белок играет ис-
ке актиновых филаментов и поддержании их
ключительно важную роль в правильной сбор-
функциональной активности.
ке актиновых филаментов и их локализации в
клетке. Установлено, что HspB7 прочно взаи-
модействует с С-концевым доменом филами-
HspB8 (Hsp22) И ШАПЕРОН-ЗАВИСИМАЯ
на С, обеспечивающим его димеризацию [69].
ИЗБИРАТЕЛЬНАЯ АУТОФАГИЯ
Удаление 16 С-концевых а.о. филамина С пред-
(CASA, CHAPERONE-ASSISTED
отвращает его связывание с HspB7 и сопровож-
SELECTIVE AUTOPHAGY)
дается перемещением филамина С из области
Z-диска в участки сократительного аппарата,
Малый белок теплового шока HspB8 экс-
наиболее подвергшиеся механическому растя-
прессируется практически во всех органах и
жению (рис. 1, таблица) [69]. Нокаут гена HspB7
тканях [5, 76]. В отличие от большинства малых
приводит к увеличению синтеза филамина С и
белков теплового шока, HspB8 преимуществен-
изменению внутриклеточной локализации сар-
но представлен в виде мономеров и/или малых
когликанов γ и δ без изменения локализации
олигомеров [77]. Считается, что в отличие от
дистрофина [70]. В этой связи высказывается
других малых белков теплового шока, HspB8
предположение о том, что HspB7 каким-то об-
слабо связывается с актиновыми филамента-
разом влияет на взаимодействие филамина С и
ми, хотя миофибриллы все же прокрашиваются
белков дистрофинового комплекса [70]. С этим
антителами на HspB8 [78]. Было установлено,
предположением согласуются данные, получен-
что HspB8 взаимодействует с универсальным
ные на мышах линии mdx, используемых при
адаптерным белком Bag3 и шаперонная актив-
изучении мышечной дистрофии, сцепленной с
ность HspB8 целиком зависит от его способно-
Х-хромосомой. В этом случае оказалось, что у
сти связываться с Bag3 [79]. В структуре Bag3
таких мышей увеличивается количество HspB7
есть 2 участка, содержащих консервативную
в цитозоле и уменьшается количество дистро-
последовательность IPV. Эти участки способны
гликанов в примембранном слое [71, 72]. У
взаимодействовать с гидрофобным карманом,
мышей с нокаутом гена HspB7 в сердце не про-
образованным β4-β8 складками α-кристалли-
исходит значительных изменений структуры
нового домена HspB8, обеспечивать формиро-
саркомеров, но выявляются значительные из-
вание прочного комплекса между двумя бел-
менения в интеркалирующих дисках, увеличи-
ками и стабилизировать структуру внутренне
вается синтез филамина С, происходит измене-
разупорядоченного Bag3 [80, 81]. Позднее было
ние локализации N-кадгерина и десмоплакина,
показано, что Bag3 способен взаимодействовать
а также белков, участвующих в формировании
и с другими малыми белками теплового шока,
интеркалирующих дисков [73]. Установлено,
такими как HspB1, HspB2, HspB5 и HspB6, од-
что в сердце HspB7 способен взаимодейство-
нако прочность комплексов, образованных эти-
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1153
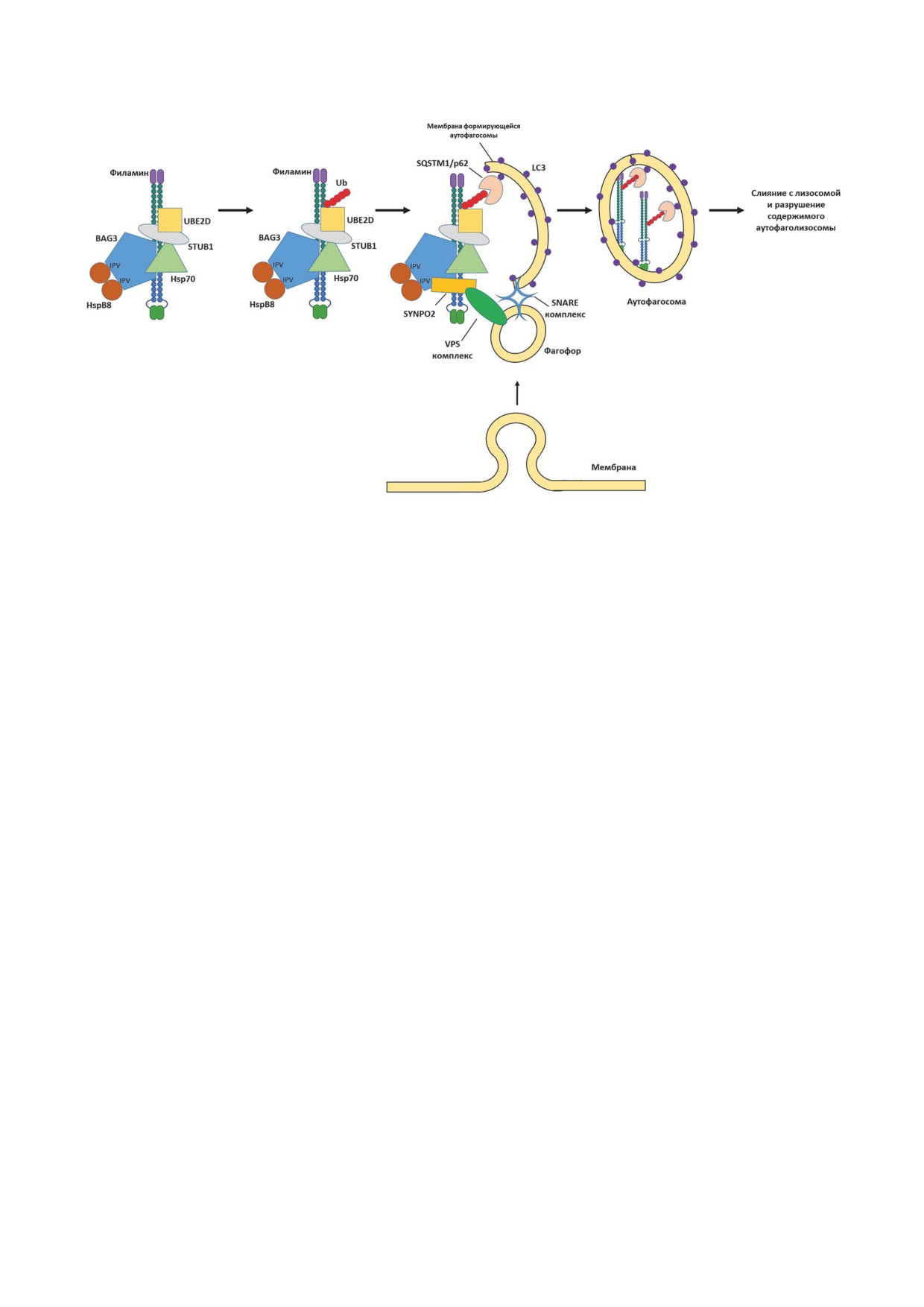
Рис. 2. Схема образования аутофагосомы в клетке. Белки сократительного аппарата клетки (например, филамин) могут
претерпевать частичную денатурацию или потерю активности во время физической работы или при стрессе. Такие не-
функциональные белки разрушаются под действием мультишаперонного комплекса, формирующегося на основе бел-
ка-адаптера Bag3, выступающего в роли платформы для сборки. Несколько центров связывания (на схеме указаны как
IPV) позволяют Bag3 привлекать HspB8, а другой участок Bag3 связывается с ATP-зависимым шапероном Hsp70. В даль-
нейшем такой тройной комплекс взаимодействует с убиквитин-конъюгирующими ферментами STUB1 и UBE2D, кото-
рые переносят убиквитин (Ub) на белок-субстрат. Белковый комплекс, собранный на платформе Bag3, вместе с убик-
витинилированным субстратом участвует в индукции процесса шаперон-зависимой избирательной аутофагии (CASA).
Мембрана формирующейся аутофагосомы содержит мембранный белок LC3, способный рекрутировать SQSTM1/p62.
Такой комплекс привлекает белок-субстрат за счет взаимодействия SQSTM1/p62 с убиквитином. Рост аутофагосомы
происходит за счет привлечения мембран фагофоров комплексом SYNPO2 и VPS, взаимодействующих с платформой
Bag3, а их слияние с мембраной формирующейся аутофагосомы обеспечивается белковым комплексом SNARE. Разру-
шение белков-субстратов происходит после слияния аутофагосомы с лизосомой
ми белками с Bag3 много меньше прочности
витинирование белка-субстрата обеспечивает
комплекса с HspB8, и поэтому в клетке имен-
взаимодействие этого белкового комплекса с
но HspB8 является истинным партнером Bag3
рецептором убиквитина SQSTM1/p62, распо-
[82, 83]. Следует особо подчеркнуть, что Bag3
ложенном на мембране фагофоров. Помимо
является универсальным адаптером, способным
этого, Bag3 взаимодействует с дополнительным
взаимодействовать со всеми белками теплового
адаптерным белком SYNPO2 (синаптоподи-
шока, белками ССТ (шаперонинами, относя-
ном 2 или миоподином), который обеспечи-
щимся к семейству Hsp60), Hsp70 и практиче-
вает взаимодействие с белковым комплексом
ски со всеми малыми белками теплового шока
VPS [85]. Процесс завершается образованием
[84]. Вероятно, именно поэтому ингибирование
аутофагосомы (рис. 2), в которой после слия-
синтеза Bag3 под действием малой интерфери-
ния с лизосомой происходит избирательный
рующей РНК подавляет синтез правильно свер-
убиквитин-зависимый протеолиз белка-мише-
нутого актина [84].
ни [86]. Весь этот белковый комплекс распола-
Bag3 является своеобразной платформой,
гается вблизи Z-диска. При этом Bag3 связыва-
на которой происходит сборка сложного бел-
ется с доменами d19-d21 филамина, наиболее
кового комплекса (рис. 2). С одной стороны,
подверженным деформации в ходе избыточных
как уже отмечалось, Bag3 связывает HspB8. Ис-
мышечных сокращений, привлекает комплекс
пользуя другие центры, Bag3 взаимодействует с
остальных белков и осуществляет протеолиз
Hsp70 и ускоряет обмен адениловых нуклеоти-
денатурированного филамина. Считается, что
дов в активном центре Hsp70. С другой сторо-
при этом Bag3 может освобождать факторы
ны, связавшийся с Bag3 Hsp70 взаимодействует
транскрипции YAP/TAZ из комплекса с инги-
со специфической убиквитин-лигазой STUB1,
биторными белками, что приводит к активации
которая, в свою очередь, связывается с убик-
синтеза филамина de novo [86, 87]. Весь этот
витин-конъюгирующим ферментом UBE2D,
сложный механизм находится под контролем и
убиквитинирующим белок-субстрат [85]. Убик-
может регулироваться путем фосфорилирова-
БИОХИМИЯ том 87 вып. 8 2022
1
154
МУРАНОВА и др.
ния под действием нескольких протеинкиназ.
себя не только ремоделирование цитоскелета и
Например, протеинкиназа ST38 способна свя-
сократительного аппарата, но и процессы, свя-
зываться с Bag3 и ингибировать зависящий от
занные с метаболизмом углеводов и жирных
этого белка процесс аутофагии [88].
кислот, энергетического обеспечения клетки, а
Зависящий от Bag3 и HspB8 процесс из-
также поддержания окислительно-восстанови-
бирательного протеолиза играет важную роль
тельного потенциала [93].
не только в поддержании функциональной ак-
тивности скелетных мышц, но и оказывается
вовлеченным в ремоделирование актиново-
ЗАКЛЮЧЕНИЕ
го скелета различных клеток. Так, например,
установлено, что ингибирование синтеза Bag3
Представленные данные свидетельствуют
и/или HspB8 сопровождается дезорганизацией
о том, что малые белки теплового шока игра-
актиновых филаментов, участвующих в пра-
ют важную роль в поддержании структуры и
вильной локализации митотического верете-
свойств актиновых филаментов. Стресс мо-
на, и нарушениями в распределении хромосом
жет сопровождаться частичной денатурацией
в ходе митоза [89]. Продолжение исследований
актина. Концентрация актина в мышечных
в этом направлении показало, что ингибиро-
клетках очень высока и достигает миллимо-
вание синтеза HspB8 приводит к уменьше-
лярных величин. Малые белки теплового шока
нию синтеза Bag3. Эти процессы приводят к
обладают шапероноподобной активностью и
замедлению цитокинеза, накоплению не пол-
поэтому узнают и взаимодействуют с частично
ностью разделившихся после митоза клеток
денатурированными белками. Вследствие того,
HeLa и клеток, содержащих несколько ядер
что концентрация актина столь велика, стресс,
[90]. Этот эффект может быть частично обра-
вызывающий частичную денатурацию акти-
щен соединениями, способствующими депо-
на, будет неизбежно сопровождаться массовой
лимеризации актина, что может означать, что
миграцией sHsp из цитозоля на актиновый фи-
в ходе митоза комплекс HspB8-Bag3 каким-то
ламент. При этом концентрация sHsp несопо-
образом влияет либо на сборку актиновых фи-
ставимо мала по сравнению с концентрацией
ламентов, либо приводит к частичной деполи-
актина и поэтому малые белки теплового шока
меризации актина [90]. Возможно, HspB8 ста-
не способны непосредственно влиять на свой-
билизирует структуру фосфорилированного
ства актинового филамента. Не являясь ис-
Bag3, который взаимодействует с различными
тинными актин-связывающими белками, sHsp
актин-связывающими белками (такими как
взаимодействуют с гигантскими эластичными
CapZ, немышечный миозин II или Arp2/3),
актин-связывающими белками (титином, фи-
что может влиять на распределение и структу-
ламином), разнообразными регуляторными
ру актиновых филаментов. Полученные экспе-
(тропонин) или адаптерными белками (14-3-3,
риментальные данные свидетельствуют о том,
Bag3) и таким образом опосредованно влияют
что комплекс HspB8-Bag3 может связывать и
на ремоделирование и целостность актиновых
ингибировать активность гистондеацетилазы 6
филаментов. Таким образом, механизм влия-
(HDAC6), которая способна деацетилировать
ния малых белков теплового шока на актино-
актин-связывающий белок кортактин. Ацети-
вые филаменты много более сложен, чем пред-
лированная форма кортактина препятствует
ставлялось ранее, и потребуются обширные
нормальному функционированию комплек-
дополнительные исследования для подробно-
са Arp2/3, ветвлению нитей актина и тем са-
го анализа взаимодействия и влияния малых
мым способствует нормальному протеканию
белков теплового шока на функционирование
митоза [91]. Как уже отмечалось, белковый
различных актин-связывающих белков.
комплекс, обеспечивающий протекание ша-
перон-зависимой избирательной аутофагии,
Вклад авторов. Л.К.М. - подбор данных ли-
сложно регулируется. С этим комплексом мо-
тературы; В.М.Ш. - подбор данных литерату-
жет связываться циклин-зависимая протеин-
ры, подготовка рисунков; Н.Б.Г. - обсуждение
киназа СDK1, которая способна фосфорили-
собранных данных и подготовка текста обзора.
ровать Thr285 в структуре Bag3 и повышать его
Финансирование. Работа выполнена при
активность при митозе [92].
финансовой поддержке гранта РНФ № 20-74-
Завершая это раздел, можно заключить,
00013 (Л.К.М.), а также при поддержке Междис-
что HspB8 образует прочный комплекс с мно-
циплинарной научно-образовательной школы
гофункциональным белком Bag3 и таким об-
Московского университета
«Молекулярные
разом может влиять на многочисленные про-
технологии живых систем и синтетическая био-
цессы, протекающие в клетке и включающие в
логия» (Н.Б.Г.).
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1155
Благодарности. В
2022 году могло бы
Авторы посвящают эту работу светлой памяти
исполниться
80 лет Андрею Дмитриевичу
этого замечательного ученого.
Виноградову, который был одним из лидеров
Конфликт интересов. Авторы заявляют об
отечественной биоэнергетики, блестящим
отсутствии конфликта интересов.
лектором и ярким критически мыслящим уче-
Соблюдение этических норм. Настоящая
ным. А.Д. Виноградов на протяжении десяти
статья не содержит описания выполнен-
лет возглавлял кафедру биохимии и способ-
ных авторами исследований с участием лю-
ствовал развитию исследований в области био-
дей и использованием животных в качестве
химии мышц и анализу процессов протеостаза.
объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Janowska, M. K., Baughman, H. E. R., Woods,
11.
Wettstein, G., Bellaye, P. S., Micheau, O., and
C. N., and Klevit, R. E. (2019) Mechanisms of small
Bonniaud, P.
(2012) Small heat shock proteins
heat shock proteins, Cold Spring Harb. Perspect. Biol.,
and the cytoskeleton: An essential interplay for cell
11, a034025, doi: 10.1101/cshperspect.a034025.
integrity? Int. J. Biochem. Cell Biol., 44, 1680-1686,
2.
Riedl, M., Strauch, A., Catici, D. A. M., and
doi: 10.1016/j.biocel.2012.05.024.
Haslbeck, M.
(2020) Proteinaceous transformers:
12.
Mounier, N., and Arrigo, A. P.
(2002) Actin
Structural and functional variability of human sHsps,
cytoskeleton and small heat shock proteins: How
Int. J. Mol. Sci., 21, 5448, doi: 10.3390/ij ms21155448.
do they interact? Cell Stress Chaperones, 7, 167-176,
3.
Kriehuber, T., Rattei, T., Weinmaier, T., Bepperling,
doi: 10.1379/1466-1268(2002)007<0167:acashs>2.0.co;2.
A., Haslbeck, M., et al. (2010) Independent evolution
13.
Miron, T., Wilchek, M., and Geiger, B.
(1988)
of the core domain and its flanking sequences in
Characterization of an inhibitor of actin
small heat shock proteins, FASEB J., 24, 3633-3642,
polymerization in vinculin-rich fraction of turkey
doi: 10.1096/fj.10-156992.
gizzard smooth muscle, Eur. J. Biochem.,
178,
4.
Bourrelle-Langlois, M., Morrow, G., Finet, S.,
543-553, doi: 10.1111/j.1432-1033.1988.tb14481.x.
and Tanguay, R. M. (2016) In vitro structural and
14.
Miron, T., Vancompernolle, K., Vandekerckhove,
functional characterization of the small heat shock
J., Wilchek, M., and Geiger, B. (1991) A 25-kDa
Proteins (sHSP) of the cyanophage S-ShM2 and
inhibitor of actin polymerization is a low molecular
its host, Synechococcus sp. WH7803, PLoS One, 11,
mass heat shock protein, J. Cell Biol., 114, 255-261,
e0162233, doi: 10.1371/journal.pone.0162233.
doi: 10.1083/jcb.114.2.255.
5.
Vos, M. J., Kanon, B., and Kampinga, H. H. (2009)
15.
Benndorf, R., Hayess, K., Ryazantsev, S.,
HSPB7 is a SC35 speckle resident small heat shock
Wieske, M., Behlke, J., et al. (1994) Phosphorylation
protein, Biochim. Biophys. Acta, 1793, 1343-1353,
and supramolecular organization of murine small heat
doi: 10.1016/j.bbamcr.2009.05.005.
shock protein HSP25 abolish its actin polymerization-
6.
Kappé, G., Franck, E., Verschuure, P., Boelens,
inhibiting activity, J. Biol. Chem., 269, 20780-20784.
W. C., Leunissen, J. A., et al.
(2003) The
16.
Jovcevski, B., Kelly, M. A., Rote, A. P., Berg, T.,
human genome encodes
10 alpha-crystallin-
Gastall, H. Y., et al.
(2015) Phosphomimics
related small heat shock
proteins: HspB1-10,
destabilize Hsp27 oligomeric assemblies and enhance
Cell Stress Chaperones,
8,
53-61, doi:
10.1379/
chaperone activity, Chem. Biol.,
22,
186-195,
1466-1268(2003)8<53:thgecs>2.0.co;2.
doi: 10.1016/j.chembiol.2015.01.001.
7.
Fontaine, J. M., Rest, J. S., Welsh, M. J.,
17.
Wieske, M., Benndorf, R., Behlke, J., Dolling, R.,
and Benndorf, R.
(2003) The sperm outer
Grelle, G., et al. (2001) Defined sequence segments
dense fiber protein is the
10th member of the
of the small heat shock proteins HSP25 and
superfamily of mammalian small stress proteins,
alphaB-crystallin inhibit actin polymerization,
Cell Stress Chaperones,
8,
62-69, doi:
10.1379/
Eur. J. Biochem.,
268,
2083-2090, doi:
10.1046/
1466-1268(2003)8<62:tsodfp>2.0.co;2
j.1432-1327.2001.02082.x.
8.
Cristofani, R., Piccolella, M., Crippa, V.,
18.
Panasenko, O. O., Kim, M. V., Marston, S. B.,
Tedesco, B., Montagnani Marelli, M., et al. (2021)
and Gusev, N. B. (2003) Interaction of the small
The role of HSPB8, a component of the chaperone-
heat shock protein with molecular mass 25 kDa
assisted selective autophagy machinery, in cancer,
(hsp25) with actin, Eur. J. Biochem., 270, 892-901,
Cells, 10, 335, doi: 10.3390/cells10020335.
doi: 10.1046/j.1432-1033.2003.03449.x.
9.
Arrigo, A. P. (2013) Human small heat shock proteins:
19.
Pivovarova, A. V., Mikhailova, V. V., Chernik,
Protein interactomes of homo- and hetero-oligomeric
I. S., Chebotareva, N. A., Levitsky, D. I., et al.
complexes: an update, FEBS Lett., 587, 1959-1969,
(2005) Effects of small heat shock proteins on the
doi: 10.1016/j.febslet.2013.05.011.
thermal denaturation and aggregation of F-actin,
10.
Xiong, J., Li, Y., Tan, X., and Fu, L. (2020) Small
Biochem. Biophys. Res. Commun., 331, 1548-1553,
heat shock proteins in cancers: Functions and
doi: 10.1016/j.bbrc.2005.04.077.
therapeutic potential for cancer therapy, Int. J. Mol.
20.
Pivovarova, A. V., Chebotareva, N. A., Chernik,
Sci., 21, 6611, doi: 10.3390/ij ms21186611.
I. S., Gusev, N. B., and Levitsky, D. I. (2007) Small
БИОХИМИЯ том 87 вып. 8 2022
1
156
МУРАНОВА и др.
heat shock protein Hsp27 prevents heat-induced
al aspects, PLoS One,
7, e29810, doi:
10.1371/
aggregation of F-actin by forming soluble complexes
journal.pone. 0029810.
with denatured actin, FEBS J.,
274,
5937-5948,
32.
Morelli, F. F., Verbeek, D. S., Bertacchini, J.,
doi: 10.1111/j.1742-4658.2007.06117.x.
Vinet, J., Mediani, L., et al.
(2017) Aberrant
21.
Golenhofen, N., Perng, M. D., Quinlan, R. A., and
compartment formation by HSPB2 mislocalizes
Drenckhahn, D. (2004) Comparison of the small heat
lamin A and compromises nuclear integrity and
shock proteins alphaB-crystallin, MKBP, HSP25,
function, Cell Rep.,
20,
2100-2115, doi:
10.1016/
HSP20, and cvHSP in heart and skeletal muscle,
j.celrep.2017.08.018.
Histochem. Cell Biol., 122, 415-425, doi: 10.1007/
33.
Tiago, T., Hummel, B., Morelli, F. F., Basile, V.,
s00418-004-0711-z.
Vinet, J., et al. (2021) Small heat-shock protein
22.
Lavoie, J. N., Hickey, E., Weber, L. A., and
HSPB3 promotes myogenesis by regulating
Landry, J. (1993) Modulation of actin microfilament
the lamin B receptor, Cell Death Dis., 12, 452,
dynamics and fluid phase pinocytosis by
doi: 10.1038/s41419-021-03737-1.
phosphorylation of heat shock protein 27, J. Biol.
34.
Shama, K. M., Suzuki, A., Harada, K., Fujitani, N.,
Chem., 268, 24210-24214.
Kimura, H., et al. (1999) Transient up-regulation
23.
Lavoie, J. N., Lambert, H., Hickey, E., Weber,
of myotonic dystrophy protein kinase-binding pro-
L. A., and Landry, J. (1995) Modulation of cellular
tein, MKBP, and HSP27 in the neonatal myocar-
thermoresistance and actin filament stability
dium, Cell Struct. Funct.,
24,
1-4, doi:
10.1247/
accompanies phosphorylation-induced changes in the
csf.24.1.
oligomeric structure of heat shock protein 27, Mol.
35.
Morrison, L. E., Whittaker, R. J., Klepper, R. E.,
Cell. Biol., 15, 505-516, doi: 10.1128/MCB.15.1.505.
Wawrousek, E. F., and Glembotski, C. C. (2004)
24.
Hu, X., Van Marion, D. M. S., Wiersma, M.,
Roles for alphaB-crystallin and HSPB2 in protecting
Zhang, D., and Brundel, B. (2017) The protective role
the myocardium from ischemia-reperfusion-induced
of small heat shock proteins in cardiac diseases: Key
damage in a KO mouse model, Am. J. Physiol.
role in atrial fibrillation, Cell Stress Chaperones, 22,
Heart Circ. Physiol., 286, H847-H855, doi: 10.1152/
665-674, doi: 10.1007/s12192-017-0799-4.
ajpheart.00715.2003.
25.
Kotter, S., Unger, A., Hamdani, N., Lang, P.,
36.
Pinz, I., Robbins, J., Rajasekaran, N. S., Benjamin,
Vorgerd, M., et al. (2014) Human myocytes are
I. J., and Ingwall, J. S. (2008) Unmasking different
protected from titin aggregation-induced stiffening by
mechanical and energetic roles for the small heat
small heat shock proteins, J. Cell Biol., 204, 187-202,
shock proteins CryAB and HSPB2 using genetically
doi: 10.1083/jcb.201306077.
modified mouse hearts, FASEB J.,
22,
84-92,
26.
Tucker, N. R., and Shelden, E. A. (2009) Hsp27
doi: 10.1096/fj.07-8130com.
associates with the titin filament system in heat-
37.
Yoshida, K., Aki, T., Harada, K., Shama, K. M.,
shocked zebrafish cardiomyocytes, Exp. Cell Res., 315,
Kamoda, Y., et al. (1999) Translocation of HSP27
3176-3186, doi: 10.1016/j.yexcr.2009.06.030.
and MKBP in ischemic heart, Cell Struct. Funct., 24,
27.
Lu, X. Y., Chen, L., Cai, X. L., and Yang, H. T.
181-185, doi: 10.1247/csf.24.181.
(2008) Overexpression of heat shock protein
27
38.
Golenhofen, N., Redel, A., Wawrousek, E. F.,
protects
against
ischaemia/reperfusion-induced
and Drenckhahn, D.
(2006) Ischemia-induced
cardiac dysfunction via stabilization of troponin I
increase of stiffness of alphaB-crystallin/HSPB2-
and T, Cardiovasc. Res., 79, 500-508, doi: 10.1093/
deficient myocardium, Pflugers Arch., 451, 518-525,
cvr/cvn091.
doi: 10.1007/s00424-005-1488-1.
28.
Martinez-Laorden, E., Almela, P., Milanes, M. V.,
39.
Verschuure, P., Croes, Y., van den Ijssel, P. R.,
and Laorden, M. L.
(2015) Expression of heat
Quinlan, R. A., de Jong, W. W., et al.
(2002)
shock protein 27 and troponin T and troponin I
Translocation of small heat shock proteins to the
after naloxone-precipitated morphine withdrawal,
actin cytoskeleton upon proteasomal inhibition,
Eur. J. Pharmacol.,
766,
142-150, doi:
10.1016/
J. Mol. Cell. Cardiol., 34, 117-128, doi: 10.1006/
j.ejphar.2015.10.006.
jmcc.2001.1493.
29.
Collier, M. P., Alderson, T. R., de Villiers, C. P.,
40.
Wang, K., and Spector, A. (1996) alpha-Crystallin
Nicholls, D., Gastall, H. Y., et al. (2019) HspB1
stabilizes actin filaments and prevents cytochalasin-
phosphorylation
regulates
its
intramolecular
induced depolymerization in a phosphorylation-
dynamics and mechanosensitive molecular chaperone
dependent manner, Eur. J. Biochem., 242, 56-66,
interaction with filamin C, Sci. Adv., 5, eaav8421,
doi: 10.1111/j.1432-1033.1996.0056r.x.
doi: 10.1126/sciadv.aav8421.
41.
Singh, B. N., Rao, K. S., Ramakrishna, T.,
30.
Clark, A. R., Vree Egberts, W., Kondrat, F. D. L.,
Rangaraj, N., and Rao, Ch. M. (2007) Association
Hilton, G. R., Ray, N. J., et al. (2018) Terminal
of alphaB-crystallin, a small heat shock protein, with
regions confer plasticity to the tetrameric assembly
actin: role in modulating actin filament dynamics
of human HspB2 and HspB3, J. Mol. Biol., 430,
in vivo, J. Mol. Biol., 366, 756-767, doi: 10.1016/
3297-3310, doi: 10.1016/j.jmb.2018.06.047.
j.jmb.2006.12.012.
31.
Prabhu, S., Raman, B., Ramakrishna, T., and
42.
Golenhofen, N., Htun, P., Ness, W., Koob, R.,
Rao, Ch. M.
(2012) HspB2/myotonic dystrophy
Schaper, W., et al. (1999) Binding of the stress
protein kinase binding protein (MKBP) as a nov-
protein alpha B-crystallin to cardiac myofi-
el molecular chaperone: Structural and function-
brils correlates with the degree of myocardi-
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1157
al damage during ischemia/reperfusion in vivo,
54.
Brophy, C. M., Lamb, S., and Graham, A. (1999)
J. Mol. Cell. Cardiol., 31, 569-580, doi: 10.1006/
The small heat shock-related protein-20 is an actin-
jmcc.1998.0892.
associated protein, J. Vasc. Surg.,
29,
326-333,
43.
Golenhofen, N., Arbeiter, A., Koob, R., and
doi: 10.1016/s0741-5214(99)70385-x.
Drenckhahn, D. (2002) Ischemia-induced association
55.
Tessier, D. J., Komalavilas, P., Panitch, A., Joshi, L.,
of the stress protein alpha B-crystallin with I-band
and Brophy, C. M. (2003) The small heat shock
portion of cardiac titin, J. Mol. Cell. Cardiol., 34,
protein (HSP) 20 is dynamically associated with the
309-319, doi: 10.1006/jmcc.2001.1513.
actin cross-linking protein actinin, J. Surg. Res., 111,
44.
Bullard, B., Ferguson, C., Minajeva, A., Leake,
152-157, doi: 10.1016/s0022-4804(03)00113-6.
M. C., Gautel, M., et al. (2004) Association of
56.
Meeks, M. K., Ripley, M. L., Jin, Z., and Rembold,
the chaperone alphaB-crystallin with titin in heart
C. M.
(2005) Heat shock protein
20-mediated
muscle, J. Biol. Chem., 279, 7917-7924, doi: 10.1074/
force suppression in forskolin-relaxed swine carotid
jbc.M307473200.
artery, Am. J. Physiol. Cell Physiol., 288, C633-C639,
45.
Kaiser, C. J. O., Peters, C., Schmid, P. W. N.,
doi: 10.1152/ajpcell.00269.2004.
Stavropoulou, M., Zou, J., et al. (2019) The structure
57.
Rembold, C. M. (2007) Force suppression and the
and oxidation of the eye lens chaperone alphaA-
crossbridge cycle in swine carotid artery, Am. J.
crystallin, Nat. Struct. Mol. Biol.,
26,
1141-1150,
Physiol. Cell Physiol., 293, C1003-1009, doi: 10.1152/
doi: 10.1038/s41594-019-0332-9.
ajpcell.00091.2007.
46.
Bukach, O. V., Seit-Nebi, A. S., Marston, S. B., and
58.
Ba, M., Singer, C. A., Tyagi, M., Brophy, C., Baker,
Gusev, N. B. (2004) Some properties of human small
J. E., et al. (2009) HSP20 phosphorylation and airway
heat shock protein Hsp20 (HspB6), Eur. J. Biochem.,
smooth muscle relaxation, Cell Health Cytoskelet.,
271, 291-302, doi: 10.1046/j.1432-1033.2003.03928.x.
2009, 27-42, doi: 10.2147/chc.s5783.
47.
Weeks, S. D., Baranova, E. V., Heirbaut, M.,
59.
Bukach, O. V., Marston, S. B., and Gusev, N. B.
Beelen, S., Shkumatov, A. V., et al. (2014) Molecular
(2005) Small heat shock protein with apparent
structure and dynamics of the dimeric human small
molecular mass 20 kDa (Hsp20, HspB6) is not a
heat shock protein HSPB6, J. Struct. Biol., 185, 342-
genuine actin-binding protein, J. Muscle Res. Cell
354, doi: 10.1016/j.jsb.2013.12.009.
Motil., 26, 175-181, doi: 10.1007/s10974-005-9008-7.
48.
Bukach, O. V., Glukhova, A. E., Seit-Nebi,
60.
Woodrum, D., Pipkin, W., Tessier, D.,
A. S., and Gusev, N. B. (2009) Heterooligomeric
Komalavilas, P., and Brophy, C. M.
(2003)
complexes formed by human small heat shock
Phosphorylation of the heat shock-related protein,
proteins HspB1 (Hsp27) and HspB6 (Hsp20),
HSP20, mediates cyclic nucleotide-dependent
Biochim. Biophys. Acta, 1794, 486-495, doi: 10.1016/
relaxation, J. Vasc. Surg., 37, 874-881, doi: 10.1067/
j.bbapap.2008.11.010.
mva.2003.153
49.
Shatov, V. M., Strelkov, S. V., and Gusev, N. B.
61.
Dreiza, C. M., Komalavilas, P., Furnish, E. J.,
(2020) The Heterooligomerization of human small
Flynn, C. R., Sheller, M. R., et al. (2010) The small
heat shock proteins is controlled by conserved motif
heat shock protein, HSPB6, in muscle function and
located in the N-terminal domain, Int. J. Mol. Sci.,
disease, Cell Stress Chaperones, 15, 1-11, doi: 10.1007/
21, 4248, doi: 10.3390/ij ms21124248.
s12192-009-0127-8.
50.
Pipkin, W., Johnson, J. A., Creazzo, T. L., Burch, J.,
62.
Dreiza, C. M., Brophy, C. M., Komalavilas, P.,
Komalavilas, P., et al.
(2003) Localization,
Furnish, E. J., Joshi, L., et al. (2005) Transducible
macromolecular associations, and function of
heat shock protein
20 (HSP20) phosphopeptide
the small heat shock-related protein HSP20 in
alters cytoskeletal dynamics, FASEB J., 19, 261-263,
rat heart, Circulation, 107, 469-476, doi: 10.1161/
doi: 10.1096/fj.04-2911fje.
01.cir.0000044386.27444.5a.
63.
Chernik, I. S., Seit-Nebi, A. S., Marston, S. B.,
51.
Tyson, E. K., Macintyre, D. A., Smith, R.,
and Gusev, N. B. (2007) Small heat shock protein
Chan, E. C., and Read, M. (2008) Evidence that
Hsp20 (HspB6) as a partner of
14-3-3gamma,
a protein kinase A substrate, small heat-shock
Mol. Cell. Biochem.,
295,
9-17, doi:
10.1007/
protein
20, modulates myometrial relaxation in
s11010-006-9266-8.
human pregnancy, Endocrinology, 149, 6157-6165,
64.
Sudnitsyna, M. V., Seit-Nebi, A. S., and Gusev,
doi: 10.1210/en.2008-0593.
N. B. (2012) Cofilin weakly interacts with 14-3-
52.
Vafiadaki, E., Arvanitis, D. A., Sanoudou, D., and
3 and therefore can only indirectly participate in
Kranias, E. G. (2013) Identification of a protein
regulation of cell motility by small heat shock protein
phosphatase-1/phospholamban complex that is
HspB6 (Hsp20), Arch. Biochem. Biophys., 521, 62-70,
regulated by cAMP-dependent phosphorylation, PLoS
doi: 10.1016/j.abb.2012.03.010.
One, 8, e80867, doi: 10.1371/journal.pone.0080867.
65.
Vafiadaki, E., Arvanitis, D. A., Eliopoulos, A. G.,
53.
Rembold, C. M., Foster, D. B., Strauss, J. D.,
Kranias, E. G., and Sanoudou, D. (2020) The cardi-
Wingard, C. J., and Eyk, J. E.
(2000) cGMP-
oprotective PKA-mediated Hsp20 phosphorylation
mediated phosphorylation of heat shock protein 20
modulates protein associations regulating cytoskeletal
may cause smooth muscle relaxation without myosin
dynamics, Int. J. Mol. Sci., 21, 9572, doi: 10.3390/
light chain dephosphorylation in swine carotid
ij ms21249572.
artery, J. Physiol., 524 Pt 3, 865-878, doi: 10.1111/
66.
Krief, S., Faivre, J. F., Robert, P., Le Douarin, B.,
j.1469-7793.2000.00865.x.
Brument-Larignon, N., et al. (1999) Identification
БИОХИМИЯ том 87 вып. 8 2022
1158
МУРАНОВА и др.
and characterization of cvHsp. A novel human small
78.
Ke, L., Meij ering, R. A., Hoogstra-Berends, F.,
stress protein selectively expressed in cardiovascular
Mackovicova, K., Vos, M. J., et al. (2011) HSPB1,
and insulin-sensitive tissues, J. Biol. Chem., 274,
HSPB6, HSPB7 and HSPB8 protect against RhoA
36592-36600, doi: 10.1074/jbc.274.51.36592.
GTPase-induced remodeling in tachypaced atrial
67.
Muranova, L. K., Shatov, V. M., Slushchev, A. V., and
myocytes, PLoS One,
6, e20395, doi:
10.1371/
Gusev, N. B. (2021) Quaternary structure and hetero-
journal.pone.0020395.
oligomerization of recombinant human Small heat
79.
Carra, S., Seguin, S. J., Lambert, H., and Landry, J.
shock protein HspB7 (cvHsp), Int. J. Mol. Sci., 22,
(2008) HspB8 chaperone activity toward poly(Q)-
7777, doi: 10.3390/ij ms22157777.
containing proteins depends on its association with
68.
Wu, T., Mu, Y., Bogomolovas, J., Fang, X.,
Bag3, a stimulator of macroautophagy, J. Biol. Chem.,
Veevers, J., et al. (2017) HSPB7 is indispensable
283, 1437-1444, doi: 10.1074/jbc.M706304200.
for heart development by modulating actin filament
80.
Fuchs, M., Poirier, D. J., Seguin, S. J., Lambert, H.,
assembly, Proc. Natl. Acad. Sci. USA, 114, 11956-
Carra, S., et al. (2009) Identification of the key
11961, doi: 10.1073/pnas.1713763114.
structural motifs involved in HspB8/HspB6-Bag3
69.
Schuld, J., Orfanos, Z., Chevessier, F., Eggers, B.,
interaction, Biochem. J., 425, 245-255, doi: 10.1042/
Heil, L., et al.
(2020) Homozygous expres-
BJ20090907.
sion of the myofibrillar myopathy-associated
81.
Shemetov, A. A. and Gusev, N. B. (2011) Biochemical
p. W2710X filamin C variant reveals major path-
characterization of small heat shock protein HspB8
omechanisms of sarcomeric lesion formation,
(Hsp22)-Bag3 interaction, Arch. Biochem. Biophys.,
Acta Neuropathol. Commun., 8, 154, doi: 10.1186/
513, 1-9, doi: 10.1016/j.abb.2011.06.014.
s40478-020-01001-9.
82.
Morelli, F. F., Mediani, L., Heldens, L.,
70.
Juo, L. Y., Liao, W. C., Shih, Y. L., Yang, B. Y., Liu,
Bertacchini, J., Bigi, I., et al. (2017) An interaction
A. B., et al. (2016) HSPB7 interacts with dimerized
study in mammalian cells demonstrates weak binding
FLNC and its absence results in progressive myopathy
of HSPB2 to BAG3, which is regulated by HSPB3
in skeletal muscles, J. Cell Sci., 129, 1661-1670,
and abrogated by HSPB8, Cell Stress Chaperones, 22,
doi: 10.1242/jcs.179887.
531-540, doi: 10.1007/s12192-017-0769-x.
71.
Doran, P., Martin, G., Dowling, P., Jockusch, H.,
83.
Rauch, J. N., Tse, E., Freilich, R., Mok, S. A.,
and Ohlendieck, K. (2006) Proteome analysis of the
Makley, L. N., et al. (2017) BAG3 is a modular,
dystrophin-deficient MDX diaphragm reveals a drastic
scaffolding protein that physically links heat
increase in the heat shock protein cvHSP, Proteomics,
shock protein 70 (Hsp70) to the small heat shock
6, 4610-4621, doi: 10.1002/pmic.200600082.
proteins, J. Mol. Biol., 429, 128-141, doi: 10.1016/
72.
Lewis, C., Carberry, S., and Ohlendieck, K. (2009)
j.jmb.2016.11.013.
Proteomic profiling of x-linked muscular dystrophy,
84.
Fontanella, B., Birolo, L., Infusini, G., Cirulli, C.,
J. Muscle Res. Cell Motil., 30, 267-269, doi: 10.1007/
Marzullo, L., et al. (2010) The co-chaperone BAG3
s10974-009-9197-6.
interacts with the cytosolic chaperonin CCT: New
73.
Liao, W. C., Juo, L. Y., Shih, Y. L., Chen, Y. H., and
hints for actin folding, Int. J. Biochem. Cell Biol., 42,
Yan, Y. T. (2017) HSPB7 prevents cardiac conduction
641-650, doi: 10.1016/j.biocel.2009.12.008.
system defect through maintaining intercalated disc
85.
Ulbricht, A., Gehlert, S., Leciejewski, B.,
integrity, PLoS Genet., 13, e1006984, doi: 10.1371/
Schiffer, T., Bloch, W., et al.
(2015) Induction
journal.pgen.1006984.
and adaptation of chaperone-assisted selective
74.
Mercer, E. J., Lin, Y. F., Cohen-Gould, L., and
autophagy CASA in response to resistance exercise
Evans, T.
(2018) Hspb7 is a cardioprotective
in human skeletal muscle, Autophagy, 11, 538-546,
chaperone facilitating sarcomeric proteostasis, Dev.
doi: 10.1080/15548627.2015.1017186.
Biol., 435, 41-55, doi: 10.1016/j.ydbio.2018.01.005.
86.
Ulbricht, A., Eppler, F. J., Tapia, V. E., van der Ven,
75.
Doran, P., Gannon, J., O’Connell, K., and
P. F., Hampe, N., et al. (2013) Cellular mechano-
Ohlendieck, K.
(2007) Aging skeletal muscle
transduction relies on tension-induced and chap-
shows a drastic increase in the small heat shock
erone-assisted autophagy, Curr. Biol., 23, 430-435,
proteins alphaB-crystallin/HspB5 and cvHsp/
doi: 10.1016/j.cub.2013.01.064.
HspB7, Eur. J. Cell Biol., 86, 629-640, doi: 10.1016/
87.
Arndt, V., Dick, N., Tawo, R., Dreiseidler, M.,
j.ejcb.2007.07.003.
Wenzel, D., et al. (2010) Chaperone-assisted selective
76.
Acunzo, J., Katsogiannou, M., and Rocchi, P. (2012)
autophagy is essential for muscle maintenance, Curr.
Small heat shock proteins HSP27 (HspB1), alphaB-
Biol., 20, 143-148, doi: 10.1016/j.cub.2009.11.022.
crystallin (HspB5) and HSP22 (HspB8) as regulators
88.
Klimek, C., Jahnke, R., Wordehoff, J., Kathage, B.,
of cell death, Int. J. Biochem. Cell Biol., 44, 1622-1631,
Stadel, D., et al. (2019) The Hippo network kinase
doi: 10.1016/j.biocel.2012.04.002.
STK38 contributes to protein homeostasis by
77.
Shatov, V. M., Sluchanko, N. N., and Gusev,
inhibiting BAG3-mediated autophagy, Biochim.
N. B. (2021) Replacement of Arg in the conserved
Biophys.Acta,
1866,
1556-1566, doi:
10.1016/
N-terminal RLFDQxFG motif affects physico-
j.bbamcr.2019.07.007.
chemical properties and chaperone-like activity
89.
Fuchs, M., Luthold, C., Guilbert, S. M., Varlet,
of human small heat shock protein HspB8
A. A., Lambert, H., et al. (2015) A role for the
(Hsp22), PLoS One, 16, e0253432, doi: 10.1371/
chaperone complex BAG3-HSPB8 in actin dynamics,
journal.pone.0253432.
spindle orientation and proper chromosome
БИОХИМИЯ том 87 вып. 8 2022
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И АКТИН
1159
segregation during mitosis, PLoS Genet.,
11,
substrate cortactin, Int. J. Mol. Sci., 22, doi: 10.3390/
e1005582, doi: 10.1371/journal.pgen.1005582.
ij ms22010142.
90. Varlet, A. A., Fuchs, M., Luthold, C., Lambert, H.,
92. Luthold, C., Lambert, H., Guilbert, S. M., Rodrigue,
Landry, J., et al.
(2017) Fine-tuning of actin
M. A., Fuchs, M., et al. (2021) CDK1-mediated
dynamics by the HSPB8-BAG3 chaperone complex
phosphorylation of BAG3 promotes mitotic cell shape
facilitates cytokinesis and contributes to its impact
remodeling and the molecular assembly of mitotic p62
on cell division, Cell Stress Chaperones, 22, 553-567,
bodies, Cells, 10, doi: 10.3390/cells10102638.
doi: 10.1007/s12192-017-0780-2.
93. Wu, W., Sun, X., Shi, X., Lai, L., Wang, C., et al.
91. Luthold, C., Varlet, A. A., Lambert, H.,
(2021) Hsp22 deficiency induces age-dependent
Bordeleau, F., and Lavoie, J. N. (2020) Chaperone-
cardiac dilation and dysfunction by impairing
assisted mitotic actin remodeling by BAG3 and
autophagy, metabolism, and oxidative response,
HSPB8 involves the deacetylase HDAC6 and its
Antioxidants, 10, 1550, doi: 10.3390/antiox10101550.
PARTICIPATION OF SMALL HEAT SHOCK PROTEINS
IN REMODELING OF ACTIN MICROFILAMNETS
Review
L. K. Muranova, V. M. Shatov, and N. B. Gusev*
Faculty of Biology, Lomonosov Moscow State University,
119991 Moscow, Russian Federation; e-mail: NBGusev@mail.ru
Small heat shock proteins (sHsp) play important role in maintaining proteome stability and particularly in
stabilization of cytoskeleton and contractile apparatus of the cell. Different kinds of stresses are accompanied by
translocation of sHsp on actin filaments and therefore it is widely believed that the small heat shock proteins are
true (genuine) actin-binding proteins. Investigations of last years have shown imperfection and incorrectness of
this view point. Stress-induced translocation of sHsp to actin filaments are not induced by direct interaction of
these proteins, but is the result of interaction of different actin-binding proteins with sHsp. HspB1 and HspB5
interact with giant elastic proteins titin and filamin and by this means provide integrity of contractile apparatus
and its proper localization in the cell. HspB6 interacts with universal adapter proteins 14-3-3 and by this way
only indirectly affects actin filament structure. HspB7 interacts with filamin C and controls actin filament
assembling. HspB8 forms tight complex with universal regulatory and adapter protein Bag3 and participates
in chaperone-assisted selective autophagy (CASA) of different actin-binding proteins (for example, filamin)
as well as in actin-depending processes running in mitoses. Thus, the mechanisms underlying participation
of sHsp in maintaining of contractile apparatus and cytoskeleton are much more complicate and diverse
than postulated earlier. The old hypothesis postulating direct interaction of sHsp with intact actin should be
revised and further detailed investigations concerning interaction of sHsp with minor proteins participating in
formation and remodeling of actin filaments are required.
Keywords: small heat shock proteins, actin, protein-protein interactions, chaperone-like activity, phosphorylation
БИОХИМИЯ том 87 вып. 8 2022