БИОХИМИЯ, 2022, том 87, вып. 9, с. 1182 - 1202
УДК 577.21
БАКТЕРИЯ Neisseria gonorrhoeae:
СИСТЕМЫ РЕПАРАЦИИ ДНК И ИХ РОЛЬ В ПАТОГЕНЕЗЕ
Обзор
© 2022 В.Ю. Савицкая1, М.В. Монахова2, Ю.В. Якушкина1,
И.И. Боровикова3, Е.А. Кубарева2*
1 Московский государственный университет имени М.В. Ломоносова,
химический факультет, 119991 Москва, Россия
2 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: kubareva@belozersky.msu.ru
3 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
Поступила в редакцию 19.04.2022
После доработки 12.07.2022
Принята к публикации 12.07.2022
Организм Neisseria gonorrhoeae (грамотрицательный диплококк) является патогеном человека и воз-
будителем гонореи - инфекционного заболевания, передаваемого половым путём. Бактерия ис-
пользует различные способы, чтобы адаптироваться к условиям окружающей среды и эффективно
размножаться в организме человека, такие как регуляция экспрессии генов поверхностных белков
и липоолигосахаридов (например, экспрессия различных форм пилина). Системы репарации повреж-
дений в ДНК играют важную роль в способности бактерии выживать в организме-хозяине. В дан-
ном обзоре описаны системы репарации ДНК N. gonorrhoeae, а также их роль в патогенезе бактерии.
Особое внимание уделено системе репарации «мисматчей» (MMR) и функционированию белков
MutS и MutL, а также рассмотрена роль этих белков в процессе регуляции антигенной вариации
пилина патогена N. gonorrhoeae.
КЛЮЧЕВЫЕ СЛОВА: система репарации «мисматчей», репарация повреждений ДНК, эксцизионная
репарация, MutS, MutL, антигенная вариация, гомологичная рекомбинация, G-квадруплекс, Neisseria
gonorrhoeae.
DOI: 10.31857/S0320972522090020, EDN: AZORAR
ВВЕДЕНИЕ
случаев заболевание представляет собой не-
осложнённую инфекцию [2, 3]. С другой сто-
Neisseria gonorrhoeae принадлежит к роду
роны, у некоторых пациентов могут возникать
Neisseria, в который входят два патогенных вида
более серьёзные последствия, включая воспа-
N. gonorrhoeae и Neisseria meningitidis, являющи-
ление маточных труб у женщин и бесплодие -
еся причинами возникновения заболеваний
у мужчин [4]. Исследования ВОЗ выявили кли-
гонореи и бактериального менингита у чело-
нические штаммы N. gonorrhoeae, устойчивые
века [1]. Организм N. gonorrhoeae в основном
к большинству известных антибиотиков [5, 6].
поражает слизистую оболочку органов репро-
Именно поэтому необходим поиск новых мето-
дуктивной системы человека. В большинстве дов лечения для предотвращения распростране-
Принятые сокращения: АР-сайт - апуриновый или апиримидиновый сайт; β-«зажим» - β-субъединица ДНК-по-
лимеразы III; BER - система эксцизионной репарации оснований; CTD - C-концевой домен белка; G4 - G-квадру-
плекс; LOS - липоолигосахарид; MMR - система репарации некомплементарных пар нуклеотидов; NER - система
эксцизионной репарации нуклеотидов; ngMutL - MutL из Neisseria gonorrhoeae; ngMutS - MutS из Neisseria gonorrhoeae;
NTD - N-концевой домен белка; 8-oxodG - 7,8-дигидро-8-оксо-2'-дезоксигуанозин; V.ngAXIII и V.ngAXIV - эндонуклеа-
зы Vsr из Neisseria gonorrhoeae; VSP - система репарации очень коротких участков..
* Адресат для корреспонденции.
1182
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1183
ния заболевания. Как и многие грамотрицатель-
Вариация фаз (регуляция экспрессии
ные бактерии, N. gonorrhoeae обладает широким
генов
[2]) белков внешней мембраны Opa
спектром факторов вирулентности: пили IV-го
N. gonorrhoeae - ещё один способ защиты от им-
типа, состоящие из белка пилина, поверхност-
мунного ответа организма-хозяина [13]. В ходе
ные белки Opa, модифицированные липооли-
этого процесса изменяется количество пента-
госахариды (LOS), белок внешней мембраны -
мерных повторов (5′-CTCTT-3′) в последователь-
порин (PorA и PorB), протеаза IgA и т.д. [3, 7].
ности, кодирующей сигнальный пептид Opa,
Первым этапом патогенеза является при-
что влияет на синтез этих белков [14]. В отли-
крепление бактерий к эпителию слизистой
чие от пилей, экспрессия генов, кодирующих
оболочки [3]. За этот процесс в N. gonorrhoeae
белок Opa, не требуется для начального прикре-
отвечают пили IV-го типа (type IV pili - Tfp) [8].
пления N. gonorrhoeae к клеткам хозяина. Одна-
Пили преимущественно состоят из белка пи-
ко после этого этапа белки Opa участвуют в свя-
лина (PilE) и являются необходимым фактором
зывании рецепторов клеток человека через свои
вирулентности бактерии. В образовании пи-
гипервариабельные области [3].
лей, кроме PilE, участвуют другие белки, спо-
Другим важнейшим фактором, обеспечива-
собствующие правильной сборке пилей. Также
ющим высокую вирулентность N. gonorrhoeae,
на конце пилей и внутри мембраны распола-
является порин (Por) - белок внешней мем-
гается белок PilC, отвечающий за прикрепле-
браны клетки, содержание которого составля-
ние к эпителиальным клеткам человека [9, 10].
ет примерно 60% от общего содержания белков
Для того чтобы «ускользать» от иммунного от-
у бактерии [15]. Его основная функция - пере-
вета, пили IV-го типа патогена N. gonorrhoeae
нос ионов и питательных веществ через внеш-
претерпевают антигенную вариацию (экспрес-
нюю мембрану, однако он также является фак-
сию различных форм одного и того же анти-
тором, защищающим патоген от иммунного
гена) с помощью механизма гомологичной
ответа человека [16]. Каскадная система про-
рекомбинации, что приводит к синтезу различ-
теолитических ферментов, которая необходима
ных вариантов пилина [11, 12].
для гуморального ответа организма на действие
Таблица 1. Некоторые механизмы защиты N. gonorrhoeae от иммунного ответа организма-хозяина
Защитный механизм
Факторы вирулентности
Результат
синтез различных
Антигенная вариация
пили IV-го типа
форм белка пилина
подавление синтеза
распознавание антигена
Opa
поверхностного
клетками организма-
белка Opa
хозяина не реализуется
Вариация фаз
синтез фрагментов
LOS
сиаловой кислоты
связывание с белковым
инактивация
комплексом C4Bp
классического пути
каскада классического
системы комплемента
Por
пути комплемента
Имитация клеток
организма-хозяина
связывание
с фактором Н каскада
альтернативного пути
LOS с фрагментами
комплемента
инактивация
сиаловой кислоты
альтернативного пути
системы комплемента
Инактивация белков
деградация белка C3b
иммунного ответа
LOS, содержащие липид А
c помощью фактора I
организма-хозяина
каталаза,
супероксиддисмутаза,
Экспрессия белков
глутатионпероксидаза,
восстановление окислительных
с окислительно-
метионин-сульфоксид-
повреждений в ДНК;
восстановительной функцией,
редуктаза,
предотвращение генетических мутаций
белков систем репарации
белки систем
репарации ДНК
БИОХИМИЯ том 87 вып. 9 2022
1
184
САВИЦКАЯ и др.
чужеродных агентов и реализации иммунного
здание подходящего уровня генетической из-
ответа в целом, называется системой компле-
менчивости, на который может воздейство-
мента и активируется классическим или аль-
вать отбор. N. gonorrhoeae в процессе своей
тернативным путями. Регуляторный участник
жизнедеятельности подвергается воздействию
классического пути системы комплемента, бел-
нейтрофилов организма-хозяина, которые
ковый комплекс C4Bp, узнает элементы клеток
производят различные активные формы кис-
организма-хозяина, предотвращая иммунную
лорода и азота [8]. Для защиты от окислитель-
атаку на собственные клетки. Por N. gonorrhoeae
ных агентов бактерия выработала защитные
эффективно связывается как с C4Bp, так и с
механизмы, заключающиеся в экспрессии
фактором H - сывороточным гликопротеином,
многочисленных белков, таких как каталаза,
функции которого также заключаются в защите
супероксиддисмутаза, глутатионпероксидаза,
человеческих клеток от иммунной атаки, но во
метионин-сульфоксид-редуктаза и др. [27-30].
время активации альтернативного пути [17, 18].
Сохранять генетическую информацию в таких
В результате клетки патогена расцениваются
стрессовых условиях помогают различные си-
как человеческие, что подавляет иммунный от-
стемы репарации ДНК, присутствующие в бак-
вет организма (табл. 1).
терии. Однако о механизмах восстановления
В подавлении альтернативного пути систе-
поврежденной ДНК N. gonorrhoeae известно
мы комплемента человека задействованы липо-
немного.
олигосахариды (LOS) N. gonorrhoeae на поверх-
Особую роль в выживаемости и измен-
ности внешней мембраны клетки (табл. 1) [8].
чивости N. gonorrhoeae отводят системе репа-
По структуре LOS N. gonorrhoeae подобны ши-
рации некомплементарных пар нуклеотидов,
роко распространённым бактериальным липо-
«мисматчей» (MMR), главная задача которой
олигосахаридам, однако не содержат полиса-
заключается в устранении «ошибок», допу-
харидных цепей О-антигена, которые легко бы
щенных ДНК-полимеразой в процессе репли-
распознавались иммунной системой организ-
кации [31]. Эффективное функционирование
ма-хозяина при инфицировании [19]. Более
системы MMR снижает количество мутаций
того, LOS N. gonorrhoeae подвергаются вариации
и поддерживает стабильность генома, а нару-
фаз. В результате одной нуклеотидной замены,
шение её работы приводит к повышенной из-
приводящей к сдвигу рамки считывания в ге-
менчивости и адаптивности бактерии.
нах гликозилтрансферазы, липоолигосахариды
В данном обзоре обобщены последние
бактерии приобретают различные углеводные
данные, касающиеся особенностей функцио-
фрагменты [20, 21]. В качестве примера можно
нирования различных систем репарации ДНК
привести процессы с участием сиалированных
в клетках N. gonorrhoeae. Направленное воздей-
липоолигосахаридов на поверхности клетки
ствие на функционирование белков систем ре-
бактерии N. gonorrhoeae [22, 23]. Остатки сиа-
парации ДНК этой бактерии может рассматри-
ловой кислоты присутствуют на поверхности
ваться как перспективный подход к терапии
клеток организма-хозяина и взаимодейству-
гонореи.
ют с фактором Н. Синтезируя сиалированные
липоолигосахариды, N. gonorrhoeae имитирует
клетки человека, связавшиеся с фактором Н,
РЕПАРАЦИЯ ПОВРЕЖДЕНИЙ ДНК
поэтому система комплемента не распознаёт
патогенные клетки [24].
Поскольку N. gonorrhoeae является патоге-
Избежать атаки иммунной системы че-
ном человека и обитает в основном в организ-
ловека также позволяют липоолигосахариды
ме хозяина, полагают, что эта бактерия, как
N. gonorrhoeae, содержащие липид А. Липид А
правило, реже подвергается прямому УФ-об-
связывается с белком C3b каскада альтерна-
лучению, обезвоживанию и воздействию дру-
тивной системы комплемента человека и вы-
гих экстремальных условий
[5]. Основные
зывает деградацию этого белка в присутствии
повреждения ДНК клетки патогена могут
фактора I (табл. 1) [25]. В результате каскад
возникнуть в результате воздействия веществ,
инактивируется, а клетки патогена не подвер-
присутствующих в организме человека. Как и
гаются лизису [26]. Таким образом, с помощью
все живые организмы, N. gonorrhoeae в том или
перечисленных выше способов N. gonorrhoeae
ином виде имеет основные системы репарации
эффективно колонизируется на поверхности
повреждений ДНК [32]. К ним относятся пря-
эпителиальных клеток организма-хозяина.
мое исправление повреждений, эксцизионная
На эволюцию и адаптацию микроорга-
репарация оснований (ВER), эксцизионная
низмов влияют две противоположные силы:
репарация нуклеотидов (NER), репарация
сохранение генетической информации и со-
«мисматчей» (MMR), репарация очень корот-
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1185
ких участков (VSP), репарация с участием си-
после чего конформация белковой молекулы
стем рекомбинации (табл. 2).
меняется, и NG1427 теряет возможность свя-
Существует точка зрения, что у N. gonor-
зывать ДНК и, соответственно, ингибировать
rhoeae отсутствует одна из наиболее важных
экспрессию генов. Schook et al. [35] предпола-
бактериальных систем репарации ДНК
-
гают, что такой механизм регуляции активно-
SOS-система, которая активируется в ответ на
сти NG1427 даёт N. gonorrhoeae преимущество
серьёзные повреждения ДНК, такие как оста-
в выживании в присутствии иммунных клеток
новка репликационной вилки [33, 34]. Это
организма-хозяина.
утверждение основано на том, что в клетках
Остановимся подробнее на системах репа-
N. gonorrhoeae не обнаружен ген белка транс-
рации, перечисленных в табл. 2.
крипционного репрессора LexA, который
Прямое исправление повреждений в ДНК.
в нормальных условиях подавляет экспрес-
Эта система репарации принципиально отли-
сию генов SOS-системы. При формировании
чается от BER, NER и MMR, так как не тре-
SOS-ответа LexA подвергается автопротеолизу,
бует «вырезания» повреждения и синтеза ДНК
что активирует транскрипцию генов, необхо-
de novo. Прямая репарация заключается в дей-
димых для репарации ДНК. Однако в работе
ствии специфических ферментов, способных
Schook et al. [35] в клетках N. gonorrhoeae был
быстро в одну стадию восстановить исходную
выявлен функциональный аналог LexA - бе-
структуру ДНК. В общепринятом смысле к
лок NG1427. Предполагается, что NG1427 мо-
прямой репарации относят систему фотореак-
жет участвовать в похожем на SOS-репарацию
тивации и системы удаления алкильных групп
пути, отличающемся, однако, по механизму ак-
гетероциклических оснований (ферменты,
тивации. Так, сигналом для начала автопротео-
удаляющие О4-алкилтиминовые и О6-алкилгу-
лиза LexA является его взаимодействие с белком
аниновые продукты, и AlkB).
RecA, который формирует в клетке комплексы с
При анализе генома N. gonorrhoeae пока-
одноцепочечными фрагментами ДНК [36]. Од-
зано отсутствие некоторых генов, отвечаю-
нако в случае NG1427 инактивация этого белка
щих за прямую репарацию метилированных
происходит и при отсутствии RecA [35]. Проде-
оснований ДНК, таких как ada, alkA, alkB
монстрировано, что в репрессоре NG1427 под
и aidB [34, 37]. В работе Kline et al. [37] сообща-
действием H2O2 происходит окисление остат-
лось о наличии гена O6-алкилгуанин-ДНК-ал-
ка С64 с образованием сульфеновой кислоты,
килтрансферазы II (Ogt). Однако в более
Таблица 2. Системы репарации ДНК организма Neisseria gonorrhoeae
Ключевые ферменты,
Пример наруше-
Возможная причина
Система репарации ДНК
которые вовлечены
ния структуры
возникновения мутации
в процесс репарации
ДНК
Система прямой
O6-алкилгуанин-ДНК-
алкилирующие
О4-метилтимин
репарации ДНК [48]
алкилтрансфераза II (Ogt)
агенты [49]
и О6-метилгуанин
ДНК-гликозилазы
Эксцизионная репарация
активные формы
7,8-дигидро-
(Nth, Tag, Ung, MutM, MutY);
оснований (ВER) [37]
кислорода [50]
8-оксогуанин [51]
АР-эндонуклеаза (Xth)
химические
Эксцизионная репарация
UvrABCD;
пиримидиновые
агенты (H2O2) [52],
нуклеотидов (NER) [52]
Mfd
димеры [53]
УФ-излучение [53]
Репарация неканонических
«ошибки»
неканонические
MutS, MutL
пар нуклеотидов (MMR) [54]
ДНК-полимеразы [55]
пары нуклеотидов
Vsr-эндонуклеазы;
Репарация очень
дезаминирование
неканонические
ДНК-полимераза I;
коротких участков (VSP) [56]
5-метилцитозина [57, 58]
dG/T-пары [56]
MutS, MutL
RecAXBCD;
излучение
Репарация с участием
двуцепочечные
RecGORQJN;
различного типа [60],
систем рекомбинации [59]
разрывы
RuvABC
химические агенты [28]
БИОХИМИЯ том 87 вып. 9 2022
1186
САВИЦКАЯ и др.
поздней работе Ambur et al. [34] эти сведения
Эксцизионная репарация оснований. В ходе
были опровергнуты. Используя базу данных
патогенеза клетки N. gonorrhoeae должны пере-
PubMLST (Public databases for molecular typing
жить атаку иммунной системы организма-хозя-
and microbial genome diversity), мы проверили
ина. Одним из ключевых компонентов врождён-
геном N. gonorrhoeae FA1090 на наличие по-
ного иммунного ответа является производство
следовательности ogt. Обнаруженный ген ко-
фагоцитами человека активных форм кисло-
дирует белок, содержащий 48% идентичных
рода и азота, которые повреждают ДНК пато-
аминокислотных остатков по сравнению с тем
гена [61]. Например, гидроксильные радикалы
же из Escherichia coli. Для дальнейшего поиска
окисляют гетероциклические основания ДНК
фермента был использован сервис AlphaFold
до 7,8-дигидро-8-оксогуанина или 5-гидрокси-
Protein Structure Database. Выяснилось, что
цитозина [50]. Считается, что эксцизионная ре-
ген NGO_0988 кодирует белок, который устра-
парация оснований (BER) является основным
няет повреждения ДНК, такие как О4-метил-
механизмом восстановления таких окислитель-
тимин и О6-метилгуанин, возникающие при
ных повреждений ДНК бактерии [62].
воздействии алкилирующих агентов (табл. 2).
Процесс BER может проходить тремя не-
Ogt E. coli осуществляет прямой перенос ал-
зависимыми друг от друга путями. Первый
кильной группы модифицированного основа-
путь предусматривает удаление повреждённо-
ния на остаток Cys фермента. Интересно, что
го гетероциклического основания монофунк-
белок после прохождения реакции не регене-
циональными ДНК-гликозилазами, катали-
рируется, поэтому его называют «суицидаль-
зирующими гидролиз N-гликозидной связи.
ным» ферментом [38-40]. Следует, однако, от-
В результате образуется апуриновый/апири-
метить, что данные о функционировании Ogt в
мидиновый участок (AP-сайт). Определённая
N. gonorrhoeae отсутствуют.
АР-эндонуклеаза узнает этот сайт и вносит од-
Ещё одним примером прямой репара-
ноцепочечный разрыв в ДНК с образованием
ции повреждений ДНК является фермента-
3′-гидроксильной (3′-ОН) и 5′-дезоксирибозо-
тивная фотореактивация, которая устраня-
фосфатной (5′-dRP) групп на концах. Послед-
ет повреждения в ДНК, появляющиеся под
няя удаляется ДНК-полимеразой, обладающей
действием коротковолнового УФ-излучения.
dRP-лиазной активностью. Фрагмент ДНК со
Примером таких повреждений являются ци-
свободной 3′-ОН-группой является субстратом
клобутан-пиримидиновые димеры и пири-
для ДНК-полимеразы, которая начинает син-
мидин-(6,4)-пиримидоновые аддукты
[40].
тез, встраивая недостающий нуклеотид (корот-
Такие модификации в ДНК мешают нормаль-
кий путь) или несколько нуклеотидов, вытес-
ному прохождению процессов транскрипции
няя цепь ДНК с dRP-фрагментом, совместно
и репликации, поэтому их удаление важно для
с Flap-эндонуклеазой (длинный путь). Про-
выживания клетки [41-43]. Процесс фоторе-
цесс репарации завершает ДНК-лигаза, вос-
активации заключается в действии ферментов
станавливающая целостность ДНК [40].
фотолиаз, которые связывают ДНК в месте
Другие два механизма удаления повреж-
повреждения и восстанавливают повреждён-
дённого основания ДНК связаны с функцио-
ные основания, используя энергию видимого
нированием бифункциональных гликозилаз
света (300-500 нм) [44, 45]. Фотолиазы содер-
семейств Nth и MutM/Fpg, которые, кроме гид-
жат восстановленную форму кофактора фла-
ролиза N-гликозидной связи, также катализи-
винадениндинуклеотида (FADH-), который
руют расщепление цепи в ДНК. В результате
активируется под действием света и выполняет
действия Nth-гликозилазы в месте разрыва на
роль донора электронов при восстановлении
3′-конце фрагмента ДНК образуется ненасы-
пиримидиновых димеров [45].
щенный альдегид, а в случае MutM - 3′-PO4.
Существует мнение, что у N. gonorrhoeae от-
Обе эти группы удаляются АР-эндонуклеазами
сутствует система фотореактивации, посколь-
с образованием свободной 3′-ОН-группы, не-
ку жизнеспособность гонококков после облу-
обходимой для функционирования ДНК-по-
чения УФ, инкубируемых как в темноте, так и
лимеразы [40].
при видимом свете, не отличалась [46]. Однако
Анализ нуклеотидных последовательно-
в геноме N. gonorrhoeae присутствует потенци-
стей генома N. gonorrhoeae выявил гены, коди-
альный гомолог ДНК-фотолиазы, кодируемый
рующие ферменты, потенциально вовлечён-
геном phr [37]. При этом показано, что орто-
ные в реализацию BER в клетках патогена
лог PhrB в N. gonorrhoeae не участвует в процессе
(табл. 2) [37]. Известно, что присутствие 7,8-ди-
фотореактивации [47]. Таким образом, функ-
гидро-8-оксо-2′-дезоксигуанозина
(8-oxodG)
ции в клетке белков Phr и их участие в процес-
может привести к ошибочному встраиванию
сах репарации только предстоит изучить.
dАMP вместо dСМР в цепь ДНК. За репарацию
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1187
подобного повреждения в клетках E. coli отвеча-
фицированного нуклеотида. Далее, с помощью
ют ДНК-гликозилазы MutM и MutY. MutM уз-
хеликазы UvrD, ДНК-полимеразы и ДНК-ли-
нает и удаляет 8-oксoгуанин, а MutY - аденин,
газы осуществляется удаление повреждённого
находящийся в составе пары dA/8-oxodG [63,
олигонуклеотидного фрагмента, синтез ком-
64]. Относящаяся к семейству гидролаз Ну-
плементарного участка цепи и лигирование
дикс (Nudix)
8-oxodG-трифосфатаза MutT
соответственно.
предотвращает включение 8-oxodGMP напро-
Несмотря на наличие у N. gonorrhoeae
тив dА в ДНК [65]. Эти три белка образуют
аналога фермента ДНК-фотолиазы, полага-
так называемую GO-систему [66].
ют, что NER является преобладающим ме-
Davidsen et al. [51] обнаружили, что функ-
ханизмом восстановления УФ-поврежде-
циональные домены гомологов MutM и MutY
ний ДНК в клетках этого патогена. Campbell
из различных микроорганизмов обладают вы-
и Yasbin [53] продемонстрировали удаление
сокой степенью консервативности. ДНК-гли-
пиримидиновых димеров, образованных при
козилазы MutY E. coli и N. gonorrhoeae специ-
воздействии УФ-излучения, с помощью бел-
фично удаляют модифицированное основание
ков системы NER. Инактивация любого из
из пары dA/8-oxodG [67]. Также проведены ис-
генов uvrABCD приводила к повышенной чув-
следования системы BER в N. meningitidis [68,
ствительности клеток N. gonorrhoeae к УФ-об-
69]. Продемонстрировано наличие фермен-
лучению или H2O2 [52].
тов MutM, MutT и MutY в клетках этой бакте-
Так как NER и BER эффективно удаляют
рии [70]. Интересно, что для N. meningitidis, в
различные повреждения ДНК патогена, спо-
отличие от других бактерий, ферменты GO-си-
собствуя его выживаемости, подавление функ-
стемы не требуются для выживания при окис-
ционирования этих систем может стать новым
лительном стрессе [68].
подходом для лечения гонореи. В частности,
Кроме окислительных повреждений, бел-
для узнавания повреждения белку UvrA необ-
ки системы BER могут участвовать в репара-
ходимо взаимодействие с ATP. Таким образом,
ции алкилированных оснований в ДНК. Так,
разработка препаратов, направленных на ин-
удаление
3-метиладенина реализуется фер-
гибирование ATPазной активности UvrA, мо-
ментом AlkA (3-метиладенин-ДНК-гликозила-
жет значительно усовершенствовать существу-
зой II) [37]. Однако в клетках N. gonorrhoeae этот
ющую терапию заболевания [73].
фермент не был обнаружен. Полагают, что его
Система репарации
«мисматчей». Особое
функции выполняет 3-метиладенин-ДНК-гли-
значение для поддержания стабильности гено-
козилаза I (Tag), ген которой был найден в ге-
ма N. gonorrhoeae имеет система репарации не-
номе бактерии [37, 71].
канонических пар нуклеотидов или «мисмат-
Эксцизионная репарация нуклеотидов. Экс-
чей» [33]. Причиной появления «мисматчей»
цизионная репарация нуклеотидов (NER) ис-
являются неточности в функционировании
пользуется для узнавания и удаления многих
ДНК-полимеразы в процессе репликации
типов окислительных повреждений ДНК или
ДНК [37]. Нарушение работы системы MMR
пиримидиновых димеров, продуцируемых
приводит к накоплению мутаций в ДНК и ге-
действием УФ-излучения [52]. Анализ нуклео-
нетической нестабильности [74].
тидных последовательностей генома бактерии
Система MMR прокариот является пред-
выявил гены белков, потенциально вовлечён-
метом нашего пристального внимания [74-77].
ных в процесс NER, включая ферменты UvrA,
Репарация в клетках N. gonorrhoeae начинается
UvrB, UvrC, UvrD и Mfd [72]. Высокая степень
после узнавания неканонической пары нуклео-
гомологии этих ферментов в N. gonorrhoeae и
тидов белком MutS, затем к комплексу MutS с
E. coli свидетельствует в пользу схожих механиз-
ДНК привлекается эндонуклеаза MutL, кото-
мов NER у этих бактерий [37]. Белковый фак-
рая вносит одноцепочечный разрыв в «дочер-
тор TRCF (Transcription Repair Coupling Factor
нюю» цепь ДНК [54, 76]. Далее, хеликаза UvrD
или Mfd) привлекает белки системы NER
расплетает ДНК, белок SSB (от single-strand
для репарации повреждений ДНК. Эти бел-
binding) связывает одноцепочечный фрагмент
ки блокируют транскрипцию до тех пор, пока
«материнской» цепи и защищает его от дегра-
не произойдёт удаление повреждения в ДНК
дации, а одноцепочечная ДНК, содержащая
и восстановление целостности цепи [52]. Ком-
«мисматч», подвергается гидролизу экзонуклеа-
плекс UvrAB узнаёт и связывает повреждённую
зами. На последнем этапе ДНК-полимераза
ДНК. После диссоциации UvrA белок UvrB
застраивает образовавшуюся «брешь», а лигаза
взаимодействует с эндонуклеазой UvrC, ко-
восстанавливает целостность цепи ДНК.
торая вносит одноцепочечные разрывы в по-
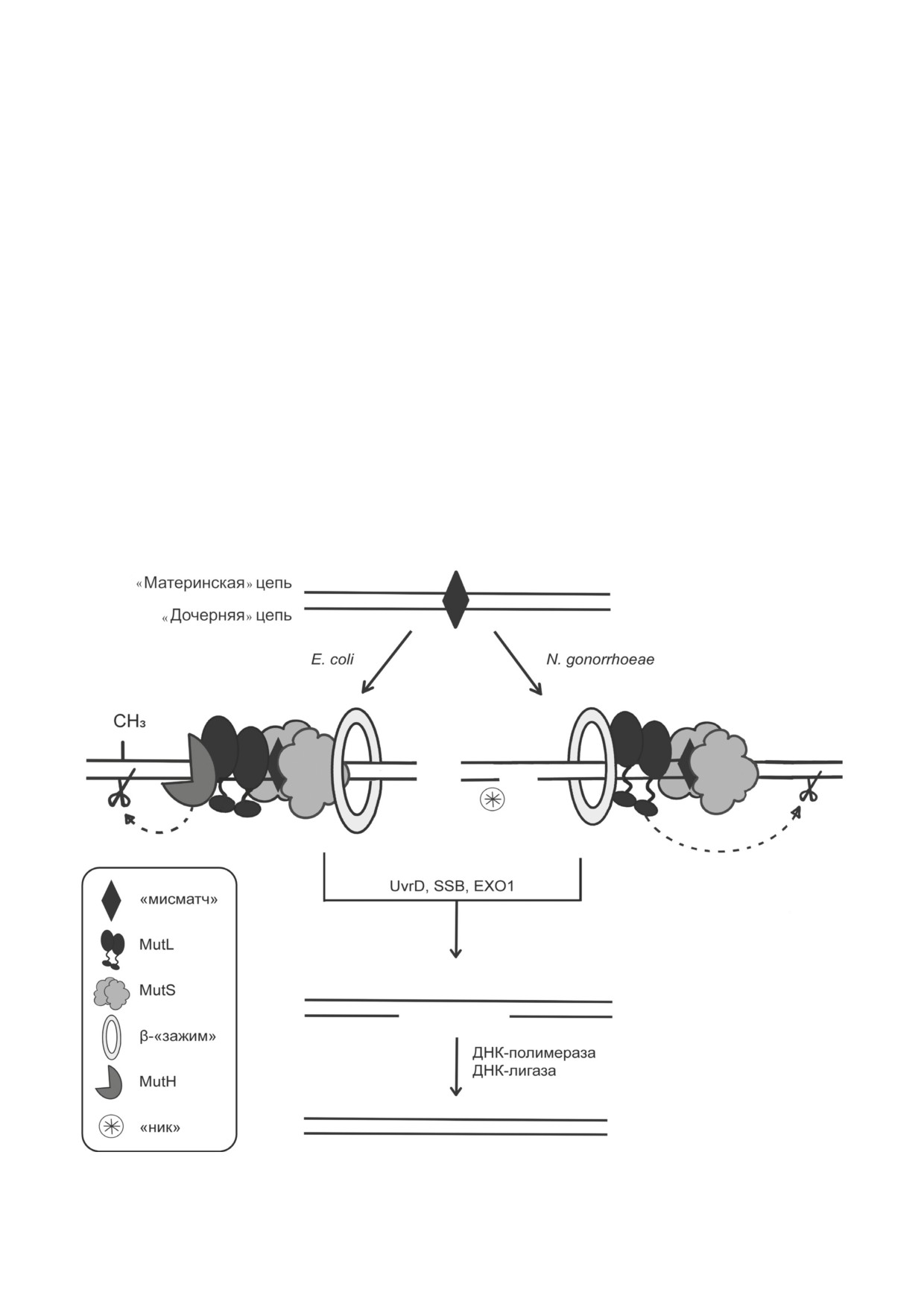
В отличие от E. coli, репарация «мисмат-
вреждённую цепь ДНК с двух сторон от моди-
чей» у N. gonorrhoeae является метилнезависи-
БИОХИМИЯ том 87 вып. 9 2022
1188
САВИЦКАЯ и др.
мой ввиду отсутствия у гонококка сайт-специ-
цей ДНК-полимеразы III (β-«зажимом») [81-
фической эндонуклеазы MutH, характерной
83]. β-«Зажим» не только повышает эффек-
лишь для ряда γ-протеобактерий. MutH вносит
тивность взаимодействия белков MutS и MutL
одноцепочечный разрыв («ник») в неметили-
с ДНК. Полагают, что за счёт образования
рованную («дочернюю») цепь монометилиро-
комплекса MutL с β-«зажимом» происходит
ванного участка
5′-Gm6ATC-3′/3′-CTAG↓-5′
дискриминация «дочерней» цепи в организ-
(рис. 1) [74]. Более того, функция MutL из E. coli
мах, лишённых MutH [84]. Также особая роль
заключается в координации белок-белковых
в этом процессе отводится «никам» в ДНК [79],
взаимодействий после узнавания «мисматча» в
что продемонстрировано для эукариотических
ДНК [78]. В случае N. gonorrhoeae (как и боль-
клеток. Однако в случае прокариот эта гипотеза
шинства других организмов [77]) именно белок
нуждается в подтверждении.
MutL отвечает за внесение одноцепочечного
Рекомбинантный белок MutS из систе-
разрыва в «дочернюю» цепь с «мисматчем» [54,
мы MMR N. gonorrhoeae (ngMutS) был впервые
79]. MutL in vitro является низкоэффективной
получен в 2017 г. Рентгеноструктурный ана-
эндонуклеазой и не имеет участка узнавания
лиз ngMutS (PDB-код: 5YK4) показал, что он
в ДНК, поэтому вопрос дискриминации «до-
существует в виде димера, а каждый мономер
черней» цепи подобными ферментами остаёт-
имеет в своём состав 864 а.о., молекулярную
ся открытым [79, 80].
массу 95 кДа и pI 6,08 [85]. Авторы также про-
Процесс репарации «мисматчей» является
демонстрировали in vitro ATPазную активность
пострепликативным. Функционирование бел-
выделенного фермента и его способность свя-
ков этой системы тесно связано с репликацией.
зывать ДНК с dG/T-парой. На сегодняшний
MutS и MutL взаимодействуют с β-субъедини-
день известно, что инициация системы репа-
Рис. 1. Схема реализации MMR в клетках Е. coli и N. gonorrhoeae. «Ник» - разрыв в одной из цепей ДНК
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1189
Рис. 2. Сравнение аминокислотных последовательностей MutS из N. gonorrhoeae и E. coli. Серым цветом отмечены кон-
сервативные а.о., светло-серым - подобные а.о. Розовой рамкой обозначен «мисматч»-связывающий домен (а.о. 1-111),
жёлтой - соединяющий (а.о. 112-262), зелёной - коровый (а.о. 263-437 и 534-561), синей - β-«зажим» (а.о. 438-521),
коричневой - рычажный (а.о. 522-561), фиолетовой - ATPазный (а.о. 562-758), голубой - мотив «спираль-пово-
рот-спираль» (HTH, а.о. 759-791). Бирюзовым отмечен консервативный «мисматч»-связывающий мотив GDFYE
рации MMR E. coli происходит в результате уз-
(алгоритм Muscle, матрица BLOSUM62 при
навания неканонической пары оснований в
консервативности 100%). Высокий процент го-
ДНК белком MutS, так как сродство фермента
мологии (52,6% идентичности и 66,6% подобия)
к субстрату с «мисматчем» гораздо выше, чем к
ngMutS и ecMutS позволяет предположить сход-
неповреждённой ДНК [86-88]. На рис. 2 при-
ство механизмов узнавания «мисматчей» этими
ведено сравнение аминокислотных последо-
белками.
вательностей MutS E. coli (ecMutS) и ngMutS,
Namadurai et al. [89] был получен реком-
выполненное с помощью программы Jalview бинантный белок MutL из системы MMR
БИОХИМИЯ том 87 вып. 9 2022
1190
САВИЦКАЯ и др.
Рис. 3. Сравнение аминокислотных последовательностей MutL из N. gonorrhoeae и E. coli. Серым цветом отмече-
ны консервативные а.о., светло-серым - подобные а.о. Розовой рамкой обозначен NTD (а.о. 1-366), синей - CTD
(а.о. 432-615), чёрной - ATPазный домен (а.о. 25-127), голубой - эндонуклеазный мотив DXHAX2EX4E (а.о. 490-502),
зелёной - мотив QHLLIP, ответственный за связывание с β-«зажимом» (а.о. 517-522)
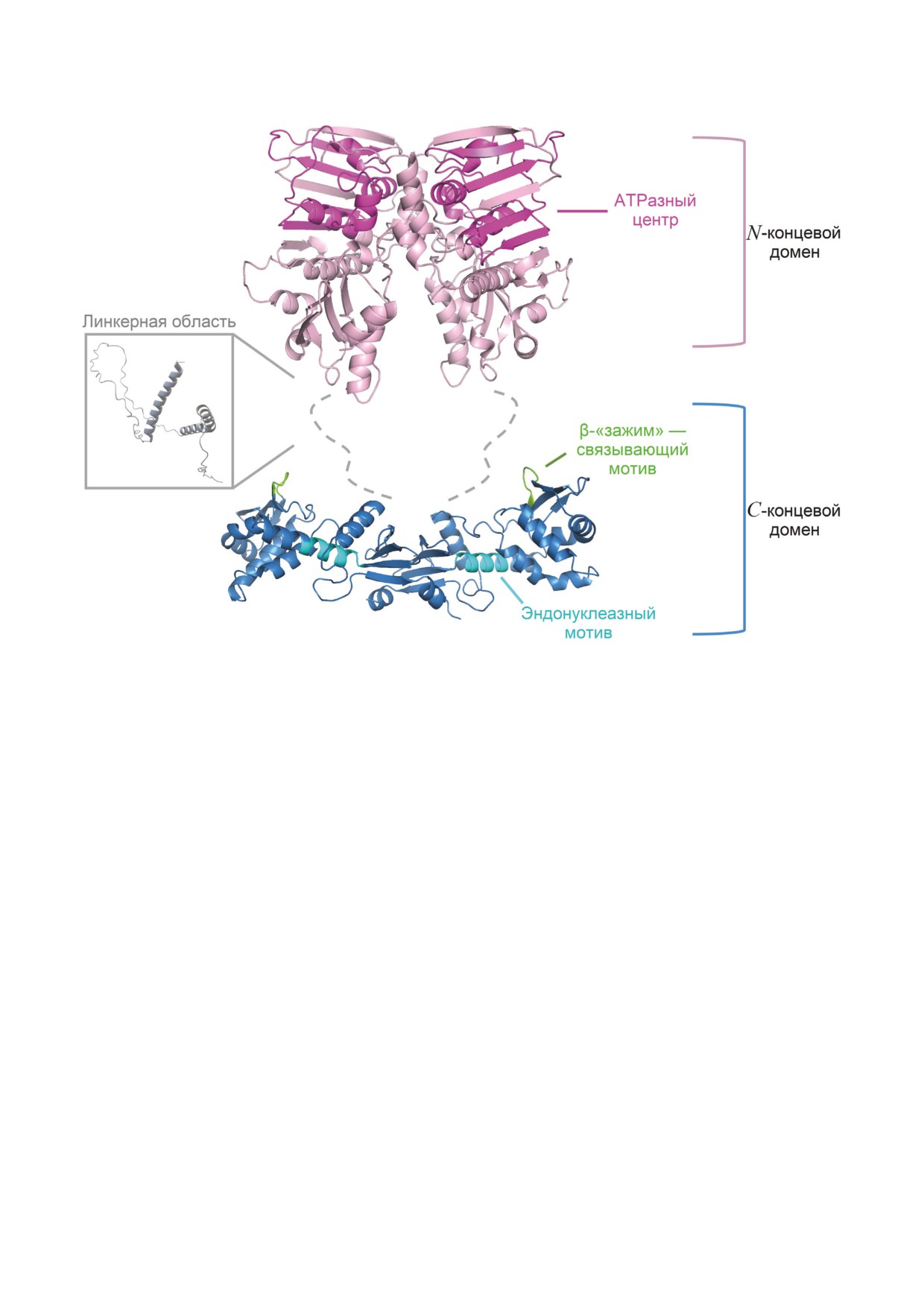
N. gonorrhoeae (ngMutL). Сравнение его амино-
доменов (52,7% идентичности и 63,9% подо-
кислотной последовательности с ранее охарак-
бия), ответственных за ATPазную и ДНК-свя-
теризованными гомологами из других организ-
зывающую активности (рис. 3).
мов позволило заключить, что ngMutL имеет
Наличие кристаллической структуры
два домена - N-концевой (NTD - 366 а.о.) и
N-концевого домена ecMutL (PDB-код: 1B63)
C-концевой (CTD - 148 а.о.), соединённые не-
позволило нам с использованием программы
структурированным линкером (144 а.о.). На се-
SwissModel получить модель NTD-ngMutL.
годняшний день продемонстрированы ATPаз-
Линкерная область белка (144 а.о.) является
ная и ДНК-связывающая активности ngMutL,
неструктурированной, и её модель была сге-
а также способность вносить одноцепочечный
нерирована в той же программе после поиска
разрыв в плазмидную ДНК в присутствии ионов
наиболее похожих по аминокислотной после-
магния или марганца [54, 76]. Хотя полнораз-
довательности белков с известной структурой
мерный белок ngMutL, как и его гомологи из
(PDB-код: 3WOD). Кристаллическая структура
других организмов, не был закристаллизован,
C-концевого домена белка получена в работе
анализ аминокислотных последовательностей
Namadurai et al. [89] (PDB-код: 3NCV). Итого-
ngMutL и ecMutL показал высокую степень го-
вые модели пространственной структуры доме-
мологии полноразмерных белков (42,6% иден-
нов мономера ngMutL представлены на рис. 4.
тичности и 55,4% подобия) и их N-концевых
CTD-ngMutL содержит высококонсервативные
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1191
Рис. 4. Модель пространственных структур доменов и линкерного участка мономера белка MutL из N. gonorrhoeae
мотивы, вовлечённые в координацию ионов
заминированию с образованием тимина [57,
двухвалентных металлов и реализацию эндону-
58]. В результате этого процесса образуется
клеазной функции фермента (рис. 3) [74].
повреждение ДНК, представляющее собой не-
Сравнение аминокислотных последова-
каноническую пару dG/T, за исправление ко-
тельностей гомологов MutL выявило наличие
торого отвечает система репарации VSP [92].
консервативного мотива QHLLIP (рис. 3) в
Ключевыми ферментами данной системы яв-
С-концевом домене белка ngMutL, ответствен-
ляются высокоспецифичные эндонуклеазы Vsr
ного за связывание с β-«зажимом» [74, 90].
и ДНК-полимераза I. Эндонуклеаза Vsr узнаёт
Исходя из этого, можно предположить меха-
неканоническую пару dG/T и вносит одноце-
низм внесения одноцепочечного разрыва в
почечный разрыв с 5′-конца от тимидина [93].
повреждённую цепь ДНК белком MutL в ходе
ДНК-полимераза I, обладающая 5′→3′-экзонук-
процесса репарации «мисматчей» организма
леазной и полимеразной активностями, вос-
N. gonorrhoeae (рис. 1). Однако прокариоти-
станавливает каноническую dG/dC-пару.
ческие MutL мало изучены, и детали о вли-
Kwiatek et al. [92] идентифицировали два
янии различных факторов на специфичное
гена N. gonorrhoeae, кодирующие эндонуклеа-
внесение одноцепочечного разрыва до сих пор
зы Vsr (V.ngAXIII и V.ngAXIV), которые име-
уточняются.
ют высокую специфичность к парам dG/T в
Система репарации очень коротких участков.
составе ДНК. Есть предположение, что белки
5-Метилцитозин, образование которого ката-
ngMutS и ngMutL в системе репарации очень
лизируется цитозиновыми ДНК-метилтранс-
коротких участков регулируют гидролитиче-
феразами, является эпигенетическим марке-
скую активность эндонуклеаз Vsr [94]. Выяв-
ром, позволяющим различать собственную и
лено взаимодействие между ngMutL и обеими
чужеродную ДНК и регулировать экспрессию
эндонуклеазами Vsr патогена [56]. Более того,
генов [91]. Однако, будучи менее стабильным,
в присутствии ngMutL эффективность специ-
чем неметилированный цитозин,
5-метил-
фичного гидролиза ДНК эндонуклеазами
цитозин легко подвергается спонтанному де-
V.ngAXIII и V.ngAXIV увеличивалась. Вместе
БИОХИМИЯ том 87 вып. 9 2022
1
192
САВИЦКАЯ и др.
с тем образования комплекса между белком
разрывов ДНК, вызванных ионизирующим из-
ngMutS и эндонуклеазами Vsr обнаружено не
лучением [60]. Stohl и Seifert [28] показали, что
было. Присутствие ngMutS понижало эффек-
выживаемость клеток N. gonorrhoeae, содержа-
тивность гидролитической активности фер-
щих делеции генов ruvA, ruvC и recG, после воз-
ментов V.ngAXIII и V.ngAXIV. Авторы предпо-
действия на них H2O2 была резко снижена по
ложили, что подобный эффект наблюдается
сравнению с клетками исходного дикого типа.
из-за того, что сродство белка ngMutS к ДНК,
Независимо от активности комплекса
содержащей неканоническую dG/T-пару, го-
RecBCD, гомологичная рекомбинация N. gonor-
раздо выше, чем сродство белков V.ngAXIII
rhoeae может происходить по так называемому
и V.ngAXIV. Однако совместное присутствие
RecF-подобному пути, в котором участвуют хе-
ngMutL и ngMutS повышало эффективность
ликаза RecQ, эндонуклеаза RecJ и белки RecO
специфичного расщепления ДНК обеими
и RecR. Последние привлекают рекомбина-
Vsr-эндонуклеазами из N. gonorrhoeae по срав-
зу RecA на одноцепочечный фрагмент репа-
нению с реакцией, катализируемой только
рируемой ДНК [100]. Интересным отличием
V.ngAXIII или V.ngAXIV. Таким образом, белки
от RecF-пути E. coli в данном случае является
ngMutS и ngMutL регулируют процесс VSP-ре-
то, что последний реализуется только в случае
парации, но механизм этого процесса остаётся
инактивации комплекса RecBCD в результате
невыясненным.
тех или иных мутаций [37].
Репарация с участием систем рекомбинации.
Наиболее изученной системой репарации ДНК
у N. gonorrhoeae является система рекомбина-
РОЛЬ РЕПАРАЦИИ
ционной репарации [95]. Восстановление по-
ПОВРЕЖДЕНИЙ ДНК В ПАТОГЕНЕЗЕ
вреждений ДНК с помощью этого механизма
может протекать по пути RecBCD, а также по
Участие рекомбинационной репарации в ва-
RecF-подобному пути. Геном N. gonorrhoeae со-
риабельности пилина. Известно, что процессы
держит гены, кодирующие белки пути RecBCD
рекомбинации используются N. gonorrhoeae не
(белки RecB, RecC и RecD), благодаря кото-
только для устранения повреждений в ДНК,
рому устраняются двуцепочечные разрывы,
но и для реализации антигенной вариации
индуцируемые излучением различного типа,
белка пилина (PilE) [101]. Ген pilE и кодируе-
действием химических веществ или возника-
мый им белок можно разделить на вариабель-
ющие в процессе репликации ДНК с одноце-
ные и консервативные области [102]. Процесс
почечными разрывами (последнее наиболее
антигенной вариации пилей заключается в
вероятно для данного организма) [28, 96]. Как
переносе вариабельной кодирующей последо-
и другие бактериальные гомологи, комплекс
вательности из неэкспрессируемого «молча-
RecBCD из N. gonorrhoeae инициирует реком-
щего» локуса (pilS) в локус экспрессии (pilE)
бинацию, связываясь с «тупым» концом по-
без изменения донорского локуса [103]. По-
вреждённой ДНК [97]. Субъединицы RecB и
следовательности pilS не имеют промотора,
RecD являются хеликазами и расплетают ДНК
но высокогомологичны с экспрессируемой
до определённой последовательности, называ-
последовательностью pilE, являясь источни-
емой Chi-сайтом (5′-GCTGGTGG-3′). Далее,
ком вариабельной генетической информации.
эндонуклеаза RecB вносит одноцепочечный
Такая изменчивость может обеспечить пато-
разрыв в цепь ДНК, содержащую Chi-сайт,
гену N. gonorrhoeae способность сохраняться в
и продолжает расплетать двойную спираль.
организме хозяина продолжительное время и
Комплекс ферментов RecBCD привлекает ре-
повторно его инфицировать [104].
комбиназу RecA на образовавшийся 3′-конец
Механизм антигенной вариации пилина
одноцепочечной ДНК, затем RecBCD рас-
N. gonorrhoeae активно изучается. Известно,
падается. Одноцепочечный фрагмент ДНК в
что в его реализации задействованы рекомби-
комплексе с RecA связывается с гомологичной
наза RecA, ферменты RecF-подобного пути
последовательностью, а вторая цепь ДНК-ду-
рекомбинации (RecOR, RecJ, RecQ), а также
плекса вытесняется с образованием структуры
комплекс белков RuvABC и RuvG для разруше-
Холидея [98]. Разрушение этой структуры про-
ния структуры Холидея [105]. Показано, что в
исходит с помощью белков RuvABC и RecG,
результате делеций генов recA, recO и recR му-
гены которых также обнаружены в геноме
тантные клеточные линии N. gonorrhoeae пол-
N. gonorrhoeae [37, 99].
ностью теряли способность к антигенной ва-
Известно, что дефекты в последователь-
риации [101]. Нокауты генов ruvA, ruvB, ruvC,
ности гена recB (но не recD) гонококков при-
recQ или recG приводили к резко сниженной
водят к нарушению репарации двуцепочечных
частоте этого процесса [106]. Тем не менее
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1193
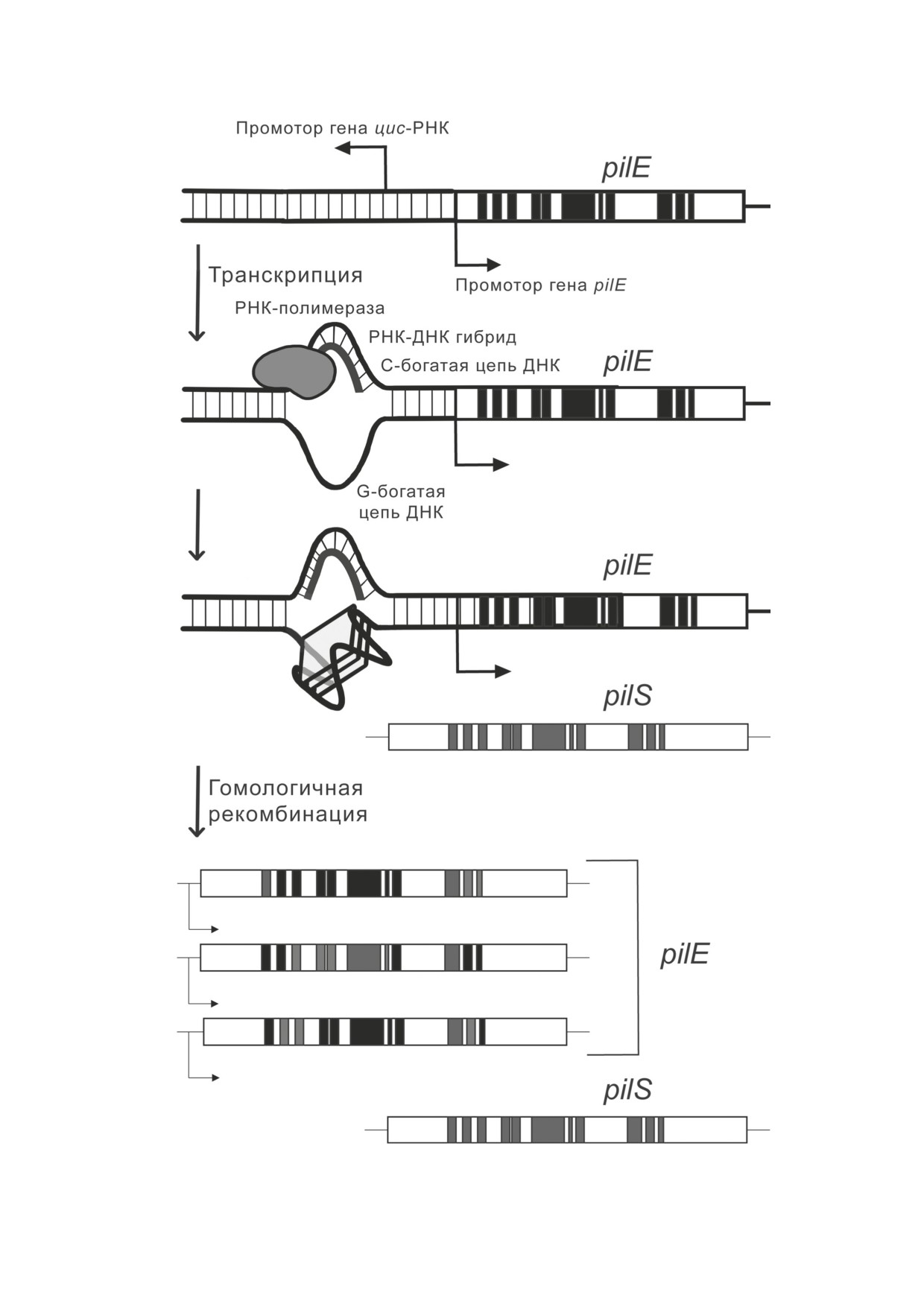
Рис. 5. Формирование параллельного G-квадруплекса для инициации антигенной вариации pilE патогена N. gonorrhoeae.
Гибридизация С-богатой последовательности ДНК с комплементарной цис-РНК стабилизирует структуру G4
3
БИОХИМИЯ том 87 вып. 9 2022
1
194
САВИЦКАЯ и др.
штаммы с инактивированными recB и recD де-
и участка дуплекса вблизи неканонической
монстрировали ту же способность к вариации
структуры. Известно, что такой активностью
пилина, что и штаммы дикого типа [107]. Это
обладает хеликаза RecQ, нокаут гена которой
свидетельствует в пользу того, что антигенная
приводит к снижению частоты антигенной ва-
вариация пилей организма N. gonorrhoeae об-
риации в клетках N. gonorrhoeae [117]. Однако
условлена гомологичной RecF-подобной ре-
в результате точечной замены D307A в хели-
комбинацией и не зависит от активности ком-
казном мотиве RecQ, инактивирующей спо-
плекса RecBCD [59, 108].
собность белка расплетать G4, но не ДНК-ду-
Помимо этого, для реализации процес-
плекс, снижение частоты антигенной вариации
са антигенной вариации пилей IV-го типа
в клетках патогена обнаружено не было. Таким
N. gonorrhoeae необходимо наличие короткой
образом, в раскручивании G4 после инициа-
богатой гуанином последовательности, распо-
ции рекомбинации RecQ не участвует, но, по
ложенной на расстоянии около 350 п.н. «выше»
всей видимости, облегчает этот процесс за счёт
промотора pilE [109]. Эта последовательность
расплетания ДНК-дуплекса вблизи G-богатой
способна образовывать параллельный G-квад-
последовательности [117].
руплекс (G4) in vitro (рис. 5) [110]. Точечные
Влияние систем NER и BER на выживае-
замены G (но не T [111]) в этой последователь-
мость и изменчивость N. gonorrhoeae. Как было
ности приводят к разрушению G4-ДНК и на-
описано выше (см. «Эксцизионная репарация
рушению способности патогена к антигенной
оснований» и «Эксцизионная репарация нук-
вариации пилина [95]. Полагают, что неболь-
леотидов»), пути NER и BER N. gonorrhoeae
шая некодирующая РНК (цис-РНК), промотор
служат преимущественно для устранения по-
которой располагается рядом с указанным мо-
вреждений, вызванных различными экзоген-
тивом G4 гена pilE и является консервативным
ными факторами. Эти важнейшие механизмы
в большинстве секвенированных штаммов
позволяют патогену выживать в среде организ-
N. gonorrhoeae, образует гибрид с C-богатой
ма-хозяина [118].
комплементарной последовательностью ДНК.
Кроме своей основной роли, белки NER
Это, в свою очередь, способствует формирова-
вносят вклад в изменчивость пилина. Несмот-
нию G4 в противоположной цепи (рис. 5) [112,
ря на то что они не вовлечены в антигенную
113], поэтому для инициации антигенной вариа-
вариацию pilE, показано, что нокаут uvrD (но
ции пилина необходима также транскрипция
не uvrABC) значительным образом увеличивает
этой цис-РНК [114].
вариацию белка PilC, входящего в состав пи-
Формирование G4 in vitro было показано для
лей IV-го типа [119]. Структурный белок PilC
многих G-богатых последовательностей ДНК.
претерпевает фазовые вариации, однако по
G-квадруплексы играют важную роль в регуля-
RecA-независимому пути. В N. gonorrhoeae при-
ции большого числа биологических процессов,
сутствуют два идентичных гена pilC1 и pilC2, ко-
в том числе и систем репарации ДНК [115, 116].
торые способны «переключаться» между собой
Для N. gonorrhoeae было продемонстрировано,
за счёт сдвига рамки считывания в областях,
что формирование параллельного G-квадру-
кодирующих сигнальный пептид [120, 121].
плекса сопровождается возникновением од-
Влияние белков MMR на адаптацию патоге-
ноцепочечных разрывов, благодаря которым
на. В настоящее время в литературе появляются
происходит дальнейшая антигенная вариация
новые данные о влиянии белков системы MMR
пилина путём гомологичной рекомбинации.
на различные процессы адаптации и изменчи-
Тем не менее на сегодняшний день неизвест-
вости N. gonorrhoeae и его родственного вида
но, какой именно фермент вносит эти разры-
N. meningitidis, системы репарации ДНК которых
вы в ДНК. Присутствие низкомолекулярного
аналогичны, как и процессы фазовой и анти-
соединения N-метил-мезопорфирина (NMM),
генной вариации [122, 123]. Так, продемонстри-
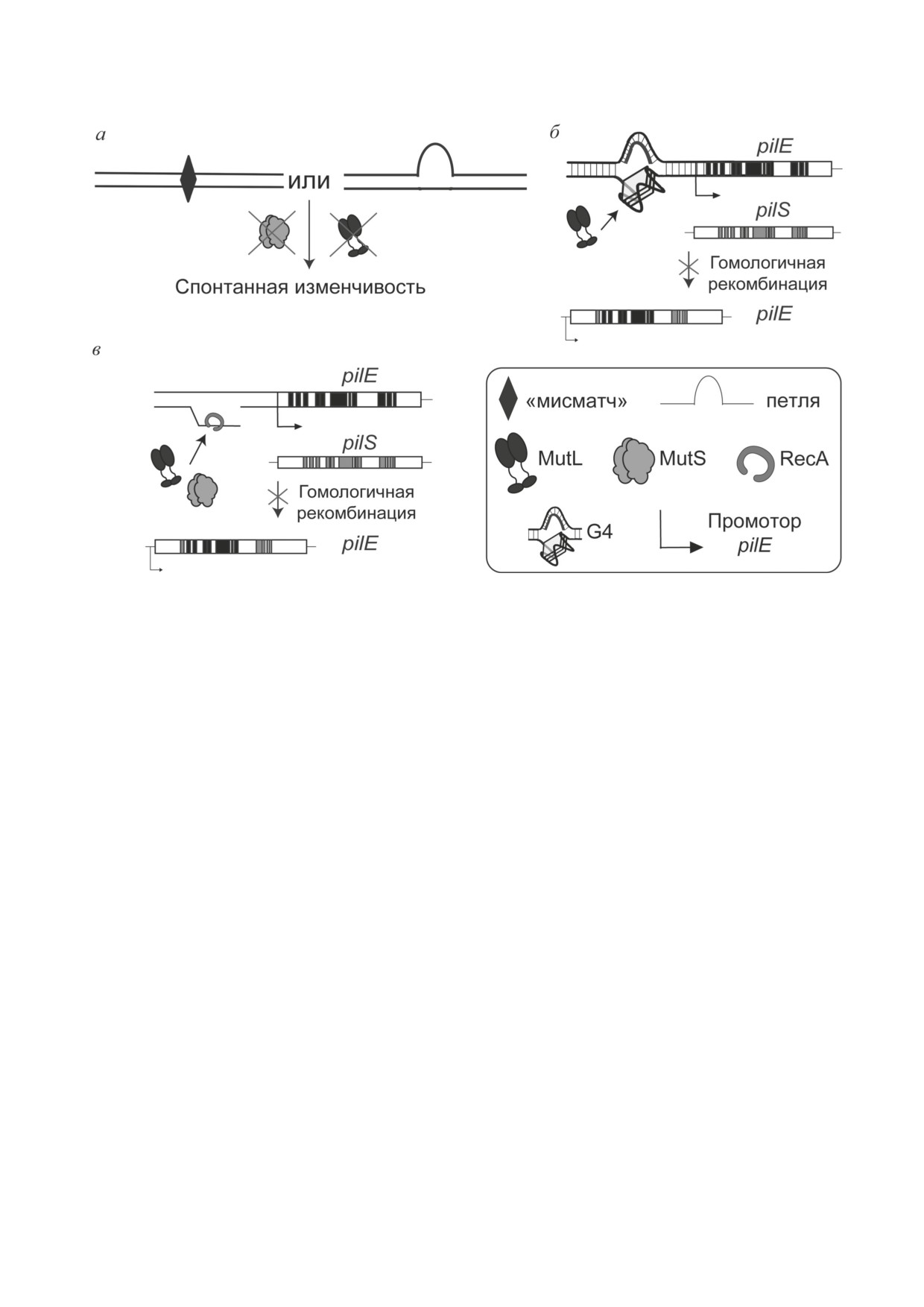
специфически связывающего G4, резко сни-
ровано, что снижение активности белков MMR
жает частоту антигенной вариации пилина
способствует видовой изменчивости и адап-
N. gonorrhoeae [110]. Предполагают, что NMM
тации бактерий к условиям окружающей сре-
ингибирует возникновение разрывов рядом с
ды (рис. 6, а) [123]. Richardson и Stojiljkovic [124]
G-богатой областью в результате конкуренции
показали, что нокауты генов mutS или mutL в
с белками RecF-подобного пути рекомбинации
клинических штаммах N. meningitidis привели к
за взаимодействие с G4-ДНК.
резкому увеличению частоты появления спон-
Из общих представлений о процессе гомо-
танной мутации устойчивости к рифампицину.
логичной рекомбинации понятно, что после
Также описана природная клеточная линия,
возникновения одноцепочечного разрыва в
экспрессирующая ген мутантной формы бел-
ДНК необходимо раскручивание как G4, так
ка MutL (32 аминокислотные замены по срав-
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1195
Рис. 6. Возможные пути влияния системы MMR на патогенез N. gonorrhoeae. а — Инактивация MMR приводит к на-
коплению мутаций и повышенной изменчивости бактерии. б — Связывание ngMutL с G4 перед промотором пилина
блокирует инициацию антигенной вариации, что препятствует изменчивости патогена. в — ngMutL и ngMutS инакти-
вируют действие RecA, снижая эффективность антигенной вариации пилина
нению с ферментом дикого типа), которая об-
как образование G4 необходимо для протека-
ладает высокой частотой фазовых вариаций и
ния этого процесса (см. «Участие рекомбина-
быстро приобретает устойчивость к этому анти-
ционной репарации в вариабельности пили-
биотику. Изолированные клетки N. meningitidis,
на»). Однако клеточные линии N. gonorrhoeae,
вырабатывающие мутантную форму MutS, так-
содержащие как делецию гена mutS, так и ген
же показывали высокую скорость изменчиво-
мутантного MutS, способный связывать только
сти по данному признаку.
G-квадруплексы, демонстрировали одинако-
Показано влияние белков MMR на ва-
во повышенную антигенную вариацию пили-
риацию поверхностного белка PorA. Штамм
на [126]. Подобный эксперимент для MutL не
N. meningitides, лишённый белка MutS, демон-
проводили, тем не менее нами также продемон-
стрировал снижение экспрессии гена, кодирую-
стрирована способность этого белка связывать
щего PorA. Это позволило патогену выработать
G4-структуры
[127]. Можно предположить,
устойчивость к антибактериальной активности
что процесс
гомологичной рекомбинации
PorA-cпецифического моноклонального анти-
N. gonorrhoeae регулируется благодаря этому
тела, являющегося основным компонентом
свойству MutL (рис. 6, б).
ряда вакцин, снижая их эффективность [125].
Показано, что MutL стимулирует G4-хе-
По некоторым данным, белки системы
ликазную активность UvrD [121, 130]. Однако
MMR N. gonorrhoeae могут принимать участие
предположение о том, что UvrD задействована
в регуляции гомологичной рекомбинации pilE/
в регуляции антигенной вариации pilE, опро-
pilS, лежащей в основе антигенной вариации пи-
вергается экспериментальными данными (но-
лина [119]. Мутантные линии патогена с нокау-
каут гена хеликазы не влияет на изменчивость
тами генов mutS или mutL (см. «Система репара-
этого белка) [119].
ции «мисматчей») демонстрируют повышенную
Один из предполагаемых механизмов вли-
частоту антигенной вариации pilE [126]. Уста-
яния белков MMR на антигенную вариацию
новлено, что белок MutS обладает высоким
пилина заключается в их взаимодействии с ре-
сродством к G4-структурам [127-129]. Предпо-
комбиназой RecA. Так, для клеток E. coli про-
лагалось, что именно за счёт этого свойства он
демонстрировано, что комплекс MutS-MutL
регулирует гомологичную рекомбинацию, так
ингибирует рекомбиназу RecA in vitro и тем
БИОХИМИЯ том 87 вып. 9 2022
3*
1
196
САВИЦКАЯ и др.
самым может регулировать гомологичную ре-
рованными белками системы MMR демонстри-
комбинацию [131] (рис. 6, в). В целом, процесс
руют повышенную изменчивость, устойчивость
регуляции антигенной вариации pilE белками
к антибиотикам и адгезивность к клеткам че-
системы MMR патогена N. gonorrhoeae остается
ловека. Предполагается, что ngMutS и ngMutL,
неясным.
помимо своей основной роли в репарации не-
Влияние MMR на изменчивость пили-
канонических пар оснований, вовлечены в ре-
на не ограничивается антигенной вариаци-
гуляцию процесса антигенной вариации пилей
ей pilE. Известно, что инактивация MutS
IV-го типа, детали которого ещё предстоит из-
и MutL N. gonorrhoeae, как и нокаут гена хели-
учить. Понимание функционирования систем
казы (uvrD), повышает вариацию PilC по не-
репараций ДНК патогена может позволить
зависимому от RecA механизму [119]. Предпо-
разработать новые подходы к созданию препа-
лагается, что эта изменчивость PilC является
ратов, позволяющих бороться с заболеванием,
результатом отсутствия репарации «мисмат-
вызываемым N. gonorrhoeae, что является акту-
чей» и небольших петель в генах рilC1 и pilC2,
альным в силу растущего числа устойчивых к
возникающих при репликации (рис. 6, а).
антибиотикам штаммов этого патогена.
Вклад авторов. В.Ю. Савицкая, М.В. Мо-
ЗАКЛЮЧЕНИЕ
нахова и Е.А. Кубарева - концепция; В.Ю. Са-
вицкая, И.И. Боровикова и Ю.В. Якушки-
Несмотря на то что бактерия N. gonorrhoeae
на
- анализ литературы; В.Ю. Савицкая,
известна на протяжении многих лет, механиз-
М.В. Монахова и Е.А. Кубарева - обсуждение
мы её адаптации к различным условиям обита-
данных литературы; В.Ю. Савицкая - под-
ния (в том числе и антибиотикам), остаются не-
готовка текста; В.Ю. Савицкая, И.И. Боро-
изученными. Большой вклад в вирулентность
викова, Ю.В. Якушкина, и М.В. Монахо-
бактерии вносят различные системы репара-
ва - подготовка иллюстративного материала,
ции ДНК, отвечающие как за устранение по-
Е.А. Кубарева и М.В. Монахова - редактиро-
вреждений и «ошибок» в ДНК (сохранение
вание обзора.
генетической информации), так и за измен-
Финансирование. Работа выполнена при
чивость белков внешней мембраны патогена.
финансовой поддержке Российского научного
Наиболее активно на сегодняшний день изу-
фонда (грант № 21-14-00161).
чают белки систем репарации очень коротких
Конфликт интересов. Авторы заявляют об
участков (VSP), рекомбинационной репарации
отсутствии конфликта интересов.
и репарации «мисматчей» (MMR), в частности,
Соблюдение этических норм. Настоящая
исследуемый в наших работах ngMutL.
статья не содержит описания каких-либо ис-
Особую роль в выживаемости N. gonorrhoeae
следований с участием людей или животных в
играет система MMR. Так, штаммы с инактиви-
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Hoffman, O., and Weber, J. R.
(2009) Review:
5. Lim, K. Y. L., Mullally, C. A., Haese, E. C., Kibble,
Pathophysiology and treatment of bacterial men-
E. A., McCluskey, N. R., et al. (2021) Anti-virulence
ingitis, Ther. Adv. Neurol. Disord.,
2,
401-412,
therapeutic approaches for Neisseria gonorrhoeae,
doi: 10.1177/1756285609337975.
Antibiotics, 10, 103, doi: 10.3390/antibiotics10020103.
2. Snyder, L. A. S., Butcher, S. A., and Saunders,
6. Liu, J., Yang, C., Cheng, C., Zhang, C., Zhao, J.,
N. J. (2001) Comparative whole-genome analyses
and Fu, C. (2021) In vitro antimicrobial effect and
reveal over 100 putative phase-variable genes in the
mechanism of action of plasma-activated liquid on
pathogenic Neisseria spp, Microbiology, 147, 2321-
planktonic Neisseria gonorrhoeae, Bioengineered, 12,
2332, doi: 10.1099/00221287-147-8-2321.
4605-4619, doi: 10.1080/21655979.2021.1955548.
3. Hill, S. A., Masters, T. L., and Wachter, J. (2016)
7. Dijokaite, A., Humbert, M. V., Borkowski, E., La
Gonorrhea - an evolving disease of the new mil-
Ragione, R. M., and Christodoulides, M.
(2021)
lennium, Microb. Cell, 3, 371-389, doi: 10.15698/
Establishing an invertebrate Galleria mellonella
mic2016.09.524.
greater wax moth larval model of Neisseria
4. Caromona-Gutierrez, D., Kainz, K., and Madeo, F.
gonorrhoeae infection, Virulence,
12,
1900-1920,
(2016) Sexually transmitted infections: old foes on
doi: 10.1080/21505594.2021.1950269.
the rise, Microb. Cell, 3, 361-362, doi: 10.15698/
8. Quillin, S. J., and Seifert, H. S. (2018) Neisse-
mic2016.09.522.
ria gonorrhoeae host adaptation and pathogene-
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1197
sis, Nat. Rev. Microbiol., 16, 226-240, doi: 10.1038/
21. Schaub, R. E., Perez-Medina, K. M., Hackett, K.
nrmicro.2017.169.
T., Garcia, D. L., and Dillard, J. P. (2019) Neisseria
9. Giltner, C. L., Nguyen, Y., and Burrows, L. L. (2012)
gonorrhoeae PBP3 and PBP4 facilitate NOD1 ag-
Type IV pilin proteins: versatile molecular modules,
onist peptidoglycan fragment release and survival
Microbiol. Mol. Biol. Rev., 76, 740-772, doi: 10.1128/
in stationary phase, Infect. Immun., 87, e00833-18,
MMBR.00035-12.
doi: 10.1128/IAI.00833-18.
10. Rudel, T., Scheuerpflug, I., and Meyer, T. F.
22. Schaub, R. E., and Dillard, J. P. (2019) The pathogenic
(1995) Neisseria PilC protein identified as type-
Neisseria use a streamlined set of peptidoglycan
4 pilus tip-located adhesin, Nature, 373, 357-359,
degradation proteins for peptidoglycan remodeling,
doi: 10.1038/373357a0.
recycling, and toxic fragment release, Front. Microbiol.,
11. Denis, K., Le Bris, M., Le Guennec, L., Barnier, J.-
10, 73, doi: 10.3389/fmicb.2019.00073.
P., Faure, C., et al. (2019) Targeting type IV pili as an
23. Wetzler, L. M., Barry, K., Blake, M. S., and
antivirulence strategy against invasive meningococcal
Gotschlich, E. C. (1992) Gonococcal lipooligosac-
disease, Nat. Microbiol., 4, 972-984, doi: 10.1038/
charide sialylation prevents complement-dependent
s41564-019-0395-8.
killing by immune sera, Infect. Immun., 60, 39-43,
12. Plant, L. J., and Jonsson, A.-B. (2006) Type IV pili
doi: 10.1128/iai.60.1.39-43.1992.
of Neisseria gonorrhoeae influence the activation of
24. Ngampasutadol, J., Ram, S., Gulati, S., Agarwal,
human CD4+ T cells, Infect. Immun., 74, 442-448,
S., Li, C., et al. (2008) Human factor H interacts
doi: 10.1128/IAI.74.1.442-448.2006.
selectively with Neisseria gonorrhoeae and results in
13. Shaughnessy, J., Ram, S., and Rice, P. A. (2019)
species-specific complement evasion, J. Immunol.,
Biology of the gonococcus: disease and pathogenesis,
180, 3426-3435, doi: 10.4049/jimmunol.180.5.3426.
Methods in Molecular Biology, Springer, Totowa, NJ.
25. Edwards, J. L., and Apicella, M. A. (2002) The role
14. Zhang, S., Tu, Y., Cai, H., Ding, H., Li, Q., et al.
of lipooligosaccharide in Neisseria gonorrhoeae
(2016) Opacity proteins of Neisseria gonorrhoeae in
pathogenesis of cervical epithelia: lipid A serves as a
lipooligosaccharide mutants lost ability to interact
C3 acceptor molecule, Cell. Microbiol., 4, 585-598,
with neutrophil-restricted CEACAM3 (CD66d),
doi: 10.1046/j.1462-5822.2002.00212.x.
J. Huazhong Univ. Sci. Technol. Med. Sci., 36, 344-
26. Heesterbeek, D. A. C., Muts, R. M., van Hensbergen,
349, doi: 10.1007/s11596-016-1589-4.
V. P., de Saint Aulaire, P., Wennekes, T., et al. (2021)
15. Britigan, B. E., Cohen, M. S., and Sparling, P. F.
Outer membrane permeabilization by the mem-
(1985) Gonococcal infection: a model of molecular
brane attack complex sensitizes Gram-negative bac-
pathogenesis, N. Engl. J. Med.,
312,
1683-1694,
teria to antimicrobial proteins in serum and phago-
doi: 10.1056/NEJM198506273122606.
cytes, PLOS Pathog., 17, e1009227, doi: 10.1371/
16. Judd, R. C. (1989) Protein I: structure, function,
journal.ppat.1009227.
and genetics, Clin. Microbiol. Rev.,
2, S41-S48,
27. Johnson, S. R., Steiner, B. M., Cruce, D. D., Perkins,
doi: 10.1128/CMR.2.Suppl.S41-S48.1989.
G. H., and Arko, R. J. (1993) Characterization of
17. Ram, S., McQuillen, D. P., Gulati, S., Elkins, C.,
a catalase-deficient strain of Neisseria gonorrhoeae:
Pangburn, M. K., et al. (1998) Binding of complement
evidence for the significance of catalase in the biology
factor H to loop 5 of porin protein 1A: a molecular
of N. gonorrhoeae, Infect. Immun., 61, 1232-1238,
mechanism of serum resistance of nonsialylated
doi: 10.1128/iai.61.4.1232-1238.1993.
Neisseria gonorrhoeae, J. Exp. Med., 188, 671-680,
28. Stohl, E. A., and Seifert, H. S. (2006) Neisseria
doi: 10.1084/jem.188.4.671.
gonorrhoeae DNA recombination and repair enzymes
18. Ram, S., Cullinane, M., Blom, A. M., Gulati, S.,
protect against oxidative damage caused by hydrogen
McQuillen, D. P., et al. (2001) Binding of C4b-
peroxide, J. Bacteriol., 188, 7645-7651, doi: 10.1128/
binding protein to porin, J. Exp. Med., 193, 281-296,
JB.00801-06.
doi: 10.1084/jem.193.3.281.
29. Skaar, E. P., Tobiason, D. M., Quick, J., Judd, R.
19. Song, W., Ma, L., Chen, R., and Stein, D. C.
C., Weissbach, H., et al. (2002) The outer membrane
(2000) Role of lipooligosaccharide in Opa-
localization of the Neisseria gonorrhoeae MsrA/B
independent invasion of Neisseria gonorrhoeae into
is involved in survival against reactive oxygen
human epithelial cells, J. Exp. Med., 191, 949-960,
species, Proc. Natl. Acad. Sci. USA, 99, 10108-10113,
doi: 10.1084/jem.191.6.949.
doi: 10.1073/pnas.152334799.
20. Chakraborti, S., Gulati, S., Zheng, B., Beurskens,
30. Tseng, H.-J., Srikhanta, Y., McEwan, A. G., and
F. J., Schuurman, J., et al. (2020) Bypassing phase
Jennings, M. P. (2001) Accumulation of manga-
variation of lipooligosaccharide (LOS): using heptose
nese in Neisseria gonorrhoeae correlates with re-
1 glycan mutants to establish widespread efficacy
sistance to oxidative killing by superoxide an-
of gonococcal anti-LOS monoclonal antibody
ion and is independent of superoxide dismutase
2C7, Infect. Immun., 88, e00862-19, doi: 10.1128/
activity, Mol. Microbiol., 40, 1175-1186, doi: 10.1046/
IAI.00862-19.
j.1365-2958.2001.02460.x.
БИОХИМИЯ том 87 вып. 9 2022
1
198
САВИЦКАЯ и др.
31. Iyer, R. R., Pluciennik, A., Burdett, V., and Modrich,
DNA repair activity in bacterial cells, Biochemistry,
P. L. (2006) DNA mismatch repair: functions and
56, 5356-5364, doi: 10.1021/acs.biochem.7b00366.
mechanisms, Chem. Rev., 106, 302-323, doi: 10.1021/
45. Thiagarajan, V., Byrdin, M., Eker, A. P. M.,
cr0404794.
Müller, P., and Brettel, K. (2011) Kinetics of cyclobu-
32. Chatterjee, N., and Walker, G. C. (2017) Mechanisms
tane thymine dimer splitting by DNA photolyase di-
of DNA damage, repair, and mutagenesis, Environ.
rectly monitored in the UV, Proc. Natl. Acad. Sci.
Mol. Mutagen., 58, 235-263, doi: 10.1002/em.22087.
USA, 108, 9402-9407, doi: 10.1073/pnas.1101026108.
33. Black, C. G., Fyfe, J. A. M., and Davies, J. K.
46. Campbell, L. A., and Yasbin, R. E. (1979) Deoxyribo-
(1998) Absence of an SOS-like system in Neisse-
nucleic acid repair capacities of Neisseria gonorrhoeae:
ria gonorrhoeae, Gene,
208,
61-66, doi:
10.1016/
absence of photoreactivation, J. Bacteriol., 140, 1109-
S0378-1119(97)00653-7.
1111, doi: 10.1128/jb.140.3.1109-1111.1979.
34. Ambur, O. H., Davidsen, T., Frye, S. A., Bal-
47. Cahoon, L. A., Stohl, E. A., and Seifert, H. S. (2011)
asingham, S. V., Lagesen, K., et al. (2009) Ge-
The Neisseria gonorrhoeae photolyase orthologue phrB
nome dynamics in major bacterial pathogens,
is required for proper DNA supercoiling but does not
FEMS Microbiol. Rev., 33, 453-470, doi: 10.1111/
function in photo-reactivation, Mol. Microbiol., 79,
j.1574-6976.2009.00173.x.
729-742, doi: 10.1111/j.1365-2958.2010.07481.x.
35. Schook, P. O. P., Stohl, E. A., Criss, A. K., and
48. Couvé, S., Ishchenko, A. A., Fedorova, O. S.,
Seifert, H. S. (2011) The DNA-binding activity of the
Ramanculov, E. M., Laval, J., et al. (2013) Direct
Neisseria gonorrhoeae LexA orthologue NG1427 is
DNA lesion reversal and excision repair in Escherichia
modulated by oxidation, Mol. Microbiol., 79, 846-860,
coli, EcoSal Plus, 5, doi: 10.1128/ecosalplus.7.2.4.
doi: 10.1111/j.1365-2958.2010.07491.x.
49. Rydberg, B., and Lindahl, T. (1982) Nonenzymatic
36. Maslowska, K. H., Makiela-Dzbenska, K., and Fijal-
methylation of DNA by the intracellular methyl group
kowska, I. J. (2019) The SOS system: A complex and
donor S-adenosyl-L-methionine is a potentially mu-
tightly regulated response to DNA damage, Environ.
tagenic reaction, EMBO J., 1, 211-216, doi: 10.1002/
Mol. Mutagen., 60, 368-384, doi: 10.1002/em.22267.
j.1460-2075.1982.tb01149.x.
37. Kline, K. A., Sechman, E. V., Skaar, E. P., and
50. Cadet, J., and Wagner, J. R. (2013) DNA base damage
Seifert, H. S.
(2003) Recombination, repair and
by reactive oxygen species, oxidizing agents, and
replication in the pathogenic Neisseriae: the 3 R′s of
UV radiation, Cold Spring Harb. Perspect. Biol., 5,
molecular genetics of two human-specific bacterial
a012559, doi: 10.1101/cshperspect.a012559.
pathogens, Mol. Microbiol., 50, 3-13, doi: 10.1046/
51. Davidsen, T., Bjørås, M., Seeberg, E. C., and
j.1365-2958.2003.03679.x.
Tønjum, T.
(2005) Antimutator role of DNA
38. Lindahl, T. (1981) DNA methyl transferase acting on
glycosylase MutY in pathogenic Neisseria species,
O6-methylguanine residues in adapted E. coli, Chromo-
J. Bacteriol.,
187,
2801-2809, doi:
10.1128/
some Damage and Repair, Springer US, New York, NY.
JB.187.8.2801-2809.2005.
39. Lindahl, T., Demple, B., and Robins, P.
(1982)
52. LeCuyer, B. E., Criss, A. K., and Seifert, H. S. (2010)
Suicide inactivation of the E. coli O6-methylguanine-
Genetic characterization of the nucleotide excision
DNA methyltransferase, EMBO J., 1, 1359-1363,
repair system of Neisseria gonorrhoeae, J. Bacteriol.,
doi: 10.1002/j.1460-2075.1982.tb01323.x.
192, 665-673, doi: 10.1128/JB.01018-09.
40. Friedberg, E. C., and Walker, G. C. (2006) DNA
53. Campbell, L. A., and Yasbin, R. E. (1984) A DNA
repair and mutagenesis, ASM Press, Second Edition,
excision repair system for Neisseria gonorrhoeae,
Washington, DC.
Mol. Gen. Genet. MGG, 193, 561-563, doi: 10.1007/
41. Setlow, R. B., Swenson, P. A., and Carrier, W. L.
BF00382101.
(1963) Thymine dimers and inhibition of DNA
54. Duppatla, V., Bodda, C., Urbanke, C., Friedhoff, P.,
synthesis by ultraviolet irradiation of cells, Science,
and Rao, D. N. (2009) The C-terminal domain
142, 1464-1466, doi: 10.1126/science.142.3598.1464.
is sufficient for endonuclease activity of Neisseria
42. Swenson, P. A., and Setlow, R. B. (1966) Effects of
gonorrhoeae MutL, Biochem. J.,
423,
265-277,
ultraviolet radiation on macromolecular synthesis
doi: 10.1042/BJ20090626.
in Escherichia coli, J. Mol. Biol.,
15,
201-219,
55. Kunkel, T. A.
(2004) DNA replication fideli-
doi: 10.1016/S0022-2836(66)80221-8.
ty, J. Biol. Chem., 279, 16895-16898, doi: 10.1074/
43. Villani, G., Boiteux, S., and Radman, M.
(1978)
jbc.R400006200.
Mechanism of ultraviolet-induced mutagenesis: extent
56. Adamczyk-Popławska, M., Bandyra, K., and
and fidelity of in vitro DNA synthesis on irradiated
Kwiatek, A. (2018) Activity of Vsr endonucleases
templates, Proc. Natl. Acad. Sci. USA, 75, 3037-3041,
encoded by Neisseria gonorrhoeae FA1090 is
doi: 10.1073/pnas.75.7.3037.
influenced by MutL and MutS proteins, BMC
44. Yamamoto, J., Shimizu, K., Kanda, T., Hosokawa, Y.,
Microbiol., 18, 95, doi: 10.1186/s12866-018-1243-3.
Iwai, S., et al. (2017) Loss of fourth electron-transfer-
57. Ehrlich, M., Norris, K. F., Wang, R. Y., Kuo, K. C.,
ring tryptophan in animal (6-4) photolyase impairs
and Gehrke, C. W. (1986) DNA cytosine methylation
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1199
and heat-induced deamination, Biosci. Rep., 6, 387-
70. Landová, B., and Šilhán, J. (2020) Conformational
393, doi: 10.1007/BF01116426.
changes of DNA repair glycosylase MutM triggered
58. Shen, J.-C., Rideout, W. M., and Jones, P. A. (1994)
by DNA binding, FEBS Lett.,
594,
3032-3044,
The rate of hydrolytic deamination of 5-methylcyto-
doi: 10.1002/1873-3468.13876.
sine in double-stranded DNA, Nucleic Acids Res., 22,
71. Michelson, A. Z., Chen, M., Wang, K., and Lee, J. K.
972-976, doi: 10.1093/nar/22.6.972.
(2012) Gas-phase studies of purine 3-methyladenine
59. Prister, L. L., Xu, J., and Seifert, H. S.
(2019)
DNA glycosylase II (AlkA) substrates, J. Am. Chem.
A double-strand break does not promote Neisseria
Soc., 134, 9622-9633, doi: 10.1021/ja211960r.
gonorrhoeae pilin antigenic variation, J. Bacteriol.,
72. Van Houten, B., Croteau, D. L., DellaVecchia,
201, e00256-19, doi: 10.1128/JB.00256-19.
M. J., Wang, H., and Kisker, C. (2005) ‘Close-fitting
60. Salvatore, P., Bucci, C., Pagliarulo, C., Tredici, M.,
sleeves’: DNA damage recognition by the UvrABC
Colicchio, R., et al. (2002) Phenotypes of a naturally
nuclease system, Mutat. Res. Mol. Mech. Mutagen.,
defective recB allele in Neisseria meningitidis clinical
577, 92-117, doi: 10.1016/j.mrfmmm.2005.03.013.
isolates, Infect. Immun., 70, 4185-4195, doi: 10.1128/
73. Bernacchia, L., Paris, A., Gupta, A., Moores, A. A.,
IAI.70.8.4185-4195.2002.
and Kad, N. M. (2022) Identification of the target
61. Fang, F. C. (2004) Antimicrobial reactive oxygen and
and mode of action for the prokaryotic nucleotide
nitrogen species: concepts and controversies, Nat. Rev.
excision repair inhibitor ATBC, Biosci. Rep., 42,
Microbiol., 2, 820-832, doi: 10.1038/nrmicro1004.
BSR20220403, doi: 10.1042/BSR20220403.
62. Van der Veen, S., and Tang, C. M. (2015) The BER
74. Монахова М. В., Милакина М. А., Трикин Р. М.,
necessities: the repair of DNA damage in human-
Орецкая Т. С., Кубарева Е. А. (2020) Особенности
adapted bacterial pathogens, Nat. Rev. Microbiol., 13,
функционирования белка MutL из системы репа-
83-94, doi: 10.1038/nrmicro3391.
рации «мисматчей» различных организмов, Биоорг.
63. Bignon, E., Gillet, N., Chan, C.-H., Jiang, T.,
Хим., 46, 563-579, doi: 10.31857/S0132342320060214.
Monari, A., et al. (2021) Recognition of a tandem le-
75. Monakhova, M., Ryazanova, A., Kunetsky, V., Li, P.,
sion by DNA bacterial formamidopyrimidine glyco-
Shilkin, E., et al. (2020) Probing the DNA-binding
sylases explored combining molecular dynamics and
center of the MutL protein from the Escherichia coli
machine learning, Comput. Struct. Biotechnol. J., 19,
mismatch repair system via crosslinking and Förster
2861-2869, doi: 10.1016/j.csbj.2021.04.055.
resonance energy transfer, Biochimie, 171-172, 43-54,
64. Tsai-Wu, J. J., Liu, H. F., and Lu, A. L.
(1992)
doi: 10.1016/j.biochi.2020.02.004.
Escherichia coli MutY protein has both N-glycosylase
76. Монахова М. В., Милакина М. А., Савицкая
and apurinic/apyrimidinic endonuclease activities on
В. Ю., Романова Е. А., Rao D. N., et al. (2021)
A.C and A.G mispairs, Proc. Natl. Acad. Sci. USA, 89,
Белок MutL из системы репарации мисматчей
8779-8783, doi: 10.1073/pnas.89.18.8779.
бактерии Neisseria gonorrhoeae: взаимодействие с
65. Nakamura, T., Meshitsuka, S., Kitagawa, S., Abe, N.,
ATP и ДНК, Мол. Биол., 55, 289-304, doi: 10.31857/
Yamada, J., et al. (2010) Structural and dynamic fea-
S0026898421020117.
tures of the MutT protein in the recognition of nucle-
77. Monakhova, M. V., Penkina, A. I., Pavlova, A. V.,
otides with the mutagenic 8-oxoguanine base, J. Biol.
Lyaschuk, A. M., Kucherenko, V. V., et al.
(2018)
Chem., 285, 444-452, doi: 10.1074/jbc.M109.066373.
Endonuclease activity of protein MutL from Rhodobacter
66. Ендуткин, А. В., Жарков, Д. О.
(2021) GO-
sphaeroides mismatch repair system, Biochemistry
система: путь репарации ДНК для борьбы с
(Moscow), 83, 281-293, doi: 10.1134/S0006297918030082.
окислительными повреждениями, Мол. Биол., 55,
78. Sancar, A., and Hearst, J.
(1993) Molecular
223-242, doi: 10.31857/S0026898421020063.
matchmakers, Science, 259, 1415-1420, doi: 10.1126/
67. Fromme, J. C., Banerjee, A., Huang, S. J., and
science.8451638.
Verdine, G. L. (2004) Structural basis for remov-
79. Putnam, C. D. (2021) Strand discrimination in DNA
al of adenine mispaired with 8-oxoguanine by MutY
mismatch repair, DNA Repair (Amst), 105, 103161,
adenine DNA glycosylase, Nature, 427, 652-656,
doi: 10.1016/j.dnarep.2021.103161.
doi: 10.1038/nature02306.
80. Guarné, A. (2012) The functions of MutL in mis-
68. Nagorska, K., Silhan, J., Li, Y., Pelicic, V., Freemont,
match repair, Progr. Mol. Biol. Transl. Sci., 110, 41-70,
P. S., et al. (2012) A network of enzymes involved
doi: 10.1016/B978-0-12-387665-2.00003-1.
in repair of oxidative DNA damage in Neisseria
81. De Saro, F. J. L., Marinus, M. G., Modrich, P., and
meningitidis, Mol. Microbiol.,
83,
1064-1079,
O’Donnell, M. (2006) The β sliding clamp binds to
doi: 10.1111/j.1365-2958.2012.07989.x.
multiple sites within MutL and MutS, J. Biol. Chem.,
69. Davidsen, T., Amundsen, E. K., Rødland, E. A.,
281, 14340-14349, doi: 10.1074/jbc.M601264200.
and Tønjum, T.
(2007) DNA repair profiles of
82. Lopez de Saro, F. J., and O’Donnell, M.
(2001)
disease-associated isolates of Neisseria meningitidis,
Interaction of the sliding clamp with MutS, ligase,
FEMS Immunol. Med. Microbiol.,
49,
243-251,
and DNA polymerase I, Proc. Natl. Acad. Sci. USA,
doi: 10.1111/j.1574-695X.2006.00195.x.
98, 8376-8380, doi: 10.1073/pnas.121009498.
БИОХИМИЯ том 87 вып. 9 2022
1200
САВИЦКАЯ и др.
83. Pluciennik, A., Burdett, V., Lukianova, O., O’Don-
pathways to the oxidative stress response and
nell, M., and Modrich, P. (2009) Involvement of the β
sensitivity of Acinetobacter baumannii to antibiotics,
clamp in methyl-directed mismatch repair in vitro, J. Biol.
Int. J. Antimicrob. Agents, 52, 629-636, doi: 10.1016/
Chem., 284, 32782-32791, doi: 10.1074/jbc.M109.054528.
j.ijantimicag.2018.07.022.
84. Fukui, K., Baba, S., Kumasaka, T., and Yano, T.
97. Michel, B., Boubakri, H., Baharoglu, Z.,
(2016) Structural features and functional dependency
Lemasson, M., and Lestini, R. (2007) Recombination
on β-clamp define distinct subfamilies of bacterial
proteins and rescue of arrested replication forks,
mismatch repair endonuclease MutL, J. Biol. Chem.,
DNA Repair (Amst),
6,
967-980, doi:
10.1016/
291, 16990-17000, doi: 10.1074/jbc.M116.739664.
j.dnarep.2007.02.016.
85. Nirwal, S., Kulkarni, D. S., Sharma, A., Rao, D. N.,
98. Dillingham, M. S., and Kowalczykowski, S. C. (2008)
and Nair, D. T. (2018) Mechanism of formation of a to-
RecBCD enzyme and the repair of double-stranded
roid around DNA by the mismatch sensor protein, Nu-
DNA breaks, Microbiol. Mol. Biol. Rev., 72, 642-671,
cleic Acids Res., 46, 256-266, doi: 10.1093/nar/gkx1149.
doi: 10.1128/MMBR.00020-08.
86. Modrich, P. (1989) Methyl-directed DNA mismatch
99. Beyene, G. T., Balasingham, S. V., Frye, S. A.,
correction, J. Biol. Chem.,
264,
6597-6600,
Namouchi, A., Homberset, H., et al.
(2016)
doi: 10.1016/S0021-9258(18)83467-6..
Characterization of the Neisseria meningitidis helicase
87. Liu, J., Hanne, J., Britton, B. M., Bennett, J.,
RecG, PLoS One, 11, e0164588, doi: 10.1371/journal.
Kim, D., et al. (2016) Cascading MutS and MutL
pone.0164588.
sliding clamps control DNA diffusion to activate
100. Morimatsu, K., and Kowalczykowski, S. C. (2003)
mismatch repair, Nature, 539, 583-587, doi: 10.1038/
RecFOR proteins load RecA protein onto gapped
nature20562.
DNA to accelerate DNA strand exchange, Mol. Cell,
88. Groothuizen, F. S., Winkler, I., Cristóvão, M., Fish,
11, 1337-1347, doi: 10.1016/S1097-2765(03)00188-6.
A., Winterwerp, H. H., et al. (2015) MutS/MutL crys-
101. Mehr, I. J., and Seifert, H. S. (1998) Differential
tal structure reveals that the MutS sliding clamp loads
roles of homologous recombination pathways in
MutL onto DNA, Elife, 4, doi: 10.7554/eLife.06744.
Neisseria gonorrhoeae pilin antigenic variation, DNA
89. Namadurai, S., Jain, D., Kulkarni, D. S., Tabib, C.
transformation and DNA repair,Mol. Microbiol., 30,
R., Friedhoff, P., et al. (2010) The C-terminal domain
697-710, doi: 10.1046/j.1365-2958.1998.01089.x.
of the MutL homolog from Neisseria gonorrhoeae
102. Jacobsen, T., Bardiaux, B., Francetic, O., Izadi-
forms an inverted homodimer, PLoS One, 5, e13726,
Pruneyre, N., and Nilges, M.
(2020) Structure
doi: 10.1371/journal.pone.0013726.
and function of minor pilins of type IV pili, Med.
90. Banasik, M., and Sachadyn, P. (2014) Conserved mo-
Microbiol. Immunol.,
209,
301-308, doi:
10.1007/
tifs of MutL proteins, Mutat. Res. Mol. Mech. Muta-
s00430-019-00642-5.
gen., 769, 69-79, doi: 10.1016/j.mrfmmm.2014.07.006.
103. Rotman, E., Webber, D. M., and Seifert, H. S. (2016)
91. Sánchez-Romero, M. A., Cota, I., and Casadesús, J.
Analyzing Neisseria gonorrhoeae pilin antigenic vari-
(2015) DNA methylation in bacteria: from the methyl
ation using 454 sequencing technology, J. Bacteriol.,
group to the methylome, Curr. Opin. Microbiol., 25,
198, 2470-2482, doi: 10.1128/JB.00330-16.
9-16, doi: 10.1016/j.mib.2015.03.004.
104. Obergfell, K. P., and Seifert, H. S. (2016) The pilin
92. Kwiatek, A., Łuczkiewicz, M., Bandyra, K., Stein,
N-terminal domain maintains Neisseria gonorrhoeae
D. C., and Piekarowicz, A. (2010) Neisseria gonor-
transformation competence during pilus phase
rhoeae FA1090 carries genes encoding two classes
variation, PLOS Genet., 12, e1006069, doi: 10.1371/
of Vsr endonucleases, J. Bacteriol., 192, 3951-3960,
journal.pgen.1006069.
doi: 10.1128/JB.00098-10.
105. Killoran, M. P., Kohler, P. L., Dillard, J. P., and Keck,
93. Bhagwat, A. S., and Lieb, M. (2002) Cooperation
J. L. (2009) RecQ DNA helicase HRDC domains are
and competition in mismatch repair: very short-
critical determinants in Neisseria gonorrhoeae pilin an-
patch repair and methyl-directed mismatch repair
tigenic variation and DNA repair, Mol. Microbiol., 71,
in Escherichia coli, Mol. Microbiol., 44, 1421-1428,
158-171, doi: 10.1111/j.1365-2958.2008.06513.x.
doi: 10.1046/j.1365-2958.2002.02989.x.
106. Sechman, E. V., Kline, K. A., and Seifert, H. S.
94. Robertson, A. B., and Matson, S. W.
(2012)
(2006) Loss of both Holliday junction processing
Reconstitution of the very short patch repair pathway
pathways is synthetically lethal in the presence of
from Escherichia col, J. Biol. Chem., 287, 32953-
gonococcal pilin antigenic variation, Mol. Microbiol.,
32966, doi: 10.1074/jbc.M112.384321.
61, 185-193, doi: 10.1111/j.1365-2958.2006.05213.x.
95. Cahoon, L. A., and Seifert, H. S. (2011) Focusing
107. Helm, R. A., and Seifert, H. S. (2009) Pilin antigenic
homologous recombination: pilin antigenic variation
variation occurs independently of the RecBCD
in the pathogenic Neisseria, Mol. Microbiol., 81, 1136-
pathway in Neisseria gonorrhoeae, J. Bacteriol., 191,
1143, doi: 10.1111/j.1365-2958.2011.07773.x.
5613-5621, doi: 10.1128/JB.00535-09.
96. Ajiboye, T. O., Skiebe, E., and Wilharm, G. (2018)
108. Ozer, E. A., Prister, L. L., Yin, S., Ward, B. H.,
Contributions of RecA and RecBCD DNA repair
Ivanov, S., et al. (2019) PacBio amplicon sequencing
БИОХИМИЯ том 87 вып. 9 2022
СИСТЕМЫ РЕПАРАЦИИ ДНК Neisseria gonorrhoeae
1201
method to measure pilin antigenic variation
120. Fussenegger, M., Rudel, T., Barten, R., Ryll, R., and
frequencies of Neisseria gonorrhoeae, mSphere,
4,
Meyer, T. F. (1997) Transformation competence and
e00562-19, doi: 10.1128/mSphere.00562-19.
type-4 pilus biogenesis in Neisseria gonorrhoeae - a
109. Kline, K. A., Criss, A. K., Wallace, A., and Seifert,
review, Gene,
192,
125-134, doi:
10.1016/S0378-
H. S. (2007) Transposon mutagenesis identifies sites
1119(97)00038-3.
upstream of the Neisseria gonorrhoeae pilE gene that
121. Ordabayev, Y. A., Nguyen, B., Niedziela-Majka,
modulate pilin antigenic variation, J. Bacteriol., 189,
A., and Lohman, T. M. (2018) Regulation of UvrD
3462-3470, doi: 10.1128/JB.01911-06.
helicase activity by MutL, J. Mol. Biol., 430, 4260-
110. Cahoon, L. A., and Seifert, H. S. (2009) An alter-
4274, doi: 10.1016/j.jmb.2018.08.022.
native DNA structure is necessary for pilin antigenic
122. Vigué, L., and Eyre-Walker, A.
(2019) The
variation in Neisseria gonorrhoeae, Science, 325, 764-
comparative population genetics of Neisseria
767, doi: 10.1126/science.1175653.
meningitidis and Neisseria gonorrhoeae, PeerJ,
7,
111. Prister, L. L., Yin, S., Cahoon, L. A., and Seifert,
e7216, doi: 10.7717/peerj.7216.
H. S. (2020) Altering the Neisseria gonorrhoeae pilE
123. Boyce, K. J. (2022) Mutators enhance adaptive micro-
guanine quadruplex loop bases affects pilin antigenic
evolution in pathogenic microbes, Microorganisms,
variation, Biochemistry, 59, 1104-1112, doi: 10.1021/
10, 442, doi: 10.3390/microorganisms10020442.
acs.biochem.9b01038.
124. Richardson, A. R., and Stojiljkovic, I.
(2001)
112. Maizels, N., and Davis, L.
(2018) Initiation of
Mismatch repair and the regulation of phase variation
homologous recombination at DNA nicks, Nucleic
in Neisseria meningitidis, Mol. Microbiol., 40, 645-655,
Acids Res., 46, 6962-6973, doi: 10.1093/nar/gky588.
doi: 10.1046/j.1365-2958.2001.02408.x.
113. Cahoon, L. A., and Seifert, H. S. (2013) Transcrip-
125. Tauseef, I., Ali, Y. M., and Bayliss, C. D. (2013)
tion of a cis-acting, noncoding, small RNA is required
Phase variation of PorA, a major outer membrane
for pilin antigenic variation in Neisseria gonorrhoe-
protein, mediates escape of bactericidal antibodies by
ae, PLoS Pathog., 9, e1003074, doi: 10.1371/journal.
Neisseria meningitidis, Infect. Immun., 81, 1374-1380,
ppat.1003074.
doi: 10.1128/IAI.01358-12.
114. Prister, L. L., Ozer, E. A., Cahoon, L. A., and Seifert,
126. Rotman, E., and Seifert, H. S. (2015) Neisseria
H. S. (2019) Transcriptional initiation of a small
gonorrhoeae MutS affects pilin antigenic variation
RNA, not R-loop stability, dictates the frequency of
through mismatch correction and not by pilE guanine
pilin antigenic variation in Neisseria gonorrhoeae, Mol.
quartet binding, J. Bacteriol.,
197,
1828-1838,
Microbiol., 112, 1219-1234, doi: 10.1111/mmi.14356.
doi: 10.1128/JB.02594-14.
115. Pavlova, A. V., Kubareva, E. A., Monakhova, M. V.,
127. Pavlova, A. V., Monakhova, M. V., Ogloblina,
Zvereva, M. I., and Dolinnaya, N. G. (2021) Impact
A. M., Andreeva, N. A., Laptev, G. Y., et al. (2020)
of G-Quadruplexes on the regulation of genome
Responses of DNA mismatch repair Proteins to a
integrity, DNA damage and repair, Biomolecules, 11,
stable G-quadruplex embedded into a DNA duplex
1284, doi: 10.3390/biom11091284.
structure, Int. J. Mol. Sci., 21, 8773, doi: 10.3390/
116. Linke, R., Limmer, M., Juranek, S., Heine, A., and
ijms21228773.
Paeschke, K. (2021) The relevance of G-quadruplexes
128. Larson, E. D., Duquette, M. L., Cummings, W. J.,
for DNA repair, Int. J. Mol. Sci., 22, 12599, doi:
Streiff, R. J., and Maizels, N. (2005) MutSα binds to
10.3390/ijms222212599.
and promotes synapsis of transcriptionally activated
117. Voter, A. F., Callaghan, M. M., Tippana, R.,
immunoglobulin switch regions, Curr. Biol., 15, 470-
Myong, S., Dillard, J. P., et al. (2020) Antigenic
474, doi: 10.1016/j.cub.2004.12.077.
variation
in
Neisseria
gonorrhoeae
occurs
129. Ehrat, E. A., Johnson, B. R., Williams, J. D.,
independently of RecQ-mediated unwinding of the
Borchert, G. M., and Larson, E. D.
(2012)
pilE G quadruplex, J. Bacteriol., 202, e00607-19,
G-quadruplex recognition activities of E. coli MutS,
doi: 10.1128/JB.00607-19.
BMC Mol. Biol., 13, 23, doi: 10.1186/1471-2199-13-23.
118. Davidsen, T., Tuven, H. K., Bjørås, M., Rødland,
130. Shukla, K., Thakur, R. S., Ganguli, D., Rao, D. N.,
E. A., and Tønjum, T. (2007) Genetic interactions
and Nagaraju, G. (2017) Escherichia coli and Neisseria
of DNA repair pathways in the pathogen Neisseria
gonorrhoeae UvrD helicase unwinds G4 DNA
meningitidis,
J.
Bacteriol.,
189,
5728-5737,
structures, Biochem. J., 474, 3579-3597, doi: 10.1042/
doi: 10.1128/JB.00161-07.
BCJ20170587.
119. Criss, A. K., Bonney, K. M., Chang, R. A., Duffin,
131. Worth, L., Clark, S., Radman, M., and Modrich, P.
P. M., LeCuyer, B. E., et al. (2010) Mismatch
(1994) Mismatch repair proteins MutS and MutL
correction modulates mutation frequency and pilus
inhibit RecA-catalyzed strand transfer between
phase and antigenic variation in Neisseria gonorrhoeae,
diverged DNAs, Proc. Natl. Acad. Sci. USA, 91, 3238-
J. Bacteriol., 192, 316-325, doi: 10.1128/JB.01228-09.
3241, doi: 10.1073/pnas.91.8.3238.
БИОХИМИЯ том 87 вып. 9 2022
1202
САВИЦКАЯ и др.
Neisseria gonorrhoeae: DNA REPAIR SYSTEMS AND THEIR ROLE IN
PATHOGENESIS
Review
V. Yu. Savitskaya1, M. V. Monakhova2, Iu. V. Iakushkina1,
I. I. Borovikova3, and E. A. Kubareva2*
1 Department of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia
2 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; email: kubareva@belozersky.msu.ru
3 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University,
119991 Moscow, Russia
Neisseria gonorrhoeae (gram-negative diplococcus) is a human pathogen and the causative agent of gonorrhea, a
sexually transmitted infection. The bacterium uses various approaches for adapting to environmental conditions
and multiply efficiently in the human body, such as regulation of gene expression of surface proteins and
lipooligosaccharides (e.g. expression of various forms of pilin). DNA damage repair systems play an important
role in the ability of bacteria to survive in the host organism. This review describes the DNA repair systems of
N. gonorrhoeae and their role in bacterial pathogenesis. A special attention is paid to the mismatch repair system
(MMR) and functioning of the MutS and MutL proteins, as well as to the role of these proteins in the regulation
of the pilin antigenic variation of the N. gonorrhoeae pathogen.
Keywords: mismatch repair system, DNA damage repair, excision repair, MutS, MutL, antigenic variation,
homologous recombination, G-quadruplex, Neisseria gonorrhoeae
БИОХИМИЯ том 87 вып. 9 2022