БИОХИМИЯ, 2022, том 87, вып. 9, с. 1260 - 1276
УДК 612.74;577.29;616.43
СИГНАЛИЗАЦИЯ И ГЕННАЯ ЭКСПРЕССИЯ
В СКЕЛЕТНОЙ МЫШЦЕ ПРИ ДИАБЕТЕ 2 ТИПА:
ТЕКУЩИЕ РЕЗУЛЬТАТЫ И ПЕРСПЕКТИВЫ
ШИРОКОЗАХВАТНЫХ ПОДХОДОВ
Обзор
© 2022 А.В. Воротников1,2*, Д.В. Попов1,3*, П.А. Махновский1
1 ФГБУН ГНЦ РФ Институт медико-биологических проблем РАН,
123007 Москва, Россия; электронная почта: a.vorotnikov@icloud.com, danil-popov@yandex.ru
2 ФГБУ Национальный медицинский исследовательский центр кардиологии
имени академика Е.И. Чазова Минздрава России, 121552 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова,
факультет фундаментальной медицины, 119991 Москва, Россия
Поступила в редакцию 10.05.2022
После доработки 09.08.2022
Принята к публикации 10.08.2022
Скелетные мышцы вносят основной вклад в появление инсулинорезистентности и нарушение утили-
зации глюкозы из кровотока, развитие гипергликемии и диабета 2-го типа. Молекулярные механиз-
мы регуляции захвата глюкозы мышечными клетками многообразны, включая инсулинозависимые
как основные, но не единственные. Они задействуют большой спектр белков, которые контролируют
внутриклеточный трафик и выход транспортеров глюкозы на поверхность клетки, формируя развет-
вленную регуляторную сеть. В обзоре подчеркивается преимущество широкозахватных подходов для
поиска активируемых инсулином регуляторных белков и генов в скелетной мышце людей с разной
степенью метаболических нарушений. Обсуждаются методические подходы для оценки метаболиче-
ских нарушений и молекулярных ответов скелетной мышцы человека на инсулин. Анализируются
известные молекулярные механизмы регуляции захвата глюкозы и первые результаты фосфопроте-
омных и транскриптомных исследований, раскрывших масштабную сеть мишеней инсулина в мы-
шечных клетках. Эти результаты показывают, что формирование ясной картины тех изменений,
которые происходят при развитии метаболических нарушений, требует системного и сочетанного
анализа на разных уровнях регуляции, включая сигнальные системы, транскрипционные факторы
и генную экспрессию. Такой анализ представляется перспективным для поиска неописанных ранее
механизмов регуляции захвата глюкозы скелетной мышцей и выявления ключевых регуляторов, яв-
ляющихся потенциальными мишенями новых терапевтических препаратов.
КЛЮЧЕВЫЕ СЛОВА: скелетная мышца, инсулинорезистентность, инсулиновая сигнализация, АМРК,
захват глюкозы, фосфопротеом, транскриптом, сахарный диабет 2 типа.
DOI: 10.31857/S032097252209007X, EDN: BAWWXU
ВВЕДЕНИЕ
нием. По прогнозам ВОЗ, к 2030 г. более 40% на-
селения этих стран будет иметь избыточный
В большинстве развитых стран Европы
вес. Ожирение служит основным фактором ри-
от 15 до 25% взрослого населения страдает ожире- ска развития инсулинорезистентности (ИнсРез),
Принятые сокращения: ИнсРез - инсулинорезистентность; СД2Т - сахарный диабет 2-го типа; ТФ - транскрипци-
онные факторы; Akt (AKT - для белка человека) - киназа, кодируемая ретровирусным онкогеном из клеток линии AKT-8,
выведенной из Стока A линии k тимомы мышей AKR; AMPK - AMP-зависимая протеинкиназа; СаМК2 (CAMK2 - для
белка человека) - кальций/кальмодулин-зависимая киназа II-типа; CK1/2 - казеинкиназы I/II-типа; Glut4 (GLUT4 -
для белка человека) - транспортер глюкозы 4-типа; GSV - везикулы хранения GLUT4; IFG - повышенный уро-
вень глюкозы натощак; IGF-1 - инсулиноподобный фактор роста-1; IGT - нарушенная глюкозотолерантность;
IRS - субстрат рецептора инсулина; mTOR (MTOR - для белка человека) - механистическая мишень рапамицина;
TBC1D1 и TBC1D4 (AS160) - белки, содержащие TBC-домен.
* Адресат для корреспонденции.
1260
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1261
ведущей к развитию гипергликемии и сахар-
позволяют одновременно регистрировать ты-
ного диабета 2-го типа (СД2Т), нарушению
сячи молекулярных событий, связанных с из-
функций кровеносных сосудов, почек и зрения,
менением содержания белков и метаболитов,
сердечно-сосудистым и онкологическим ослож-
их модификаций, генной экспрессии, эпигено-
нениям [1, 2]. Это подчеркивает системный и
ма и метаболома. Комплексная биоинформати-
взаимосвязанный характер метаболических на-
ческая обработка таких «больших» данных по-
рушений, накладывая определенные ограниче-
зволяет предположить причинно-следственные
ния на их изучение непосредственно у человека.
связи и обозначить ключевые молекулярные
ИнсРез проявляется как снижение способно-
механизмы и регуляторы, изменение функций
сти тканей захватывать глюкозу из кровотока
которых может быть связано с развитием мета-
в ответ на инсулин. С точки зрения регуляции
болических нарушений.
уровня глюкозы в плазме крови, основными
Данный обзор сфокусирован на результаты
мишенями инсулина выступают печень, жир и
пока немногочисленных работ, в которых была
скелетные мышцы. В норме скелетные мышцы
предпринята попытка связать системные нару-
составляют 30-40% от массы тела. Даже в покое
шения метаболизма с молекулярными измене-
на них приходится до 80% инсулинозависимо-
ниями в скелетных мышцах у человека и живот-
го захвата глюкозы [3]. Это свидетельствует об
ных. Для этого сначала обсуждаются подходы
исключительной роли скелетных мышц в разви-
для оценки системной ИнсРез и сравнитель-
тии метаболических нарушений и подчеркивает
ного анализа изменений, ассоциированных с
важность изучения молекулярных механизмов
развитием ИнсРез и СД2Т. Чтобы высветить их
развития ИнсРез именно в этой ткани.
масштабный характер даже на конечном, мо-
Изучение различий метаболических па-
лекулярном уровне, далее кратко рассмотрены
раметров в биоптатах скелетных мышц людей
внутриклеточные механизмы регуляции захва-
с разной выраженностью метаболических на-
та глюкозы клетками. Наконец, обсуждаются
рушений позволяет обнаружить наиболее яр-
имеющиеся результаты и перспективы широ-
кие изменения экспрессии и/или активности
козахватных методик для получения комплекс-
ферментов и сигнальных белков. Животные
ной картины тех изменений, которые могут
модели, включая нокаутных и трансгенных
позволить выявить значимые терапевтические
животных, позволяют расширить эксперимен-
мишени.
тальные возможности и сопоставить динамику
молекулярных и патофизиологических измене-
ний [4, 5]. Однако накапливается все больше
СПОСОБЫ ОЦЕНКИ СИСТЕМНЫХ
данных о различиях метаболизма грызунов и
ИЗМЕНЕНИЙ МЕТАБОЛИЗМА
человека. Кроме того, животные крайне устой-
чивы к развитию СД2Т. В частности, у грызунов
До сих пор нет четкой картины молекуляр-
срок жизни слишком короткий для достижения
ных изменений, в том числе в скелетной мыш-
конечных стадий СД2Т. Поэтому результаты,
це, при развитии СД2Т. Это связано с тем, что
полученные на животных моделях, следует с
они многочисленны и взаимосвязаны, но не
осторожностью переносить на человека [6]. На-
происходят дискретно, а развиваются долго и
конец, клеточные модели крайне полезны для
неоднородно, в соответствии с индивидуаль-
изучения динамики внутриклеточных реакций,
ными особенностями человека. Изучение их
в том числе сигнальных на инсулин и другие
динамики предполагает анализ биопсийного
стимулы [7, 8]. Они удобны для моделирования
материала добровольцев, стратифицирован-
отдельных стадий патогенеза СД2Т (например,
ных по степени развитости метаболических
гиперлипидемии, гиперинсулинемии или ги-
нарушений. Для этого, по данным обширных
пергликемии) [9-11] и для выяснения эпигене-
клинических наблюдений, были определены
тических изменений, происходящих при ожи-
и общеприняты референсные показатели [18-
рении и СД2Т [12-15].
20]. Ими служат уровень инсулина или глюко-
В последнее время стало ясно, что инсулин
зы в плазме крови натощак (т.е. до начала глю-
активирует в клетках большой набор сигналь-
козотолерантного теста), уровень глюкозы в
ных молекул, объединенных в единую сеть [7,
крови через 2 ч после начала глюкозотолерант-
8]. Стал очевиден масштабный характер мо-
ного теста и уровень гликированного гемогло-
лекулярных изменений, сопровождающих по-
бина (A1C) в крови натощак. Стратификация
явление и прогресию ИнсРез и СД2Т [16, 17].
пациентов происходит на основе этих показа-
Для изучения многокомпонентных сигнальных
телей или их сочетаний (см. ниже).
клеточных систем все большую значимость
Ожирение, связанное с накоплением пре-
приобретают широкозахватные методы. Они
имущественно висцерального жира, является
БИОХИМИЯ том 87 вып. 9 2022
1262
ВОРОТНИКОВ и др.
основным фактором риска развития метабо-
зачастую повышен (>9 мкМЕ/мл), но пиковая
лических нарушений, ИнсРез и СД2Т [18]. Это
концентрация инсулина в крови не изменяется
состояние связано с хроническим чрезмерным
в процессе глюкозотолерантного теста и пада-
потреблением пищи (так называемая «запад-
ет на поздних стадиях заболевания (рис. 1, в).
ная диета») и снижением энергозатрат из-за
Это связано с прогрессирующей дисфункцией
малоактивного образа жизни. На ранней фазе
панкреатических β-клеток и нарушением се-
клинические проявления метаболических на-
креции инсулина. В результате инсулинозави-
рушений, как правило, отсутствуют [21, 22].
симые ткани снижают захват глюкозы из крови
Прогрессирующее ожирение ведет к наруше-
после приема пищи, и развивается устойчивая
нию жирового обмена, развитию воспаления в
гипергликемия. На этом этапе патология СД2Т
жировой ткани и дисфункции адипоцитов [23,
становится практически необратимой, соеди-
24]. В том числе снижается секреция адипонек-
няя в себе основные черты диабета типов 1 и 2,
тина, который увеличивает чувствительность
и лечение становится симптоматическим.
клеток к инсулину, а секреция провоспали-
Отсутствие клинически релевантных мар-
тельных цитокинов и липолиз в жировой ткани
керов молекулярных изменений в скелетной
усиливаются. В результате уровень свободных
мышце при ИнсРез и маркеров степени дис-
жирных кислот и липопротеидных триглице-
функции β-клеток затрудняет определение ста-
ридов в плазме крови повышается, приводя
дий заболевания и стратификацию пациентов
к накоплению эктопического жира в других
для получения биопсийного материала и ин-
тканях, в том числе в скелетных мышцах [21,
терпретации результатов его сравнительного
25, 26]. Считается, что эти факторы являются
анализа. Для решения этой проблемы исполь-
основными триггерами ИнсРез в скелетных
зуются референсные значения глюкозы и инсу-
мышцах [16, 27].
лина крови, полученные в глюкозотолерантном
ИнсРез может развиваться в скрытой форме
тесте (рис. 1, а). Они позволяют унифицировать
годами без видимых клинических проявлений.
группы сравнения испытуемых [18] и получать
Это связано с тем, что повышенная секреция
результаты на больших выборках [19, 20].
инсулина компенсирует ослабление клеточных
Глюкозотолерантный тест достаточно
реакций, поддерживая углеводный и жировой
прост, и поэтому рутинно используется для
обмен на нужном уровне [22]. Первые призна-
определения показателей углеводного обмена
ки некомпенсируемой ИнсРез проявляются
(в т.ч. IFG и IGT). Он отражает исходное состоя-
как небольшое повышение уровня глюкозы в
ние (натощак) и системную реакцию организ-
крови натощак от 5,6 до 7,8 мМ (IFG, impaired
ма (изменение уровня глюкозы в плазме крови)
fasting glucose) и/или как системное наруше-
на прирост эндогенного инсулина. Поскольку
ние толерантности к глюкозе (IGT, impaired
последний сам по себе зависит от степени вы-
glucose tolerance) [18-20] (рис. 1, а и б). Инди-
раженности патологии, количественная оценка
видуальное или сочетанное проявление этих
чувствительности к инсулину с помощью глю-
параметров отражает гетерогенность патоге-
козотолерантного теста невозможна. Важно
неза СД2Т и тоже может использоваться при
отметить, что в этом тесте для всех людей ис-
стратификации пациентов [19]. IGT определя-
пользуется стандартная доза глюкозы (75 г), что
ют с помощью глюкозотолерантного теста как
затрудняет сопоставление и интерпретацию
повышенное содержание глюкозы (7,8-11 мМ)
результатов для людей, значительно различаю-
в крови через 2 ч после принятия раствора 75 г
щихся по массе тела.
глюкозы натощак [18]. В состоянии предиабета
Для количественной оценки системной
уровень инсулина в крови натощак повышен
ИнсРез в качестве «золотого стандарта» ис-
лишь иногда, но он всегда выше в ответ на на-
пользуется гиперинсулинемический эуглике-
грузку глюкозой (рис. 1, а и в). Таким образом,
мический клэмп-тест [29]. В кровь одновре-
IFG отражает наличие дефектов как инсули-
менно вводят инсулин и глюкозу, подбирая
нозависимых, так и независимых механизмов
скорость подачи инсулина так, чтобы его уро-
поглощения глюкозы тканями натощак [28],
вень (100 мкМЕ/мл) был сопоставим с макси-
тогда как IGT отражает нарушения захвата
мальным физиологическим уровнем при прие-
глюкозы тканями в ответ на стимуляцию эндо-
ме пищи. При этом скорость введения глюкозы
генным инсулином.
подбирается так, чтобы поддерживать ее уро-
СД2Т характеризуется устойчивым повы-
вень в крови постоянным. Через 2-3 ч удается
шением уровня глюкозы натощак (>7 мМ) и
достичь равновесия между скоростью введения
через 2 ч после начала глюкозотолерантного те-
и утилизации глюкозы тканями. Этот баланс
ста (>11 мМ) (рис. 1, а и б) [18]. На ранних ста-
поддерживается в течение 1-2 ч, и по коли-
диях СД2Т уровень инсулина в крови натощак
честву введенной (и утилизированной) за это
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1263
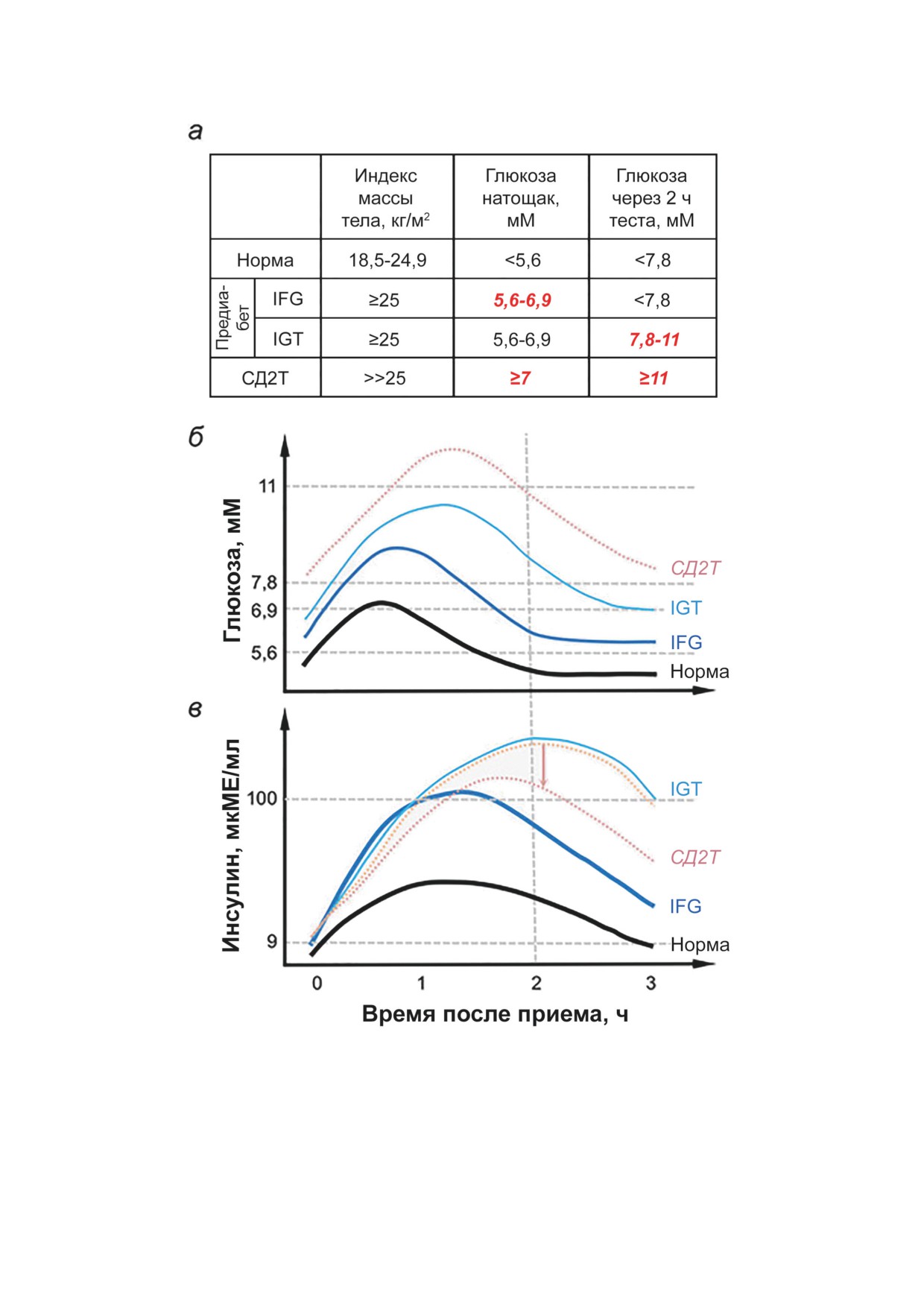
Рис. 1. Референсные значения (а) и изменения уровня глюкозы (б) и инсулина (в) в крови при глюкозотолерантном
тесте, стандартно используемые для оценки степени выраженности нарушений углеводного обмена. Зависимости (б)
и (в) обобщены по результатам измерений у более чем 5000 добровольцев [20]. В таблице и на оси ординат графиков
отмечены референсные значения показателей для определения повышенного уровня глюкозы в крови натощак (IFG),
системного нарушения толерантности к глюкозе (IGT) и сахарного диабета 2-го типа (СД2Т). Стрелка отражает сдвиг
показателя при длительном течении СД2Т. Уровень инсулина традиционно выражен в международных единицах (мил-
лиэквивалентах, МЕ), количественно отражающих терапевтическое действие инсулина без учета его молекулярной мас-
сы (в). Одна единица инсулина эквивалентна 0,0347 мг инсулина, а 100 мкМЕ/мл соответствует концентрации 0,6 пкМ
инсулина. С цветными вариантами рис. 1-3 можно ознакомиться в электронной версии статьи на сайте журнала
БИОХИМИЯ том 87 вып. 9 2022
1264
ВОРОТНИКОВ и др.
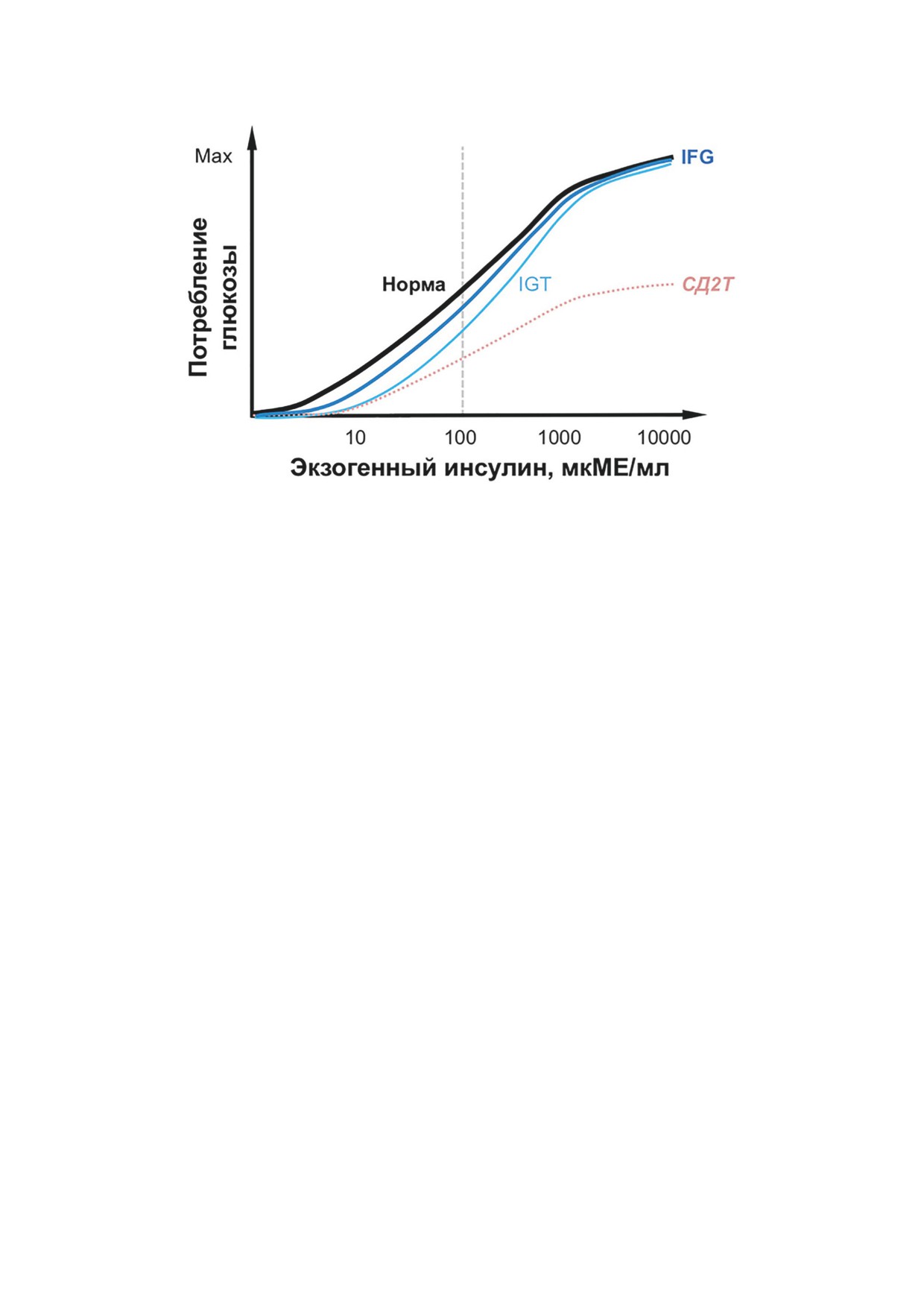
Рис. 2. Изменения зависимости скорости утилизации глюкозы от концентрации экзогенного инсулина на разных
стадиях развития ИнсРез и СД2Т. Схематически представлены обобщенные результаты нескольких эугликемических
клэмп-тестов с использованием разных равновесных концентраций инсулина [30]. Вертикальная линия соответствует
используемой в стандартном клэмп-тесте равновесной концентрации инсулина 100 мкМЕ/мл. Сокращения как на рис. 1
время глюкозы рассчитывается М-индекс си-
после клэмп-теста следует интерпретировать с
стемной чувствительности к инсулину. Исполь-
осторожностью. Кроме того, клеточные иссле-
зование нескольких таких тестов с различной
дования показали, что инсулин вызывает бы-
целевой концентрацией инсулина позволило
стрые (несколько минут) и динамично меняю-
оценить зависимость «концентрация инсули-
щиеся сигнальные реакции [7, 12, 13, 31, 32],
на - потребление глюкозы» [30] (рис. 2). При
тогда как достижение стационарных условий
развитии ИнсРез эта зависимость сдвигается
в клэмп-тесте требует значительного времени.
вправо, отражая снижение чувствительности
Это значит, что клэмп-тест не идеален для из-
тканей к инсулину (наличие IFG и/или IGT).
учения полного спектра молекулярных ответов
На поздних стадиях СД2Т снижается не толь-
скелетной мышцы на инсулин.
ко чувствительность, но и отклик (максималь-
Альтернативой для изучения молекуляр-
ная реакция на инсулин), отражая дисфункцию
ных ответов на инсулин in vivo является их
β-клеток. Зависимость, показанная на рис. 2,
измерение в условиях, максимально прибли-
сдвигается вправо и вниз.
женных к естественным, например, после при-
Снижение системной чувствительности
ема пищи, нормированной на массу тела или
к инсулину, определяемое с помощью стан-
основной обмен [22]. Подобный подход был
дартного гиперинсулинемического эуглике-
использован для исследования суточных изме-
мического клэмп-теста, отражает снижение
нений фосфопротеома скелетных мышц у гры-
утилизации глюкозы тканями при наиболее
зунов [33]. Представляется, что он перспекти-
показательной концентрации инсулина в кро-
вен и для людей при использовании приема
ви - 100 мкМЕ/мл (вертикальный пунктир
глюкозы или смешанной пищи, нормирован-
на рис. 2). Вместе с тем этот тест не позволяет
ной на массу тела или основной обмен. У лю-
оценить ни максимальный отклик на инсулин,
дей с ожирением секреция инсулина после
ни реакцию на его разовое введение. Во время
приема пищи значительно выше, что объясня-
клэмп-теста высокий уровень инсулина под-
ется не только наличием ИнсРез, но и большей
держивается долгое время, после чего обычно
массой съедаемой пищи. Поэтому такая нор-
берется проба ткани. У здоровых людей и даже
мировка позволяет сильнее отразить различия
у людей с ИнсРез такого продолжительного
в молекулярных ответах мышцы на инсулин у
и выраженного (~100 мкМЕ/мл) увеличения
людей с ИнсРез и нормальным метаболизмом.
инсулина в крови после приема пищи не на-
Этот подход до сих пор не был использован для
блюдается [22]. Поэтому изменения внутри-
исследования молекулярных ответов в скелет-
клеточной сигнализации и генной экспрессии
ной мышце человека.
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1265
МНОЖЕСТВЕННОСТЬ МЕХАНИЗМОВ
цитоскелета, подстилающего мембрану клетки,
РЕГУЛЯЦИИ ЗАХВАТА ГЛЮКОЗЫ
позиционируются по отношению к ней и сли-
ваются, экспонируя на поверхность функцио-
Молекулярные механизмы возникновения
нальный Glut4 (рис. 3). Пока нет однозначного
ИнсРез связывают с нарушением внутрикле-
понимания, с какими из этих молекул связаны
точной регуляции захвата глюкозы мышечны-
нарушения, возникающие при ИнсРез и СД2Т.
ми и жировыми клетками [34]. Дефекты мо-
Это могут быть и элементы сигнальных каска-
гут касаться непосредственных регуляторов
дов, и их конечные мишени, непосредственно
транспорта глюкозы [27, 35] и быть чувстви-
регулирующие перемещение и экспозицию
тельны к контролирующим их активность сиг-
транспортеров глюкозы на поверхность клетки,
нальным молекулам разных каскадов, включая
и их комбинации.
инсулиновый [16, 17] и другие каскады [36].
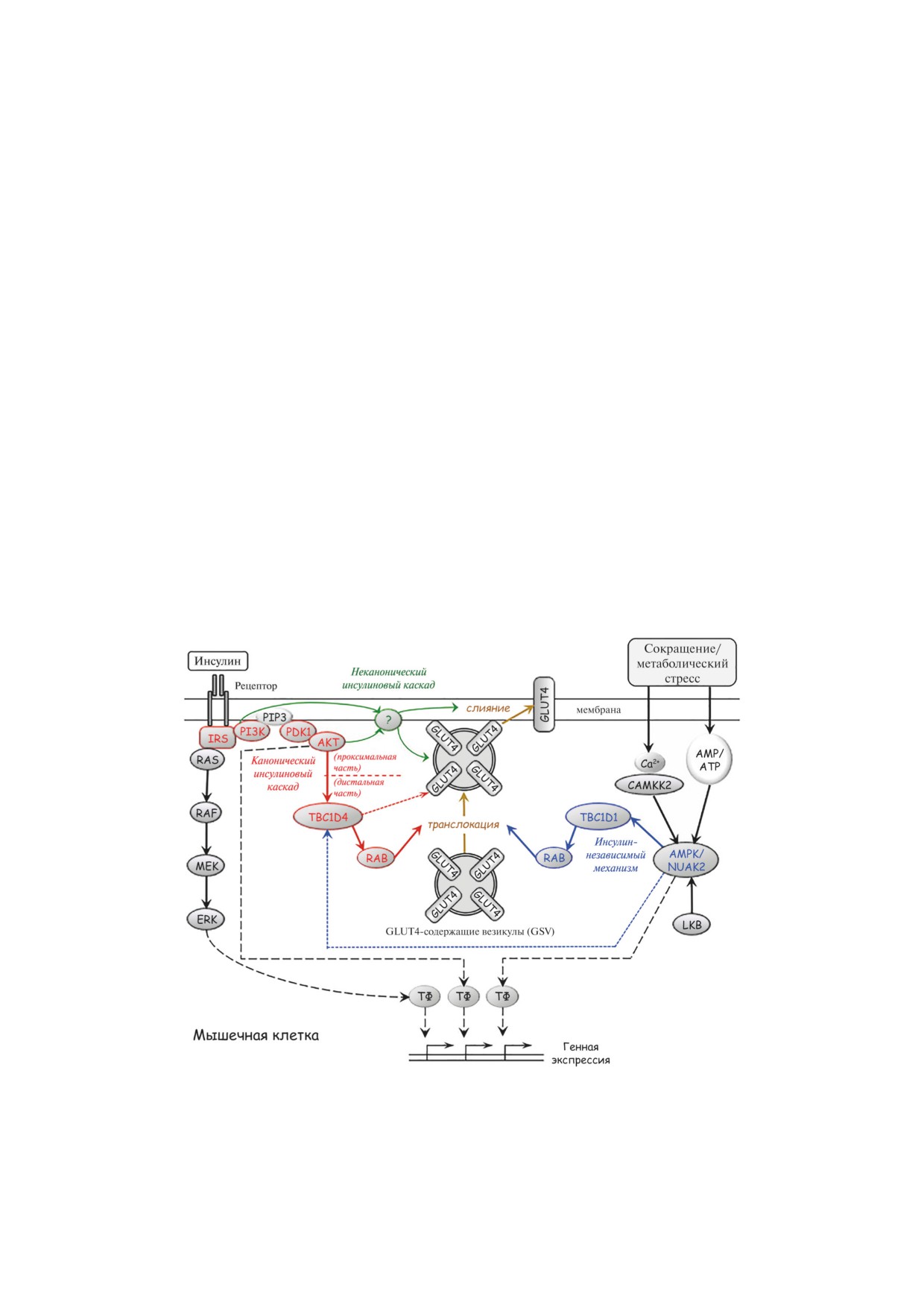
Канонический инсулиновый каскад (ре-
Эти нарушения также плотно связаны с дис-
цептор → белок IRS → PI3-киназа → Akt → белок
балансом метаболических потоков при ожи-
TBC1D4 (AS160) → GTPаза Rab → Glut4) рассмат-
рении [23, 25, 27]. Активация захвата глюкозы
ривается как основной механизм сигнальной
происходит в несколько стадий, каждая из ко-
активации захвата глюкозы инсулином у жи-
торых требует своих регуляторов, действующих
вотных и человека (рис. 3). Он регулирует пре-
комбинаторно на разных этапах [37-39]. В со-
имущественно транслокацию GSV к периферии
стоянии покоя основной инсулинозависимый
клетки с участием GAP-белков TBC1D4 (он
транспортер глюкозы Glut4 находится в клет-
же AS160) и GTPаз Rab8а и Rab13 (в мышечных
ке в специальных везикулах хранения (Glut4
клетках) или Rab10 (в адипоцитах) [38, 39]. Од-
storage vesicles, GSV) [40]. Это стационарные
нако есть уже много данных о том, что у людей
везикулы, удерживаемые в цитозоле и освобож-
с системной ИнсРез активность этого каскада,
дающиеся после связывания набора регулято-
измеренная на уровне киназы Akt, снижена
ров [37]. После этого они перемещаются на пе-
не всегда или существенно меньше, чем ин-
риферию, проходят сквозь сеть кортикального
сулинозависимый захват глюкозы [27, 41, 42].
Рис. 3. Сигнальные механизмы регуляции захвата глюкозы с участием транспортера GLUT4 в мышечной клетке. В до-
полнение к каноническому инсулиновому каскаду (выделен красным), преимущественно регулирующему переход
GLUT4-содержащих везикул из цитозоля к клеточной мембране, условный неканонический инсулиновый каскад (по-
казан зеленым) регулирует подход, позиционирование и слияние этих везикул с мембраной, обеспечивая экспозицию
GLUT4 на поверхности клетки. Инсулиннезависимый механизм с участием АМРК/NUAK2 (выделен синим) отвечает за
экспозицию GLUT4 и захват глюкозы в ответ на сокращение и возрастание уровня AMP в клетке. Пунктирные линии
показывают сопряжение этих каскадов с активацией транскрипционных факторов (ТФ) и генной экспрессии
БИОХИМИЯ том 87 вып. 9 2022
1266
ВОРОТНИКОВ и др.
Этот феномен может быть связан с несколь-
инсулину связано не только с одной из них, а со
кими причинами. Во-первых, основные нару-
скоординированными изменениями группы та-
шения внутри канонического инсулинового
ких мишеней.
каскада могут происходить в его дистальной
Альтернативные механизмы могут регули-
части, ниже Akt [27]. Во-вторых, они могут
ровать гомеостаз глюкозы натощак (когда уро-
быть связаны с самими регуляторами актива-
вень инсулина очень низок) и особенно в ответ
ции GSV в примембранном компартменте [38]
на сократительную (физическую) активность.
или экзоцитоза везикул [39], находящихся под
Они включают AMP-зависимую протеинкина-
контролем ветвей канонического каскада или
зу (AMPK) [44] и родственные киназы (рис. 3).
других путей передачи сигнала от рецептора
Последние образуют группу из
12 фермен-
инсулина, совокупно представленных как ус-
тов [45], функции которых пока мало понятны.
ловный неканонический инсулиновый каскад
Однако по крайней мере два из них, АМРК-по-
на рис. 3. Наконец, дополнительная актива-
добные киназы NUAK1 [46] и NUAK2 [47], уча-
ция Akt может достигаться за счет других рецеп-
ствуют в регуляции уровня глюкозы в крови.
торов, связанных с PI3-киназным каскадом,
Как и АМРК, NUAK2 формирует независимый
но не передающих сигнал к GSV. В этом плане
от инсулина механизм регуляции захвата глю-
может заслуживать внимания преимуществен-
козы с участием АМР и киназы LKB1. В отли-
ная роль изоформы Akt2 в регуляции захвата
чие от инсулинового, этот механизм преиму-
глюкозы [43]. Вопрос о том, могут ли разные
щественно опосредован малой GTPазой Rab14
рецепторы, например инсулина и инсулинопо-
и ее регулятором TBC1D1 [38]. Значимость
добного фактора роста (IGF-1), по-разному ак-
альтернативных механизмов подтверждается
тивировать Akt1 и Akt2 остается открытым.
тем, что избирательный для скелетной мышцы
Необходимость одновременного участия
нокаут генов, кодирующих рецепторы к инсу-
нескольких разных регуляторов на каждой
лину и IGF-1 [48], или изоформ Akt1/2 [49], или
стадии трафика GSV, различие механизмов их
сверхэкспрессия Akt2 в скелетной мышце [33]
активации и комбинаторный характер их дей-
не изменяли чувствительности к инсулину у
ствия придают регуляции трафика GSV слож-
мышей, в том числе после высокожировой ди-
ную сетевую структуру. В совокупном виде она
еты [33], а также тем, что активность АМРК
условно показана как неканонический инсули-
возрастает при физической нагрузке и улучшает
новый каскад на рис. 3. Хотя его детализация
захват глюкозы мышцами из кровотока [28], но
выходит за рамки данного обзора и описана в
снижена у людей с ожирением и ИнсРез [50, 51].
ряде обзоров [35, 37-40], здесь стоит отметить
Наличие нескольких механизмов регуля-
два механизма. Оба механизма необходимы,
ции трафика Glut4 и захвата глюкозы в скелет-
поскольку регулируют экспозицию транспор-
ных мышцах значительно расширяет список
теров глюкозы независимо от Akt и дистальной
сигнальных белков, нарушение активности ко-
части канонического инсулинового каскада.
торых может вызывать ИнсРез. Они представ-
Один - активация малой GTPазы Rac1 под дей-
ляют не только фундаментальный интерес, но
ствием PI3-киназы; Rac1 вызывает перестрой-
и потенциальные мишени антидиабетических
ки кортикального цитоскелета и обеспечивает
препаратов. Изменения активности этих белков
подход GSV к мембране клетки. Другой меха-
у людей с ожирением, ИнсРез или СД2Т могут
низм запускается непосредственно от рецепто-
быть вызваны как изменением их посттрансля-
ра инсулина, требует ионов Са2+ и задействует
ционных модификаций (главным образом фос-
классический комплекс белков SNARE, обе-
форилирования), так и изменением содержа-
спечивающих слияние GSV с плазматической
ния в клетке. Учитывая длительность развития
мембраной и выход транспортеров на поверх-
ИнсРез и многообразие участников, логично
ность клетки.
предположить, что нарушения их активности
Многие регуляторы везикулярного трафи-
связаны с изменениями активности ряда тран-
ка, в том числе TBC1D4/AS160 и GTPазы Rab,
скрипционных факторов (ТФ) и генной экспрес-
регулируют не только какой-то один этап тра-
сии (рис. 3), закрепляющими состояние ИнсРез
фика, но и критичны для прохождения других
и последующий диабетический фенотип.
этапов, действуя в комбинации с другими регу-
ляторами. Таким образом, экспозиция транс-
портеров и захват глюкозы находятся под мно-
ИЗМЕНЕНИЯ ПРОТЕОМА
жественным контролем как канонических, так
СКЕЛЕТНЫХ МЫШЦ ПРИ ИнсРез и СД2Т
и неканонических мишеней инсулина, которые
пока далеко не все известны [35]. Возможно, что
Считается, что в каждой ткани экспрессиру-
снижение чувствительности захвата глюкозы к
ется до 10 000 белков, без учета их изоформ [52].
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1267
В пробах скелетной мышцы редко удается де-
данных предсказывать изменение активности
тектировать даже треть от общего количества
фосфорилирующих их киназ. В пробах скелет-
всех белков и это главным образом высококо-
ных мышц в основном детектируются фосфо-
пийные белки. Наличие высокопредставленных
сайты высокопредставленных мышечных бел-
саркомерных белков значительно ограничивает
ков, но фосфосайты низкокопийных белков
глубину протеомного масс-спектрометрическо-
удается детектировать гораздо реже. Однако
го анализа.
именно они составляют большинство киназ и
Протеом скелетных мышц людей с мета-
регуляторных белков. Считается, что даже со-
болическими нарушениями изучался в ряде
временные фосфопротеомные методики по-
работ. Наиболее глубокий анализ позволил
зволяют детектировать лишь около 10% всех
оценить изменения содержания более 2000 бел-
фосфосайтов [54]. Тем не менее фосфопроте-
ков у 148 добровольцев (здоровые, пациенты с
омный анализ позволяет гораздо шире охватить
ИнсРез, без или с СД2Т) [53]. Если только менее
изменения спектра фосфорилирования многих
100 белков изменили экспрессию при ИнсРез,
белков скелетных мышц, вызванные ИнсРез
то гораздо более масштабные изменения были
или СД2Т, как в базальном состоянии (нато-
обнаружены у пациентов с СД2Т. Из более чем
щак), так и в ответ на инсулин.
400 белков, которые изменили содержание,
Базальное состояние. В скелетных мышцах
только несколько его увеличили. Снизили со-
людей с СД2Т не было выявлено серьезных от-
держание многие митохондриальные фермен-
личий от здоровых людей в базальном уровне
ты и транспортеры, регуляторы метаболизма
фосфорилирования белков канонического ин-
аминокислот, синтеза белка (киназа MTOR
сулинового каскада (в состоянии натощак) ни
(механистическая мишень рапамицина), фак-
методом иммуноблоттинга [55-64], ни с помо-
тор элонгации 2, белки рибосом), протеосо-
щью целевой масс-спектрометрии [65]. Другие
мальные белки и белки теплового шока, а также
масс-спектрометрические исследования по-
ряд киназ (киназа легких цепей миозина SPEG,
казали лишь небольшие изменения отдельных
CAMK2G, MAPK12 и др.). Увеличили содержа-
фосфосайтов в проксимальной (IRS1) [66] и
ние главным образом саркомерные белки, ха-
дистальной (TBC1D4) [53] частях каскада. От-
рактерные преимущественно для быстрых мы-
сутствие выраженных изменений в инсулино-
шечных волокон (изоформы тяжелых и легких
вом каскаде в базальном состоянии при СД2Т
цепей миозина, тропонина, тропомиозина).
согласуется с результатами, полученными для
Интересно, что изменения в содержании бел-
скелетной мышцы крыс после нескольких
ков при СД2Т частично совпали с изменениями
недель высокожировой диеты, моделирую-
уровня их фосфорилирования (см. ниже). Од-
щей ИнсРез [33, 67].
нако протеомный анализ не позволяет предпо-
С другой стороны, фосфопротеомное иссле-
ложить механизмы возникновения этих изме-
дование с участием 148 человек с разной степе-
нений, указывая на важность более детального
нью метаболических нарушений показало, что в
анализа транскриптома и посттрансляционных
базальном состоянии наблюдаются прогресси-
модификаций, особенно фосфопротеома.
рующие изменения при ИнсРез (IFG или IGT)
и СД2Т [53]. Преимущественно снижалась ак-
тивность киназ (оцениваемая по изменению
ИЗМЕНЕНИЯ ФОСФОПРОТЕОМА
уровня фосфорилирования их субстратов), не
СКЕЛЕТНЫХ МЫШЦ ПРИ ИнсРез и СД2Т
входящих в инсулиновый каскад. В том числе это
киназы семейства PKC, казеинкиназы СК1/2,
Фосфорилирование является одним из ос-
кальций/кальмодулин-зависимая киназа II-ти-
новных способов передачи сигнала в клетке.
па (CAMK2), циклин-зависимые киназы CDK,
Существуют сотни киназ, каждая из которых
киназа, связанная с миотонической дистрофи-
может фосфорилировать несколько субстра-
ей (DMPK), CDC2-подобная киназа двойной
тов, и общее число сайтов фосфорилирования
специфичности, митоген-активируемые кина-
может достигать 100 000 [54]. Иммуноблоттинг
зы (МАР-киназы, MAPК) и другие. Также на-
позволяет оценить лишь порядка 10 разных сай-
блюдались изменения фосфорилирования со-
тов фосфорилирования в одном исследовании,
кратительных и структурных белков (изоформы
что определяется доступностью и специфич-
тяжелых цепей миозина, тропонин, небулин,
ностью антител. Напротив, фосфопротеом-
титин, десмин и др.). Если связь метаболиче-
ный масс-спектрометрический анализ позво-
ских нарушений с PKC ожидаема [16], то уча-
ляет одновременно детектировать более 10 000
стие казеинкиназы типа I/II (CK1/2) достаточ-
различных фосфосайтов в составе нескольких
но неожиданно. СК1/2 фосфорилируют сотни
тысяч различных белков и на основании этих
субстратов [54], выполняя множество функций,
БИОХИМИЯ том 87 вып. 9 2022
1268
ВОРОТНИКОВ и др.
в частности, фосфорилируя гликогенсинтазу и
сопоставлявших влияние инсулина на фос-
регулируя обмен гликогена [68]. Эти данные по
фопротеом скелетной мышцы людей без или
фосфопротеому человека [53] согласуются с ре-
с ИнсРез, или с СД2Т мы не обнаружили.
зультатами после высокожировой диеты у гры-
Фосфопротеом скелетной мышцы крыс в
зунов [33, 67], дополнительно обнаружившими
период ночной активности, когда животные
влияние высокожировой диеты на фосфорили-
активно питаются, был сопоставлен с таковым
рование белков-регуляторов жирового обмена,
в период дневного отдыха [33]. У животных на
воспаления и деградации белков.
жировой диете прирост инсулина после прие-
Суммируя, влияние ИнсРез и СД2Т на
ма пищи был более чем в 2 раза выше, чем у
базальный фосфопротеом скелетной мыш-
контрольных (что говорит о наличии ИнсРез),
цы (натощак) остается малоизученным. По
но фосфорилирование белков канонического
имеющимся данным, выраженных изменений
инсулинового каскада сильно не различалось.
в базальной активности канонического инсу-
Это говорит о том, что снижение чувствитель-
линового каскада при СД2Т не происходит. Это
ности к инсулину при высокожировой диете
дает основание предполагать, что такие изме-
успешно компенсируется повышенной секре-
нения отсутствуют и при ИнсРез, а основные
цией инсулина.
различия между здоровыми людьми и пациен-
Таким образом, только часть исследований
тами с СД2Т, скорее всего, связаны с реакцией
обнаружила при метаболических нарушениях
на инсулин. Кроме того, при СД2Т в скелетных
отдельные, не всегда ярко выраженные и вос-
мышцах происходят достаточно масштабные
производимые, нарушения активации белков
изменения фосфорилирования многих других
канонического инсулинового каскада инсу-
сигнальных белков, принимающих участие в
лином в скелетной мышце. Это подтолкнуло
регуляции углеводно-жирового и белкового об-
к анализу зависимости уровня фосфорилиро-
мена и воспалительных реакций, которые пря-
вания этих белков от концентрации инсулина.
мо не связаны с каноническим инсулиновым
Оказалось, что в адипоцитах даже малое уве-
каскадом, по крайней мере, с его проксималь-
личение фосфорилирования ключевой киназы
ной частью.
проксимальной части каскада (Akt) было до-
Стимуляция инсулином. Гиперинсулинеми-
статочным для полной активации дистальных
ческий эугликемический клэмп-тест наиболее
элементов (например, Glut4 или транскрипци-
популярен в исследованиях молекулярных от-
онного фактора Foxo1) [41, 42]. Была выдвинута
ветов скелетной мышцы человека на инсулин.
гипотеза об «избыточности» в клетке молекул
Как правило, в этом тесте концентрация инсу-
проксимальной части каскада (рецептор инсу-
лина в крови поддерживается достаточно высо-
лина, IRS, PI3-киназа и Akt), которые селек-
кой (~100 мкМЕ/мл) на протяжении несколь-
тивно передают сигнал в направлении других,
ких часов. Как и ожидалось, ряд исследований
менее представленных, мишеней [27]. Эта ги-
выявил меньший прирост уровня фосфорили-
потеза позволяет объяснить, почему основные
рования и/или активности белков канониче-
нарушения, связанные с ИнсРез, происходят
ского инсулинового каскада у людей с СД2Т
и должны быть более выражены в дистальной
по сравнению со здоровым контролем [55-62].
части каскада на уровне регуляторов трансло-
Однако в других работах различий обнаружено
кации GSV, но не в проксимальной части, где
не было [63, 64, 69]. Фосфопротеомный ана-
их обычно ищут и не всегда находят. При этом
лиз с помощью целевой масс-спектрометрии
конкретный механизм «дистальных» наруше-
выявил относительно небольшие изменения
ний остается пока неизвестным [27].
уровня фосфорилирования лишь в нескольких
В упомянутой выше модели [33] повыше-
из двух десятков сайтов IRS1 через 0,5, 1 и 4 ч
ние эндогенного инсулина в ответ на прием
клэмп-теста в мышце людей с СД2Т по сравне-
пищи вызывало масштабные изменения фос-
нию со здоровыми добровольцами [65, 66].
форилирования более 2500 сайтов белков в ске-
Панорамный фосфопротеомный анализ
летной мышце контрольных крыс и животных
скелетной мышцы здоровых людей после 2 ч
на высокожировой диете. Несмотря на разный
стимуляции инсулином в процессе клэмп-те-
уровень инсулина у животных этих двух групп,
ста показал изменение фосфорилирования
относительное повышение уровня фосфорили-
~700 фосфосайтов в более чем 400 белках. Пре-
рования Akt, mTOR и p70S6K1 (все - мишени
имущественно изменения наблюдались в сиг-
инсулина) и снижение уровня фосфорилирова-
нальных каскадах киназ AKT, MTOR и MAPK,
ния PKA были сходными. Различия наблюда-
а также различных ТФ [70]. Поскольку эти
лись только в белках-регуляторах метаболизма
молекулы являются мишенями инсулина, та-
гликогена. Масштабные межгрупповые разли-
кой результат вполне ожидаем. Исследований,
чия возникали также после приема пищи и в
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1269
степени фосфорилирования ~3000 сайтов бел-
ло, что изменения фосфопротеома, связанные
ков. Биоинформатический анализ предсказал,
с ИнсРез, выходят далеко за пределы канони-
что у животных с метаболическими нарушения-
ческого инсулинового каскада и связаны, в
ми активируются киназы CaMK2, рибосомаль-
частности, с изменением активности CaМК2,
ные киназы р70S6K1 и р90S6K, но снижается
рибосомальных S6-киназ p70S6K1 и p90S6K, а
активность казеинкиназы CK2 [33]. Поскольку
также CK2 [33]. Другие мишени по-прежнему
в скелетной мышце людей с СД2Т базальная
требуют идентификации и подтверждения, по
активность СК2 тоже снижена и активность
крайней мере, в разных моделях.
CAMK2 изменена [53], эти результаты указыва-
ют на роль CK2 и CAMK2 в изменениях внут-
риклеточной сигнализации в скелетной мышце
ИЗМЕНЕНИЯ ТРАНСКРИПТОМА
при развитии ИнсРез и, возможно, СД2Т.
СКЕЛЕТНЫХ МЫШЦ ПРИ ИнсРез и СД2Т
Таким образом, изменения фосфопротео-
ма скелетной мышцы, происходящие при сти-
При метаболических нарушениях в ске-
муляции инсулином, значительно отличаются в
летной мышце наблюдается изменение уров-
условиях ИнсРез и СД2Т по сравнению со здо-
ня фосфорилирования множества киназ как
ровым контролем. Одно из возможных объяс-
в базальном состоянии [33, 53], так и в ответ
нений состоит в том, что при ИнсРез инсулин
на инсулин [33, 70]. Эти киназы регулируют
может связываться с рецепторами IGF-1 и ги-
активность сотен белков, включая транскрип-
бридными рецепторами IGF-1/инсулина [71].
ционные факторы. Логично предположить, что
Сродство инсулина к этим рецепторам на по-
метаболические нарушения должны вызывать
рядок ниже, чем у IGF-1, и в норме инсулин
значительные изменения генной экспрессии.
их не активирует. Однако при компенсаторной
Базальное состояние. Изменения базально-
гиперинсулинемии в условиях ИнсРез уровень
го транскриптома скелетной мышцы человека
инсулина длительно повышен и вероятность
при СД2Т изучались многократно и выявили
активации рецепторов IGF-1 и гибридных ре-
значительные отличия по сравнению со здоро-
цепторов возрастает [72]. Уровень IGF-1 также
вым контролем. Один из первых метаанализов,
растет в этих условиях, пока уровень глюкозы
обобщивший 6 исследований, показал, что при
в крови остается нормальным, но стабилизи-
СД2Т изменяется экспрессия нескольких сотен
руется при IFG и падает при СД2Т, тогда как
генов [74]. Наиболее яркие изменения были
содержание гибридных рецепторов в скелет-
связаны со снижением экспрессии генов цикла
ной мышце растет при ожирении, коррелируя
трикарбоновых кислот и окислительного фос-
с индексом массы тела [71]. Несмотря на то что
форилирования, β-окисления жирных кислот
все эти рецепторы активируют те же прокси-
и регуляторов метаболизма аминокислот. Сни-
мальные звенья каскадов (PI3-киназа → Akt и
жение экспрессии генов окислительного мета-
MAP-киназы (Erk); см. рис. 3), дистальные зве-
болизма согласуется с последующими больши-
нья могут быть не идентичны, вызывая разные
ми транскриптомными исследованиями
[75,
сигнальные ответы [73]. Насколько велики эти
76] и подтверждается данными протеомного
различия остается вопросом, но масштабность
анализа скелетной мышцы людей с СД2Т [53].
изменений фосфопротеома при ИнсРез пред-
Однако другой метаанализ не обнаружил
полагает, что они не единичны и лишь могут
снижения экспрессии этих генов у людей с
вносить определенный вклад.
ИнсРез [77]. Это может объясняться тем, что
Суммируя, нарушения активации инсули-
снижение окислительных возможностей мышц
ном компонентов канонического инсулинового
связано не только (и не столько) с ИнсРез,
каскада обнаруживаются далеко не всегда при
сколько с другими факторами (возраст, уро-
ИнсРез и СД2Т. Это может быть связано с тем,
вень двигательной активности и др.). Наруше-
что основные нарушения происходят в дисталь-
ние экспрессии генов, регулирующих обмен
ной части каскада, на уровне низкопредстав-
аминокислот при СД2Т, подтвердилось в ряде
ленных регуляторов везикулярного транспорта,
работ [75-78], так же, как и активация провос-
в неканонических или других механизмах, ре-
палительных генов и регуляторов убиквити-
гулирующих захват глюкозы. Влияние ИнсРез
нирования [75, 76]. Эти данные согласуются с
и СД2Т на фосфопротеом скелетной мышцы
повышенным уровнем аминокислот в плазме
при стимуляции инсулином остается практи-
крови [79] и латентным воспалением в жиро-
чески не изученным. Единственное исследова-
вой ткани при ожирении [23, 24, 26]. Помимо
ние, изучавшее ответ на эндогенный инсулин
этого, было обнаружено, что при СД2Т сни-
после приема пищи в скелетной мышце грызу-
жена экспрессия мРНК генов белков канони-
нов в модели с высокожировой диетой, показа-
ческого инсулинового каскада IRS2, PIK3CB,
БИОХИМИЯ том 87 вып. 9 2022
1270
ВОРОТНИКОВ и др.
PIK3CA, PIK3R1, SLC2A4 (GLUT4) [76], ре-
ном в процессе клэмп-теста. Если через 30 мин
цепторов инсулина (INSR) и IGF-1 (IGF1R) и
изменения генной экспрессии отсутствова-
адаптерного белка тирозинкиназных рецепто-
ли [83], то через 3-4 ч менялась экспрессия со-
ров (GRB14) [77]. При этом величина снижения
тен генов [83-85]. Как и в цитируемом выше ис-
экспрессии INSR и IRS2 хоть и коррелировала
следовании на миотубах [81], инсулин вызывал
с выраженностью метаболических нарушений,
экспрессию генов провоспалительных цитоки-
но оказалась очень мала [80].
нов (IL17D, CCL2, CCL8, CXCL2), их рецепто-
Какие факторы отвечают за изменение
ров (IL1R1, IL13R) и фактора роста (TGFB2), а
генной экспрессии при ИнсРез и СД2Т? Ком-
также нескольких десятков генов ТФ. В числе по-
плексные изменения в содержании различных
следних были факторы раннего ответа (EGR1/3,
субстратов, метаболитов, гормонов и регуля-
IER2), факторы семейства AP-1 (JUNB, FOS,
торных факторов в крови и в скелетной мыш-
FOSB), регуляторы гликолиза и окислительного
це не позволяют дать однозначный ответ. Ис-
фосфорилирования (NR4A1 и NR4A3), жиро-
пользование биоинформатических подходов в
вого метаболизма (SREBF1), факторы инициа-
нескольких работах позволило наметить тран-
ции транскрипции (TBPL1, BTF3) и др. [83-85].
скрипционные регуляторы, ассоциированные с
Снижение экспрессии было выявлено для мио-
генами, изменявшими экспрессию при метабо-
генных факторов (MEF2B, MYF6), ключевого
лических нарушениях [78, 80]. Однако эти рабо-
регулятора жирового обмена (PPARG), ядерных
ты были нацелены на поиск регуляторов, свя-
факторов гепатоцитов (HNF1/2), рецептора ти-
занных с генами белков инсулинового каскада,
реоидного гормона (THRA) [85]. Масштабное
тогда как регуляторы, связанные с более мас-
изменение экспрессии генов ТФ дает основание
штабными изменениями транскриптомного
полагать, что должна изменяться экспрессия
профиля, во многом остались невыясненными.
множества генов-мишеней в процессе восста-
Стимуляция инсулином. Изменения инсули-
новления после стимуляции инсулином. Клю-
нозависимого транскриптома скелетной мыш-
чевые эффекты инсулина в скелетной мышце
цы при метаболических нарушениях изучались
человека (активация захвата глюкозы, синтеза
лишь в единичных работах. Поэтому сначала
гликогена и MTOR-зависимого синтеза белка)
будут рассмотрены эффекты инсулина в клет-
опосредованы посттрансляционной регуляци-
ках и мышцах здоровых людей.
ей. По-видимому, инсулин также может влиять
В первичных миотубах человека динамика
на эти процессы на уровне транскрипции, в том
транскриптома (0,5, 1, 2, 4, 8 и 24 ч) была ис-
числе усиливая экспрессию генов гексокиназы-2
следована в одной из ранних работ после сти-
(HK2), рибосомальных белков и ряда факторов,
муляции клеток сверхвысокой концентрацией
регулирующих трансляцию [84, 85].
инсулина (1 мкМ) [81]. Оказалось, что уже на
В скелетной мышце людей с метаболиче-
самых ранних этапах изменялась (в основном
скими нарушениями направленность изме-
увеличивалась) экспрессия генов ТФ раннего
нений экспрессии генов была сопоставима со
ответа (FOS, SRF, EGR1/2, JUNB, IER3, ATF3
здоровым контролем в ответ на стимуляцию
и ID1), провоспалительных цитокинов и регу-
инсулином в ходе клэмп-теста [86, 87]. Биоин-
ляторов ангиогенеза. На более поздних этапах
форматический анализ связал эти изменения с
усиливалась экспрессия генов факторов роста
участием интерлейкинов, PPAR и ретиноидных
и метаболических ферментов, а через 24 ч из-
рецепторов [86]. В единственной работе, сопо-
менения практически отсутствовали. Резуль-
ставлявшей ответ на инсулин при метаболи-
таты этой работы следует интерпретировать с
ческих нарушениях, было показано, что через
осторожностью из-за очень высокого уровня
5 ч клэмп-теста у людей с ИнсРез изменилась
инсулина, который поддерживался в течение
экспрессия меньшего числа генов, чем у здо-
всего эксперимента, тогда как физиологиче-
ровых индивидов [87]. В частности, это было
ские концентрации инсулина не превышают
связано с отсутствием у людей с ИнсРез влия-
1 нМ в течение относительно коротких интер-
ния инсулина на экспрессию генов ключевых
валов [22]. Тем не менее можно заключить, что,
ферментов катаболизма углеводов - киназы
по аналогии с различными стресс-воздействия-
пируватдегидрогеназы 4, гексокиназы-2 (HK2)
ми в разных клеточных культурах [82], инсулин
и др. При этом у людей с ИнсРез инсулин более
вызывает быструю активацию генов ТФ ранне-
выраженно активировал гены ТФ, регулирую-
го ответа в миотубах.
щие жировой метаболизм (CEBPA и SREBF1).
В скелетной мышце людей с нормальной
Суммируя, стимуляция инсулином вызывает
чувствительностью к инсулину изменения
масштабные изменения транскриптомного про-
транскриптома были исследованы только в двух
филя в мышечных клетках, включая увеличение
временных точках после стимуляции инсули-
экспрессии генов различных ТФ, цитокинов,
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1271
регуляторов углеводно-жирового обмена и син-
Прирост эндогенного инсулина, вызван-
теза белка. Однако динамика этих изменений и
ный приемом пищи, значительно больше при
сигнальные пути, их индуцирующие, остаются
ИнсРез, чем в здоровом состоянии и у лю-
практически не изученными, так же, как и изме-
дей [22], и у животных [33]. При этом уровень
нения транскриптомного ответа на инсулин при
глюкозы и свободных жирных кислот в кро-
развитии метаболических нарушений.
ви здоровых людей и людей с ИнсРез одина-
ков [22], а у контрольных животных и живот-
ных на жировой диете детектируемые различия
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
в проксимальной части канонического инсу-
линового каскада минимальны, если вообще
Развитие ИнсРез и СД2Т тесно связано со
есть [33]. Это говорит о том, что способность
снижением инсулинозависимого захвата глю-
сигнальной системы отвечать на инсулин со-
козы скелетными мышцами, однако молеку-
храняется на молекулярном уровне за счет
лярные механизмы этого нарушения до сих пор
компенсаторного повышения уровня инсули-
неизвестны. При СД2Т не всегда обнаружива-
на. Усиление секреции инсулина может быть
ются изменения активации и уровня фосфори-
связано с бóльшим количеством пищи, потреб-
лирования сигнальных белков проксимальной
ляемой людьми с избыточной массой тела.
части канонического инсулинового каскада
Это значит, что для понимания молекулярных
(от рецептора до AKT, рис. 3). Обсуждаются
различий в сигнализации от инсулина важно
гипотезы, объясняющие снижение инсулино-
исследовать ответы на нормированный объем
зависимого захвата глюкозы дефектами в дис-
пищи, моделируя ситуацию в жизни. Такие ис-
тальной части каскада или неканонической
следования до сих пор отсутствуют.
инсулиновой сигнализации на уровне регуля-
Метаболические нарушения вызывают в
ции трафика и слияния GSV с плазматической
скелетной мышце комплексные изменения в
мембраной [27]. Бурное развитие методов ко-
активации сигнальных белков и ТФ, экспрес-
личественной панорамной фосфопротеоми-
сии мРНК, содержании их белковых продук-
ки значительно расширило представления о
тов и различных метаболитов. Они происходят
сигнальных реакциях на инсулин. Стало ясно,
как в базальном состоянии, так и в ответ на
что активация множества киназ и ТФ выходит
стимуляцию инсулином. При этом нет ясной
далеко за рамки канонического инсулинового
картины о взаимосвязи изменений, происхо-
каскада. Невысокая способность детектировать
дящих на разных уровнях регуляции в клетке.
низкокопийные белки, которые зачастую игра-
Для одновременной детекции инсулинозави-
ют ключевую роль во внутриклеточной переда-
симых изменений на разных уровнях недавно
че сигнала, пока остается существенным огра-
был предложен так называемый «транс-омикс-
ничением панорамного фосфопротеомного
ный» подход, который использует комбинацию
анализа [54]. Совершенствование аппаратных
широкозахватных фосфопротеомных, проте-
средств и способов пробоподготовки должно
омных, транскриптомных и метаболомных ме-
увеличить глубину фосфопротеомного анали-
тодик с биоинформатическим анализом. Пре-
за и расширить список сигнальных мишеней
имущество транс-омиксного анализа состоит
инсулина. Эти белки представляют фундамен-
в возможности реконструкции не отдельных
тальный интерес и могут быть потенциальными
каскадов, а молекулярных сетей, состоящих
мишенями новых терапевтических препаратов.
из взаимосвязанных друг с другом каскадов.
Изменения транскриптомного профиля
Такой подход уже позволил выявить в клетках
в скелетных мышцах людей с ИнсРез и СД2Т
гепатомы крысы молекулярные сети, активи-
охарактеризованы достаточно подробно для
рующиеся пико- и наномолярными концентра-
базального состояния. По-видимому, они вы-
циями инсулина, характерными для базального
званы изменением многих факторов, включая
состояния и ответа на прием пищи соответ-
и циркулирующие в крови, и находящиеся в
ственно [88]. Оказалось, что в низких концен-
мышечной ткани, а также тесно связаны с хро-
трациях инсулин преимущественно влияет на
ническим недостатком двигательной актив-
фосфорилирование факторов трансляции, Akt
ности. Однако сигнальные механизмы и ТФ,
и p38 MАРК, изменяя активность ТФ (Foxo1,
ответственные за эти изменения в мышечных
Creb1 и др.), разнонаправленно регулирую-
клетках, почти не изучены. Реакции генной
щих экспрессию мРНК ферментов гликоли-
экспрессии на острую стимуляцию инсулином
за, регуляторов синтеза жиров и метаболизма
нарушены при СД2Т. Эти изменения до сих пор
аминокислот, изменяя концентрации соответ-
плохо охарактеризованы, так же, как и регули-
ствующих метаболитов. Напротив, в высоких
рующие их механизмы.
концентрациях инсулин преимущественно
БИОХИМИЯ том 87 вып. 9 2022
1272
ВОРОТНИКОВ и др.
стимулирует Akt и Erk1/2 МАРК, активируя
Регуляция углеводно-жирового обмена у
ТФ раннего ответа (Egr1, Hes1 и др.) и увели-
животных и людей отличается, поэтому исполь-
чивая экспрессию их генов-мишеней, в том
зование транс-омиксного анализа для исследо-
числе ряд других ТФ. Подобный подход был
вания механизмов ИнсРез у человека представ-
недавно экспериментально использован для
ляется крайне перспективным направлением.
реконструкции молекулярных сетей (сигналь-
Учитывая ведущую роль скелетной мускулатуры
ные белки → ТФ → гены-мишени → регуляторы
в развитии метаболических нарушений, бли-
метаболизма → метаболиты), отвечающих за
жайшие усилия должны быть направлены на
стимулируемый инсулином рост эмбриональ-
комбинирование широкозахватных методов для
ных клеток Drosophila melanogaster S2R+ [89].
выяснения молекулярных механизмов развития
В другой работе была одновременно исследо-
ИнсРез и СД2Т в скелетной мышце человека.
вана динамика фосфопротеома, транскрипто-
ма и протеома [90]. Были реконструированы
Вклад авторов. Д.В. Попов, А.В. Ворот-
молекулярные сети, регулирующие содержа-
ников
- концепция обзора; Д.В. Попов,
ние различных метаболитов в печени мыши в
П.А. Махновский, А.В. Воротников - сбор ин-
течение 6 ч после инъекции инсулина. Это по-
формации, обсуждение результатов исследова-
зволило понять, что быстрые реакции (изме-
ний, написание и редактирование текста.
нения углеводного и жирового метаболизма)
Финансирование. Работа выполнена при
регулируются на уровне фосфорилирования
финансовой поддержке Российского научного
сигнальных белков, но более поздние (метабо-
фонда (грант № 21-75-10146).
лизм аминокислот и нуклеотидов) контроли-
Конфликт интересов. Авторы заявляют об
руются дополнительно на уровне экспрессии
отсутствии конфликта интересов.
белков-регуляторов. При этом изменение со-
Соблюдение этических норм. Настоящая
держания этих регуляторов происходит глав-
статья не содержит экспериментов и каких-ли-
ным образом за счет изменения трансляции, а
бо исследований с участием людей или живот-
не уровня их мРНК.
ных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Di Pino, A., and DeFronzo, R. A. (2019) Insulin
mTORC2, Cell Metab., 17, 1009-1020, doi: 10.1016/
resistance and atherosclerosis: implications for
j.cmet.2013.04.010.
insulin-sensitizing agents, Endocr. Rev., 40, 1447-1467,
8. Ohno, S., Quek, L. E., Krycer, J. R., Yugi, K.,
doi: 10.1210/er.2018-00141.
Hirayama, A., et al.
(2020) Kinetic trans-omic
2. Nencioni, A., Caffa, I., Cortellino, S., and Longo,
analysis reveals key regulatory mechanisms for insulin-
V. D.
(2018) Fasting and cancer: molecular
regulated glucose metabolism in adipocytes, iScience,
mechanisms and clinical application, Nat. Rev. Cancer,
23, 101479, doi: 10.1016/j.isci.2020.101479.
18, 707-719, doi: 10.1038/s41568-018-0061-0.
9. Krako Jakovljevic, N., Pavlovic, K., Zujovic, T., Krav-
3. DeFronzo, R. A., Gunnarsson, R., Bjorkman, O.,
ic-Stevovic, T., Jotic, A., et al. (2021) In vitro models
Olsson, M., and Wahren, J. (1985) Effects of insulin
of insulin resistance: Mitochondrial coupling is differ-
on peripheral and splanchnic glucose metabolism
ently affected in liver and muscle cells, Mitochondrion,
in noninsulin-dependent (type II) diabetes mellitus,
61, 165-173, doi: 10.1016/j.mito.2021.10.001.
J. Clin. Invest., 76, 149-155, doi: 10.1172/JCI111938.
10. Li, Z., Lai, Z. W., Christiano, R., Gazos-Lopes, F.,
4. Deer, J., Koska, J., Ozias, M., and Reaven, P. (2015)
Walther, T. C., et al. (2018) Global analyses of selec-
Dietary models of insulin resistance, Metabolism, 64,
tive insulin resistance in hepatocytes caused by palmi-
163-171, doi: 10.1016/j.metabol.2014.08.013.
tate lipotoxicity, Mol. Cell. Proteomics, 17, 836-849,
5. Nandi, A., Kitamura, Y., Kahn, C. R., and Accili, D.
doi: 10.1074/mcp.RA117.000560.
(2004) Mouse models of insulin resistance, Physiol.
11. Samsonov, M. V., Podkuychenko, N. V., Khapchaev,
Rev., 84, 623-647, doi: 10.1152/physrev.00032.2003.
A. Y., Efremov, E. E., Yanushevskaya, E. V., et al.
6. Kowalski, G. M., and Bruce, C. R. (2014) The
(2021) AICAR protects vascular endothelial cells from
regulation of glucose metabolism: implications
oxidative injury induced by the long-term palmitate
and considerations for the assessment of
excess, Int. J. Mol. Sci., 23, doi: 10.3390/ijms23010211.
glucose homeostasis in rodents, Am. J. Physiol.
12. Batista, T. M., Jayavelu, A. K., Wewer Albrechtsen,
Endocrinol. Metab.,
307, E859-871, doi:
10.1152/
N. J., Iovino, S., Lebastchi, J., et al. (2020) A cell-au-
ajpendo.00165.2014.
tonomous signature of dysregulated protein phos-
7. Humphrey, S. J., Yang, G., Yang, P., Fazakerley,
phorylation underlies muscle insulin resistance in
D. J., Stockli, J., et al. (2013) Dynamic adipocyte
type
2 diabetes, Cell Metab.,
32,
844-859.e845,
phosphoproteome reveals that Akt directly regulates
doi: 10.1016/j.cmet.2020.08.007.
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1273
13.
Haider, N., Lebastchi, J., Jayavelu, A. K., Batista, T.
25.
Samuel, V. T., and Shulman, G. I. (2016) The
M., Pan, H., et al. (2021) Signaling defects associated
pathogenesis of insulin resistance: integrating signaling
with insulin resistance in nondiabetic and diabetic
pathways and substrate flux, J. Clin. Invest., 126, 12-
individuals and modification by sex, J. Clin. Invest.,
22, doi: 10.1172/JCI77812.
131, doi: 10.1172/JCI151818.
26.
Sakers, A., De Siqueira, M. K., Seale, P., and
14.
Gaster, M. (2019) The diabetic phenotype is preserved
Villanueva, C. J. (2022) Adipose-tissue plasticity in
in myotubes established from type 2 diabetic subjects:
health and disease, Cell, 185, 419-446, doi: 10.1016/
a critical appraisal, APMIS, 127, 3-26, doi: 10.1111/
j.cell.2021.12.016.
apm.12908.
27.
James, D. E., Stockli, J., and Birnbaum, M. J. (2021)
15.
Varemo, L., Henriksen, T. I., Scheele, C., Broholm,
The aetiology and molecular landscape of insulin
C., Pedersen, M., et al. (2017) Type 2 diabetes and
resistance, Nat. Rev. Mol. Cell Biol., 22, 751-771,
obesity induce similar transcriptional reprogramming
doi: 10.1038/s41580-021-00390-6.
in human myocytes, Genome Med., 9, 47, doi: 10.1186/
28.
Sylow, L., Kleinert, M., Richter, E. A., and Jensen,
s13073-017-0432-2.
T. E. (2017) Exercise-stimulated glucose uptake — regu-
16.
Petersen, M. C., and Shulman, G. I. (2018) Mecha-
lation and implications for glycaemic control, Nat. Rev.
nisms of insulin action and insulin resistance, Physiol.
Endocrinol., 13, 133-148, doi: 10.1038/nrendo.2016.162.
Rev., 98, 2133-2223, doi: 10.1152/physrev.00063.2017.
29.
DeFronzo, R. A., Tobin, J. D., and Andres, R. (1979)
17.
White, M. F., and Kahn, C. R.
(2021) Insulin
Glucose clamp technique: a method for quantifying
action at a molecular level
-
100 years of
insulin secretion and resistance, Am. J. Physiol., 237,
progress, Mol. Metab.,
52,
101304, doi:
10.1016/
E214-223, doi: 10.1152/ajpendo.1979.237.3.E214.
j.molmet.2021.101304.
30.
Kolterman, O. G., Insel, J., Saekow, M., and Olefsky,
18.
American Diabetes Association Professional Prac-
J. M. (1980) Mechanisms of insulin resistance in
tice, C., American Diabetes Association Professional
human obesity: evidence for receptor and postreceptor
Practice, C., Draznin, B., Aroda, V. R., Bakris, G.,
defects, J. Clin. Invest., 65, 1272-1284, doi: 10.1172/
Benson, G., Brown, F. M., et al. (2022) 2. Classifi-
JCI109790.
cation and diagnosis of diabetes: standards of medi-
31.
Humphrey, S. J., Azimifar, S. B., and Mann, M.
cal care in diabetes-2022, Diabetes Care, 45, S17-S38,
(2015) High-throughput phosphoproteomics reveals in
doi: 10.2337/dc22-S002.
vivo insulin signaling dynamics, Nat. Biotechnol., 33,
19.
Liu, Y., Li, J., Wu, Y., Zhang, H., Lv, Q., et al. (2022)
990-995, doi: 10.1038/nbt.3327.
Evidence from a systematic review and meta-analysis:
32.
Minard, A. Y., Tan, S. X., Yang, P., Fazakerley, D.
Classical impaired glucose tolerance should be divided
J., Domanova, W., et al. (2016) mTORC1 is a major
into subgroups of isolated impaired glucose tolerance
regulatory node in the FGF21 signaling network
and impaired glucose tolerance combined with im-
in adipocytes, Cell Rep., 17, 29-36, doi: 10.1016/
paired fasting glucose, according to the risk of progres-
j.celrep.2016.08.086.
sion to diabetes, Front. Endocrinol. (Lausanne), 13,
33.
Small, L., Brandon, A. E., Parker, B. L., Desh-
835460, doi: 10.3389/fendo.2022.835460.
pande, V., Samsudeen, A. F., et al. (2019) Reduced
20.
Wang, Q., Jokelainen, J., Auvinen, J., Puukka, K.,
insulin action in muscle of high fat diet rats over the
Keinanen-Kiukaanniemi, S., et al. (2019) Insulin
diurnal cycle is not associated with defective insu-
resistance and systemic metabolic changes in
lin signaling, Mol. Metab., 25, 107-118, doi: 10.1016/
oral glucose tolerance test in 5340 individuals: an
j.molmet.2019.04.006.
interventional study, BMC Med., 17, 217. doi: 10.1186/
34.
Samuel, V. T., Petersen, K. F., and Shulman, G. I.
s12916-019-1440-4.
(2010) Lipid-induced insulin resistance: unravelling
21.
Frayn, K. N. (2019) Turning over our fat stores:
the mechanism, Lancet, 375, 2267-2277, doi: 10.1016/
the key to metabolic health Blaxter Award Lecture
S0140-6736(10)60408-4.
2018, Proc. Nutr. Soc., 78, 398-406, doi: 10.1017/
35.
Klip, A., McGraw, T. E., and James, D. E. (2019)
S0029665118002598.
Thirty sweet years of GLUT4, J. Biol. Chem., 294,
22.
McQuaid, S. E., Hodson, L., Neville, M. J., Dennis,
11369-11381, doi: 10.1074/jbc.REV119.008351.
A. L., Cheeseman, J., et al. (2011) Downregulation
36.
Deshmukh, A. S. (2016) Insulin-stimulated glucose
of adipose tissue fatty acid trafficking in obesity: a
uptake in healthy and insulin-resistant skeletal muscle,
driver for ectopic fat deposition? Diabetes, 60, 47-55,
Horm. Mol. Biol. Clin. Invest., 26, 13-24, doi: 10.1515/
doi: 10.2337/db10-0867.
hmbci-2015-0041.
23.
Vorotnikov, A. V., Stafeev, I. S., Menshikov, M. Y.,
37.
Bogan, J. S. (2012) Regulation of glucose trans-
Shestakova, M. V., and Parfyonova, Y. V. (2019) La-
porter translocation in health and diabetes,
tent inflammation and defect in adipocyte renewal as
Annu. Rev. Biochem.,
81,
507-532, doi:
10.1146/
a mechanism of obesity-associated insulin resistance,
annurev-biochem-060109-094246.
Biochemistry (Moscow), 84, 1329-1345, doi: 10.1134/
38.
Jaldin-Fincati, J. R., Pavarotti, M., Frendo-Cumbo,
S0006297919110099.
S., Bilan, P. J., and Klip, A. (2017) Update on GLUT4
24.
Stafeev, I. S., Vorotnikov, A. V., Ratner, E. I.,
vesicle traffic: A cornerstone of insulin action,
Menshikov, M. Y., and Parfyonova, Y. V.
(2017)
Trends Endocrinol. Metab., 28, 597-611, doi: 10.1016/
Latent inflammation and insulin resistance in
j.tem.2017.05.002.
adipose tissue, Int. J. Endocrinol., 2017, 5076732,
39.
Leney, S. E., and Tavare, J. M. (2009) The molecular
doi: 10.1155/2017/5076732.
basis of insulin-stimulated glucose uptake: signalling,
8
БИОХИМИЯ том 87 вып. 9 2022
1274
ВОРОТНИКОВ и др.
trafficking and potential drug targets, J. Endocrinol.,
sion in adipose tissue, J. Lipid Res., 53, 792-801, doi:
203, 1-18, doi: 10.1677/JOE-09-0037.
10.1194/jlr.P022905.
40.
Stockli, J., Fazakerley, D. J., and James, D. E. (2011)
52.
Wang, D., Eraslan, B., Wieland, T., Hallstrom, B.,
GLUT4 exocytosis, J. Cell Sci.,
124,
4147-4159,
Hopf, T., et al. (2019) A deep proteome and tran-
doi: 10.1242/jcs.097063.
scriptome abundance atlas of
29 healthy human
41.
Ng, Y., Ramm, G., Burchfield, J. G., Coster, A. C.,
tissues, Mol. Syst. Biol., 15, e8503, doi: 10.15252/
Stockli, J., et al. (2010) Cluster analysis of insulin
msb.20188503.
action in adipocytes reveals a key role for Akt at the
53.
Ohman, T., Teppo, J., Datta, N., Makinen, S.,
plasma membrane, J. Biol. Chem., 285, 2245-2257,
Varjosalo, M., et al. (2021) Skeletal muscle pro-
doi: 10.1074/jbc.M109.060236.
teomes reveal downregulation of mitochondri-
42.
Tan, S. X., Ng, Y., Meoli, C. C., Kumar, A., Khoo,
al proteins in transition from prediabetes into
P. S., et al. (2012) Amplification and demultiplex-
type 2 diabetes, iScience, 24, 102712, doi: 10.1016/
ing in insulin-regulated Akt protein kinase path-
j.isci.2021.102712.
way in adipocytes, J. Biol. Chem., 287, 6128-6138,
54.
Needham, E. J., Parker, B. L., Burykin, T., James,
doi: 10.1074/jbc.M111.318238.
D. E., and Humphrey, S. J. (2019) Illuminating the
43.
Dummler, B., and Hemmings, B. A.
(2007)
dark phosphoproteome, Sci. Signal., 12, doi: 10.1126/
Physiological roles of PKB/Akt isoforms in
scisignal.aau8645.
development and disease, Biochem. Soc. Trans., 35,
55.
Krook, A., Roth, R. A., Jiang, X. J., Zierath, J. R.,
231-235, doi: 10.1042/BST0350231.
and Wallberg-Henriksson, H. (1998) Insulin-stim-
44.
Hayashi, T., Hirshman, M. F., Kurth, E. J., Winder,
ulated Akt kinase activity is reduced in skeletal mus-
W. W., and Goodyear, L. J. (1998) Evidence for 5′
cle from NIDDM subjects, Diabetes, 47, 1281-1286,
AMP-activated protein kinase mediation of the effect
doi: 10.2337/diab.47.8.1281.
of muscle contraction on glucose transport, Diabetes,
56.
Tonks, K. T., Ng, Y., Miller, S., Coster, A. C.,
47, 1369-1373, doi: 10.2337/diab.47.8.1369.
Samocha-Bonet, D., et al.
(2013) Impaired Akt
45.
Lizcano, J. M., Goransson, O., Toth, R., Deak, M.,
phosphorylation in insulin-resistant human mus-
Morrice, N. A., et al. (2004) LKB1 is a master ki-
cle is accompanied by selective and heterogeneous
nase that activates 13 kinases of the AMPK subfami-
downstream defects, Diabetologia,
56,
875-885,
ly, including MARK/PAR-1, EMBO J., 23, 833-843,
doi: 10.1007/s00125-012-2811-y.
doi: 10.1038/sj.emboj.7600110.
57.
Albers, P. H., Pedersen, A. J., Birk, J. B., Kristensen,
46.
Inazuka, F., Sugiyama, N., Tomita, M., Abe, T.,
D. E., Vind, B. F., et al. (2015) Human muscle fiber
Shioi, G., et al. (2012) Muscle-specific knock-out
type-specific insulin signaling: impact of obesity and
of NUAK family SNF1-like kinase 1 (NUAK1) pre-
type 2 diabetes, Diabetes, 64, 485-497, doi: 10.2337/
vents high fat diet-induced glucose intolerance,
db14-0590.
J. Biol. Chem.,
287,
16379-16389, doi:
10.1074/
58.
Vind, B. F., Birk, J. B., Vienberg, S. G., Andersen,
jbc.M111.302687.
B., Beck-Nielsen, H., et al. (2012) Hyperglycaemia
47.
Koh, H. J., Toyoda, T., Fujii, N., Jung, M. M., Rath-
normalises insulin action on glucose metabolism but
od, A., et al. (2010) Sucrose nonfermenting AMPK-re-
not the impaired activation of AKT and glycogen
lated kinase (SNARK) mediates contraction-stimu-
synthase in the skeletal muscle of patients with type
lated glucose transport in mouse skeletal muscle, Proc.
2 diabetes, Diabetologia, 55, 1435-1445, doi: 10.1007/
Natl. Acad. Sci. USA, 107, 15541-15546, doi: 10.1073/
s00125-012-2482-8.
pnas.1008131107.
59.
Kim, Y. B., Kotani, K., Ciaraldi, T. P., Henry, R. R.,
48.
O’Neill, B. T., Lauritzen, H. P., Hirshman, M. F.,
and Kahn, B. B. (2003) Insulin-stimulated protein
Smyth, G., Goodyear, L. J., et al. (2015) Differential
kinase C lambda/zeta activity is reduced in skeletal
role of insulin/IGF-1 receptor signaling in muscle
muscle of humans with obesity and type 2 diabetes:
growth and glucose homeostasis, Cell Rep., 11, 1220-
reversal with weight reduction, Diabetes, 52, 1935-
1235, doi: 10.1016/j.celrep.2015.04.037.
1942, doi: 10.2337/diabetes.52.8.1935.
49.
Jaiswal, N., Gavin, M. G., Quinn, W. J., III, Lu-
60.
Kim, Y. B., Nikoulina, S. E., Ciaraldi, T. P., Henry, R.
ongo, T. S., Gelfer, R. G., et al. (2019) The role of
R., and Kahn, B. B. (1999) Normal insulin-dependent
skeletal muscle Akt in the regulation of muscle mass
activation of Akt/protein kinase B, with diminished
and glucose homeostasis, Mol. Metab., 28, 1-13,
activation of phosphoinositide 3-kinase, in muscle
doi: 10.1016/j.molmet.2019.08.001.
in type 2 diabetes, J. Clin. Invest., 104, 733-741,
50.
Gauthier, M. S., O’Brien, E. L., Bigornia, S., Mott,
doi: 10.1172/JCI6928.
M., Cacicedo, J. M., et al. (2011) Decreased AMP-
61.
Bandyopadhyay, G. K., Yu, J. G., Ofrecio, J., and
activated protein kinase activity is associated with
Olefsky, J. M. (2005) Increased p85/55/50 expression
increased inflammation in visceral adipose tissue and
and decreased phosphotidylinositol 3-kinase activity in
with whole-body insulin resistance in morbidly obese
insulin-resistant human skeletal muscle, Diabetes, 54,
humans, Biochem. Biophys. Res. Commun., 404, 382-
2351-2359, doi: 10.2337/diabetes.54.8.2351.
387, doi: 10.1016/j.bbrc.2010.11.127.
62.
Karlsson, H. K., Zierath, J. R., Kane, S., Krook,
51.
Xu, X. J., Gauthier, M. S., Hess, D. T., Apovian, C.
A., Lienhard, G. E., et al. (2005) Insulin-stimulated
M., Cacicedo, J. M., et al. (2012) Insulin sensitive and
phosphorylation of the Akt substrate AS160 is impaired
resistant obesity in humans: AMPK activity, oxida-
in skeletal muscle of type 2 diabetic subjects, Diabetes,
tive stress, and depot-specific changes in gene expres-
54, 1692-1697, doi: 10.2337/diabetes.54.6.1692.
БИОХИМИЯ том 87 вып. 9 2022
МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ В СКЕЛЕТНОЙ МЫШЦЕ ПРИ СД2Т
1275
63.
Hojlund, K., Staehr, P., Hansen, B. F., Green, K. A.,
tion of markers for diabetes, Cell Rep., 11, 921-933,
Hardie, D. G., et al. (2003) Increased phosphorylation
doi: 10.1016/j.celrep.2015.04.010.
of skeletal muscle glycogen synthase at NH2-terminal
75.
Scott, L. J., Erdos, M. R., Huyghe, J. R., Welch, R.
sites during physiological hyperinsulinemia in type
P., Beck, A. T., et al. (2016) The genetic regulatory
2 diabetes, Diabetes, 52, 1393-1402, doi: 10.2337/
signature of type 2 diabetes in human skeletal muscle,
diabetes.52.6.1393.
Nat. Commun., 7, 11764, doi: 10.1038/ncomms11764.
64.
Beeson, M., Sajan, M. P., Dizon, M., Grebenev, D.,
76.
Wu, C., Xu, G., Tsai, S. A., Freed, W. J., and Lee,
Gomez-Daspet, J., et al. (2003) Activation of pro-
C. T. (2017) Transcriptional profiles of type 2 diabetes
tein kinase C-zeta by insulin and phosphatidylinosi-
in human skeletal muscle reveal insulin resistance,
tol-3,4,5-(PO4)3 is defective in muscle in type 2 di-
metabolic defects, apoptosis, and molecular signatures
abetes and impaired glucose tolerance: amelioration
of immune activation in response to infections,
by rosiglitazone and exercise, Diabetes, 52, 1926-1934,
Biochem. Biophys. Res. Commun.,
482,
282-288,
doi: 10.2337/diabetes.52.8.1926.
doi: 10.1016/j.bbrc.2016.11.055.
65.
Karlsson, H. K. R., Kasahara, A., Ikeda, M.,
77.
Timmons, J. A., Atherton, P. J., Larsson, O., Sood, S.,
Chibalin, A. V., Harada, J., et al. (2021) Quantitative
Blokhin, I. O., et al. (2018) A coding and non-coding
phosphoproteomic analysis of IRS1 in skeletal muscle
transcriptomic perspective on the genomics of human
from men with normal glucose tolerance or type 2
metabolic disease, Nucleic Acids Res., 46, 7772-7792,
diabetes: A case-control study, Metabolism,
118,
doi: 10.1093/nar/gky570.
154726, doi: 10.1016/j.metabol.2021.154726.
78.
Chaudhuri, R., Khoo, P. S., Tonks, K., Junutula, J.
66.
Langlais, P., Yi, Z., Finlayson, J., Luo, M., Mapes, R.,
R., Kolumam, G., et al. (2015) Cross-species gene
De Filippis, E., et al. (2011) Global IRS-1 phosphor-
expression analysis identifies a novel set of genes
ylation analysis in insulin resistance, Diabetologia, 54,
implicated in human insulin sensitivity, NPJ Syst. Biol.
2878-2889, doi: 10.1007/s00125-011-2271-9.
Appl., 1, 15010, doi: 10.1038/npjsba.2015.10.
67.
Sun, Y. N., Huang, J. Q., Chen, Z. Z., Du, M.,
79.
Caballero, B., Finer, N., and Wurtman, R. J.
Ren, F. Z., et al. (2020) Amyotrophy induced by
(1988) Plasma amino acids and insulin levels
a high-fat diet is closely related to inflammation
in obesity: response to carbohydrate intake and
and protein degradation determined by quantitative
tryptophan supplements, Metabolism, 37, 672-676,
phosphoproteomic analysis in skeletal muscle of
doi: 10.1016/0026-0495(88)90089-3.
C57BL/6 J mice, J. Nutr., 150, 294-302, doi: 10.1093/
80.
Cen, H. H., Hussein, B., Botezelli, J. D., Wang,
jn/nxz236.
S., Zhang, J. A., et al. (2022) Human and mouse
68.
Roach, P. J., Depaoli-Roach, A. A., Hurley, T.
muscle transcriptomic analyses identify insulin
D., and Tagliabracci, V. S. (2012) Glycogen and its
receptor mRNA downregulation in hyperinsulinemia-
metabolism: some new developments and old themes,
associated insulin resistance, FASEB J., 36, e22088,
Biochem. J., 441, 763-787, doi: 10.1042/BJ20111416.
doi: 10.1096/fj.202100497RR.
69.
Meyer, M. M., Levin, K., Grimmsmann, T.,
81.
Hansen, L., Gaster, M., Oakeley, E. J., Brusgaard, K.,
Beck-Nielsen, H., and Klein, H. H. (2002) Insulin
Damsgaard Nielsen, E. M., et al. (2004) Expression
signalling in skeletal muscle of subjects with or with-
profiling of insulin action in human myotubes:
out Type II-diabetes and first degree relatives of pa-
induction of inflammatory and pro-angiogenic
tients with the disease, Diabetologia, 45, 813-822,
pathways in relationship with glycogen synthesis and
doi: 10.1007/s00125-002-0830-9.
type 2 diabetes, Biochem. Biophys. Res. Commun., 323,
70.
Needham, E. J., Hingst, J. R., Parker, B. L., Mor-
685-695, doi: 10.1016/j.bbrc.2004.08.146.
rison, K. R., Yang, G., et al. (2022) Personalized
82.
Arner, E., Daub, C. O., Vitting-Seerup, K.,
phosphoproteomics identifies functional signal-
Andersson, R., Lilje, B., et al. (2015) Transcribed
ing, Nat. Biotechnol.,
40,
576-584, doi:
10.1038/
enhancers lead waves of coordinated transcription in
s41587-021-01099-9.
transitioning mammalian cells, Science, 347, 1010-
71.
Haywood, N. J., Slater, T. A., Matthews, C. J., and
1014, doi: 10.1126/science.1259418.
Wheatcroft, S. B. (2019) The insulin like growth factor
83.
Coletta, D. K., Balas, B., Chavez, A. O., Baig,
and binding protein family: Novel therapeutic targets
M., Abdul-Ghani, M., et al. (2008) Effect of acute
in obesity & diabetes, Mol. Metab., 19, 86-96, doi:
physiological hyperinsulinemia on gene expression
10.1016/j.molmet.2018.10.008.
in human skeletal muscle in vivo, Am. J. Physiol.
72.
Belfiore, A., Frasca, F., Pandini, G., Sciacca, L., and
Endocrinol. Metab.,
294, E910-917, doi:
10.1152/
Vigneri, R. (2009) Insulin receptor isoforms and insu-
ajpendo.00607.2007.
lin receptor/insulin-like growth factor receptor hybrids
84.
Rome, S., Clement, K., Rabasa-Lhoret, R., Loizon,
in physiology and disease, Endocr. Rev., 30, 586-623,
E., Poitou, C., et al. (2003) Microarray profiling of
doi: 10.1210/er.2008-0047.
human skeletal muscle reveals that insulin regulates
73.
Hakuno, F., and Takahashi, S. I. (2018) IGF1 receptor
approximately 800 genes during a hyperinsulinemic
signaling pathways, J. Mol. Endocrinol., 61, T69-T86,
clamp, J. Biol. Chem., 278, 18063-18068, doi: 10.1074/
doi: 10.1530/JME-17-0311.
jbc.M300293200.
74.
Varemo, L., Scheele, C., Broholm, C., Mardino-
85.
Wu, X., Wang, J., Cui, X., Maianu, L., Rhees, B., et al.
glu, A., Kampf, C., et al. (2015) Proteome- and
(2007) The effect of insulin on expression of genes
transcriptome-driven reconstruction of the human
and biochemical pathways in human skeletal muscle,
myocyte metabolic network and its use for identifica-
Endocrine, 31, 5-17, doi: 10.1007/s12020-007-0007-x.
БИОХИМИЯ том 87 вып. 9 2022
8*
1276
ВОРОТНИКОВ и др.
86. Rudkowska, I., Jacques, H., Weisnagel, S. J., Marette,
lective responses to induced and basal insulin across
A., and Vohl, M. C. (2013) Transcriptomic profiles of
signaling, transcriptional, and metabolic networks,
skeletal muscle tissue following an euglycemic-hyper-
iScience, 7, 212-229, doi: 10.1016/j.isci.2018.07.022.
insulinemic clamp in insulin-resistant obese subjects,
89. Terakawa, A., Hu, Y., Kokaji, T., Yugi, K., Morita, K.,
Genes Nutr., 8, 91-98, doi: 10.1007/s12263-012-0298-2.
et al. (2022) Trans-omics analysis of insulin action reveals
87. Sears, D. D., Hsiao, G., Hsiao, A., Yu, J. G., Court-
a cell growth subnetwork which co-regulates anabolic
ney, C. H., Ofrecio, J. M., et al. (2009) Mechanisms of
processes, iScience, 25, doi: 10.1016/j.isci.2022.104231.
human insulin resistance and thiazolidinedione-medi-
90. Matsuzaki, F., Uda, S., Yamauchi, Y., Matsumoto,
ated insulin sensitization, Proc. Natl. Acad. Sci. USA,
M., Soga, T., et al. (2021) An extensive and dynamic
106, 18745-18750, doi: 10.1073/pnas.0903032106.
trans-omic network illustrating prominent regulato-
88. Kawata, K., Hatano, A., Yugi, K., Kubota, H.,
ry mechanisms in response to insulin in the liver, Cell
Sano, T., et al. (2018) Trans-omic analysis reveals se-
Rep., 36, 109569, doi: 10.1016/j.celrep.2021.109569.
SIGNALING AND GENE EXPRESSION IN SKELETAL MUSCLE IN TYPE 2
DIABETES: CURRENT RESULTS AND OMICS PERSPECTIVES
Review
A. V. Vorotnikov1,2*, D. V. Popov1,3*, and P. A. Makhnovskii1
1 Institute of Biomedical Problems, Russian Academy of Sciences,
123007 Moscow, Russia; E-mail: a.vorotnikov@icloud.com; danil-popov@yandex.ru
2 National Medical Research Center of Cardiology, Ministry of Healthcare of the Russian Federation,
121552 Moscow, Russia
3 Faculty of Fundamental Medicine, Lomonosov Moscow State University, 119991 Moscow, Russia
Skeletal muscles primarily contribute to insulin resistance, decreased glucose utilization from the bloodstream
and development of type 2 diabetes. Molecular mechanisms that regulate glucose uptake are diverse, including
insulin-dependent as the major, but not the only ones. They involve a large range of proteins that control
intracellular traffic and exposure of glucose transporters on the cell surface to create an extensive regulatory
network. Here, we highlight the advantage of omics approaches for identification of insulin-regulated proteins
and genes in human skeletal muscle with varying degrees of metabolic disorders. We discuss methodological
aspects of the assessment of metabolic disorders and molecular responses of human skeletal muscle to insulin.
The known molecular mechanisms of glucose uptake regulation and the first results of phosphoproteomic and
transcriptomic studies are analyzed, which unveiled a large-scale array of insulin targets in muscle cells. They
demonstrate that a clear depiction of the changes that occur during metabolic dysfunction requires systemic
and combined analysis of the events at different levels of regulation, including signaling pathways, transcription
factors, and gene expression. Such an analysis lends perspectives to identify previously undescribed regulatory
mechanisms of glucose uptake by skeletal muscle and key regulators as the potential therapeutic targets.
Keywords: skeletal muscle, insulin resistance, insulin signaling, AMPK, glucose uptake, phosphoproteome,
transcriptome, type 2 diabetes
БИОХИМИЯ том 87 вып. 9 2022