БИОХИМИЯ, 2022, том 87, вып. 9, с. 1301 - 1317
УДК 576.315.42
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
В ХОДЕ ЭВОЛЮЦИИ ПОЗВОНОЧНЫХ -
СЛУЧАЙНОСТЬ ИЛИ ЗАКОНОМЕРНОСТЬ?
Обзор
© 2022 О.В. Яровая1*, С.В. Ульянов1,2, Е.С. Юдинкова1, С.В. Разин1,2
1 Институт биологии гена РАН,
119334 Москва, Россия; электронная почта: iarovaia@inbox.ru
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119234 Москва, Россия
Поступила в редакцию 22.07.2022
После доработки 18.08.2022
Принята к публикации 19.08.2022
Обзор посвящен закономерностям эволюции доменов α- и β-глобиновых генов. Впервые представле-
на гипотеза, в соответствии с которой сегрегация предкового кластера α/β-глобиновых генов Amniota
закономерна и обусловлена выполнением α-глобинами и β-глобинами неканонических функций, не
связанных с транспортом кислорода.
КЛЮЧЕВЫЕ СЛОВА: эволюция α- и β-глобиновых генов, регуляция транскрипции, неканонические
функции α- и β-глобинов.
DOI: 10.31857/S0320972522090093, EDN: BBEVGH
ВВЕДЕНИЕ
α-глобиновых и β-глобиновых генов с тем, что-
бы в эритроцитах количество α-глобиновых це-
У позвоночных животных транспорт кисло-
пей и β-глобиновых цепей было примерно оди-
рода от органов дыхания к потребляющим кис-
наковым. Избыток α- или β-глобиновых цепей,
лород тканям обеспечивается гемоглобином.
ассоциированный с генетическими заболева-
Молекула гемоглобина состоит из двух поли-
ниями, приводит к образованию нестабиль-
пептидных цепей α-типа и двух полипептидных
ных полипептидных агрегатов из избыточных
цепей β-типа, каждая из которых связана с про-
белков, нарушающих нормальное функциони-
стетической группой - железосодержащим ге-
рование эритроцитов, их разрушению и ане-
мом. Гены, кодирующие α- и β-глобины тепло-
мии [9-11]. Представляется очевидным, что
кровных, - классический модельный объект
проще всего координированная сбалансиро-
молекулярной биологии. Структура кластеров
ванная эквимолярная экспрессия достигает-
α- и β-глобиновых генов, механизмы регуля-
ся, когда α- и β-глобиновые гены соседствуют
ции их транскрипции в эритроидных клетках
в составе единого локуса, транскрибируются с
и эволюция изучены очень основательно [1-8].
общего промотора и/или используют общий
Структура молекулы гемоглобина предполага-
энхансер. Именно такую структуру, вероятнее
ет необходимость эквимолярной экспрессии всего, имел предковый локус, в котором α- и
β-глобиновые гены, предположительно, лока-
Принятые сокращения: CTC - циркулирующие опу-
лизовались в непосредственной близости друг
холевые клетки; KLF1 и KLF4 - транскрипционные фак-
от друга и находились в составе общего регуля-
торы, регулирующие транскрипцию α- и β-глобиновых
генов; LCR - область контроля локуса, эритроид-специ-
торного домена [12].
фичный суперэнхансер; MRE - главный регуляторный
Предковые α- и β-глобиновые гены про-
элемент локуса α-глобиновых генов, эритроид-специ-
изошли в результате дупликации прото-глоби-
фичный энхансер; RIG-1 - рецептор распознавания па-
тогенов; RNS - активные формы азота; ROS - активные
нового гена у общего предка челюстноротых и
формы кислорода.
сохранили соседство после дивергенции. Тес-
* Адресат для корреспонденции.
ное соседство α- и β-глобиновых генов и ко-
1301
1
302
ЯРОВАЯ и др.
ординированная экспрессия в составе общего
не только возможным, но и необходимым се-
кластера сохранились в геномах современных
грегацию α- и β-глобиновых генов и их незави-
рыб и земноводных. Однако, наряду со слитым
симую экспрессию. Можно предположить, что
доменом α/β-глобиновых генов, у некоторых
потери в результате произошедшей сегрегации
групп земноводных в геноме присутствуют се-
оказались не очень существенными. Корегуля-
грегированные глобиновые гены. У рептилий,
ция изолированных α- и β-глобиновых генов
птиц и плацентарных млекопитающих α- и
в эритроидных клетках - по всей видимости,
β-глобиновые гены сегрегированы полностью
задача легко разрешимая в силу того, что уро-
и располагаются на разных хромосомах. Транс-
вень экспрессии глобиновых генов выведен на
позиция предкового гена β-глобина разруши-
максимальное значение, и весь метаболический
ла стройную и простую систему, обеспечива-
потенциал эритробласта используется для до-
ющую координированную экспрессию α- и
стижения одной цели - синтеза максимально
β-глобиновых генов, и обусловила появление
возможного количества гемоглобина. Возмож-
независимых систем регуляции транскрипции
ные приобретения, возникшие после сегрега-
доменов α- и β-глобиновых генов. На первый
ции, очень значительны. Одним из таких при-
взгляд, событие сегрегации, разрушающее сло-
обретений является возможность независимого
жившийся регуляторный контекст, контрпро-
участия только α- или только β-глобинов в фор-
дуктивно, биологического смысла не имеет и не
мировании надмолекулярных комплексов, от-
должно было закрепиться в эволюции. Пред-
личных от гемоглобина. Тогда сегрегация ге-
ставляется очевидным, что отбор должен быть
нов неслучайна, имеет биологический смысл и
направлен в сторону сохранения соседства и
должна закрепиться в эволюции.
общих регуляторных механизмов для генов, ко-
Гипотеза о закономерном характере сегре-
дирующих субъединицы одного белка. Однако
гации α- и β-глобиновых генов в ходе эволюции
давление естественного отбора в направлении
позвоночных представлена в научной литерату-
сегрегации очевидно обеспечивало возмож-
ре впервые.
ные эволюционные преимущества, окупающие
«потери», сопровождающие разрушение ре-
гуляторного контекста предкового кластера
ЭВОЛЮЦИЯ ГЛОБИНОВ, КОДИРУЮЩИХ
α/β-глобиновых генов. Результатом сегрегации
ИХ ГЕНОВ И РЕГУЛЯТОРНЫХ СИСТЕМ
предкового кластера могла стать возможность
независимой экспрессии α- и β-глобиновых
По общему мнению, глобиновые гены по-
генов в неэритроидных тканях. Можно осто-
явились в геноме эукариот одновременно с
рожно предположить, что первые попытки
митохондриями и пластидами в результате пе-
сегрегации α- и β-глобиновых генов совпали
реноса генов, а возможно, и поглощения или
по времени с выходом на сушу общего предка
слияния геномов. Вероятнее всего, функция-
Tetrapoda и окончательно закрепились в гено-
ми предковых глобинов были ферментативная,
мах Amniota вследствие полной утраты связи с
сигнальная и защитная [13], так как для древ-
водной средой обитания.
них анаэробных организмов кислород, вероят-
Выход на сушу был огромным эволюцион-
нее всего, был токсичен. Анализ экзон-интрон-
ным скачком. Изменение среды обитания по-
ной структуры глобинов позволяет утверждать,
требовало решения многих, возникших в связи
что почти все эукариотические глобины про-
с этим, проблем развития новых физиологиче-
изошли от одного предка. Весь репертуар гло-
ских функций, систем органов и адаптивных
биновых генов современных позвоночных
механизмов. Возможно, приобретение новых
обязан своим появлением нескольким циклам
функций у общего предка наземных животных
полногеномных дупликаций и ряду сегментных
сопровождалось
«плейотропизацией» генов
дупликаций в ходе эволюции с последующей
и кодируемых ими полипептидов, причем не
cуб- и неофункционализацией. Полногеном-
только регуляторных и сигнальных, но и части
ные дупликации предоставили широкие воз-
структурных белков; и именно в этом направ-
можности для быстрой специализации дочер-
лении шел отбор. Мы предполагаем, что неза-
них форм и функциональной диверсификации
висимо экспрессирующиеся α- и β-глобины у
белков, кодируемых паралогичными генами.
первых обитателей суши были приспособлены
В геномах современных позвоночных
для выполнения неких особых функций, воз-
присутствует несколько групп глобиновых ге-
можно, ассоциированных с решением проблем,
нов, кодирующих нейроглобин (Ngb), цито-
возникших в связи с расширением среды оби-
глобин (Cygb), андроглобин (Adgb), гемогло-
тания и прямо не связанных с эритроцитарным
бин (Hb), миоглобин (Mb), а также менее
транспортом кислорода. Именно это сделало
распространенные глобины X, Y и E (GbX, GbY
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1303
и GbE) [14-16]. Основными функциями этих
турой главного локуса α/β-глобиновых генов
глобинов являются запасание кислорода в тка-
современных рыб. В составе домена присут-
нях, а также защита от оксидативного стрес-
ствуют как α-, так и β-глобиновые гены [23].
са. В результате двух раундов полногеномных
Ближайшее эволюционно консервативное
дупликаций и последующей неофункционали-
окружение слитого домена обеспечивает ре-
зации появились глобины, приспособленные
гуляторный контекст, который остается акту-
к запасанию кислорода в клетках разного типа
альным на протяжении всей эволюционной
(Mb, Cygb, GbE) [17]. Далее в ходе эволюции
истории позвоночных и сохраняется в гено-
возникла возможность физиологического раз-
ме Tetrapoda (рис. 1). С одной стороны, локус
деления труда между функциями запасания
фланкирован тремя генами домашнего хозяй-
и транспорта кислорода; появились предше-
ства (RHBDF, MPG и NPRL3), и в одном из этих
ственники α-глобинов и β-глобинов челюст-
генов (NPRL3) расположен эритроид-специ-
норотых и гемоглобины бесчелюстных [18],
фичный энхансер (который у млекопитающих
приспособленные к транспорту кислорода от
обладает характерными чертами суперэнхан-
органов дыхания к тканям, что дало неоцени-
сера), контролирующий транскрипцию гло-
мые эволюционные преимущества позвоноч-
биновых генов. Необходимо отметить, что в
ным животным [19]. Уникальная способность
ходе эволюции костистых рыб произошла те-
гемоглобина транспортировать кислород из
леост-специфическая полногеномная дупли-
органов дыхания по всему организму обуслов-
кация. В результате локус α/β-глобиновых ге-
лена его способностью эффективно захва-
нов дуплицировался, и в геномах современных
тывать кислород в легких или жабрах и легко
костистых рыб чередующиеся α- и β-глобино-
высвобождать в тканях. Оптимизация транс-
вые гены располагаются на двух хромосомах в
портных функций требовала усложнения моле-
главном и минорном локусах. Минорный локус
кулы-транспортера кислорода. Современный
глобиновых генов синтенен главному, однако
гемоглобин обязан своим появлением несколь-
из трех фланкирующих генов домашнего хозяй-
ким событиям: дупликации прото-глобинового
ства в нем присутствует только один - RHBDF.
гена, точечным мутациям в составе дочерних
В минорном локусе Danio rerio картирован эри-
паралогов и дальнейшей дифференцировке α-
троид-специфичный энхансер, но его проис-
и β-глобиновых генов [19]. Дупликация про-
хождение и эволюционные взаимоотношения с
то-глобинового гена произошла 450-500 млн
энхансером главного локуса остаются невыяс-
лет назад у общего предка современных позво-
ненными [24].
ночных [19, 20]. С использованием статистиче-
Характерное для рыб соседство и геном-
ских и биохимических методов для реконструк-
ный контекст α- и β-глобиновых генов в со-
ции и экспериментальной характеристики
ставе единого кластера отчасти сохраняется и у
древних белков были восстановлены мутации,
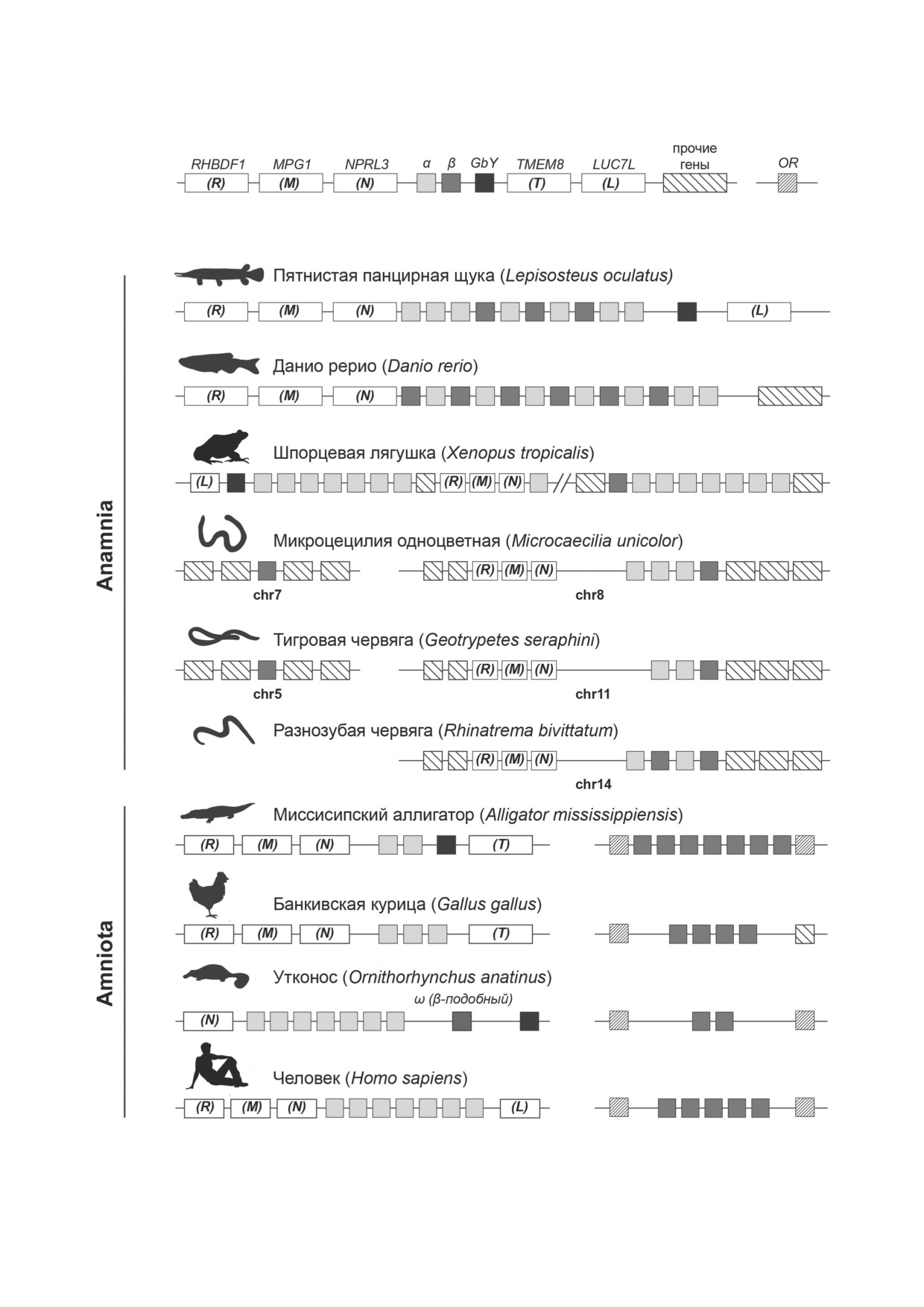
земноводных (рис. 1) [25-27]. Предполагается,
которые привели к появлению около 400 млн
что у общего предка амфибий предковый локус
лет назад тетрамерного гемоглобина. Всего две
имел следующую конфигурацию: 5′-RHBDF1-
постдупликационные замены на поверхности
MPG1-NPRL3-αE-αA-βT-βA-GbY-LUC7L-3′.
глобулы реконструированного предкового гло-
Ген GBY присутствует в геномах современных
бина привели к появлению глобинов α-типа и
костистых рыб, шпорцевой лягушки, некото-
β-типа и обеспечили возможность его тетраме-
рых пресмыкающихся и утконоса [28, 29]. Его
ризации [21]. Появление сложной тетрамерной
физиологическая роль на настоящий момент
структуры гемоглобина современных позво-
изучена мало. В ходе эволюции земноводных
ночных сделало возможным кооперативное
синтения в левой части кластера сохранилась,
связывание и высвобождение кислорода, а так-
противоположный конец подвергся перестрой-
же аллостерическую регуляцию этого процесса,
кам, в результате чего возникли два локуса.
невозможную у древних мономерных или гомо-
Один локус содержал и α- и β-глобиновые гены
димерных транспортеров кислорода [22].
(5′-NPRL3-αE-αA-βT-3′), а другой
- ген(ы)
Сравнение организации, геномной лока-
β-глобина и ген глобина Y, GBY (5′-LUC7L-
лизации и механизмов регуляции экспрессии
GbY-βA-3′). Таким образом, в результате пере-
глобиновых генов у филогенетически удален-
стройки предкового локуса у нескольких групп
ных организмов может предоставить важные
земноводных появляется сегрегированный ген
данные о закономерностях их эволюции, в том
β-глобина, причем у некоторых систематиче-
числе о механизмах и последствиях сегрегации
ских групп слитый α/β-глобиновый домен и
α- и β-глобиновых доменов. Предполагается,
сегрегированный ген β-глобина располагают-
что геномный контекст и структура постдупли-
ся на разных хромосомах. Анализ геномного
кационного предкового локуса схожа со струк-
окружения этого сегрегированного β-глобина
БИОХИМИЯ том 87 вып. 9 2022
1304
ЯРОВАЯ и др.
Рис. 1. Организация и геномное окружение слитых и сегрегированных генов гемоглобина позвоночных (с акцентом
на геномах земноводных). Верхняя панель - названия генов
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1305
позволяет предположить, что события транспо-
утраты α-глобиновых генов или в результате
зиции части кластера происходили в эволюции
транспозиции β-глобинового гена с соседствую-
несколько раз и независимо у разных таксоно-
щим регуляторным элементом или только
мических групп земноводных. Было бы очень
β-глобиновых генов на другую хромосому [29].
заманчиво предположить, что α- и β-глобино-
В результате этой перестройки была разрушена
вые гены в составе сегрегированных кластеров
связь глобиновых генов с геном NPRL3, в со-
дифференциально экспрессируются на разных
ставе которого находится энхансер глобиновых
стадиях индивидуального развития и именно
генов рыб и, предположительно, земноводных.
сегрегация обеспечила их независимую стадие-
Новое геномное окружение потребовало появ-
специфическую экспрессию, однако систе-
ления нового регуляторного контекста, в том
матические данные о стадиеспецифическом
числе новых регуляторных элементов.
характере экспрессии β-глобиновых генов в
составе слитого или сегрегированного локуса у
земноводных отсутствуют.
ОРГАНИЗАЦИЯ СЛИТЫХ
У общего предка Amniota происходит важ-
И СЕГРЕГИРОВАННЫХ ЛОКУСОВ
ное событие, существенно изменившее ге-
α/β-ГЛОБИНОВЫХ ГЕНОВ
номный контекст и механизмы регуляции
У СОВРЕМЕННЫХ ПОЗВОНОЧНЫХ
α- и β-глобиновых генов - окончательная се-
грегация α- и β-глобиновых генов. Если у рыб
Анализу особенностей организации и ме-
и земноводных по крайней мере часть α- и
ханизмов регуляции экспрессии α- и β-глоби-
β-глобиновых генов колокализованы в едином
новых генов посвящено огромное количество
кластере, то у подавляющего большинства со-
экспериментальных статей и обзоров [2, 8, 37].
временных рептилий, птиц и млекопитающих
Поэтому мы остановимся на этом вопросе очень
α- и β-глобиновые гены располагаются на раз-
коротко. У костистых рыб α- и β-глобиновые
ных хромосомах [4].
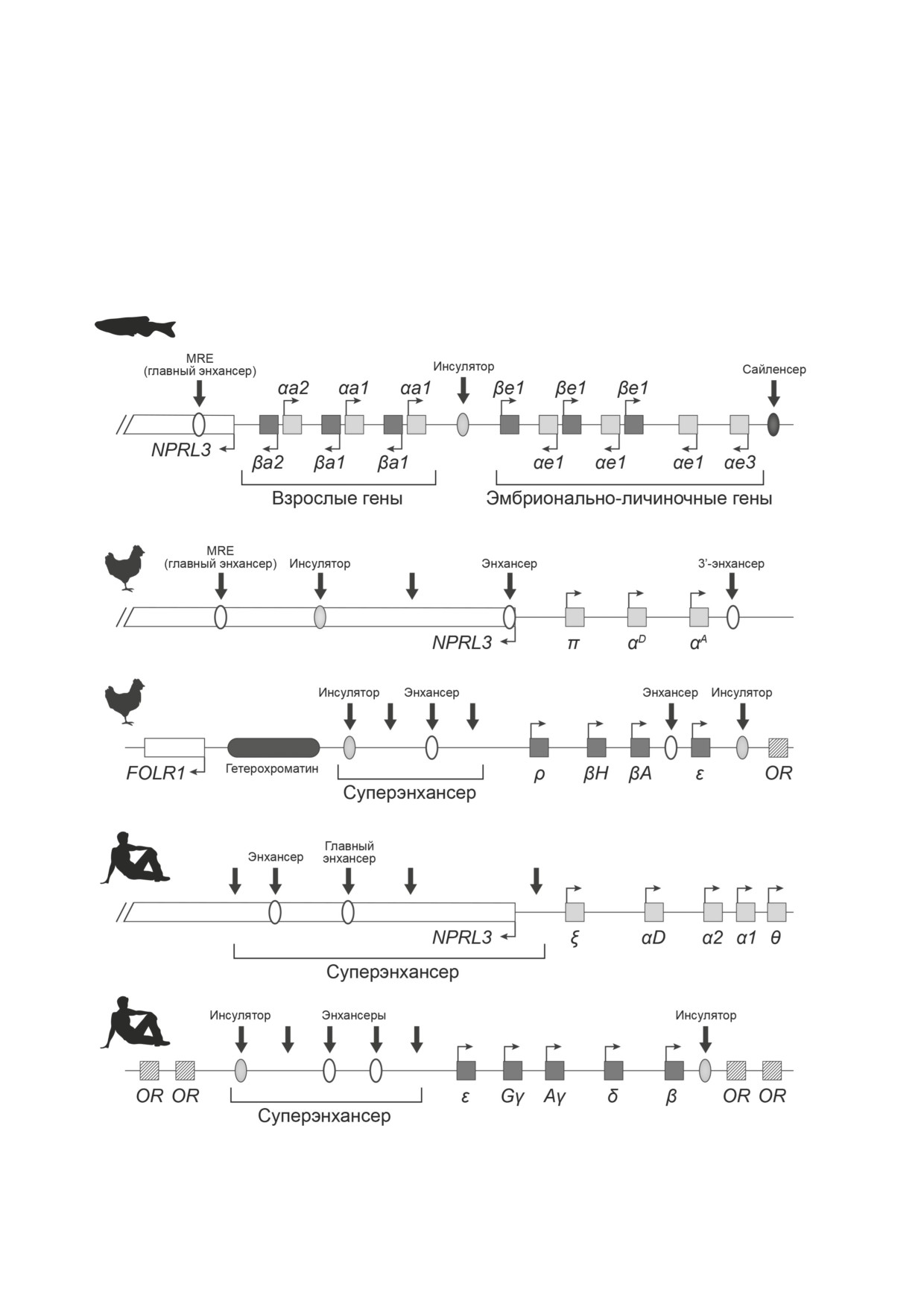
гены расположены в двух синтенных кластерах,
Геномное окружение α-глобиновых генов
расположенных на разных хромосомах, в глав-
эволюционно очень консервативно. Практи-
ном и минорном локусах, которые являются
чески у всех птиц и млекопитающих сохраня-
продуктами полногеномной телеост-специфи-
ется соседство кластера глобиновых генов с
ческой дупликации [23]. В главном локусе гло-
генами NPRL3, MPG1 и RHBDF1, характерное
биновых генов Danio rerio (который близок по
для главного локуса глобиновых генов рыб [30].
своей структуре к предковому) располагаются
В геномах завропсид произошла инверсия на
13 α- и β-глобиновых генов, транскрибирующихся
3′-конце локуса [4], благодаря чему ген TMEM8
в противоположных направлениях (рис. 2). Ло-
оказался сближен с глобиновыми генами и, по
кус разделен на два стадиеспецифичных субдо-
крайней мере у птиц, вовлечен в регуляторную
мена, содержащих гены, транскрибирующиеся
сеть глобиновых генов и приобрел эритро-
на взрослой и эмбрионально-личиночной ста-
ид-специфичный характер экспрессии [31, 32].
диях развития. Взрослые гены находятся под
Гены MPG1 и RHBDF1 у пресмыкающихся не
контролем общего удаленного эритроид-специ-
являются обязательной частью синтении, од-
фичного энхансера (MRE), который располо-
нако, возможно, их отсутствие связано с недо-
жен во фланкирующем кластер гене NPRL3.
статками картирования.
Эмбрионально-личиночные гены, предположи-
Древняя ассоциация α-глобиновых генов и
тельно, общего энхансера не имеют. Репрессия
родственного β-глобину орфанного ω-глоби-
эмбрионально-личиночных генов во взрослых
нового гена в составе общего кластера - свое-
эритроцитах, вероятнее всего, обеспечивается
образный генетический атавизм - сохраняется
сайленсером, расположенным в конце класте-
только у однопроходных и сумчатых млекопи-
ра. Стадиеспецифические субдомены разделе-
тающих (рис. 1) [29, 33-35]. У Amniota после
ны CTCF-зависимым инсулятором, обеспечи-
окончательной сегрегации локусы α- и β-глоби-
вающим изоляцию эмбрионально-личиночных
новых генов оказались на разных хромосомах.
генов от энхансера MRE, направляющего экс-
В геномах млекопитающих и у части пресмыкаю-
прессию генов взрослого субдомена [38]. В ре-
щихся β-глобиновые гены находятся в окру-
зультате сегрегации и транспозиции всего
жении или фланкированы многочисленными
предкового локуса или его части и последущей
генами одорантных рецепторов, которые экс-
независимой эволюции в синтенном предково-
прессируются в обонятельных нейронах [36].
му кластере остались исключительно α-глоби-
Сегрегация β-глобиновых генов могла произой-
новые гены, β-глобиновые гены переместились
ти в результате дупликации [35] или транспози-
у общего предка Amniota на другую хромосо-
ции целого предкового домена и последующей
му. Локус α-глобиновых генов теплокровных
10
БИОХИМИЯ том 87 вып. 9 2022
1306
ЯРОВАЯ и др.
содержит несколько генов, которые являются
дит в состав протяженного суперэнхансера [39].
продуктами дупликаций и кодируют разные
Регуляторная оснастка домена α-глобиновых
изоформы α-глобина, в том числе экспрессирую-
генов птиц устроена несколько более слож-
щиеся на разных стадиях онтогенеза. Главный
но. Помимо MRE, в регуляции транскрипции
эритроид-специфичный энхансер и у птиц, и у
α-глобиновых генов Gallus gallus принимают
млекопитающих, так же, как и у рыб, находит-
участие два дополнительных энхансера, один
ся в интроне гена NPRL3. У человека и мыши
из которых фланкирует локус и, предположи-
вместе с дополнительным энхансером, который
тельно, обеспечивает экспрессию эмбриональ-
также расположен в интроне NPRL3, MRE вхо-
ного α-глобинового гена [40]. Помимо этого,
Рис. 2. Организация кластеров α- и β-глобиновых генов и их регуляторных элементов у разных видов позвоночных.
Черными стрелками обозначены участки, гиперчувствительные к ДНКазе I, овалами - регуляторные элементы, прямо-
угольниками - транскрипционные единицы
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1307
в регуляторную сеть эритроид-специфичных
Сегрегация α- и β-глобиновых генов у об-
регуляторных элементов оказался вовлечен
щего предка Amniota сопровождалась появ-
эритроидный энхансер гена TMEM8, который
лением и быстрой эволюцией нового сложно
фланкирует домен с 3′-конца и очутился там в
устроенного многофункционального регуля-
результате инверсии небольшого участка, специ-
торного элемента - LCR. Присутствие инсуля-
фичной для завропсид [31, 32]. Таким обра-
тора в составе LCR можно объяснить наличием
зом, регуляторный контекст главного локуса
некого прото-инсулятора в составе транслоци-
α/β-глобиновых генов рыб и локусов α-глоби-
рованной на другую хромосому части домена
новых генов теплокровных, различаясь в ассор-
либо «удачным приземлением» транслоциро-
тименте регуляторных элементов, остается в
ванного сегмента в область, уже защищенную
части наличия главного энхансера (MRE) очень
инсуляторами. Последнее маловероятно; при
консервативным на протяжении всей эволю-
любых обстоятельствах при отсутствии такого
ции позвоночных. Более того, MRE-подобный
изолирующего элемента трудно себе предста-
энхансер, расположенный в одном из интро-
вить механизмы сохранения эритроид-специ-
нов NPRL3, картирован в локусе глобиновых
фичного характера экспрессии β-глобина в
генов круглоротых [18]. Глобиновые гены круг-
новой геномной локации и в окружении нейро-
лоротых паралогичны α/β-глобиновым генам
нальных генов. Предположительно, предковый
челюстноротых, но эволюционно гораздо бли-
α/β-глобиновый домен уже был сегрегирован
же гену цитоглобина и, скорее всего, являются
на два или несколько структурно и функцио-
продуктом эволюции общего предка генов ци-
нально независимых субдомена (такое устрой-
тоглобина, α-глобина и β-глобина. Таким обра-
ство кластера и даже присутствие CTCF-зави-
зом, регуляторный контекст глобиновых генов
симого инсулятора мы видим в главном локусе
мог сформироваться раньше дивергенции ци-
глобиновых генов Danio rerio [38]). Вероятнее
тоглобина и гемоглобина, что выглядит доста-
всего, похожая сегрегация предкового локуса
точно парадоксально.
могла быть обусловлена экспрессией диверги-
После транспозиции на другую хромосому
ровавших изоформ гемоглобина (например,
домен β-глобиновых генов оказался фланкиро-
приспособленных к дыханию в водной среде и
ван (у завропсид) или окружен генами обоня-
на суше). Однако достаточных материалов для
тельных рецепторов (у млекопитающих) [12, 36,
анализа этого вопроса с использованием со-
41]. У современных Tetrapoda в составе домена
временных экспериментальных моделей нет.
присутствуют несколько β-глобиновых генов,
Заключая, необходимо еще раз отметить, что
кодирующих разные, в том числе стадиеспеци-
сегрегация и транспозиция части предково-
фические, изоформы гемоглобина. Локус нахо-
го домена на другую хромосому сопровожда-
дится под контролем сложного, протяженного
лась формированием нового, независимого
удаленного регуляторного элемента (LCR) [42-
от предкового, регуляторного контекста пере-
44]. В состав LCR входят энхансеры, сайлен-
мещенного локуса. В то же время регуляция
серы, инсулятор и регуляторы хроматинового
транскрипции α-глобиновых генов, синтенных
статуса и времени репликации β-глобиновых
предковому домену, сохранила эволюционно
генов. У птиц, по сравнению с млекопитающи-
древние особенности, вероятно, присущие об-
ми, в дополнение к LCR картирован еще один
щему предку челюстноротых и бесчелюстных
энхансер, расположенный между глобиновыми
позвоночных [18].
генами [45]. Важным эволюционным приобре-
Филогенетический анализ и анализ син-
тением в ассортименте регуляторных элементов
тений локусов α- и β-глобиновых генов у раз-
β-глобиновых генов после транспозиции яви-
ных таксономических групп позволяет с осто-
лись инсуляторы, изолирующие домен эритро-
рожностью заключить, что сегрегация общего
ид-специфичных β-глобиновых генов от ней-
α/β-глобинового предкового локуса коррели-
рональных генов одорантных рецепторов [6,
ровала с освоением суши общими предками
46-48]. Именно изоляция, присутствие инсуля-
Tetrapoda и окончательным разрывом с водной
торов на границах домена, определяет границы
средой обитания у общего предка Amniota.
хроматиновых доменов и позволяет защитить
Изменение среды обитания сопровождалось,
соседствующие гены от «чужих» энхансеров.
прежде всего, изменениями в физиологии ды-
И в случае α-, и в случае β-глобиновых генов
хания - от жаберного дыхания у рыб к сме-
важным этапом их активации в эритробластах
шанному легочному и кожному дыханию у
является сближение в пространстве ядра и фор-
земноводных и легочному дыханию у Amniota.
мирование контактов между кодирующими
Мы предполагаем, что приобретение новых
единицами и удаленными регуляторными эле-
функций у общего предка наземных живот-
ментами доменов [49-51].
ных, в том числе принципиальные изменения
БИОХИМИЯ том 87 вып. 9 2022
10*
1
308
ЯРОВАЯ и др.
в физиологии дыхания, сопровождалось «пле-
кислорода и углекислого газа гемоглобином не
йотропизацией» α- и β-глобинов и участием их
сопровождаются изменением степени окис-
в формировании альтернативных гемоглобину
ления железа. Однако при определенных ус-
надмолекулярных комплексов в неэритроид-
ловиях железо в составе гемоглобина может
ных клетках. Это, в свою очередь, повлекло за
окисляться или восстанавливаться, и это
собой необходимость независимой экспрессии
свойство обеспечивает возможность участия
α- и β-глобиновых генов и формирования не-
гемоглобина в метаболизме NO и H2S, деток-
зависимых регуляторных механизмов. Именно
сикации ROS и активных форм азота (RNS),
поэтому отбор мог быть направлен в сторону
обеспечении сенсорных функций и участии
сегрегации доменов α- и β-глобиновых генов и
в передаче сигнала [62]. Приобретя возмож-
их регуляторных сетей.
ность эффективного транспорта кислорода,
современный гемоглобин позвоночных со-
хранил эволюционно более древние функции
ФУНКЦИИ ГЕМОГЛОБИНА
глобинов. Так, гем-Fe(II)-O2 способен реа-
В НЕЭРИТРОИДНЫХ ТКАНЯХ
гировать с пероксинитритом с образованием
нитрата и Fe(III). Гем обладает пероксидазной
Есть ли какие-то основания полагать, что
активностью, причем способность гемогло-
у современных амниот возможность незави-
бина утилизировать H2O2 даже выше, чем у
симой экспрессии α- и β-глобиновых генов
ферментативной системы глутатионперокси-
действительно реализуется? Независимая экс-
дазы/глутатионредуктазы [63-65]. В целом ряде
прессия имеет явный биологический смысл в
оригинальных исследований была продемон-
неэритроидных тканях и, возможно, незави-
стрирована важная роль гемоглобина не толь-
симо экспрессирующиеся α- или β-глобины
ко в запасании кислорода, но и в антиокси-
действительно выполняют некие важные функ-
дантной защите неэритроидных клеток, в том
ции, отличные от транспортировки кислоро-
числе нейронов, клеток мезангиального эпите-
да. В этом случае промежуточным логическим
лия и гепатоцитов [66-68]. Не исключено, что
звеном является принципиальная возможность
гемоглобин выполняет роль сенсора энерге-
экспрессии α- и β-глобинов в неэритроидных
тического статуса нейронов и даже принимает
тканях. Действительно, не так давно феномен
участие в регуляции биогенеза рибосом, авто-
неэритроидной экспрессии глобинов был об-
фагии и эпигенетической регуляции экспрес-
наружен как на транскрипционном уровне, так
сии [69, 70]. Гемоглобин может играть важную
и на уровне синтеза белка. При этом синтез ге-
роль в митохондриальном дыхании, предпо-
моглобина в неэритроидных клетках имеет не-
ложительно, взаимодействуя с компонентами
ожиданно распространенный характер, что и
электрон-транспортной цепи митохондрий,
отражено в литературных обзорах [14, 15, 52].
участвуя в регуляции окислительно-восстано-
В целом ряде случаев гемоглобин неэритроид-
вительных реакций и защите митохондриаль-
ных клеток обеспечивает запасание кислорода
ных белков от оксидативного и нитрозативного
в клетке и тем самым отчасти дублирует функ-
стресса [58, 71, 72].
ции миоглобина и цитоглобина. Такое дубли-
В альвеолярных клетках Hb не только обе-
рование особенно актуально для клеток, имею-
спечивает пограничный транспорт кислорода
щих высокую чувствительность к гипоксии или
между воздушной средой и кровью, но и вы-
резко увеличенную потребность в кислороде: в
полняет роль сенсора содержания кислорода и
нейронах разного типа, в клетках эндометрия,
скавенджера ROS и RNS при окислительном и
пигментных клетках ретины [53-59]. Неэри-
нитрозативном стрессе [73, 74]. В условиях ги-
троцитарный гемоглобин способен удержи-
поксии уровень экспресии HIF-2α (транскрип-
вать и секвестрировать кислород в тканях,
ционный фактор, индуцируемый гипоксией)
для которых нормой являются высокогипок-
увеличивается, что, в свою очередь вызывает
сические условия. Так, удержание кислорода
одновременное увеличение синтеза гемоглоби-
гемоглобином в хрусталике имеет протектив-
на и уменьшение синтеза про-сурфактантных
ную роль, т.к. избыток кислорода в хрусталике
белков в альвеолярных клетках. Это обеспечи-
опасен с точки зрения возможного окисления
вает поддержание гомеостаза легочного эпите-
белков и продукции активных форм кислоро-
лия и защиту его от повреждения и отека в ус-
да (ROS) [60, 61].
ловиях гипоксии [75].
Неэритроцитарный гемоглобин может обе-
Гемоглобин экспрессируется в целом ряде
спечивать целый ряд функций, никак не свя-
раковых клеток [76-79], предположительно,
занных с удержанием, запасанием или транс-
обеспечивая их устойчивость к оксидативному
портом кислорода. Связывание и диссоциация
стрессу, в том числе в ходе химиотерапии.
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1309
Свободный гемоглобин и гемоцидины
го из факторов врожденного противовирусного
(биологически активные продукты протеоли-
иммунитета. Также β-глобин индуцирует про-
за Hb) являются сильными антибактериаль-
дукцию ROS, что вызывает убиквитинирование
ными агентами. Экспрессия гемоглобина в ва-
RIG-1 и усиление противовирусного ответа [82,
гинальном и цервикальном эпителии [79-81]
87]. Таким образом, в ходе вирусной инфекции
обеспечивает защиту клеток от бактериальной
β-глобин функционирует независимо от α-гло-
инфекции и воспаления. Продемонстрирова-
бина в качестве плейотропного противовирус-
на важная роль гемоглобина и гемоцидинов в
ного агента и регулятора иммунного ответа.
модуляции имунного ответа [82]. Лизис эри-
Независимая экспрессия α-глобина как
троцитов, ассоциированный с травмами и ря-
на уровне РНК, так и на уровне белка обна-
дом инфекций, ведет к появлению свободного
руживается в синцитиотрофобластах и стро-
гемоглобина в плазме крови. Взаимодействуя
ме плаценты в условиях гипоксии, а также
с патоген-ассоциированными молекулами,
при преэклампсии - патологическом состоя-
Toll-подобными рецепторами, белками тепло-
нии, ассоциированном с дисфункцией пла-
вого шока, гемоглобин стимулирует проинфла-
центы [88]. Выполняет ли α-глобин защитную
маторную экспрессию цитокинов [83-85] и та-
функцию или, напротив, является патологиче-
ким образом выполняет сигнальную функцию.
ским фактором, остается неясным. Накопление
β-глобина было обнаружено в митохондриях
нейронов больных рассеянным склерозом [69,
НЕЗАВИСИМАЯ ЭКСПРЕССИЯ
89]. Возможно, накопление β-глобина являет-
α- И β-ГЛОБИНОВЫХ ГЕНОВ
ся протективным механизмом, защищающим
нейроны от гибели, а не пассивным следствием
Обнаружение экспрессии гемоглобина в
патологического процесса.
неэритроидных клетках позволило предполо-
Продукция минорной формы β-глобина
жить, что α- и β-глобины могут использоваться
была обнаружена в мышиных макрофагах, об-
для выполнения неканонических функций как
работанных липополисахаридом и интерферо-
в виде мономерных белков, так и в составе неге-
ном (т.е. в условиях, моделирующих активацию
моглобиновых надмолекулярных комплексов.
лимфоцитов при встрече с патогеном) [90].
Независимая экспрессия α- и β-глобиновых
Высокий уровень продукции RNS и ROS акти-
генов тем более облегчается их сегрегацией на
вированными макрофагами является важной
разных хромосомах у Amniota, использовани-
составляющей их бактерицидного действия
ем независимых механизмов регуляции тран-
и сопровождается индукцией NO-синтазы,
скрипции и вследствие этого возможностью их
NADPH-оксидазы и ингибированием клеточ-
независимой активации и репрессии. Хочется
ного дыхания. Не исключено, что мономерный
еще раз подчеркнуть, что давление отбора в
β-глобин функционирует в качестве сенсора
направлении закрепления сегрегации может
содержания NO и O2 и запускает механизмы
быть обусловлено именно возможностью и не-
защиты макрофагов от оксидативного стресса,
обходимостью независимой экспрессии α- и
при этом не участвуя прямо в метаболизме NO.
β-глобинов в связи с выполнением α-глобином
Интересно, что индукции экспрессии Hbb-b1
и β-глобином самых неожиданных функций,
в этих условиях не происходит. Возможно, из-
не связанных с транспортом, запасанием или
бирательная индукция объясняется наличием
удержанием кислорода. Обнаружение неза-
разного количества сайтов связывания одного
висимой экспрессии α- и β-глобинов у совре-
из активаторов транскрипции β-глобиновых
менных позвоночных существенно расширило
генов - KLF1. В регуляторных последователь-
наши представления о спектре неканонических
ностях Hbb-b1 присутствуют три таких сайта,
функций α- и β-глобинов.
против одного - в Hbb-b2.
Было обнаружено, что β-глобин является
Экспрессия β-глобина, но не α-глобина,
мощным противовирусным агентом, причем
была обнаружена в циркулирующих опухоле-
его противовирусное действие реализуется с
вых клетках (CTC) [91]. Механизмы выживания
привлечением нескольких независимых меха-
CTC в кровотоке в условиях постоянного окси-
низмов. При инфекции свиней флавивирусом
дативного стресса изучены плохо. В модельной
β-глобин связывает капсидный белок и инги-
системе индукция ROS в культивируемых CTC
бирует репликацию вирусной РНК, что умень-
сопровождалась KLF4-зависимой транскрип-
шает инфекционность вируса [86]. Кроме того,
цией гена β-глобина, причем деплеция β-глоби-
β-глобин индуцирует синтез интерферона по
на существенно увеличивала уровень апоптоза
RIG-зависимому сигнальному пути, т.е. в дан-
в раковых клетках. Предположительно, в CTC
ном случае β-глобин выступает в качестве одно-
β-глобин выполняет роль цитопротектора
БИОХИМИЯ том 87 вып. 9 2022
1310
ЯРОВАЯ и др.
и обеспечивает выживание метастазирующих
что вызывает прерывание сигнального каскада
клеток в условиях постоянного взаимодействия
и последующую вазоконстрикцию. В этом слу-
с имунными клетками и хронического окисли-
чае α-глобин является участником сложного
тельного стресса.
надмолеклярного комплекса, который обеспе-
Помимо способности транспортировать и
чивает передачу сигнала между разными типа-
запасать кислород, гемоглобин сохранил эво-
ми клеток, образующими стенку перифериче-
люционно более древние функции глобинов -
ских артерий. Интересно, что гиперпродукция
сенсорную и сигнальную. В случае тетрамерно-
α-глобина в клетках эндотелия легочных альвео-
го гемоглобина эти функции обеспечиваются,
лярных сосудов ассоциирована с развитием ле-
в частности, его способностью взаимодейство-
гочной гипертензии [98].
вать с NO. NO является одной из наиболее важ-
Таким образом, мономерный α-глобин
ных сигнальных молекул в организме тепло-
входит в состав сложных надмолекулярных
кровных и эффектором редокс-регулируемой
комплексов, отличных от тетрамерного эритро-
передачи сигнала, обусловленной наличием
цитарного гемоглобина. α-Глобин в составе не-
неспаренного электрона. Образование NO свя-
гемоглобинового надмолекулярного комплек-
зано с энзиматической активностью NO-син-
са «вспоминает» эволюционно более древние
таз, нитрат- и нитрит-редуктаз и неэнзимати-
функции, связанные с процессами окисления
ческим восстановлением нитрита. Молекула
и восстановления низкомолекулярных веществ
NO свободно проникает через мембраны син-
и передачи сигналов. Нельзя исключить, что
тезировавшей его клетки, диффундирует через
сходным образом происходит образование
межклеточное пространство и попадает в клет-
комплексов α- или β-глобина с другими ткане-
ки-мишени. В клетках-мишенях NO, будучи
специфичными формами eNOS.
высокореактивным радикалом, легко вступает
К сожалению, молекулярные механизмы
в реакции с другими соединениями и выступает
избирательной активации α-глобиновых генов
в качестве сигнальной молекулы, вызывая мо-
или β-глобиновых генов неясны. Возможно, в
дификации белков, в том числе нитрозилируя
обоих случаях одним из факторов активации
цистеиновые остатки или связываясь с гемом
может быть транскрипционный статус флан-
растворимой гуанилатциклазы и запуская со-
кирующих генов. Возможность избирательной
ответствующие сигнальные пути [92, 93].
активации тесно связана с тем, что механизмы
Особую роль в регуляции тонуса сосудов
репрессии α-глобиновых и β-глобиновых генов
играет экспрессия α-глобина в местах контакта
в неэритроидных тканях существенно различа-
(myoendothelial junction, MEJ) эндотелиальных
ются [99-102]. α-Глобиновые гены находятся в
клеток с миоцитами сосудистой стенки пери-
окружении генов домашнего хозяйства. Нельзя
ферических артерий [94-97]. Эндотелиальная
исключить, что низкоуровневая транскрип-
NO-синтаза (eNOS) обеспечивает присутствие
ция α-глобина может обеспечиваться простым
пула NO в клетках эндотелия. NO свободно
их привлечением к рядом расположенной ак-
диффундирует через MEJ и поглощается клет-
тивно работающей в большинстве типов кле-
ками мышечной стенки сосудов. В этих клетках
ток транскрипционной фабрике. В эритроид-
NO запускает сигнальный каскад, который в ко-
ных клетках такая ассоциация описана [103].
нечном итоге вызывает вазодилатацию, увели-
Уровень транскрипции α-глобиновых генов
чение оксигенации тканей и понижение давле-
в неэритроидных клетках может находиться в
ния. α-Глобин регулирует биодоступность NO
прямой зависимости от уровня транскрипции
посредством редокс-зависимого шаттлинга
окружающих его генов, который, в свою оче-
α-глобина между NO-синтазой и AHSP - специа-
редь, может существенно отличаться в разных
лизированным шапероном, препятствующим
типах клеток. β-Глобин, в отличие от α-гло-
преципитации мономерного α-глобина. В ус-
бина, в неэритроидных тканях гетерохромати-
ловиях гипоксии или ацидоза AHSP секвестри-
низирован и окружен генами одорантных ре-
рует Fe3+ α-глобин в инертном, но стабильном
цепторов, имеющими нейрональный характер
состоянии. Вследствие этого прекращается де-
экспрессии [36]. Активация генов одорантных
градация глобином NO, обеспечивается вазоди-
рецепторов, которая в том числе возможна в
латация и увеличивается оксигенация тканей.
ненейрональных тканях [104], может распро-
Эндотелиальная цитохром b5-редуктаза обеспе-
страняться на соседствующий с ними домен
чивает переход железа из окисленного в восста-
β-глобиновых генов - в основном за счет из-
новленное состояние. Когда железо находится
менения хроматинового статуса всего локуса,
в восстановленном состоянии (Fe2+), eNOS за-
включая гены одорантных рецепторов.
мещает AHSP в комплексе с глобином, синте-
Промоторы и энхансеры α- и β-глобиновых
зированный ею NO деградируется α-глобином,
генов связывают целый ряд общих транскрип-
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1311
ционных факторов, в том числе GATA1, KLF1,
Высокий уровень транскрипции α- и β-гло-
SCL, NF-E2, LMO2, NF-Y и другие [51, 105,
биновых генов в эритроидных клетках обуслов-
106]. Канонические активаторы транскрипции
лен в первую очередь удаленными энхансерами,
глобиновых генов в эритробластах (GATA1,
которые взаимодействуют с индивидуальными
NFE2, KLF1), а также HIF-1α часто обнаружи-
промоторами. Уровень как координированной,
вают в неэритроидных клетках как в норме, так
так и селективной экспрессии глобиновых ге-
и при воздействии разных стимулов (например,
нов в эритробластах и неэритроидных тканях
в условиях гипоксии или в ходе воспалительной
несопоставим. Представляется интересным вы-
реакции) [107-110].
яснить, участвуют ли удаленные энхансеры в
Некоторые универсальные активаторы
регуляции экспрессии глобиновых генов в не-
транскрипции и α- и β-глобиновых генов мо-
эритроидных клетках и связана ли независимая
гут действовать селективно в силу того, что ме-
экспрессия α- и β-глобина с селективным вовле-
ханизмы репрессии α- и β-глобиновых генов
чением энхансеров в регуляцию транскрипции.
в неэритроидных тканях принципиально раз-
личаются. Поэтому конкуренция эпигенети-
ческого сайленсинга с универсальными акти-
ВОЗМОЖНЫЕ ПРИЧИНЫ
вирующими транскрипционными факторами
СЕГРЕГАЦИИ α- И β-ГЛОБИНОВЫХ
может иметь разные последствия для возмож-
ГЕНОВ У ЭВОЛЮЦИОННЫХ
ной селективной экспрессии α-глобиновых и
ПРЕДШЕСТВЕННИКОВ Tetrapoda И Amniota
β-глобиновых генов.
Возможны альтернативные и более специ-
Из приведенных примеров очевидно, что
фические механизмы активации независимой
у современных млекопитащих (а возможно и
экспрессии глобиновых генов. Избирательная
других Tetrapoda) возможна не только неэри-
активация β-глобинового гена может быть свя-
троцитарная экспрессия гемоглобина, но и не-
зана с наличием ARE (ARE-antioxydant response
зависимая экспрессия α- и β-глобиновых генов
elements) в составе β-глобина - регуляторных
в неэритроидных тканях по поводу выполнения
элементов, связывающих активатор транскрип-
ими функций, никак не связанных ни с транс-
ции NRF2 [111]. Продукция NRF2 индуциру-
портом, ни с запасанием, ни с удерживанием
ется в условиях оксидативного стресса [112].
кислорода. Возможно, важным условием неза-
Селективная экспрессия α-глобиновых генов
висимой транскрипции и обусловленным этим
может индуцироваться NF-κB
- фактором
обстоятельством расширения функционала
транскрипции, контролирующим экспрессию
явилась сегрегация эволюционно-древнего
генов иммунного ответа, регуляторов апоптоза
слитого локуса, в котором α- и β-глобиновые
и клеточного цикла [113]. Индукция синтеза тет-
гены корегулировались. Предположительно,
рамерного гемоглобина и cвязывание NF-κB в
сегрегация слитого домена в ходе эволюции
промоторе гена α-глобина были продемонстри-
происходила неоднократно и независимо у от-
рованы при обработке нормальных и трансфор-
дельных систематических групп земноводных,
мированных клеток цервикального эпителия
у общего предка птиц и пресмыкающихся и у
липополисахаридами (LPS)
[81]. Интересно,
млекопитающих. Это позволяет заключить, что
что в эритроидных клетках NF-κB, напротив,
существовали общие условия, которые опре-
является репрессором транскрипции эмбрио-
делили давление отбора в направлении сегре-
нального α-глобина [114]. Таким образом, один
гации. Сегрегация α- и β-глобиновых генов у
и тот же транскрипционный фактор в зависи-
Tetrapoda коррелировала с выходом позвоноч-
мости от типа тканей и регуляторного контекста
ных на сушу. Коренное изменение физиологии
может иметь разнонаправленное действие.
в связи с выходом на сушу потребовало разви-
Уровень экспрессии α-глобина в клетках
тия дополнительных сенсорных возможностей
эндотелия коронарных артерий находится под
и/или сигнальных путей, и именно это обусло-
контролем KLF2 и KLF4, причем KLF4 связы-
вило плейотропизацию протеома и усложне-
вается с промотором α-глобиновых генов [115].
ние многих сложившихся регуляторных сетей.
Дополнительная механическая нагрузка на
С другой стороны, принципиальное изменение
стенки артерий при гипертонии повышает уро-
условий обитания сопровождалось расшире-
вень экспрессии этих транскрипционных фак-
нием ассортимента стрессовых факторов: вы-
торов, в результате увеличивается содержание
нужденными периодами гипоксии и дегидрата-
α-глобина в эндотелии и падает эффективная
ции, расширением диапазона температур среды
концентрация NO. Это вносит свой вклад в
обитания, ультрафиолетовым облучением и пр.
развитие патологического процесса при гипер-
Возможно, защита от оксидативного стресса
тонии [116].
для первых обитателей суши и первых Amniota
БИОХИМИЯ том 87 вып. 9 2022
1312
ЯРОВАЯ и др.
имела первостепенное значение не только из-за
форм кислорода [120]. Антиоксидантная защи-
стрессовых факторов, но также из-за развития
та - только одна из возможных неканонических
принципиально новых форм дыхания - кожно-
функций мономерных α- и β-глобинов. К сожа-
го и легочного, в дополнение или альтернативно
лению, мы можем только догадываться о том,
жаберному. Можно предположить, что вместе
какие конкретно условия изменившейся среды
эти обстоятельства повлекли за собой времен-
обитания потребовали независимой экспрес-
ную (зависящую от стадии жизненного цикла
сии α- и β-глобиновых генов у предковых форм
или климатических условий) и/или локальную
Amniota в связи с их окончательным разрывом с
(зависящую от смены среды обитания) дис-
водной средой.
функцию потребления кислорода как на физио-
логическом, так и на биохимическом уровнях,
гиперпродукцию ROS и RNS, хронический ок-
ЗАКЛЮЧЕНИЕ
сидативный стресс и необходимость привлече-
ния дополнительных механизмов антистрессо-
Сегрегация предкового домена α/β-гло-
вой защиты. В нормальных условиях примерно
биновых генов, которая повторялась неодно-
90% ROS в клетке образуются в митохондриях
кратно в ходе эволюции позвоночных, по всей
из-за утечки 1-2% электронов в дыхательной
видимости, носила закономерный характер.
цепи [117]. Активные формы кислорода пред-
Сегрегация сделала возможной независимую
ставляют собой гетерогенный класс соедине-
экспрессию α- или β-глобиновых генов и была
ний, которые способны окислять все известные
важной составной частью грандиозного «про-
биомолекулы. В нормальных физиологических
екта плейотропизации» генов и возникнове-
условиях ROS принимают участие в передаче
ния инновационных приспособительных ме-
внутриклеточных и межклеточных сигналов, а
ханизмов в связи с выходом на сушу и полным
также играют важную роль в иммунном ответе.
разрывом с водной средой обитания. Клас-
Координированная работа дыхательной цепи
теризация корегулируемых генов может в ходе
митохондрий, комплекса оксидаз и антиокси-
эволюции утрачиваться в силу того, что пре-
дантной системы обеспечивает поддержание
имущества кластеризации постепенно ниве-
окислительно-восстановительного гомеостаза
лируются, тогда как сегрегация предоставляет
клетки [118]. Нарушение окислительно-восста-
новые регуляторные и функциональные воз-
новительного гомеостаза клетки под действием
можности. Соответственно, давление отбора
внешних (гипероксия, ионизирующая радиа-
может быть разнонаправленным - как в сторо-
ция и т.п.) или внутренних факторов (актива-
ну сохранения кластеризованной организации
ция оксидаз, нарушение функции антиокси-
дуплицированных корегулируемых паралогов,
дантов) приводит к гиперпродукции ROS и их
так и в направлении изоляции и последующей
производных (нитрозилирующие агенты, ги-
сегрегации генов. Начинаясь на уровне муль-
погалогениты, карбонилы и др.), что вызывает
типликации регуляторных элементов и сегре-
окислительные повреждения всех важнейших
гации функциональных субдоменов, изоляция
биологических макромолекул (ДНК, белки, ли-
может завершиться разрывом кластера дупли-
пиды и углеводы) и приводит к развитию окис-
цированных генов, транслокацией на другую
лительного стресса, лежащего в основе многих
хромосому, принципиальным изменением ге-
патологических состояний. Токсическое дей-
номного и регуляторного контекста трансло-
ствие высоких концентраций ROS предотвра-
цированного локуса, а, возможно, и характера
щается широким спектром низкомолекулярных
тканеспецифической экспрессии. Именно эта
антиоксидантов и комплексом специализиро-
логика направляла эволюцию α- и β-глобино-
ванных антиоксидантных ферментов [119]. Как
вых генов позвоночных. По нашему предполо-
тетрамерный гемоглобин, так и мономерные
жению, обусловленная сегрегацией независи-
α- и β-глобины могут участвовать в нейтрализа-
мая экспрессия α- и β-глобиновых генов могла
ции ROS в условиях оксидативного стресса, ког-
играть важную роль у предков Amniota, в том
да и если канонические факторы нейтрализа-
числе обеспечивая защиту первых сухопутных
ции оказываются недостаточными. Интересно,
позвоночных от стрессовых факторов новой
что в условиях сезонного перехода от гипоксии
среды обитания.
к нормальному дыханию и связанного с этим
переходом оксидативного стресса, гемоглобин
Вклад авторов. Все авторы участвовали в
некоторых видов черепах полимеризуется за
выработке концепции и написании обзора.
счет образования дисульфидных связей между
Финансирование. Работа С.В. Разина под-
молекулами тетрамерного гемоглобина и таким
держана Российским научным фондом (грант
образом участвует в нейтрализации активных
№ 21-64-00001). Работа О.В. Яровой поддержа-
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1313
на Российским фондом фундаментальных ис-
Соблюдение этических норм. Настоящая
следований (грант № 20-04-00003).
статья не содержит описания каких-либо ис-
Конфликт интересов. Авторы заявляют об
следований с участием людей или животных в
отсутствии конфликта интересов.
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. De Simone, G., Quattrocchi, A., Mancini, B., di
sensing, J. Biol. Chem., 283, 8773-8777, doi: 10.1074/
Masi, A., Nervi, C., et al. (2022) Thalassemias:
jbc.R700029200.
from gene to therapy, Mol. Aspects Med., 84, 101028,
14. Burmester, T., and Hankeln, T. (2014) Function and
doi: 10.1016/j.mam.2021.101028.
evolution of vertebrate globins, Acta Physiol., 211, 501-
2. Fromm, G., and Bulger, M. (2009) A spectrum of gene
514, doi: 10.1111/apha.12312.
regulatory phenomena at mammalian beta-globin gene
15. Keppner, A., Maric, D., Correia, M., Koay, T. W.,
loci, Biochem. Cell Biol., 87, 781-790, doi: 10.1139/
Orlando, I. M. C., et al. (2020) Lessons from the post-
O09-048.
genomic era: Globin diversity beyond oxygen binding
3. Hardison, R. C. (2012) Evolution of hemoglobin and
and transport, Redox Biol., 37, 101687, doi: 10.1016/
its genes, Cold Spring Harb. Perspect.Med., 2, a011627,
j.redox.2020.101687.
doi: 10.1101/cshperspect.a011627.
16. Song, S., Starunov, V., Bailly, X., Ruta, C., Kerner, P.,
4. Hoffmann, F. G., Vandewege, M. W., Storz, J. F., and
et al. (2020) Globins in the marine annelid Platynereis
Opazo, J. C. (2018) Gene turnover and diversification
dumerilii shed new light on hemoglobin evolution in
of the alpha- and beta-globin gene families in sau-
bilaterians, BMC Evol. Biol., 20, 165, doi: 10.1186/
ropsid vertebrates, Genome Biol. Evol., 10, 344-358,
s12862-020-01714-4.
doi: 10.1093/gbe/evy001.
17. Hoffmann, F. G., Opazo, J. C., and Storz, J. F. (2012)
5. Iarovaia, O. V., Ioudinkova, E. S., Petrova, N. V.,
Whole-genome duplications spurred the functional
Dolgushin, K. V., Kovina, A. V., et al. (2014) Evolu-
diversification of the globin gene superfamily in
tion of alpha- and beta-globin genes and their regula-
vertebrates, Mol. Biol. Evol., 29, 303-312, doi: 10.1093/
tory systems in light of the hypothesis of domain or-
molbev/msr207.
ganization of the genome, Biochemistry (Moscow), 79,
18. Miyata, M., Gillemans, N., Hockman, D., Demmers,
1141-1150, doi: 10.1134/S0006297914110017.
J. A. A., Cheng, J. F., et al. (2020) An evolutionarily
6. Kattamis, A., Kwiatkowski, J. L., and Aydinok,
ancient mechanism for regulation of hemoglobin
Y.
(2022) Thalassaemia, Lancet,
399,
2310-2324,
expression in vertebrate red cells, Blood, 136, 269-278,
doi: 10.1016/S0140-6736(22)00536-0.
doi: 10.1182/blood.2020004826.
7. Mettananda, S., Gibbons, R. J., and Higgs, D. R.
19. Storz, J. F., Opazo, J. C., and Hoffmann, F. G.
(2016) Understanding alpha-globin gene regulation and
(2013) Gene duplication, genome duplication, and
implications for the treatment of beta-thalassemia, Ann.
the functional diversification of vertebrate globins,
NY Acad. Sci., 1368, 16-24, doi: 10.1111/nyas.12988.
Mol. Phylogenet. Evol., 66, 469-478, doi: 10.1016/
8. Oudelaar, A. M., Beagrie, R. A., Kassouf, M. T.,
j.ympev.2012.07.013.
and Higgs, D. R. (2021) The mouse alpha-globin
20. Pelleg, A., and Porter, R. S. (1990) The pharmacology
cluster: a paradigm for studying genome regulation
of adenosine, Pharmacotherapy, 10, 157-174.
and organization, Curr. Opin. Genet. Dev., 67, 18-24,
21. Pillai, A. S., Chandler, S. A., Liu, Y., Signore, A.
doi: 10.1016/j.gde.2020.10.003.
V., Cortez-Romero, C. R., et al. (2020) Origin of
9. Philipsen, S., and Hardison, R. C. (2018) Evolution
complexity in haemoglobin evolution, Nature, 581,
of hemoglobin loci and their regulatory elements,
480-485, doi: 10.1038/s41586-020-2292-y.
Blood Cells Mol. Diseases, 70, 2-12, doi: 10.1016/
22. Weber, R. E., and Fago, A. (2004) Functional adapta-
j.bcmd.2017.08.001.
tion and its molecular basis in vertebrate hemoglobins,
10. Razin, S. V., Ulianov, S. V., Ioudinkova, E. S.,
neuroglobins and cytoglobins, Respirat. Physiol. Neu-
Gushchanskaya, E. S., Gavrilov, A. A., et al. (2012)
robiol., 144, 141-159, doi: 10.1016/j.resp.2004.04.018.
Domains of alpha- and beta-globin genes in the
23. Ganis, J. J., Hsia, N., Trompouki, E., de Jong, J. L.,
context of the structural-functional organization of the
DiBiase, A., et al. (2012) Zebrafish globin switching
eukaryotic genome, Biochemistry (Moscow), 77, 1409-
occurs in two developmental stages and is controlled
1423, doi: 10.1134/S0006297912130019.
by the LCR, Dev. Biol., 366, 185-194, doi: 10.1016/
11. Recillas-Targa, F., and Razin, S. V. (2001) Chromatin
j.ydbio.2012.03.021.
domains and regulation of gene expression: familiar
24. Nefedochkina, A. V., Petrova, N. V., Ioudinkova, E.
and enigmatic clusters of chicken globin genes, Crit.
S., Kovina, A. P., Iarovaia, O. V., et al. (2016) Char-
Rev. Eukaryot. Gene Express., 11, 227-242.
acterization of the enhancer element of the Danio rerio
12. Hardison, R. C. (2008) Globin genes on the move,
minor globin gene locus, Histochem. Cell Biol., 145,
J. Biol., 7, 35, doi: 10.1186/jbiol92.
463-473, doi: 10.1007/s00418-016-1413-z.
13. Vinogradov, S. N., and Moens, L. (2008) Diversity
25. Hosbach, H. A., Wyler, T., and Weber, R. (1983)
of globin function: enzymatic, transport, storage, and
The Xenopus laevis globin gene family: chromosom-
БИОХИМИЯ том 87 вып. 9 2022
1314
ЯРОВАЯ и др.
al arrangement and gene structure, Cell, 32, 45-53,
38. Kovina, A. P., Petrova, N. V., Gushchanskaya, E. S.,
doi: 10.1016/0092-8674(83)90495-6.
Dolgushin, K. V., Gerasimov, E. S., et al. (2017) Evo-
26. Jeffreys, A. J., Wilson, V., Wood, D., Simons,
lution of the genome 3D organization: comparison of
J. P., Kay, R. M., et al. (1980) Linkage of adult
fused and segregated globin gene clusters, Mol. Biol.
alpha- and beta-globin genes in X. laevis and gene
Evol., 34, 1492-1504, doi: 10.1093/molbev/msx100.
duplication by tetraploidization, Cell, 21, 555-564,
39. Hay, D., Hughes, J. R., Babbs, C., Davies, J. O. J.,
doi: 10.1016/0092-8674(80)90493-6.
Graham, B. J., et al. (2016) Genetic dissection of the
27. Queiroz, J. P. F., Lima, N. C. B., and Rocha, B. A.
alpha-globin super-enhancer in vivo, Nat. Genet., 48,
M. (2021) The rise and fall of globins in the amphibia,
895-903, doi: 10.1038/ng.3605.
Compar. Biochem. Physiol. D Genom. Proteom., 37,
40. Garcia-Gonzalez, E., and Recillas-Targa, F. (2014)
100759, doi: 10.1016/j.cbd.2020.100759.
A regulatory element affects the activity and chroma-
28. Fuchs, C., Burmester, T., and Hankeln, T. (2006)
tin structure of the chicken alpha-globin 3′ enhancer,
The amphibian globin gene repertoire as revealed by
Biochim. Biophys. Acta, 1839, 1233-1241, doi: 10.1016/
the Xenopus genome, Cytogenet. Genome Res., 112,
j.bbagrm.2014.09.009.
296-306, doi: 10.1159/000089884.
41. Bulger, M., Bender, M. A., van Doorninck, J. H.,
29. Patel, V. S., Cooper, S. J., Deakin, J. E., Fulton, B.,
Wertman, B., Farrell, C. M., et al. (2000) Comparative
Graves, T., et al. (2008) Platypus globin genes and
structural and functional analysis of the olfactory
flanking loci suggest a new insertional model for be-
receptor genes flanking the human and mouse beta-
ta-globin evolution in birds and mammals, BMC Biol.,
globin gene clusters, Proc. Natl. Acad. Sci. USA, 97,
6, 34, doi: 10.1186/1741-7007-6-34.
14560-14565, doi: 10.1073/pnas.97.26.14560.
30. Hughes, J. R., Cheng, J. F., Ventress, N., Prabhakar,
42. Bulger, M., and Groudine, M.
(1999) Looping
S., Clark, K., et al. (2005) Annotation of cis-regula-
versus linking: toward a model for long-distance gene
tory elements by identification, subclassification, and
activation, Genes Dev., 13, 2465-2477, doi: 10.1101/
functional assessment of multispecies conserved se-
gad.13.19.2465.
quences, Proc. Natl. Acad. Sci. USA, 102, 9830-9835,
43. Levings, P. P., and Bungert, J. (2002) The human
doi: 10.1073/pnas.0503401102.
beta-globin locus control region, Eur. J. Biochem., 269,
31. Filonenko, E. S., Gavrilov, A. A., Razin, S. V., and
1589-1599, doi: 10.1046/j.1432-1327.2002.02797.x.
Iarovaia, O. V. (2010) Expansion of the functional
44. Li, Q., Peterson, K. R., Fang, X., and Stamatoyan-
domain of chicken alpha-globin genes [in Russian],
nopoulos, G. (2002) Locus control regions, Blood,
Genetika, 46, 1164-1167.
100, 3077-3086, doi: 10.1182/blood-2002-04-1104.
32. Philonenko, E. S., Klochkov, D. B., Borunova, V. V.,
45. Choi, O. R., and Engel, J. D. (1986) A 3′ enhancer is
Gavrilov, A. A., Razin, S. V., et al. (2009) TMEM8 —
required for temporal and tissue-specific transcriptional
a non-globin gene entrapped in the globin web, Nucleic
activation of the chicken adult beta-globin gene,
Acids Res., 37, 7394-7406, doi: 10.1093/nar/gkp838.
Nature, 323, 731-734, doi: 10.1038/323731a0.
33. De Leo, A. A., Wheeler, D., Lefevre, C., Cheng, J.
46. Chung, J. H., Bell, A. C., and Felsenfeld, G. (1997)
F., Hope, R., et al. (2005) Sequencing and mapping
Characterization of the chicken beta-globin insulator,
hemoglobin gene clusters in the Australian mod-
Proc. Natl. Acad. Sci. USA, 94, 575-580, doi: 10.1073/
el dasyurid marsupial Sminthopsis macroura, Cy-
pnas.94.2.575.
togenet. Genome Res., 108, 333-341, doi: 10.1159/
47. Rival-Gervier, S., Pantano, T., Viglietta, C., Maed-
000081528.
er, C., Prince, S., et al. (2003) The insulator effect of
34. Opazo, J. C., Hoffmann, F. G., and Storz, J. F.
the 5′HS4 region from the beta-globin chicken locus
(2008) Genomic evidence for independent origins
on the rabbit WAP gene promoter activity in transgen-
of beta-like globin genes in monotremes and therian
ic mice, Transgenic Res., 12, 723-730, doi: 10.1023/
mammals, Proc. Natl. Acad. Sci. USA, 105, 1590-1595,
b:trag.0000005242.72076.d1.
doi: 10.1073/pnas.0710531105.
48. Wallace, J. A., and Felsenfeld, G. (2007) We gath-
35. Wheeler, D., Hope, R. M., Cooper, S. J., Gooley, A.
er together: insulators and genome organization,
A., and Holland, R. A. (2004) Linkage of the beta-
Curr. Opin. Genet. Dev., 17, 400-407, doi: 10.1016/
like omega-globin gene to alpha-like globin genes in
j.gde.2007.08.005.
an Australian marsupial supports the chromosome
49. De Laat, W., and Grosveld, F.
(2003) Spatial
duplication model for separation of globin gene
organization of gene expression: the active chromatin
clusters, J. Mol. Evol., 58, 642-652, doi: 10.1007/
hub, Chromosome Research: An International Journal
s00239-004-2584-0.
on the Molecular, Supramolecular and Evolutionary
36. Bulger, M., van Doorninck, J. H., Saitoh, N., Telling,
Aspects of Chromosome Biology,
11,
447-459,
A., Farrell, C., et al. (1999) Conservation of sequence
doi: 10.1023/a:1024922626726.
and structure flanking the mouse and human beta-
50. Oudelaar, A. M., Harrold, C. L., Hanssen, L. L. P.,
globin loci: the beta-globin genes are embedded within
Telenius, J. M., Higgs, D. R., et al. (2019) A revised
an array of odorant receptor genes, Proc. Natl. Acad.
model for promoter competition based on multi-way
Sci. USA, 96, 5129-5134, doi: 10.1073/pnas.96.9.5129.
chromatin interactions at the alpha-globin locus, Nat.
37. Palstra, R. J., de Laat, W., and Grosveld, F. (2008)
Commun., 10, 5412, doi: 10.1038/s41467-019-13404-x.
Beta-globin regulation and long-range interac-
51. Vernimmen, D., Marques-Kranc, F., Sharpe, J. A.,
tions, Adv. Genetics,
61,
107-142, doi:
10.1016/
Sloane-Stanley, J. A., Wood, W. G., et al. (2009)
S0065-2660(07)00004-1.
Chromosome looping at the human alpha-globin
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1315
locus is mediated via the major upstream regulatory
chim. Biophys. Acta,
1637,
46-54, doi:
10.1016/
element (HS-40), Blood, 114, 4253-4260, doi: 10.1182/
s0925-4439(02)00213-2.
blood-2009-03-213439.
65. Reeder, B. J. (2017) Redox and peroxidase activities
52. Saha, D., Patgaonkar, M., Shroff, A., Ayyar, K.,
of the hemoglobin superfamily: relevance to health
Bashir, T., et al.
(2014) Hemoglobin expression
and disease, Antioxid. Redox Signal., 26, 763-776,
in nonerythroid cells: novel or ubiquitous? Int. J.
doi: 10.1089/ars.2016.6803.
Inflamm., 2014, 803237, doi: 10.1155/2014/803237.
66. Franco, R., Navarro, G., and Martinez-Pinilla,
53. Russo, R., Zucchelli, S., Codrich, M., Marcuzzi, F.,
E.
(2019) Antioxidant defense mechanisms in
Verde, C., and Gustincich, S. (2013) Hemoglobin
erythrocytes and in the central nervous system,
is present as a canonical alpha2beta2 tetramer in
Antioxidants, 8, doi: 10.3390/antiox8020046.
dopaminergic neurons, Biochim. Biophys. Acta, 1834,
67. Liu, W., Baker, S. S., Baker, R. D., Nowak, N. J., and
1939-1943, doi: 10.1016/j.bbapap.2013.05.005.
Zhu, L. (2011) Upregulation of hemoglobin expression
54. Tezel, T. H., Geng, L., Lato, E. B., Schaal, S., Liu, Y.,
by oxidative stress in hepatocytes and its implication
et al. (2009) Synthesis and secretion of hemoglobin by
in nonalcoholic steatohepatitis, PLoS One, 6, e24363,
retinal pigment epithelium, Invest. Ophthalmol. Vis.
doi: 10.1371/journal.pone.0024363.
Sci., 50, 1911-1919, doi: 10.1167/iovs.07-1372.
68. Nishi, H., Inagi, R., Kato, H., Tanemoto, M., Ko-
55. Wu, C. W., Liao, P. C., Yu, L., Wang, S. T., Chen, S.
jima, I., et al.
(2008) Hemoglobin is expressed
T., et al. (2004) Hemoglobin promotes Abeta oligomer
by mesangial cells and reduces oxidant stress,
formation and localizes in neurons and amyloid de-
J. Am. Soc. Nephrol., 19, 1500-1508, doi: 10.1681/
posits, Neurobiol. Disease, 17, 367-377, doi: 10.1016/
ASN.2007101085.
j.nbd.2004.08.014.
69. Brown, N., Alkhayer, K., Clements, R., Singhal,
56. Biagioli, M., Pinto, M., Cesselli, D., Zaninello,
N., Gregory, R., et al. (2016) Neuronal hemoglobin
M., Lazarevic, D., et al. (2009) Unexpected ex-
expression and its relevance to multiple sclerosis
pression of alpha- and beta-globin in mesencephal-
neuropathology, J. Mol. Neurosci.,
59,
1-17,
ic dopaminergic neurons and glial cells, Proc. Natl.
doi: 10.1007/s12031-015-0711-6.
Acad. Sci. USA, 106, 15454-15459, doi: 10.1073/
70. Codrich, M., Bertuzzi, M., Russo, R., Frances-
pnas.0813216106.
catto, M., Espinoza, S., et al. (2017) Neuronal he-
57. Schelshorn, D. W., Schneider, A., Kuschinsky, W.,
moglobin affects dopaminergic cells’ response to
Weber, D., Kruger, C., et al. (2009) Expression of
stress, Cell Death Disease, 8, e2538, doi: 10.1038/
hemoglobin in rodent neurons, J. Cereb. Blood Flow
cddis.2016.458.
Metab., 29, 585-595, doi: 10.1038/jcbfm.2008.152.
71. Shephard, F., Greville-Heygate, O., Marsh, O., An-
58. Richter, F., Meurers, B. H., Zhu, C., Medvedeva, V.
derson, S., and Chakrabarti, L. (2014) A mitochondri-
P., and Chesselet, M. F. (2009) Neurons express he-
al location for haemoglobins - dynamic distribution
moglobin alpha- and beta-chains in rat and human
in ageing and Parkinson’s disease, Mitochondrion, 14,
brains, J. Compar. Neurol., 515, 538-547, doi: 10.1002/
64-72, doi: 10.1016/j.mito.2013.12.001.
cne.22062.
72. Shirai, T., Imori, H., Konomi, G., Ikuta, T., Minoda,
59. Dassen, H., Kamps, R., Punyadeera, C., Dijcks, F.,
H., et al. (1989) Trace elements in patients on chronic
de Goeij, A., et al. (2008) Haemoglobin expression
hemodialysis. 1. Plasma aluminium, Fukuoka Shika
in human endometrium, Hum. Reprod., 23, 635-641,
Daigaku Gakkai zasshi, 16, 1-10.
doi: 10.1093/humrep/dem430.
73. Bhaskaran, M., Chen, H., Chen, Z., and Liu, L.
60. Babalola, O. E., Danboyi, P., and Abiose, A. A. (2000)
(2005) Hemoglobin is expressed in alveolar epithelial
Hereditary congenital cataracts associated with sickle
type II cells, Biochem. Biophys. Res. Commun., 333,
cell anaemia in a Nigerian family, Tropic. Doc., 30, 12-
1348-1352, doi: 10.1016/j.bbrc.2005.06.042.
14, doi: 10.1177/004947550003000107.
74. Newton, D. A., Rao, K. M., Dluhy, R. A., and Baatz,
61. Wride, M. A., Mansergh, F. C., Adams, S., Everitt,
J. E. (2006) Hemoglobin is expressed by alveolar
R., Minnema, S. E., et al. (2003) Expression profiling
epithelial cells, J. Biol. Chem.,
281,
5668-5676,
and gene discovery in the mouse lens, Mol. Vis., 9,
doi: 10.1074/jbc.M509314200.
360-396.
75. Grek, C. L., Newton, D. A., Spyropoulos, D. D., and
62. Alayash, A. I., Patel, R. P., and Cashon, R. E.
Baatz, J. E. (2011) Hypoxia up-regulates expression of
(2001) Redox reactions of hemoglobin and myo-
hemoglobin in alveolar epithelial cells, Am. J. Respi-
globin: biological and toxicological implications,
rat. Cell Mol. Biol.,
44,
439-447, doi:
10.1165/
Antioxid. Redox Signal., 3, 313-327, doi: 10.1089/
rcmb.2009-0307OC.
152308601300185250.
76. Emara, M., Turner, A. R., and Allalunis-Turner, J.
63. Goldstein, S., and Samuni, A. (2005) Intra- and
(2014) Adult, embryonic and fetal hemoglobin are
intermolecular oxidation of oxymyoglobin and
expressed in human glioblastoma cells, Int. J. Oncol.,
oxyhemoglobin induced by hydroxyl and carbonate
44, 514-520, doi: 10.3892/ijo.2013.2186.
radicals, Free Radic. Biol. Med.,
39,
511-519,
77. Funnell, A. P., Vernimmen, D., Lim, W. F.,
doi: 10.1016/j.freeradbiomed.2005.04.003.
Mak, K. S., Wienert, B., et al. (2014) Differen-
64. Masuoka, N., Kodama, H., Abe, T., Wang, D. H.,
tial regulation of the alpha-globin locus by Krup-
and Nakano, T. (2003) Characterization of hydro-
pel-like Factor
3 in erythroid and non-eryth-
gen peroxide removal reaction by hemoglobin in
roid cells, BMC Mol. Biol., 15, 8, doi: 10.1186/
the presence of reduced pyridine nucleotides, Bio-
1471-2199-15-8.
БИОХИМИЯ том 87 вып. 9 2022
1316
ЯРОВАЯ и др.
78. Gorr, T. A., Wichmann, D., Pilarsky, C., Theu-
ters, Front. Immunol.,
12,
709173, doi:
10.3389/
rillat, J. P., Fabrizius, A., et al. (2011) Old pro-
fimmu.2021.709173.
teins
— new locations: myoglobin, haemoglobin,
90. Liu, L., Zeng, M., and Stamler, J. S.
(1999)
neuroglobin and cytoglobin in solid tumours and
Hemoglobin induction in mouse macrophages, Proc.
cancer cells, Acta Physiol., 202, 563-581, doi: 10.1111/
Natl. Acad. Sci. USA, 96, 6643-6647, doi: 10.1073/
j.1748-1716.2010.02205.x.
pnas.96.12.6643.
79. Li, X., Wu, Z., Wang, Y., Mei, Q., Fu, X., and
91. Zheng, Y., Miyamoto, D. T., Wittner, B. S., Sullivan,
Han, W. (2013) Characterization of adult alpha- and
J. P., Aceto, N., et al. (2017) Expression of beta-
beta-globin elevated by hydrogen peroxide in cervical
globin by cancer cells promotes cell survival during
cancer cells that play a cytoprotective role against
blood-borne dissemination, Nat. Commun., 8, 14344,
oxidative insults, PLoS One, 8, e54342, doi: 10.1371/
doi: 10.1038/ncomms14344.
journal.pone.0054342.
92. Tuteja, N., Chandra, M., Tuteja, R., and Misra, M.
80. Patgaonkar, M., Aranha, C., Bhonde, G., and Reddy,
K. (2004) Nitric oxide as a unique bioactive signaling
K. V. (2011) Identification and characterization of
messenger in physiology and pathophysiology,
anti-microbial peptides from rabbit vaginal fluid, Vet.
J. Biomed. Biotechnol., 2004, 227-237, doi: 10.1155/
Immunol. Immunopathol., 139, 176-186, doi: 10.1016/
S1110724304402034.
j.vetimm.2010.10.012.
93. Kleschyov, A. L. (2017) The NO-heme signaling
81. Saha, D., Koli, S., Patgaonkar, M., and Reddy, K.
hypothesis, Free Radic. Biol. Med., 112, 544-552,
V. (2017) Expression of hemoglobin-alpha and beta
doi: 10.1016/j.freeradbiomed.2017.08.025.
subunits in human vaginal epithelial cells and their
94. Lechauve, C., Butcher, J. T., Freiwan, A., Biwer, L. A.,
functional significance, PLoS One,
12, e0171084,
Keith, J. M., et al. (2018) Endothelial cell alpha-globin
doi: 10.1371/journal.pone.0171084.
and its molecular chaperone alpha-hemoglobin-stabi-
82. Coates, C. J., and Decker, H. (2017) Immunological
lizing protein regulate arteriolar contractility, J. Clin.
properties of oxygen-transport proteins: hemoglobin,
Invest., 128, 5073-5082, doi: 10.1172/JCI99933.
hemocyanin and hemerythrin, Cell. Mol. Life Sci., 74,
95. Parikh, J., Kapela, A., and Tsoukias, N. M. (2017)
293-317, doi: 10.1007/s00018-016-2326-7.
Can endothelial hemoglobin-alpha regulate ni-
83. Jeney, V., Eaton, J. W., Balla, G., and Balla, J. (2013)
tric oxide vasodilatory signaling? Am. J. Physiol.
Natural history of the bruise: formation, elimina-
Heart Circ. Physiol., 312, H854-H866, doi: 10.1152/
tion, and biological effects of oxidized hemoglo-
ajpheart.00315.2016.
bin, Oxid. Med. Cellular Longev.,
2013,
703571,
96. Shu, X., Ruddiman, C. A., Keller, T. C. S. 4th., Keller,
doi: 10.1155/2013/703571.
A. S., Yang, Y., et al. (2019) Heterocellular contact can
84. Shaver, C. M., Upchurch, C. P., Janz, D. R., Grove,
dictate arterial function, Circ. Res., 124, 1473-1481,
B. S., Putz, N. D., et al. (2016) Cell-free hemoglobin:
doi: 10.1161/CIRCRESAHA.118.313926.
a novel mediator of acute lung injury, Am. J. Physiol.
97. Straub, A. C., Lohman, A. W., Billaud, M., John-
Lung Cell. Mol. Physiol., 310, L532-541, doi: 10.1152/
stone, S. R., Dwyer, S. T., et al. (2012) Endothelial
ajplung.00155.2015.
cell expression of haemoglobin alpha regulates nitric
85. Zhong, Q., Zhou, K., Liang, Q. L., Lin, S., Wang, Y.
oxide signalling, Nature, 491, 473-477, doi: 10.1038/
C., et al. (2016) Interleukin-23 secreted by activated
nature11626.
macrophages drives gammadeltaT cell production
98. Alvarez, R. A., Miller, M. P., Hahn, S. A., Galley,
of interleukin-17 to aggravate secondary injury after
J. C., Bauer, E., et al. (2017) Targeting pulmonary
intracerebral hemorrhage, J. Am. Heart Assoc., 5,
endothelial hemoglobin alpha improves nitric oxide
doi: 10.1161/JAHA.116.004340.
signaling and reverses pulmonary artery endothelial
86. Li, D., Dong, H., Li, S., Munir, M., Chen, J., et al.
dysfunction, Am. J. Respir. Cell Mol. Biol., 57, 733-
(2013) Hemoglobin subunit beta interacts with the
744, doi: 10.1165/rcmb.2016-0418OC.
capsid protein and antagonizes the growth of classical
99. Cao, A., and Moi, P.
(2002) Regulation of
swine fever virus, J. Virol., 87, 5707-5717, doi: 10.1128/
the globin genes, Pediatr. Res.,
51,
415-421,
JVI.03130-12.
doi: 10.1203/00006450-200204000-00003.
87. Yang, Q., Bai, S. Y., Li, L. F., Li, S., Zhang, Y., et al.
100. Garrick, D., De Gobbi, M., Samara, V., Rugless, M.,
(2019) Human hemoglobin subunit beta functions as
Holland, M., et al. (2008) The role of the polycomb
a pleiotropic regulator of RIG-I/MDA5-mediated
complex in silencing alpha-globin gene expression
antiviral innate immune responses, J. Virol.,
93,
in nonerythroid cells, Blood,
112,
3889-3899,
doi: 10.1128/JVI.00718-19.
doi: 10.1182/blood-2008-06-161901.
88. Masoumi, Z., Erlandsson, L., Hansson, E.,
101. Iarovaia, O. V., Kovina, A. P., Petrova, N. V., Razin,
Magnusson, M., Mezey, E., et al.
(2021) Hy-
S. V., Ioudinkova, E. S., et al. (2018) Genetic and
poxia-induced alpha-globin expression in syn-
epigenetic mechanisms of beta-globin gene switching,
cytiotrophoblasts mimics the pattern observed in pre-
Biochemistry (Moscow), 83, 381-392, doi: 10.1134/
eclamptic placentas, Int. J. Mol. Sci., 22, doi: 10.3390/
S0006297918040090.
ijms22073357.
102. Petrova, N. V., Klimenko, N. S., Kovina, A. P., Ioud-
89. Derakhshani, A., Safarpour, H., Abdoli Shad-
inkova, E. S., Gavrilov, A. A., et al. (2021) Mecha-
bad, M., Hemmat, N., Leone, P., et al.
(2021)
nisms mediating suppression of globin gene transcrip-
The role of hemoglobin subunit delta in the immu-
tion in Danio rerio nonerythroid cells, Biochimie, 181,
nopathy of multiple sclerosis: mitochondria mat-
96-99, doi: 10.1016/j.biochi.2020.11.021.
БИОХИМИЯ том 87 вып. 9 2022
СЕГРЕГАЦИЯ КЛАСТЕРОВ α- И β-ГЛОБИНОВЫХ ГЕНОВ
1317
103. Zhou, G. L., Xin, L., Song, W., Di, L. J., Liu, G.,
and disease, Front. Vet. Sci., 5, 242, doi: 10.3389/
et al. (2006) Active chromatin hub of the mouse
fvets.2018.00242.
alpha-globin locus forms in a transcription factory
112. Ma, Q. (2013) Role of nrf2 in oxidative stress and
of clustered housekeeping genes, Mol. Cell. Biol., 26,
toxicity, Ann. Rev. Pharmacol. Toxicol., 53, 401-426,
5096-5105, doi: 10.1128/MCB.02454-05.
doi: 10.1146/annurev-pharmtox-011112-140320.
104. Feldmesser, E., Olender, T., Khen, M., Yanai, I.,
113. Taniguchi, K., and Karin, M. (2018) NF-kappaB, in-
Ophir, R., et al. (2006) Widespread ectopic expres-
flammation, immunity and cancer: coming of age, Nat.
sion of olfactory receptor genes, BMC Genom., 7, 121,
Rev. Immunol., 18, 309-324, doi: 10.1038/nri.2017.142.
doi: 10.1186/1471-2164-7-121.
114. Hou, C. H., Huang, J., and Qian, R. L. (2002) Identi-
105. Cantor, A. B., and Orkin, S. H. (2002) Transcriptional
fication of a NF-kappaB site in the negative regulato-
regulation of erythropoiesis: an affair involving multi-
ry element (epsilon-NRAII) of human epsilon-globin
ple partners, Oncogene, 21, 3368-3376, doi: 10.1038/
gene and its binding protein NF-kappaB p50 in the
sj.onc.1205326.
nuclei of K562 cells, Cell Res., 12, 79-82, doi: 10.1038/
106. Higgs, D. R., Vernimmen, D., and Wood, B. (2008)
sj.cr.7290113.
Long-range regulation of alpha-globin gene ex-
115. Sangwung, P., Zhou, G., Lu, Y., Liao, X., Wang, B.,
pression, Adv. Genet.,
61,
143-173, doi:
10.1016/
et al. (2017) Regulation of endothelial hemoglobin
S0065-2660(07)00005-3.
alpha expression by Kruppel-like factors, Vasc. Med.,
107. Palazon, A., Goldrath, A. W., Nizet, V., and Johnson,
22, 363-369, doi: 10.1177/1358863X17722211.
R. S. (2014) HIF transcription factors, inflammation,
116. Nayak, L., Lin, Z., and Jain, M. K. (2011) “Go with
and immunity, Immunity, 41, 518-528, doi: 10.1016/
the flow”: how Kruppel-like factor 2 regulates the
j.immuni.2014.09.008.
vasoprotective effects of shear stress, Antioxid. Redox
108. Imtiyaz, H. Z., and Simon, M. C. (2010) Hypoxia-
Signal., 15, 1449-1461, doi: 10.1089/ars.2010.3647.
inducible factors as essential regulators of inflamma-
117. McCord, J. M. (2000) The evolution of free radicals
tion, Curr. Top. Microbiol. Immunol., 345, 105-120,
and oxidative stress, Am. J. Med., 108, 652-659,
doi: 10.1007/82_2010_74.
doi: 10.1016/s0002-9343(00)00412-5.
109. Hasselbalch, H. C. (2014) A role of NF-E2 in chron-
118. Heinrich, J. (1988) Cardiotocography practice. Case
ic inflammation and clonal evolution in essential
16, Zentralblatt fur Gynakologie, 110, 1604-1605.
thrombocythemia, polycythemia vera and myelo-
119. He, L., He, T., Farrar, S., Ji, L., Liu, T., and Ma, X.
fibrosis? Leuk. Res.,
38,
263-266, doi:
10.1016/
(2017) Antioxidants maintain cellular redox homeosta-
j.leukres.2013.07.002.
sis by elimination of reactive oxygen species, Cell. Physi-
110. Jain, M. K., Sangwung, P., and Hamik, A. (2014)
ol. Biochem., 44, 532-553, doi: 10.1159/000485089.
Regulation of an inflammatory disease: Krup-
120. Petersen, A. G., Petersen, S. V., Frische, S., Draku-
pel-like factors and atherosclerosis, Arterioscler.
lic, S., Golas, M. M., et al.(2018) Hemoglobin poly-
Thromb. Vasc. Biol.,
34,
499-508, doi:
10.1161/
merization via disulfide bond formation in the hypox-
ATVBAHA.113.301925.
ia-tolerant turtle Trachemys scripta: implications for
111. Kasai, S., Mimura, J., Ozaki, T., and Itoh, K.
antioxidant defense and O2 transport, Am. J. Physi-
(2018) Emerging regulatory role of Nrf2 in iron,
ol. Regul. Integr. Comp. Physiol.,
314, R84-R93,
Heme, and hemoglobin metabolism in physiology
doi: 10.1152/ajpregu.00024.2017.
SEGREGATION OF α- AND β-GLOBIN GENE CLUSTERS
IN VERTEBRATE EVOLUTION: CHANCE OR NECESSITY?
Review
O. V. Iarovaia1*, S. V. Ulianov1,2, E. S. Ioudinkova1, and S. V. Razin1,2
1 Institute of Gene Biology, Russian Academy of Sciences,
119334 Moscow, Russia; E-mail: iarovaia@inbox.ru
2 Faculty of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia
The review is devoted to the patterns of evolution of α- and β-globin gene domains. A hypothesis is presented
according to which the segregation of the ancestral cluster of α/β-globin genes in Amniota is due to the
performance by α-globins and β-globins of non-canonical functions not related to oxygen transport.
Keywords: evolution of α- and β-globin genes, regulation of transcription, non-canonical functions of α- and β-globins
БИОХИМИЯ том 87 вып. 9 2022