БИОХИМИЯ, 2022, том 87, вып. 9, с. 1334 - 1341
УДК 577.15
АНАЛИЗ АКТИВНОСТИ СТЕРОИДОГЕННОГО
РЕГУЛЯТОРНОГО БЕЛКА ОСТРОЙ ФАЗЫ (STARD1) ЧЕЛОВЕКА
В КЛЕТКАХ Escherichia coli
© 2022 С.В. Замалутдинова1*, Л.В. Исаева2, А.В. Замалутдинов1,
Я.В. Фалетров3, М.А. Рубцов1,4, Л.А. Новикова2*
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: podgorodova.sofya@yandex.ru
2 Московский государственный университет имени М.В. Ломоносова,
НИИ физико-химической биологии имени А.Н. Белозерского,
119234 Москва, Россия; электронная почта: novik@genebee.msu.su
3 Белорусский государственный университет, НИИ физико-химических проблем,
220030 Минск, Беларусь; электронная почта: yaroslav82@tut.by
4 ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России,
119991 Москва, Россия; электронная почта: ma_rubtsov@mail.ru
Поступила в редакцию 17.07.2022
После доработки 18.08.2022
Принята к публикации 19.08.2022
Одним из главных препятствий для успешного использования в биотехнологических процессах
клеток Escherichia coli, способных осуществлять трансформацию стероидов, является неэффек-
тивный транспорт в клетки стероидных субстратов. В работе тестирована возможность исполь-
зования белка-переносчика холестерола человека - стероидогенного регуляторного белка острой
фазы (STARD1) - для повышения эффективности поглощения стероидов клетками E. coli. Полу-
чены генетические конструкции для синтеза в клетках E. coli BL21(DE3) делетированной версии
белка STARD1, включающей функциональный домен (66-285 аминокислотные остатки), или белка
STARD1(66-285)-GFP, несущих на N-конце последовательность бактериального белка pelB, адресую-
щую белок в периплазму. Анализ препаратов клеток E. coli/pET22b/STARD1-GFP с использованием
флуориметрии и Вестерн-иммуноблоттинга подтвердил, что использованная система экспрессии
обеспечивает синтез полноразмерного гетерологичного белка. С использованием флуоресцент-
ной спектроскопии показано, что присутствие STARD1 обеспечивает увеличение эффективности
ассимиляции NBD-меченых аналогов холестерола клетками E. coli/pET22b/STARD1 в 1,3-1,6 раза
(p < 0,05) в сравнении с клетками дикого штамма. Таким образом, впервые обнаружено, что STARD1
человека способен проявлять функциональную активность в клетках бактерий, что открывает пер-
спективы для оптимизации и использования фундаментально нового подхода для повышения эф-
фективности поглощения стероидов клетками - включения в мембрану клетки специфического
белка-переносчика, который может расширить арсенал методов, использующихся при получении
штаммов микроорганизмов для синтеза широко востребованных стероидных соединений.
КЛЮЧЕВЫЕ СЛОВА: стероидогенный регуляторный белок острой фазы, Escherichia coli, холестерол,
биотрансформация стероидов, флуоресценция.
DOI: 10.31857/S0320972522090111, EDN: BBHEIB
ВВЕДЕНИЕ
Большой интерес, в частности, представляют
штаммы микроорганизмов, с использовани-
В настоящее время всё шире используют-
ем которых можно обеспечить более дешёвое
ся технологии, основанные на биокатализе. и экологически безопасное по сравнению с
Принятые сокращения: МЦД - метилированный β-циклодекстрин; 20NP - 20-((NBD)амино)-прегн-5-ен-3β-ол;
GFP - зелёный флуоресцентный белок; NBD - 7- нитробенз-2-окса-1,3-диазол-4-ил; pelB - N-концевая сигнальная
последовательность пектатлиазы B Erwinia carotovora; STARD1 - стероидогенный регуляторный белок острой фазы
(StAR, steroidogenic acute regulatory protein).
* Адресат для корреспонденции.
1334
STARD1 ЧЕЛОВЕКА ФУНКЦИОНАЛЬНО АКТИВЕН В E. coli
1335
химическими способами производство стеро-
МАТЕРИАЛЫ И МЕТОДЫ
идных соединений, в том числе и различных
лекарственных препаратов, которые пользу-
Материалы. В работе использованы: мети-
ются очень высоким спросом на фармацев-
лированный β-циклодекстрин (МЦД) («Wacker
тическом рынке [1]. В литературе представ-
Chemie», Германия), нитроцеллюлозные филь-
лено множество сообщений о получении и
тры Hybond-C Extra («Amersham Biosciences»,
использовании штаммов микроорганизмов,
Великобритания), конъюгат первичных ан-
содержащих функционально активные стероид-
тител козы против зелёного флуоресцентного
трансформирующие ферменты, способные
белка (GFP) с пероксидазой хрена («Rockland»,
осуществлять стерео- и региоспецифичные ре-
США),
22-NBD-холестерол
(«Thermo Fisher
акции (см, например, [2-5]), однако такие мик-
Scientific», США), наборы реактивов для рабо-
роорганизмы часто демонстрируют низкую
ты с ДНК - ZymoPURETM Plasmid Miniprep Kit
каталитическую активность. Основным огра-
и ZymocleanTM Gel DNA Recovery Kit («Zymo
ничивающим фактором является плохая рас-
Research», США), и Western blotting detection
творимость экзогенных стероидных субстратов
kit Western BrightTM ECL («Advansta», США),
в водной среде, что лимитирует их поглоще-
эндонуклеазы рестрикции, ДНК-полимеразы
ние клеткой из среды культивирования [5, 6].
и ДНК-модифицирующие ферменты
(«MBI
Подходы, используемые для увеличения рас-
Fermentas», Литва). Олигонуклеотиды синтези-
творимости стероидов и снятия данного огра-
рованы в компании «Евроген» (Россия). Ана-
ничения, включают как внесение в среды ор-
лог холестерола 20-((NBD)амино)-прегн-5-ен-
ганических добавок (например, органических
3β-ол (20NP) синтезирован ранее как описано
растворителей или детергентов, которые часто
Фалетровым и соавторами [14].
нарушают целостность и жизнеспособность
Использованные штаммы E. coli и плазмиды.
клеток и таким образом снижают их биоката-
В работе использованы клетки E. coli, штамм
литическую активность) [7], так и использо-
Top10 («Евроген») и штамм BL21(DE3) («Gibco
вание жидких двухфазных систем [8] (что мо-
BRL», США). Вектор pET-22b(+), содержащий
жет приводить к усложнению технологических
промотор бактериофага T7 и pelB, кодирующую
процессов).
N-концевую адресующую в периплазму после-
В клетках коры надпочечников и половых
довательность пектатлиазы B Erwinia carotovora,
желез млекопитающих транспорт холестерола
поставлен фирмой «Novagen» (США). Плазми-
к внутренней мембране митохондрий, лими-
да H-MBP-3C-STARD166-285 [13], содержащая
тирующий процесс синтеза стероидных гор-
кДНК, кодирующую STARD1(66-285), лю-
монов, осуществляется с участием белка StAR
безно предоставлена Н.Н. Случанко (Инсти-
(steroidogenic acute regulatory protein - стерои-
тут биохимии имени А.Н. Баха, Федеральный
догенный регуляторный белок острой фазы),
исследовательский центр
«Фундаментальные
называемого также STARD1 [9]. Данный белок,
основы биотехнологии» Российской академии
имеющий липид-связывающий домен START,
наук, Москва); плазмида pcDNA3.1/pCoxIV-
доставляет холестерол от наружной к внутрен-
P450scc-2A-GFP [15], содержащая кДНК, коди-
ней митохондриальной мембране, где локали-
рующую GFP, сконструирована ранее.
зован цитохром P450scc (CYP11A1), катализи-
Конструирование плазмид. Молекулярное
рующий начальные реакции каскада конверсии
клонирование осуществляли с использовани-
холестерола в стероидные гормоны [10, 11].
ем E. coli Top10 согласно стандартным прото-
В нескольких работах, проводимых с целью вы-
колам [16]. pET-22b/STARD1. Фрагмент ДНК
деления STARD1 и изучения его каталитиче-
-BamHI-STARD1(66-285)-HindIII- вырезали из
ских и структурных характеристик in vitro, про-
H-MBP-3C-STARD166-285 и лигировали с век-
демонстрирована возможность синтеза STARD1
тором pET-22b(+), расщеплённым по тем же
в клетках E. coli и правильного последующего
сайтам. Промежуточный вектор обрабатывали
фолдинга (например, [12, 13]). Однако к настоя-
BamHI и фрагментом Кленова (для удаления двух
щему времени не проводилось исследований,
пар оснований) и лигировали по тупым концам.
направленных на изучение функционирования
Целевая плазмида pET-22b/STARD1 содержала
STARD1 в живых микроорганизмах.
в рамке считывания кДНК для STARD1(66-285)
Целью данной работы являлось тестиро-
с N-концевой сигнальной последовательностью
вание активности STARD1 человека в клетках
pelB (22 а.о.). pET-22b/STARD1-GFP. Последова-
E. coli и возможности использования данного
тельности кДНК, кодирующие STARD1 и GFP,
белка-переносчика холестерола для повыше-
получены с помощью ПЦР-амплификации:
ния эффективности транспорта стероидных
STARD1 - с использованием pET22b/STARD1
соединений в клетку бактерий.
в качестве матрицы и прямого (содержащего
БИОХИМИЯ том 87 вып. 9 2022
1
336
ЗАМАЛУТДИНОВА и др.
сайт рестрикции BamHI) и обратного (содер-
Анализ функциональной активности STARD1
жащего сайт рестрикции XbaI и точечные ну-
в клетках E. coli. Культуры нетрансформирован-
клеотидные замены для удаления стоп-кодона)
ных клеток и клеток, экспрессирующих кДНК
праймеров; GFP - с использованием pcDNA3.1/
STARD1, выращенные в течение ночи в присут-
pCoxIV-P450scc-2A-GFP и прямого и обратно-
ствии лактозы [17], разбавляли свежей средой
го праймеров с сайтами рестрикции XbaI и NotI
до А600 = 1,0 и далее культивировали в услови-
соответственно. ПЦР-Продукты обрабатывали
ях индукции синтеза рекомбинантных белков
BamHI/XbaI (ген STARD1) или XbaI/NotI (ген
в присутствии МЦД (0,01 мМ), ампициллина
GFP) и встраивали в вектор pET-22b(+), рестри-
(100 мкг/мл) и стероида 22-NBD-холестерола
цированный BamHI/NotI. Получена плазмида,
(10 мкМ) или 20NP (4 мкМ), периодически отби-
включающая последовательности, кодирующие
рая аликвоты контрольных и опытных суспен-
STARD1 с N-концевым сигнальным пептидом
зий, содержащие одинаковое количество клеток.
pelB и белок GFP, слитые в одну рамку считы-
Клетки осаждали (12 000 g, 2 мин, «Eppendorf
вания. Cтруктуры плазмид подтверждали секве-
Minispin»), трижды промывали раствором МЦД
нированием.
(0,05 мМ) и разрушали, обрабатывая суспензию
Экспрессия кДНК рекомбинантных белков.
клеток в 96%-ном EtOH ультразвуком (15 сек и
Гетерологичные гены экспрессировали в клет-
20 сек, интервал 10 сек). Полученные после цен-
ках E. coli BL21(DE3), культивируемых в «среде
трифугирования (12 000 g, 2 мин) супернатанты
для аутоиндукции» (среда LB с добавлением
и осадки, суспендированные в 0,5 мл 96%-ного
солей и сахаров) [17] в присутствии ампицил-
EtOH, использовали для анализа. Объем
лина (100 мкг/мл). Синтез рекомбинантных
проб - 2 мл, состав проб: 0,4 мл опытного об-
белков индуцировали добавлением 0,2%-ной
разца (фон - 0,4 мл 96%-ного EtOH) и 1,6 мл
α-лактозы и осуществляли в течение 3-48 ч
72%-ного EtOH. Уровень содержания NBD-ме-
при 26 °C-28 °C.
ченых стеролов в пробах оценивали с использо-
Ds-Na-ПААГ-электрофорез и Вестерн-блот-
ванием флуориметра (FluoroMax-3, «HORIBA
анализ. Клетки из 1,5 мл культуры осажда-
Jobin Yvon GmbH»); условия регистрации спект-
ли центрифугированием
(12
000 g,
5 мин,
ра флуоресценции: поглощение 470 нм/испу-
«Eppendorf Minispin», Германия), осадки ре-
скание 535 нм, щель 5 нм. Для статистической
суспендировали в 100 мкл буфера для приго-
обработки полученных данных использовали
товления образцов для электрофореза (Sample
язык программирования R 4.2.1. [21]. При срав-
Buffer) [18] и денатурировали белки кипячени-
нении групп использовали двухвыборочный
ем (100 °C, 2 мин). Лизаты клеток анализирова-
t-критерий Стьюдента. Статистически значи-
ли, используя Ds-Na-ПААГ-электрофорез [18]
мыми считали отличия при p < 0,05.
и Вестерн-блоттинг [19]. При проведении им-
муноблоттинга мембраны последовательно
обрабатывали конъюгатом первичных антител
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
козы против GFP с пероксидазой хрена в раз-
ведении 1 : 10000 (v/v) и хемилюминесцентным
Белок STARD1, осуществляющий в стерои-
(ECL) субстратом в соответствии с инструкци-
догенных клетках млекопитающих перенос
ей производителя. Концентрацию белка опре-
молекул холестерола от наружной к внутрен-
деляли по методу Лоури [20].
ней мембране митохондрий, обнаружен как на
Анализ клеток на наличие GFP. Клетки,
наружной мембране, так и в межмембранном
трансформированные pET-22b/STARD1-GFP,
пространстве [22]. Для получения аналогичной
выращенные в течение 17 или 25 ч в присут-
модели на основе клеток бактерий для изучения
ствии лактозы [17], осаждали из 2 мл культуры
функциональных характеристик STARD1 мы
(12 000 g, 5 мин, «Eppendorf Minispin») и ресус-
планировали осуществить синтез STARD1, ко-
пендировали в буфере, содержащем 10 мМ
торый будет направляться в периплазму клеток.
Tris-HCl (pH 8,0) и 150 мМ NaCl. Указанный
В работе использована кДНК, кодирую-
буфер использовали для разведения и полу-
щая STARD1(66-285 а.о.), включающий толь-
чения проб с величиной поглощения A600, со-
ко функциональный START-домен, так как
ответствующей 0,125, 0,25, 0,5, 1,0 или 3,0.
известно, что такая версия белка проявляет ту
Испускание GFP в пробах (объем 2 мл) изме-
же функциональную активность, что и полно-
рялось с помощью флуориметра FluoroMax-3
размерный STARD1 - укороченный с N-кон-
(«HORIBA Jobin Yvon GmbH», Германия).
ца STARD1 теряет способность импортиро-
Условия регистрации спектра флуоресцен-
ваться в митохондрии, но остаётся полностью
ции: поглощение 395 нм/испускание 507 нм,
активным [11]. Далее в тексте для удобства
щель 5 нм.
STARD1(66-285) обозначен как STARD1.
БИОХИМИЯ том 87 вып. 9 2022
STARD1 ЧЕЛОВЕКА ФУНКЦИОНАЛЬНО АКТИВЕН В E. coli
1337
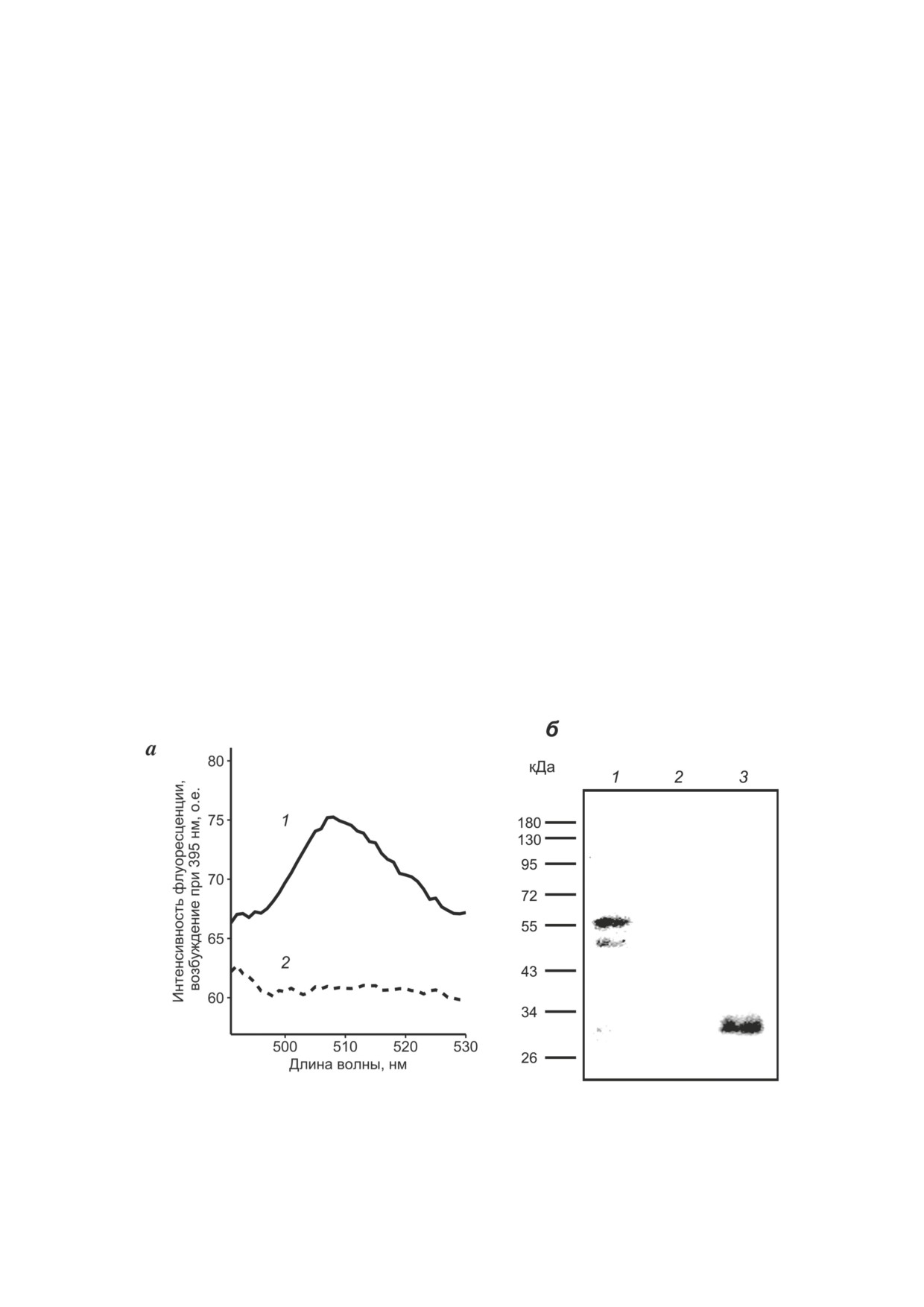
Анализ экспрессии кДНК слитого белка
испускания флуоресценции (507 нм) соответ-
STARD1-GFP в рекомбинантных клетках. Пер-
ствует максимуму испускания флуоресценции
вой задачей исследования являлась оценка
индивидуального GFP, что свидетельству-
возможности синтеза в клетках E. coli белка че-
ет о присутствии в клетках полноразмерного
ловека STARD1, несущего адресующий сигнал
STARD1-GFP и о правильной конформации
для периплазматической локализации. Реком-
хромофора GFP в составе слитого белка.
бинантный штамм получен с использованием
Анализ лизатов клеток E. coli/pET22b/
плазмиды pET22b/STARD1-GFP, включающей
STARD1-GFP, культивированных в условиях
кДНК, кодирующую слитый белок, составлен-
индукции синтеза гетерологичных белков ме-
ный из STARD1 с N-концевым сигнальным
тодом Вестерн-иммуноблоттинга с использова-
пептидом пектатлиазы B (pelB) и слитого с его
нием антисыворотки против GFP, подтвердил,
С-концом репортерного флуоресцентного бел-
что в них присутствует слитый белок с ожидае-
ка GFP. Присоединение GFP предпринято для
мой молекулярной массой ~57 кДа (рис. 1, б,
облегчения анализа синтеза гетерологичного
дорожка 1). STARD1-GFP в клетках бактерий,
белка в клетках E. coli.
вероятно, частично подвергается деградации -
Для проведения анализа использованы сус-
в лизате клеток детектируется некоторое коли-
пензии клеток E. coli/pET22b/STARD1-GFP и
чество меньшего по размеру иммуноспецифич-
контрольных нетрансформированных клеток,
ного белка (рис. 1, б, дорожка 1).
выращенных в условиях индукции экспрессии
Таким образом, мы показали, что генетиче-
гетерологичных генов в течение 17 или 25 ч (см.
ская конструкция pET22b/STARD1-GFP обе-
раздел «Материалы и методы») с А600 от 0,125 до
спечивает синтез полноразмерного гетероло-
3,0. Для идентификации STARD1-GFP в пробах
гичного белка в клетках E. coli.
осуществлялась регистрация спектра флуорес-
Анализ функциональной активности STARD1
ценции GFP. Во всех пробах, содержащих ре-
в клетках E. coli. Для проведения эксперимен-
комбинантные клетки, в отличие от контроль-
тов с целью оценки влияния STARD1 человека
ных, детектирован флуоресцентный белок. На
на эффективность поглощения стероидных со-
рис. 1, а приведены спектры, полученные при
единений клетками E. coli получена плазмида
анализе суспензий рекомбинантных и кон-
pET22b/STARD1, способная направлять син-
трольных клеток, выращенных в течение 17 ч,
тез в клетках бактерий индивидуального белка
с А600 = 3,0. Зарегистрированный максимум STARD1(66-285) c N-концевой адресующей
Рис. 1. Идентификация STARD1-GFP в клетках E. coli/pET22b/STARD1-GFP. а - Анализ суспензий клеток E. coli/
pET22b/STARD1-GFP (1) и клеток контрольного штамма (2) с использованием флуориметрии; время индукции 17 ч,
А600 = 3,0. Максимум испускания флуоресценции - 507 нм. б - Анализ лизатов клеток методом Вестерн-блоттинга:
Ds-Na-ПААГ-электрофорез в 10%-ном геле с последующей иммунодетекцией белков с использованием антител к GFP.
1 - Лизат клеток E. coli/pET22b/STARD1-GFP (50 мкг), 2 - лизат контрольных нетрансформированных клеток (50 мкг),
3 - белок-стандарт GFP (20 мкг). Слева показано положение белков-маркеров молекулярной массы
12
БИОХИМИЯ том 87 вып. 9 2022
1338
ЗАМАЛУТДИНОВА и др.
последовательностью pelB, но без репортерно-
ны как «препараты клеток», в полученных осад-
го белка на С-конце, так как присутствие GFP
ках флуоресценция не регистрируется (данные
могло препятствовать его функционированию.
не приведены).
Для оценки способности STARD1 переносить
Обнаружено, что во всех временных точках
стеролы в клетки проведён сравнительный ана-
(4, 7, 24 или 48 ч инкубации) содержание флуо-
лиз эффективности включения флуоресцирую-
ресцентных соединений в рекомбинантных
щих аналогов холестерола, 22-NBD-холесте-
клетках превышает их содержание в клетках
рола и 20NP, в клетки контрольного штамма и
контрольного штамма.
штамма клеток E. coli/pET22b/STARD1. Ранее
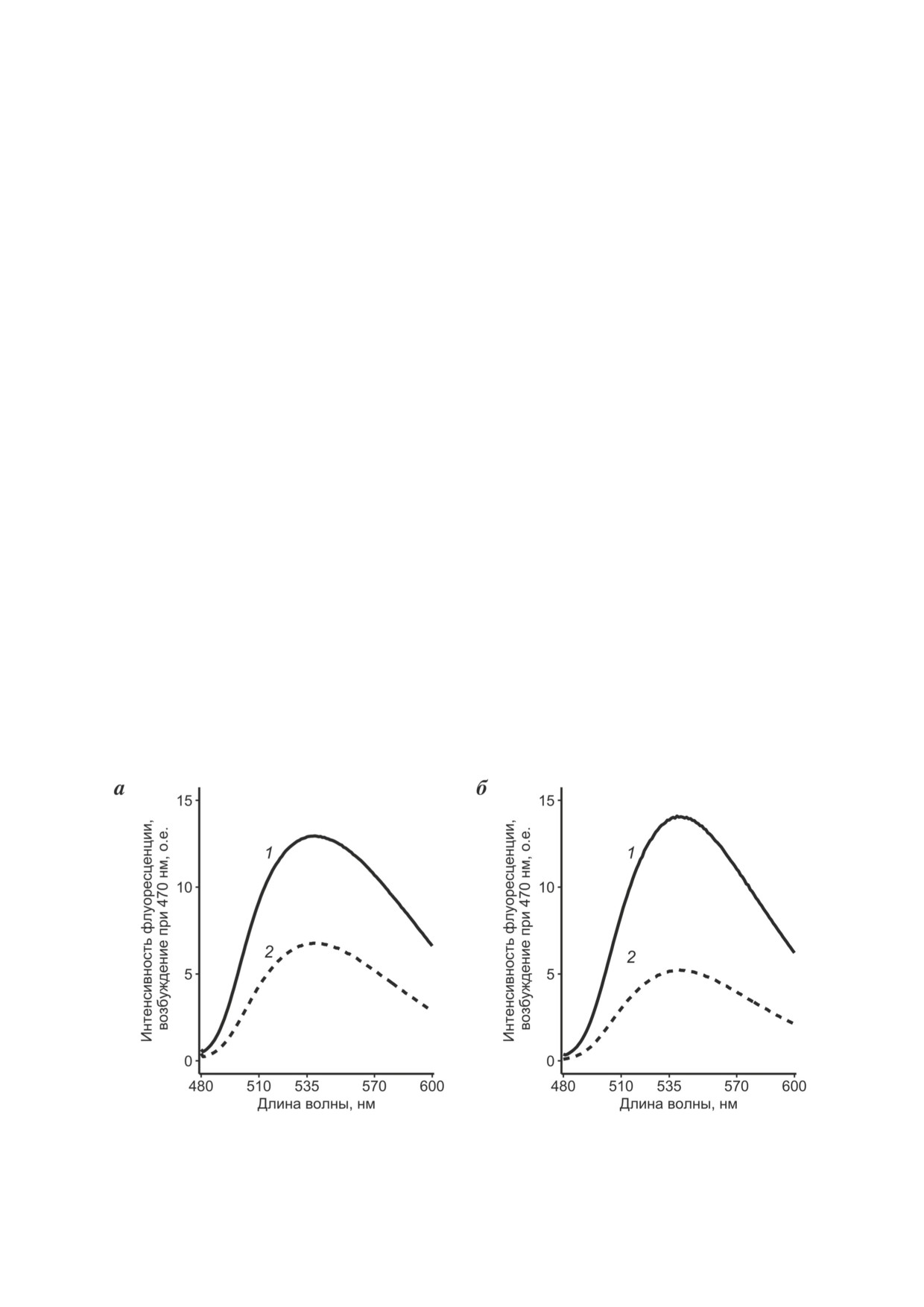
На рис. 2 представлены результаты одно-
нами было показано, что 22-NBD-холестерол и
го из проведённых экспериментов: спектры
20NP способны проникать в клетки E. coli [23].
флуоресценции
22-NBD-холестерола и сте-
Кроме того, в нескольких работах при проведе-
рола 20NP, регистрируемые в препаратах кле-
нии экспериментов в системе in vitro была про-
ток, несущих ген белка STARD1, в сравнении
демонстрирована способность изолированного
со спектрами препаратов контрольных клеток,
белка STARD1 связывать данные стероидные
иллюстрирующие разницу в эффективности
соединения (например, [24]).
накопления стероидов в клетках в течение 7 ч.
Клетки культивировали в условиях индук-
В случае 22-NBD-холестерола экспрессия гена
ции синтеза STARD1 в присутствии 22-NBD-хо-
STARD1 приводит к превышению его содер-
лестерола или 20NP в течение 48 ч, периодиче-
жания в клетке примерно в ~1,8 раза по срав-
ски отбирая аликвоты контрольных и опытных
нению с контрольными клетками (рис. 2, а),
суспензий, содержащие одинаковое количество
в случае 20NP содержание стероида выше в
клеток. Для удаления стеролов с поверхности
~2,5 раза (рис. 2, б). Согласно результатам
клеток их несколько раз промывали раствором
статистической обработки полученных дан-
МЦД. Клетки суспендировали в EtOH и раз-
ных (результатов 12 измерений для каждого
рушали с использованием ультразвука; пробы
флуоресцентного субстрата при проведении
центрифугировали и в полученных осадках и
3 независимых экспериментов), присутствие
супернатантах определяли уровень содержания
STARD1 в клетках увеличивает эффективность
флуоресцирующих стеролов с использовани-
транспорта аналогов холестерола в 1,31 ± 0,16
ем флуоресцентной спектроскопии (см. раздел
раза для 22-NBD-холестерола и в 1,58 ± 0,32
«Материалы и методы»). Можно сразу отме-
раза для 20NP (Mean ± SD; p < 0,05). Регистри-
тить, что флуоресцентные субстраты полностью
руемая разница в эффективности ассимиляции
экстрагируются EtOH и присутствуют только в
22-NBD-холестерола и 20NP клетками (рис. 2),
пробах-супернатантах, которые далее обозначе-
возможно, является следствием различия фи-
Рис. 2. Влияние рекомбинантного STARD1 на эффективность включения NBD-меченых стеролов в клетки бактерий.
Анализ препаратов клеток, культивированных в течение 7 ч в условиях индукции синтеза рекомбинантного белка в при-
сутствии (а) 22-NBD- холестерола или (б) 20NP. а, б: 1 - препарат клеток E. coli/pET22b/STARD1, 2 - препарат клеток
контрольного штамма E. coli. Максимум испускания флуоресценции - 530 нм
БИОХИМИЯ том 87 вып. 9 2022
STARD1 ЧЕЛОВЕКА ФУНКЦИОНАЛЬНО АКТИВЕН В E. coli
1339
зико-химических свойств данных стероидов,
В данном исследовании впервые обнару-
обладающих разной структурой, либо связана
жено, что рекомбинантные клетки E. coli, осу-
с разным положением NBD-группы в составе
ществляющие синтез белка-переносчика холе-
стероида, что, как ранее сообщалось, влияет на
стерола STARD1, демонстрируют способность
взаимодействие NBD-меченых аналогов холе-
более эффективно ассимилировать аналоги хо-
стерола с белком STARD1 [24].
лестерола в сравнении с клетками дикого штам-
Из представленных данных следует, что
ма. Полученные результаты указывают на то,
STARD1 человека способен проявлять функцио-
что предложенный подход - включение в мем-
нальную активность в клетках бактерий - свя-
брану специфического белка-переносчика для
зывать аналоги холестерола и осуществлять их
повышения эффективности транспорта в клет-
транспорт через мембрану клеток и таким об-
ки стероидов или других гидрофобных субстра-
разом влиять на внутриклеточное содержание
тов - является перспективным и может быть
стероидных соединений. Присутствие STARD1
использован, в частности, для оптимизации
в клетках в функционально-активном состоя-
функционирования микроорганизмов-биока-
нии указывает на его корректный фолдинг в
тализаторов. Результаты работы представляют
клетках E. coli. STARD1 является чрезвычай-
собой основу для дальнейших исследований,
но важным регуляторным белком и вовлечён в
направленных на понимание механизма функ-
развитие ряда серьёзных заболеваний, однако
ционирования STARD1 в живых клетках E. coli,
к настоящему времени нет однозначных дан-
а также на развитие указанного подхода и поиск
ных о механизме его функционирования [22].
других белков-переносчиков стероидов, при-
С учётом данных о том, что STARD1 способен
годных для повышения эффективности био-
осуществлять транспорт холестерола не толь-
трансформации стероидов клетками E. coli.
ко в стероидогенных клетках млекопитающих,
но и в нестероидогенных клетках, таких как
Вклад авторов. Л.А. Новикова, М.А. Руб-
клетки почек обезьяны COS-1 [25] и клетки
цов - концепция и руководство работой, напи-
карциномы печени человека HepG2 [26], King
сание текста; С.В. Замалутдинова, Л.В. Исаева,
et al. [26] высказали предположение, что меха-
А.В. Замалутдинов, Я.В. Фалетров, Л.А. Новико-
низм, посредством которого функционирует
ва - проведение экспериментов; А.В. Замалут-
STARD1, может быть реализован в разных ти-
динов - статистическая обработка результатов.
пах клеток. Наши результаты свидетельствуют
Благодарности. Работа выполнена при
в пользу этого предположения и указывают на
финансовой поддержке Российского фонда
то, что STARD1 может функционировать не
фундаментальных исследований (грант № 20-
только в разных типах клеток млекопитающих,
08-00467-а). Авторы выражают благодарность
но и, возможно, в клетках разных микроорга-
Случанко Н.Н. за предоставленные плазмиды
низмов. Возможность присутствия в клетках
pET-22b(+) и H-MBP-3C-STARD166-285.
E. coli активного STARD1 человека открыва-
Конфликт интересов. Авторы заявляют об
ет перспективы для проведения исследований
отсутствии конфликта интересов.
его характеристик не только с использованием
Соблюдение этических норм. Настоящая
выделенного белка или культур клеток млеко-
статья не содержит описания каких-либо ис-
питающих, но и в простых модельных системах
следований с участием людей или животных в
in vivo на основе клеток E. coli.
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Kuhl, H.
(2011) Pharmacology of progestogens,
technologies of gene engineering, Biochemistry (Mos-
J. Reproduktionsmed. Endokrinol., 8, 157-176, doi:
cow), 74, 1482-1504, doi:10.1134/s0006297909130057.
10.1007/978-3-319-14385-9_2.
4. Mauersberger, S., Novikova, L. A., and Shkumatov,
2. Fu, B., Ren, Q., Ma, J., Chen, Q., Zhang, Q., et al.
V. M. (2013) in Yarrowia Lipolytica. Microbiology
(2022) Enhancing the production of physiologically
Monographs (Barth, G., ed.) vol. 25. Springer, Berlin,
active vitamin D3 by engineering the hydroxylase
Heidelberg, doi: 10.1007/978-3-642-38583-4_7.
CYP105A1 and the electron transport chain, World
5. Donova, M. V., and Egorova, O. V. (2012) Microbi-
J. Microbiol. Biotechnol.,
38,
14, doi:
10.1007/
al steroid transformations: Current state and pros-
s11274-021-03193-1.
pects, Appl. Microbiol. Biotechnol., 94, 1423-1447,
3. Novikova, L. A., Faletrov Y. V., Kovaleva I. E., Mau-
doi: 10.1007/s00253-012-4078-0.
ersberger, S., Luzikov, V. N., et al. (2009) From struc-
6. Efimova, V. S., Isaeva, L. V., Rubtsov, M. A., and
ture and functions of steroidogenic enzymes to new
Novikova, L. A. (2019) Analysis of in vivo activity
БИОХИМИЯ том 87 вып. 9 2022
12*
1
340
ЗАМАЛУТДИНОВА и др.
of the bovine cholesterol hydroxylase/lyase system
system in the HEK293T cell line, J. Cell. Biochem.,
proteins expressed in Escherichia coli, Mol. Biotechnol.,
120, 3124-3136, doi: 10.1002/jcb.27577.
61, 261-273, doi: 10.1007/s12033-019-00158-6.
16.
Sambrook, J., and Russell, D. W. (2001) Molecular
7.
Thevenieau, F., Beopoulos, F., Desfougeres, T.,
Cloning: A Laboratory Manual, Cold Spring Harbor,
Sabirova, J., Albertin, K., et al. (2010) in Hand-
Cold Spring Harbor Laboratory Press, N.Y.
book of Hydrocarbon and Lipid Microbiology (Tim-
17.
Studier, F. W. (2005) Protein production by auto-
mis, K., ed.) 2nd Edn Springer, Berlin, Heidelberg,
induction in high density shaking cultures, Protein
pp. 1514-1527.
Expr. Purif., 41, 207-34. doi: 10.1016/j.pep.2005.01.016.
8.
Liu, W.-H., Horng, W.-C., and Tsai, M.-S. (1996)
18.
Laemmli, U. K. (1970) Cleavage of structural pro-
Bioconversion of cholesterol to cholest-4-en-3-
teins during the assembly of the head of bacte-
one in aqueous/organic solvent two-phase reactors,
riophage T4, Nature, 227, 680-685, doi: 10.1038/
Enzyme Microb. Technol., 18, 184-189, doi: 10.1016/
227680a0.
0141-0229(95)00091-7.
19.
Towbin, H., Staehelin, T., and Gordon, J. (1979) Elec-
9.
Clark, B. J., Wells, J., King, S. R., and Stocco, D. M.
trophoretic transfer of proteins from polyacrylamide
(1994) The purification, cloning, and expression of a
gels to nitrocellulose sheets: procedure and some ap-
novel luteinizing hormone-induced mitochondrial
plications, Proc. Natl. Acad. Sci. USA, 76, 4350-4354,
protein in MA-10 mouse Leydig tumor cells. Charac-
doi: 10.1073/pnas.76.9.4350.
terization of the steroidogenic acute regulatory protein
20.
Lowry, O. H., Rosebrough, N. J., Farr, A. L., and
(StAR), J. Biol. Chem., 269, 28314-28322.
Randall, R. J. (1951). Protein measurement with the
10.
Kallen, C. B., Billheimer, J. T., Summers, S. A.,
Folin phenol reagent, J. Biol. Chem., 193, 265-270.
Stayrook, S. E., Lewis, M., et al. (1998) Steroidogen-
21.
R. Core Team (2021) R: A Language and Environment
ic acute regulatory protein (StAR) is a sterol trans-
for Statistical Computing. R Foundation for Statistical
fer protein, J. Biol. Chem.,
273,
26285-26288,
Computing, Vienna, Austria.
doi: 10.1074/jbc.273.41.26285.
22.
Tugaeva, K. V., and Sluchanko, N. N.
(2019)
11.
Arakane, F., Sugawara, T., Nishino, H., Liu, Z.,
Steroidogenic acute regulatory protein: structure,
Holt, J. A., et al. (1996) Steroidogenic acute reg-
functioning, and regulation, Biochemistry (Moscow),
ulatory protein (StAR) retains activity in the ab-
84, 233-253, doi: 10.1134/S0006297919140141.
sence of its mitochondrial import sequence: Impli-
23.
Efimova, V., Faletrov, Y., Isaeva, L., Novikova, L.,
cations for the mechanism of StAR action, Proc.
Rubtsov, M., et al. (2015) Interaction of NBD-labelled
Natl. Acad. Sci. USA, 93, 13731-13736, doi: 10.1073/
fluorescent steroids and a fatty acid with Escherich-
pnas.93.24.13731.
ia coli, FEBS J., 282, Suppl. 1, p. 135, doi: 10.1111/
12.
Arakane, F., Kallen, C. B., Watari, H., Foster, J. A.,
febs.13321.
Sepuri, N. B. V., et al. (1998) The mechanism of ac-
24.
Tugaeva, K. V., Faletrov, Y. V., Allakhverdiev, E. S.,
tion of steroidogenic acute regulatory protein (StAR).
Shkumatov, V. M., Maksimov, E. G., et al. (2018)
StAR acts on the outside of mitochondria to stimulate
Effect of the NBD-group position on interaction of
steroidogenesis, J. Biol. Chem., 273, 16339-16345,
fluorescently-labeled cholesterol analogues with hu-
doi: 10.1074/jbc.273.26.16339.
man steroidogenic acute regulatory protein STARD1,
13.
Sluchanko, N. N., Tugaeva, K. V., Faletrov, Y. V.,
Biochem. Biophys. Res. Commun.,
497,
58-64,
and Levitsky, D. I. (2016) High-yield soluble ex-
doi: 10.1016/j.bbrc.2018.02.014.
pression, purification and characterization of hu-
25.
Sugawara, T., Holt, J. A., Driscoll, D., Strauss, J. F.
man steroidogenic acute regulatory protein (StAR)
3rd, Lin, D., et al. (1995) Human steroidogenic acute
fused to a cleavable Maltose-Binding Protein (MBP),
regulatory protein: functional activity in COS-1 cells,
Protein Expr. Purif.,
119,
27-35, doi:
10.1016/
tissue-specific expression, and mapping of the struc-
j.pep.2015.11.002.
tural gene to 8p11.2 and a pseudogene to chromo-
14.
Faletrov,Y., Brzostek, A., Plocinska, R., Dz-
some 13, Proc. Natl. Acad. Sci. USA, 92, 4778-4782,
iadek, J., Rudaya, E., et al. (2017) Uptake and me-
doi: 10.1073/pnas.92.11.4778.
tabolism of fluorescent steroids by mycobacterial
26.
King, S. R., Liu, Z., Soh, J., Eimerl, S., Orly, J., et al.
cells, Steroids,
117,
29-37, doi:
10.1016/j.steroids.
(1999) Effects of disruption of the mitochondrial elec-
2016.10.001.
trochemical gradient on steroidogenesis and the Ste-
15.
Efimova, V. S., Isaeva, L. V., Labudina, A. A., Tash-
roidogenic Acute Regulatory (StAR) protein, J. Ste-
litsky, V. N., Rubtsov, M. A., et al. (2019) Polycistronic
roid Biochem. Mol. Biol., 69, 143-154, doi: 10.1016/
expression of the mitochondrial steroidogenic P450scc
s0960-0760(98)00152-6.
БИОХИМИЯ том 87 вып. 9 2022
STARD1 ЧЕЛОВЕКА ФУНКЦИОНАЛЬНО АКТИВЕН В E. coli
1341
ANALYSIS OF THE ACTIVITY OF THE HUMAN STEROIDOGENIC
ACUTE REGULATORY PROTEIN (STARD1)
EXPRESSED IN Escherichia coli
S. V. Zamalutdinova1*, L. V. Isaeva2, A. V. Zamalutdinov1, Y. V. Faletrov3,
M. A. Rubtsov1,4, and L. A. Novikova2*
1 Faculty of Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; e-mail: zamalutdinova.sofya@mail.ru
2 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; e-mail: novik@genebee.msu.su
3 Research Institute for Physical Chemical Problems, Belarusian State University,
220030 Minsk, Belarus. e-mail: yaroslav82@tut.by
4 Sechenov First Moscow State Medical University,
119991 Moscow, Russia; e-mail: ma_rubtsov@mail.ru
One of the main obstacles to the successful use in biotechnological processes of Escherichia coli cells capable
of steroid transformation is the inefficient transport of steroid substrates into cells. We tested the possibility
of using a human cholesterol transfer protein, steroidogenic acute regulatory protein (STARD1), to increase
the efficiency of steroid uptake by bacterial cells. Genetic constructs were obtained for the synthesis in E. coli
BL21(DE3) cells of a deleted version of the STARD1 protein, including a functional domain (66-285 amino
acid residues), or of the STARD1(66-285)-GFP protein, both bearing periplasmic targeting sequence of the
bacterial protein pelB at the N terminus. Analysis of E. coli/pET22b/STARD1-GFP cell preparations using
fluorimetry and Western immunoblotting confirmed that the expression system used provides the synthesis
of a full-length heterologous protein. Using fluorescence spectroscopy, it was shown that the presence of
STARD1 provides an increase in the efficiency of assimilation of NBD-labeled cholesterol analogues by
E. coli/pET22b/STARD1 cells by 1.3-1.6 times (p < 0.05) compared with the cells of the wild strain. Thus, for
the first time it was found that human STARD1 is able to exhibit functional activity in bacterial cells, which
opens up prospects for optimization and use of a fundamentally new approach to increase the efficiency of
steroid uptake by cells - the inclusion of a specific carrier protein in the cell membrane, which can expand
the arsenal of methods used to create microorganism strains for the synthesis of widely demanded steroid
compounds.
Keywords: steroidogenic acute regulatory protein, STARD1, Escherichia coli, cholesterol, biotransformation of
steroids, fluorescence
БИОХИМИЯ том 87 вып. 9 2022