БИОХИМИЯ, 2023, том 88, вып. 1, с. 14 - 28
УДК 616-006.6
ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНЫЙ ПЕРЕХОД
КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ
ТРАНСКРИПЦИОННОГО ФАКТОРА SNAIL1
© 2023 Н.И. Литовка#, И.Ю. Житняк#, Н.А. Глушанкова*
ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина»
Министерства здравоохранения Российской Федерации,
115478 Москва, Россия; электронная почта: natglu@hotmail.com
Поступила в редакцию 01.09.2022
После доработки 27.10.2022
Принята к публикации 11.11.2022
Программа эпителиально-мезенхимального перехода (ЭМП) используется опухолевыми клетками
при активации инвазионно-метастатического каскада. С помощью конфокальной и видеомикроско-
пии нами изучены изменения цитоскелетных структур клеток линии рака молочной железы MCF-7
в ходе ЭМП при активации транскрипционного фактора Snail1. В работе была использована линия
клеток MCF-7, стабильно экспрессирующих tetOff-регулируемую конструкцию SNAI1 (MCF-7-
SNAI1). При отмывке от тетрациклина и активации Snail1 клетки MCF-7-SNAI1 вступали в ЭМП
и приобретали миграционный фенотип, сохраняя при этом экспрессию Е-кадхерина. Мы выделили
пять вариантов мезенхимального фенотипа, различающихся по морфологии клеток и скорости ми-
грации. Мигрирующие клетки обладали выраженной пластичностью и были способны быстро из-
менять как фенотип, так и скорость движения. Как показала иммунофлуоресцентная микроскопия,
в основе изменений фенотипа клеток MCF-7-SNAI1 при ЭМП лежат Arp2/3-зависимая полимериза-
ция актиновой сети в ламеллиподиях на ведущем крае, активация контрактильности миозина в зоне
за ядром, перераспределение белков межклеточной адгезии из зон межклеточного взаимодействия
на ведущий край и реорганизация сети промежуточных кератиновых филаментов.
КЛЮЧЕВЫЕ СЛОВА: опухолевая клетка, Snail1/SNAI1, эпителиально-мезенхимальный переход, клеточ-
ная миграция, пластичность опухолевых клеток, межклеточная адгезия, цитоскелет, актин, миозин.
DOI: 10.31857/S0320972523010025, EDN: PAZYYU
ВВЕДЕНИЕ
холевого микроокружения; гипоксией [3-5].
Одним из признаков ЭМП является оверэкс-
Эпителиально-мезенхимальный переход
прессия транскрипционных факторов ЭМП из
(ЭМП), в результате которого эпителиальные
семейств Snail, Twist, Zeb, которые подавляют
клетки приобретают мезенхимальный фенотип
экспрессию эпителиальных генов и активиру-
и способность к миграции, играет важную роль
ют экспрессию мезенхимальных генов [6, 7].
в эмбриональном развитии [1]. Опухолевые
Во многих случаях опухолевые клетки, всту-
клетки используют программу ЭМП для ини-
пая в ЭМП, переходят в гибридное эпители-
циации инвазионно-метастатического каска-
ально-мезенхимальное состояние. Такое со-
да [2]. В опухолях активация ЭМП связана с
стояние не является стационарным, позволяя
дерегуляцией или активацией сигнальных пу-
опухолевым клеткам претерпевать дальнейшие
тей (EGF, HGF, Wnt, TGF-β, IGF, Notch-сиг-
изменения, а также способствует их выжива-
налингом) в результате мутаций генов ре-
нию и диссеминации [8, 9].
цепторов и других компонентов сигнальных
Транскрипционный фактор Snail1, от-
путей; сигналами от матрикса и от клеток опу- носящийся к семейству Snail, имеет четы-
ре цинковых пальца, домены SNAG, NES и
богатый серином SRD-домен. Основной ми-
Принятые сокращения: ЭМП - эпителиально-мезен-
химальный переход; АК - межклеточные адгезионные
шенью Snail1 является ген CDH1, продукт ко-
контакты.
торого - белок межклеточных адгезионных
* Адресат для корреспонденции.
контактов (АК) Е-кадхерин [10-12]. Посред-
# Авторы внесли равный вклад в работу.
ством цинковых пальцев Snail1 связывается с
14
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
15
Е-боксами (5′-CACCTG-3′) промоторной об-
железы человека MCF-7 и ее производную
ласти гена CDH1, а N-концевой SNAG-домен
MCF-7-SNAI1 с tetOff-регулируемой экспрес-
взаимодействует с корепрессорными комплек-
сией гена SNAI1 [28]. В работе также исполь-
сами, что приводит к репрессии транскрипции
зовали линию эпителия молочной железы че-
гена CDH1 через эпигенетические модифика-
ловека MCF-10A («ATCC», США). Клеточные
ции хроматина (метилирование и деацетили-
линии предоставлены проф. A. Готро.
рование гистонов Н3 и Н4) [6, 13]. При иссле-
В работе использовали первичные мы-
довании образцов рака молочной железы, рака
шиные моноклональные антитела: анти-Е-
желудка, рака толстой кишки и гепатокарци-
кадхерин, клон 36 и анти-β-катенин, клон 14
ном была показана обратная корреляция между
(«BD Transduction Laboratories», США); анти-
уровнем экспрессии Snail1 и Е-кадхерина [14].
β-актин, клон 4C2 («Merck Millipore», США);
В клетках плоскоклеточной карциномы поло-
анти-α-тубулин, клон DM1A; анти-винкулин,
сти рта было обнаружено также, что Snail1 мо-
клон hVin1; анти-α-актинин-1, клон BM-75.2;
жет активировать эндоцитозный путь деграда-
анти-γ-тубулин, клон GTU88 («Sigma-Aldrich»,
ции Е-кадхерина [15]. Подавление экспрессии
США); анти-α-катенин, клон 15D9 («Enzo»,
или аккумуляции Е-кадхерина на цитоплаз-
США), анти-кератин-8, клон H1 [29], кроли-
матической мембране сопровождается разру-
чьи поликлональные антитела: анти-p34-Arc/
шением АК, что приводит к ослаблению связи
ARPC2 («Upstate, Merck», Германия), анти-
опухолевой клетки с соседними клетками, ак-
фосфорилированные легкие цепи миозина
тивирует миграцию, инвазию и метастазиро-
(«Cell Signaling Technology», США), анти-Snail1
вание [10, 11]. Наряду с Е-кадхерином, Snail1
и крысиные поликлональные антитела, анти-
подавляет также экспрессию других эпители-
Snail1 («Cell Signaling Technology»). В качестве
альных маркеров, таких как белки клеточной
вторичных использовали антитела, конъюги-
полярности Crumbs3, Pals1, Patj, белки плотных
рованные с флуорохромами AlexaFluor 488,
контактов окклюдин и клаудины, белки десмо-
AlexaFluor 594 или AlexaFluor 647 («Jackson
сом десмоплакин и плакофилин, цитокератины
ImmunoResearch», США). В качестве вторич-
17, 18, 19, 20, интегрины α6, β4 [10, 11, 16-20].
ных антител для Вестерн-блоттинга также ис-
Snail1 рекрутирует коактиваторы к промото-
пользовали вторичные антитела козы к иммуно-
рам мезенхимальных генов, и тем самым инду-
глобулинам мыши и крысы, конъюгированные
цирует экспрессию виментина, N-кадхерина,
с пероксидазой («Jackson ImmunoResearch»).
металлопротеиназ MT1-MMP, MMP 1, 2, 7,
Также использовали флуоресцентные краси-
интегринов α2, β1, β3, коллагена, фибронек-
тели, которые добавляли вместе со вторичны-
тина, клаудина 11, что может стимулировать
ми антителами: Phalloidin, конъюгированный
миграцию опухолевых клеток [11, 21-23]. В те-
с AlexaFluor 488 («Molecular Probes», США) или
стах in vitro показано, что экспрессия экзоген-
с TRITC («Fluka», США); DAPI («Sigma-Aldrich»).
ного Snail1 индуцирует миграционную и инва-
Видеомикроскопия, обработка видео и кимо-
зивную активность эпителиальных клеток [24].
граммы. DIC (differential interference contrast)-
Оверэкспрессия Snail1 обнаружена на инвазив-
видеомикроскопию проводили на микроско-
ном фронте многих карцином [11, 25]. В опухо-
пе Nikon Eclipse Ti («Nikon», Япония) с ис-
левых клетках, экспрессирующих Snail1, индук-
пользованием объектива Plan Apo
20×/0.75
цию миграции связывают с активным Rac1 [21,
DIC N2 («Nikon») на разных сроках отмывки
26]. Также показано, что в клетках рака проста-
клеток от тетрациклина (24, 48, 72 ч). Для съем-
ты Snail1 подавлял экспрессию RKIP (Raf kinase
ки использовали 35-мм чашки со стеклянным
inhibitor protein) - ингибитора Raf/MEK/ERK и
дном («MatTek Corporation», США) или мече-
NF-κB сигнальных путей, вовлеченных в акти-
ные стекла («Bellco Biotechnologies», США),
вацию метастазирования [27]. Вместе с тем до
помещенные в 35-мм чашки со стеклянным
настоящего времени остаются практически не
дном («Greiner Bio-One», Австрия). Непосред-
изученными изменения структур цитоскелета,
ственно перед съемкой культуральную среду
определяющие возникновение миграционного
DMEM («Sigma-Aldrich») заменяли на DMEM/
фенотипа у опухолевых клеток при активации
F12 («Sigma-Aldrich»). Съемку проводили с ча-
драйвера ЭМП - Snail1.
стотой 1 кадр в мин. С помощью программы
ImageJ 1.53C («NIH», США) и плагина Manual
Tracking были определены координаты клеток
МАТЕРИАЛЫ И МЕТОДЫ
для построения треков и анализа характера их
перемещения. С помощью программы Excel
Клеточные линии, антитела и реагенты.
были построены диаграммы и графики.
В работе использовали линию рака молочной
Для построения кимограмм клеточного края
БИОХИМИЯ том 88 вып. 1 2023
16
ЛИТОВКА и др.
снимали видео с частотой 1 кадр в 4 с с исполь-
поставления сюжетов. С помощью программы
зованием микроскопа Nikon Eclipse Ti с объ-
ImageJ проводили измерения интенсивности
ективом Plan Apo VC 100×/1.40 Oil («Nikon»).
флуоресценции (ИФ) Snail1 в ядрах, исполь-
С помощью программы ImageJ и плагина Multi
зуя параметр Mean Grey Value (MGV) для ядра
Kymograph были построены кимограммы вдоль
и околоядерной зоны (фона). Далее вычисляли
вектора перемещения клетки. Ширина линии
ИФ по формуле:
для построения кимограммы - 1 пиксель.
Коиммунопреципитация и Вестерн-блоттинг.
ИФ = (MGVядра - MGVфона)/MGVфона.
Для лизирования клеток использовали бу-
фер (50 мМ Tris-HCl (pH 7,4), 120 мМ NaCl,
Диаграммы строили в программе GraphPad
1 мМ EDTA, 1% NP-40, 0,025% Na-дезоксихолат,
Prism 6 («GraphPad Software», США).
PIC (коктейль ингибиторов протеаз, «Roche»
Статистическая обработка данных. При ста-
США). Для промывок использовали Wash-бу-
тистической обработке использовали t-крите-
фер (50 мМ Tris-HCl (pH 7,4), 120 мМ NaCl,
рий Стьюдента и h-критерий Краскела-Уоллиса
1 мМ EDTA). При проведении коиммунопреци-
(для объединенных выборок). Данные представ-
питации клеточные лизаты инкубировали 20 мин
ляли как средние значения ± ошибка среднего.
с антителами, затем добавляли Protein-G агарозу
(«Invitrogen», «Thermo Fisher Scientific», США)
на 2,5 ч. Вестерн-блоттинг проводили стан-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
дартным способом с помощью ячейки Bio-RAD
(«Bio-RAD Laboratories», США): вертикальный
Целью работы было изучение миграцион-
электрофорез в 10%-ном ПААГ, затем пере-
ной активности опухолевых клеток, вступив-
нос на мембрану HybondTM-C или HybondTM-P
ших в ЭМП при активации Snail1, анализ цито-
(«Amersham», Великобритания).
скелетных структур, определяющих изменения
Флуоресцентная микроскопия, анализ флуо-
клеточной морфологии при прохождении ЭМП.
ресцентных изображений. Для флуоресцентного
В работе была использована культура клеток
окрашивания клетки фиксировали 3,7%-ным
линии рака молочной железы MCF-7, стабиль-
параформальдегидом с последующей пермеаби-
но экспрессирующих tetOff-регулируемую кон-
лизацией 0,25% (w/v) Triton X-100 или 1%-ным
струкцию SNAI1 (MCF-7-SNAI1) [28]. При
параформальдегидом с дофиксацией метано-
наличии в культуральной среде тетрацикли-
лом. Для флуоресцентной микроскопии исполь-
на клетки MCF-7-SNAI1 сохраняли фенотип,
зовали микроскоп Nikon Eclipse Ti с объективом
близкий к фенотипу родительской линии MCF-
Plan Fluor 40×/1.30 oil DIC H/N2 («Nikon») и
7, образовывая островки плотно сцепленных
сканирующий лазерный конфокальный микро-
клеток. В редкой культуре одиночные клетки
скоп Leica SP5 («Leica», Германия) с объективом
MCF-7-SNAI1 имели два варианта фенотипа:
PL APO HCX 63×/1.40-0.60 oil («Leica»). Для от-
дискоидные распластанные клетки с невысокой
слеживания конкретных фенотипов и поведе-
ламеллярной активностью по всему периме-
ния клеток непосредственно перед фиксацией
тру (М0) и неполяризованные клетки, образую-
проводили DIC-видеомикроскопию на мече-
щие дискретные протрузии (М1). Клетки обоих
ных стеклах, которые затем окрашивали для со-
фенотипов не меняли местоположение (рис. 1).
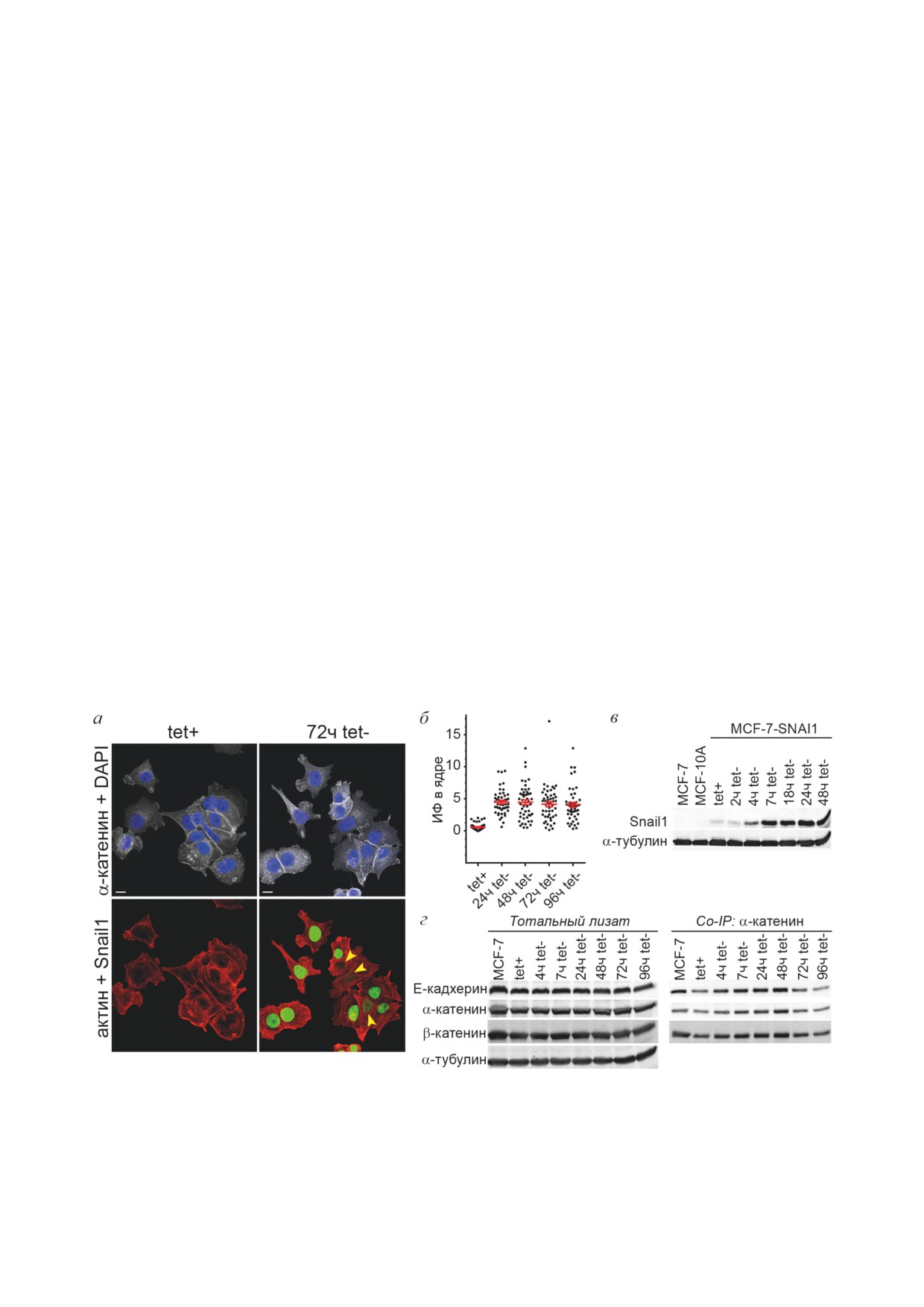
Рис. 1. Клетки MCF-7-SNAI1 в присутствии тетрациклина (tet+, контроль), варианты фенотипов. Флажками указаны
протрузии. DIC-видеомикроскопия. Шкала - 10 мкм
БИОХИМИЯ том 88 вып. 1 2023
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
17
При отмывке от тетрациклина клетки
более стабилен по сравнению со SNAI1, также
MCF-7-SNAI1 уже через 4 ч начинали экспрес-
было показано недавно в работе Wee et al. [31].
сировать Snail1, а к 24 ч его содержание в клет-
Ранее при изучении панели из более чем 60
ках (при определении Вестерн-блоттингом)
опухолевых линий было обнаружено, что со-
выходило на плато (рис. 2). Уровень экспрес-
держание Е-кадхерина в клетках не коррели-
сии Snail1, анализируемый по интенсивности
рует с уровнем экспрессии SNAI1, в отличие
флуоресценции ядер на препаратах, окрашен-
от транскрипционных факторов Snail2, TCF8
ных специфическими антителами к Snail1, мог
и ZFHX1B [32]. Экспрессия Е-кадхерина в
различаться значительно, в некоторых клет-
клетке может регулироваться на нескольких
ках MCF-7-SNAI1 в среде без тетрацикли-
уровнях, включая метилирование промотора
на Snail1 не определялся совсем. По данным
Е-кадхерина, регуляцию на уровне транскрип-
Vetter et al. [30], получивших линию MCF-7-
ции и трансляции, при этом микроРНК регу-
SNAI1, уровень экспрессии мРНК Е-кадхери-
лируют уровень экспрессии транскрипцион-
на при активации Snail1 снижался в 3-4 раза,
ных факторов ЭМП.
однако на уровне белка исследования не про-
Вместе с тем Snail1, не влияя на уровень
водились. Вместе с тем при анализе содер-
экспрессии Е-кадхерина, приводил к появ-
жания Е-кадхерина в клетках MCF-7-SNAI1
лению миграционной активности у клеток
с использованием Вестерн-блоттинга мы не
MCF-7-SNAI1: при активации Snail1 клетки
обнаружили снижения уровня его экспрессии
утрачивали эпителиальный фенотип, выходи-
при активации Snail1 (рис. 2, г). При анализе
ли из островков и мигрировали по подложке,
клеточных лизатов с помощью коиммунопре-
то есть входили в ЭМП (рис. 3, а). Как пока-
ципитации было обнаружено, что на протяже-
зало конфокально-микроскопическое иссле-
нии 96 ч после начала отмывки от тетрацикли-
дование, радикальное изменение морфологии
на в клетках сохранялись белковые комплексы
и приобретение клетками MCF-7-SNAI1 ме-
межклеточной адгезии, включающие Е-кадхе-
зенхимального фенотипа при активации Snail1
рин, α-катенин и β-катенин. Сохранение высо-
было связано с реорганизацией актинового
кого уровня экспрессии эпителиальных генов,
цитоскелета, полимеризацией актина на сво-
в частности Е-кадхерина, и включение его в
бодном крае, что определяло образование ак-
состав АК в клетках MCF-7, трансфицирован-
тивных протрузий, а также с разрушением ста-
ных трансгеном SNAI1 6SA, продукт которого
бильных АК (рис. 3, б). В контрольной культуре
Рис. 2. Активация Snail1 в клетках MCF-7-SNAI1 при отмывке от тетрациклина. а - Snail1 (зеленый канал) в ядрах
при отмывке клеток от тетрациклина. Иммунофлуоресцентное окрашивание. Флажки указывают на ядра с низкой экс-
прессией Snail1. Конфокальная микроскопия. Шкала - 10 мкм. б - Диаграмма интенсивности флуоресценции Snail1
в ядрах на разных сроках отмывки от тетрациклина. Среднее значение ± ошибка среднего, n = 55. в - Вестерн-блоттинг
лизатов клеток MCF-7, MCF-10A и MCF-7-SNAI1 на разных сроках отмывки от тетрациклина. г - Коиммунопреци-
питация белков межклеточных адгезионных контактов в клетках MCF-7 и MCF-7-SNAI1 на разных сроках отмывки
от тетрациклина. α-Тубулин - маркер загрузки
2
БИОХИМИЯ том 88 вып. 1 2023
18
ЛИТОВКА и др.
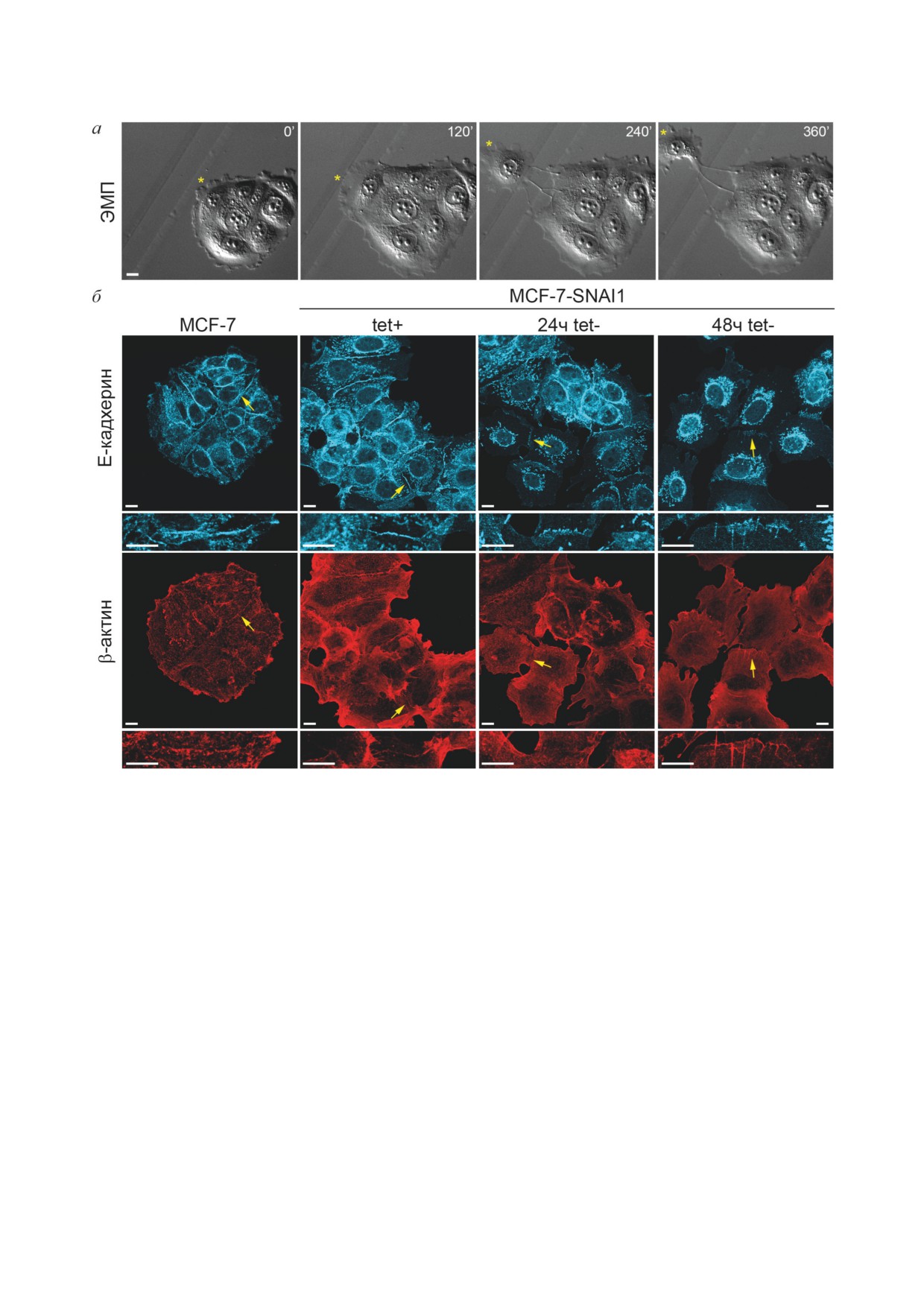
Рис. 3. ЭМП клеток MCF-7-SNAI1 при отмывке от тетрациклина. а - DIC-видеомикроскопия (начало съемки - 24 ч
tet-). Выход клетки из островка (помечена звездочкой). Шкала - 10 мкм. б - Окрашивание на Е-кадхерин и β-актин.
Контрольные клетки MCF-7 и MCF-7-SNAI1 tet+, клетки MCF-7-SNAI1 tet- на разных сроках отмывки от тетра-
циклина. Стрелками отмечены межклеточные контакты, показанные ниже при большем увеличении. Конфокальная
микроскопия. Шкала - 10 мкм
контактирующие клетки MCF-7-SNAI1 так же,
замещались радиальными или точечными АК.
как и исходные клетки MCF-7, образовывали
Радиальные АК могли быть ассоциированы с
плотные островки, в апикальной части кото-
прямыми актиновыми пучками. Как мы по-
рых располагались узкие кольцевые актино-
казали ранее [33, 34], радиальные и точечные
вые пучки, ассоциированные со стабильными
контакты нестабильны. Клетки MCF-7-SNAI1
тангенциальными АК, образованными кадхе-
при активации Snail1, несмотря на сохранение
рин-катениновыми комплексами. На свобод-
экспрессии Е-кадхерина, также утрачивали
ных краях в некоторых клетках были видны
стабильную межклеточную адгезию, они отры-
краевые актиновые пучки. В клетках, вступив-
вались от соседних клеток и мигрировали по
ших в ЭМП при активации Snail1, происходила
субстрату.
фрагментация или полное разрушение кольце-
Важным событием, определяющим ослаб-
вого актинового пучка, на межклеточных гра-
ление межклеточной адгезии в ходе ЭМП, яв-
ницах появлялись ламеллиподии. Вместе с тем
ляется фрагментация кольцевого актинового
клетки могли сохранять контакты друг с дру-
пучка, который отвечает за стабильность тан-
гом, однако тангенциальные АК в зонах меж-
генциальных Е-кадхериновых АК, характерных
клеточных взаимодействий во многих случаях
для эпителия [34]. Мы предложили гипотезу,
БИОХИМИЯ том 88 вып. 1 2023
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
19
объясняющую закономерности превращения
перераспределением α-катенина и α-актинина-1
неподвижных эпителиоцитов в мигрирующие
на ведущий край клеток. Недавно было пока-
клетки, разрывающие связи с соседними клет-
зано, что взаимодействие α-катенина с вин-
ками. Согласно этой гипотезе, разрушение коль-
кулином необходимо для распластывания фи-
цевого актинового пучка при активации ЭМП
бробластов и механо-сенсинга подлежащего
приводит к высвобождению мономерного ак-
субстрата [39]. Ранее было показано, что α-ак-
тина. В свете имеющихся данных о существова-
тинин-1 участвует в сборке актина в инвадопо-
нии в клетке конкуренции между актиновыми
диях, и его нокдаун угнетает образование инва-
системами за глобулярный актин [35], высвобож-
доподий клетками рака молочной железы [40].
дение G-актина из разрушающегося кольце-
Мы предполагаем, что оба этих актин-связываю-
вого актинового пучка на ранних этапах ЭМП
щих белка могут быть вовлечены в активацию
может приводить к включению актина во вновь
образования ламеллиподий при прохождении
образующуюся сеть ламеллиподий, что стиму-
клетками ЭМП.
лирует миграцию.
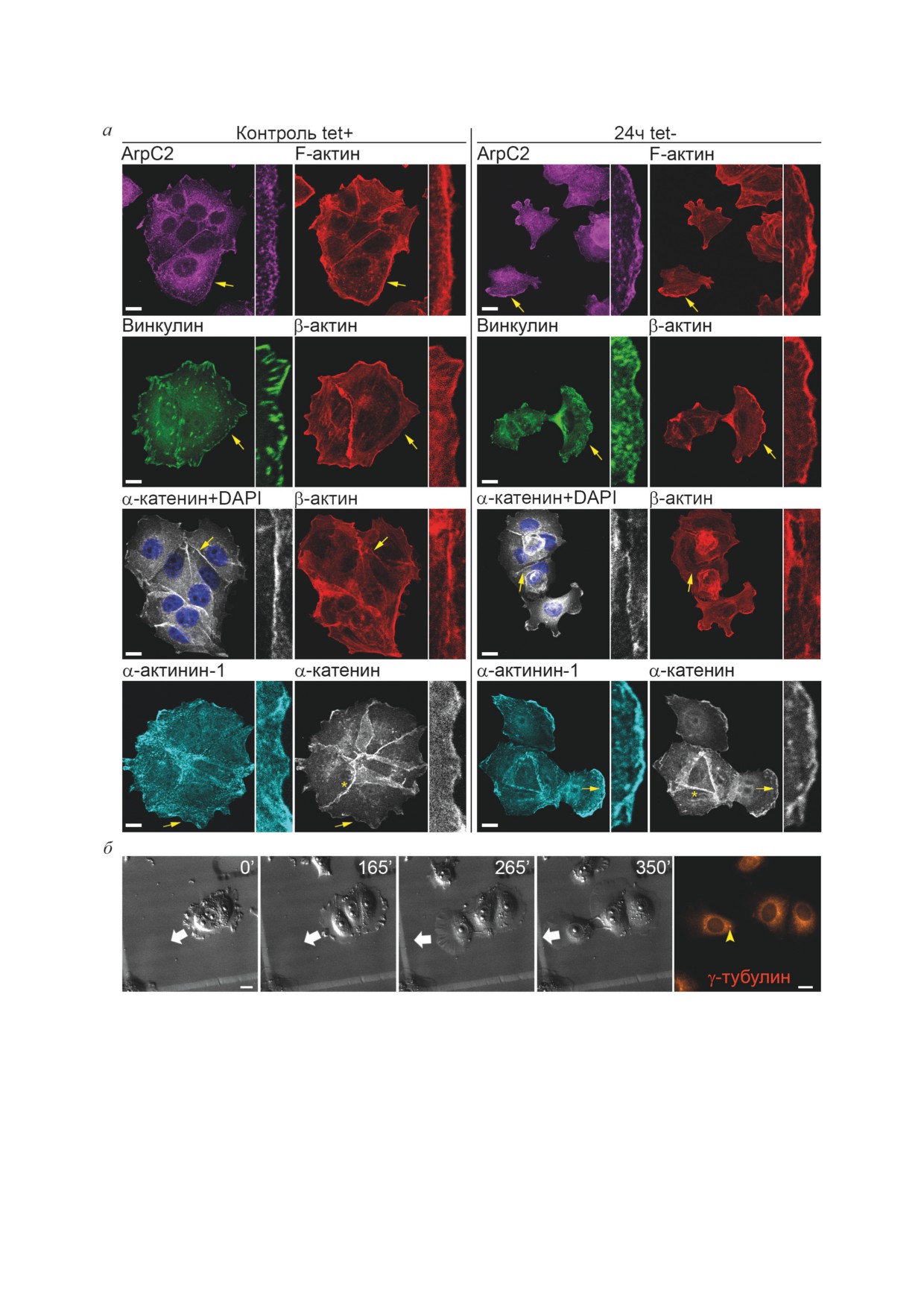
Мы также исследовали положение центра
Полимеризация актиновой сети, определяю-
организации микротрубочек, ассоциирован-
щая образование ламеллиподий, лежит в осно-
ных с центросомой, в мигрирующих клетках.
ве мезенхимального типа миграции. Клетки,
Для этого после 6 ч видеосъемки клеток 24 ч
экспрессирующие Snail1, активно образовыва-
tet- на меченых стеклах проводили окраши-
ли ламеллиподии на свободном крае (рис. 3, а).
вание на маркер центра организации микро-
Хорошо известно, что малая ГТФаза Rac ин-
трубочек - γ-тубулин. С помощью разметки
дуцирует WAVE2-зависимую полимеризацию
на меченом стекле отыскивали отснятые с по-
актина и образование ламеллиподий [36]. Ранее
мощью DIC-микроскопии сюжеты и снимали
было показано, что Rac1 активирует миграцию
их с помощью флуоресцентной микроскопии.
клеток рака поджелудочной железы, экспрес-
Центр организации центросомальных микро-
сирующих экзогенный Snail1 [21]. Ключевую
трубочек был виден не во всех клетках, однако
роль в формировании сети актиновых фила-
во многих мигрирующих клетках MCF-7-SNAI1
ментов в составе ламеллиподий и мезенхималь-
он выявлялся сзади ядра. Как недавно стало
ной миграции играет комплекс Arp2/3 [37].
ясно, такое его положение определяется балан-
При конфокально-микроскопичеком исследо-
сом сил, влияющих на сеть микротрубочек со
вании клеток MCF-7-SNAI1 с активным Snail1
стороны актина-миозина [41].
мы обнаружили аккумуляцию белка ArpС2,
Культура клеток MCF-7-SNAI1, вошед-
входящего в комплекс Arp2/3, на внешнем крае
ших в ЭМП при активации Snail1, отличалась
формирующихся ламеллиподий (рис. 4, а). Как
значительной гетерогенностью. Уже через 24 ч
показало окрашивание на винкулин, в активно
после начала отмывки от тетрациклина при
мигрирующих клетках ламеллиподии прикре-
видеомикроскопическом исследовании мож-
плялись к подложке посредством многочис-
но было видеть мигрирующие клетки с мезен-
ленных мелких фокальных адгезий (рис. 4, а),
химальным фенотипом. Клетки различались
в отличие от крупных штриховых фокальных
существенно как по форме, так и по скорости
адгезий, типичных для контрольных клеток,
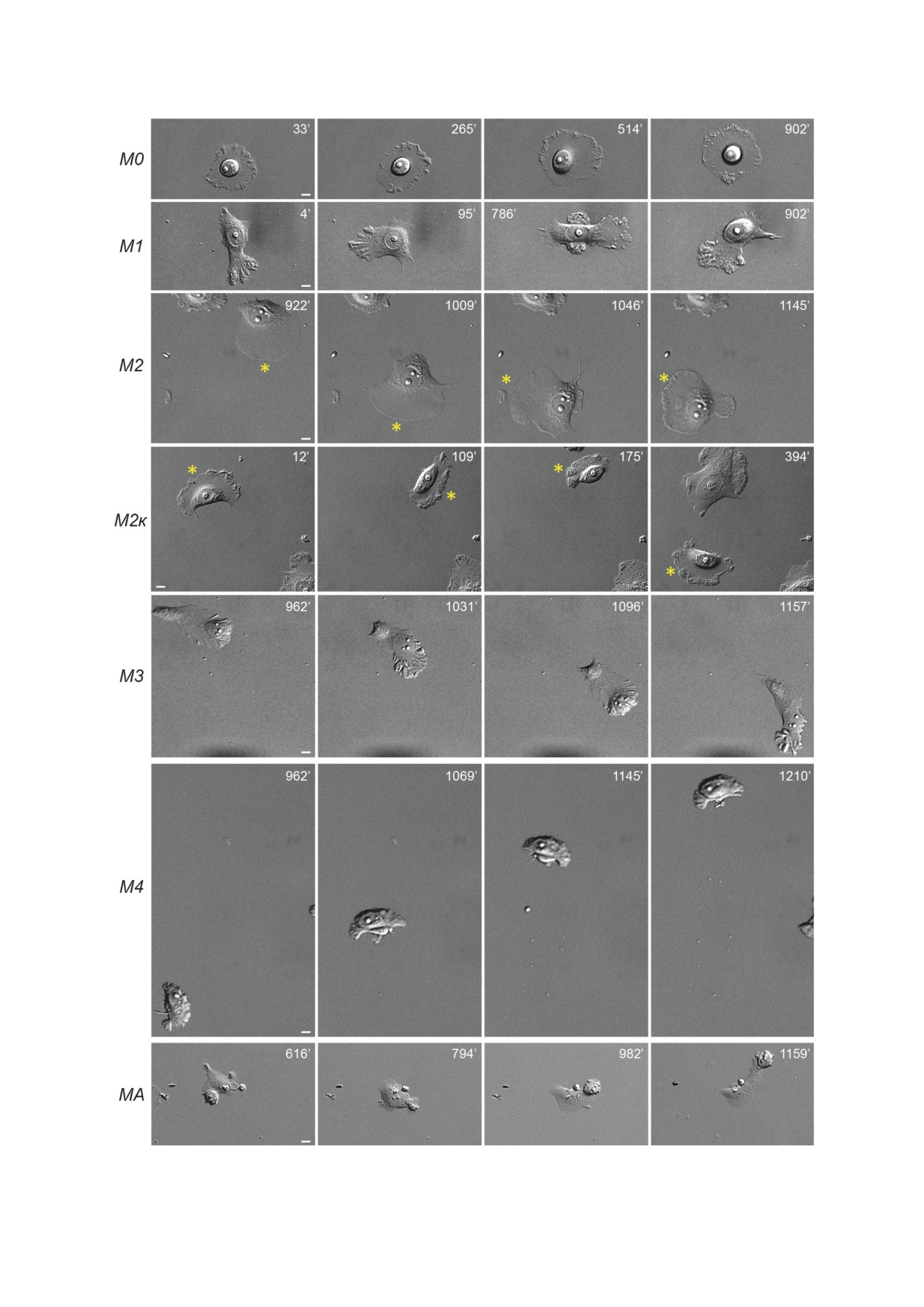
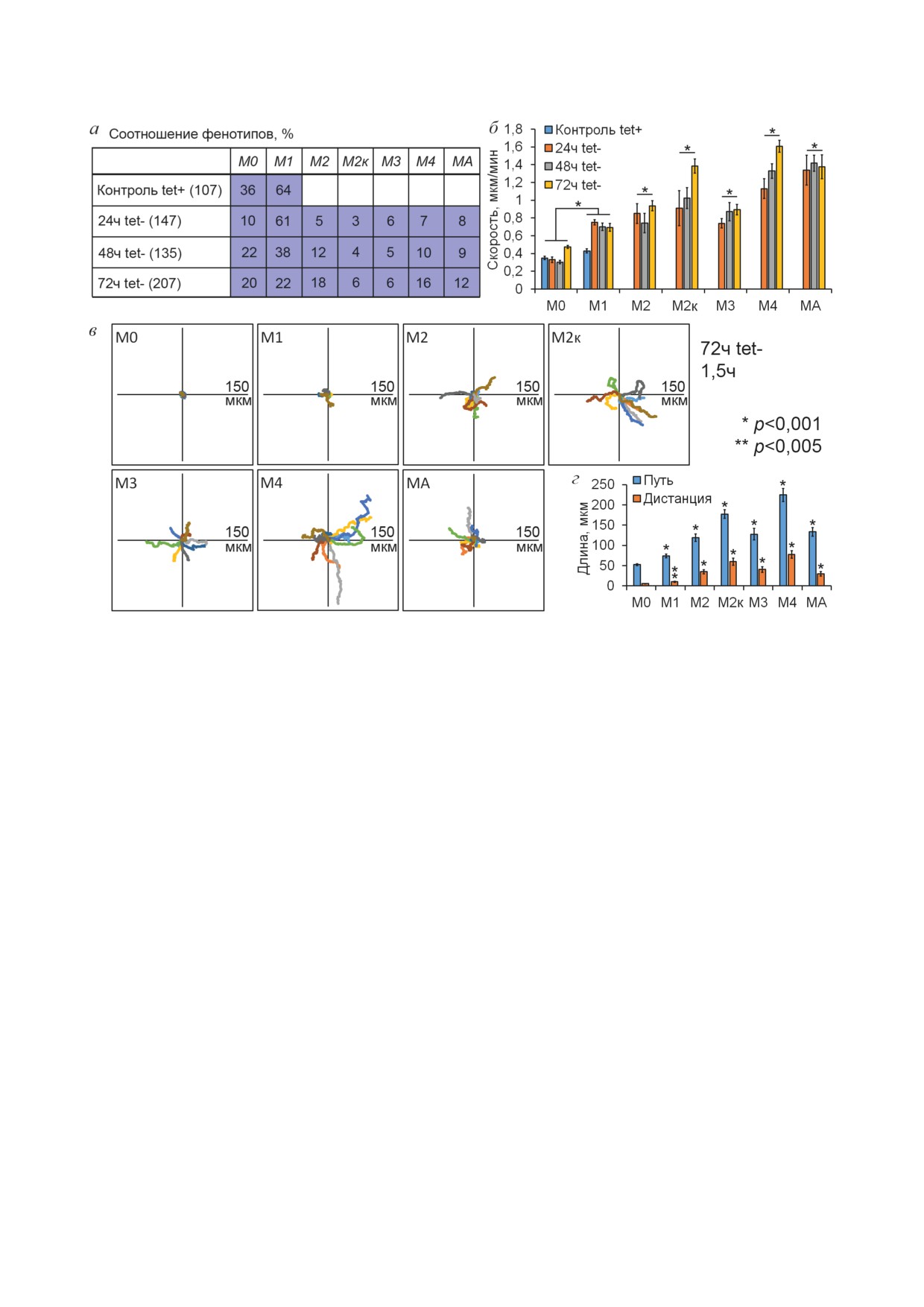
миграции. Мы выделили пять вариантов мезен-
хорошо прикрепленных к подлежащему суб-
химальных фенотипов (рис. 5 и 6, а): 1) клетки
страту. Клетки с активированным Snail1 также
с фибробласто-подобным фенотипом, образую-
отличались от контрольных клеток внутрикле-
щие широкие плоские ламеллиподии на веду-
точным распределением актин-связывающих
щем крае и хвостовую часть, прикрепленную к
белков α-катенина и α-актинина-1. В контроль-
подложке (М2); 2) быстро мигрирующие кера-
ных клетках MCF-7-SNAI1 α-катенин входил
тоцито-подобные клетки с активным ведущим
в состав тангенциальных АК. α-Катенин игра-
краем, не имеющие хвостовой части (М2к);
ет важную роль в привлечении актина в зоны
3) медленно мигрирующие поляризованные
межклеточной адгезии и стабилизации АК [38].
клетки со складчатой ламеллой, в которую мог-
В клетках MCF-7-SNAI1 с активным Snail1
ло смещаться ядро, и хвостовой частью (М3);
α-катенин, наряду с участием в построении АК,
4) быстро мигрирующие клетки, не имеющие
перемещался на ведущий край активно мигри-
хвостовой части, в ведущей ламелле которых
рующих клеток. В узкой зоне активной поли-
располагалось ядро (М4); 5) клетки с проме-
меризации актина также аккумулировался дру-
жуточным мезенхимально-амебоидным фено-
гой актин-связывающий белок - α-актинин-1
типом, образующие как ламеллиподии, так и
(рис. 4). Таким образом, вхождение в ЭМП при
блебы (МА). Клетки могли также не проявлять
активации Snail1 сопровождалось кардиналь-
направленной миграционной активности (М0 -
ной реорганизацией актинового цитоскелета,
малоподвижный фенотип и М1 - фенотип,
БИОХИМИЯ том 88 вып. 1 2023
2*
20
ЛИТОВКА и др.
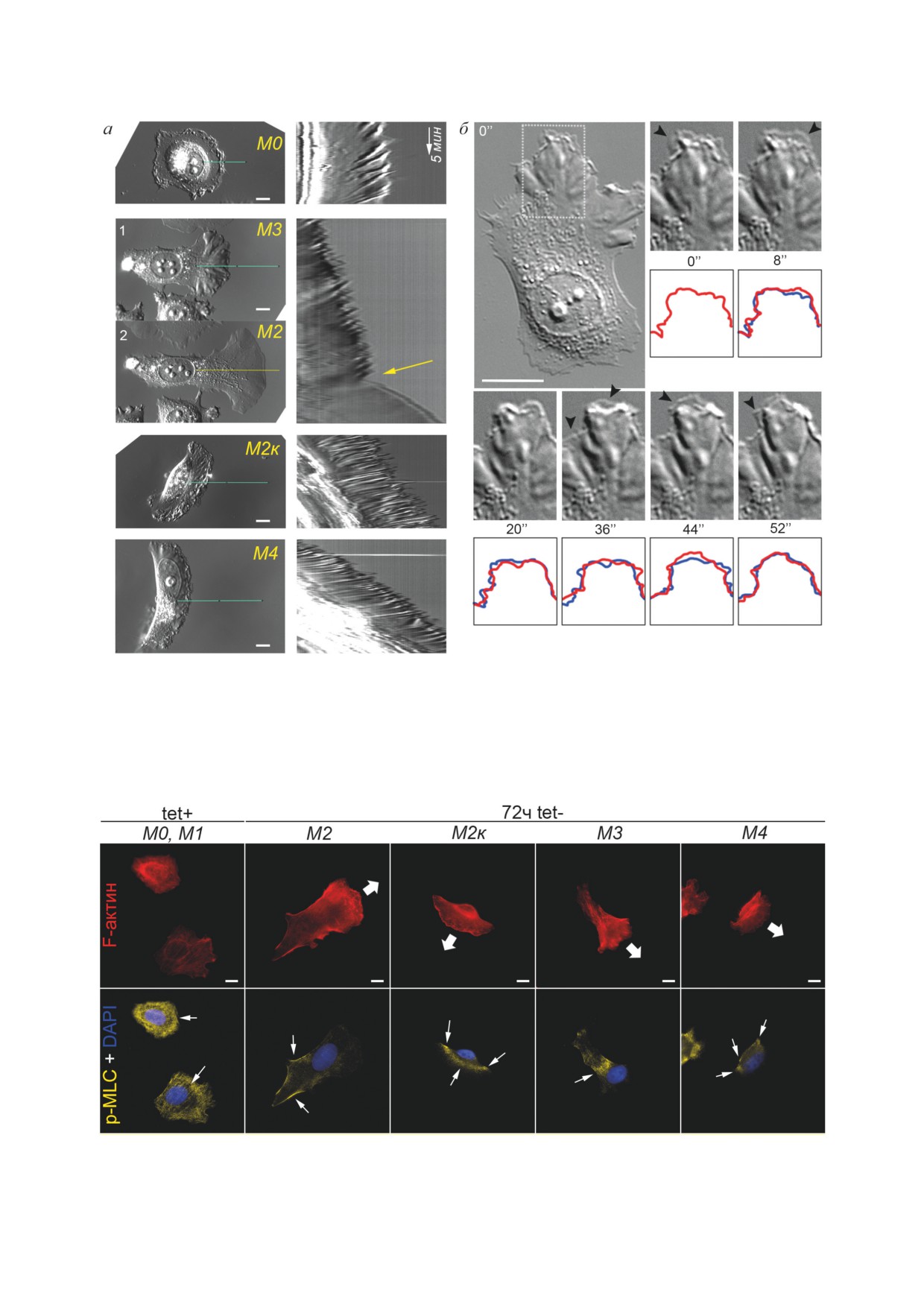
Рис. 4. Актиновый цитоскелет, межклеточные адгезионные контакты, актин-связывающие белки и центр организации
микротрубочек в клетках MCF-7-SNAI1, проходящих ЭМП при индукции Snail1. а - Флуоресцентное окрашивание
и конфокальная микроскопия. Стрелки указывают на зоны врезок. Звездочками отмечены АК. б - Положение центра
организации микротрубочек (флажок) в клетке, проходящей ЭМП. Слева - кадры видеосъемки. Стрелка показывает
направление миграции клетки из островка. Справа - окрашивание на γ-тубулин. Шкала - 10 мкм
у которого протрузии образуются не направлен-
С помощью DIC-микроскопии на разных
но). Мезенхимальная миграция, сопровождаю-
сроках отмывки от тетрациклина анализирова-
щаяся перемещением ядра на ведущий край,
ли поведение клеток в культуре. Были опреде-
описана нами впервые.
лены скорость, пройденный путь и дистанция,
БИОХИМИЯ том 88 вып. 1 2023
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
21
Рис. 5. Варианты фенотипов клеток MCF-7-SNAI1 при отмывке от тетрациклина (72 ч tet-). Звездочки маркируют
клетку с определенным фенотипом, если в кадре больше одной клетки. DIC-видеомикроскопия. Шкала - 10 мкм
БИОХИМИЯ том 88 вып. 1 2023
22
ЛИТОВКА и др.
Рис. 6. Фенотипы клеток MCF-7-SNAI1. а - Встречаемость фенотипов в культуре на разных сроках отмывки от тетра-
циклина в процентах. б - Скорости миграции клеток различных фенотипов (h-критерий Краскела-Уоллиса, скорости
клеток с определенным фенотипом относительно скоростей клеток М0 и М1). в - Траектории движения клеток раз-
личных фенотипов за 1,5 ч (72 ч tet-), n = 10. г - Средние значения пройденного за 1,5 ч пути и дистанции, на которую
удалились клетки от начальной точки, для разных фенотипов (t-критерий Стьюдента относительно М0 и М1)
на которую переместились клетки, построены
тетрациклина были М1 → М4 и М1 → М0. В куль-
траектории движения 10 клеток каждого фе-
туре клеток через 72 ч после начала отмывки от
нотипа за 1,5 ч видеонаблюдения (рис. 6, в-г).
тетрациклина фенотип клеток становился более
Наиболее быстро мигрирующими клетками
стабильным, значительная часть клеток могла
были клетки с фенотипами М2к и М4 через 72 ч
в течение 1,5-2 ч поддерживать определенную
после начала отмывки от тетрациклина.
морфологию, что не коррелировало с уровнем
Важнейшей характеристикой опухолевых
экспрессии Snail1. Молекулярные механизмы,
клеток MCF-7-SNAI1, вошедших в ЭМП при
приводящие к смене фенотипов, на данный мо-
активации Snail1, была фенотипическая пла-
мент не ясны и требуют дальнейшего изучения.
стичность: клетки в течение нескольких ми-
При большем увеличении мы исследова-
нут могли менять свой фенотип, направление
ли характер образования протрузий клеток и с
и скорость миграции (рис. 7).
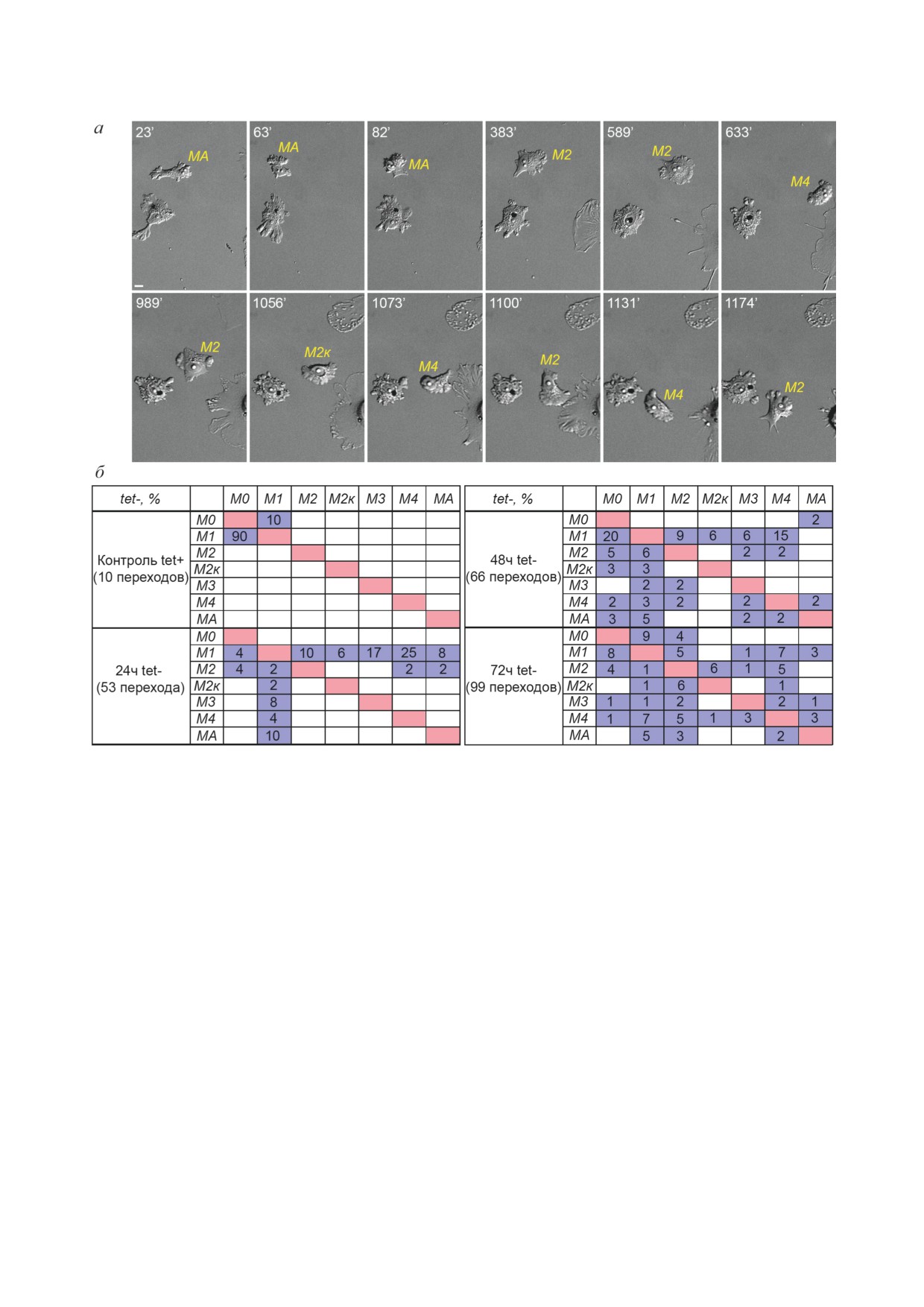
использованием плагина Multi Kymograph по-
Как видно из таблицы (рис. 7, б), в контро-
строили кимограммы, отражающие динами-
ле (в присутствии тетрациклина) клетки име-
ку протрузий на активном крае клеток и сме-
ли только фенотипы M0 и M1, контрольные
щение активного края в результате миграции
клетки значительно чаще переходили из М1 к
(рис. 8, а). Активный край клеток MCF-7-SNAI1
более распластанному фенотипу М0. Через 24 ч
с мезенхимальным фенотипом был образован
после начала отмывки от тетрациклина и акти-
непрерывно формирующимися ламеллиподия-
вации Snail1 можно было наблюдать несколько
ми, во многих клетках более проксимальная
вариантов переходов. Самыми частыми были
часть ламеллы становилась объемной, образо-
переходы М1 → М4 и М1 → М3. Далее (через
вание таких вздутий связано, по-видимому, с
48-72 ч после начала отмывки от тетрациклина)
дефектностью актинового кортекса в опухоле-
наблюдалось еще большее разнообразие вари-
вых клетках (рис. 8).
антов переходов. Самыми частыми вариантами
Были изучены особенности организации ци-
переходов через 48 ч после начала отмывки от тоскелетных структур в клетках MCF-7-SNAI1,
БИОХИМИЯ том 88 вып. 1 2023
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
23
Рис. 7. Варианты переходов между различными фенотипами клеток MCF-7-SNAI1. а - DIC-видеомикроскопия клеток
MCF-7-SNAI1 (72 ч tet-). Шкала - 10 мкм. б - Результаты анализа видео, 24-часовая съемка. Строки - исходные фено-
типы, столбцы - конечные фенотипы. Значения указаны в процентах от общего числа переходов для каждой времен-
ной точки отмывки от тетрациклина
имеющих различный миграционный фено-
новые филаменты формировали сеть, запол-
тип: проведено флуоресцентное окрашивание
няя всю цитоплазму и концентрируясь вокруг
актина, миозина и промежуточных филамен-
ядра (рис. 10, а). Известно, что промежуточные
тов. Как известно, одним из основных белков,
филаменты в клетках стабилизируют положе-
определяющих перестройки актинового ци-
ние ядра и его форму [43].
тоскелета, является миозин, контрактильная
В клетках с мезенхимальным фенотипом М2
функция которого активируется при фосфори-
на ведущем крае собиралась сеть актиновых мик-
лировании легких цепей миозина [42]. Актив-
рофиламентов, сеть промежуточных филамен-
ный миозин можно детектировать специфи-
тов в этой зоне была более разреженной, более
ческими антителами к фосфорилированным
плотная сеть промежуточных филаментов кон-
легким цепям миозина (p-MLC). В контроль-
центрировалась за ядром. Акто-миозиновые
ной культуре MCF-7-SNAI1 в присутствии те-
пучки, включающие фосфо-миозин, располага-
трациклина активный миозин в составе тонких
лись вдоль боковых краев клетки. Такие пучки
акто-миозиновых пучков детектировался в ци-
ограничивают псевдоподиальную активность и
топлазме (рис. 9).
определяют подтягивание задней хвостовой ча-
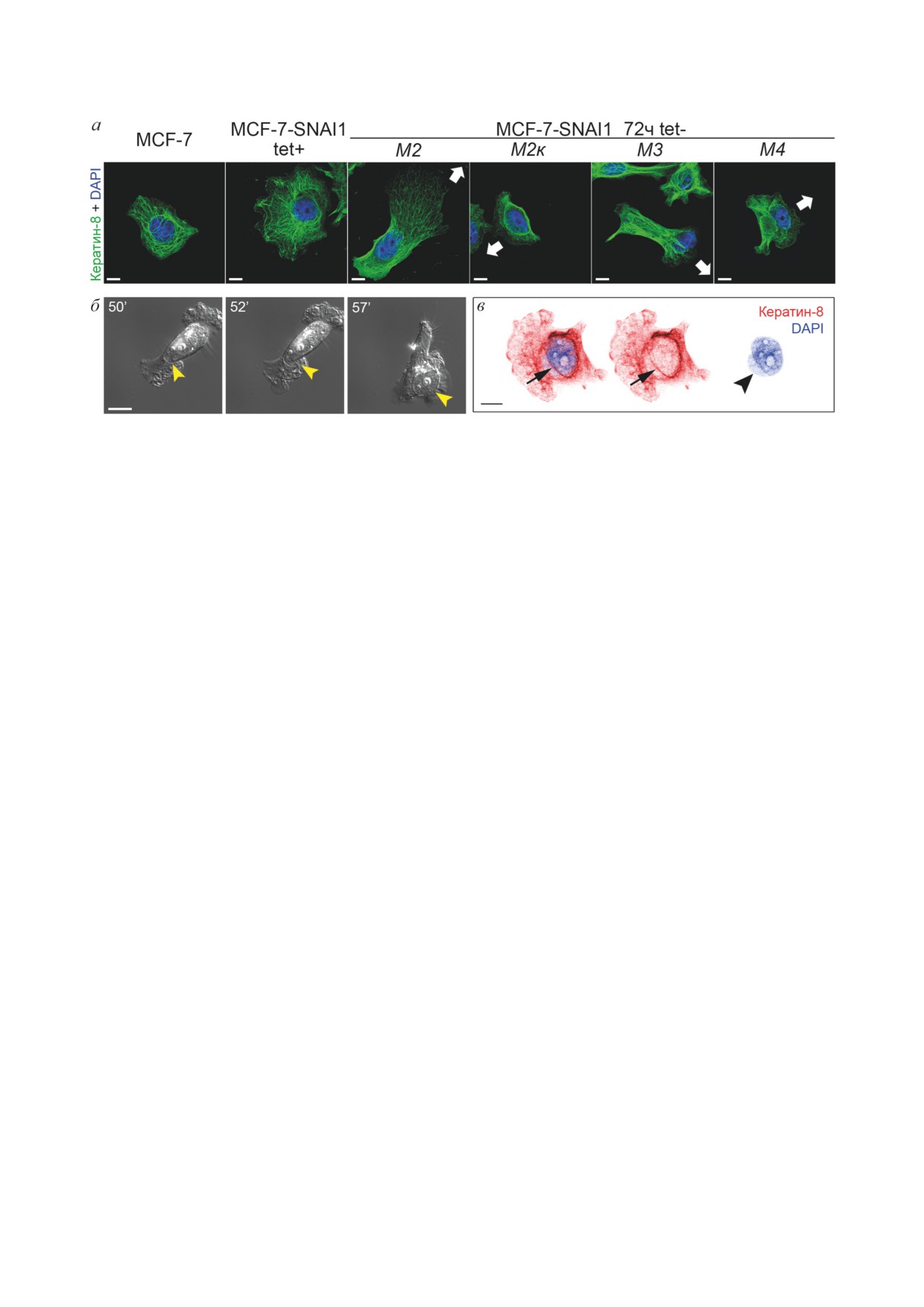
Промежуточные филаменты в клетках
сти клетки во время движения. В клетках М2к,
MCF-7 представлены кератинами, нами были
как и в кератоцитах, актин образовывал сеть
использованы антитела к кератину-8. Керати-
микрофиламентов в ламеллиподиях на ведущем
БИОХИМИЯ том 88 вып. 1 2023
24
ЛИТОВКА и др.
Рис. 8. Динамика активного края клеток MCF-7-SNAI1 (72 ч tet-). а - Кимограммы активного края. Слева - клетка
в начальной точке построения кимограммы (голубая линия), или в конечной точке (желтая линия). Справа - соответ-
ствующая кимограмма. Цифрами 1 и 2 обозначены две временные точки одного сюжета, между которыми произошла
смена типа выбрасываемой протрузии (желтая стрелка на кимограмме). Шкала - 10 мкм. Временная шкала (5 мин)
соответствует длине белой стрелки. б - Образование протрузий на активном крае. DIC-видеомикроскопия, интервалы
в секундах. Шкала - 10 мкм. Флажки указывают на вновь формирующиеся ламеллиподии. Кадры из видеомикроско-
пии продублированы контуром края клетки, где красная линия отражает текущий контур, а синяя линия дублирует
контур из предыдущей показанной временной точки для сравнения
Рис. 9. Распределение актинового цитоскелета и фосфорилированных легких цепей миозина (p-MLC) в клетках
MCF-7-SNAI1 разных фенотипов. Толстые стрелки показывают направление клеточной миграции. Тонкие стрелки
указывают на локализацию p-MLC. Флуоресцентная микроскопия. Шкала - 10 мкм
БИОХИМИЯ том 88 вып. 1 2023
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
25
Рис. 10. Локализация ядра и промежуточных филаментов в клетках разных фенотипов. а - Распределение керати-
на-8 в клетках MCF-7 и MCF-7-SNAI1 разных фенотипов. Стрелки показывают направление клеточной мигра-
ции. Конфокальная микроскопия. Шкала - 10 мкм. б - Клетка MCF-7-SNAI1 (72 ч tet-) выталкивает ядро на край.
DIC-видеомикроскопия. Шкала - 10 мкм. Флажки указывают на ядро. в - Клетка MCF-7-SNAI1 (24 ч tet-) с дефор-
мированным ядром, которое переходит в ламеллу (переход М1/М2 → M4). Стрелкой показаны промежуточные фила-
менты, концентрирующиеся вокруг ядра. Флажком показана деформированная часть ядра. Конфокальная микроско-
пия. Шкала - 10 мкм
крае и арко-подобный, содержащий фосфо-
ведущем крае клеток, активацией контрак-
миозин, пучок, параллельный ведущему краю,
тильности актина-миозина, перераспределе-
над ядром концентрировались кератиновые
нием белков актин-катенинового комплекса и
промежуточные филаменты. Полимеризация
актин-связывающих белков, перераспределе-
актиновой сети и сокращение арко-подобных
нием фокальных контактов и реорганизацией
пучков определяют перемещение таких клеток.
сети промежуточных филаментов. Миграцион-
В клетках с М3-фенотипом актиновые микро-
ный фенотип опухолевых клеток чрезвычайно
филаменты заполняли всю цитоплазму, а фос-
пластичен, реорганизации актинового цито-
форилированный миозин концентрировался за
скелета лежат в основе такой пластичности.
ядром. Можно предположить, что сокращение
акто-миозиновых пучков в этой области обу-
Вклад авторов. Н.А. Глушанкова - кон-
словливало выталкивание ядра на клеточный
цепция и руководство работой; Н.И. Литовка,
край. Промежуточные филаменты при этом
И.Ю. Житняк - проведение экспериментов;
смещались в заднюю часть клетки. В клет-
И.Ю. Житняк - анализ результатов; Н.И. Ли-
ках с фенотипом М4 акто-миозиновые пуч-
товка, И.Ю. Житняк, Н.А. Глушанкова - об-
ки, ориентированные параллельно ведущему
суждение результатов исследования; И.Ю. Жит-
краю, располагались за ядром, их сокращение,
няк - подготовка рисунков; Н.А. Глушанкова,
по-видимому, и приводило к перемещению
И.Ю. Житняк - написание текста.
ядра на ведущий край. Мы предполагаем, что
Финансирование. Работа выполнена при
особенности миграции клеток MCF-7 с акти-
финансовой поддержке Российского научного
вированным SNAI1 определяются не только
фонда (грант № 22-15-00347).
активной полимеризацией актина на ведущем
Благодарности. Выражаем благодарность
крае, но также и выраженной контрактильно-
А. Готро (Политехническая школа, Франция)
стью актина-миозина в области за клеточным
за клетки MCF-7-SNAI1, MCF-7-CTRL3,
ядром, что приводит к выталкиванию ядра на
MCF-10A, А.М. Щербакову (НМИЦ онко-
край клетки. При перемещении на ведущий
логии им. Н.Н. Блохина) за антитела к Snail1,
край клетки ядро высвобождалось из сети про-
И.Н. Бычкову за участие в экспериментах на
межуточных филаментов и часто при этом де-
начальной стадии выполнения проекта.
формировалось (рис. 10, б и в).
Конфликт интересов. Авторы заявляют об
Проведенные исследования показали, что
отсутствии конфликта интересов.
направленная клеточная миграция при ЭМП,
Соблюдение этических норм. Настоящая
как результат активации Snail1, ассоциирова-
статья не содержит описания каких-либо ис-
на с разрушением стабильных тангенциаль-
следований с участием людей или животных
ных АК, полимеризацией актиновой сети на
в качестве объектов.
БИОХИМИЯ том 88 вып. 1 2023
26
ЛИТОВКА и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Nieto, M. A., Huang, R. Y. Y. J., Jackson, R. A. A.,
14.
Barrallo-Gimeno, A., and Nieto, M. A.
(2005)
and Thiery, J. P. P. (2016) EMT: 2016, Cell, 166, 21-
The Snail genes as inducers of cell movement and
45, doi: 10.1016/J.CELL.2016.06.028.
survival: implications in development and cancer,
2.
Lambert, A. W., Pattabiraman, D. R., and Weinberg,
Development, 132, 3151-3161, doi: 10.1242/DEV.01907.
R. A.
(2017) Emerging biological principles of
15.
Kume, K., Haraguchi, M., Hijioka, H., Ishida,
metastasis, Cell, 168, 670-691, doi: 10.1016/J.CELL.
T., Miyawaki, A., Nakamura, N., and Ozawa, M.
2016.11.037.
(2013) The transcription factor Snail enhanced
3.
Dongre, A., and Weinberg, R. A. (2019) New insights
the degradation of E-cadherin and desmoglein
2
into the mechanisms of epithelial-mesenchymal
in oral squamous cell carcinoma cells, Biochem.
transition and implications for cancer, Nat. Rev. Mol.
Biophys. Res. Commun., 430, 889-94, doi: 10.1016/
Cell Biol., 20, 69-84, doi: 10.1038/S41580-018-0080-4.
J.BBRC.2012.12.060.
4.
Nikolaou, S., and Machesky, L. M.
(2020)
16.
De Craene, B., Gilbert, B., Stove, C., Bruyneel, E.,
The stressful tumour environment drives plasticity of
Van Roy, F., and Berx, G. (2005) The transcription
cell migration programmes, contributing to metastasis,
factor snail induces tumor cell invasion through
J. Pathol., 250, 612-623, doi: 10.1002/PATH.5395.
modulation of the epithelial cell differentiation
5.
Joseph, J. P., Harishankar, M. K., Pillai, A. A., and
program, Cancer Res., 65, 6237-6244, doi: 10.1158/
Devi, A. (2018) Hypoxia induced EMT: A review on
0008-5472.CAN-04-3545.
the mechanism of tumor progression and metastasis
17.
Whiteman, E. L., Liu, C. J., Fearon, E. R., and
in OSCC, Oral Oncol., 80, 23-32, doi: 10.1016/
Margolis, B. (2008) The transcription factor snail
J.ORALONCOLOGY.2018.03.004.
represses Crumbs3 expression and disrupts apico-
6.
Peinado, H., Olmeda, D., and Cano, A. (2007) Snail,
basal polarity complexes, Oncogene, 27, 3875-3879,
Zeb and bHLH factors in tumour progression: an
doi: 10.1038/ONC.2008.9.
alliance against the epithelial phenotype? Nat. Rev.
18.
Ikenouchi, J., Matsuda, M., Furuse, M., and Tsukita,
Cancer, 7, 415-428, doi: 10.1038/NRC2131.
S. (2003) Regulation of tight junctions during the
7.
Stemmler, M. P., Eccles, R. L., Brabletz, S., and
epithelium-mesenchyme transition: direct repression
Brabletz, T. (2019) Non-redundant functions of EMT
of the gene expression of claudins/occludin by Snail,
transcription factors, Nat. Cell Biol., 21, 102-112,
J. Cell Sci., 116, 1959-1967, doi: 10.1242/JCS.00389.
doi: 10.1038/S41556-018-0196-Y.
19.
Vincent, T., Neve, E. P. A., Johnson, J. R., Kukalev,
8.
Thompson, E. W., and Nagaraj, S. H.
(2018)
A., Rojo, F., Albanell, J., Pietras, K., Virtanen, I.,
Transition states that allow cancer to spread, Nature,
Philipson, L., Leopold, P. L., Crystal, R. G., de
556, 442-444, doi: 10.1038/D41586-018-04403-X.
Herreros, A. G., Moustakas, A., Pettersson, R. F., and
9.
Lu, W., and Kang, Y. (2019) Epithelial-mesenchy-
Fuxe, J. (2009) A SNAIL1-SMAD3/4 transcriptional
mal plasticity in cancer progression and metastasis,
repressor complex promotes TGF-β mediated
Dev. Cell,
49,
361-374, doi:
10.1016/J.DEVCEL.
epithelial-mesenchymal transition, Nat. Cell Biol., 11,
2019.04.010.
943-950, doi: 10.1038/NCB1905.
10.
Batlle, E., Sancho, E., Francí, C., Domínguez, D.,
20.
Haraguchi, M., Okubo, T., Miyashita, Y., Miyamoto,
Monfar, M., Baulida, J., and De Herreros, A. G.
Y., Hayashi, M., Crotti, T. N., McHugh, K. P., and
(2000) The transcription factor Snail is a repressor of
Ozawa, M. (2008) Snail regulates cell-matrix adhesion
E-cadherin gene expression in epithelial tumour cells,
by regulation of the expression of integrins and
Nat. Cell Biol., 2, 84-89, doi: 10.1038/35000034.
basement membrane proteins, J. Biol. Chem., 283,
11.
Cano, A., Pérez-Moreno, M. A., Rodrigo, I.,
23514-23523, doi: 10.1074/JBC.M801125200.
Locascio, A., Blanco, M. J., Del Barrio, M. G.,
21.
Shields, M. A., Krantz, S. B., Bentrem, D. J., Dangi-
Portillo, F., and Nieto, M. A. (2000) The transcription
Garimella, S., and Munshi, H. G. (2012) Interplay
factor
Snail
controls
epithelial-mesenchymal
between β1-integrin and Rho signaling regulates
transitions by repressing E-cadherin expression, Nat.
differential scattering and motility of pancreatic cancer
Cell Biol., 2, 76-83, doi: 10.1038/35000025.
cells by snail and slug proteins, J. Biol. Chem., 287,
12.
Kaufhold, S., and Bonavida, B. (2014) Central role
6218-6229, doi: 10.1074/JBC.M111.308940.
of Snail1 in the regulation of EMT and resistance in
22.
Yokoyama, K., Kamata, N., Fujimoto, R., Tsutsumi,
cancer: a target for therapeutic intervention, J. Exp.
S., Tomonari, M., Taki, M., Hosokawa, H., and
Clin. Cancer Res.,
33,
62, doi:
10.1186/S13046-
Nagayama, M. (2003) Increased invasion and matrix
014-0062-0.
metalloproteinase-2 expression by Snail-induced
13.
Wang, Y., Shi, J., Chai, K., Ying, X., and Zhou, B.
mesenchymal transition in squamous cell carcinomas,
(2014) The role of Snail in EMT and tumorigenesis,
Int. J. Oncol., 22, 891-898, doi: 10.3892/IJO.22.4.891.
Curr. Cancer Drug Targets, 13, 963-972, doi: 10.2174/
23.
Li, C. F., Chen, J. Y., Ho, Y. H., Hsu, W. H., Wu, L. C.,
15680096113136660102.
Lan, H. Y., Hsu, D. S. S., Tai, S. K., Chang, Y. C.,
БИОХИМИЯ том 88 вып. 1 2023
ЭМП КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ АКТИВАЦИИ SNAIL1
27
and Yang, M. H. (2019) Snail-induced claudin-11
E-cadherin expression: an integrative study, Mol. Cancer
prompts collective migration for tumour progression,
Ther., 9, 1-16, doi: 10.1158/1535-7163.MCT-09-0321.
Nat. Cell Biol., 21, 251-262, doi: 10.1038/S41556-
33.
Ayollo, D. V., Zhitnyak, I. Y., Vasiliev, J. M., and
018-0268-Z.
Gloushankova, N. A. (2009) Rearrangements of the
24.
Santamaria, P. G., Moreno-Bueno, G., Portillo, F.,
actin cytoskeleton and E-cadherin-based adherens
and Cano, A. (2017) EMT: present and future in clin-
junctions caused by neoplasic transformation change
ical oncology, Mol. Oncol., 11, 718-738, doi: 10.1002/
cell-cell interactions, PLoS One, 4, e8027, doi: 10.1371/
1878-0261.12091.
JOURNAL.PONE.0008027.
25.
Usami, Y., Satake, S., Nakayama, F., Matsumoto, M.,
34.
Zhitnyak, I. Y., Rubtsova, S. N., Litovka, N. I., and
Ohnuma, K., Komori, T., Semba, S., Ito, A., and Yo-
Gloushankova, N. A. (2020) Early events in actin cyto-
kozaki, H. (2008) Snail-associated epithelial-mesen-
skeleton dynamics and E-cadherin-mediated cell-cell
chymal transition promotes oesophageal squamous
adhesion during epithelial-mesenchymal transition,
cell carcinoma motility and progression, J. Pathol.,
Cells, 9, 578, doi: 10.3390/CELLS9030578.
215, 330-339, doi: 10.1002/path.2365.
35.
Suarez, C., and Kovar, D. R. (2016) Internetwork
26.
Henderson, V., Smith, B., Burton, L. J., Randle,
competition for monomers governs actin cytoskeleton
D., Morris, M., and Odero-Marah, V. A.
(2015)
organization, Nat. Rev. Mol. Cell Biol., 17, 799-810,
Snail promotes cell migration through PI3K/AKT-
doi: 10.1038/NRM.2016.106.
dependent Rac1 activation as well as PI3K/AKT-
36.
Miki, H., Suetsugu, S., and Takenawa, T.
(1998)
independent pathways during prostate cancer pro-
WAVE, a novel WASP-family protein involved in actin
gression, Cell Adhes. Migr., 9, 255-264, doi: 10.1080/
reorganization induced by Rac, EMBO J., 17, 6932-
19336918.2015.1013383.
6941, doi: 10.1093/EMBOJ/17.23.6932.
27.
Beach, S., Tang, H., Park, S., Dhillon, A. S., Keller,
37.
Campellone, K. G., and Welch, M. D. (2010) A nuclea-
E. T., Kolch, W., and Yeung, K. C. (2008) Snail is a
tor arms race: cellular control of actin assembly, Nat. Rev.
repressor of RKIP transcription in metastatic prostate
Mol. Cell Biol., 11, 237-251, doi: 10.1038/NRM2867.
cancer cells, Oncogene,
27,
2243, doi:
10.1038/
38.
Buckley, C. D., Tan, J., Anderson, K. L., Hanein, D.,
SJ.ONC.1210860.
Volkmann, N., Weis, W. I., Nelson, W. J., and Dunn,
28.
Yatskou, M., Novikov, E., Vetter, G., Muller, A.,
A. R. (2014) The minimal cadherin-catenin complex
Barillot, E., Vallar, L., and Friederich, E.
(2008)
binds to actin filaments under force, Science, 346,
Advanced spot quality analysis in two-colour
1254211, doi: 10.1126/SCIENCE.1254211.
microarray experiments, BMC Res. Notes,
1, 80,
39.
Mukherjee, A., Melamed, S., Damouny-Khoury, H.,
doi: 10.1186/1756-0500-1-80.
Amer, M., Feld, L., Nadjar-Boger, E., Sheetz, M. P.,
29.
Guelstein, V. I., Tchypysheva, T. A., Ermilova, V. D.,
and Wolfenson, H. (2022) α-Catenin links integrin
Litvinova, L. V., Troyanovsky, S. M., and Bannikov,
adhesions to F-actin to regulate ECM mechanosensing
G. A.
(1988) Monoclonal antibody mapping of
and rigidity dependence, J. Cell Biol., 221, e202102121,
keratins 8 and 17 and of vimentin in normal human
doi: 10.1083/JCB.202102121.
mammary gland, benign tumors, dysplasias and breast
40.
Yamaguchi, H., Ito, Y., Miura, N., Nagamura, Y.,
cancer, Int. J. Cancer, 42, 147-153, doi: 10.1002/
Nakabo, A., Fukami, K., Honda, K., and Sakai, R.
IJC.2910420202.
(2017) Actinin-1 and actinin-4 play essential but
30.
Vetter, G., Le Béchec, A., Muller, J., Muller, A.,
distinct roles in invadopodia formation by carcinoma
Moes, M., Yatskou, M., Al Tanoury, Z., Poch, O.,
cells, Eur. J. Cell Biol., 96, 685-694, doi: 10.1016/
Vallar, L., and Friederich, E. (2009) Time-resolved
J.EJCB.2017.07.005.
analysis of transcriptional events during SNAI1-
41.
Jimenez, A. J., Schaeffer, A., De Pascalis, C., Letort,
triggered epithelial to mesenchymal transition,
G., Vianay, B., Bornens, M., Piel, M., Blanchoin, L.,
Biochem. Biophys. Res. Commun.,
385,
485-491,
and Théry, M. (2021) Acto-myosin network geometry
doi: 10.1016/j.bbrc.2009.05.025.
defines centrosome position, Curr. Biol., 31, 1206-
31.
Wee, K., Hediyeh-Zadeh, S., Duszyc, K., Verma, S.,
1220.e5, doi: 10.1016/j.cub.2021.01.002.
Nanavati, B. N., Khare, S., Varma, A., Daly, R. J.,
42.
Vicente-Manzanares, M., Ma, X., Adelstein, R. S.,
Yap, A. S., Davis, M. J., and Budnar, S. (2020) Snail
and Horwitz, A. R. (2009) Non-muscle myosin II
induces epithelial cell extrusion by regulating RhoA
takes centre stage in cell adhesion and migration, Nat.
contractile signalling and cell-matrix adhesion, J. Cell
Rev. Mol. Cell Biol., 10, 778, doi: 10.1038/NRM2786.
Sci., 133, jcs235622, doi: 10.1242/jcs.235622.
43.
Lowery, J., Kuczmarski, E. R., Herrmann, H., and
32.
Reinhold, W. C., Reimers, M. A., Lorenzi, P., Ho,
Goldma, R. D. (2015) Intermediate filaments play
J., Shankavaram, U. T., Ziegler, M. S., Bussey, K. J.,
a pivotal role in regulating cell architecture and
Nishizuka, S., Ikediobi, O., Pommier, Y. G., and
function, J. Biol. Chem., 290, 17145, doi: 10.1074/
Weinstein, J. N. (2010) Multifactorial regulation of
JBC.R115.640359.
БИОХИМИЯ том 88 вып. 1 2023
28
ЛИТОВКА и др.
EPITHELIAL-MESENCHYMAL TRANSITION
OF BREAST CANCER CELLS ACTIVATED BY SNAIL1
TRANSCRIPTION FACTOR
N. I. Litovka#, I. Y. Zhitnyak#, and N. A. Gloushankova*
N. N. Blokhin National Medical Research Center of Oncology of the Ministry of Health of the Russian Federation,
115478 Moscow, Russia; e-mail: natglu@hotmail.com
Cancer cells use the program of epithelial-mesenchymal transition for initiation of the invasion-metastasis
cascade. Using confocal and video-microscopy, in breast cancer MCF-7 cells undergoing Snail1-induced
epithelial-mesenchymal transition reorganization of cytoskeleton was studied. We used the line of MCF-7
cells stably expressing tetOff SNAI1 construct (MCF-7-SNAI1 cells). After tetracycline washing and Snail1
activation MCF-7-SNAI1 cells underwent EMT and acquired a migratory phenotype retaining expression
of E-cadherin. We identified five variants of the mesenchymal phenotype, differing in cell morphology and
migration rate. Migrating cells had high degree of plasticity which allowed them to quickly change both
the phenotype and the speed of movement. The changes of phenotype of MCF-7-SNAI1 cells are based
on Arp2/3-mediated branched actin polymerization in lamellipodia, myosin-based contractility in the
zone behind the nucleus, redistribution of adhesive proteins from cell-cell contacts to the leading edge and
reorganization of intermediate keratin filaments.
Keywords: cancer cell, Snail1/SNAI1, epithelial-mesenchymal transition, cell migration, cancer cell plasticity, cell-
cell adhesion, cytoskeleton, actin, myosin
БИОХИМИЯ том 88 вып. 1 2023