БИОХИМИЯ, 2023, том 88, вып. 1, с. 29 - 46
УДК 577.22
ИНКАПСУЛИНЫ: СТРУКТУРА, СВОЙСТВА,
ПРИМЕНЕНИЕ В БИОТЕХНОЛОГИИ
Обзор
© 2023 Н.С. Чмелюк1,2, В.В. Ода1, А.Н. Габашвили1, М.А. Абакумов1,2*
1 ФГАОУ ВО «Национальный исследовательский технологический университет «МИСиС»,
119049 Москва, Россия; электронная почта: abakumov1988@gmail.com
2 ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова»
Минздрава России, 117977 Москва, Россия
Поступила в редакцию 16.09.2022
После доработки 04.11.2022
Принята к публикации 07.11.2022
В 1994 году был обнаружен новый класс прокариотических компартментов, получивших собиратель-
ное название «инкапсулины» или «нанокомпартменты». Белки-протомеры оболочек инкапсулинов
самоорганизуются с образованием икосаэдрических структур различных диаметров (24-42 нм).
Внутри оболочек нанокомпартментов могут быть инкапсулированы один или несколько грузовых
белков, разнообразных по своим функциям. Кроме того, в нанокомпартменты могут быть загруже-
ны ненативные грузовые белки, а поверхности оболочек возможно модифицировать при помощи
различных соединений, что позволяет создавать системы направленной доставки препаратов, метки
для оптической и МРТ-визуализации, а также использовать инкапсулины в качестве биореакторов.
В настоящем обзоре описывается ряд подходов к применению инкапсулинов в различных областях
науки, включая биомедицину и нанобиотехнологии.
КЛЮЧЕВЫЕ СЛОВА: инкапсулины, самоорганизация, наноконтейнерные системы, направленная
доставка, генетические метки, отслеживание клеток.
DOI: 10.31857/S0320972523010037, EDN: PBIQDI
ВВЕДЕНИЕ
часто необратимым последствиям. Главными
«депо» для избытка солей тяжелых металлов
Известно, что для поддержания гомеостаза
являются кровеносное русло и печень. Прока-
у млекопитающих используются различные ме-
риотические клетки обычно лишены мембран-
ханизмы: например, транспорт железа в клетках
ных компартментов, характерных для эукариот,
осуществляется трансферринами, а его нако-
но вместо этого содержат множество белковых
пление, в том числе для защиты от оксидатив-
компартментов, способных накапливать боль-
ного стресса, происходит за счет ферритинов;
шое количество молекул. Впервые особые бел-
Na/K-АТФаза контролирует количество ионов
ковые нанокомпартменты, позднее названные
натрия и калия внутри клетки. Практически все
инкапсулинами, были обнаружены в 1994 году
реакции в живых организмах протекают при
в надосадочной жидкости культуры бактерий
участии различных ферментов, которые могут
штамма Brevibacterium linens, проявлявших
содержать в себе ионы таких металлов, как Fe,
бактериостатическую активность в отноше-
Zn, Cu и др., однако количество этих металлов
нии различных штаммов Arthrobacter, Bacillus,
в организме невелико, а их сильный избыток
Brevibacterium, Corynebacterium и Listeria [1].
или недостаток при изменяющихся внешних
Впоследствии подобные белковые комплексы
факторах может приводить к разным тяжелым, были идентифицированы в надосадочной жид-
Принятые сокращения: Bfr - бактериоферритин; CLP - пептид загрузки; DHFR - дигидрофолатредуктаза; DyP -
пероксидаза, обесцвечивающая краситель; eMIONs - магнитные наночастицы оксида железа, продуцируемые инкапсу-
лином; FLP - ферритиноподобный белок; FolB - фермент, отвечающий за синтез фолиевой кислоты; IMEF - железо-
минерализующий инкапсулин-ассоциированный белок Firmicute; miniSOG - мини-генератор синглетного кислорода;
OVA - овальбумин; Т - триангуляционное число.
* Адресат для корреспонденции.
29
30
ЧМЕЛЮК и др.
кости культур Mycobacterium tuberculosis (Myc.
проведенных исследований была создана база
tuberculosis) [2] и Thermotoga maritima [3], при-
данных бактериальных микрокомпартментов,
чем оказалось, что эти структуры содержат
включающая в себя также описание и различ-
в себе протеолитические ферменты. В ходе
ные характеристики инкапсулинов [25].
ряда исследований инкапсулины были об-
наружены также у бактерий Mycobacterium
leprae, Streptomyces и позднее - у Quasibacillus
СТРУКТУРА И СВОЙСТВА
thermotolerans [4-9]. Однако в последующих
ОБОЛОЧКИ НАНОКОМПАРТМЕНТОВ
исследованиях протеолитическая активность
не была подтверждена, и на сегодняшний день
Оболочки инкапсулинов представляют со-
считается, что инкапсулины выполняют по
бой икосаэдрические (12 вершин, 20 граней,
большей степени структурную функцию [10].
30 ребер) комплексы, образующиеся путем са-
В середине 2000-х годов было установлено, что
мосборки белков-протомеров, гомологичных
наблюдаемые структуры с высокой молеку-
по своей структуре gp5 - основному капсид-
лярной массой представляют собой белковые
ному белку фага HK97 [26]. Как и в случае
капсидоподобные комплексы [10-12].
вирусных капсидов, белки оболочки инкапсу-
С течением времени исследования нано-
линов могут собираться в икосаэдры различ-
компартментов были продолжены. Часть иссле-
ных размеров. На сегодняшний день известно
дований была направлена на поиск новых бел-
3 различных типа инкапсулинов, которые ха-
ковых компартментов и изучение их свойств,
рактеризуют с помощью триангуляционно-
а также выяснение физиологической роли ин-
го числа (Т), представляющего собой частное
капсулинов и их грузовых белков в естественном
от деления числа протомеров в оболочке ин-
бактериальном
«контексте». Другие работы
капсулина на 60 [27]. Например, инкапсули-
были посвящены применению таких струк-
нами с Т = 1 являются T. maritima [10], Myc.
тур в качестве биореакторов, систем доставки
tuberculosis [22] и Rhodococcus jostii [21] (диа-
препаратов, а также эндогенных меток [13-20].
метр оболочки
20-24 нм, оболочка состо-
Биоинформационный анализ секвенирован-
ит из 60 идентичных субъединиц белка-про-
ных геномов позволил выявить тысячи си-
томера). В качестве примера инкапсулинов
стем нанокомпартментов как в бактериях, так
с Т = 3 можно привести нанокомпартмен-
и в археях с огромным разнообразием грузо-
ты бактерий Pyrococcus furiosus [12], Kuenenia
вых белков [19, 21-24]. Позднее на основании
stuttgartiensis
[28,
29] и Myxococcus xanthus
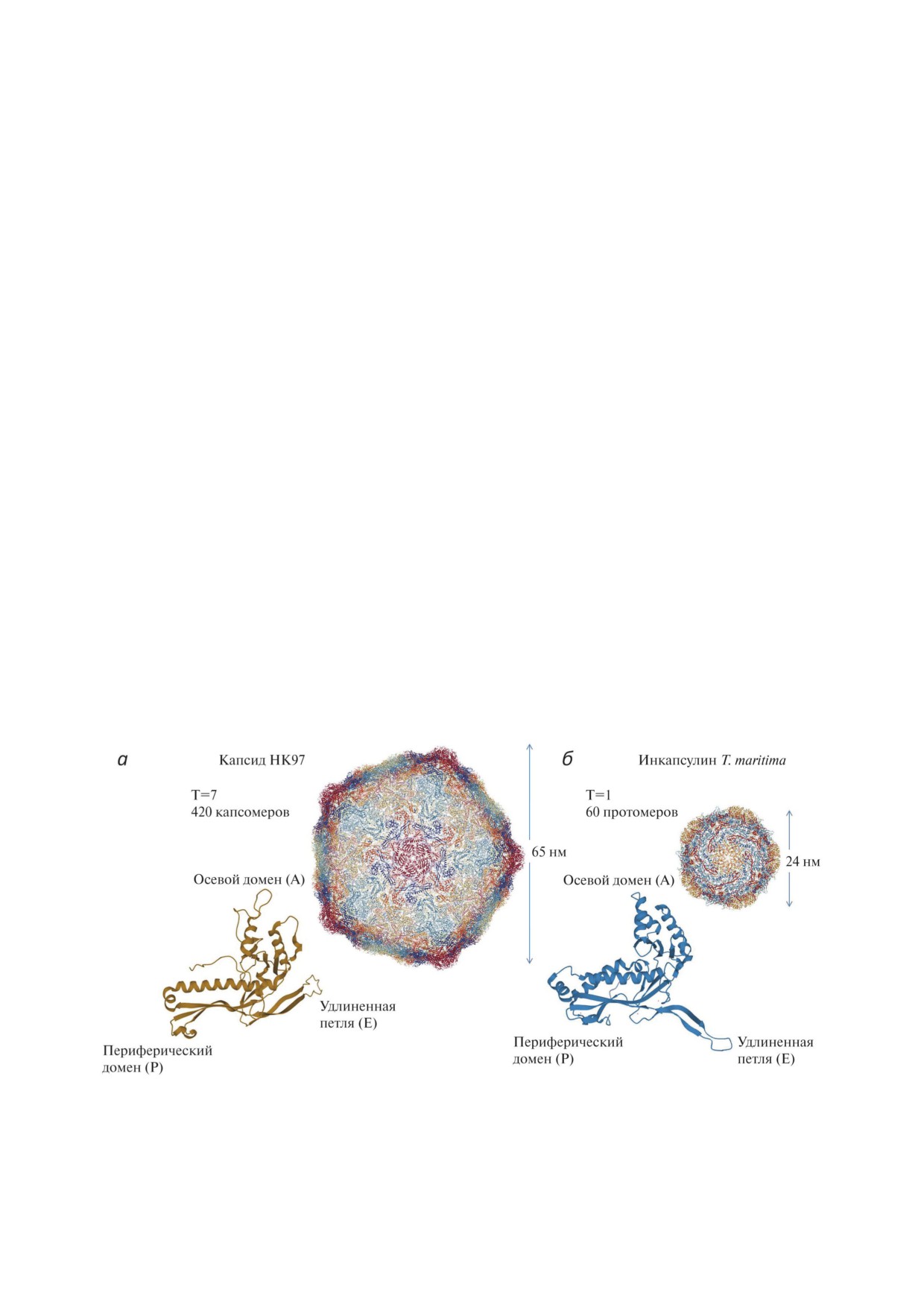
Рис. 1. Структура белкового капсида бактериофага HK97 (а). Капсид имеет диаметр 65 нм и состоит из 420 белков-
капсомеров (PDB-ID 2FT1). Ниже приведена структура отдельного капсомера (gp5). Структура оболочки инкапсулина
бактерии T. maritima (б). Инкапсулин T. maritima образован 60 идентичными белками-протомерами, диаметр белко-
вой оболочки составляет 24 нм (PDB-ID 3DKT). Ниже приведено строение белка-протомера оболочки инкапсулина
T. maritima. Как в структуре белка-протомера оболочки инкапсулина, так и в структуре капсомера gp5 имеется 3 кон-
сервативных домена: периферический домен (P), осевой домен (A) и удлиненная петля (E)
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
31
(Myx. xanthus) [23] (диаметр оболочки 30-32 нм,
ским свойствам. Например, в инкапсулинах
180 протомеров). Наконец, самыми крупны-
T. maritima поры в местах соединения пяти
ми инкапсулинами, обнаруженными на сегод-
протомеров состоят из пяти остатков гисти-
няшний день, являются инкапсулины бакте-
дина и имеют положительный заряд, а поры
рии Q. thermotolerans с T = 4 (диаметр оболочки
в местах соединения трех протомеров состо-
42 нм, 240 протомеров) [30].
ят из трех остатков фенилаланина и не имеют
В структуре белка-протомера оболочки ин-
заряда [33]. А в инкапсулинах Q. thermotolerans
капсулина, подобно капсомеру gp5 фага HK97,
все поры имеют отрицательный заряд, что
имеется 3 консервативных домена. Первым
позволяет транспортировать положительно
является периферический домен (P), содер-
заряженные субстраты [30]. Кроме того, из-
жащий несколько α-спиралей и β-складок,
вестно, что внутренняя поверхность оболочки
второй - осевой домен (A), который также
инкапсулина имеет много отрицательно заря-
имеет несколько α-спиралей и β-складок и об-
женных аминокислотных остатков, что указы-
разует ось симметрии пятого порядка, и, нако-
вает на существование определенного пути к
нец, третий - удлиненная петля (E), которая
ферритиноподобному белку (FLP, ferritin-like
важна для сборки инкапсулина и определяет
protein) для ионов железа после попадания
симметрию всего комплекса [4, 10, 13, 27, 30].
в инкапсулин [34].
Из рис. 1 хорошо видно, насколько гомологич-
Поры инкапсулина Synechococcus elongatus
но строение капсомера фага HK97 (рис. 1, а)
(Syn. elongatus) отличаются от T. maritima и
и белка-протомера оболочки инкапсулина
имеют положительно заряженные аминокис-
T. maritima (рис. 1, б).
лотные остатки снаружи [32]. Это, возможно,
Однако несмотря на высокую структурную
некая адаптация, позволяющая транспор-
гомологию протомеров инкапсулинов и капсо-
тировать отрицательно заряженный депро-
меров фага HK97, гомология аминокислотных
тонированный субстрат (L-цистеин). Поры
последовательностей в этих белках невелика.
инкапсулинов Mycobacterium smegmatis так-
Таким образом, согласно классификации базы
же имеют положительно заряженные гисти-
данных семейств белковых доменов Pfam, ин-
дины, что позволяет селективно пропускать
капсулины и HK97 являются членами одного
внутрь отрицательно заряженные субстра-
и того же клана (CL0373), но разделяются на
ты для своего грузового белка - фермента
отдельные семейства (инкапсулины относятся
пероксидазы [34].
к семейству PF04454, а бактериофаг HK97 -
Поры в оболочках инкапсулинов могут
к PF05065) [31].
иметь не только различные заряды, но и раз-
В местах соединения протомеров оболочек
ные конформации. Существует интересная ра-
нанокомпартментов имеются множественные
бота, в которой были обнаружены две конфор-
поры, диаметр которых составляет 3-7 Å [10,
мации пор у инкапсулина Haliangium ochraceum:
12]. Поры, вероятно, служат барьером прони-
закрытые и открытые
[35]. Это позволяет
цаемости для более крупных молекул, позволяя
предположить, что поры могут реагировать на
проходить через оболочку небольшим молеку-
внешние раздражители.
лам и ионам. Например, низкомолекулярные
Также известно, что размер пор может
субстраты инкапсулированных ферментов,
быть искусственно увеличен. Например, в од-
такие как перекись водорода или двухвалент-
ном из исследований была описана возмож-
ное железо, способны проходить через обо-
ность увеличения пор в оболочке инкапсулина
лочку, в то время как белки и другие крупные
T. maritima с 3 до 11 Å, то есть в 3,7 раза [36]. Ав-
молекулы - нет [16, 17, 21, 24]. В инкапсулинах
торы работы исследовали влияние аминокис-
присутствуют грузовые белки, обладающие
лотных замен и делеций в петле, формирующей
каталитической функцией, что может указы-
пору в местах соединения пяти белков-прото-
вать на избирательность транспорта субстра-
меров, на структурную целостность оболочки
та через оболочку [10], при этом транспорт
инкапсулина. В инкапсулине T. maritima такая
будет зависеть от типа инкапсулированного фер-
петля состоит из 13 а.о. Авторами было созда-
мента [32]. Считается, что наиболее вероятные
но несколько мутантных штаммов T. maritima,
транспортные каналы расположены вдоль пор,
имеющих различные замены и/или делеции
образующихся в местах соединения пяти про-
аминокислот в этой петле. Согласно получен-
томеров (так называемые 5-fold pores), по-
ным данным, самым оптимальным мутантом
скольку эти поры являются самыми крупны-
оказался штамм с делецией 7 а.о. в петле. Диа-
ми [10, 30].
метр пор в оболочке такого инкапсулина увели-
Недавно было показано, что поры мо-
чился до 11 Å, при этом целостность оболочки
гут различаться по своим электростатиче-
не нарушилась.
БИОХИМИЯ том 88 вып. 1 2023
32
ЧМЕЛЮК и др.
ГРУЗОВЫЕ БЕЛКИ ИНКАПСУЛИНОВ
фераза, приводит к их загрузке [10, 14, 16, 17, 19,
22]. Однако существуют альтернативные моде-
Впервые понимание механизма инкапсу-
ли, описывающие взаимодействие между гру-
ляции грузового белка возникло при изуче-
зовыми белкам и белками оболочки инкапсу-
нии кристаллической структуры инкапсулина
лина. В некоторых случаях, как, например, в
T. maritima. Методом рентгеновской кристал-
инкапсулинах P. furiosus, CLP отсутствует, од-
лографии было установлено наличие неболь-
нако ген, кодирующий оболочку, слит с геном,
шого количества дополнительной электронной
кодирующим грузовой белок, в результате чего
плотности, относящейся к гидрофобному кар-
образуется один полипептид (рис. 2, б) [12].
ману на люминальной поверхности оболочки
В инкапсулинах, обнаруженных у бактерий
инкапсулина, что соответствовало короткой
типа Firmicute существует одна особенность:
(около 10 а.о.) С-концевой последовательно-
загрузка грузовых белков может происходить
сти FLP, обнаруженной рядом с геном обо-
и через C-конец, и через N-конец CLP. Такой
лочки инкапсулина в геноме T. maritima [10].
нанокомпартмент содержит 2 грузовых белка:
Методом биоинформационного анализа было
C-конец CLP связан с железоминерализую-
установлено, что эта С-концевая последова-
щим инкапсулин-ассоциированным белком
тельность сохраняется у разных видов бакте-
Firmicute IMEF (iron-mineralizing encapsulin-
рий, в которых гены грузового белка и гены
associated Firmicute protein), участвующим в
оболочки инкапсулина находятся вместе в
минерализации железа, а депонирующий желе-
предполагаемом опероне. Примеры таких
зо белок ферредоксин - с N-концом CLP [19].
«предсказанных» грузовых белков включают:
Известно, что в одну оболочку наноком-
FLP, DyP (пероксидаза, обесцвечивающая
партмента может быть инкапсулировано не-
краситель, Dye-decolorizing peroxidase), геме-
сколько грузовых белков. Например, показано,
ритрин и руберитрин [10, 19].
что в инкапсулинах бактерий Myx. xanthus при-
Было показано, что эта C-концевая после-
сутствует 3 разных грузовых белка: EncB, EncC
довательность, в дальнейшем названная пепти-
и EncD [23], а у Myc. tuberculosis присутствуют
дом загрузки (cargo loading peptide (CLP)), явля-
белки: Mt-DyP, Mt-BfrB (бактериоферритин) и
ется достаточной для инкапсуляции грузового
Mt-FolB (фермент биосинтеза фолиевой кис-
белка в оболочку нанокомпартмента (рис. 2, а).
лоты) [22].
Последовательность, кодирующая CLP, может
Еще одним важным вопросом, связанным
находиться как на 3′-конце, так и на 5′-конце
с загрузкой, является доля, занимаемая грузо-
гена, кодирующего грузовой белок. Удаление
вым белком в нанокомпартменте. Каждый бе-
последовательности CLP нарушает инкапсу-
лок-протомер оболочки в инкапсулине имеет
ляцию грузового белка, в то время как слияние
сайт связывания с CLP, но, очевидно, что ко-
CLP с C-концом гетерологичных белков, таких
личество груза ограничено объемом оболочки.
как зеленый флуоресцентный белок или люци-
При этом важно понимать, что стехиометрия
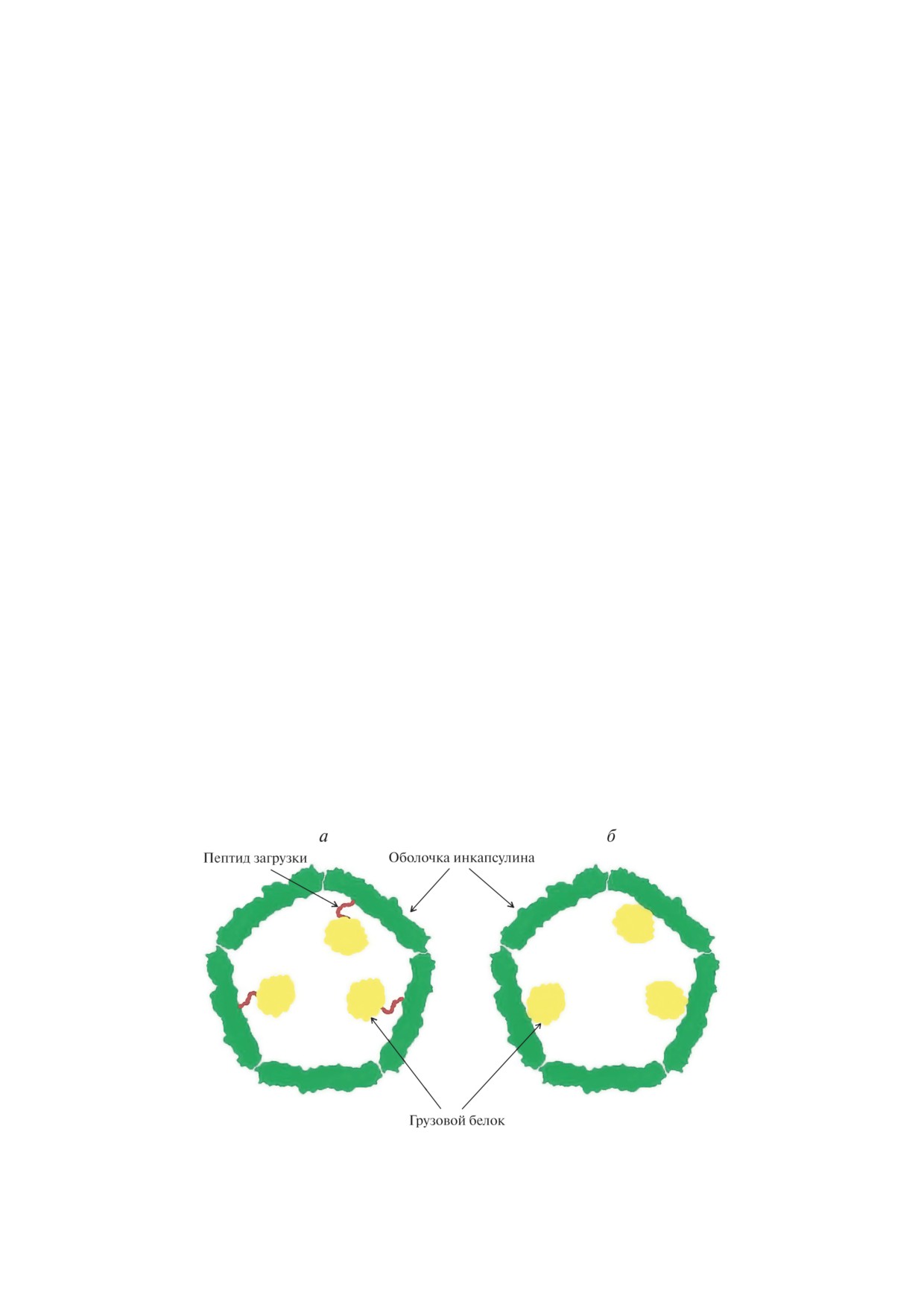
Рис. 2. Грузовой белок может быть инкапсулирован в оболочку нанокомпартмента посредством пептида загрузки (а).
В некоторых случаях ген, кодирующий грузовой белок, и ген, кодирующий оболочку инкапсулина, слиты, что сводит
на нет необходимость в пептиде загрузки (б)
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
33
зависит не только от размера оболочки ин-
(тример димеров) диаметром 89 Å. Было пред-
капсулина, но и от состояния олигомеризации
сказано, что стерические затруднения огра-
грузового(ых) белка(ов). Работы по модели-
ничат загрузку одним таким гексамером на
рованию показали, что из-за возникновения
нанокомпартмент [10], а измерения методом
стерических затруднений невозможно достичь
нативной масс-спектрометрии подтвердили
соотношения груза и белка-протомера более,
наличие 6 мономеров DyP в нанокомпартменте
чем 1 : 1 [10]. В качестве примера здесь мож-
с T = 1, что дает соотношение грузового белка
но привести нанокомпартмент B. linens, грузо-
к белку-протомеру 1 : 10 [37]. В таблице при-
вым белком которого является уже упомянутый
ведены данные о загрузке различных грузовых
выше фермент DyP, собирающийся в гексамер
белков в нанокомпартменты.
Загрузка нативных грузовых белков в различных инкапсулиновых системах
Соотношение
Инкапсулин
Грузовой белок
Число
загруженного белка
(количество
(количество
загруженных
Метод оценки
Источники
к количеству
протомеров)
субъединиц)
субъединиц
протомеров*
спектроскопия
Rhodococcu jostii (60)
DypB (6)
6
1 : 8,6**
в видимом
[21]
диапазоне
6
1 : 10
нативная МС
[37]
Brevibacterium linens (60)
DyP (6)
6
1 : 10
крио-ЭМ
[38]
6
1 : 10
ЭМ
[39]
Mycobacterium
DyP (6)
smegmatis (60)
6 и 12
1 : 10 и 1 : 5
крио-ЭМ
[40]
DyP (6)
6
1 : 10
Mycobacterium
FolB (4 или 8)
4 или 8
1 : 1
5 или 1 : 7,5
ЭМ
[22]
tuberculosis (60)
BfrB (24)
24
1 : 2
Pyrococcus furiosus (180)
FLP (10)
180
1 : 1
-
[12]
Thermotog maritima (60)
FLP (10)
30, 40 и 50
1 : 2, 1 : 1,5 и 1 : 1,2
крио-ЭМ
[41]
Haliangium ochraceum (60)
FLP (10)
40
1 : 1,2
крио-ЭМ
[35]
36 EncB
92 EncC
1 : 1
[23]
EncB
47 EncD
Myxococcus xanthus (180)
EncC
SDS-PAGE
EncD
86 ± 3 EncB
93 ± 9 EncC
1 : 1
[42]
50 ± 15 EncD
240
1 : 1
SDS-PAGE
Quasibacillus
IMEF (2)
thermotolerans (240)
84
1 : 2,9
крио-ЭМ
[30]
IMEF (2)
150
1 : 1,2
Bacillaceae bacterium (180)
SDS-PAGE
[4]
Fd (1)
10
1 : 18
Synechococcus elongatus (60)
CyD (2)
1 или 2
1 : 30 или 1 : 15
крио-ЭМ
[32]
Примечание. Fd - ферродоксин; CyD - цистеиндесульфураза, ЭМ - электронная микроскопия, МС - масс-спектрометрия.
* Загрузку определяют как соотношение между количеством мономерных единиц грузового белка и количеством прото-
меров инкапсулиновой оболочки.
** Загрузка груза путем разборки и сборки инкапсулиновой оболочки в кислых условиях.
3
БИОХИМИЯ том 88 вып. 1 2023
34
ЧМЕЛЮК и др.
ФИЗИОЛОГИЧЕСКАЯ ФУНКЦИЯ
бактерии R. jostii RHA1 с делецией гена, коди-
НАНОКОМПАРТМЕНТОВ
рующего DyP, не способен к деградации лиг-
нина [49], в то время как в бактериях штамма
О том, какую роль инкапсулины играют
дикого типа катаболизм лигнина происходит
в процессах метаболизма бактерий и архей,
активно. Исследования также показали, что ак-
известно не так много. На сегодняшний день
тивность комплекса инкапсулин-DypB в отно-
наиболее информативные результаты получе-
шении деградации нитрированного лигнина в
ны в исследованиях инкапсулинов, содержа-
8 раз выше по сравнению с неинкапсулирован-
щих FLP. Данные позволяют предположить,
ным ферментом DypB [21]. Увеличение фер-
что нанокомпартменты способны депониро-
ментативной активности при инкапсуляции
вать железо, снижая оксидативный стресс -
позволяет предположить, что нанокомпарт-
ярким примером здесь являются бактерии
мент может действовать либо путем стабили-
Q. thermotolerans, в геноме которых отсутству-
зации грузового белка, либо путем увеличения
ют ферритины [27]. В другой работе при ис-
локальной концентрации субстрата для фер-
следовании клеток Myx. xanthus в условиях
мента, тем самым усиливая ферментативную
аминокислотного голодания было обнаруже-
реакцию [50].
но, что экспрессия генов протомера оболоч-
Например, предполагается, что для выпол-
ки инкапсулина (EncA) и трех его грузовых
нения ферментативной функции такого грузо-
белков FLP (EncB, EncC и EncD) значительно
вого белка, как DyP, инкапсуляция не требу-
повышалась [23]. Авторы выдвинули гипоте-
ется [10]. Однако наблюдения подтверждают
зу о том, что инкапсулин может выступать в
гипотезу о том, что инкапсуляция позволяет
роли вторичной ферритиноподобной систе-
увеличить стабильность и/или продолжитель-
мы, имеющей большую емкость, и способ-
ность жизни грузовых белков, например, пу-
ной накапливать железо во время стресса при
тем повышения устойчивости к протеазам.
вынужденной «голодовке» или секвестриро-
К примеру, инкапсулины T. maritima крайне
вать железо во время оксидативного стресса.
устойчивы к воздействию высокой темпера-
Когда двухвалентное железо (Fe2+) подверга-
туры и денатурации [10, 17], а инкапсулины
ется воздействию активных форм кислорода,
B. linens стабильны в крайне широком диапазо-
происходит реакция Фентона, в которой Fe2+
не pH [38]. Подобно капсидам вирусных фагов,
окисляется до Fe3+ с образованием побочного
оболочки нанокомпартментов демонстрируют
продукта - гидроксильного радикала [43, 44],
минимальную деградацию после обработки
ферритины же защищают клетки от токси-
неспецифическими протеазами [16, 17]. Рези-
ческого действия, обусловленного этим про-
стентность к протеазам также распространя-
дуктом. Например, в работе McHugh et al. [23]
ется и на грузовые белки, например, люцифе-
было продемонстрировано, что мутантный
раза светлячка, упакованная в инкапсулины
штамм Myx. xanthus с делецией в последо-
Rhodococcus erythropolis N771, не подвергалась
вательности генов, кодирующих оболочки
деградации после обработки трипсином, в то
инкапсулинов, оказался более чувствителен
время как неинкапсулированная люцифераза
к добавлению перекиси водорода, по срав-
полностью деградировала [16].
нению с Myx. xanthus дикого типа. В условиях
Инкапсулины часто обнаруживаются в су-
оксидативного стресса, вызванного инкуба-
пернатанте бактериальной культуры [1, 2, 21],
цией бактерий с 0,5 мМ раствором переки-
в связи с чем была выдвинута гипотеза, что
си водорода в течение 6 часов, жизнеспособ-
нанокомпартменты являются продуктом бак-
ность мутантного штамма Myx. xanthus ока-
териальной секреции. Это было частично под-
залась существенно ниже по сравнению
тверждено в ходе наблюдения за локализацией
с жизнеспособностью Myx. xanthus дико-
инкапсулинов на мембранах клеток [2], одна-
го типа (25% и 75% жизнеспособных бак-
ко такая локализация наблюдается далеко не у
терий соответственно). Такое же свойство
всех прокариот, например, нанокомпартменты
есть и у Myc. tuberculosis [22]: каждый из трех
Streptomyces griseus находятся в цитоплазме [9].
грузовых белков, о которых уже было сказа-
Помимо этого, не существует известного ме-
но ранее (BfrB, FolB и DyP), в инкапсулинах
ханизма секреции интактного 24-42-нм бел-
Myc. tuberculosis обладает антиоксидантной ак-
кового комплекса [51]. Принимая во внима-
тивностью [45-48].
ние крайне высокие химическую стабильность
В дополнение к потенциальной роли в
и устойчивость к протеазам, более вероятно
снижении оксидативного стресса, DyP-содер-
предположить, что инкапсулины накаплива-
жащие инкапсулины также участвуют в ката-
ются в надосадочной жидкости культуры после
болизме [21]. Например, мутантный штамм
лизиса клеток [52].
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
35
ПРИМЕНЕНИЕ НАНОКОМПАРТМЕНТОВ
в клетках линии HepG2 [61, 62]. Белок обо-
В БИОТЕХНОЛОГИИ
лочки T. maritima (Encap) содержит два остат-
ка цистеина (C123 и C197), C123 расположен
Суммируя все вышесказанное, инкапсули-
на внешней поверхности Encap, что позволяет
ны - это особые белковые наночастицы, имею-
конъюгировать пептид SP94 и флуоресцентную
щие два основных преимущества. Во-первых,
метку (флуоресцеин) на поверхность оболочки
как и все наночастицы, инкапсулины облада-
инкапсулина. Таким образом, получившееся
ют развитой поверхностью (Sуд. >> Vуд.) и, что
«наноустройство» было способно специфи-
самое главное, имеют две поверхности - вну-
чески связываться с клетками HepG2 и визуа-
треннюю и внешнюю поверхности оболоч-
лизировать их за счет присутствия флуорофо-
ки инкапсулина. Во-вторых, инкапсулины
ра (рис. 3, а). В дальнейшем было показано,
кодируются генетически (т.е. происходит их
что в полученную конструкцию может быть за-
биосинтез) и поэтому могут быть получены в
гружен альдоксорубицин (6-малеимидокапро-
биологических системах со 100%-ной воспро-
ил) гидразон из доксорубицина, являющийся
изводимостью, чего нельзя достичь никакими
пролекарством и высвобождающийся при кис-
физическими или химическими методами син-
лом pH внутри опухолевых клеток. Также была
теза наночастиц любых составов. В отличие от
установлена дозозависимая цитотоксичность
химического и физического синтеза биосинтез
препарата в отношении клеток HepG2.
более экономичен и, что немаловажно, без-
В работе Putri et al. [38] было обнаружено,
опасен для окружающей среды, поскольку в
что инкапсулины B. linens, загруженные TFP
процессе биосинтеза не образуется токсичных
(teal fluorescent protein, бирюзовый флуорес-
побочных продуктов, которые необходимо
центный белок), успешно захватывались мак-
утилизировать специальным образом.
рофагами мыши J774 в культуре in vitro, что
Инкапсулины в качестве платформы для
приводило к флуоресценции клеток. При этом
доставки лекарств. Известно, что за послед-
инкапсулины оставались в цитоплазме макро-
нее десятилетие было разработано большое
фагов и не попадали в ядро. Авторы работы
количество наноразмерных систем направ-
отмечают, что выбранный модельный грузо-
ленной доставки на основе мицелл [53, 54],
вой белок с флуоресцентными свойствами воз-
липосом [55], неорганических [56] и полимер-
можно заменить на терапевтический агент и
ных [57] наночастиц, а также белковых ком-
использовать для его доставки технологию на
партментов [58, 59]. Все эти частицы с загру-
основе инкапсулинов.
женными на них препаратами используются
В одном из исследований [63] в оболочки
с целью увеличить эффективность доставки,
инкапсулинов T. maritima был загружен био-
уровень накопления препаратов в сравнении
логический фотосенсибилизатор miniSOG
с неинкапсулированными лекарственными
(мини-генератор синглетного кислорода, mini-
средствами, время циркуляции в кровотоке и
Singlet Oxygen Generator) путем слияния CLP
снизить количество побочных эффектов [60].
с С-концом белка miniSOG. Получившийся
Помимо этого, препараты для направленной
фоточувствительный нанореактор был назван
доставки могут сыграть свою роль и в диагно-
Enc-mSOG. Авторами была проведена оценка
стике заболеваний путем взаимодействия со
образования активных форм кислорода в клет-
специфическими молекулярными мишенями,
ках рака легкого A549 после облучения синим
экспрессирующимися при той или иной пато-
лазером. Предварительно клетки были инку-
логии. Как уже упоминалось выше, инкапсули-
бированы со свободным miniSOG либо с Enc-
ны - это крайне стабильные и прочные струк-
mSOG в течение 7 часов. В качестве контроля
туры, что позволяет применять их в качестве
использовали клетки без добавления фотосен-
платформы для решения различных задач био-
сибилизатора. Исследование показало, что
медицины.
наибольший уровень активных форм кислоро-
Например, в одном из исследований [13]
да после облучения синим лазером наблюдался
инкапсулины T. maritima были использованы в
в клетках, инкубированных с Enc-mSOG [63].
качестве системы направленной доставки зон-
Подобные системы были получены для на-
дов с флуорофором и терапевтического пре-
правленной терапии HER2 положительной
парата. Оболочки нанокомпартментов были
карциномы молочной железы [64]. В данной
модифицированы путем добавления на них
работе авторы также использовали в качестве
SP94-пептида, специфически связывающе-
платформы генетически кодируемую оболочку
гося с белко GRP78 (Glucose-regulated protein,
инкапсулина T. maritima, содержащую внутри
78 кДа), избыточно экспрессированным в
себя фотосенсибилизатор miniSOG, за счет
различных опухолевых клетках, в том числе
слияния C-конца белка с CLP. Поверхность
БИОХИМИЯ том 88 вып. 1 2023
3*
36
ЧМЕЛЮК и др.
инкапсулина была насыщена DARPin9.29
нетически модифицированы таким образом,
(Designed Ankyrin repeat protein), способным
чтобы экспрессировать на своей поверхности
селективно связываться с рецептором эпидер-
пептид, связывающий Fc-домен IgG (IgG Fc
мального фактора роста 2 (HER2), избыточно
domain-binding peptide; FcBP) [65], имеющий
экспрессированным на поверхности клеток
высокую аффинность к Fc-фрагменту имму-
карциномы молочной железы. DARPin9.29
ноглобулина G кролика [66]. При помощи ме-
был клонирован в рамке считывания с геном
тодов поверхностного плазмонного резонанса
инкапсулина T. maritima для получения сли-
в реальном времени и пьезоэлектрического
того белка TmEnc-DARPin-STII. Полученная
микровзвешивания было показано, что FcBP
система показала высокую активность по от-
действительно присутствует на внешней по-
ношению к выбранной модели рака и низкую
верхности инкапсулина и доступен для связы-
специфичность по отношению к контрольным
вания Fc IgG кролика. Полученная векторная
клеткам, не имеющим на своей поверхности
конструкция была способна специфически
белок HER2. Авторы исследования показали,
связываться с клетками линии SCC-7 (плоско-
что модифицированные инкапсулины спо-
клеточная карцинома мыши). Moon et al. [65]
собны специфически связываться с клетками
предполагают, что полученная конструкция
линии SK-BR-3 (аденокарцинома молочной
может быть использована в качестве наноплат-
железы человека), интернализоваться внутрь и
формы при разработке многофункциональной
доставлять, таким образом, в клетки инкапсу-
системы для тераностики плоскоклеточной
лированную форму miniSOG. После облучения
карциномы.
клеток SK-BR-3 синим светом, авторы отмеча-
Также было показано, что поверхность обо-
ют существенное снижение жизнеспособно-
лочки инкапсулина бактерии R. erythropolis N771,
сти клеток (до 48%), обусловленное действи-
о которой уже шла речь выше, может быть
ем miniSOG. Примечательно, что в качестве
успешно покрыта полиэтиленгликолем (ПЭГ).
контрольных клеток в вышеописанной работе
Хорошо известно, что ПЭГ является биосов-
использовали мезенхимные стволовые клетки
местимым модификатором носителей лекар-
человека, и подобного драматического сни-
ственных средств. Его присутствие затрудняет
жения жизнеспособности отмечено не было.
распознавание носителей клетками моноцитар-
Главным преимуществом данной системы яв-
но-макрофагальной системы, а также снижает
ляется принципиальная возможность создания
агрегацию. Кроме того, авторы исследования
действующего препарата на основе инкапсули-
показали, что ПЭГилирование не препятствует
на из одной плазмиды, в которой были закоди-
самосборке нанокомпартмента [20].
рованы все три составляющие: носитель (обо-
Инкапсулины в качестве платформы для соз-
лочка инкапсулина), вектор (DARPin9.29) для
дания вакцин. Ни для кого не секрет, что разра-
доставки и действующее вещество (miniSOG).
ботка новых безопасных вакцин является одной
Системы доставки на основе инкапсулинов
из важнейших задач человечества. Инкапсули-
также нашли применение в иммунотерапии рака.
ны благодаря их возможности одновременно-
Например, в одном из исследований [18] ин-
го синтеза как протомеров инкапсулина, так и
капсулины T. maritima использовали в качестве
других белков могут быть важной платформой
наноконтейнеров для доставки к дендритным
для создания вакцин. Например, имеется ин-
клеткам антигена (OT-1-пептида), представляю-
тересная работа, посвященная использованию
щего собой эпитоп белка OVA (овальбумин).
инкапсулинов T. maritima в качестве носителя
Презентация OT-1-пептида дендритными клет-
эктодомена белка М2 вируса гриппа А (М2е-
ками приводит к активации Т-клеточного им-
эпитоп) [67] (рис. 3, б). Белок М2 формирует
мунного ответа с образованием ОТ-1-специ-
ионные каналы на поверхности вириона и яв-
фичных цитотоксических CD8 Т-лимфоцитов.
ляется необходимым для транспорта вирусных
У мышей, на in vivo модели подкожных опухо-
рибонуклеопротеиновых комплексов в цито-
лей, полученных путем имплантации трансген-
плазму клетки-носителя. Его аминокислотная
ных клеток меланомы мыши В16 с экспрессией
последовательность крайне консервативна, а
ОТ-1 (B16-OVA), было продемонстрировано,
иммуногенность в процессе природной ин-
что вакцинация мышей при помощи инкапсу-
фекции достаточно низка [68]. Эти свойства
линов, содержащих ОТ-1, существенно препят-
делают М2е хорошим кандидатом для создания
ствовала развитию опухолей. Кроме того, было
вакцины широкого спектра действия. В работе
показано, что опухоли обширно инфильтриро-
было продемонстрировано присутствие специ-
ваны CD8 Т-клетками.
фических антител к М2е-эпитопу в сыворотке
Кроме того, было продемонстрировано
мышей после иммунизации полученными кон-
что инкапсулины T. maritima могут быть ге-
струкциями.
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
37
Инкапсуляция флуорофоров. Фотопереклю-
лей, требующей введения стабильных и био-
чаемые флуорофоры и, в частности, спиропи-
совместимых наночастиц золота в область ин-
раны представляют собой важный инструмент,
тереса с последующим облучением требуемой
применяемый в микроскопии сверхвысокого
длиной волны и гибелью опухолевых клеток,
разрешения. Сам процесс фотопереключения
более чувствительных к повышению темпера-
метки необходим для того, чтобы стало воз-
туры по сравнению со здоровыми клетками.
можным картирование флуоресцентных то-
Инкапсулиновые системы, способные к
чек, достигающееся путем стохастической ак-
биоминерализации железа, могут быть при-
тивации некоторого количества флуорофоров
менены в магнито-гипертермической тера-
в определенный момент времени, в то время
пии (МГТ). В работе Zhang et al. [72] инкапсули-
как остальные флуорофоры «выключены». За-
ны бактерии Myx. xanthus были использованы
тем изображения сверхвысокого разрешения
для синтеза магнитных наночастиц, получив-
могут быть реконструированы из множества
ших название eMIONs (encapsulin-produced
таких полученных флуоресцентных изображе-
magnetic iron oxide nanoparticles, магнитные
ний. Кроме того, возможность «включения»
наночастицы оксида железа, продуцируемые
и «выключения» флуоресценции может ока-
инкапсулином). Было показано, что частицы
заться полезной, чтобы избежать перекрытия
являются монодисперсными, устойчивыми
флуоресцентных сигналов в присутствии раз-
к экстремальным значениям pH и расщепле-
личных меченых структур. Инкапсулины могут
нию протеазами. При воздействии перемен-
быть модифицированы с помощью фотопе-
ного магнитного поля eMIONs эффективно
реключаемых флуорофоров [69], в частности,
поглощали магнитную энергию, что приве-
инкапсулин B. linens был модифицирован по
ло к выраженному повышению температуры
карбодиимидному методу флуорофорами на
in vitro и in vivo. Кроме того, eMIONs способны
основе спиропиранов - органических соеди-
разлагать H2O2 с образованием O2, тем самым
нений, обладающих фотохромными свойства-
вызывая специфическую гибель опухолевых
ми. При облучении ультрафиолетовым и види-
клеток из-за повышенной концентрации H2O2
мым светом спиропираны способны обратимо
в них. Учитывая высокую проникающую спо-
переключаться между своим флуоресцентным
собность магнитных полей, eMIONs являются
фотоизомером мероцианином и безызлуча-
перспективным терапевтическим средством
тельным изомером, что позволяет «включать»
для лечения солидных опухолей.
и «выключать» флуоресценцию [70] (рис. 3, в).
Помимо наночастиц оксида железа, нано-
Очень важным здесь является то, что инкапсу-
компартменты способны синтезировать на-
лины сохраняли свою структурную целост-
ночастицы серебра. Например, инкапсулины
ность как минимум в течение 5 циклов фото-
T. maritima использовались в качестве платфор-
переключения.
мы для получения монодисперсных наночастиц
Накопление неорганических наночастиц в
серебра со средним диаметром 13,5 нм [19].
инкапсулинах. Особо стоит отметить возмож-
Стоит отметить, что способность инкапсу-
ность контролируемой «разборки» инкапсули-
линов накапливать в себе ионы металлов может
нов на белковые субъединицы при добавлении
быть использована для очистки воды. Извест-
кислоты с загрузкой грузового белка интереса
но, что, например, Zn2+ в значительной степе-
за счет аффинности к тем или иным белковым
ни выбрасывается в воду во многих отраслях
последовательностям оболочки с последующим
промышленности и представляет серьезную
восстановлением структуры нанокомпартмен-
угрозу для окружающей среды. Wang et al. [73]
та при возвращении pH к нейтральному. Таким
предложили систему, состоящую из модифици-
образом, возможно загружать в оболочку ин-
рованных бактерий Escherichia coli, имеющих
капсулина молекулы/частицы, размер которых
в своем геноме ген, кодирующий инкапсулин
превышает диаметр пор. Интересным приме-
cEnc Candidatus Brocadia fulgida, который может
ром является работа Künzle et al. [71], где авто-
накапливать и восстанавливать ионы цинка.
ры выбрали в качестве груза наночастицы зо-
Полученные результаты позволяют обеспечить
лота диаметром 13 ± 1 нм, покрытые бромидом
эффективную стратегию повышения толе-
(11-меркаптоундецил)-N,N,N-триметиламмо-
рантности бактерий к токсичным металлам для
ния. Данные наночастицы были загружены в
восстановления Zn2+, что в перспективе может
оболочку инкапсулинов T. maritima при помо-
быть использовано для восстановления окру-
щи частичной замены стабилизирующего на-
жающей среды.
ночастицы лиганда на CLP, упомянутый ранее.
Инкапсулины в качестве генетически коди-
Подобный подход потенциально может быть
руемых меток. Помимо накопления неорганиче-
применен в фототермальной терапии опухо-
ских наночастиц для понижения концентрации
БИОХИМИЯ том 88 вып. 1 2023
38
ЧМЕЛЮК и др.
металлов вне оболочки инкапсулина, нельзя не
зовой белок, представляющий собой фермент
отметить блок работ, посвященных отслежива-
ферроксидазу, а также переносчик железа, не-
нию клеток при помощи МРТ за счет накопле-
обходимый для более эффективного транспор-
ния железосодержащих инкапсулинов в клет-
та железа в клетки. Через 24 часа после транс-
ках эукариот. На данный момент существует
фекции к клеткам добавляли сульфат аммония
два основных подхода, применяющихся для
железа, являющийся источником двухвалент-
мечения клеток. Первым подходом является
ного железа, окисляемого ферроксидазой с
прямое мечение, при котором экзогенные мет-
образованием магнитных наночастиц внутри
ки добавляются в ростовую среду к клеткам на
инкапсулинов (рис. 3, г). В случае инкапсулина
этапе культивирования. При этом в качестве
Q. hermotolerans криоэлектронная микроскопия
меток могут быть использованы магнитные
показала, что в клетках его оболочка самоорга-
наночастицы, радиоизотопы, а также низко-
низуется в нанокомпартменты с икосаэдриче-
молекулярные флуорофоры [74, 75]. Второй
ской симметрией T = 4 и диаметром ~ 42 нм.
подход основан на введении в геном клеток ге-
Кроме того, было установлено, что нативный
нетических последовательностей, кодирующих
грузовой белок сохраняет свою ферроксидаз-
эндогенные метки, такие как люцифераза или
ную активность, что позволяет эффективно
флуоресцентные белки [76]. Для оптического
биоминерализовать железо. В частности, пока-
мониторинга с использованием первого под-
зано, что ферритиноподобный грузовой белок
хода в качестве меток чаще всего применяют
Myx. xanthus был способен минерализовать до
квантовые точки и флуорофоры [77, 78], для
30 000 атомов железа на нанокомпартмент, что
ОФЭКТ (однофотонная эмиссионная компью-
примерно на порядок больше того количества,
терная томография) и ПЭТ (позитронно-эмис-
которое может депонироваться в ферритинах.
сионная томография) - радионуклиды, для
В другом исследовании [96] было продемон-
МРТ - суперпарамагнитные частицы (СМЧ)
стрировано, что в инкапсулины Myx. xanthus
оксида железа [79-84]. Важным недостатком
могут быть загружены сразу два грузовых бел-
здесь является то, что в процессе деления кле-
ка: флуоресцентный PAmCherry и ферритино-
ток накопление метки будет уменьшаться, и
подобный белок В. Авторы работы также пока-
интенсивность сигнала снизится, в силу чего
зали, что клетки НЕК293Т, экспрессирующие
мечение с использованием экзогенных агентов
инкапсулины, настолько хорошо накаплива-
не вполне подходит для длительного монито-
ют железо, что успешно поддаются магнитной
ринга клеток.
сортировке на коммерческих сортировочных
При проведении исследований, требующих
колонках (порядка 5% от исходной популяции
длительного отслеживания клеток после вве-
клеток) и даже могут быть обнаружены in vivo
дения, применяют непрямое специфическое
методом МРТ при введении в головной мозг
мечение с использованием репортерных генов.
крысы. Стоит отметить, что, в отличие от эк-
Чаще всего это гены, кодирующие флуоресцент-
зогенных меток на основе наночастиц оксида
ные белки [85-93] или люциферазу светляч-
железа, наночастицы, образующиеся в ин-
ка [94]. Для таких методов, как ОФЭКТ и ПЭТ,
капсулинах, не выбрасываются клетками, а,
также существуют свои генетические метки, а
следовательно, и не фагоцитируются соседни-
именно магнитно-резонансные репортерные
ми клетками, например клетками микроглии.
гены, продуцирующие внутриклеточные ме-
Это существенное преимущество, позволяю-
таллопротеины, такие как трансферрин, фер-
щее избежать искажения МР-сигнала с тече-
ритин, тирозиназа [95]. Как уже было упомяну-
нием времени, а также ошибок в интерпрета-
то выше, некоторые инкапсулиновые системы
ции результатов исследования. Гетерологичная
способны депонировать железо. Это свойство
транзиторная экспрессия генов инкапсулинов
позволяет использовать нанокомпартменты в
может быть достигнута не только в клетках ли-
качестве генетически кодируемых меток для
нии НЕК293Т, но и в других клеточных линиях,
МРТ-визуализации клеток. Существует ряд
например, в клетках гепатоцеллюлярной кар-
исследований, посвященных гетерологичной
циномы HepG2 [97].
экспрессии генов, кодирующих инкапсулино-
Кроме того, имеются работы, в которых
вые системы, в клетках млекопитающих. Так,
показана возможность получения стабильных
в работе Sigmund et al. [42] методом транзитор-
клеточных линий, содержащих инкапсули-
ной котрансфекции в клетках линии НЕК293Т
новые системы, депонирующие железо. На-
была достигнута экспрессия генов инкапсули-
пример, было показано, что мезенхимальные
нов Q. thermotolerans и Myx. xanthus. Трансфек-
стволовые клетки человека способны ста-
ция клеток производилась плазмидными ДНК,
бильно экспрессировать гены инкапсулина
кодирующими оболочку инкапсулина, его гру-
Myx. xanthus [98], а клетки карциномы молоч-
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
39
ной железы мыши 4T1 - гены инкапсулина
частицы еще должны быть охарактеризованы,
Q. thermotolerans [99]. И в первом, и во втором
а их токсичность должна быть протестирована
случае было показано, что наличие такой ге-
на клеточной линии, чтобы убедиться в без-
нетической метки не влияло на жизнеспособ-
опасности их применения [100].
ность и пролиферацию клеток, а время релак-
Инкапсулины как биореакторы. Еще одним
сации Т2 для генетически модифицированных
способом применения инкапсулинов является
клеток, содержащих инкапсулины, было ниже
их использование в качестве биореакторов. Из-
по сравнению с контрольными клетками, что
вестно, что тонкий химический синтез может
позволяло детектировать клетки методом МРТ.
быть проведен при помощи различных фермен-
Это очень важное преимущество, выгодно вы-
тов, что позволяет сильно упростить условия
деляющее инкапсулины на фоне остальных
проведения реакции. Огромное количество ре-
меток, которые часто оказываются токсичны
акций в химии и химической промышленности
и способны влиять на пролиферацию клеток.
протекает в присутствии катализаторов, а сами
Помимо этого, в упомянутых работах было
катализаторы для гетерофазных систем пред-
показано, что формирование наночастиц в
ставляют собой различные мелкодисперсные
инкапсулинах протекало достаточно быстро и
частицы или же наносятся на пористый носи-
занимало около 24 часов, в противоположность
тель для увеличения эффективности процесса.
получению наночастиц методом химического
В одной из работ в качестве такого носителя
синтеза, который очень часто может занимать
были использованы инкапсулины T. maritima, а
несколько дней с учетом выделения, очистки
«нанесение» катализатора осуществлялось при
и функционализации поверхности, после чего
помощи связывания необходимых ферментов
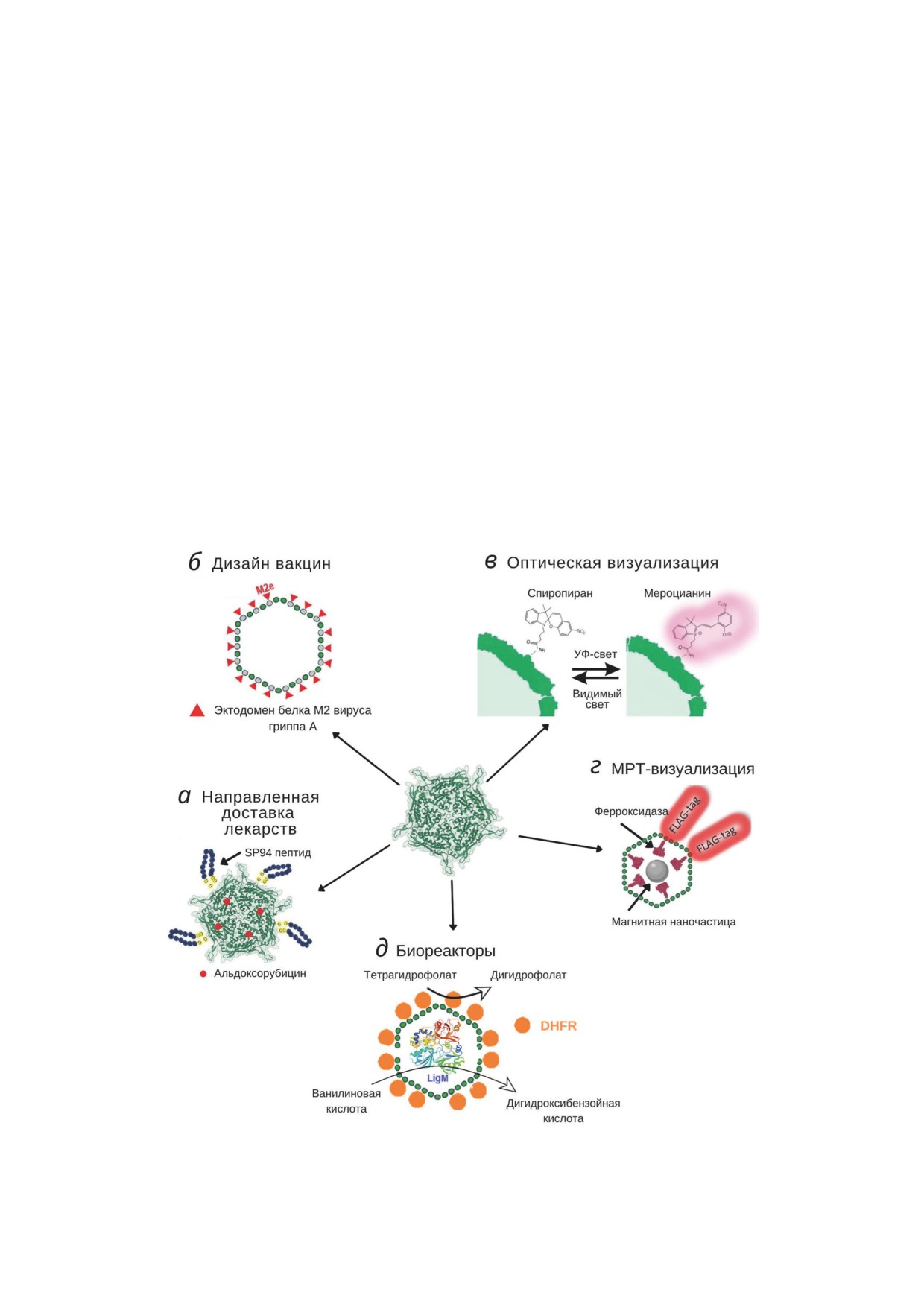
Рис. 3. Использование инкапсулинов для решения различных биотехнологических задач: а - наноконтейнерные систе-
мы для адресной доставки лекарств; б - новые типы вакцин; в - фотопереключаемые метки; г - генетически кодируе-
мые метки для МРТ-визуализации; д - биосинтез при помощи инкапсулированных ферментов
БИОХИМИЯ том 88 вып. 1 2023
40
ЧМЕЛЮК и др.
с поверхностями (внутренней и внешней) бел-
размер и возможность функционализации по-
кового компартмента. Инкапсулины на основе
верхности для селективного взаимодействия со
T. maritima были сконструированы следующим
специфическими белками, позволяют созда-
образом: на внешней оболочке при помощи тех-
вать различные системы направленной достав-
нологии SpyCatcher/SpyTag С-конец протомера
ки препаратов или меток. Инкапсулины могут
был конъюгирован с фибронектином FbaB58, а
выступать в роли нанореакторов, что позво-
затем последовательно связан с N-концом ди-
ляет получать очень гомологичные друг другу
гидрофолатредуктазы E. coli (DHFR), а внутрь
наночастицы или же использовать этот эффект
инкапсулина был загружен тетрагидрофолат-
для устранения ионов металлов из окружаю-
зависимый фермент (демитилаза LigM). На обо-
щей среды. Также инкапсулины могут быть
лочке инкапсулина удалось ковалентно связать
платформой для конъюгации с различными
порядка 60 копий DHFR (рис. 3, д).
ферментами, что позволяет изучать их кинети-
Тетрагидрофолат, продуцируемый на внеш-
ку в естественных условиях. Инкапсулиновые
ней оболочке при помощи DHFR, был спосо-
системы, биоминерализующие железо с обра-
бен управлять деметилированием арильного
зованием магнитных наночастиц, могут быть
субстрата, полученного из лигнина, упакован-
использованы в качестве контрастных агентов
ными деметилазами. Было показано, что по-
для МРТ при мониторинге распространения
следующее введение делеции, увеличивающей
клеток в организме.
поры в оболочке инкапсулина, усиливает об-
Проводя сравнение инкапсулинов с други-
мен метаболитов. Таким образом, такая кон-
ми наночастицами, использующимися в био-
струкция на основе инкапсулина функциони-
технологии, немаловажным преимуществом
рует со скоростью, эквивалентной скорости
первых, на наш взгляд, является высокая вос-
двух ферментов, свободно диспергированных
производимость биосинтеза инкапсулинов
в растворе [101].
в клетках. Будь то прокариотические клетки
Благодаря своему внутреннему размеру
или же эукариотические - синтез инкапсу-
белковые компартменты являются превосход-
линов имеет генетическую основу, в то время
ной имитацией замкнутого внутриклеточно-
как химический синтез представляет собой
го окружения и позволяют изучать кинетику
крайне многофакторный процесс, успех кото-
ферментов в более естественных условиях [102,
рого зависит от чистоты и качества реактивов,
103]. Было показано, что в оболочку инкапсу-
выбранных методик т.д. Если более подроб-
лина R. erythropolis могут быть загружены такие
но остановиться именно на магнитных нано-
белки, как GFP и люцифераза светлячка (Luc),
частицах, использующихся для мониторинга
не являющиеся нативными для этого бактери-
клеток методом МРТ, то здесь наночастицы,
ального штамма [16]. При этом GFP сохранял
образующиеся в инкапсулинах, проигрывают
способность флуоресцировать, а люцифера-
экзогенным магнитным меткам в интенсив-
за проявляла ферментативную активность в
ности создаваемого ими МР-сигнала. Однако
отношении своего субстрата, люциферина.
экзогенные магнитные наночастицы обладают
Подобное исследование было проведено с ин-
существенным недостатком. Дело в том, что
капсулинами B. linens. С-Концевая последо-
наночастицы железа, захватываемые клетка-
вательность нативного грузового белка DyP
ми на этапе культивирования, могут выбра-
была слита с С-концом TFP [104]. После под-
сываться после введения клеток в ткани и в
тверждения структурной целостности изолиро-
дальнейшем захватываться другими клетками,
ванных нанокомпартментов было определено,
например макрофагами, что будет приводить
что в среднем в одном инкапсулине содержится
к искажению МР-сигнала и затруднять лока-
12 молекул TFP.
лизацию введенных клеток. Еще одним важ-
ным недостатком наночастиц, получаемых
методами химического синтеза, является их
ЗАКЛЮЧЕНИЕ
токсичность в отношении различных клеточ-
ных культур, особенно это касается первичных
Несомненно, инкапсулины на данный мо-
культур стволовых клеток. Помимо магнитных
мент остаются относительно новым объектом
наночастиц, существуют также генетически ко-
исследований, не все свойства и их изначаль-
дируемые метки для МРТ, например, метки на
ное предназначение в прокариотах определены
основе ферритинов, но подобные метки про-
и изучены. Однако практическое применение
игрывают железозапасающим инкапсулинам в
инкапсулинов в области биотехнологии ста-
емкости (ферритин способен накопить около
новится все более многообещающим. Такие
3000 атомов железа, в то время как инкапсулин
свойства нанокомпартментов, как небольшой
Q. thermotolerans - на порядок больше). Другим
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
41
вопросом, касающимся применения различ-
ресной альтернативой конвенциональным на-
ных наноконтейнерных систем на основе ин-
ноплатформам. С каждым годом открываются
капсулинов, является их возможная иммуно-
новые типы инкапсулинов у различных штам-
генность in vivo. Предполагается, что частично
мов бактерий и архей, в свете чего дальней-
эта проблема может быть решена путем покры-
шее исследование этих структур и их свойств
тия инкапсулинов ПЭГом. В настоящее время
видится весьма перспективным для широкого
in vivo оценки иммуногенности инкапсулинов,
круга биомедицинских задач.
выделенных из бактерий или эукариотиче-
ских клеток, не было проведено, однако было
Вклад авторов. Н.С. Чмелюк, В.В. Ода -
показано, что уже упомянутые в настоящем
написание текста, подготовка иллюстраций;
обзоре злокачественные клетки карциномы
А.Н. Габашвили, М.А. Абакумов - редактиро-
молочной железы мыши 4Т1, стабильно экс-
вание текста.
прессирующие гены инкапсулиновой системы
Финансирование. Работа выполнена при
Q. thermotolerans, успешно формировали под-
финансовой поддержке Российского научного
кожные опухоли после имплантации иммуно-
фонда (грант № 21-75-00096).
компетентным мышам, а динамика роста этих
Конфликт интересов. Авторы заявляют об
опухолей не отличалась от динамики роста
отсутствии конфликта интересов.
опухолей, полученных из клеток 4Т1, не содер-
Соблюдение этических норм. Настоящая
жащих каких-либо трансгенов.
статья не содержит описания каких-либо ис-
Несмотря на вышеописанные недостатки,
следований с участием людей или животных
инкапсулины уже сейчас показали себя инте- в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Valdes-Stauber, N., and Scherer, S.
(1994)
7. Kawamoto, S., Watanabe, M., Saito, N., Hesketh, A.,
Isolation and characterization of linocin M18, a
Vachalova, K., et al. (2001) Molecular and functional
bacteriocin produced by Brevibacterium linens, Appl.
analyses of the gene (eshA) encoding the 52-kilodalton
Environ. Microbiol.,
60,
3809-3814, doi:
10.1128/
protein of Streptomyces coelicolor A3(2) required for
aem.60.10.3809-3814.1994.
antibiotic production, J. Bacteriol., 183, 6009-6016,
2. Rosenkrands, I., Rasmussen, P. B., Carnio, M.,
doi: 10.1128/JB.183.20.6009-6016.2001.
Jacobsen, S., Theisen, M., et al. (1998) Identification
8. Kwak, J., McCue, L. A., Trczianka, K., and Kendrick,
and characterization of a 29-kilodalton protein from
K. E. (2001) Identification and characterization of a
Mycobacterium tuberculosis culture filtrate recognized
developmentally regulated protein, EshA, required
by mouse memory effector cells, Infect. Immun., 66,
for sporogenic hyphal branches in Streptomyces
2728-2735, doi: 10.1128/iai.66.6.2728-2735.1998.
griseus, J. Bacteriol., 183, 3004-3015, doi: 10.1128/
3. Hicks, P. M., Rinker, K. D., Baker, J. R., and Kelly,
JB.183.10.3004-3015.2001.
R. M.
(1998) Homomultimeric protease in the
9. Saito, N., Matsubara, K., Watanabe, M., Kato,
hyperthermophilic bacterium Thermotoga maritima
F., and Ochi, K. (2003) Genetic and biochemical
has structural and amino acid sequence homology to
characterization of EshA, a protein that forms large
bacteriocins in mesophilic bacteria, FEBS Lett., 440,
multimers and affects developmental processes in
393-398, doi: 10.1016/S0014-5793(98)01451-3.
Streptomyces griseus, J. Biol. Chem., 278, 5902-5911,
4. Giessen, T. W., and Silver, P. A. (2017) Widespread
doi: 10.1074/jbc.M208564200.
distribution
of
encapsulin nanocompartments
10. Sutter, M., Boehringer, D., Gutmann, S., Günther,
reveals functional diversity, Nat. Microbiol., 2, 17029,
S., Prangishvili, D., et al.
(2008) Structural
doi: 10.1038/nmicrobiol.2017.29.
basis of enzyme encapsulation into a bacterial
5. Winter, N., Triccas, J. A., Rivoire, B., Pessolani, M.
nanocompartment, Nat. Struct. Mol. Biol., 15, 939-
C. V., Eiglmeier, K., et al. (1995) Characterization
947, doi: 10.1038/nsmb.1473.
of the gene encoding the immunodominant 35 kDa
11. Namba, K., Hagiwara, K., Tanaka, H., Nakaishi, Y.,
protein of Mycobacterium leprae, Mol. Microbiol., 16,
Chong, K. T., et al. (2005) Expression and molecular
865-876, doi: 10.1111/j.1365-2958.1995.tb02314.x.
characterization of spherical particles derived from
6. Triccas, J. A., Roche, P. W., Winter, N., Feng, C. G.,
the genome of the hyperthermophilic euryarchaeote
Ruth Butlin, C., et al. (1996) A 35-kilodalton protein
Pyrococcus furiosus, J. Biochem.,
138,
193-199,
is a major target of the human immune response to
doi: 10.1093/jb/mvi111.
Mycobacterium leprae, Infect. Immun., 64, 5171-5177,
12. Akita, F., Chong, K. T., Tanaka, H., Yamashita,
doi: 10.1128/iai.64.12.5171-5177.1996.
E., Miyazaki, N., et al. (2007) The crystal structure
БИОХИМИЯ том 88 вып. 1 2023
42
ЧМЕЛЮК и др.
of a virus-like particle from the hyperthermophilic
nanocompartment that stores iron and protects
archaeon Pyrococcus furiosus provides insight into the
bacteria from oxidative stress, EMBO J., 33, 1896-
evolution of viruses, J. Mol. Biol., 368, 1469-1483,
1911, doi: 10.15252/embj.201488566.
doi: 10.1016/j.jmb.2007.02.075.
24. He, D., Hughes, S., Vanden-Hehir, S., Georgiev, A.,
13. Moon, H., Lee, J., Min, J., and Kang, S. (2014)
Altenbach, K., et al. (2016) Structural characterization
Developing genetically engineered encapsulin protein
of encapsulated ferritin provides insight into iron
cage nanoparticles as a targeted delivery nanoplatform,
storage in bacterial nanocompartments, Elife,
5,
Biomacromolecules,
15,
3794-3801, doi:
10.1021/
e18972, doi: 10.7554/eLife.18972.
bm501066m.
25. Ochoa, J. M., Bair, K., Holton, T., Bobik, T. A.,
14. Rurup, W. F., Snijder, J., Koay, M. S. T., Heck, A.
and Yeates, T. O. (2021) MCPdb: The bacterial
J. R., and Cornelissen, J. J. L. M. (2014) Self-sorting
microcompartment database, PLoS One,
16,
of foreign proteins in a bacterial nanocompartment,
e0248269, doi: 10.1371/journal.pone.0248269.
J. Am. Chem. Soc., 136, 3828-3832, doi: 10.1021/
26. Wikoff, W. R., Liljas, L., Duda, R. L., Tsuruta,
ja410891c.
H., Hendrix, R. W., et al.
(2000) Topologically
15. Snijder, J., Van De Waterbeemd, M., Damoc, E.,
linked protein rings in the bacteriophage HK97
Denisov, E., Grinfeld, D., et al. (2014) Defining the
capsid, Science,
289,
2129-2133, doi:
10.1126/
stoichiometry and cargo load of viral and bacterial
science.289.5487.2129.
nanoparticles by orbitrap mass spectrometry, J. Am.
27. Caspar, D. L., and Klug, A. (1962) Physical principles
Chem. Soc., 136, 7295-7299, doi: 10.1021/ja502616y.
in the construction of regular viruses, Cold Spring
16. Tamura, A., Fukutani, Y., Takami, T., Fujii,
Harb. Symp. Quant. Biol., 27, 1-24, doi: 10.1101/
M., Nakaguchi, Y., et al. (2015) Packaging guest
SQB.1962.027.001.005.
proteins into the encapsulin nanocompartment from
28. Almeida, A. V., Carvalho, A. J., and Pereira, A. S.
Rhodococcus erythropolis N771, Biotechnol. Bioeng.,
(2021) Encapsulin nanocages: protein encapsulation
112, 13-20, doi: 10.1002/bit.25322.
and iron sequestration, Coord. Chem. Rev.,
448,
17. Cassidy-Amstutz, C., Oltrogge, L., Going, C. C.,
214188, doi: 10.1016/j.ccr.2021.214188.
Lee, A., Teng, P., et al. (2016) Identification of a
29. Tracey, J. C., Coronado, M., Giessen, T. W., Lau,
minimal peptide tag for in vivo and in vitro loading of
M. C. Y., Silver, P. A., et al. (2019) The discovery of
encapsulin, Biochemistry, 55, 3461-3468, doi: 10.1021/
twenty-eight new encapsulin sequences, including
acs.biochem.6b00294.
three in anammox bacteria, Sci. Rep., 9, 20122,
18. Choi, B., Moon, H., Hong, S. J., Shin, C., Do, Y.,
doi: 10.1038/s41598-019-56533-5.
et al. (2016) Effective delivery of antigen-encapsulin
30. Giessen, T. W., Orlando, B. J., Verdegaal, A. A.,
nanoparticle fusions to dendritic cells leads to
Chambers, M. G., Gardener, J., et al. (2019) Large
antigen-specific cytotoxic T cell activation and tumor
protein organelles form a new iron sequestration
rejection, ACS Nano, 10, 7339-7350, doi: 10.1021/
system with high storage capacity, Elife, 8, e46070,
acsnano.5b08084.
doi: 10.7554/eLife.46070.
19. Giessen, T. W., and Silver, P. A. (2016) Converting
31. El-Gebali, S., Mistry, J., Bateman, A., Eddy, S. R.,
a natural protein compartment into a nanofactory
Luciani, A., et al. (2019) The Pfam protein families
for the size-constrained synthesis of antimicrobial
database in 2019, Nucleic Acids Res., 47, D427-D432,
silver nanoparticles, ACS Synth. Biol., 5, 1497-1504,
doi: 10.1093/nar/gky995.
doi: 10.1021/acssynbio.6b00117.
32. Nichols, R. J., LaFrance, B., Phillips, N. R., Radford,
20. Sonotaki, S., Takami, T., Noguchi, K., Odaka, M.,
D. R., Oltrogge, L. M., et al. (2021) Discovery and
Yohda, M., et al. (2017) Successful PEGylation of
characterization of a novel family of prokaryotic
hollow encapsulin nanoparticles from: Rhodococcus
nanocompartments involved in sulfur metabolism,
erythropolis N771 without affecting their disassembly
Elife, 10, e59288, doi: 10.7554/eLife.59288.
and reassembly properties, Biomater. Sci., 5, 1082-
33. Wiryaman, T., and Toor, N. (2021) Cryo-EM structure
1089, doi: 10.1039/c7bm00207f.
of a thermostable bacterial nanocompartment, IUCrJ,
21. Rahmanpour, R., and Bugg, T. D. H. (2013) Assembly
8, 342-350, doi: 10.1107/S2052252521001949.
in vitro of Rhodococcus jostii RHA1 encapsulin and
34. Wiryaman, T., and Toor, N. (2022) Recent advances
peroxidase DypB to form a nanocompartment,
in the structural biology of encapsulin bacterial
FEBS J., 280, 2097-2104, doi: 10.1111/febs.12234.
nanocompartments, J. Struct. Biol. X, 6, 100062,
22. Contreras, H., Joens, M. S., McMath, L. M., Le, V.
doi: 10.1016/j.yjsbx.2022.100062.
P., Tullius, M. V., et al. (2014) Characterization of a
35. Ross, J., McIver, Z., Lambert, T., Piergentili, C., Bird,
Mycobacterium tuberculosis nanocompartment and its
J. E., et al. (2022) Pore dynamics and asymmetric
potential cargo proteins, J. Biol. Chem., 289, 18279-
cargo loading in an encapsulin nanocompartment, Sci.
18289, doi: 10.1074/jbc.M114.570119.
Adv., 8, eabj4461, doi: 10.1126/sciadv.abj4461.
23. McHugh, C. A., Fontana, J., Nemecek, D., Cheng,
36. Williams, E. M., Jung, S. M., Coffman, J. L., and Lutz,
N., Aksyuk, A. A., et al. (2014) A virus capsid-like
S. (2018) Pore engineering for enhanced mass transport
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
43
in encapsulin nanocompartments, ACS Synth. Biol., 7,
pig model of infection, J. Bacteriol., 194, 567-575,
2514-2517, doi: 10.1021/acssynbio.8b00295.
doi: 10.1128/JB.05553-11.
37. Snijder, J., Kononova, O., Barbu, I. M., Uetrecht, C.,
49. Ahmad, M., Roberts, J. N., Hardiman, E. M., Singh,
Rurup, W. F., et al. (2016) Assembly and mechanical
R., Eltis, L. D., et al. (2011) Identification of DypB
properties of the cargo-free and cargo-loaded bacterial
from Rhodococcus jostii RHA1 as a lignin peroxidase,
nanocompartment encapsulin, Biomacromolecules, 17,
Biochemistry, 50, 5096-5107, doi: 10.1021/bi101892z.
2522-2529, doi: 10.1021/acs.biomac.6b00469.
50. Bobik, T. A., Lehman, B. P., and Yeates, T. O. (2015)
38. Putri, R. M., Allende-Ballestero, C., Luque, D.,
Bacterial microcompartments: widespread prokaryotic
Klem, R., Rousou, K. A., et al. (2017) Structural
organelles for isolation and optimization of metabolic
characterization of native and modified encapsulins
pathways, Mol. Microbiol., 98, 193-207, doi: 10.1111/
as nanoplatforms for in vitro catalysis and cellular
mmi.13117.
uptake, ACS Nano, 11, 12796-12804, doi: 10.1021/
51. Green, E. R., and Mecsas, J. (2016) Bacterial se-
acsnano.7b07669.
cretion systems: an overview, Microbiol. Spectr., 4,
39. Kirykowicz, A. M., and Woodward, J. D. (2020) Shot-
doi: 10.1128/microbiolspec.vmbf-0012-2015.
gun EM of mycobacterial protein complexes during
52. Wang, P., Robert, L., Pelletier, J., Dang, W. L., Taddei,
stationary phase stress, Curr. Res. Struct. Biol., 2, 204-
F., et al. (2010) Robust growth of Escherichia coli, Curr.
212, doi: 10.1016/j.crstbi.2020.09.002.
Biol., 20, 1099-1103, doi: 10.1016/j.cub.2010.04.045.
40. Tang, Y., Mu, A., Zhang, Y., Zhou, S., Wang, W.,
53. Gong, J., Chen, M., Zheng, Y., Wang, S., and
et al. (2021) Cryo-EM structure of Mycobacterium
Wang, Y. (2012) Polymeric micelles drug delivery
smegmatis DyP-loaded encapsulin, Proc. Natl. Acad.
system in oncology, J. Control. Release, 159, 312-323,
Sci., 118, e2025658118, doi: 10.1073/pnas.2025658118.
doi: 10.1016/j.jconrel.2011.12.012.
41. LaFrance, B. J., Cassidy-Amstutz, C., Nichols, R. J.,
54. Rösler, A., Vandermeulen, G. W. M., and Klok, H.
Oltrogge, L. M., Nogales, E., et al. (2021) The encap-
A. (2012) Advanced drug delivery devices via self-
sulin from Thermotoga maritima is a flavoprotein with
assembly of amphiphilic block copolymers, 53, 95-108,
a symmetry matched ferritin-like cargo protein, Sci.
Adv. Drug Deliv. Rev., doi: 10.1016/j.addr.2012.09.026.
Rep., 11, 22810, doi: 10.1038/s41598-021-01932-w.
55. Allen, T. M., and Cullis, P. R. (2013) Liposomal drug
42. Sigmund, F., Pettinger, S., Kube, M., Schneider, F.,
delivery systems: from concept to clinical applications,
Schifferer, M., et al. (2019) Iron-sequestering nano-
Adv. Drug Deliv. Rev.,
65,
36-48, doi:
10.1016/
compartments as multiplexed electron microscopy
j.addr.2012.09.037.
gene reporters, ACS Nano, 13, 8114-8123, doi: 10.1021/
56. Wang, A. Z., Langer, R., and Farokhzad, O. C.
acsnano.9b03140.
(2012) Nanoparticle delivery of cancer drugs, Annu.
43. Imlay, J. A., Chin, S. M., and Linn, S. (1988) Toxic
Rev. Med.,
63,
185-198, doi:
10.1146/annurev-
DNA damage by hydrogen peroxide through the
med-040210-162544.
fenton reaction in vivo and in vitro, Science, 240, 640-
57. Haag, R., and Kratz, F. (2006, February 13) Polymer
642, doi: 10.1126/science.2834821.
therapeutics: Concepts and applications, Angew. Chemie
44. Andrews, S. C. (1998) Iron storage in bacteria, Adv.
Int. Ed., 45, 1198-215, doi: 10.1002/anie.200502113.
Microb. Physiol., 40, 281-351, doi: 10.1038/279015a0.
58. Ma, Y., Nolte, R. J. M., and Cornelissen, J. J. L. M.
45. Goulding, C. W., Apostol, M. I., Sawaya, M. R.,
(2012) Virus-based nanocarriers for drug delivery,
Phillips, M., Parseghian, A., et al. (2005) Regulation by
Adv. Drug Deliv. Rev., 64, 811-825, doi: 10.1016/
oligomerization in a mycobacterial folate biosynthetic
j.addr.2012.01.005.
enzyme, J. Mol. Biol., 349, 61-72, doi: 10.1016/
59. MaHam, A., Tang, Z., Wu, H., Wang, J., and Lin,
j.jmb.2005.03.023.
Y.
(2009) Protein-based nanomedicine platforms
46. Sugano, Y., Muramatsu, R., Ichiyanagi, A., Sato, T.,
for drug delivery, Small, 5, 1706-1721, doi: 10.1002/
and Shoda, M. (2007) DyP, a unique dye-decolorizing
smll.200801602.
peroxidase, represents a novel heme peroxidase family:
60. Brigger, I., Dubernet, C., and Couvreur, P. (2002)
ASP171 replaces the distal histidine of classical peroxi-
Nanoparticles in cancer therapy and diagnosis,
dases, J. Biol. Chem., 282, 36652-36658, doi: 10.1074/
Adv. Drug Deliv. Rev., 54, 631-651, doi: 10.1016/
jbc.M706996200.
S0169-409X(02)00044-3.
47. Pandey, R., and Rodriguez, G. M. (2012) A ferritin
61. Toita, R., Murata, M., Tabata, S., Abe, K., Narahara,
mutant of Mycobacterium tuberculosis is highly suscep-
S., et al. (2012) Development of human hepatocellu-
tible to killing by antibiotics and is unable to establish
lar carcinoma cell-targeted protein cages, Bioconjug.
a chronic infection in mice, Infect. Immun., 80, 3650-
Chem., 23, 1494-1501, doi: 10.1021/bc300015f.
3659, doi: 10.1128/IAI.00229-12.
62. Toita, R., Murata, M., Abe, K., Narahara, S., Piao, J.
48. Reddy, P. V., Puri, R. V., Khera, A., and Tyagi,
S., et al. (2013) A nanocarrier based on a genetically
A. K. (2012) Iron storage proteins are essential for
engineered protein cage to deliver doxorubicin to hu-
the survival and pathogenesis of Mycobacterium
man hepatocellular carcinoma cells, Chem. Commun.,
tuberculosis in THP-1 macrophages and the guinea
49, 7442-7444, doi: 10.1039/c3cc44508a.
БИОХИМИЯ том 88 вып. 1 2023
44
ЧМЕЛЮК и др.
63. Diaz, D., Vidal, X., Sunna, A., and Care, A. (2021)
75. Di Corato, R., Gazeau, F., Le Visage, C., Fayol, D.,
Bioengineering a light-responsive encapsulin nano-
Levitz, P., et al. (2013) High-resolution cellular MRI:
reactor: a potential tool for in vitro photodynamic
gadolinium and iron oxide nanoparticles for in-depth
therapy, ACS Appl. Mater. Interfaces, 13, 7977-7986,
dual-cell imaging of engineered tissue constructs, ACS
doi: 10.1021/acsami.0c21141.
Nano, 7, 7500-7512, doi: 10.1021/nn401095p.
64. Van de Steen, A., Khalife, R., Colant, N., Mustafa
76. Schrepfer, S., Deuse, T., Reichenspurner, H.,
Khan, H., Deveikis, M., et al. (2021) Bioengineering
Fischbein, M. P., Robbins, R. C., et al. (2007) Stem
bacterial encapsulin nanocompartments as targeted
cell transplantation: the lung barrier, Transplant. Proc.,
drug delivery system, Synth. Syst. Biotechnol., 6, 231-
39, 573-576, doi: 10.1016/j.transproceed.2006.12.019.
241, doi: 10.1016/j.synbio.2021.09.001.
77. Michalet, X., Pinaud, F. F., Bentolila, L. A., Tsay,
65. Moon, H., Lee, J., Kim, H., Heo, S., Min, J., et al.
J. M., Doose, S., et al. (2005) Quantum dots for live
(2014) Genetically engineering encapsulin protein
cells, in vivo imaging, and diagnostics, Science, 307,
cage nanoparticle as a SCC-7 cell targeting optical
538-544, doi: 10.1126/science.1104274.
nanoprobe, Biomater. Res.,
18,
21, doi:
10.1186/
78. Kalchenko, V., Shivtiel, S., Malina, V., Lapid, K.,
2055-7124-18-21.
Haramati, S., et al. (2006) Use of lipophilic near-
66. Jung, Y., Kang, H. J., Lee, J. M., Jung, S. O., Yun,
infrared dye in whole-body optical imaging of hema-
W. S., et al. (2008) Controlled antibody immobiliza-
topoietic cell homing, J. Biomed. Opt., 11, 050507,
tion onto immunoanalytical platforms by synthetic
doi: 10.1117/1.2364903.
peptide, Anal. Biochem., 374, 99-105, doi: 10.1016/
79. Himes, N., Min, J. Y., Lee, R., Brown, C., Shea, J.,
j.ab.2007.10.022.
et al. (2004) In vivo MRI of embryonic stem cells in a
67. Lagoutte, P., Mignon, C., Stadthagen, G.,
mouse model of myocardial infarction, Magn. Reson.
Potisopon, S., Donnat, S., et al. (2018) Simultaneous
Med., 52, 1214-1219, doi: 10.1002/mrm.20220.
surface display and cargo loading of encapsulin
80. Arbab, A. S., Bashaw, L. A., Miller, B. R., Jordan,
nanocompartments and their use for rational vaccine
E. K., Bulte, J. W. M., et al. (2003) Intracytoplas-
design, Vaccine,
36,
3622-3628, doi:
10.1016/
mic tagging of cells with ferumoxides and transfec-
j.vaccine.2018.05.034.
tion agent for cellular magnetic resonance imaging
68. Cho, K. J., Schepens, B., Seok, J. H., Kim, S., Roose,
after cell transplantation: methods and techniques,
K., et al. (2015) Structure of the extracellular domain
Transplantation,
76,
1123-1130, doi:
10.1097/
of matrix protein 2 of influenza A virus in complex
01.TP.0000089237.39220.83.
with a protective monoclonal antibody, J. Virol., 89,
81. Frank, J. A., Miller, B. R., Arbab, A. S., Zywicke, H. A.,
3700-3711, doi: 10.1128/jvi.02576-14.
Jordan, E. K., et al. (2003) Clinically applicable labeling
69. Putri, R. M., Fredy, J. W., Cornelissen, J. J. L. M.,
of mammalian and stem cells by combining superpara-
Koay, M. S. T., and Katsonis, N. (2016) Labelling
magnetic iron oxides and transfection agents, Radiolo-
bacterial nanocages with photo-switchable fluoro-
gy, 228, 480-487, doi: 10.1148/radiol.2281020638.
phores, ChemPhysChem, 17, 1815-1818, doi: 10.1002/
82. Bos, C., Delmas, Y., Desmoulière, A., Solanilla, A.,
cphc.201600013.
Hauger, O., et al. (2004) In vivo MR imaging of intra-
70. Klajn, R. (2014) Spiropyran-based dynamic materials,
vascularly injected magnetically labeled mesenchymal
Chem. Soc. Rev., 43, 148-184, doi: 10.1039/c3cs60181a.
stem cells in rat kidney and liver, Radiology, 233, 781-
71. Künzle, M., Mangler, J., Lach, M., and Beck, T.
789, doi: 10.1148/radiol.2333031714.
(2018) Peptide-directed encapsulation of inorganic
83. Di Tucci, A. A., Matta, G., Deplano, S., Gabbas,
nanoparticles into protein containers, Nanoscale, 10,
A., Depau, C., et al. (2008) Myocardial iron overload
22917-22926, doi: 10.1039/c8nr06236f.
assessment by T2* magnetic resonance imaging in
72. Zhang, Y., Wang, X., Chu, C., Zhou, Z., Chen, B., et
adult transfusion dependent patients with acquired
al. (2020) Genetically engineered magnetic nanocages
anemias, Haematologica, 93, 1385-1388, doi: 10.3324/
for cancer magneto-catalytic theranostics, Nat.
haematol.12759.
Commun., 11, 5421, doi: 10.1038/s41467-020-19061-9.
84. Ittrich, H., Lange, C., Tögel, F., Zander, A. R., Dahn-
73. Wang, Q., Zhou, Y.-M., Xing, C.-Y., Li, W.-C., Shen,
ke, H., et al. (2007) In vivo magnetic resonance imaging
Y., et al. (2022) Encapsulins from Ca. Brocadia fulgida:
of iron oxide-labeled, arterially-injected mesenchymal
An effective tool to enhance the tolerance of engineered
stem cells in kidneys of rats with acute ischemic kidney
bacteria (pET-28a-cEnc) to Zn2+, J. Hazard. Mater.,
injury: detection and monitoring at 3T, J. Magn. Reson.
435, 128954, doi: 10.1016/j.jhazmat.2022.128954.
Imaging, 25, 1179-1191, doi: 10.1002/jmri.20925.
74. Kim, T., Momin, E., Choi, J., Yuan, K., Zaidi, H., et
85. Massoud, T. F., and Gambhir, S. S. (2003) Molecular
al. (2011) Mesoporous silica-coated hollow manganese
imaging in living subjects: seeing fundamental
oxide nanoparticles as positive T1 contrast agents
biological processes in a new light, Genes Dev., 17,
for labeling and MRI tracking of adipose-derived
545-580, doi: 10.1101/gad.1047403.
mesenchymal stem cells, J. Am. Chem. Soc., 133,
86. Wu, J. C., Tseng, J. R., and Gambhir, S. S. (2004)
2955-2961, doi: 10.1021/ja1084095.
Molecular imaging of cardiovascular gene prod-
БИОХИМИЯ том 88 вып. 1 2023
ПРИМЕНЕНИЕ ИНКАПСУЛИНОВ В БИОТЕХНОЛОГИИ
45
ucts, J. Nucl. Cardiol., 11, 491-505, doi: 10.1016/
engineering, Nat. Commun., 9, 1990, doi: 10.1038/
j.nuclcard.2004.04.004.
s41467-018-04227-3.
87. Contag, C. H., Jenkins, D., Contag, P. R., and
97. Efremova, M. V, Bodea, S.-V., Sigmund, F., Semkina,
Negrin, R. S. (2000) Use of reporter genes for optical
A., Westmeyer, G. G., et al. (2021) Genetically encoded
measurements of neoplastic disease in vivo, Neoplasia,
self-assembling iron oxide nanoparticles as a possible
2, 41-52, doi: 10.1038/sj.neo.7900079.
platform for cancer-cell tracking., Pharmaceutics, 13,
88. Herschman, H. R. (2004) Noninvasive imaging of
397, doi: 10.3390/pharmaceutics13030397.
reporter gene expression in living subjects, Adv. Cancer
98. Gabashvili, A. N., Vodopyanov, S. S., Chmelyuk, N.
Res., 92, 29-80, doi: 10.1016/S0065-230X(04)92003-9.
S., Sarkisova, V. A., Fedotov, K. A., et al. (2021) En-
89. Inubushi, M., and Tamaki, N. (2007) Radionuclide
capsulin based self-assembling iron-containing protein
reporter gene imaging for cardiac gene therapy,
nanoparticles for stem cells MRI visualization., Int. J.
Eur. J. Nucl. Med. Mol. Imaging, 34 Suppl 1, S27-S33,
Mol. Sci., 22, 12275, doi: 10.3390/ijms222212275.
doi: 10.1007/s00259-007-0438-x.
99. Gabashvili, A. N., Efremova, M. V., Vodopyanov, S.
90. Joo, H. K., and Chung, J. K. (2008) Molecular-
S., Chmelyuk, N. S., Oda, V. V., et al. (2022) New
genetic imaging based on reporter gene expression,
approach to non-invasive tumor model monitoring
J. Nucl. Med., 49 Suppl 2, 164S-179S, doi: 10.2967/
via self-assemble iron containing protein nanocom-
jnumed.107.045955.
partments, Nanomaterials, 12, 1657, doi: 10.3390/
91. Gambhir, S. S., Barrio, J. R., Phelps, M. E., Iyer,
nano12101657.
M., Namavari, M., et al. (1999) Imaging adenoviral-
100. Roy, N., Gaur, A., Jain, A., Bhattacharya, S., and
directed reporter gene expression in living animals with
Rani, V. (2013) Green synthesis of silver nanopar-
positron emission tomography, Proc. Natl. Acad. Sci.
ticles: an approach to overcome toxicity, Environ.
USA, 96, 2333-2338, doi: 10.1073/pnas.96.5.2333.
Toxicol. Pharmacol.,
36,
807-812, doi:
10.1016/j.
92. Phelps, M. E. (2000) Positron emission tomography
etap.2013.07.005.
provides molecular imaging of biological processes,
101. Jenkins, M. C., and Lutz, S. (2021) Encapsulin nano-
Proc. Natl. Acad. Sci. USA,
97,
9226-9233,
containers as versatile scaffolds for the development of
doi: 10.1073/pnas.97.16.9226.
artificial metabolons, ACS Synth. Biol., 10, 857-869,
93. Zhang, S. J., and Wu, J. C. (2007) Comparison of
doi: 10.1021/acssynbio.0c00636.
imaging techniques for tracking cardiac stem cell
102. Maity, B., Fujita, K., and Ueno, T. (2015) Use of the
therapy, J. Nucl. Med., 48, 1916-1919, doi: 10.2967/
confined spaces of apo-ferritin and virus capsids as
jnumed.107.043299.
nanoreactors for catalytic reactions, Curr. Opin. Chem.
94. Okada, S., Ishii, K., Yamane, J., Iwanami, A.,
Biol., 25, 88-97, doi: 10.1016/j.cbpa.2014.12.026.
Ikegami, T., et al. (2005) In vivo imaging of engrafted
103. Safont-Sempere, M. M., Fernández, G., and
neural stem cells: its application in evaluating the
Würthner, F.
(2011) Self-sorting phenomena in
optimal timing of transplantation for spinal cord injury,
complex supramolecular systems, Chem. Rev., 111,
FASEB J., 19, 1839-1841, doi: 10.1096/fj.05-4082fje.
5784-5814, doi: 10.1021/cr100357h.
95. Gilad, A. A., Winnard, P. T., van Zijl, P. C. M., and
104. Ai, H. W., Henderson, J. N., Remington, S. J.,
Bulte, J. W. M. (2007) Developing MR reporter genes:
and Campbell, R. E.
(2006) Directed evolution
promises and pitfalls, NMR Biomed., 20, 275-290,
of a monomeric, bright and photostable version
doi: 10.1002/nbm.1134.
of Clavularia cyan fluorescent protein: structur-
96. Sigmund, F., Massner, C., Erdmann, P., Stelzl, A.,
al characterization and applications in fluorescence
Rolbieski, H., et al. (2018) Bacterial encapsulins
imaging, Biochem. J., 400, 531-540, doi: 10.1042/
as orthogonal compartments for mammalian cell
BJ20060874.
ENCAPSULINS: STRUCTURE, PROPERTIES,
APPLICATION IN BIOTECHNOLOGY
Review
N. S. Chmelyuk1,2, V. V. Oda1, A. N. Gabashvili1, and M. A. Abakumov1,2*
1 National Research Technological University “MISiS”,
119049 Moscow, Russia; E-mail: abakumov1988@gmail.com
2 Russian National Research Medical University named after N.I. Pirogov
of the Ministry of Health of the Russian Federation, 117977 Moscow, Russia
БИОХИМИЯ том 88 вып. 1 2023
46
ЧМЕЛЮК и др.
In 1994 a new class of prokaryotic compartments was discovered, collectively called “encapsulins” or
“nanocompartments”. Encapsulin shell protomer proteins self-assemble to form icosahedral structures of
various diameters (24-42 nm). Inside of nanocompartments shells, one or several cargo proteins, diverse in their
functions, can be encapsulated. In addition, non-native cargo proteins can be loaded into nanocompartments,
and shell surfaces can be modified via various compounds, which makes it possible to create targeted drug
delivery systems, labels for optical and MRI imaging, and to use encapsulins as bioreactors. This review
describes a number of approaches to the application of encapsulins in various fields of science, including
biomedicine and nanobiotechnologies.
Keywords: encapsulins, self-organization, nanocontainer systems, targeted delivery, genetic tags, cell tracking
БИОХИМИЯ том 88 вып. 1 2023