БИОХИМИЯ, 2023, том 88, вып. 1, с. 83 - 96
УДК 577.29
ВЛИЯНИЕ ХИМИЧЕСКИХ ШАПЕРОНОВ
НА ПРОЦЕССЫ АГРЕГАЦИИ БЕЛКОВ,
ПРОТЕКАЮЩИЕ В РАЗЛИЧНЫХ КИНЕТИЧЕСКИХ РЕЖИМАХ
© 2023 В.В. Михайлова*, Т.Б. Еронина, Н.А. Чеботарева,
Б.И. Курганов
ФГУ ФИЦ «Фундаментальные основы биотехнологии» РАН, Институт биохимии имени А.Н. Баха,
119071 Москва, Россия; электронная почта: mikhaylova.inbi@inbox.ru
Поступила в редакцию 20.10.2022
После доработки 29.11.2022
Принята к публикации 29.11.2022
Формирование и накопление белковых агрегатов отрицательно сказываются на внутриклеточных
процессах в живой клетке и являются негативными факторами при производстве и хранении бел-
ковых препаратов. Химические шапероны способны предотвращать агрегацию белков, однако это
их свойство не является универсальным и зависит от структуры белка-мишени и кинетики его
агрегации. В настоящей работе изучено влияние бетаина (Bet) и лизина (Lys) на тест-системы, ос-
нованные на тепловой агрегации мышечной гликогенфосфорилазы b (ФБ) при 48 °С, УФ-облучен-
ной ФБ (УФ-ФБ) при 37 °С и апо-формы ФБ (апо-ФБ) при 37 °С, характеризующиеся порядком
агрегации по белку (n), равным 0,5; 1 или 2 соответственно. Методами динамического светорассе-
яния, дифференциальной сканирующей калориметрии и аналитического ультрацентрифугирова-
ния показано, что Bet защищает ФБ и апо-ФБ от агрегации, однако ускоряет агрегацию УФ-ФБ.
В то же время Lys препятствует агрегации УФ-ФБ и апо-ФБ, но увеличивает скорость формиро-
вания агрегатов ФБ. Обсуждаются механизмы действия химических шаперонов на третичную и
четвертичную структуры и кинетику тепловой агрегации белков-мишеней. Сравнение влияния хи-
мических шаперонов на тест-системы с разными кинетическими режимами агрегации позволяет
получить более полную информацию о механизме их действия.
КЛЮЧЕВЫЕ СЛОВА: агрегация, кинетический режим, химический шаперон, гликогенфосфорилаза b.
DOI: 10.31857/S0320972523010062, EDN: PBWUAU
ВВЕДЕНИЕ
вой молекулы (intermediate state), нуклеации и
роста агрегатов за счет присоединения разверну-
Потеря нативной структуры белка под влия-
тых молекул к сформировавшимся ядрам [6, 7].
нием повышенной температуры, изменения
Для олигомерных белков стадия денатурации
рН или ионной силы, УФ-облучения и других
также включает их диссоциацию на мономе-
стрессовых воздействий может приводить к
ры [8]. Кинетику агрегации модельного белка в
формированию аморфных или фибриллопо-
заданных условиях будет определять самая мед-
добных агрегатов [1, 2]. Накопление белковых
ленная стадия процесса. Если рассматривать
агрегатов в живой клетке негативно влияет на
агрегацию как необратимую реакцию, в которой
внутриклеточные процессы и может провоци-
n неагрегированных молекул белка (P) переходят
ровать развитие таких заболеваний, как ката-
в агрегированное состояние, то скорость агрега-
ракта, сахарный диабет, нейродегенеративные
ции (vagg) можно интерпретировать как:
заболевания [3-5]. Неконтролируемая агрега-
ция также является негативным фактором при
vagg = -d[P]/dt = nk[P]n,
(1)
производстве и хранении белковых препаратов.
В общем виде процесс агрегации белков
где [P] - концентрация неагрегированного бел-
включает в себя стадии разворачивания белко- ка, t - время, n - порядок агрегации по белку
Принятые сокращения: апо-ФБ - апо-форма гликогенфосфорилазы b; ДЛС - динамическое лазерное светорас-
сеяние; ДСК - дифференциальная сканирующая калориметрия; УФ-ФБ - УФ-облученная гликогенфосфорилаза b;
ФБ - гликогенфосфорилаза b; AUC - аналитическое ультрацентрифугирование; Bet - бетаин; IS - ионная сила.
* Адресат для корреспонденции.
83
6*
84
МИХАЙЛОВА и др.
и k - константа скорости агрегации n-го по-
ция при 48 °C лимитируется стадией обратимой
рядка [7]. Предложенный подход позволяет де-
диссоциации димера на быстро денатурирую-
лать выводы о кинетическом режиме агрегации
щие мономеры [36]. Порядок агрегации по бел-
белков [9-11], который может определять спо-
ку (n) для данной тест-системы равен 0,5 [37].
собность различных агентов воздействовать на
УФ-Облучение ФБ (УФ-ФБ) или удаление пи-
этот процесс.
ридоксаль-5′-фосфата из активного центра
Осмолиты накапливаются в клетке в от-
фермента (апо-ФБ) приводит к изменению
вет на неблагоприятные внешние условия
кинетического режима агрегации белка. Лими-
и играют важную роль в защите живых кле-
тирующей стадией тепловой агрегации УФ-ФБ
ток от осмотического, теплового и других ви-
при 37 °С является стадия структурной реор-
дов стресса. Многие из осмолитов способны
ганизации молекулы белка; n = 1 [38]. Агрега-
функционировать как химические шапероны:
ция апо-ФБ при 37 °С лимитируется скоростью
защищать клеточные компоненты от денату-
бимолекулярной реакции присоединения раз-
рирующих стрессовых воздействий, повышать
вернутых белковых молекул к образовавшим-
стабильность белковых молекул, сохранять их
ся ядрам; n = 2 [37]. Различие лимитирующих
структуру и функции [12-15]. Механизмы дей-
стадий тепловой агрегации этих белков может
ствия осмолитов и их потенциальное исполь-
приводить к различию механизмов действия на
зование в качестве терапевтических молекул в
них химических шаперонов.
настоящее время активно изучаются [16].
Имеются данные, что тепловая агрегация
Бетаин (N,N,N-триметилглицин, Bet) яв-
ФБ при 48 °C (n = 0,5) тормозится в присут-
ляется одним из наиболее эффективных и
ствии Bet, но ускоряется в присутствии Lys [39].
широко распространенных осмолитов как
В настоящей работе был проведен подробный
в прокариотических, так и в эукариотиче-
анализ влияния Bet и Lys на кинетику тепловой
ских клетках. В условиях стресса концентра-
агрегации ФБ. Впервые было исследовано влия-
ция Bet в клетках может достигать значений
ние данных шаперонов на агрегацию УФ-ФБ и
0,7-1,0 М [17]. Bet способен стабилизировать
апо-ФБ при 37 °C (n = 1 и n = 2 соответствен-
белки, ингибировать их агрегацию, активиро-
но). Сравнение действия химических шаперо-
вать рефолдинг белков, а также стимулировать
нов на тест-системы с различной кинетикой
дезагрегацию амилоидных фибрилл [17-21].
агрегации позволило более детально охаракте-
С другой стороны, Bet может усиливать агрега-
ризовать механизмы действия Bet и Lys.
цию/фибрилляцию полиглутамина или бычье-
го сывороточного альбумина [22, 23]. В неко-
торых тест-системах действие этого осмолита
МАТЕРИАЛЫ И МЕТОДЫ
на агрегацию белка может варьироваться в за-
висимости от его концентрации или рН рас-
Материалы. В работе были использованы
твора [24, 25].
Hepes, гидрохлорид L-лизина («Sigma-Aldrich»,
В качестве химических шаперонов способ-
США), бетаин («ICN Biomedicals Inc.», США),
ны выступать не только осмолиты. Известно,
NaCl («Реахим», Россия), дитиотреитол (ДТТ;
что L-лизин (Lys) может стабилизировать на-
«Panreac», Испания). Воду для всех растворов
тивную структуру белков, повышать их раство-
готовили с использованием системы Easy-
римость, защищать их от аморфной агрегации
Pure II RF («Barnstead International», США).
и от инактивации [26-30]. Lys широко исполь-
Все эксперименты проводились в 30 мМ Hepes
зуется биотехнологами для хранения терапев-
(рН 6,8) с постоянной ионной силой (IS), рав-
тических белков [31]. Тем не менее существуют
ной 150 мМ, создаваемой NaCl там, где это
тест-системы, в которых Lys ускоряет агрега-
было необходимо.
цию модельного белка или же его влияние на
Выделение и подготовка белков. ФБ из ске-
стабильность белковой молекулы и ее склон-
летных мышц кролика выделяли, хранили и
ность к агрегации варьируется в зависимости
подготавливали к эксперименту согласно мето-
от условий среды или концентрации амино-
дикам, описанным в работах Kurganov et al. [36]
кислоты [32-34].
и Eronina et al. [40]. УФ-Облучение ФБ прово-
Целью настоящей работы являлось изуче-
дили с использованием Hg-Xe лампы L8252
ние влияния химических шаперонов Bet и Lys
(«Hamamatsu Photonics», Япония) в кварце-
на тест-системы, характеризующиеся различ-
вой кювете с длиной оптического пути 1 см
ными кинетическими режимами агрегации.
при 6 °C, как описано ранее [38]. Мощность
Мышечная гликогенфосфорилаза b (ФБ) пред-
падающего света составляла 10,4 мВт/см2, вре-
ставляет собой димерный белок с молекуляр-
мя облучения составляло 15 мин, доза облуче-
ной массой 194,7 кДа [35]. Ее тепловая агрега-
ния составляла 9,4 Дж/см2.
БИОХИМИЯ том 88 вып. 1 2023
ЭФФЕКТ ШАПЕРОНОВ НА КИНЕТИКУ АГРЕГАЦИИ БЕЛКОВ
85
Выделение апо-ФБ проводили согласно ме-
где I - интенсивность светорассеяния, t - вре-
тодике, описанной в работе Shaltiel et al. [41].
мя, I0 - начальная интенсивность светорассея-
Сульфат-аммонийный осадок, полученный по-
ния в момент t = 0, t* - длительность стадии
сле отделения пиридоксальфосфата (PLP), рас-
нуклеации, определяемая отрезком на оси абс-
творяли в 30мМ буфере Hepes-NaOH (рН 6,8),
цисс, отсекаемым теоретической кривой, рас-
содержащем 150 мМ NaCl и 5 мМ ДТТ (для
считанной из этого уравнения, v0 - начальная
опытов, проводимых методом ДСК (см. ниже),
скорость процесса агрегации на стадии роста
буфер не содержал ДТТ). Оставшийся PLP и
агрегатов и B - константа. Уравнение (3) при-
сульфат аммония отделяли от апо-ФБ на ко-
менимо только для описания части кинетиче-
лонке с Sephadex G-25, уравновешенной тем же
ской кривой выше точки перегиба.
буфером. Нанофотометр NP80 («Implen», Гер-
Размеры стартовых агрегатов (Rh,0), детек-
мания) использовали для спектрофотометри-
тируемых в растворе в начальный момент уве-
ческого определения концентрации белков при
личения интенсивности светорассеяния, опре-
280 нм (коэффициент поглощения A1%см = 13,2).
деляли на основании зависимости (I - I0) от Rh,
Динамическое лазерное светорассеяние (ДЛС).
как описано ранее [43]. Размер агрегатов, де-
Метод ДЛС применялся для изучения кинети-
тектируемых после завершения стадии нуклеа-
ки тепловой агрегации ФБ при 48 °C, УФ-ФБ
ции (Rh*), определяли на основании зависимо-
при 37 °C и апо-ФБ при 37 °C в отсутствие и в
сти Rh(t) в момент времени t = t*.
присутствии химических шаперонов. Кривые
Дифференциальная сканирующая калориме-
светорассеяния регистрировали с использова-
трия (ДСК). Исследования влияния химиче-
нием корреляционного спектрометра Photocor
ских шаперонов на тепловое разворачивание
Complex («PhotoCor Instruments Inc.», США),
ФБ и апо-ФБ проводились с использованием
как описано в работах Eronina et al. [39, 40].
дифференциального сканирующего калориме-
Буфер или растворы химических шаперонов в
тра MicroCal VP-Capillary DSC («Malvern Instru-
буфере инкубировали в ячейке в течение 5 мин
ments», США) при скорости нагрева 1 °C/мин.
при 48 °С для опытов с ФБ или при 37 °С - для
Концентрация белка составляла 1 мг/мл. В опы-
опытов с УФ-ФБ или апо-ФБ перед добавле-
тах с химическими шаперонами в контроль-
нием белка-мишени до конечной концентра-
ную и экспериментальную ячейки добавляли
ции 0,3 мг/мл. Все эксперименты были повто-
одну и ту же концентрацию шаперона. Кор-
рены не менее трех раз.
ректировку калориметрических сканов, оцен-
Полидисперсный анализ корреляцион-
ку термостабильности белка и расчет калори-
ных функций флуктуаций интенсивности рас-
метрической энтальпии (ΔHcal) проводили, как
сеянного света, полученных методом ДЛС,
описано ранее [44].
проводили с использованием программно-
Аналитическое ультрацентрифугирование (AUC).
го обеспечения DynaLS («Alango», Израиль),
Эксперименты по скоростной седиментации
как описано ранее [38]. Полученное значение
проводились в аналитической ультрацентри-
коэффициента диффузии частиц (D) приме-
фуге модели E («Beckman», США), оснащенной
нялось для расчета размеров гидродинамиче-
абсорбционной оптикой, фотоэлектрическим
ских радиусов Rh белковых молекул и их агре-
сканером, монохроматором и компьютером
гатов в растворе с использованием уравнения
онлайн. В экспериментах использовали ротор
Стокса-Эйнштейна:
с шестью отверстиями (An-G Ti) и 12-мм двух-
секторные ячейки. Перед опытом ротор пред-
D = kBT / 6πηRh,
(2)
варительно грели в термостате при 48 °C в те-
чение ночи. Профили седиментации образцов
где kB - постоянная Больцмана, T - абсолют-
регистрировали путем измерения оптической
ная температура, а η - динамическая вязкость
плотности при 280 нм. Все ячейки сканиро-
растворителя. Коэффициенты преломления
вались одновременно с интервалом в 2,5 мин.
и значения динамической вязкости, необхо-
Распределения дифференциальных коэффици-
димые для определения Rh, представлены в
ентов седиментации [c(s) vs s] были определены
табл. П1 и П2 в Приложении.
при 48 °C и приведены к стандартным условиям
Анализ кинетических кривых агрегации.
(растворитель с плотностью и вязкостью воды
В отсутствие и в присутствии химических ша-
при 20 °C) с помощью программы SEDFIT [45].
перонов кинетические кривые тепловой агре-
Скорость ротора во всех опытах составляла
гации белков-мишеней можно описать уравне-
48 000 об./мин. Значения плотности и дина-
нием [42]:
мической вязкости растворов, используемых
в опытах AUC, представлены в таблицах П1
I - I0 = v0(t - t*) - B(t - t*)2, (t > t*),
(3)
и П2 в Приложении.
БИОХИМИЯ том 88 вып. 1 2023
86
МИХАЙЛОВА и др.
Анализ данных. Программное обеспечение
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Origin («OriginLab Corporation», США) вер-
сии 8.0 и выше было использовано для анализа
Влияние Bet на кинетику тепловой агрегации
полученных данных. Для характеристики со-
модельных белков. Влияние химического шапе-
ответствия экспериментальных данных теоре-
рона Bet на агрегацию ФБ при 48 °C, УФ-ФБ
тическим уравнениям использовался коэффи-
при 37 °C и апо-ФБ при 37 °C изучалось мето-
циент детерминации R2. Все представленные в
дом ДЛС. На рис. 1 представлены зависимости
работе данные характеризовались значениями
интенсивности светорассеяния (I-I0) и разме-
R2 ≥ 0,98.
ров гидродинамических радиусов агрегатов (Rh)
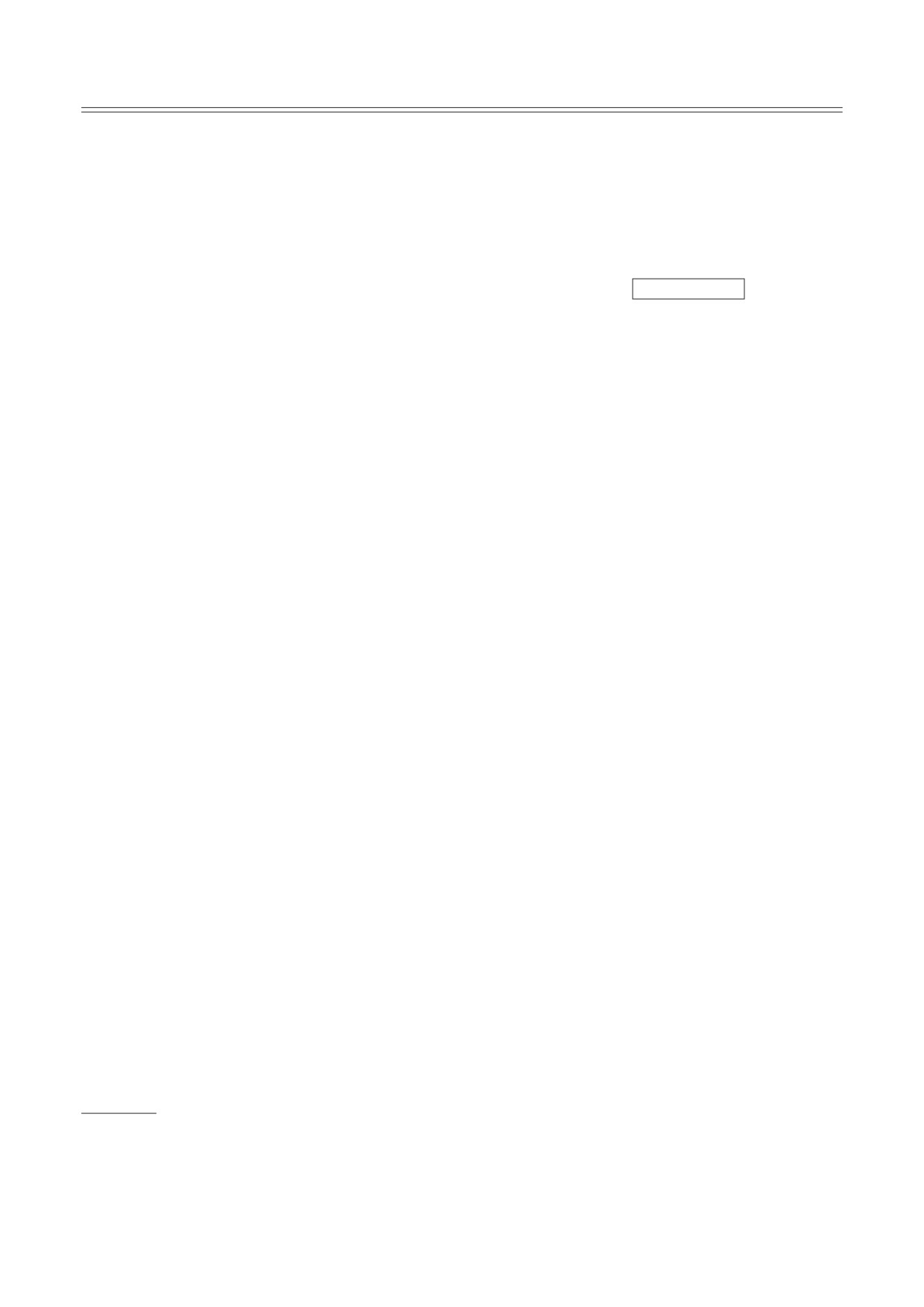
Рис. 1. Влияние Bet на кинетику агрегации модельных белков. Зависимости (I-I0) (а, в и д) и Rh (б, г и е) от t для
ФБ при 48 °C (а и б), УФ-ФБ при 37 °C (в и г) и апо-ФБ при 37 °C (д и е) в присутствии Bet. Концентрации шапе-
рона указаны на панелях; концентрация белка во всех экспериментах составляла 0,3 мг/мл. Исследования проводили
в 30 мМ Hepes (рН 6,8) при постоянной ионной силе (IS) 150 мМ, создаваемой NaCl. Для наглядности на рис. 1 приве-
дены данные не для всех изученных концентраций Bet
БИОХИМИЯ том 88 вып. 1 2023
ЭФФЕКТ ШАПЕРОНОВ НА КИНЕТИКУ АГРЕГАЦИИ БЕЛКОВ
87
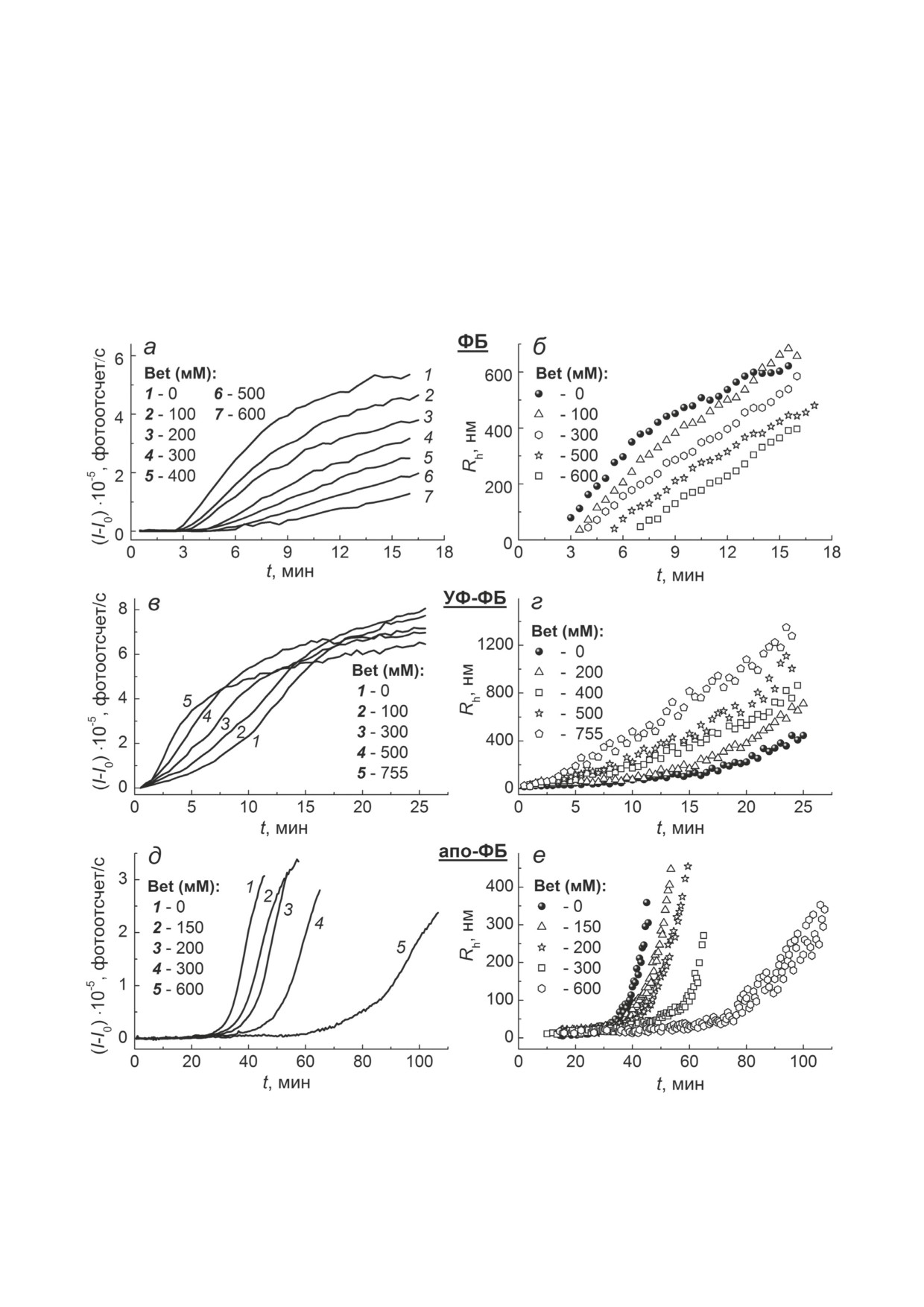
Таблица 1. Изменения основных параметров, характеризующих кинетику агрегации ФБ при 48 °C, УФ-ФБ при 37 °C и
апо-ФБ при 37 °C, при повышении концентрации Bet
Тест-система и диапазон концентраций Bet
Основные
параметры агрегации
ФБ при 48 °C (n = 0,5);
УФ-ФБ при 37 °C (n = 1);
апо-ФБ при 37 °C (n = 2);
[Bet]: 0-600 мМ
[Bet]: 0-755 мМ
[Bet]: 0-600 мМ
возрастает
снижается
возрастает
Длительность стадии
с 3,02 ± 0,04
с 7,14 ± 0,11
с 33,02 ± 0,11
нуклеации, t*, мин
до 6,06 ± 0,18
до 1,22 ± 0,07
до 73,70 ± 0,75
снижается
возрастает
снижается
Начальная скорость роста
с 8,90 ± 0,14
с 8,44 ± 0,23
с 3,38 ± 0,10
агрегатов, v0·10-4, мин-1
до 1,40 ± 0,09
до 12,00 ± 0,33
до 0,66 ± 0,05
снижается
изменяется
снижается
Размер стартовых
с 60,1 ± 2,8
с 20,0 ± 1,0
с 16,4 ± 0,9
агрегатов, Rh,0, нм
до 19,8 ± 2,7
до 26,3 ± 2,1
до 11,4 ± 1,2
возрастает
с 44,4 ± 1,1
снижается
возрастает
до 63,7 ± 1,3
Размер ядер, Rh*, нм
с 70,3 ± 3,1
с 40,2 ± 1,5
(100 мМ Bet);
до 28,8 ± 1,7
до 67,4 ± 2,7
далее снижается
до 35,4 ± 1,2
Примечание. Концентрация белка составляла 0,3 мг/мл (30 мМ Hepes (pH 6,8); IS = 150 мM).
от времени (t) для белков-мишеней в присут-
роста агрегатов (v0) модельных белков была по-
ствии различных концентраций Bet. Согласно
лучена с использованием уравнения (3). Так-
полученным данным, рост концентрации Bet в
же были оценены размеры стартовых агрега-
диапазоне 0-600 мМ сопровождается увеличе-
тов (Rh,0) и ядер (Rh*) (см. раздел «Материалы и
нием продолжительности лаг-периода на кине-
методы»). Таблица 1 демонстрирует изменения
тических кривых агрегации ФБ и апо-ФБ и сни-
значений этих параметров с ростом концентра-
жением значений I-I0 и Rh (рис. 1, а, б, д и е).
ции Bet для каждой тест-системы. Полный на-
Это указывает на то, что Bet защищает данные
бор полученных данных для ФБ, УФ-ФБ и апо-
белки от тепловой агрегации. Прямо противо-
ФБ в присутствии различных концентраций
положное влияние Bet оказывает на УФ-ФБ, и
Bet представлен в табл. П3-П5 в Приложении.
рост концентрации Bet до 755 мМ стимулирует
Влияние Bet на термостабильность модель-
формирование агрегатов (рис. 1, в и г).
ных белков. Денатурация белка является одной
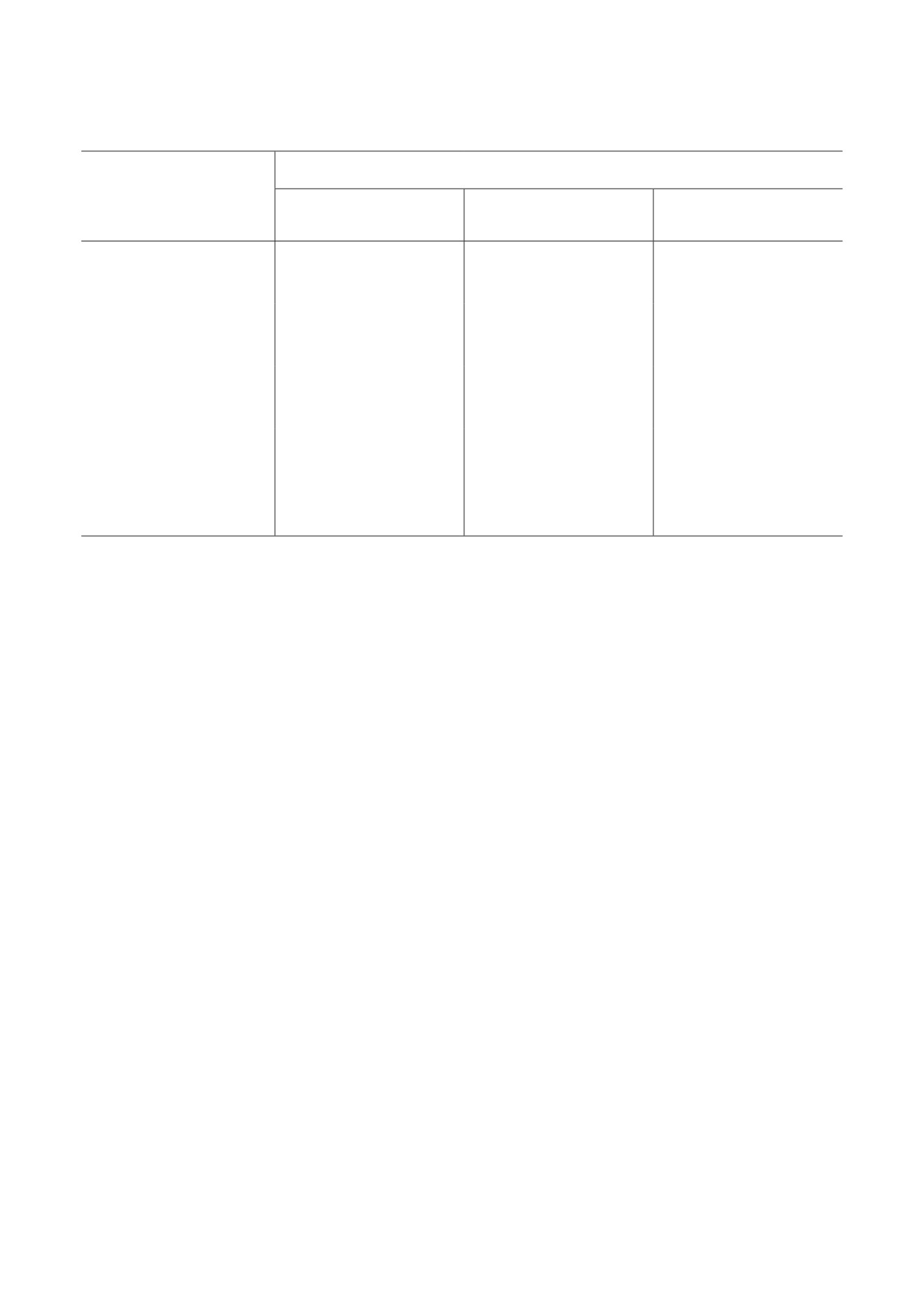
При анализе влияния шаперонов на кине-
из ключевых стадий процесса его агрегации
тику агрегации модельных белков важно по-
(схема). Для оценки влияния Bet на тепловое
нимать, по какому пути идет агрегация этих
разворачивание модельных белков исполь-
белков в отсутствие добавок. Подобные иссле-
зовался метод ДСК. Температурные зави-
дования были проведены в наших предыдущих
симости избыточного теплопоглощения для
работах [37, 38]. На схеме представлены основ-
ФБ (1 мг/мл) и апо-ФБ (1 мг/мл) в отсутствие
ные стадии процесса агрегации ФБ, УФ-ФБ и
и в присутствии 100 мМ или 600 мМ Bet пред-
апо-ФБ в выбранных условиях; скорость-ли-
ставлены на рис. 2. Получить аналогичные
митирующая стадия для каждой тест-системы
данные для УФ-ФБ не представляется возмож-
выделена серым цветом. Следует отметить, что
ным, поскольку нативная третичная структура
все предлагаемые механизмы агрегации осно-
белка практически утрачивается в процессе
ваны на предположении, что рост белковых
УФ-облучения [38].
агрегатов происходит за счет присоединения
Температура максимума (Tmax) профиля ДСК
развернутых белковых молекул к сформиро-
для ФБ соответствует значению 57,8 °C (рис. 2, а;
вавшимся ядрам, а концентрация ядер по за-
сплошная кривая). Добавление 100 или 600 мМ
вершении стадии нуклеации пропорциональ-
Bet повышает термостабильность ФБ и сдви-
на исходной концентрации белка [46].
гает кривую в сторону более высоких темпера-
Количественная оценка влияния Bet на
тур до Tmax = 58,3 °C или 59,9 °C соответственно
длительность стадии нуклеации (t*) и на на-
(рис. 2, а; штриховая и штрихпунктирная кри-
чальную скорость роста агрегатов на стадии
вые). Основные калориметрические параметры,
БИОХИМИЯ том 88 вып. 1 2023
88
МИХАЙЛОВА и др.
Схема. Механизмы тепловой агрегации ФБ при 48 °C (а), УФ-ФБ при 37 °C (б) и апо-ФБ при 37 °C (в). Для каждой
тест-системы обозначены скорость-лимитирующая стадия (выделены серым цветом и жирными стрелками на схеме)
и основные параметры, характеризующие стадию нуклеации (t*, Rh*) и стадию роста агрегатов (v0)
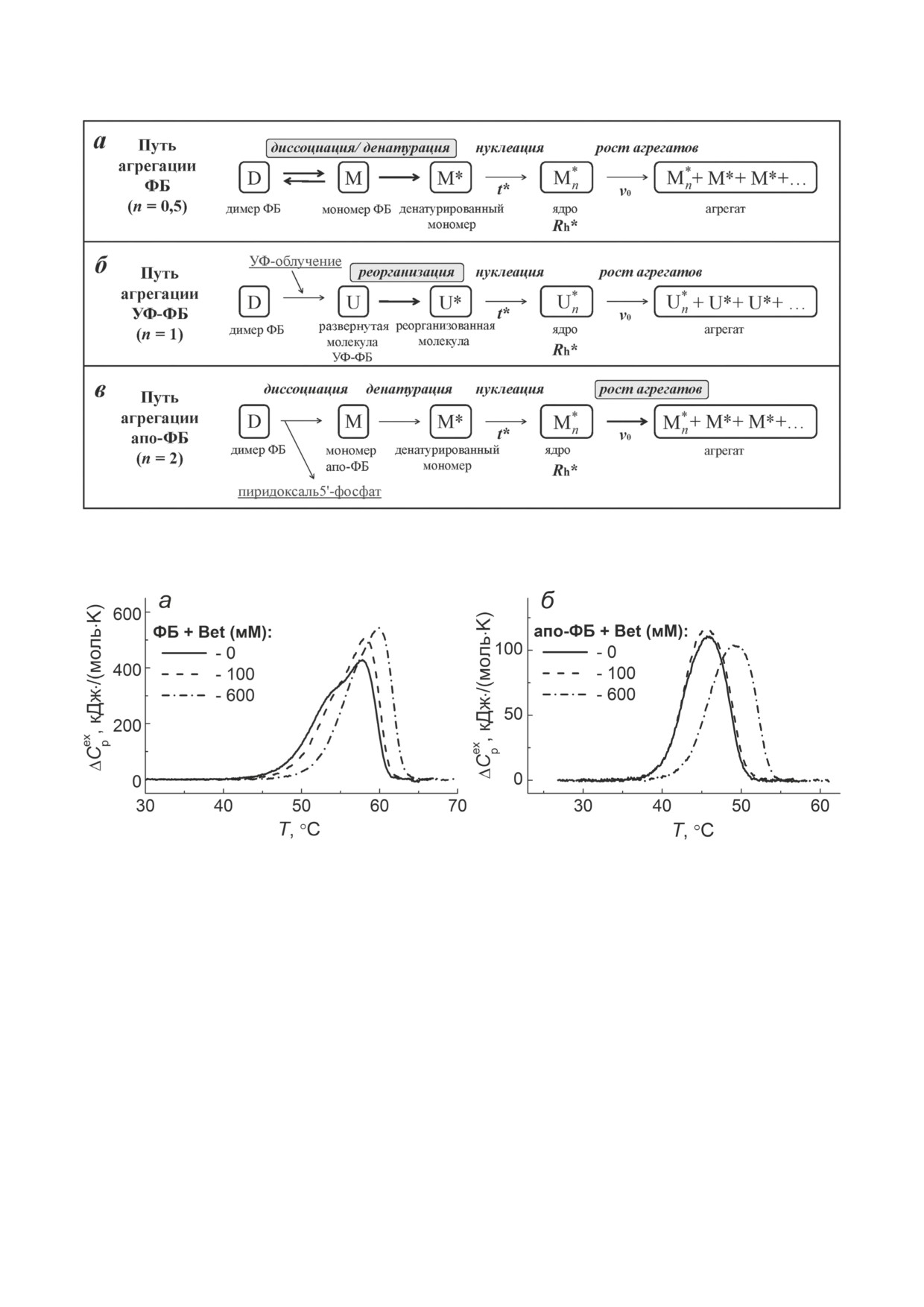
Рис. 2. Влияние Bet на термостабильность ФБ и апо-ФБ. Температурные зависимости избыточного теплопоглоще-
ния (ΔCpex), полученные для ФБ (1 мг/мл, панель а) и апо-ФБ (1 мг/мл, панель б) в отсутствие и в присутствии 100
или 600 мМ Bet
характеризующие профили ДСК, представле-
тически не влияет на энтальпию, ширину и
ны в табл. 2. Согласно табл. 2, калориметриче-
форму пика, а положение Tmax смещается в
ская энтальпия (ΔHcal) теплового перехода ФБ,
сторону более высоких температур до 49,2 °C
определяемая как площадь под кривой ДСК,
только при высоких (600 мМ) концентрациях
незначительно увеличивается при добавлении
шаперона. Это означает, что Bet может повы-
шаперона, а сам переход становится более коо-
шать термостабильность апо-ФБ, однако не
перативным, о чем свидетельствует уменьшение
инициирует значительных структурных пере-
ширины пика. Это указывает на конформацион-
строек в молекуле белка.
ные изменения, происходящие в молекуле ФБ
Механизм действия Bet на агрегацию ФБ
под влиянием Bet.
при 48 °C. Согласно схеме, первым этапом про-
Тепловая денатурация молекулы апо-ФБ
цесса тепловой агрегации ФБ является стадия
(рис. 2, б; табл. 2) в отсутствие добавок ха-
денатурации белковой молекулы. Эта стадия
рактеризуется значениями Tmax = 45,9 °C и
неразрывно связана с обратимой диссоциаци-
ΔHcal = 725 кДж⋅моль-1. Присутствие Bet прак-
ей нативного димера ФБ на мономеры (D ↔ М).
БИОХИМИЯ том 88 вып. 1 2023
ЭФФЕКТ ШАПЕРОНОВ НА КИНЕТИКУ АГРЕГАЦИИ БЕЛКОВ
89
Таблица 2. Основные калориметрические параметры тепловых переходов ФБ и апо-ФБ в присутствии химических
шаперонов
Белок
Шаперон
Tmax, °C
ΔHcal, кДж⋅моль-1
Ширина пика, °C
нет
57,8 ± 0,1
3470 ± 210
7,97 ± 0,09
100 мМ Bet
58,3 ± 0,1
3620 ± 230
6,85 ± 0,07
ФБ
(1 мг/мл)
600 мМ Bet
59,9 ± 0,1
3700 ± 245
6,45 ± 0,09
100 мМ Lys
53,9 ± 0,1
3750 ± 260
8,93 ± 0,11
нет
45,9 ± 0,1
725 ± 45
6,30 ± 0,07
100 мМ Bet
45,7 ± 0,1
775 ± 47
6,44 ± 0,09
aпo-ФБ
(1 мг/мл)
600 мМ Bet
49,2 ± 0,1
730 ± 45
6,74 ± 0,08
100 мМ Lys
46,1 ± 0,1
783 ± 50
6,38 ± 0,07
Примечание. В таблице приведены средние значения полученных данных ± стандартное отклонение.
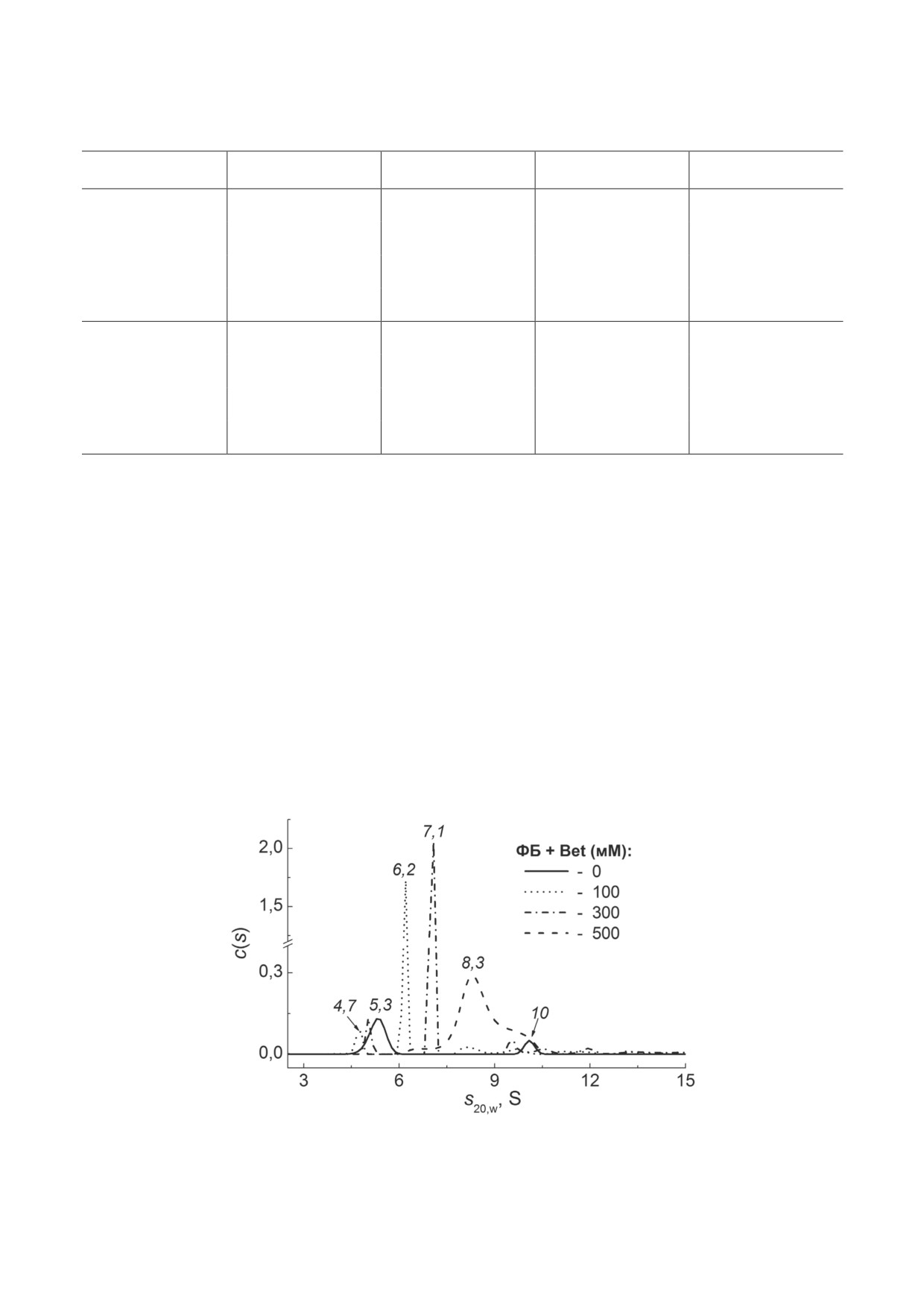
Поскольку химические шапероны могут ока-
6,2; 7,1 и 8,3 S, которые могут соответствовать
зывать значительное влияние на этот про-
частично развернутым димерам с разной кон-
цесс, олигомерное состояние ФБ в отсутствие
формацией. Небольшое плечо s20,w = 10 S на
и в присутствии Bet было исследовано мето-
распределении c(s) в присутствии 500 мМ Bet
дом AUC. Полученные данные седиментации
указывает на то, что небольшая часть димера
представлены на рис. 3.
может находиться в нативной форме.
Распределение c(s) для ФБ показывает два
Таким образом, данные AUC указывают
пика с коэффициентами седиментации (s20,w)
на смещение равновесия D ↔ М в сторону ди-
5,3 и 10 S, которые соответствуют мономерной
мерной формы ФБ под влиянием Bet, что кор-
и димерной формам белка. Сравнение это-
релирует с полученными ранее данными [40].
го распределения с таковыми для смесей ФБ
Способность осмолитов стабилизировать на-
в присутствии Bet (100, 300 и 500 мМ; рис. 3)
тивную структуру белков широко обсуждается
показало, что доля мономера ФБ (5,3 S) умень-
в недавнем обзоре Sharma et al. [47]. Следует от-
шалась с ростом концентрации шаперона. При
метить, что краудинг, возникающий из-за при-
этом появляются новые пики с s20,w, равные
сутствия высоких концентраций шаперонов,
Рис. 3. Влияние Bet на олигомерное состояние ФБ. Дифференциальные распределения по коэффициентам седимен-
тации, c(s), для ФБ (0,37 мг/мл) в отсутствие и в присутствии 100, 300 или 500 мМ Bet. Значения коэффициента седи-
ментации выделены курсивом. Распределения c(s) были получены при 48 °C и приведены к стандартным условиям.
Общее время при 48 °С составило 80 мин
БИОХИМИЯ том 88 вып. 1 2023
90
МИХАЙЛОВА и др.
также может препятствовать диссоциации ФБ
ингибирует относительно быструю стадию раз-
и стабилизировать димерную форму белка на
ворачивания апо-ФБ, однако он значительно
этой стадии.
замедляет стадию роста агрегатов. Стабилизи-
Димер ФБ денатурирует медленнее, чем
рующее воздействие осмолитов на структуру
его мономер [36], что объясняет повышение
белков во время стресса обсуждается во мно-
термостабильности белка в присутствии Bet
гих работах [13, 14, 17, 47]. Однако исследова-
(данные ДСК). Стабилизация третичной и чет-
ния группы Pielak указывают на необходимость
вертичной структуры молекулы ФБ с ростом
учитывать влияние осмолитов не только на
концентрации Bet приводит к снижению скоро-
стабильность белков, но и на белок-белковые
сти его разворачивания под действием темпера-
взаимодействия, такие как ассоциация/агрега-
туры. Согласно данным ДЛС (табл. 1), сниже-
ция и формирование комплексов [50]. Это кор-
ние параметра v0 свидетельствует о замедлении
релирует с полученными нами данными по за-
процесса слипания развернутых белковых мо-
щитному действию Bet при агрегации апо-ФБ.
лекул. Длительность стадии нуклеации возрас-
Сравнение эффекта Bet на ФБ и апо-ФБ пока-
тает (параметр t*), а значительное уменьшение
зывает, что данный шаперон может стабили-
размеров Rh,0 и Rh* может означать, что в обра-
зировать как нативное состояние белка, так и
зовании стартовых агрегатов и ядер участвует
снижать скорость слипания белковых молекул
меньшее количество развернутых белковых мо-
друг с другом.
лекул или что конформация этих молекул более
В то же время Bet стимулирует агрегацию
компактна.
УФ-ФБ при 37 °C (рис. 1, в и г). Известно, что
Можно заключить, что защитный эф-
УФ-излучение повреждает конформационные
фект Bet при тепловой агрегации ФБ при 48 °C
замки димеров ФБ, что приводит к диссоциа-
обусловлен в первую очередь ингибированием
ции и разворачиванию белковой молекулы
лимитирующей для данной тест-системы ста-
и утрате ее нативной структуры [38]. Это со-
дии диссоциации/денатурации ФБ (n = 0,5;
провождается изменением гидрофобности по-
схема, а). Вследствие этого количество развер-
верхности белка и образованием относительно
нутых молекул белка в растворе нарастает мед-
устойчивых первичных кластеров размером
ленно, что приводит к снижению скоростей
~10 нм [38, 51]. В результате процесс агрега-
формирования ядер и роста агрегатов.
ции УФ-ФБ не включает стадию денатурации
Механизмы действия Bet при тепловой агре-
(схема, б). Стадиям нуклеации и роста агрега-
гации апо-ФБ и УФ-ФБ. В отличие от натив-
тов предшествует медленная стадия структур-
ной ФБ, апо-ФБ является мономерным тер-
ной реорганизации молекул УФ-ФБ, и порядок
молабильным белком, поскольку удаление
агрегации по отношению к белку становится
пиридоксаль-5′-фосфата из активного центра
равным единице (n = 1) [38].
фермента приводит к его диссоциации [48, 49].
Недавние исследования показали, что ме-
При 37 °C стадия денатурации апо-ФБ проте-
тиламины способны образовывать комплексы
кает быстро, а скорость-лимитирующей стано-
с гидрофобными участками на поверхности
вится стадия роста агрегатов (n = 2; схема, в)
белка [52, 53]. На поверхности УФ-облучен-
[37]. Данные ДЛС (рис. 1, д) показывают, что
ной молекулы ФБ такие участки могут обра-
Bet в концентрации 600 мМ замедляет агрега-
зовываться за счет экспонирования колец аро-
цию белка-мишени, увеличивая значение t* и
матических аминокислот, с которыми Bet
снижая v0 (табл. 1). Это может быть связано со
преимущественно связывается, нежели исклю-
способностью осмолитов повышать термоста-
чается с поверхности [54]. Можно предполо-
бильность белков и защищать их от разворачи-
жить, что взаимодействие Bet с УФ-ФБ уско-
вания в денатурирующих условиях [47], как это
ряет структурную перестройку молекулы белка
было показано для ФБ. Однако данные ДСК
(скорость-лимитирующая стадия на схеме, б).
показывают, что Bet в концентрации 100 мМ
Конформация молекул/кластеров изменяется
практически не влияет на тепловое разворачи-
и становится менее компактной, о чем сви-
вание апо-ФБ (рис. 2, б; табл. 2). Повышение
детельствует увеличение гидродинамических
термостабильности белка при высокой кон-
радиусов Rh,0 и Rh* в присутствии 100 мМ Bet
центрации шаперона (рис. 2, б; штрихпунктир-
(табл. 1; табл. П4 в Приложении). Снижение
ная кривая) может быть связано с эффектом
значений Rh* при дальнейшем увеличении
краудинга, который стабилизирует более ком-
концентрации Bet может быть обусловлено эф-
пактную конформацию и препятствует раз-
фектом краудинга, который, с одной стороны,
ворачиванию белка. В рамках предложенного
стимулирует формирование более компактной
механизма (схема, в) полученные результаты
структуры белка, а с другой - ускоряет стадию
можно объяснить тем, что Bet неэффективно
агрегации. Увеличение значения v0 (табл. 1)
БИОХИМИЯ том 88 вып. 1 2023
ЭФФЕКТ ШАПЕРОНОВ НА КИНЕТИКУ АГРЕГАЦИИ БЕЛКОВ
91
Таблица 3. Изменение основных параметров, характеризующих кинетику агрегации ФБ при 48 °C, УФ-ФБ при 37 °C
и апо-ФБ при 37 °C при повышении концентрации Lys
Тест-система и диапазон концентраций Lys
Основные параметры
агрегации
ФБ при 48 °C (n = 0,5);
УФ-ФБ при 37 °C (n = 1);
апо-ФБ при 37 °C (n = 2);
[Lys]: 0-125 мМ
[Lys]: 0-120
[Lys]: 0-124 мМ
Длительность стадии
возрастает
возрастает
возрастает
нуклеации, t*, мин
с 3,02 ± 0,04 до 3,55 ± 0,05
с 7,14 ± 0,11 до 12,46 ± 0,36
с 33,02 ± 0,11 до 48,71 ± 0,32
Начальная скорость роста
возрастает
снижается
снижается
агрегатов, v0·10-4, мин-1
с 8,90 ± 0,14 до 10,17 ± 0,18
с 8,44 ± 0,23 до 4,96 ± 0,40
с 3,38 ± 0,10 до 0,98 ± 0,14
Размер стартовых
возрастает
снижается
снижается
агрегатов, Rh,0, нм
с 60,1 ± 2,8 до 78,2 ± 1,9
с 20,0 ± 1,0 до 13,9 ± 0,8
с 16,4 ± 0,9 до 4,2 ± 0,6
возрастает
снижается
не изменяется,
Размер ядер, Rh*, нм
с 70,3 ± 3,1 до 112,5 ± 1,7
с 44,4 ± 1,1 до 37,5 ± 1,6
‹Rh*› = 40,9 ± 1,0
Примечание. Концентрация белка составляла 0,3 мг/мл (30 мМ Hepes (pH 6,8); IS = 150 мМ).
указывает на то, что Bet-индуцированное из-
повышении концентрации Lys, представлены
менение конформации молекул УФ-ФБ сти-
в табл. 3 и табл. П6-П8 в Приложении.
мулирует их слипание с ядрами. Ранее было
Исследования стабильности ФБ мето-
показано, что добавление Bet к ФБ на стадии
дом ДСК (рис. 4, а; табл. 2) показали, что в
роста агрегатов ускоряет процесс агрегации
присутствии 100 мМ Lys значение Tmax смеща-
белка [39]. Данные настоящей работы указы-
ется на 3,9 °C в сторону более низких темпера-
вают на способность Bet взаимодействовать с
тур. Это сопровождалось существенным изме-
поверхностью развернутого белка и усиливать
нением формы профиля ДСК и уменьшением
его агрегацию.
кооперативности теплового перехода. По-ви-
Ускорение тепловой агрегации ФБ под влия-
димому, Lys вызывает значительные конфор-
нием Lys. Представляло интерес сравнить ме-
мационные перестройки в молекуле ФБ, что
ханизмы действия Bet на агрегацию модельных
приводит к снижению ее термостабильности,
белков с действием другого шаперона. Соглас-
и процесс разворачивания белка под влиянием
но данным ДЛС (рис. П1 в Приложении), Lys
температуры заметно ускоряется.
стимулирует агрегацию ФБ при 48 °C, но зна-
Важную информацию может дать оценка
чительно тормозит агрегацию УФ-ФБ и апо-
влияния Lys на олигомерное состояние ФБ.
ФБ при 37 °C. Изменения параметров, харак-
Данные AUC (рис. 4, б), полученные при на-
теризующих кинетику агрегации белков при
гревании белка в течение 100 мин при 48 °C,
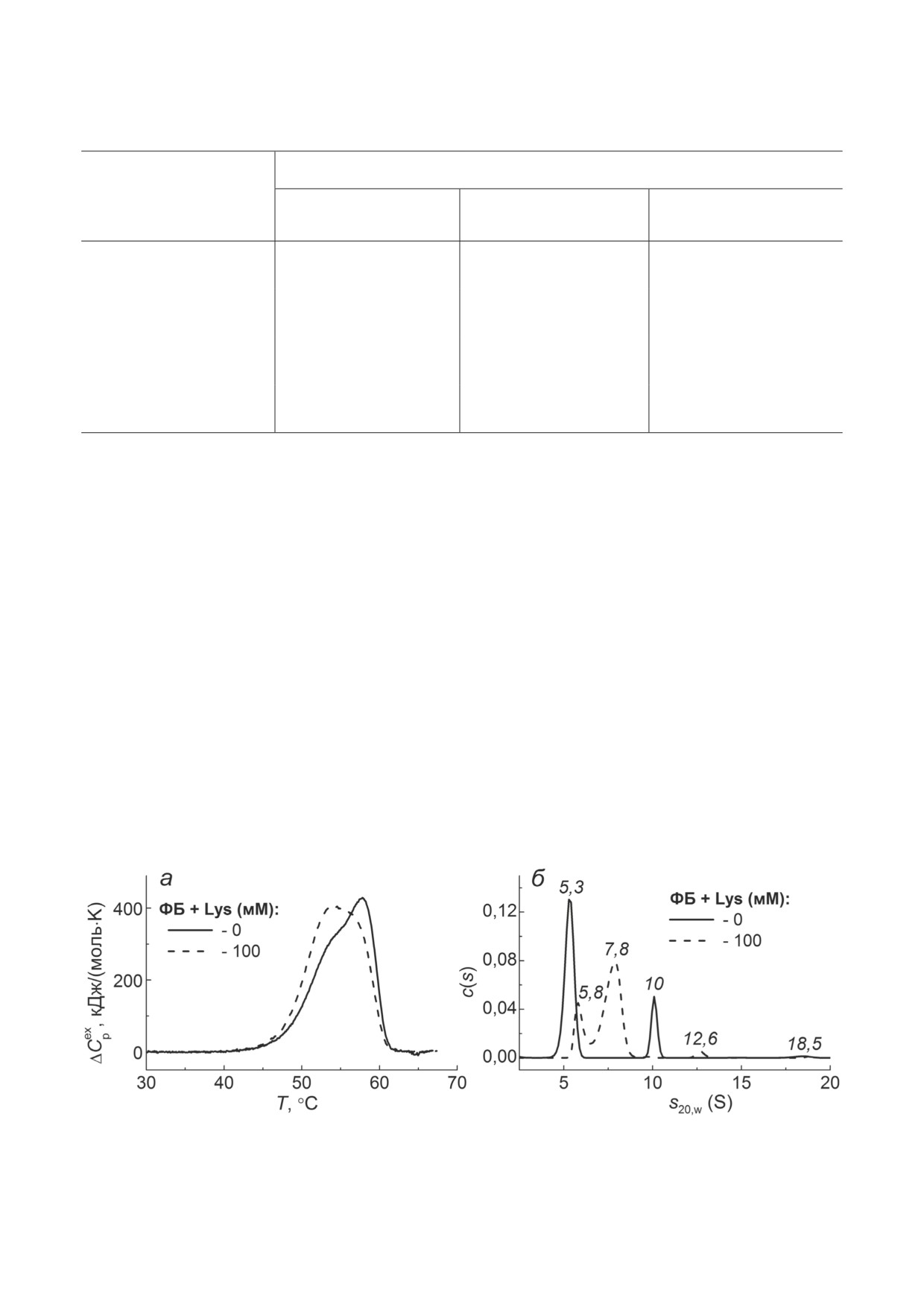
Рис. 4. Влияние Lys на термостабильность и олигомерное состояние ФБ. а - Зависимости избыточного теплопоглоще-
ния (ΔCpex) от температуры для ФБ (1 мг/мл); б - распределения c(s) для ФБ (0,38 мг/мл) в отсутствие и в присутствии
100 мМ Lys. Значения коэффициентов седиментации показаны курсивом. Распределения c(s) были получены при 48 °C
и скорректированы до стандартных условий; общее время при 48 °С составило 100 мин
БИОХИМИЯ том 88 вып. 1 2023
92
МИХАЙЛОВА и др.
показывают, что распределение c(s) для ФБ
Защитное действие Lys на тепловую агре-
в присутствии 100 мМ Lys (штриховая кри-
гацию УФ-ФБ и апо-ФБ. В случае УФ-ФБ и
вая) имеет два основных пика с s20,w, равными
апо-ФБ при 37 °С Lys действует как химиче-
5,8 и 7,8 S, что может соответствовать смесям
ский шаперон, тормозя их тепловую агрега-
комплексов Lys с денатурированными моно-
цию. В обоих случаях взаимодействие модель-
мерными и димерными формами белка раз-
ных белков с Lys характеризуется увеличением
личной конформации. Кроме того, в растворе
длительности стадии нуклеации и снижени-
присутствуют мелкие агрегаты 12,6 S. Оценка
ем скорости роста агрегатов (табл. 3; параме-
доли агрегированной ФБ (γagg), осаждающейся
тры t*, v0). Однако механизмы защиты от агре-
при ускорении ротора в экспериментах AUC,
гации для двух белков, демонстрируемые Lys,
указывает на тенденцию к увеличению зна-
различны из-за различий в путях агрегации
чения γagg в присутствии Lys. Зарегистрирова-
самих белков (схема, б и в).
но, что через 100 мин при 48 °C величина γagg
Согласно схеме и данным табл. 3, защитное
для ФБ изменяется от 69 до 73% в отсутствие и
действие Lys при тепловой агрегации УФ-ФБ
в присутствии 100 мМ Lys соответственно. При
обусловлено ингибированием процесса струк-
увеличении общего времени нагрева до 3,5 ч
турной реорганизации белковых молекул/клас-
(данные AUC не представлены) значение γagg
теров УФ-ФБ, что приводит к снижению ско-
изменялось от 82% (для ФБ) до 92% в присут-
рости их слипания. Уменьшение размеров Rh,0
ствии 25 мМ Lys. Коэффициент седиментации
и Rh*(табл. 3; табл. П7 в Приложении) может
оставшегося в растворе неагрегированного
свидетельствовать о более компактной кон-
белка составлял 3,5 S, что может соответство-
формации/конфигурации белковой молекулы в
вать развернутой асимметричной мономерной
присутствии Lys.
форме. При увеличении концентрации Lys
Интерпретация полученных данных для
до 50 мМ в этих условиях весь белок преципи-
апо-ФБ при 37 °С иная. Согласно данным ДСК
тировал.
(табл. 2; рис. П2 в Приложении), основные
Можно заключить, что индуцированные
калориметрические параметры, характери-
Lys конформационные изменения в молеку-
зующие плавление апо-ФБ в отсутствие и в
ле ФБ в процессе ее нагрева приводят к суще-
присутствии 100 мМ Lys, практически не из-
ственной дестабилизации как третичной, так
меняются. Это означает, что основное защит-
и четвертичной структуры белка (данные ДСК
ное действие как Lys, так и Bet на тепловую
и AUC). За счет смещения равновесия D ↔ М в
агрегацию апо-ФБ направлено на снижение
сторону мономерной формы и снижения тер-
скорости слипания белковых молекул без су-
мостабильности белка стадия диссоциации/
щественного влияния на процесс их развора-
денатурации ФБ ускоряется (схема, а). Незна-
чивания.
чительное замедление стадии нуклеации, веро-
Однако анализ размеров Rh,0 и Rh*, детекти-
ятно, связано с формированием более крупных
руемых в присутствии Bet или Lys (табл. 1 и 3),
агрегатов в присутствии Lys, о чем свидетель-
указывает на различия во влиянии этих шапе-
ствует рост значений Rh,0, Rh* (ДЛС, табл. 3)
ронов на комплексообразование и белок-бел-
и γagg (AUC).
ковые взаимодействия. Увеличение концен-
Здесь интересно сравнить механизмы
трации Lys от 0 до 124 мМ сопровождается
действия Lys и другой аминокислоты, арги-
снижением значений Rh,0 в ~4 раза, что может
нина (Arg), который часто влияет на белки
быть следствием уменьшения количества моле-
сходным с Lys образом [26-30]. Arg ускоряет
кул апо-ФБ, образующих стартовые агрегаты,
тепловую агрегацию ФБ, однако не вызывает
или их более компактой конформацией. Это
значительных конформационных изменений в
приводит к более длительному формированию
молекуле белка, не влияет на размеры Rh,0 и Rh*
ядер, размер которых остается постоянным не-
и уменьшает t* [44]. Сходный с Lys эффект Arg
зависимо от концентрации Lys (табл. 3). Инте-
на агрегацию ФБ также обусловлен сдвигом
ресно отметить, что одинаковые размеры Rh*
равновесия D ↔ M вправо. Однако Arg деста-
получены для ФБ [44] и апо-ФБ (неопублико-
билизирует преимущественно четвертичную
ванные данные) и в присутствии различных
структуру молекулы ФБ, обладая способно-
концентраций Arg при IS = 150 мМ. Возмож-
стью разрушать конформационные замки и
но, это обусловлено влиянием электростати-
стимулировать диссоциацию олигомерного
ческого взаимодействия зарядов аминокислот
белка [44]. Дальнейшее ускорение стадии ро-
с поверхностью формирующихся стартовых
ста агрегатов характерно для обоих агентов,
агрегатов и ядер. Нейтрально заряженный Bet
хотя увеличение параметра v0 с ростом кон-
незначительно снижает значение Rh,0, но стиму-
центрации Lys не очень значимо (табл. 3).
лирует рост ядер Rh*. Скорость присоединения
БИОХИМИЯ том 88 вып. 1 2023
ЭФФЕКТ ШАПЕРОНОВ НА КИНЕТИКУ АГРЕГАЦИИ БЕЛКОВ
93
белковых молекул к сформировавшимся ядрам
экспериментов и анализ полученных данных;
(параметр v0) также снижается заметнее в при-
В.В. Михайлова, Т.Б. Еронина, Н.А. Чебота-
сутствии Lys, чем Bet (табл. 3; табл. П5 и П8
рева, Б.И. Курганов - обсуждение результатов
в Приложении). Подобная эффективность Lys
исследования; В.В. Михайлова - написание
может быть связана с тем, что сродство этого
текста; В.В. Михайлова, Т.Б. Еронина, Н.А. Че-
шаперона к апо-ФБ в 3 раза выше, чем у Bet
ботарева - редактирование текста статьи.
(данные не представлены).
Финансирование. Работа выполнена при
финансовой поддержке Российского научного
фонда (грант № 16-14-10055 для В.В.М., Т.Б.Е.,
ЗАКЛЮЧЕНИЕ
Н.А.Ч., Б.И.К.) и Министерства науки и высше-
го образования РФ (для В.В.М., Т.Б.Е., Н.А.Ч.).
В настоящей работе были проанализиро-
Благодарности. Эта статья посвящена памя-
ваны и описаны различные механизмы дей-
ти нашего научного руководителя, профессора
ствия химических шаперонов Bet и Lys на мо-
Бориса Ивановича Курганова (1938-2021 гг.).
дельные белки, характеризующиеся различной
Свою жизнь Б.И. Курганов посвятил изучению
кинетикой агрегации (ФБ при 48 °C, n = 0,5;
структуры и функций аллостерических фер-
УФ-ФБ при 37 °C, n = 1; апо-ФБ при 37 °C,
ментов, а также процессов их денатурации и
n = 2). Были сформулированы следующие вы-
агрегации. Основной сферой его интересов в
воды. 1) Механизм действия химических шапе-
последние годы было изучение кинетики агре-
ронов на комплекс белок-мишень зависит от
гации белков и влияния на нее химических и
структуры и кинетического режима агрегации
белковых шаперонов. Б.И. Кургановым были
белка. 2) Сходный эффект на агрегацию бел-
разработаны подходы по установлению меха-
ков может быть результатом разных механиз-
низмов агрегации белков в различных тест-си-
мов действия шаперонов. 3) Сравнение дей-
стемах и методы количественной оценки и
ствия химического шаперона на тест-системах
сравнения антиагрегационной активности
с различной кинетикой агрегации дает более
шаперонов различной природы. Работы, вы-
полную информацию о возможностях при-
полненные под руководством Б.И. Курганова,
менения данного шаперона. Характеристи-
свидетельствуют об успешном применении
ка механизмов функционирования шаперо-
предложенных методов.
нов, приведенная в данной работе, расширяет
Конфликт интересов. Авторы заявляют об
наши представления о влиянии химических
отсутствии конфликта интересов.
шаперонов на разные стадии общего процесса
Соблюдение этических норм. Настоящая
агрегации белков и может быть полезна другим
статья не содержит описания каких-либо ис-
исследователям.
следований с участием людей или животных в
качестве объектов.
Вклад авторов. Б.И. Курганов - концеп-
Дополнительные материалы. Приложение к
ция и руководство работой; В.В. Михайлова,
статье опубликовано на сайте журнала «Биохи-
Т.Б. Еронина, Н.А. Чеботарева - проведение
СПИСОК ЛИТЕРАТУРЫ
1. Wang, W., and Roberts, C. J.
(2018) Protein
5. Stefani, M., and Dobson, C. M. (2003) Protein
aggregation - mechanisms, detection, and control,
aggregation and aggregate toxicity: new insights into
Int. J. Pharm., 550, 251-268, doi: 10.1016/j.ijpharm.
protein folding, misfolding diseases and biological
2018.08.043.
evolution, J. Mol. Med. (Berl),
81,
678-699,
2. Siddiqi, M. K., Alam, P., Chaturvedi, S. K., Shahein,
doi: 10.1007/s00109-003-0464-5.
Y. E., and Khan, R. H. (2017) Mechanisms of protein
6. Wang, W., Nema, S., and Teagarden, D. (2010) Pro-
aggregation and inhibition, Front. Biosci., 9, 1-20,
tein aggregation-pathways and influencing factors,
doi: 10.2741/e781.
Int. J. Pharm., 390, 89-99, doi: 10.1016/j.ijpharm.
3. Hartl, F. U. (2017) Protein misfolding diseases, Annu.
2010.02.025.
Rev. Biochem.,
86,
21-26, doi:
10.1146/annurev-
7. Kurganov, B. I. (2002) Kinetics of protein aggregation.
biochem-061516-044518.
Quantitative estimation of the chaperone-like activity
4. Harding, J. J. (1998) Cataract, Alzheimer’s disease, and
in test-systems based on suppression of protein
other conformational diseases, Curr. Opin. Ophthalmol.,
aggregation, Biochemistry (Moscow),
67,
409-422,
9, 10-13, doi: 10.1097/00055735-199802000-00003.
doi: 10.1023/a:1015277805345.
БИОХИМИЯ том 88 вып. 1 2023
94
МИХАЙЛОВА и др.
8.
Chebotareva, N. A., Roman, S. G., and Kurganov,
21.
Dar, M. A., Wahiduzzaman, Islam, A., Hassan, M. I.,
B. I. (2016) Dissociative mechanism for irreversible
and Ahmad, F. (2018) Counteraction of the deleterious
thermal denaturation of oligomeric proteins, Biophys.
effects of urea on structure and stability of mammalian
Rev., 8, 397-407, doi: 10.1007/s12551-016-0220-z.
kidney proteins by osmolytes, Int. J. Biol. Macromol.,
9.
Chebotareva, N. A., Eronina, T. B., Roman, S. G.,
107, 1659-1667, doi: 10.1016/j.ijbiomac.2017.10.021.
Mikhaylova, V. V., Kleymenov, S. Y., and Kurganov,
22.
Saha, I., Singh, V., Burra, G., and Thakur, A. K.
B. I.
(2019) Kinetic regime of Ca2+ and Mg2+-
(2018) Osmolytes modulate polyglutamine aggregation
induced aggregation of phosphorylase kinase at 40°C,
in a sequence dependent manner, J. Pept. Sci., 24,
Int. J. Biol. Macromol., 138, 181-187, doi: 10.1016/
e3115, doi: 10.1002/psc.3115.
j.ijbiomac.2019.06.240.
23.
Dasgupta, M., and Kishore, N.
(2017) Selective
10.
Borzova, V. A., Markossian, K. A., Kara, D. A., and
inhibition of aggregation/fibrillation of bovine serum
Kurganov, B. I. (2015) Kinetic regime of dithiothreitol-
albumin by osmolytes: mechanistic and energetics
induced aggregation of bovine serum albumin,
insights, PLoS One,
12, e0172208, doi:
10.1371/
Int. J. Biol. Macromol., 80, 130-138, doi: 10.1016/
journal.pone.0172208.
j.ijbiomac.2015.06.040.
24.
Natalello, A., Liu, J., Ami, D., Doglia, S. M., and
11.
Kurganov, B. I. (2018) Kinetic regime of aggregation of
de Marco, A. (2009) The osmolyte betaine promotes
UV-irradiated glyceraldehyde-3-phosphate dehydro-
protein misfolding and disruption of protein aggregates,
genase from rabbit skeletal muscle, Biochem. Biophys.
Proteins, 75, 509-517, doi: 10.1002/prot.22266.
Res. Commun., 495, 1182-1186, doi: 10.1016/j.bbrc.
25.
Singh, L. R., Dar, T. A., Rahman, S., Jamal, S., and
2017.11.166.
Ahmad, F. (2009) Glycine betaine may have opposite
12.
Kinne, R. K. (1993) The role of organic osmolytes in
effects on protein stability at high and low pH values,
osmoregulation: from bacteria to mammals, J. Exp.
Biochim. Biophys. Acta, 1794, 929-935, doi: 10.1016/
Zool., 265, 346-355, doi: 10.1002/jez.1402650403.
j.bbapap.2009.02.005.
13.
Yancey, P. H. (2005) Organic osmolytes as compatible,
26.
Sabbaghian, M., Ebrahim-Habibi, A., Hosseinkhani,
metabolic and counteracting cytoprotectants in high
S., Ghasemi, A., and Nemat-Gorgani, M. (2011) Pre-
osmolarity and other stresses, J. Exp. Biol., 208, 2819-
vention of thermal aggregation of an allosteric pro-
2830, doi: 10.1242/jeb.01730.
tein by small molecules: some mechanistic insights,
14.
Bolen, D. W. (2001) Protein stabilization by naturally
Int. J. Biol. Macromol., 49, 806-813, doi: 10.1016/
occurring osmolytes, Methods Mol. Biol., 168, 17-36,
j.ijbiomac.2011.07.016.
doi: 10.1385/1-59259-193-0:017.
27.
Li, S., Zheng, Y., Xu, P., Zhu, X., and Zhou, C. (2018)
15.
Kumar, R. (2009) Role of naturally occurring os-
L-Lysine and L-arginine inhibit myosin aggregation
molytes in protein folding and stability, Arch. Biochem.
and interact with acidic amino acid residues of myosin:
Biophys., 491, 1-6, doi: 10.1016/j.abb.2009.09.007.
The role in increasing myosin solubility, Food Chem.,
16.
Khan, S. H., Ahmad, N., Ahmad, F., and Kumar, R.
242, 22-28, doi: 10.1016/j.foodchem.2017.09.033.
(2010) Naturally occurring organic osmolytes: from
28.
Saadati-Eskandari, N., Navidpour, L., Yaghmaei,
cell physiology to disease prevention, IUBMB Life, 62,
P., and Ebrahim-Habibi, A. (2019) Amino acids as
891-895, doi: 10.1002/iub.406.
additives against amorphous aggregation: in vitro and
17.
Caldas, T., Demont-Caulet, N., Ghazi, A., and
in silico study on human lysozyme, Appl. Biochem.
Richarme, G. (1999) Thermoprotection by glycine
Biotechnol., 189, 305-317, doi: 10.1007/s12010-019-
betaine and choline, Microbiology (Reading), 145,
03010-4.
2543-2548, doi: 10.1099/00221287-145-9-2543.
29.
Haghighi-Poodeh, S., Kurganov, B., Navidpour,
18.
Mortazavi, M., Shokrgozar, M. A., Sardari, S., Azad-
L., Yaghmaei, P., and Ebrahim-Habibi, A. (2020)
manesh, K., Mahdian, R., et al. (2018) Physicochem-
Characterization of arginine preventive effect on
ical screening for chemical stabilizer of erythropoietin
heat-induced aggregation of insulin, Int. J. Biol.
to prevent its aggregation, Prep. Biochem. Biotechnol.,
Macromol., 145, 1039-1048, doi: 10.1016/j.ijbiomac.
48, 121-127, doi: 10.1080/10826068.2017.1405270.
2019.09.196.
19.
Venkatraman, A., Murugan, E., Lin, S. J., Peh, G.
30.
Shiraki, K., Kudou, M., Fujiwara, S., Imanaka, T., and
S. L., Rajamani, L., and Mehta, J. S. (2020) Effect
Takagi, M. (2002) Biophysical effect of amino acids
of osmolytes on in-vitro aggregation properties of
on the prevention of protein aggregation, J. Biochem.,
peptides derived from TGFBIp, Sci. Rep., 10, 4011,
132,
591-595, doi:
10.1093/oxfordjournals.jbchem.
doi: 10.1038/s41598-020-60944-0.
a003261.
20.
Bhojane, P. P., Joshi, S., Sahoo, S.J., and Rathore,
31.
Arakawa, T., Dix, D. B., and Chang, B. S. (2003)
A. S. (2021) Unexplored excipients in biotherapeutic
The effects of protein stabilizers on aggregation
formulations: natural osmolytes as potential stabilizers
induced by multiple-stresses, Yakugaku Zasshi., 123,
against thermally induced aggregation of IgG1 biother-
957-961, doi: 10.1248/yakushi.123.957.
apeutics, AAPS PharmSciTech., 23, 26, doi: 10.1208/
32.
Rishi, V., Anjum, F., Ahmad, F., and Pfeil, W. (1998)
s12249-021-02183-8.
Role of non-compatible osmolytes in the stabilization
БИОХИМИЯ том 88 вып. 1 2023
ЭФФЕКТ ШАПЕРОНОВ НА КИНЕТИКУ АГРЕГАЦИИ БЕЛКОВ
95
of proteins during heat stress, Biochem. J., 329, 137-
44.
Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
143, doi: 10.1042/bj3290137.
Shubin, V. V., Kleymenov, S. Y., and Kurganov,
33.
Wang, X., Feng, T., Wang, X., Zhang, X., and Xi, S.
B. I.
(2020) Effect of arginine on stability and
(2021) Gelation and microstructural properties of fish
aggregation of muscle glycogen phosphorylase b,
myofibrillar protein gels with the incorporation of
Int. J. Biol. Macromol., 165, 365-374, doi: 10.1016/
L-lysine and L-arginine at low ionic strength, J. Sci.
j.ijbiomac.2020.09.101.
Food Agric., 101, 5469-5477, doi: 10.1002/jsfa.11195.
45.
Brown, P. H., and Schuck, P. (2006) Macromolecular
34.
Smirnova, E., Safenkova, I., Stein-Margolina, B.,
size-and-shape distributions by sedimentation velocity
Shubin, V., and Gurvits, B.
(2013) L-arginine
analytical ultracentrifugation, Biophys. J., 90, 4651-
induces protein aggregation and transformation of
4661, doi: 10.1529/biophysj.106.081372.
supramolecular structures of the aggregates, Amino
46.
Kurganov, B. I. (2002) Estimation of the activity
Acids, 45, 845-855, doi: 10.1007/s00726-013-1528-7.
of molecular chaperones in test-systems based on
35.
Barford, D., and Johnson, L. N. (1989) The allosteric
suppression of protein aggregation, Usp. Biol. Khim.,
transition of glycogen phosphorylase, Nature, 340,
42, 89-138.
609-616, doi: 10.1038/340609a0.
47.
Sharma, G. S., Krishna, S., Dar, T. A., Khan, K.
36.
Kurganov, B. I., Kornilaev, B. A., Chebotareva, N. A.,
A., and Singh, L. R. (2021) Protecting thermody-
Malikov, V. P., Orlov, V. N., et al. (2000) Dissociative
namic stability of protein: the basic paradigm against
mechanism of thermal denaturation of rabbit skeletal
stress and unfolded protein response by osmolytes,
muscle glycogen phosphorylase b, Biochemistry, 39,
Int. J. Biol. Macromol., 177, 229-240, doi: 10.1016/
13144-13152, doi: 10.1021/bi000975w.
j.ijbiomac.2021.02.102.
37.
Eronina, T. B., Mikhaylova, V. V., Chebotareva,
48.
Hedrick, J. L., Shaltliel, S., and Fischer, E. H.
N. A., and Kurganov, B. I. (2016) Kinetic regime
(1966) On the role of pyridoxal 5′-phosphate in
of thermal aggregation of holo- and apoglycogen
phosphorylase.
3. Physicochemical properties and
phosphorylases b, Int. J. Biol. Macromol., 92, 1252-
reconstitution of apophosphorylase b, Biochemistry, 5,
1257, doi: 10.1016/j.ijbiomac.2016.08.038.
2117-2125, doi: 10.1021/bi00870a045.
38.
Mikhaylova, V. V., Eronina, T. B., Chebotareva, N. A.,
49.
Gunar, V. I., Sugrobova, N. P., Chebotareva, N. A.,
Kleymenov, S. Y., Shubin, V. V., and Kurganov, B.
Stepanova, S. V., Poznanskaya, A. A., Kurganov, B. I.
I. (2017) A thermal after-effect of UV irradiation of
in Fukui, T., Kagamiyama, H., Soda, K., and Wada,
muscle glycogen phosphorylase b, PLoS One, 12,
H. (Eds) (1990) Enzymes Dependent on Pyridoxal
e0189125, doi: 10.1371/journal.pone.0189125.
Phosphate and Other Carbonyl Compounds as Cofactors,
39.
Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
Pergamon Press, Oxford, pp. 417-419.
Kleymenov, S. Y., Pivovarova, A. V., and Kurganov,
50.
Rydeen, A. E., Brustad, E. M., and Pielak, G. J.
B. I. (2022) Combined action of chemical chaperones
(2018) Osmolytes and protein-protein interactions,
on stability, aggregation and oligomeric state of muscle
J. Am. Chem. Soc., 140, 7441-7444, doi: 10.1021/
glycogen phosphorylase b, Int. J. Biol. Macromol., 203,
jacs.8b03903.
406-416, doi: 10.1016/j.ijbiomac.2022.01.106.
51.
Roman, S. G., Chebotareva, N. A., Eronina, T. B.,
40.
Eronina, T. B., Mikhaylova, V. V., Chebotareva, N. A.,
Kleymenov, S. Y., Makeeva, V. F., et al. (2011) Does the
Tugaeva, K. V., and Kurganov, B. I. (2022) Effect
crowded cell-like environment reduce the chaperone-
of betaine and arginine on interaction of alphaB-
like activity of alpha-crystallin? Biochemistry, 50,
crystallin with glycogen phosphorylase b, Int. J. Mol.
10607-10623, doi: 10.1021/bi201030y.
Sci., 23, 3816, doi: 10.3390/ijms23073816.
52.
Su, Z., Mahmoudinobar, F., and Dias C. L.
41.
Shaltiel, S., Hedrick, J. L., and Fischer, E. H. (1966)
(2017) Effects of trimethylamine-N-oxide on the
On the role of pyridoxal 5′-phosphate in phosphorylase.
conformation of peptides and its implications for
II. Resolution of rabbit muscle phosphorylase b,
proteins, Phys. Rev. Lett., 119, 108102, doi: 10.1103/
Biochemistry, 5, 2108-2116, doi: 10.1021/bi00870a044.
PhysRevLett.119.108102.
42.
Mikhaylova, V. V., Eronina, T. B., Chebotareva, N. A.,
53.
Mukherjee, M., and Mondal, J. (2020), Unifying
Shubin, V. V., Kalacheva, D. I., and Kurganov, B. I.
the contrasting mechanisms of protein-stabilizing
(2020) Effect of arginine on chaperone-like activity of
osmolytes, J. Phys. Chem. B.,
124,
6565-6574,
HspB6 and monomeric 14-3-3ζ, Int. J. Mol. Sci., 21,
doi: 10.1021/acs.jpcb.0c04757.
2039, doi: 10.3390/ijms21062039.
54.
Felitsky, D. J., Cannon, J. G., Capp, M. W.,
43.
Khanova, H. A., Markossian, K. A., Kurganov, B.
Hong, J., Van Wynsberghe, A. W., et al.
(2004)
I., Samoilov, A. M., Kleimenov, S. Y., et al. (2005)
The exclusion of glycine betaine from anionic
Mechanism of chaperone-like activity. Suppression
biopolymer surface: why glycine betaine is an
of thermal aggregation of betaL-crystallin by
effective osmoprotectant but also a compatible
alpha-crystallin, Biochemistry,
44,
15480-15487,
solute, Biochemistry, 43, 14732-14743, doi: 10.1021/
doi: 10.1021/bi051175u.
bi049115w.
БИОХИМИЯ том 88 вып. 1 2023
96
МИХАЙЛОВА и др.
EFFECT OF CHEMICAL CHAPERONES ON PROCESSES OF PROTEIN
AGGREGATION PROCEEDING IN DIFFERENT KINETIC REGIMES
V. V. Mikhaylova*, T. B. Eronina, N. A. Chebotareva, and
B. I. Kurganov
Bach Institute of Biochemistry, Federal Research Centre “Fundamentals of Biotechnology”
of the Russian Academy of Sciences, 119071 Moscow, Russia; e-mail: mikhaylova.inbi@inbox.ru
The formation and accumulation of protein aggregates adversely affect intracellular processes in a living cell
and are a negative factor in the production and storage of protein preparations. Chemical chaperones can
prevent protein aggregation, but this property is not universal and depends on the structure of the target
protein and the kinetics of its aggregation. In this work, we studied the effect of betaine (Bet) and lysine
(Lys) on test systems based on thermal aggregation of muscle glycogen phosphorylase b (Phb) at 48°C,
UV-irradiated Phb (UV-Phb) at 37°C and apo-form of Phb (apo-Phb) at 37°C and characterized by the order
of aggregation with respect to the protein (n) equal to 0.5, 1 or 2, respectively. Dynamic light scattering,
differential scanning calorimetry, and analytical ultracentrifugation have shown that Bet protects Phb and
apo-Phb from aggregation, but accelerates the aggregation of UV-Phb. At the same time, Lys prevents
UV-Phb and apo-Phb aggregation, but increases the rate of Phb aggregate formation. The mechanisms of
chemical chaperone action on the tertiary and quaternary structures and the kinetics of thermal aggregation
of the target proteins are discussed. Comparison of the effect of chemical chaperones on test systems
with different kinetic regimes of aggregation provides more complete information about the mechanism
of their action.
Keywords: aggregation, kinetic regime, chemical chaperone, glycogen phosphorylase b
БИОХИМИЯ том 88 вып. 1 2023