БИОХИМИЯ, 2023, том 88, вып. 10, с. 1717 - 1730
УДК 577.355;577.352.5;57.088
Л.А. ДРАЧЕВ И ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
Обзор
© 2023 В.В. Птушенко, А.Ю. Семенов*
НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119992 Москва, Россия; электронная почта: semenov@belozersky.msu.ru
Поступила в редакцию 23.06.2023
После доработки 14.07.2023
Принята к публикации 17.07.2023
В работах в области биоэнергетики важное методическое место принадлежит прямому электро-
метрическому методу. Принцип этого метода заключается в измерении трансмембранной разно-
сти электрических потенциалов, создаваемой между двумя отсеками ячейки белками - генера-
торами электрического (электрохимического) потенциала, ассоциированными с разделяющей
отсеки искусственной липидной мембраной. Само существование таких белков было одним из
следствий хемиосмотической концепции Питера Митчелла; обнаружение белков - генераторов
электрического тока - и исследование их работы послужило одним из аргументов для признания
справедливости этой концепции и способствовало в итоге присуждению Митчеллу заслуженной
Нобелевской премии. Одним из главных создателей прямого электрометрического метода был
Л.А. Драчев (1926-2022). С его участием были выполнены ключевые работы по электрогенезу мем-
бранных белков фотосинтетических и дыхательных электрон-транспортных цепей: бактеориоро-
допсина, зрительного родопсина, фотосинтетических бактериальных реакционных центров, цито-
хромоксидазы и др.
КЛЮЧЕВЫЕ СЛОВА: хемиосмотическая концепция Митчелла, трансмембранная разность электрических
потенциалов (Δψ), методы измерения мембранного потенциала, белки-генераторы Δψ, протеолипосомы,
хроматофоры, бактериородопсин, фотосистема 1.
DOI: 10.31857/S0320972523100019, EDN: OSIXRA
ВВЕДЕНИЕ
биофизика Ефима Арсентьевича Либермана.
Е.А. Либерман, за несколько лет до этого раз-
Лель Александрович Драчев пришел на
работавший метод синтетических проникаю-
работу в Межфакультетскую научно-исследо-
щих ионов для измерения мембранного потен-
вательскую лабораторию молекулярной био-
циала, в это время тесно сотрудничал с только
логии и биоорганической химии (далее для
что назначенным директором Межфакультет-
краткости будем называть ее просто Меж-
ской лаборатории Владимиром Петровичем
факультетской лабораторией; сейчас - НИИ
Скулачевым и его сотрудниками.
физико-химической биологии имени А.Н. Бе-
лозерского, НИИФХБ) МГУ в 1973 г. на долж-
ность заведующего вновь образованным от-
ГИПОТЕЗА МИТЧЕЛЛА И ПОИСК
делом новых физических методов. Ставка
АДЕКВАТНЫХ МЕТОДОВ ИССЛЕДОВАНИЯ
была предоставлена ему незадолго до этого
назначенным ректором МГУ и однокурсником
Возникновение и развитие прямого элек-
Л.А. Драчева по физическому факультету МГУ
трометрического метода связано с появлением
Ремом Викторовичем Хохловым при посредни-
представлений о трансмембранной разности
честве еще одного однокурсника и известного электрических потенциалов (Δψ), возникающей
Принятые сокращения: БР - бактериородопсин; ИЛМ - искусственная липидная мембрана; РЦ - бактериальный
реакционный центр; ФС 1 и ФС 2 - фотосистемы 1 и 2; Δψ - трансмембранная разность электрических потенциалов;
~
H+ - трансмембранная разность электрохимических потенциалов ионов водорода.
* Адресат для корреспонденции.
1717
1718
ПТУШЕНКО, СЕМЕНОВ
на внутриклеточных, так называемых сопряга-
измерения электрического потенциала в све-
ющих, мембранах митоходрий и хлоропластов,
товом градиенте [9, 10]. В этом методе исполь-
а также на внутренних мембранах бактерий.
зовались макроскопические изменения Δψ
Эти представления вытекали из выдвинутой
(и, следовательно, макроэлектродная техника)
будущим нобелевским лауреатом П. Митчел-
в оптически плотной суспензии тилакоидов
лом хемиосмотической концепции сопря-
хлоропластов, возникающие благодаря сум-
жения дыхательного и фотосинтетического
мированию дипольных моментов отдельных
переноса электронов и фосфорилирования,
везикул. Чтобы не возвращаться к обсуждению
рассматривавшей трансмембранную разность
этих методов, которые впоследствии широко
электрохимических потенциалов ионов водо-
использовались и принесли много ценных
~
H+) в качестве промежуточной формы
данных о протекании световых реакций фото-
энергии при окислительном и фотосинтети-
синтеза, сразу скажем об их ограничениях,
ческом фосфорилировании. Реальное суще-
которые будут важны в контексте дальней-
~
H+ на сопрягающих мембранах
шего изложения. Метод регистрации транс-
оказалось одним из экспериментально прове-
мембранного потенциала, основанный на
ряемых следствий концепции Митчелла, и на
измерении электрохромного сдвига фотосин-
его доказательство были направлены усилия
тетических пигментов (преимущественно, ка-
исследователей, которые одними из первых
ротиноидов), широко применяется при изуче-
приняли хемиосмотическую гипотезу - групп
нии хлоропластов растений и хроматофоров
В.П. Скулачева и Е.А. Либермана. Заметим,
пурпурных бактерий, но оказался неэффек-
что, как стало ясно много позже, Δψ не всегда
тивным для цианобактерий и изолированных
~
H+; так,
пигмент-белковых комплексов в модельных
в хлоропластах FΔψ (где F - число Фарадея)
системах. Кроме того, этот метод обеспечи-
значительно ниже, чем концентрационное
вал относительно низкое отношение сигнала к
~
H+, - RTΔpH [1, 2]. В последующие
шуму, что было в значительной мере преодоле-
годы также была открыта «натриевая энер-
но лишь полтора десятилетия спустя в работах
гетика», в которой роль мембранной формы
Joliot и Joliot [11].
энергии играет трансмембранный электро-
Методы, основанные на микроэлектродной
химический потенциал ионов натрия, что
технике, позволили получить важную инфор-
позволило обобщить представления, сформу-
мацию о светозависимых токах, возникающих
лированные Митчеллом [3]. Здесь мы также
на мембранах хлоропластов, но их не удалось
опускаем обсуждение дискуссии между Мит-
расширить на более мелкие объекты (к кото-
челлом и Р. Вильямсом о роли протонов в
рым относились протеолипосомы и хромато-
энергизации мембран, которая подробно опи-
форы пурпурных бактерий). Неизбежно высо-
сана в литературе (см. например, статью Weber
кое активное сопротивление микроэлектродов
и Prebble [4]).
также приводило к ограничениям временного
Ключевым для адекватного измере-
разрешения метода (порядка 1 мс). С помощью
ния Δψ был выбор метода. Характерно, что в
метода светового градиента оказалось возмож-
это время почти одновременно начинается
ным регистрировать кинетику образования
разработка самых разнообразных методов
мембранного потенциала во временном диа-
измерения трансмембранного потенциала -
пазоне от 20 пс до 50 нс, однако регистрация
по-видимому, именно дискуссии вокруг гипо-
более медленных процессов была ограничена
тезы Митчелла породили всплеск активности
диссипацией образующегося градиента элек-
исследователей именно в этом направлении.
трического потенциала за счет ионной про-
В 1968 г. Junge и Witt [5] используют электро-
водимости буферного раствора, в котором сус-
хромный сдвиг в спектре поглощения хлоро-
пендированы мембранные везикулы.
филла b (хотя они его еще так не называют)
Дальнейшее развитие метода измерения в
для изучения фотоиндуцированной генера-
световом градиенте, связанное с использова-
ции трансмембранного потенциала и ионного
нием многослойных электрически ориентиро-
транспорта при фотосинтезе в изолированных
ванных фрагментов белково-липидных мем-
хлоропластах шпината. Чуть позже Булычев
бран последовало лишь полтора десятилетия
и соавт. [6-8] разработали микроэлектродный
спустя [12]. Переход к гелям и снижение ион-
метод измерения Δψ, который был применен
ной проводимости позволили поднять верх-
при исследованиях гигантских хлоропластов
нюю границу временно го окна измерений [13].
(размером до 15-25 мкм) высшего растения
Заметим, что описанный ниже метод, разра-
Peperomia metallica, как изолированных, так и
ботанный Е.А. Либерманом и В.П. Скулаче-
in vivo. Еще чуть позже был предложен метод
вым, равно как и выросший из него прямой
БИОХИМИЯ том 88 вып. 10 2023
ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
1719
СИНТЕЗ ДВУХ ПОДХОДОВ
В 1971 г. Oesterhelt и Stoeckenius [16] опуб-
ликовали в журнале Nature New Biology статью,
описывающую родопсиноподобный белок из
пурпурных мембран галобактерии Halobac-
terium halobium. По инициативе В.П. Скулачева
штамм H. halobium был привезен в Москву, из
его пурпурных мембран был выделен белок
Рис. 1. Липофильные ионы тетрафенилбор (ТФБ-) и те-
бактериородопсин (БР), способный к свето-
трафенилфосфоний (ТФФ+)
зависимому трансмембранному переносу про-
тонов. Исследование этого мембранного белка
электрометрический метод, в своих первона-
в отделе биоэнергетики, а затем в отделе новых
чальных вариантах также были ограничены по
физических методов Межфакультетской лабо-
многим из перечисленных параметров.
ратории МГУ стало первым этапом на пути раз-
Е.А. Либерман и В.П. Скулачев для реше-
работки прямого электрометрического метода.
ния этой задачи применили остроумную идею,
Летом 1973 г. в Межфакультетской лабора-
основанную на использовании синтетических
тории появился Л.А. Драчев, перешедший из
проникающих ионов. «Проникающие (через
Всесоюзного института научно-технической
мембрану) ионы» представлялись в то время
информации (ВИНИТИ). Вместе с пришед-
как оксюморон, поскольку наличие у частицы
шим на диплом биохимиком А.Д. Кауленом он
заряда, очевидно, делало ее гидрофильной и
проводил непосредственные измерения элек-
создавало энергетический барьер для погруже-
трического потенциала, генерируемого между
ния в гидрофобную среду мембраны. Однако,
двумя отсеками тефлоновой ячейки бакте-
по предположению Е.А. Либермана, этот барь-
риородопсином, встроенным в разделяющую
ер мог бы быть существенно снижен, если бы
ячейки плоскую искусственную липидную
заряд был распределен по большому объему
мембрану (ИЛМ). БР встраивался в мембрану
частицы или окружен относительно гидрофоб-
непосредственно из раствора фосфолипидов
ными молекулярными группами. Поиск таких
в н-декане, в который его добавляли в солю-
«липофильных ионов» среди запасов коллег-
билизированном виде в присутствии детерген-
химиков увенчался успехом и подтвердил пер-
та [17]. В отличие от косвенного метода измере-
воначальную идею: некоторые из найденных
ний с использованием проникающих ионов,
соединений, в частности, анионы фенилди-
этот подход позволял непосредственно изме-
карбаундекаборана (ФКБ-) и тетрафенилбора
рять генерацию Δψ белком. Однако этот метод
(ТФБ-), а также катион тетрафенилфосфония
характеризовался значительным разбросом ве-
(ТФФ+) оказались способны достаточно легко
личин и даже направлений фотоиндуцирован-
проникать через мембрану (рис. 1). При этом
ного сигнала от эксперимента к эксперименту.
их распределение по разные стороны мембра-
Позже стало ясно, что этот разброс связан со
ны определялось, в соответствии с уравнением
случайной ориентацией БР в мембране: при-
~
H+:
мерно одинаковое количество белков встраи-
положительно заряженные ионы накапли-
валось в мембрану с «плюс»- и «минус»-ори-
вались внутри митохондрий, на внутренней
ентацией, и даже небольшой разброс в их
мембране которых в ходе окислительного
соотношении приводил к значительным из-
фосфорилирования образовывалась Δψ (со
менениям разностного сигнала и вариациям
знаком минус внутри в случае митохондрий и
знака Δψ.
знаком плюс - в случае субмитохондриальных
Осенью 1973 г. в эти работы включился
частиц).
один из авторов этой статьи (АЮС), только что
В результате концентрация этих ионов
окончивший кафедру молекулярной биологии
снаружи, в суспензии, убывала, что, в свою
биологического факультета МГУ. Предметом
очередь, уже можно было зарегистрировать
изучения были протеолипосомы, содержа-
потенциометрически [14]. С помощью этого
щие БР, незадолго до того введенные в прак-
подхода впервые было показано, что в про-
тику биоэнергетиками Kagawa и Racker [18].
цессе дыхания на мембранах митохондрий
Белок, встроенный в протеолипосомы, обра-
и субмитохондриальных частиц происходит
зовывал трансмембранный потенциал в ответ
образование Δψ, подавляемое в присутствии
на освещение
[19]. Измерительная система
ингибиторов дыхания или разобщителей окис-
представляла собой ячейку, состоящую из двух
ления и фосфорилирования [15].
отсеков, заполненных раствором электролита
БИОХИМИЯ том 88 вып. 10 2023
1720
ПТУШЕНКО, СЕМЕНОВ
«конкурирующий» с ним трансмембранный
градиент pH. Именно с этой целью соли ам-
мония были добавлены в среду в значитель-
ной концентрации (0,1 М) в качестве прони-
кающего внутрь протеолипосом pH-буфера.
В этих условиях при повторном образовании
ИЛМ фотоэлектрический сигнал возрастал во
времени, что трудно было объяснить в рамках
представлений о механизме действия проника-
ющих ионов. То, что эффект наблюдался при
высокой концентрации соли, вызвало подо-
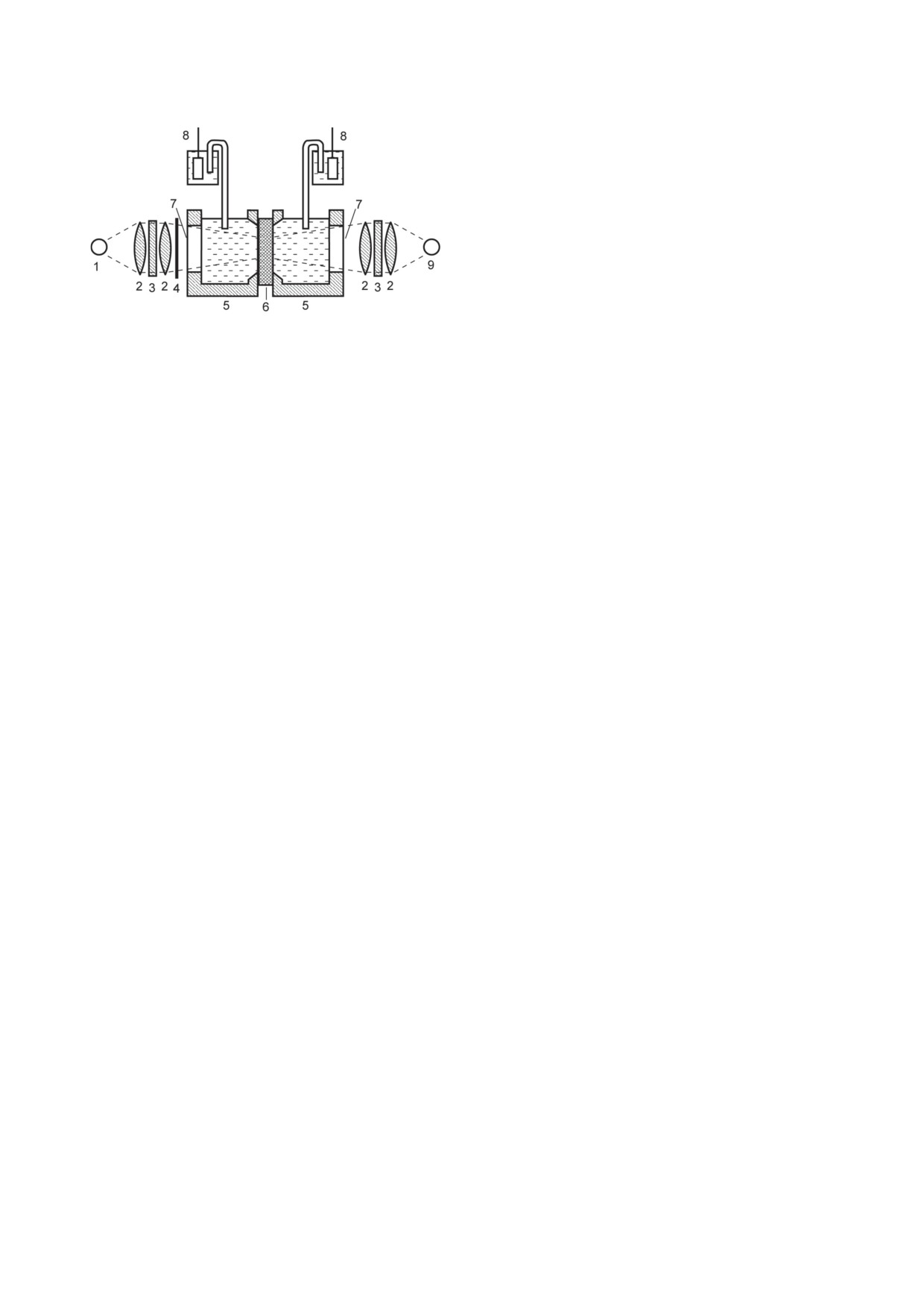
Рис. 2. Схема измерительной системы. 1 - Источник
постоянного освещения (галогеновая лампа), 2 - лин-
зрение, что он может быть связан с изменени-
за, 3 - светофильтр, 4 - затвор, 5 - тефлоновая кюве-
ем поверхностных зарядов. Замена однозаряд-
та, 6 - искусственная липидная мембрана на основе
ных ионов в фоновом электролите на меньшую
мембранного пористого фильтра, 7 - стеклянное окно,
концентрацию (10-20 мМ) двухзарядных (Ca2+
8 - хлорсеребряный электрод, 9 - импульсный лазер
и Mg2+) привела к тому, что возрастание сиг-
нала стало происходить гораздо быстрее. Это
и разделенных плоской ИЛМ, нанесенной на
указывало на вероятную роль экранирования
отверстие в разделяющей их перегородке. В оба
фиксированных отрицательных зарядов фос-
отсека ячейки были погружены хлорсеребря-
фолипидов катионами фонового электролита,
ные электроды, соединенные с электрометри-
в котором двухзарядные катионы значительно
ческим вольтметром, и в ходе экспериментов
эффективнее, чем однозарядные. Экраниро-
измерялось изменение разности потенциалов
вание поверхностных зарядов мембран про-
между отсеками ячейки (рис. 2). В обе ячейки
теолипосом и ИЛМ должно было ускорить их
добавляли проникающие анионы (ФКБ-), а в
агрегацию и адсорбцию на ИЛМ, разделявшей
одну из них - также БР-протеолипосомы. При
отсеки ячейки. Это означало, что возраста-
освещении этой ячейки ионы ФКБ- поглоща-
ние светоиндуцированной Δψ могло проис-
лись протеолипосомами вследствие генерации
ходить за счет БР в мембранах протеолипосом,
трансмембранного потенциала, и в резуль-
ассоциированных с ИЛМ, за счет слипания с
тате возникала разность потенциалов между
нею протеолипосом. Чтобы убедиться в этом,
отсеками ячейки - небольшая по амплитуде
Е.А. Либерман предложил провести такой же
(~ 0,01 В), но вполне достаточная для надеж-
эксперимент в отсутствие проникающих ионов.
ного измерения.
И действительно, даже без добавления в сре-
Как известно из истории науки, открытию
ду ФКБ-, при инкубации суспензии протеоли-
каких-либо новых явлений часто помогает слу-
посом в течение 30 минут в присутствии 20 мМ
чайность. Беккерель хранил соли урана вместе
CaCl2 наблюдалось постепенное увеличение
с фотопластинками, Пастер слишком долго
амплитуды фотоиндуцированной Δψ вплоть
хранил кристаллы винной кислоты, Флеминг
до ~250 мВ.
не уберег чашки Петри от грибного зараже-
В отличие от метода смешивания сус-
ния. В данном случае в процессе длительного
пензии БР в детергенте с раствором фосфо-
эксперимента ИЛМ оказалась недостаточно
липидов в н-декане для образования ИЛМ,
стабильной и в результате электрических или
первоначально используемого Л.А. Драчевым
механических флуктуаций периодически те-
и А.Д. Кауленом, при встраивании БР в мем-
ряла сопротивление. В результате фотоэлек-
браны липосом в этих экспериментах наблюда-
трический сигнал исчезал, и приходилось
лась высокая степень асимметрии - более 95%
впрыскивать каплю раствора фосфолипидов
молекул белка оказывались ориентированны-
в отверстие в тефлоновой ячейке для повтор-
ми «плюсом» внутрь (это было доказано позже
ного образования ИЛМ. Еще одним обстоя-
с использованием ионов лантана, ингибирую-
тельством, способствовавшим обнаружению
щих работу БР при связывании во «входном»
этого ключевого для последующего развития
протонном канале на его протон-донорной
метода эффекта, была высокая концентрация
стороне). В результате светозависимое обра-
ионов аммония в среде. Поскольку электро-
зование Δψ всегда имело один и тот же знак и
химический потенциал на мембране липосом
относительно небольшой разброс величины,
мог содержать как электрическую, так и кон-
определяемый преимущественно точностью,
центрационную (pH-зависимую) компоненты,
с которой было возможно задавать суммарный
то чтобы максимально увеличить измеряемый
внутренний объем протеолипосом. Очевидно,
электрический сигнал, было решено снизить
что такая асимметрия встраивания белка была
БИОХИМИЯ том 88 вып. 10 2023
ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
1721
обусловлена, в частности, асимметрией мем-
При этом гипотетически возможны разные
браны, имеющей ненулевую кривизну в случае
варианты распределения белков: они могли
замкнутой сферической везикулы. В случае
бы переходить из мембран протеолипосом в
же плоской ИЛМ кривизна, которая могла бы
ИЛМ либо же оставаться в пределах мембран
обеспечить асимметрию встраивания, очевид-
протеолипосом. Подобный же вопрос впо-
но, отсутствовала.
следствии возник при работе с природными
Таким образом, как у метода синтети-
замкнутыми везикулами
- хроматофорами
ческих проникающих ионов, так и у метода
фотосинтезирующих бактерий для распреде-
смешивания БР с раствором фосфолипидов
ленных в мембранах хроматофоров молекул
имелись свои достоинства и недостатки. Обна-
пула убихинона-10. Однако если гидрофоб-
ружение адсорбции протеолипосом на поверх-
ный убихинон свободно перераспределялся
ности ИЛМ позволило «гибридизировать» эти
между мембранами хроматофоров и ИЛМ, то
два метода, объединив их достоинства: высо-
для молекул белка такой обмен не происходил.
кую степень асимметрии встраивания белка в
Доказательство того, что внутри везикул со-
мембраны протеолипосом (а, следовательно, и
храняется водная фаза (получившая в литера-
большую величину сигнала), характерную для
туре жаргонное название «третья вода»), а все
косвенного метода синтетических проникаю-
белки локализованы на внешних поверхностях
щих ионов, и непосредственное измерение
пузырьков, было основано на измерениях по-
генерируемого белком потенциала, обеспечи-
тенциалов, генерируемых в присутствии раз-
ваемое прямым электрометрическим методом.
общителей-протонофоров различного типа.
Дальнейшее развитие этого гибридного метода
Так, грамицидин A, образующий каналы в
было связано с работами Л.А. Драчева и его
мембране, существенно снижал потенциал, ге-
сотрудников - А.Д. Каулена и А.Ю. Семенова.
нерируемый БР на свету, однако практически
В литературе за ним закрепилось название
не влиял на общее электрическое сопротив-
«прямого электрометрического метода» или
ление мембраны. В то же время протонофоры
«метода Драчева».
«челночного типа» (например, карбонилциа-
нид-м-хлорфенилгидразон) снижали и свето-
зависимый потенциал, и сопротивление мем-
ДОКАЗАТЕЛЬСТВО
браны [20]. Такое различие, очевидно, могло
ЭКВИВАЛЕНТНОЙ СХЕМЫ
возникать только из-за наличия в системе двух
И ПОДБОР ИСКУССТВЕННОЙ
типов мембран. Грамицидин создавал каналы
МЕМБРАНЫ
в той же бислойной мембране, в которой были
локализованы генераторы Δμ+ (БР). Однако в
«Гибридизация» двух методических под-
относительно толстой плоской ИЛМ, разделяю-
ходов обеспечивала новые эксперименталь-
щей ячейки и определяющей сопротивление
ные возможности, однако одновременно ста-
измеряемой системы, грамицидин не мог об-
вила новые вопросы. Выше мы говорили об
разовать сквозные каналы, в то время как для
ассоциации протеолипосом с поверхностью
«челночных» протонофоров она оставалась
плоской ИЛМ. Однако эквивалентна ли та-
проницаемой (рис. 3, б).
кая белково-липидная система той, которая
Как в экспериментах Драчева и Каулена
образуется при непосредственном встраива-
с непосредственным встраиванием молекул
нии белков в присутствии детергента в ИЛМ
белка в плоскую мембрану, так и в опытах
(кроме различий в асимметрии встраивания)?
Семенова на протеолипосомах использовали
От этого зависела правильная количественная
толстые (толщиной порядка 100 мкм) фосфо-
интерпретация результатов измерений. Экви-
липидные мембраны, разделяющие два отсека
валентность могла бы обеспечиваться, если
тефлоновой экспериментальной ячейки. Не-
бы мембрана протеолипосомы, адсорбирую-
смотря на то что белок не мог пронизать такую
щейся на плоскую ИЛМ, претерпевала раз-
мембрану насквозь и перенести через нее про-
рыв и фосфолипиды мембран протеолипосом
тон, тем не менее при встраивании в нее он
«растекались» по ИЛМ, а белки оказывались
превращал ее в аналог H+-селективного элек-
бы встроены в ИЛМ. Однако возможен и аль-
трода, что позволяло регистрировать электри-
тернативный сценарий, при котором мембра-
ческий сигнал. Однако такая мембрана обла-
ны протеолипосом не претерпевают тополо-
дала одним существенным недостатком: при
гических изменений и остаются замкнутыми
большом липидном объеме мембрана обладала
везикулами, ассоциированными с поверхно-
низкой электрической емкостью, что при-
стью ИЛМ. В этом случае внутри протеолипо-
водило к значительному увеличению време-
сом сохранялась бы водная фаза (рис. 3, а).
ни электрического отклика системы. В итоге
БИОХИМИЯ том 88 вып. 10 2023
1722
ПТУШЕНКО, СЕМЕНОВ
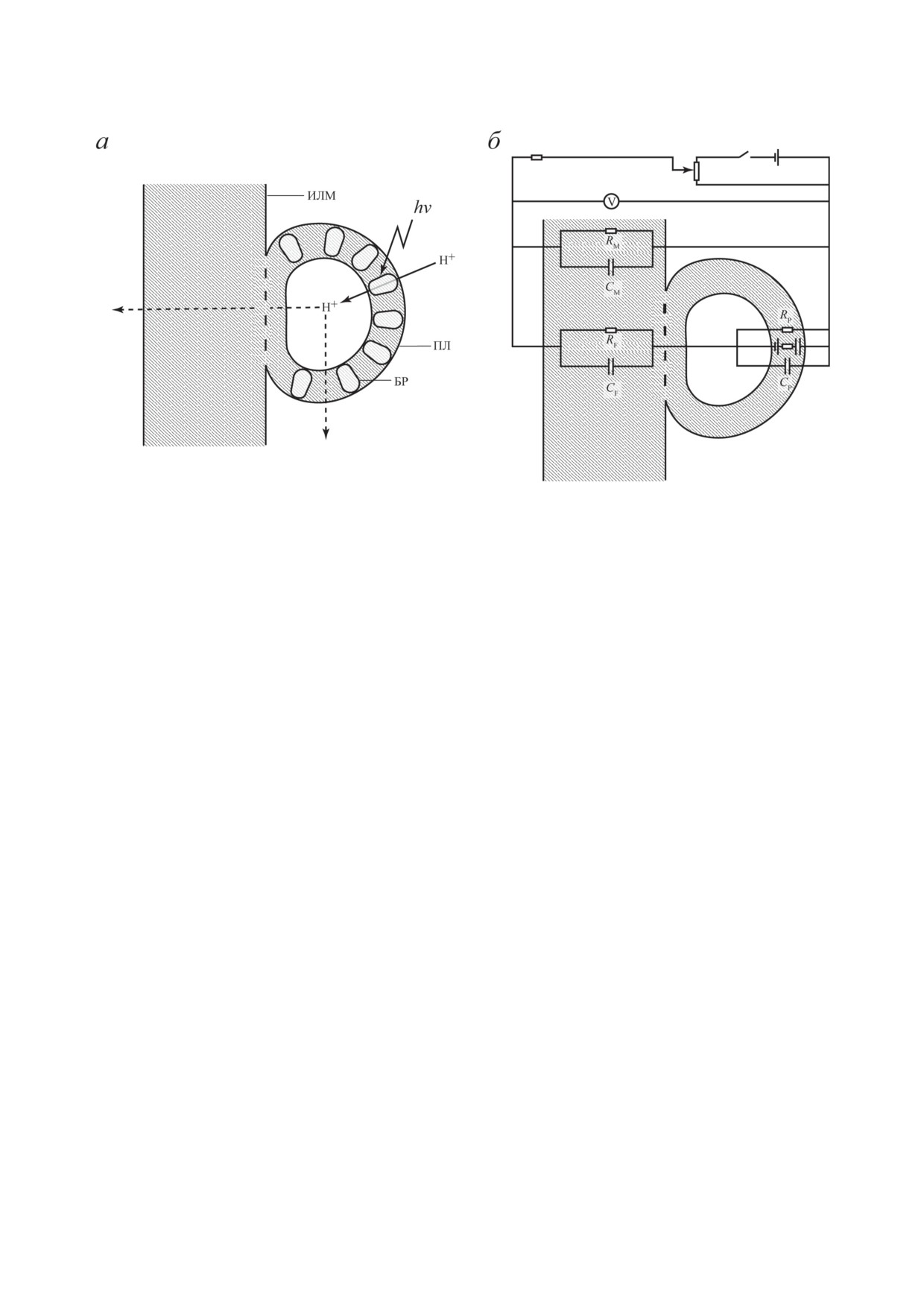
Рис. 3. Схема взаимодействия протеолипосомы, содержащей бактериородопсин, с плоской фосфолипидной ИЛМ (а)
и эквивалентная электрическая схема (б). ПЛ - протеолипосома, БР - молекула бактериородопсина. Ориентация
молекул БР в мембране ПЛ асимметрична (~95%-ное преобладание ориентации, при которой протоны закачиваются
внутрь ПЛ). Экспериментальные данные показывают, что в области слияния мембран БР практически отсутствует.
V - электрометрический вольтметр с высоким входным сопротивлением; CP, RP, СM, RM, CF, RF - значения электриче-
ской емкости (C) и сопротивления (R) мембраны ПЛ, ИЛМ и области слияния мембран соответственно. Изображение
дано не в масштабе (толщина ИЛМ превосходит толщину мембраны ПЛ на несколько порядков)
минимальное характерное время процесса
браны, пробовали различные мембранные
генерации Δψ, которое могло быть получено
пористые фильтры, которые пропитывали
в такой системе, составляло около 10 мс. Это
раствором фосфолипидов. Несмотря на то
было значительно больше, чем характерные
что толщина самих фильтров была достаточно
времена основных процессов переноса заряда
большой (как и для толстой фосфолипидной
в БР, и для экспериментов по изучению кине-
мембраны, порядка
0,1 мм), была надежда,
тики этого переноса требовалась значительно
что фосфолипидные пленки, которые затянут
более тонкая мембрана. Аналог природной -
поры в материале фильтра, окажутся тоньше.
бислойной фосфолипидной - мембраны, к
При работе с фильтрами стало ясно, что не
сожалению, использовать не удавалось: несмо-
только материал фильтра и размер пор суще-
тря на многие попытки получить бислойную
ственны для измерительной системы, но и
мембрану (такая мембрана получила название
исследуемые объекты. Так, для исследования
«черной мембраны» вследствие пониженно-
протеолипосом с БР практически все изучен-
го оптического пропускания, возникающего
ные виды фильтров обеспечивали эффектив-
из-за интерференции отраженного от двух по-
ные измерения. В то же время при работе с
верхностей света, хорошо заметного под бино-
хроматофорами свойства фильтров начинали
куляром), она оставалась очень нестабильной.
сказываться на результатах. Использование
В «черную мембрану» не удавалось встроить
фильтров из химически инертного материала
белки - при попытках добавить белок в детер-
(флуоропор, тефлон) позволяло получить са-
генте в электролит, омывающий мембрану,
мые большие электрические ответы, незави-
мембрана неизменно лопалась. Пришлось от-
симо от диаметра пор, сравнимые с величи-
казаться от попытки использования плоских
ной потенциала на фосфолипидной мембране
бислойных мембран в электрометрическом
(до 0,25 В; [21, 22]). При работе с хроматофо-
методе и искать другие варианты.
рами (но не протеолипосомами) и фильтрами
Поиск других вариантов плоской ИЛМ
на основе целлюлозы электрический отклик
оказался весьма длительным и непростым.
системы оказывался меньшим, причем для
Было очевидно, что для повышения прочно-
смеси ацетата и нитрата целлюлозы ниже, чем
сти мембраны необходимо как-то «армиро-
для чистого нитрата. В случае присутствия в
вать» ее. В качестве каркаса, составляющего
материале фильтра ацетата целлюлозы начи-
жесткую основу такой армированной мем-
нал играть роль и размер пор - более крупные
БИОХИМИЯ том 88 вып. 10 2023
ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
1723
поры обеспечивали более высокие значения
В 1979-1980 гг. аналогичные измерения были
измеряемых потенциалов [21]. Однако при ис-
проведены на различных мембранных пори-
пользовании любых фильтров оставалась та же
стых фильтрах, пропитанных раствором фос-
непреодолимая временна я граница разрешаю-
фолипидов в н-декане. Типичный фотоэлек-
щей способности - порядка 10 мс.
трический ответ на включение и выключение
Кроме фильтров, имевшихся тогда в про-
освещения в системе мембранный фильтр - БР
даже, для получения подходящих «каркасов»
протеолипосомы приведен на рис. 4. В этом
попытались использовать даже существовав-
случае при включении света наблюдалось бы-
шие на тот момент «высокие технологии».
строе образование Δψ со знаком плюс внут-
Вспоминается визит Л.А. Драчева и его моло-
ри протеолипосом, достигавшее амплитуды
дых коллег в Дубну в руководимую Г.Н. Фле-
~200 мВ. Фотоэлектрический сигнал оставался
ровым Лабораторию ядерных реакций Объ-
примерно на таком уровне по крайней мере
единенного института ядерных исследований.
10 минут освещения и полностью спадал при
Для различных технических задач в лабора-
выключении освещения. При хранении си-
тории изготавливали собственные фильтры:
стемы мембранный фильтр - БР протеолипо-
пластинки из различных полимеров помещали
сомы в темноте светозависимый потенциал
под пучок ускорителя, который превращал их
с амплитудой > 150 мВ сохранялся в течение
в «решето». Диаметр и плотность расположе-
72 часов, а затем спадал параллельно со спа-
ния дыр в этом решете можно было варьиро-
дом сопротивления ИЛМ.
вать за счет тех или иных параметров пучка.
В предыдущем разделе было указано, что
Однако ни один из таких фильтров не подо-
при использовании «толстых» фосфолипид-
шел - фосфолипидная мембрана его не про-
ных ИЛМ и ИЛМ на основе мембранных
питывала, отказываясь садиться на длинные
фильтров наличие малой емкости СM, сопо-
узкие цилиндрические поры.
ставимой с входной емкостью операционного
Последний вариант, найденный Драче-
усилителя (~5 пФ), приводило к искажению
вым и его сотрудниками и оказавшийся наи-
кинетики образования Δψ в ответ на лазер-
лучшим для их исследований - нитроцеллю-
ную вспышку. Поэтому для исследования бы-
лозные коллодиевые пленки. Такие пленки
строй кинетики была применена коллодиевая
активно использовались в качестве подложек
фосфолипидная ИЛМ толщиной ~200 нм, зна-
для электронной микроскопии и потому были
чение СM которой составляло ~5000 пФ. Вре-
достаточно доступны. Пленка, состоящая из
менно е разрешение такой системы составляло
длинных целлюлозных нитей, образующих
0,2 мкс. В этой системе была исследована ин-
небольшое число слоев, имела сравнительно
дуцированная лазерными вспышками кине-
небольшую толщину (~200-300 нм). При про-
тика образования Δψ на протеолипосомах с
питке раствором фосфолипидов она обеспе-
БР и бактериальными реакционными центра-
чивала достаточную устойчивость мембраны
ми (РЦ), а также на хроматофорах из различ-
и одновременно малое время электрического
ных фотосинтезирующих бактерий [28-30].
отклика (порядка 200 нс). Бо льшая часть по-
Как показано на рис. 4, а, лазерная вспыш-
следующих работ лаборатории была выполне-
ка в системе коллодиевая ИЛМ - протеолипо-
на именно на коллодиевых ИЛМ. Поиск этого
сомы со встроенным фотосинтетическими РЦ
ключевого компонента измерительной систе-
из Rhodobacter sphaeroides в отсутствие донора
мы занял почти пять лет.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ,
ПОЛУЧЕННЫЕ С ПОМОЩЬЮ ПРЯМОГО
ЭЛЕКТРОМЕТРИЧЕСКОГО МЕТОДА
С 1974 по 1980 г. в системах: толстая фос-
фолипидная мембрана - замкнутая везикула
(протеолипосомы, содержащие различные мем-
бранные белки или хроматофоры) было про-
демонстрировано образование разности потен-
циалов БР, зрительным родопсином, митохон-
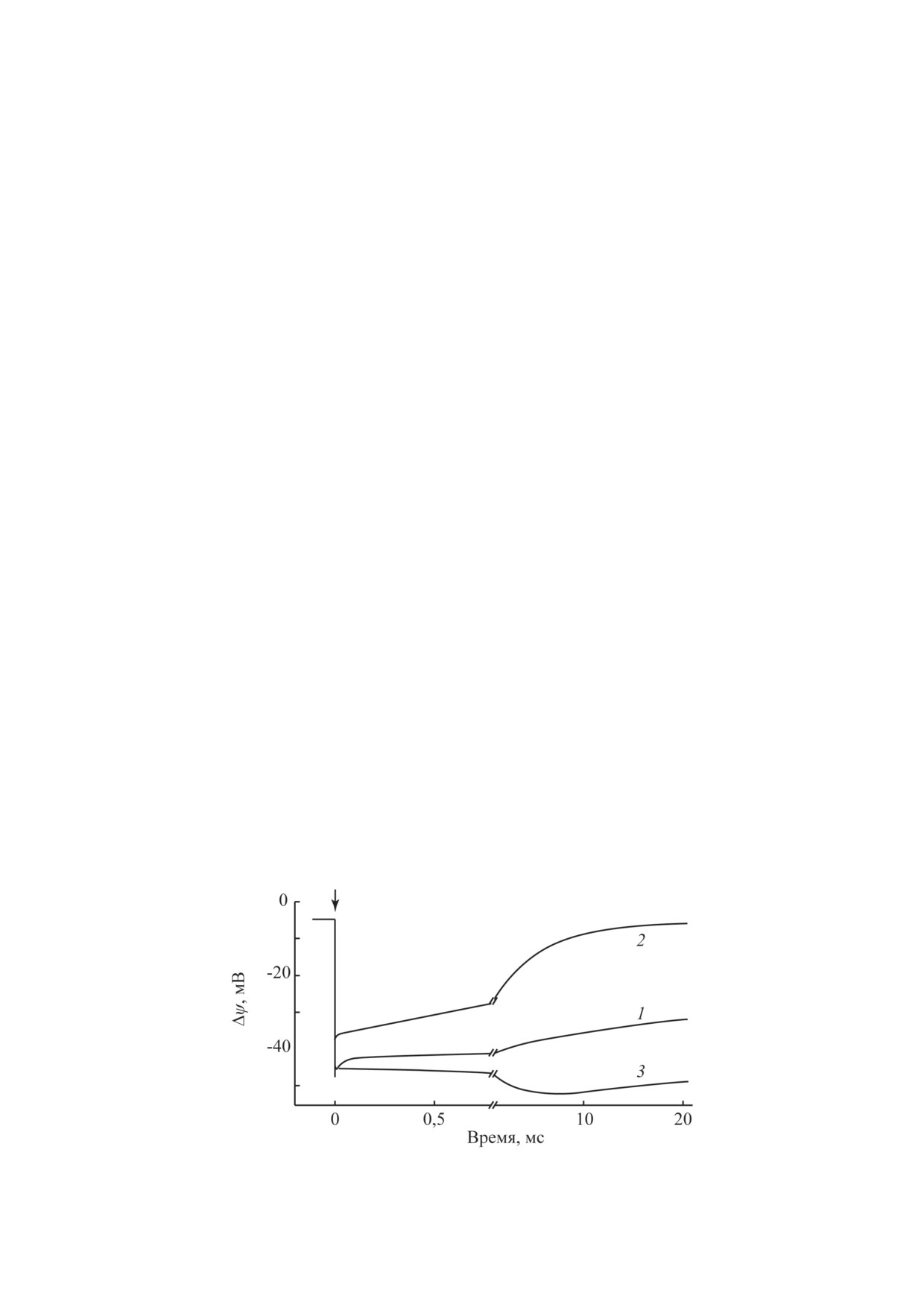
Рис. 4. Фотоэлектрический ответ протеолипосом, содер-
дриальными цитохром с оксидазой, АТРазой
жащих бактериальный фотосинтетический реакционный
и трансгидрогеназой, а также хроматофора-
центр без добавок (а) и в присутствии 2 мМ аскорбата
ми фотосинтезирующих бактерий
[23-27].
и 2 мкМ природного донора электрона цитохрома с (б)
БИОХИМИЯ том 88 вып. 10 2023
1724
ПТУШЕНКО, СЕМЕНОВ
электрона вызывает образование Δψ со зна-
В отсутствие добавок (кривая 1) на этих
ком минус внутри амплитудой
~ 15-20 мВ.
препаратах наблюдается фотоэлектрический
Этот потенциал обусловлен образованием
ответ со знаком минус внутри амплитудой
ион-радикальной пары Р870Q–, образующейся
~50 мВ и кинетикой спада с τ = 100 мс. При
при переносе электрона от первичного доно-
добавлении 100 мМ сильного восстановите-
ра РЦ R. sphaeroides, димера бактериохлоро-
ля - дитионита натрия, амплитуда Δψ несколь-
филла Р870, к связанному в РЦ убихинону QA,
ко снижается, а спад ускоряется до нескольких
выполняющему роль акцептора [31]. При до-
миллисекунд (кривая 2). Этот эффект об-
бавлении 2 мМ аскорбата и 2 мкМ природного
условлен восстановлением дитионитом терми-
донора электрона цитохрома с2 в кинетике на-
нальных 4Fe4S кластеров FA/FB, в результате
растания фотоэлектрического ответа, помимо
чего спад Δψ происходит с предыдущего 4Fe4S
быстрой фазы, наблюдалась дополнительная
кластера FX. В то же время добавление 0,4 М
более медленная компонента с характерным
природного донора электрона для ФС 1
-
временем τ = 250 мкс (рис 4, б). Наблюдаемая
пластоцианина, вызывает появление допол-
фаза нарастания генерации Δψ была обуслов-
нительной электрогенной компоненты с τ =
лена электрогенным восстановлением Р870 от
= 3 мс (кривая 3). Эта компонента обусловле-
цитохрома с2. На препаратах хроматофоров
на электрогенным восстановлением фотоокис-
из R. sphaeroides, Rhodospirillum rubrum, Ecto-
ленного первичного донора электрона ФС 1 -
thiorhodospira shaposhnikovii, Chromatium minutis-
димера хлорофилла Р700 - от пластоцианина.
simum и Blastochloris viridis, помимо электроген-
Одной из важных особенностей прямого
ных реакций, обусловленных восстановле-
электрометрического метода оказалась воз-
нием окисленного первичного донора Р+ от
можность оценивать с его помощью распре-
различных цитохромов типа с, в ответ на чет-
деление диэлектрической проницаемости (ε)
ные вспышки света была обнаружена еще одна
в мембранных гидрофобных белках, содержа-
электрогенная компонента, связанная с прото-
щих редокс-кофакторы. Перемещение заря-
нированием из внешней водной фазы вторич-
да (электрона или протона) внутри белка от
ного хинонного акцептора QB [32]. Кроме того,
одной группы к другой вызывает изменение
на хроматофорах R. sphaeroides были исследо-
разности потенциалов между двумя сторона-
ваны индуцированные лазерными вспышками
ми мембраны. Это изменение зависит как от
электрогенные реакции, обусловленные пере-
расстояния, на которое перемещается заряд в
носом электронов и протонов в цитохромном
мембране (точнее, от нормальной по отноше-
bc1-комплексе [33].
нию к поверхности мембраны компоненты его
Аналогичный подход был применен к ис-
перемещения), так и от значения ε той обла-
следованию электрогенных реакций на про-
сти белка, в которой это перемещение про-
теолипосомах, содержащих комплексы фото-
исходит. В области, где содержится больше
систем (ФС) 1 и 2 из цианобактерий и высших
полярных аминокислотных остатков, и, следо-
растений [34, 35]. На рис. 5 приведены типич-
вательно, выше ε, индуцируемая перемещени-
ные фотоэлектрические ответы протеолипо-
ем заряда разность потенциалов оказывается
сом, содержащих комплексы ФС 1 из циано-
ниже, а в областях с гидрофобными остатками
бактерии Synechocystis sp. PCC 6803.
(низкое значение ε) - выше. С появлением
Рис. 5. Фотоэлектрический ответ протеолипосом, содержащих ФС 1: 1 - без добавок, 2 - в присутствии дитионита
натрия, 3 - в присутствии 10 мМ аскорбата и 0,4 мМ природного восстановителя ФС 1 пластоцианина
БИОХИМИЯ том 88 вып. 10 2023
ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
1725
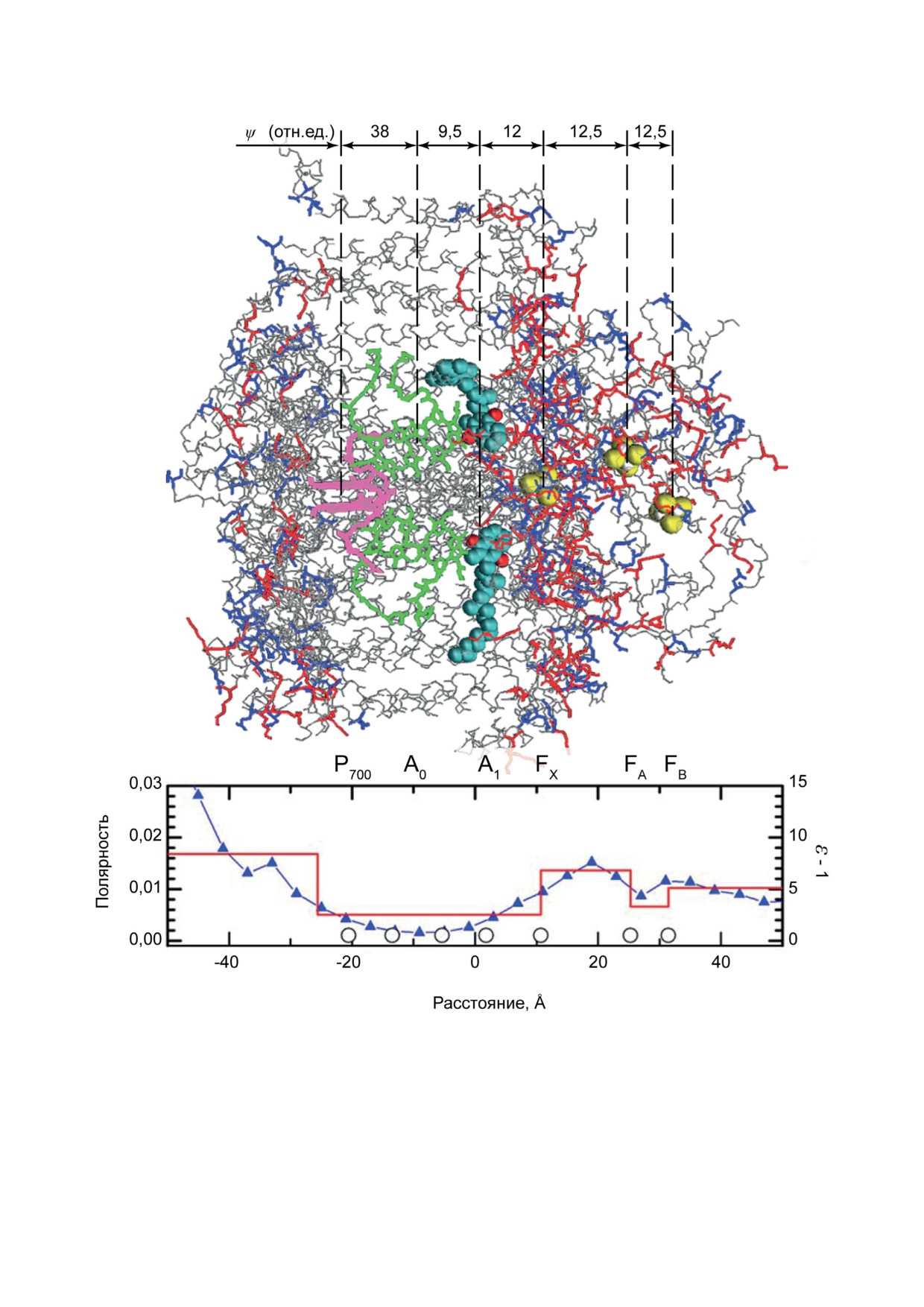
Рис. 6. Трехмерная структура ФС 1 (донорная сторона (экспонированная в люмен) - слева, акцепторная (экспо-
нированная в строму) - справа) и график распределения полярности и диэлектрической проницаемости белкового
комплекса вдоль нормали к плоскости мембраны. Полярность рассчитана как доля атомов, несущих заметный пар-
циальный заряд (N, O, S боковых цепей аминокислотных остатков). Кругами у оси абсцисс обозначены координаты
расположения редокс-кофакторов. Перенос электрона между первичным донором P700 (показан в структуре розовым
цветом) и хинонными акцепторами A1 (показаны бирюзовыми и красными сферами, обозначающими атомы угле-
рода и кислорода соответственно, входящими в состав хинона) может происходить по двум различным ветвям A и B
(на рисунке - верхняя и нижняя). В каждой из ветвей между P700 и A1 расположена пара молекул хлорофилла (показа-
ны зеленым), функционирующая как единый кофактор A0 в силу электронного сопряжения между двумя параллель-
ными друг другу порфириновыми кольцами. В структуре белков ФС 1 показаны только пептидные цепи (серым цве-
том) и боковые цепи анионо- и катионогенных аминокислотных остатков (синий и красный цвета соответственно)
БИОХИМИЯ том 88 вып. 10 2023
1
726
ПТУШЕНКО, СЕМЕНОВ
независимых данных о расстояниях между
изменения свободной энергии кофактора при
кофакторами (на основе рентгеноструктур-
переносе его внутрь белка, которые, следова-
ного анализа) стало возможным извлечь из
тельно, должны быть рассчитаны с исполь-
данных, предоставляемых прямым электро-
зованием разных подходов и учетом свойств
метрическим методом, среднее значение ε
белка через различные диэлектрические кон-
в области белка между двумя кофакторами.
станты [39, 40]. В итоге впервые в рамках
Таким образом, группе Драчева удалось оце-
одного подхода удалось рассчитать редокс-
нить распределение ε в бактериальном фото-
потенциалы всех кофакторов ФС 1, начиная
синтетическом РЦ из R. sphaeroides, в ФС 1
с первичного донора P700/Р700 и заканчивая
из цианобактерий и ФС 2 из высших расте-
железосерными кластерами FX, FA, FB [38].
ний [36, 37]. Разумеется, подобные данные
имеют лишь оценочный характер, поскольку
полярность соседних областей белка также
ЗАКЛЮЧЕНИЕ
сказывается на величине генерируемого по-
тенциала. Однако сопоставление полученных
Одним из следствий хемиосмотической
таким образом данных с распределением по-
концепции Питера Митчелла являлось суще-
лярных и неполярных остатков в белке пока-
ствование класса мембранных белков - гене-
зывает хорошее соответствие между этими
раторов Δψ. С помощью прямого электромет-
характеристиками белка. На рис. 6 приведен
рического метода было продемонстрировано
график распределения вдоль нормали к по-
существование таких белков, что послужило
верхности мембраны диэлектрической про-
одним из доказательств справедливости этой
ницаемости ФС 1, оцененной с помощью пря-
концепции и способствовало в итоге присуж-
мого электрометрического метода [38]. Видно,
дению Митчеллу заслуженной Нобелевской
что характер этого распределения хорошо со-
премии по химии.
ответствует распределению полярных групп в
Прямой электрометрический метод и его
структуре белкового комплекса. Доля атомов,
варианты применялись (и применяются) не
несущих заметный парциальный заряд и об-
только в отделе Драчева, а позже в отделах
условливающих диэлектрический ответ атом-
А.Д. Каулена (АДК) и А.Ю. Семенова (АЮС),
ной подсистемы белка, определенная на ос-
но и в некоторых зарубежных лабораториях.
нове данных рентгеноструктурного анализа о
В частности, этот метод был использован в
трехмерной структуре ФС 1, приведена на том
лаборатории Дж. Фейера (Ла Хойя, США) для
же графике. Сами полярные группы показаны
изучения электрогенных реакций в бактери-
в структуре ФС 1 синим (остатки Asp и Glu)
альных РЦ [41], в лаборатории П. Бжезинского
и красным цветом (Lys, Arg, His). В структуре
в Гетеборге (Швеция) для исследования элек-
также отмечены редокс-кофакторы (первич-
трогенных реакций в ФС 1 [42], в лаборатории
ный донор электрона, P700, первичные и вто-
В. Юнге в Оснабрюке (Германия) для исследо-
ричные акцепторы в обеих ветвях редокс-
вания кинетики генерации Δψ при переходах
кофакторов А и В, A0 и A1, и 4Fe4S акцепто-
между S-состояниями в комплексах ФС 2 [43],
ры FX, FA, FB), а также показаны значения ге-
в лаборатории М. Викстрема в Хельсинки
нерируемого потенциала, измеряемого электро-
(Финляндия) для исследования электрогенных
метрическим методом, при переносе электрона
реакций при функционировании терминаль-
на соответствующем участке.
ных оксидаз митохондрий и бактерий (см. об-
Данные о распределении ε в ФС 1 послу-
зор Wikström и Verkhovsky [44]).
жили одной из основ для построения алго-
Разработка прямого электрометрического
ритма расчета электростатических взаимодей-
метода была оценена как одно из главных (сре-
ствий в белковом комплексе и в конечном счете
ди примерно 40) экспериментальных иссле-
определения окислительно-восстановитель-
дований ХХ века в областях окислительного
ных характеристик кофакторов переносчиков
и фотосинтетического фосфорилирования,
электрона. Второй основой предложенного
наряду с работами Г. Эмбдена и О. Мейергофа,
алгоритма стали идеи Л.И. Кришталика о пре-
В.А. Энгельгардта, О. Варбурга, В.А. Белицера
одолении конфликта между парадигмой мак-
и Е.Т. Цыбаковой, А. Ленинджера, Д. Арнона,
роскопической электростатики и использова-
Б. Чанса, П. Бойера и других [45].
нием в расчетах рентгеноструктурных данных
Хотелось бы остановиться на роли само-
о трехмерной структуре белка и, в частности,
го Л.А. Драчева в разработке и модифика-
парциальных зарядов его атомов. Л.И. Криш-
ции прямого электрометрического метода.
талик показал, что эти данные несут разный
Л.А. был радиофизиком, специалистом по элек-
объем информации о различных компонентах
тронике и лазерной технике высочайшего
БИОХИМИЯ том 88 вып. 10 2023
ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
1727
уровня. Когда он пришел на работу в Меж-
ным инженером, и любые проблемы с при-
факультетскую лабораторию МГУ, то имел до-
борами он выявлял и устранял чрезвычайно
вольно поверхностное представление о белках
эффективно.
и в целом биохимии и молекулярной биологии.
Однажды сотрудники в каком-то контексте
Большую роль в привлечении его интереса к
сказали ему: «…ведь Вы - наш научный руко-
мембранным белкам сыграли Е.А. Либерман и
водитель!» На что Драчев в полушутку ответил:
В.П. Скулачев.
«Я не научный руководитель, а технический
С 1973 по 1993 г. он постоянно работал с
директор». Однако Л.А., конечно, существен-
молодыми в то время биохимиками АДК и од-
но преуменьшил свою роль. В действительно-
ним из авторов настоящей статьи АЮС. АДК
сти, полученные результаты постоянно обсуж-
и АЮС выполняли биохимическую работу,
дались Л.А. Драчевым и его сотрудниками, а
выделяя белки, получая различные протео-
при их интерпретации и планировании буду-
липосомы или хроматофоры, варьируя со-
щих экспериментов его мнение играло чрезвы-
став фосфолипидов протеолипосом и ИЛМ,
чайно важную роль.
а также подбирая различные мембранные
фильтры в качестве каркаса для ИЛМ. Кроме
Вклад авторов. В.В. Птушенко - написа-
того, они непосредственно занимались изме-
ние части разделов рукописи, обсуждение тек-
рениями Δψ, продуцируемой различными мем-
ста, редактирование; А.Ю. Семенов - форму-
бранными белками в ответ на включение осве-
лирование концепции статьи, написание части
щения или добавку соответствующего суб-
разделов рукописи, обсуждение текста, редак-
страта; проводили рН- и редокс-титрование
тирование.
фотоэлектрических сигналов, исследовали
Финансирование. Настоящая работа была
кинетику образования Δψ в ответ на лазер-
выполнена при финансовой поддержке Россий-
ные вспышки. Однако детальная разработка
ского научного фонда (грант № 23-74-00025).
метода, включая систему регистрации обра-
Конфликт интересов. Авторы заявляют об
зования мембранного потенциала, и доказа-
отсутствии конфликта интересов.
тельство эквивалентной электрической схемы
Соблюдение этических норм. Настоящая
были бы невозможны без кропотливой и вы-
статья не содержит описания каких-либо ис-
сокопрофессиональной работы Л.А. Драчева.
следований с участием людей или животных
Кроме всего прочего, Л.А. был высококласс-
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Тихонов А. Н. (2012) Энергетическая и регуляторная
ропласта высшего наземного растения, Физиол.
роль протонного потенциала в хлоропластах, Био-
Раст., 18, 248-256.
химия, 77, 1155-1176, doi: 10.1134/S0006297912090027.
7. Булычев А., Андрианов В., Курелла Г., Литвин Ф.
2. Johnson, M. P., and Ruban, A. V. (2014) Rethink-
(1971) Трансмембранный потенциал хлоропласта
ing the existence of a steady-state Δψ component of
и его фотоиндуцированные изменения, Доклады
the proton motive force across plant thylakoid mem-
АН СССР, 197, 473-477.
branes, Photosynth. Res., 119, 233-242, doi: 10.1007/
8. Bulychev, A. A., Andrianov, V. K., Kurella, G. A., and
s11120-013-9817-2.
Litvin, F. F. (1972) Micro-electrode measurements
3. Skulachev, V. P.
(1984) Sodium bioenergetics,
of the transmembrane potential of chloroplasts and
Trends Biochem. Sci.,
9,
483-485, doi:
10.1016/
its photoinduced changes, Nature,
236,
175-177,
0968-0004(84)90317-7.
doi: 10.1038/236175a0.
4. Weber, B. H., and Prebble, J. N. (2006) An issue of
9. Witt, H. T., and Zickler, A. (1974) Vectorial electron
originality and priority: the correspondence and the-
flow across the thylakoid membrane. Further evidence
ories of oxidative phosphorylation of Peter Mitchell
by kinetic measurements with an electrochromic
and Robert JP Williams, 1961-1980, J. History Biol.,
and electrical method, FEBS Lett., 39, 205-208,
39, 125-163, doi: 10.1007/s10739-005-3052-4.
doi: 10.1016/0014-5793(74)80051-7.
5. Junge, W., and Witt, H. T. (1968) On the ion transport
10. Fowler, C. F., and Kok, B. (1974) Direct observation
system of photosynthesis
- Investigations on a
of a light-induced electric field in chloroplasts,
molecular level, Zeitschrift Für Naturforschung B, 23,
Biochim. Biophys. Acta Bioenergetics, 357, 308-318,
244-254, doi: 10.1515/znb-1968-0222.
doi: 10.1016/0005-2728(74)90069-3.
6. Булычев А., Андрианов В., Курелла Г., Литвин Ф.
11. Joliot, P., and Joliot, A. (1984) Electron transfer
(1971) Трансмембранный потенциал клетки и хло-
between the two photosystems. I. Flash excitation
БИОХИМИЯ том 88 вып. 10 2023
1
728
ПТУШЕНКО, СЕМЕНОВ
under oxidizing conditions, Biochim. Biophys.
23.
Большаков В. И., Драчев А. Л., Каламкаров Г. Р.,
Acta Bioenergetics,
765,
210-218, doi:
10.1016/
Каулен А. Д., Островский М. А., Скулачев В. П.
0005-2728(84)90015-X.
(1979) Общность свойств бактериального и зри-
12.
Deprez, J., Trissl, H. W., and Breton, J.
(1986)
тельного родопсинов: превращение энергии света
Excitation trapping and primary charge stabilization in
в разность электрических потенциалов, Доклады
Rhodopseudomonas viridis cells, measured electrically
Академии Наук СССР, 249, 1462-1466.
with picosecond resolution, Proc. Natl. Acad. Sci.
24.
Drachev, L. A., Kalamkarov, G. R., Kaulen, A. D.,
USA, 83, 1699-1703, doi: 10.1073/pnas.83.6.1699.
Ostrovsky, M. A., and Skulachev, V. P.
(1981)
13.
Trissl, H.-W., Leibl, W., Deprez, J., Dobek, A., and
Fast stages of photoelectric processes in biological
Breton, J. (1987) Trapping and annihilation in the
membranes: II. Visual rhodopsin, Eur. J. Biochem.,
antenna system of photosystem I, Biochim. Biophys.
117, 471-481, doi: 10.1111/j.1432-1033.1981.tb06362.x
Acta Bioenergetics,
893,
320-332, doi:
10.1016/
25.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D.,
0005-2728(87)90053-3.
Kondrashin, A. A., Liberman, E. A., Nemecek, I. B.,
14.
Либерман Е., Мохова Е., Скулачев В., Топалы В.
Ostroumov, S. A., Semenov, A. Yu., and Skulachev,
(1968) Действие разобщителей окислительного
V. P. (1974) Direct measurement of electric current
фосфорилирования на бимолекулярные фосфо-
generation by cytochrome oxidase, H+-ATPase
липидные мембраны. Биофизика, 13, 188-193.
and bacteriorhodopsin, Nature,
249,
321-324,
15.
Liberman, E. A., Topaly, V. P., Tsofina, L. M.,
doi: 10.1038/249321a0.
Jasaitis, A. A., and Skulachev, V. P. (1969) Mecha-
26.
Drachev, L. A., Kondrashin, A. A., Semenov,
nism of coupling of oxidative phosphorylation and
A. Y., and Skulachev, V. P. (1980) Reconstitution of
the membrane potential of mitochondria, Nature,
biological molecular generators of electric current:
222, 1076-1078, doi: 10.1038/2221076a0.
transhydrogenase, Eur. J. Biochem., 113, 213-217,
16.
Oesterhelt, D., and Stoeckenius, W.
(1971)
doi: 10.1111/j.1432-1033.1980.tb06158.x.
Rhodopsin-like protein from the purple membrane of
27.
Drachev, L. A., Frolov, V. N., Kaulen, A. D., Kon-
Halobacterium halobium, Nat. New Biol., 233, 149-152,
drashin, A. A., Samuilov, V. D., Semenov, A. Y., and
doi: 10.1038/newbio233149a0.
Skulachev, V. P. (1976) Generation of electric cur-
17.
Drachev, L. A., Kaulen, A. D., Ostroumov, S. A.,
rent by chromatophores of Rhodospirillum rubrum and
and Skulachev, V. P. (1974) Electrogenesis by bacte-
reconstitution of electrogenic function in subchro-
riorhodopsin incorporated in a planar phospholip-
matophore pigment-protein complexes, Biochim. Bio-
id membrane, FEBS Lett., 39, 43-45, doi: 10.1016/
phys. Acta Bioenergetics, 440, 637-660, doi: 10.1016/
0014-5793(74)80012-8.
0005-2728(76)90048-7.
18.
Kagawa, Y., and Racker, E. (1971) Partial resolu-
28.
Drachev, L. A., Kaulen, A. D., Khitrina, L., and
tion of the enzymes catalyzing oxidative phosphor-
Skulachev, V. P. (1981) Fast stages of photoelectric
ylation: XXV. Reconstitution of vesicles catalyzing
processes in biological membranes: I. Bacteriorho-
32Pi-adenosine triphosphate exchange, J. Biol. Chem.,
dopsin, Eur. J. Biochem., 117, 461-470, doi: 10.1111/
246, 5477-5487, doi: 10.1016/S0021-9258(18)61930-1.
j.1432-1033.1981.tb06361.x.
19.
Kayushin, L. P., and Skulachev, V. P.
(1974)
29.
Drachev, L. A., Semenov, A. Y., Skulachev, V. P.,
Bacteriorhodopsin as an electrogenic proton pump:
Smirnova, I. A., Chamorovsky, S. K., Kononenko,
Reconstitution of bacteriorhodopsin proteoliposomes
A. A., Rubin, A. B., and Uspenskaya, N. Ya. (1981)
generating Δψ and ΔpH, FEBS Lett., 39, 39-42,
Fast stages of photoelectric processes in biological
doi: 10.1016/0014-5793(74)80011-6.
membranes: III. Bacterial photosynthetic redox
20.
Drachev, L. A., Frolov, V. N., Kaulen, A. D., Liberman,
system, Eur. J. Biochem., 117, 483-489, doi: 10.1111/
E. A., Ostroumov, S. A., Plakunova, V. G., Semenov,
j.1432-1033.1981.tb06363.x.
A. Y., and Skulachev, V. P. (1976) Reconstitution of
30.
Chamorovsky, S. K., Drachev, A. L., Drachev, L. A.,
biological molecular generators of electric current.
Karagul’yan, A. K., Kononenko, A. A., Rubin, A. B.,
Bacteriorhodopsin, J. Biol. Chem., 251, 7059-7065,
Semenov, A. Yu., and Skulachev, V. P. (1985) Fast
doi: 10.1016/S0021-9258(17)32940-X.
phases of the generation of the transmembrane elec-
21.
Драчев Л. А., Каулен А. Д., Самуилов В. Д., Севе-
tric potential in chromatophores of the photosyn-
рина И. И., Семенов А. Ю., Скулачев В. П., Чеку-
thetic bacterium Ectothiorhodospira shaposhnikovii,
лаева Л. Н.(1979) Встраивание протеолипосом и
Biochim. Biophys. Acta Bioenergetics, 808, 201-208,
хроматофоров в мембраны на основе фильтров,
doi: 10.1016/0005-2728(85)90044-1.
Биофизика, 24, 1035-1042.
31.
Drachey, L. A., Kaminskaya, O. P., Konstantinov,
22.
Drachev, L. A., Kaulen, A. D., Semenov, A. Y.,
A. A., Kotova, E. A., Mamedov, M. D., Samuilov,
Severina, I. I., and Skulachev, V. P. (1979) Lipid-
V. D., Semenov, A. Y., and Skulachev, V. P. (1986)
impregnated filters as a tool for studying the elec-
The effect of cytochrome c, hexammineruthenium
tric current-generating proteins, Anal. Biochem.,
and ubiquinone-10 on the kinetics of photoelectric
96, 250-262, doi: 10.1016/0003-2697(79)90580-3.
responses of Rhodospirillum rubrum reaction centres,
БИОХИМИЯ том 88 вып. 10 2023
ПРЯМОЙ ЭЛЕКТРОМЕТРИЧЕСКИЙ МЕТОД
1729
Biochim. Biophys. Acta Bioenergetics, 848, 137-146,
electrostatic
calculations of redox potentials
doi: 10.1016/0005-2728(86)90169-6.
in photosystem I, Photosynth. Res.,
97,
55-74,
32.
Kaminskaya, O. P., Drachev, L. A., Konstantinov,
doi: 10.1007/s11120-008-9309-y.
A. A., Semenov, A. Y., and Skulachev, V. P. (1986)
39.
Krishtalik, L. I. (1989) Dielectric constant in cal-
Electrogenic reduction of the secondary quinone
culations of the electrostatics of biopolymers,
acceptor in chromatophores of Rhodospirillum rubrum:
J. Theor. Biol., 139, 143-154, doi: 10.1016/S0022-
rapid kinetics measurements, FEBS Lett.,
202,
5193(89)80097-9.
224-228, doi: 10.1016/0014-5793(86)80691-3.
40.
Krishtalik, L. I., Kuznetsov, A. M., and Mertz, E. L.
33.
Drachev, L. A., Kaurov, B. S., Mamedov, M. D.,
(1997) Electrostatics of proteins: description in terms
Mulkidjanian, A. Y., Semenov, A. Y., Shinkarev,
of two dielectric constants simultaneously, Proteins
V. P., Skulachev, V. P., and Verkhovsky, M. I. (1989)
Struct. Funct. Bioinformatics, 28, 174-182, doi: 10.1002/
Flash-induced electrogenic events in the photosyn-
(SICI)1097-0134(199706)28:2<174::AID-PROT6>
thetic reaction center and bc1 complexes of Rhodo-
3.0.CO;2-F.
bacter sphaeroides chromatophores, Biochim. Bio-
41.
Brzezinski, P., Okamura, M. Y., and Feher, G.
phys. Acta Bioenergetics, 973, 189-197, doi: 10.1016/
(1992) Structural changes following the formation
S0005-2728(89)80421-9.
of D+ QA- in bacterial reaction centers: measurement
34.
Mamedov, M. D., Mamedova, A. A., Chamorovsky,
of light-induced electrogenic events in RCs incorpo-
S. K., and Semenov, A. Y. (2001) Electrogenic reduc-
rated in a phospholipid monolayer, The Photosyn-
tion of the primary electron donor P700 by plastocy-
thetic Bacterial Reaction Center II: Structure, Spec-
anin in photosystem I complexes, FEBS Lett., 500,
troscopy and Dynamics, pp. 321-330, doi: 10.1007/
172-176, doi: 10.1016/S0014-5793(01)02615-1.
978-1-4615-3050-3_36.
35.
Mamedov, M. D., Gourovskaya, K. N., Vassiliev,
42.
Sigfridsson, K., Hansson, O., and Brzezinski, P.
I. R., Golbeck, J. H., and Sememov, A. Y. (1998)
(1995) Electrogenic light reactions in photosystem I:
Electrogenicity accompanies photoreduction of the
resolution of electron-transfer rates between the
iron-sulfur clusters FA and FB in photosystem I,
iron-sulfur centers, Proc. Natl. Acad. Sci. USA, 92,
FEBS Lett., 431, 219-223, doi: 10.1016/S0014-5793
3458-3462, doi: 10.1073/pnas.92.8.3458.
(98)00759-5.
43.
Haumann, M., Mulkidjanian, A., and Junge, W.
36.
Чаморовский К., Чаморовский С., Семенов А.
(1997) Electrogenicity of electron and proton transfer
(2005) Диэлектрические и фотоэлектрические
at the oxidizing side of photosystem II, Biochemistry,
свойства фотосинтетических реакционных цен-
36, 9304-9315, doi: 10.1021/bi963114p.
тров, Биохимия, 70, 315-322.
44.
Wikström, M., and Verkhovsky, M. I.
(2007)
37.
Semenov, A. Y., Mamedov, M. D., and Chamo-
Mechanism and energetics of proton translocation
rovsky, S. K. (2006) Electrogenic reactions associ-
by the respiratory heme-copper oxidases, Biochim.
ated with electron transfer in photosystem I, Photo-
Biophys. Acta Bioenergetics,
1767,
1200-1214,
system I: The Light-driven Plastocyanin: Ferredoxin
doi: 10.1016/j.bbabio.2007.06.008.
Oxidoreductase, Springer, p. 319-338, doi: 10.1007/
45.
Beinert, H. (1992) Trails of inquiry and thought
978-1-4020-4256-0_21.
leading toward today’s bioenergetics, Biochim. Bio-
38.
Ptushenko, V. V, Cherepanov, D. A., Krishtalik,
phys. Acta Bioenergetics, 1101, 125-133, doi: 10.1016/
L. I., and Semenov, A. Y. (2008) Semi-continuum
S0005-2728(05)80002-7.
LEL A. DRACHEV AND THE DIRECT ELECTROMETRIC METHOD
Review
V. V. Ptushenko and A. Y. Semenov*
Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; e-mail: semenov@belozersky.msu.ru
In the bioenergetics studies, the direct electrometric method played an important role. This method is based
on measuring the electrical potential difference (Δψ) between two compartments of the experimental cell
generated by some membrane proteins. These proteins are incorporated into closed lipid-protein mem-
brane vesicles associated with an artificial lipid membrane that separates the compartments. The very ex-
istence of such proteins able to generate Δψ was one of the consequences of Peter Mitchell’ s chemiosmotic
concept. The discovery and investigation of their functioning contributed to the recognition of this concept
2
БИОХИМИЯ том 88 вып. 10 2023
1
730
ПТУШЕНКО, СЕМЕНОВ
and, eventually the well-deserved awarding of the Nobel Prize to P. Mitchell. Lel A. Drachev (1926-2022)
was one of the main authors of the direct electrometrical method. With his participation, key studies were
carried out on the electrogenesis of photosynthetic and respiratory membrane proteins, including bacteri-
orhodopsin, visual rhodopsin, photosynthetic bacterial reaction centers, cytochrome oxidase and others.
Keywords: Mitchell’ s chemiosmotic hypothesis, transmembrane electric potential difference (Δψ), methods
of membrane potential measurement, molecular electric generators, proteoliposomes, chromatophores,
bacteriorodopsin, photosystem I
БИОХИМИЯ том 88 вып. 10 2023