БИОХИМИЯ, 2023, том 88, вып. 10, с. 1742 - 1760
УДК 577.355.3
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ: РЕГУЛЯЦИЯ
И АЛЬТЕРНАТИВНЫЕ ПУТИ ПЕРЕНОСА ЭЛЕКТРОНОВ
Обзор
© 2023 А.Н. Тихонов
Московский государственный университет имени М.В. Ломоносова,
физический факультет, кафедра биофизики,
119991 Москва, Россия; электронная почта: an_tikhonov@mail.ru
Поступила в редакцию 21.06.2023
После доработки 09.07.2023
Принята к публикации 10.07.2023
Работа посвящена обзору механизмов регуляции электронного транспорта в хлоропластах в кон-
тексте структурно-функциональной организации фотосинтетического аппарата растений. Основ-
ное внимание уделено окислению пластохинола цитохромным b6 f-комплексом - лимитирующей
стадии переноса электронов между фотосистемами 2 и 1. Кратко описаны процессы электронного
транспорта по цепям нециклического, циклического и псевдоциклического транспорта электро-
нов, их связь с созданием транс-тилакоидной разности электрохимических потенциалов ионов
водорода в хлоропластах, обсуждаются механизмы рН-зависимой регуляции функционирования
цитохромного b6 f-комплекса. Рассмотрены процессы электронного переноса, связанные с участи-
ем альтернативных редокс-медиаторов - молекулярного кислорода (О2) и аскорбата.
КЛЮЧЕВЫЕ СЛОВА: фотосинтез, хлоропласты, электронный транспорт, регуляция.
DOI: 10.31857/S0320972523100032, EDN: OSOXVT
ВВЕДЕНИЕ
макроэргические продукты
«световых ста-
дий» фотосинтеза - используются в реакциях
Оксигенный фотосинтез
- важнейший
цикла Кальвина-Бенсона (ЦКБ) для фикса-
процесс в биосфере Земли, который обеспечи-
ции CO2 [1, 2].
вает выделение молекулярного кислорода (О2)
Структурно-функциональная организация
и фиксацию СО2 за счет энергии солнечно-
фотосинтетического аппарата растений хоро-
го света, поглощаемого светособирающими
шо изучена [3-21]. В то же время остаются не-
пигментами растений, водорослей и циано-
решенными некоторые проблемы, связанные
бактерий. Фотосинтетический аппарат этих
с регуляцией фотосинтетических процессов и
организмов содержит две фотосистемы (ФС) -
акклимацией фотосинтетического аппарата к
пигмент-белковые комплексы ФС1 и ФС2,
изменяющимся условиям среды. В настоящем
цитохромный комплекс b6 f и АТР-синтазный
обзоре кратко рассмотрены структурная орга-
комплекс CF0-CF1, катализирующий образо-
низация фотосинтетического аппарата окси-
вание ATP из ADP и ортофосфата Pi. Перенос
генных организмов и основные механизмы
двух электронов от водоокисляющего ком-
регуляции электронного и протонного транс-
плекса ФС2 к NADP+ (терминальный акцептор
порта, обеспечивающие высокую эффектив-
электронов в ФС1) обеспечивает восстанов-
ность преобразования световой энергии в
ление NADP+ до NADPН. АТP и NADPН - хлоропластах. В первой части статьи описаны
Принятые сокращения: АФК - активные формы кислорода; ФС1 и ФС2 - фотосистема 1 и фотосистема 2; ЦКБ -
цикл Кальвина-Бенсона; ЦЭТ - циклический электронный транспорт; ЭПР - электронный парамагнитный резо-
нанс; ЭТЦ - электрон-транспортная цепь; Asc, MDHA, DHA - три редокс-формы аскорбата (полностью восстанов-
ленная, семихинонная и полностью окисленная); ISP - железосерный белок, входящий в ФС1; Fd - ферредоксин;
FNR - ферредоксин-NADP-редуктаза; NDH-1 - NAD(P)H-дегидрогеназа хлоропластов типа 1; Р700 и Р680 - первичные
доноры электрона в ФС1 и ФС2; Pc - пластоцианин; PGR5 и PGRL1 - белки, участвующие в циклическом переносе
электронов вокруг ФС1; PQ - пластохинон; PQH2 - пластохинол; PTOX - терминальная оксидаза хлоропластов.
1742
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1743
процессы нециклического, циклического и
ный b6 f-комплекс и мобильные переносчики
псевдоциклического переноса электронов, их
электрона - пластохинол (PQH2) и пластоциа-
роль в создании транс-тилакоидной разности
нин (Pc) - обеспечивают связь между встро-
электрохимических потенциалов ионов водо-
енными в мембрану малоподвижными белко-
~
H+), а также обсуждаются механизмы
выми комплексами ФС2 и ФС1.
рН-зависимой регуляции функционирова-
Перенос электронов сопряжен с генера-
ния цитохромного комплекса b6 f хлороплас-
цией транс-тилакоидной разности электрохи-
~
тов. Во второй части рассмотрены процессы,
H+).
связанные с участием молекулярного кисло-
В результате разложения воды водоокисляю-
рода (О2) и аскорбата (Asc) в качестве медиато-
щим комплексом ФС2 и за счет работы b6 f-
ров переноса электронов в хлоропластах.
комплекса происходит защелачивание стро-
мы и накопление ионов водорода в люмене.
Тилакоидные мембраны имеют сравнительно
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ
низкую проницаемость для ионов водорода
ОРГАНИЗАЦИЯ ФОТОСИНТЕТИЧЕСКОГО
и заряженных молекул. Они способны под-
~
АППАРАТА РАСТЕНИЙ.
H+, благодаря чему встроенные
ЦЕПЬ ЭЛЕКТРОННОГО ТРАНСПОРТА
в них АТР-синтазные комплексы (CF0-CF1)
обеспечивают образование ATP из ADP и ор-
У растений процессы светоиндуцирован-
тофосфата Pi [3-5]. В хлоропластах основной
~
ного транспорта электронов и трансмембран-
H+ вносит разность рН,
ного переноса протонов протекают в хлоро-
ΔрН = pHout - pHin, где pHout и pHin - значения
пластах - энергопреобразующих органеллах
рН стромы и люмена [22, 23].
растительной клетки [18-21]. Хлоропласт отде-
Фотосистема 2 (ФС2) функционирует как
лен от цитоплазмы оболочкой, которая состоит
оксидоредуктаза, окисляющая воду и восста-
из двух близлежащих мембран - наружной и
навливающая пластохинон (PQ) до пластохи-
внутренней. Под оболочкой, в строме, нахо-
нола (PQH2) [6, 7, 9-11]. В фотореакционных
дятся мембраны ламелл. В нормальных физио-
центрах ФС2 энергия от возбужденных све-
логических условиях из ламелл формируются
тособирающих пигментов мигрирует к пер-
граны, представляющие собой стопки упло-
вичному донору электронов, который пред-
щенных и тесно прижатых друг к другу замкну-
ставляет собой ансамбль из четырех молекул
тых везикул (тилакоидов), имеющих форму
хлорофилла а (ChlD1/PD1/PD2/ChlD2). Первич-
сплющенных дисков диаметром ~350-600 нм.
ный донор электрона, известный как P680,
Продолжением отдельных тилакоидов гран
передает электрон феофитину (Phe) через
являются обращенные в строму межгранные
хлорофилл ChlD1, от которого он поступает к
тилакоиды. Тилакоидные мембраны плотно
пластохинону PQA, прочно связанному с ФC2
заполнены белковыми комплексами, которые
(P680 → ChlD1 → PheA → PQA). PQ− восстанавли-
составляют ~70-80% от общей массы мембран.
вает вторую молекулу пластохинона PQВ
В тилакоидные мембраны встроены пигмент-
(PQ−PQB → PQAPQ−). После присоединения к
белковые электрон-транспортные комплексы.
PQ− второго электрона и протонирования
В строме содержатся молекулы РНК, ДНК,
PQ2- за счет ионов водорода стромы (PQ2- +
рибосомы, крахмальные зерна, а также фер-
+ 2Hout → PQВH2) молекула PQH2 диссоциирует
менты, которые обеспечивают усвоение CO2
в липидную фазу мембраны, а ее место зани-
растениями в ЦКБ.
мает другая окисленная молекула PQ (PQВH2 +
Схема, иллюстрирующая взаимодействие
+ PQ → PQВ + PQH2). Дальнейший перенос
электрон-транспортных комплексов, пока-
электронов по ЭТЦ включает диффузию PQH2
зана на рис. 1. Энергия квантов света, погло-
к цитохромному b6 f-комплексу (пластохинол-
щаемых пигментами светособирающих ан-
пластоцианин оксидоредуктаза). В этом ком-
тенн ФС1 и ФС2, мигрирует к реакционным
плексе происходит двухэлектронное (бифурка-
центрам, в которых происходит разделение
ционное) окисление PQH2 до PQ, приводящее
зарядов и инициируется перенос электро-
к восстановлению Cyt f, восстанавливающего
нов по фотосинтетической электрон-транс-
затем Pc, который служит донором электрона
портной цепи (ЭТЦ) [6-17]. Согласованное
для ФС1. Два иона водорода, поглощенные
функционирование ФС1 и ФС2 обеспечи-
из стромы при образовании PQH2 (PQ +
вает окисление воды в водоокисляющем ком-
+ 2e- + 2Hout → PQH2), выделяются в люмен при
плексе ФС2 (2Н2О → О2 + 4e- + 4Н+) и восста-
окислении PQH2 цитохромным комплексом b6 f.
новление NADP+ до NADPH за счет работы
Фотосистема 1 (ФС1). У растений ФС1 -
ФС1 (NADP+ + 2e- + Н+ → NADPH).Цитохром-
это мономерный комплекс, включающий в себя
БИОХИМИЯ том 88 вып. 10 2023
1744
ТИХОНОВ
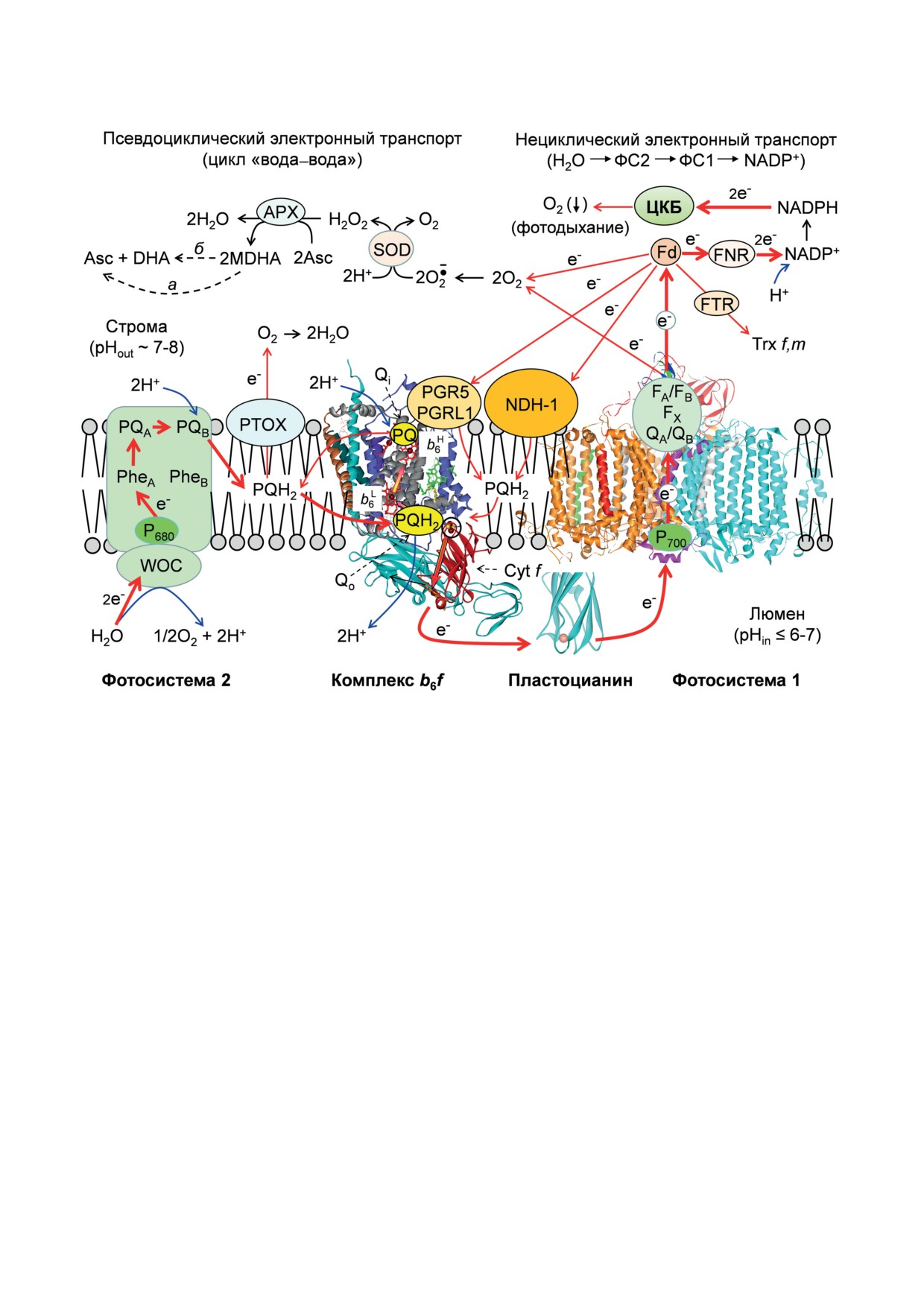
Рис. 1. Схема, иллюстрирующая взаимодействие между электрон-транспортными комплексами (Фотосистема 1,
Фотосистема 2 и цитохромный b6f-комплекс), встроенными в тилакоидную мембрану, и подвижными электронными
переносчиками (ферредоксин - Fd; пластохинон - PQ; пластохинол - PQH2; пластоцианин - Pc). FX, FA и FB - же-
лезосерные центры, входящие в состав ФС1; QA и QB - молекулы филлохинона, связанные с ФС1; PQA и PQB - моле-
кулы пластохинона, связанные с ФС2; APX - аскорбат пероксидаза; FNR - ферредоксин-NADP-редуктаза; FTR -
ферредоксин-тиоредуктаза; NDH-1 - NAD(P)H-дегидрогеназа хлоропластов типа 1; PTOX - терминальная оксидаза
хлоропластов; ЦКБ - цикл Кальвина-Бенсона; SOD - супероксиддисмутаза; Asc, MDHA и DHA - полностью вос-
становленная, семихинонная (монодегидроаскорбат) и окисленная (дегидроаскорбат) формы аскорбата соответ-
ственно; Trx f,m - изоформы f и m тиоредоксина. Расшифровка остальных обозначений и сокращений дана в основ-
ном тексте статьи. Красными стрелками показаны основные пути переноса электронов, голубые стрелки - перенос
ионов водорода. Стрелками, обозначенными буквами а и б, отмечены два способа образования Asc из MDHA
светособирающие пигменты и электронные
дается ферредоксину, находящемуся в строме
переносчики; у цианобактерий ФС1, как пра-
(FX → FA → FВ → Fd). Две молекулы восстанов-
вило, является тримерным суперкомплек-
ленного ферредоксина (Fd-) обеспечивают вос-
сом [6, 7]. Возбуждение Р700 - первичного до-
становление NADP+ до NADPH с помощью
нора электрона в ФС1, приводит к разделению
ферредоксин-NADP-редуктазы (FNR). Таким
зарядов в ФС1 и образованию окисленной
образом, за счет совместной работы ФС2
формы Р700 (Р
700
), которая принимает электрон
и ФС1 осуществляется нециклический пере-
от восстановленного пластоцианина (Pc-).
нос электронов от воды к NADP+, обеспечи-
От ФС1 электрон переносится к ферредок-
вающий образование молекул NADPH, по-
сину (Fd) [6-8]. На акцепторной стороне ФС1
требляемых в основном в реакциях ЦКБ.
переносчики электрона расположены в виде
На уровне пула Fd может происходить раз-
двух квази-симметричных ветвей. От Р700
ветвление электронных потоков. Кроме неци-
электрон поступает (через молекулы Chl a и
клического электронного транспорта (НЭТ)
филлохинона) к железосерному акцептору FX,
от ФС1 к NADP+, Fd участвует в переносе
а затем через редокс-центры FA и FB пере-
электронов вокруг ФС1 (циклический элек-
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1745
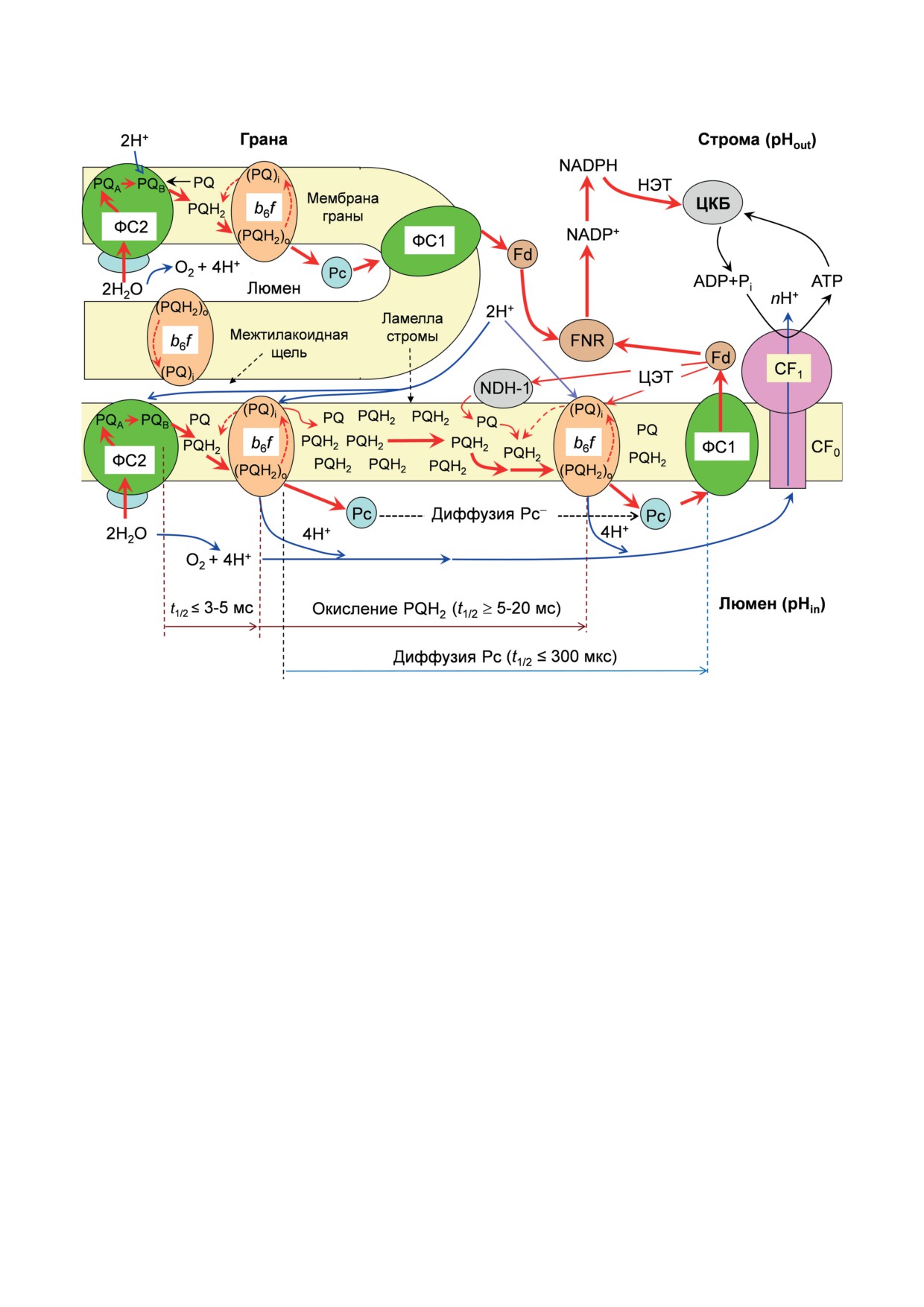
Рис. 2. Схема расположения электрон-транспортных комплексов в мембранах тилакоидов гран и межгранных тила-
коидов, экспонированных в строму. Стрелками, обозначенными символами НЭТ, ЦЭТ-1 и ЦЭТ-2, показаны разные
участки переноса электронов на акцепторной стороне ФС1. НЭТ означает нециклический перенос электронов, свя-
занный с восстановлением NADP+. ЦЭТ-1 - путь циклического переноса электронов вокруг ФС1, предполагающий
участие в этом процессе белков PGR5 и PGRL1, ассоциированных с цитохромным b6f-комплексом. ЦЭТ-2 - цикличе-
ский перенос электронов с помощью NADP-дегидрогеназного комплекса типа 1 (NDH-1)
тронный транспорт, ЦЭТ), когда электрон
плекс b6 f - связующее звено в цепи электрон-
от Fd возвращается в пластохиноновый пул
ного транспорта, обеспечивающее взаимо-
хлоропластов [24-31]. На рис. 2 показаны воз-
действие между ФС2 и ФС1. Окисление PQH2
можные пути ЦЭТ, по которым электроны
комплексом b6 f - самая медленная стадия в цепи
с акцепторной стороны ФС1 возвращаются
переноса электронов от ФС2 к ФС1 [36-41].
в пул молекул пластохинона. Один из них
Лимитирующим звеном на этом участке ЭТЦ
предполагает участие в ЦЭТ гипотетического
является оборот пластохинона (PQ → PQH2 →
белка FQR (ферредоксин-хинон редуктаза),
→ PQ), включающий в себя образование PQH2
существование которого было постулировано
в ФС2 и взаимодействие PQH2 с b6 f-ком-
ранее [24]. В настоящее время имеются веские
плексом. Экспериментально доказано, что в
основания считать, что роль FQR выполняют
широком диапазоне условий (рН, температу-
белки PGR5 и PGRL1, ассоциированные с
ра) восстановление PQ до PQH2 в ФС2 и его
цитохромным b6 f-комплексом [28-30]. Кроме
диффузия в мембране к b6 f-комплексу проис-
этого, возможен перенос электрона от вос-
ходят быстрее, чем непосредственное окис-
становленного Fd к пластохиноновому пулу с
ление PQH2 внутри цитохромного комплек-
участием минорного NADРH-дегидрогеназ-
са [37, 38, 40, 41].
ного комплекса типа 1 (NDH-1), образующего
Цитохромный b6 f-комплекс организован
суперкомплекс с ФС1 [31-35].
как димерный комплекс, состоящий из двух
Окисление пластохинола в цитохромном
одинаковых белковых фрагментов [12-17, 42].
b6 f-комплексе. Q-цикл. Цитохромный ком- Окисление PQH2 происходит в хинол-свя-
3
БИОХИМИЯ том 88 вып. 10 2023
1746
ТИХОНОВ
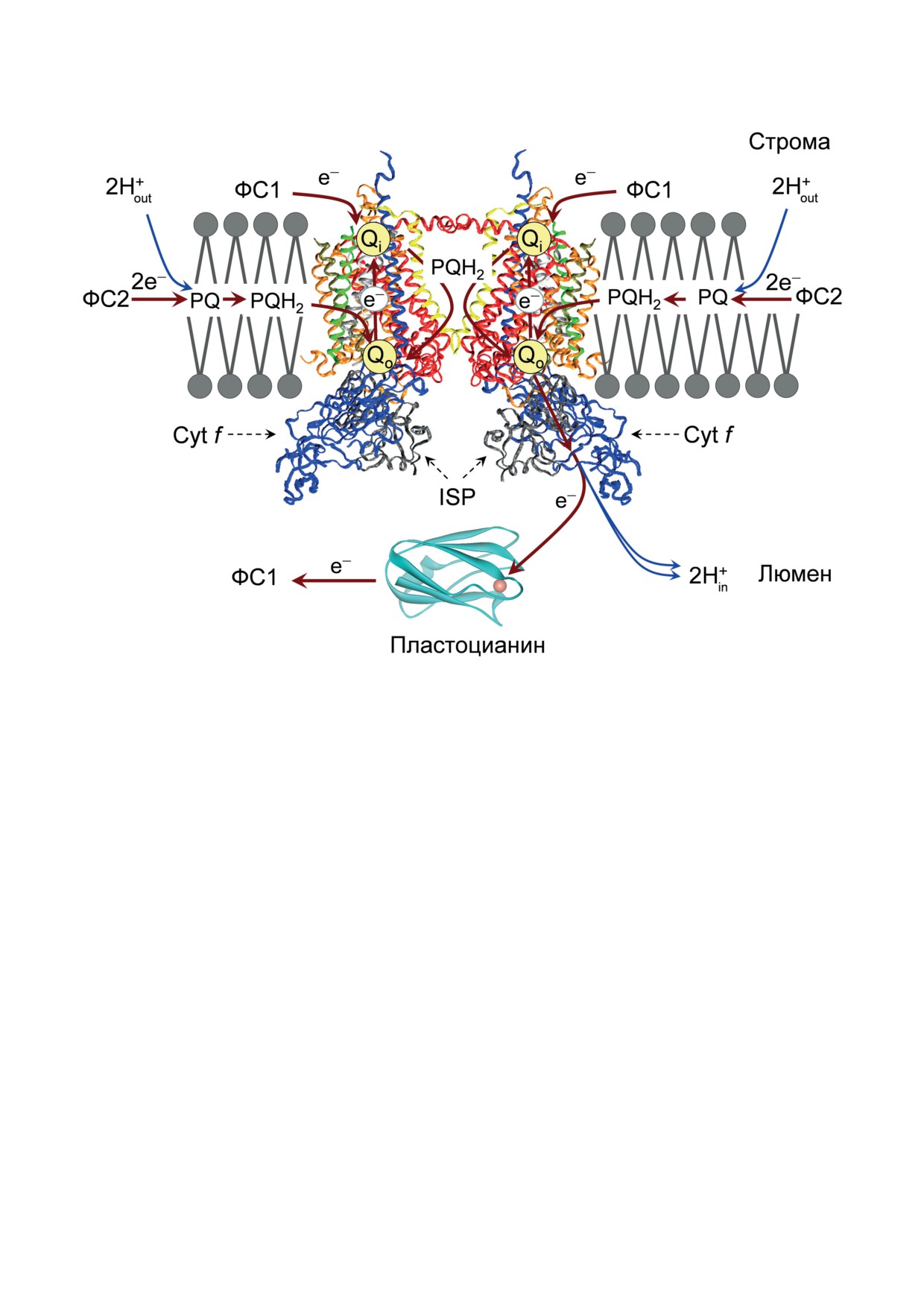
Рис. 3. Димерный цитохромный комплекс b6f. Изображение построено c помощью программы Accelerys DV visualizer
зывающих центрах димерного комплекса
руемый PQH2, переносится по низкопотен-
(рис. 3, каталитические сайты Qo). Каждый из
циальной цепи b6 f-комплекса, включающей в
Qo-центров расположен около люменальной
себя два гема цитохрома b6 и гем cn. Этот элек-
стороны тилакоидной мембраны, между низ-
трон поступает к молекуле PQ, находящейся в
копотенциальным гемом bL и кластером Fe2S2
центре Qi (bL → bH → PQ). Согласно модели мо-
высокопотенциального белка (ISP), назы-
дифицированного Q-цикла, второй электрон
ваемого часто белком Риске. Каталитические
поступает в центр Qi от акцепторного участ-
функции мономеров осуществляются за счет
ка ФС1. После 2-кратного восстановления PQ
четырех окислительно-восстановительных цен-
и присоединения двух протонов из стромы
тров: Fe2S2-кластер ISP, двух гемов цито-
(PQ + 2e- + 2Hout → PQH2) восстановленная мо-
хрома b6 (bL и bH) и цитохрома f. Согласно
лекула PQH2 диссоциирует из центра Qi и воз-
механизму Q-цикла Митчелла [42-46], окисле-
вращается в каталитический центр Qo (см. по-
ние PQH2 имеет бифуркационный характер;
дробнее [12-17, 42-45]). В итоге получается,
два электрона, донируемых молекулой PQH2,
что в расчете на один электрон, переносимый
переносятся по разным цепям: один элек-
в ЦКБ от ФС1 (ФС1 → NADP+), внутрь тила-
трон поступает к окисленному Fe2S2-кластеру
коида переносятся два протона (Н+/e- = 2) [46].
ISP, второй электрон переносится на низко-
Диффузия пластоцианина в люмене. Цито-
потенциальный гем bL. При этом два протона,
хромный комплекс восстанавливает молеку-
переносимые молекулой PQH2, диссоции-
лу Pc. Диффундируя внутри люмена, Pc- пере-
руют в люмен. В высокопотенциальной цепи
носит электрон к ФC1. Диффузия Pc- и его
переноса электрона ISP окисляется гемом f,
окисление за счет ФC1 происходят быстрее
от которого электрон поступает к пласто-
(при комнатных температурах τ1/2 < 300 мкс),
цианину и далее к окисленному центру Р
700
чем диффузия PQH2 от ФC2 к b6 f-комплек-
(ISP → f → Pc → Р700). Второй электрон, дони-
су и взаимодействие PQH2 с b6 f-комплексом
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1747
(τ1/2 ≥ 4-20 мс)
[36-41]. При определенных
но прижатых друг к другу тилакоидах гран.
условиях (например, в хлоропластах, адапти-
С латеральной гетерогенностью тилакоидных
рованных к темноте) стерические ограниче-
мембран можно связать структурно-функцио-
ния могут препятствовать перемещению мо-
нальные свойства тилакоидов. Цитохромные
лекул Pc- внутри узкого (~ 4-5 нм) просвета
комплексы, локализованные в гранальных и
люмена [47]. Ширина просвета люмена может
стромальных областях, могут участвовать в
увеличиваться при освещении хлоропластов,
переносе электронов по разным путям: «гра-
поэтому латеральная диффузия Pc- в люмене
нальные» b6 f-комплексы функционируют в
перестает лимитировать перенос электронов
цепи нециклического («линейного») переноса
от b6 f-комплексов к ФС1 [47].
электронов от ФС2 к ФС1 и далее к NADP+
Наряду с описанными выше процессами в
(ФС2 → PQ → b6 f → Pc → ФС1 → NADP+), «стро-
хлоропластах могут происходить альтернатив-
мальные» комплексы могут быть включены в
ные реакции электронного переноса, среди
цепь циклического переноса электронов во-
которых особая роль принадлежит так назы-
круг ФС1 (ФС1 → Fd → PQ → b6 f → Pc → ФС1).
ваемому псевдоциклическому переносу элек-
Взаимодействие между малоподвижными
тронов, когда конечным акцептором электро-
удаленными белковыми комплексами обеспе-
нов, донируемых ФС1, служит молекулярный
чивается за счет диффузии подвижных элек-
кислород (реакция Мелера [48-51]). Восста-
тронных переносчиков
- пластохинона и
новление О2 до воды может также катализи-
пластоцианина. Высокая плотность белковых
роваться терминальной оксидазой хлороплас-
комплексов в тилакоидной мембране ограни-
тов (PTOX), окисляющей PQH2 [52-56]. Сле-
чивает подвижность пластохинона, а также
дует отметить, что содержание PTOX в зрелых
стерические ограничения, затрудняющие дви-
тилакоидах очень низкое - всего лишь один
жение пластоцианина в узкой щели люмена,
комплекс на 100 ФС2 [57]. Содержание NDH-1
могут ограничивать скорости диффузионно-
примерно в 3 раза меньше, чем содержание
контролируемых стадий электронного перено-
PTOX [57, 58].
са [64]. Отметим, что, несмотря на стерические
В метаболизме растительной клетки также
ограничения, диффузия PQH2 в тилакоидной
особую роль играют редокс-реакции с участи-
мембране не лимитирует скорость переноса
ем аскорбата, которые обеспечивают детокси-
электронов между фотосистемами. Как уже
кацию активных форм кислорода (АФК) [59].
было сказано выше, в широком диапазоне
Альтернативные пути переноса электронов
экспериментальных условий (рН, температу-
подробнее рассмотрены ниже.
ра) образование PQH2 в ФС2 и его диффузия
происходят быстрее, чем непосредственное
окисление PQH2 после его проникновения в
ЛАТЕРАЛЬНАЯ ГЕТЕРОГЕННОСТЬ
каталитический центр Qо цитохромного b6 f-
ТИЛАКОИДНЫХ МЕМБРАН
комплекса [37, 38]. Несмотря на то что многие
И АЛЬТЕРНАТИВНЫЕ ПУТИ
комплексы ФC2 и ФС1 удалены друг от друга,
ФОТОСИНТЕТИЧЕСКОГО
значительная часть b6 f-комплексов, распо-
ПЕРЕНОСА ЭЛЕКТРОНОВ
ложенных в гранах, находится вблизи от ФС2.
Близкое расположение этих комплексов ми-
Фотосинтетические белковые комплексы
нимизирует среднее расстояние, которое про-
неравномерно распределены между тилакоида-
ходят молекулы пула пластохинона, обеспе-
ми гран и межгранными тилакоидами [18-21,
чивая быстрый обмен между молекулами
60-63]. Тилакоиды гран обогащены комплек-
PQH2 и PQ, образующимися в результате ра-
сами ФС2; большинство ФC1 и АТР-синтаз-
боты ФС2 (восстановленные молекулы PQH2)
ных комплексов сосредоточено в межгранных
и b6 f-комплекса (окисленные молекулы PQ).
тилакоидах, на краях и торцах гран, экспони-
Таким образом, за счет высокой подвижности
рованных в строму. Цитохромные комплек-
пластохинола в мембране и быстрой диффузии
сы распределены приблизительно равномерно
Pc в люмене [38, 40] обеспечивается эффек-
вдоль ламеллярных мембран, из которых фор-
тивный переносе электронов от ФС2 к ФС1 и
мируются тилакоиды гран и стромы [60-63].
далее к NADP+ (нециклический электронный
Неоднородное распределение комплексов об-
транспорт).
условлено стерическими ограничениями
-
Цитохромные b6 f-комплексы, находящие-
АТР-синтазы и комплексы ФС1 имеют белко-
ся в межгранных тилакоидах рядом с комплек-
вые фрагменты, значительно выступающие за
сами ФС1, могут быть непосредственно вклю-
пределы мембраны, что препятствует компакт-
чены в цепь циклического электронного транс-
ному расположению этих комплексов в тес-
порта вокруг ФС1. Эффективному функцио-
БИОХИМИЯ том 88 вып. 10 2023
3*
1
748
ТИХОНОВ
нированию ЦЭТ может способствовать обра-
фракциями зависит от условий акклимации
зование суперкомплекса из электрон-транс-
растений: у растений, выращиваемых на сла-
портных комплексов b6 f и ФС1 [27]. Возмож-
бом свету, практически не наблюдается экс-
ны различные пути ЦЭТ. В качестве медиа-
прессии Fd1; в условиях, стимулирующих ЦЭТ
торов электронного переноса, участвующих
(высокая интенсивность света, засуха), экс-
в работе ЦЭТ, служат белки PGR5 и PGRL1,
прессия Fd1 значительно возрастает [68, 69].
функционирующие совместно с b6 f-комплек-
В качестве примера, иллюстрирующего
сом [28-30].
различие в функционировании Fd1 и Fd2,
Другой путь ЦЭТ вокруг ФС1 реализуется с
рассмотрим результаты опытов с хлороплас-
помощью минорного NAD(P)H-дегидрогеназ-
тами бобов класса Б (хлоропласты с нару-
ного комплекса типа 1, являющегося аналогом
шенной внешней мембраной, лишенные
подобного комплекса в митохондриях [31-33].
ферредоксина), воспроизведенные на рис. 4
NDH-1 выполняет роль оксидоредуктазы, окис-
с использованием кинетических данных ра-
ляющей ферредоксин и восстанавливающей
боты Гинс и соавт. [70]. В этих хлоропластах
пластохинон
[34,
35]. Электронный транс-
сохранялась связанная с мембраной ферре-
порт по ЦЭТ вокруг ФС1 сопряжен с создани-
доксин-NADP-редуктаза, но терялись нахо-
~
H+ и, соответственно, может обеспечивать
дившиеся в строме молекулы ферредоксина.
синтез ATP. При этом, однако, не происходит
Добавление NADP+ - физиологического ак-
восстановления NADP+. Сосуществование ли-
цептора электронов - не сказывалось на ки-
нейного и циклического потоков электронов
нетике электронного переноса, оцениваемой
позволяет поддерживать стехиометрию между
по светоиндуцированным изменениям сиг-
молекулами ATP и NADPH, необходимую
нала электронного парамагнитнного резо-
для оптимального функционирования ЦКБ
нанса (ЭПР) от окисленных центров Р
700
[70].
(ATP/NADPH = 3/2) [1, 2].
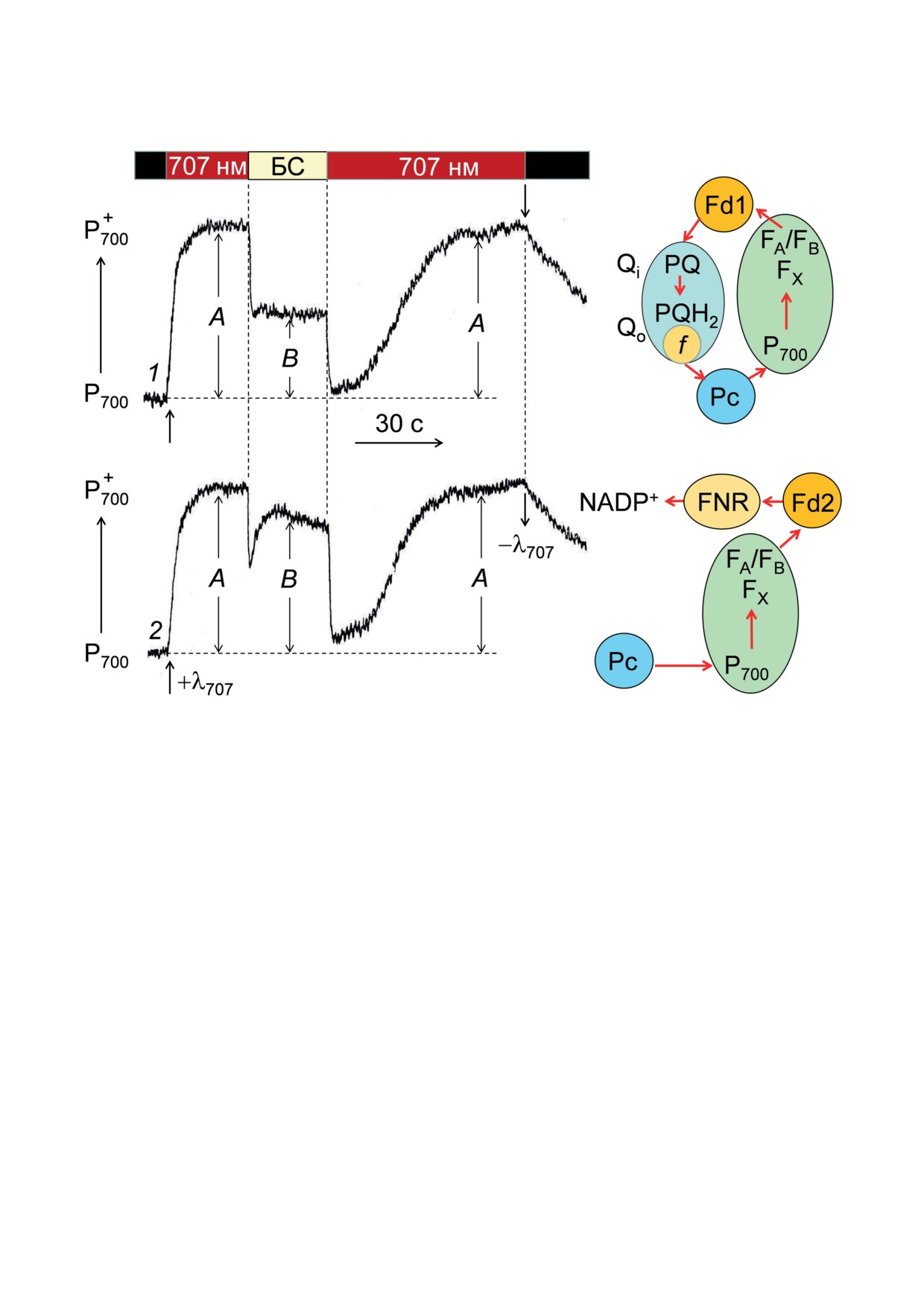
Обе формы ферредоксина, Fd1 и Fd2, про-
Распределение b6 f-комплексов между ти-
являли активность в качестве медиаторов пе-
лакоидами гран и межгранными тилакоидами
реноса электронов. В обоих случаях дальний
зависит от функционального состояния фото-
красный свет (λмакс = 707 нм), возбуждающий
синтетического аппарата. Изменения архитек-
преимущественно ФС1, вызывал заметное
туры хлоропластов может приводить к пере-
окисление Р700. Однако при действии белого
распределению электронных потоков между
света (БС), возбуждающего обе фотосистемы,
нециклическим и циклическим потоками. Ла-
добавление Fd1 или Fd2, взаимодействующих
теральное перемещение части b6 f-комплексов
с FNR, влияло на кинетику редокс-превраще-
из гран в стромальные области тилакоидных
ний Р700 разным образом. Fd2 более эффек-
мембран должно способствовать увеличению
тивно катализировал
«линейный» перенос
относительного вклада ЦЭТ в работу хлоро-
электрона от ФС1 к FNR и далее к NADP+.
пластов. Предполагается, что такое перерас-
Об этом свидетельствует тот факт, что в при-
пределение b6 f-комплексов может происхо-
сутствии Fd2 белый свет вызывал более силь-
дить, например, за счет светоиндуцированных
ный рост сигнала ЭПР от Р
700
(рис. 4, па-
изменений расстояния между прилегающими
раметр В), чем в случае добавления Fd1.
друг к другу соседними тилакоидами гран [65].
Fd1 проявлял заметную активность в качестве
Две изоформы ферредоксина и альтернатив-
электронного переносчика в цепи ЦЭТ во-
ные потоки электронов. С учетом локализации
круг ФС1. В присутствии Fd1 интенсивность
b6 f-комплексов в разных областях хлороплас-
сигнала от Р
700
при действии белого света была
тов представляют интерес данные о существо-
меньше, чем в случае Fd2. Такое различие мог-
вании нескольких изоформ ферредоксина (как
ло быть обусловлено ускорением оттока элек-
минимум двух фракций - минорной (Fd1) и
тронов от ФС1 к NADP+ за счет Fd2, а также
основной (Fd2)), которые незначительно раз-
тем, что Fd1 катализирует циклический пере-
личаются по физико-химическим (например,
нос электронов вокруг ФС1, возвращая элек-
по значениям стандартных редокс-потенциа-
троны к ФС1, тем самым уменьшая концентра-
лов) и некоторым функциональным свой-
цию Р
700
. Было также показано, что добавление
ствам [66-70]. Белки Fd1 и Fd2 имеют близкие
антимицина - ингибитора ЦЭТ - ускоряло
аминокислотные последовательности, но в
фотоокисление Р700. Эффект антимицина за-
хлоропластах С3-растений они присутствуют
метнее проявлялся в случае Fd1, чем Fd2. Это
в разных количествах. Например, у арабидоп-
указывает на более высокую активность Fd1 в
сиса и гороха фракции Fd1 и Fd2 составляют
качестве медиатора ЦЭТ вокруг ФС1. В лите-
соответственно 10% и 90% от общего пула мо-
ратуре высказывалось предположение, что
лекул ферредоксина [66]. Соотношение между
варьирование экспрессии разных изоформ Fd
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1749
Рис. 4. Влияние двух изоформ ферредоксина гороха, Fd1 и Fd2, на кинетику изменений величины сигнала ЭПР
от Р700 в изолированных хлоропластах бобов (Vicia faba) класса Б, индуцированных действием дальнего крас-
ного (λмакс = 707 нм) и белого света (БС) в присутствии 2 мМ NADP+. Добавки ферредоксина: 1 - 60 мкМ Fd1,
2 - 60 мкМ Fd2. Рисунок построен с использованием кинетических кривых, приведенных в работе [70]
позволяет растениям оптимизировать исполь-
превращений Р700 в хлоропластах шпината и
зование солнечной энергии и избегать избы-
бобов [37, 38], недавно получил дополнитель-
точного восстановления переносчиков цепи
ное подтверждение в опытах на мутантах ара-
электронного транспорта при неблагоприят-
бидопсиса, у которых диаметр гран варьировал
ных условиях внешней среды [68, 69].
в широких пределах (от 370 до 1600 нм). В ра-
боте Höhner et al. [40] было показано, что во
всех случаях характерное время образования
РЕГУЛЯЦИЯ ЭЛЕКТРОННОГО
PQH2 в ФС2 и его диффузии к b6 f-комплексу
ТРАНСПОРТА НА УРОВНЕ b6 f-КОМПЛЕКСА
составляло ~ 3,2÷3,6 мс. Это время существен-
но меньше общего времени окисления PQH2,
Стадия окисления PQH2, лимитирующая пе-
независимо от диаметра гран. Данные резуль-
ренос электронов между ФС2 и ФС1. Имеются
таты убедительно доказывают, что именно
доказательства, что в широком диапазоне экс-
окисление PQH2 в каталитическим центре Qo,
периментальных условий (рН, температура)
а не диффузия PQH2 в тилакоидной мембра-
лимитирующей стадией переноса электронов
не, является стадией, лимитирующей перенос
между ФС2 и ФС1 является не диффузия PQH2
электронов от ФС2 к b6 f-комплексу [37, 38].
от ФС2 к b6 f-комплексу, а перенос электрона
После восстановления ISP его подвижный
от PQH2 к Fe2S2-кластеру белка Риске, проис-
домен, содержащий Fe2S2-кластер, смеща-
ходящий после образования комплекса меж-
ется к цитохрому f и передает электрон гему f.
ду PQH2 и ISP. Этот вывод, сделанный ранее
От цитохрома f электрон переносится к Pc.
на основании исследования кинетики редокс-
После окисления ISP его мобильный домен
БИОХИМИЯ том 88 вып. 10 2023
1
750
ТИХОНОВ
возвращается в исходное положение. Движе-
протонируемой группы ISP и контролируется
ние мобильного домена не лимитирует общую
величиной pHin [12, 14]. Окисление ISP после
скорость переноса электрона: значительные
переноса электрона к гему f сопровождается
смещения редокс-центра ISP происходят бы-
уменьшением pKa, что должно стимулиро-
стро по сравнению со скоростью окисления
вать депротонирование ISP [82] и, соответ-
PQH2 кластером Fe2S2. При комнатных тем-
ственно, способствовать окислению PQH2.
пературах перенос электронов от ISPred к Cyt f
Однако при достаточно сильном закислении
протекает с характерным временем ≈ 2-4 мс
люмена (pHin ≤ pKa) депротонирование ISP
[71, 72], которое меньше времени полуокис-
будет затрудняться, а потому поток электро-
ления PQH2 и восстановления цитохрома f
нов через цитохромный b6 f-комплекс будет
(τ1/2 ≥ 5-20 мс [36-41]). Это означает, что ско-
ослабевать. Простая математическая модель,
рость окисления PQH2 определяется в основ-
основанная на том, что перенос электронов
ном стадией переноса электрона от PQH2 к
через цитохромный комплекс контролируется
окисленному Fe2S2-кластеру после образова-
процессами протонирования/депротонирова-
ния субстрат-ферментного комплекса PQH2-
ния ISP, хорошо описывает рН-зависимость
ISPox.
электронного переноса через b6 f-комплекс [12,
рН-Зависимая регуляция электронного пере-
14]. Альтернативная гипотеза об участии моле-
носа в хлоропластах. Известны два основных
кулы воды в качестве первичного акцептора
механизма рН-зависимого торможения элек-
протона при окислении убихинола в цито-
тронного переноса между ФC2 и ФC1, об-
хромном комплексе bc1 была выдвинута в ра-
условленные уменьшением pH люмена (рНin):
боте Postila et al. [88].
1) замедление окисления PQH2 цитохромным
Явление фотосинтетического контроля.
b6 f-комплексом [12-15, 73-76] и 2) ослабление
рН-зависимая регуляция электронного транс-
фотохимической активности ФC2 за счет явле-
порта лежит в основе явления, называемого
ния, известного как нефотохимическое туше-
«фотосинтетическим контролем» [89-92]. Суть
ние (НФТ) возбуждения хлорофилла [77-79].
этого явления заключается в том, что поток
Влияние рНin на скорость окисления PQH2
электронов между ФC2 и ФC1 коррелиру-
происходит по механизму отрицательной об-
ет с величиной
«фосфатного потенциала»,
ратной связи: окисление PQH2 сопровожда-
P = [ATP]/([ADP] × [Pi]), где
[ATP],
[ADP]
ется выделением протонов в люмен, закисле-
и [Pi] - концентрации ATP, ADP и Pi. Отно-
ние люмена (рНin↓) тормозит окисление PQH2.
шение АТР/ADP может изменяться в зави-
Согласно модели «proton-gated» [80, 81], де-
симости от физиологического состояния
протонирование PQH2 стимулирует перенос
растительной клетки и взаимодействия фото-
электрона на окисленный белок Риске (ISPox);
синтетического аппарата с митохондриями и
замедление депротонирования PQH2 при
другими метаболическими системами [93-96].
понижении рНin должно тормозить окисле-
В состоянии «фотосинтетического контроля»
ние РQH2. Имеются все основания считать,
(«состояние 4» по терминологии Chance и
что от PQH2 протон переносится к гистидино-
Williams [89]), когда пулы молекул ADP и/или
вому остатку ISP, являющегося лигандом для
Pi исчерпаны, синтез АТР и трансмембран-
одного из ионов Fe кластера Fe2S2, и это про-
ный поток протонов через АТР-синтазу
исходит одновременно с переносом электрона
(комплекс CF0-CF1) ослабевают, при этом
к Fe2S2-кластеру ISP (см. подробнее [12-16,
рН люмена снижается достаточно сильно
42, 44]). Величина рКa протонируемой группы
(pHin < 6), что замедляет работу цитохромного
ISP зависит от редокс-состояния Fe2S2-клас-
комплекса. В «состоянии 3», когда происходит
тера [82]. Два процесса - депротонирование
интенсивный синтез АТР, выход протонов из
PQH2 (перенос протона к гистидиновому ос-
люмена в строму ускоряется и потому не про-
татку ISP) и перенос электрона к Fe2S2-класте-
исходит столь сильного закисления люмена
ру ISP можно рассматривать как сопряженные
(pHin ≥ 6-6,5), которое могло бы существенно
процессы, которые взаимосвязаны и проис-
замедлить перенос электронов. При этом обес-
ходят практически одновременно
[83-87].
печивается эффективный синтез АТР и одно-
Депротонированное состояние ISP - необ-
временно поддерживается высокая скорость
ходимое условие для того, чтобы перенос про-
электронного транспорта [74-76, 90-92].
тона от PQH2 к ISP мог осуществиться. Депро-
Увеличение рН стромы (рНout), обуслов-
тонирование ISP связано с выходом протона
ленное переносом протонов из стромы в лю-
в люмен; вероятность этого процесса зависит
мен, также может влиять на скорость работы
от рНin. Протонирование/депротонирование
фотосинтетической ЭТЦ. Повышение рНout до
ISP зависит от эффективного значения pKa
уровня рНout ≈ 7,8-8,0 способствует активации
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1751
реакций ЦКБ [1]. Это должно приводить к
ственным для поддержания оптимального
ускорению потребления NADPH и, соответ-
энергетического баланса в хлоропластах и
ственно, к более быстрому оттоку электро-
защите фотосинтетического аппарата расте-
нов от ФС1. Опыты с инфильтрацией в листья
ний от окислительного стресса. В качестве
протонофоров (разобщителей), выравниваю-
примеров, иллюстрирующих влияние оттока
щих рН внутри (люмен, pHin) и снаружи (стро-
электронов от ФС1 к О2, служат результаты
ма, pHout) тилакоидов, подтверждают сказанное
опытов с инфильтрацией в лист метилвиологе-
выше о рН-зависимой регуляции электронно-
на - искусственного медиатора электронного
го транспорта в хлоропластах [97, 98].
транспорта, который заметно ускоряет фото-
окисление Р700, увеличивая стационарный уро-
700
вень Р
, а также опыты по варьированию со-
АЛЬТЕРНАТИВНЫЕ ПУТИ ПЕРЕНОСА
держания О2 в среде, окружающей лист, или в
ЭЛЕКТРОНОВ В ХЛОРОПЛАСТАХ
суспензии клеток цианобактерий [103-106].
Наряду с потоком электронов к О2 от
Наряду с рассмотренными выше электрон-
низкопотенциальных акцепторов, входящих
транспортными процессами, связанными с
в состав ФС1 [99-101], определенный вклад
восстановлением NADP+ и ЦЭТ вокруг ФС1,
в образование АФК вносят восстановленный
в хлоропластах протекают другие редокс-реак-
ферредоксин [51, 102], цитохромный b6 f-ком-
ции, среди которых важнейшую роль в функ-
плекс и редокс-активные молекулы пластосе-
ционировании фотосинтетического аппарата
михинона и пластохинона внутри тилакоидной
играют молекулярный кислород и аскорбат.
мембраны [51, 107-109]. Вклад ФС2 в восста-
Взаимодействие О2 с хлоропластами. Моле-
новление О2 невелик. Сравнивая цитохром-
кулярный кислород (О2) - активный участ-
ные комплексы b6 f и bc1, следует отметить, что
ник метаболических процессов в раститель-
b6 f-комплекс проявляет заметно более высо-
ной клетке. Молекулы О2 служат акцепторами
кую (на порядок) скорость восстановления О2,
электрона, взаимодействующими с ЭТЦ хло-
чем bс1-комплекс [107]. Предполагается, что
ропластов. При этом могут возникать актив-
это может быть объяснено присутствием мо-
ные формы кислорода: супероксидные ради-
лекулы хлорофилла а вблизи от места лока-
калы (O•-), пероксид водорода (Н2О2) и очень
лизации PQH2 в каталитическом центре Qo.
токсичный радикал ОН• [51]. У растений об-
Фитильный хвост хлорофилла может создавать
разование O•- происходит в результате одно-
стерические затруднения, препятствующие сме-
электронного восстановления О2 за счет его
щению в сторону гема bL молекулы пластосе-
взаимодействия с фотосинтетической ЭТЦ.
михинона, образующейся после реакции пере-
Основным источником электронов для об-
носа электрона от PQH2 к белку Риске. Тем
разования АФК служит акцепторный уча-
самым увеличивается время жизни редокс-
сток ФС1, которой содержит входящие в ФС1
активного радикала (пластосемихинон) и воз-
низкопотенциальные медиаторы электронного
растает эффективность восстановления О2.
переноса. Такими донорами электронов могут
Восстановление О2 в аэробных условиях
быть филлохинон PhQ и низкопотенциальные
за счет электронов, донируемых перенос-
железосерные центры FA, FB, FX, а также фер-
чиками ЭТЦ на участке между ФС2 и ФС1,
редоксин [99-102]. От ФС1 электрон перено-
получившее название
«хлорореспирации»
сится на молекулу О2, которая восстанавлива-
(chlororespiration), хорошо известно
[52-56].
ется до супероксидного радикала (О2 + e- → O•-,
При этом происходит окисление пула PQH2, о
реакция Мелера
[48-49]). Супероксидный
чем можно судить, например, по измерениям
радикал (O•-) превращается затем в перок-
индукции флуоресценции хлорофилла а в ходе
сид водорода и О2 за счет супероксид-дисму-
адаптации листьев растений к темноте [103,
тазной реакции (2O•- + 2Н+ → Н2О2 + О2) [51].
104]. Этот процесс происходит с участием тер-
Численные оценки вклада реакции Мелера в
минальной оксидазы хлоропластов, которая
образование АФК неоднозначны. Большин-
окисляет PQH2 и обеспечивает перенос элек-
ство авторов считает, что вклад реакции Ме-
трона к молекуле О2. Относительный вклад
лера невелик, он составляет не более ~10%;
этого пути восстановления О2 мал по сравне-
по другим сообщениям поток электронов к О2
нию с вкладом светоиндуцируемой реакции
достигает 40% от суммарного потока электро-
Мелера [51, 57, 58]. Однако хлорореспирация
нов, донируемый ФС2 (см. обзоры [49-51]
проявляется, например, когда мы оцениваем
и цитированную в них литературу). Тем не
изменение редокс-статуса ЭТЦ хлороплас-
менее даже сравнительно слабый поток элек-
тов при адаптации растений к темноте. Этим
тронов от ФС1 к О2 может оказаться суще-
каналом оттока электронов к О2 объясняется
БИОХИМИЯ том 88 вып. 10 2023
1
752
ТИХОНОВ
сравнительно медленное (минуты-десятки ми-
те за счет дыхания. При этом концентрация
нут) окисление пула пластохинона в темноте.
О2 внутри листьев, находящихся в контакте с
Наконец, хорошо известно, что в интактных
воздухом, практически не меняется в ответ на
хлоропластах может происходить поглощение
включение и выключение света [110].
кислорода на уровне Рубиско за счет явления,
Отметим также, что скорость диффузии
называемого фотодыханием (см. [1, 51] и цити-
О2 через тилакоидные мембраны, определен-
руемую в них литературу).
ная путем зондирования мембран с помощью
Другой механизм восстановления О2 за счет
липидо-растворимых спиновых зондов, явля-
пластохинола был предложен в работах Бори-
ется высокой [111]. Проницаемость липидного
са Николаевича Иванова и соавт. (см. обзор
бислоя тилакоидных мембран хлоропластов
этих работ в статье Иванова и соавт. [51]).
шпината для О2, измеренная при 20 °С, состав-
Результаты их исследований позволяют пред-
ляет 39,5 см⋅с-1, что на 20% выше коэффици-
положить, что донорами электрона для вос-
ента проницаемости слоя воды той же тол-
становления О2 являются редокс-активные
щины, что у липидной мембраны. Высокая
молекулы пластосемихинона (предпочтитель-
проницаемость мембран для О2 может спо-
но, депротонированная форма PQ•-), кото-
собствовать выравниванию концентраций О2
рые могут образовываться в результате реак-
в разных компартментах растительной клет-
ции «компропорционирования» (PQH2 + PQ ↔
ки. Согласно оценкам, приведенным в работе
↔ 2PQH• ↔ 2PQ•- + 2H+). Реакционноспособ-
Ligeza et al. [110], транс-тилакоидная разность
ные радикалы PQ•- окисляются за счет их
концентраций О2 невелика, она не превышает
взаимодействия с О2. Этим также можно объ-
1 мкМ. Хорошая «вентиляция» внутреннего
яснить тот факт, что в темноте в аэробных
интерьера листьев растений указывает на
условиях содержание PQH2 в хлоропластах
то, что значительного накопления О2 внутри
постепенно уменьшается [103, 104]. В рабо-
растительных клеток, которое могло бы воз-
тах Иванова и соавт. [51, 108, 109] также раз-
никать за счет окисления воды в ФС2, не про-
вивается и обосновывается идея о том, что,
исходит, что должно ограничивать генера-
помимо восстановления молекул О2 в пуле
цию АФК.
пластохинона молекулами пластосемихинона,
Хорошая аэрация растительной клетки
может быть, более важную роль играет вос-
должна способствовать тому, что фотосинте-
становление молекулами пластогидрохинона
тический аппарат хлоропластов будет эффек-
супероксидных анион-радикалов, образую-
тивно взаимодействовать с другими метабо-
щихся как в этом пуле, так и в ФС1. По мне-
лическими системами растительной клетки.
нию авторов, этот процесс участвует как в
Показательным является тот факт, что при
детоксикации O•-, так, и что важнее, в продук-
удалении О2 путем обдувания листьев инерт-
ции сигнальных молекул пероксида водорода,
ным газом (N2 или Ar) резко падает концентра-
которые, образовавшись именно таким пу-
ция окисленных центров Р
700
при освещении
тем, являются мессенджерами, передающими
листьев светом, возбуждающим обе фото-
информацию другим системам хлоропласта
системы [103-105]. Одно из объяснений этого
и клетки о состоянии ЭТЦ - чувствительном
явления
- ограничение оттока электронов
датчике состояния окружающей среды.
от ФС1 к О2, препятствующее окислению Р700.
Проницаемость тилакоидных мембран для О2.
Избыточное восстановление переносчиков
Не останавливаясь на том, как изменение кон-
на акцепторной стороне ФС1, не способных
центрации О2 внутри растительной клетки мо-
принимать электроны от Р700, будет ускорять
жет влиять на функционирование других мета-
рекомбинацию зарядов в ФС1, препятствуя
болических систем [94-96], отметим некото-
фотоокислению Р700. При этом может образо-
рые свойства мембран хлоропластов, важные
ваться синглетный кислород, весьма опасная
для понимания особенностей их взаимодей-
форма АФК [112]. Можно также предполо-
ствия с О2. Установлено, что у растений про-
жить, что при дефиците О2 замедляется работа
исходит сравнительно быстрое выравнивание
дыхательной цепи митохондрий растительной
концентраций кислорода внутри листа и в
клетки и/или нарушается функционирование
окружающей атмосфере. Это было показано
других метаболических систем, что могло бы
методом ЭПР с использованием твердых кис-
ослаблять потребление NADPH - конечного
лород-чувствительных парамагнитных частиц,
акцептора электронов в ФС1, и тем самым
которые вводили внутрь листа с помощью
препятствовать окислению Р700.
микрошприца [110]. Такие образцы листьев
Взаимодействие аскорбата с хлоропластами.
сохраняют способность выделять О2 на свету
В метаболизме растений особую роль играют
за счет работы ФС2 и поглощать О2 в темно-
окислительно-восстановительные процессы
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1753
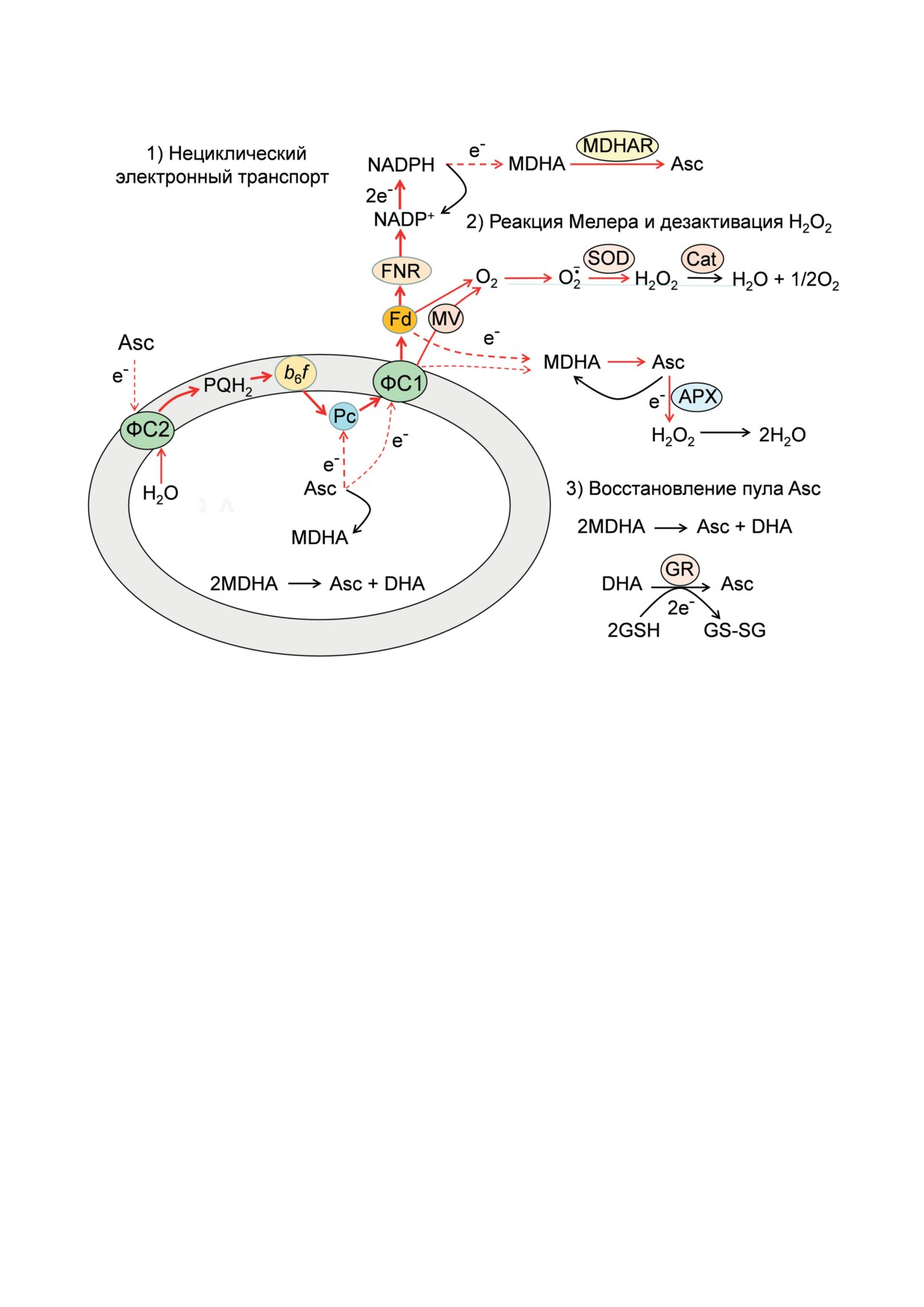
Рис. 5. Схема, иллюстрирующая взаимодействие различных форм аскорбата (Asc, MDHA, DHA) с хлоропластами.
Сокращения: APX - аскорбат пероксидаза; GR - глутатион-редуктаза; GSH и GS-SG - восстановленная и окисленная
формы глутатиона; Cat - каталаза; MV - метилвиологен; MDHAR - MDHA-редуктаза; SOD - суперосиддисмутаза
с участием аскорбата, способного взаимо-
Аскорбат является эффективным антиокси-
действовать с ЭТЦ хлоропластов и нейтра-
дантом, он служит ловушкой АФК, участвуя
лизовать АФК
[59]. Содержание аскорбата
в ферментативном восстановлении H2O2 и
в тканях растений бывает высоким, у неко-
супероксидных радикалов. Например, фер-
торых видов растений его концентрация со-
ментативное окисление Asc до MDHA в ре-
ставляет 20-50 мМ, в зависимости от вида и
зультате аскорбат-пероксидазной реакции,
условий культивирования растений [113-116].
катализирующей превращение Н2О2 в Н2О.
Физиологическая роль реакций с участием
Аскорбат является донором электронов для
аскорбата связана с установлением окисли-
виолаксантин-деэпоксидазной реакции (вио-
тельно-восстановительного гомеостаза в расти-
лаксантин → зеаксантин), в результате которой
тельной клетке и с защитой фотосинтетическо-
в светособирающей антенне ФС2 усилива-
го аппарата от повреждений, вызываемых АФК.
ется тепловая диссипация энергии (нефото-
Аскорбат вместе с глутатионом выполняют роль
химическое тушение возбуждения хлорофил-
редокс-буферов, когда изменения внешних
ла) [117-119].
условий (например, флуктуации интенсив-
Аскорбат и его окисленные формы (моно-
ности и спектрального состава света) могут
дегидроаскорбат, MDHA, и дегидроаскорбат,
нарушать редокс-состояние растительной
DHA) взаимодействуют с хлоропластами на
клетки [59]. Аскорбат препятствует ингибиро-
различных участках ЭТЦ. Среднеточечный
ванию фотосинтетических процессов в усло-
редокс-потенциал (Em′) пары Asc/DHA равен
виях стресса (избыток света, недостаток влаги
~ 60-90 мВ [120]. Это означает, что аскорбат
и др.). В хлоропластах имеется сложная много-
(полностью восстановленная форма) может
ступенчатая система биохимических реакций,
взаимодействовать с ЭТЦ хлоропластов в ка-
препятствующих накоплению Н2О2 [51, 59].
честве донора электронов на участке между
БИОХИМИЯ том 88 вып. 10 2023
1
754
ТИХОНОВ
ФС2 и ФС1; в то время как окисленные фор-
тронов вокруг ФС1 предохраняют фотосин-
мы аскорбата служат акцепторами электронов,
тетический аппарат от избыточной энергии
донируемыми ФС1. Благодаря этому аскорбат
света, реакции с участием аскорбата обеспе-
способствует поддержанию оптимального ре-
чивают защиту фотосинтетического аппарата
докс-статуса растительной клетки. На рис. 5
от повреждений при избыточном освещении,
приведена схема, показывающая, как восста-
способствуя диссипации энергии в тепло и
новленные и окисленные формы взаимодей-
антиоксидантной защите растительной клет-
ствуют с ЭТЦ хлоропластов. Полностью вос-
ки. Аскорбат может служить альтернатив-
становленная форма аскорбата (Asc) может
ным медиатором электронного переноса в
служить донором электронов на донорной
хлоропластах: стимулируя отток электронов
стороне ФС2 и на пластоцианиновом участ-
от ФС1 и Fd-, MDHA предотвращает избы-
ке ЭТЦ между ФС2 и ФС1 [121, 122]. Аскорбат,
точное восстановление переносчиков на ак-
проникающий внутрь тилакоидов, способен
цепторном участке ФС1. С другой стороны,
восстанавливать Pc, который, в свою очередь,
восстановленные молекулы аскорбата могут
служит эффективным донором электронов
компенсировать ослабление фотохимической
для ФС1. Поток электронов от Asc к ФС1
активности ФС2, вызванное неблагоприят-
может достигать ~50-70% от нециклическо-
ными факторами среды и служить донора-
го электронного транспорта [121]. При одно-
ми электронов на участке цепи между ФС2
электронном окислении Asc он превращается
и ФС1 [125-127].
в радикал MDHA, который дает характерный
дублетный сигнал ЭПР. Отметим, что Asc
может непосредственно восстанавливать окис-
ЗАКЛЮЧЕНИЕ
ленные центры Р
700
, что наглядно доказыва-
ется опытами с изолированными комплекса-
Оптимальное функционирование фото-
ми ФС1 [122]. Однако в этом случае скорость
синтетического транспорта электронов в хло-
восстановления Р
700
низкая; характерное вре-
ропластах достигается в первую очередь за
мя восстановления Р
700
составляет ~20-30 c,
счет регуляции электронного переноса на двух
что существенно медленнее по сравнению с
участках цепи электронного переноса: от ФC2
восстановлением Р
700
за счет Pc-.
к цитохромному b6 f-комплексу и на стадии от-
Окисление Asc - обратимый процесс. Вос-
тока электронов от ФC1 в ЦКБ. Важную роль
становление семихиноновой формы MDHA до
в этих процессах играют структурно-функ-
полностью восстановленной формы Asc про-
циональные перестройки фотосинтетического
исходит разными путями. MDHA может полу-
аппарата, которые определяют лабильность
чать электрон непосредственно от ФС1 [51,
хлоропластов и их способность быстро реа-
123]. Характерная скорость переноса элек-
гировать на изменения внешних условий,
трона от ФС1 к MDHA, приводящая к обра-
а также альтернативные редокс-медиаторы
зованию полностью восстановленной фор-
(О2 и аскорбат), обеспечивающие редокс-го-
мы Asc, сопоставима со скоростью переноса
меостаз растительной клетки и стабильность
электронов между фотосистемами. Молекулы
работы ЭТЦ.
MDHA могут также принимать электроны
от Fd- и NADPH [51, 124]. Скорость восстанов-
Благодарности. Данная статья посвящена
ления MDHA зависит от концентрации Fd- и
памяти Л.А. Драчева - одного из крупнейших
в определенных условиях может многократно
отечественных биофизиков-экспериментаторов,
превышать скорость светоиндуцированного
чьи научно-технические разработки и пионер-
восстановления NADP+ от FNR.
ские исследования в области фотосинтеза спо-
Другой канал образования восстановле-
собствовали глубокому пониманию процессов
ний формы Asc - это реакция диспропор-
разделения и переноса зарядов в реакционных
ционирования радикалов MDHA (2MDHA ↔
центрах фотосинтезирующих систем.
↔ Asc + DHA) [122]. Образующаяся при этом
Автор признателен Э.К. Рууге, Г.Б. Хому-
полностью окисленная форма DHA может за-
тову и Л.Ю. Устынюк, совместно с которыми
тем восстанавливаться до Asc. Важную роль в
ранее были получены основные результаты по
этом играет глутатион-оксидазная реакция, в
экспериментальному и теоретическому изуче-
которой донором электронов служит восста-
нию регуляции электронного транспорта в
новленный глутатион [59].
хлоропластах, на которые автор ссылается в
Таким образом, подобно тому, как псев-
настоящем обзоре. Автор благодарит аноним-
доциклический транспорт электронов (цикл
ных рецензентов за полезные замечания и ре-
«вода-вода») и циклический перенос элек-
комендации.
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1755
Финансирование. Работа проводилась в рам-
фонда фундаментальных исследований (грант
ках темы научно-исследовательских работ
№ 21-04-20047).
физического факультета Московского государ-
Конфликт интересов. Автор заявляет об от-
ственного университета имени М.В. Ломоносо-
сутствии конфликта интересов.
ва «Физические основы строения, функциони-
Соблюдение этических норм. Настоящая
рования и регуляции биологических систем»
статья не содержит описания каких-либо ис-
(Госрегистрация № 012004 085 35) и при час-
следований с участием людей или животных
тичной финансовой поддержке Российского
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Edwards, G., and Walker, D. (1983) C3, C4: Mecha-
pathways, Plant Physiol. Biochem.,
81,
163-183,
nisms, and Cellular and Environmental Regulation of
doi: 10.1016/j.plaphy.2013.12.011.
Photosynthesis, Univ. of California Press, Berkeley.
13.
Cramer, W. A., and Hasan, S. S. (2016) Struc-
2.
Gurrieri, L., Fermani, S., Zaffagnini, M., Sparla, F.,
ture-function of the cytochrome b6 f lipoprotein com-
and Trost, P. (2021) Calvin-Benson cycle regulation
plex, in Cytochrome Complexes: Evolution, Structures,
is getting complex, Trends Plant Sci., 26, 898-912,
Energy Transduction, and Signaling (Cramer, W. A.,
doi: 10.1016/j.tplants.2021.03.008
and Kallas, T., eds) Springer, Dordrecht, pp. 177-207,
3.
Boyer, P. D. (1997) The ATP synthase - a splendid
doi: 10.1007/978-94-017-7481-9_9.
molecular machine, Annu. Rev. Biochem., 66, 717-749,
14.
Tikhonov, A. N. (2018) The cytochrome b6 f com-
doi: 10.1146/annurev.biochem.66.1.717.
plex: biophysical aspects of its functioning in chlo-
4.
Junge, W., and Nelson, N. (2015) ATP synthase,
roplasts, in Membrane Protein Complexes: Structure
Annu. Rev. Biochem.,
83,
631-657, doi:
10.1146/
and Function, Subcellular Biochemistry (Harris, J. R.,
annurev-biochem060614-034124.
Boekema, E. J., eds), 87, Springer Nature, Singa-
5.
Romanovsky, Y. M., and Tikhonov, A. N. (2010)
pore Pte Ltd., pp. 287-328, doi: 10.1007/978-981-
Molecular energy transducers of the living cell. Proton
10-7757-9_10.
ATP synthase: a rotating molecular motor, Physics Usp.,
15.
Malone, L. A., Proctor, M. S., Hitchcock, A., Hunter,
53, 893-914, doi: 10.3367/UFNe.0180.201009b.0931.
C. N., and Johnson, M. P. (2021) Cytochrome b6 f -
6.
Nelson, N., and Yocum, C. F. (2006) Structure
Orchestrator of photosynthetic electron transfer,
and function of photosystems I and II, Annu. Rev.
Biochim. Biophis. Acta, 1862, 148380, doi: 10.1016/
Plant Biol.,
57,
521-565, doi:
10.1146/annurev.
j.bbabio.2021.148380.
arplant.57.032905.105350.
16.
Sarewicz, M., Pintscher, S., Pietras, R., Borek, A.,
7.
Mamedov, M., Govindjee, Nadtochenko, V., and
Bujnowicz, Ł., Hanke, G., Cramer, W. A., Finazzi, G.,
Semenov, A. Yu. (2015) Primary electron transfer
and Osyczka, A. (2021) Catalytic reactions and en-
processes in photosynthetic reaction centers from
ergy conservation in the cytochrome bc1 and b6 f
oxygenic organisms, Photosynth. Res., 125, 51-63,
complexes of energy-transducing membranes, Chem.
doi: 10.1007/ s11120-015-0088-y.
Rev.,
121,
2020-2108, doi:
10.1021/acs.chemrev.
8.
Brettel, K. (1997) Electron transfer and arrange-
0c00712.
ment of the redox cofactors in photosystem I, Bio-
17.
Sarewicz, M., Szwalec, M., Pintscher, S., Indyka, P.,
chim. Biophys. Acta, 1318, 322-373, doi: 10.1016/
Rawski, M., Pietras, R., Mielecki, B., Koziej, Ł.,
S0005-2728(96)00112-0.
Jaciuk, M., Glatt, S., and Osyczka, A. (2023) High-
9.
Allakhverdiev, S. I. (2011) Recent progress in the
resolution cryo-EM structures of plant cytochrome b6 f
studies of structure and function of photosystem II,
at work, Sci. Adv., 9, 1-12, doi: 10.1126/sciadv.add9688.
J. Photochem. Photobiol. B, 104, 1-8, doi: 10.1016/
18.
Staehelin, L. A. (2003) Chloroplast structure: from
j.jphotobiol.2011.03.010.
chlorophyll granules to supramolecular architecture of
10.
Müh, F., Glöckner, C., Hellmich, J., and Zouni, A.
thylakoid membranes, Photosynth. Res., 76, 185-196,
(2012) Light-induced quinone reduction in photo-
doi: 10.1023/A:1024994525586.
system II, Biochim. Biophys. Acta,
1817,
44-65,
19.
Albertsson, P.-Å. (2001) A quantitative model of
doi: 10.1016/j.bbabio.2011.05.021.
the domain structure of the photosynthetic mem-
11.
Shevela, D., Kern, J. F., Govindjee, G., and
brane, Trends Plant Sci., 6, 349-354, doi: 10.1016/
Messinger, J.
(2023) Solar energy conversion by
S1360-1385(01)02021-0.
photosystem II: principles and structures, Photosynth.
20.
Dekker, J. P., and Boekema, E. J. (2005) Supramo-
Res., 156, 279-307, doi: 10.1007/s11120-022-00991-y.
lecular organization of thylakoid membrane proteins
12.
Tikhonov, A. N. (2014) The cytochrome b6 f complex
in green plants, Biochim. Biophys. Acta, 1706, 12-39,
at the crossroad of photosynthetic electron transport
doi: 10.1016/j.bbabio.2004.09.009.
БИОХИМИЯ том 88 вып. 10 2023
1
756
ТИХОНОВ
21.
Pribil, M., Labs, M., and Leister, D. (2014) Structure
33.
Laughlin, T. G, Bayne, A. N, Trempe, J. F, Savage,
and dynamics of thylakoids in land plants, Environ.
D. F., and Davies, K. M.
(2019) Structure of
Bot., 65, 1955-1972, doi: 10.1093/jxb/eru090.
the complex I-like molecule NDH of oxygenic
22.
Kramer, D. M., Avenson, T. J., and Edwards, G. E.
photosynthesis, Nature, 566, 411-414, doi: 10.1038/
(2004) Dynamic flexibility in the light reactions of
s41586-019-0921-0.
photosynthesis governed by both electron and proton
34.
Schuller, J. M., Birrell, J.A., Tanaka, H., Konuma, T.,
transfer reactions, Trends Plant. Sci., 9, 349-357,
Wulfhorst, H., Cox, N., Schuller, S. K., Thiemann, J.,
doi: 10.1016/j.tplants.2004.05.001.
Lubitz, W., Sétif, P., Ikegami, T., Engel, B. D.,
23.
Johnson, M. P., and Ruban, A. V. (2014) Rethink-
Kurisu, G., and Nowaczyk, M. M. (2019) Structural
ing the existence of a steady-state Δψ component of
adaptations of photosynthetic complex I enable ferre-
the proton motive force across plant thylakoid mem-
doxin-dependent electron transfer, Science, 363, 257-
branes, Photosynth. Res., 119, 233-242, doi: 10.1007/
260, doi: 10.1126/science.aau3613.
s11120-013-9817-2.
35.
Zhang, C., Shuai, J., Ran, Z., Zhao, J., Wu, Z.,
24.
Bendall, D. S., and Manasse, R. S. (1995) Cyclic
Liao, R., Wu, J., Ma, W., and Lei, M. (2020) Struc-
photophosphorylation and electron transport,
tural insights into NDH-1 mediated cyclic electron
Biochim. Biophys. Acta, 1229, 23-38, doi: 10.1016/
transfer, Nat. Commun., 11, 888, doi: 10.1038/s41467-
0005-2728(94)00195-B.
020-14732-z.
25.
Joliot, P., and Joliot, A. (2006) Cyclic electron flow
36.
Stiehl, H. H., and Witt, H. T. (1969) Quantitative
in C3 plants, Biochim. Biophys. Acta, 1757, 362-368,
treatment of the function of plastoquinone in
doi: 10.1016/j.bbabio.2006.02.018.
photosynthesis, Z. Naturforsch. B, 24, 1588-1598,
26.
Joliot, P., Sellés, J., Wollman, F.-A., and Verméglio, A.
doi: 10.1515/znb-1969-1219.
(2022) High efficient cyclic electron flow and
37.
Haehnel, W. (1976) The reduction kinetics chlo-
functional supercomplexes in Chlamydomonas cells,
rophyll aI as indicator for proton uptake between
Biochim. Biophys. Acta Bioenerg.,
1863,
148909,
the light reactions in chloroplasts, Biochim. Bio-
doi: 10.1016/j.bbabio.2022.148909.
phys. Acta,
440,
506-521, doi:
10.1016/0005-2728
27.
Iwai, M., Takizawa, K., Tokutsu, R., Okamuro, A.,
(76)90038-4.
Takahashi, Y., and Minagawa, J. (2010) Isolation of the
38.
Tikhonov, A. N., Khomutov, G. B., and Ruuge, E. K.
elusive supercomplex that drives cyclic electron flow in
(1984) Electron transport control in chloroplasts.
photosynthesis, Nature, 464, 1210-1213, doi: 10.1038/
Effects of magnesium ions on the electron flow be-
nature08885.
tween two photosystems, Photobiochem. Photobiophys.,
28.
Munekage, Y., Hojo, M., Meurer, J., Endo, T.,
8, 261-269.
Tasaka, M., and Shikanai, T. (2002) PGR5 is in-
39.
Haehnel, W. (1984) Photosynthetic electron trans-
volved in cyclic electron flow around photosys-
port in higher plants, Annu. Rev. Plant Physiol., 35,
tem I and is essential for photoprotection in Arabi-
659-693, doi: 10.1146/annurev.pp.35.060184.003303.
dopsis, Cell, 110, 361-371, doi: 10.1016/S0092-8674
40.
Höhner, R., Pribil, M., Herbstová, M., Lopez, L. S.,
(02)00867-X.
Kunz, H.-H., Li, M., Wood, M., Svoboda, M.,
29.
DalCorso, G., Pesaresi, P., Masiero, S., Aseeva, E.,
Puthiyaveetil, S., Leister, L., and Kirchhoff, H. (2020)
Schünemann, D., Finazzi, G., Joliot, P., Barbato, R.,
Plastocyanin is the long-range electron carrier between
and Leister, D. (2008) A complex containing PGRL1
photosystem II and photosystem I in plants, Proc.
and PGR5 is involved in the switch between linear and
Natl. Acad. Sci. USA, 117, 15354-15362, doi: 10.1073/
cyclic electron flow in Arabidopsis, Cell, 132, 273-285,
pnas.2005832117.
doi: 10.1016/j.cell.2007.12.028.
41.
Tikhonov, A. N. (2013) pH-Dependent regulation of
30.
Buchert, F., Mosebach, L., Gäbelein, P., and
electron transport and ATP synthesis in chloroplasts,
Hippler, M. (2020) PGR5 is required for efficient
Photosynth. Res., 116, 511-534, doi: 10.1007/s11120-
Q cycle in the cytochrome b6f complex during
013-9845-y.
cyclic electron flow, Biochem. J., 477, 1631-1650,
42.
Berry, E. A., Guergova-Kuras, M., Huang, L. S.,
doi: 10.1042/BCJ20190914.
and Crofts, A. R. (2000) Structure and function of
31.
Strand, D. D., Fisher, N., and Kramer, D. M. (2016)
cytochrome bc complexes, Annu. Rev. Biochem., 69,
Distinct energetics and regulatory functions of the two
1005-1075, doi: 10.1146/annurev.biochem.69.1.1005.
major cyclic electron flow pathways in chloroplasts,
43.
Mitchell, P.
(1976) Possible molecular mecha-
in Chloroplasts: Current Research and Future Trends
nisms of the protonmotive function of cytochrome
(Kirchhoff Helmut, ed.) Norfolk: UK, Caister
systems, J. Theor. Biol., 62, 327-367, doi: 10.1016/
Academic Press, pp. 89-100.
0022-5193(76)90124-7.
32.
Shikanai, T. (2016) Chloroplast NDH: A different
44.
Cramer, W. A., Hasan, S. S., and Yamashita, E. (2011)
enzyme with a structure similar to that of respiratory
The Q cycle of cytochrome bc complexes: a structure
NADH dehydrogenase, Biochim. Biophys. Acta, 1857,
perspective, Biochim. Biophys. Acta, 1807, 788-802,
1015-1022, doi: 10.1016/j.bbabio.2015.10.013.
doi: 10.1016/j.bbabio.2011.02.006.
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1757
45.
Chow, W. S., and Hope, A. B. (2004) Kinetics of
Rev. Plant Biol., 66, 49-74, doi: 10.1146/annurev-
reactions around the cytochrome bf complex studied
arplant-043014-114744.
in intact leaf disks, Photosynth. Res., 81, 153-163,
57.
Lennon, A. M., Prommeenate, P., and Nixon, P. J.
doi: 10.1023/B:PRES.0000035027.02655.8c.
(2003) Location, expression and orientation of
46.
Ivanov, B. (1993) Stoichiometry of proton uptake by
the putative chlororespiratory enzymes, Ndh and
thylakoids during electron transport in chloroplasts,
IMMUTANS, in higher-plant plastids, Planta, 218,
in Photosynthesis: Photoreactions to Plant Productivity,
254-260, doi: 10.1007/s00425-003-1111-7.
Springer, Dordrecht, (Abrol, Y. P., Mohanty, P.,
58.
Ifuku, K., Endo, T., Shikanai, T., and Aro, E.-M.
and Govindjee, G., eds) pp. 108-128, doi: 10.1007/
(2011) Structure of the chloroplast NADH dehy-
978-94-011-2708-0_4.
drogenase-like complex: nomenclature for nuclear-
47.
Kirchhoff, H., Hall, C., Wood, M., Herbstová, M.,
encoded subunits, Plant Cell Physiol., 52, 1560-1568,
Tsabari, O., Nevo, R., Charuvi, D., Shimoni, E.,
doi: 10.1093/pcp/pcr098.
and Reich, Z. (2011) Dynamic control of protein
59.
Foyer, C. H., and Noctor, G. (2011) Ascorbate and
diffusion within the granal thylakoid lumen, Proc.
glutathione: the heart of the redox hub, Plant Physiol.,
Natl. Acad. Sci. USA, 108, 20248-20253, doi: 10.1073/
155, 2-18, doi: 10.1104/pp.110.167569.
pnas.1104141109.
60.
Anderson, J. M. (1982) Distribution of the cyto-
48.
Mehler, A. H. (1951) Studies on reactions of illu-
chromes of spinach chloroplasts between the ap-
minated chloroplasts: I. Mechanism of the reduc-
pressed membranes of grana stacks and stroma-ex-
tion of oxygen and other hill reagents, Arch. Bio-
posed thylakoid regions, FEBS Lett., 138, 62-66,
chem. Biophys., 33, 65-77, doi: 10.1016/0003-9861
doi: 10.1016/0014-5793(82)80395-5.
(51)90082-3.
61.
Vallon, O., Bulte, L., Dainese, P., Olive, J., Bassi, R.,
49.
Asada, K. (1999) The water-water cycle in chloroplasts:
and Wollman, F.-A. (1991) Lateral redistribution of
scavenging of active oxygens and dissipation of excess
cytochrome b6 /f complexes along thylakoid membranes
photons, Ann. Rev. Plant Physiol. Plant Mol. Biol.,
upon state transitions, Proc. Natl. Acad. Sci. USA,
50, 601-639, doi: 10.1146/annurev.arplant.50.1.601.
88, 8262-8266, doi: 10.1073/pnas.88.18.8262.
50.
Heber, U. (2002) Irrungen, Wirrungen? The Mehler
62.
Dumas, L., Chazaux, M., Peltier, G., Johnson, X.,
reaction in relation to cyclic electron transport in
and Alric, J. (2016) Cytochrome b6 f function and lo-
C3 plants, Photosynth. Res., 73, 223-231.
calization, phosphorylation state of thylakoid mem-
51.
Иванов Б., Хоробрых С., Козулева М., Борисова-
brane proteins and consequences on cyclic electron
Мубаракшина М. (2014) Роль кислорода и его
flow, Photosynth. Res., 129, 307-320, doi: 10.1007/
активных форм в фотосинтезе, Современные Про-
s11120-016-0298-y.
блемы Фотосинтеза (под ред. Аллахвердиева С.И.,
63.
Kirchhoff, H., Li, M., and Puthiyaveetil, S. (2017)
Рубина А.Б., Шувалова В.А.), Ижевский Ин-
Sublocalization of cytochrome b6 f complexes in pho-
ститут Компьютерных Исследований, Ижевск-
tosynthetic membranes, Trends Plant. Sci., 22, 574-
Москва, 1, 407-460.
582, doi: 10.1016/j.tplants.2017.04.004.
52.
Nixon, P. J. (2000) Chlororespiration. Philos. Trans.
64.
Kirchhoff, H., Horstmann, S., and Weis, E. (2000)
R. Soc. Lond. Ser. B Biol. Sci., 355, 1541-1547,
Control of the photosynthetic electron transport
doi: 10.1098/rstb.2000.0714.
by PQ diffusion in microdomains in thylakoids of
53.
Peltier, G., and Cournac, L. (2002) Chlororespiration,
higher plants, Biochim. Biophys. Acta, 1459, 148-168,
Annu. Rev. Plant Biol., 53, 523-550, doi: 10.1146/
doi: 10.1016/S0005-2728(00)00143-2.
annurev.arplant.53.100301.13524.
65.
Wood, W. H. J., MacGregor-Chatwin, C., Barnett,
54.
Joët, T., Genty, B., Josse, E.-M., Kuntz, M.,
S. F. H., Mayneord, G. E., Huang, X., Hobbs, J. K.,
Cournac, L., and Peltier, G. (2002) Involvement of
Hunter, C. N., and Johnson, M. P. (2018) Dynamic
a plastid terminal oxidase in plastoquinone oxidation
thylakoid stacking regulates the balance between
as evidenced by expression of the Arabidopsis thaliana
linear and cyclic photosynthetic electron transfer, Nat.
enzyme in tobacco, J. Biol. Chem., 277, 31623-31630,
Plants, 4, 116-127, doi: 10.1038/s41477-017-0092-7.
doi: 10.1074/jbc.M203538200.
66.
Hanke, G. T., Kimata-Ariga, Y., Taniguchi, I., and
55.
McDonald, A. E., Ivanov, A. G., Bode., R., Maxwell,
Hase, T. (2004) A post genomic characterization of
D. P., Rodermel, S. R., and Huner, N. P. A. (2011)
Arabidopsis ferredoxins, Plant Physiol., 134, 255-264,
Flexibility in photosynthetic electron transport:
doi: 10.1104/pp.103.032755.
The physiological role of plastoquinol terminal oxidase
67.
Hanke, G. T., and Hase, T. (2008) Variable photosyn-
(PTOX), Biochim. Biophys. Acta,
1807,
954-967,
thetic roles of two leaf-type ferredoxins in Arabidopsis,
doi: 10.1016/j.bbabio.2010.10.024.
as revealed by RNA interference, Photochem. Photobiol.,
56.
Nawrocki, W. J., Tourasse, N. J., Taly, A.,
84, 1302-1309, doi: 10.1111/j.1751-1097.2008.00411.x.
Rappaport, F., and Wollman, F.-A. (2015) The plastid
68.
Blanco, N., Ceccoli, R., Dalla Via, M. V., Voss, I.,
terminal oxidase: its elusive function points to
Segretin, M. E., Bravo-Almonacid, F. F., Melzer, M.,
multiple contributions to plastid physiology, Annu.
Hajirezaei, M.-R., Scheibe, R., and Hanke, G. T.
БИОХИМИЯ том 88 вып. 10 2023
1
758
ТИХОНОВ
(2013) Expression of the minor isoform pea ferredoxin
81.
Link, T. A. (1997) The role of the “Rieske” iron sulfur
in tobacco alters photosynthetic electron partitioning
protein in the hydroquinone oxidation (Qp) site of the
and enhances cyclic electron flow, Plant Physiol., 161,
cytochrome bc1 complex: the “proton-gated affinity
866-879, doi: 10.1104/pp.112.211078.
change” mechanism, FEBS Lett.,
412,
257-264,
69.
Lehtimäki, N., Lintala, M., Allahverdiyeva, Y., Aro,
doi: 10.1016/S0014-5793(97)00772-2.
E. M., and Mulo, P. (2010) Drought stress-induced
82.
Zu, Y., Manon, M.-J., Couture, M. M.-J., Kolling,
upregulation of components involved in ferredoxin-
D. R. J., Crofts, A. R., Eltis, L. D., Fee, J. A, and
dependent cyclic electron transfer, J. Plant Physiol.,
Hirst, J. (2003) The reduction potentials of Rieske
167, 1018-1022, doi: 10.1016/j.jplph.2010.02.006.
clusters: the importance of the coupling between cou-
70.
Гинс В. К., Тихонов А. Н., Мухин Е. Н., Рууге
pling between oxidation state and histidine protonation
Э. К. (1982) Особенности функционирования двух
state, Biochemistry, 42, 12400-12408, doi: 10.1021/
молекулярных форм ферредоксина гороха в цепи
bi0350957.
электронного транспорта хлоропластов, Биохи-
83.
Crofts, A. R., Guergova-Kuras, M., Kuras, R.,
мия, 47, 1859-1866.
Ugulava, N., Li, J., and Hong, S. (2000) Proton-
71.
Gong, X.-S., Chung, S., and Fernandez-Velasco,
coupled electron transfer at the Qo site: What type of
J. G. (2001) Electron transfer and stability of the
mechanism can account for the high activation barrier?
cytochrome b6f complex in a small domain deletion
Biochim. Biophys. Acta, 1459, 456-466, doi: 10.1016/
mutant of cytochrome f, J. Biol. Chem., 276, 24365-
S0005-2728(00)00184-5.
24371, doi: 10.1074/jbc.M010721200.
84.
Zhu, J., Egawa, T., Yeh, S.-R., Yu, L., and Yu, C.-A.
72.
Yan, J., and Cramer, W. A. (2003) Functional insen-
(2007) Simultaneous reduction of iron-sulfur protein
sitivity of the cytochrome b6 f complex to structure
and cytochrome bL during ubiquinol oxidation in
changes in the hinge region of the Rieske iron-sul-
cytochrome bc1 complex, Proc. Natl. Acad, Sci. USA,
fur protein, J. Biol. Chem.,
278,
20925-20933,
104, 4864-4869, doi: 10.1073/pnas.0607812104.
doi: 10.1074/jbc.M212616200.
85.
Osyczka, A., Moser, C. C, and Dutton P. L. (2005)
73.
Rumberg, B., and Siggel, U. (1969) pH changes in the
Fixing the Q cycle, Trends. Biochem. Sci., 30, 176-182,
inner phase of the thylakoids during photosynthesis,
doi: 10.1016/j.tibs.2005.02.001.
Naturwissenschaften,
56,
130-132, doi:
10.1007/
86.
Ustynyuk, L. Yu., and Tikhonov, A. N.
(2018)
BF00601025.
The cytochrome b6 f complex: DFT modeling of the
74.
Tikhonov, A. N., Khomutov, G. B., Ruuge, E. K.,
first step of plastoquinol oxidation by the iron-sul-
and Blumenfeld, L. A. (1981) Electron transport con-
fur protein, J. Organomet. Chem.,
867,
290-299,
trol in chloroplasts. Effects of photosynthetic control
doi: 10.1016/j.jorganchem.2018.01.023.
monitored by the intrathylakoid pH, Biochem. Bio-
87.
Ustynyuk, L. Yu., and Tikhonov, A. N. (2022) Plas-
phys. Acta, 637, 321-333, doi: 10.1016/0005-2728(81)
toquinol oxidation: rate-limiting stage in the electron
90171-7.
transport chain of chloroplasts, Biochemistry (Moscow),
75.
Kramer, D. M., Sacksteder, C. A., and Cruz, J. A.
87, 1084-1097, doi: 10.1134/S0006297922100029.
(1999) How acidic is the lumen? Photosynth. Res., 60,
88.
Postila, P.A., Kaszuba,K., Sarewicz, M., Osyczka, A.,
151-163, doi: 10.1023/A:1006212014787.
Vattulainen, I., and Róg, T. (2013) Key role of water
76.
Тихонов А. Н. (2012) Энергетическая и регулятор-
in proton transfer at the Qo-site of the cytochrome bc1
ная роль протонного потенциала в хлоропластах,
complex predicted by atomistic molecular dynamics
Биохимия, 77, 1155-1176.
simulations, Biochim. Biophys. Acta, 1827, 761-768,
77.
Li, Z., Wakao, S., Fischer, B. B., and Niyogi, K. K.
doi: 10.1016/j.bbabio.2013.02.005.
(2009) Sensing and responding to excess light, Annu.
89.
Chance, B., and Williams, G. R. (1956) The respiratory
Rev. Plant Biol., 60, 239-260, doi: 10.1146/annurev.
chain and oxidative phosphorylation, Adv. Enzymol.,
arplant.58.032806.103844.
17, 65-134, doi: 10.1002/9780470122624.ch2.
78.
Demmig-Adams, B, Cohu, C. M., Muller, O., and
90.
Foyer, C. H., Neukermans, J., Queval, G.,
Adams, W. W. (2012) Modulation of photosynthetic
Noctor, G., and Harbinson, J. (2012) Photosynthetic
energy conversion efficiency in nature: from seconds
control of electron transport and the regulation of gene
to seasons, Photosynth. Res., 113, 75-88, doi: 10.1007/
expression, J. Exp. Bot., 63, 1637-1661, doi: 10.1093/
s11120-012-9761-6.
jxb/ers013.
79.
Horton, P. (2012) Optimization of light harvesting and
91.
Tikhonov, A. N., Agafonov, R. V., Grigor’ev, I. A.,
photoprotection: molecular mechanisms and physi-
Kirilyuk, I. A., Ptushenko, V. V., and Trubitsin, B. V.
ological consequences, Philos. Trans. R. Soc. Lond. B
(2008) Spin-probes designed for measuring the intra-
Biol. Sci., 367, 3455-3465, doi: 10.1098/rstb.2012.0069.
thylakoid pH in chloroplasts, Biochim. Biophys. Acta,
80.
Brandt, U. (1996) Bifurcated ubihydroquinone ox-
1777, 285-294, doi: 10.1016/j.bbabio.2007.12.002.
idation in the cytochrome bc1 complex by pro-
92.
Vershubskii, A. V., Trubitsin, B. V., Priklonskii, V. I.,
ton-gated charge transfer, FEBS Lett.,
387,
1-6,
and Tikhonov, A. N. (2017) Lateral heterogeneity of
doi: 10.1016/0014-5793(96)00436-X.
the proton potential along the thylakoid membranes
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОННЫЙ ТРАНСПОРТ В ХЛОРОПЛАСТАХ
1759
of chloroplasts, Biochim. Biophys. Acta, 1859, 388-401,
Biochim. Biophys. Acta, 1807, 336-347, doi: 10.1016/
doi: 10.1016/j.bbamem.2016.11.016.
j.bbabio.2010.12.012.
93. Buchanan, B. B. (1984) The ferredoxin/thioredoxin
105. Tikhonov, A. N., and Subczynski, W. K.
(2019)
system: a key element in the regulatory function of
Oxygenic photosynthesis: EPR study of photosynthetic
light in photosynthesis, Bioscience,
34,
378-383,
electron transport and oxygen-exchange, an overview,
doi: 10.2307/1309730.
Cell Biochem. Biophys.,
77,
47-59, doi:
10.1007/
94. Dietz, K. J. (2003) Redox control, redox signaling and
s12013-018-0861-6.
redox homeostasis in plant cells, Int. Rev. Cytol., 228,
106. Trubitsin, B. V., Ptushenko, V. V., Koksharova, O. A.,
141-193, doi: 10.1016/S0074-7696(03)28004-9.
Mamedov, M. D., Vitukhnovskaya, L. A., Grigor’ev,
95. Selinski, J., and Scheibe, R. (2019) Malate valves:
I. A., Semenov, A. Yu., and Tikhonov, A. N. (2005)
old shuttles with new perspectives, Plant Biol.,
EPR study of electron transport in the cyanobacterium
21 (Suppl. 1), 21-30, doi: 10.1111/plb12869.
Synechocystis sp. PCC 6803: Oxygen-dependent inter-
96. Scheibe, R. (2019) Maintaining homeostasis by con-
relations between photosynthetic and respiratory elec-
trolled alternatives for energy distribution in plant cells
tron transport chains, Biochim. Biophys. Acta, 1708,
under changing conditions of supply and demand,
238-249, doi: 10.1016/j.bbabio.2005.03.004.
Photosynth. Res., 139, 81-91, doi: 10.1007/s11120-
107. Baniulis, D., Hasan, S. S., Stofleth, J. T., and Cramer,
018-0583-z.
W. A. (2013) Mechanism of enhanced superoxide
97. Tikhonov, A. N. (2015) Induction events and short-
production in the cytochrome b6 f complex of oxy-
term regulation of electron transport in chloroplasts:
genic photosynthesis, Biochemistry, 52, 8975-8983,
An overview, Photosynth Res., 125, 65-94, doi: 10.1007/
doi: 10.1021/bi4013534.
s11120-015-0094-0.
108. Иванов Б. Н. (2008) Кооперация Фотосистемы 1
98. Trubitsin, B. V., Vershubskii, A. V., Priklonskii, V. I.,
и пула пластохинона в восстановлении кисло-
and Tikhonov, A. N. (2015) Short-term regulation and
рода в хлоропластах высших растений, Биохимия,
alternative pathways of photosynthetic electron trans-
73, 137-144.
port in Hibiscus rosa-sinensis leaves, J. Photochem.
109. Ivanov, B., Borisova-Mubarakshina, M., Vilyanen, D.,
Photobiol. B, 152, 400-415, doi: 10.1016/j.jphotobiol.
Vetoshkina, D., Kozuleva, M. (2022) Cooperative
2015.07.015.
pathway of O2 reduction to H2O2 in chloroplast thyla-
99. Kozuleva, M. A., Petrova, A. A., Mamedov, M. D.,
koid membrane: new insight into the Mehler reac-
Semenov, A. Y., and Ivanov, B. N. (2014) O2 reduc-
tion, Biophys. Rev., 14, 857-869, doi: 10.1007/s12551-
tion by photosystem I involves phylloquinone under
022-00980-4.
steady-state illumination, FEBS Lett., 588, 4364-4368,
110. Ligeza, A., Tikhonov, A. N., Hyde, J. S., and
doi: 10.1016/j.febslet.2014.10.003.
Subczynski, W. K. (1998) Oxygen permeability of
100. Kozuleva, M. A., and Ivanov, B. N. (2016) The mech-
thylakoid membranes: electron paramagnetic res-
anisms of oxygen reduction in the terminal re-
onance spin labeling study, Biochim. Biophys. Acta,
ducing segment of the chloroplast photosynthet-
1365, 453-463, doi: 10.1016/S0005-2728(98)00098-X.
ic electron transport chain, Plant Cell Physiol., 57,
111. Ligeza, A., Tikhonov, A. N., and Subczynski, W. K.
1397-1404, doi: 10.1093/pcp/pcw035.
(1997) In situ measurements of oxygen production
101. Cherepanov, D. A., Milanovsky, G. E., Petrova, A. A.,
and consumption using paramagnetic fusinite particles
Tikhonov, A. N., Semenov, A. Yu. (2017) Electron
injected into a bean leaf, Biochim. Biophys. Acta, 1319,
transfer through the acceptor side of Photosystem I:
133-137, doi: 10.1016/S0005-2728(96)00122-3.
Interaction with exogenous acceptors and molecu-
112. Rutherford, A. W., Osyczka, A., and Rappaport, F.
lar oxygen, Biochemistry (Moscow), 82, 1249-1268,
(2012) Back-reactions, short-circuits, leaks and other
doi: 10.1134/S0006297917110037.
energy wasteful reactions in biological electron trans-
102. Kozuleva, M. A., and Ivanov, B. N. (2010) Evaluation
fer: Redox tuning to survive life in O2, FEBS Lett.,
of the participation of ferredoxin in oxygen reduction
586, 603-616, doi: 10.1016/j.febslet.2011.12.039.
in the photosynthetic electron transport chain of
113. Foyer, C., Rowell, J., and Walker, D. (1983) Measure-
isolated pea thylakoids, Photosynth. Res., 105, 51-61,
ment of the ascorbate content of spinach leaves pro-
doi: 10.1007/s11120-010-9565-5.
toplasts and chloroplasts during illumination, Planta,
103. Кувыкин И. В., Вершубский А. В., Птушенко
157, 239-244, doi: 10.1007/BF00405188.
В. В., Тихонов А. Н. (2008) Кислород как альтер-
114. Law, M. Y., Charles, S. A., and Halliwell, B. (1983)
нативный акцептор в фотосинтетической цепи
Glutathione and ascorbic acid in spinach (Spinacia
электронного транспорта С3-растений, Биохимия,
oleracea) chloroplasts. The effect of hydrogen per-
73, 1329-1343.
oxide and of paraquat, Biochem. J., 210, 899-903,
104. Kuvykin, I. V., Ptushenko, V. V., Vershubskii, A. V.,
doi: 10.1042/bj2100899.
and Tikhonov, A. N. (2011) Regulation of electron
115. Smirnoff, N. (1996) The function and metabolism
transport in C3 plant chloroplasts in situ and in silico.
of ascorbic acid in plants, Ann. Bot., 78, 661-669,
Short-term effects of atmospheric CO2 and O2,
doi: 10.1006/anbo.1996.0175.
БИОХИМИЯ том 88 вып. 10 2023
1
760
ТИХОНОВ
116. Gest, N., Gautier, H., and Stevens, R.
(2013)
with photosystem I, Photosynth. Res., 122, 215-231,
Ascorbate as seen through plant evolution: the rise
doi: 10.1007/s11120-014-0023-7.
of a successful molecule? J. Exp. Bot., 64, 33-53,
123. Forti, G., and Ehrenheim, A. M. (1993) The role of
doi: 10.1093/jxb/ers297.
ascorbic acid in photosynthetic electron transport,
117. Eskling, M., Arvidsson, P.-O., and Akerlund, H.-E.
Biochim. Biophys. Acta, 1183, 408-412, doi: 10.1016/
(1997) The xanthophylls cycle, its regulation
0005-2728(93)90246-C.
and components, Physiol. Plant.,
100,
806-816,
124. Miyake, C., and Asada, K.
(1994) Ferredoxin-
doi: 10.1034/j.1399-3054.1997.1000407.x.
dependent photoreduction of monodehydroascor-
118. Eskling, M., and Akerlund, H.-E. (1998) Changes
bate radicals in spinach thylakoids, Plant Cell
in the quantities of violaxanthin deepoxidase,
Physiol., 35, 539-549, doi: 10.1093/oxfordjournals.
xanthophylls and ascorbate in spinach upon shift
pcp.a078628.
from low to high light, Photosynth. Res., 57, 41-50,
125. Mano, J., Ushimaru, T., and Asada, K. (1997) Ascor-
doi: 10.1023/A:1006015630167.
bate in thylakoids lumen as an endogenous electron
119. Müller-Moulé, P., Conclin, P. L., and Niyogy, K. K.
donor to photosystem II: protection of thylakoids
(2002) Ascorbate deficiency can limit violaxanthin
from photoinhibition and regeneration of ascorbate
de-epoxidase activity in vivo, Plant Physiol., 128,
in stroma by dehydroascorbate reductase, Photosynth.
970-977, doi: 10.1104/pp.010924.
Res., 53, 197-204.
120. Iyanagi, T, Yamazaki, I., and Anan, K.
(1985)
126. Tóth, S. Z., Puthur, J. T, Nagi, V., and Garab, G.
One-electron oxidation-reduction properties of
(2009)
Experimental evidence for ascorbate-
ascorbic acid, Biochim. Biophys. Acta, 806, 255-261,
dependent electron transport in leaves with inactive
doi: 10.1016/0005-2728(85)90103-3.
oxygen evolving complexes, Plant Physiol.,
149,
121. Mano, J., Hideg, E., and Asada, K. (2004) Ascorbate
1568-1578, doi: 10.1104/pp.108.132621.
in thylakoid lumen functions as an alternative
127. Tóth, S. Z., Nagi, V., Puthur, J. T., Kovács, L.,
electron donor to photosystem II and photosystem I,
and Garab, G.
(2011) The physiological role of
Arch. Biochim. Biophys., 429, 71-80, doi: 10.1016/
ascorbate as photosystem II electron donor: pro-
j.abb.2004.05.022.
tection against photoinactivation in heat-stressed
122. Trubitsin, B. V., Mamedov, M. D., Semenov, A. Yu.,
leaves, Plant Physiol., 156, 382-392, doi: 10.1104/
and Tikhonov, A. N. (2014) Interaction of ascorbate
pp.110.171918.
ELECTRON TRANSPORT IN CHLOROPLASTS: REGULATION
AND ALTERNATIVE PATHWAYS OF ELECTRON TRANSFER
Review
A. N. Tikhonov
Faculty of Physics, Lomonosov Moscow State University,
119991 Moscow, Russia; e-mail: an_tikhonov@mail.ru
This work represents an overview of electron transport regulation in chloroplasts as considered in the con-
text of structure-function organization of photosynthetic apparatus in plants. A basic focus of the article
is concentrated on a bifurcated oxidation of plastoquinol by the cytochrome b6 f complex, which repre-
sents the rate-limiting step of electron transfer between photosystems 2 and 1. Electron transport along
the chains of the noncyclic, cyclic and pseudocyclic electron flow, their relationships to generation of
the trans-thylakoid difference in electrochemical potentials of protons in chloroplasts, and the pH-
dependent mechanisms of regulation of the cytochrome b6f complex, are considered. Redox reactions with
the participation of molecular oxygen and ascorbate, the alternative mediators of electron transport in chlo-
roplasts, have also been discussed.
Keywords: photosynthesis, chloroplasts, electron transport, regulation
БИОХИМИЯ том 88 вып. 10 2023