БИОХИМИЯ, 2023, том 88, вып. 10, с. 1761 - 1774
УДК 577.352.4
ЭЛЕКТРИЧЕСКИЕ СИГНАЛЫ ПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ
И ИХ ВЛИЯНИЕ НА ФЛУОРЕСЦЕНЦИЮ ХЛОРОФИЛЛА
В ХЛОРОПЛАСТАХ Chara in vivo
© 2023 А.А. Булычев*, С.Ю. Шапигузов, А.В. Алова
Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: bulychev@biophys.msu.ru
Поступила в редакцию 31.05.2023
После доработки 30.06.2023
Принята к публикации 02.07.2023
Потенциалы действия растительных клеток участвуют в регуляции многих клеточных процессов,
включая фотосинтез и течение цитоплазмы. Возбудимые клетки харовых водорослей, находясь
в средах с повышенным содержанием K+, способны генерировать гиперполяризационные элек-
трические сигналы. Активный ответ плазмалеммы возникает при пропускании входящего элек-
трического тока, сравнимого по величине с природными токами, циркулирующими в освещенных
междоузлиях Chara. В литературе отсутствуют сведения о влиянии гиперполяризационных ответов
Chara на активность фотосинтеза. В данной работе показано, что гиперполяризационный сдвиг
мембранного потенциала клетки, вызывающий поток K+ в цитоплазму, сопровождается задер-
жанным снижением выхода фактической флуоресценции хлорофилла (F′) и максимального вы-
хода (Fm′) на фоновом свету с интенсивностью 12,5 мкмоль/м2⋅с. Переходные изменения F′ и Fm′
проявлялись только в освещенных клетках, что свидетельствует об их тесной связи с фотосинте-
тическим преобразованием энергии в хлоропластах. Пропускание входящего тока вызывало также
возрастание pH у поверхности клетки (pHo), что служит показателем высокой H+/OH--проводимо-
сти плазмалеммы и указывает на снижение pH цитоплазмы при поступлении в клетку протонов.
Сдвиги pHo проявлялись лишь в ответ на первый гиперполяризующий импульс, но исчезали при
повторной стимуляции, что свидетельствует о длительной инактивации H+/OH--проводимости
плазмалеммы. Подавление потоков H+ через плазмалемму не устраняло гиперполяризационные
ответы и анализируемые изменения флуоресценции хлорофилла. Результаты указывают на участие
потоков K+ между средой, цитоплазмой и стромой в изменениях состояния хлоропластов, выяв-
ляемых по динамике выхода флуоресценции F′ и Fm′.
КЛЮЧЕВЫЕ СЛОВА: Chara, электрические сигналы, гиперполяризация, K+-проводимость плазмалеммы,
изменения флуоресценции хлорофилла, транспорт H+, взаимодействия плазмалеммы и хлоропластов.
DOI: 10.31857/S0320972523100044, EDN: OSQNJB
ВВЕДЕНИЕ
транспорт электронов (ФТЭ), сопряженный
с переносом H+ и генерацией фотопотенциала.
Многие процессы растительной клет-
В лаборатории Л.А. Драчева был предложен
ки, такие как фотосинтез, передача сигна-
эффективный способ изучения электрогене-
лов и внутриклеточная регуляция, связаны с
за фототрофных бактерий c использовани-
изменением электрических потенциалов на
ем полимерных пленок и адсорбированных
плазмалемме и мембранах органелл. Возбу-
пигмент-белковых комплексов и хромато-
димые мембраны генерируют потенциалы дей-
форов [1]. Действие коротких вспышек по-
ствия в ответ на механическую, химическую
зволяло устранить ряд кинетических огра-
и электрическую стимуляцию. Мембраны ти-
ничений, таких как темновая инактивация
лакоидов осуществляют фотосинтетический акцепторного участка фотосистемы I (ФСI) и
Принятые сокращения: ГО - гиперполяризационный ответ; ИПВ - искусственная прудовая вода; КВ - кван-
товый выход переноса электронов; ПД - потенциал действия; ФТЭ - фотосинтетический транспорт электронов;
Фл - флуоресценция; ФС - фотосистема; ФСА - фотосинтетический аппарат; Хл - хлорофилл; NPQ - нефотохи-
мическое тушение; pHo - pH в примембранных слоях среды.
* Адресат для корреспонденции.
1761
4
1
762
БУЛЫЧЕВ и др.
замедление ФТЭ при повышении ΔpH в тила-
При этом возрастает ΔpH в тилакоидах, что
коидах. Вместе с тем лимитирующие факторы
усиливает NPQ и замедляет линейный поток
существенно влияют на ФТЭ в изолированных
электронов [12].
пластидах и хлоропластах целых клеток, моду-
Внутренняя мембрана оболочки хлоро-
лируя индукционные кривые мембранного
пластов содержит ионные каналы, проницае-
потенциала и флуоресценции (Фл) хлорофил-
мые для одно- и двухвалентных катионов,
ла (Хл) [2, 3]. В связи с этим понятен интерес
а также системы обменного транспорта K+/H+
к изучению путей регуляции ФТЭ in vivo, кото-
(KEA1/2) [13-15]. Важная роль ионного обме-
рые намного разнообразнее, чем в препаратах
на, опосредованного транспортерами KEA1/2,
тилакоидов и интактных пластид. Влияние
выявляется по нарушениям фотосинтеза при
электрических сигналов плазмалеммы на фо-
выращивании мутантных растений на средах
тосинтез представляет один из аспектов этой
с разным солевым составом. В опытах с выде-
проблемы.
ленными хлоропластами показано, что уда-
Метод импульсно модулированной микро-
ление K+ из наружной среды понижает pH
флуориметрии позволяет судить о квантовом
стромы и замедляет фотосинтетическое выде-
выходе фотореакции ФСII (КВ ФСII) и скоро-
ление О2 в связи с K+/H+-обменом [16]. Вместе
сти линейного ФТЭ на микроучастках клетки,
с тем остается неясным, сказываются ли воз-
а также следить за быстрыми изменениями
действия, повышающие уровень K+ в цито-
нефотохимического тушения (NPQ), которые
плазме и строме пластид, на функциональных
отражают величину ΔpH в тилакоидах. Иссле-
параметрах хлоропластов в краткосрочных
дования возбудимых клеток водоросли Chara
опытах in vivo.
выявили участие электрогенеза плазмалеммы
Электрическая активность клеток харовых
в регуляции потока электронов при фотосин-
водорослей не ограничена генерацией ПД.
тезе. Генерация потенциала действия (ПД) в
Стимуляция клеток входящим электрическим
освещенных клетках вызывала быстрое (~30 c)
током в средах с повышенным содержанием K+
снижение КВ ФСII с амплитудой до 50% от
вызывает активный гиперполяризационный
исходного уровня, а также возрастание NPQ
ответ (ГО), представленный немонотонными
на период до 15 мин [4, 5]. Очевидно, что со-
изменениями мембранного потенциала [17, 18].
став компонентов цитоплазмы (ионов и мета-
Важно отметить, что индуцирующие гиперпо-
болитов) весьма лабилен и зависит от состоя-
ляризацию токи сравнимы по величине с при-
ния ионных каналов плазмалеммы. Опыты с
родными круговыми электрическими токами
чередованием локального и общего освещения
освещенных клеток. Наблюдаемый в ходе ГО
клетки говорят о том, что пространственная
сдвиг мембранного потенциала обусловлен
неоднородность цитоплазмы, обусловленная
частичной инактивацией K+-проводимости, а
наличием фотосинтетически активных и неак-
также параллельным включением других мало
тивных зон, остается скрытой в стационарных
изученных электрогенных механизмов. Све-
условиях при регистрации Фл на заданном
дения о возможном влиянии ГО у харовых
участке клетки, но проявляется после обрати-
водорослей на Фл Хл в настоящее время от-
мой остановки циклоза при возбуждении [6].
сутствуют. Однако они представляют интерес,
Изменения состава цитоплазмы представ-
поскольку потоки ионов, связанные с этим
ляют лишь одно звено в цепи трансформации
сигналом плазмалеммы, кардинально отлича-
сигнала плазмалеммы до функциональных
ются от потоков, запускаемых при ПД. В ходе
проявлений на уровне хлоропластов. Важной
измерений ГО исследуемая часть клетки нахо-
стадией в каскаде событий является пере-
дится в среде с концентрацией K+ ~100 мМ
нос в строму из цитоплазмы агентов-посред-
и полностью деполяризована. Отрицательный
ников, к которым относятся прежде всего H+
сдвиг потенциала цитоплазмы при пропуска-
и Ca2+ [7, 8]. Влияние Ca2+ на Фл Хл опосре-
нии входящего тока заставляет K+ поступать
довано его действием на активность фермен-
внутрь в количествах, превышающих потоки
тов и сопутствующими сдвигами pH в стро-
других ионов. Это связано с высокой про-
ме и люмене. При генерации ПД в клетках
ницаемостью мембраны для K+ и высокой
растений уровень [Ca2+]цит повышается от 0,1
концентрацией K+ в среде. Благодаря транс-
до 10-40 мкМ [9]. Это способствует поступ-
портерам мембран оболочки накопление K+
лению Ca2+ в освещенные пластиды под влия-
в цитоплазме должно индуцировать поступле-
нием отрицательного потенциала стромы [10].
ние K+ в строму хлоропласта в обмен на уда-
Известно, что повышение
[Ca2+] в строме
ление H+ из стромы. В таком случае ГО может
подавляет реакции цикла Кальвина и потреб-
модулировать Фл хлоропластов при участии
ление в этих реакциях АТР и NADPH [11].
K+/H+-обмена через оболочку пластид.
БИОХИМИЯ том 88 вып. 10 2023
ФЛУОРЕСЦЕНЦИЯ КЛЕТОК Chara ПРИ ГИПЕРПОЛЯРИЗАЦИИ
1763
В данной работе изучено влияние электри-
ской изоляции отсеков. Площадь поверхности
ческих сигналов плазмалеммы Chara и Nitella
клетки Chara в центральной секции состав-
на Фл Хл как показатель состояния фото-
ляла примерно 0,1 см2. Раствор в центральном
синтетического аппарата (ФСА). Показано
отсеке контактировал с электродом сравнения
действие гиперполяризации на выход факти-
Ag/AgCl (площадь поверхности ~15 см2) через
ческой флуоресценции (F′) и максимальный
гибкий солевой мостик, заполненный раство-
выход (Fm′) на фоновом свету. Результаты вы-
ром 1 М KCl с добавлением 2% агара. Разность
являют связи между ГО плазмалеммы, пото-
потенциалов на плазмалемме измеряли с по-
ками H+ из среды в цитоплазму и параметра-
мощью капиллярных микропипеток из стек-
ми Фл хлоропластов, что расширяет сведения
ла пирекс. Измерения проводили в средней
о путях регуляции фотосинтеза при участии
части клетки, расположенной в центральном
электрической активности плазмалеммы.
отсеке. Разность потенциалов регистрировали
электрометрическим усилителем У5-9 («НПО
им. В.И. Ленина», Минск, СССР); напряже-
МАТЕРИАЛЫ И МЕТОДЫ
ние c выхода усилителя поступало на ана-
лого-цифровой преобразователь (PCI-6024E,
Опыты проводили на клетках междоуз-
«National Instruments», США) и монитор ком-
лий харовых водорослей Chara australis R. Br.
пьютера.
и Nitella translucens (Pers.) C.Agardh. Культуры
В боковых отсеках камеры находились со-
были получены из лаборатории профессора
единенные между собой электроды Ag/AgCl,
Ilse Foissner (University of Salzburg). Водоросли
к которым через нагрузочное сопротивление
выращивали в стеклянных сосудах при ком-
1,2 МОм прикладывали командное напря-
натном освещении. Интернодальные клетки
жение от АЦП (PCI-6024E) для пропуска-
длиной 40-50 мм и диаметром 0,9 мм и 0,3 мм
ния ступени тока. Сила тока варьировала от 3
(для Chara и Nitella соответственно) вырезали
до 8 мкА, что соответствовало плотности тока
из побега и помещали в искусственную пру-
от 30 до 80 мкА/см2 в центральной части
довую воду (ИПВ), содержащую 0,1 мМ KCl,
клетки Chara.
1 мМ NaCl и 0,1 мМ CaCl2. В подготовлен-
Флуоресценцию Хл измеряли на участках
ный раствор вносили NaHCO3 для доведения
клеток диаметром ~100 мкм. Выход фактиче-
pH до 7,0. Изолированные клетки выдержи-
ской флуоресценции F′ при фоновом освеще-
вали в ИПВ не менее суток после их отделения
нии клетки измеряли с помощью модулиро-
от примыкающих междоузлий.
ванного синего света, излучаемого светодиодом
Закончившие рост междоузлия Chara струк-
устройства Microscopy-PAM («Walz», Германия).
турно неоднородны. В цитоплазме по длине
междоузлия чередуются области с высоким и
низким содержанием харасом - особых орга-
нелл с высоким содержанием H+-ATPазы,
способствующих поступлению в клетки суб-
страта фотосинтеза (СО2) [19]. Неоднородные
свойства проявляются также в чередовании
вдоль оси кальцинированных и свободных от
кристаллов областей на поверхности клетки.
Кальцинированные области, как правило, рас-
полагаются в участках с низкой активностью
фотосинтеза и высоким pH в примембранных
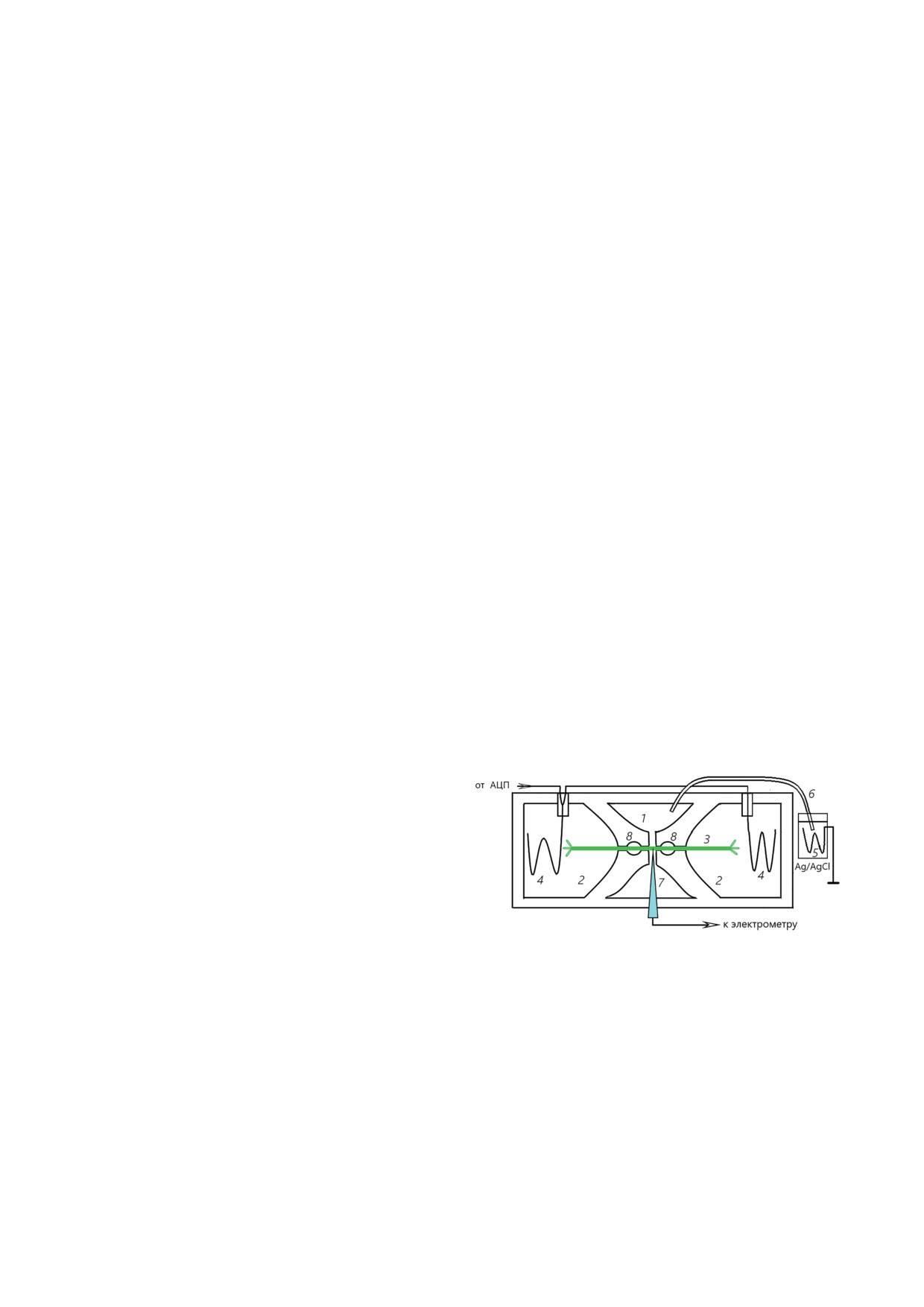
Рис. 1. Схема расположения интернодальной клетки
и электродов в трехсекционной экспериментальной
слоях среды. Измерения Фл хлоропластов и
камере. 1 - Центральный отсек, заполненный средой
мембранного потенциала плазмалеммы прово-
с повышенной концентрацией KCl; 2 - боковые отсеки,
дили в некальцинированных или слабо кальци-
заполненные искусственной прудовой водой; 3 - интер-
нированных участках клеток.
нодальная клетка водоросли Chara (Nitella); 4 - электро-
ды Ag/AgCl, используемые для пропускания электриче-
Интернодальную клетку укрепляли в
ского тока; 5 - электрод сравнения Ag/AgCl, общий для
трехсекционной прозрачной камере (рис. 1),
измерительной цепи и пути пропускания тока; 6 - гиб-
которую помещали на столик инвертирован-
кий солевой мостик; 7 - электродный микродатчик (ка-
ного микроскопа Axiovert
25-CFL
(«Zeiss»,
пиллярный внутриклеточный электрод для измерения
мембранного потенциала плазмалеммы или pH-чувстви-
Германия), оснащенного микрофлуориметром
тельный внеклеточный микроэлектрод для измерения
Microscopy-PAM («Walz», Германия). Между
локальных сдвигов pH на поверхности клетки); 8 - воз-
секциями камеры имелись воздушные полости
душные полости, обеспечивающие электрическую изо-
диаметром 4 мм, служившие для электриче-
ляцию между центральным и боковыми отсеками
БИОХИМИЯ том 88 вып. 10 2023
4*
1
764
БУЛЫЧЕВ и др.
Вспышки измерительного света длительностью
кривые сдвигов F′ со стандартными ошибками
5 мкс следовали с частотой 24 Гц. Длительность
представлены с указанием общего числа изме-
насыщающих вспышек, создаваемых тем же
рений (n) на разных клетках (N). Для усредне-
светодиодом, составляла 800 мс. Перед вход-
ния значений F′, полученных на разных клет-
ным окном фотоумножителя был расположен
ках, кинетические кривые нормировали на
красный светофильтр RG645 толщиной 2 мм
средние уровни флуоресценции в интервале
(«Schott», Германия). Подробное описание
времени 0-25 с, регистрируемые до приложе-
устройства Microscopy-PAM можно найти на
ния импульса тока. Усредненная кинетика Fm′
для разных клеток получена после нормирова-
downloads.html); особенности измерения вы-
ния значений Fm′ в ответ на первый насыщаю-
хода флуоресценции хлорофилла на одиноч-
щий импульс в серии из 30 вспышек.
ных клетках описаны в работе Goh et al. [20].
Общее фоновое освещение клетки создавали
верхним осветителем микроскопа, свет от ко-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
торого проходил через сине-зеленый (СЗС-22,
λ < 580 нм) и нейтральный (НС-3) светофиль-
Мембранный потенциал освещенных клеток
тры. Интенсивность фоновой подсветки со-
Chara в стандартных условиях (клетки, омы-
ставляла 12,5 мкмоль квантов/м2⋅с. Эффек-
ваемые ИПВ) составлял от -170 до -210 мВ.
тивный КВ переноса электронов в ФСII нахо-
Стимуляция клетки деполяризующим импуль-
дили с помощью насыщающих световых им-
сом тока (2 мкА, 150 мс) вызывала генерацию
пульсов и программы WinControl-3 («Walz»,
потенциала действия с амплитудой до 200 мВ,
Германия). Значения КВ ФСII (YII) на фоно-
которая сопровождалась кратковременной оста-
вом свету в контрольных условиях составляли
новкой течения цитоплазмы и его возобновле-
0,7-0,745. Выходной сигнал ФЭУ обрабаты-
нием за время ~5 мин при температуре 25 °C.
вали в программах WinControl-3 и WinWCP
Влияние света и течения цитоплазмы на
(«Strathclyde Electrophysiology», Великобрита-
гиперполяризационый ответ плазмалеммы. Из-
ния) и выводили на монитор компьютера.
мерения характерных значений мембранного
Влияние гиперполяризационного ответа
потенциала в покое и при возбуждении в на-
на максимальный выход флуоресценции Fm′
чале каждого опыта, а также регистрация эф-
изучали с применением насыщающих свето-
фективного квантового выхода переноса элек-
вых импульсов, разделенных интервалами 10 с.
тронов в реакции ФСII на уровне 0,7-0,745
Включение серии насыщающих импульсов
служили показателем адекватного физиологи-
обычно сопровождалось заметным снижением
ческого состояния клетки. После замены ИПВ
амплитуды Fm′. В связи с этим клетку стиму-
в центральном отсеке камеры на аналогичный
лировали ступенчатым импульсом тока после
раствор с высоким содержанием KCl (0,1 М)
замедления вызванного вспышками паде-
пропускание стандартного надпорогового им-
ния Fm′.
пульса тока вызывало скачкообразную депо-
Величину pH у поверхности клетки (pHo)
ляризацию клетки до уровня мембранного
измеряли с помощью H+-специфичных сурь-
потенциала ~ 0 мВ. Это состояние характери-
мяных микроэлектродов в стеклянной изоля-
зуется высокой K+-проводимостью плазмалем-
ции и электрометрического усилителя У5-9 [4].
мы [21] и мембранным потенциалом, соответ-
При обработке исходных показаний микродат-
ствующим нулевому равновесному нернстов-
чика pH вычитали постоянное падение напря-
скому потенциалу.
жения, создаваемое током на последователь-
Последующее пропускание прямоуголь-
ном сопротивлении среды, солевого мостика
ного импульса входящего тока (плотность
и электрода сравнения.
тока 30-80 мкА/см2, длительность импульса
В работе использовали раствор цитохала-
50-75 с) сопровождалось генерацией актив-
зина D («Sigma», США) в диметилсульфокси-
ного гиперполяризационного ответа (рис. 2).
де (ДМСО), который разводили до конечной
Развитие ГО характеризуется ускоряющимся
концентрации 10-20 мкМ. Конечная концен-
нарастанием отрицательного потенциала ци-
трация ДМСО не превышала 0,2%. В данной
топлазмы, которое завершается острым спай-
концентрации ДМСО не оказывает влияния
ком и последующей небольшой деполяризаци-
на параметры Фл Хл, мембранный потенциал
ей мембраны [22]. При равных концентрациях
и скорость движения цитоплазмы.
K+ в среде и цитоплазме (~100 мМ) отрица-
На рисунках приведены результаты типич-
тельный сдвиг мембранного потенциала за-
ных опытов, выполненных не менее чем на
ставляет ионы K+ поступать в клетку в связи
четырех клетках. Усредненные кинетические
с высокой K+-проводимостью мембраны.
БИОХИМИЯ том 88 вып. 10 2023
ФЛУОРЕСЦЕНЦИЯ КЛЕТОК Chara ПРИ ГИПЕРПОЛЯРИЗАЦИИ
1765
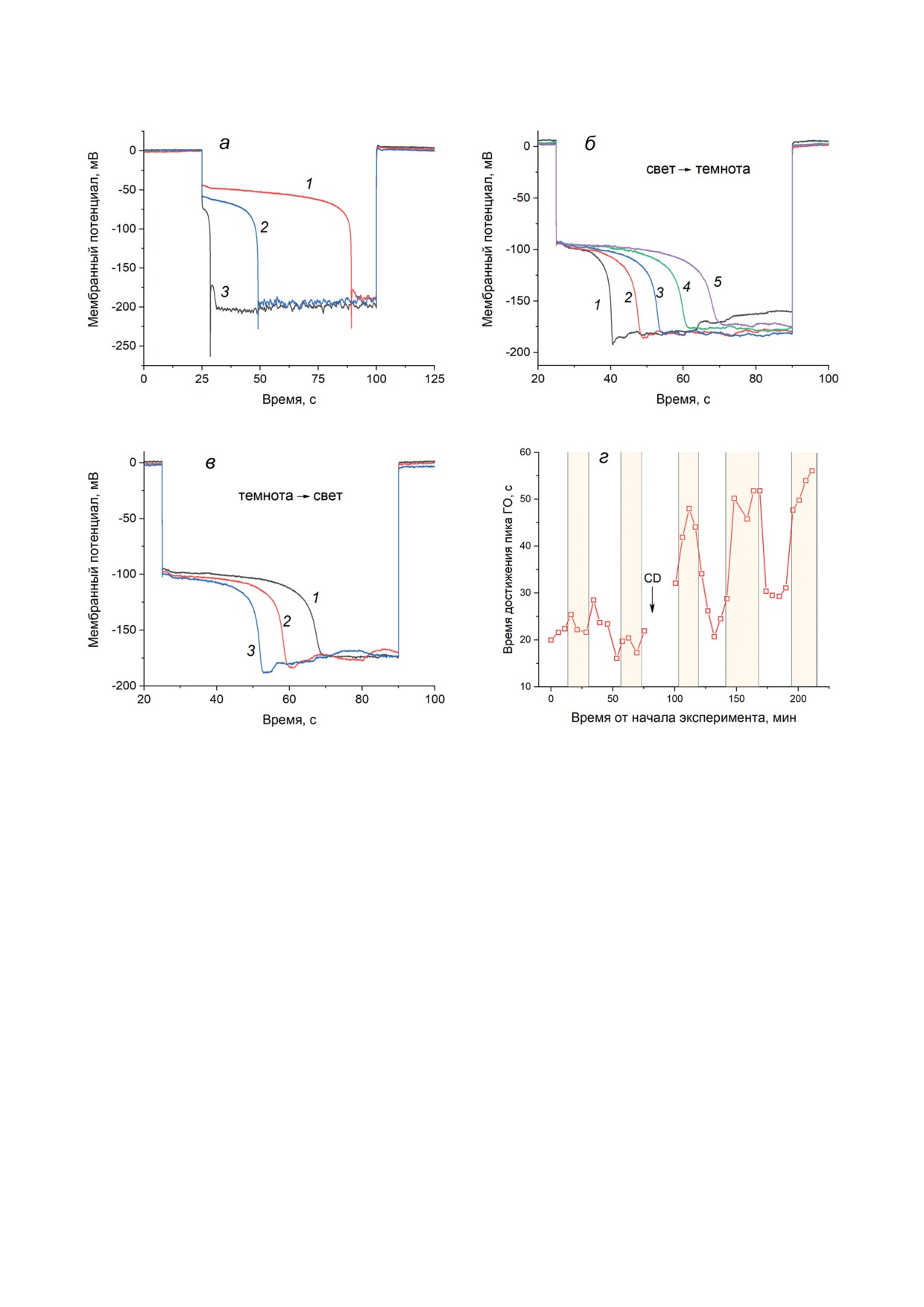
Рис. 2. Гиперполяризационные ответы (ГО) клеток Chara, вызываемые пропусканием входящего электрическо-
го тока в присутствии 0,1 М KCl в среде. а - Кинетические кривые ГО при разной плотности электрического тока:
33 мкА/см2 (1); 45 мкА/см2 (2); 50 мкА/см2 (3). б - Кинетические кривые ГО, наблюдаемые в присутствии 20 мкМ ци-
тохалазина D после переноса клетки в темноту: на фоновом свету (плотность потока квантов - 12,5 мкмоль/м2⋅с) (1);
через 0,5, 5, 10 и 15 мин после выключения фонового освещения (2-5 соответственно). в - Кинетические кривые
ГО той же клетки в присутствии цитохалазина D после перехода от темноты к освещению через 0,5, 5 и 10 мин по-
сле включения света (1-3 соответственно). Плотность электрического тока в период импульса на панелях (б) и (в)
составила 33 мкА/см2. г - Влияние смены световых условий на время достижения пика ГО от момента включения
входящего тока в отсутствие ингибиторов и после подавления циклоза 20 мкМ цитохалазином D (CD). Момент внесе-
ния CD отмечен стрелкой. Вертикальные светлые и затененные полосы отмечают периоды освещения и затемнения
клетки соответственно; плотность тока в период импульсов - 58 мкА/см2
Время достижения пиковой гиперполяри-
и ссылки в ней). В наших опытах внесение в
зации сокращалось с повышением плотности
среду 20 мкМ цитохалазина D вызывало оста-
входящего тока (рис. 2, а). При этом стацио-
новку течения цитоплазмы. В присутствии ин-
нарный потенциал, наблюдаемый после спай-
гибитора кинетические кривые ГО при посто-
ка, слабо зависел от плотности тока. Стадии
янной плотности тока существенно зависели
пиковой гиперполяризации и последующей
от освещения клетки (рис. 2, б и в).
быстрой деполяризации заметно сглаживались
При затемнении клетки время дости-
при обработке клеток цитохалазином D, инги-
жения спайка возрастало в течение ~20 мин
битором полимеризации актина (рис. 2, б и в).
(рис. 2, б), а при возобновлении освещения -
Сходное подавление этих стадий ранее наблю-
сокращалось (рис. 2, в). Интересно, что влия-
дали при действии цитохалазина B на поверх-
ние смены световых условий на ГО, наблю-
ностную мембрану изолированной капли ци-
даемое в присутствии цитохалазина D, не
топлазмы, не содержащей хлоропластов ([22]
проявлялось в контрольных условиях без до-
БИОХИМИЯ том 88 вып. 10 2023
1766
БУЛЫЧЕВ и др.
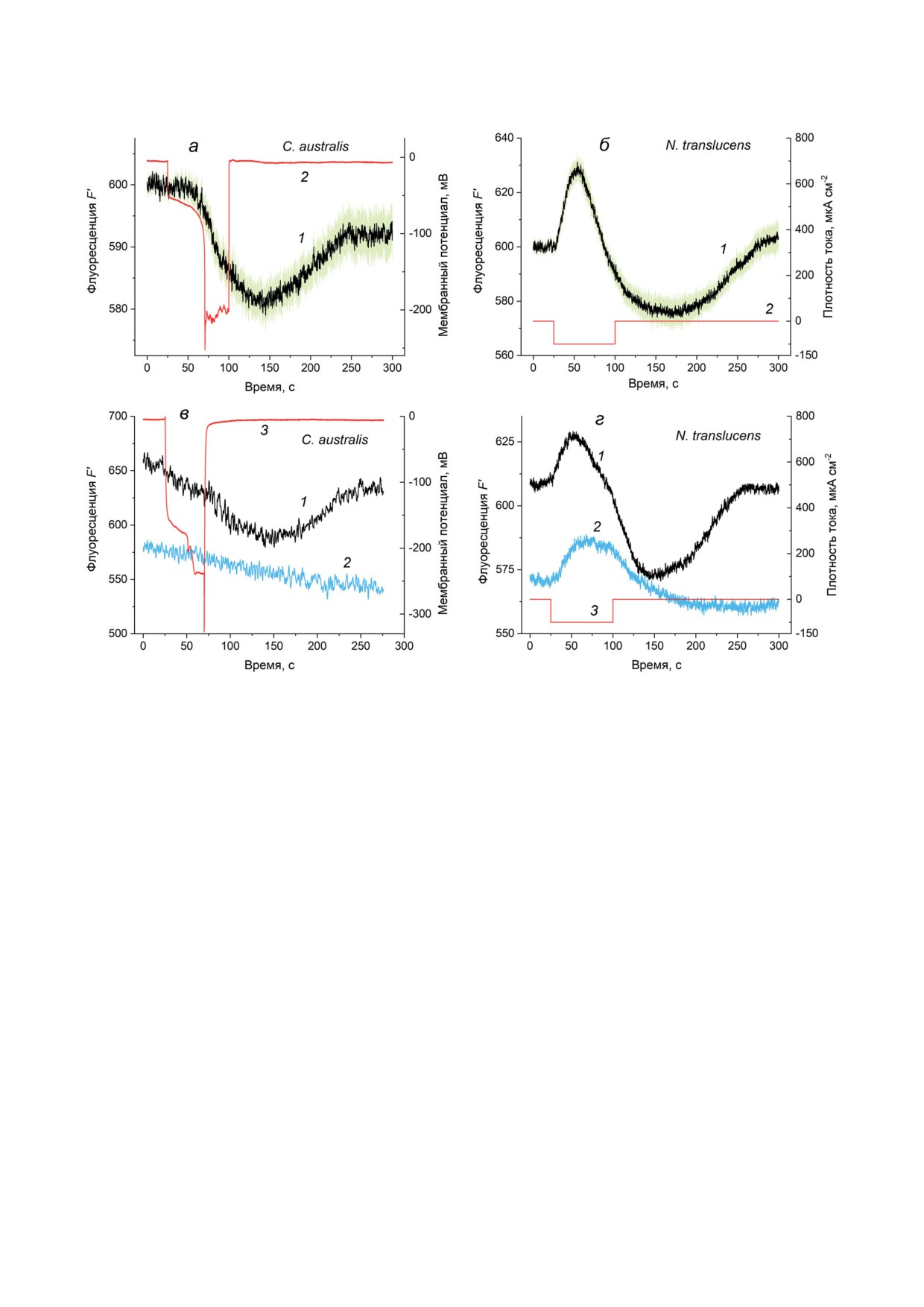
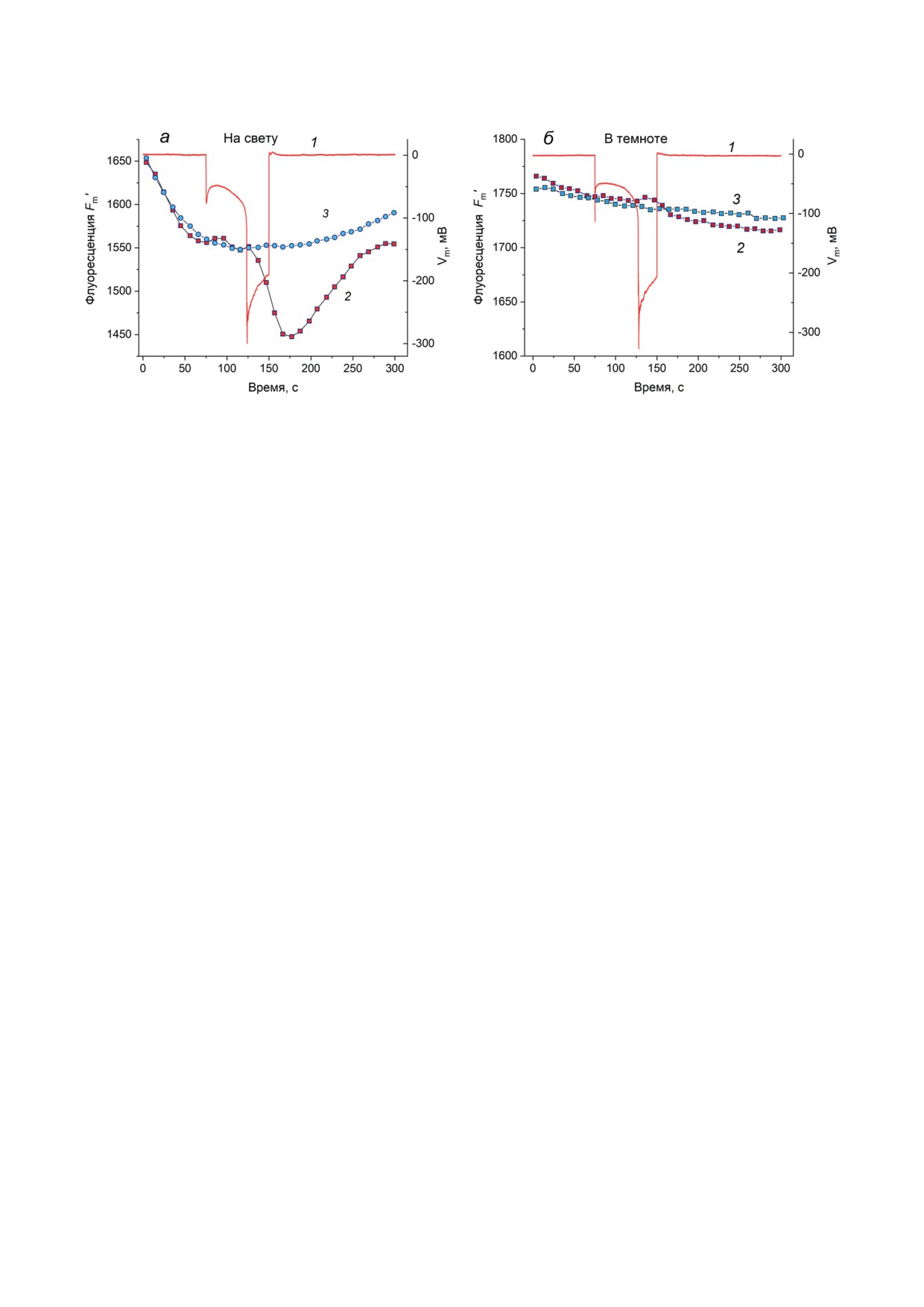
Рис. 3. Изменения флуоресценции хлорофилла F′, вызванные ступенью входящего электрического тока в клетках
водорослей Chara australis (а, в) и Nitella translucens (б, г). а - Динамика изменений F′ (1) и мембранного потенциа-
ла (2), вызванных пропусканием входящего тока. Изменения F′ (1, черная линия) представляют усредненную запись
(n = 45, N = 9) на фоне стандартной ошибки среднего. Кривая 2 отражает изменения мембранного потенциала,
вызванные импульсом тока с плотностью 35 мкА/см2. б - Изменения Фл Хл в клетках N. translucens (кривая 1), вы-
званные импульсом входящего тока плотностью 100 мкА/см2 (кривая 2). Усредненная динамика значений F′ пред-
ставлена на фоне стандартной ошибки (n = 11, N = 4). в и г - Зависимость индуцируемого гиперполяризацией сни-
жения F′ от световых условий в опытах с клетками C. australis и N. translucens (n = 9-11). 1 - Изменения F′ на свету;
2 - изменения F′ в темноте. Кривая 3 на панели (в) показывает изменения напряжения в период ГО, а на панели (г) -
плотность тока на центральном участке клетки
бавления этого ингибитора. Как видно из
Влияние гиперполяризационного ответа на
рис. 2, г, времена достижения пика ГО на свету
выход флуоресценции F′. Наибольший инте-
и в темноте примерно совпадали при нормаль-
рес представляло возможное влияние ГО на
ном течении цитоплазмы, но существенно раз-
параметры Фл Хл, которые отражают редокс-
личались при подавлении циклоза цитохала-
состояние фотосинтетической электрон-транс-
зином D.
портной цепи и энергозависимую диссипацию
Таким образом, хлоропласты оказывают
возбужденных состояний (NPQ). Создание
влияние на ионные каналы плазмалеммы при
движущей силы для потока K+ из среды в ци-
нарушениях актинового цитоскелета. Перехо-
топлазму при отрицательном смещении мем-
ды «свет-темнота», вероятно, модифицируют
бранного потенциала плазмалеммы должно
состав цитоплазмы, что сказывается на со-
сопровождаться накоплением K+ в цитоплаз-
стоянии каналов плазмалеммы, участвующих
ме, что, в свою очередь, может индуцировать
в генерации ГО. Однако это влияние ниве-
K+/H+-обмен через оболочку хлоропластов и
лируется при активном течении цитоплазмы,
оказывать влияние на флуоресценцию хлоро-
которое сглаживает состав цитоплазмы ме-
пластов.
жду частями клетки с разной активностью
На рис. 3, а и б показаны изменения выхо-
фотосинтеза.
да флуоресценции F′, индуцируемые импуль-
БИОХИМИЯ том 88 вып. 10 2023
ФЛУОРЕСЦЕНЦИЯ КЛЕТОК Chara ПРИ ГИПЕРПОЛЯРИЗАЦИИ
1767
сом входящего тока в клетках водорослей
Chara australis и Nitella translucens, помещен-
ных на фоновый свет низкой интенсивности
(12,5 мкмоль/м2⋅с). У обоих видов измене-
ния F′ включали задержанную стадию сниже-
ния выхода Фл, которая начиналась примерно
через 25 с от момента приложения импульса
тока и продолжалась в течение ~50 с после
завершения ГО.
В клетках N. translucens снижению F′ пред-
шествовала стадия возрастания Фл, которая
начиналась с первых секунд после приложения
импульса тока. У клеток C. australis иногда на-
блюдали возрастание F′, предшествующее сни-
жению F′, однако эта стадия не проявлялась
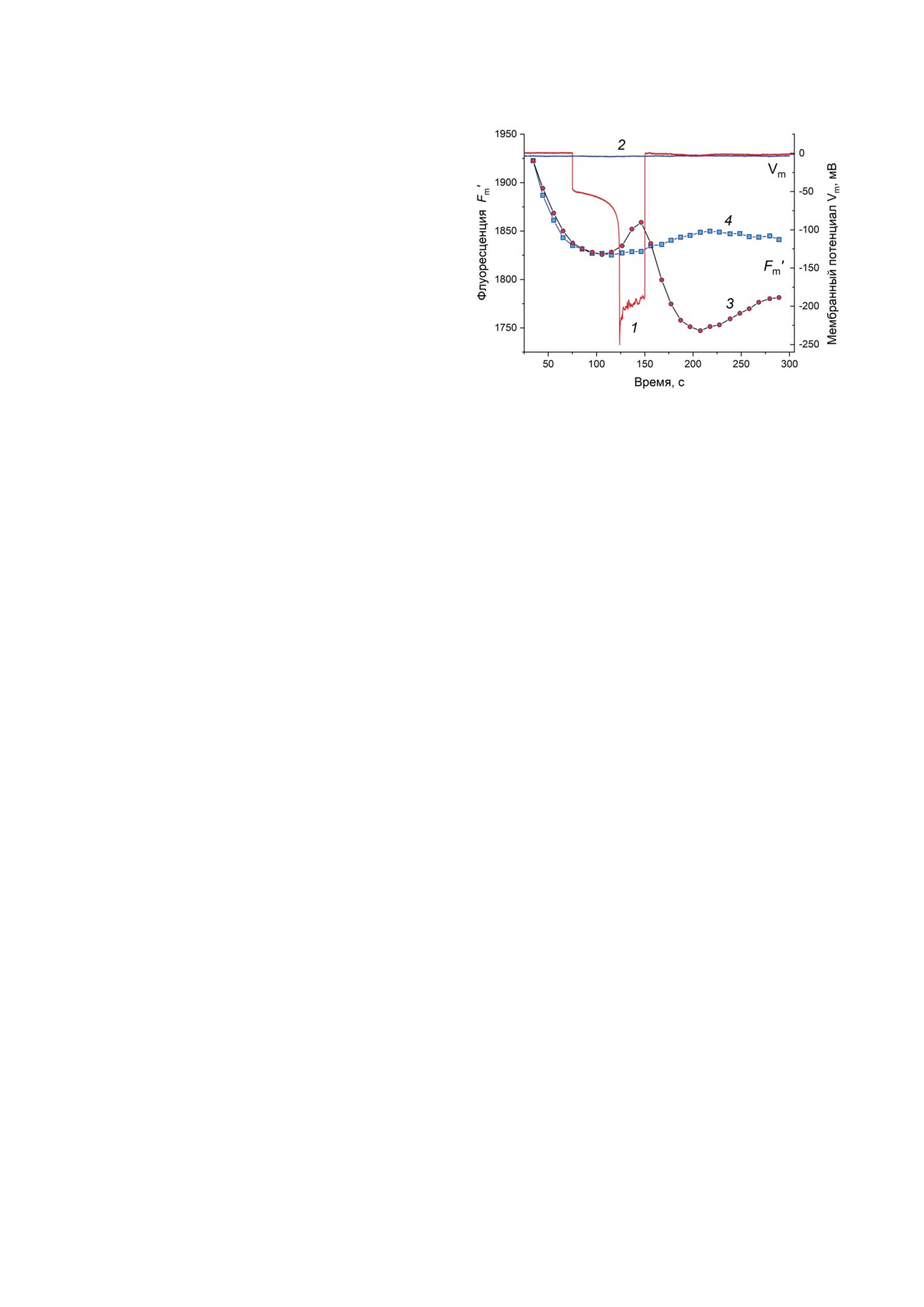
Рис. 4. Гиперполяризационный ответ плазматической
на усредненных записях. Появление противо-
мембраны в K+-проводящем состоянии и его влияние на
положно направленных изменений F′, связан-
флуоресценцию Fm′. Гиперполяризацию плазмалеммы
ных с ГО, указывает на протекание несколь-
(кривая 1) индуцировали пропусканием импульса вхо-
ких процессов различной природы. Среди них
дящего тока (42 мкА/см2, длительность 75 с) при слабом
фоновом освещении (12,5 мкмоль/м2⋅с); в отсутствие
только медленные изменения F′ могут быть
электрической стимуляции мембранный потенциал оста-
следствием K+/H+-обмена через мембранную
вался стабильно деполяризованным (кривая 2). Кривые
оболочку хлоропластов, поскольку высокая
с символами представляют изменения Fm′, наблюдаемые
концентрация K+ в цитоплазме (~100 мМ)
при генерации ГО (кривая 3), а также без индукции ГО
исключает ее быстрые изменения. Причины
(кривая 4). Монотонное снижение Fm′ на отрезке време-
ни t ≤ 75-100 c вызвано включением серии насыщающих
быстрого возрастания Фл в клетках N. trans-
световых импульсов. Кривые (3) и (4) получены в типич-
lucens на данный момент не ясны. Не исклю-
ном опыте при усреднении результатов по пяти изме-
чено, что протекание входящего тока связано
рениям для каждого варианта
с электроосмотическим поступлением воды в
цитоплазму и внешне неразличимым набуха-
нием пластид. Об этом косвенно говорит тот
товые импульсы, тестирующие Fm′, применяли
факт, что возрастание F′ проявлялось наибо-
либо в сочетании с электрической стимуляци-
лее отчетливо в клетках малого диаметра с
ей, либо без электростимуляции. Клетку по-
повышенным отношением площади поверх-
очередно подвергали нескольким циклам таких
ности к объему (N. translucens).
воздействий: записи с индукцией ГО чередо-
Стадию задержанного снижения флуорес-
вали с записями при стационарной деполяри-
ценции при генерации ГО наблюдали только
зации. Запуск насыщающих вспышек с интер-
на освещенных клетках C. australis и N. trans-
валами в 10 с часто сопровождался начальным
lucens; при помещении клеток в темноту раз-
снижением Fm′ (рис. 4, кривые 3 и 4; участки
витие ГО не вызывало таких изменений F′
при t ≤ 75 с). После замедления спада Fm′ (че-
(рис. 3, в и г). При этом стадия возрастания F′,
рез 75 с после начала записи) подавали ступень
отчетливо заметная у клеток N. translucens,
тока для индукции ГО плазмалеммы на иссле-
не зависела от условий освещения. Это под-
дуемом участке клетки (рис. 4, кривая 1). В тех
тверждает предположение о разной природе
же условиях без пропускания тока плазмалем-
изменений Фл различной полярности.
ма оставалась в деполяризованном состоянии
Влияние гиперполяризационного ответа
(рис. 4, кривая 2).
на выход флуоресценции Fm′. В междоузлиях
Как видно из рис. 4, кривые изменений Fm′
Chara, помещенных в стандартную ИПВ с кон-
(3) и (4) практически совпадали на начальном
центрацией K+ 0,1 мМ, значения Fm′ на слабом
участке (при t ≤ 75 с) - до индукции ГО. Вме-
свету приближались к наибольшему уровню,
сте с тем выявлено существенное расхождение
что означает отсутствие нефотохимического
записей при t > 100 c в зависимости от генера-
тушения. Вместе с тем замена ИПВ на среду с
ции или отсутствия ГО (рис. 4, кривые 3 и 4).
добавлением 0,1 М KCl приводила к заметному
В варианте опыта, когда плазмалемма оста-
снижению Fm′, т.е. к появлению NPQ. В связи
валась в деполяризованном состоянии, зна-
с этим мы изучили влияние гиперполяриза-
чения Fm′ выходили к постоянному уровню
ции плазмалеммы на уровень Fm′ как инди-
после сглаженного максимума (рис. 4, кри-
катор NPQ. На рис. 4 показаны результаты
вая 4). В случае индуцированной гиперполя-
типичного опыта, в котором насыщающие све-
ризации плазмалеммы наблюдали небольшое
БИОХИМИЯ том 88 вып. 10 2023
1768
БУЛЫЧЕВ и др.
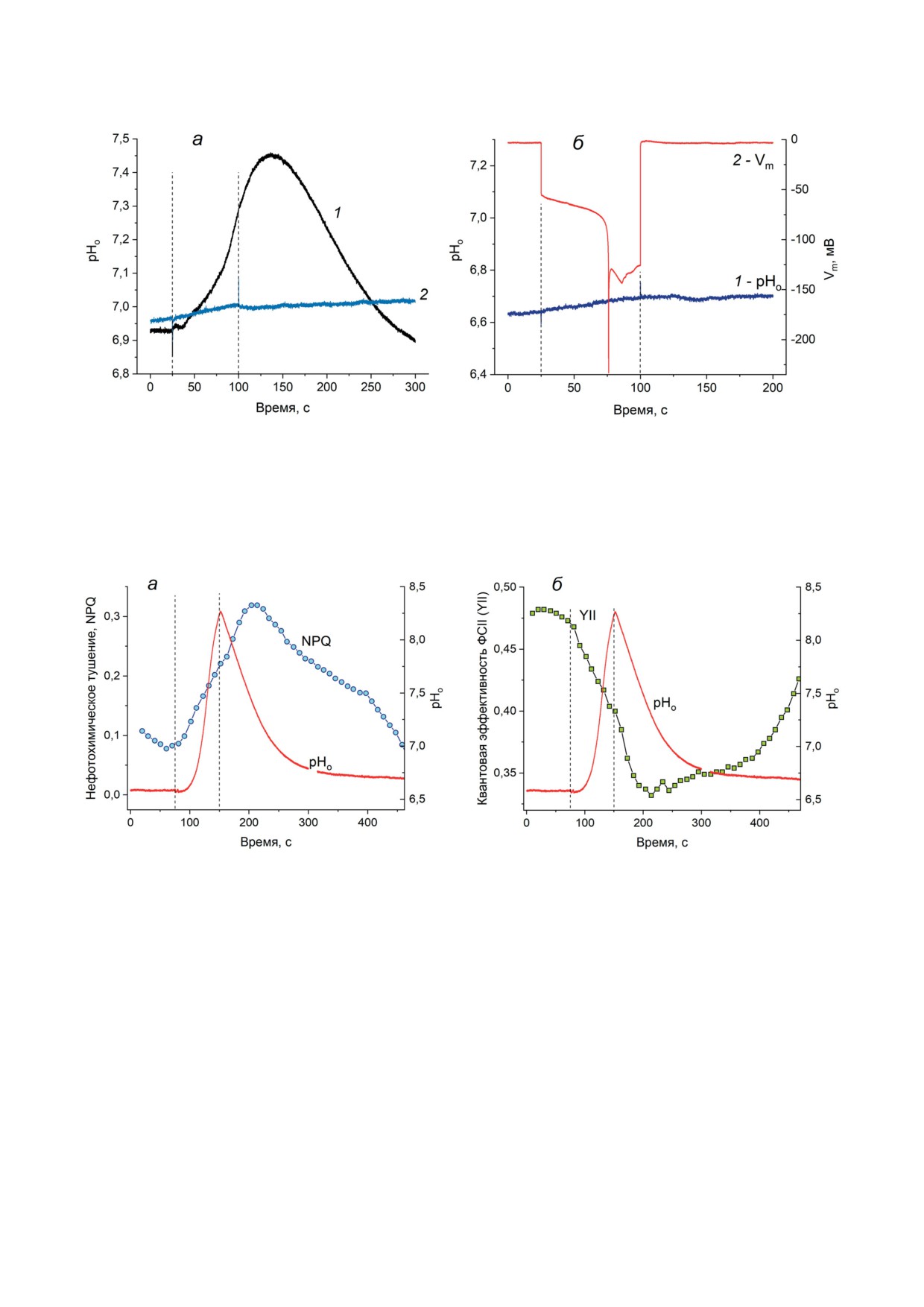
Рис. 5. Зависимость вызываемых гиперполяризацией изменений Fm′ от световых условий. а - Гиперполяризация плаз-
малеммы освещенных клеток вызывает задержанное снижение Fm′. б - Влияние гиперполяризации на Fm′ исчезает
после переноса клетки в темноту. 1 - Изменения мембранного потенциала, вызванные прямоугольным импульсом
тока (83 мкА/см2); 2 - изменения Fm′, вызываемые насыщающими световыми импульсами и генерацией ГО: на све-
ту (а) и в темноте (б). 3 - Изменения Fm′, вызываемые насыщающими световыми импульсами в покое (без электро-
стимуляции и индукции ГО). Записи кривых (2) и (3) отражают средние значения, полученные по двум измерениям
для каждого варианта опыта
возрастание (или плечо) Fm′, которое сменя-
щими. Вместе с тем отрицательный сдвиг
лось сильным снижением Fm′ (рис. 4, кри-
потенциала цитоплазмы при ГО предположи-
вая 3). Последующее восстановление флуо-
тельно может вызвать перераспределение H+
ресценции Fm′ занимало ~10 мин. Кинетиче-
между цитоплазмой и средой, поскольку плаз-
ские кривые изменений Fm′ проявляли неко-
малемма освещенных клеток Chara обладает
торое сходство с изменениями F′ при ГО.
проводимостью для ионов H+ или OH- [4, 5].
Квантовая эффективность переноса элек-
В связи с этим были проведены измерения pH
тронов в ФСII (параметр YII) претерпевала
в примембранных слоях среды (pHo) при ин-
сравнительно небольшое понижение (≤0,03)
дуцированной током гиперполяризации плаз-
при низкой интенсивности фонового освеще-
малеммы Chara.
ния. Вместе с тем при интенсивности света
Кривая 1 на рис. 6, а показывает сдвиги pHo,
25 мкмоль/м2⋅с вызванное гиперполяриза-
вызываемые пропусканием ступени входящего
цией снижение КВ ФСII достигало суще-
тока через плазмалемму клеток Chara. Видно,
ственных величин (~0,15 ед.). При помещении
что гиперполяризующий импульс вызывает
клеток в темноту развитие ГО не оказывало
повышение pHo примерно на 0,5 ед., которое в
влияния на КВ ФСII.
ряде случаев, но не всегда, продолжается неко-
Как показано на рис. 5, влияние ГО на Fm′
торое время после завершения импульса тока.
проявлялось только на свету, но исчезало по-
Скорость изменений pHo возрастала в период
сле затемнения клетки. В освещенной клетке
действия стимула, что предположительно свя-
кинетические кривые изменений Fm′ при дей-
зано с нарастающей гиперполяризацией и
ствии гиперполяризующего стимула и в его от-
увеличением движущей силы для поступле-
сутствие резко различались (рис. 5, а). Однако
ния H+ из среды в цитоплазму. По заверше-
после помещения клетки в темноту изменения
нии импульса тока значения pHo опускались,
Fm′ при пропускании тока и без стимуляции
как правило, ниже исходного уровня (рис. 6, а;
практически совпадали (рис. 5, б). Таким обра-
кривая 1), однако понижение pHo со временем
зом, фотосинтетический перенос электронов,
ослаблялось (рис. 6, а; кривая 2).
сопряженный с мембранным транспортом H+,
В отличие от действия первого электро-
является необходимым условием для пере-
стимула на pHo, приложение второго или,
дачи сигнала от плазматической мембраны
реже, третьего импульса тока не вызывало су-
к хлоропластам.
щественных сдвигов pHo (рис. 6, а; кривая 2).
Трансмембранные потоки H+ при гиперпо-
Это говорит о почти полной инактивации
ляризации и их инактивация. При высокой
пассивной H+-проводимости плазмалеммы в
K+-проводимости плазмалеммы трансмем-
результате действия первого гиперполяризую-
бранные потоки K+ являются преобладаю-
щего стимула. На отдельных клетках H+-про-
БИОХИМИЯ том 88 вып. 10 2023
ФЛУОРЕСЦЕНЦИЯ КЛЕТОК Chara ПРИ ГИПЕРПОЛЯРИЗАЦИИ
1769
Рис. 6. Изменения pH в примембранных слоях среды при индуцированной током гиперполяризации. а - Измене-
ния pH у поверхности клетки Chara (pHo) при пропускании через плазмалемму гиперполяризующего импульса тока
(плотность тока 58 мкА/см2): 1 - повышение pHo в ответ на первый импульс тока указанной силы; 2 - исчезнове-
ние сдвигов pHo при последующем приложении импульса тока той же силы. б - Подавление изменений pHo в ответ
на повторные пропускания тока через плазмалемму (кривая 1, pHo) не устраняло гиперполяризационные измене-
ния мембранного потенциала (кривая 2, Vm). Результаты, представленные на панелях (а) и (б), получены на разных
клетках. Штриховые вертикальные прямые отмечают время включения и отключения входящего в клетку электри-
ческого тока
Рис. 7. Изменения нефотохимического тушения (NPQ), эффективного квантового выхода фотореакции ФСII (YII)
и pH на поверхности клетки Chara (pHo), вызванные пропусканием гиперполяризующего импульса тока с плотностью
33 мкА/см2. Центральный отсек камеры заполнен средой (ИПВ) с добавлением 30 мМ KCl; интенсивность фонового
освещения - 25 мкмоль/м2·с. Вертикальные штриховые линии отмечают моменты включения и выключения электри-
ческого тока
водимость восстанавливалась после периода
Как видно из рис. 7, сдвиги pHo, связанные
покоя ~ 1 ч. Однако во многих случаях вос-
с пропусканием гиперполяризующего импуль-
становления H+-проводимости в непрерыв-
са тока, достигают 1,5 ед. и сопровождаются
ном эксперименте заметить не удавалось.
значительным возрастанием нефотохимиче-
Тем не менее сдвиги pHo в ответ на импульс
ского тушения (рис. 7, а), а также переходным
тока восстанавливались на следующие после
снижением эффективного квантового выхода
опыта сутки при нахождении клеток в стан-
фотореакции ФСII (рис. 7, б). В параллельных
дартной ИПВ. Данные, представленные на
опытах было проверено возникновение ГО
рис. 6, б, показывают, что подавление H+-про-
в данных условиях проведения эксперимента.
водимости плазмалеммы (кривая 1) не оказы-
Уменьшение квантового выхода YII говорит
вало ингибирующего действия на развитие ГО
о переходном торможении линейного фото-
(кривая 2).
синтетического потока электронов.
БИОХИМИЯ том 88 вып. 10 2023
1
770
БУЛЫЧЕВ и др.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
кортикального актина на каналы плазмалеммы
Chara. В основе чувствительности ГО к осве-
Клетки многих растений отвечают на
щению клетки могут лежать изменения содер-
физиологические и повреждающие стимулы
жания Ca2+ и H+ в цитоплазме, которые вы-
генерацией электрических сигналов (потен-
званы фотоиндуцированными потоками этих
циал действия, вариабельный потенциал),
ионов через оболочку пластид и оказывают
которые вызывают изменения фотосинтеза
прямое или косвенное влияние на активность
и Фл Хл [4, 5, 23]. Пути трансформации сиг-
каналов. Пути воздействия Ca2+ и H+ на цито-
нала плазмалеммы до уровня мембран хлоро-
скелет растительной клетки рассмотрены в об-
пластов прослежены лишь частично. Зави-
зоре Hepler [26].
симость состояния ФСА от электрической
Основное внимание в работе уделено
активности плазмалеммы удобно изучать на
влиянию ГО на состояние ФСА, выявляемое
одиночных клетках Characeae, поскольку они
по изменениям F′ и Fm′. Здесь важно отме-
сочетают возбудимость, течение цитоплазмы
тить возможные связи ГО с физиологически-
и пространственно неоднородное распреде-
ми процессами клетки. Известно, что в осве-
ление потоков H+ и фотосинтеза.
щенных клетках Chara и Nitella циркулируют
Способность плазмалеммы генерировать
круговые электрические токи между частями
активные гиперполяризационные ответы из-
клетки, образующими наружные кислые и ще-
вестна уже давно [17, 24], однако связь ГО
лочные зоны [27]. Плотность светозависимого
с другими клеточными процессами и его влия-
входящего тока в «щелочных зонах» клеток
ние на ФСА оставались неизученными. Мы
Chara составляет 20-60 мкА/см2 [28]. В нашей
обнаружили, что время достижения пика ГО
работе ГО плазмалеммы вызывали пропуска-
меняется при переходах свет-темнота у кле-
нием электрического тока с плотностью 30-
ток, в которых течение цитоплазмы остановле-
80 мкА/см2. Таким образом, плотности инду-
но вследствие нарушения актинового цитоске-
цирующих ГО токов лежат в физиологиче-
лета цитохалазином D. Влияние освещения и
ском диапазоне, а описанные взаимодействия
затемнения на скорость развития ГО (рис. 2),
между поверхностной мембраной и хлоро-
вероятно, обусловлено сдвигами состава цито-
пластами могут, в принципе, проявляться при
плазмы при запуске и отключении светозави-
повышении уровня K+ в среде. При попада-
симого транспорта через мембранную обо-
нии освещенной клетки в среду с повышен-
лочку хлоропластов. Профиль продольного
ным содержанием K+ (10-100 мМ) входящий
распределения компонентов цитоплазмы, об-
ток, возможно, вызывает защитное снижение
мениваемых через оболочку пластид, по-ви-
K+-проводимости благодаря генерации ГО, а
димому, становится более неравномерным в
также блокирует проводимость для H+ (рис. 6),
отсутствие циклоза, поскольку интенсивное
чтобы исключить работу H+-насоса в режиме
течение цитоплазмы сглаживает перепады
короткого замыкания.
концентрации этих компонентов. Это пред-
Гиперполяризационные сигналы харовых
ставление объясняет отсутствие заметного
водорослей имеют некоторые черты сходства с
влияния освещения на развитие ГО при актив-
гиперполяризационными сигналами у высших
ном течении цитоплазмы, а также выражен-
растений, которые возникают при нагреве
ную зависимость ГО от действия света после
листа или его повреждении открытым пла-
остановки циклоза.
менем. В частности, умеренный нагрев ли-
На изолированной капле цитоплазмы
стьев пшеницы вызывал градуальную гипер-
ранее отмечали, что нарушение актинового
поляризацию клеток на 10-20 мВ в течение
цитоскелета под действием цитохалазина B
20 мин, которая сопровождалась возрастани-
устраняет острый пик ГО, предположитель-
ем нефотохимического тушения [29]. Резуль-
но вызванный активностью электрогенного
таты, полученные на клетках Chara, пока-
насоса ([22] и ссылки в ней). Действие цито-
зывают, что активные гиперполяризацион-
халазина D на целые клетки (рис. 2) также
ные ответы большой амплитуды (~250 мВ),
сглаживало пик гиперполяризации и стадию
развивающиеся за сравнительно короткое вре-
деполяризации. Эти наблюдения говорят о
мя (10-75 c), вызывают заметное возраста-
том, что состояние актинового цитоскелета
ние регулируемой диссипации энергии в ФСII
регулирует проводимость каналов, участвую-
(рис. 7, а), а также снижение квантового вы-
щих в формировании ГО. В литературе обсу-
хода реакции ФСII и торможение линейного
ждают разные варианты взаимодействия ион-
потока электронов (рис. 7, б).
ных каналов с актиновым цитоскелетом [25],
Особый интерес к изучению влияния ГО
которые, вероятно, применимы и к влиянию
на клеточные процессы связан с тем, что отри-
БИОХИМИЯ том 88 вып. 10 2023
ФЛУОРЕСЦЕНЦИЯ КЛЕТОК Chara ПРИ ГИПЕРПОЛЯРИЗАЦИИ
1771
цательный сдвиг мембранного потенциала в
ского поступления воды в цитоплазму клетки
период развития ГО создает движущую силу
и сопутствующего набухания хлоропластов.
для поступления K+ в цитоплазму через мем-
Распределение гранальной системы в большем
брану, обладающую высокой K+-проводимо-
объеме, возможно, лежит в основе быстрого
стью. Поэтому ГО можно использовать в ка-
возрастания F′ в клетках N. translucens, отли-
честве инструмента для повышения уровня
чающихся повышенным отношением площа-
K+ в цитоплазме и изучения последствий воз-
ди поверхности к объему (S/V). Кроме того,
растания [K+]цит на состояние ФСА.
поступление K+ в строму пластид в обмен на
В данной работе использовали сравни-
выход H+ может также сопровождаться осмо-
тельно долгие интервалы между токовыми
тической регуляцией объема хлоропластов.
импульсами (600 с), чтобы не препятствовать
Учет всех сопутствующих факторов будет
восстановлению [K+]цит при переходах от ГО
способствовать более глубокому пониманию
к состоянию покоя. Клетки, подвергнутые
механизмов влияния электрических процес-
неоднократной генерации ГО в ходе опыта,
сов плазмалеммы на состояние и активность
сохраняли жизнеспособность на следующий
хлоропластов.
день, а измеряемые параметры - скорость те-
Гиперполяризация создает движущую силу
чения цитоплазмы, эффективный КВ ФСII и
не только для входа K+, но и для поступле-
потенциал покоя - оставались в пределах нор-
ния H+ в цитоплазму. Влияние сдвигов мем-
мы. Как правило, перераспределение ионов
бранного потенциала на pH цитозоля пред-
в связи с генерацией ГО не вызывало необ-
ставлялось вероятным, поскольку плазма-
ратимого повреждения клетки. Вместе с тем
лемма Chara содержит пассивные пути, про-
генерация ГО приводила к длительной инак-
водящие H+ или OH- [5, 27]. Ранее критерием
тивации потоков H+/OH-. В физиологичес-
существования H+/OH--проводимости плаз-
ких условиях проводимость для H+/OH- зави-
малеммы служило образование узких щелоч-
сит от освещения. Потоки H+/OH-, вызван-
ных зон на поверхности клеток при низком
ные генерацией ГО, проявлялись и на свету,
содержании K+ в наружной среде и ярком
и, изредка, в темноте. Вместе с тем остается
освещении, т.е. в условиях циркуляции кру-
неясным, зависят ли потенциал-чувствитель-
говых электрических токов и низкой K+-
ные потоки H+/OH- от локализации анализи-
проводимости. В данной работе показаны
руемого участка в фотосинтетически активных
потоки H+, вызываемые гиперполяризацией
или неактивных областях.
при высокой K+-проводимости плазмалеммы
Повышение [K+]цит само по себе является
(рис. 6 и 7).
недостаточным для воздействия на ФСА, но
Результаты, представленные на рис. 6 и 7,
оно может влиять на ионный состав стромы при
выявляют два принципиально различных типа
участии переносчиков, локализованных в обо-
изменений pHo после выключения входя-
лочке пластид. Внутренняя мембрана оболоч-
щего тока. Мгновенная смена знака измене-
ки содержит K+/H+-антипортеры [13, 14, 30].
ний на пике pH на рис. 7 и продолжающееся
При повышении уровня
[K+]цит эти транс-
нарастание pH после завершения импульса
портеры должны переносить K+ в строму
тока на рис. 6 говорят о том, что вызванные
в обмен на удаление H+ из стромы пластид,
гиперполяризацией изменения pH включа-
причем активность KEA1/2 сохраняется и
ют стадии, имеющие разное происхождение.
в темноте [31]. Повышение pH стромы, как
Сдвиги pH, меняющие направление после
известно, стимулирует реакции фиксации
смещения мембранного потенциала к нуле-
углекислоты, что может сместить редокс-со-
вым значениям, по-видимому, отражают по-
стояние пластохинона и акцептора QA в сторо-
тенциал-зависимый перенос H+ (или OH-) по
ну окисления и понизить фактический выход
проводящим путям плазмалеммы. В отличие
Фл F′ (рис. 3). Согласно предполагаемой схе-
от этого, изменения pH, продолжающиеся с
ме, задержанные изменения F′ и Fm′ в ответ
почти прежней скоростью после устранения
на гиперполяризацию плазматической мем-
движущей силы (рис. 6), говорят об иной при-
браны обусловлены индукцией K+/H+-обмена
роде пост-гиперполяризационного сдвига pH.
через оболочку хлоропластов.
Такое нарастание pH имеет черты сходства
Вместе с тем гиперполяризующие импуль-
с образованием локальной щелочной зоны
сы электрического тока потенциально могут
в области микроукола клетки Chara после
влиять на водный баланс клетки и хлоро-
латентного периода ~ 30 с [32]. Параллель-
пластов. Если просвет K+-каналов плазма-
ные измерения локальных сдвигов pH и кон-
леммы несет фиксированные отрицательные
центрации O2 в области микроповреждения
заряды, нельзя исключать электроосмотиче-
клетки в контроле и при действии ингиби-
БИОХИМИЯ том 88 вып. 10 2023
1
772
БУЛЫЧЕВ и др.
торов указывали на то, что возрастание pH,
Существование длительного лаг-перио-
сопровождаемое резким падением уровня О2,
да, предшествующего ГО-индуцированным
обусловлено переносом электронов через
изменениям F′ и Fm′, отражает многостадий-
плазмалемму от NADPH на О2 и последую-
ное преобразование электрического сигнала
щим потреблением H+ в реакции восстанов-
плазмалеммы до отклика флуоресценции в
ления О• до H2O2 [33]. С учетом этих сведений
мембранах тилакоидов. Предполагаемые про-
можно сделать вывод, что в защелачивании
межуточные стадии включают сдвиг [K+]цит,
среды при гиперполяризации плазмалеммы
обмен K+/H+ через оболочку хлоропласта,
могут участвовать разные механизмы: транс-
модуляцию активности стромальных фермен-
мембранный перенос H+ под влиянием элек-
тов и влияние pH на транспорт электронов
трохимического градиента протонов, а также
и тушение флуоресценции в антенне.
комбинированный механизм, включающий
Таким образом, в работе выявлены но-
биохимические стадии, нечувствительные к
вые взаимодействия между плазматической
трансмембранному градиенту H+.
мембраной и хлоропластами, которые опо-
Интересно отметить, что сдвиги pHo воз-
средованы потоками ионов в ответ на элек-
никали лишь в ответ на первый (реже, и на
трические сигналы клетки. Результаты пока-
второй) импульс тока, тогда как последую-
зывают, что гиперполяризация плазмалеммы
щие стимулы практически не оказывали влия-
в состоянии с высокой K+-проводимостью
ния на pHo. Поскольку влияние ГО на пара-
приводит к заметным изменениям флуорес-
метры флуоресценции F′ и Fm′ проявлялось в
ценции хлорофилла F′ и Fm′. Эти изменения
ответ на приложение не только первого, но и
указывают на существование регуляторных
последующих электростимулов, можно пред-
связей, которые отличаются от ранее обнару-
полагать, что потоки H+, вызываемые гипер-
женного пути, связанного с генерацией потен-
поляризацией, не играли критической роли
циала действия. Экспериментальные наблю-
в передаче сигнала от плазмалеммы к хлоро-
дения согласуются с представлением о том,
пластам в условиях неоднократного приложе-
что K+/H+-обмен на внутренней мембране
ния стимула. Вместе с тем, учитывая возмож-
оболочки оказывает регуляторное действие
ные сдвиги pH цитоплазмы при развитии ГО,
не только в долговременных опытах (напри-
представляется важным в дальнейшем вни-
мер, при выращивании растений в условиях
мательно исследовать их роль в перестрой-
засоления), но и при относительно коротких
ках ФСА.
воздействиях. Для более глубокого понима-
Переходные смещения Fm′, вызываемые
ния выявленных внутриклеточных взаимодей-
ГО, сходны в некоторых чертах с изменения-
ствий и механизмов влияния электрических
ми Fm′, возникающими после генерации ПД
процессов плазмалеммы на состояние и актив-
при умеренной интенсивности освещения.
ность хлоропластов необходимы дальнейшие
Известно, что гиперполяризация может ак-
исследования.
тивировать Ca2+-проводящие каналы
[34],
открывая путь для поступления Ca2+ в цито-
Вклад авторов. А.А. Булычев - общий план
плазму. Согласно одной из гипотез, стадия
работ, проведение опытов и написание статьи;
деполяризации после пика ГО в капле цито-
С.Ю. Шапигузов - выполнение эксперимен-
плазмы харовых водорослей аналогична фрон-
тов и обработка результатов; А.В. Алова - об-
ту потенциала действия интактных клеток и
суждение результатов и руководство работой
связана с повышением концентрации цито-
по проекту РФФИ.
плазматического Ca2+ [22]. В применении к
Финансирование. Работа выполнена при
интактным клеткам эта гипотеза не вполне
финансовой поддержке Российского фон-
убедительна, поскольку течение цитоплазмы
да фундаментальных исследований (грант
не прекращается на пике ГО, хотя скорость
№ 20-54-12015), а также в рамках научно-
циклоза крайне чувствительна к повыше-
го проекта государственного задания МГУ
нию [Ca2+] в цитоплазме [35]. О регуляции F′
№ 121032500058-7.
и Fm′ при участии ΔpH тилакоидов говорит
Конфликт интересов. Авторы заявляют об
тот факт, что влияние ГО на эти параметры
отсутствии конфликта интересов.
проявлялось только в освещенных клетках и
Соблюдение этических норм. Настоящая
исчезало в темноте вместе с прекращением
статья не содержит каких-либо исследований с
фотосинтетического транспорта электронов
участием людей и животных в качестве объек-
(рис. 3 и 5).
тов исследования.
БИОХИМИЯ том 88 вып. 10 2023
ФЛУОРЕСЦЕНЦИЯ КЛЕТОК Chara ПРИ ГИПЕРПОЛЯРИЗАЦИИ
1773
СПИСОК ЛИТЕРАТУРЫ
1.
Drachev, L. A., Mamedov, M. D., and Semenov,
Acta Bioenerg., 1767, 781-788, doi: 10.1016/j.bbabio.
A. Yu. (1987) The antimycin-sensitive electrogenesis
2007.01.004.
in Rhodopseudomonas sphaeroides chromatophores,
13.
Pottosin, I., and Shabala, S. (2016) Transport across
FEBS Lett., 213, 128-132, doi: 10.1016/0014-5793
chloroplast membranes: optimizing photosynthe-
(87)81477-1.
sis for adverse environmental conditions, Mol. Plant,
2.
Bulychev, A. A., Dassen, J. H. A., Vredenberg, W. J.,
9, 356-370, doi: 10.1016/j.molp.2015.10.006.
Opanasenko, V. K., and Semenova, G. A. (1998)
14.
Szabò, I., and Spetea, C. (2017) Impact of the ion
Stimulation of photocurrent in chloroplasts related
transportome of chloroplasts on the optimization
to light-induced swelling of thylakoid system,
of photosynthesis, J. Exp. Bot.,
68,
3115-3128,
Bioelectrochem. Bioenerg., 46, 71-78, doi: 10.1016/
doi: 10.1093/jxb/erx063.
S0302-4598(98)00129-9.
15.
Höhner, R., Aboukila, A., Kunz, H. H., and
3.
Bulychev, A. A., and Vredenberg, W. J. (1999) Light-
Venema, K. (2016) Proton gradients and proton-
triggered electrical events in the thylakoid membrane
dependent transport processes in the chloroplast,
of plant chloroplasts, Physiol. Plant., 105, 577-584,
Front. Plant Sci., 7, 1-7, doi: 10.3389/fpls.2016.00218.
doi: 10.1034/j.1399-3054.1999.105325.x.
16.
Wu, W., and Berkowitz, G. A. (1992) Stromal pH
4.
Bulychev, A. A., and Kamzolkina, N. A. (2006) Dif-
and photosynthesis are affected by electroneutral K+
ferential effects of plasma membrane electric exci-
and H+ exchange through chloroplast envelope ion
tation on H+ fluxes and photosynthesis in characean
channels, Plant Physiol., 98, 666-672, doi: 10.1104/
cells, Bioelectrochemistry, 69, 209-215, doi: 10.1016/
pp.98.2.666.
j.bioelechem.2006.03.001.
17.
Kishimoto, U. (1966) Hyperpolarizing response in
5.
Bulychev, A. A., and Kamzolkina, N. A. (2006) Effect
Nitella internodes, Plant Cell Physiol., 7, 429-439,
of action potential on photosynthesis and spatially
doi: 10.1093/oxfordjournals.pcp.a079194.
distributed H+ fluxes in cells and chloroplasts of Chara
18.
Homblé, F. (1987) A tight-seal whole cell study of
corallina, Russ. J. Plant Physiol., 53, 1-9, doi: 10.1134/
the voltage-dependent gating mechanism of K+-
S1021443706010018.
channels of protoplasmic droplets of Chara corallina,
6.
Bulychev, A. A., and Alova, A. V. (2022) Microflu-
Plant Physiol., 84, 433-437, doi: 10.1104/pp.84.2.433.
idic interactions involved in chloroplast respons-
19.
Schmölzer, P. M., Höftberger, M., and Foissner, I.
es to plasma membrane excitation in Chara, Plant
(2011) Plasma membrane domains participate in pH
Physiol. Biochem., 183, 111-119, doi: 10.1016/j.plaphy.
banding of Chara internodal cells, Plant Cell Physiol.,
2022.05.005.
52, 1274-1288, doi: 10.1093/pcp/pcr074.
7.
Johnson, C. H., Shingles, R., and Ettinger, W. F.
20.
Goh, C. H., Schreiber, U., and Hedrich, R. (1999)
(2007) Regulation and role of calcium fluxes in the
New approach of monitoring changes in chloro-
chloroplast, in Structure and Function of Plastids (Wise,
phyll a fluorescence of single guard cells and proto-
R. R. and Hoober, J. K., eds.) Springer, Dordrecht,
plasts in response to physiological stimuli, Plant Cell
pp. 403-416, doi: 10.1007/978-1-4020-4061-0_20.
Environ., 22, 1057-1070, doi: 10.1046/j.1365-3040.
8.
Hochmal, A. K., Schulze, S., Trompelt, K., and
1999.00475.x.
Hippler, M. (2015) Calcium-dependent regulation
21.
Beilby, M. J. (2015) Salt tolerance at single cell level
of photosynthesis, Biochim. Biophys. Acta Bioenerg.,
in giant-celled characeae, Front. Plant Sci., 6, 1-16,
1847, 993-1003, doi: 10.1016/j.bbabio.2015.02.010.
doi: 10.3389/fpls.2015.00226.
9.
Williamson, R. E., and Ashley, C. C. (1982) Free Ca2+
22.
Прищепов Е. Д., Андрианов В. К., Курелла Г. А.,
and cytoplasmic streaming in the alga Chara, Nature,
Рубин А. Б.
(1984) Структурно-функциональ-
296, 647-651, doi: 10.1038/296647a0.
ные характеристики поверхностной мембраны
10.
Kreimer, G., Melkonian, M., and Latzko, E. (1985)
капель протоплазмы, полученных из клеток ха-
An electrogenic uniport mediates light-dependent
ровых водорослей. IV. Исследование электри-
Ca2+ influx into intact spinach chloroplasts,
ческих свойств мембраны капли методами фик-
FEBS Lett., 180, 253-258, doi: 10.1016/0014-5793
сации тока и потенциала, Физиология растений,
(85)81081-4.
31, 59-72.
11.
Stael, S., Wurzinger, B., Mair, A. N., Mehlmer, N.,
23.
Sukhov, V. (2016) Electrical signals as mechanism of
Vothknecht, U. C., and Teige, M.
(2012) Plant
photosynthesis regulation in plants, Photosynth. Res.,
organellar calcium signalling: an emerging field,
130, 373-387, doi: 10.1007/s11120-016-0270-x.
J. Exp. Bot., 63, 1525-1542, doi: 10.1093/jxb/err394.
24.
Blinks, L. R. (1936) The effects of current flow on
12.
Krupenina, N. A., and Bulychev, A. A. (2007) Action
bioelectric potential: III. Nitella, J. Gen. Physiol., 20,
potential in a plant cell lowers the light requirement
229-265, doi: 10.1085/jgp.20.2.229.
for non-photochemical energy-dependent quench-
25.
Shaw, J. E., and Koleske, A. J. (2021) Functional
ing of chlorophyll fluorescence, Biochim. Biophys.
interactions of ion channels with the actin cytoskeleton:
БИОХИМИЯ том 88 вып. 10 2023
1
774
БУЛЫЧЕВ и др.
does coupling to dynamic actin regulate NMDA
nels and transporters in Arabidopsis, Physiol. Plant.,
receptors? J. Physiol., 599, 431-441, doi: 10.1113/
161, 16-27, doi: 10.1111/ppl.12568.
JP278702.
31. Aranda Sicilia, M. N., Sánchez Romero, M. E.,
26. Hepler, P. K.
(2016) The cytoskeleton and its
Rodríguez Rosales, M. P., and Venema, K. (2021)
regulation by calcium and protons, Plant Physiol., 170,
Plastidial transporters KEA1 and KEA2 at the inner
3-22, doi: 10.1104/pp.15.01506.
envelope membrane adjust stromal pH in the dark,
27. Beilby, M. J., and Bisson, M. A. (2012) PH banding
New Phytol., 229, 2080-2090, doi: 10.1111/nph.17042.
in charophyte algae, in Plant Electrophysiol. (Volkov,
32. Bulychev, A. A., Alova, A. V., and Bibikova, T. N.
A. G., ed) Springer, Berlin-Heidelberg, pp. 247-271,
(2013) Strong alkalinization of Chara cell surface in
doi: 10.1007/978-3-642-29119-7_11.
the area of cell wall incision as an early event in mech-
28. Lucas, W. J., and Nuccitelli, R. (1980) HCO3- and
anoperception, Biochim. Biophys. Acta, 1828, 2359-
OH- transport across the plasmalemma of Chara,
2369, doi: 10.1016/j.bbamem.2013.07.002.
Planta, 150, 120-131, doi: 10.1007/BF00582354.
33. Alova, A., Erofeev, A., Gorelkin, P., Bibikova, T.,
29. Yudina, L., Sukhova, E., Popova, A., Zolin, Y.,
Korchev, Y., Majouga, A., and Bulychev, A. (2020)
Abasheva, K., Grebneva, K., and Sukhov, V. (2023)
Prolonged oxygen depletion in microwounded cells of
Local action of moderate heating and illumination
Chara corallina detected with novel oxygen nanosen-
induces propagation of hyperpolarization electri-
sors, J. Exp. Bot., 71, 386-398, doi: 10.1093/jxb/erz433.
cal signals in wheat plants, Front. Sustain. Food Syst.,
34. Hedrich, R. (2012) Ion channels in plants, Physiol.
6, 1-20, doi: 10.3389/fsufs.2022.1062449.
Rev., 92, 1777-1811, doi: 10.1152/physrev.00038.2011.
30. Spetea, C., Herdean, A., Allorent, G., Carraretto, L.,
35. Shimmen, T. (2007) The sliding theory of cytoplasmic
Finazzi, G., and Szabo, I. (2017) An update on the
streaming: fifty years of progress, J. Plant Res., 120,
regulation of photosynthesis by thylakoid ion chan-
31-43, doi: 10.1007/s10265-006-0061-0.
ELECTRICAL SIGNALS OF THE PLASMA MEMBRANE
AND THEIR EFFECT ON CHLOROPHYLL FLUORESCENCE
IN Chara CHLOROPLASTS in vivo
A. A. Bulychev*, S. Yu. Shapiguzov, and A. V. Alova
Faculty of Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; e-mail: bulychev@biophys.msu.ru
Action potentials of plant cells are involved in regulation of many cell processes, such as photosynthesis
and cytoplasmic streaming. Excitable cells of characean algae submerged in media with elevated K+ con-
tent are able to generate hyperpolarizing electrical responses. This active response of plasma membrane
arises upon the passage of inward electric current comparable in extent to natural currents circulating in
illuminated Chara internodes. It remains currently unknown whether the hyperpolarizing electrical signals
in Chara affect the photosynthetic activity. Here we show that the negative shift of cell membrane poten-
tial, which causes the K+ influx into the cytoplasm, is accompanied by a delayed decrease in the effective
chlorophyll fluorescence yield (F′) and maximal yield (Fm′) under low background light (12.5 μmol m-2 s-1).
The transient changes in F′ and Fm′ were evident under illumination only, which indicates their close re-
lation to photosynthetic energy conversion in chloroplasts. The passage of inward current caused an in-
crease in pH at the cell surface (pHo), which reflects a high H+/OH- conductance of the plasmalemma and
points to the decrease in cytoplasmic pH due to H+ entry into the cell. The shifts in pHo arising in response
to the first hyperpolarizing pulse disappeared upon repeated stimulations, thus indicating the long-term
inactivation of plasmalemmal H+/OH- conductance. Despite the suppression of plasmalemmal H+ flux-
es, the hyperpolarizing responses and the analyzed chlorophyll fluorescence changes did not disappear.
The results indicate the participation of K+ flows between the outer medium, cytoplasm, and stroma in
chloroplast functional changes that are reflected by the dynamics of F′ and Fm′.
Keywords: Chara, electrical signals, hyperpolarization, plasma membrane K+-conductance, chlorophyll fluorescence
changes, H+ transport, plasmalemma-chloroplast interactions
БИОХИМИЯ том 88 вып. 10 2023