БИОХИМИЯ, 2023, том 88, вып. 10, с. 1775 - 1799
УДК 577.352.54
ИОННЫЕ КАНАЛЫ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
У ВЫСШИХ РАСТЕНИЙ
Обзор
© 2023 М.А. Мудрилов, М.М. Ладейнова, Д.В. Кузнецова, В.А. Воденеев*
Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского,
Институт биологии и биомедицины, кафедра биофизики, 603022 Нижний Новгород, Россия;
электронная почта: v.vodeneev@mail.ru
Поступила в редакцию 21.06.2023
После доработки 16.09.2023
Принята к публикации 18.09.2023
Электрические сигналы (ЭС) растений, возникающие при действии различных внешних факто-
ров, играют важную роль в адаптации к изменяющимся условиям окружающей среды. Генерация
ЭС в клетках высших растений связана с активацией потоков Ca2+, K+, анионов, а также измене-
нием активности H+-ATPазы плазмалеммы. В настоящем обзоре на основе сопоставления данных
молекулярно-генетических и электрофизиологических исследований выполнен анализ молекуляр-
ной природы ионных каналов, вносящих вклад в передачу ЭС у высших растений. На основе таких
характеристик ионных каналов, как селективность, механизм активации, а также внутриклеточная
и тканевая локализация, из широкого разнообразия ионных каналов высших растений выделены
те, которые отвечают требованиям к потенциальным участникам генерации ЭС. Анализ данных
экспериментальных исследований, выполненных на мутантах с подавленной или усиленной экс-
прессией гена определённого канала, выявил те каналы, активация которых вносит вклад в фор-
мирование ЭС. К числу каналов, ответственных за возникновение потока Ca2+ при генерации ЭС,
относятся каналы семейства GLR, потока K+ - GORK, анионов - MSL. Рассмотрение перспектив
дальнейших исследований говорит о необходимости объединения в рамках единого исследования
электрофизиологических и генетических подходов наряду с анализом ионных концентраций в ин-
тактных растениях.
КЛЮЧЕВЫЕ СЛОВА: электрические сигналы у растений, дистанционные сигналы, ионные каналы,
потенциал действия, вариабельный потенциал.
DOI: 10.31857/S0320972523100056, EDN: OTUVVP
ВВЕДЕНИЕ
распространения которых у растений может
достигать десятков сантиметров в секунду, на-
Растения в естественной среде обитания
ряду с гидравлическими относятся к быстрым
подвергаются действию различных неблаго-
дистанционным сигналам [1-4].
приятных факторов окружающей среды.
Распространение ЭС вызывает широкий
Для развития скоординированного систем-
спектр функциональных изменений в нераз-
ного ответа на действие внешних факторов
дражённых частях растения. Индуцированные
необходима передача дистанционных сигна-
ЭС ответы включают изменение активности
лов. У растений выделяют три типа дистан-
фотосинтеза и транспирации, усиление дыха-
ционных сигналов - химические, гидравли-
ния, изменение содержания ATP, экспрессию
ческие и электрические, различающиеся как
защитных генов и др. [1, 3, 5]. Такие изменения
по природе, так и по скорости распростране-
играют важную роль в адаптации растений к
ния. Электрические сигналы (ЭС), скорость изменяющимся условиям окружающей среды.
Принятые сокращения: АФК - активные формы кислорода; ВП - вариабельный потенциал; ПД - потенциал дей-
ствия; СП - системный потенциал; ЭС - электрический сигнал; CNGC - cyclic nucleotide-gated channels, каналы,
управляемые циклическими нуклеотидами; DAMP - damage-associated molecular pattern, молекулярный паттерн, свя-
занный с повреждением; GLR - glutamate-like receptor, ионотропные глутаматные рецепторы; MSL - mechanosensitive-
like channels, механочувствительно-подобные каналы.
* Адресат для корреспонденции.
1775
1
776
МУДРИЛОВ и др.
Известно, что механизмы индукции ЭС систем-
работы Н+-ATPазы плазмалеммы метаболи-
ного ответа у растений основаны на изменениях
ческой компоненты в общую величину элек-
ионных концентраций во время генерации ЭС,
трического потенциала [6, 8]. Электрический
среди которых особо важную роль играют сдви-
трансмембранный потенциал как составляю-
ги концентраций Са2+ и Н+ [5, 6]. Приводящие
щая электрохимического градиента является
к изменениям концентраций ионные потоки
движущей силой мембранного транспорта, в
возникают вследствие изменения активности
том числе для потока ионов при генерации ЭС.
ион-транспортирующих систем, в первую оче-
В настоящее время у растений выделяют три
редь ионных каналов [2, 3, 7]. Однако вопрос о
типа ЭС: потенциал действия (ПД), вариабель-
молекулярной природе таких каналов остаётся
ный потенциал (ВП) и системный потенциал
открытым.
(СП) [1, 3, 7, 12]. Последний в силу недоста-
Идентификация молекулярной природы
точной изученности лежащих в его основе
ионных каналов, участвующих в генерации
механизмов не рассматривается в настоящем
ЭС у высших растений, сопряжена с рядом
обзоре. Разделение сигналов на различные
трудностей. В первую очередь необходимо от-
типы основано на нескольких характеристиках,
метить, что исследование параметров ЭС и
включая направленность изменения потенциа-
механизмов их генерации проводилось на ра-
ла (де-/гиперполяризация), длительность элек-
стениях различных видов. В частности, тради-
трической реакции, характер распростране-
ционным объектом исследования в электро-
ния, а также типичные раздражители, которые
физиологии растений являются локомоторные
индуцируют сигнал определённого типа.
растения. Другим модельным объектом, на
ПД представляет собой переходную депо-
котором был получен значительный объём
ляризацию амплитудой несколько десятков
данных о механизмах генерации ЭС и впер-
мВ, имеющую характерную импульсную фор-
вые была экспериментально показана роль
му, возникающую по пороговому принципу и
ионных каналов, служили гигантские клет-
подчиняющуюся закону «всё или ничего» [1,
ки харовых водорослей, удобные для иссле-
6, 12, 13]. Отмеченные свойства ПД растений
дований с методической точки зрения [8-11].
сходны с таковыми для классического нерв-
В то же время модельным объектом в молеку-
ного импульса. Основные же различия свя-
лярно-генетических исследованиях растений яв-
заны с временными характеристиками реак-
ляется арабидопсис (Arabidopsis thaliana L.), на
ции: длительность ПД у растений в тысячи раз
котором выполнено относительно небольшое
больше длительности нервного импульса - от
количество работ по изучению ЭС. Вышеска-
нескольких секунд у локомоторных, таких как
занное не позволяет прямо сопоставить элек-
мимоза и венерина мухоловка, до нескольких
трофизиологические и молекулярно-генетичес-
десятков секунд у обычных, нелокомоторных
кие данные, представленные в литературе.
растений [1, 13].
В настоящем обзоре предпринята попытка
Механизм генерации ПД в клетках расте-
такого сопоставления: рассматриваются све-
ний (рис. 1) также отличается от классической
дения о природе ионных потоков, лежащих в
Na+/K+-схемы нервного импульса. У растений
основе механизмов генерации ЭС, приводятся
формирование фазы деполяризации ПД свя-
данные об ионных каналах, генетическая при-
зано с входящим потоком Ca2+ и выходящим
надлежность которых идентифицирована на
потоком анионов, прежде всего Cl-, а также,
сегодняшний день, а также выполняется ана-
вероятно, со временным снижением активно-
лиз наиболее вероятных участников процесса
сти H+-ATPазы. При этом ионы Ca2+ играют
генерации ЭС у высших растений.
преимущественно сигнальную роль, вызывая
активацию потока анионов и инактивацию
H+-ATPазы [1, 12, 13]. В то же время для от-
ЭЛЕКТРИЧЕСКИЕ СИГНАЛЫ
дельных видов растений продемонстрирована
ВЫСШИХ РАСТЕНИЙ
определяющая роль Ca2+ в изменении величи-
ны электрического потенциала при формиро-
В состоянии покоя величина электриче-
вании фазы деполяризации [14, 15], что пока-
ского мембранного потенциала клеток расте-
зывает вариативность механизма генерации
ний находится в значительно более отрица-
ПД среди различных растений. Формирование
тельной области по сравнению с клетками
фазы реполяризации связано с выходящим
животных и составляет ниже -100 мВ, а для
потоком K+, значительная движущая сила для
некоторых растений и отдельных тканей ниже
которого возникает при деполяризации, а так-
-200 мВ. Столь большие значения обусловле-
же с реактивацией H+-ATPазы вследствие уда-
ны значительным вкладом создаваемой за счёт
ления из клетки избытка ионов Ca2+ [3, 8, 13].
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1777
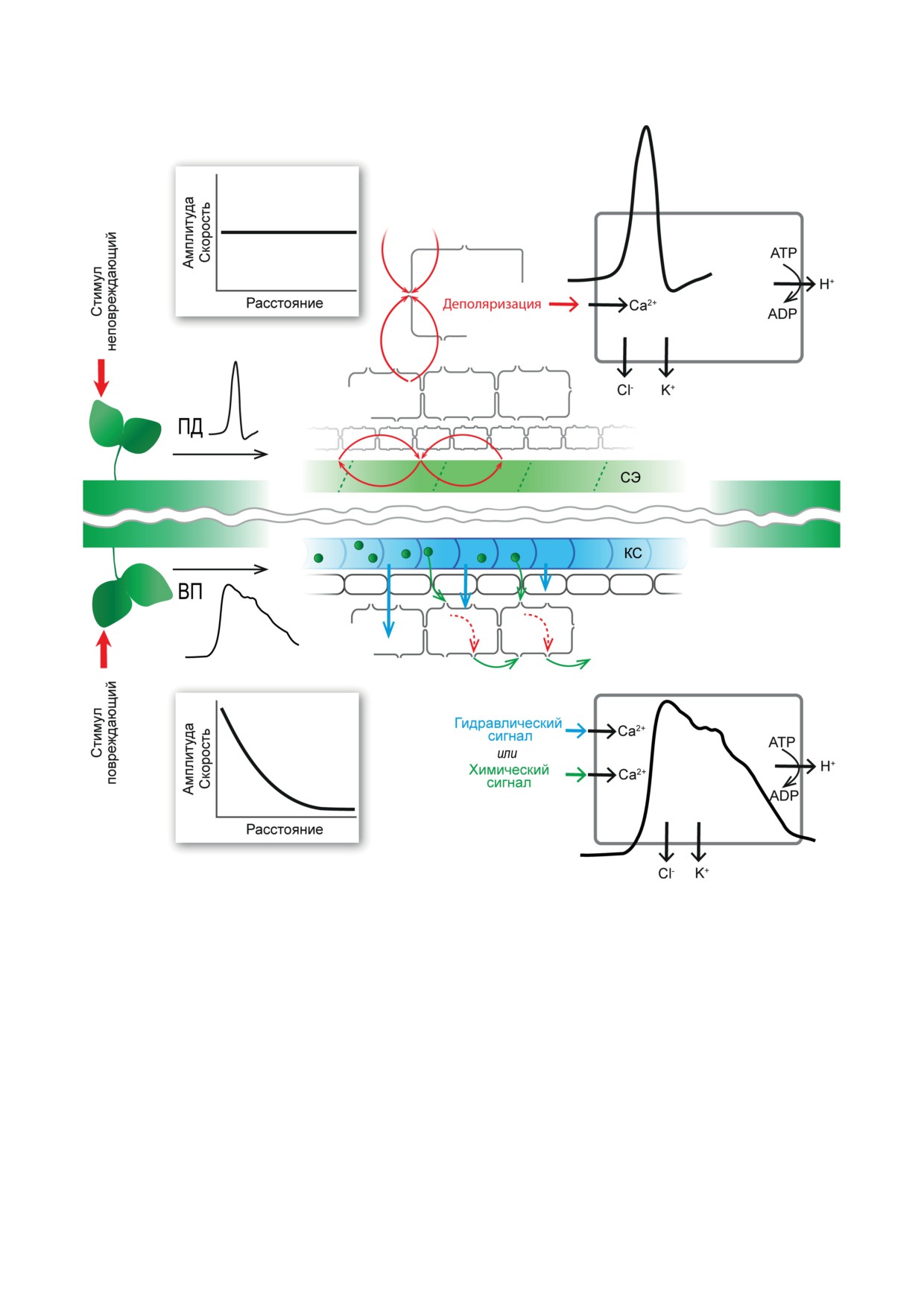
Рис. 1. Схема генерации и распространения потенциала действия (ПД) и вариабельного потенциала (ВП) по проводя-
щим тканям высших растений. Неповреждающий стимул вызывает генерацию ПД, который распространяется пре-
имущественно по флоэме вследствие возникновения локальных токов (обозначены красными стрелками). Повреж-
дающий стимул вызывает ВП, который распространяется вследствие передачи по ксилеме химического (обозначено
зелёными точками) или гидравлического сигнала (обозначено голубыми стрелками). На схеме справа представлены
механизмы генерации ПД и ВП (пояснения в тексте). КС - ксилема, СЭ - ситовидные элементы
Распространение ПД по растению (рис. 1)
токов и последующую активную генерацию
происходит без значительного снижения ам-
ПД в этих участках [8, 12, 13]. В целом, можно
плитуды и скорости, которая составляет обыч-
говорить о принципиальном сходстве меха-
но от долей до нескольких см/с, достигая
низма распространения нервного импульса
8-10 см/с у локомоторных растений [1, 7, 16].
и ПД у растений, несмотря на меньшую на
Бездекрементное распространение ПД указы-
2-3 порядка скорость последнего. Однако от-
вает на то, что этот процесс является актив-
крытым остаётся вопрос об основных путях
ным: генерация ПД вызывает деполяризацию
передачи ПД у высших растений. Проводящие
клеток в соседних участках до порогового
пучки высших растений являются общепри-
уровня вследствие возникновения локальных
знанным путём системной передачи сигналов
5
БИОХИМИЯ том 88 вып. 10 2023
1
778
МУДРИЛОВ и др.
всех типов, включая электрические [1, 5, 7].
вход Ca2+ в клетку, что вызывает снижение ак-
Предположительно, клетки флоэмы
- как
тивности H+-ATPазы, значительно более про-
ситовидные элементы, так и флоэмная парен-
должительное, чем при ПД. В формирова-
хима - ответственны за незатухающую пере-
ние фазы деполяризации также вносит вклад
дачу ПД [1, 3]. Также имеет место радиальное
поток анионов, в частности Cl- [5, 12, 25, 26].
распространение ПД от проводящих пучков
Формирование фазы реполяризации проис-
к соседним клеткам благодаря связям через
ходит благодаря восстановлению активности
плазмодесмы, вероятно, уже в виде затухаю-
H+-ATPазы, а также, вероятно, выходу из клет-
щего сигнала [1, 12, 13].
ки K+ [1, 26]. Несмотря на то что в генерации
Генерацию ПД вызывают различные непо-
как ПД, так и ВП участвует общий набор
вреждающие стимулы, включая изменение тем-
ионов (Ca2+, Cl-, K+, H+), ион-транспортирую-
пературы, освещённости, прикосновение и др.
щие системы клеточных мембран, ответствен-
Механизмы преобразования энергии дей-
ные за их перенос, вероятно, различаются для
ствующего стимула в изменения потенциала
двух типов ЭС. Косвенным доказательством
и роль определённых ионных каналов в этом
этого является такая особенность ВП, как его
процессе рассмотрены в соответствующих об-
способность возникать в период абсолютной
зорах [3, 7, 17]. Отдельно необходимо подчерк-
рефрактерности для ПД [8, 16].
нуть, что генерацию ПД у растений, как и в
В отличие от ПД, ВП не является само-
нервном волокне, можно индуцировать путём
распространяющимся ЭС (рис. 1), представ-
прямой электрической стимуляции [15], что
ляя собой локальную электрическую реакцию,
свидетельствует об определяющей роли по-
индуцированную гидравлическим или хими-
тенциал-зависимых ионных каналов в индук-
ческим сигналом [1, 5, 7, 26]. Возможность вы-
ции ПД.
звать ВП путём искусственного повышения
ВП (рис. 1), как и ПД, представляет собой
давления [27] подтверждает роль гидравличес-
переходную деполяризацию амплитудой не-
кой волны в его индукции, предполагая акти-
сколько десятков мВ, однако имеет гораздо
вацию механочувствительных ионных кана-
большую длительность, до нескольких десят-
лов [1, 16, 26]. В роли химического сигнала,
ков минут, и нерегулярную форму [1, 3, 7,
предположительно, выступает распространение
13, 16]. Отмечая большую продолжительность
из зоны повреждения по проводящим пучкам
ВП, в силу чего его часто обозначают как
«раневого вещества», вызывающего вход Са2+
«медленная волна потенциала» (SWP, slow wave
в клетку. Согласно современным представле-
potential), нужно подчеркнуть, что причиной
ниям, такими сигнальными молекулами мо-
этого является медленная фаза реполяризации
гут быть активные формы кислорода (АФК),
ВП, в то время как продолжительность депо-
продуцируемые NADPH-оксидазами, веро-
ляризации обычно не превышает нескольких
ятно, RBOHD (respiratory burst oxidase homo-
секунд, как и в случае ПД. ВП, в отличие от
log D) [28]. Системное распространение H2O2
ПД, не подчиняется правилу «всё или ничего»,
показано при действии типичных для ВП сти-
его амплитуда и длительность зависят от типа
мулов - при механическом повреждении, на-
стимула [18, 19] и площади повреждения [16].
греве и сильном свете [28-30]. В свою очередь,
Скорость распространения ВП составляет 0,1-
Са2+ способен активировать RBOHD, вызывая
10 мм/с. По мере удаления от места стимуляции
увеличение производства H2O2 [7, 31], что мо-
наблюдается декремент амплитуды и скорости
жет обеспечивать самоподдержание распро-
его распространения [1, 3, 6, 13]. Генерацию
страняющегося сигнала.
ВП вызывают повреждающие стимулы [1, 3],
Изложенные выше сведения о механиз-
такие как ожог [18, 19], механическое повреж-
мах генерации и распространения ЭС у выс-
дение [18, 20, 21] и нагрев [18, 19, 22].
ших растений были получены с применением
В качестве основного механизма формиро-
комплекса электрофизиологических методов,
вания ВП (рис. 1) длительное время рассматри-
включающих анализ градиентов электрохими-
валось исключительно переходное угнетение
ческого потенциала различных ионов, реги-
активности H+-ATPазы плазмалеммы [13, 16].
страцию сдвигов ионных концентраций при
Впоследствии было показано, что, наряду с
возбуждении, варьирование ионного состава
переходной инактивацией протонного насоса,
среды, ингибиторный анализ с применением
вклад в генерацию ВП вносят пассивные по-
блокаторов ионных каналов и др.
токи ионов Ca2+, Cl- и K+, которые, вероятно,
Прежде всего стоит отметить, что в основе
возникают при активации соответствующих
генерации ЭС лежат пассивные потоки ионов
ионных каналов [7, 23, 24]. Как и в случае ПД,
по градиенту концентрации [6, 32]. Для Ca2+
на начальном этапе генерации ВП происходит
присутствует значительный электрохимический
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1779
градиент ввиду низких концентраций Ca2+ в
доминировала точка зрения об отсутствии
цитозоле и высоких - в апопласте и внутри-
падения сопротивления, что являлось одним
клеточных компартментах, таких как вакуоль
из основных аргументов о ключевой роли
и ЭПР [33]. Содержание анионов в цитозоле
электрогенного H+-насоса, а не ионных ка-
превышает их содержание в апопласте [34],
налов, в формировании ВП [13, 16, 26]. Одна-
что в совокупности с отрицательным внутри-
ко впоследствии было зафиксировано паде-
клеточным электрическим потенциалом со-
ние сопротивления во время генерации ВП,
здаёт значительный направленный наружу
что указывает на активацию ионных кана-
градиент [6]. Для K+, находящегося близко к
лов [25, 26].
равновесному состоянию в покое, направлен-
Типы ионных каналов, активация которых
ный наружу градиент возникает при деполя-
обусловливает выявленные ионные потоки,
ризации [6, 32, 35].
формирующие ЭС, были исследованы с помо-
Вклад определённых ионов в генерацию
щью блокаторов. Так, участие Са2+-каналов в
ЭС исходно был исследован путём варьиро-
генерации ЭС было показано путём подавле-
вания ионного состава среды с оценкой его
ния ЭС La3+, блокатором Са2+-каналов всех ти-
влияния на параметры ЭС. Таким образом
пов, в случае как ПД [15, 41], так и ВП [22, 25].
было выявлено участие Са2+, Cl- и K+ в гене-
Применение более специфичных блокаторов,
рации ПД у высших растений [8, 13]. Также
а именно верапамила, блокирующего потен-
благодаря этому был установлен источник по-
циал-зависимые каналы, а также неомицина
вышения концентрации Ca2+ в цитозоле, кото-
и рутения красного, блокирующего выход
рым является внеклеточное депо, поскольку
Са2+ из внутриклеточных источников, показа-
хелатирование Ca2+ во внеклеточной среде ве-
ло участие соответствующих Са2+-каналов в
дёт к практически полному подавлению ПД
генерации ПД [15, 42, 43]. Gd3+, ингибитор ме-
и значительному, но не полному угнетению
ханочувствительных Са2+-каналов, подавлял
ВП [14, 25, 26].
распространение ВП в нераздражённые тка-
В силу большой длительности генерация
ни, но не подавлял генерацию ВП в зоне сти-
даже одиночного ЭС у растений, в отличие
муляции [24]. Блокаторы анионных каналов,
от животных, вызывает заметные сдвиги ион-
такие как этакриновая кислота, 5-нитро-2-(3-
ных концентраций. Относительные изменения
фенилпропиламино)-бензойная кислота (NPPB,
сильнее выражены в тех компартментах, где
5-nitro-2-(3-phenylpropylamino)-benzoic acid) и
концентрация соответствующего иона в покое
антрацен-9-карбоновая кислота (А-9-С, an-
низка - Са2+ в цитозоле, K+ и Cl- в апоплас-
thracene-9-carboxylic acid), снижают амплиту-
те [36, 37]. Изменения концентраций ионов
ду и скорость деполяризации ПД [15, 41, 43]
были зарегистрированы с помощью ряда ме-
и ВП [24, 25, 38]. Блокатор К+-каналов тетра-
тодов, таких как ион-селективные электро-
этиламмоний (ТЭА) замедляет фазу реполя-
ды [24, 38], измерение ионного потока вибри-
ризации ПД, а также увеличивает амплитуду
рующими микроэлектродами (MIFE)
[39],
импульса и снижает продолжительность де-
метод пламенной фотометрии и радиоактив-
поляризации [15, 41, 43]. Последнее указывает
ных индикаторов [8], а также ион-чувстви-
на то, что выход K+ начинается на фазе депо-
тельные химические или генетически кодируе-
ляризации ПД, т.е. имеет место перекрытие
мые флуоресцентные сенсоры [40]. Результаты
деполяризующих и реполяризующих ионных
свидетельствуют о входе в клетку Ca2+ и выходе
потоков. В отношении ВП показано увеличе-
из клетки K+ и Cl- при генерации как ПД, так
ние длительности фазы реполяризации под
и ВП [24, 26, 38]. Вышеуказанное в совокуп-
влиянием ТЭА [24, 25, 38].
ности с данными о направленности движу-
Таким образом, исходя из результатов элек-
щей силы подтверждает, что потоки указанных
трофизиологического анализа, можно заклю-
ионов являются пассивными, движущимися
чить, что генерация ПД связана с активацией
через ионные каналы по градиенту электро-
потенциал-зависимых Са2+-каналов, тогда как
химического потенциала.
генерация ВП связана, прежде всего, с акти-
Классическим способом оценки актива-
вацией лиганд-зависимых и механочувстви-
ции ионных каналов является измерение элек-
тельных Са2+-каналов. Анионные и K+-каналы
трического сопротивления мембраны при воз-
принимают участие в процессе генерации как
буждении. Генерация ПД у растений, как и в
ПД, так и ВП. Также в генерацию ЭС важный
случае нервного импульса, сопровождается
вклад вносит H+-ATPаза плазмалеммы.
снижением сопротивления мембраны, что слу-
Анализируя роль ионных каналов в гене-
жит доказательством активации ионных кана-
рации ЭС у высших растений, рассматри-
лов [26]. В отношении ВП длительное время
вают в первую очередь каналы плазмалеммы.
БИОХИМИЯ том 88 вып. 10 2023
5*
1
780
МУДРИЛОВ и др.
В то же время изменения ионных концентра-
Кальций-проницаемые каналы. Несмотря
ций могут быть обусловлены активацией кана-
на широко известную важность кальция для
лов, локализованных на мембранах внутри-
жизнедеятельности растений, в том числе как
клеточных компартментов, в первую очередь
вторичного мессенджера, у растений отсут-
самого крупного из них - вакуоли [33]. У харо-
ствуют каноничные ионные каналы с Са2+-
вых водорослей обнаружена электровозбуди-
селективными фильтрами. Вместо них у расте-
мость тонопласта и продемонстрирована роль
ний имеются Ca2+-проницаемые катионные
вакуоли в качестве источника Са2+ и Cl- при
каналы, способные пропускать также другие
генерации ЭС [10, 44]. Отдельные работы сви-
двух- и одновалентные катионы [45, 55], од-
детельствуют о сходной роли вакуоли у других
нако для удобства в большинстве работ это
растений [10, 15], в том числе продемонстри-
уточнение опускают, именуя их просто «Са2+-
рована электровозбудимость тонопласта и вы-
каналами», что сделано и в настоящем обзоре.
ход Са2+ из вакуоли на растениях арабидопси-
По электрофизиологическим характеристикам
са [44]. Это говорит о необходимости прини-
Са2+-каналы растений делят на три группы:
мать во внимание при анализе ионные каналы
активируемые деполяризацией Са2+-каналы
тонопласта, несмотря на отсутствие однознач-
(DACC, depolarization-activated Ca2+ channels),
ных данных о его роли в генерации ЭС у выс-
активируемые гиперполяризацией Ca2+-каналы
ших растений.
(HACC, hyperpolarization-activated Ca2+ chan-
Необходимо отметить, что на данный мо-
nels) и потенциал-независимые Ca2+-кана-
мент ни для одного из типов ЭС не идентифи-
лы (VICC, voltage-independent Ca2+ channels),
цирован полный набор генов ионных каналов,
иногда отдельно выделяя из последней груп-
с работой которых связано формирование фаз
пы механочувствительные каналы (MSCC,
деполяризации и реполяризации ЭС. Исходя
mechanosensitive Ca2+ channels). Ещё раз отме-
из анализа данных электрофизиологических
тим, что гены, кодирующие DACC плазма-
исследований, при отборе каналов, потенци-
леммы, до сих пор не выявлены. Са2+-Каналы
ально участвующих в генерации ЭС, следует
также классифицируют по кинетике актива-
руководствоваться следующими критериями:
ции, по которой их делят на быстро активиру-
1) селективность: прежде всего интересны кана-
ющиеся (за миллисекунды), медленно активи-
лы с Са2+-, K+- и Cl--проводимостью; 2) меха-
рующиеся (за секунды) и каналы импульсной
низм активации, возможность активации при
проводимости (1-3 мс) [45, 55].
деполяризации, механическом или химическом
С помощью молекулярно-генетических под-
стимуле; 3) локализация преимущественно на
ходов у высших растений на данный момент
плазмалемме (и, возможно, на тонопласте)
выявлены следующие семейства Са2+-каналов:
клеток проводящих тканей.
ионотропные глутаматные рецепторы (GLR,
glutamate-like receptor); каналы, управляемые
циклическими нуклеотидами (CNGC, cyclic
ИОННЫЕ КАНАЛЫ ВЫСШИХ РАСТЕНИЙ
nucleotide-gated channels); аннексины (ANN,
annexins); двухпоровые каналы (TPC, two-pore
К настоящему времени охарактеризова-
channels); каналы MID-1-комплементарной
ны с применением электрофизиологических
активности (MCA, Mid1-complementing activity
методов различные группы ионных каналов
channels); индуцирующиеся гиперосмоляль-
растений, однако, как подчёркнуто в обзоре
ностью Ca2+-каналы (OSCA1, hyperosmolal-
Demidchik et al. [45], во многом остаётся не-
ity-induced [Ca2+]i increase 1) и пьезоканалы
известно, какие гены кодируют эти каналы.
(Piezo) [45, 55], а также недавно выявленные
За последние два десятилетия соотнесение
быстро активируемые механочувствительные
молекулярно-генетических и электрофизиоло-
Ca2+-каналы (RMA, rapidly activated calcium
гических данных было в значительной сте-
mechanosensitive channel) [95].
пени выполнено для некоторых групп ион-
GLR представляют собой интегральные
ных каналов, таких как K+-каналы [46, 47].
мембранные белки, локализованные преиму-
В то же время для Са2+-каналов, в частности
щественно на плазмалемме и проявляющие
для Ca2+-каналов плазмалеммы, активируемых
активность неселективного лиганд-зависимо-
деполяризацией, кодирующие гены выявлены
го ионного канала, электрофизиологически
не были [45]. В данном разделе систематизи-
относящегося к VICC. Их лигандами могут
рованы данные по известным группам ионных
выступать различные аминокислоты и их
каналов, которые потенциально могут при-
производные, причём ряд активаторов явля-
нимать участие в формировании ЭС растений
ется специфичным для отдельных каналов
(таблица).
семейства [45, 48, 55]. Экспрессия генов GLR
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1781
Са2+-, K+- и анионные каналы высших растений и их характеристика
Клеточная
Тканевая
Канал
Селективность
Стимул
Регуляция
Ссылка
локализация
локализация
лист, корень,
GLR1.1
↓Ψw
[48]
цветок, стручки
GLR1.2
Ca2+
ПМ
лист, корень, пыльца
холод
Ser, Glu
[45, 48-51]
GLR1.3
ПМ
лист, стебель, корень
холод
[48, 49]
Trp, Met, Phe, Leu,
Na+, K+,
GLR1.4
ПМ
лист, корень, стебель
Tyr, Asn, Thr, Glu,
[45, 48, 52]
NH4+, Cl-
Gly, Arg
лист, стебель, корень,
GLR2.1
Glu
[48]
цветок, стручки
лист, корень,
[20, 48,
GLR3.1
Ca2+
ПМ
↓Ψw, МП
Met
ЗК, стебель
51, 53]
лист, стебель,
GLR3.2
NaCl, МП
Ser, Met, Gly
[20, 48, 53]
корень, ПТ
БС, МП,
Glu, Ala, Asn, Gln,
GLR3.3
Ca2+ > Na+ = K+
лист, корень, ПТ
[23, 48, 51]
Грв
Cys, Gly, Ser, GSH
лист, стебель,
холод,
Asn, Ser, Gly, Ala,
GLR3.4
Са2+ > Na+
ПМ, Т, ЭМ
[48, 54, 55]
корень, ЗК, ПТ
NaCl, Прик
Glu, Gln, Cys, Asp
GLR3.5
ПМ, ЭМ
↓Ψw, МП
Met
[48, 51, 56]
лист, стебель,
[23, 48,
GLR3.6
Ca2+ > Na+ = K+
ПМ
БС, МП
Glu
корень, ПТ
51, 57]
лист, стебель,
GLR3.7
Ca2+
ПМ
NaCl
[48]
корень
Са2+, K+, Pb+, Na+,
CNGC1
корень, лист
М
[58]
Zn2+, Mn2+, Cd2+
лист, ПТ,
CNGC2
Са2+, Na+, K+
ПМ
БС, нагрев
cAMP, ATP
[58, 59]
цветок, корень
корень, ПТ,
CNGC3
K+, Na+
ПМ, Т
NaCl
Na+
[58, 60]
лист, стебель
CNGC4
Са2+, Na+, K+
БС
[58]
CNGC5
Mg2+, Ca2+, Na+
ПМ
лист, корень, ЗК
Гип, cGMP
[61]
цветок > листья >
Гип, cAMP,
CNGC6
Mg2+, Ca2+, Na+
ПМ
> стручки > корень >
БС, нагрев
[58, 61, 62]
cGMP
> стебель, ЗК
CNGC7
ПМ
пыльца
[63]
CNGC8
корень > лист,
CNGC10
К+, Na+
ПМ, ЭМ
Грв, NaCl
[58, 64]
мезофилл, эпидермис
CNGC11
Са2+, К+
ПМ
БС
cAMP, cGMP
[65]
CNGC12
CNGC14
Са2+
ПМ
корень
Грв
Ауксины, ATP
[66, 67]
CNGC15
Са2+
ПМ, ядро
NO3-
[67, 68]
CNGC16
Са2+
пыльца
нагрев
cGMP
[69]
БИОХИМИЯ том 88 вып. 10 2023
1
782
МУДРИЛОВ и др.
Таблица (продолжение)
Клеточная
Тканевая
Канал
Селективность
Стимул
Регуляция
Ссылка
локализация
локализация
CNGC17
ПМ
cGMP
[70]
CNGC18
Са2+
ПМ
пыльца
cAMP, cGMP
[58]
CNGC19
Са2+
Т, ПМ, ЭМ
лист, корень, ПТ
БС, МП
Гип, cAMP, DAMP
[55, 58, 71]
корень, ЗК,
CNGC20
Т, ЭМ
NaCl
[58]
цветок, мезофилл
NaCl, МП,
ПМ, Т, ЭМ,
холод,
ANN1
Ca2+ = K+ > Na+
корень, эпидермис
OH•, H2O2, НМ
[72-77]
Цит
нагрев,
↓Ψw
лист, корень, цветок,
↓Ψw,
ANN2
Са2+
ПМ, Цит
CRY2
[72, 74]
гипокотиль, стручки
нагрев
корень, гипокотиль,
↓Ψw,
ANN3
Са2+
ПМ, Цит
CRY2
[74]
семядоли
нагрев
лист, корень, цветок,
↓Ψw, NaCl,
ANN4
Са2+, K+
ПМ, ЭМ
[73, 76]
стебель
холод
ЭМ, ядро,
цветок, стручки,
ANN5
Са2+ ?
[Са2+]cyt
[78, 79]
Цит
пыльца, корень
ANN8
ПМ, ядро
↓Ψw, NaCl
[80]
лист, ПТ, корень,
Деп, [Са2+]cyt,
[32, 45,
TPC1
Ca2+ ≈ K+ ≈ Na+
Т
цветок, эпидермис,
БС, NaCl
[Са2+]vac, ↓pH
55, 81]
мезофилл
лист, ПТ, стебель,
холод,
MCA1
Са2+
ПМ, Т, ЭМ
корень, цветок,
НМ
[82, 83]
↓Ψw, Грв
стручки, эпидермис
лист, ПТ, стебель,
MCA2
Са2+
ПМ, Т, ЭМ
корень, цветок,
холод, Грв
[82, 83]
стручки
K+ > Ba2+ ≈
лист, корень,
OSCA1.1
≈ Ca2+ > Na+ =
ПМ
↓Ψw
НМ
[84]
цветок, ЗК
= Mg2+ = Cs+
OSCA1.3
Са2+
ПМ
ЗК
БС
DAMP
[85]
OSCA1.7
Са2+?
БС
DAMP
[85]
лист, гипокотиль,
Piezo1
Са2+?
Т
БС, Прик
НМ
[86, 87]
корень, ПТ
DEK1
Са2+
ПМ
эпидермис
НМ
[88]
нагрев, M,
MSL1
Cl- ≈ K+
ЭМ, ПМ
НМ
[55, 89]
↓Ψw, NaCl
MSL2,
ЭМ, ПМ
↓Ψw
[90]
MSL3
MSL4
MSL5
ПМ
корень
НМ
[90]
MSL6
ПМ
MSL8
Cl- > Na+
пыльца
НМ
[45, 91]
ЭПР, Т
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1783
Таблица (окончание)
Клеточная
Тканевая
Канал
Селективность
Стимул
Регуляция
Ссылка
локализация
локализация
MSL9
Cl- > Ca2+
ПМ, ЭМ
↓Ψw
НМ
[90, 92]
MSL10
Cl- > Ca2+ ≈ Na+
ПМ, ЭМ
ПТ
↓Ψw
НМ
[90, 92-96]
БС, ↓Ψw,
SLAC1
Cl-, NO3-
ЗК, гипокотиль
АБК, Ca2+
[32, 97, 98]
Темн
SLAH1
Cl-, NO3-
корень
[32, 97, 98]
[32, 34,
SLAH2
NO3-
корень
97, 98]
Деп, pH,
[32, 34,
SLAH3
NO3-
корень, лист, ЗК
АБК, NO3-
97-99]
малат, фумарат >
лист, ЗК,
ALMT6
> цитрат,
Т
Ca2+, pH, малат
[100, 101]
цветок, корень
Cl-, NO3-
ALMT12/
малат и сульфат
ЗК
Деп, малат
[32, 98]
QUAC1
TMEM16A
ЭМ
Ca2+
[32, 102]
DTX33
корень, лист, ЗК,
Т
рН
[103]
DTX35
цветок, стебель
VCCN1
Cl- > NO3-
ЭМ
лист, цветок
свет
Деп, Са2+
[104]
БС, NaCl,
Деп, H2O2,
[47,
GORK1
K+, NH4+
корень, ЗК, лист
АФК
↓pH, Гип
105, 106]
корень, ПТ,
Деп, H2O2,
SKOR
K+ > Na+
[47, 107]
стебель, лист
[K+]in, ↓pH
[47,
KAT1
K+
ПМ, ЭМ
ЗК
свет
Гип, АБК
108-110]
[47,
KAT2
K+
ПМ
ЗК
Гип, ↓pH
108, 109]
KC1
K+
ПМ
корень, ЗК, лист
↓pH
[47, 109]
[47,
AKT1
K+ > Na+
ПМ
Корень
Гип, ↓pH
108, 109]
Гип, Ca2+,
[47, 105,
AKT2
K+
ПМ
ПТ
cAMP, ↓pH
109, 111]
ЗК, корень,
[Ca2+]cyt, АБК,
TPK1
K+ > NH4+ >> Na+
Т
мезофилл, ПТ,
NaCl
[47, 112]
CO2, ↓pH, ↑pH
пыльца
НМ, ↓pHcyt,
TPK4
K+ > NH4+ >> Na+
ПМ
корень, пыльца
[47, 113]
↓ΨW, [Ca2+]out
лист, стебель,
KCO3
K+
Т
↓Ψw
[47, 114]
корень, цветок, ПТ
SPIK
K+
ПМ
пыльца
Гип, ↓pH
[47, 115]
Примечание. Зачёркнутым отображено показанное отсутствие указанной селективности, локализации и т.д. Сокра-
щения: ПМ - плазматическая мембрана, Т - тонопласт, ЭМ - эндомембраны, Цит - цитозоль, ЗК - замыкающие
клетки, ПТ - проводящие ткани, ↓Ψw - осмотический стресс, БС - биотический стресс, М - тяжёлые металлы, МП -
механическое повреждение, АБК - абсцизовая кислота, Грв - гравитация, Прик - прикосновение, Темн - темнота,
НМ - натяжение мембраны, Деп - деполяризация, Гип - гиперполяризация, DAMP - молекулярный паттерн, свя-
занный с повреждением (damage-associated molecular pattern).
БИОХИМИЯ том 88 вып. 10 2023
1
784
МУДРИЛОВ и др.
наблюдается во всём растении, хотя некото-
TPC представлены в арабидопсисе един-
рые из них являются в той или иной степени
ственным геном TPC1, повсеместно экспрес-
органо- и тканеспецифичными (таблица). Ряд
сирующимся в тканях растения на вакуолярной
GLR имеет локализацию преимущественно в
мембране. Белок TPC1 является слабоселек-
проводящих тканях, по которым у растений
тивным катионным каналом с медленной ки-
происходит распространение ЭС [48, 55, 116].
нетикой активации, с небольшим преимуще-
Стимулы, индуцирующие активацию GLR,
ством для Са2+ [55, 116]. Известно, что TPC1
весьма разнообразны и включают засуху, хо-
активируется деполяризацией и цитозольным
лод, биотические стрессоры и механические
Са2+ [45, 55]. TPC1 участвует в защитном от-
повреждения [48, 51, 55, 116]. Хорошо извест-
вете на разнообразные стрессоры, такие как
но, что данный набор стимулов вызывает так-
засоление, наводнение, атаки вредителей и
же изменения как мембранного потенциала,
т.д., участвует в закрытии устьиц, гормональ-
так и внутриклеточной концентрации Са2+ [3],
ной регуляции и продукции АФК NADPH-
что в совокупности с локализацией делает ка-
оксидазами [45, 55, 116], т.е. физиологических
налы этой группы весьма вероятными канди-
процессах, регуляция которых связана с пе-
датами на участие в генерации ЭС в высших
редачей ЭС [1, 2, 4, 5, 7]. По таким критериям,
растениях.
как селективность, локализация на тонопласте
CNGC являются низкоселективными ка-
и механизм активации, канал TPC1 является
тионными каналами, структурно близкими к
перспективным кандидатом на роль участника
рассматриваемым далее K+-каналам шейкер-
в электрической сигнализации.
типа. Для ряда CNGC показана активация
Рассмотрение механочувствительных Са2+-
как циклическими нуклеотидами, такими как
каналов следует начать с каналов семейства
cAMP и cGMP, так и гиперполяризацией, что
MCA [45, 55], которые локализованы на плаз-
позволяет одновременно отнести их к элек-
малемме и особенно интенсивно экспресси-
трофизиологическим группам HACC и VICC
руются в проводящих тканях [55, 82, 90]. MCA
[45, 55, 58]. CNGC преимущественно локали-
активируются изменением натяжения мембра-
зованы на плазмалемме, а также присутствуют
ны, вызванным осмотическим стрессом, меха-
на ядерной мембране и тонопласте. Многие
ническим воздействием, холодом и другими
CNGC тканеспецифичны и в основном пред-
стимулами [82, 90, 116-118]. Проницаемость
ставлены в проводящих тканях, эпидермисе
для Са2+ и локализация в проводящих пучках
и замыкающих клетках [55, 58, 116]. Для ка-
выделяют данное семейство каналов как наи-
налов этой группы показано участие в вос-
более вероятных участников в генерации ЭС
приятии различных стимулов и/или защитном
среди механочувствительных Са2+-каналов.
ответе на стрессоры, в том числе те, которые
Каналы OSCA1 представляют собой сла-
вызывают изменение электрической актив-
боселективные катионные каналы плазма-
ности [3], включая засоление, засуху, измене-
леммы, локализованные преимущественно в
ние температуры, патогены, тяжёлые металлы
замыкающих клетках устьиц [45, 55]. Их акти-
и др. (таблица) [55, 58, 67, 116]. Локализация
вация происходит при изменении натяжения
CNGC на плазматической мембране клеток
мембраны, сами они при этом выступают ос-
проводящих тканей, а также их электрофи-
мосенсорами и регулируют закрытие устьиц,
зиологические свойства позволяют предпо-
хотя некоторые члены семейства, возможно,
ложить участие отдельных кандидатов этого
активируются молекулярными паттернами,
семейства каналов в генерации ЭС высших
связанными с повреждением (DAMP, damage-
растений.
associated molecular pattern), опосредованно
Аннексины представляют собой группу
через другие рецепторы и участвуют в защит-
цитоплазматических белков, способных свя-
ном ответе на патогены [55, 85]. Достаточно
зываться с фосфолипидами плазмалеммы, то-
специфичная локализация и функциональная
нопласта и мембраны ЭПР и выполнять функ-
роль каналов OSCA1 делают их маловероят-
ции низкоселективных катионных каналов,
ными участниками ЭС.
вероятно, относящихся к группе VICC [45, 55].
Другими механочувствительными канала-
Стимулы, индуцирующие активацию ряда
ми, выявленными у растений, являются пьезо-
каналов данного семейства, включают засу-
канал растений Piezo1 и не родственный ему,
ху, засоление, изменение температуры. В ка-
но также сходный по электрофизиологическим
честве регулятора активности аннексинов
характеристикам с пьезоканалом мыши канал
могут выступать АФК (таблица), которые,
RMA, кодируемый геном DEK1 (DEFECTIVE
как отмечено выше, могут служить индукто-
KERNEL1) из семейства фитокальпаинов. Оба
рами ВП [45, 55, 72-74].
канала представляют собой быстро активиру-
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1785
ющиеся и инактивирующиеся катионные ка-
преимущественно анионную проводимость
налы низкой проводимости [45, 55]. RMA рас-
у высших растений, несмотря на традицион-
положен преимущественно на плазмалемме
ное для многих обзоров причисление MSL к
эпидермальных клеток и, судя по всему, отве-
Са2+-каналам [45, 55]. Представители данного
чает за правильное формирование эпидермиса
семейства преимущественно локализованы
и нижележащих тканей [95]. Piezo1 распола-
на плазмалемме и мембране ЭПР (таблица).
гается главным образом в корневом чехлике,
Многие MSL-каналы плазмалеммы имеют
в проводящих тканях, в пыльце и пыльцевой
высокую ткане- и органоспецифичность и в
трубке, причём в последней локализуется пре-
основном представлены в корне, за исключе-
имущественно на тонопласте. Основные его
нием MSL8, экспрессирующегося в пыльце,
функции связаны с механочувствительностью
и MSL10, имеющего выраженную экспрессию
корней в твёрдом субстрате и противовирус-
в проводящих тканях наряду с корнем [45, 90,
ным иммунитетом [86, 87, 119]. Ограниченное
94, 96]. Каналы MSL активируются измене-
количество сведений о каналах Piezo1 и RMA
нием натяжения мембраны, в том числе при
на данный момент не позволяет сделать одно-
осмотическом стрессе, и отличаются относи-
значного заключения об их возможной роли
тельно высокой проводимостью по сравнению
в генерации ЭС растений.
с другими механочувствительными канала-
Можно заключить, что представители ряда
ми [45, 55, 90, 94]. Большинство членов семей-
семейств Са2+-каналов потенциально способ-
ства MSL, вероятно, нельзя отнести к числу
ны участвовать в формировании ЭС в расте-
участников генерации ЭС ввиду их специфич-
ниях. По таким критериям, как локализация,
ной роли и преимущественной локализации
механизм активации, индуцирующие стимулы
в корне. Однако один из членов семейства,
и функциональная роль, наиболее вероят-
MSL10, требует более детального рассмотре-
ными кандидатами являются отдельные члены
ния в качестве потенциального участника ме-
семейств каналов GLR, CNGC, ТРС1, МСА
ханизма генерации ЭС, так как он отвечает
и ANN.
большинству критериев: помимо механочув-
Анионные каналы. Многие анионные кана-
ствительности, селективности в отношении
лы растений проводят не только ионы хлора,
Cl- и локализации на плазматической мембра-
но и другие анионы, в число которых входят
не клеток проводящих пучков, он также обла-
нитраты, сульфаты и некоторые органические
дает способностью к активации продукции
анионы. Важным отличием анионных кана-
АФК при участии NADPH-оксидазы, рабо-
лов растений также является тот факт, что в
та которой, как отмечалось выше, может вно-
норме у растений анионы находятся в боль-
сить вклад в распространение ВП [55, 90, 94,
шей концентрации внутри клетки, чем сна-
96, 116, 117].
ружи, поэтому их градиент направлен наружу.
Члены семейства медленных анионных
По электрофизиологическим характеристикам
каналов (SLAC/SLAH, slow anion channel as-
анионные каналы традиционно подразделяют
sociated) относятся к каналам S-типа, локали-
на два типа: быстрые (R-тип) и медленные
зованным на плазмалемме. Между членами
(S-тип). Первые, R-типа, являются потенциал-
семейства существуют различия по селектив-
зависимыми, характеризуются быстрой акти-
ности: SLAH2 и SLAH3 преимущественно
вацией/деактивацией (в течение миллисекунд)
проводят нитраты и не проводят значимых
и преимущественно проводят хлориды, ни-
хлоридных токов, тогда как остальные каналы
траты и сульфаты, тогда как каналы S-типа,
семейства проводят как хлориды, так и нитра-
потенциал-независимые, со временем актива-
ты [32, 34, 98]. Имеются различия и в лока-
ции/деактивации около 10 с, имеют высокую
лизации: SLAH1 и SLAH2 преимущественно
проницаемость для нитратов и более низкую -
экспрессируются в корне, тогда как SLAC1 и
для остальных анионов [32, 34, 97, 98]. Стоит
SLAH3 имеют более широкую экспрессию, в
отметить, что данная классификация появи-
том числе в замыкающих клетках. Активация
лась при исследовании анионных каналов в
SLAC1 может быть вызвана различными сти-
замыкающих клетках, впоследствии также были
мулами, ряд из которых вызывает изменение
выявлены анионные каналы иных типов, на-
электрической активности, а именно: атакой
пример, выделяемые отдельно алюминий-чув-
патогенов, повышением концентрации СО2,
ствительные каналы, механочувствительные
засухой, темнотой и т.д., вероятно, по Са2+-за-
анионные каналы и анионные каналы эндо-
висимому пути. SLAH3, помимо Са2+-зависи-
мембран [32, 34].
мой регуляции, может активироваться депо-
Механочувствительно-подобные каналы
ляризацией и закислением цитозоля [32, 34,
(MSL, mechanosensitive-like channels) имеют
97-99]. Среди членов данного семейства SLAC1
БИОХИМИЯ том 88 вып. 10 2023
1
786
МУДРИЛОВ и др.
и SLAH3 можно отнести к потенциальным
Калиевые каналы. Сопоставление элек-
кандидатам на роль участников генерации ЭС
трофизиологических характеристик каналов
ввиду соответствия критериям селективности
и кодирующих их генов наиболее полно на
и регуляции.
сегодняшний день выполнено для K+-кана-
В качестве канала R-типа был выявлен
лов. Основным вариантом классификации
представитель семейства активированных алю-
K+-каналов является деление в зависимости
минием транспортеров малата (ALMT, alu-
от механизма активации и от типа наблюдае-
minum activated malate transporter), кодируемый
мой проводимости [35, 46, 47]. По механизму
геном ALMT12. Другое название ALMT12 -
активации их делят на потенциал-зависимые и
быстро активирующийся анионный канал
потенциал-независимые каналы. Потенциал-
(QUAC1, quickly activating anion channel 1) -
зависимые K+-каналы локализуются на плаз-
присвоено вследствие нетипичного для дан-
малемме, тогда как потенциал-независимые,
ного семейства отсутствия активации данного
за некоторым исключением, являются K+-ка-
канала алюминием [32, 34]. Канал QUAC1 ло-
налами эндомембран [46, 47]. Потенциал-за-
кализован на плазмалемме замыкающих кле-
висимые K+-каналы подразделяют на каналы
ток и участвует в закрытии устьиц, активиру-
внешнего (K
out
) и внутреннего (K
in
) выпрямле-
ется деполяризацией, имеет характерные для
ния, иногда выделяя из последних каналы сла-
каналов R-типа времена активации/деактива-
бой проводимости (Kweak) [35, 46, 120].
ции и проводит малат и сульфат. Другой член
На настоящий момент определены два
семейства, локализованный на тонопласте
семейства генов K+-каналов: K+-каналы шей-
ALMT6, обладает преимущественно малатной
кер-типа (Shaker) и двухпоровые K+-каналы
и фумаратной проводимостью, но также про-
(TPK, two-pore K+ channels). Все члены семей-
водит хлориды, активируется Са2+ и кислым
ства каналов шейкер-типа относятся к потен-
вакуолярным рН [100, 101]. Другие хорошо ис-
циал-зависимым каналам и, в свою очередь,
следованные на сегодняшний день представи-
делятся на каналы внешнего (GORK, SKOR)
тели ALMT в основном локализуются в корнях
и внутреннего выпрямления (AKT, KAT) [46].
и, судя по всему, проявляют специфическую
Иногда среди генов K
in
-каналов отдельно вы-
алюминий-зависимую активацию [32, 34, 98].
деляют ген KC1 (KAT3), кодирующий регу-
Среди членов семейства ALMT по электрофи-
ляторную субъединицу, не способную само-
зиологическим характеристикам QUAC1 мо-
стоятельно образовывать канал, но влияющую
жет выступать в роли участника механизма
на характеристики K
in
-каналов при присо-
генерации ЭС, однако сведения о его локали-
единении к ним [46, 109]. Все остальные гены
зации, имеющиеся на сегодня, скорее проти-
подгруппы K
in
-каналов шейкер-типа, KAT1,
воречат такой возможности.
KAT2, AKT1, AKT2, AKT5 и SPIK (AKT6), коди-
Среди других анионных каналов можно
руют субъединицы, формирующие каналы,
отметить представителей семейства перенос-
причём эти каналы могут формироваться как
чиков оттока детоксификации (DTX, detoxi-
гомомерами, так и гетеромерами, имеющими
fication efflux carrier), DTX33 и DTX35, лока-
несколько различающиеся электрофизиологи-
лизованных на тонопласте во многих тканях
ческие характеристики [47, 108]. Все каналы
растения. Эти каналы отвечают за потенциал-
этой подгруппы активируются гиперполя-
зависимый входящий ток хлоридов и других
ризацией и формируют входящие токи K+, за
анионов в вакуоль, механизмом их регуля-
исключением AKT2, способного выполнять
ции служит изменение рН [103]. Локализован-
также роль канала утечки [109, 111], и кото-
ный на мембране ЭПР белок, кодируемый
рый часто относят к выделяемой подгруп-
геном TMEM16, потенциально может функ-
пе Kweak [46, 47, 120].
ционировать как Са2+-активируемый анион-
K
out
-Каналов шейкер-типа в растениях вы-
ный канал [32, 102]. Также имеются сведения о
делено всего два, GORK (guard cell K+ outward
потенциал-зависимом Cl--канале тилакоидов
rectifying channel) и SKOR (Shaker-type K+ out-
VCCN1 (voltage-dependent Cl- channel 1), кото-
ward rectifying channel), они активируются
рый активируется деполяризацией и светом,
деполяризацией. Кроме того, их активация
но не Са2+, и участвует в регуляции фотосин-
может происходить с участием Са2+-зависи-
теза [104].
мых протеинкиназ, а также АФК, что говорит
Таким образом, с точки зрения потенци-
о возможной роли этих каналов в формиро-
ального участия в генерации ЭС среди выяв-
вании ЭС. Однако стоит отметить, что SKOR
ленных на данный момент анионных кана-
практически не экспрессируется за пределами
лов особое внимание следует обратить на
корня (таблица), поэтому вероятность его уча-
MSL10, QUAC1, SLAC1 и SLAH3.
стия в формировании ЭС в побегах довольно
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1787
мала, в отличие от широко экспрессирующе-
УЧАСТИЕ ИОННЫХ КАНАЛОВ
гося GORK [46, 47, 120].
В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
TPK (KCO) представляют собой потен-
циал-независимые каналы, локализованные
Прежде чем перейти к обсуждению полу-
на тонопласте, за исключением TPK4, нахо-
ченных на данный момент доказательств уча-
дящегося на плазмалемме (преимущественно
стия генетически идентифицированных ион-
пыльцы) [46, 47]. Для TPK1 показана актива-
ных каналов в генерации ЭС, следует кратко
ция Са2+ и закислением цитозоля (рН 6,7 при
остановиться на методических ограничениях
норме 7,5-7,8), он отвечает за выход вакуо-
в подобных исследованиях. Основным подхо-
лярного K+, например, при закрытии устьиц.
дом является использование мутантных линий
Также есть сведения о том, что данные каналы
растений с дефицитом или сверхэкспрессией
могут являться механочувствительными, вос-
интересующего гена, у которых такие пара-
принимая изменения кривизны тонопласта в
метры ЭС, как амплитуда, длительность, осо-
качестве осмосенсора. Что касается локализо-
бенности распространения и др., сопостав-
ванного на плазмалемме TPK4, то он рН-не-
ляются с параметрами ЭС растений дикого
чувствителен и блокируется внеклеточным
типа (рис. 2). Наличие различий рассматри-
Са2+ [47, 90, 112, 117].
вают как свидетельство участия определён-
Таким образом, из выявленных на дан-
ного ионного канала в процессах генерации
ный момент K+-каналов только GORK и TPK1
и распространения ЭС [20, 53, 93, 121]. По-
являются наиболее вероятными участниками
мимо непосредственного сравнения парамет-
формирования ЭС у высших растений.
ров ЭС, может применяться одновременная
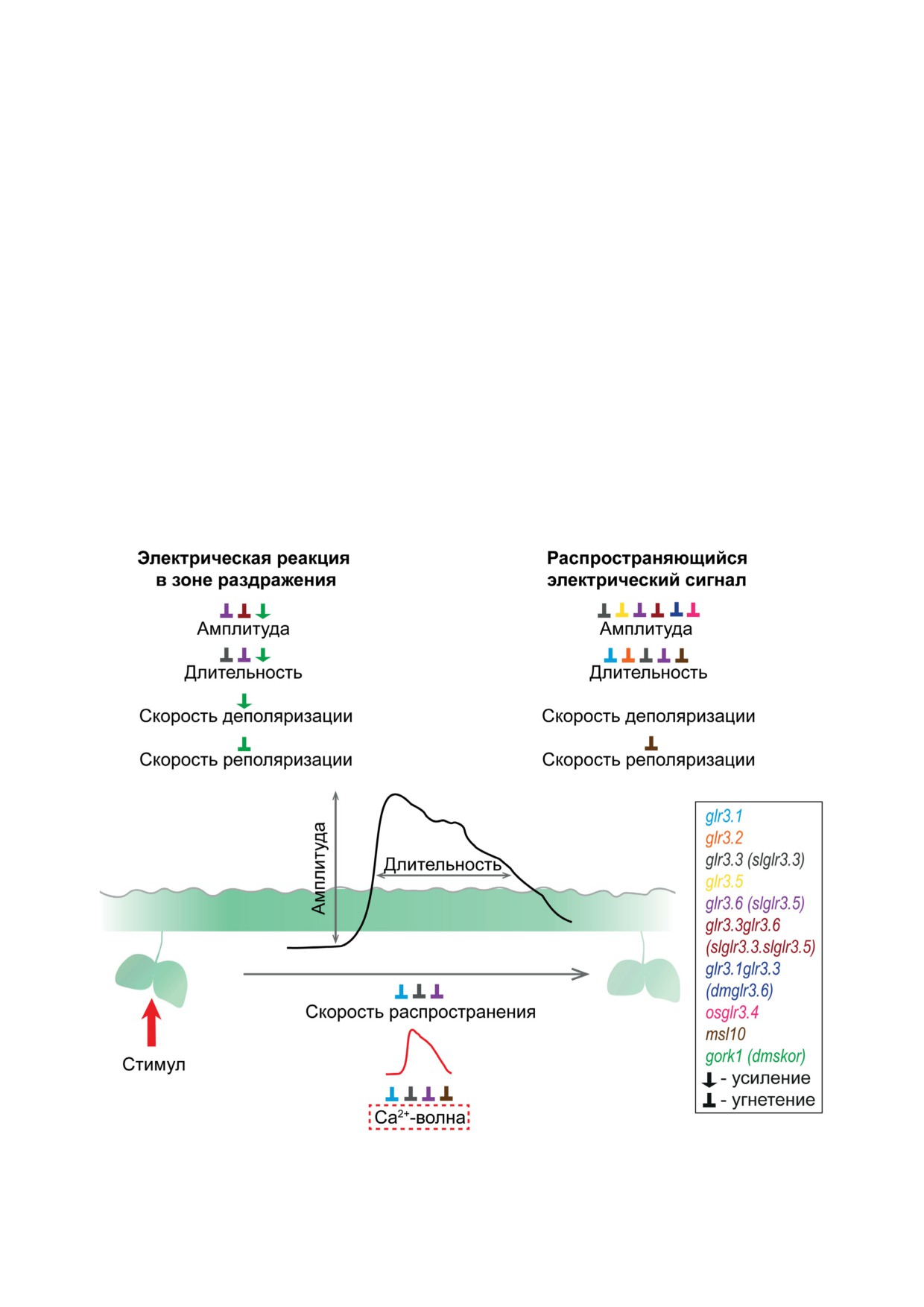
Рис. 2. Схема влияния нокаут-мутаций по генам ионных каналов на параметры электрического сигнала и волну Са2+
в высших растениях. Чёрная линия обозначает мембранный потенциал, красная - волну Са2+. Цвет стрелки обозна-
чает тип нокаут-мутации (пояснения в тексте)
БИОХИМИЯ том 88 вып. 10 2023
1
788
МУДРИЛОВ и др.
регистрация изменений ионных концентра-
в листьях растений glr3.3glr3.6 по сравнению
ций, опосредуемых изучаемыми каналами,
с диким типом [23]. В случае одиночных му-
и сравнение характера этих изменений как
тантов glr3.3 и glr3.6 наблюдается лишь сни-
между различными линиями, так и с парамет-
жение амплитуды и длительности распростра-
рами ЭС [23, 53, 122]. Кроме того, в качестве
няющегося ВП [20, 53, 122]. Отметим, что если
доказательства участия конкретных каналов
в составе ВП, индуцированного рассечением
в генерации ЭС может использоваться их ис-
листа, имеется быстрая импульсная ПД-образ-
кусственная активация или деактивация спе-
ная компонента, а также медленная волна де-
цифичными для них лигандами, вызываю-
поляризации, то в мутантах glr3.6 подавляется
щая типичные изменения мембранного по-
только последняя [56]. Что касается GLR3.3,
тенциала, однако такой подход ограничен ли-
то он в сравнении с GLR3.6, возможно, вно-
ганд-активируемыми каналами [23, 123]. Выше-
сит больший вклад в формирование ответа на
описанные методы имеют также свои недо-
термические воздействия, поскольку двойная
статки, одним из которых является возможное
мутация glr3.1glr3.3 также полностью подав-
взаимодействие кодируемых разными генами
ляла реакцию на ожог лазером, но не на меха-
субъединиц для формирования полноцен-
ническое повреждение [53]. Важно отметить,
ного гетеромерного канала при возможности
что при сопоставлении мутантов glr с диким
сборки гомомерного канала. Характеристики
типом в случае одновременной регистрации ди-
и возможная функциональная роль гомо- и
намики концентрации Са2+ и динамики элек-
гетеромерных комплексов могут различать-
трического потенциала, индуцированных ло-
ся
[47, 109, 124]. При этом исследования с
кальным воздействием, были выявлены их
двойными и более мутантами также не могут
согласованные изменения: в мутантных расте-
однозначно показать, связано ли изменение
ниях с дефицитом GLR были подавлены как
параметров ЭС с тем, что не формируются
Са2+-волна, так и ВП [23, 53, 122]. Это свиде-
определённые гетеромерные каналы, или же
тельствует о непосредственной связи измене-
подавлен ряд гомомерных каналов, принимаю-
ний концентрации Са2+, опосредованных ка-
щих участие в генерации ЭС [20, 53, 122].
налами GLR, и генерации ВП.
Интерпретацию результатов затрудняет и
В ряде работ была проведена искусствен-
наличие компенсаторного механизма в случае
ная активация каналов GLR путём добавле-
участия в генерации ЭС нескольких каналов,
ния глутамата, что вызвало как рост концен-
когда дисфункция подавляемого гена компен-
трации Са2+ в цитозоле [57], так и генерацию
сируется повышенной экспрессией другого,
ЭС [23]. Причём в мутантных растениях glr3.3
выполняющего ту же или близкую роль [77].
и glr3.6 добавление глутамата практически
И наконец, для некоторых каналов показано,
не вызывало ни роста концентрации Са2+, ни
что они способны выполнять некоторые свои
ЭС [23, 57]. В свете этого, с учётом данных о
функции, например, регуляцию клеточной
пространственно-временной динамике Са2+,
смерти, за счёт неканальных субъединиц [125].
стоит отметить потенциальную возможность
Таким образом, хотя использование мутантов
участия GLR3.3 и GLR3.6 в дистанционном
не даёт однозначного ответа, на сегодня нет
сигнале в ответ на прикосновение [126] и на-
иного подхода для сопоставления электрофи-
падение тлей [121], а для GLR3.3 - и на соле-
зиологических и молекулярно-генетических
вой стресс [127].
данных на уровне организма.
О роли GLR в формировании ЭС сви-
Наиболее исследованными участниками
детельствуют также данные, полученные на
генерации ЭС в растениях являются Са2+-
растениях томата (Solanum lycopersicum L.):
каналы, прежде всего из семейства GLR
у двойных мутантов по SlGLR3.3 и SlGLR3.5
(рис. 2) [51]. В двойных мутантах арабидоп-
(гомологи GLR3.3 и GLR3.6 арабидопсиса)
сиса по GLR3.3 и GLR3.6 (glr3.3glr3.6) наблю-
происходило полное подавление распростра-
дается полное подавление распространения
нения ВП в соседние листочки при механи-
ВП за пределы раздражаемого листа в ответ на
ческом повреждении, тогда как в самом раз-
механическое повреждение [20, 21, 53, 56, 122],
дражаемом листе имело место лишь снижение
нападение грызущих насекомых [20], сильный
амплитуды [128].
свет [122] и повреждение лазером [53]. При
Преимущественная экспрессия GLR3.3 и
этом в раздражаемом листе амплитуда элек-
GLR3.6 в проводящих пучках является допол-
трической реакции снижается, но не подав-
нительным свидетельством участия соответ-
ляется полностью [20, 21, 56]. При механиче-
ствующих каналов в системном распростране-
ском повреждении корней также происходит
нии ЭС. Так, в листьях арабидопсиса показана
уменьшение амплитуды и длительности ЭС
их выраженная экспрессия как в первичных,
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1789
так и во вторичных и в третичных пучках. Сто-
Другим типом каналов, для которых уча-
ит отметить, что в первичных проводящих пуч-
стие в формировании ЭС было определено с
ках GLR3.3 экспрессируется прежде всего во
помощью молекулярно-генетического подхо-
флоэме, тогда как GLR3.6 - в ксилеме [53, 57].
да, являются анионные каналы, относящиеся
Для других потенциальных кандидатов
к семейству механочувствительных каналов
из данного семейства показано, что у мутан-
MSL (рис. 2). В мутантах msl10 наблюдается
тов по GLR3.1 и GLR3.2 происходит снижение
уменьшение длительности системно распро-
амплитуды и длительности ЭС в ответ на ме-
страняющегося ВП, индуцированного механи-
ханическое повреждение и повреждение лазе-
ческим повреждением, за счёт исчезновения
ром [20, 53], однако даже в двойных мутантах,
выделенной авторами в составе ВП фазы «мед-
за исключением ранее упомянутого glr3.1glr3.3,
ленной деполяризации». ВП в растениях msl10
реакция не подавлялась полностью ни систем-
проявлял сходство по своим характеристикам
но, ни локально [53]. Для GLR3.1 при этом
с ВП в одиночных мутантах glr3.3 и glr3.6.
предполагается участие в распространении ЭС
При этом для других мутантов семейства MSL,
за пределами проводящих пучков вследствие
а именно msl4, msl5, msl6 и msl9, никаких изме-
нарушения ассоциированного с ЭС ради-
нений в параметрах ВП не было выявлено [93].
ального распространения Са2+-сигнала [53].
Как отмечено выше, экспрессия MSL10 на-
Каналы, кодируемые GLR3.5, могут отвечать
блюдается в проводящих пучках, включая как
за формирование ПД-образной фазы ЭС в
флоэму, так и ксилему. Канал MSL10 показы-
ответ на механическое повреждение, однако,
вает анионную, однако не кальциевую прово-
возможно, картина несколько сложнее. Так, в
димость [93, 132]. Тем не менее работа MSL10,
мутантных растениях ПД-образная фаза от-
судя по всему, активирует приток Са2+ в клет-
сутствовала в нераздражённых листьях, имею-
ку при механическом повреждении через
щих прямые сосудистые связи с раздражаемым
GLR3.3 и GLR3.6. При этом было продемон-
листом (в отличие от дикого типа), но присут-
стрировано, что начальная стадия деполяри-
ствовала в нераздражённых листьях, имеющих
зации опережает по времени начало измене-
непрямые сосудистые связи с раздражаемым
ний концентрации Са2+ [93], что подвергает
листом (в которых у растений дикого типа
сомнению общепринятый механизм генера-
ПД-образная фаза отсутствовала) [56]. Это
ции ВП.
служит ещё одним свидетельством сложности
И наконец, был выявлен канал, обеспе-
и многогранности процессов генерации и рас-
чивающий поток К+ в ходе фазы реполяриза-
пространения ЭС в растениях, особенности
ции ПД - GORK1. В мутантах gork1 амплитуда
которых ещё предстоит выяснить.
и скорость деполяризации индуцированного
Канал DmGLR3.6 венериной мухоловки,
электрическим током ПД была выше по срав-
гомолог GLR3.1/3.3 арабидопсиса, потенциаль-
нению с диким типом, тогда как реполяри-
но может участвовать в распространении ПД,
зация была значительно медленнее (рис. 2).
индуцированного прикосновением, из сен-
Последующее математическое моделирование
сорного волоска в лист ловушки, о чём свиде-
подтвердило участие этого канала в гене-
тельствует специфичная картина экспрессии
рации ПД. Кроме того, было показано, что
данного гена и возможность индукции ПД глу-
GORK1 активируется ещё на фазе деполяриза-
таматом в листе-ловушке [129, 130]. Для одно-
ции, в норме уменьшая её скорость и ампли-
дольных на примере риса (Oryza sativa L.) среди
туду [105]. Также в этой работе было обна-
GLR можно выделить ген OsGLR3.4, кодирую-
ружено, что другой К+-канал, AKT2, может
щий Са2+-канал, сходный по функциональ-
влиять на генерацию ПД, однако не напря-
ной роли с GLR3.3 и GLR3.6 арабидопсиса:
мую, а через регуляцию возбудимости плазма-
в дефицитных по этому каналу мутантах риса
леммы [105].
частично подавляется системное распростра-
В недавних исследованиях на венери-
нение ВП при механическом повреждении, ло-
ной мухоловке было выявлено участие двух
кальная электрическая реакция при этом не
К+-каналов: DmSKOR, относящегося к той же
подавляется [123]. Также стоит отметить, что
группе, что и ранее рассмотренный GORK1,
канал OsGLR3.4 может активироваться сразу
и KDM1 - гомолога KAT1 арабидопсиса [37,
несколькими аминокислотами [123], в отличие
129]. Подавление экспрессии DmSKOR коро-
от глутамат-специфичных GLR3.3 и GLR3.6
натином, угнетающим в венериной мухолов-
арабидопсиса [23], что может быть обусловле-
ке экспрессию генов, связанных с возбуди-
но тем, что OsGLR3.4 находится относительно
мостью, приводило к увеличению времени
далеко от GLR3.3 и GLR3.6 с филогенетической
реполяризации при генерации механически
точки зрения [131].
индуцированного ПД в листе-ловушке, что мо-
БИОХИМИЯ том 88 вып. 10 2023
1790
МУДРИЛОВ и др.
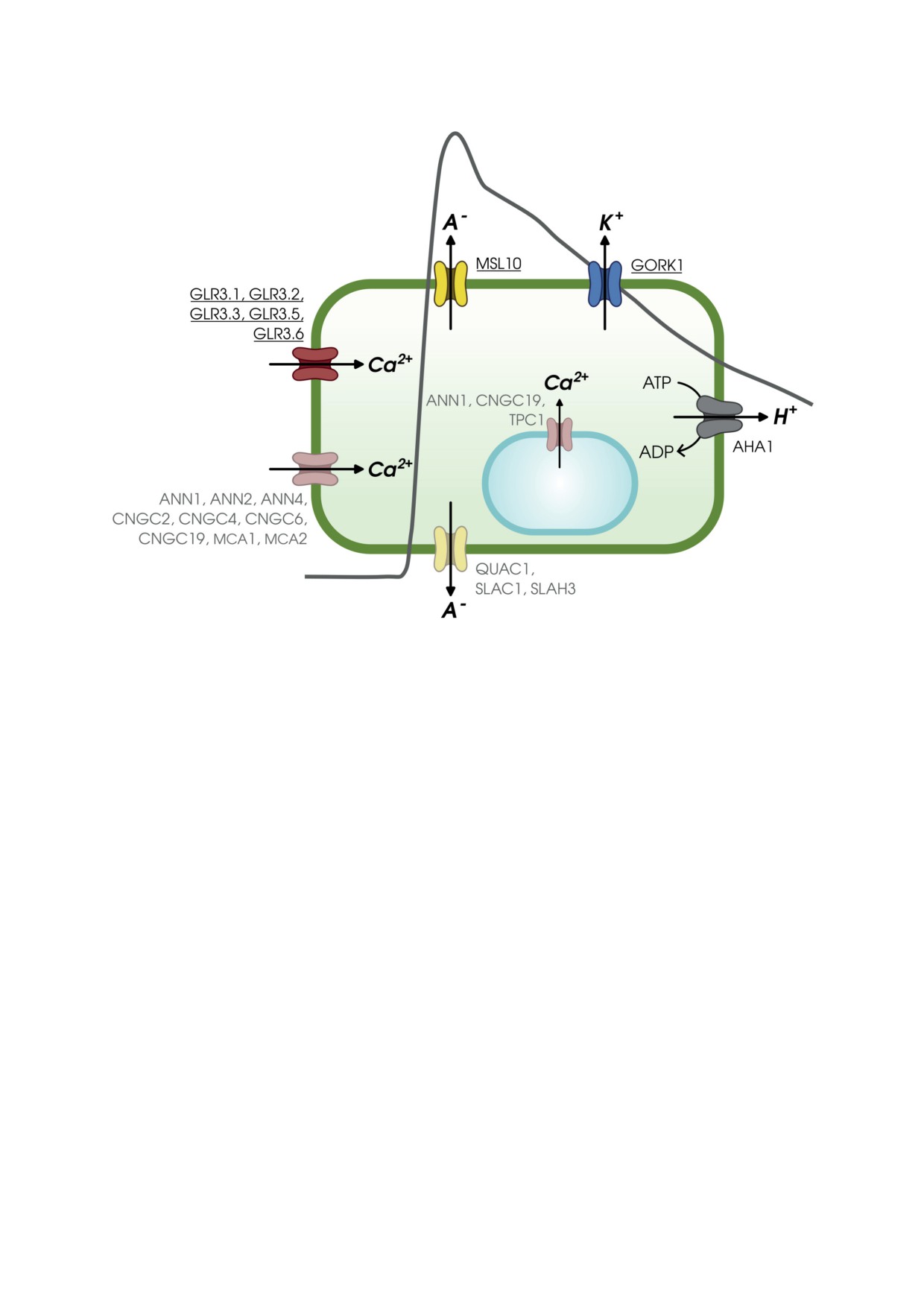
Рис. 3. Ионные каналы, принимающие участие в генерации и распространении ЭС в клетке высших растений. Рас-
положение ионных каналов соответствует определённой фазе процесса генерации ЭС, в формирование которой они
вносят вклад, за исключением Ca2+-каналов, которые могут активироваться на разных стадиях процесса формиро-
вания ЭС. Ионные каналы, для которых экспериментально подтверждено участие в генерации ЭС, обозначены
подчёркнутым шрифтом. Ионные каналы, для которых потенциально возможно участие в генерации ЭС, обозна-
чены обычным шрифтом. A- - анионы. На схеме также обозначена H+-ATPаза AHA1, которая вносит вклад в гене-
рацию ЭС [2, 7]
жет говорить об участии DmSKOR в форми-
лу TPC1 наблюдалось снижение амплитуды и
ровании фазы реполяризации ПД [129, 130].
скорости волны Са2+ в ответ на засоление
KDM1 представляет собой активируемый ги-
[81, 133] и механическое повреждение [134].
перполяризацией и кислым рН апопласта ка-
В случае атаки тлей сверхэкспрессия TPC1
нал, локализованный исключительно в меха-
приводит к развитию системного повышения
ночувствительных волосках и отвечающий за
концентрации Са2+, которое не наблюдается
вход K+ в клетку. Математическое моделиро-
в диком типе [121]. Тем не менее для засоле-
вание и сопоставление с экспериментальными
ния и механического повреждения авторы
данными показало, что роль данного канала
предположили лишь вспомогательную роль
состоит в восстановлении концентрации K+ в
TPC1, заключающуюся в усилении сдвига
ходе генерации серий ПД, приводящих к за-
концентрации Са2+, инициируемого другими
хлопыванию ловушки венериной мухоловки и
каналами
[133, 134]. Продемонстрированная
инициирующих выработку пищеварительных
роль TPC1 в формировании Са2+-волны при
ферментов [37].
различных стимулах, предположения о роли
На потенциальный вклад определённых
тонопласта в генерации ЭС [44], а также дан-
каналов в генерацию ЭС могут указывать воз-
ные ингибиторного анализа [15, 42] в совокуп-
действия мутаций не только на параметры
ности указывают на непосредственное участие
собственно ЭС, но также и на параметры Са2+-
TPC1 в генерации ЭС. Вклад в формирова-
сигнала вследствие высокого сходства в дина-
ние Са2+-сигнала был показан и для канала из
мике концентрации Са2+ и изменений элек-
другого семейства, CNGC19, локализованного
трического потенциала при возбуждении [53,
на плазмалемме клеток флоэмы: было выяв-
129]. Так, у мутантов по вакуолярному кана-
лено его участие в повышении концентрации
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1791
Са2+ в ответ на нападение грызущих насеко-
QUAC1, SLAC1 и SLAH3 отсутствуют, однако
мых, причём активация CNGC19 может быть
их свойства свидетельствует о потенциальном
опосредована как Рер1 (Protein elicitor pep-
вкладе в генерацию ЭС.
tide 1) - одним из DAMP, выделяющимся при
повреждении клеток - так и непосредственно
cAMP, содержание которого также повышается
ЗАКЛЮЧЕНИЕ
при повреждении [71].
Помимо результатов исследований рас-
В завершение анализа молекулярных ме-
пространяющегося Са2+-сигнала, можно при-
ханизмов электрической сигнализации у выс-
влечь данные по изменениям концентрации
ших растений констатируем необходимость
Са2+ в зоне действия стимула, в частности, на
большого объёма дальнейших исследований.
примере таких хорошо изученных стимулов,
Наибольший результат может принести со-
как охлаждение и нагрев. Работы на мутан-
средоточение усилий на решении следую-
тах по МСА1 и МСА2 [118], ANN1 и ANN4 [73],
щих вопросов: идентификация молекулярной
OsCNGC14 и OsCNGC16 (гомологи CNGC2 и
природы потенциал-зависимых Ca2+-каналов
CNGC4 арабидопсиса) [135] показали сниже-
плазмалеммы, ответственных за инициацию
ние амплитуды роста концентрации Са2+ в
ПД, возникновение которого у растений имеет
цитозоле, индуцированного холодом, по срав-
место при достижении пороговой деполяри-
нению с диким типом. При этом амплитуда
зации [8], и поиск генов, кодирующих ион-
снижается и под действием ингибиторов, по-
ные каналы, в растениях различных видов,
давляющих ПД, что вместе с характерной
включая традиционные для электрофизио-
формой Са2+-сигнала позволяет предположить
логических исследований локомоторные и на-
участие этих каналов в генерации электриче-
секомоядные растения. Наряду с этим необ-
ской реакции в зоне охлаждения [73, 118, 135].
ходимо изучение многообразия электрической
Отметим, что ни в одном из мутантов, в том
сигнализации у растений как в отношении
числе двойных [118], рост концентрации Са2+
различных типов ЭС, так и в отношении осо-
не был подавлен полностью. К тому же при
бенностей ЭС у растений различных видов.
условном суммировании доли его снижения
Наилучший результат может дать объединение
от разных мутаций получается значительно
в рамках единого исследования электрофизио-
более 100%, что явно свидетельствует либо
логических и генетических подходов в сочета-
о компенсаторной экспрессии иных генов,
нии с методами анализа ионных концентра-
либо о разных участниках изменения уровня
ций в интактных растениях, в частности, на
Са2+ в разных видах растений [73, 118, 135].
основе генетически кодируемых флуоресцент-
Для другого хорошо изученного стимула -
ных сенсоров.
нагрева - показано подавление волны Са2+ в
Идентификация и характеризация участ-
цитозоле у мутантов по генам CNGC2, CNGC6,
вующих в генерации ЭС ионных каналов
OsCNGC14, OsCNGC16, ANN1 и ANN2 в от-
внесёт значительный вклад не только в рас-
вет на стимул, причём в диком типе инду-
шифровку механизмов возбуждения у расте-
цированный нагревом рост уровня Са2+ по
ний, но также и в формирование целостной
форме и длительности напоминает ВП [62,
картины функциональной роли ЭС, посколь-
72, 135, 136]. Изложенное указывает, что пе-
ку индукция распространяющимся ЭС функ-
речисленные каналы могут вносить вклад
ционального ответа базируется на измене-
в генерацию электрической реакции в зоне
ниях концентрации ионов в клетках и тканях,
раздражения при действии соответствующего
вызванных распространением ЭС [5, 6]. Впо-
стимула.
следствии это будет способствовать решению
В целом, на данный момент можно до-
таких важных вопросов, как возможность пе-
статочно уверенно говорить, что в генерации
редачи информации при участии ЭС у расте-
распространяющихся ЭС у высших растений
ний [3] и взаимодействие электрической сиг-
участвуют такие Са2+-каналы, как GLR3.1,
нальной системы с другими типами сигнальных
GLR3.2, GLR3.3, GLR3.5 и GLR3.6, анион-
систем, таких как гормональная, кальциевая
ный канал MSL10 и K+-канал GORK1 (рис. 3).
и АФК [1, 2, 4, 7].
Потенциальными участниками генерации ЭС
также являются Са2+-каналы ANN1, ANN2,
Вклад авторов. В.А. Воденеев - концеп-
ANN4, CNGC2, CNGC4, CNGC6, CNGC19,
ция и руководство работой; М.А. Мудрилов,
а также вакуолярный TPC1 и механочувстви-
М.М. Ладейнова, Д.В. Кузнецова и В.А. Во-
тельные MCA1 и MCA2. Экспериментальные
денеев
- поиск материала; М.А. Мудрилов
доказательства участия анионных каналов
и М.М. Ладейнова
- написание текста;
БИОХИМИЯ том 88 вып. 10 2023
1
792
МУДРИЛОВ и др.
М.М. Ладейнова и Д.В. Кузнецова - оформле-
Конфликт интересов. Авторы заявляют об
ние рисунков; М.А. Мудрилов, М.М. Ладейнова
отсутствии конфликта интересов.
и В.А. Воденеев - редактирование текста.
Соблюдение этических норм. Настоящая
Финансирование. Работа выполнена за счёт
статья не содержит описания выполненных ав-
гранта Российского научного фонда (проект
торами исследований с участием людей или ис-
№ 22-14-00388).
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Huber, A. E., and Bauerle, T. L. (2016) Long-distance
11.
Lunevsky, V. Z., Zherelova, O. M., Vostrikov, I. Y.,
plant signaling pathways in response to multiple
and Berestovsky, G. N. (1983) Excitation of Characeae
stressors: the gap in knowledge, J. Exp. Bot., 67,
cell membranes as a result of activation of calcium
2063-2079, doi: 10.1093/jxb/erw099.
and chloride channels, J. Membr. Biol., 72, 43-58,
2.
Johns, S., Hagihara, T., Toyota, M., and Gilroy, S.
doi: 10.1007/BF01870313.
(2021) The fast and the furious: rapid long-range
12.
Воденеев В. А., Катичева Л. А., and Сухов В. С.
signaling in plants, Plant Physiol., 185, 694-706,
(2016) Электpичеcкие cигналы у выcшиx pаcте-
doi: 10.1093/plphys/kiaa098.
ний: меxанизмы генеpации и pаcпpоcтpанения,
3.
Mudrilov, M., Ladeynova, M., Grinberg, M.,
Биофизика, 61, 598-606.
Balalaeva, I., and Vodeneev, V. (2021) Electrical
13.
Fromm, J., and Lautner, S. (2007) Electrical signals
signaling of plants under abiotic stressors: transmission
and their physiological significance in plants: electrical
of stimulus-specific information, Int. J. Mol. Sci., 22,
signals in plants, Plant Cell Environ., 30, 249-257,
10715, doi: 10.3390/ijms221910715.
doi: 10.1111/j.1365-3040.2006.01614.x.
4.
Ladeynova, M., Kuznetsova, D., Mudrilov, M.,
14.
Hodick, D., and Sievers, A.
(1988) The action
and Vodeneev, V. (2023) Integration of electrical
potential of Dionaea muscipula Ellis, Planta, 174, 8-18,
signals and phytohormones in the control of systemic
doi: 10.1007/BF00394867.
response, Int. J. Mol. Sci., 24, 847, doi: 10.3390/
15.
Krol, E., Dziubinska, H., Stolarz, M., and
ijms24010847.
Trebacz, K. (2006) Effects of ion channel inhibitors
5.
Sukhov, V., Sukhova, E., and Vodeneev, V. (2019)
on cold- and electrically-induced action potentials in
Long-distance electrical signals as a link between
Dionaea muscipula, Biol. Plant.,
50,
411-416,
the local action of stressors and the systemic phys-
doi: 10.1007/s10535-006-0058-5.
iological responses in higher plants, Prog. Biophys.
16.
Stahlberg, R., Cleland, R. E., and Van Volkenburgh, E.
Mol. Biol., 146, 63-84, doi: 10.1016/j.pbiomolbio.
(2006) Slow wave potentials - a propagating elec-
2018.11.009.
trical signal unique to higher plants, in Commu-
6.
Klejchova, M., Silva-Alvim, F. A. L., Blatt, M. R., and
nication in Plants (Baluška, F., Mancuso, S., and
Alvim, J. C. (2021) Membrane voltage as a dynamic
Volkmann, D., eds), Springer Berlin Heidelberg,
platform for spatiotemporal signaling, physiological,
Berlin, Heidelberg, pp. 291-308, doi: 10.1007/978-3-
and developmental regulation, Plant Physiol., 185,
540-28516-8_20.
1523-1541, doi: 10.1093/plphys/kiab032.
17.
Li, Q., Wang, C., and Mou, Z. (2020) Perception of
7.
Farmer, E. E., Gao, Y., Lenzoni, G., Wolfender, J.,
damaged self in plants, Plant Physiol., 182, 1545-1565,
and Wu, Q. (2020) Wound- and mechanostimulated
doi: 10.1104/pp.19.01242.
electrical signals control hormone responses, New
18.
Vodeneev, V., Mudrilov, M., Akinchits, E., Bala-
Phytol., 227, 1037-1050, doi: 10.1111/nph.16646.
laeva, I., and Sukhov, V. (2018) Parameters of elec-
8.
Опритов В. А., Пятыгин С. С., Ретивин В. Г.
trical signals and photosynthetic responses induced
(1991) Биоэлектрогенез у высших растений, Наука,
by them in pea seedlings depend on the nature of
Москва.
stimulus, Funct. Plant Biol., 45, 160, doi: 10.1071/
9.
Bulychev, A. A., and Komarova, A. V.
(2014)
FP16342.
Long-distance signal transmission and regulation of
19.
Mudrilov, M., Ladeynova, M., Berezina, E., Grin-
photosynthesis in characean cells, Biochemistry (Mos-
berg, M., Brilkina, A., Sukhov, V., and Vodeneev, V.
cow), 79, 273-281, doi: 10.1134/S0006297914030134.
(2021) Mechanisms of specific systemic response in
10.
Kisnieriene, V., Trębacz, K., Pupkis, V., Koselski, M.,
wheat plants under different locally acting heat stimuli,
and Lapeikaite, I. (2022) Evolution of long-distance
J. Plant Physiol.,
258-259,
153377, doi:
10.1016/
signalling upon plant terrestrialization: compar-
j.jplph.2021.153377.
ison of action potentials in Characean algae and
20.
Mousavi, S. A. R., Chauvin, A., Pascaud, F.,
liverworts, Ann. Bot., 130, 457-475, doi: 10.1093/
Kellenberger, S., and Farmer, E. E. (2013) Glutamate
aob/mcac098.
receptor-like genes mediate leaf-to-leaf wound
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1793
signalling, Nature,
500,
422-426, doi:
10.1038/
AtRbohF, Biochim. Biophys. Acta, 1833, 2775-2780,
nature12478.
doi: 10.1016/j.bbamcr.2013.06.024.
21.
Salvador-Recatalà, V., Tjallingii, W. F., and Farmer,
32.
Hedrich, R. (2012) Ion channels in plants, Physiol.
E. E. (2014) Real-time, in vivo intracellular recordings
Rev., 92, 1777-1811, doi: 10.1152/physrev.00038.2011.
of caterpillar-induced depolarization waves in sieve
33.
Costa, A., Navazio, L., and Szabo, I. (2018) The
elements using aphid electrodes, New Phytol., 203,
contribution of organelles to plant intracellular calcium
674-684, doi: 10.1111/nph.12807.
signalling, J. Exp. Bot., 69, 4175-4193, doi: 10.1093/
22.
Julien, J. L., Desbiez, M. O., De Jaegher, G., and
jxb/ery185.
Frachisse, J. M. (1991) Characteristics of the wave
34.
Kollist, H., Jossier, M., Laanemets, K., and
of depolarization induced by wounding in Bidens
Thomine, S. (2011) Anion channels in plant cells:
Pilosa L., J. Exp. Bot., 42, 131-137, doi: 10.1093/
plant anion channels, FEBS J.,
278,
4277-4292,
jxb/42.1.131.
doi: 10.1111/j.1742-4658.2011.08370.x.
23.
Shao, Q., Gao, Q., Lhamo, D., Zhang, H., and
35.
Véry, A.-A., and Sentenac, H. (2002) Cation channels
Luan, S. (2020) Two glutamate- and pH-regulat-
in the Arabidopsis plasma membrane, Trends Plant
ed Ca2+ channels are required for systemic wound
Sci., 7, 168-175, doi: 10.1016/S1360-1385(02)02262-8.
signaling in Arabidopsis, Sci. Signal., 13, eaba1453,
36.
Fromm, J., and Spanswick, R. (1993) Characteristics
doi: 10.1126/scisignal.aba1453.
of action potentials in willow (Salix viminalis L.),
24.
Zimmermann, M. R., and Felle, H. H.
(2009)
J. Exp. Bot., 44, 1119-1125, doi: 10.1093/jxb/44.7.1119.
Dissection of heat-induced systemic signals: superiority
37.
Iosip, A. L., Böhm, J., Scherzer, S., Al-Rasheid, K.
of ion fluxes to voltage changes in substomatal
A. S., Dreyer, I., Schultz, J., Becker, D., Kreuzer, I.,
cavities, Planta, 229, 539-547, doi: 10.1007/s00425-
and Hedrich, R. (2020) The Venus flytrap trigger hair-
008-0850-x.
specific potassium channel KDM1 can reestablish
25.
Katicheva, L., Sukhov, V., Akinchits, E., and
the K+ gradient required for hapto-electric signaling,
Vodeneev, V. (2014) Ionic nature of burn-induced
PLoS Biol.,
18, e3000964, doi:
10.1371/journal.
variation potential in wheat leaves, Plant Cell Physiol.,
pbio.3000964.
55, 1511-1519, doi: 10.1093/pcp/pcu082.
38.
Vodeneev, V. A., Akinchits, E. K., Orlova, L. A., and
26.
Vodeneev, V., Akinchits, E., and Sukhov, V. (2015)
Sukhov, V. S. (2011) The role of Ca2+, H+, and Cl- ions
Variation potential in higher plants: Mechanisms
in generation of variation potential in pumpkin plants,
of generation and propagation, Plant Signal.
Russ. J. Plant Physiol., 58, 974-981, doi: 10.1134/
Behav., 10, e1057365, doi: 10.1080/15592324.2015.
S1021443711050256.
1057365.
39.
Shabala, S., Cuin, T. A., Shabala, L., and
27.
Stahlberg, R., and Cosgrove, D. J.
(1997) The
Newman, I. (2012) Quantifying kinetics of net ion
propagation of slow wave potentials in pea epi-
fluxes from plant tissues by non-invasive microelec-
cotyls, Plant Physiol., 113, 209-217, doi: 10.1104/
trode measuring MIFE technique, in Plant Salt Tol-
pp.113.1.209.
erance (Shabala, S., and Cuin, T. A., eds), Humana
28.
Miller, G., Schlauch, K., Tam, R., Cortes, D., Torres,
Press, Totowa, NJ, pp. 119-134, doi: 10.1007/978-1-
M. A., Shulaev, V., Dangl, J. L., and Mittler, R.
61779-986-0_7.
(2009) The plant NADPH oxidase RBOHD medi-
40.
Hilleary, R., Choi, W.-G., Kim, S.-H., Lim, S. D.,
ates rapid systemic signaling in response to diverse
and Gilroy, S. (2018) Sense and sensibility: the use
stimuli, Sci. Signal., 2, ra45, doi: 10.1126/scisignal.
of fluorescent protein-based genetically encoded
2000448.
biosensors in plants, Curr. Opin. Plant Biol., 46, 32-38,
29.
Devireddy, A. R., Zandalinas, S. I., Gómez-
doi: 10.1016/j.pbi.2018.07.004.
Cadenas, A., Blumwald, E., and Mittler, R. (2018)
41.
Lewis, B. D., Karlin-Neumann, C., and Spalding,
Coordinating the overall stomatal response of plants:
E. P.
(1997) Ca2+-activated anion channels and
rapid leaf-to-leaf communication during light stress,
membrane depolarizations induced by blue light and
Sci. Signal., 11, eaam9514, doi: 10.1126/scisignal.
cold in Arabidopsis seedlings, Plant Physiol., 114,
aam9514.
1327-1334, doi: 10.1104/pp.114.4.1327.
30.
Volkov, R. A., Panchuk, I. I., Mullineaux, P. M.,
42.
Krol, E., Dziubinska, H., and Trebacz, K. (2004)
and Schöffl, F. (2006) Heat stress-induced H2O2
Low-temperature-induced transmembrane potential
is required for effective expression of heat shock
changes in mesophyll cells of Arabidopsis thaliana,
genes in Arabidopsis, Plant Mol. Biol., 61, 733-746,
Helianthus annuus and Vicia faba, Physiol. Plant, 120,
doi: 10.1007/s11103-006-0045-4.
265-270, doi: 10.1111/j.0031-9317.2004.0244.x.
31.
Kawarazaki, T., Kimura, S., Iizuka, A., Hanamata, S.,
43.
Vodeneev, V. A., Opritov, V. A., and Pyatygin, S. S.
Nibori, H., Michikawa, M., Imai, A., Abe, M.,
(2006) Reversible changes of extracellular pH during
Kaya, H., and Kuchitsu, K.
(2013) A low
action potential generation in a higher plant Cucurbita
temperature-inducible protein AtSRC2 enhances
pepo, Russ. J. Plant Physiol., 53, 481-487, doi: 10.1134/
the ROS-producing activity of NADPH oxidase
S102144370604008X.
6
БИОХИМИЯ том 88 вып. 10 2023
1
794
МУДРИЛОВ и др.
44.
Dindas, J., Dreyer, I., Huang, S., Hedrich, R., and
55.
Ghosh, S., Bheri, M., and Pandey, G. K. (2021)
Roelfsema, M. R. G. (2021) A voltage-dependent
Delineating calcium signaling machinery in plants:
Ca2+ homeostat operates in the plant vacuolar mem-
tapping the potential through functional genom-
brane, New Phytol., 230, 1449-1460, doi: 10.1111/
ics, Curr. Genomics,
22,
404-439, doi:
10.2174/
nph.17272.
1389202922666211130143328.
45.
Demidchik, V., Shabala, S., Isayenkov, S., Cuin, T. A.,
56.
Salvador-Recatalà, V.
(2016) New roles for the
and Pottosin, I. (2018) Calcium transport across plant
GLUTAMATE RECEPTOR-LIKE 3.3, 3.5, and 3.6
membranes: mechanisms and functions, New Phytol.,
genes as on/off switches of wound-induced systemic
220, 49-69, doi: 10.1111/nph.15266.
electrical signals, Plant Signal. Behav., 11, e1161879,
46.
Dreyer, I., and Uozumi, N. (2011) Potassium chan-
doi: 10.1080/15592324.2016.1161879.
nels in plant cells: potassium channels in plants,
57.
Toyota, M., Spencer, D., Sawai-Toyota, S., Jiaqi, W.,
FEBS J., 278, 4293-4303, doi: 10.1111/j.1742-4658.
Zhang, T., Koo, A. J., Howe, G. A., and Gilroy, S.
2011.08371.x.
(2018) Glutamate triggers long-distance, calcium-
47.
Sharma, T., Dreyer, I., and Riedelsberger, J. (2013)
based plant defense signaling, Science, 361, 1112-1115,
The role of K+ channels in uptake and redistribu-
doi: 10.1126/science.aat7744.
tion of potassium in the model plant Arabidopsis
58.
Jha, S. K., Sharma, M., and K. Pandey, G. (2016)
thaliana, Front. Plant Sci., 4, 224, doi: 10.3389/fpls.
Role of cyclic nucleotide gated channels in stress
2013.00224.
management in plants, Curr. Genomics, 17, 315-329,
48.
Naz, R., Khan, A., Alghamdi, B. S., Ashraf, G. M.,
doi: 10.2174/1389202917666160331202125.
Alghanmi, M., Ahmad, A., Bashir, S. S., and Haq,
59.
Wang, L., Ning, Y., Sun, J., Wilkins, K. A., Matthus, E.,
Q. M. R. (2022) An insight into animal glutamate
McNelly, R. E., Dark, A., Rubio, L., Moeder, W.,
receptors homolog of Arabidopsis thaliana and their
Yoshioka, K., Véry, A., Stacey, G., Leblanc-
potential applications - a review, Plants, 11, 2580,
Fournier, N., Legué, V., Moulia, B., and Davies,
doi: 10.3390/plants11192580.
J. M. (2022) Arabidopsis thaliana CYCLIC NUCLE-
49.
Zheng, Y., Luo, L., Wei, J., Chen, Q., Yang, Y.,
OTIDE-GATED CHANNEL2 mediates extracel-
Hu, X., and Kong, X. (2018) The glutamate receptors
lular ATP signal transduction in root epidermis, New
AtGLR1.2 and AtGLR1.3 increase cold tolerance by
Phytol., 234, 412-421, doi: 10.1111/nph.17987.
regulating jasmonate signaling in Arabidopsis thaliana,
60.
Gobert, A., Park, G., Amtmann, A., Sanders, D., and
Biochem. Biophys. Res. Commun.,
506,
895-900,
Maathuis, F. J. M. (2006) Arabidopsis thaliana cyclic
doi: 10.1016/j.bbrc.2018.10.153.
nucleotide gated channel 3 forms a non-selective
50.
Michard, E., Lima, P. T., Borges, F., Silva, A. C.,
ion transporter involved in germination and cation
Portes, M. T., Carvalho, J. E., Gilliham, M., Liu,
transport, J. Exp. Bot., 57, 791-800, doi: 10.1093/jxb/
L.-H., Obermeyer, G., and Feijó, J. A.
(2011)
erj064.
Glutamate receptor-like genes form Ca2+ channels
61.
Wang, Y.-F., Munemasa, S., Nishimura, N., Ren,
in pollen tubes and are regulated by pistil D-serine,
H.-M., Robert, N., Han, M., Puzõrjova, I., Kollist, H.,
Science, 332, 434-437, doi: 10.1126/science.1201101.
Lee, S., Mori, I., and Schroeder, J. I. (2013) Identifi-
51.
Yu, B., Liu, N., Tang, S., Qin, T., and Huang, J.
cation of cyclic GMP-activated nonselective Ca2+-per-
(2022) Roles of glutamate receptor-like channels
meable cation channels and associated CNGC5 and
(GLRs) in plant growth and response to environ-
CNGC6 genes in Arabidopsis guard cells, Plant Physi-
mental stimuli, Plants,
11,
3450, doi:
10.3390/
ol., 163, 578-590, doi: 10.1104/pp.113.225045.
plants11243450.
62.
Gao, F., Han, X., Wu, J., Zheng, S., Shang, Z.,
52.
Tapken, D., Anschütz, U., Liu, L.-H., Huelsken, T.,
Sun, D., Zhou, R., and Li, B. (2012) A heat-activat-
Seebohm, G., Becker, D., and Hollmann, M. (2013)
ed calcium-permeable channel - Arabidopsis cyclic
A plant homolog of animal glutamate receptors is
nucleotide-gated ion channel 6 - is involved in heat
an ion channel gated by multiple hydrophobic ami-
shock responses: CNGC6 is a heat-activated calci-
no acids, Sci. Signal., 6, ra47, doi: 10.1126/scisignal.
um channel, Plant J., 70, 1056-1069, doi: 10.1111/
2003762.
j.1365-313X.2012.04969.x.
53.
Nguyen, C. T., Kurenda, A., Stolz, S., Chételat, A.,
63.
Tunc-Ozdemir, M., Rato, C., Brown, E., Rogers, S.,
and Farmer, E. E. (2018) Identification of cell pop-
Mooneyham, A., Frietsch, S., Myers, C. T., Poulsen,
ulations necessary for leaf-to-leaf electrical signal-
L. R., Malhó, R., and Harper, J. F. (2013) Cyclic
ing in a wounded plant, Proc. Natl. Acad. Sci. USA,
nucleotide gated channels 7 and 8 are essential for
115, 10178-10183, doi: 10.1073/pnas.1807049115.
male reproductive fertility, PLoS One, 8, e55277,
54.
Meyerhoff, O., Müller, K., Roelfsema, M. R. G.,
doi: 10.1371/journal.pone.0055277.
Latz, A., Lacombe, B., Hedrich, R., Dietrich, P., and
64.
Christopher, D. A., Borsics, T., Yuen, C. Y.,
Becker, D. (2005) AtGLR3.4, a glutamate receptor
Ullmer, W., Andème-Ondzighi, C., Andres, M. A.,
channel-like gene is sensitive to touch and cold, Plan-
Kang, B.-H., and Staehelin, L. A. (2007) The cyclic
ta, 222, 418-427, doi: 10.1007/s00425-005-1551-3.
nucleotide gated cation channel AtCNGC10 traffics
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1795
from the ER via Golgi vesicles to the plasma membrane
74.
Liu, T., Du, L., Li, Q., Kang, J., Guo, Q., and
of Arabidopsis root and leaf cells, BMC Plant Biol.,
Wang, S. (2021) AtCRY2 negatively regulates the
7, 48, doi: 10.1186/1471-2229-7-48.
functions of AtANN2 and AtANN3 in drought
65.
Yoshioka, K., Moeder, W., Kang, H.-G., Kachroo, P.,
tolerance by affecting their subcellular localization
Masmoudi, K., Berkowitz, G., and Klessig, D. F. (2006)
and transmembrane Ca2+ flow, Front. Plant Sci., 12,
The chimeric Arabidopsis CYCLIC NUCLEOTIDE-
754567, doi: 10.3389/fpls.2021.754567.
GATED ION CHANNEL11/12 activates multiple
75.
Davies, J.
(2014)
Annexin-mediated calcium
pathogen resistance responses, Plant Cell, 18, 747-763,
signalling in plants, Plants, 3, 128-140, doi: 10.3390/
doi: 10.1105/tpc.105.038786.
plants3010128.
66.
Shih, H.-W., DePew, C. L., Miller, N. D., and
76.
Huh, S. M., Noh, E. K., Kim, H. G., Jeon, B. W.,
Monshausen, G. B. (2015) The cyclic nucleotide-
Bae, K., Hu, H.-C., Kwak, J. M., and Park, O. K.
gated channel CNGC14 regulates root gravitropism
(2010) Arabidopsis annexins AnnAt1 and AnnAt4
in Arabidopsis thaliana, Curr. Biol., 25, 3119-3125,
interact with each other and regulate drought and salt
doi: 10.1016/j.cub.2015.10.025.
stress responses, Plant Cell Physiol., 51, 1499-1514,
67.
DeFalco, T. A., Moeder, W., and Yoshioka, K. (2016)
doi: 10.1093/pcp/pcq111.
Opening the gates: insights into cyclic nucleotide-
77.
Laohavisit, A., Shang, Z., Rubio, L., Cuin, T. A., Véry,
gated channel-mediated signaling, Trends Plant Sci.,
A.-A., Wang, A., Mortimer, J. C., Macpherson, N.,
21, 903-906, doi: 10.1016/j.tplants.2016.08.011.
Coxon, K. M., Battey, N. H., Brownlee, C., Park,
68.
Tipper, E., Leitão, N., Dangeville, P., Lawson,
O. K., Sentenac, H., Shabala, S., Webb, A. A. R., and
D. M., and Charpentier, M. (2023) A novel mutant
Davies, J. M. (2012) Arabidopsis Annexin1 mediates
allele of AtCNGC15 reveals a dual function of nuclear
the radical-activated plasma membrane Ca2+- and K+-
calcium release in the root meristem, J. Exp. Bot., 74,
permeable conductance in root cells, Plant Cell, 24,
2572-2584, doi: 10.1093/jxb/erad041.
1522-1533, doi: 10.1105/tpc.112.097881.
69.
Tunc-Ozdemir, M., Tang, C., Ishka, M. R., Brown, E.,
78.
Lichocka, M., Rymaszewski, W., Morgiewicz, K.,
Groves, N. R., Myers, C. T., Rato, C., Poulsen, L. R.,
Barymow-Filoniuk, I., Chlebowski, A., Sobczak, M.,
McDowell, S., Miller, G., Mittler, R., and Harper,
Samuel, M. A., Schmelzer, E., Krzymowska, M.,
J. F.
(2013) A cyclic nucleotide-gated channel
and Hennig, J. (2018) Nucleus- and plastid-targeted
(CNGC16) in pollen is critical for stress tolerance in
annexin
5 promotes reproductive development in
pollen reproductive development, Plant Physiol., 161,
Arabidopsis and is essential for pollen and embryo
1010-1020, doi: 10.1104/pp.112.206888.
formation, BMC Plant Biol., 18, 183, doi: 10.1186/
70.
Ladwig, F., Dahlke, R. I., Stührwohldt, N.,
s12870-018-1405-3.
Hartmann, J., Harter, K., and Sauter, M.
(2015)
79.
Zhu, J., Wu, X., Yuan, S., Qian, D., Nan, Q., An, L.,
Phytosulfokine regulates growth in Arabidopsis
and Xiang, Y. (2014) Annexin5 plays a vital role in
through a response module at the plasma membrane
Arabidopsis pollen development via Ca2+-dependent
that includes CYCLIC NUCLEOTIDE-GATED
membrane trafficking, PLoS One,
9, e102407,
CHANNEL17, H+-ATPase, and BAK1, Plant Cell,
doi: 10.1371/journal.pone.0102407.
27, 1718-1729, doi: 10.1105/tpc.15.00306.
80.
Yadav, D., Ahmed, I., Shukla, P., Boyidi, P., and
71.
Meena, M. K., Prajapati, R., Krishna, D., Divakaran, K.,
Kirti, P. (2016) Overexpression of Arabidopsis An-
Pandey, Y., Reichelt, M., Mathew, M. K., Boland,
nAt8 alleviates abiotic stress in transgenic Arabi-
W., Mithöfer, A., and Vadassery, J. (2019) The Ca2+
dopsis and tobacco, Plants,
5,
18, doi:
10.3390/
channel CNGC19 regulates Arabidopsis defense
plants5020018.
against spodoptera herbivory, Plant Cell, 31, 1539-
81.
Evans, M. J., Choi, W.-G., Gilroy, S., and Morris,
1562, doi: 10.1105/tpc.19.00057.
R. J. (2016) A ROS-assisted calcium wave dependent
72.
Wang, X., Ma, X., Wang, H., Li, B., Clark, G.,
on the AtRBOHD NADPH oxidase and TPC1 cation
Guo, Y., Roux, S., Sun, D., and Tang, W. (2015)
channel propagates the systemic response to salt
Proteomic study of microsomal proteins reveals a
stress, Plant Physiol., 171, 1771-1784, doi: 10.1104/
key role for Arabidopsis annexin 1 in mediating heat
pp.16.00215.
stress-induced increase in intracellular calcium levels,
82.
Yamanaka, T., Nakagawa, Y., Mori, K., Nakano, M.,
Mol. Cell. Proteomics, 14, 686-694, doi: 10.1074/
Imamura, T., Kataoka, H., Terashima, A., Iida, K.,
mcp.M114.042697.
Kojima, I., Katagiri, T., Shinozaki, K., and Iida, H.
73.
Liu, Q., Ding, Y., Shi, Y., Ma, L., Wang, Y., Song, C.,
(2010) MCA1 and MCA2 that mediate Ca2+ uptake
Wilkins, K. A., Davies, J. M., Knight, H., Knight,
have distinct and overlapping roles in Arabidopsis,
M. R., Gong, Z., Guo, Y., and Yang, S.
(2021)
Plant Physiol.,
152,
1284-1296, doi:
10.1104/
The calcium transporter ANNEXIN1 mediates cold-
pp.109.147371.
induced calcium signaling and freezing tolerance
83.
Hattori, T., Otomi, Y., Nakajima, Y., Soga, K.,
in plants, EMBO J., 40, e104559, doi: 10.15252/
Wakabayashi, K., Iida, H., and Hoson, T. (2020)
embj.2020104559.
MCA1 and MCA2 are involved in the response
БИОХИМИЯ том 88 вып. 10 2023
6*
1
796
МУДРИЛОВ и др.
to hypergravity in Arabidopsis hypocotyls, Plants, 9,
Bonus, M., Mishra, S., Hartwig, T., Bezrutczyk, M.,
590, doi: 10.3390/plants9050590.
Basu, D., Farmer, E. E., Gohlke, H., Malkovskiy, A.,
84.
Yuan, F., Yang, H., Xue, Y., Kong, D., Ye, R.,
Haswell, E. S., Lercher, M. J., Ehrhardt, D. W.,
Li, C., Zhang, J., Theprungsirikul, L., Shrift, T.,
Frommer, W. B., and Kleist, T. J. (2021) Interdepen-
Krichilsky, B., Johnson, D. M., Swift, G. B.,
dence of a mechanosensitive anion channel and glu-
He, Y., Siedow, J. N., and Pei, Z.-M. (2014) OSCA1
tamate receptors in distal wound signaling, Sci. Adv.,
mediates osmotic-stress-evoked Ca2+ increases vital
7, eabg4298, doi: 10.1126/sciadv.abg4298.
for osmosensing in Arabidopsis, Nature, 514, 367-371,
94.
Tran, D., Girault, T., Guichard, M., Thomine, S.,
doi: 10.1038/nature13593.
Leblanc-Fournier, N., Moulia, B., De Langre, E.,
85.
Thor, K., Jiang, S., Michard, E., George, J.,
Allain, J.-M., and Frachisse, J.-M. (2021) Cellular
Scherzer, S., Huang, S., Dindas, J., Derbyshire, P.,
transduction of mechanical oscillations in plants by
Leitão, N., DeFalco, T. A., Köster, P., Hunter, K.,
the plasma-membrane mechanosensitive channel
Kimura, S., Gronnier, J., Stransfeld, L., Kadota, Y.,
MSL10, Proc. Natl. Acad. Sci. USA, 118, e1919402118,
Bücherl, C. A., Charpentier, M., Wrzaczek, M.,
doi: 10.1073/pnas.1919402118.
MacLean, D., Oldroyd, G. E. D., Menke, F. L. H.,
95.
Guerringue, Y., Thomine, S., and Frachisse, J.-M.
Roelfsema, M. R. G., Hedrich, R., Feijó, J., and
(2018) Sensing and transducing forces in plants with
Zipfel, C. (2020) The calcium-permeable channel
MSL10 and DEK1 mechanosensors, FEBS Lett., 592,
OSCA1.3 regulates plant stomatal immunity, Nature,
1968-1979, doi: 10.1002/1873-3468.13102.
585, 569-573, doi: 10.1038/s41586-020-2702-1.
96.
Basu, D., and Haswell, E. S. (2020) The mech-
86.
Fang, X., Liu, B., Shao, Q., Huang, X., Li, J., Luan, S.,
anosensitive ion channel MSL10 potentiates re-
and He, K. (2021) AtPiezo plays an important role
sponses to cell swelling in Arabidopsis seedlings,
in root cap mechanotransduction, Int. J. Mol. Sci.,
Curr. Biol.,
30,
2716-2728.e6, doi:
10.1016/j.cub.
22, 467, doi: 10.3390/ijms22010467.
2020.05.015.
87.
Radin, I., Richardson, R. A., Coomey, J. H.,
97.
Hedrich, R., and Geiger, D.
(2017) Biology of
Weiner, E. R., Bascom, C. S., Li, T., Bezanilla, M.,
SLAC1-type anion channels - from nutrient uptake to
and Haswell, E. S. (2021) Plant PIEZO homologs
stomatal closure, New Phytol., 216, 46-61, doi: 10.1111/
modulate vacuole morphology during tip growth,
nph.14685.
Science, 373, 586-590, doi: 10.1126/science.abe6310.
98.
Barbier-Brygoo, H., De Angeli, A., Filleur, S.,
88.
Tran, D., Galletti, R., Neumann, E. D., Dubois, A.,
Frachisse, J.-M., Gambale, F., Thomine, S., and
Sharif-Naeini, R., Geitmann, A., Frachisse, J.-M.,
Wege, S. (2011) Anion channels/transporters in plants:
Hamant, O., and Ingram, G. C. (2017) A mechanosen-
from molecular bases to regulatory networks, Annu.
sitive Ca2+ channel activity is dependent on the
Rev. Plant Biol., 62, 25-51, doi: 10.1146/annurev-
developmental regulator DEK1, Nat. Commun., 8,
arplant-042110-103741.
1009, doi: 10.1038/s41467-017-00878-w.
99.
Lehmann, J., Jørgensen, M. E., Fratz, S., Müller,
89.
Lee, C. P., Maksaev, G., Jensen, G. S., Murcha,
H. M., Kusch, J., Scherzer, S., Navarro-Retamal, C.,
M. W., Wilson, M. E., Fricker, M., Hell, R., Haswell,
Mayer, D., Böhm, J., Konrad, K. R., Terpitz, U.,
E. S., Millar, A. H., and Sweetlove, L. J. (2016) MSL1
Dreyer, I., Mueller, T. D., Sauer, M., Hedrich, R.,
is a mechanosensitive ion channel that dissipates
Geiger, D., and Maierhofer, T. (2021) Acidosis-in-
mitochondrial membrane potential and maintains
duced activation of anion channel SLAH3 in the
redox homeostasis in mitochondria during abiotic
flooding-related stress response of Arabidopsis,
stress, Plant J., 88, 809-825, doi: 10.1111/tpj.13301.
Curr. Biol.,
31,
3575-3585.e9, doi:
10.1016/j.cub.
90.
Hamilton, E. S., Schlegel, A. M., and Haswell, E. S.
2021.06.018.
(2015) United in diversity: mechanosensitive ion
100. Ye, W., Koya, S., Hayashi, Y., Jiang, H., Oishi, T.,
channels in plants, Annu. Rev. Plant Biol., 66, 113-137,
Kato, K., Fukatsu, K., and Kinoshita, T.
(2021)
doi: 10.1146/annurev-arplant-043014-114700.
Identification of genes preferentially expressed in
91.
Hamilton, E. S., Jensen, G. S., Maksaev, G., Katims,
stomatal guard cells of Arabidopsis thaliana and
A., Sherp, A. M., and Haswell, E. S. (2015) Mecha-
involvement of the aluminum-activated malate
nosensitive channel MSL8 regulates osmotic forces
transporter 6 vacuolar malate channel in stomatal
during pollen hydration and germination, Science,
opening, Front. Plant Sci., 12, 744991, doi: 10.3389/
350, 438-441, doi: 10.1126/science.aac6014.
fpls.2021.744991.
92.
Haswell, E. S., Peyronnet, R., Barbier-Brygoo, H.,
101. Meyer, S., Scholz-Starke, J., De Angeli, A.,
Meyerowitz, E. M., and Frachisse, J.-M. (2008) Two
Kovermann, P., Burla, B., Gambale, F., and
MscS homologs provide mechanosensitive channel
Martinoia, E. (2011) Malate transport by the vacuolar
activities in the Arabidopsis root, Curr. Biol., 18,
AtALMT6 channel in guard cells is subject to multiple
730-734, doi: 10.1016/j.cub.2008.04.039.
regulation: AtALMT6 mediates malate transport
93.
Moe-Lange, J., Gappel, N. M., Machado, M.,
in guard cells, Plant J., 67, 247-257, doi: 10.1111/
Wudick, M. M., Sies, C. S. A., Schott-Verdugo, S. N.,
j.1365-313X.2011.04587.x.
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1797
102. Boccaccio, A., Picco, C., Di Zanni, E., and Scholz-
the AKT2 channel abolished by voltage-depen-
Starke, J.
(2022) Phospholipid scrambling by a
dent phosphorylation: regulation of AKT2 by phos-
TMEM16 homolog of Arabidopsis thaliana, FEBS J.,
phorylation, Plant J.,
44,
783-797, doi:
10.1111/
289, 2578-2592, doi: 10.1111/febs.16279.
j.1365-313X.2005.02566.x.
103. Zhang, H., Zhao, F.-G., Tang, R.-J., Yu, Y., Song, J.,
112. Gobert, A., Isayenkov, S., Voelker, C., Czempinski, K.,
Wang, Y., Li, L., and Luan, S. (2017) Two tonoplast
and Maathuis, F. J. M. (2007) The two-pore channel
MATE proteins function as turgor-regulating chloride
TPK1 gene encodes the vacuolar K+ conductance
channels in Arabidopsis, Proc. Natl. Acad. Sci. USA,
and plays a role in K+ homeostasis, Proc. Natl.
114, E2036-E2045, doi: 10.1073/pnas.1616203114.
Acad. Sci. USA,
104,
10726-10731, doi:
10.1073/
104. Herdean, A., Teardo, E., Nilsson, A. K., Pfeil, B. E.,
pnas.0702595104.
Johansson, O. N., Ünnep, R., Nagy, G., Zsiros, O.,
113. Becker, D., Geiger, D., Dunkel, M., Roller, A.,
Dana, S., Solymosi, K., Garab, G., Szabó, I.,
Bertl, A., Latz, A., Carpaneto, A., Dietrich, P.,
Spetea, C., and Lundin, B. (2016) A voltage-de-
Roelfsema, M. R. G., Voelker, C., Schmidt, D.,
pendent chloride channel fine-tunes photosynthe-
Mueller-Roeber, B., Czempinski, K., and Hedrich, R.
sis in plants, Nat. Commun., 7, 11654, doi: 10.1038/
(2004) AtTPK4, an Arabidopsis tandem-pore K+
ncomms11654.
channel, poised to control the pollen membrane
105. Cuin, T., Dreyer, I., and Michard, E. (2018) The
voltage in a pH- and Ca2+-dependent manner, Proc.
role of potassium channels in Arabidopsis thaliana
Natl. Acad. Sci. USA, 101, 15621-15626, doi: 10.1073/
long distance electrical signalling: AKT2 modu-
pnas.0401502101.
lates tissue excitability while GORK shapes action
114. Rocchetti, A., Sharma, T., Wulfetange, C., Scholz-
potentials, Int. J. Mol. Sci., 19, 926, doi: 10.3390/
Starke, J., Grippa, A., Carpaneto, A., Dreyer, I.,
ijms19040926.
Vitale, A., Czempinski, K., and Pedrazzini, E. (2012)
106. Demidchik, V., Cuin, T. A., Svistunenko, D.,
The putative K+ channel subunit AtKCO3 forms
Smith, S. J., Miller, A. J., Shabala, S., Sokolik, A.,
stable dimers in Arabidopsis, Front. Plant Sci., 3, 251,
and Yurin, V.
(2010) Arabidopsis root K+-efflux
doi: 10.3389/fpls.2012.00251.
conductance activated by hydroxyl radicals: single-
115. Li, D.-D., Guan, H., Li, F., Liu, C.-Z., Dong, Y.-X.,
channel properties, genetic basis and involvement in
Zhang, X.-S., and Gao, X.-Q. (2017) Arabidopsis
stress-induced cell death, J. Cell Sci., 123, 1468-1479,
shaker pollen inward K+ channel SPIK functions
doi: 10.1242/jcs.064352.
in SnRK1 complex-regulated pollen hydration on
107. Gaymard, F., Pilot, G., Lacombe, B., Bouchez, D.,
the stigma: SPIK functions in pollen hydration on
Bruneau, D., Boucherez, J., Michaux-Ferrière, N.,
stigma, J. Integr. Plant Biol., 59, 604-611, doi: 10.1111/
Thibaud, J.-B., and Sentenac, H. (1998) Identification
jipb.12563.
and disruption of a plant shaker-like outward channel
116. Jammes, F., Hu, H.-C., Villiers, F., Bouten, R., and
involved in K+ release into the xylem sap, Cell,
Kwak, J. M.
(2011) Calcium-permeable channels
94, 647-655, doi: 10.1016/S0092-8674(00)81606-2.
in plant cells: plant calcium channels, FEBS J., 278,
108. Lebaudy, A., Pascaud, F., Véry, A.-A., Alcon, C.,
4262-4276, doi: 10.1111/j.1742-4658.2011.08369.x.
Dreyer, I., Thibaud, J.-B., and Lacombe, B. (2010)
117. Basu, D., and Haswell, E. S. (2017) Plant mech-
Preferential KAT1-KAT2 heteromerization determines
anosensitive ion channels: an ocean of possibili-
inward K+ current properties in Arabidopsis guard
ties, Curr. Opin. Plant Biol., 40, 43-48, doi: 10.1016/
cells, J. Biol. Chem., 285, 6265-6274, doi: 10.1074/
j.pbi.2017.07.002.
jbc.M109.068445.
118. Mori, K., Renhu, N., Naito, M., Nakamura, A.,
109. Jeanguenin, L., Alcon, C., Duby, G., Boeglin, M.,
Shiba, H., Yamamoto, T., Suzaki, T., Iida, H., and
Chérel, I., Gaillard, I., Zimmermann, S., Sentenac, H.,
Miura, K.
(2018) Ca2+-permeable mechanosensi-
and Véry, A.-A. (2011) AtKC1 is a general modula-
tive channels MCA1 and MCA2 mediate cold-in-
tor of Arabidopsis inward Shaker channel activity:
duced cytosolic Ca2+ increase and cold tolerance in
Modulatory subunit of inward K+ channel activi-
Arabidopsis, Sci. Rep., 8, 550, doi: 10.1038/s41598-
ty, Plant J., 67, 570-582, doi: 10.1111/j.1365-313X.
017-17483-y.
2011.04617.x.
119. Zhang, Z., Tong, X., Liu, S.-Y., Chai, L.-X., Zhu,
110. Kwak, J. M., Murata, Y., Baizabal-Aguirre, V. M.,
F.-F., Zhang, X.-P., Zou, J.-Z., and Wang, X.-B.
Merrill, J., Wang, M., Kemper, A., Hawke, S. D.,
(2019) Genetic analysis of a Piezo-like protein sup-
Tallman, G., and Schroeder, J. I. (2001) Dominant
pressing systemic movement of plant viruses in Ara-
negative guard cell K+ channel mutants reduce inward-
bidopsis thaliana, Sci. Rep., 9, 3187, doi: 10.1038/
rectifying K+ currents and light-induced stomatal
s41598-019-39436-3.
opening in Arabidopsis, Plant Physiol., 127, 473-485,
120. Véry, A.-A., and Sentenac, H. (2003) Molecular mech-
doi: 10.1104/pp.010428.
anisms and regulation of K+ transport in higher plants,
111. Michard, E., Dreyer, I., Lacombe, B., Sentenac, H.,
Annu. Rev. Plant Biol., 54, 575-603, doi: 10.1146/
and Thibaud, J.-B. (2005) Inward rectification of
annurev.arplant.54.031902.134831.
БИОХИМИЯ том 88 вып. 10 2023
1
798
МУДРИЛОВ и др.
121. Vincent, T. R., Avramova, M., Canham, J., Higgins, P.,
transduction in tomato, Front. Agr. Sci. Eng., 8, 292-
Bilkey, N., Mugford, S. T., Pitino, M., Toyota, M., Gil-
301, doi: 10.15302/J-FASE-2021395.
roy, S., Miller, A. J., Hogenhout, S. A., and Sanders, D.
129. Scherzer, S., Böhm, J., Huang, S., Iosip, A. L.,
(2017) Interplay of plasma membrane and vacuolar ion
Kreuzer, I., Becker, D., Heckmann, M., Al-Rasheid,
channels, together with BAK1, elicits rapid cytosolic
K. A. S., Dreyer, I., and Hedrich, R. (2022) A unique
calcium elevations in Arabidopsis during aphid feeding,
inventory of ion transporters poises the Venus flytrap
Plant Cell, 29, 1460-1479, doi: 10.1105/tpc.17.00136.
to fast-propagating action potentials and calcium
122. Fichman, Y., and Mittler, R.
(2021) Integration
waves, Curr. Biol., 32, 4255-4263.e5, doi: 10.1016/
of electric, calcium, reactive oxygen species and
j.cub.2022.08.051.
hydraulic signals during rapid systemic signaling in
130. Hedrich, R., and Kreuzer, I. (2023) Demystifying
plants, Plant J., 107, 7-20, doi: 10.1111/tpj.15360.
the Venus flytrap action potential, New Phytol., 239,
123. Yu, B., Wu, Q., Li, X., Zeng, R., Min, Q., and
2108-2112, doi: 10.1111/nph.19113.
Huang, J.
(2022) Glutamate receptor-like gene
131. Zeng, H., Zhao, B., Wu, H., Zhu, Y., and Chen, H.
OsGLR3.4 is required for plant growth and systemic
(2020) Comprehensive in silico characterization and
wound signaling in rice (Oryza sativa), New Phytol.,
expression profiling of nine gene families associ-
233, 1238-1256, doi: 10.1111/nph.17859.
ated with calcium transport in soybean, Agronomy,
124. Kong, D., Hu, H.-C., Okuma, E., Lee, Y., Lee,
10, 1539, doi: 10.3390/agronomy10101539.
H. S., Munemasa, S., Cho, D., Ju, C., Pedoeim, L.,
132. Maksaev, G., and Haswell, E. S. (2012) MscS-Like10
Rodriguez, B., Wang, J., Im, W., Murata, Y., Pei,
is a stretch-activated ion channel from Arabidopsis
Z.-M., and Kwak, J. M. (2016) L-Met activates
thaliana with a preference for anions, Proc. Natl.
Arabidopsis GLR Ca2+ channels upstream of ROS
Acad. Sci. USA, 109, 19015-19020, doi: 10.1073/
production and regulates stomatal movement, Cell
pnas.1213931109.
Rep., 17, 2553-2561, doi: 10.1016/j.celrep.2016.11.015.
133. Choi, W.-G., Toyota, M., Kim, S.-H., Hilleary, R.,
125. Veley, K. M., Maksaev, G., Frick, E. M., January, E.,
and Gilroy, S. (2014) Salt stress-induced Ca2+ waves
Kloepper, S. C., and Haswell, E. S. (2014) Arabidopsis
are associated with rapid, long-distance root-to-shoot
MSL10 has a regulated cell death signaling activity that
signaling in plants, Proc. Natl. Acad. Sci. USA, 111,
is separable from its mechanosensitive ion channel
6497-6502, doi: 10.1073/pnas.1319955111.
activity, Plant Cell,
26,
3115-3131, doi:
10.1105/
134. Kiep, V., Vadassery, J., Lattke, J., Maaß, J., Boland, W.,
tpc.114.128082.
Peiter, E., and Mithöfer, A. (2015) Systemic cytosolic
126. Xue, N., Zhan, C., Song, J., Li, Y., Zhang, J., Qi, J.,
Ca2+ elevation is activated upon wounding and
and Wu, J. (2022) The glutamate receptor-like 3.3 and
herbivory in Arabidopsis, New Phytol., 207, 996-1004,
3.6 mediate systemic resistance to insect herbivores in
doi: 10.1111/nph.13493.
Arabidopsis, J. Exp. Bot., 73, 7611-7627, doi: 10.1093/
135. Cui, Y., Lu, S., Li, Z., Cheng, J., Hu, P., Zhu, T.,
jxb/erac399.
Wang, X., Jin, M., Wang, X., Li, L., Huang, S.,
127. Bellandi, A., Papp, D., Breakspear, A., Joyce, J.,
Zou, B., and Hua, J. (2020) CYCLIC NUCLEO-
Johnston, M. G., de Keijzer, J., Raven, E. C., Ohtsu, M.,
TIDE-GATED ION CHANNELs 14 and 16 promote
Vincent, T. R., Miller, A. J., Sanders, D., Hogenhout,
tolerance to heat and chilling in rice, Plant Physiol.,
S. A., Morris, R. J., and Faulkner, C. (2022) Diffu-
183, 1794-1808, doi: 10.1104/pp.20.00591.
sion and bulk flow of amino acids mediate calcium
136. Finka, A., Cuendet, A. F. H., Maathuis, F. J. M.,
waves in plants, Sci. Adv., 8, eabo6693, doi: 10.1126/
Saidi, Y., and Goloubinoff, P. (2012) Plasma membrane
sciadv.abo6693.
cyclic nucleotide gated calcium channels control land
128. Hu, C., Duan, S., Zhou, J., and Yu, J. (2021) Char-
plant thermal sensing and acquired thermotolerance,
acteristics of herbivory/wound-elicited electrical signal
Plant Cell, 24, 3333-3348, doi: 10.1105/tpc.112.095844.
ION CHANNELS IN ELECTRICAL SIGNALING IN HIGHER PLANTS
Review
M. A. Mudrilov, M. M. Ladeynova, D. V. Kuznetsova, and V. A. Vodeneev*
Lobachevsky State University of Nizhni Novgorod - National Research University, Department of Biophysics,
603022 Nizhny Novgorod, Russia; e-mail: v.vodeneev@mail.ru
Electrical signals (ESs) of plants occurring under the action of various external factors play an important role
in adaptation to changing environmental conditions. The generation of ESs in higher plant cells is associated
БИОХИМИЯ том 88 вып. 10 2023
ИОННЫЕ КАНАЛЫ РАСТЕНИЙ В ЭЛЕКТРИЧЕСКОЙ СИГНАЛИЗАЦИИ
1799
with the activation of Ca2+, K+, and anion fluxes, as well as changes in the activity of plasma membrane
H+-ATPase. In the present review, the molecular nature of ion channels contributing to ESs transmission
in higher plants is analyzed based on the comparison of data from molecular-genetic and electrophysio-
logical studies. Based on such characteristics of ion channels as selectivity, activation mechanism, and in-
tracellular and tissue localization, those ion channels that meet the requirements for potential participants
of ESs generation were selected from a wide variety of ion channels in higher plants. Analysis of the data
of experimental studies performed on mutants with suppressed or enhanced expression of a certain channel
gene revealed those channels whose activation contributes to ESs formation. The channels responsible for
Ca2+ flux during ESs generation include channels of GLR family, for K+ flux - GORK, for anions - MSL.
Consideration of the prospects for further studies suggests the need to combine electrophysiological and
genetic approaches along with the analysis of ion concentrations in intact plants within a single study.
Keywords: electrical signals in plants, long-distance signals, ion channels, action potential, variation potential
БИОХИМИЯ том 88 вып. 10 2023