БИОХИМИЯ, 2023, том 88, вып. 10, с. 1818 - 1828
УДК 577.151.63
ГЕНЕРАЦИЯ МЕМБРАННОГО ПОТЕНЦИАЛА ЦИТОХРОМОМ bd
Обзор
© 2023 В.Б. Борисов
НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: bor@belozersky.msu.ru
Поступила в редакцию 10.06.2023
После доработки 08.07.2023
Принята к публикации 11.07.2023
В обзоре даны современные представления о механизме генерации трансмембранной разности
электрических потенциалов (Δψ) в ходе каталитического цикла трёхгемовой терминальной хинол-
оксидазы типа bd. Предполагается, что основной вклад в образование Δψ вносит перемещение Н+
поперёк мембраны по внутрибелковому гидрофильному протон-проводящему пути из цитоплазмы
к кислородоредуктазному активному центру этого бактериального фермента.
КЛЮЧЕВЫЕ СЛОВА: дыхательная цепь, терминальная оксидаза, цитохром bd, гем, протон-движущая
сила, мембранный потенциал.
DOI: 10.31857/S032097252310007X, EDN: OTSSEC
ВВЕДЕНИЕ
ственного фотоактивируемого восстановителя
выступает трис(2,2′-бипиридил)рутений(II) хло-
В 1974 г. в НИИ физико-химической био-
рид (RuBpy), образующий за счёт электроста-
логии имени А.Н. Белозерского МГУ Л.А. Дра-
тических взаимодействий комплекс с сайтом
чёв и соавторы разработали электрометриче-
связывания цитохрома с в оксидазе вблизи
ский метод прямого измерения электрической
входного редокс-центра CuA [5, 6]. В результате
активности сопрягающих мембран, дающий
фотовозбуждения RuBpy импульсным лазе-
уникальную возможность отслеживать внутри-
ром электрон с RuBpy* переносится на CuA.
белковое перемещение электрических заря-
Окисленный RuBpy ревосстанавливается ани-
дов в пределах одного молекулярного оборота
лином. Этот подход позволяет регистрировать
фермента [1]. С помощью этого метода удалось
с разрешением во времени электрогенный
наблюдать в реальном времени генерацию
перенос зарядов в ходе отдельных одноэлек-
трансмембранной разности электрических по-
тронных переходов в каталитическом цикле
тенциалов (Δψ) бактериородопсином [2], реак-
цитохром с-оксидазы [7]. Во втором подходе
ционными центрами [3] и цитохромом bc1 [4]
для инициирования ферментативной реакции
фотосинтезирующих бактерий, а также терми-
в режиме одного оборота используется лазер-
нальной цитохром с-оксидазой [5-7] и нека-
ный импульсный фотолиз комплекса моно-
ноническими ретиналь-содержащими бакте-
оксида углерода (СО) с кислородсвязывающим
риальными белками [8, 9]. Для изучения элек-
высокоспиновым гемом a3. Образование ком-
трогенного механизма цитохром с-оксидаз при-
плекса СО с частично или полностью восста-
меняются два разных подхода. В первом под-
новленным ферментом происходит в анаэроб-
ходе используется фотохимическая инъекция
ных условиях. Затем в анаэробную ячейку
одного электрона во встроенный в липосо-
с оксидазой, связавшей СО, вносят при помо-
му фермент. При этом в качестве непосред- щи техники быстрого смешивания растворён-
Принятые сокращения: Н+/e- - стехиометрия протон/электрон, которая в случае дыхательной цепи Escherichia coli
подразумевает количество высвобождаемых в периплазму протонов на один электрон, используемый для восстанов-
ления кислорода до воды; Δp - протон-движущая сила; Δψ - трансмембранная разность электрических потенциалов;
τ - характеристическое время, обратное константе скорости (t1/e).
1818
ЭЛЕКТРОГЕННЫЙ ЦИТОХРОМ bd
1819
ный в воде кислород (О2). В ходе распада ком-
качки протон/электрон (Н+/e-) [25, 26]. Цито-
плекса СО-оксидаза, запускаемого фотолизом,
хромы bo3, bd-I и bd-II кодируются оперонами
О2 связывается с гемом a3 и восстанавливается
cyoABCDE, cydABX и appCBX соответственно.
электронами, присутствующими в оксидазе,
cyoABCDE экспрессируется преимущественно
что сопровождается генерацией Δψ [10]. Таким
при высоком парциальном давлении O2, тогда
образом, во втором подходе используется соче-
как cydABX - преимущественно в микроаэроб-
тание прямого электрометрического метода [1]
ных условиях. Экспрессия appCBX индуциру-
и метода «флоу-флэш» [11]. У терминальных
ется при анаэробном росте E. coli, вступлении
хинолоксидаз, в том числе цитохрома bd, кото-
культуры в стационарную фазу роста и фосфат-
рому и посвящён этот обзор, сайт связывания
ном голодании [24]. В последнее время появля-
цитохрома с отсутствует. По этой причине для
ется всё больше свидетельств того, что, помимо
отслеживания перемещения электрических
функционирования в качестве молекулярных
зарядов внутри их белковой молекулы первый
преобразователей энергии, оксидазы типа bd
подход неприменим.
принимают участие в других жизненно важ-
ных процессах в бактериальной клетке [27-30].
Цитохром bd-I вовлечён в образование дисуль-
ОБЩАЯ ХАРАКТЕРИСТИКА
фидных связей при сворачивании белка [31],
ЦИТОХРОМА bd
процесс биосинтеза гема [32], а также защиту
бактерии от антибиотиков [33], пероксини-
Мембраносвязанные терминальные окси-
трита [34], монооксида азота [35-41] и аммиа-
дазы аэробных дыхательных цепей организмов
ка [42]. Обе bd-оксидазы (bd-I и bd-II) также
относят к транслоказам (класс 7 ферментов).
наделяют E. coli устойчивостью к цианиду [43],
Они катализируют реакцию четырехэлектрон-
сульфиду [43-45] и перекиси водорода [46-54].
ного восстановления молекулярного кислоро-
Недавно были опубликованы трёхмерные
да до воды ферроцитохромом с либо хинолом
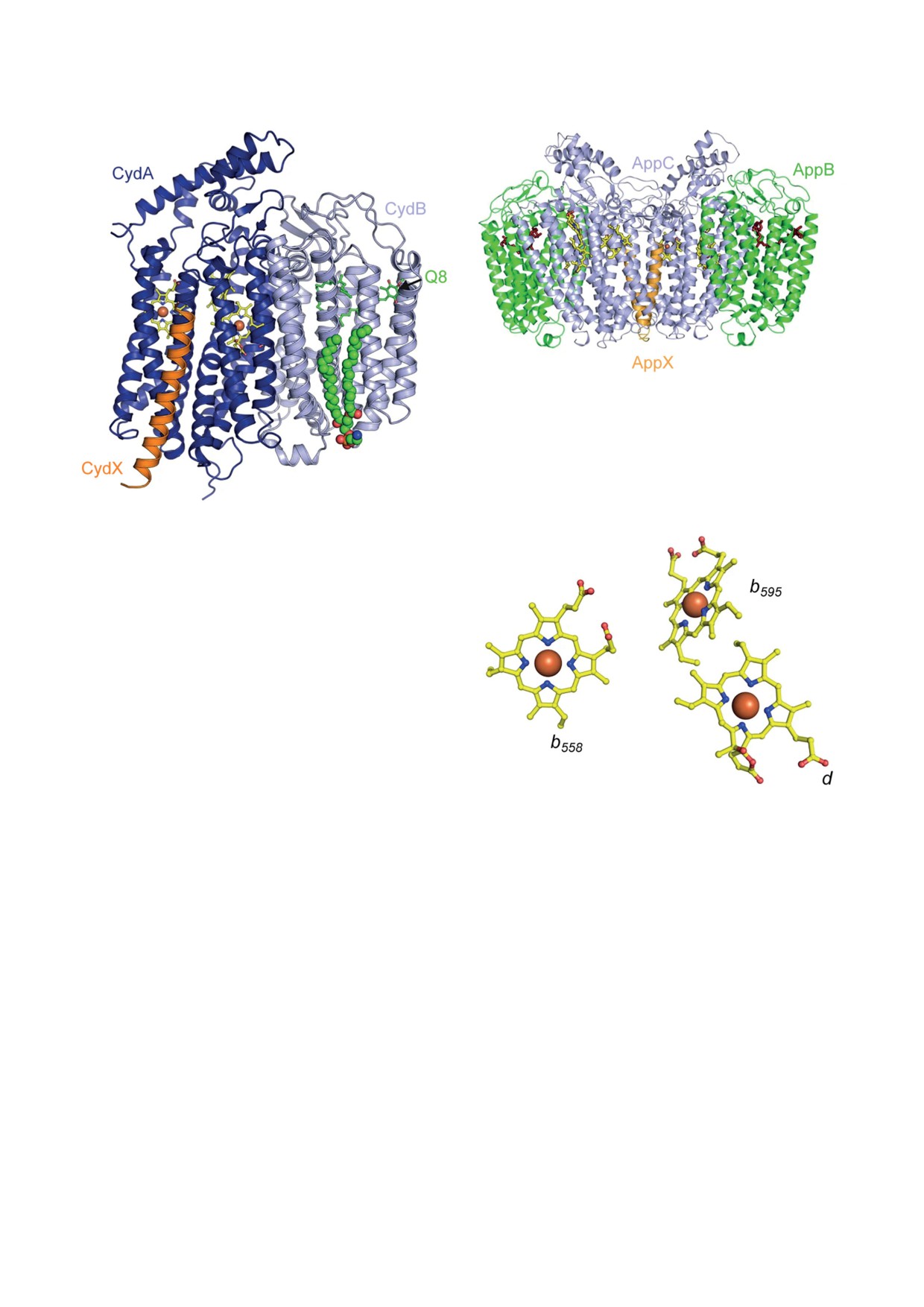
структуры обоих bd-ферментов E. coli (рис. 1, 2)
(убихинолом, менахинолом и, возможно, плас-
[55-58]. Обнаружено, что цитохром bd-I содер-
тохинолом) [12, 13]. Катализируемая окисли-
жит четыре субъединицы (CydA, CydB, CydX,
тельно-восстановительная реакция сопряже-
CydY), тогда как цитохром bd-II - только три
на с генерацией Δp (протон-движущей силы).
(AppC, AppB, AppX). При этом субъединицы
Δp представляет собой «энергетическую валю-
CydA, CydB и CydX имеют гомологию с субъ-
ту» и используется клеткой для синтеза ATP
единицами AppC, AppB и AppX соответствен-
с помощью механизма окислительного фос-
но. Две большие субъединицы, CydA/AppC и
форилирования [14]. Терминальные оксидазы
CydB/AppB, образуют структурную сердцевину
делят на два эволюционно неродственных
белка. Из других структурных отличий между
надсемейства: гем/Cu-содержащих оксидаз и
двумя bd-оксидазами следует отметить, что
оксидаз типа bd, также называемых цитохро-
белок bd-II, встроенный в амфиполы, в основ-
мами bd [15-18]. В отличие от гем-медных ок-
ном присутствует в виде димера (рис. 2), тогда
сидаз, все биохимически охарактеризованные
как фермент bd-I существует только в виде
цитохромы bd являются хинолоксидазами, не
мономера [57] (рис. 1). Кислородный канал
содержат Cu и встречаются только у бакте-
в цитохроме bd-II имеет меньший диаметр
рий и архей, в том числе патогенных [19-21].
по сравнению с таковым цитохрома bd-I [57].
Последнее обстоятельство позволяет рассма-
Кроме того, предполагаемый протон-прово-
тривать bd-ферменты в качестве перспективных
дящий путь в ферменте bd-II короче, чем в
терапевтических мишеней [21, 22]. Поскольку
оксидазе bd-I [57]. Субъединица CydA/AppC
генерация Δψ в режиме одного молекулярного
содержит в своём составе три разных гема,
оборота изучена пока только у терминальных
выступающих в качестве редокс-кофакторов:
bd-оксидаз Escherichia coli, следует остановить-
один низкоспиновый гексакоординирован-
ся на этих ферментах подробнее.
ный, b558, и два высокоспиновых пентакоорди-
Подобно электрон-транспортным цепям
нированных, b595 и d. Аксиальными лигандами
многих бактерий, аэробная дыхательная цепь
гемов служат аминокислотные остатки субъ-
E. coli разветвлена. Её терминальный участок в
единицы CydA/AppC. Это His186 и Met393 для
общем случае представлен тремя хинолоксида-
гема b558 и Glu445 для гема b595 [55-58]. В цито-
зами: гем-медным цитохромом bo3 и двумя ци-
хроме bd-II аксиальным лигандом гема d явля-
тохромами bd - bd-I и bd-II [23, 24]. В отличие
ется His19 [57-58]. В случае цитохрома bd-I
от оксидаз типа bd, цитохром bo3 образует Δp
данные о природе аксиального лиганда гема d
по механизму протонного насоса, что позво-
противоречивы. Safarian et al. [56] утверждают,
ляет двукратно увеличить стехиометрию пере-
что это также His19, однако согласно модели
БИОХИМИЯ том 88 вып. 10 2023
1820
БОРИСОВ
Рис. 2. Трёхмерная структура димера цитохрома bd-II
E. coli с разрешением 3,0 Å (PDB ID 7OSE). Помимо
гемов b558, b595 и d, связанных с субъединицей AppC,
в структуре белка обнаруживается убихинон-8 (пока-
зан красным цветом), связанный с субъединицей AppB.
Рисунок взят из работы Grauel et al. [57] в соответствии
с лицензией Creative Commons Attribution 4.0 International
License
Рис. 1. Трёхмерная структура цитохрома bd-I E. coli с раз-
решением 3,3 Å (PDB ID 6RX4). Помимо гемов b558, b595
и d, связанных с субъединицей CydA, в структуре белка
обнаруживаются убихинон-8 (Q8) и глицерофосфолипид
(показан символами сферической формы), связанные
с субъединицей CydB. Рисунок взят из работы Theßeling
et al. [55] в соответствии с лицензией Creative Commons
Attribution 4.0 International License
Theßeling et al. [55], таким лигандом служит
Glu99. Гемы в белке расположены треуголь-
ником (рис. 3). Дополнительным структур-
ным элементом в CydA/AppC является так
называемая Q-петля. Она находится вблизи
гема b558 и непосредственно участвует в свя-
зывании хинола, липофильного донора элек-Рис. 3. Треугольное расположение гемов b
558, b595 и d
в субъединице CydA цитохрома bd-I E. coli. Периплаз-
тронов. Другая большая субъединица, CydB/
AppB, не обнаруживает в своём составе каких- ма - вверху рисунка, цитоплазма - внизу рисунка. Ри-
сунок взят из работы Theßeling et al. [55] в соответствии
либо металл-содержащих кофакторов. Вместо
с лицензией Creative Commons Attribution 4.0 International
этого она несёт на себе прочно связанный уби-
License
хинон-8 или деметилменахинон-8. Этот хинон
занимает положение, эквивалентное сайту
связывания гема в CydA/AppC, и, вероятно,
му у гем-медных оксидаз. Тем не менее ван-
играет роль в стабилизации структуры белка.
дер-ваальсовы контакты между этими гемами
Гем b558 является первичным акцептором элек-
возможны, поскольку расстояние между их
тронов при окислении хинола. Гем d служит
краями гораздо меньше (3,5-3,8 Å) [55-58].
сайтом связывания O2 и его последующего
Последнее обстоятельство предполагает воз-
восстановления до 2H2O [59, 60]. Гем d в цито-
можность очень быстрого переноса электрона
хроме bd-I имеет необычайно высокое срод-
между гемами b595 и d, что получило экспери-
ство к О2, при этом образующийся оксигени-
ментальное подтверждение [65, 66]. Поэтому
рованный комплекс очень стабилен [61-64].
можно считать, что эти гемы образуют функ-
Функция гема b595 не вполне понятна. Слиш-
циональный дигемовый центр. Такое предпо-
ком большое расстояние между центральными
ложение согласуется с данными ряда иссле-
атомами Fe гемов b595 и d (10,9-11,3 Å), скорее
дований
[67-79]. Электрон, пришедший с
всего, не позволяет им сформировать струк-
хинола на гем b558, по-видимому, переносится
турный биядерный центр, подобный таково-
на гем b595 и затем на гем d.
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОГЕННЫЙ ЦИТОХРОМ bd
1821
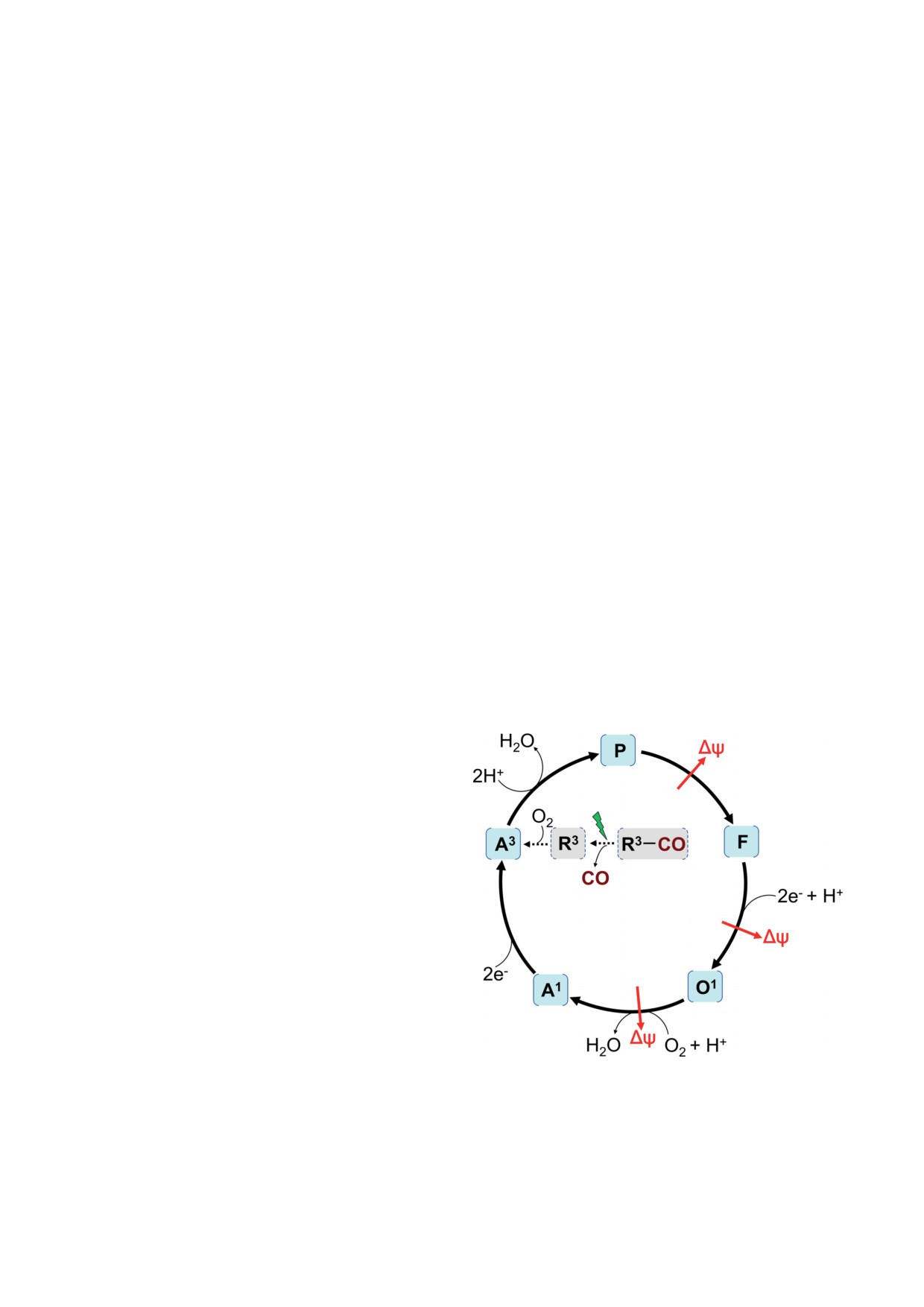
ЭЛЕКТРОГЕННЫЕ РЕАКЦИИ
подчеркнуть, что Paulus et al. [84] наблюдали
И КАТАЛИТИЧЕСКИЙ ЦИКЛ
образование соединения Р при температуре
ЦИТОХРОМА bd-I E. coli
+1 °C, то есть в нефизиологических условиях.
Возможно, что спектральный интермедиат Р,
Использование оптического и электро-
появление которого в реальном времени за-
метрического методов в сочетании с методом
регистрировали Belevich et al. [82], является
«флоу-флэш» позволило наблюдать в реальном
смесью истинного перекисного комплекса
времени промежуточное образование и рас-
(b5582+b5953+d3+-O-O-(H)) и феррил π-катион-
пад отдельных интермедиатов каталитического
радикала (b5582+b5953+d*4+=O2-) при условии
цикла цитохрома bd-I E. coli при температуре
того, что они имеют схожие спектры погло-
21 °C [26, 80-83]. Предполагаемая схема послед-
щения. На следующей стадии Р превращается
него показана на рис. 4. В спектроскопических
(с τ ~ 47 мкс) в нерадикальную форму фер-
исследованиях гемопротеин находился в ми-
рильного комплекса гема d (соединение F), что
целлах детергента, а в электрометрических был
сопровождается окислением гема b558. Катали-
встроен в липосомы. Исходно в эксперименте
тический интермедиат F, скорее всего, имеет
фермент переводился в полностью восстанов-
структуру b5583+b5953+d4+=O2-. Переход P → F со-
ленное состояние, в котором гем d был свя-
пряжён с генерацией Δψ [26, 82, 83].
зан с СО (R3-CO, b5582+b5952+d2+-CO). Фотолиз
bd-Оксидаза имеет в своём составе три
СО из этого состояния оксидазы приводит к
гема. Поэтому если выделенный фермент не
промежуточному появлению формы цитохро-
содержит связанного хинола, то можно ожи-
ма bd-I, не связанной с СО (R3, b5582+b5952+d2+).
дать, что в полностью восстановленном со-
Этот переход (R3-CO → R3) не разрешается во
стоянии он несёт на себе три электрона (R3).
времени как в спектрофотометрических, так
В этом случае реакция R3 с О2 останавлива-
и в электрометрических измерениях. В при-
ется на образовании соединения F [80]. Если
сутствии O2 происходит связывание молекулы
же цитохром bd-I включает в себя молекулу
этого двухатомного газа с гемом d. В результа-
связанного хинола, являющегося двухэлек-
те образуется оксигенированный комплекс -
тронным донором, то его окисление в при-
интермедиат A3 (b5582+b5952+d2+-O2). Скорость об-
сутствии O2 позволяет осуществить превраще-
разования A3 прямо пропорциональна концен-
ние F в интермедиат A1 с τ ~ 0,6-1,1 мс [81, 82].
трации O2, при этом константа скорости вто-
A1, вероятно, представляет собой одноэлек-
рого порядка составляет около 2 × 109 М-1 с-1
тронную форму оксидазы с оксикомплексом
[64, 82]. Переход R3 → A3 не сопровождается ге-
нерацией Δψ [26, 82, 83]. A3 быстро (τ ~ 4,5 мкс,
τ - характеристическое время, обратное кон-
станте скорости, t1/e) превращается в интерме-
диат, который Belevich et al. впервые описали
и назвали соединением P [82]. Обнаружено, что
переход A3 → P также не сопряжён с генера-
цией Δψ [26, 82, 83]. В отличие от генерации
A3 из R3, скорость образования соединения Р
не зависит от концентрации О2. В ходе пере-
хода A3 → P гем b595 подвергается окислению,
гем b558 остаётся в восстановленном состоя-
нии, а новая кислородная форма гема d демон-
стрирует необычный максимум поглощения
при 635 нм [82]. Единого мнения о химиче-
ской структуре соединения P до сих пор нет.
Belevich et al. в первоначальной работе [82]
предположили, что P - истинный перекис-
ный комплекс либо феррильный интермедиат
с аминокислотным радикалом или катион-
Рис. 4. Каталитический цикл цитохрома bd-I E. coli. Со-
радикалом порфиринового кольца. Согласно
единения A3, P, F, O1, A1 - каталитические интермедиаты
более поздним данным Paulus et al. [84], со-
фермента. Соединения R3 и R3-CO не являются частью
каталитического цикла оксидазы, но могут быть полу-
единение Р представляет собой феррильную
чены искусственным путём. Красные «стрелки сопря-
форму гема d с π-катион-радикалом на пор-
жения» обозначают генерацию Δψ при переходах P → F
фириновом кольце, которая находится в маг-
и F → A1. Структура соединений обсуждается в тексте
нитном взаимодействии с гемом b595. Важно
обзора
БИОХИМИЯ том 88 вып. 10 2023
1822
БОРИСОВ
гема d (b5583+b5953+d2+-O2). Переход F → A1, как
и предыдущий, P → F, сопровождается генера-
цией Δψ [81, 82]. Образуется ли Δψ ещё на од-
ной частной стадии каталитического цикла - в
переходе A1 → A3 (рис. 4), пока неизвестно.
Обнаружено, что в стационарных усло-
виях в присутствии O2 и убихинола-1 основ-
ными каталитическими интермедиатами цито-
хрома bd-I являются F и A1 (каждый составляет
примерно по 40% от общего количества) [60].
При этом около 20% оксидазы, вероятно, нахо-
дится в состоянии O1 - одноэлектронной фор-
ме с окисленным гемом d (b5582+b5953+d3+-ОН).
Состояние O1 в экспериментах в режиме од-
ного оборота с использованием метода «флоу-
флэш» зарегистрировано не было [80, 82, 83].
Тем не менее в настоящее время принято ду-
мать, что O1, по-видимому, также является ка-
талитическим интермедиатом цитохрома bd-I
(рис. 4). Стоит также отметить, что форма R3
фермента, скорее всего, не входит в число его
каталитических интермедиатов [59, 60], однако
для нужд эксперимента может быть легко про-
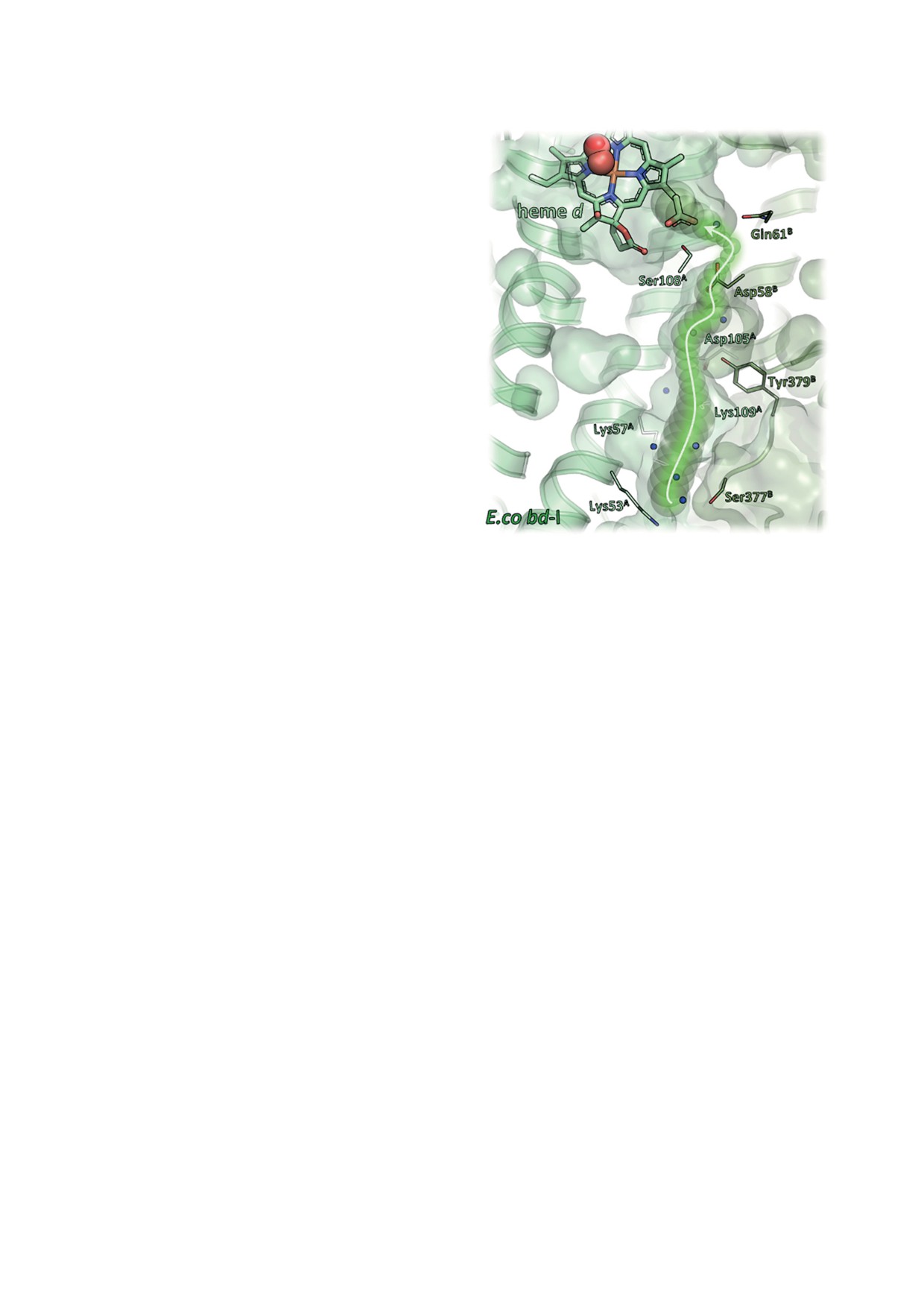
Рис. 5. Предполагаемый протон-проводящий путь в ци-
изведена искусственным путём.
тохроме bd-I E. coli. Путь выстлан боковыми цепями
В 2005 г. Belevich et al. [81] на основании
нескольких гидрофильных аминокислот и позволяет пе-
реносить протоны с цитоплазматической стороны мем-
полученных результатов постулировали суще-
браны к пропионату гема d. В нём также обнаруживаются
ствование внутрибелкового протон-проводя-
многочисленные молекулы воды (обозначены символами
щего пути для переноса Н+ из цитоплазмы в
сферической формы синего цвета). Рисунок взят из рабо-
кислородоредуктазный центр цитохрома bd-I.
ты Friedrich et al. [22] в соответствии с лицензией Creative
Commons Attribution 4.0 International License
Авторы предположили, что такое перемеще-
ние Н+ поперёк мембраны, сопряжённое с пе-
реносом электрона с гема b558 на гемы b595 и d,
облегчая перенос Н+ с Asp58CydB на пропионат
сопровождается генерацией Δψ, наблюдаемой
гема d [56].
в экспериментах [26, 80-83]. Выброс Н+ в пе-
Belevich et al. [81] также выдвинули гипо-
риплазматическое пространство при окисле-
тезу, согласно которой в молекуле bd-I два
нии хинола ферментом также вносит вклад в
аминокислотных остатка с протонируемыми
создание Δp. Опубликованные в 2019 г. трёх-
группами чувствительны к редокс-состоя-
мерные структуры bd-I-оксидазы с разреше-
нию высокоспиновых пентакоординирован-
нием 2,68 Å (PDB ID 6RKO) [56] и 3,3 Å (PDB
ных гемов b595 и d. Исследования мутантных
ID 6RX4) [55] подтвердили гипотезу, выдвину-
форм Glu445Ala и Glu107Leu цитохрома bd-I
тую Belevich et al. [81]. В структурах видна це-
E. coli методами электрометрии и абсорбци-
почка молекул воды, тянущаяся вдоль гидро-
онной спектроскопии с микросекундным
фильного протон-проводящего пути, который
разрешением указывают на то, что такими
начинается в цитоплазматическом интерфейсе
функционально важными остатками служат
между субъединицами CydA и CydB и прохо-
высококонсервативные Glu445CydA и Glu107CydA
дит перпендикулярно плоскости мембраны к
соответственно [81, 83].
гему d. Этот протон-проводящий путь состав-
Как указано выше, Glu445CydA - аксиаль-
ляют несколько гидрофильных аминокислот-
ный лиганд железа гема b595 [55, 56]. Его замена
ных остатков (рис. 5). С цитоплазматической
на Ala в субъединице CydA приводит к инак-
стороны путь начинается с Asp119CydA, затем,
тивации фермента. При этом гем b595 удержи-
по-видимому, в его состав входят Lys57CydA,
вается в белке, но теряет способность к вос-
Lys109CydA, Asp105CydA, Tyr379CydB и, наконец,
становлению даже в присутствии сильного
Asp58CydB, с которого протоны, вероятно, по-
донора электронов - дитионита, добавленного
ступают на пропионатную группу гема d [55].
в избытке [81]. Как и в случае цитохрома bd-I
Высказано предположение, что консерватив-
дикого типа, в реакции восстановленного му-
ные гидрофильные остатки Ser108CydA, Glu107CydA
тантного фермента Glu445Ala с кислородом на-
и Ser140CydA также относятся к этому пути,
блюдается начальная неэлектрогенная стадия,
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОГЕННЫЙ ЦИТОХРОМ bd
1823
состоящая из переходов R3 → A3 и A3 → P. Од-
равно 0, то есть он является несопряжённой
нако у мутанта, в отличие от дикого типа, при
хинолоксидазой. При этом известно, что цито-
генерации Δψ не выявляется микросекундная
хромы bd-I и bo3 E. coli - сопряжённые хинол-
фаза. Вместо этого у мутантной формы наблю-
оксидазы, со значениями Н+/e- 1 и 2 соответ-
дается более медленная, небольшая электро-
ственно [25, 26]. Bekker et al. сконструировали
генная фаза (τ ~ 1,3 мс; амплитуда - 0,36 мВ),
мутантный штамм E. coli MB37, в дыхательной
за которой следует электрогенный переход
цепи которого присутствовал цитохром bd-II,
гораздо большей амплитуды (τ ~ 12,5 мс; ам-
но отсутствовали все известные на тот момент
плитуда - 1,7 мВ). Обе электрогенные фазы,
первичные генераторы протонного потенциа-
скорее всего, отражают переход P → F в раз-
ла: NADH-дегидрогеназа 1 (NDH-1), цито-
ных субпопуляциях фермента Glu445Ala [81].
хром bo3 и цитохром bd-I. Авторы вычисляли
Таким образом, замена Glu445 на Ala сильно
Н+/e-, используя сравнительные значения спе-
ингибирует перенос заряда поперёк мем-
цифических скоростей потребления кислорода
браны, сопряжённый с окислением цитохро-
и синтеза ATP штамма MB37 с другими мутант-
ма bd-I кислородом.
ными штаммами E. coli, для которых уже были
Аналогично, замена Glu107 на Leu в субъ-
измерены величины Н+/e- [85]. Бактериальные
единице CydA ведёт к потере цитохромом bd-I
клетки всех штаммов растили в одинаковых
хинолоксидазной активности. Полностью вос-
условиях, а скорость синтеза ATP рассчиты-
становленная мутантная форма Glu107Leu
вали из скоростей образования продуктов ме-
белка (R3) связывает O2 примерно с той же
таболизма - СО2, ацетата, этанола и лактата.
скоростью, что и фермент дикого типа. Однако
Неожиданным оказалось следующее наблюде-
образование феррильного интермедиата (F) в
ние: штамм MB37, который, по предположе-
мутантной оксидазе, как полагают, существен-
нию авторов работы, должен был обладать пол-
но замедляется в сравнении с ферментом ди-
ностью несопряжённой аэробной дыхательной
кого типа. Об этом свидетельствуют результа-
цепью, оказался способен к росту в аэроб-
ты спектрофотометрических экспериментов,
ных условиях на несбраживаемых субстратах.
согласно которым продукции соединения F в
Однако возникает вопрос: как же в таком слу-
100-микросекундной временной шкале у му-
чае обеспечивается синтез ATP? Bekker et al.
тантной оксидазы не наблюдается, в отличие
выдвинули гипотезу
[85], согласно которой
от белка дикого типа [83]. Этот вывод согласу-
ATP в штамме MB37 продуцируется исключи-
ется с тем фактом, что скорость генерации Δψ
тельно за счёт субстратного фосфорилирова-
(основной фазы) мутантной оксидазой при-
ния. В более поздней работе Shepherd et al. [86]
мерно в 350 раз ниже, чем таковая, измерен-
предположили, что в этом мутантном штам-
ная для фермента дикого типа [83].
ме протонный потенциал образуется за счёт
Glu445CydA, по-видимому, протонируется
функционирования электрогенного антипор-
при переходе гема b595 из окисленной в вос-
тера, который переносит внутрь клетки анион
становленную форму, т.е. служит для компен-
глутаминовой кислоты (глутамат) в обмен на
сации отрицательного заряда электрона, при-
выброс из клетки нейтральной γ-аминомасля-
шедшего на гем. В случае гема d такую же роль,
ной кислоты (ГАМК). При этом ГАМК в клет-
возможно, выполняет Glu107CydA. Согласно
ке синтезируется из глутамата, в процессе чего
опубликованной трёхмерной структуре цито-
потребляется внутриклеточный протон.
хрома bd-I E. coli, гем b595 расположен вбли-
Borisov et al. [26] нашли неубедительными
зи периплазматической поверхности [55, 56].
выводы авторов этих двух работ и экспери-
Поэтому если Н+ при восстановлении гема b595
ментально проверили, генерирует ли цито-
поступает на Glu445CydA с периплазматической
хром bd-II Δp. Обнаружили, что в стационар-
стороны мембраны, то он вряд ли использу-
ных условиях оба компонента Δp - Δψ и ΔpH -
ется в катализируемой ферментом кислородо-
образуются за счёт хинолоксидазной актив-
редуктазной реакции.
ности цитохрома bd-II [26]. Измерили соот-
ношение Н+/e-. Как и в случае цитохрома bd-I,
оно оказалось равным 1 [26]. Также показали,
МОЖЕТ ЛИ ЦИТОХРОМ bd-II
что оксидаза bd-II способна генерировать Δψ
ИЗ E. coli ГЕНЕРИРОВАТЬ Δψ?
в ходе одного молекулярного оборота фермен-
та, предположительно, при переходах P → F и
Функциональные исследования цито-
F → A1 [26]. Таким образом, можно заключить,
хрома bd-II E. coli пока находятся на самом
что цитохром bd-II E. coli является первичным
начальном этапе. Bekker et al. [85] сообщили,
генератором Δp. Следовательно, для объясне-
что для фермента bd-II соотношение Н+/e-
ния роста клеток штамма E. coli MB37 в аэроб-
БИОХИМИЯ том 88 вып. 10 2023
1824
БОРИСОВ
ных условиях альтернативные механизмы обра-
левичу, Н.П. Белевичу, Д.А. Блоху (безвре-
зования ATP, предложенные в работах Bekker
менно ушедшему) и А. Ясайтису за то чудесное
et al. и Shepherd et al. [85, 86], не требуются.
время, которое мы провели, измеряя электро-
генную активность загадочного цитохрома bd.
Финансирование. Исследование выполнено за
Конфликт интересов. Автор заявляет об от-
счёт гранта Российского научного фонда № 22-
сутствии конфликта интересов в финансовой
или любой другой сфере.
Благодарность. Автор хотел бы выразить
Соблюдение этических норм. Эта статья не
свою глубочайшую благодарность М.И. Вер-
содержит каких-либо исследований с участием
ховскому (безвременно ушедшему), И.Н. Бе-
людей или животных, выполненных автором.
СПИСОК ЛИТЕРАТУРЫ
1.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D.,
8.
Bogachev, A. V., Bertsova, Y. V., Verkhovskaya,
Kondrashin, A. A., Liberman, E. A., Nemecek, I. B.,
M. L., Mamedov, M. D., and Skulachev, V. P. (2016)
Ostroumov, S. A., Semenov, A. Y., and Skulachev, V. P.
Real-time kinetics of electrogenic Na+ transport
(1974) Direct measurement of electric current genera-
by rhodopsin from the marine flavobacterium
tion by cytochrome oxidase, H+-ATPase and bacterior-
Dokdonia sp. PRO95, Sci. Rep., 6, 21397, doi: 10.1038/
hodopsin, Nature, 249, 321-324, doi: 10.1038/249321a0.
srep21397.
2.
Drachev, L. A., Kaulen, A. D., Khitrina, L. V.,
9.
Siletsky, S. A., Lukashev, E. P., Mamedov, M. D.,
and Skulachev, V. P. (1981) Fast stages of photoelectric
Borisov, V. B., Balashov, S. P., Dolgikh, D. A., Rubin,
processes in biological membranes. I. Bacteriorho-
A. B., Kirpichnikov, M. P., and Petrovskaya, L. E.
dopsin, Eur. J. Biochem., 117, 461-470, doi: 10.1111/
(2021) His57 controls the efficiency of ESR, a light-
j.1432-1033.1981.tb06361.x.
driven proton pump from Exiguobacterium sibiricum
3.
Dracheva, S. M., Drachev, L. A., Konstantinov, A. A.,
at low and high pH, Biochim. Biophys. Acta Bioenerg.,
Semenov, A. Y., Skulachev, V. P., Arutjunjan, A. M.,
1862, 148328, doi: 10.1016/j.bbabio.2020.148328.
Shulalov, V. A., and Zaberezhnaya, S. M.
(1988)
10.
Verkhovsky, M. I., Morgan, J. E., Verkhovskaya, M.,
Electrogenic steps in the redox reactions catalyzed by
and Wikstrom, M. (1997) Translocation of electrical
photosynthetic reaction-centre complex from Rho-
charge during a single turnover of cytochrome-c
dopseudomonas viridis, Eur. J. Biochem., 171, 253-264,
oxidase, Biochim. Biophys. Acta,
1318,
6-10,
doi: 10.1111/j.1432-1033.1988.tb13784.x.
doi: 10.1016/S0005-2728(96)00147-8.
4.
Mulkidjanian, A. Y., Mamedov, M. D., Semenov, A. Y.,
11.
Gibson, Q., and Greenwood, C. (1963) Reactions of
Shinkarev, V. P., Verkhovsky, M. I., and Drachev, L. A.
cytochrome oxidase with oxygen and carbon monox-
(1990) Partial reversion of the electrogenic reaction
ide, Biochem. J., 86, 541-554, doi: 10.1042/bj0860541.
in the ubiquinol: cytochrome c2-oxidoreductase
12.
Siletsky, S. A., Borisov, V. B., and Mamedov, M. D.
of Rhodobacter sphaeroides chromatophores under
(2017) Photosystem II and terminal respiratory
neutral and alkaline conditions, FEBS Lett., 277,
oxidases: molecular machines operating in opposite
127-130, doi: 10.1016/0014-5793(90)80825-4.
directions, Front. Biosci. (Landmark Ed.), 22, 1379-
5.
Zaslavsky, D., Kaulen, A. D., Smirnova, I. A.,
1426, doi: 10.2741/4550.
Vygodina, T., and Konstantinov, A. A.
(1993)
13.
Azarkina, N. V., Borisov, V. B., Oleynikov, I. P.,
Flash-induced membrane potential generation by
Sudakov, R. V., and Vygodina, T. V. (2023) Interaction
cytochrome c oxidase, FEBS Lett., 336, 389-393,
of terminal oxidases with amphipathic molecules,
doi: 10.1016/0014-5793(93)80843-j.
Int. J. Mol. Sci., 24, 6428, doi: 10.3390/ijms24076428.
6.
Konstantinov, A. A., Siletsky, S., Mitchell, D.,
14.
Zharova, T. V., Grivennikova, V. G., and Borisov, V. B.
Kaulen, A., and Gennis, R. B. (1997) The roles of the
(2023) F1·Fo ATP Synthase/ATPase: contemporary
two proton input channels in cytochrome c oxidase
view on unidirectional catalysis, Int. J. Mol. Sci., 24,
from Rhodobacter sphaeroides probed by the effects of
5417, doi: 10.3390/ijms24065417.
site-directed mutations on time-resolved electrogenic
15.
Arutyunyan, A. M., Sakamoto, J., Inadome, M.,
intraprotein proton transfer, Proc. Natl. Acad. Sci.
Kabashima, Y., and Borisov, V. B. (2012) Optical
USA, 94, 9085-9090, doi: 10.1073/pnas.94.17.9085.
and magneto-optical activity of cytochrome bd from
7.
Siletsky, S., Kaulen, A. D., and Konstantinov, A. A.
Geobacillus thermodenitrificans, Biochim. Biophys. Acta,
(1999) Resolution of electrogenic steps couples to
1817, 2087-2094, doi: 10.1016/j.bbabio.2012.06.009.
conversion of cytochrome c oxidase from the peroxy
16.
Borisov, V. B., and Siletsky, S. A. (2019) Features of
to the ferryl-oxo state, Biochemistry, 38, 4853-4861,
organization and mechanism of catalysis of two fam-
doi: 10.1021/bi982614a.
ilies of terminal oxidases: heme-copper and bd-type,
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОГЕННЫЙ ЦИТОХРОМ bd
1825
Biochemistry (Moscow), 84, 1390-1402, doi: 10.1134/
rial tolerance to oxidative and nitrosative stress, Bio-
S0006297919110130.
chim. Biophys. Acta, 1837, 1178-1187, doi: 10.1016/
17.
Murali, R., Gennis, R. B., and Hemp, J.
(2021)
j.bbabio.2014.01.016.
Evolution of the cytochrome bd oxygen reductase
30.
Borisov, V. B., Forte, E., Siletsky, S. A., Arese, M.,
superfamily and the function of CydAA′ in Archaea,
Davletshin, A. I., Sarti, P., and Giuffre, A. (2015) Cy-
ISME J.,
15,
3534-3548, doi:
10.1038/s41396-
tochrome bd protects bacteria against oxidative and
021-01019-4.
nitrosative stress: a potential target for next-genera-
18.
Siletsky, S. A., and Borisov, V. B. (2021) Proton
tion antimicrobial agents, Biochemistry (Moscow), 80,
pumping and non-pumping terminal respiratory
565-575, doi: 10.1134/S0006297915050077.
oxidases: Active sites intermediates of these molecular
31.
Bader, M., Muse, W., Ballou, D. P., Gassner, C., and
machines and their derivatives, Int. J. Mol. Sci., 22,
Bardwell, J. C. A. (1999) Oxidative protein folding
10852, doi: 10.3390/ijms221910852.
is driven by the electron transport system, Cell, 98,
19.
Forte, E., Borisov, V. B., Vicente, J. B., and Giuffre, A.
217-227, doi: 10.1016/S0092-8674(00)81016-8.
(2017) Cytochrome bd and gaseous ligands in bac-
32.
Mobius, K., Arias-Cartin, R., Breckau, D., Hannig,
terial physiology, Adv. Microb. Physiol., 71, 171-234,
A. L., Riedmann, K., Biedendieck, R., Schroder, S.,
doi: 10.1016/bs.ampbs.2017.05.002.
Becher, D., Magalon, A., Moser, J., Jahn, M., and
20.
Borisov, V. B., Gennis, R. B., Hemp, J., and Verkhov-
Jahn, D. (2010) Heme biosynthesis is coupled to
sky, M. I. (2011) The cytochrome bd respiratory oxy-
electron transport chains for energy generation, Proc.
gen reductases, Biochim. Biophys. Acta, 1807, 1398-
Natl. Acad. Sci. USA, 107, 10436-10441, doi: 10.1073/
1413, doi: 10.1016/j.bbabio.2011.06.016.
pnas.1000956107.
21.
Borisov, V. B., Siletsky, S. A., Paiardini, A.,
33.
Seregina, T. A., Lobanov, K. V., Shakulov, R. S., and
Hoogewijs, D., Forte, E., Giuffre, A., and Poole,
Mironov, A. S. (2022) Inactivation of terminal oxidase
R. K. (2021) Bacterial oxidases of the cytochrome bd
bd-I leads to supersensitivity of E. coli to quinolone
family: Redox enzymes of unique structure, function
and beta-lactam antibiotics, Mol. Biol. (Mosk), 56,
and utility as drug targets, Antioxid. Redox Signal., 34,
619-627, doi: 10.1134/S0026893322040100.
1280-1318, doi: 10.1089/ars.2020.8039.
34.
Borisov, V. B., Forte, E., Siletsky, S. A., Sarti, P., and
22.
Friedrich, T., Wohlwend, D., and Borisov, V. B. (2022)
Giuffre, A. (2015) Cytochrome bd from Escherichia
Recent advances in structural studies of cytochrome
coli catalyzes peroxynitrite decomposition, Biochim.
bd and its potential application as a drug target, Int. J.
Biophys. Acta, 1847, 182-188, doi: 10.1016/j.bbabio.
Mol. Sci., 23, 3166, doi: 10.3390/ijms23063166.
2014.10.006.
23.
Borisov, V. B. (1996) Cytochrome bd: structure and
35.
Borisov, V. B., Forte, E., Konstantinov, A. A., Poole,
properties, Biochemistry (Moscow), 61, 565-574.
R. K., Sarti, P., and Giuffre, A. (2004) Interaction
24.
Borisov, V. B., and Verkhovsky, M. I. (2015) Oxygen
of the bacterial terminal oxidase cytochrome bd with
as acceptor, EcoSal Plus, 6, doi: 10.1128/ecosalplus.
nitric oxide, FEBS Lett., 576, 201-204, doi: 10.1016/
ESP-0012-2015.
j.febslet.2004.09.013.
25.
Puustinen, A., Finel, M., Haltia, T., Gennis, R. B.,
36.
Borisov, V. B., Forte, E., Sarti, P., Brunori, M.,
and Wikstrom, M.
(1991) Properties of the two
Konstantinov, A. A., and Giuffre, A. (2006) Nitric
terminal oxidases of Escherichia coli, Biochemistry, 30,
oxide reacts with the ferryl-oxo catalytic intermediate
3936-3942, doi: 10.1021/bi00230a019.
of the CuB-lacking cytochrome bd terminal oxidase,
26.
Borisov, V. B., Murali, R., Verkhovskaya, M. L., Bloch,
FEBS Lett., 580, 4823-4826, doi: 10.1016/j.febslet.
D. A., Han, H., Gennis, R. B., and Verkhovsky, M. I.
2006.07.072.
(2011) Aerobic respiratory chain of Escherichia coli is
37.
Borisov, V. B., Forte, E., Sarti, P., Brunori, M.,
not allowed to work in fully uncoupled mode, Proc.
Konstantinov, A. A., and Giuffre, A. (2007) Redox
Natl. Acad. Sci. USA, 108, 17320-17324, doi: 10.1073/
control of fast ligand dissociation from Escherichia coli
pnas.1108217108.
cytochrome bd, Biochem. Biophys. Res. Commun., 355,
27.
Forte, E., Borisov, V. B., Konstantinov, A. A.,
97-102, doi: 10.1016/j.bbrc.2007.01.118.
Brunori, M., Giuffre, A., and Sarti, P. (2007) Cyto-
38.
Mason, M. G., Shepherd, M., Nicholls, P., Dobbin,
chrome bd, a key oxidase in bacterial survival and
P. S., Dodsworth, K. S., Poole, R. K., and Cooper,
tolerance to nitrosative stress, Ital. J. Biochem.,
C. E. (2009) Cytochrome bd confers nitric oxide
56, 265-269.
resistance to Escherichia coli, Nat. Chem. Biol., 5,
28.
Giuffre, A., Borisov, V. B., Mastronicola, D., Sarti, P.,
94-96, doi: 10.1038/nchembio.135.
and Forte, E. (2012) Cytochrome bd oxidase and
39.
Borisov, V. B., Forte, E., Giuffre, A., Konstantinov, A.,
nitric oxide: From reaction mechanisms to bacterial
and Sarti, P. (2009) Reaction of nitric oxide with the
physiology, FEBS Lett., 586, 622-629, doi: 10.1016/
oxidized di-heme and heme-copper oxygen-reducing
j.febslet.2011.07.035.
centers of terminal oxidases: different reaction
29.
Giuffre, A., Borisov, V. B., Arese, M., Sarti, P., and
pathways and end-products, J. Inorg. Biochem., 103,
Forte, E. (2014) Cytochrome bd oxidase and bacte-
1185-1187, doi: 10.1016/j.jinorgbio.2009.06.002.
8
БИОХИМИЯ том 88 вып. 10 2023
1826
БОРИСОВ
40.
Shepherd, M., Achard, M. E., Idris, A., Totsika, M.,
52.
Al-Attar, S., Yu, Y., Pinkse, M., Hoeser, J.,
Phan, M. D., Peters, K. M., Sarkar, S., Ribeiro, C. A.,
Friedrich, T., Bald, D., and de Vries, S.
(2016)
Holyoake, L. V., Ladakis, D., Ulett, G. C., Sweet,
Cytochrome bd displays significant quinol peroxidase
M. J., Poole, R. K., McEwan, A. G., and Schembri,
activity, Sci. Rep., 6, 27631, doi: 10.1038/srep27631.
M. A. (2016) The cytochrome bd-I respiratory oxidase
53.
Borisov, V. B., Siletsky, S. A., Nastasi, M. R., and
augments survival of multidrug-resistant Escherichia
Forte, E. (2021) ROS defense systems and terminal
coli during infection, Sci. Rep., 6, 35285, doi: 10.1038/
oxidases in bacteria, Antioxidants (Basel), 10, 839,
srep35285.
doi: 10.3390/antiox10060839.
41.
Borisov, V. B., and Forte, E. (2022) Bioenergetics and
54.
Forte, E., Nastasi, M. R., and Borisov, V. B. (2022)
reactive nitrogen species in bacteria, Int. J. Mol. Sci.,
Preparations of terminal oxidase cytochrome bd-II iso-
23, 7321, doi: 10.3390/ijms23137321.
lated from Escherichia coli reveal significant hydrogen
42.
Forte, E., Siletsky, S. A., and Borisov, V. B. (2021) In
peroxide scavenging activity, Biochemistry (Moscow),
Escherichia coli ammonia inhibits cytochrome bo3 but
87, 720-730, doi: 10.1134/S0006297922080041.
activates cytochrome bd-I, Antioxidants (Basel), 10,
55.
Theßeling, A., Rasmussen, T., Burschel, S.,
13, doi: 10.3390/antiox10010013.
Wohlwend, D., Kagi, J., Muller, R., Bottcher, B., and
43.
Forte, E., Borisov, V. B., Falabella, M., Colaco,
Friedrich, T. (2019) Homologous bd oxidases share
H. G., Tinajero-Trejo, M., Poole, R. K., Vicente,
the same architecture but differ in mechanism, Nat.
J. B., Sarti, P., and Giuffre, A. (2016) The terminal
Commun., 10, 5138, doi: 10.1038/s41467-019-13122-4.
oxidase cytochrome bd promotes sulfide-resistant
56.
Safarian, S., Hahn, A., Mills, D. J., Radloff, M.,
bacterial respiration and growth, Sci. Rep., 6, 23788,
Eisinger, M. L., Nikolaev, A., Meier-Credo, J.,
doi: 10.1038/srep23788.
Melin, F., Miyoshi, H., Gennis, R. B., Sakamoto, J.,
44.
Borisov, V. B., and Forte, E. (2021) Terminal oxidase
Langer, J. D., Hellwig, P., Kuhlbrandt, W., and
cytochrome bd protects bacteria against hydrogen
Michel, H. (2019) Active site rearrangement and struc-
sulfide toxicity, Biochemistry (Moscow), 86, 22-32,
tural divergence in prokaryotic respiratory oxidases,
doi: 10.1134/S000629792101003X.
Science, 366, 100-104, doi: 10.1126/science.aay0967.
45.
Borisov, V. B., and Forte, E. (2021) Impact of
57.
Grauel, A., Kagi, J., Rasmussen, T., Makarchuk, I.,
hydrogen sulfide on mitochondrial and bacterial
Oppermann, S., Moumbock, A. F. A., Wohlwend, D.,
bioenergetics, Int. J. Mol. Sci., 22, 12688, doi: 10.3390/
Muller, R., Melin, F., Gunther, S., Hellwig, P.,
ijms222312688.
Bottcher, B., and Friedrich, T.
(2021) Structure
46.
Borisov, V., Gennis, R., and Konstantinov, A. A.
of Escherichia coli cytochrome bd-II type oxidase
(1995) Peroxide complex of cytochrome bd: kinetics
with bound aurachin D, Nat. Commun., 12, 6498,
of generation and stability, Biochem. Mol. Biol. Int.,
doi: 10.1038/s41467-021-26835-2.
37, 975-982.
58.
Grund, T. N., Radloff, M., Wu, D., Goojani, H. G.,
47.
Borisov, V. B., Gennis, R. B., and Konstantinov, A. A.
Witte, L. F., Josting, W., Buschmann, S., Muller, H.,
(1995) Interaction of cytochrome bd from Escherichia
Elamri, I., Welsch, S., Schwalbe, H., Michel, H.,
coli with hydrogen peroxide, Biochemistry (Moscow),
Bald, D., and Safarian, S. (2021) Mechanistic and
60, 231-239.
structural diversity between cytochrome bd isoforms
48.
Lindqvist, A., Membrillo-Hernandez, J., Poole, R. K.,
of Escherichia coli, Proc. Natl. Acad. Sci. USA,
and Cook, G. M. (2000) Roles of respiratory oxi-
118, e2114013118, doi: 10.1073/pnas.2114013118.
dases in protecting Escherichia coli K12 from oxi-
59.
Yang, K., Borisov, V. B., Konstantinov, A. A., and
dative stress, Antonie Van Leeuwenhoek, 78, 23-31,
Gennis, R. B. (2008) The fully oxidized form of the
doi: 10.1023/a:1002779201379.
cytochrome bd quinol oxidase from E. coli does not
49.
Borisov, V. B., Davletshin, A. I., and Konstantinov,
participate in the catalytic cycle: direct evidence from
A. A. (2010) Peroxidase activity of cytochrome bd from
rapid kinetics studies, FEBS Lett., 582, 3705-3709,
Escherichia coli, Biochemistry (Moscow), 75, 428-436,
doi: 10.1016/j.febslet.2008.09.038.
doi: 10.1134/S000629791004005X.
60.
Borisov, V. B., Forte, E., Sarti, P., and Giuffre, A.
50.
Borisov, V. B., Forte, E., Davletshin, A., Mas-
(2011) Catalytic intermediates of cytochrome bd
tronicola, D., Sarti, P., and Giuffre, A. (2013) Cyto-
terminal oxidase at steady-state: Ferryl and oxy-ferrous
chrome bd oxidase from Escherichia coli displays high
species dominate, Biochim. Biophys. Acta,
1807,
catalase activity: an additional defense against oxida-
503-509, doi: 10.1016/j.bbabio.2011.02.007.
tive stress, FEBS Lett., 587, 2214-2218, doi: 10.1016/
61.
Borisov, V. B., Smirnova, I. A., Krasnosel’skaya, I. A.,
j.febslet.2013.05.047.
and Konstantinov, A. A. (1994) Oxygenated cyto-
51.
Forte, E., Borisov, V. B., Davletshin, A., Mas-
chrome bd from Escherichia coli can be converted into
tronicola, D., Sarti, P., and Giuffre, A.
(2013)
the oxidized form by lipophilic electron acceptors,
Cytochrome bd oxidase and hydrogen peroxide
Biochemistry (Moscow), 59, 437-443.
resistance in Mycobacterium tuberculosis, MBio, 4,
62.
D’mello, R., Hill, S., and Poole, R. K. (1996) The
e01006-01013, doi: 10.1128/mBio.01006-13.
cytochrome bd quinol oxidase in Escherichia coli has
БИОХИМИЯ том 88 вып. 10 2023
ЭЛЕКТРОГЕННЫЙ ЦИТОХРОМ bd
1827
an extremely high oxygen affinity and two-oxygen-
Vos, M. H. (2002) Interactions between heme d and
binding haems: implications for regulation of activity
heme b595 in quinol oxidase bd from Escherichia coli: a
in vivo by oxygen inihibition, Microbiology,
142,
photoselection study using femtosecond spectroscopy,
755-763, doi: 10.1099/00221287-142-4-755.
Biochemistry, 41, 1654-1662, doi: 10.1021/bi0158019.
63.
Belevich, I., Borisov, V. B., Konstantinov, A. A.,
74.
Arutyunyan, A. M., Borisov, V. B., Novoderezhkin,
and Verkhovsky, M. I. (2005) Oxygenated complex
V. I., Ghaim, J., Zhang, J., Gennis, R. B., and
of cytochrome bd from Escherichia coli: stability
Konstantinov, A. A. (2008) Strong excitonic inter-
and photolability, FEBS Lett.,
579,
4567-4570,
actions in the oxygen-reducing site of bd-type oxi-
doi: 10.1016/j.febslet.2005.07.011.
dase: the Fe-to-Fe distance between hemes d and b595
64.
Belevich, I., Borisov, V. B., Bloch, D. A.,
is 10 Å, Biochemistry, 47, 1752-1759, doi: 10.1021/
Konstantinov, A. A., and Verkhovsky, M. I. (2007)
bi701884g.
Cytochrome bd from Azotobacter vinelandii: evidence
75.
Borisov, V. B. (2008) Interaction of bd-type quinol
for high-affinity oxygen binding, Biochemistry, 46,
oxidase from Escherichia coli and carbon monoxide:
11177-11184, doi: 10.1021/bi700862u.
heme d binds CO with high affinity, Biochemistry
65.
Siletsky, S. A., Zaspa, A. A., Poole, R. K., and
(Moscow), 73, 14-22, doi: 10.1134/S0006297908010021.
Borisov, V. B.
(2014) Microsecond time-resolved
76.
Bloch, D. A., Borisov, V. B., Mogi, T., and Verkhovsky,
absorption spectroscopy used to study CO compounds
M. I.
(2009) Heme/heme redox interaction and
of cytochrome bd from Escherichia coli, PLoS One,
resolution of individual optical absorption spectra
9, e95617, doi: 10.1371/journal.pone.0095617.
of the hemes in cytochrome bd from Escherichia
66.
Siletsky, S. A., Rappaport, F., Poole, R. K., and
coli, Biochim. Biophys. Acta,
1787,
1246-1253,
Borisov, V. B. (2016) Evidence for fast electron transfer
doi: 10.1016/j.bbabio.2009.05.003.
between the high-spin haems in cytochrome bd-I from
77.
Rappaport, F., Zhang, J., Vos, M. H., Gennis, R. B.,
Escherichia coli, PLoS One, 11, e0155186, doi: 10.1371/
and Borisov, V. B. (2010) Heme-heme and heme-
journal.pone.0155186.
ligand interactions in the di-heme oxygen-reducing
67.
Hill, J. J., Alben, J. O., and Gennis, R. B. (1993)
site of cytochrome bd from Escherichia coli revealed
Spectroscopic evidence for a heme-heme binuclear
by nanosecond absorption spectroscopy, Biochim.
center in the cytochrome bd ubiquinol oxidase from
Biophys. Acta,
1797,
1657-1664, doi:
10.1016/
Escherichia coli, Proc. Natl. Acad. Sci. USA, 90,
j.bbabio.2010.05.010.
5863-5867, doi: 10.1073/pnas.90.12.5863.
78.
Borisov, V. B., and Verkhovsky, M. I. (2013) Ac-
68.
Muntyan, M. S., Bloch, D. A., Drachev, L. A.,
commodation of CO in the di-heme active site of
and Skulachev, V. P. (1993) Kinetics of CO bind-
cytochrome bd terminal oxidase from Escherich-
ing to putative Na+-motive oxidases of the o-type
ia coli, J. Inorg. Biochem., 118, 65-67, doi: 10.1016/
from Bacillus FTU and of the d-type from Esche-
j.jinorgbio.2012.09.016.
richia coli, FEBS Lett., 327, 347-350, doi: 10.1016/
79.
Siletsky, S. A., Dyuba, A. V., Elkina, D. A.,
0014-5793(93)81018-u.
Monakhova, M. V., and Borisov, V. B. (2017) Spectral-
69.
Tsubaki, M., Hori, H., Mogi, T., and Anraku, Y.
kinetic analysis of recombination reaction of heme
(1995) Cyanide-binding site of bd-type ubiquinol
centers of bd-type quinol oxidase from Escherichia
oxidase from Escherichia coli, J. Biol. Chem., 270,
coli with carbon monoxide, Biochemistry (Moscow),
28565-28569, doi: 10.1074/jbc.270.48.28565.
82, 1354-1366, doi: 10.1134/S000629791711013X.
70.
Borisov, V., Arutyunyan, A. M., Osborne, J. P., Gen-
80.
Jasaitis, A., Borisov, V. B., Belevich, N. P., Morgan,
nis, R. B., and Konstantinov, A. A. (1999) Magnetic
J. E., Konstantinov, A. A., and Verkhovsky, M. I.
circular dichroism used to examine the interaction of
(2000) Electrogenic reactions of cytochrome bd, Bio-
Escherichia coli cytochrome bd with ligands, Biochem-
chemistry, 39, 13800-13809, doi: 10.1021/bi001165n.
istry, 38, 740-750, doi: 10.1021/bi981908t.
81.
Belevich, I., Borisov, V. B., Zhang, J., Yang, K.,
71.
Vos, M. H., Borisov, V. B., Liebl, U., Martin, J. L., and
Konstantinov, A. A., Gennis, R. B., and Verkhovsky,
Konstantinov, A. A. (2000) Femtosecond resolution of
M. I. (2005) Time-resolved electrometric and optical
ligand-heme interactions in the high-affinity quinol
studies on cytochrome bd suggest a mechanism
oxidase bd: A di-heme active site? Proc. Natl. Acad.
of electron-proton coupling in the di-heme active
Sci. USA, 97, 1554-1559, doi: 10.1073/pnas.030528197.
site, Proc. Natl. Acad. Sci. USA, 102, 3657-3662,
72.
Borisov, V. B., Sedelnikova, S. E., Poole, R. K., and
doi: 10.1073/pnas.0405683102.
Konstantinov, A. A. (2001) Interaction of cytochrome
82.
Belevich, I., Borisov, V. B., and Verkhovsky, M. I.
bd with carbon monoxide at low and room tempera-
(2007) Discovery of the true peroxy intermediate in
tures: evidence that only a small fraction of heme b595
the catalytic cycle of terminal oxidases by real-time
reacts with CO, J. Biol. Chem., 276, 22095-22099,
measurement, J. Biol. Chem.,
282,
28514-28519,
doi: 10.1074/jbc.M011542200.
doi: 10.1074/jbc.M705562200.
73.
Borisov, V. B., Liebl, U., Rappaport, F., Martin, J. L.,
83.
Borisov, V. B., Belevich, I., Bloch, D. A., Mogi, T.,
Zhang, J., Gennis, R. B., Konstantinov, A. A., and
and Verkhovsky, M. I. (2008) Glutamate 107 in
БИОХИМИЯ том 88 вып. 10 2023
8*
1828
БОРИСОВ
subunit I of cytochrome bd from Escherichia coli is part
85. Bekker, M., de Vries, S., Ter Beek, A., Hellingwerf,
of a transmembrane intraprotein pathway conducting
K. J., and de Mattos, M. J. (2009) Respiration of Esch-
protons from the cytoplasm to the heme b595/heme d
erichia coli can be fully uncoupled via the nonelectro-
active site, Biochemistry, 47, 7907-7914, doi: 10.1021/
genic terminal cytochrome bd-II oxidase, J. Bacteriol.,
bi800435a.
191, 5510-5517, doi: 10.1128/JB.00562-09.
84. Paulus, A., Rossius, S. G., Dijk, M., and de
86. Shepherd, M., Sanguinetti, G., Cook, G. M., and
Vries, S. (2012) Oxoferryl-porphyrin radical catalytic
Poole, R. K. (2010) Compensations for diminished
intermediate in cytochrome bd oxidases protects
terminal oxidase activity in Escherichia coli:
cells from formation of reactive oxygen species,
cytochrome bd-II-mediated respiration and glutamate
J. Biol. Chem., 287, 8830-8838, doi: 10.1074/jbc.
metabolism, J. Biol. Chem.,
285,
18464-18472,
M111.333542.
doi: 10.1074/jbc.M110.118448.
MEMBRANE POTENTIAL GENERATION BY CYTOCHROME bd
Review
V. B. Borisov
Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e-mail: bor@belozersky.msu.ru
This treatise gives an overview of current thinking on the mechanism of generation of a transmembrane
electric potential difference (Δψ) during the catalytic cycle of a bd-type triheme terminal quinol oxidase.
It is assumed that the main contribution to the Δψ formation is made by the movement of H+ across the
membrane along the intraprotein hydrophilic proton-conducting pathway from the cytoplasm to the active
site for oxygen reduction of this bacterial enzyme.
Keywords: respiratory chain, terminal oxidase, cytochrome bd, heme, protonmotive force, membrane potential
БИОХИМИЯ том 88 вып. 10 2023