БИОХИМИЯ, 2023, том 88, вып. 10, с. 1829 - 1846
УДК 577.23;577.151;577.352
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО
ПОТЕНЦИАЛА ГЕМ-МЕДНЫМИ ДЫХАТЕЛЬНЫМИ ОКСИДАЗАМИ
В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
Обзор
© 2023 С.А. Силецкий
Научно-исследовательский институт физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: siletsky@belozersky.msu.ru
Поступила в редакцию 29.06.2023
После доработки 15.08.2023
Принята к публикации 15.08.2023
Гем-медные дыхательные оксидазы являются высокоэффективными молекулярными машинами.
Эти мембранные ферменты катализируют конечный этап клеточного дыхания эукариот и многих
прокариот: перенос электронов от цитохромов или хинолов к молекулярному кислороду и восста-
новление O2 до воды. Высвобождаемая в этой окислительно-восстановительной реакции свобод-
ная энергия преобразуется гем-медными дыхательными оксидазами в трансмембранный гради-
ент электрохимического потенциала ионов водорода (ΔμH+). Гем-медные дыхательные оксидазы
обладают уникальным механизмом генерации ΔμH+ - редокс-сопряженной протонной помпой.
Использование в исследовании гем-медных оксидаз комбинации прямого электрометрического
метода измерения кинетики генерации мембранного потенциала с подходами и методами пред-
стационарной кинетики и направленного мутагенеза позволяет получать уникальную информа-
цию о перемещении протонов внутри белка в режиме реального времени. В обзоре суммированы
результаты применения разрешенной во времени электрометрии к расшифровке механизмов ра-
боты этих важнейших биоэнергетических ферментов.
КЛЮЧЕВЫЕ СЛОВА: биоэнергетика, цитохромоксидаза, протеолипосомы, электрогенный, перенос про-
тонов, генерация ΔΨ, протонный насос, фотовосстановление, цитохром aa3, кинетика, прямой электро-
метрический метод, емкостная потенциометрия, временно е разрешение, ионы цинка.
DOI: 10.31857/S0320972523100081, EDN: OTDXSA
ВВЕДЕНИЕ.
потенциала ионов водорода (ΔμH+)
[3-7].
ОБЩАЯ ХАРАКТЕРИСТИКА
Образующийся ΔμH+ используется в клетках
ГЕМ-МЕДНЫХ ДЫХАТЕЛЬНЫХ ОКСИДАЗ
в дальнейшем в качестве источника энергии
для энергопотребляющих процессов: биохи-
Терминальные дыхательные оксидазы пред-
мического синтеза, мембранного транспорта,
ставляют собой ключевой компонент дыха-
механического движения бактериальных кле-
тельной цепи митохондрий и большинства
ток и т.д.
аэробных бактерий [1, 2]. Будучи распростра-
Терминальные дыхательные оксидазы при-
нены повсеместно, эти ферменты располага-
нято делить на две основные подгруппы: над-
ются в конце дыхательной цепи и катализиру-
семейство гем-медных оксидаз и надсемей-
ют восстановление молекулярного кислорода
ство цитохромов bd [7]. Характерной чертой
цитохромом c или убихинолом, сопряженно с
гем-медных оксидаз является кислород-вос-
образованием протон-движущей силы - транс-
станавливающий каталитический центр, ко-
мембранного градиента электрохимического торый образован близко расположенными
Принятые сокращения: ЦО - цитохромоксидаза; BNC - биядерный центр; F, O, OH, P, E, EH, R - состояния
цитохром с оксидазы; P- и N-стороны мембраны - положительно и отрицательно заряженные водные фазы, раз-
деленные сопрягающей мембраной; PLS - сайт загрузки протонов; Rubpy - трис-бипиридильный комплекс рутения;
ΔΨ - трансмембранная разность электрических потенциалов; ΔμH+ - трансмембранный градиент электрохимиче-
ского потенциала ионов водорода.
1829
1830
СИЛЕЦКИЙ
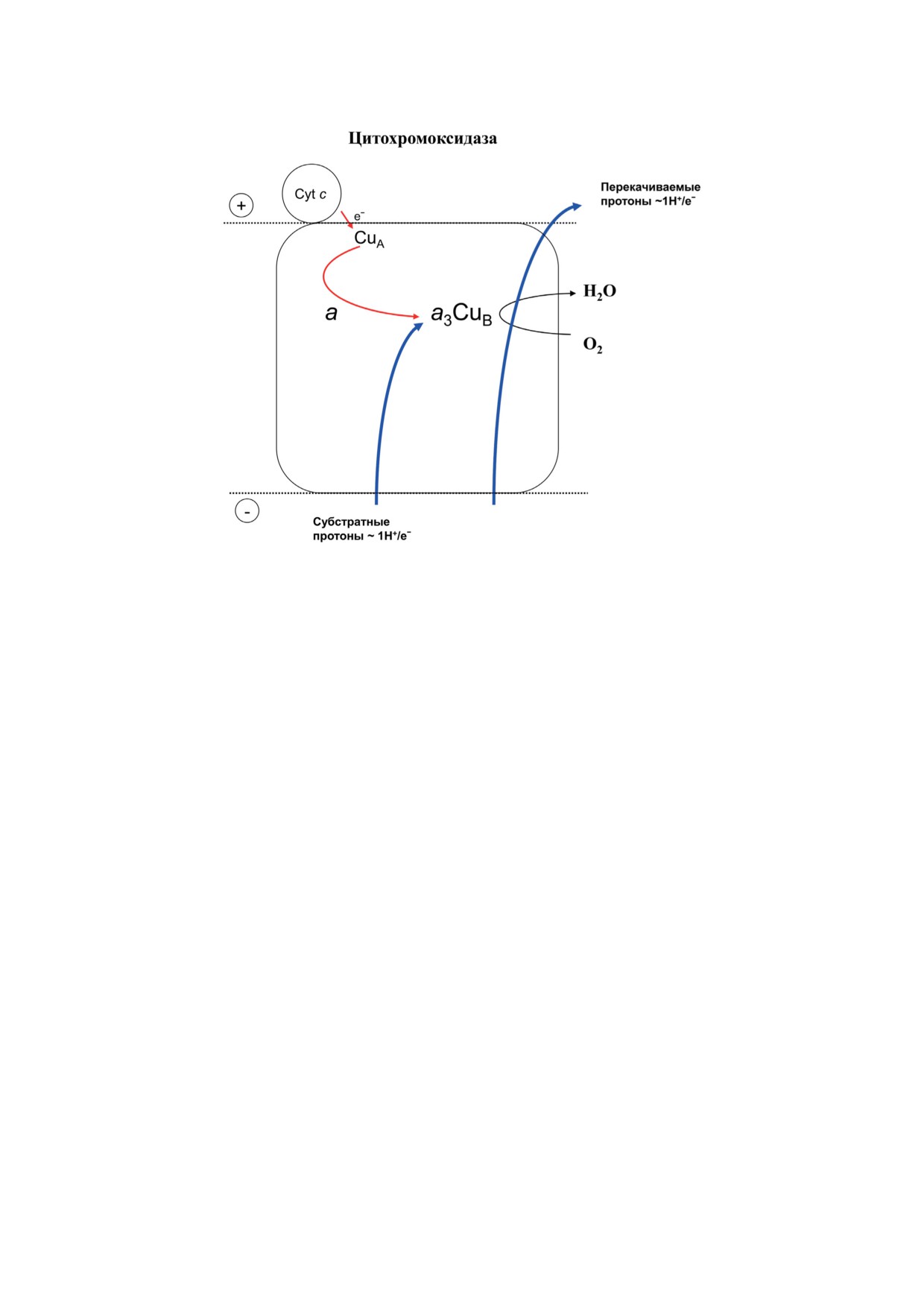
Рис. 1. Общая схема функционирования цитохромоксидазы. Отрицательно и положительно заряженные стороны
мембраны обращены в матрикс митохондрий и в межмембранное пространство соответственно. В случае прокарио-
тического фермента соответствующие стороны мембраны обращены в цитоплазму и в периплазматическое простран-
ство. Красными и синими стрелками обозначены перенос электронов и протонов соответственно
ионом железа гемовой группы и ионом меди
ной мышцы быка и дрожжей, оксидазы аа3 из
(так называемый биядерный или бинуклеар-
Paracoccus denitrificans и Rhodobacter sphaeroides,
ный центр, BNC). Цитохромоксидаза (ЦО) из
оксидаза caa3 из Thermus thermophiles, а так-
митохондрий содержит четыре редокс-цен-
же хинол-оксидаза bo-типа из Escherichia coli
тра (рис. 1). Каталитический центр в гидро-
[9-17]. Типичным представителем значитель-
фобном ядре ЦО состоит из двух редокс-цен-
но менее изученного семейства B является
тров: высокоспинового железа гема a3 и иона
цитохромоксидаза ba3 из T. thermophilus, имею-
меди CuB. Через 2 других редокс-центра (CuA и
щая низкую гомологию аминокислотной по-
низкоспиновый гем a) в BNC последовательно
следовательности с представителями семей-
поступают 4 электрона от четырех молекул
ства А [18, 19]. Наиболее удаленное, с эволю-
цитохрома с, что приводит в итоге к восста-
ционной точки зрение, семейство С состав-
новлению одной молекулы кислорода до двух
ляют представители оксидаз cbb3 из различных
молекул воды. В бактериальных ЦО низкоспи-
организмов [20, 21].
новый гем a может заменяться гемом b-типа,
Цитохромоксидаза генерирует протон-
а вместо высокоспинового гема a3 могут быть
движущую силу вследствие векторной (т.е. на-
гемы o3- или b3-типа. Некоторые бактериаль-
правленной поперек мембраны) организации
ные оксидазы могуть иметь дополнительные
доставки электронов и протонов, необходи-
гемовые центры c-типа.
мых для протекания каталитической реакции
В надсемействе гем-медных оксидаз при-
восстановления кислорода до воды, в BNC.
нято выделять 3 большие группы: семейства A,
При этом так называемые «химические» (или
B и C [8]. Помимо них, сравнительный анализ
субстратные) протоны переносятся в BNC
геномов и структурное моделирование позво-
из внутренней водной фазы (с отрицатель-
лили идентифицировать гены 5 новых (D, E,
но заряженной N-стороны мембраны), в то
F, G и H) семейств терминальных оксидаз,
время как электроны переносятся туда же
встречающихся в архебактериях [5]. К семей-
от цитохрома с с внешней (положительной)
ству А относится наиболее представительная
стороны мембраны (P-сторона) (рис. 1; [22]).
и наиболее изучаемая группа ферментов,
Кроме этого, ЦО дополнительно переносит с
включающая такие модельные объекты, как
N-стороны на P-сторону мембраны в среднем
цитохромоксидазы из митохондрий сердеч-
4 протона («помпируемые» или перекачивае-
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1831
мые протоны) на каждую восстановленную
сердечной мышцы быка
[32-35], бактери-
молекулу кислорода, т.е. является протонной
альные ЦО aa3-типа из P. denitrificans [36-38]
помпой [23, 24]. Таким образом, катализируе-
и R. sphaeroides [39, 40], хинол-оксидаза bo3
мая ЦО химическая реакция сопряжена с раз-
из E. coli [41] и ЦО сaa3 из T. thermophiles [42].
делением зарядов, соответствующим направ-
Кроме того, атомная структура была полу-
ленному трансмембранному переносу 8 зарядов
чена для представителей семейств B и C, цито-
на каждую восстановленную молекулу кисло-
хрома ba3 из T. thermophilus [19, 43] и cbb3 из
рода. Полная реакция, катализируемая цито-
Pseudomonas shutzeri [21] соответственно.
хромоксидазой, может быть описана уравне-
Для гем-медных оксидаз характерно нали-
нием (1):
чие центральной самой крупной субъедини-
цы I, построенной из 12 пересекающих мем-
4 с2+ + O2 + 8H+n → 4c3+ + 2H2O + 4H+p,
(1)
брану α-спиральных столбов. В то время как
бактериальные ЦО содержат не более 4-х субъ-
где n - внутримитохондриальное простран-
единиц, цитохромоксидаза из митохондрий
ство; p - межмембранное пространство.
млекопитающих состоит из 13 субъединиц и
Генерация мембранного потенциала встро-
имеет примерно вдвое большую молекулярную
енной в протеолипосомы ЦО митохондрий в
массу (~200 кДа). Три наибольшие субъеди-
стационарном режиме (т.е. в режиме много-
ницы ЦО митохондрий кодируются митохон-
кратных оборотов фермента) была продемон-
дриальным геномом, образуют каталитическое
стрирована в лаборатории Л.А. Драчева на заре
ядро фермента и гомологичны трем основным
развития прямого электрометрического ме-
субъединицам, встречающимся в большин-
тода [25]. Однако эти эксперименты не могли
стве типичных прокариотических ЦО аа3-типа
раскрыть электрогенный механизм генера-
семейства А надсемейства гем-медных терми-
ции мембранного потенциала и формирова-
нальных оксидаз.
ния ΔμH+ в ходе каталитического цикла фер-
В структурах всех ЦО семейства А выявле-
мента. Развитие прямого электрометрического
ны 2 потенциальных протон-проводящих пути
метода с адекватным временным разрешением
из внутренней водной фазы в направле-
для изучения событий внутри каталитического
нии к BNC, включающие в себя консерва-
цикла фотоактивных белков [26] было позд-
тивные протон-обменивающие аминокислот-
нее успешно применено к изучению механиз-
ные остатки и молекулы связанной воды [19,
мов работы гем-медных оксидаз. Поскольку
32, 36, 39, 42]. Протон-проводящий путь D
гем-медные оксидазы не относятся к фото-
(D-канал [30-32]) ведет от остатка D132 через
активируемым белкам, для изучения их элек-
цепочку связанных водородными связями мо-
трогенных механизмов с высоким временным
лекул воды и аминокислотных остатков к кон-
разрешением были разработаны и исполь-
сервативному аминокислотному остатку E286,
зованы методические подходы (см. далее),
располагающемуся на расстоянии 10-12 Å от
основанные на комбинации прямого элек-
BNC и 24-26 Å - от остатка D132 [24-26]. Мо-
трометрического метода и специальных фото-
лекулы воды в канале стабилизированы по-
активируемых химических реакций для запу-
средством водородных связей с рядом высоко-
ска реакции переноса электронов и протонов
консервативных гидрофильных аминокислот-
в ЦО с помощью наносекундных импульсов
ных остатков: N139, N121, N207, S142, S200,
лазерного света. Это позволяет получать уни-
S201 и S197 [33]. Протон-проводящий путь K
кальную информацию об устройстве и работе
(К-канал [44-46]) расположен непосредствен-
редокс-зависимого протонного насоса ЦО, ме-
но под BNC и ведет от поверхности белка с
ханизме сопряжения, об этапах перемещения
N-стороны мембраны через остатки T352,
протонов внутри белка в режиме реального
T359, K362 и связанную воду к остатку Y288
времени (предстационарном режиме) [27-31].
вблизи BNC. В формировании входа в К-ка-
нал участвует остаток E101 второй субъеди-
ницы I [38, 47]. Цепочка водородных связей
ТРЕХМЕРНАЯ СТРУКТУРА
прерывается на пути между остатками K362
ЦИТОХРОМОКСИДАЗЫ
и T359. Предполагается, что изменение кон-
формации остатка K362 замыкает цепочки
С помощью рентгеноструктурного ана-
водородных связей, обеспечивая контролируе-
лиза установлена трехмерная кристалли-
мое проведение протона [38, 48].
ческая структура нескольких типичных
Над гемовыми группами и CuB распо-
представителей семейства А гем-медных тер-
лагается гидрофильный домен, через кото-
минальных оксидаз. Это ЦО из митохондрий
рый теоретически может происходить выход
БИОХИМИЯ том 88 вып. 10 2023
1832
СИЛЕЦКИЙ
перекачиваемого протона в водную фазу с
После образования интермедиата PM, од-
внешней стороны мембраны [49]. Этот домен
ноэлектронное восстановление PM переводит
включает в себя кластер отрицательно заря-
ЦО в состояние F (перенос третьего электро-
женных групп белка (в том числе консерватив-
на в каталитическом цикле на тирозин Y288).
ные остатки D399 и D404), несколько остатков
Окисление четвертой молекулы цитохрома с
аргинина, пропионатные заместители гемов,
и перенос четвертого электрона в BNC за-
молекулы воды и связанный редокс-неактив-
вершает каталитический цикл с образова-
ный атом металла (ион Mg2+ - в ЦО митохон-
нием полностью окисленного состояния OH
дрий, частично замещаемый ионом Mn2+ -
(рис. 2). При отсутствии доноров электронов
в ЦО прокариот) [38]. Путь переноса моле-
окисленное
«неотрелаксированное» состоя-
кулярного кислорода в BNC организован по-
ние OH в течение нескольких секунд спон-
средством нескольких гидрофобных каналов
танно превращается в окисленное стабильное
в срединной части мембранного бислоя по на-
состояние (O). Состояния O и OH отличаются
правлению к активному центру [32, 39, 50, 51].
между собой сродством к электрону соответ-
Выход на P-сторону мембраны молекул воды,
ствующих редокс-центров фермента, а также
образующихся в биядерном каталитическом
способностью к трансмембранной перекачке
центре, происходит, по-видимому, над гемо-
протонов [11, 29, 63-66]. Путем специфиче-
выми группами в области контакта субъеди-
ской обработки перекисью водорода или оки-
ниц I и II, вблизи Mg2+/Mn2+ сайта [52].
сью углерода практически вся популяция фер-
мента может быть переведена в стационарное
состояние PM или F, которые соответствуют в
ИНТЕРМЕДИАТЫ КАТАЛИТИЧЕСКОГО
каталитическом цикле ЦО частичному вос-
ЦИКЛА ЦИТОХРОМОКСИДАЗЫ
становлению молекулярного кислорода в BNC
двумя или тремя электронами.
Каталитический цикл ЦО семейства А мо-
жет быть описан двумя фазами реакции: окис-
лительной и восстановительной полуреакция-
ПОДХОДЫ К ИЗУЧЕНИЮ ПЕРЕНОСА
ми (рис. 2), каждая из которых включает в себя
ЗАРЯДОВ В ЦИТОХРОМОКСИДАЗЕ
по 2 одноэлектронных перехода [53]. В ходе
С ВРЕМЕННЫМ РАЗРЕШЕНИЕМ
восстановительной фазы (переходы O → E и
E → R) первые 2 электрона переносятся в BNC,
В ходе измерений прямым электрометри-
в результате чего он приобретает способность
ческим методом протеолипосомы с изучаемым
связывать молекулярный кислород. Окисли-
белком прикрепляют к искусственной макро-
тельная фаза начинается с взаимодействия
скопической мембране (коллодиевая пленка,
восстановленного BNC (состояние R; рис. 2)
пропитанная раствором фосфолипидов в дека-
с молекулой кислорода с образованием пер-
не) и регистрируют кинетику генерации транс-
вичного двухатомного кислородного аддук-
мембранного потенциала с помощью хлор-
та (состояние А; не показано на рис. 2) [54].
серебряных макроскопических электродов с
Молекула кислорода переносится через CuB к
субмикросекундным временным разрешением.
центральному атому железа высокоспинового
Трансмембранная разность электрических по-
гема а3 с образованием оксикомплекса [55],
тенциалов (ΔΨ) на измеряемой макроскопи-
представляющего собой смесь состояний:
ческой мембране нарастает пропорционально
Fe2+-O2 и Fe3+-O– [56]. На следующей стадии
генерации разности электрических потен-
происходит разрыв межатомной O-O связи
циалов на мембране протеолипосом, что поз-
и образование состояния PM (рис. 2). Обра-
воляет отслеживать кинетику электрогенной
зование PM требует переноса на O2 четырех
транслокации зарядов в изучаемом белке с
электронов из активного центра и по крайней
адекватным временным разрешением в пред-
мере одного протона [57, 58]. Два электрона
стационарном режиме [26, 67, 68].
поступают при окислении иона Fe2+ гема а3 до
Каталитический цикл ЦО происходит
оксоферрильного состояния Fe4+=O2-. Один
в миллисекундном временно м диапазоне и
электрон поступает от CuB+, окисляющейся
включает в себя последовательность проме-
до Cu2+. Четвертый электрон и протон посту-
жуточных состояний кислород-редуктазного
пают от близко расположенного консерватив-
биядерного центра и наборов отдельных ста-
ного остатка Y288 [59], образующего ковалент-
дий переноса электронов и протонов внутри
ную связь с гистидиновым лигандом CuB [33,
переходов между промежуточными состояния-
60, 61]. Отдавая электрон и протон, остаток
ми BNC. Все эти реакции происходят быстрее
тирозина образует радикальную форму [62].
временно го разрешения методов быстрого
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1833
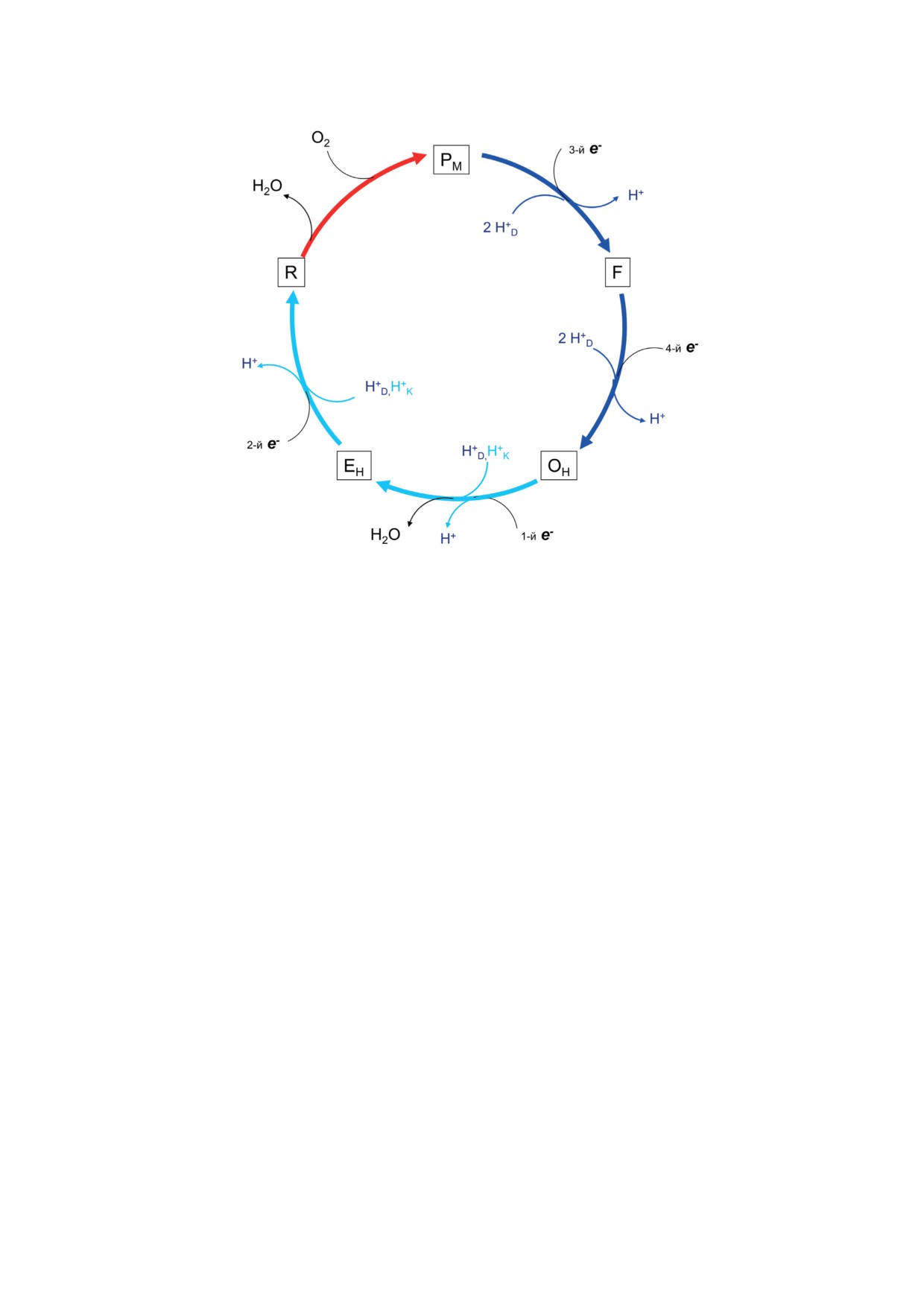
Рис. 2. Схема каталитического цикла цитохромоксидазы семейства А. Переходы от состояния R к OH образуют окисли-
тельную фазу, в то время как переходы от OH к R - восстановительную фазу каталитического цикла. В переходе R → PM
(красная стрелка) происходит связывание молекулы O2 с гемом а3 BNC в полностью восстановленном состоянии
Fe2+ CuB1+, разрыв межатомной O-O связи и образование оксоферрильного комплекса гема а3 Fe4+=O2- и CuB1+-OH-.
В переходах PM → F, F → OH, OH → EH, EH → R (синие и сине-зеленые стрелки) происходит последовательный перенос
4-х электронов в BNC ЦО и перекачивание протонов
смешивания. При исследовании каталитиче-
использован раньше. Нужно отметить важное
ского цикла ЦО с временным разрешением
преимущество «инъекций» электрона в ЦО,
для синхронизации всего ансамбля молекул
которое заключается в возможности разде-
фермента (одновременного запуска реакции
лить наборы элементарных стадий переноса
переноса электронов внутри всей популяции
зарядов, сопряженные с отдельными одно-
фермента) используются реакции окисления
электронными переходами в каталитическом
либо восстановления ЦО, индуцированные с
цикле. Кроме этого, методически окисление
помощью наносекундной лазерной вспышки.
фермента молекулой кислорода в первом под-
В первом варианте (так называемый метод
ходе происходит из ненаблюдаемого в обычных
«флоу-флэш») изучается кинетика окисления
условиях полностью восстановленного состоя-
молекулярным кислородом полностью восста-
ния R (в котором в ферменте восстановлены,
новленного фермента (состояние R) в режиме
помимо BNC, еще и входные редокс-цен-
одного оборота фермента. Чтобы время сме-
тры). В этом обзоре более детально освещены
шивания с кислородом не было лимитирую-
результаты, полученные при использовании
щей стадией реакции, процесс взаимодействия
«инъекции» электрона с помощью фотоакти-
с кислородом запускается фотолизом предва-
вируемых комплексов Rubpy. Подробное опи-
рительно образованного комплекса CO с вос-
сание результатов, полученных при исполь-
становленным биядерным центром ЦО [69].
зовании метода «флоу-флэш», можно найти в
Во втором случае - в фермент, переведенный
блестящих обзорах [71, 72].
исходно в одно из состояний восстановлен-
ности кислорода в BNC (O, P или F), произ-
водится
«инъекция» электрона с помощью
КИНЕТИКА ГЕНЕРАЦИИ
фотоактивируемых комплексов Rubpy (трис-
МЕМБРАННОГО ПОТЕНЦИАЛА
бипиридильный комплекс рутения) [70].
МИТОХОНДРИАЛЬНОЙ ЦО
Несмотря на то что второй подход был
разработан позднее первого, в комбинации с
Впервые стадии транслокации зарядов в
прямым электрометрическим методом он был переходе F → O цитохромоксидазы митохон-
БИОХИМИЯ том 88 вып. 10 2023
1834
СИЛЕЦКИЙ
дрий сердечной мышцы быка были зареги-
лентен транслокации элементарного заряда
стрированы совместными усилиями сотруд-
на ½ величины диэлектрического барьера мем-
ников лабораторий А.Д. Каулена и А.А. Кон-
браны. Отсюда, суммарная амплитуда милли-
стантинова [73, 74]. Перенос электрона в ЦО
секундных протонных фаз (80%) эквивалентна
запускался с помощью индуцированной ла-
трансмембранной транслокации двух полных
зерной вспышкой одноэлектронной
«инъ-
зарядов, что соответствовало бы переносу из
екции» от комплекса Rubpy. Позднее приме-
внутренней водной фазы в BNC одного про-
нение данного технического подхода было
тона на половину толщины мембраны для
распространено на ЦО, зафиксированную в
протонирования восстановленного кислород-
состоянии PM (третий электрон в каталитиче-
ного атома («субстратный» протон) и сопря-
ском цикле; рис. 2), а также полностью окис-
женной транслокации двух «перекачиваемых»
ленное состояние O [63, 75, 76]. Через несколь-
протонов: одного - через всю мембрану и еще
ко лет после получения разрешенной во вре-
одного - на половину ее толщины [63, 73].
мени кинетики генерации мембранного по-
Эта оценка согласовывалась со сделанными
тенциала ЦО в НИИФХБ имени Белозерско-
ранее выводами, полученными при изучении
го в Хельсинкской Биоэнергетической группе
стационарного квазиравновесного обращения
(Verkhovsky et al. [77]) был разработан подход,
цитохромоксидазной реакции в сопряженных
в котором использована комбинация разре-
митохондриях. Предполагалось, что в окисли-
шенной во времени электрометрической тех-
тельной фазе каталитического цикла ЦО мо-
ники и метода «флоу-флэш».
жет происходить перенос через мембрану всех
При «инъекции» электрона в состояние F
четырех перекачиваемых протонов [79]. Было
(переход F → OH) цитохромоксидазы семей-
принято считать, что восстановительная часть
ства А были разрешены 3 основных компонен-
фотоцикла не обладает достаточным запасом
ты генерации мембранного потенциала [73, 74].
свободной энергии и не сопряжена с пере-
«Быстрая» микросекундная фаза
(~40 мкс)
качиванием протонов, что следовало также из
отражала перенос электрона от CuA к гему а.
относительно низких значений редокс-потен-
Две другие компоненты («средняя» (~1 мс) и
циалов BNC в стационарных условиях (в со-
«медленная» (~4 мс)) отражают стадии вектор-
стоянии О) [80].
ного переноса протонов в ферменте, вызван-
ные переносом электрона от гема а в BNC.
Сам по себе перенос электрона между гемом а
КИНЕТИКА ГЕНЕРАЦИИ
и биядерным центром происходит вдоль мем-
МЕМБРАННОГО ПОТЕНЦИАЛА
браны, т.е. неэлектрогенно [22]. «Инъекция»
БАКТЕРИАЛЬНЫХ ЦО СЕМЕЙСТВА А
электрона от Rubpy в состояние P митохон-
дриальной ЦО (переход P → F) сопровождается
Применение прямой электрометрии к из-
сходным по амплитуде, но несколько более
учению механизма работы ЦО получило даль-
быстрым набором протонных компонент ге-
нейшее развитие благодаря возможности на-
нерации ΔΨ [63], в то время как фотовосста-
правленного мутагенеза бактериальных ЦО
новление окисленной ЦО («инъекция» в со-
семейства А, гомологичных ЦО митохондрий.
стоянии O) ограничивается восстановлением
Основными объектами большинства исследо-
гема а от СuA [63, 70, 76].
ваний являются 2 бактериальные ЦО аа3-типа:
Суммарная амплитуда миллисекундных
ЦО из R. sphaeroides [15, 28, 30, 31, 45, 81, 82] и
электрогенных компонент в кинетиках гене-
из P. denitrificans [76, 83-86].
рации потенциала для стадий P → F и F → O
Исследование перехода F → O в мутантной
имела близкое значение (~80%), что привело
ЦО аа3-типа из R. sphaeroides с несопряжен-
к первоначальной оценке суммарного пере-
ным фенотипом (с заменой N139D [30, 87,
качивания через мембрану ~3-х протонов (или
88]) привело к переоценке электрогенности
по ~1,5 «перекачиваемых» протона на каждой
одноэлектронных переходов в окислительной
из одноэлектронных стадий окислительной
фазе ЦО. Оксидаза с мутацией N139D в D-ка-
фазы каталитического цикла [63, 73]). Данная
нале полностью сохраняет кислород-редуктаз-
оценка амплитуд в предстационарных измере-
ную активность в стационарных измерениях,
ниях была получена, используя эффект мем-
утратив способность к закислению внешнего
бранного потенциала на стационарное редокс-
пространства протеолипосом (т.е. к перекач-
равновесие между цитохромом с и гемом а [78].
ке протонов через мембрану в стационарных
Из него следовало, что перенос электрона от
измерениях). Генерация мембранного потен-
CuA к гему a (20% фотоэлектрического ответа;
циала на стадии F → O в ответ на «инъекцию»
«быстрая» компонента) может быть эквива-
электрона в этом мутанте отражает транслока-
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1835
цию через мембрану одного элементарного за-
Таким образом, была исследована кинетика
ряда, а именно: перенос электрона и протона
генерации мембранного потенциала, сопря-
с противоположных сторон мембраны к оксо-
женная с одноэлектронным восстановлением
ферилльному комплексу гема a3 [30].
метастабильного окисленного состояния ОН
Соотношение амплитуд электрогенных со-
цитохромоксидазы. С временным разрешени-
ставляющих переноса электрона с внешней
ем было показано [85, 86], что непосредствен-
стороны мембраны
[30, 31] и субстратного
но после быстрого окисления полностью вос-
протона из внутренней водной фазы в BNС
становленной ЦО образуется короткоживущее
ЦО c заменой N139D позволило оценить элек-
окисленное состояние OH, в котором редокс-
трогенное расстояние гема а и биядерного
потенциал BNC значительно положительнее,
центра от внешней водной фазы (~0,4 толщи-
чем в O. В отличие от О, «инъекция» электрона
ны мембранного диэлектрика), что находит-
в ЦО в состоянии OH сопровождается быстрым
ся в близком соответствии со структурными
переносом электрона в BNC и сопряженными
данными [32, 36]. Соответственно, относитель-
стадиями электрогенной транслокации прото-
ная амплитуда электрогенной фазы, отра-
нов [65, 85, 86, 91, 92]. Характеристики элек-
жающей перенос субстратного протона в
трогенных фаз в одноэлектронном переходе
мутанте N139D из внутренней водной фазы
OH → EH [85, 86], в целом, напоминают таковые
в BNC составило ~0,6 толщины мембранного
для переходов в окислительной фазе и согла-
диэлектрика. Суммарная амплитуда «средней»
суются с трансмембранной перекачкой одного
и «медленной» электрогенных фаз в переходах
протона. Перекачка протона в ходе перехода
P → F и F → O ЦО дикого типа и ЦО митохон-
OH → EH была подтверждена и в случае есте-
дрий в ~4 раза больше амплитуды электро-
ственного (а не икусственного, как Rubpy) до-
генной фазы переноса электрона с внешней
нора электрона при исследовании гем-медной
стороны мембраны к гему а [31, 63, 73], что
оксидазы семейства А (подсемейства А2) caa3
эквивалентно переносу ~1,6 положительного
из T. thermophilus, имеющей дополнительный
заряда через всю толщину мембранного ди-
редокс-центр (цитохром с) и соответствен-
электрика. То есть, помимо переноса одного
но, 5 электронов в полностью восстановлен-
субстратного протона из внутренней водной
ном состоянии [11]. При окислении молекулой
фазы в BNC (~0,6 толщины мембранного ди-
кислорода полностью восстановленной окси-
электрика), дополнительный электрогенный
дазы caa3 из T. thermophilus в режиме одного
вклад в одноэлектронном переходе ЦО дико-
оборота конечным переходом естественным
го типа, в сравнении с N139D, соответствует
образом является переход OH → EH [92]. Конеч-
переносу через мембрану приблизительно од-
ным акцептором электрона в переходе OH → EH
ного протона. Иными словами, оба одноэлек-
ЦО caa3 из T. thermophiles, как и в случае с
тронных перехода окислительной фазы ката-
искуственным донором электрона Rubpy, яв-
литического цикла ЦО сопряжены с переносом
лялся CuB.
одного субстратного протона в BNC и пере-
Переход EH → R, по-видимому, также со-
качиванием через мембрану не более одного
пряжен с перекачкой одного протона. Однако
протона. Близкие оценки были получены для
стадия переноса второго электрона в катали-
переходов P → F и F → O в реакции полностью
тическом цикле ЦО до сих пор остается наи-
восстановленной ЦО с кислородом при изме-
менее изученной, поскольку не удается по-
рении электрометрическим методом [89] и с
лучить гомогенную популяцию фермента в
помощью измерения кинетики протонирова-
одноэлектронном состоянии (EH). В первую
ния pH-индикатора [90].
очередь это связано с трудностью зафикси-
Независимо, Verkhovsky et al. [53] в Хель-
ровать фермент в одноэлектронном состоя-
синкской биоэнергетической группе были по-
нии EH и с множественностью возможных со-
лучены экспериментальные указания на то, что
стояний как одноэлектронного (E и EH), так и
генерация суммарного мембранного потен-
окисленного фермента (O и OH), отличающихся
циала восстановительной полуреакции ка-
функциональными свойствами. Так, обработка
талитического цикла ЦО может включать в
состояния F окисью углерода в стационарных
себя не только перенос протонов в BNC, но
условиях переводит ЦО в состояние Е, имею-
и трансмембранную перекачку протонов.
щее на 1 электронный эквивалент больше,
Позднее в этой лаборатории была использо-
чем окисленное состояние O. Электронная
вана комбинация метода
«флоу-флэш» для
инъекция в это состояние от Rubpy приводи-
окисления полностью восстановленной ЦО
ла к фотоэлектрическому ответу, схожему по
молекулой O2 в режиме одного оборота с по-
характеристикам с переходом F → O [84]. Од-
следующей «инъекцией» электрона от Rubpy.
нако распределение электрона между редокс-
БИОХИМИЯ том 88 вып. 10 2023
1836
СИЛЕЦКИЙ
центрами в полученном таким образом со-
как D-канал обеспечивает перенос субстрат-
стоянии Е существенно отличается от такового
ных протонов в окислительной части цикла
для состояния EH, образующегося при «инъ-
и всех перекачиваемых протонов в каталити-
екции» электрона от Rubpy в ЦО в состоя-
ческом цикле (как в окислительной фазе, так
нии OH [65, 86, 92].
и в восстановительной). Действительно, если
бы через К-канал происходил перенос пере-
качиваемых протонов, то мутация N139D в
ФУНКЦИОНАЛЬНАЯ РОЛЬ
D-канале (сохраняющая кислород-редуктаз-
ПРОТОН-ПРОВОДЯЩИХ ПУТЕЙ
ную функцию, но полностью ингибирующая
В КАТАЛИТИЧЕСКОМ ЦИКЛЕ
перекачивание протона через мембрану [30, 87])
ЦИТОХРОМОКСИДАЗ СЕМЕЙСТВА А
не должна была бы влиять на перенос перека-
чиваемых протонов в восстановительной фазе
Изучение влияния мутаций протон-обме-
каталитического цикла. В соответствии с этим
нивающих групп на функциональные характе-
не было выявлено мутаций по каналу К, спе-
ристики сопряженного переноса протонов ЦО
цифически ингибирущих способность к пере-
свидетельствует о том, что электрогенная транс-
качиванию протонов через мембрану. В на-
локация протонов цитохромоксидазами се-
стоящее время принято считать, что К-канал
мейства А происходит через протон-проводя-
переносит один или оба (рис. 2) субстратных
щие структуры («каналы» D и К), содержащие
протона в восстановительной части цикла [12,
критически важные консервативные протон-
85, 95]. Было обнаружено, что присутствую-
обменивающие остатки [30, 31, 45, 81]. Однако
щая в cтруктурах окисленной ЦО водородная
участие каналов в проведении протонов раз-
связь гидроксильной группы фарнезильного
ных типов на отдельных стадиях каталити-
заместителя гема а3 с редокс-активным остат-
ческого цикла организовано нетривиально.
ком тирозина (Y288) отсутствует в кристаллах
Исходя из влияния мутаций по ряду аминокис-
восстановленной формы ЦО [40] и замещается
лотных остатков [93, 94], а также разрешенной
молекулами воды. То есть может служить сво-
трехмерной структуры ЦО [32, 36], предпо-
его рода «защелкой» в верхней части К-канала.
лагалось, что эти два канала специализированы
Сигналом к выключению К-канала может
и служат для проведения, соответственно, суб-
служить образование оксоферрильного со-
стратных протонов (К-канал) и протонов, пере-
стояния гема а3 при образовании интермедиа-
качиваемых через мембрану (D-канал).
та P в переходе A → P. Образующееся оксено-
Мутации, блокирующие как D-, так и
вое состояние атома кислорода (в качестве
K-канал, в том случае, если бы они отвечали
сильного аксиального лиганда гемового же-
за перенос протонов разных типов, должны
леза) может вызывать изменение конформа-
были ингибировать переход F → O. Однако если
ции фермента, аналогично переходу R → T в
замены в D-канале приводят к подавлению
гемоглобине [45]. Незначительное смещение
миллисекундных компонент генерации потен-
зарядов внутри К-канала, перекрытого в верх-
циала и, соответственно, электрогенного пере-
ней части, может происходить и на стадиях
носа протонов на стадии F → O, то блокирова-
окислительной полуреакции каталитического
ние К-канала не ингибировало электрогенный
цикла [31, 82]. Роль таких смещений зарядов
перенос протонов на этой стадии [30, 31, 45, 81].
внутри канала не ясна, но может приводить к
При этом в условиях избытка субстратов дыха-
уменьшению энергетического барьера для ре-
ния, т.е. когда приток электронов не является
акций переноса электрона внутрь гидрофоб-
лимитирующей стадией реакции, в мутантах по
ного белкового ядра ЦО.
К-каналу затруднено восстановление биядер-
В митохондриальной цитохромоксидазе в
ного центра (переход O → R) вследствие блоки-
дополнение к D- и K-каналам рассматрива-
рования захвата протонов из матрикса в BNC
ется возможное участие третьего протонного
в восстановительной части каталитического
пути - H-канала, роль которого в проведении
цикла. Был сделан вывод, что D- и K-каналы
протонов остается предметом дискуссий [34,
отличаются не по типу проводимых протонов
96]. Согласно мнению авторов рентгенострук-
(субстратный или помпируемый), а по типу
турного анализа ЦО млекопитающих [34, 35,
обcлуживаемой полуреакции каталитического
96], идентифицировавших этот гипотетиче-
цикла [45, 81, 85].
ский протон-проводящий путь, H-канал слу-
Более поздние экспериментальные ре-
жит для проведения перекачиваемых протонов
зультаты свидетельствовали о том, что К-ка-
в ЦО с N-стороны мембраны через окрест-
нал, по-видимому, не участвует в проведении
ность гема а к остатку D51, располагающемуся
перекачиваемых протонов вовсе, в то время
вблизи P-стороны мембраны. Функция этого
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1837
канала и регуляция проведения протонов по
щается раньше субстратного. Соответственно,
нему, включая физиологические аспекты этой
«медленная» фаза сохранялась в мутанте и
регуляции, изучена мало [14]. Согласно одной
была интерпретирована как перенос субстрат-
из гипотез, H-канал участвует в проведении
ного протона в BNC.
перекачиваемого протона через всю мембра-
В присутствии ионов цинка (ингибитора
ну [97]; согласно другой - используется только
протонного транспорта), добавленных снару-
верхняя часть этого пути [98]. Наконец, со-
жи к протеолипосомам c ЦО митохондрий или
гласно третьей гипотезе, H-канал не выполня-
ЦО аа3 дикого типа из R. sphaeroides [15, 105],
ет функцию перекачивания протонов вообще,
«медленная» электрогенная протонная фаза
а является так называемым диэлектрическим
замедлялась. Такого же эффекта на «среднюю»
«колодцем», роль которого может заключаться
электрогенную фазу не наблюдалось. Также
в модуляции редокс-потенциала близлежащего
отсутствовал эффект ионов цинка на протон-
переносчика электронов гема а [99, 100].
ную электрогенную фазу в несопряженном му-
Есть указания, что мутации в H-канале мо-
танте N139D. В совокупности это свидетель-
гут ингибировать протон-транслоцирующую
ствует о том, что «медленная» электрогенная
функцию в митохондриальной ЦО [34, 96].
фаза в диком типе содержит в своем составе
Однако направленный мутагенез в фермен-
стадию высвобождения перекачиваемого про-
те высших эукариот сложен технически, что
тона на внешнюю сторону мембраны и что
затрудняет интерпретацию получаемых ре-
именно этот процесс, по всей вероятности, яв-
зультатов [101]. В то же время выходная часть
ляется скорость-лимитирующей реакцией для
протонного H-канала, конформационные из-
всей «медленной» электрогенной фазы [15].
менения в которой являются ключевым мо-
В отличие от входных протонных путей, траек-
ментом альтернативного гипотетического ме-
тории выхода протонов на внешнюю сторону
ханизма перекачивания протонов митохон-
мембраны в ЦО мало изучены. Есть указания
дриальной ЦО, не сохраняется в гомологич-
на то, что путь выхода молекул воды органи-
ных бактериальных оксидазах [102, 103]. Более
зован в виде дискретной траектории через две
того, мутации по гомологичным остаткам
канало-подобные структуры, которые могут
канала H не ингибируют бактериальные ЦО
принимать участие также в проведении пере-
аа3-типа [103, 104]. Исследования цитохром-
качиваемого протона на внешнюю сторону
оксидазы низших эукариот (дрожжей) не под-
мембраны [52, 106]. В ходе изучения влияния
держивают концепцию о роли H-канала в пе-
разных концентраций цинка на кинетику ге-
рекачивании протонов [16].
нерации мембранного потенциала встроенной
в мембрану протеолипосомы цитохромокси-
дазы aa3 из R. sphaeroides были получены экс-
МЕХАНИЗМ ГЕНЕРАЦИИ
периментальные результаты, указывающие на
МЕМБРАННОГО ПОТЕНЦИЛА
наличие не менее двух отдельных эффектив-
ЦО В ХОДЕ ОДНОЭЛЕКТРОННОГО
ных сайтов связывания ионов Zn2+ ЦО с P-сто-
ПЕРЕХОДА F → O
роны мембраны. Также они свидетельствовали
о том, что выход перекачиваемого протона из
Для идентификации электрогенных про-
сайта загрузки протонов (PLS) ЦО во внеш-
цессов, лежащих в основе «средней» и «мед-
нюю водную фазу может осуществляться по
ленной» фаз кинетики генерации мембранно-
нескольким траекториям [15].
го потенциал ЦО в переходе F → O, оказалось
В случае анализа «средней» и «медленной»
полезным исследованием эффектов влияния
протонных фаз, согласно модели последова-
на них изотопного замещения и ионов цинка.
тельных реакций, значения их относительных
Электрогенные фазы значительно отличают-
амплитуд имеют близкую величину [107, 108].
ся между собой эффектом изотопного заме-
При нормировании к амплитуде «быстрой»
щения, что позволило идентифицировать их
электрогенной компоненты относительная
аналоги при исследовании мутантных форм и
амплитуда «средней» и «медленной» электро-
соотнести их с переносом протонов разного
генных фаз для перехода F → O в митохон-
типа [30]. «Средняя» фаза отсутствовала в не-
дриальном ферменте составляет ~1,9-2,1 от
сопряженном мутанте с заменой в D-канале
величины
«быстрой» электрогенной фазы,
(N139D), сохраняющем килород-редуктазную
т.е. соответствует переносу суммарно двух
активность без перекачивания протонов через
протонов через большую часть мембранно-
мембрану. Это указывает на связь «средней»
го диэлектрика [108]. Как уже было сказано,
фазы с переносом перекачиваемого протона
D-канал обеспечивает перенос и перекачи-
и на то, что перекачиваемый протон переме-
ваемого, и субстратного протонов в переходах
БИОХИМИЯ том 88 вып. 10 2023
1838
СИЛЕЦКИЙ
окислительной фазы каталитического ци-
Есть указания на то, что роль PLS может вы-
кла ЦО [45, 81]. Поэтому «средняя» и «медлен-
полняться кластером протон-обменивающих
ная» протонные электрогенные фазы могут
групп, включающим пропионаты A и D гема а3
быть интерпретированы как 2 последователь-
и расположенные вблизи остатки (D52 и K171,
ных идентичных процесса репротонирования
как в случае ЦО митохондрий) [113], либо гид-
некоторого ключевого остатка в D-канале,
рофильным доменом над гемом a [98].
располагающегося в окрестности биядерного
В переходе F → O субстратный протон
центра, c минорным вкладом других сопря-
переносится также от остатка E286 непосред-
женных внутрибелковых перемещений заря-
ственно в BNC, а сам остаток E286 в ходе всего
да [107, 109, 110].
перехода дважды репротонируется через D-ка-
В качестве промежуточного донора про-
нал. «Cредняя» электрогенная фаза включает
тона, обеспечивающего проведение перекачи-
в себя электрогенный перенос протона H+ от
ваемого и субстратного протонов, служит кон-
остатка Е286 к первичному акцептору про-
сервативный остаток E286, располагающийся
тона (PLS), а также одно из последователь-
в верхней части D-канала (рис. 3). E286 явля-
ных электрогенных репротонирований остат-
ется точкой бифуркации в транслокации про-
ка E286 из внутренней водной N-фазы через
тонов через D-канал либо по пути переноса
D-канал (рис. 3). «Медленная» электрогенная
субстратного протона к центру гема a3/CuB,
фаза включает в себя второе репротонирова-
либо на внешнюю сторону мембраны. Заме-
ние остатка E286, следующее за переносом
на E286 на непротонируемый аналог (E286Q)
протона, участвующего в химическом превра-
ингибирует перенос и перекачиваемого, и суб-
щении кислорода, от E286-COOH к BNC.
стратного протонов в одноэлектронном пере-
Есть указания на то, что собственно пере-
ходе F → O [45, 81]. При исследовании мута-
нос протона от E286 в BNC (стадия 5) входит
ции N139L, перекрывающей вход в D-канал,
в состав «медленной» электрогенной фазы в
была выявлена электрогенная стадия пере-
случае ЦО из R. sphaeroides и в состав «сред-
носа протона от предполагаемого первичного
ней» электрогенной фазы в случае ЦО из
донора протона для BNC (остатка E286) в ка-
митохондрий [28]. В ходе переноса субстрат-
талитический центр BNC и установлено элек-
ного протона в BNC происходит нейтрализа-
трогенное расстояние между ними (~0,15 тол-
ция перенесенного туда электрона, отрица-
щины мембранного диэлектрика)
[31]. Это
тельный заряд которого мог стабилизировать
находится в близком соответствии со структур-
находящийся в PLS перекачиваемый протон.
ными данными, согласно которым расстояние
Перенос нового протона вглубь мембранного
до остатка E286 от внутренней водной фазы
диэлектрика при репротонировании остат-
составляет ~ 0,56 геометрической толщины мем-
ка E286 должен приводить к электростатиче-
браны [107]. В условиях дефицита протонов в
скому выталкиванию перекачиваемого про-
D-канале (с депротонированным E286) роль
тона из PLS [112, 114, 115]. Соответственно,
донора протона для BNC может выполнять
«медленная» электрогенная фаза включает в
остаток Y35 в средней части канала [27].
себя также высвобождение протона из PLS на
Одноэлектронный переход F → O в гем-
внешнюю сторону мембраны, которое может
медных оксидазах семейства А при «инъек-
быть замедлено добавлением ионов цинка
ции» электрона от Rubpy начинается с вос-
с P-стороны мембраны (рис. 3).
становления CuA и электрогенного переноса
электрона от СuA на гем а («быстрая» компо-
нента кинетики генерации ΔΨ) (рис. 3; [17]).
ПРИМЕНЕНИЕ
Возможное смещение положительного заряда
ПРЯМОЙ ЭЛЕКТРОМЕТРИИ
внутри закрытого К-канала в ответ на восста-
К ИССЛЕДОВАНИЮ ГЕМ-МЕДНЫХ
новление гема а может облегчить этот процесс
ОКСИДАЗ СЕМЕЙСТВА B
(стадия 2′ на рис. 3; [31]). Перенос электрона
от гема а к гему a34+=O2- происходит вдоль
Для понимания механизма сопряженного
плоскости мембраны практически электро-
протонного насоса цитохромоксидазы боль-
нейтрально. Транслокация протонов начина-
шое значение имеет изучение всего многооб-
ется с переноса перекачиваемого протона от
разия надсемейства гем-медных терминальных
остатка E286 в «ловушку» протонов (PLS), рас-
оксидаз [8], включая гораздо менее изучен-
положенную выше BNC. В разных гем-медных
ные и эволюционно отдаленные семейства B
оксидазах семейства А в качестве PLS могут
и C [19, 116, 117]. Изучение оксидаз семейств B
рассматриваться A-пропионат гема а3 и/или
и C начато относительно недавно, активно
один из гистидиновых лигандов CuB [111, 112].
развивается в последние годы [29, 95, 118, 119].
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1839
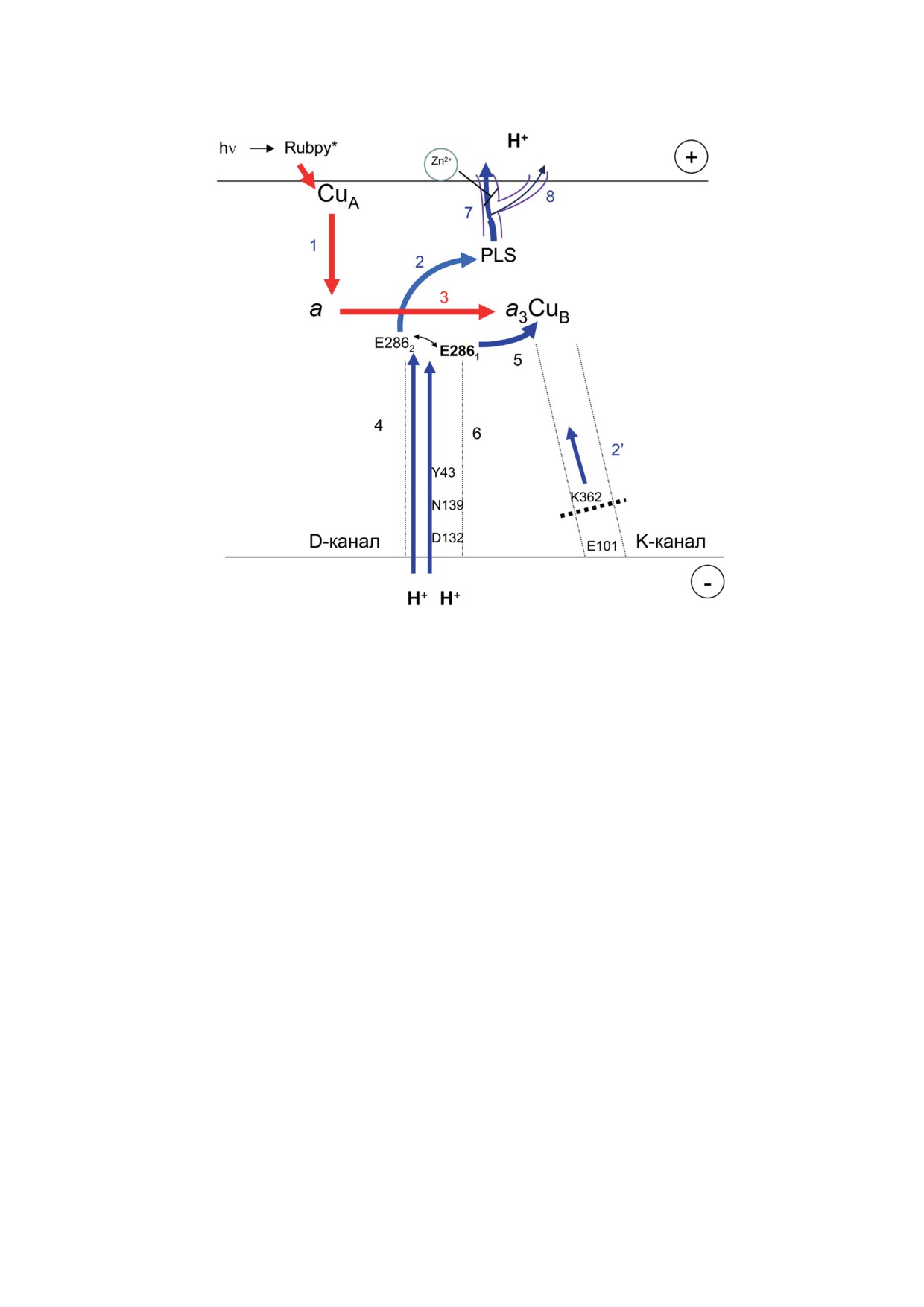
Рис. 3. На схеме приведены электрогенные стадии, разрешаемые при одноэлектронной фотоинъекции с помощью
Rubpy в переходе F → O (перенос четвертого электрона в каталитическом цикле цитохромоксидазы). Перед началом
реакции гем а3 находится в оксоферрильном состоянии (не показано). Красные стрелки указывают направление
переноса электрона, в то время как синие - стадии транслокации протонов. Показаны 2 протон-проводящих пути
(D- и K-каналы), приведены ряд консервативных аминокислотных остатков в них. Стадии 1 и 3 отражают перенос
электрона от CuA к гему а и от гема а в BNC соответственно. В ходе перехода F → O оба протона (субстратный и пере-
качиваемый) переносятся через D-канал. Предполагается, что изомеризация E286 (переход между конформациями
E2861 и E2862) предшествует переносу протона от E286 к сайту загрузки перекачиваемого протона (PLS). Частные
стадии переноса протонов (2, 4) входят в состав «средней» электрогенной фазы, в то время как стадии 6 и 7 - в состав
«медленной». Показан дополнительный путь выхода перекачиваемого протона из PLS (8), выявляемый в присутствии
ионов цинка [15]. Перенос протона от E286 в BNC (стадия 5) предположительно входит в состав «средней» (в случае
ЦО из митохондрий) и «медленной» (ЦО из R. sphaeroides) электрогенных фаз соответственно. Стадия 2′ - возможное
смещение заряда в К-канале в ответ на восстановление гема а [31]
Не в последней степени это связано с их широ-
ленном состоянии O цитохромоксидазу ba3 из
кой распространенностью в патогенных мик-
T. thermophilus в присутствии перекиси водоро-
роорганизмах, наряду с не содержащими медь
да наблюдается дополнительная электрогенная
оксидазами bd-типа, и, соответственно, важ-
реакция, скорость которой прямо пропорцио-
ным биомедицинским значением [120].
нальна концентрации добавленной перекиси.
В случае ЦО ba3 из T. thermophilus, типич-
Иными словами, фактически неактивный в
ного представителя семейства B, с помощью
окисленном состоянии по отношению к внеш-
прямого электрометрического метода была об-
ним лигандам BNC ЦО ba3 из T. thermophilus
наружена интересная особенность активного
приобретает способность связывать лиганды
центра BNC этого фермента [121]. ЦО ba3-типа
(переходит в активное/открытое состояние) в
из T. thermophilus в исходном окисленном со-
ответ на одноэлектронную «инъекцию» и вос-
стоянии не реагирует с экзогенными лиган-
становление гема b [121].
дами и поэтому ее не удается перевести и ста-
Важным обстоятельством в контексте
билизировать в состоянии P или F с помощью
уникальности и пользы применения прямого
обработки перекисью водорода или CO [121]
электрометрического метода к изучению цито-
так, как это делалось для типичных аа3-окси-
хромоксидазы ba3-типа из T. thermophilus явля-
даз [63]. Однако при «инъекции» электрона
ется то, что оцениваемые по степени закисле-
от Rubpy в находящуюся в полностью окис-
ния внешнего отсека протеолипосом в условиях
БИОХИМИЯ том 88 вып. 10 2023
1840
СИЛЕЦКИЙ
стационарной кислород-редуктазной реакции
В первичной последовательности ЦО се-
усредненные параметры каталитического цикла
мейства B, по-видимому, сохраняется и функ-
этого фермента свидетельствуют о вариабель-
ционирует лишь один входной протонный
ности стехиометрии перекачивания прото-
канал, гомологичный К-каналу оксидаз семей-
нов. В отличие от оксидаз семейства А, сте-
ства А [5, 29]. С помощью прямого электроме-
хиометрия перекачивания протонов в ЦО
трического метода было прямо показано, что,
семейств B и C в стационарных измерениях
в отличие от семейства А, в ЦО семейства B
может варьировать в значительных пределах:
для переноса и субстратных, и перекачиваемых
в среднем от 0,5 протона на электрон (H+/e-),
протонов в окислительной фазе каталитическо-
поступающий в BNC, до ~0,85 H+/e- [66, 118,
го цикла необходим К-канал. Мутация T315V
121-124]. Прямой электрометрический метод
в К-канале ЦО ba3 из T. thermophilus приводит
позволяет получить и сравнить электрогенные
как к замедлению перехода F → OН вследствие
параметры одноэлектронных переходов по
замедления переноса субстратного протона
отдельности и получить уникальную информа-
в BNC, так и к десопряжению, т.е. к полному
цию об особенностях механизма сопряжения.
отсутствию перекачки протонов в окислитель-
Для ЦО ba3 из T. thermophilus, как типично-
ной фазе каталитического цикла [29].
го представителя семейства B, были разреше-
ны стадии электрогенного переноса протонов
Финансирование. Исследование выполне-
в окислительной фазе каталитического ци-
но при поддержке Российского научного фон-
кла [122] и в первом переходе восстановитель-
да (грант № 23-24-00143).
ной части каталитического цикла [66]. Были
Благодарность. В первую очередь автор
выявлены стадии, перенос электрона в кото-
хотел бы выразить свою глубочайшую благо-
рых не сопряжен с перекачиванием протона
дарность безвременно ушедшим А.А. Кон-
через мембрану, что объясняет снижение эф-
стантинову, А.Д. Каулену, М.И. Верховскому,
фективной стехиометрии перекачки протонов
Л.А. Драчеву, В.П. Скулачеву. Cотрудничество
и ее значительную вариабельность в оксидазах
с этими выдающимися учеными в разное вре-
семейства B [66, 122]. В частности, было пока-
мя оказало на автора неизгладимое впечат-
зано, что, в отличие от оксидаз семейства А,
ление. Также автор очень благодарен Д.Л. За-
в окислительной фазе каталитического цикла
славскому, И.А. Смирновой, И.Н. Белевичу,
ЦО ba3 из T. thermophilus происходит перека-
проф. М. Викстрему и проф. Р. Геннису за со-
чивание одного протона через мембрану вме-
трудничество в исследованиях гем-медных ок-
сто двух [122]. В то же время перенос одного
сидаз с применением прямого электрометри-
электрона в восстановительной части катали-
ческого метода.
тического цикла (переход OH → EH) также не
Конфликт интересов. Автор заявляет об от-
сопряжен с перекачиванием протонов через
сутствии конфликта интересов в финансовой
мембрану, что может быть следствием влия-
или любой другой сфере.
ния формирующегося в окислительной фазе
Соблюдение этических норм. Эта статья не
каталитического цикла мембранного потен-
содержит каких-либо исследований с участием
циала [66].
людей или животных, выполненных автором.
СПИСОК ЛИТЕРАТУРЫ
1. Anraku, Y. (1988) Bacterial electron transport chains,
5. Hemp, J., and Gennis, R. B. (2008) Diversity of the
Ann. Rev. Biochem., 57, 101-132, doi: 10.1146/annurev.
heme-copper superfamily in archaea: insights from
bi.57.070188.000533.
genomics and structural modeling, Results Probl. Cell
2. Garcia-Horsman, J. A., Barquera, B., Rumbley, J.,
Differ., 45, 1-31, doi: 10.1007/400_2007_046.
Ma, J., and Gennis, R. B. (1994) The superfamily of
6. Rich, P. R.
(2017) Mitochondrial cytochrome c
heme-copper respiratory oxidases, J. Bacteriol., 176,
oxidase: catalysis, coupling and controversies,
5587-5600, doi: 10.1128/jb.176.18.5587-5600.1994.
Biochem. Soc. Trans., 45, 813-829, doi: 10.1042/
3. Babcock, G. T., and Wikström, M. (1992) Oxygen ac-
BST20160139.
tivation and the conservation of energy in cell respira-
7. Siletsky, S. A., and Borisov, V. B. (2021) Proton
tion, Nature, 356, 301-309, doi: 10.1038/356301a0.
pumping and non-pumping terminal respiratory
4. Ferguson-Miller, S., and Babcock, G. T.
(1996)
oxidases: active sites intermediates of these molecular
Heme/copper terminal oxidases, Chem. Rev., 7, 2889-
machines and their derivatives, Int. J. Mol. Sci., 22,
2907, doi: 10.1021/cr950051s.
10852, doi: 10.3390/ijms221910852.
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1841
8.
Pereira, M. M., Santana, M., and Teixeira, M. (2001)
19.
Soulimane, T., Buse, G., Bourenkov, G. B., Bartunik,
A novel scenario for the evolution of haem-copper
H. D., Huber, R., and Than, M. E. (2000) Structure
oxygen reductases, Biochim. Biophys. Acta,
1505,
and mechanism of the aberrant ba3-cytochrome c
185-208, doi: 10.1016/S0005-2728(01)00169-4.
oxidase from Thermus thermophilus, EMBO J., 19,
9.
Yoshikawa, S., and Shimada, A. (2015) Reaction
1766-1776, doi: 10.1093/emboj/19.8.1766.
mechanism of cytochrome c oxidase, Chem. Rev.,
20.
Pitcher, R. S., and Watmough, N. J. (2004) The bacte-
115, 1936-1989, doi: 10.1021/cr500266a.
rial cytochrome cbb3 oxidases, Biochim. Biophys. Acta,
10.
Fee, J. A., Yoshida, T., Surerus, K. K., and Mather,
1655, 388-399, doi: 10.1016/j.bbabio.2003.09.017.
M. W. (1993) Cytochrome caa3 from the ther-
21.
Buschmann, S., Warkentin, E., Xie, H., Langer, J. D.,
mophilic bacterium Thermus thermophilus: a mem-
Ermler, U., and Michel, H. (2010) The structure
ber of the heme-copper oxidase superfamily,
of cbb3 cytochrome oxidase provides insights into
J. Bioenerg. Biomembr., 25, 103-114, doi: 10.1007/
proton pumping, Science, 329, 327-330, doi: 10.1126/
BF00762852.
science.1187303.
11.
Siletsky, S. A., Belevich, I., Soulimane, T., Verkhovsky,
22.
Mitchell, P. (1968) Chemiosmotic coupling and energy
M. I., and Wikström, M. (2013) The fifth electron in
transduction, Glynn Research Ltd., Bodmin.
the fully reduced caa3 from Thermus thermophilus is
23.
Wikström, M.
(1977) Proton pump coupled to
competent in proton pumping, Biochim. Biophys. Acta,
cytochrome c oxidase in mitochondria, Nature,
1827, 1-9, doi: 10.1016/j.bbabio.2012.09.013.
266, 271-273, doi: 10.1038/266271a0.
12.
Wikström, M., Krab, K., and Sharma, V.
(2018)
24.
Wikström, M. (2004) Cytochrome c oxidase: 25 years
Oxygen activation and energy conservation by
of the elusive proton pump, Biochim. Biophys. Acta,
cytochrome c oxidase, Chem. Rev., 118, 2469-2490,
1655, 241-247, doi: 10.1016/j.bbabio.2003.07.013.
doi: 10.1021/acs.chemrev.7b00664.
25.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D.,
13.
Forte, E., Borisov, V. B., Siletsky, S. A., Petrosino, M.,
Kondrashin, A. A., Liberman, E. A., Nemecek, I. B.,
and Giuffre, A.
(2019) In the respiratory chain
Ostroumov, S. A., Semenov, A., and Skulachev, V. P.
of Escherichia coli cytochromes bd-I and bd-II
(1974) Direct measurement of electric current
are more sensitive to carbon monoxide inhibition
generation by cytochrome oxidase, H+-ATPase
than cytochrome bo3, Biochim. Biophys. Acta
and bacteriorhodopsin, Nature,
249,
321-324,
Bioenergetics,
1860,
148088, doi:
10.1016/j.bbabio.
doi: 10.1038/249321a0.
2019.148088.
26.
Drachev, L. A., Kaulen, A. D., Khitrina, L. V., and
14.
Bjorck, M. L., Vilhjalmsdottir, J., Hartley, A. M.,
Skulachev, V. P. (1981) Fast stages of photoelectric
Meunier, B., Nasvik Ojemyr, L., Marechal, A., and
processes in biological membranes. I. Bacteriorho-
Brzezinski, P. (2019) Proton-transfer pathways in the
dopsin, Eur. J. Biochem., 117, 461-470, doi: 10.1111/
mitochondrial S. cerevisiae cytochrome c oxidase, Sci.
j.1432-1033.1981.tb06361.x.
Rep., 9, 20207, doi: 10.1038/s41598-019-56648-9.
27.
Belevich, I., Gorbikova, E., Belevich, N. P.,
15.
Siletsky, S. A., and Gennis, R. B. (2021) Time-
Rauhamaki, V., Wikström, M., and Verkhovsky, M. I.
resolved electrometric study of the F → O transition in
(2010) Initiation of the proton pump of cytochrome c
cytochrome c oxidase. The effect of Zn2+ ions on the
oxidase, Proc. Natl. Acad. Sci. USA, 107, 18469-18474,
positive side of the membrane, Biochemistry (Moscow),
doi: 10.1073/pnas.1010974107.
86, 105-122, doi: 10.1134/S0006297921010107.
28.
Siletsky, S. A., and Konstantinov, A. A.
(2012)
16.
Marechal, A., Xu, J. Y., Genko, N., Hartley, A. M.,
Cytochrome c oxidase: charge translocation coupled
Haraux, F., Meunier, B., and Rich, P. R. (2020)
to single-electron partial steps of the catalytic cycle,
A common coupling mechanism for A-type heme-
Biochim. Biophys. Acta, 1817, 476-488, doi: 10.1016/
copper oxidases from bacteria to mitochondria, Proc.
j.bbabio.2011.08.003.
Natl. Acad. Sci. USA, 117, 9349-9355, doi: 10.1073/
29.
Siletsky, S. A., Soulimane, T., Belevich, I., Gennis,
pnas.2001572117.
R. B., and Wikström, M. (2021) Specific inhibition
17.
Siletsky, S. A. (2013) Steps of the coupled charge
of proton pumping by the T315V mutation in the K
translocation in the catalytic cycle of cytochrome c
channel of cytochrome ba3 from Thermus thermophilus,
oxidase, Front. Biosci. (Landmark Ed), 18, 36-57,
Biochim. Biophys. Acta Bioenergetics, 1862, 148450,
doi: 10.2741/4086.
doi: 10.1016/j.bbabio.2021.148450.
18.
Fee, J. A., Sanders, D., Slutter, C. E., Doan, P. E.,
30.
Siletsky, S. A., Pawate, A. S., Weiss, K., Gennis, R. B.,
Aasa, R., Karpefors, M., and Vänngård, T. (1995)
and Konstantinov, A. A.
(2004) Transmembrane
Multi-frequency epr evidence for a binuclear CuA cen-
charge separation during the ferryl-oxo → oxidized
ter in cytochrome c oxidase: studies with a 63Cu- and
transition in a non-pumping mutant of cytochrome c
65Cu-enriched, soluble domain of the cytochrome
oxidase, J. Biol. Chem.,
279,
52558-52565,
ba3, subunit II from Thermus Thermophilus, Biochem.
doi: 10.1074/jbc.M407549200.
Biophys. Res. Commun., 212, 77-83, doi: 10.1006/
31.
Siletsky, S. A., Zhu, J., Gennis, R. B., and
bbrc.1995.1938.
Konstantinov, A. A. (2010) Partial steps of charge
9
БИОХИМИЯ том 88 вып. 10 2023
1842
СИЛЕЦКИЙ
translocation in the nonpumping N139L mutant of
41.
Abramson, J., Riistama, S., Larsson, G., Jasaitis, A.,
Rhodobacter sphaeroides cytochrome c oxidase with
Svensson-Ek, M., Laakkonen, L., Puuustinen, A.,
a blocked D-channel, Biochemistry, 49, 3060-3073,
Iwata, S., and Wikström, M. (2000) The structure of
doi: 10.1021/bi901719e.
the ubiquinol oxidase from Escherichia coli and its
32.
Tsukihara, T., Aoyama, H., Yamashita, E., Takashi, T.,
ubiquinone binding site, Nat. Struct. Biol., 7, 910-917,
Yamaguichi, H., Shinzawa-Itoh, K., Nakashima, R.,
doi: 10.1038/82824.
Yaono, R., and Yoshikawa, S. (1996) The whole
42.
Noor, M. R., and Soulimane, T. (2013) Structure
structure of the 13-subunit oxidized cytochrome c
of caa(3) cytochrome c oxidase - a nature-made
oxidase at 2.8 Å, Science, 272, 1136-1144, doi: 10.1126/
enzyme-substrate complex, Biol. Chem., 394, 579-591,
science.272.5265.1136.
doi: 10.1515/hsz-2012-0343.
33.
Yoshikawa, S., Shinzawa-Itoh, K., Nakashima, R.,
43.
Luna, V. M., Chen, Y., Fee, J. A., and Stout, C. D.
Yaono, R., Inoue, N., Yao, M., Fei, M. J., Libeu,
(2008) Crystallographic studies of Xe and Kr bind-
C. P., Mizushima, T., Yamaguchi, H., Tomizaki, T.,
ing within the large internal cavity of cytochrome ba3
and Tsukihara, T.
(1998) Redox-coupled crystal
from Thermus thermophilus: structural analysis and
structural changes in bovine heart cytochrome c oxi-
role of oxygen transport channels in the heme-Cu
dase, Science, 280, 1723-1729, doi: 10.1126/science.
oxidases, Biochemistry, 47, 4657-4665, doi: 10.1021/
280.5370.1723.
bi800045y.
34.
Tsukihara, T., Shimokata, K., Katayama, Y.,
44.
Fetter, J. R., Qian, J., Shapleigh, J., Thomas, J. W.,
Shimada, H., Muramoto, K., Aoyama, H.,
Garcia-Horsman, A., Schmidt, E., Hosler, J.,
Mochizuki, M., Shinzawa-Itoh, K., Yamashita, E.,
Babcock, G. T., Gennis, R. B., and Ferguson-
Yao, M., Ishimura, Y., and Yoshikawa, S.
(2003)
Miller, S. (1995) Possible proton relay pathways in
The low-spin heme of cytochrome c oxidase as the
cytochrome c oxidase, Proc. Natl. Acad. Sci. USA, 92,
driving element of the proton-pumping process, Proc.
1604-1608, doi: 10.1073/pnas.92.5.1604.
Natl. Acad. Sci. USA, 100, 15304-15309, doi: 10.1073/
45.
Konstantinov, A. A., Siletsky, S., Mitchell, D.,
pnas.2635097100.
Kaulen, A., and Gennis, R. B. (1997) The roles of the
35.
Muramoto, K., Hirata, K., Shinzawa-Itoh, K.,
two proton input channels in cytochrome c oxidase
Yoko-o, S., Yamashita, E., Aoyama, H., Tsukihara, T.,
from Rhodobacter sphaeroides probed by the effects of
and Yoshikawa, S. (2007) A histidine residue acting
site-directed mutations on time resolved electrogenic
as a controlling site for dioxygen reduction and
intraprotein proton transfer, Proc. Natl. Acad. Sci.
proton pumping by cytochrome c oxidase, Proc.
USA, 94, 9085-9090, doi: 10.1073/pnas.94.17.9085.
Natl. Acad. Sci. USA, 104, 7881-7886, doi: 10.1073/
46.
Gennis, R. B. (1998) Multiple proton-conducting
pnas.0610031104.
pathways in cytochrome oxidase and a proposed role
36.
Iwata, S., Ostermeier, C., Ludwig, B., and Michel, H.
for the active-site tyrosine, Biochim. Biophys. Acta,
(1995) Structure at 2.8 Å resolution of cytochrome c
1365, 241-248, doi: 10.1016/S0005-2728(98)00075-9.
oxidase from Paracoccus denitrificans, Nature, 376,
47.
Branden, M., Tomson, F., Gennis, R. B., and
660-669, doi: 10.1038/376660a0.
Brzezinski, P. (2002) The entry point of the K-pro-
37.
Ostermeier, C., Iwata, S., Ludwig, B., and Michel, H.
ton-transfer pathway in cytochrome c oxidase, Bio-
(1995) FV fragment-mediated crystallization of the
chemistry, 41, 10794-10798, doi: 10.1021/bi026093+.
membrane protein bacterial cytochrome c oxidase,
48.
Hofacker, I., and Schulten, K. (1998) Proteins: Struc-
Nat. Struct. Biol., 2, 842, doi: 10.1038/nsb1095-842.
ture, Function, and Genetics, 30, 100-107, doi: 10.1002/
38.
Koepke, J., Olkhova, E., Angerer, H., Muller, H.,
(SICI)1097-0134(199801)30:1<100::AID-PROT9>
Peng, G., and Michel, H. (2009) High resolution crys-
3.0.CO;2-S.
tal structure of Paracoccus denitrificans cytochrome c
49.
Popovic, D. M., and Stuchebrukhov, A. A. (2005)
oxidase: New insights into the active site and the pro-
Proton exit channels in bovine cytochrome c oxi-
ton transfer pathways, Biochim. Biophys. Acta, 1787,
dase, J. Phys. Chem. B, 109, 1999-2006, doi: 10.1021/
635-645, doi: 10.1016/j.bbabio.2009.04.003.
jp0464371.
39.
Svensson-Ek, M., Abramson, J., Larsson, G.,
50.
Riistama, S., Puustinen, A., Verkhovsky, M. I.,
Tornroth, S., Brzezinski, P., and Iwata, S.
(2002)
Morgan, J. E., and Wikström, M. (2000) Binding
The X-ray crystal structures of wild-type and EQ(I-
of O2 and its reduction are both retarded by replace-
286) mutant cytochrome c oxidases from Rhodobacter
ment of valine 279 by isoleucine in cytochrome c oxi-
sphaeroides, J. Mol. Biol., 321, 329-339, doi: 10.1016/
dase from Paracoccus denitrificans, Biochemistry, 39,
S0022-2836(02)00619-8.
6365-6372, doi: 10.1021/bi000123w.
40.
Qin, L., Liu, J., Mills, D. A., Proshlyakov, D. A.,
51.
Salomonsson, L., Lee, A., Gennis, R. B., and
Hiser, C., and Ferguson-Miller, S. (2009) Redox
Brzezinski, P. (2004) A single-amino-acid lid renders
dependent conformational changes in cytochrome c
a gas-tight compartment within a membrane-bound
oxidase suggest a gating mechanism for proton uptake,
transporter, Proc. Natl. Acad. Sci. USA, 101, 11617-
Biochemistry, 48, 5121-5130, doi: 10.1021/bi9001387.
11621, doi: 10.1073/pnas.0402242101.
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1843
52.
Schmidt, B., McCracken, J., and Ferguson-
63.
Siletsky, S., Kaulen, A. D., and Konstantinov, A. A.
Miller, S. (2003) A discrete water exit pathway in the
(1999) Resolution of electrogenic steps coupled to
membrane protein cytochrome c oxidase, Proc. Natl.
conversion of cytochrome c oxidase from the peroxy
Acad. Sci. USA, 100, 15539-15542, doi: 10.1073/
to the ferryl-oxo state, Biochemistry, 38, 4853-4861,
pnas.2633243100.
doi: 10.1021/bi982614a.
53.
Verkhovsky, M. I., Jasaitis, A., Verkhovskaya, M. L.,
64.
Sharma, V., Karlin, K. D., and Wikstrom, M. (2013)
Morgan, L., and Wikström, M. (1999) Proton translo-
Computational study of the activated OH state in the
cation by cytochrome c oxidase, Nature, 400, 480-483,
catalytic mechanism of cytochrome c oxidase, Proc.
doi: 10.1038/22813.
Natl. Acad. Sci. USA, 110, 16844-16849, doi: 10.1073/
54.
Chance, B., Saronio, C., and Leigh, J. S., Jr. (1975)
pnas.1220379110.
Functional intermediates in the reaction of mem-
65.
Siletsky, S. A., Belevich, I., Wikström, M.,
brane-bound cytochrome oxidase with oxygen, J. Biol.
Soulimane, T., and Verkhovsky, M. I. (2009) Time-
Chem.,
250,
9226-9237, doi:
10.1016/S0021-9258
resolved OH → EH transition of the aberrant ba3 oxidase
(19)40634-0.
from Thermus thermophilus, Biochim. Biophys. Acta,
55.
Hill, B. C., and Greenwood, C. (1983) Spectro-
1787, 201-205, doi: 10.1016/j.bbabio.2008.12.020.
scopic evidence for the participation of compound A
66.
Siletsky, S. A., Belevich, I., Belevich, N. P., Souli-
(Fea32+-O2) in the reaction of mixed-valence cy-
mane, T., and Wikström, M. (2017) Time-resolved
tochrome c oxidase with oxygen at room tem-
generation of membrane potential by ba3 cytochrome c
perature, Biochem. J., 215, 659-667, doi: 10.1042/
oxidase from Thermus thermophilus coupled to
bj2150659.
single electron injection into the O and OH states,
56.
Muramoto, K., Ohta, K., Shinzawa-Itoh, K., Kan-
Biochim. Biophys. Acta, 1858, 915-926, doi: 10.1016/
da, K., Taniguchi, M., Nabekura, H., Yamashita, E.,
j.bbabio.2017.08.007.
Tsukihara, T., and Yoshikawa, S. (2010) Bovine cy-
67.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P.,
tochrome c oxidase structures enable O2 reduction
Balashov, S. P., Dolgikh, D. A., Rubin, A. B.,
with minimization of reactive oxygens and provide
Kirpichnikov, M. P., and Petrovskaya, L. E. (2016)
a proton-pumping gate, Proc. Natl. Acad. Sci. USA,
Electrogenic steps of light-driven proton transport in
107, 7740-7745, doi: 10.1073/pnas.0910410107.
ESR, a retinal protein from Exiguobacterium sibiricum,
57.
Kitagawa, T., and Ogura, T. (1997) Oxygen activation
Biochim. Biophys. Acta, 1857, 1741-1750, doi: 10.1016/
mechanism at the binuclear site of heme-copper
j.bbabio.2016.08.004.
oxidase superfamily as revealed by time-resolved
68.
Kaulen, A. D. (2000) Electrogenic processes and
resonance Raman spectroscopy, in Progress in
protein conformational changes accompanying the
Inorganic Chemistry (Karlin, K. D., ed) Wiley & Sons,
bacteriorhodopsin photocycle, Biochim. Biophys. Acta,
pp. 431-479, doi: 10.1002/9780470166468.ch6.
1460, 204-219, doi: 10.1016/S0005-2728(00)00140-7.
58.
Proshlyakov, D. A., Pressler, M. A., and Babcock,
69.
Gibson, Q. H., and Greenwood, C. (1963) Reac-
G. T. (1998) Dioxygen activation and bond cleav-
tions of cytochrome oxidase with oxygen and carbon
age by mixed-valence cytochrome c oxidase, Proc.
monoxide, Biochem. J., 86, 541-554, doi: 10.1042/
Natl. Acad.Sci. USA, 95, 8020-8025, doi: 10.1073/
bj0860541.
pnas.95.14.8020.
70.
Nilsson, T. (1992) Photoinduced electron transfer
59.
Proshlyakov, D. A., Pressler, M. A., DeMaso, C.,
from tris(2,2′-bipyridyl)ruthenium to cytochrome c
Leykam, J. F., DeWitt, D. L., and Babcock, G. T.
oxidase, Proc. Natl. Acad. Sci. USA, 89, 6497-6501,
(2000) Oxygen activation and reduction in respiration:
doi: 10.1073/pnas.89.14.6497.
involvement of redox-active tyrosine 244, Science,
71.
Belevich, I., and Verkhovsky, M. I. (2008) Molec-
290, 1588-1591, doi: 10.1126/science.290.5496.1588.
ular mechanism of proton translocation by cyto-
60.
Buse, G., Soulimane, T., Dewor, M., Meyer, H. E.,
chrome c oxidase, Antioxid. Redox Signal., 10, 1-29,
and Bloggel, M. (1999) Evidence for a copper co-
doi: 10.1089/ars.2007.1705.
ordinated histidine-tyrosine crosslink in the active
72.
Kaila, V. R., Verkhovsky, M. I., and Wikström, M.
site of cytochrome oxidase, Protein Sci., 8, 985-990,
(2010) Proton-coupled electron transfer in cytochrome
doi: 10.1110/ps.8.5.985.
oxidase, Chem. Rev., 110, 7062-7081, doi: 10.1021/
61.
Rauhamaki, V., Baumann, M., Soliymani, R.,
cr1002003.
Puustinen, A., and Wikström, M. (2006) Identifi-
73.
Zaslavsky, D., Kaulen, A., Smirnova, I. A., Vygodina,
cation of histidin-tyrosin cross-link in the active site
T. V., and Konstantinov, A. A. (1993) Flash-induced
of the cbb3-type cytochrome c oxidase from Rhodo-
membrane potential generation by cytochrome c
bacter sphaeroides, Proc. Natl. Acad. Sci. USA, 103,
oxidase, FEBS Lett., 336, 389-393, doi: 10.1016/
16135-16140, doi: 10.1073/pnas.0606254103.
0014-5793(93)80843-J.
62.
Babcock, G. T. (1999) How oxygen is activated and
74.
Zaslavsky, D. L., Smirnova, I. A., Siletsky, S. A.,
reduced in respiration, Proc. Natl. Acad. Sci. USA, 96,
Kaulen, A. D., Millett, F., and Konstantinov, A. A.
12971-12973, doi: 10.1073/pnas.96.23.12971.
(1995) Rapid kinetics of membrane potential
БИОХИМИЯ том 88 вып. 10 2023
9*
1
844
СИЛЕЦКИЙ
generation by cytochrome c oxidase with the pho-
Proc. Natl. Acad. Sci. USA,
104,
2685-2690,
toactive Ru(II)-tris-bipyridyl derivative of cyto-
doi: 10.1073/pnas.0608794104.
chrome c as electron donor, FEBS Lett., 359, 27-30,
87.
Pawate, A. S., Morgan, J., Namslauer, A., Mills, D.,
doi: 10.1016/0014-5793(94)01443-5.
Brzezinski, P., Ferguson-Miller, S., and Gennis, R. B.
75.
Siletsky, S. A., Kaulen, A. D., and Konstantinov, A. A.
(2002) A mutation in subunit I of cytochrome oxidase
(1997) Electrogenic events associated with peroxy- to
from Rhodobacter sphaeroides results in an increase in
ferryl-oxo state transition in cytochrome c oxidase,
steady-state activity but completely eliminates proton
Eur. J. Biophys., 26, 98.
pumping, Biochemistry, 41, 13417-13423, doi: 10.1021/
76.
Verkhovsky, M. I., Tuukkanen, A., Backgren, C.,
bi026582+.
Puustinen, A., and Wikström, M. (2001) Charge
88.
Pfitzner, U., Hoffmeier, K., Harrenga, A., Kannt, A.,
translocation coupled to electron injection into oxi-
Michel, H., Bamberg, E., Richter, O.-M. H., and
dized cytochrome c oxidase from Paracoccus denitri-
Ludwig, B. (2000) Tracing the D-pathway in recon-
ficans, Biochemistry, 40, 7077-7083, doi: 10.1021/
stituted site-directed mutants of cytochrome c oxi-
bi010030u.
dase from Paracoccus denitrificans, Biochemistry, 39,
77.
Verkhovsky, M. I., Morgan, J. E., Verkhovskaya, M.,
6756-6762, doi: 10.1021/bi992235x.
and Wikström, M. (1997) Translocation of electrical
89.
Ribacka, C., Verkhovsky, M. I., Belevich, I., Bloch,
charge during a single turnover of cytochrome c
D. A., Puustinen, A., and Wikström, M.
(2005)
oxidase, Biochim. Biophys. Acta,
1318,
6-10,
An elementary reaction step of the proton pump is
doi: 10.1016/S0005-2728(96)00147-8.
revealed by mutation of tryptophan-164 to phenylala-
78.
Hinkle, P., and Mitchell, P. (1970) Effect of membrane
nine in cytochrome c oxidase from Paracoccus denitri-
potential on the redox poise between cytochrome a and
ficans, Biochemistry, 44, 16502-16512, doi: 10.1021/
cytochrome c in rat liver mitochondria, J. Bioenerg.,
bi0511336.
1, 45-60, doi: 10.1007/BF01516088.
90.
Faxen, K., Gilderson, G., Adelroth, P., and
79.
Wikström, M.
(1989) Identification of the elec-
Brzezinski, P. (2005) A mechanistic principle for pro-
tron transfers in cytochrome oxidase that are cou-
ton pumping by cytochrome c oxidase, Nature, 437,
pled to proton-pumping, Nature,
338,
776-778,
286-289, doi: 10.1038/nature03921.
doi: 10.1038/338776a0.
91.
Brand, S. E., Rajagukguk, S., Ganesan, K., Geren, L.,
80.
Wikström, M., Krab, K., and Saraste, M.
(1981)
Fabian, M., Han, D., Gennis, R. B., Durham, B.,
Cytochrome Oxidase - A Synthesis, Academic Press,
and Millett, F. (2007) A new ruthenium complex
New York.
to study single-electron reduction of the pulsed OH
81.
Siletsky, S. A., Kaulen, A. D., Mitchell, D., Gennis,
state of detergent-solubilized cytochrome oxidase,
R. B., and Konstantinov, A. A. (1996) Resolution of
Biochemistry, 46, 14610-14618, doi: 10.1021/bi701424d.
two proton conduction pathways in cytochrome c
92.
Siletsky, S. A., Belevich, I., Belevich, N. P., Soulimane,
oxidase, EBEC Short Rep., 9, 90.
T., and Verkhovsky, M. I. (2011) Time-resolved single-
82.
Lepp, H., Svahn, E., Faxen, K., and Brzezinski, P.
turnover of caa3 oxidase from Thermus thermophilus.
(2008) Charge transfer in the K proton pathway linked
Fifth electron of the fully reduced enzyme converts OH
to electron transfer to the catalytic site in cytochrome c
into EH state, Biochim. Biophys. Acta, 1807, 1162-1169,
oxidase, Biochemistry, 47, 4929-4935, doi: 10.1021/
doi: 10.1016/j.bbabio.2011.05.006.
bi7024707.
93.
Thomas, J. W., Puustinen, A., Alben, J. O., Gennis,
83.
Ruitenberg, M., Kannt, A., Bamberg, E., Ludwig, B.,
R. B., and Wikström, M. (1993) Substitution of as-
Michel, H., and Fendler, K. (2000) Single-electron
paragine for aspartate-135 in subunit I of the cyto-
reduction of the oxidized state is coupled to proton
chrome bo ubiquinol oxidase of Escherichia coli elim-
uptake via the K pathway in Paracoccus denitrificans
inates proton-pumping activity, Biochemistry,
32,
cytochrome c oxidase, Proc. Natl. Acad. Sci. USA,
10923-10928, doi: 10.1021/bi00091a048.
97, 4632-4636, doi: 10.1073/pnas.080079097.
94.
Garcia-Horsman, J. A., Puustinen, A., Gennis,
84.
Ruitenberg, M., Kannt, A., Bamberg, E., Fendler, K.,
R. B., and Wikström, M. (1995) Proton transfer in
and Michel, H. (2002) Reduction of cytochrome c ox-
cytochrome bo3 ubiquinol oxidase of Escherichia coli:
idase by a second electron leads to proton transloca-
second site mutations in subunit I that restore proton
tion, Nature, 417, 99-102, doi: 10.1038/417099a.
pumping in the decoupled mutant Asp135Asn, Bio-
85.
Bloch, D., Belevich, I., Jasaitis, A., Ribacka, C.,
chemistry, 34, 4428-4433, doi: 10.1021/bi00013a035.
Puustinen, A., Verkhovsky, M. I., and Wikström, M.
95.
Siletsky, S. A., Borisov, V. B., and Mamedov, M. D.
(2004) The catalytic cycle of cytochrome c oxidase is
(2017) Photosystem II and terminal respiratory
not the sum of its two halves, Proc. Natl. Acad. Sci.
oxidases: molecular machines operating in opposite
USA, 101, 529-533, doi: 10.1073/pnas.0306036101.
directions, Front. Biosci. (Landmark Ed), 22, 1379-
86.
Belevich, I., Bloch, D. A., Wikström, M., and
1426, doi: 10.2741/4550.
Verkhovsky, M. I. (2007) Exploring the proton pump
96.
Shimokata, K., Katayama, Y., Murayama, H., Sue-
mechanism of cytochrome c oxidase in real time,
matsu, M., Tsukihara, T., Muramoto, K., Aoyama, H.,
БИОХИМИЯ том 88 вып. 10 2023
ИССЛЕДОВАНИЕ МЕХАНИЗМА ГЕНЕРАЦИИ МЕМБРАННОГО ПОТЕНЦИАЛА 1845
Yoshikawa, S., and Shimada, H. (2007) The proton
107. Medvedev, D. M., Medvedev, E. S., Kotelnikov,
pumping pathway of bovine heart cytochrome c ox-
A. I., and Stuchebrukhov, A. A. (2005) Analysis of
idase, Proc. Natl. Acad. Sci. USA, 104, 4200-4205,
the kinetics of the membrane potential generated by
doi: 10.1073/pnas.0611627104.
cytochrome c oxidase upon single electron injection,
97. Yoshikawa, S., Shimada, A., and Shinzawa-Itoh, K.
Biochim. Biophys. Acta, 1710, 47-56, doi: 10.1016/
(2015) Respiratory conservation of energy with
j.bbabio.2005.08.008.
dioxygen: cytochrome c oxidase, Met. Ions Life Sci.,
108. Siletsky, S., and Konstantinov, A. A. (2006) Electro-
15, 89-130, doi: 10.1007/978-3-319-12415-5_4.
genic mechanism of cytochrome c oxidase, The 8th
98. Capitanio, N., Palese, L. L., Capitanio, G., Martino,
European Biological Chemistry Conference, p. 80.
P. L., Richter, O. M., Ludwig, B., and Papa, S.
109. Siletsky, S. A., Han, D., Brand, S., Morgan, J. E.,
(2012) Allosteric interactions and proton conducting
Fabian, M., Geren, L., Millett, F., Durham, B.,
pathways in proton pumping aa(3) oxidases: heme a as
Konstantinov, A. A., and Gennis, R. B. (2006) Single-
a key coupling element, Biochim. Biophys. Acta, 1817,
electron photoreduction of the PM intermediate of
558-566, doi: 10.1016/j.bbabio.2011.11.003.
cytochrome c oxidase, Biochim. Biophys. Acta, 1757,
99. Rich, P. R., and Marechal, A. (2013) Functions
1122-1132, doi: 10.1016/j.bbabio.2006.07.003.
of the hydrophilic channels in protonmotive cyto-
110. Sugitani, R., Medvedev, E. S., and Stuchebrukhov,
chrome c oxidase, J. R. Soc. Interface, 10, 20130183,
A. A. (2008) Theoretical and computational analysis
doi: 10.1098/rsif.2013.0183.
of the membrane potential generated by cytochrome c
100. Sharma, V., Jambrina, P. G., Kaukonen, M.,
oxidase upon single electron injection into the
Rosta, E., and Rich, P. R. (2017) Insights into func-
enzyme, Biochim. Biophys. Acta, 1777, 1129-1139,
tions of the H channel of cytochrome c oxidase from
doi: 10.1016/j.bbabio.2008.05.006.
atomistic molecular dynamics simulations, Proc. Natl.
111. Kaila, V. R., Sharma, V., and Wikström, M. (2011)
Acad. Sci. USA, 114, E10339-E10348, doi: 10.1073/
The identity of the transient proton loading site of the
pnas.1708628114.
proton-pumping mechanism of cytochrome c oxidase,
101. Wikström, M., and Verkhovsky, M. I. (2007) Mech-
Biochim. Biophys. Acta, 1807, 80-84, doi: 10.1016/
anism and energetics of proton translocation by the
j.bbabio.2010.08.014.
respiratory heme-copper oxidases, Biochim. Bio-
112. Popovic, D. M., and Stuchebryukhov, A. A. (2004)
phys. Acta, 1767, 1200-1214, doi: 10.1016/j.bbabio.
Proton pumping mechanism and catalytic cycle of
2007.06.008.
cytochrome c oxidase: Coulomb pump model with
102. Salje, J., Ludwig, B., and Richter, O.-M. H. (2005)
kinetic gating, FEBS Lett., 566, 126-130, doi: 10.1016/
Is a third proton-conducting pathway operative in
j.febslet.2004.04.016.
bacterial cytochrome c oxidase? Biochem. Soc. Trans.,
113. Lu, J., and Gunner, M. R. (2014) Characterizing the
33, 829-831, doi: 10.1042/BST0330829.
proton loading site in cytochrome c oxidase, Proc.
103. Lee, H.-m., Das, T. K., Rousseau, D. L., Mills, D.,
Natl. Acad. Sci. USA, 111, 12414-12419, doi: 10.1073/
Fergusson-Miller, S., and Gennis, R. (2000) Muta-
pnas.1407187111.
tions in the putative H-channel in the cytochrome c
114. Rich, P. R. (1995) Towards an understanding of the
oxidase from Rhodobacter sphaeroides show that
chemistry of oxygen reduction and proton transloca-
this channel is not important for proton conduc-
tion in the iron-copper respiratory oxidases, Aust. J.
tion but reveals modulation of the properties of
Plant Physiol., 22, 479-486, doi: 10.1071/PP9950479.
heme a, Biochemistry, 39, 2989-2996, doi: 10.1021/
115. Wikström, M., and Sharma, V. (2018) Proton pumping
bi9924821.
by cytochrome c oxidase - a 40 year anniversary,
104. Pfitzner, U., Odenwald, A., T.., O., Weingard, L.,
Biochim. Biophys. Acta Bioenergetics, 1859, 692-698,
Ludwig, B., and Richter, O. M. (1998) Cytochrome
doi: 10.1016/j.bbabio.2018.03.009.
c oxidase (heme aa3) from Paracoccus denitrificans:
116. Zimmermann, B. H., Nitsche, C. I., Fee, J. A.,
analysis of mutations in putative proton channels
Rusnak, F., and Munck, E. (1988) Properties of a
of subunit I, J. Bioenerg. Biomembr., 30, 89-97,
copper-containing cytochrome ba3: a second terminal
doi: 10.1023/A:1020515713103.
oxidase from the extreme thermophile Thermus Ther-
105. Kuznetsova, S. S., Azarkina, N. V., Vygodina, T. V.,
mophilus, Proc. Natl. Acad. Sci. USA, 85, 5779-5783,
Siletsky, S. A., and Konstantinov, A. A. (2005) Zink
doi: 10.1073/pnas.85.16.5779.
ions as cytochrome c oxidase inhibitors: two sites
117. Rauhamaki, V., Bloch, D. A., Verkhovsky, M. I., and
of action, Biochemistry (Moscow),
70,
128-136,
Wikström, M. (2009) Active site of cytochrome cbb3,
doi: 10.1007/s10541-005-0091-6.
J. Biol. Chem.,
284,
11301-11308, doi:
10.1074/
106. Sugitani, R., and Stuchebrukhov, A. A. (2009) Mo-
jbc.M808839200.
lecular dynamics simulation of water in cytochrome c
118. Rauhamaki, V., Bloch, D. A., and Wikström, M. (2012)
oxidase reveals two water exit pathways and the mech-
Mechanistic stoichiometry of proton translocation
anism of transport, Biochim. Biophys. Acta, 1787,
by cytochrome cbb3, Proc. Natl. Acad. Sci. USA, 109,
1140-1150, doi: 10.1016/j.bbabio.2009.04.004.
7286-7291, doi: 10.1073/pnas.1202151109.
БИОХИМИЯ том 88 вып. 10 2023
1846
СИЛЕЦКИЙ
119. Steimle, S., van Eeuwen, T., Ozturk, Y., Kim,
ing of the binuclear centre, FEBS Lett., 457, 98-102,
H. J., Braitbard, M., Selamoglu, N., Garcia, B. A.,
doi: 10.1016/S0014-5793(99)01019-4.
Schneidman-Duhovny, D., Murakami, K., and Dal-
122. Siletsky, S. A., Belevich, I., Jasaitis, A., Konstantinov,
dal, F. (2021) Cryo-EM structures of engineered ac-
A. A., Wikström, M., Soulimane, T., and Verkhovsky,
tive bc1-cbb3 type CIII2CIV super-complexes and
M. I. (2007) Time-resolved single-turnover of ba3 oxi-
electronic communication between the complex-
dase from Thermus thermophilus, Biochim. Biophys. Acta,
es, Nat. Commun., 12, 929, doi: 10.1038/s41467-
1767, 1383-1392, doi: 10.1016/j.bbabio.2007.09.010.
021-21051-4.
123. Kannt, A., Lancaster, C. R., and Michel, H. (1998)
120. Borisov, V. B., Siletsky, S. A., Nastasi, M. R., and
The coupling of electron transfer and proton translo-
Forte, E. (2021) ROS defense systems and terminal
cation: electrostatic calculations on Paracocus denitri-
oxidases in bacteria, Antioxidants (Basel), 10, 839,
ficans cytochrome c oxidase, Biophys. J., 74, 708-721,
doi: 10.3390/antiox10060839.
doi: 10.1016/S0006-3495(98)73996-7.
121. Siletskiy, S., Soulimane, T., Azarkina, N., Vygodina,
124. Rauhamaki, V., and Wikström, M. (2014) The causes
T. V., Buse, G., Kaulen, A., and Konstantinov, A.
of reduced proton-pumping efficiency in type B and
(1999) Time-resolved generation of membrane po-
C respiratory heme-copper oxidases, and in some
tential by ba3 cytochrome c oxidase from Thermus
mutated variants of type A, Biochim. Biophys. Acta,
thermophilus. Evidence for reduction-induced open-
1837, 999-1003, doi: 10.1016/j.bbabio.2014.02.020.
INVESTIGATION OF THE MECHANISM OF MEMBRANE
POTENTIAL GENERATION BY HEME-COPPER RESPIRATORY
OXIDASES IN REAL TIME MODE
Review
S. A. Siletsky
Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e-mail: siletsky@belozersky.msu.ru
Heme-copper respiratory oxidases are highly efficient molecular machines. These membrane enzymes
catalyze the final stage of cellular respiration of eukaryotes and many prokaryotes: the transfer of electrons
from cytochromes or quinols to molecular oxygen and the reduction of O2 to water. The free energy released
in this redox reaction is converted by heme-copper respiratory oxidases into a transmembrane gradient
of the electrochemical potential of hydrogen ions (ΔμH+). Heme-copper respiratory oxidases have a unique
mechanism for generation ΔμH+ - a redox-coupled proton pump. The use of a combination of a direct
electrometric method for measuring the kinetics of membrane potential generation with approaches and
methods of prestationary kinetics and directed mutagenesis in the study of heme-copper oxidases makes
it possible to obtain unique information about the movement of protons inside the protein in real time.
The review summarizes the results of the use of the permitted time.
Keywords: bioenergetics, cytochrome oxidase, proteoliposomes, electrogenic, proton transfer, generation ΔΨ,
proton pump, photoreduction, cytochrome aa3, kinetics, direct electrometric method, capacitive potentiometry,
time resolution, zinc ions
БИОХИМИЯ том 88 вып. 10 2023