БИОХИМИЯ, 2023, том 88, вып. 10, с. 1847 - 1866
УДК 577.3
СХОДСТВО И РАЗЛИЧИЕ ФОТОХИМИИ
РОДОПСИНОВ I И II ТИПОВ
Обзор
© 2023 М.А. Островский1,2, О.А. Смитиенко2, А.В. Боченкова3, Т.Б. Фельдман1,2*
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119991 Москва, Россия; электронная почта: feldmantb@mail.ru
2 Институт биохимической физики им. Н.М. Эмануэля РАН, 119334 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова, химический факультет,
119991 Москва, Россия
Поступила в редакцию 01.07.2023
После доработки 20.07.2023
Принята к публикации 12.08.2023
Разнообразие ретиналь-содержащих белков (родопсинов) в природе чрезвычайно велико. Принци-
пиальное сходство структуры и фотохимических свойств объединяет их в одно семейство. Однако
до сих пор идет дискуссия о происхождении родопсинов: дивергентная или конвергентная эволю-
ция? В обзоре на основе результатов собственных и литературных данных проведен сравнительный
анализ сходства и различий фотопревращения родопсинов I и II типов. Представлены результаты
экспериментальных исследований прямых и обратных фотореакций бактериородопсина (родоп-
сина I типа) и зрительного родопсина (родопсина II типа) в фемто- и пикосекундном интервале
времен, фотообратимой реакции родопсина осьминога (родопсина II типа), фотоэлектрических
реакций родопсинов I и II типов, а также квантово-химические расчеты прямых фотореакций. Об-
суждается вопрос о вероятной конвергентной эволюции родопсинов I и II типов.
КЛЮЧЕВЫЕ СЛОВА: ретиналь-содержащие белки, зрительный родопсин, бактериородопсин, конвер-
гентная эволюция, фотохимия, фемтосекундная спектроскопия, квантово-химические расчеты.
DOI: 10.31857/S0320972523100093, EDN: OTFNWZ
ВВЕДЕНИЕ
или конвергентной [11-15] эволюции чаша
весов, как нам представляется, склоняется в
Семейство ретиналь-содержащих бел-
пользу последней. Другими словами, предпо-
ков (РСБ) содержит три типа родопсинов:
лагается, что нет общего предка для всех трех
микробные (I тип), животные (II тип) и срав-
типов родопсинов. И если это так, то, скорее
нительно недавно обнаруженные гелиородоп-
всего, давление внешних факторов (дарвинов-
сины (III тип)
[1-7]. Несмотря на то что
ский естественный отбор) и физиологическая
функции их чрезвычайно разнообразны, прин-
потребность привели к столь удивительной по-
ципиальное сходство структуры, 7-α-спираль-
хожести столь неродственных РСБ. В этой связи
ной трансмембранной топографии белковой
сравнение и понимание эволюции каждого из
части и ретиналя в качестве хромофорной
этих типов родопсинов представляет самостоя-
группы, а также фотохимических и спек-
тельный и исключительно большой интерес. Об
тральных свойств поражают воображение.
этом свидетельствует все нарастающее число
Естественно, возникает вопрос об их эволю-
публикаций по этому поводу [3-5, 11, 16-18].
ционном происхождении. При всей противо-
Разнообразие РСБ, как сейчас становится
речивости мнений об их дивергентной [8-10] ясно, чрезвычайно велико. В настоящее время
Принятые сокращения: волновой пакет - набор когерентных возбужденных колебательных состояний; ППЭ -
поверхность потенциальной энергии; РСБ - ретиналь-содержащие белки; РПШО - протонированное шиффово
основание ретиналя; ТМ - трансмембранная спираль; ф/и - фотоиндуцированный; BR - бактериородопсин археи
Halobacterium salinarum; CI - коническое пересечение ППЭ; FC - франк-кондоновское состояние; HOOP - вне-
плоскостные колебания атомов водорода; Rh - зрительный родопсин быка Bos taurus.
* Адресат для корреспонденции.
1847
1848
ОСТРОВСКИЙ и др.
они обнаружены во всех доменах живой при-
ской реакции изомеризации хромофора, лежа-
роды - бактериях, археях и эукариотах, а так-
щей в основе функционирования всех РСБ.
же в гигантских вирусах. Родопсины I типа
Рассматривая роль ближайшего белкового
характерны для бактерий, архей, вирусов и
окружения РПШО в хромофорном центре
низших эукариот; они очень разнообразны по
опсина, допустимо говорить о белковом ката-
выполняемым функциям, основные из кото-
лизе процесса фотоизомеризации. При этом
рых - фотоэнергетическая (ионные насосы)
вопрос о природе взаимодействия белок-хро-
и фотоинформационная (сенсорные род-
мофор - стерическом, электростатическом,
опсины, катионные и анионные каналы) [6].
водородном и гидрофобном - остается пред-
Родопсины II типа характерны для высших
метом активного изучения [20].
животных, в большинстве случаев они пред-
Что касается топологии в мембране бел-
ставляют собой специализированные G-бе-
ковой части молекулы, то если в родопсинах
лок-связывающие рецепторы, которые обес-
I и II типов N-конец обращен наружу клетки,
печивают в основном фотоинформационные
а С-конец - внутрь, в родопсинах III типа на-
функции, основная из которых - зритель-
блюдается противоположное расположение,
ная [1, 2]. Родопсины III типа широко рас-
при котором N-конец обращен внутрь клетки,
пространены в живых организмах из тех же
а С-конец - наружу [4, 7, 21]. Причина и биоло-
доменов, что и родопсины I типа, и, предпо-
гический смысл такого расположения родопси-
ложительно, выполняют фотоинформационную
нов III типа в мембране клетки остаются неяс-
функцию [7].
ными. Удивительно и то, что «перевернутая»
Изначально термин родопсин относился
топология белковой части молекулы обнару-
только к зрительному белку. Открытый в 1876 г.
жена и у обонятельных G-белок-связывающих
Ференцем Боллем (Ferenz Boll), он был назван
рецепторов насекомых [22].
«зрительным веществом» (Sehestoff), затем в
Родопсины эубактерий и архей I типа,
силу своего цвета - «зрительным пурпуром»
включая бактериородопсин, осуществляющий
(Sehpurpur) и позже - родопсином от грече-
простейший фотосинтез, - одни из самых
ских слов: «rhodo» - розовый и «opsis» - видеть.
древних белков биосферы, они возникли в
Открытый Уолтером Стоккениусом (Walther
клетках прокариот около 3,8 млрд лет назад.
Stoeckenius) и Дитером Остерхельтом (Dieter
Родопсины одноклеточных эукариот I типа
Oesterhelt) почти 100 лет спустя РСБ - протон-
возникли около 3,2 млрд лет назад, в то вре-
ный насос галофильной археи Halobacterium
мя как родопсины высших животных II типа,
salinarum, был назван ими по аналогии со
включая зрительный родопсин, появились в
зрительным родопсином - бактериородопси-
многоклеточных эукариотах менее 1 млрд лет
ном [19]. В настоящее время название родоп-
назад [5, 11, 18, 23-25].
сины распространилось на все семейство РСБ
В рамках теории конвергентной эволю-
I, II и III типов. Общим для них являются,
ции родопсинов предполагается, что пред-
во-первых, структура апо-белка
- опсина,
шественниками микробных родопсинов были
с его семью трансмембранными α-спираль-
лизосомальные переносчики цистеина, име-
ными «тяжами» и, во-вторых, кофактор (хро-
ющие 7-α-спиральную структуру [15]. Пред-
мофор)
- ретиналь, поглощающий кванты
шественниками животных родопсинов были,
света. Становится все более очевидным, что
как считается, cAMP-зависимые G-белок-свя-
7-α-спиральный белковый каркас РСБ и кон-
зывающие рецепторы с классической 7-α-спи-
сервативен, и одновременно необыкновенно
ральной структурой, то есть не содержащие
пластичен. Что касается ретиналя, то он, как
ретиналь рецепторы [12-14], а ретиналь в ка-
правило, ковалентно связан протонирован-
честве хромофора был «вставлен» в хромофор-
ным шиффовым основанием (РПШО) с лизи-
ный центр зрительных опсинов позже.
новым аминокислотным остатком опсина в
В рамках теории дивергентной эволюции
седьмой трансмембранной α-спирали (ТМ7)
в одной из работ предполагается, что сна-
и находится в полностью-транс (родопсины
чала из cAMP-рецепторов произошли родоп-
I и III типов) или 11-цис (родопсины II типа)
сины II типа (как и другие G-белок-связы-
изомерной форме. Следует подчеркнуть, что
вающие рецепторы класса А), от которых
хромофорный центр - это наиболее консерва-
затем произошли родопсины I типа путем
тивный домен опсина. Ближайшее белковое
горизонтального переноса генов от эукариот
окружение РПШО является принципиально
к прокариотам [9]. В другой работе, исходя
важным как для спектральной настройки мо-
из оптимизации электронных свойств хро-
лекулы родопсина, так и для осуществления
мофора, невзирая при этом на явное раз-
сверхбыстрой и эффективной фотохимиче-
личие аминокислотных последовательностей,
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1849
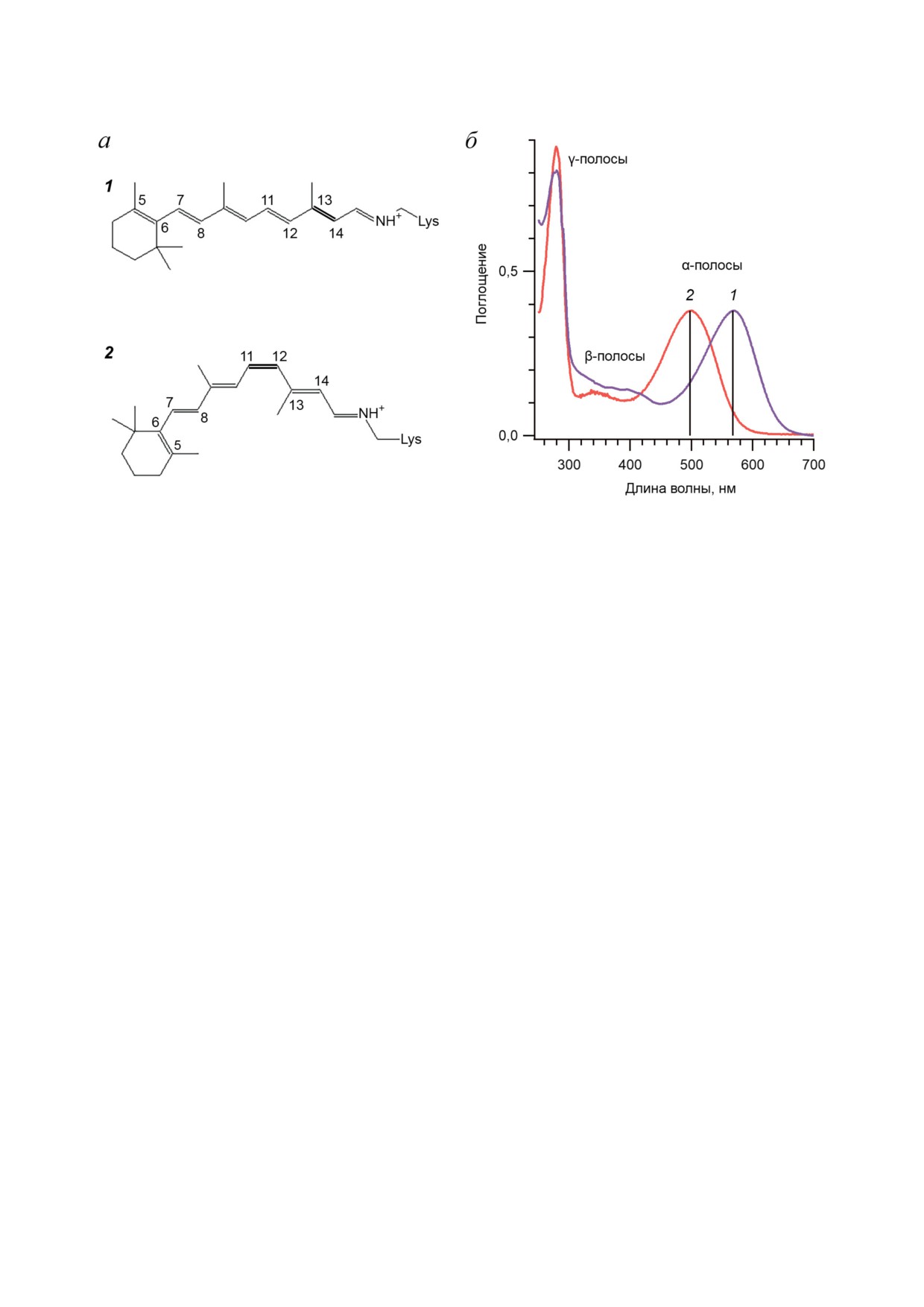
Рис. 1. Физико-химические характеристики хромофорной группы родопсинов I и II типов. а - Химические структуры
хромофорной группы родопсинов - полностью-транс РПШО в родопсинах I типа (1) и 6-s-цис-11-цис РПШО в род-
опсинах II типа (2). Реакционная связь выделена жирным. б - Нормированные по α-полосе стационарные спектры
поглощения суспензии пурпурных мембран, содержащих бактериородопсин археи Halobacterium salinarum (BR) (1), и
детергентного экстракта зрительного родопсина быка Bos taurus (Rh) (2)
авторы предполагают существование дивер-
СРАВНЕНИЕ ПЕРВИЧНЫХ
гентного пути эволюции, но уже от родопси-
РЕАКЦИЙ ФОТОПРЕВРАЩЕНИЯ
нов I типа к родопсинам II типа [8]. Еще в
РОДОПСИНОВ I И II ТИПОВ
одной работе, сравнивая структуры Na-связы-
вающего центра в консервативном ароматиче-
В основе функционирования родопсинов
ском остатке в TM6 и функционально важный
лежит фотохимическая реакция изомериза-
наклон этой спирали в микробных родопсинах
ции хромофорной группы РПШО (полно-
и G-белок-связывающих рецепторах, авторы
стью-транс → 13-цис в родопсинах I типа и
приходят к предположению об их общем про-
11-цис → полностью-транс в родопсинах II ти-
исхождении [10].
па) (рис. 1, а) [1, 2, 26-30]. Фотореакция про-
Что касается недавно обнаруженных род-
текает в возбужденном состоянии и характе-
опсинов III типа, то их происхождение оста-
ризуется уникальными параметрами, которые
ется загадкой. По мнению авторов одной из
определяются как химическими свойствами
работ, гелиородопсины произошли от эукарио-
самого хромофора, так и влиянием белково-
тических родопсинов II типа, впоследствии
го окружения на хромофор [26, 31-33]. При
были захвачены гигантскими вирусами и пере-
этом энергия кванта света запасается путем
шли в клетки прокариот [16]. Это предпола-
образования напряженной, сильно скручен-
гает, как и в одной из гипотез происхождения
ной конфигурации изомеризованного РПШО
родопсинов I типа [9], необычную направлен-
в хромофорном центре
[34]. Кроме того,
ность эволюции от эукариот к прокариотам.
в случае родопсинов I типа дополнительный
Как бы то ни было, совокупность накоп-
вклад в запасание энергии кванта света вно-
ленных к настоящему времени данных позво-
сит изменение структуры водородных связей
ляет предпочесть представление о конвергент-
в области РПШО [27]. Эти процессы проте-
ной, независимой эволюции всех трех типов
кают в фемто- и раннем пикосекундном вре-
РСБ I, II и III типов. В данном обзоре рас-
менны х диапазонах [27]. Далее, происходит
сматривается сходство и различие молекуляр-
переход напряженной конфигурации хромо-
ных механизмов фотохимической реакции в
фора в отрелаксированное состояние с высво-
родопсинах I и II типов. На основании наших
бождением запасенной энергии, что, в свою
собственных экспериментальных данных и
очередь, приводит к перестройке его бли-
квантово-химических расчетов приводятся
жайшего белкового окружения в хромофор-
доводы в пользу конвергентной эволюции РСБ.
ном центре. Этот процесс в конечном итоге
БИОХИМИЯ том 88 вып. 10 2023
1850
ОСТРОВСКИЙ и др.
запускает глобальные структурные изменения
фемтосекундном временно м диапазоне, - это
во всей белковой части молекулы, необходи-
поглощение и вынужденное испускание из
мые для ее функционирования.
возбужденного состояния S1 (рис. 2, а (2 и 3);
В данном разделе обзора рассматрива-
рис. 2, б (2)). Далее, эти сигналы сменяются
ются механизмы фотоиндуцированных (ф/и)
поглощением первого фотопродукта, находя-
реакций родопсинов I и II типов на примере
щегося в основном электронном состоянии S0,
наиболее изученных представителей этих двух
а в области поглощения исходного состоя-
классов РСБ - протонного насоса бактерио-
ния родопсина проявляется отрицательная
родопсина археи H. salinarum (BR) и G-белок-
полоса выцветания (рис. 2, а (5), 600-700 нм;
связывающего зрительного родопсина быка
рис. 2, б (4), 540-700 нм). В течение несколь-
Bos taurus (Rh).
ких пикосекунд полоса поглощения первого
На рис. 1, б представлены стационарные
фотопродукта немного сдвигается в коротко-
спектры поглощения BR и Rh, которые состо-
волновую область, что отражает образование
ят из α-, β- и γ-полос, последняя из которых
следующего продукта в результате процес-
определяется поглощением опсина и имеет
сов колебательной релаксации хромофорной
максимум при 280 нм. α- и β-полосы связаны
группы и ее ближайшего аминокислотного
с поглощением РПШО в составе хромофорного
окружения (рис. 2, а (6); рис. 2, б (6)). Часть
центра. При этом в зависимости от изомерной
возбужденных молекул BR и Rh возвраща-
формы, протонирования шиффова основа-
ется в исходное состояние с неизомеризован-
ния и особенностей строения хромофорного
ным РПШО, что определяет квантовый выход
центра спектральные, фотохимические и ряд
реакции.
других функционально важных свойств моле-
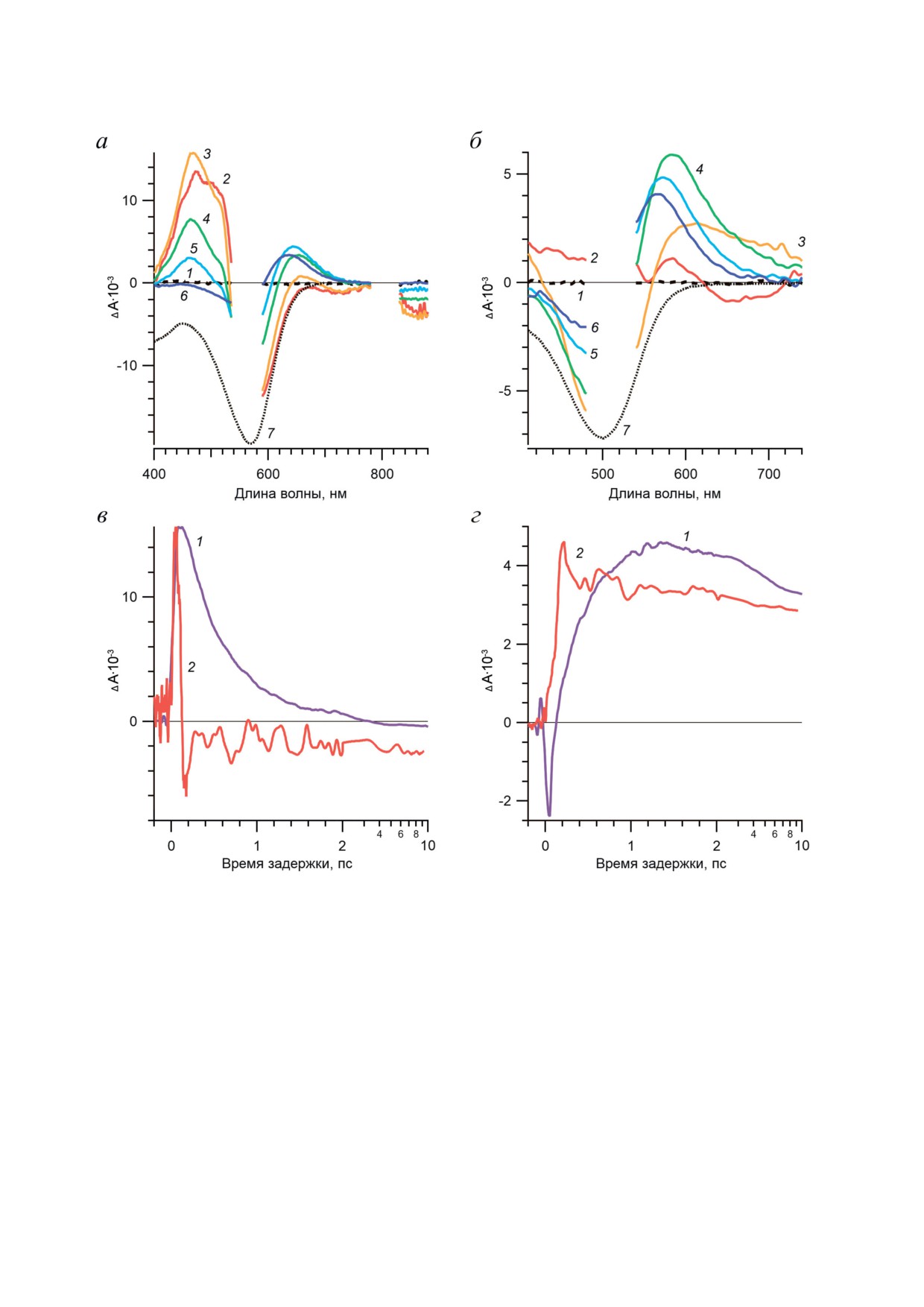
Сравнительный анализ спектров ф/и-по-
кулы меняются самым существенным обра-
глощения BR и Rh показывает различия как в
зом [35]. Положение α-полосы поглощения
положении полос поглощения и вынужденно-
определяет спектральный диапазон функ-
го испускания, так и во времени образования
ционирования родопсинов (300-700 нм) [2].
первичных продуктов. В случае BR сигналы из
В случае BR максимум положения α-полосы -
возбужденного состояния (I460) возникают ко
568 нм (рис. 1, б (1)), а в случае Rh - 498 нм
времени задержки 100 фс (рис. 2, а (2 и 3); 400-
(рис. 1, б (2)). На положение максимума погло-
540 нм и 700-880 нм) [42-44]. В течение 1 пс
щения РПШО большое влияние оказывает
эти сигналы практически полностью исчезают
положение β-иононового кольца [36]. В BR
и сменяются положительным сигналом погло-
хромофорная группа имеет плоскую транс-
щения первого продукта (J625) (рис. 2, а (5)),
конфигурацию связей С5 = С6 и С7 = С8 отно-
содержащего РПШО в 13-цис-конфигурации.
сительно одинарной связи С6 - С7 (6-s-транс;
Следующий продукт (K590) образуется в пико-
рис. 1, а (1)), тогда как в Rh - цис-конфигура-
секундном масштабе времени (рис. 2, а (6)).
цию (6-s-цис; рис. 1, а (2)), которая является
В случае Rh сигналы из возбужденного
неплоской из-за стерических затруднений, что
состояния (Rh510) возникают за время < 30 фс
приводит к уменьшению длины цепи сопряже-
(рис. 2, б (2); 410-480 нм и 620-720 нм) [41, 42],
ния хромофора и сдвигу максимума поглоще-
что значительно быстрее, чем в BR. Ко вре-
ния Rh в более коротковолновую область.
мени задержки 100 фс эти сигналы уже исче-
Прямые фотореакции родопсинов I и
зают и сменяются положительным сигналом
II типов. При поглощении кванта света про-
поглощения первого продукта (Фото570), кото-
исходит фотохимическая реакция изомериза-
рый окончательно образуется к 200 фс после
ции РПШО и образуются первичные фотопро-
поглощения кванта света (рис. 2, б (3 и 4)) [37,
дукты, обладающие спектральными свойствами,
38, 41, 42]. Следующий продукт (Бато535) об-
отличными от исходного состояния. В данном
разуется в течение нескольких пикосекунд
обзоре представлены наши собственные ре-
(рис. 2, б (5 и 6)).
зультаты по динамике первичных процессов
На рис. 2 приведены кинетические кри-
фотопревращения BR и Rh, полученные мето-
вые ф/и-поглощения BR и Rh, отражающие
дом фемтосекундной абсорбционной лазерной
образование и распад возбужденного состоя-
спектроскопии [37-46] и дополненные данны-
ния (I460 и Rh510 соответственно; рис. 2, в) и
ми квантово-химических расчетов [32, 47-50].
образование первого продукта фотореак-
На рис. 2 представлены дифференциаль-
ции (J625 и Фото570 соответственно; рис. 2, г).
ные спектры и кинетические кривые ф/и-по-
В случае Rh фотореакция протекает значи-
глощения BR и Rh, полученные на временах
тельно быстрее (60 фс) по сравнению с BR
задержки зондирующего импульса до 10 пс.
(480 фс) [40, 42-44], что хорошо согласуется
Первые ф/и-сигналы, наблюдаемые в раннем
с данными работ Kochendoerfer и Mathies [51],
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1851
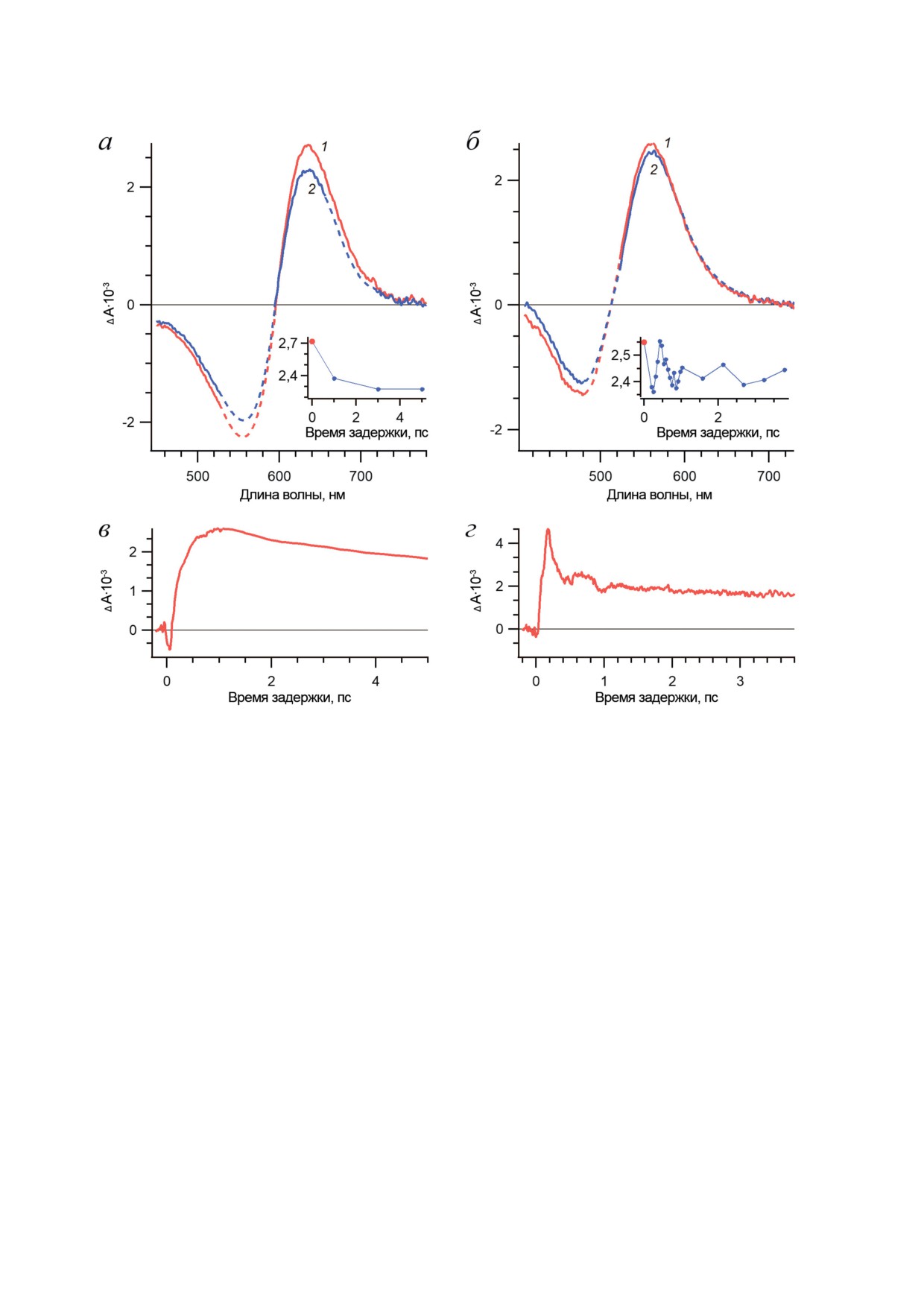
Рис. 2. Прямые фотореакции BR и Rh. а - Спектры ф/и-поглощения BR, зарегистрированные на временах задержки:
-0,2 (1), 0,05 (2), 0,12 (3), 0,5 (4), 1 (5) и 10 (6) пс. б - Спектры ф/и-поглощения Rh, зарегистрированные на време-
нах задержки: -0,2 (1), 0,03 (2), 0,1 (3), 0,2 (4), 0,8 (5) и 10 (6) пс. Стационарные спектры поглощения BR (а) и Rh (б)
представлены с обратным знаком (7). в, г - Нормированные кинетические кривые ф/и-поглощения BR (1) и Rh (2),
зарегистрированные в полосе поглощения возбужденного состояния (в) на длинах волн зондирования 470 (BR)
и 410 (Rh) нм и в полосе поглощения продукта фотореакции (г) на длинах волн зондирования 640 (BR) и 580 (Rh) нм.
Кинетические кривые представлены в линейном масштабе времени задержки до 2 пс и далее - в логарифмическом
масштабе. Рисунок адаптирован с разрешения [44]
Polli et al. [52] и Johnson et al. [53, 54]. Время
распад приводит к образованию только исход-
образования второго продукта реакции BR
ного состояния РСБ, поэтому такой путь рас-
(K590) оценивается в 1,8 пс, а второго продук-
пада называется нереакционным [44]. Нали-
та реакции Rh (Бато535) - в 2,2 пс [44]. Анализ
чие нескольких путей распада возбужденного
динамики распада возбужденного состояния
состояния, некоторые из которых могут быть
(как Rh, так и BR) показывает, что в неболь-
нереакционными, в целом характерно для род-
шой доле молекул (≈4%) возбужденное со-
опсинов I типа [55-58] и в меньшей степени -
стояние живет гораздо дольше (2,4 пс), а его
для родопсинов II типа [59]. Это связывают
БИОХИМИЯ том 88 вып. 10 2023
1852
ОСТРОВСКИЙ и др.
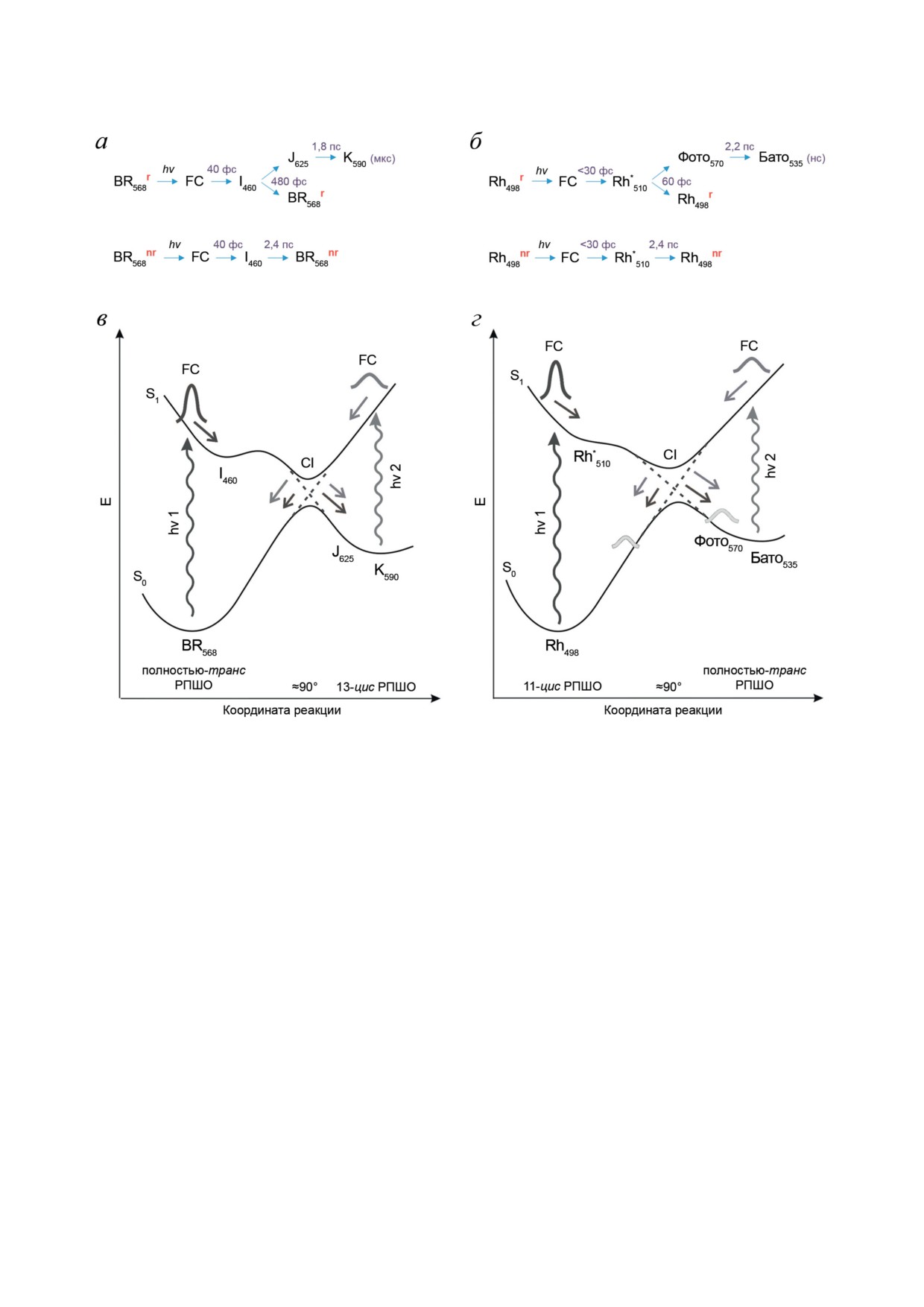
Рис. 3. Кинетические схемы элементарной реакции фотоизомеризации в родопсине I типа - BR (а) и в родопсине
II типа - Rh (б). На схемах приведены времена жизни промежуточных состояний и указаны реакционные (индекс «r»)
и нереакционные (индекс «nr») пути распада возбужденного состояния. Строение поверхностей потенциальной энер-
гии (S0 и S1) родопсинов I типа на примере BR (в) и родопсинов II типа на примере Rh (г), показывающее реакцион-
ный путь их прямой (темно-серый цвет) и обратной (серый цвет) фотореакций в фемто- и пикосекундном диапазонах
времен. FC - франк-кондоновское состояние; CI - коническое пересечение. Рисунок адаптирован с разрешения [42]
с разделением путей реакции во франк-кон-
ется наличие осцилляционной составляющей
доновском состоянии (FC) или с исходной ге-
в ее динамике на ранних временах [29, 42,
терогенностью белковой части молекулы [28,
53, 63, 64]. Фазы и амплитуды этих осцил-
60]. Последнее предположение было подтвер-
ляций позволили интерпретировать их воз-
ждено для натриевого насоса KR2 бактерии
никновение как результат нестационарного
Krokinobacter eikastus [49, 57] и для протонных
колебательного движения в возбужденном и
насосов протеородопсина и BR [58]. Соотно-
основном электронных состояниях реагента
шение доли возбужденных молекул, претерпе-
и продуктов реакции. В фотохимических ре-
вающих изомеризацию, и доли возбужденных
акциях такого типа, вопреки классическим
молекул, возвращающихся в исходное состоя-
представлениям, образование продукта проис-
ние по реакционному и нереакционному пу-
ходит как результат согласованного движения
тям, определяет квантовый выход изомери-
ядер молекулы и завершается быстрее процес-
зации, который составляет 0,64 для BR [61] и
сов колебательной релаксации и дефазировки
0,65 - для Rh [62]. Кинетическая схема и вре-
различных колебательных состояний в воз-
мена наблюдаемых процессов представлены
бужденном состоянии [65, 66]. Такие реакции
на рис. 3, а и б.
называются когерентными и могут быть опи-
Отличительной особенностью фотореак-
саны как движение волнового пакета (набо-
ции РПШО в родопсинах и в растворе явля- ра когерентных возбужденных колебательных
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1853
состояний) сначала по S1, а потом по S0-по-
≈60 фс достигает области CI, где разделяется
верхности потенциальной энергии (ППЭ)
на два подпакета. Первый подпакет двига-
вдоль координаты реакции. Такой быстрый
ется по S0 ППЭ Фото570, что сопровождается
переход S1 → S0 возможен из-за наличия мно-
колебательной релаксацией этого продукта и
гомерной области конического пересечения
отражается в ярко выраженных осцилляциях
(conical intersection, CI) S1/S0 ППЭ, благодаря
кинетических кривых (рис. 2, г), а второй под-
которой происходит эффективное и сверхбы-
пакет переходит на S0 ППЭ исходного состоя-
строе преобразование энергии квантов света в
ния Rh498, где также продолжает свое движе-
химическую энергию [31, 67].
ние. Таким образом, переход S1 → S0 волнового
Основные отличия динамики прямых фо-
пакета в процессе фотореакции Rh происходит
тореакций BR и Rh связаны со строением S0, S1
быстро, направленно и безбарьерно с сохране-
и S2 ППЭ реакционных форм этих родопсинов
нием значительной доли когерентности [37, 38,
(рис. 3, в и г), которое определяется как изо-
42, 63]. Такой тип динамики называется бал-
мерной формой РПШО, так и влиянием на хро-
листическим или импульсным [26, 70].
мофор специфического белкового окружения.
Для объяснения различий в динамике про-
В случае BR, как и других родопсинов
текания ф/и-процессов и специфичности реак-
I типа, прямая фотореакция описывается моде-
ции фотоизомеризации в BR и Rh были прове-
лью трех состояний (S0, S1 и S2) [26, 28, 55, 68],
дены квантово-химические расчеты структуры
постулирующей наличие небольшого барьера
этих РСБ и проведен анализ активности коле-
на пути распада возбужденного состояния S1
бательных мод при фотовозбуждении S0 → S1 и
из-за взаимодействия с S2 ППЭ, что силь-
их связи с реакционными модами при безыз-
но влияет на динамику реакции (рис. 3, в).
лучательном переходе S1 → S0.
При возбуждении молекулы BR на S1 ППЭ
На рис. 4 показаны оптимизированные
образуется состояние FC, которое в резуль-
структуры полностью-транс и 11-цис РПШО
тате движения волнового пакета вдоль полно-
в основном электронном состоянии в бел-
симметричных (C=C и С-С) колебательных
ковом окружении BR и Rh соответственно,
мод РПШО за время 40 фс переходит в воз-
полученные при помощи комбинированного
бужденное состояние I460. Далее волновой па-
метода квантовой и молекулярной механи-
кет начинает двигаться вдоль реакционных ко-
ки (КМ/ММ) [48].
лебательных мод - внеплоскостных колебаний
В белковом окружении хромофоры оказы-
атомов водорода H-C=C-H (hydrogen-out-of-
ваются существенно скрученными по реак-
plane, HOOP) и торсионных колебаний и, пре-
ционным связям (рис. 4, а и в). При этом вне
одолевая небольшой барьер на S1 ППЭ, до-
белкового окружения такая скрученность отсут-
стигает области CI с характерным временем
ствует и π-сопряженная система является пло-
480 фс. В области CI волновой пакет раз-
ской за исключением двойной связи β-ионо-
деляется на два подпакета, один из которых
нового кольца. Эта связь в зависимости от
переходит на S0 ППЭ продукта J625, а вто-
конфигурации РПШО либо лежит в плоско-
рой - на S0 ППЭ исходного состояния BR568.
сти сопряжения остальных пяти двойных свя-
В результате преодоления барьера на S1 ППЭ
зей (6-s-транс; рис. 1, а (1)), либо выходит из
волновой пакет сильно теряет свои когерент-
плоскости сопряжения (6-s-цис; рис. 1, а (2)).
ные свойства, что видно по отсутствию ярко
Необходимо отметить, что в белковом окруже-
выраженных осцилляций во времяразрешен-
нии угол выхода двойной связи β-иононового
ных сигналах поглощения первого продук-
кольца из плоскости сопряжения в BR прак-
та J625 (рис. 2, г (1)) [29, 42-44, 55, 56]. Такой
тически не меняется, тогда как в Rh он значи-
тип динамики называется диффузным [26].
тельно увеличивается [48].
В случае Rh, как и других родопсинов
Таким образом, белковое окружение дей-
II типа, прямая фотореакция описывается мо-
ствительно способствует изменению конфор-
делью двух состояний (S0 и S1) (рис. 3, г) [2, 26,
мации и «скручиванию» хромофорной группы,
28, 69]. В результате возбуждения молекулы Rh
что обусловлено ее взаимодействием с ближай-
на S1 ППЭ образуется состояние FC, которое
шими аминокислотными остатками в хромо-
меньше чем за 30 фс переходит в возбужден-
форном центре. Это связано главным образом
ное состояние Rh510, как результат движения
с образованием водородных связей между про-
волнового пакета вдоль полносимметричных
тонированным шиффовым основанием и пер-
(С=С и С-С) колебательных мод РПШО, как
вичным противоионом, что сильно влияет на
и в случае BR. Далее волновой пакет двигается
торсионный угол реакционной связи. Кроме
вдоль реакционных внеплоскостных (HOOP
того, речь идет и о стерических взаимодействи-
и торсионных) колебательных мод, через
ях в области β-иононового кольца ретиналя.
БИОХИМИЯ том 88 вып. 10 2023
1854
ОСТРОВСКИЙ и др.
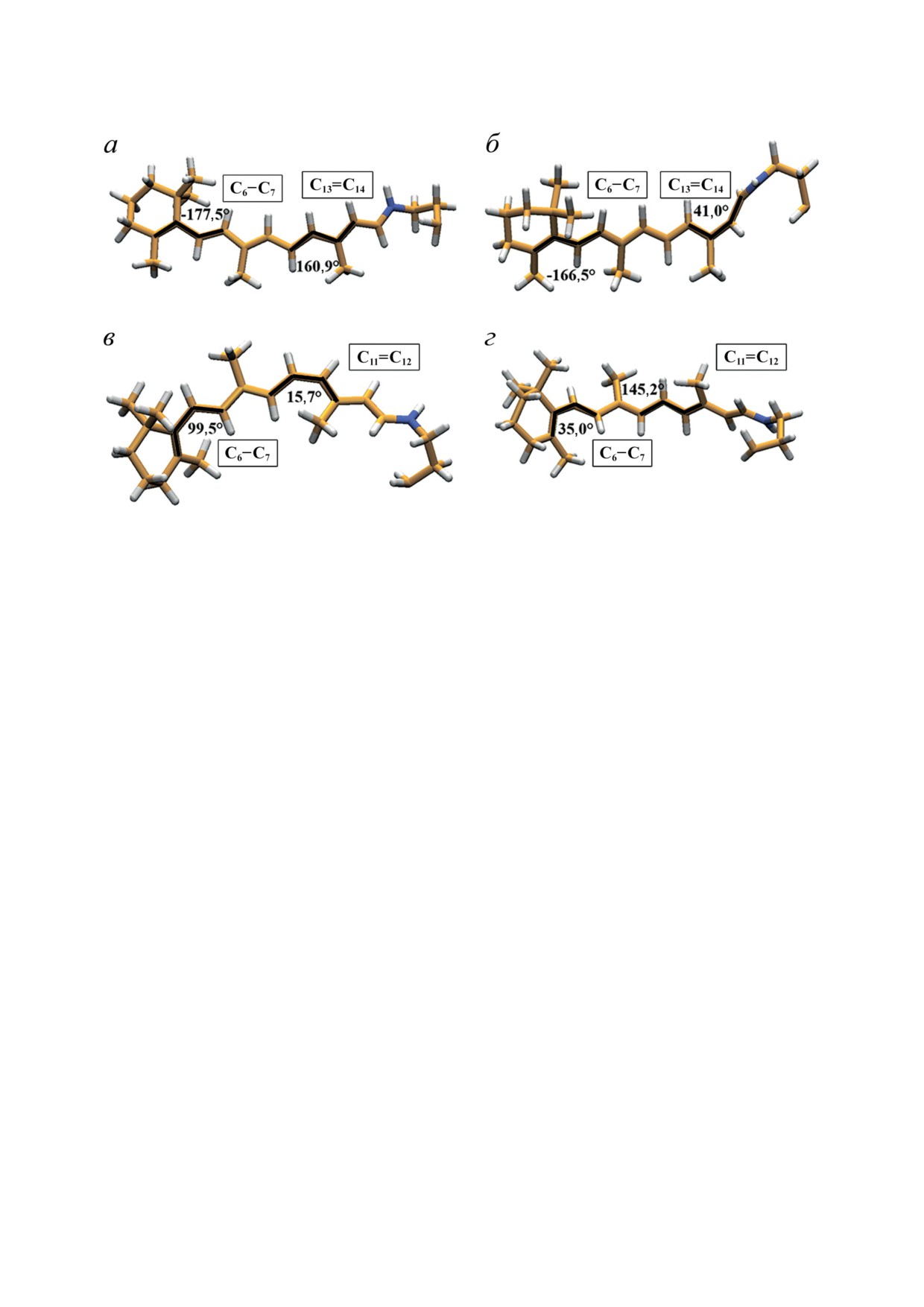
Рис. 4. Оптимизированные структуры реагентов и первичных фотопродуктов BR и Rh - полностью-транс РПШО
в BR568 (а), 13-цис РПШО в K590 (б), 11-цис РПШО в Rh498 (в) и полностью-транс РПШО в Бато535 (г). Черными линия-
ми обозначены двугранные углы, их значения приведены на рисунке
Как и ожидалось, геометрии первичных фото-
терпевает существенные изменения. Таким
продуктов оказываются еще более скручен-
образом, конформация β-иононового кольца
ными по реакционным связям из-за их не-
оказывается менее значимой в родопсинах
релаксированности в белковом окружении,
I типа по сравнению с родопсинами II типа.
которое на пикосекундных временах еще оста-
О влиянии скрученности по реакционным
ется более оптимальным для исходных изоме-
связям различных изомеров РПШО на дина-
ров РПШО (рис. 4, б и г).
мику фотоизомеризации в белковом окруже-
Интересно отметить, что в газовой фазе
нии можно также судить, исходя из сравне-
барьер вращения по одинарной связи С6-С7
ния их с фотооткликом в газовой фазе. Как
не превышает 3 ккал/моль [50], что обуслов-
было отмечено выше, в изолированном со-
ливает практически свободный переход между
стоянии изомеры РПШО обладают плоской
конформациями 6-s-транс и 6-s-цис РПШО.
структурой основной части π-сопряженной
Как было отмечено выше, длина цепи π-сопря-
системы. С помощью экспериментов в газо-
жения является важным фактором, влияющим
вой фазе с фемтосекундным временным раз-
на положение длины волны максимума по-
решением и квантово-химических расчетов
глощения. Внутримолекулярное вращение по
было показано, что динамика релаксации
одинарной связи С6-С7 приводит к аномаль-
электронно-возбужденного состояния S1 11-цис-
но широкому спектру поглощения изомеров
изомера РПШО проходит на субпикосекунд-
РПШО в газовой фазе [71], тогда как белковое
ных временах (400 фс) [32] и сопоставима со
окружение может легко влиять на конформа-
сверхбыстрыми временами фотоизомеризации
цию РПШО в области β-иононового кольца и,
хромофора в Rh (50-100 фс) [40, 42, 51-54].
в зависимости от величины двугранного угла
При этом специфичность реакции и средние
по связи С6-С7, регулировать длину цепи π-со-
времена жизни возбужденного состояния пол-
пряжения в хромофоре, тем самым настраивая
ностью-транс-изомера РПШО значительно
его поглощение на определенный диапазон.
различаются в изолированном состоянии (3 пс)
Такой механизм регуляции фотофизических
[32] и белковом окружении BR (≈500 фс) [29,
свойств РПШО может лежать в основе спек-
55, 56, 58]. Важно отметить, что в газовой
тральной настройки родопсинов II типа. При-
фазе фотоизомеризация плоского полностью-
мечательно, что в BR положение β-иононового
транс-изомера РПШО происходит медленно,
кольца не меняется ни по сравнению с газовой
но селективно. Наименьший барьер изомери-
фазой, ни при переходе в первичные фотопро-
зации в состоянии S1 наблюдается в случае
дукты, тогда как в Rh его конформация пре-
связи С11=С12, а не связи С13=С14, как в BR.
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1855
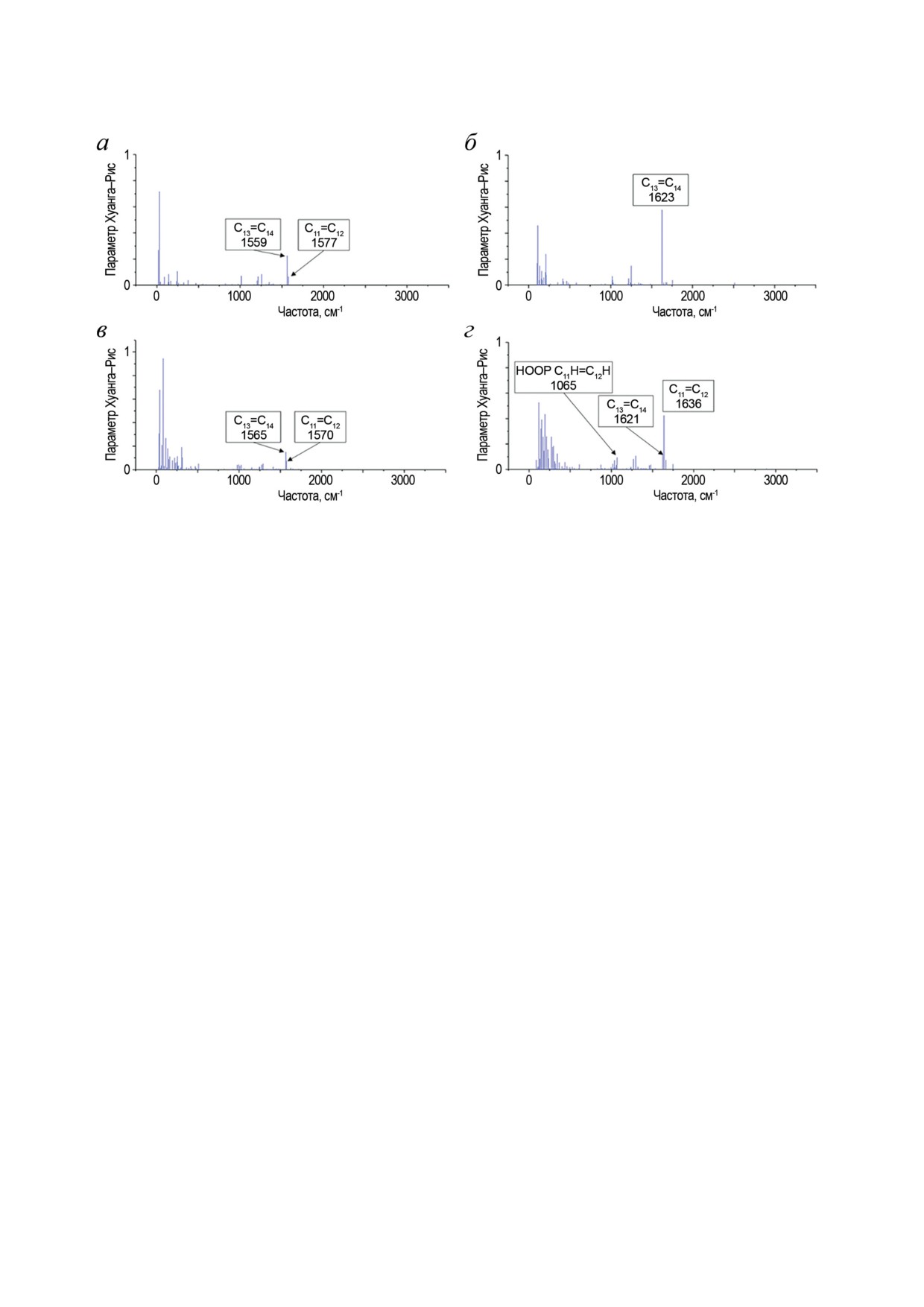
Рис. 5. Активность колебательных мод РПШО при переходе S0 → S1 в газовой фазе и белковом окружении: полностью-
транс РПШО в газовой фазе (а) и в BR568 (б); 11-цис РПШО в газовой фазе (в) и в Rh498 (г)
Таким образом, влияние белкового окру-
вое окружение BR способствует возбуждению
жения является ключевым в случае родопсинов
колебаний связи С13=С14, тогда как в случае Rh
I типа. В случае же родопсинов II типа исполь-
белковое окружение способствует возбужде-
зуется более совершенный, с точки зрения фо-
нию колебаний связи С11=С12. Об активности
тохимических свойств, 11-цис-изомер РПШО.
колебательных мод при фотовозбуждении мож-
При этом в Rh реакция идет на сверхкоротких
но судить по смещениям минимумов ППЭ со-
временах, что также говорит о важном влия-
стояний S0 и S1 вдоль этих мод. Смещения ха-
нии белкового окружения в хромофорном
рактеризуют изменения геометрии хромофора
центре. Это отличие приводит к протеканию
в S1-состоянии по сравнению с S0. Определен-
первичной фотохимической реакции в родоп-
ное колебание будет тем активнее при фото-
синах II типа в ярко выраженном когерентном
возбуждении, чем больше смещение вдоль
режиме.
этой моды. Удобным безразмерным парамет-
Влияние конформации реакционных свя-
ром, по которому можно судить об активности
зей РПШО на динамику фотоизомеризации
колебательной моды при электронном пере-
независимо подтверждено и при изучении
ходе, является так называемый фактор Хуанга-
химически модифицированного полностью-
Рис, который связан с квадратом смещения
транс-хромофора, скрученного по одной из
вдоль нормальной моды в гармоническом при-
двойных связей. Изменение конформации
ближении. На рис. 5 представлены факторы
РПШО по реакционной связи приводит к
Хуанга-Рис для полностью-транс и
11-цис
значительному уменьшению величины барь-
РПШО в белковом окружении и газовой фазе,
ера фотоизомеризации и к субпикосекундным
рассчитанные при помощи метода КМ/ММ
временам, что характерно для реакции в бел-
с использованием многоконфигурационной
ковом окружении [47].
квазивырожденной теории возмущений вто-
Скрученность по реакционной связи в
рого порядка [48, 49].
электронном состоянии S0 не только изменяет
В газовой фазе у плоских изомеров пол-
топографию ППЭ в состоянии S1, уменьшая
ностью-транс и 11-цис РПШО при возбужде-
барьер фотоизомеризации, но и способствует
нии в состояние S1 активны два высокочастот-
одновременному возбуждению определенных
ных валентных колебания связей C11=C12 и
колебательных мод при переходе S0 → S1 [48, 49].
C13=C14. В случае BR активность колебатель-
Происходит возбуждение как валентных ко-
ной моды, локализованной на связи С13=С14,
лебаний, локализованных преимущественно
становится значительно больше по сравнению
на реакционной двойной связи, так и HOOP-
с газовой фазой, а валентное колебание связи
колебаний при этой связи. При этом белко-
C11=C12 полностью пропадает. В случае же Rh,
БИОХИМИЯ том 88 вып. 10 2023
1856
ОСТРОВСКИЙ и др.
наоборот, интенсивность моды, связанной с
Фотохромизм родопсинов I и II типов. Ро-
колебаниями связи C11=C12, заметно увеличи-
допсины обладают фотохромными свой-
вается, а интенсивность моды C13=C14 умень-
ствами [30, 34, 61, 72], то есть способностью
шается. Более того, в Rh также становятся
осуществлять фотопереходы из промежуточ-
активными внеплоскостные HOOP-колебания
ных продуктов прямой фотореакции обрат-
атомов водорода при связи C11=C12.
но в исходное состояние. Эта способность,
Таким образом, увеличение скрученности
реализуемая в природе в ряде родопсинов,
по реакционной связи способствует увеличе-
начиная с наносекундного временно го диа-
нию активности соответствующего валентно-
пазона, служит для выполнения определен-
го колебания при фотовозбуждении. Следует
ных физиологических функций в таких ро-
отметить, что специфичность фотоотклика
допсинах I типа, как сенсорный родопсин I
РПШО и активность колебаний, способству-
H. salinarum [73], сенсорный родопсин циано-
ющих фотоизомеризации по определенной
бактерии Anabaena sp. [29] и канальный родоп-
двойной связи (в данном случае валентные и
син одноклеточной зеленой водоросли Chlamy-
HOOP-колебания), в большей степени харак-
domonas reinhardtii [74] и в таких родопсинах
терны именно для Rh. Это коррелирует с очень
II типа, как зрительные родопсины беспозво-
высокой скоростью фотохимической реакции
ночных [75-77] и близкородственные им ме-
в этом родопсине II типа. Важным фактором
ланопсины позвоночных [78].
также является возможность возбуждения раз-
Несмотря на то что на первых стадиях
личного типа реакционных мод в одинаковой
фотопревращения родопсинов обратные фо-
фазе, что способствует когерентному протека-
топереходы в природе практически не реали-
нию реакции в Rh.
зуются, тем не менее изучение такого сверх-
Таким образом, результаты квантово-хи-
быстрого фотохромизма в условиях in vitro
мических расчетов позволили объяснить обна-
может дать дополнительные сведения о моле-
руженную экспериментально разницу в дина-
кулярных механизмах фотохимической реак-
мике протекания ф/и-процессов в BR и Rh.
ции этих РСБ. В данном обзоре представлены
Основным фактором, влияющим на эти про-
результаты наших исследований по изучению
цессы и определяющим различие в динамике
обратной фотореакции BR и Rh, инициирован-
протекания фотореакции в обоих случаях,
ной в фемто- и раннем пикосекундном вре-
является белковое окружение РПШО. Фото-
менны х диапазонах [39, 41, 42].
отклик хромофорной группы в родопсинах I и
На рис. 6 представлен спектр ф/и-погло-
II типа становится высоко специфичным по
щения BR, зарегистрированный на времени
сравнению с газовой фазой уже на ранних вре-
задержки 100 пс после действия первого воз-
менах, приводя к возбуждению определенных
буждающего импульса с длиной волны 560 нм
колебательных мод, способствующих изо-
(импульс 1) и состоящий из полосы поглощения
меризации по реакционной связи. Хромофор
продукта K590 и полосы выцветания исходного
11-цис РПШО родопсинов II типа является
состояния BR568 (рис. 6, а (1)). Второй возбуж-
более быстрым и селективным по сравнению
дающий импульс с длиной волны 680 нм (им-
с полностью-транс РПШО BR. Кроме этого,
пульс 2), следующий с задержкой 5 пс, воз-
белковое окружение Rh приводит к возбужде-
буждает молекулы K590, часть из которых в
нию не только валентных колебаний реакци-
результате обратной фотореакции
(13-цис →
онной связи, но и внеплоскостных колебаний
→ полностью-транс РПШО) возвращается в
атомов водорода при этой связи, непосред-
исходное состояние BR568. При этом умень-
ственно приводящих к реакции фотоизо-
шается темновое образование продукта K590 и
меризации. Необходимо также отметить, что
увеличивается поглощение исходного состоя-
конформация β-иононового кольца 6-s-цис-
ния BR568 (рис. 6, а (2)). Квантовый выход об-
11-цис изомера РПШО, по всей видимости,
ратной фотореакции BR из продукта K590 со-
является важным фактором регуляции фото-
ставляет 0,81 [16], что согласуется с данными
физических свойств хромофорной группы ро-
работ Kim et al. [61] и Balashov et al. [79]. Об-
допсинов II типа, что связано с механизмом
ратный фотопереход может быть осуществлен
спектральной настройки.
не только из продукта K590 (рис. 6, а (встав-
Таким образом, судя по всему, эволюци-
ка: 3 и 5 пс)), но и из продукта J625 (рис. 6, а
онно более «молодые» родопсины II типа об-
(вставка: 1 пс)) примерно с одинаковой эф-
ладают более совершенными хромофорным
фективностью [42].
центром опсина и изомерной формой хромо-
В случае Rh действие импульса 2 (620 нм),
фора для осуществления эффективной прямой
следующего с задержкой относительно им-
фотохимической реакции.
пульса 1 (500 нм) 0,2-3,8 пс, также приводит
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1857
Рис. 6. Обратные фотореакции BR и Rh. а, б - Спектры ф/и-поглощения BR (а) и Rh (б), зарегистрированные на
времени задержки зондирования 100 пс после действия одного (1) и двух (2) возбуждающих импульсов с задержкой
второго возбуждающего импульса 5 пс (а) и 200 фс (б). В спектральных областях прохождения возбуждающих им-
пульсов экспериментальные кривые были достроены модельными кривыми (пунктирные кривые). Вставка: значения
ф/и-поглощения BR (а) и Rh (б), зарегистрированные на длинах волн зондирования 635 нм (а) и 560 нм (б) до и по-
сле действия второго возбуждающего импульса в зависимости от его времени задержки. в, г - Кинетические кривые
ф/и-поглощения BR (в) и Rh (г), зарегистрированные после действия одного возбуждающего импульса на длинах
волн зондирования 680 нм (в) и 620 нм (г). Рисунок адаптирован с разрешения [41, 42]
к индуцированию обратной фотореакции
Обратный фотохимический процесс BR
(рис. 6, б) [39, 41, 42, 46]. В зависимости от
и Rh, индуцированный на ранних стадиях,
задержки импульса
2 происходит обрат-
можно описать как движение волнового па-
ный фотопереход (полностью-транс → 11-цис
кета вдоль правой ветви S1 ППЭ продуктов
РПШО) из продукта Фото570 (рис. 6, б (встав-
исходной фотохимической реакции в направ-
ка: 0,2-2 пс)) или из продукта Бато535 (рис. 6, б
лении области CI S1/S0 ППЭ (рис. 3, в и г).
(вставка: 3-3,8 пс)). Эффективность обратной
Для Rh теоретические расчеты показали, что
фотореакции Rh из продукта Фото570 зави-
это та же область CI, которая участвует в пря-
сит от фазы осцилляций во времяразрешен-
мой фотореакции [81]. Переход молекул из
ных сигналах поглощения этого продукта
возбужденного состояния S1 на S0 ППЭ через
(рис. 6, б (вставка); рис. 6, г), а время этой
область CI приводит к образованию тех же
фотореакции сравнимо или меньше времени
состояний, что и в процессе прямой фотореак-
прямой фотореакции [41]. Квантовый выход
ции: BR568 и J625 - в случае BR; Rh498 и Фото570 -
обратной фотореакции Rh из продукта Бато535
в случае Rh. Если эффективность обратной
составляет 0,15 [41, 42, 46], что значительно
фотореакции BR практически не зависит от
меньше значения
(0,5), полученного ранее
времени задержки импульса 2 (рис. 6, а (встав-
при 77 K в работе Suzuki и Callender [80].
ка)), то для Rh она напрямую коррелирует
10
БИОХИМИЯ том 88 вып. 10 2023
1858
ОСТРОВСКИЙ и др.
с динамикой волнового пакета в продукте
стью-транс → 11-цис РПШО идут с квантовы-
Фото570 (рис. 6, б (вставка); рис. 6, г), что свя-
ми выходами, близкими по значению (0,11
зано с ярко выраженным когерентным харак-
и 0,14 соответственно) [84]. Исходя из этого
тером прямой фотореакции Rh. В данном слу-
можно заключить, что столь различные кван-
чае эффективность обратной фотореакции
товые выходы аналогичных обратных фоторе-
коррелирует с количеством молекул продук-
акций BR и Rh определяются специфическим
та Фото570, возбужденных импульсом 2.
влиянием белкового окружения в хромофор-
Скорость обратной фотохимической реак-
ном центре.
ции в родопсинах сильно зависит от конкрет-
Можно отметить, что, с функциональной
ной изомерной формы РПШО. Фотопере-
точки зрения, столь малый квантовый выход
ход из транс- в цис-форму обычно протекает
обратной фотореакции Rh, по сравнению
медленнее по сравнению с фотопереходом
с BR, является преимуществом, способствую-
цис → транс, и это наблюдается как в белке,
щим более надежному осуществлению прямой
так и в газовой фазе, и растворе [26, 29, 32, 52,
реакции, запускающей процесс фототрансдук-
57, 58, 82]. Это различие обусловлено строе-
ции. Поглощение света родопсинами I типа
нием S0, S1 и S2 ППЭ, как было описано выше
служит в основном фотоэнергетической функ-
на примерах BR и Rh (рис. 3, в и г). В рабо-
ции, как в случае BR, и обратные фотореак-
те Gai et al. [56] было показано, что в случае
ции, вполне вероятно, не могут существенно
BR при возбуждении продукта K590 обратная
повлиять на ее эффективность. Однако в слу-
фотохимическая реакция из 13-цис- в полно-
чае родопсинов II типа, которые являются
стью-транс-форму РПШО проходит за время
G-белок-связывающими рецепторами, 11-цис
≈100 фс, что значительно короче, чем время
РПШО действует как эффективный лиганд-
протекания прямой фотореакции
(480 фс).
антагонист, поддерживающий низкий тепло-
Можно предположить, что для Rh будет на-
вой «темновой» шум фоторецепторной клетки.
блюдаться обратная закономерность. Однако,
При поглощении света изомеризованный пол-
как было показано экспериментально для про-
ностью-транс РПШО превращается в мощ-
дукта Фото570 [41] и теоретически для продук-
ный лиганд-агонист, и активированный Rh
та Бато535 [81], время обратного фотоперехода
инициирует процесс фототрансдукции. В этом
из полностью-транс- в 11-цис-форму РПШО
случае вероятность возникновения обратной
сравнимо или меньше времени прямого фото-
фотореакции может значительно снизить эф-
перехода (60 фс). Предположительно, на ско-
фективность запуска процесса фототранс-
рость (и селективность) обратной фотохими-
дукции.
ческой реакции BR и Rh влияет значительный
Таким образом, меньшая эффективность
поворот реакционной связи хромофора в их
обратной фотореакции Rh, повышающая на-
первичных продуктах на угол от -39° до -20° и
дежность прямой фотореакции, может рас-
от -36° до -34,8° соответственно [31, 83]. Это
сматриваться как один из аргументов в пользу
позволяет быстро и безбарьерно достичь обла-
отбора в ходе эволюции 11-цис-изомера в каче-
сти CI даже в случае перехода транс → цис, как
стве хромофорной группы родопсинов II типа.
это имеет место в случае обратной фотореак-
Это свидетельствует о более совершенном
ции Rh.
строении хромофорного центра Rh и выборе в
Следует подчеркнуть, что если кванто-
процессе эволюции такого хромофора (11-цис
вые выходы прямой фотореакции BR и Rh
РПШО), который позволяет эффективно осу-
практически совпадают (≈0,65), то квантовые
ществлять процесс фототрансдукции. Есте-
выходы их обратной фотореакции из пер-
ственно, в реальных, физиологических усло-
вых фотопродуктов сильно отличаются - 0,81
виях вероятность попадания второго кванта
и 0,15 соответственно. Согласно теоретиче-
света на столь короткоживущий интермедиат
ским расчетам [31, 81], квантовый выход обра-
фотолиза Rh, как Бато535 и тем более Фото570,
зования продукта, как прямой, так и обратной
крайне низка, однако потенциальная возмож-
фотореакций родопсинов, определяется соот-
ность снижения вероятности обратной фото-
ношением фаз HOOP и торсионных колеба-
реакции в структуре Rh и его хромофорного
тельных мод РПШО в момент перехода S1 → S0.
центра заложена.
Также немаловажную роль в эффективно-
Вместе с тем совершенно очевиден физио-
сти фотореакции играет исходное заселение
логический смысл обратных фотохимических
С=С и НООР колебательных мод при реак-
реакций родопсинов II типа беспозвоночных
ционной связи при возбуждении, как было
животных с поздних промежуточных стадий
сказано выше. В растворе метанола фото-
фотопревращения. У большинства беспозво-
реакции 13-цис → полностью-транс и полно-
ночных животных это один из основных путей
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1859
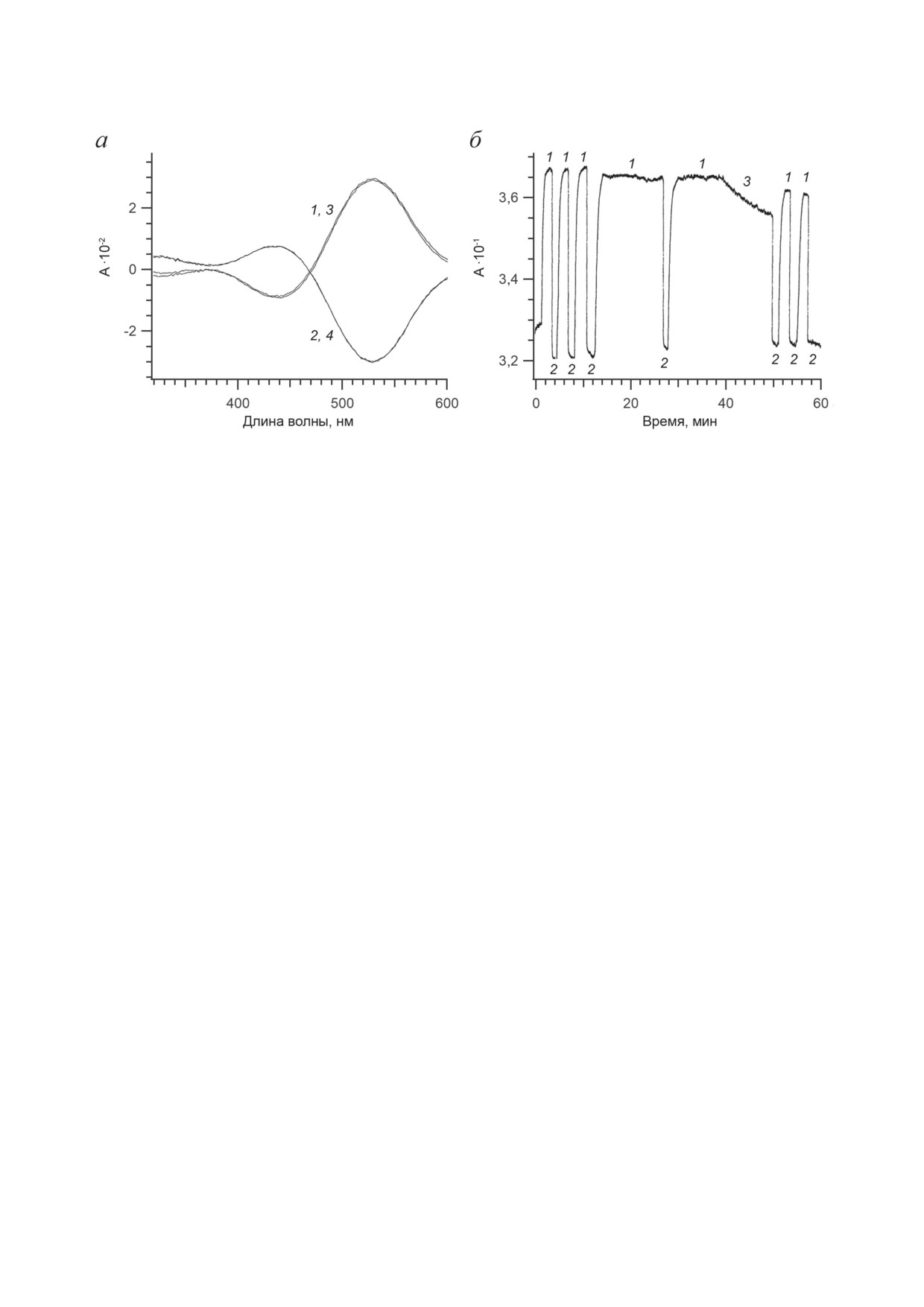
Рис. 7. Фотохромные реакции родопсина осьминога. а - Дифференциальные спектры двух последовательных ци-
клов родопсина осьминога, демонстрирующие обратимое фотопревращение родопсина в кислый метародопсин:
метародопсин минус родопсин (1 и 3, после освещения синим светом) и фоторегенерированный родопсин минус
метародопсин (2 и 4, после освещения красным светом). б - Фотообратимость родопсина осьминога, зарегистриро-
ванная на длине волны максимума кислого метародопсина 528 нм при действии синего света (1), красного света (2)
и в темноте (3). Рисунок адаптирован с разрешения [76]
регенерации (фоторегенерации) зрительного
денном состоянии путем перехода через CI
пигмента [75, 77]. Например, конечным про-
S1/S0 ППЭ, и время этого перехода находится
дуктом прямой фотореакции родопсина ось-
в фемтосекундном диапазоне. Первые про-
минога является так называемый кислый
дукты ф/и-превращения BR и Rh с изомери-
метародопсин, а обратной - снова родоп-
зованным РПШО (J625 и Фото570 соответствен-
син (рис. 7, а) [76].
но) образуются в основном (S0) состоянии и
В ходе прямой фотореакции образуется
являются колебательно-возбужденными пред-
несколько интермедиатов с разными спек-
шественниками следующих продуктов (K590
трами поглощения, а в ходе обратной - только
и Бато535 соответственно), образующихся в
два состояния, соответствующие конформа-
масштабе нескольких пикосекунд. На этом эта-
ционным изменениям сначала вблизи хромо-
пе завершается изомеризация РПШО, а в на-
фора, а затем во всем белке, которые возвра-
пряженной структуре продуктов K590 и Бато535
щают родопсин в исходное состояние. Как
запасается часть энергии кванта света. Кван-
нами было показано на детергентных экстрак-
товый выход прямых фотореакций BR и Rh
тах родопсина осьминога, фотообратимая ре-
практически совпадает (≈0,65). Реакция фо-
акция родопсина II типа беспозвоночных жи-
тоизомеризации РПШО в BR и Rh, как и в
вотных исключительно стабильна, в условиях
других родопсинах, а также и в растворе про-
in vitro она может быть повторена многократно
текает когерентно, что является внутренним
в течение достаточно длительного времени
свойством хромофора.
(рис. 7, б) [76].
Динамика и эффективность фотореакции
Сравнение механизмов фотопревращения
РПШО в родопсинах зависит от его изомер-
родопсинов I и II типов. При сравнении пер-
ной формы (посредством длины сопряженных
вичных реакций фотопревращения BR и Rh
π-связей) и взаимодействия с белковым окру-
можно выделить как общие, так и отличитель-
жением, что приводит не только к дополнитель-
ные особенности. Модельные кинетические
ному скручиванию хромофора, но и к сильным
схемы (рис. 3, а и б) имеют много общего и
электростатическим взаимодействиям с про-
отражают предположение, что гетерогенность
тивоионом. Эти факторы влияют на структуру
возбужденных состояний исследуемых родоп-
S0, S1 и S2 ППЭ хромофора, например, умень-
синов связана с гетерогенностью их началь-
шая барьер на S1 ППЭ в родопсинах I типа,
ных состояний. В BR и Rh в процессе реакции
что сильно влияет на скорость и когерентный
образуются аналогичные по своим свойствам
характер реакции. Также меняется активность
интермедиаты: I460, J625, K590 и Rh510, Фото570,
определенных колебательных мод при элек-
Бато535 соответственно. Элементарный акт
тронном переходе S0 → S1. Селективное и одно-
изомеризации РПШО протекает в возбуж-
временное возбуждение колебательных мод,
БИОХИМИЯ том 88 вып. 10 2023
10*
1860
ОСТРОВСКИЙ и др.
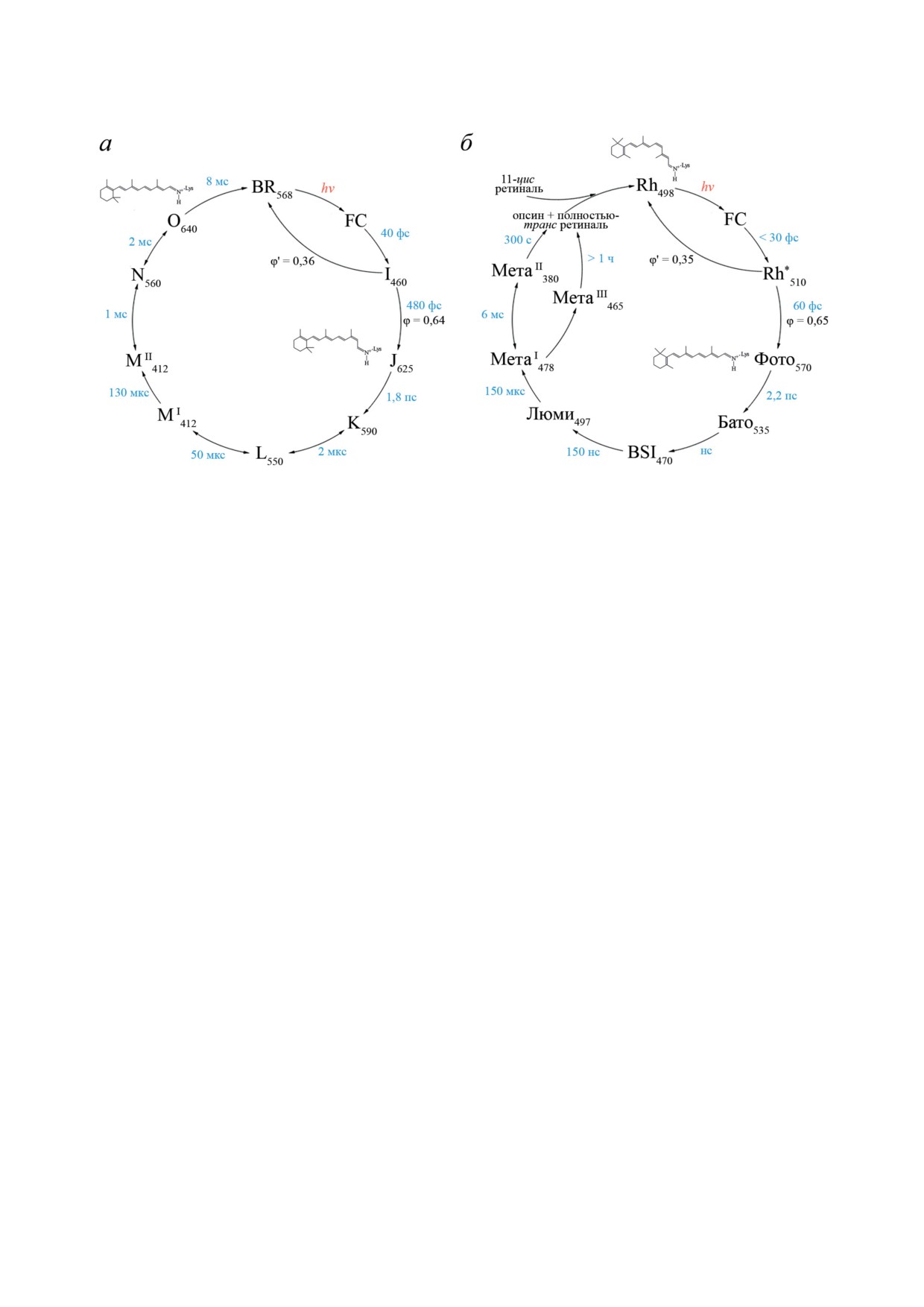
Рис. 8. Схемы фотоцикла родопсинов I типа на примере BR (а) и фотолиза родопсинов II типа позвоночных живот-
ных на примере Rh (б)
связанных с реакционными модами безызлуча-
Все перечисленные выше особенности
тельного перехода S1 → S0 в продукты реакции,
11-цис РПШО крайне важны для функциони-
уже на ранних этапах ф/и-динамики приводит
рования родопсинов II типа, выполняющих
к высокой скорости и большому квантовому
фотоинформационную функцию. Возможно,
выходу реакции фотоизомеризации.
именно поэтому 11-цис РПШО был выбран в
Можно заключить, что взаимодействие
ходе эволюции в качестве хромофорной груп-
РПШО с опсином существенно повышает
пы зрительных родопсинов и беспозвоночных,
скорость и квантовый выход фотореакции по
и позвоночных животных.
сравнению с наблюдаемыми в газовой фазе
Следует подчеркнуть, что, хотя реакция
и растворе, а селективность реакции дости-
фотоизомеризации является общей для родоп-
гает 100%. Наиболее тонкая регуляция этих
синов I и II типа, конечная стадия фотоакти-
параметров осуществляется в родопсинах
вируемых процессов существенно различается.
II типа, в которых фотореакция имеет более
В родопсинах I типа 13-цис РПШО на одной
выраженный когерентный характер. Хромо-
из последних стадий претерпевает тепловую
фор-белковые взаимодействия также могут
изомеризацию обратно в полностью-транс-
быть причиной возникновения гетерогенно-
форму, замыкая фотоактивируемые процессы
сти начального состояния РСБ, поскольку в
в фотоцикл (рис. 8. а). В родопсинах II типа
газовой фазе она не наблюдается [32].
большинства беспозвоночных животных для
Уменьшение длины цепи π-сопряжения в
замыкания цикла требуется поглощение вто-
6-s-цис-11-цис РПШО по сравнению с полно-
рого кванта света одним из долгоживущих
стью-транс-изомером также приводит к сдви-
промежуточных продуктов фотопревращения.
гу максимума поглощения родопсина в синюю
В родопсинах II типа позвоночных живот-
область и, что очень важно, к увеличению
ных цикл не замыкается, и изомеризованный
барьера тепловой 11-цис → транс изомериза-
полностью-транс-ретиналь высвобождается из
ции [26]. Первый эффект активно использует-
хромофорного центра опсина, что называется
ся родопсинами II типа как один из факторов
«фотообесцвечиванием» или фотолизом род-
для спектральной настройки. Второй имеет
опсина (рис. 8, б). Иными словами, молекула
большое значение для уменьшения «темново-
родопсина II типа позвоночных животных -
го шума» фоторецепторной клетки, чему так-
это молекула однократного действия. Для ее
же сильно способствует ограниченный объем
дальнейшей работы - регенерации родопси-
хромофорного центра [85]. В случае же BR и
на - требуется доставка в хромофорный центр
некоторых других родопсинов I типа хромо-
нового ретиналя в 11-цис-форме (подробнее
форный центр достаточно просторный и не
см. в обзоре Островского и Фельдман [20]).
препятствует тепловой транс → 13-цис изоме-
Принципиальная похожесть первичных фо-
ризации, происходящей в темноте.
тохимических реакций родопсинов I и II типов
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1861
и их существенное различие на последующих
пы - ретиналем, который во многом опреде-
стадиях фотопревращения ярко проявились
ляет механизм фотореакции как ключевой ста-
в их фотоэлектрических реакциях. В конце
дии функционирования РСБ. А наблюдаемые
70-х-начале 80-х гг., используя разработан-
различия в характере фотореакции родопси-
ный Л.А. Драчевым метод [86], мы совместно с
нов I и II типов, судя по всему, определяются
ним и группой В.П. Скулачева подробно срав-
различной изомерной формой хромофора, вы-
нили генерацию фотопотенциала Rh на фоторе-
бранной в процессе эволюции в соответствии
цепторной мембране дисков палочек и BR на
с выполняемыми ими функциями. В рамках
пурпурной мембране галоархей [87-89]. Как
теории конвергентной эволюции родопсинов
и следовало ожидать, как переход полностью-
I и II типа можно предположить, что похожие и
транс → 13-цис в BR, так и переход 11-цис →
вместе с тем пластичные 7-α-спиральные бел-
→ полностью-транс в Rh сопровождаются воз-
ковые структуры этих двух типов совершен-
никновением быстрого фотоэлектрического
ствовались независимо, движимые в том числе
ответа. Однако и в этом есть существенное
необходимостью оптимизации электронных
различие: если генерация потенциала на пур-
свойств своих хромофорных групп в полно-
пурной мембране сопровождается еще и пере-
стью-транс и 11-цис изомерных формах.
носом протона, что принципиально важно
Сходство структуры и механизма работы
для фотоэнергетической функции BR, то в
такой сложной молекулярной системы, как
случае Rh такой перенос отсутствует. Именно
ретиналь-содержащие трансмембранные све-
с этого момента физиологические пути BR
точувствительные белки, явилось результатом
и Rh расходятся. Отсутствие переноса про-
давления естественно отбора при, подчерк-
тона через фоторецепторную мембрану диска
нем, определенных физико-химических огра-
было нами затем показано в прямом экспери-
ничениях. Сам же этот отбор был направлен
менте [90].
на максимально эффективное выполнение
В случае Rh одновременно с разделением
функции каждым из типов родопсинов.
зарядов происходят конформационные изме-
Совершенно очевидно, что механизмы
нения белковой части молекулы, что приводит
эволюции на молекулярном и субмолекуляр-
на стадии метародопсина II сначала к быстро-
ном уровнях всех трех известных в настоящее
му депротонированию РПШО, а затем к мед-
время типов РСБ - микробных (I тип), живот-
ленному высвобождению протона во внешнюю
ных (II тип) и сравнительно недавно обнару-
среду [91]. В результате всех этих конформаци-
женных гелиородопсинов (III тип) - еще ждут
онных перестроек Rh на стадии метародопси-
своего дальнейшего подробного изучения.
на II приобретает способность взаимодейство-
вать с G-белком (трансдуцином) и запускать
Вклад авторов. М.А. Островский - концеп-
процесс фототрансдукции [24, 92]. По своим
ция и руководство работой; М.А. Островский,
характерным временам и по полярности бы-
О.А. Смитиенко, А.В. Боченкова, Т.Б. Фельд-
стрый компонент фотоответа Rh является, по
ман - написание и редактирование текста
существу, так называемым ранним рецептор-
статьи.
ным потенциалом, который регистрируется
Финансирование. Исследование выполне-
при обычном электрофизиологическом отве-
но при поддержке гранта Министерства науки
дении от сетчатки [93].
и высшего образования Российской Федера-
В то время как BR, фотоактивируемые
ции (соглашение № 075-15-2020-795, внутрен-
процессы которого замкнуты в фотоцикл, ге-
ний № 13.1902.21.0027).
нерирует на пурпурной мембране устойчивый
Благодарности. Авторы выражают благо-
электрический потенциал в течение всего пе-
дарность м.н.с, к.ф.-м.н. П.А. Кусочеку и
риода освещения, в случае Rh, претерпеваю-
В.В. Логвинову за проведение части квантово-
щего фотолиз, быстрый фотоэлектрический
химических расчетов. Расчеты проведены с
ответ необратимо падает задолго до выклю-
использованием вычислительного кластера ла-
чения света и на повторное включение света
боратории квантовой фотодинамики химиче-
никак не реагирует [88, 89].
ского факультета, закупленного по программе
развития МГУ имени М.В. Ломоносова.
Конфликт интересов. Авторы заявляют об
ЗАКЛЮЧЕНИЕ
отсутствии конфликта интересов.
Соблюдение этических норм. Настоящая
Таким образом, можно заключить, что
статья не содержит описания каких-либо ис-
сходство фотохимии родопсинов I и II типов
следований с участием людей или животных
связано с природой общей хромофорной груп-
в качестве объектов.
БИОХИМИЯ том 88 вып. 10 2023
1862
ОСТРОВСКИЙ и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Spudich, J. L., Yang, C.-S., Jung, K.-H., and
13.
Feuda, R., Hamilton, S. C., McInerney, J. O.,
Spudich, E. N. (2000) Retinylidene proteins: Struc-
and Pisani, D. (2012) Metazoan opsin evolution
tures and functions from archaea to humans, Annu.
reveals a simple route to animal vision, Proc. Natl.
Rev. Cell Dev. Biol., 16, 365-392, doi: 10.1146/annurev.
Acad. Sci. USA, 109, 18868-18872, doi: 10.1073/
cellbio.16.1.365.
pnas.1204609109.
2.
Ernst, O. P., Lodowski, D. T., Elstner, M., Hege-
14.
Feuda, R., Menon, A. K., and Göpfert, M. C. (2022)
mann, P., Brown, L. S., and Kandori, H. (2014)
Rethinking opsins, Mol. Biol. Evol., 39, doi: 10.1093/
Microbial and animal rhodopsins: Structures,
molbev/msac033.
functions, and molecular mechanisms, Chem. Rev.,
15.
Zhai, Y., Heijne, W. H., Smith, D. W., and Saier,
114, 126-163, doi: 10.1021/cr4003769.
M. H., Jr. (2001) Homologues of archaeal rhodopsins
3.
Nagata, T., and Inoue, K. (2021) Rhodopsins at a
in plants, animals and fungi: Structural and functional
glance, J. Cell Sci., 134, jcs258989, doi: 10.1242/
predications for a putative fungal chaperone protein,
jcs.258989.
Biochim. Biophys. Acta, 1511, 206-223, doi: 10.1016/
4.
Rozenberg, A., Inoue, K., Kandori, H., and Béjà, O.
s0005-2736(00)00389-8.
(2021) Microbial rhodopsins: The last two decades,
16.
Bulzu, P.-A., Kavagutti, V. S., Andrei, A.-S., and
Annu. Rev. Microbiol., 75, 427-447, doi: 10.1146/
Ghai, R. (2022) The evolutionary kaleidoscope of
annurev-micro-031721-020452.
rhodopsins, mSystems, 7, e00405-22, doi: 10.1128/
5.
Gordeliy, V., Kovalev, K., Bamberg, E., Rodriguez-
msystems.00405-22.
Valera, F., Zinovev, E., Zabelskii, D., Alekseev, A.,
17.
Govorunova, E. G., Sineshchekov, O. A., and Spudich,
Rosselli, R., Gushchin, I., and Okhrimenko, I. (2022)
J. L. (2022) Emerging diversity of channelrhodopsins
Microbial rhodopsins, in Rhodopsin (Gordeliy, V., ed)
and their structure-function relationships, Front. Cell.
Methods Mol. Biol., 2501, 1-52, Humana, New York,
Neurosci., 15, 800313, doi: 10.3389/fncel.2021.800313.
NY, doi: 10.1007/978-1-0716-2329-9_1.
18.
Островский М. А. (2017) Родопсин: эволюция и
6.
Kandori, H. (2020) Biophysics of rhodopsins and
сравнительная физиология, Палеонтол. Журн., 5,
optogenetics, Biophys. Rev., 12, 355-361, doi: 10.1007/
103-113.
s12551-020-00645-0.
19.
Oesterhelt, D., and Stoeckenius, W.
(1971)
7.
Pushkarev, A., Inoue, K., Larom, S., Flores-
Rhodopsin-like protein from the purple membrane of
Uribe, J., Singh, M., Konno, M., Tomida, S.,
Halobacterium halobium, Nat. New Biol., 233, 149-152,
Ito, S., Nakamura, R., Tsunoda, S. P., Philosof, A.,
doi: 10.1038/newbio233149a0.
Sharon, I., Yutin, N., Koonin, E. V., Kandori, H.,
20.
Островский М. А., Фельдман Т. Б. (2012) Химия и
and Béjà, O.(2018) A distinct abundant group of mi-
молекулярная физиология зрения: светочувстви-
crobial rhodopsins discovered using functional metag-
тельный белок родопсин, Успехи химии, 81, 1071-
enomics, Nature, 558, 595-599, doi: 10.1038/s41586-
1090, doi: 10.1070/RC2012v081n11ABEH004309.
018-0225-9.
21.
Kovalev, K., Volkov, D., Astashkin, R., Alekseev, A.,
8.
Luk, H. L., Melaccio, F., Rinaldi, S., and Olivucci, M.
Gushchin, I., Haro-Moreno, J. M., Chizhov, I.,
(2015) Molecular bases for the selection of the chro-
Siletsky, S., Mamedov, M., Rogachev, A., Balandin, T.,
mophore of animal rhodopsins, Proc. Natl. Acad. Sci.
Borshchevskiy, V., Popov, A., Bourenkov, G., Bam-
USA, 112, 15297-15302, doi: 10.1073/pnas.1510262112.
berg, E., Rodriguez-Valera, F., Büldt, G., and
9.
Mackin, K. A., Roy, R. A., and Theobald, D. L.
Gordeliy, V. (2020) High-resolution structural insights
(2014) An empirical test of convergent evolution in
into the heliorhodopsin family, Proc. Natl. Acad. Sci.
rhodopsins, Mol. Biol. Evol., 31, 85-95, doi: 10.1093/
USA, 117, 4131-4141, doi: 10.1073/pnas.1915888117.
molbev/mst171.
22.
Benton, R., Sachse, S., Michnick, S.W., and Vosshall,
10.
Shalaeva, D. N., Galperin, M. Y., and Mulkidjanian,
L.B. (2006) Atypical membrane topology and hetero-
A. Y. (2015) Eukaryotic G protein-coupled receptors
meric function of Drosophila odorant receptors in vivo,
as descendants of prokaryotic sodium-translocating
PLoS Biol., 4, e20, doi: 10.1371/journal.pbio.0040020.
rhodopsins, Biol. Direct, 10, 63, doi: 10.1186/s13062-
23.
Lamb, T. D., Collin, S. P., and Pugh, E. N., Jr.
015-0091-4.
(2007) Evolution of the vertebrate eye: Opsins, photo-
11.
Kojima, K., and Sudo, Y. (2023) Convergent evolution
receptors, retina and eye cup, Nat. Rev. Neurosci., 8,
of animal and microbial rhodopsins, RSC Adv., 13,
960-976, doi: 10.1038/nrn2283.
5367-5381, doi: 10.1039/d2ra07073a.
24.
Hofmann, K. P., and Lamb, T. D. (2023) Rhodopsin,
12.
Krishnan, A., Almen, M. S., Fredriksson, R.,
light-sensor of vision, Prog. Retin. Eye Res., 93,
and Schioth, H. B. (2012) The origin of GPCRs:
101116, doi: 10.1016/j.preteyeres.2022.101116.
Identification of mammalian like rhodopsin, adhesion,
25.
Розанов А.Ю. (2009) Условия жизни на ранней
glutamate and frizzled GPCRs in fungi, PLoS One,
земле после 4,0 млрд лет назад, Проблемы проис-
7, e29817, doi: 10.1371/journal.pone.0029817.
хождения жизни, ПИН РАН, Москва, стр. 185-201.
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1863
26.
Gozem, S., Luk, H. L., Schapiro, I., and Olivucci, M.
за зрительного пигмента родопсина, Докл. Акад.
(2017) Theory and simulation of the ultrafast dou-
Наук, 421, 277-281.
ble-bond isomerization of biological chromo-
38.
Смитиенко О. А., Мозговая М. Н., Шелаев И. В.,
phores, Chem. Rev., 117, 13502-13565, doi: 10.1021/
Гостев Ф. Е., Фельдман Т. Б., Надточенко В. А.,
acs.chemrev.7b00177.
Саркисов О. М., Островский М. А. (2010) Фемто-
27.
Kandori, H.
(2011) Protein-controlled ultrafast
секундная динамика образования первичных про-
photoisomerization in rhodopsin and bacteriorho-
дуктов фотопревращения зрительного пигмента
dopsin, Supramolecular Photochemistry: Controlling
родопсина, Биохимия, 75, 34-45.
Photochemical Processes, Chapter
14,
571-595,
39.
Мозговая М. Н., Смитиенко О. А., Шелаев И. В.,
doi: 10.1002/9781118095300.ch14.
Гостев Ф. Е., Фельдман Т. Б., Надточенко В. А.,
28.
Diller, R. (2008) Primary reactions in retinal proteins,
Саркисов О. М., Островский М. А. (2010) Фото-
In: Braun M., Gilch P., Zinth W. (eds) Ultrashort
хромизм зрительного пигмента родопсина в фем-
laser pulses in biology and medicine. Biological and
тосекундной шкале времени: когерентное управ-
Medical Physics, Biomedical Engineering, Springer,
ление фотоизомеризацией хромофора ретиналя,
Berlin. Heidelberg, Germany, Chapter 10, 243-277,
Докл. Акад. Наук, 435, 262-266.
doi: 10.1007/978-3-540-73566-3_10.
40.
Надточенко В. А., Смитиенко О. А., Фельдман
29.
Wand, A., Gdor, I., Zhu, J., Sheves, M., and
Т. Б., Мозговая М. Н., Шелаев И. В., Гостев Ф. Е.,
Ruhman, S. (2013) Shedding new light on retinal pro-
Саркисов О. М., Островский М. А. (2012) Участие
tein photochemistry, Annu. Rev. Phys. Chem., 64, 437-
конического пересечения в фемтосекундной ди-
458, doi: 10.1146/annurev-physchem-040412-110148.
намике цис-транс фотоизомеризации хромофора
30.
Hampp, N. (2000) Bacteriorhodopsin as a photo-
зрительного пигмента родопсина, Докл. Акад.
chromic retinal protein for optical memories, Chem.
Наук, 446, 460-465.
Rev., 100, 1755-1776, doi: 10.1021/cr980072x.
41.
Smitienko, O., Nadtochenko, V., Feldman, T.,
31.
Schapiro, I., Melaccio, F., Laricheva, E. N., and
Balatskaya, M., Shelaev, I., Gostev, F., Sarkisov, O.,
Olivucci, M. (2011) Using the computer to under-
and Ostrovsky, M. (2014) Femtosecond laser spec-
stand the chemistry of conical intersections, Pho-
troscopy of the rhodopsin photochromic reaction:
tochem. Photobiol. Sci., 10, 867-886, doi: 10.1039/
A concept for ultrafast optical molecular switch
c0pp00290a.
creation (ultrafast reversible photoreaction of rho-
32.
Kiefer, H.V., Gruber, E., Langeland, J., Kusochek,
dopsin), Molecules, 19, 18351-18366, doi: 10.3390/
P. A., Bochenkova, A. V., and Andersen, L. H. (2019)
molecules191118351.
Intrinsic photoisomerization dynamics of protonated
42.
Feldman, T. B., Smitienko, O. A., Shelaev, I. V.,
Schiff-base retinal, Nat. Commun.,
10,
1210,
Gostev, F. E., Nekrasova, O. V., Dolgikh, D. A.,
doi: 10.1038/s41467-019-09225-7.
Nadtochenko, V. A., Kirpichnikov, M. P., and Ost-
33.
Agathangelou, D., Roy, P. P., del Carmen Marin, M.,
rovsky, M. A. (2016) Femtosecond spectroscopic study
Ferre, N., Olivucci, M., Buckup, T., Léonard, J., and
of photochromic reactions of bacteriorhodopsin and
Haacke, S. (2021) Sub-picosecond C=C bond photo-
visual rhodopsin, J. Photochem. Photobiol. B., 164,
isomerization: evidence for the role of excited state
296-305, doi: 10.1016/j.jphotobiol.2016.09.041.
mixing, Comptes Rendus Physique, 22, S2, 111-138,
43.
Смитиенко О. А., Некрасова О. В., Кудрявцев
doi: 10.5802/crphys.41.
А. В., Яковлева М. А., Шелаев И. В., Гостев Ф. Е.,
34.
Birge, R. R., Cooper, T. M., Lawrence, A. F., Masthay,
Долгих Д. А., Кольчугина И. Б., Надточенко В. А.,
M. B., Vasilakis, C., Fan Zhang, C., and Zidovetzki, R.
Кирпичников М. П., Фельдман Т. Б., Островский
(1989) A spectroscopic, photocalorimetric, and theo-
М. А. (2017) Фемто- и пикосекундная динамика
retical investigation of the quantum efficiency of the
первичных реакций рекомбинантного бактерио-
primary event in bacteriorhodopsin, J. Am. Chem.
родопсина в сравнении с природным белком в
Soc., 111, 4063-4074, doi: 10.1021/ja00193a044.
тримерном и мономерном состояниях, Биохимия,
35.
Wang, W., Geiger, J. H., and Borhan, B.
(2013)
82, 664-676.
The photochemical determinants of color vision,
44.
Smitienko, O., Feldman, T., Petrovskaya, L.,
BioEssays, 36, 65-74, doi: 10.1002/bies.201300094.
Nekrasova, O., Yakovleva, M., Shelaev, I., Gostev, F.,
36.
Okada, T., Sugihara, M., Bondar, A.-N., Elstner, M.,
Cherepanov, D., Kolchugina, I., Dolgikh, D.,
Entel, P., and Buss, V. (2004) The retinal conformation
Nadtochenko, V., Kirpichnikov, M., and Ostrovsky, M.
and its environment in rhodopsin in light of a new
(2021) Comparative femtosecond spectroscopy of pri-
2.2 Å crystal structure, J. Mol. Biol., 342, 571-583,
mary photoreactions of Exiguobacterium sibiricum rho-
doi: 10.1016/j.jmb.2004.07.044.
dopsin and Halobacterium salinarum bacteriorhodop-
37.
Смитиенко О. А., Шелаев И. В., Гостев Ф. Е.,
sin, J. Phys. Chem. B., 125, 4, 995-1008, doi: 10.1021/
Фельдман Т. Б., Надточенко В. А. Саркисов О. М.,
acs.jpcb.0c07763.
Островский М. А. (2008) Когерентные процессы
45.
Медведева А. С., Смитиенко О. А., Фельдман Т. Б.,
при образовании первичных продуктов фотоли-
Островский М. А. (2020) Сравнительное исследо-
БИОХИМИЯ том 88 вып. 10 2023
1
864
ОСТРОВСКИЙ и др.
вание фотохимии микробиальных родопсинов
orhodopsin, Science, 279, 1886-1891, doi: 10.1126/
(I типа) и родопсинов животных (II типа), Журн.
science.279.5358.1886.
Эвол. Биохим. и Физиол., 56, 519-523, doi: 10.31857/
57.
Tahara, S., Takeuchi, S., Abe-Yoshizumi, R.,
S0044452920070943.
Inoue K., Ohtani H., Kandori, H., and Tahara, T.
46.
Островский М. А., Надточенко В. А.
(2021)
(2018) Origin of the reactive and nonreactive excited
Фемтохимия родопсинов, Хим. Физ., 40, 76-84,
states in the primary reaction of rhodopsins: pH de-
doi: 10.31857/S0207401X21040117.
pendence of femtosecond absorption of light-driv-
47.
Gruber, E., Kabylda, A. M., Nielsen, M. B.,
en sodium ion pump rhodopsin KR2, J. Phys.
Rasmussen, A. P., Teiwes, R., Kusochek, P. A.,
Chem. B,
122,
4784-4792, doi:
10.1021/acs.jpcb.
Bochenkova, A. V., and Andersen, L. H. (2022) Light
8b01934.
driven ultrafast bioinspired molecular motors: Steering
58.
Chang, C.-F., Kuramochi, H., M., Abe-Yoshizumi, R.,
and accelerating photoisomerization dynamics of
Tsukuda, T., Kandori, H., and Tahara, T.
(2022)
retinal, J. Am. Chem. Soc., 144, 69-73, doi: 10.1021/
A unified view on varied ultrafast dynamics of
jacs.1c10752.
the primary process in microbial rhodopsins, An-
48.
Kusochek, P. A., Logvinov, V. V., and Bochenkova,
gew. Chem. Int. Ed., 61, e202111930, doi: 10.1002/
A. V. (2021) Role of the protein environment in
anie.202111930.
photoisomerization of type I and type II rhodopsins:
59.
Kandori, H., Futurani, Y., Nishimura, S., Shichida, Y.,
A theoretical perspective, Moscow Univ. Chem. Bull.,
Chosrowjan, H., Shibata, Y., and Mataga, N. (2001)
76, 407-416, doi: 10.3103/S0027131421060110.
Excited-state dynamics of rhodopsin probed by
49.
Kusochek, P. A., Scherbinin, A. V., and Bochenkova,
femtosecond fluorescence spectroscopy, Chem.
A. V. (2021) Insights into the early-time excited-
Phys. Lett., 334, 271-276, doi: 10.1016/S0009-2614
state dynamics of structurally inhomogeneous
(00)01457-3.
rhodopsin KR2, J. Phys. Chem. Lett., 12, 8664-8671,
60.
Kochendoerfer, G. G., and Mathies, R. A. (1995) Ul-
doi: 10.1021/acs.jpclett.1c02312.
trafast spectroscopy of rhodopsins - photochemistry
50.
Toker, Y., Svendsen, A., Bochenkova, A. V., and
at its best! Isr. J. Chem., 35, 211-226, doi: 10.1002/
Andersen, L. H. (2012) Probing the barrier for internal
ijch.199500028.
rotation of the retinal chromophore, Angew. Chem.
61.
Kim, J. E., Tauber, M. J., and Mathies, R. A. (2001)
Intl. Ed., 51, 8757-8761, doi: 10.1002/anie.201203746.
Wavelength dependent cis-trans isomerization in
51.
Kochendoerfer, G. G., and Mathies, R. A. (1996)
vision, Biochemistry, 40, 13774-13778, doi: 10.1021/
Spontaneous emission study of the femtosecond
bi0116137.
isomerization dynamics of rhodopsin, J. Phys. Chem.,
62.
Govindjee, R., Balashov, S. P., and Ebrey T. G.
100, 14526-14532, doi: 10.1021/jp960509+.
(1990) Quantum efficiency of the photochemical
52.
Polli, D., Altoè, P., Weingart, O., Spillane, K. M.,
cycle of bacteriorhodopsin, Biophys. J., 58, 597-608,
Manzoni, C., Brida, D., Tomasello, G., Orlandi, G.,
doi: 10.1016/S0006-3495(90)82403-6.
Kukura, P., Mathies, R. A., Garavelli, M., and
63.
Wang, Q., Shoenlein, R. W., Peteanu, L. A., Mathies,
Cerullo, G. (2010) Conical intersection dynamics
R. A., and Shank, C. V. (1994) Vibrationally coherent
of the primary photoisomerization event in vision,
photochemistry in the femtosecond primary event
Nature, 467, 440-443, doi: 10.1038/nature09346.
of vision, Science,
266,
422-424, doi:
10.1126/
53.
Johnson, P. J. M., Halpin, A., Morizumi, T.,
science.7939680.
Prokhorenko, V. I., Ernst, O. P., and Miller, R. J. D.
64.
Liebel, M., Schnedermann, C., Bassolino, G.,
(2015) Local vibrational coherences drive the primary
Taylor, G., Watts, A., and Kukura, P. (2014) Direct
photochemistry of vision, Nat. Chem., 7, 980-986,
observation of the coherent nuclear response after the
doi: 10.1038/nchem.2398.
absorption of a photon, Phys. Rev. Lett., 112, 238301,
54.
Johnson, P. J. M., Farag, M. H., Halpin, A.,
doi: 10.1103/PhysRevLett.112.238301.
Morizumi, T., Prokhorenko, V. I., Knoester, J.,
65.
Zewail, A. H. (2000) Femtochemistry: Atomic-scale
Jansen, T. L. C., Ernst, O. P., and Miller, R. J. D.
dynamics of the chemical bond, J. Phys. Chem. A, 104,
(2017) The primary photochemistry of vision occurs
5660-5694, doi: 10.1021/jp001460h.
at the molecular speed limit, J. Phys. Chem. B, 121,
66.
Саркисов О. М., Уманский С. Я. (2001) Фемто-
4040-4047, doi: 10.1021/acs.jpcb.7b02329.
химия, Успехи химии, 70, 515-538, doi: 10.1070/
55.
Hasson, K. C., Gai, F., and Anfinrud, P. A. (1996)
RC2001v070n06ABEH000664.
The photoisomerization of retinal in bacteriorho-
67.
Klessinger, M.
(1995) Conical intersections and
dopsin: Experimental evidence for a three-state
the mechanism of singlet photoreactions, Angew.
model, Proc. Natl. Acad. Sci. USA, 93, 15124-15129,
Chem. Int. Ed. Engl., 34, 549-551, doi: 10.1002/
doi: 10.1073/pnas.93.26.15124.
anie.199505491.
56.
Gai, F., Hasson, K. C., McDonald, J. C., and An-
68.
Gozem, S., Johnson, P. J. M., Halpin, A., Luk,
finrud, P. A. (1998) Chemical dynamics in pro-
H. L., Morizumi, T., Prokhorenko, V. I., Ernst, O. P.,
teins: The photoisomerization of retinal in bacteri-
Olivucci, M., and Miller, R. J. D. (2020) Excited-
БИОХИМИЯ том 88 вып. 10 2023
ФОТОХИМИЯ РОДОПСИНОВ I И II ТИПОВ
1865
state vibronic dynamics of bacteriorhodopsin from
79.
Balashov, S. P., Imasheva, E. S., Govindjee, R., and
two-dimensional electronic photon echo spectroscopy
Ebrey, T. G. (1991) Quantum yield ratio of the forward
and multiconfigurational quantum chemistry,
and back light reactions of bacteriorhodopsin at low
J. Phys. Chem. Lett., 11, 3889-3896, doi: 10.1021/
temperature and photosteady-state concentration of
acs.jpclett.0c01063.
the bathoproduct K, Photochem. Photobiol., 54, 955-
69.
Rivalta, I., Nenov, A., Weingart, O., Cerullo, G.,
961, doi: 10.1111/j.1751-1097.1991.tb02116.x.
Garavelli, M., and Mukamel, S. (2014) Modelling
80.
Suzuki, T., and Callender, R. H. (1981) Prima-
time-resolved two-dimensional electronic spectrosco-
ry photochemistry and photoisomerization of reti-
py of the primary photoisomerization event in rhodop-
nal at 77 degrees K in cattle and squid rhodopsins,
sin, J. Phys. Chem. B, 118, 8396-8405, doi: 10.1021/
Biophys. J., 34, 261-270, doi: 10.1016/S0006-3495
jp502538m.
(81)84848-5.
70.
Hayashi, S., Tajkhorshid, E., and Schulten, K. (2009)
81.
Schapiro, I., Ryazantsev, M. N., Frutos, L. M.,
Photochemical reaction dynamics of the primary
Ferré, N., Lindh, R., and Olivucci, M. (2011) The
event of vision studied by means of a hybrid molecular
ultrafast photoisomerizations of rhodopsin and ba-
simulation, Biophys. J., 96, 403-416, doi: 10.1016/
thorhodopsin are modulated by bond length al-
j.bpj.2008.09.049.
ternation and HOOP driven electronic effects,
71.
Rajput, J., Rahbek, D. B., Andersen, L. H.,
J. Am. Chem. Soc., 133, 3354-3364, doi: 10.1021/
Hirshfeld, A., Sheves, M., Altoè, P., Orlandi, G.,
ja1056196.
and Garavelli, M. (2010) Probing and modeling the
82.
Schoenlein, R. W., Peteanu, L. A., Mathies, R. A.,
absorption of retinal protein chromophores in vacuo,
and Shank, C. V. (1991) The first step in vision:
Angew. Chem. Intl. Ed., 49, 1790-1793, doi: 10.1002/
Femtosecond isomerization of rhodopsin, Science,
anie.200905061.
254, 412-415, doi: 10.1126/science.1925597.
72.
Yoshizawa, T., and Wald, G. (1963) Pre-lumirhodopsin
83.
Altoè, P., Cembran, A., Olivucci, M., and
and the bleaching of visual pigments, Nature, 197,
Garavelli, M. (2010) Aborted double bicycle-ped-
1279-1286, doi: 10.1038/1971279a0.
al isomerization with hydrogen bond breaking is the
73.
Takahashi, T., Mochizuki, Y., Kamo, N., and
primary event of bacteriorhodopsin proton pump-
Kobatake, Y. (1985) Evidence that the long-lifetime
ing, Proc. Natl. Acad. Sci. USA, 107, 20172-20177,
photointermediate of s-rhodopsin is a receptor for
doi: 10.1073/pnas.1007000107.
negative phototaxis in Halobacterium halobium,
84.
Koyama, Y., Kubo, K., Komori, M., Yasuda,
Biochem. Biophys. Res. Commun.,
127,
99-105,
H., and Mukai, Y. (1991) Effect of protonation
doi: 10.1016/s0006-291x(85)80131-5.
on the isomerization properties of n-butylamine
74.
Bruun, S., Stoeppler, D., Keidel, A., Kuhlmann,
Schiff base of isomeric retinal as revealed by di-
U., Luck, M., Diehl, A., Geiger, M. A., Woodman-
rect HPLC analyses: Selection of isomerization
see, D., Trauner, D., Hegemann, P., Oschkinat, H.,
pathways by retinal proteins, Photochem. Photo-
Hildebrandt, P., and Stehfest, K. (2015) Light-dark
biol.,
54,
433-443, doi:
10.1111/j.1751-1097.1991.
adaptation of channelrhodopsin involves photocon-
tb02038.x.
version between the all-trans and 13-cis retinal iso-
85.
Ikuta, T., Shihoya, W., Sugiura, M., Yoshi-
mers, Biochemistry, 54, 5389-5400, doi: 10.1021/acs.
da, K., Watari, M., Tokano, T., Yamashita, K.,
biochem.5b00597.
Katayama, K., Tsunoda, S. P., Uchihashi, T., Kan-
75.
Dixon, S. F., and Cooper, A. (1987) Quantum ef-
dori, H., and Nureki, O. (2020) Structural insights
ficiencies of the reversible photoreaction of octo-
into the mechanism of rhodopsin phosphodiester-
pus rhodopsin, Photochem. Photobiol., 46, 115-119,
ase, Nat. Commun., 11, 5605, doi: 10.1038/s41467-
doi: 10.1111/j.1751-1097.1987.tb04744.x.
020-19376-7.
76.
Ostrovsky, M. A., and Weetall, H. H. (1998) Octopus
86.
Драчев Л. А., Каулен А. Д., Скулачев В. П. (1977)
rhodopsin photoreversibility of a crude extract
Временные характеристики бактериородопсина
from whole retina over several weeks’ duration,
как молекулярного биологического генератора
Biosens. Bioelectron., 13, 61-65, doi: 10.1016/S0956-
тока, Мол. Биол., 11, 1377-1387.
5663(97)00078-X.
87.
Большаков В. И., Драчев Л. А., Каламкаров Г. Р.,
77.
Inoue, K., Tsuda, M., and Terazima, M.
(2007)
Каулен А. Д., Островский М. А., Скулачев В. П.
Photoreverse reaction dynamics of octopus rho-
(1979) Общность свойств бактериального и зри-
dopsin, Biophys. J., 92, 3643-3651, doi: 10.1529/
тельного родопсинов: превращение энергии све-
biophysj.106.101741.
та в разность электрических потенциалов, ДАН
78.
Koyanagi, M., and Terakita, A. (2008) Gq-cou-
СССР, 249, 1462-1466.
pled rhodopsin subfamily composed of inverte-
88.
Drachev, L. A., Kalamkarov, G. R., Kaulen, A. D.,
brate visual pigment and melanopsin, Photochem.
Ostrovsky, M. A., and Skulachev, V. P.
(1981)
Photobiol., 84, 1024-1030, doi: 10.1111/j.1751-1097.
Fast stages of photoelectric processes in biologi-
2008.00369.x.
cal membranes. II. Visual rhodopsin, Eur. J. Bio-
БИОХИМИЯ том 88 вып. 10 2023
1866
ОСТРОВСКИЙ и др.
chem., 117, 471-481, doi: 10.1111/j.1432-1033.1981.
91. Островский М. А., Федорович И. Б., Поляк С. Е.
tb06362.x.
(1968) Изменение рН-среды при освещении сус-
89. Drachev, L. A., Kaulen, A. D, Khitrina, L. V., and
пензии наружных сегментов фоторецепторов сет-
Skulachev, V. P. (1981) Fast stages of photoelectric
чатки, Биофизика, 13, 338-339.
processes in biological membranes. I. Bacteriorho-
92. Каламкаров Г. Р., Островский М. А. (2002) Моле-
dopsin, Eur. J. Biochem., 117, 461-470, doi: 10.1111/
кулярные механизмы зрительной рецепции, Наука,
j.1432-1033.1981.tb06361.x.
Москва, стр. 1-280.
90. Шевченко Т. Ф., Каламкаров Г. Р., Островский
93. Brindley, G. S., and Gardner-Medwin, A. R. (1966)
М. А. (1987) Отсутствие переноса Н+ через фото-
The origin of the early receptor potential of the retina,
рецепторную мембрану в ходе фотолиза родопси-
J. Physiol., 182, 185-194, doi: 10.1113/jphysiol.1966.
на, Сенс. Сист., 1, 117-126.
sp007817.
SIMILARITY AND DIFFERENCE IN THE PHOTOCHEMISTRY
OF TYPE I AND II RHODOPSINS
Review
M. A. Ostrovsky1,2, O. A. Smitienko2, A. V. Bochenkova3, and T. B. Feldman1,2*
1 Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia; e-mail: feldmantb@mail.ru
2 Emanuel Institute of Biochemical Physics, 119334 Moscow, Russia
3 Faculty of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia
The diversity of retinal-containing proteins in nature is extremely large. The fundamental similarity of the
structure and photochemical properties unites them into one family. However, there is still a debate about
the origin of retinal-containing proteins: divergent or convergent evolution? In this review, based on the
results of our own and literature data, a comparative analysis of the similarities and differences in the pho-
toconversion of rhodopsin types I and II is carried out. The results of experimental studies of direct and
reverse photoreactions of rhodopsin types I (bacteriorhodopsin) and II (visual rhodopsin) in the femto- and
picosecond time interval, photo-reversible reaction of rhodopsin type II (octopus rhodopsin), photovoltaic
reactions of rhodopsin types I and II, as well as quantum chemical calculations of forward photoreactions of
bacteriorhodopsin and visual rhodopsin are presented. The question of the probable convergent evolution of
rhodopsin types I and II is discussed.
Keywords: retinal-containing proteins, visual rhodopsin, bacteriorhodopsin, convergent evolution, photochemistry,
femtosecond spectroscopy, quantum chemical calculations
БИОХИМИЯ том 88 вып. 10 2023