БИОХИМИЯ, 2023, том 88, вып. 10, с. 1867 - 1879
УДК 577.112+577.34
ОСОБЕННОСТИ МЕХАНИЗМА ТРАНСПОРТА ПРОТОНОВ В ESR,
РЕТИНАЛЬНОМ БЕЛКЕ Exiguobacterium sibiricum
Обзор
© 2023 Л.Е. Петровская1*, С.А. Силецкий2, М.Д. Мамедов2, Е.П. Лукашев3,
С.П. Балашов4, Д.А. Долгих1,3, М.П. Кирпичников1,3
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
117997 Москва, Россия; электронная почта: lpetr65@yahoo.com
2 Московский государственный университет имени М.В. Ломоносова,
Научно-исследовательский институт физико-химической биологии имени А.Н. Белозерского,
119991 Москва, Россия
3 Московский государственный университет имени М. В. Ломоносова, биологический факультет,
119234 Москва, Россия
4 Университет Калифорнии, Отдел физиологии и биофизики, 92697 Ирвайн CA, США
Поступила в редакцию 15.06.2023
После доработки 11.07.2023
Принята к публикации 11.07.2023
Ретиналь-содержащие светочувствительные белки - родопсины - обнаружены у многих микро-
организмов. Интерес к ним во многом объясняется их ролью в запасании энергии света и фото-
регуляции в микроорганизмах, а также перспективами использования в оптогенетике с целью
контроля активности нейронов, в том числе для терапии различных заболеваний. Одним из пред-
ставителей микробных родопсинов является ESR, ретинальный белок Exiguobacterium sibiricum.
От гомологичных белков ESR отличает наличие остатка лизина (Lys96) в качестве донора протонов
для основания Шиффа. Эта особенность, наряду с водородной связью акцептора протонов Asp85
с остатком His57, определяет его функциональные характеристики как протонного насоса. В об-
зоре рассматриваются результаты исследований ESR, проведенных с использованием различных
методов, включая метод прямой электрометрии. Сравнение полученных данных с результатами
определения пространственной структуры и с другими ретинальными белками позволяет сделать
выводы о механизмах транспорта ионов водорода в молекуле ESR и подобных ретинальных белков.
КЛЮЧЕВЫЕ СЛОВА: ретинальный белок, протеородопсин, основание Шиффа, акцептор протонов,
донор протонов, фотоцикл, прямой электрометрический метод.
DOI: 10.31857/S032097252310010X, EDN: OTMNUZ
ВВЕДЕНИЕ
света инициирует изомеризацию ретиналя из
all-trans в конфигурацию 13-cis. Релаксация ре-
Микробные родопсины относятся к семей-
тиналя в исходное состояние сопровождается
ству ретиналь-содержащих белков, осущест-
рядом конформационных преобразований в
вляющих светозависимый транспорт ионов,
молекуле белка, сопряженных с транспортом
сенсорные и другие функции [1-3]. Моле-
протона (для родопсинов, выполняющих функ-
кулы этих белков обладают схожей структу-
цию протонного насоса) [5, 6]. Детали этого
рой, включающей семь или восемь (в случае
процесса наиболее подробно изучены для бак-
ферментных родопсинов) трансмембранных
териородопсина Halobacterium salinarum (BR),
альфа-спиральных сегментов и ретиналь, ко-
первого представителя семейства микробных
валентно связанный через основание Шиффа
родопсинов, который был открыт более 50 лет
с остатком лизина [3, 4]. Поглощение кванта назад
[7-9]. Установлено, что в процессе
Принятые сокращения: BR - бактериородопсин Halobacterium salinarum; ESR - ретинальный белок Exiguobacterium
sibiricum; PR - протеородопсин; PRG - протон-выделяющая группа.
* Адресат для корреспонденции.
1867
1868
ПЕТРОВСКАЯ и др.
фотоцикла происходит депротонирование осно-
время был получен ряд важных новых резуль-
вания Шиффа, образованного ретиналем и
татов, во многом благодаря использованию ме-
остатком лизина, и перенос протона на акцеп-
тода прямой электрометрии, разработанного
торный остаток Asp85. Одновременно с этим
Л.А. Драчевым и его коллегами [22, 23].
осуществляется выделение протона на внекле-
Примененный нами вариант данного мето-
точной поверхности белка с участием остатков
да основан на использовании протеолипосом,
Glu194 и Glu204 (так называемой PRG - про-
содержащих исследуемый белок, и макроско-
тон-выделяющей группы [10]). Затем осно-
пической плоской фосфолипидной мембраны,
вание Шиффа репротонируется при участии
армированной для большей стабильности кол-
донорного остатка Asp96, который затем по-
лодиевой пленкой. Перед измерением про-
лучает протон из цитоплазмы. В конце фото-
теолипосомы адсорбируются на поверхности
цикла протон переносится от акцептора на
макроскопической мембраны, разделяющей
остатки протон-выделяющей группы [7, 10].
отсеки измерительной ячейки [23]. В ответ
Указанные молекулярные события соответ-
на вспышку за счет трансмембранного пере-
ствуют возникновению и распаду спектрально
носа протонов, а также движения заряженных
идентифицируемых промежуточных состоя-
групп белка перпендикулярно плоскости мем-
ний (интермедиатов) фотоцикла BR + hν → K →
браны генерируется разность электрических
→ L → M1 ↔ M2 ↔ N1 ↔ N2 ↔ O → BR [7, 10]. Дан-
потенциалов (ΔΨп) на мембране протеолипо-
ные функциональных исследований BR хоро-
сом и пропорциональная ей ΔΨм на макро-
шо согласуются с результатами определения
скопической мембране, которая регистриру-
его пространственной структуры в различных
ется с помощью электрометрической техники
состояниях [11-13].
с высоким временным разрешением.
В дальнейшем в ходе различных геномных
Одним из первых белков, для которого
и метагеномных исследований было обнаруже-
были проведены прямые электрометрические
но множество новых белков, гомологичных BR
измерения, стал BR [22, 24]. Впоследствии ме-
и выполняющих сходные функции [3, 14, 15].
тод широко использовался в исследованиях
В частности, протеородопсины (PR) встреча-
различных ретинальных белков [25-27], ком-
ются у многих представителей Proteobacteria
понентов фотосистем I и II [28-30], цитохром-
и играют важную роль в выживании мик-
оксидазы [31-35] и других объектов. В данном
роорганизмов в неблагоприятных условиях.
обзоре обсуждаются недавние результаты, по-
Исследования PR позволили установить, что
лученные нами в ходе исследований ESR и его
они, подобно BR, содержат акцепторный и
мутантных вариантов, в том числе с использо-
донорный остатки (аспартат и глутамат соот-
ванием метода прямой электрометрии, и про-
ветственно), однако PRG в их молекулах от-
водится их анализ в сравнении с ранее опуб-
сутствует [16, 17]. Важной особенностью PR
ликованными для BR и других ретинальных
является водородная связь между акцептор-
белков.
ным остатком (аспартатом) и боковой группой
остатка гистидина, которая регулирует степень
протонирования и функциональное состояние
ФОТОЦИКЛ ESR: СОПРЯЖЕНИЕ
акцептора в зависимости от рН и участвует в
РЕАКЦИЙ С ПОГЛОЩЕНИЕМ
выделении протона [18, 19].
И ВЫДЕЛЕНИЕМ ПРОТОНОВ
ESR, ретинальный белок почвенной бак-
терии Exiguobacterium sibiricum, также отно-
Изучение светоиндуцированных измене-
сится к протеородопсинам, однако обнару-
ний поглощения в ESR методом флэш-фото-
живает существенное структурное отличие от
лиза обнаружило в его фотоцикле наличие
типичных представителей семейства. Амино-
основных интермедиатов, характерных также
кислотная последовательность ESR содержит
для BR [36] и PR [37]. Вслед за распадом ин-
остаток Lys96 в положении, соответствующем
термедиатов К и L наблюдается рост поглоще-
карбоксильным остаткам с функцией донора
ния при 410 нм в микросекундной временной
протонов для основания Шиффа в молеку-
шкале, что соответствует образованию М-со-
лах BR и PR (Asp96 и Glu108 соответствен-
стояния (депротонированного основания
но) [20] (рис. 1). Эта особенность, наряду с
Шиффа). Интересно отметить, что для ESR в
другими, вызвала интерес к исследованиям
мицеллах детергента DDM (n-додецил-β-D-
структуры и механизма функционирования
мальтопиранозид) этот интермедиат детекти-
ESR, которые проводятся нами на протяже-
руется только при рН выше 8, в то время как
нии более 10 лет. В 2015 году мы опубликовали
для белка в мицеллах липидоподобного де-
обзор этих работ [21], однако за прошедшее
тергента LPG (1-пальмитоил-2-гидрокси-sn-
БИОХИМИЯ том 88 вып. 10 2023
ESR, РЕТИНАЛЬНЫЙ БЕЛОК E. sibiricum
1869
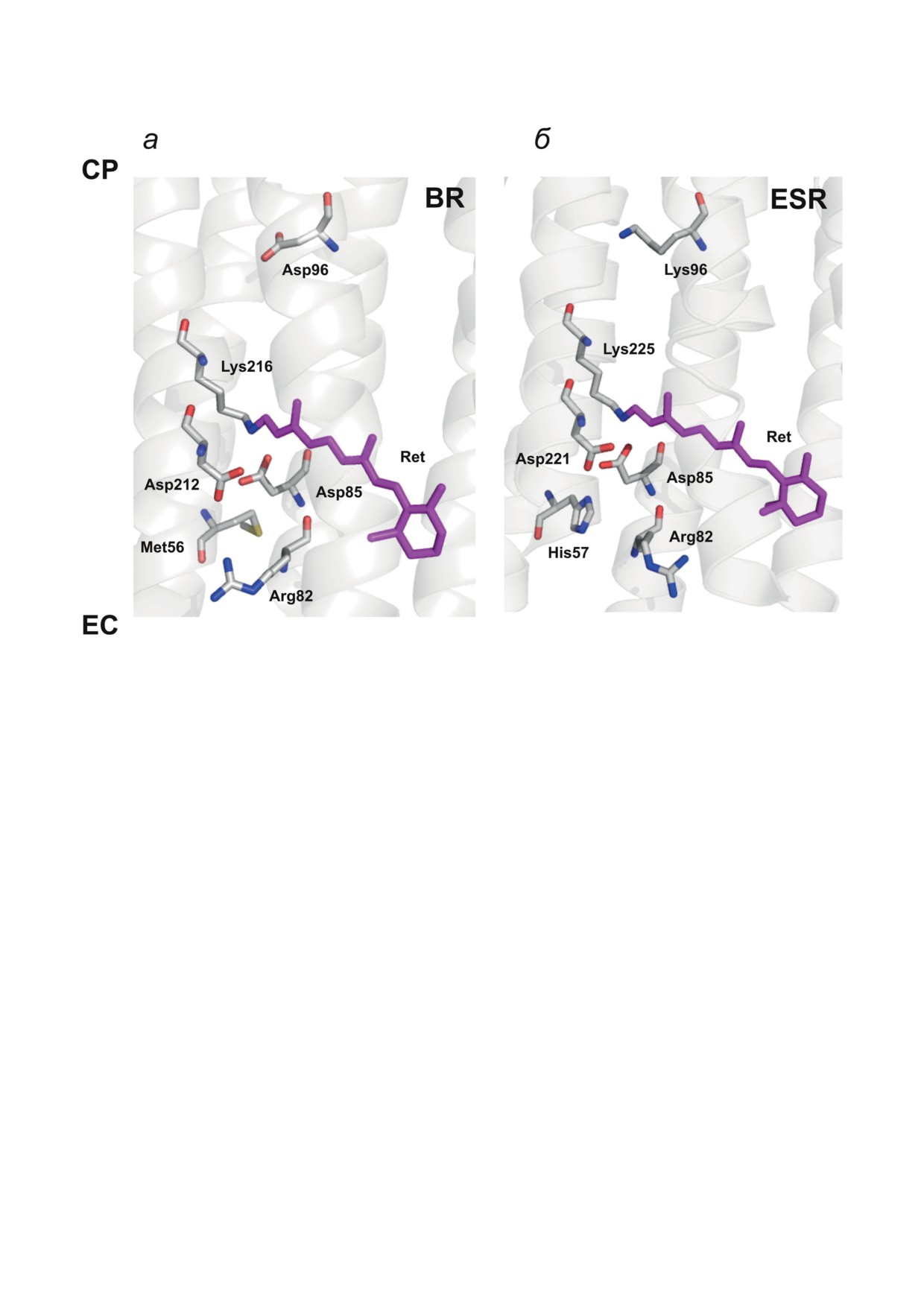
Рис. 1. Пространственная структура BR (а) и ESR (б). Показаны участки молекул, расположенные вблизи основания
Шиффа. Рисунки подготовлены в программе PyMol с использованием координат 1C3W и 4HYJ соответственно. Ret -
all-транс ретиналь; CP - цитоплазматическая поверхность белка; EC - внеклеточная поверхность белка
глицеро-3-фосфо-1′-rac-глицерин) или в про-
от BR, ESR осуществляет выделение протонов
теолипосомах pKa его образования составля-
в конце фотоцикла, что коррелирует с отсут-
ет ~ 6,5 [38, 39]. Репротонирование основания
ствием в его молекуле остатков, гомологич-
Шиффа сопровождается снижением поглоще-
ных PRG [20]. Измерения, проведенные в
ния при 410 нм (отражающим распад состоя-
присутствии рН-чувствительного красителя
ния М) и возникновением интермедиатов N1
пиранина, позволили уточнить временную
и N2, для которых характерен рост поглоще-
связь этого события с распадом длинновол-
ния при 510 и 550 нм. В результате реизоме-
новых интермедиатов фотоцикла и восстанов-
ризации ретиналя образуется интермедиат О,
лением исходного состояния [41]. Сравнение
который поглощает при 590 нм и распадается
кинетик поглощения протона и распада M-ин-
с возвращением в исходное состояние ESR.
термедиата в ESR дикого типа показало, что,
N-Интермедиат присутствует в фотоцикле ESR
в отличие от BR, поглощение протона в этом
вплоть до его завершения [40], таким образом,
белке предшествует репротонированию осно-
схема фотоцикла включает следующие пере-
вания Шиффа, что особенно заметно при про-
ходы: ESR-hν → K, L → M1 ↔ M2 ↔ N1 ↔ N2/O →
ведении измерений в D2O.
→ ESR [39].
При освещении суспензии клеток Es-
cherichia coli, экспрессирующих ESR, или ESR-
ЭЛЕКТРОГЕННЫЕ СТАДИИ
содержащих протеолипосом наблюдается за-
ФОТОЦИКЛА ESR
кисление суспензии, подтверждающее транс-
мембранный перенос протонов с участием
Использование метода прямой электроме-
данного белка [20, 38]. Добавление к клеткам
трии с временным разрешением обеспечивает
протонофора СССР устраняет этот эффект,
возможность вычленения и изучения отдель-
что подтверждает протон-транспортную функ-
ных электрогенных (т.е. направленных пер-
цию ESR [38]. Установлено, что, в отличие
пендикулярно плоскости мембраны) стадий
БИОХИМИЯ том 88 вып. 10 2023
1870
ПЕТРОВСКАЯ и др.
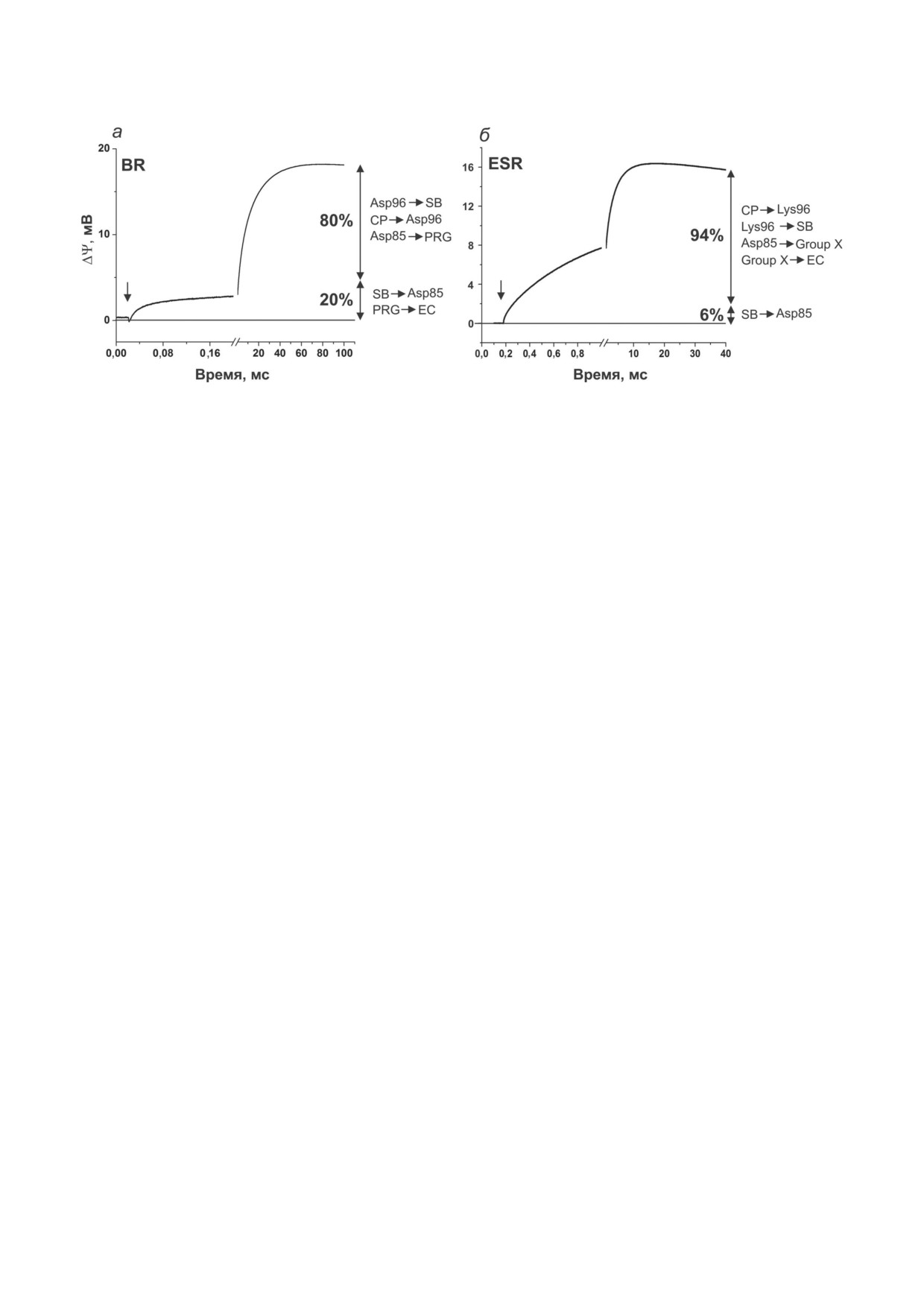
Рис. 2. Кинетика светоиндуцированного образования мембранного электрического потенциала (ΔΨ) протеолипосо-
мами, содержащими BR (а) и ESR (б), при рН 7,5. Стрелкой обозначен момент лазерной вспышки. Приведены отно-
сительные амплитуды микросекундной и миллисекундной электрогенных фаз с указанием соответствующих стадий
переноса протона. SB - основание Шиффа; PRG - протон-выделяющая группа; EC - внеклеточная поверхность бел-
ка; CP - цитоплазматическая поверхность белка; Group X - неидентифицированный остаток/группа остатков, осу-
ществляющих выделение протонов на внеклеточной поверхности ESR. Для удобства фотоэлектрический ответ обоих
белков приводится в одном направлении
перемещения зарядов внутри белка в ответ на
ствует стадиям BR → K → L (фотоиндуцирован-
одиночную вспышку, а параллельный анализ
ной изомеризации ретиналя и последующей
кинетики изменений поглощения позволяет
релаксации соседних остатков). Вторая стадия
связать их со стадиями фотоцикла в ретиналь-
(30-50 мкс) отражает перемещение протона от
ном белке. В отличие от метода с использо-
основания Шиффа на акцептор Asp85 и одно-
ванием красителя, такие измерения, во-пер-
временное освобождение протона во внеш-
вых, позволяют получать прямую уникальную
нюю среду протон-выделяющей группой. Ам-
информацию о перемещении протона внутри
плитуда последней фазы (5-20 мс) составляет
белка, а не только данные об исчезновении
до 80% всего ответа и соответствует переносу
или появлении протона на его поверхности;
протона от внутреннего донора Asp96 на осно-
во-вторых, не ограничены областью рН, близ-
вание Шиффа и последующее репротонирова-
кой к pKa красителя, что в целом открывает
ние донора, а также перенос протона от Asp85
перспективы воссоздания полной картины
к PRG [43] (рис. 2, а).
функционирования протонной помпы при
Кинетика образования мембранного потен-
различных значениях рН.
циала ESR существенно отличается от выше-
Для ESR-содержащих протеолипосом из-
описанной для BR. В частности, в фотоэлек-
мерения проводили при рН 5,1-9,5 [39]. Об-
трическом ответе ESR не наблюдается бы-
щая амплитуда фотоэлектрического ответа при
страя негативная фаза, характерная для BR
нейтральных значениях рН достигала 50 мВ,
(рис. 2, б). Детальный анализ кинетических
что сопоставимо с максимальной величиной
кривых при рН 5,1 позволил, однако, обна-
ответа BR [22]. Однако направление ответа у
ружить ее наличие, «замаскированное» поло-
этих белков было противоположным вслед-
жительными сигналами электрогенных фаз,
ствие различной ориентации их молекул в
совпадающих с ней во времени. Относи-
протеолипосомах (ESR встраивается в том же
тельная суммарная амплитуда микросекунд-
направлении, что и в клетках, N-концом нару-
ных электрогенных фаз ESR (3, 24 и 100 мкс
жу [20, 38], а BR - в противоположном [42]).
при рН 7,5) оказалась примерно в три раза
Соответственно, ESR переносит протоны из
меньше, чем у BR, что может быть связано с
протеолипосом наружу, а для BR наблюдается
отсутствием раннего выделения протонов в
транспорт протонов внутрь протеолипосом
молекуле ESR. Распад интермедиата М вклю-
вследствие обратной по сравнению с клетками
чает две электрогенные фазы, 0,6 и 3,4 мс, с
ориентации.
общим вкладом 75%, предположительно, отра-
Ранее было показано, что фотоэлектриче-
жающие переход M ↔ N1 ↔ N2/O. Последняя
ский ответ BR включает три основных электро-
электрогенная фаза ESR (~18,4 мс) ассоцииро-
генных процесса, причем наиболее быстрый
вана с возвращением к исходному состоянию
(<1 мкс) имеет отрицательный знак и соответ-
(N2/O → ESR) и отражает депротонирование
БИОХИМИЯ том 88 вып. 10 2023
ESR, РЕТИНАЛЬНЫЙ БЕЛОК E. sibiricum
1871
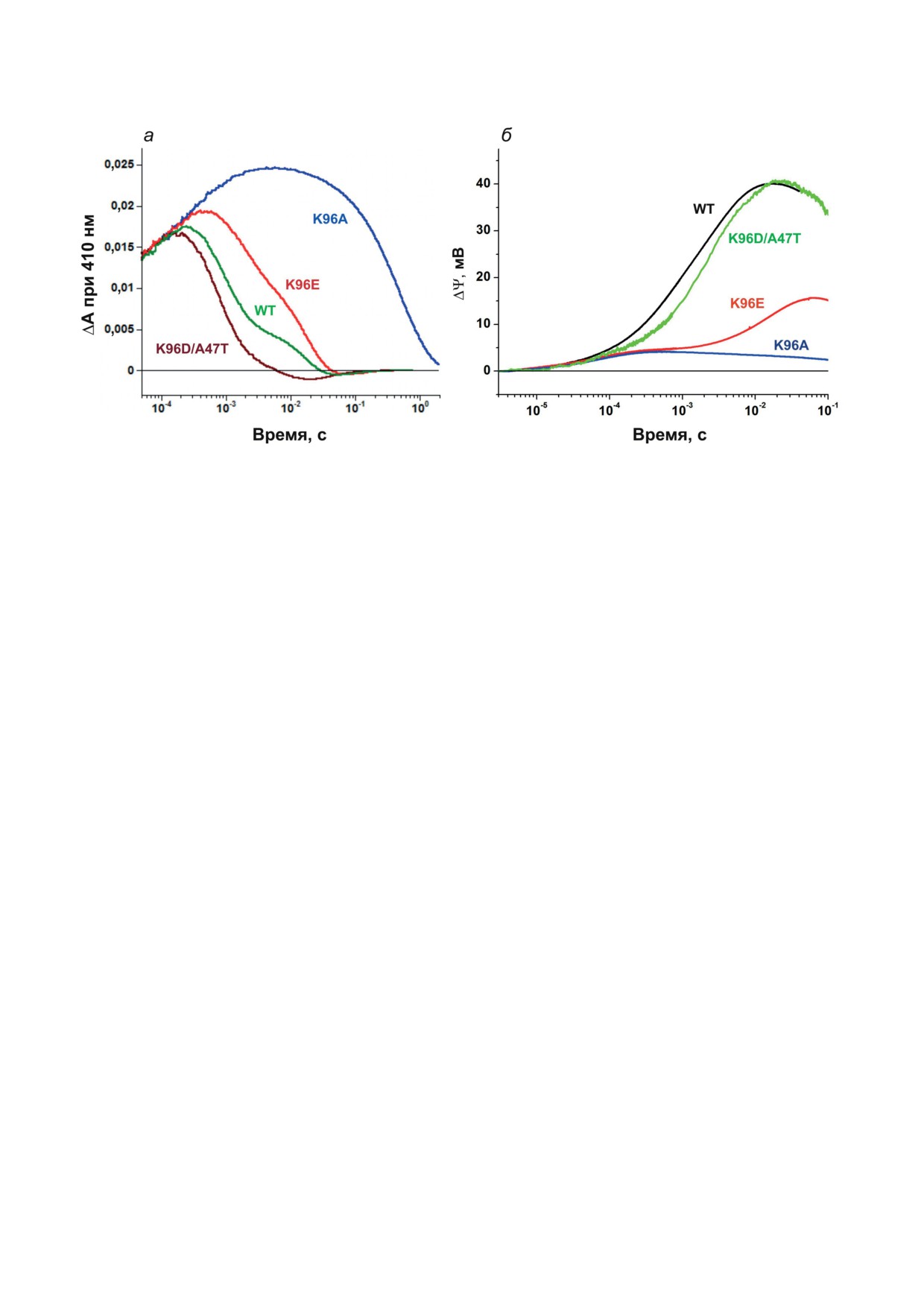
Рис. 3. Свойства мутантных вариантов ESR, содержащих замены остатка Lys96. а - Кинетика светоиндуцированных
изменений поглощения при 410 нм ESR дикого типа (WT) и его мутантных вариантов в 0,06%-ном липидоподобном
детергенте LPG, 100 мM NaCl, рН 7,5; б - кинетика образования трансмембранной разницы потенциалов (ΔΨ) про-
теолипосомами, содержащими ESR дикого типа и его мутантные варианты, при рН 7,5. Из [46], с изменениями
акцептора Asp85 и высвобождение протона мо-
цептора Asp85 и/или связанного с ним остат-
лекулой белка во внешнюю водную среду [39].
ка His57 в исходном состоянии.
Следует отметить, что в фотоэлектриче-
ском ответе ESR-содержащих протеолипосом
при рН 8,4 наблюдается 10-кратное (по срав-
Lys96 - ЭФФЕКТИВНЫЙ ДОНОР
нению с pH 6,5) замедление электрогенных
ПРОТОНОВ ДЛЯ ОСНОВАНИЯ
стадий, соответствующих распаду М-интерме-
ШИФФА В ESR
диата, в результате изменения относительного
вклада кинетических составляющих в пользу
Для определения функциональной роли
более медленной компоненты. При этом до-
остатка Lys96 мы использовали классический
полнительно выделяется отдельная электроген-
подход, включающий получение и исследова-
ная фаза с τ ~ 0,25 мс, соответствующая прото-
ние мутантных вариантов ESR [41, 46]. На пер-
нированию исходно нейтрального Lys96 [39].
вом этапе был сконструирован мутант К96А,
Эти данные свидетельствуют о том, что в ESR
характерными чертами фотоцикла которого
Lys96 и/или взаимодействующая с ним моле-
явились значительное (более чем в 100 раз) за-
кула воды приобретает протон после образо-
медление распада интермедиата М (рис. 3, а) и
вания M-состояния и вскоре после этого пере-
зависимость скорости этого процесса от рН [41].
дает его на основание Шиффа. Таким образом,
Клетки E. coli, экспрессирующие этот мутант,
подтверждается ранее сделанное заключение,
демонстрировали значительное снижение про-
что остаток Lys96 не протонирован в исходном
тонного транспорта по сравнению с клетками,
состоянии при нейтральном рН и временно
содержащими белок дикого типа. Таким обра-
протонируется в М-состоянии с pKa ~ 8,5 [41].
зом, было показано, что наличие остатка Lys96
В молекуле ESR Lys96 окружен преимуществен-
ускоряет репротонирование основания Шиф-
но гидрофобными остатками [44], что пред-
фа в молекуле ESR.
положительно способствует поддержанию со-
В результате измерений фотоэлектрическо-
стояния со сниженным pKa. Сходная ситуация
го ответа протеолипосом, содержащих К96А,
наблюдается для остатка Asp96 в BR, который
было установлено, что данная мутация сопро-
нейтрален и имеет очень высокий pKa в исходном
вождается практически полным исчезнове-
состоянии (~11,4) и, соответственно, протониро-
нием миллисекундной электрогенной фазы,
ван благодаря гидрофобному окружению [45].
которая связана с репротонированием основа-
Понижение рН до 5,1 сопровождается прак-
ния Шиффа (распадом интермедиата М) [47]
тически полным подавлением фотоэлектриче-
(рис. 3, б). Как показали расчеты, замедление
ского ответа ESR и возникновением заметных
этого процесса, характерное для мутанта К96А,
отрицательных по направлению фаз, предпо-
само по себе не должно было привести к тако-
ложительно в результате протонирования ак-
му результату.
БИОХИМИЯ том 88 вып. 10 2023
1872
ПЕТРОВСКАЯ и др.
Аппроксимация экспериментальной кри-
са протонов и электрогенности мутантов ESR
вой суммой кинетических компонент выявило
K96E и K96D/A47T [46]. В отличие от мутан-
наличие в миллисекундной части кинетики
та К96А, скорости поглощения протона и его
нескольких электрогенных фаз, имеющих отри-
переноса на основание Шиффа в этих белках
цательное направление. Отрицательное значе-
сопоставимы с таковыми в белке дикого типа.
ние амплитуд миллисекундных фаз, соответ-
В K96E распад M происходит несколько мед-
ствующих быстрому распаду М-интермедиата
леннее, чем в диком типе - с большей долей
в мутантном белке, указывает на то, что ре-
медленного компонента, а в K96D/A47T -
протонирование основания Шиффа проис-
даже быстрее, чем в диком типе (временная
ходит в необычном направлении - со стороны
константа быстрого компонента составляет
внеклеточной поверхности белка. Об этом же
~ 0,7 мс против 1 мс у дикого типа) (рис. 3, а).
свидетельствует и незначительная амплитуда
Репротонирование основания Шиффа и по-
положительной компоненты электрогенного
глощение протонов из среды у этих мутантов
ответа, которая, по-видимому, включает в себя
происходят почти одновременно во время пе-
как диффузию протона с цитоплазматической
рехода M в N (как в ESR дикого типа при ней-
поверхности белка, так и его движение в про-
тральном рН), тогда как у BR эти две стадии
тивоположном направлении. При низких рН
хорошо разделены и совпадают во времени с пе-
преобладает первый из указанных механиз-
реходами M в N и N в O соответственно [48, 50].
мов, в то время как при рН 8,5 начинает доми-
Это отражает различный механизм участия до-
нировать второй. Добавление азида к данному
нора в репротонировании основания Шиффа
мутанту приводило к ускорению доставки
в BR и ESR. Интересно отметить, что у му-
протонов с цитоплазматической стороны бел-
тантов K96D/A47T и K96E образование со-
ка и к увеличению амплитуды положительных
стояния M сопровождается частичным выс-
компонентов электрогенного ответа [47].
вобождением протона, предположительно на ци-
Таким образом, проведенные эксперимен-
топлазматической поверхности белка (т.е. пе-
ты показали, что пониженная эффективность
ремещением в обратном направлении). Причи-
транспорта протонов в мутанте K96A объяс-
ны этого явления будут рассмотрены ниже.
няется не только замедлением фотоцикла, но
Фотоэлектрический ответ мутантов K96D/
и уменьшением прямого транспорта и повы-
A47T и K96E содержит электрогенные милли-
шением вклада обратных реакций, предпо-
секундные фазы, связанные с репротониро-
ложительно, со стороны акцепторного участка
ванием основания Шиффа, которые анало-
His57-Asp85. Следует отметить, что в BR му-
гичны таковым у дикого типа, но отсутствуют
тации по донорному остатку (D96N и D96A)
у мутанта K96A. Основным отличием в элек-
сопровождаются замедлением фотоэлектриче-
трогенной кинетике мутанта K96E является
ского ответа в миллисекундной области, но не
гораздо более медленный основной миллисе-
его исчезновением, что является следствием
кундный компонент генерации ΔΨ (рис. 3, б).
различной конфигурации протон-акцептор-
В протеолипосомах, содержащих K96D/A47T,
ного участка BR и ESR (рис. 1) и указывает на
генерация ΔΨ происходит в основном во вре-
отличия в механизме протонного транспорта
мя распада интермедиата М, в то время как у
в этих белках [48, 49]. Дополнительные аргу-
мутанта K96E - во время распада N. Это яв-
менты в пользу роли отстатка His57 в возник-
ляется независимым доказательством того,
новении обратных реакций были получены в
что карбоксильные остатки функционируют
ходе исследования мутантов по этому остат-
как доноры протонов в ESR с эффективно-
ку (см. ниже).
стью, сравнимой с эффективностью лизина
в случае двойного мутанта и несколько мень-
шей - в K96E.
КАРБОКСИЛЬНЫЕ
Следует отметить, что японские ученые
АМИНОКИСЛОТНЫЕ ОСТАТКИ
опубликовали исследование мутантных вари-
НА МЕСТЕ Lys96 В ESR
антов PR, в котором остаток аспартата замени-
ли на лизин и глутамин (E108K и E108Q), а так-
«Могут ли карбоксильные остатки выпол-
же ESR c заменами К96D, K96Q и K96E [51].
нять функцию донора протонов в молеку-
Мутант K96D демонстрировал быструю ско-
ле ESR?» - такой вопрос мы задавали в пре-
рость распада M, сравнимую с диким типом,
дыдущем обзоре [21]. Сейчас можно уверенно
в то время как мутация K96E демонстрировала
ответить на него: «В целом да, но есть отличия
более медленную скорость распада M. Было
по сравнению с тем, как они работают в BR».
показано также, что Lys может заменять на-
Мы исследовали кинетику фотоцикла, перено-
тивный Glu в донорном участке PR [51].
БИОХИМИЯ том 88 вып. 10 2023
ESR, РЕТИНАЛЬНЫЙ БЕЛОК E. sibiricum
1873
Отсутствие существенной задержки между
что замена His57 оказывает радикальное воз-
поглощением протонов и репротонировани-
действие на различные свойства ESR, вклю-
ем основания Шиффа у мутантов K96D/A47T
чая рН-зависимость максимума поглощения
и K96E, а также раннее освобождение протона
и рКа образования интермедиата М [38]. В от-
с обратной стороны мембраны свидетельству-
личие от ESR дикого типа, максимум погло-
ют о том, что у мутантов ESR карбоксильные
щения которого слабо зависит от рН в диа-
остатки в положении 96 протонированы (не за-
пазоне 3-10, для мутанта H57M характерен
ряжены) в исходном состоянии, аналогич-
значительный (на 47 нм) сдвиг максимума при
но BR. Предположительно, после образования
повышении рН от 5 до 8,5. При рН 5 макси-
промежуточного продукта M они попадают
мум поглощения H57M составляет 565 нм, что
в более гидрофильное окружение по сравне-
соответствует максимуму поглощения мутан-
нию с исходным состоянием, в результате чего
та D85N. Таким образом, связь с His57 опре-
происходит снижение их pKa до 6,5-8,5. Это
деляет степень протонирования остатка Asp85,
приводит к частичному депротонированию
т.е. его способность функционировать в каче-
донорных остатков и освобождению протона в
стве акцептора протонов от основания Шиф-
среду, за которыми следуют репротонирование
фа. С целью уточнения функциональной роли
основания Шиффа и почти одновременное
данного взаимодействия мы продолжили из-
поглощение протона. Следовательно, донор-
учение свойств ESR с заменой H57N и двой-
ные остатки в ESR способны быстро переклю-
ного мутанта H57N/K96A с помощью метода
чаться от равновесия со средой на равновесие
прямой электрометрии.
с основанием Шиффа во время перехода от M
В результате измерений фотоцикла протео-
к N, что согласуется с данными структурных
липосом, содержащих данный мутант, установ-
исследований. Боковая цепь Lys96 обладает
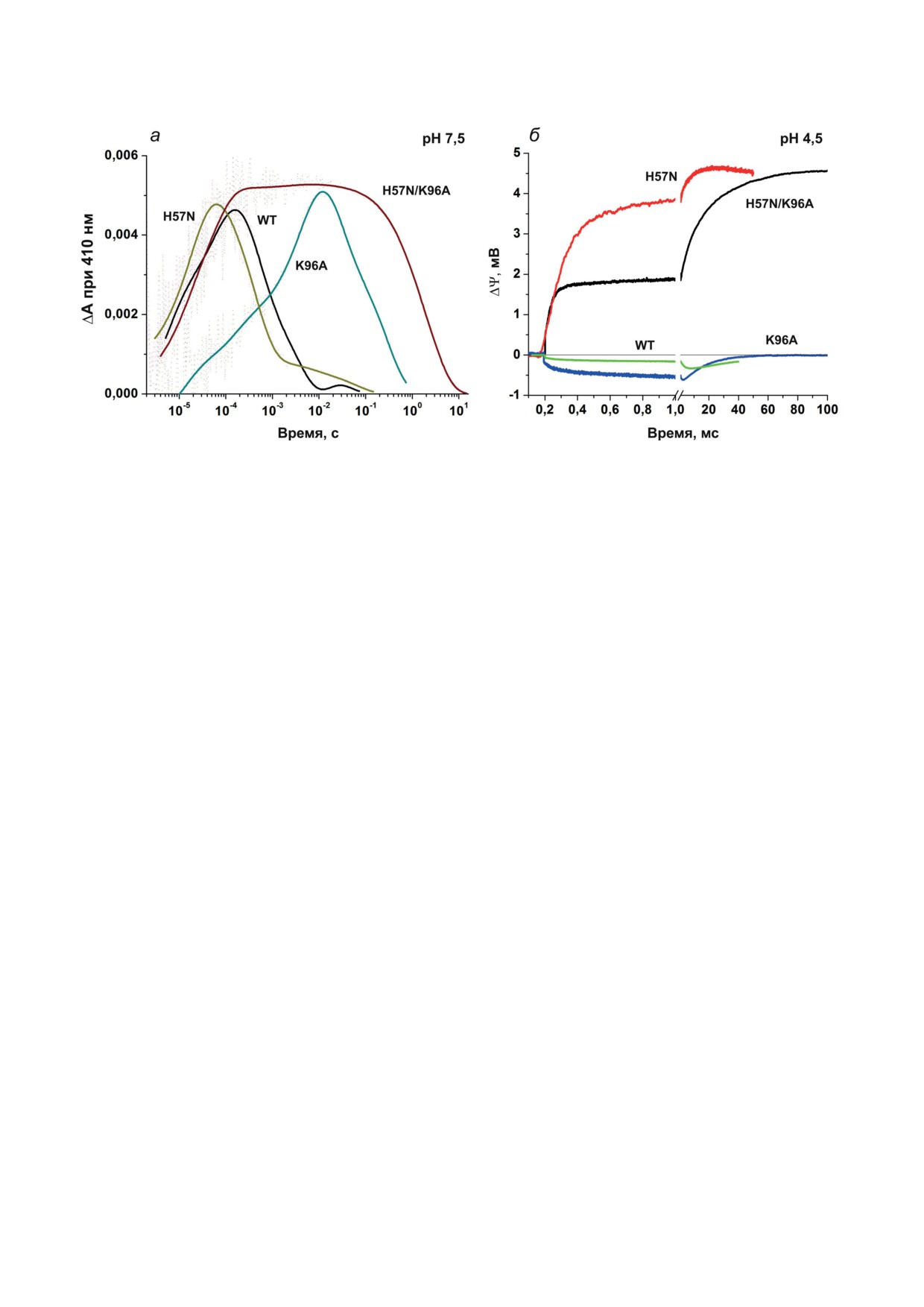
лено, что замена H57N приводит к ускорению
определенной подвижностью, а полость вокруг
образования интермедиата М благодаря отсут-
этого остатка находится очень близко к поверх-
ствию в этом процессе медленной фазы спек-
ности белка и отделена от водной среды только
тральных изменений, ранее обнаруженной в
полярной боковой цепью Thr43, что отлича-
фотоцикле ESR и мутанта К96А (рис. 4, а).
ет ESR от более скрытого положения протон-
Аналогичная компонента отсутствует также
ных донорных групп в BR и XR [44]. Аналогич-
и в фотоэлектрическом ответе, что указывает
ный вывод был сделан Sasaki et al. [51], которые
на связь медленной фазы генерации М в ESR
предположили, что конформационные изме-
с остатком Нis57 (возможное объяснение
нения белка, связанные с репротонированием
этой связи приводится в следующем разделе).
основания Шиффа, меньше у мутантов ESR,
По сравнению с диким типом ESR, распад М
чем у BR, и могут включать движения боковой
в мутанте H57N также происходит быстрее и
цепи донорного остатка, соединяя его со сре-
включает единственную стадию, поскольку не
дой или с основанием Шиффа.
сопровождается накоплением состояния N1.
Интересно, что в двойном мутанте H57N/
K96A распад интермедиата M происходит
ЗАМЕНА His57 ОБЕСПЕЧИВАЕТ
в 1000 раз медленнее, чем в диком типе и
ТРАНСПОРТ ПРОТОНОВ ESR
в мутанте H57N, и в 10 раз медленнее, чем
В ШИРОКОМ ДИАПАЗОНЕ рН
в К96А (рис. 4, а). Это явление можно объ-
яснить устранением обратного перемещения
Наличие остатка гистидина, связанного
протонов на основание Шиффа в результа-
водородной связью с акцепторным остатком
те замены Н57N. Предположительно, замена
аспартата, является отличительной чертой
остатка His57 в окружении акцептора прото-
белков, относящихся к семейству протеоро-
нов Asp85 приводит к изменениям заряда или
допсинов, включая ESR, a также ксанторо-
других свойств среды, в результате чего созда-
допсинов (XR) [38, 52, 53]. Взаимодействие
ется кинетический барьер для такого переме-
между боковой цепью гистидина и остатками
щения.
соседней субъединицы играет важную роль
Ранее при исследовании рН-зависимости
в олигомеризации PR и родопсина Gloeo-
транспорта протонов клетками E. coli, экс-
bacter (GR) [54-56]. Тесное взаимодействие
прессирующими ESR, было установлено, что
His57 и Asp85 в молекуле ESR было выявлено
при рН ниже 5 эффективность работы белка
как в результате функциональных исследо-
дикого типа как протонной помпы существен-
ваний мутантов по этому остатку [38], так
но снижена [38]. Оказалось, что в тех же усло-
и благодаря определению пространственной
виях мутанты H57N и H57N/K96A демонстри-
структуры белка [44] (рис. 1). Установлено,
руют высокую эффективность транспорта [57].
11
БИОХИМИЯ том 88 вып. 10 2023
1874
ПЕТРОВСКАЯ и др.
Рис. 4. Свойства мутантных вариантов ESR, содержащих замены остатка His57. а - Кинетика светоиндуцирован-
ных изменений поглощения при 410 нм протеолипосомами, содержащими ESR дикого типа (WT) и его мутантные
варианты, при рН 7,5; б - кинетика образования трансмембранной разницы потенциалов (ΔΨ) протеолипосомами,
содержащими ESR дикого типа и его мутантные варианты, при рН 4,5. Из [57], с изменениями
В соответствии с этими данными, при pH 4,5
ОСОБЕННОСТИ
мутанты с заменой H57N сохраняют амплиту-
ФУНКЦИОНИРОВАНИЯ ESR
ду и направление фотоэлектрического ответа,
КАК ПРОТОННОГО НАСОСА
в отличие от дикого типа и мутанта с одиноч-
ной заменой K96A (рис. 4, б). Таким образом,
На основании полученных результатов мы
взаимодействие His57 и Asp85 ограничивает
предложили схемы функционирования ESR
транспорт протонов при низких рН для дикого
и его мутантных вариантов в различных усло-
типа ESR. В мутанте H57N при рН 4,5 оста-
виях [21, 39, 46, 47, 57]. Ранее опубликованная
ток Lys96, предположительно, протонирован
последовательность реакций переноса протона
уже в исходном состоянии. Благодаря этому
для дикого типа ESR включала в себя: 1) пере-
репротонирование основания Шиффа в про-
нос протона от основания Шиффа на акцептор
цессе распада интермедиата М происходит с
Asp85 в процессе образования интермедиата М;
высокой скоростью, после чего донор полу-
2) протонирование донора Lys96 с цитоплазма-
чает протон из среды, подобно тому, как это
тической поверхности белка; 3) репротонирова-
происходит при нейтральных рН в BR, где до-
ние основания Шиффа с участием Lys96 и 4) де-
нор Asp96 исходно протонирован. Полученные
протонирование Asp85 и освобождение протона
данные свидетельствуют в пользу того, что Lys96
на внеклеточной поверхности белка с участием
может эффективно выполнять функцию донора
неустановленной группы остатков [41]. Основ-
и при низких значениях рН.
ные этапы этой схемы были прямо подтвержде-
Как указывалось выше, на основа-
ны и охарактеризованы при измерении с вре-
нии рН-зависимости максимума поглоще-
менным разрешением электрогенных событий
ния от рН ранее был сделан вывод о том, что
перемещения протона в ходе фотоцикла ESR.
при рН < 6 акцептор протонов от основания
Кроме того, схема была дополнена с учетом
Шиффа Asp85 в мутанте H57N должен нахо-
данных, полученных в результате измерений
диться в протонированном состоянии в де-
прямым электрометрическим методом. В част-
тергенте DDM. Однако последующие экспе-
ности, было уточнено происхождение мед-
рименты продемонстрировали эффективную
ленных стадий образования интермедиата М,
работу этого мутанта как протонной помпы
которые наблюдаются в ESR при нейтральных
при рН ниже 5 в мембранах липосом. Можно
значениях рН. Поскольку в мутанте H57N этот
предположить, что pKa Asp85 в H57N понижа-
процесс ускорен и не включает медленные ком-
ется в более гидрофобном окружении липосом
поненты, так же как и в белке дикого типа в ще-
и после изомеризации ретиналя в конфигура-
лочных условиях, был сделан вывод об их связи
цию 13-cis, открывая возможность для пере-
с наличием положительного заряда на остатке
хода протона на основание Шиффа в процессе
гистидина, который препятствует переносу про-
распада интермедиата L.
тона от основания Шиффа на акцептор Asp85.
БИОХИМИЯ том 88 вып. 10 2023
ESR, РЕТИНАЛЬНЫЙ БЕЛОК E. sibiricum
1875
Наличие остатка His57 и его взаимодей-
значение для понимания механизма функцио-
ствие с Asp85 объясняет также и некоторые
нирования открытых позднее ретинальных
другие особенности протонного транспор-
белков, также содержащих остаток лизина
та в ESR, включая пониженную эффектив-
в качестве донора протонов для основания
ность транспорта при низких значениях рН
Шиффа [59, 60].
и повышенную роль обратных реакций в му-
Как было отмечено выше, отсутствие про-
танте К96А по сравнению с аналогичными
тон-выделяющей группы и раннего выделе-
мутантами BR. Обратные реакции, т.е. возвра-
ния протонов является важным отличием ESR
щение протона от акцептора Asp85 на основа-
от BR. Однако в ходе исследования мутантных
ние Шиффа, могут определяться пониженным
вариантов белка были обнаружены данные,
значением pKa акцептора ESR (Asp85-His57) в
свидетельствующие о частичном освобожде-
М-состоянии по сравнению с BR или меньшим
нии протона на более ранних стадиях фото-
барьером для обратного переноса от Asp85
цикла - в момент образования интермедиата М.
на основание Шиффа. Высокое значение
Так, относительная амплитуда соответствую-
pK Asp85 в BR на этой стадии (~11) связано с
щей электрогенной фазы у мутанта H57N ока-
удалением положительно заряженного остатка
залась существенно больше, чем у ESR дикого
аргинина от Asp85, повышением гидрофоб-
типа (28% и 5% соответственно). Предположи-
ности окружения Asp85 и ранним выделением
тельно, у мутанта она включает в себя также
протона с участием PRG [10, 58]. В молеку-
освобождение протона на внеклеточной сто-
ле ESR выделение протона происходит в конце
роне белка, подобно тому, как это происходит
фотоцикла [20, 38], вследствие чего внеклеточ-
у BR [56]. Раннее выделение протона было
ная часть белка может сохранять положитель-
также зафиксировано у мутантов, содержащих
ный заряд достаточно длительное время. Это,
замены лизина на карбоксильные остатки,
предположительно, приводит к увеличению
K96D/A47T и K96E. В этом случае, по-види-
вероятности обратного переноса протона от
мому, оно происходит на цитоплазматической
акцептора на основание Шиффа [47]. В ESR
поверхности белка и является результатом уве-
дикого типа благодаря присутствию донора
личения гидратированности полости, содер-
Lys96 и быстрому репротонированию основа-
жащей донорные остатки, в процессе обра-
ния Шиффа обратные реакции играют незна-
зования интермедиата М [46]. Для уточнения
чительную роль, однако в мутанте К96А их
механизмов этих процессов в дальнейшем бу-
влияние оказывается драматическим, приводя
дут проведены дополнительные исследования.
к существенному снижению эффективности
транспорта протонов [41, 47].
Таким образом, важной функцией Lys96
ЗАКЛЮЧЕНИЕ
в молекуле ESR является, помимо непосред-
ственно репротонирования основания Шиф-
Многочисленные работы последних лет,
фа, еще и предотвращение обратных реакций,
посвященные ретинальным белкам, продемон-
снижающих эффективность работы помпы.
стрировали их впечатляющее природное раз-
В отличие от BR и PR, в которых функцию
нообразие, а также широкое распространение
донора протонов выполняют исходно про-
среди микроорганизмов, населяющих различ-
тонированные карбоксильные остатки, оста-
ные экологические ниши. Так, установлено,
ток лизина в молекуле ESR приобретает про-
что более половины представителей микроб-
тон непосредственно перед передачей его на
ных сообществ Мирового океана содержат гены
основание Шиффа. Такая последовательность
родопсинов, которые вносят существенный
событий ранее была установлена в экспери-
вклад в усвоение солнечной энергии микроор-
ментах с использованием рН-чувствительного
ганизмами [61, 62]. Общее устройство молеку-
красителя [41] и затем подтверждена с помо-
лы и основные механизмы функционирования
щью метода прямой электрометрии [39]. Об-
этих белков являются универсальными для все-
наружение отдельной электрогенной стадии,
го семейства, однако эволюционная адаптация
соответствующей протонированию донора в
к конкретным условиям существования при-
процессе перехода М1 ↔ М2 в результате повы-
водит к возникновению тонких настроек этих
шения рН до 8,4 и соответствующего замед-
механизмов [5]. На примере ESR, ретинального
ления репротонирования основания Шиффа,
белка почвенной бактерии, мы показали, каким
дополнительно продемонстрировало возмож-
образом изменения первичной структуры на-
ности данного метода, поскольку в оптиче-
ходят отражение в особенностях протонного
ских измерениях эта стадия никак не проявля-
транспорта в его молекуле. Неоценимую роль
лась. Описанные закономерности могут иметь
в этих исследованиях играют методы, позво-
БИОХИМИЯ том 88 вып. 10 2023
11*
1876
ПЕТРОВСКАЯ и др.
ляющие с высоким временным разрешением
Вклад авторов. Л.Е. Петровская, С.А. Си-
наблюдать за процессами, происходящими в
лецкий, С.П. Балашов, Д.А. Долгих, М.П. Кир-
молекуле белка в ответ на поглощение кванта
пичников - концепция и руководство работой,
света. В этой связи метод прямой электроме-
редактирование текста статьи; Л.Е. Петровская,
трии занимает особую нишу, обеспечивая по-
С.А. Силецкий, М.Д. Мамедов, Е.П. Лукашев,
лучение уникальной информации о перемеще-
С.П. Балашов - написание текста статьи.
нии протона внутри молекул протонных помп.
Финансирование. Работа выполнена при
Изучение деталей пространственной структу-
поддержке Российского научного фонда (грант
ры и функциональных особенностей микроб-
№ 22-14-00104).
ных родопсинов способствует более полному
Конфликт интересов. Авторы заявляют об
пониманию принципов их устройства, а также
отсутствии конфликта интересов.
открывает возможность разработки подходов
Соблюдение этических норм. Настоящая
для направленного изменения их свойств, на-
статья не содержит описания каких-либо ис-
пример, с целью создания новых инструментов
следований с участием людей или животных
для оптогенетики [6, 63-65].
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Engelhard, M. (2022) Molecular Biology of Microbial
10.
Balashov, S. P. (2000) Protonation reactions and
Rhodopsins, in Rhodopsin: Methods and Protocols
their coupling in bacteriorhodopsin, Biochim.
(Gordeliy, V., ed) Springer US, New York, NY,
Biophys. Acta Bioenergetics, 1460, 75-94, doi: 10.1016/
pp. 53-69, doi: 10.1007/978-1-0716-2329-9_2.
S0005-2728(00)00131-6.
2.
Govorunova, E. G., Sineshchekov, O. A., Li, H., and
11.
Neutze, R., Pebay-Peyroula, E., Edman, K.,
Spudich, J. L. (2017) Microbial rhodopsins: diversity,
Royant, A., Navarro, J., and Landau, E. M. (2002)
mechanisms, and optogenetic applications, Annu.
Bacteriorhodopsin: a high-resolution structural
Rev. Biochem., 86, 845-872, doi: 10.1146/annurev-
view of vectorial proton transport, Biochim. Biophys.
biochem-101910-144233.
Acta Biomembranes,
1565,
144-167, doi:
10.1016/
3.
Rozenberg, A., Inoue, K., Kandori, H., and Béjà, O.
S0005-2736(02)00566-7.
(2021) Microbial rhodopsins: the last two decades,
12.
Luecke, H., Schobert, B., Richter, H.-T., Cartailler,
Annu. Rev. Microbiol., 75, 427-447, doi: 10.1146/
J.-P., and Lanyi, J. K. (1999) Structural changes in
annurev-micro-031721-020452.
bacteriorhodopsin during ion transport at 2 angstrom
4.
Gushchin, I., and Gordeliy, V. (2018) Microbial
resolution, Science,
286,
255-260, doi:
10.1126/
Rhodopsins, in Membrane Protein Complexes: Struc-
science.286.5438.255.
ture and Function (Harris, J. R., and Boekema,
13.
Nango, E., Royant, A., Kubo, M., Nakane, T.,
E. J., eds) Springer Singapore, Singapore. pp 19-56,
Wickstrand, C., Kimura, T., Tanaka, T., Tono, K.,
doi: 10.1007/978-981-10-7757-9_2.
Song, C., Tanaka, R., Arima, T., Yamashita, A.,
5.
Brown, L. S. (2022) Light-driven proton transfers and
Kobayashi, J., Hosaka, T., Mizohata, E., Nogly, P.,
proton transport by microbial rhodopsins - A bio-
Sugahara, M., et al. (2016) A three-dimensional movie
physical perspective, Biochim. Biophys. Acta Biomem-
of structural changes in bacteriorhodopsin, Science,
branes, 1864, 183867, doi: 10.1016/j.bbamem.2022.
354, 1552-1557, doi: 10.1126/science.aah3497.
183867.
14.
Pushkarev, A., and Béjà, O.
(2016) Functional
6.
Kandori, H. (2020) Biophysics of rhodopsins and
metagenomic screen reveals new and diverse microbial
optogenetics, Biophys. Rev., 12, 355-361, doi: 10.1007/
rhodopsins, ISME J., 10, 2331-2335, doi: 10.1038/
s12551-020-00645-0.
ismej.2016.7.
7.
Lanyi, J. K.
(2006) Proton transfers in the
15.
Inoue, K.
(2021) Diversity, Mechanism, and
bacteriorhodopsin photocycle, Biochim. Biophys. Acta,
Optogenetic Application of Light-Driven Ion Pump
1757, 1012-1018, doi: 10.1016/j.bbabio.2005.11.003.
Rhodopsins, in Optogenetics: Light-Sensing Proteins
8.
Skulachev, V. P., Bogachev, A. V., and Kasparinsky,
and Their Applications in Neuroscience and Beyond
F. O.
(2013) Bacteriorhodopsin, in Principles of
(Yawo, H., Kandori, H., Koizumi, A., and Kageyama,
Bioenergetics, Springer-Verlag. Berlin, Heidelberg,
R., eds) Springer Singapore, Singapore, pp. 89-126,
pp. 139-156, doi: 10.1007/978-3-642-33430-6_6.
doi: 10.1007/978-981-15-8763-4_6.
9.
Oesterhelt, D., and Stoeckenius, W. (1971) Rhodop-
16.
Bamann, C., Bamberg, E., Wachtveitl, J., and
sin-like protein from the purple membrane of Halo-
Glaubitz, C. (2014) Proteorhodopsin, Biochim. Bio-
bacterium halobium, Nat. New Biol., 233, 149-152,
phys. Acta Bioenergetics, 1837, 614-625, doi: 10.1016/
doi: 10.1038/newbio233149a0.
j.bbabio.2013.09.010.
БИОХИМИЯ том 88 вып. 10 2023
ESR, РЕТИНАЛЬНЫЙ БЕЛОК E. sibiricum
1877
17.
Brown, L. S. (2014) Eubacterial rhodopsins - unique
heliorhodopsin family, Proc. Natl. Acad. Sci. USA,
photosensors and diverse ion pumps, Biochim. Biophys.
117, 4131-4141, doi: 10.1073/pnas.1915888117.
Acta Bioenergetics,
1837,
553-561, doi:
10.1016/
27.
Rokitskaya, T. I., Maliar, N. L., Siletsky, S. A.,
j.bbabio.2013.05.006.
Gordeliy, V., and Antonenko, Y. N. (2022) Electro-
18.
Bergo, V. B., Sineshchekov, O. A., Kralj, J. M.,
physiological Characterization of Microbial Rho-
Partha, R., Spudich, E. N., Rothschild, K. J., and
dopsin Transport Properties: Electrometric and ΔpH
Spudich, J. L. (2009) His-75 in proteorhodopsin, a
Measurements Using Planar Lipid Bilayer, Collodion
novel component in light-driven proton translocation
Film, and Fluorescent Probe Approaches, in Rhodop-
by primary pumps, J. Biol. Chem., 284, 2836-2843,
sin: Methods and Protocols (Gordeliy, V. ed) Spring-
doi: 10.1074/jbc.M803792200.
er US, New York, NY, pp. 259-275, doi: 10.1007/
19.
Hempelmann, F., Holper, S., Verhoefen, M. K.,
978-1-0716-2329-9_12.
Woerner, A. C., Kohler, T., Fiedler, S. A., Pfleger, N.,
28.
Mamedov, M. D., Beshta, O. E., Samuilov, V. D.,
Wachtveitl, J., and Glaubitz, C. (2011) His75-Asp97
and Semenov, A. Y. (1994) Electrogenicity at the
cluster in green proteorhodopsin, J. Am. Chem. Soc.,
secondary quinone acceptor site of cyanobacterial
133, 4645-4654, doi: 10.1021/Ja111116a.
photosystem II, FEBS Lett.,
350,
96-98,
20.
Petrovskaya, L. E., Lukashev, E. P., Chupin, V. V.,
doi: 10.1016/0014-5793(94)00742-X.
Sychev, S. V., Lyukmanova, E. N., Kryukova, E. A.,
29.
Mamedov, M., Gadzhieva, R., Gourovskaya, K.,
Ziganshin, R. H., Spirina, E. V., Rivkina, E. M.,
Drachev, L., and Semenov, A. Y. (1996) Electroge-
Khatypov, R. A., Erokhina, L. G., Gilichinsky,
nicity at the donor/acceptor sides of cyanobacterial
D. A., Shuvalov, V. A., and Kirpichnikov, M. P.
photosystem I, J. Bioenerg. Biomembr., 28, 517-522,
(2010) Predicted bacteriorhodopsin from Exiguo-
doi: 10.1007/BF02110441.
bacterium sibiricum is a functional proton pump,
30.
Mamedov, M. D., Tyunyatkina, A. A., Siletsky, S. A.,
FEBS Lett., 584, 4193-4196, doi: 10.1016/j.febslet.
and Semenov, A. Y. (2006) Voltage changes involv-
2010.09.005.
ing photosystem II quinone-iron complex turnover,
21.
Petrovskaya, L., Balashov, S., Lukashev, E.,
Eur. Biophys. J., 35, 647-654, doi: 10.1007/s00249-
Imasheva, E., Gushchin, I. Y., Dioumaev, A.,
006-0069-3.
Rubin, A., Dolgikh, D., Gordeliy, V., Lanyi, J., and
31.
Siletsky, S. A., and Konstantinov, A. A.
(2012)
Kirpichnikov, M. (2015) ESR - A retinal protein with
Cytochrome c oxidase: charge translocation coupled
unusual properties from Exiguobacterium sibiricum,
to single-electron partial steps of the catalytic cycle,
Biochemistry (Moscow), 80, 688-700, doi: 10.1134/
Biochim. Biophys. Acta Bioenergetics, 1817, 476-488,
S000629791506005X.
doi: 10.1016/j.bbabio.2011.08.003.
22.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D.,
32.
Siletsky, S. A., Soulimane, T., Belevich, I., Gennis,
Kondrashin, A. A., Liberman, E. A., Nemecek, I. B.,
R. B., and Wikström, M. (2021) Specific inhibition
Ostroumov, S. A., Semenov, A. Y., and Skulachev,
of proton pumping by the T315V mutation in the K
V. P. (1974) Direct measurement of electric cur-
channel of cytochrome ba3 from Thermus thermo-
rent generation by cytochrome oxidase, H+-ATPase
philus, Biochim. Biophys. Acta Bioenergetics, 1862,
and bacteriorhodopsin, Nature,
249,
321-324,
148450, doi: 10.1016/j.bbabio.2021.148450.
doi: 10.1038/249321a0.
33.
Siletsky, S. A., and Gennis, R. B. (2021) Time-re-
23.
Drachev, L. A., Kaulen, A. D., Semenov, A. Y.,
solved electrometric study of the F→O transi-
Severina, I. I., and Skulachev, V. P. (1979) Lip-
tion in cytochrome c oxidase. The effect of Zn2+
id-impregnated filters as a tool for studying the elec-
ions on the positive side of the membrane, Bio-
tric current-generating proteins, Anal. Biochem., 96,
chemistry (Moscow),
86,
105-122, doi:
10.1134/
250-262, doi: 10.1016/0003-2697(79)90580-3.
S0006297921010107.
24.
Drachev, L. A., Kaulen, A. D., Khitrina, L. V.,
34.
Siletsky, S. A., Belevich, I., Belevich, N. P., Soulimane,
and Skulachev, V. P. (1981) Fast stages of photoelectric
T., and Wikström, M. (2017) Time-resolved generation
processes in biological membranes. I. Bacteriorho-
of membrane potential by ba3 cytochrome c oxidase
dopsin, Eur. J. Biochem., 117, 461-470, doi: 10.1111/
from Thermus thermophilus coupled to single electron
j.1432-1033.1981.tb06361.x.
injection into the O and OH states, Biochim. Biophys.
25.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P.,
Acta Bioenergetics,
1858,
915-926, doi:
10.1016/
Balashov, S. P., and Petrovskaya, L. E. (2022) Appli-
j.bbabio.2017.08.007.
cation of direct electrometry in studies of microbial
35.
Siletsky, S. A., Belevich, I., Belevich, N. P.,
rhodopsins reconstituted in proteoliposomes, Biophys.
Soulimane, T., and Verkhovsky, M. I. (2011) Time-
Rev., 14, 771-778, doi: 10.1007/s12551-022-00986-y.
resolved single-turnover of caa3 oxidase from Thermus
26.
Kovalev, K., Volkov, D., Astashkin, R., Alekseev, A.,
thermophilus. Fifth electron of the fully reduced
Gushchin, I., Haro-Moreno, J. M., Chizhov, I.,
enzyme converts OH into EH state, Biochim. Biophys.
Siletsky, S., Mamedov, M., and Rogachev, A.
Acta Bioenergetics, 1807, 1162-1169, doi: 10.1016/
(2020) High-resolution structural insights into the
j.bbabio.2011.05.006.
БИОХИМИЯ том 88 вып. 10 2023
1878
ПЕТРОВСКАЯ и др.
36.
Lozier, R. H., Bogomolni, R. A., and Stoeckenius, W.
teriorhodopsin by using time-resolved attenuated
(1975) Bacteriorhodopsin: A light-driven proton pump
total reflection Fourier-transform infrared spectros-
in Halobacterium halobium, Biophys. J., 15, 955-963,
copy, Proc. Natl. Acad. Sci. USA, 96, 5498-5503,
doi: 10.1016/S0006-3495(75)85875-9.
doi: 10.1073/pnas.96.10.5498.
37.
Dioumaev, A. K., Brown, L. S., Shih, J., Spudich,
46.
Petrovskaya, L. E., Lukashev, E. P., Siletsky, S. A.,
E. N., Spudich, J. L., and Lanyi, J. K. (2002) Proton
Imasheva, E. S., Wang, J. M., Mamedov, M. D.,
transfers in the photochemical reaction cycle of
Kryukova, E. A., Dolgikh, D. A., Rubin, A. B.,
proteorhodopsin, Biochemistry,
41,
5348-5358,
Kirpichnikov, M. P., Balashov, S. P., and Lanyi, J. K.
doi: 10.1021/bi025563x.
(2022) Proton transfer reactions in donor site mutants
38.
Balashov, S. P., Petrovskaya, L. E., Lukashev, E. P.,
of ESR, a retinal protein from Exiguobacterium
Imasheva, E. S., Dioumaev, A. K., Wang, J. M.,
sibiricum, J. Photochem. Photobiol. B, 234, 112529,
Sychev, S. V., Dolgikh, D. A., Rubin, A. B., Kirpich-
doi: 10.1016/j.jphotobiol.2022.112529.
nikov, M. P., and Lanyi, J. K. (2012) Aspartate-histidine
47.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P.,
interaction in the retinal Schiff base counterion of the
Balashov, S. P., Dolgikh, D. A., Rubin, A. B., Kirpich-
light-driven proton pump of Exiguobacterium sibiricum,
nikov, M. P., and Petrovskaya, L. E. (2019) Elimina-
Biochemistry, 51, 5748-5762, doi: 10.1021/bi300409m.
tion of proton donor strongly affects directionality and
39.
Siletsky, S. A., Mamedov, M. D., Lukashev, E. P.,
efficiency of proton transport in ESR, a light-driven
Balashov, S. P., Dolgikh, D. A., Rubin, A. B.,
proton pump from Exiguobacterium sibiricum, Biochim.
Kirpichnikov, M. P., and Petrovskaya, L. E. (2016)
Biophys. Acta Bioenergetics, 1860, 1-11, doi: 10.1016/
Electrogenic steps of light-driven proton transport in
j.bbabio.2018.09.365.
ESR, a retinal protein from Exiguobacterium sibiricum,
48.
Otto, H., Marti, T., Holtz, M., Mogi, T., Lindau, M.,
Biochim. Biophys. Acta Bioenergetics, 1857, 1741-1750,
Khorana, H. G., and Heyn, M. P. (1989) Aspartic
doi: 10.1016/j.bbabio.2016.08.004.
acid-96 is the internal proton donor in the reprotonaion
40.
Dioumaev, A. K., Petrovskaya, L. E., Wang, J. M.,
of the Schiff base of bacteriorhodopsin, Proc.
Balashov, S. P., Dolgikh, D. A., Kirpichnikov, M. P.,
Natl. Acad. Sci. USA, 86, 9228-9232, doi: 10.1073/
and Lanyi, J. K. (2013) Photocycle of Exiguobacterium
pnas.86.23.9228.
sibiricum rhodopsin characterized by low-temperature
49.
Holz, M., Drachev, L. A., Mogi, T., Otto, H., Kaulen,
trapping in the IR and time-resolved studies in the vis-
A. D., Heyn, M. P., Skulachev, V. P., and Khorana,
ible, J. Phys. Chem. B, 117, 7235-7253, doi: 10.1021/
H. G. (1989) Replacement of aspartic acid-96 by
jp402430w.
asparagine in bacteriorhodopsin slows both the decay
41.
Balashov, S. P., Petrovskaya, L. E., Imasheva, E. S.,
of the M intermediate and the associated proton
Lukashev, E. P., Dioumaev, A. K., Wang, J. M.,
movement, Proc. Natl. Acad. Sci. USA, 86, 2167-2171,
Sychev, S. V., Dolgikh, D. A., Rubin, A. B., Kir-
doi: 10.1073/pnas.86.7.2167.
pichnikov, M. P., and Lanyi, J. K. (2013) Breaking
50.
Dioumaev, A. K., Brown, L. S., Needleman, R., and
the carboxyl rule: lysine 96 facilitates reprotonation of
Lanyi, J. K. (2001) Coupling of the reisomerization of
the Schiff base in the photocycle of a retinal protein
the retinal, proton uptake, and reprotonation of Asp-96
from Exiguobacterium sibiricum, J. Biol. Chem., 288,
in the N photointermediate of bacteriorhodopsin,
21254-21265, doi: 10.1074/jbc.M113.465138.
Biochemistry, 40, 11308-11317, doi: 10.1021/bi011027d.
42.
Huang, K.-S., Bayley, H., and Khorana, H. G. (1980)
51.
Sasaki, S., Tamogami, J., Nishiya, K., Demura, M.,
Delipidation of bacteriorhodopsin and reconstitution
and Kikukawa, T. (2021) Replaceability of Schiff
with exogenous phospholipid, Proc. Nat. Acad. Sci.
base proton donors in light-driven proton pump
USA, 77, 323-327, doi: 10.1073/pnas.77.1.323.
rhodopsins, J. Biol. Chem., 297, 101013, doi: 10.1016/
43.
Kaulen, A. D. (2000) Electrogenic processes and protein
j.jbc.2021.101013.
conformational changes accompanying the bacteriorho-
52.
Balashov, S. P., Imasheva, E. S., Boichenko, V. A.,
dopsin photocycle, Biochim. Biophys. Acta Bioenergetics,
Antón, J., Wang, J. M., and Lanyi, J. K. (2005)
1460, 204-219, doi: 10.1016/S0005-2728(00)00140-7.
Xanthorhodopsin: a proton pump with a light-
44.
Gushchin, I., Chervakov, P., Kuzmichev, P., Popov,
harvesting carotenoid antenna, Science, 309, 2061-
A. N., Round, E., Borshchevskiy, V., Ishchenko, A.,
2064, doi: 10.1126/science.1118046.
Petrovskaya, L., Chupin, V., Dolgikh, D. A., Arseniev,
53.
Luecke, H., Schobert, B., Stagno, J., Imasheva, E. S.,
A. S., Kirpichnikov, M., and Gordeliy, V.
(2013)
Wang, J. M., Balashov, S. P., and Lanyi, J. K. (2008)
Structural insights into the proton pumping by unusu-
Crystallographic structure of xanthorhodopsin, the
al proteorhodopsin from nonmarine bacteria, Proc.
light-driven proton pump with a dual chromophore,
Natl. Acad. Sci. USA, 110, 12631-12636, doi: 10.1073/
Proc. Natl. Acad. Sci. USA,
105,
16561-16565,
pnas.1221629110.
doi: 10.1073/pnas.0807162105.
45.
Zscherp, C., Schlesinger, R., Tittor, J., Oesterhelt, D.,
54.
Ran, T., Ozorowski, G., Gao, Y., Sineshchekov, O. A.,
and Heberle, J. (1999) In situ determination of tran-
Wang, W., Spudich, J. L., and Luecke, H. (2013)
sient pKa changes of internal amino acids of bac-
Cross-protomer interaction with the photoactive site
БИОХИМИЯ том 88 вып. 10 2023
ESR, РЕТИНАЛЬНЫЙ БЕЛОК E. sibiricum
1879
in oligomeric proteorhodopsin complexes, Acta Cryst.,
60. Martin-Cuadrado, A. B., Garcia-Heredia, I., Molto,
D69, 1965-1980, doi: 10.1107/S0907444913017575.
A. G., Lopez-Ubeda, R., Kimes, N., Lopez-
55.
Maciejko, J., Kaur, J., Becker-Baldus, J., and
Garcia, P., Moreira, D., and Rodriguez-Valera, F.
Glaubitz, C.
(2019) Photocycle-dependent con-
(2015) A new class of marine Euryarchaeota group II
formational changes in the proteorhodopsin cross-
from the Mediterranean deep chlorophyll maximum,
protomer Asp-His-Trp triad revealed by DNP-en-
ISME J., 9, 1619-1634, doi: 10.1038/ismej.2014.249.
hanced MAS-NMR, Proc. Nat. Acad. Sci. USA, 116,
61. Finkel, O. M., Béjà, O., and Belkin, S. (2013) Global
8342-8349, doi: 10.1073/pnas.1817665116.
abundance of microbial rhodopsins, ISME J., 7,
56.
Morizumi, T., Ou, W.-L., Van Eps, N., Inoue, K.,
448-451, doi: 10.1038/ismej.2012.112.
Kandori, H., Brown, L. S., and Ernst, O. P. (2019)
62. Gómez-Consarnau, L., Raven, J. A., Levine, N. M.,
X-ray crystallographic structure and oligomerization
Cutter, L. S., Wang, D., Seegers, B., Arístegui, J.,
of Gloeobacter rhodopsin, Sci. Rep.,
9,
1-14,
Fuhrman, J. A., Gasol, J. M., and Sañudo-Wilhelmy,
doi: 10.1038/s41598-019-47445-5.
S. A. (2019) Microbial rhodopsins are major contribu-
57.
Siletsky, S. A., Lukashev, E. P., Mamedov, M. D.,
tors to the solar energy captured in the sea, Sci. Adv.,
Borisov, V. B., Balashov, S. P., Dolgikh, D. A., Rubin,
5, eaaw8855, doi: 10.1126/sciadv.aaw8855.
A. B., Kirpichnikov, M. P., and Petrovskaya, L. E.
63. Kojima, K., Shibukawa, A., and Sudo, Y.
(2020)
(2021) His57 controls the efficiency of ESR, a light-
The unlimited potential of microbial rhodopsins as
driven proton pump from Exiguobacterium sibiricum at
optical tools, Biochemistry, 59, 218-229, doi: 10.1021/
low and high pH, Biochim. Biophys. Acta Bioenergetics,
acs.biochem.9b00768.
1862, 148328, doi: 10.1016/j.bbabio.2020.148328.
64. De Grip, W. J., and Ganapathy, S. (2022) Rhodop-
58.
Luecke, H., Schobert, B., Richter, H.-T., Cartailler,
sins: an excitingly versatile protein species for research,
J.-P., and Lanyi, J. K. (1999) Structure of bacteri-
development and creative engineering, Front. Chem.,
orhodopsin at 1.55 Å resolution, J. Mol. Biol., 291,
10, 879609, doi: 10.3389/fchem.2022.879609.
899-911, doi: 10.1006/jmbi.1999.3027.
65. Emiliani, V., Entcheva, E., Hedrich, R., Hegemann, P.,
59.
Iverson, V., Morris, R. M., Frazar, C. D., Berthiaume,
Konrad, K. R., Lüscher, C., Mahn, M., Pan, Z.-H.,
C. T., Morales, R. L., and Armbrust, E. V. (2012)
Sims, R. R., Vierock, J., and Yizhar, O. (2022) Op-
Untangling genomes from metagenomes: revealing an
togenetics for light control of biological systems, Nat.
uncultured class of marine Euryarchaeota, Science,
Rev. Meth. Primers, 2, 55, doi: 10.1038/s43586-022-
335, 587-590, doi: 10.1126/science.1212665.
00136-4.
FEATURES OF PROTON TRANSPORT MECHANISM IN ESR,
A RETINAL PROTEIN FROM Exiguobacterium sibiricum
Review
L. E. Petrovskaya1*, S. A. Siletsky2, M. D. Mamedov2, E. P. Lukashev3, S. P. Balashov4,
D. A. Dolgikh1,3, and M. P. Kirpichnikov1,3
1 Shemyakin & Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
117997 Moscow, Russia; e-mail: lpetr65@yahoo.com
2 Belozersky Institute of Physical-Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
3 Department of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia
4 Department of Physiology and Biophysics, University of California, Irvine 92697, USA
Retinal-containing photosensitive proteins, rhodopsins, have been detected in many microorganisms.
The interest in them is largely explained by their role in storing light energy and photoregulation in micro-
organisms and the prospects for use in optogenetics in order to control the activity of neurons, including
for the treatment of various diseases. One of the representatives of microbial rhodopsins is ESR, a retinal
protein from Exiguobacterium sibiricum. The presence of a lysine residue (Lys96) as a proton donor for the
Schiff base distinguishes ESR from homologous proteins. This feature, along with the hydrogen bonding
of the proton acceptor Asp85 with the His57 residue, determines its functional characteristics as a proton
pump. The review examines the results of ESR studies conducted using various methods, including the
method of direct electrometry. Comparison of the obtained data with the results of spatial structure de-
termination and with other retinal proteins allows drawing conclusions about the mechanisms of transport
of hydrogen ions in the ESR molecule and similar retinal proteins.
Keywords: retinal protein, proteorhodopsin, Schiff base, proton acceptor, proton donor, photocycle, direct
electrometric method
БИОХИМИЯ том 88 вып. 10 2023