БИОХИМИЯ, 2023, том 88, вып. 10, с. 1880 - 1897
УДК 577.3
КАНАЛЬНЫЕ РОДОПСИНЫ: ОТ ФОТОТАКСИСА К ОПТОГЕНЕТИКЕ
Обзор
© 2023 Е.Г. Говорунова, О.А. Синещеков*
электронная почта: egovoru@yahoo.com; oleg_sinesh@yahoo.com
Поступила в редакцию 24.06.2023
После доработки 09.07.2023
Принята к публикации 09.07.2023
Среди всего многообразия ретинальных белков канальные родопсины выделяются своей уникаль-
ной способностью к генерации пассивных ионных токов при фотовозбуждении. Благодаря этой
способности канальные родопсины широко используются в нейрофизиологии и кардиологии как
инструменты для оптогенетической манипуляции активностью возбудимых клеток. Впервые токи,
генерируемые канальными родопсинами, были обнаружены в нативных клетках зеленых водорос-
лей в 1970-е гг. В этом обзоре мы прослеживаем историю этого открытия и обсуждаем современное
состояние исследований в этой области.
КЛЮЧЕВЫЕ СЛОВА: родопсины, ионные каналы, фоторецепция, мембранный потенциал, жгутиковые
водоросли, нейроны.
DOI: 10.31857/S0320972523100111, EDN: OTOPOF
ВВЕДЕНИЕ
ренос протона из цитоплазмы во внеклеточ-
ную среду и обеспечивающая основной меха-
Бактериородопсин, у истоков изучения ко-
низм утилизации солнечной энергии в клетках
торого стоял Л.А. Драчев [1-3], был первым
галоархей.
ретинальным белком, обнаруженным не в тка-
Обнаружение фотоэлектрической активно-
нях животных, а у микроорганизмов. Открытие
сти бактериородопсина стимулировало поиски
бактериородопсина Oesterhelt и Stoeckenius [4]
подобных процессов у других микроорганиз-
в начале 1970-х гг. стало сенсацией, а легкость
мов. Большинство подвижных про- и эукариот
выделения этого белка в больших количествах
способны реагировать на свет изменением ха-
из организма-хозяина, галоархеи Halobacterium
рактера своего движения [9, 10]. Первые сен-
salinarum, и исключительная стабильность сде-
сорные родопсины, SRI [11-13] и SRII [14],
лали его излюбленным объектом интенсив-
были открыты у Hal. salinarum. При фотовоз-
ных биофизических, биохимических и струк-
буждении эти белки не генерируют транс-
турно-биологических исследований [5-8]. Без
мембранные электрические токи, а запускают
преувеличения можно сказать, что сегодня мы
энзиматический каскад, в конце концов при-
знаем о бактериородопсине не только больше,
водящий к двигательным реакциям клеток.
чем о любом другом ретинальном белке, но и
В отличие от галоархей, реагирующих на свет
больше, чем о любом интегральном мембран-
изменением частоты реверсий направления
ном белке, моделью изучения которых он слу-
движения, одноклеточные зеленые водоросли
жит. В отличие от зрительных родопсинов,
способны к настоящему фототаксису, т.е. к
выполняющих сенсорную функцию посред-
ориентированному движению по направлению
ством активирования энзиматического каскада,
светового луча [15]. Обсуждение этого явления
бактериородопсин - электрогенная протонная
с Е.Н. Кондратьевой, известным специалистом
помпа, осуществляющая трансмембранный пе- по фототрофным микроорганизмам [16], а так-
же успешная регистрация фотоиндуцирован-
ных изменений потенциала изолированных
Принятые сокращения: КР - канальный родопсин;
ПФТ - поздний фоторецепторный ток; РФТ - ранний
хлоропластов высших растений [17] способ-
фоторецепторый ток.
ствовали началу работ по изучению возмож-
* Адресат для корреспонденции.
ной роли электрических процессов в фото-
1880
КАНАЛЬНЫЕ РОДОПСИНЫ
1881
рецепции зеленых водорослей на кафедре
ретиналя, позволил подтвердить это предпо-
физико-химической биологии биологического
ложение [30-32]. Идентифицировать же фото-
факультета МГУ под руководством Ф.Ф. Лит-
рецепторные белки хламидомонады (а точнее,
вина. Электрические стадии трансдукции фо-
кодирующие их гены) на молекулярном уровне
тосенсорного сигнала не удалось обнаружить,
удалось только после того, как были разрабо-
вводя микроэлектрод в клетку водоросли,
таны дешевые методы секвенирования поли-
как это делается для регистрации электриче-
нуклеотидных последовательностей, причем
ских явлений, связанных с фотосинтезом [18].
оказалось, что геном C. reinhardtii кодирует не
Только разработка нового метода внеклеточ-
один, а два таких белка [23, 33-35]. Примеча-
ного отведения при помощи электрода-при-
тельно, что по своей аминокислотной последо-
соски вторым автором настоящего обзора по-
вательности, изомерному составу хромофора
зволила этого достичь [19, 20].
и первичным фотохимическим процессам ро-
При помощи этого метода было показано,
допсины C. reinhardtii оказались ближе к бакте-
что освещение в спектральной области, ха-
риородопсину, чем к зрительным родопсинам
рактерной для фототаксиса, приводит к гене-
животных. Исследование фоторецепторных то-
рации трансмембранного фоторецепторного
ков генетических трансформантов хламидомо-
потенциала в области мембраны, прилегаю-
нады с пониженным содержанием родопсинов
щей к «глазку» (стигме) - внутриклеточному
позволило установить, что эти белки служат
органоиду, представляющему собой скопление
фоторецепторами при фототаксисе и фото-
каротиноидных гранул и служащему для моду-
фобной (фотошоковой) двигательной реак-
ляции освещенности фоторецептора во время
ции этой водоросли, хотя генерируемые ими
движения клетки. Изотоническое распростра-
фоторецепторные токи различаются по своим
нение деполяризующего фоторецепторного
свойствам [23, 28].
потенциала на мембрану жгутиков вызывает
Но в полной мере уникальность родопси-
регенеративную электрическую реакцию, по-
нов хламидомонады выявилась путем экс-
добную потенциалу действия нейронов. Успех
прессии их генов в клетках животных, таких
этих работ был в значительной мере связан с
как ооциты шпорцевой лягушки, выполнен-
удачным выбором объекта - Haematococcus
ной Nagel et al. [33, 34] (ранее эта методика
pluvialis, зеленой водоросли относительно боль-
была успешно применена и к бактериоро-
шого размера с эластичной клеточной стен-
допсину [36]). Оказалось, что, в отличие от
кой. Разработка вторым автором этого обзора
этого последнего, родопсины хламидомонады
другого оригинального метода - измерения
осуществляют пассивный транспорт катио-
фототоков в суспензии свободно плавающих
нов (не только протонов, но и ионов натрия,
микроорганизмов - позволяет регистрировать
калия и, в значительно меньшей степени,
обе стадии этого фотоэлектрического сенсор-
кальция) через клеточную мембрану, т.е. пред-
ного каскада практически в любом организме,
ставляют собой фотоактивируемые катионные
обладающем фототаксисом, независимо от его
каналы, единственные в своем роде. Эта осо-
размера [21]. При помощи суспензиального
бенность послужила основанием для введе-
метода удалось измерить фототоки у всех ис-
ния специального термина для обозначения
следованных зеленых и криптофитовых водо-
этих белков, «канальные родопсины» (chan-
рослей [22-27].
nelrhodopsins, КР), быстро вытеснившего их
В отличие от бактериородопсина, основ-
прежние наименования «сенсорные родопси-
ного компонента пурпурных мембран, занима-
ны хламидомонады» [23] и «родопсины архей-
ющих ~50% поверхности клетки, фоторецеп-
ного типа» [35].
торные белки, ответственные за фототаксис
Широкую известность КР приобрели по-
жгутиковых водорослей, присутствуют в их
сле того, как было показано, что с их помо-
клетках в очень низкой концентрации [28] и не
щью можно стимулировать активность ней-
поддаются очистке биохимическими метода-
ронов освещением [37-39]. Эта методика, по-
ми. На основании анализа спектров действия
лучившая название «оптогенетики», произве-
фототаксиса Foster и Smyth [29] было высказа-
ла настоящую революцию в нейрофизиологии
но предложение, что они могут быть ретиналь-
и смежных областях [40-43]. Более того, есть
ными белками. Oбширный набор косвенных
основания надеяться, что КР могут оказаться
данных, полученных в 1980-1990-е гг., вклю-
полезными для генной терапии многих нерв-
чая восстановление фототаксиса у «слепых»
ных, психиатрических и сердечно-сосудистых
мутантов зеленой водоросли Chlamydomonas
заболеваний [44, 45]. Особый оптимизм вызы-
reinhardtii, не способных синтезировать ка-
вает возможность оптогенетического восста-
ротиноиды, после добавления экзогенного
новления зрения у пациентов с дегенерацией
БИОХИМИЯ том 88 вып. 10 2023
1882
ГОВОРУНОВА, СИНЕЩЕКОВ
сетчатки [46]. Протонные помпы, подобные
ванных изменений мембранного потенциала
бактериородопсину, тоже находят примене-
палочек и колбочек сетчатки, опосредованных
ние в оптогенетике в качестве инструментов
закрытием каналов, регулируемых цикличе-
для подавления активности нейронов
[47],
скими нуклеотидами [66]. Малый объем кле-
хотя они переносят против электрохимическо-
ток жгутиковых водорослей, однако, затруд-
го градиента менее одного заряда на каждый
няет использование этого метода для изучения
поглощенный фотон и потому генерируют не
канальной активности их родопсинов. Некото-
такие большие токи, как КР, что требует более
рые зеленые жгутиконосцы, в первую очередь
интенсивного и/или длительного освещения
H. pluvialis, обладают эластичной клеточной
для изменения мембранного потенциала.
стенкой, позволяющей всасывать их клетки в
Массовое секвенирование геномов и тран-
микроприсоску. При этом не образуется гига-
скриптомов привело к открытию КР у эука-
омного контакта мембраны клетки со стеклом
риот из нескольких других базовых таксонов,
присоски, необходимого для фиксации мем-
помимо зеленых водорослей. Более того, вы-
бранного потенциала (технология пэтч-кламп),
яснилось, что кроме катионных КР, у фото-
но асимметричное распределение КР в мем-
трофных
[48] и даже гетеротрофных
[49]
бране позволяет регистрировать генерируемые
протистов широко распространены КР, се-
ими фотоиндуцированные сигналы [19, 20].
лективно проводящие анионы. Катионная же
Тринадцать лет спустя этот метод (получив-
проводимость, по всей вероятности, незави-
ший название метода электрода-присоски;
симо возникла по крайней мере дважды в эво-
рис. 1, а) был применен к мутанту C. reinhardtii,
люции КР, причем в одном случае эти белки
лишенному твердых слоев клеточной обо-
сохранили многие черты, роднящие их с бак-
лочки [67], а еще через восемь лет - к мутанту
териородопсином [50]. Наконец, в прошлом
Volvox carteri [68]. C. reinhardtii - модельный
году были обнаружены катионные КР, про-
объект многих биологических исследований, и
водящие ионы калия много лучше, чем ионы
именно в его геноме впоследствии были иден-
натрия [51], и можно предполагать, что этим
тифицированы первые гены КР [23, 33-35].
разнообразие КР еще не исчерпывается.
Метод электрода-присоски позволил впер-
У ретинальных ионных помп, подобных
вые обнаружить, что восприятие света фото-
бактериородопсину, все этапы ионного транс-
рецепторными молекулами жгутиковых водо-
порта строго привязаны к определенным ста-
рослей приводит к деполяризации их мем-
диям цикла фотохимических превращений
браны [19, 20], что и заложило основу для
пигмента (фотоцикла), регистрируемого опти-
развития оптогенетики четверть века спустя.
ческими методами на очищенных белках или
Однако этот метод не только является доста-
мембранах [52]. В отличие от помп, фототоки
точно трудоемким, но его применение еще и
КР различных семейств коррелируют с раз-
ограничено клетками с эластичной оболочкой,
ными стадиями фотоцикла, предоставляя ин-
редко встречающимися среди жгутиконосцев.
формацию о механизмах функционирования
Кроме того, механическое всасывание клетки
каналов [50, 53-55].
в присоску может стимулировать активность
В этом обзоре мы рассмотрим методы ре-
ее механорецепторов [69] и в любом случае
гистрации канальной активности родопсинов
представляет собой неестественную ситуацию.
в нативных клетках, фотоэлектрический ка-
Асимметричная локализация молекул-генера-
скад жгутиковых водорослей, фоторецептор-
торов фототоков в разных участках клеточной
ную роль КР в фототаксисе, а также затронем
мембраны, установленная методом «электро-
их разнообразие и оптогенетическое примене-
да-присоски», привела к мысли, что суммар-
ние. Более детальные сведения о молекуляр-
ный ток тысяч клеток в суспензии может быть
ных механизмах КР могут быть почерпнуты
зарегистрирован и без искусственного уве-
из других обзоров [56-59]. Истории и прин-
личения сопротивления между различными
ципам оптогенетики также посвящено много
участками мембраны стеклом присоски.
публикаций [42, 60-65].
В первой модификации суспензиально-
го метода фотовспышка направляется вдоль
линии, соединяющей электроды (рис. 1, б).
МЕТОДЫ РЕГИСТРАЦИИ КАНАЛЬНОЙ
Фоторецепторный ток, генерируемый КР в
АКТИВНОСТИ РОДОПСИНОВ В КЛЕТКАХ
клетках жгутиконосцев, повернутых в момент
ЖГУТИКОВЫХ ВОДОРОСЛЕЙ
световой вспышки своими фоторецепторами
в сторону источника света, превышает по
Внутриклеточные микроэлектроды широко
амплитуде ток, генерируемый клетками, ори-
применяются для регистрации фотоиндуциро-
ентированными противоположным образом,
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1883
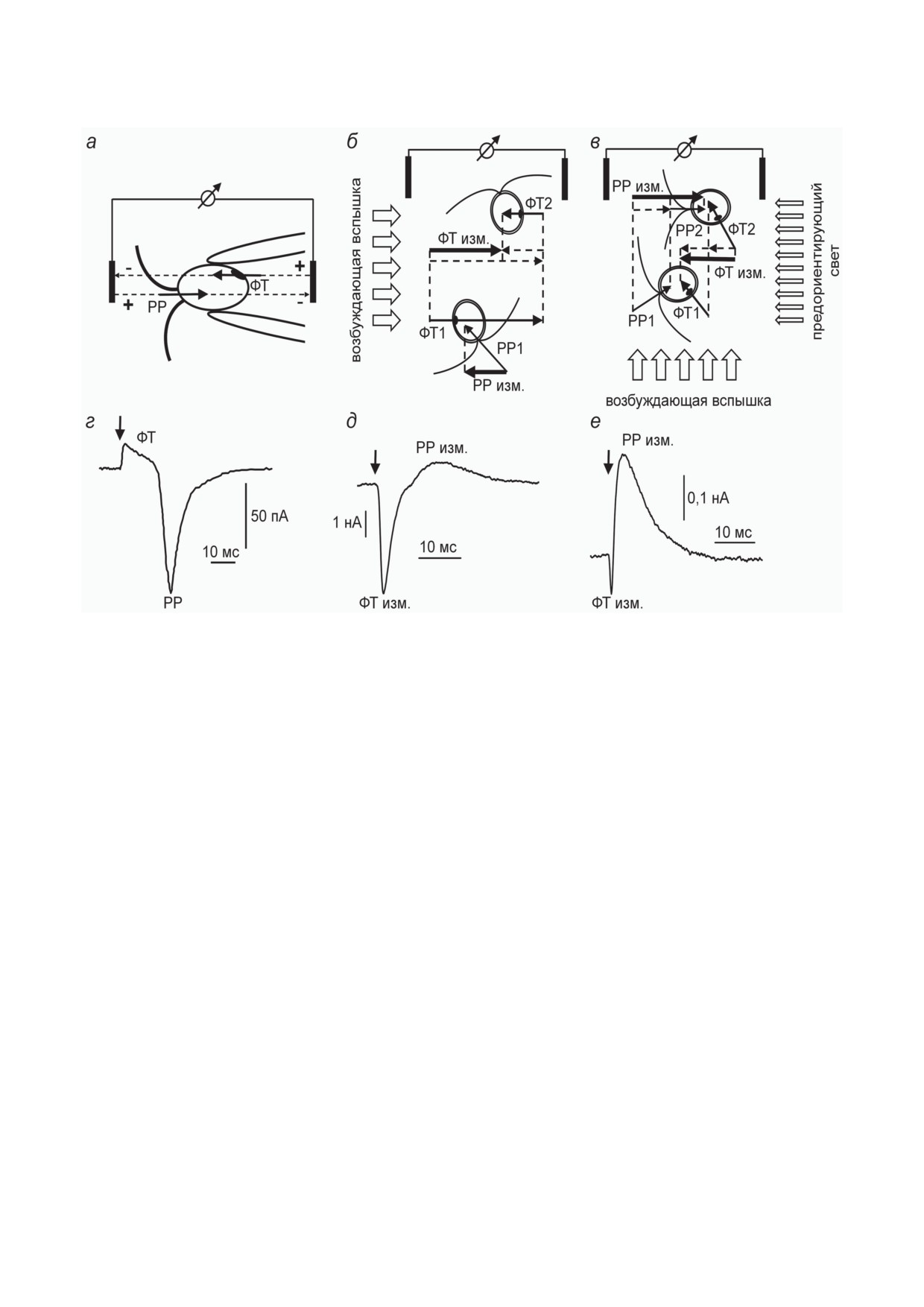
Рис. 1. Методы измерения и примеры фотоэлектрических сигналов, регистрируемых в клетках зеленых жгутиковых
водорослей: а-в - схемы метода электрода-присоски (а), измерений в суспензии неориентированных клеток (б)
и измерений в суспензии предориентированных клеток (в); г-е - примеры сигналов, отводимых от одиночной
клетки (г), суспензии неориентированных клеток (д) и суспензии предориентированных клеток (е). Стрелками на
панелях г-е показан момент возбуждающей вспышки. ФТ - фоторецепторный ток; РР - регенеративная реакция;
изм. - измеряемый
и разница между этими токами регистрируется
у «слепых» бескаротиноидных мутантов после
погруженными в суспензию электродами. Дру-
добавления экзогенного ретиналя действи-
гая модификация метода измерения фоторецеп-
тельно связано с регенерацией самих фото-
торных токов в суспензии водорослей основана
рецепторных белков, а не, например, встраи-
на предориентации клеток светом, вызываю-
ванием ретиналя в стигму [31]. Более того,
щим фототаксис, или гравитационным полем,
суспензиальный метод позволил обнаружить и
направленными перпендикулярно измеритель-
охарактеризовать генерируемые КР фотоинду-
ной вспышке (рис. 1, в). В этом случае элек-
цированные сигналы еще у целого ряда зеле-
троды регистрируют проекцию фоторецептор-
ных водорослей, а именно, представителей
ного тока на направление предориентирующего
родов Spermatozopsis, Hafniomonas, Polytomella,
фактора, что позволяет оценить и мгновенное
Mesostigma и Platymonas, а также у филогене-
значение степени ориентации [21, 70, 71].
тически далекой криптофитовой водоросли
При использовании обеих модификаций
Cryptomonas [24-27]. Наконец, суспензиаль-
суспензиального метода регистрация произ-
ный метод измерения фоторецепторных токов
водится в полностью физиологических усло-
был использован как косвенный подход для
виях и не ограничивается размерами микро-
изучения гравирецепции [21] и хеморецеп-
организмов и строением их клеточной стенки.
ции [75] хламидомонады, а также послужил
Универсальность и техническая простота по-
основой для разработки экспресс-биотеста
зволили распространить этот метод на иссле-
для оценки степени загрязнения воды тяже-
дование большого числа мутантов хламидо-
лыми металлами и формальдегидом [76, 77].
монады с нарушениями строения стигмы [72]
С более детальным техническим описанием
и дефектами фотоповедения [73, 74]. Кроме
обоих методов, электрода-присоски и суспен-
того, при помощи суспензиального метода
зиального, можно ознакомиться в нескольких
было установлено, что появление фототаксиса
ранее опубликованных обзорах [25, 70, 71].
БИОХИМИЯ том 88 вып. 10 2023
1884
ГОВОРУНОВА, СИНЕЩЕКОВ
Электрофизиологические исследования фо-
иммунофлуоресцентной микроскопии. Было
торецепторного тока предоставили сведения
показано, что КР C. reinhardtii сосредоточены
о фоторецепторных белках жгутиковых водо-
главным образом в области стигмы [35, 84,
рослей еще до того, как были клонированы
85], что полностью соответствует результатам
кодирующие их гены. Произведение квантово-
электрофизиологических измерений. Анализ
го выхода на оптическое сечение поглощения
препарата изолированных стигм методами
молекулы, полученное путем аппроксимации
протеомики тоже показал наличие КР [86].
световой зависимости фоторецепторного тока,
Согласно текущим представлениям, молеку-
имеет характерное для ретинальных белков
лы КР встроены в плазматическую мембрану,
значение 0,8 Å [78]. Восстановление фоторе-
обнаруживающую особую ультраструктуру в
цепторного тока после насыщающей вспышки
области, прилегающей к стигме [87]. У клеток
позволило оценить длительность фотоцикла
C. reinhardtii, выращиваемых при циклическом
фоторецепторного пигмента (100 мс). Иссле-
освещении, иммунофлуоресцентными метода-
дования зависимости амплитуды фоторецеп-
ми КР найдены, помимо стигмы, еще в жгути-
торного тока от ориентации плоскости по-
ках и базальных телах, причем их количество
ляризации светового стимула показало, что
в этих органоидах зависит от фазы цикла [88,
ретинальный хромофор расположен в плоско-
89]. Функциональное состояние локализован-
сти мембраны клетки [79, 80]. Спектры дей-
ных там родопсинов пока неизвестно.
ствия фоторецепторного тока и фотоповедения
Во время движения клетки жгутиконосцев
H. pluvialis имеют сложную многополосную
вращаются вокруг своей оси, так что фоторе-
форму, указывающую на то, что фоторецеп-
цепторный участок плазматической мембраны
торная система жгутиконосцев может состоять
испытывает периодическое изменение осве-
из нескольких пигментов. Вклад двух фото-
щенности [9, 29, 90-94]. Для клетки, удержи-
рецепторных белков в фототаксис был непо-
ваемой на микроприсоске, эти условия можно
средственно продемонстрирован на модельном
смоделировать периодическим освещением с
организме C. reinhardtii [23], а у других водо-
частотой около 1 Гц. При использовании ин-
рослей обнаружено еще больше кандидатов на
тенсивности света, вызывающей фототаксис,
эту роль. Однако все эти белки представляют
у клетки H. pluvialis наблюдается увеличение
собой не светоактивируемые ионные помпы,
частоты биения цис-жгутика (ближайшего к
как бактериородопсин, а светоактивируемые
стигме) и снижение частоты биения транс-
ионные каналы [33, 34].
жгутика на включение света, и противополож-
ные реакции - на его выключение [78, 90, 95].
У свободно плавающей клетки такие асимме-
ФОТОЭЛЕКТРИЧЕСКИЙ КАСКАД
тричные изменения биения жгутиков должны
ПРИ ФОТОТАКСИСЕ
приводить к изменению направления ee дви-
ЖГУТИКОВЫХ ВОДОРОСЛЕЙ
жения, т.е. фототаксису. Более детально иссле-
дованные фотоиндуцированные двигательные
Фотоэлектрический сигнал, отводимый от
реакции жгутиков C. reinhardtii выражаются в
клеток H. pluvialis, фиксированных на мик-
изменении не только частоты, но и амплитуды
роприсоске, состоит из градуального фоторе-
и скорости биения [96-99].
цепторного тока и вызываемой им вторичной
Регенеративная электрическая реакция про-
регенеративной реакции, протекающей по
текает в мембране жгутиков и потому часто
принципу «все или ничего». Сравнение знаков
описывается в литературе как «жгутиковый
этих компонентов сигнала при всасывании в
ток» [32, 67, 70]. Параллельная регистрация бие-
присоску различных частей клетки позволило
ния жгутиков фиксированной на присоске
установить, что первичный ток, направлен-
клетки и ее фотоэлектрического ответа пока-
ный внутрь клетки, протекает только через
зала, что регенеративная реакция вызывает
небольшой участок мембраны, подстилающий
изменение характера биения жгута, наблюдае-
стигму [19, 20, 67]. Первоначально предполага-
мого у свободно движущейся клетки во время
лось, что сам этот внутриклеточный органоид
фотофобной реакции [19, 20, 78, 95, 100]. Эта
содержит фоторецепторный пигмент [81], но
реакция представляет собой резкую остановку
впоследствии выяснилось, что он играет толь-
и/или изменение направления движения клет-
ко вспомогательную роль затеняющего и/или
ки, наблюдаемую, когда интенсивность или дли-
фокусирующего свет образования [29, 82, 83].
тельность светового стимула превышает неко-
После клонирования генов КР появилась
торый порог [9, 10, 91, 101, 102].
возможность исследовать внутриклеточную ло-
Амплитуда регенеративной реакции прак-
кализацию кодируемых ими белков методами
тически не зависит от интенсивности свето-
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1885
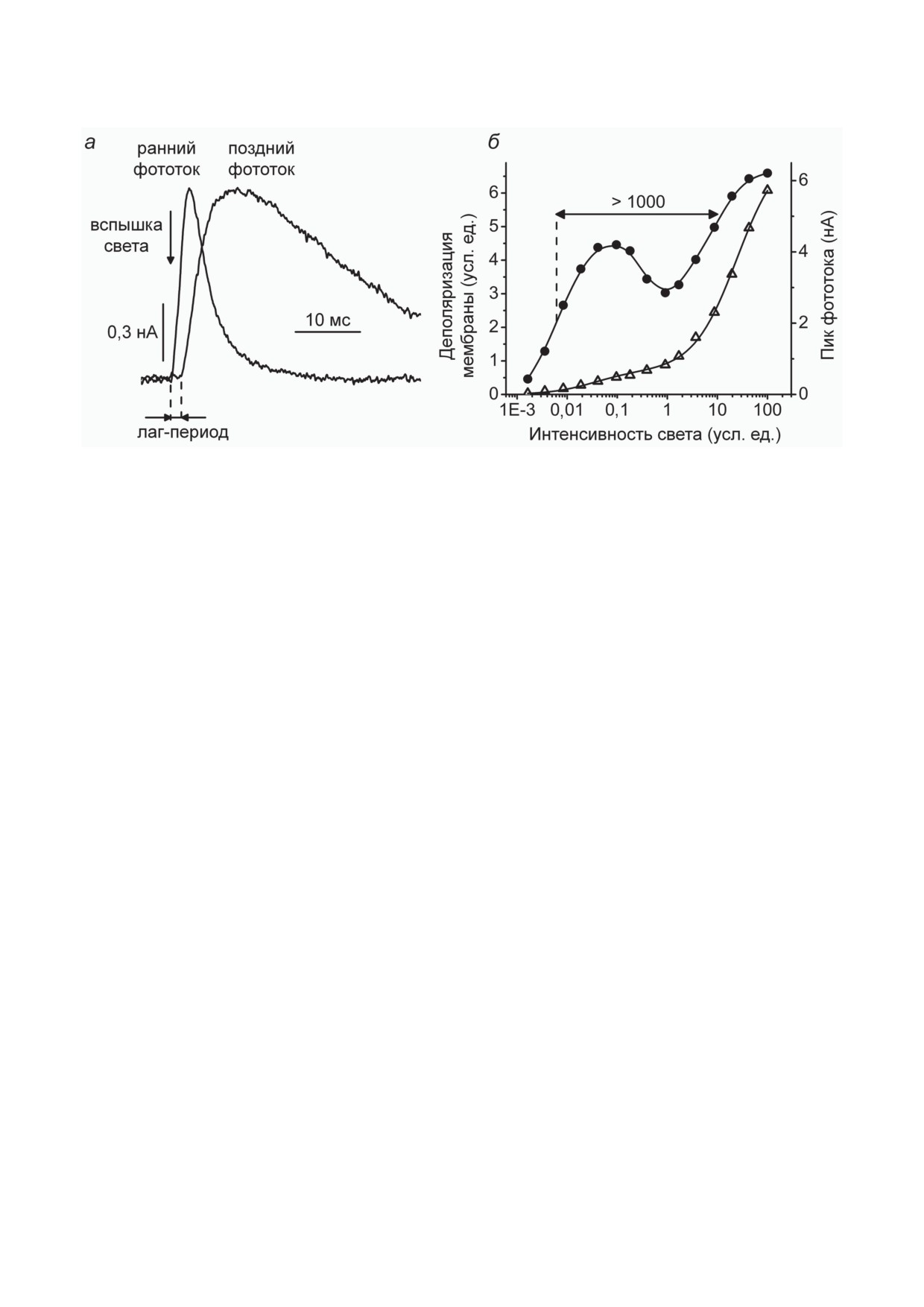
вого стимула, в то время как длительность лаг-
определяется только фотохимическими про-
периода от начала освещения до начала этой
цессами поглощения света, в то время как
реакции обнаруживает обратную зависимость
насыщение ПФТ наблюдается при интенсив-
от интенсивности света. Интервал под кри-
ностях примерно в 1000 раз меньше. Только
вой фоторецепторного тока до начала регене-
ПФТ, но не РФТ, обнаруживает зависимость
ративной реакции остается постоянным при
от температуры и красного фонового освеще-
любой интенсивности и увеличивается при
ния, активирующего фотосинтез и приводя-
использовании красного фонового освеще-
щего к гиперполяризации мембраны [18, 106].
ния, гиперполяризующего мембрану за счет
Наконец, ПФТ обладает более выраженной
фотосинтеза [18, 78, 79, 103]. Это показывает,
зависимостью от концентрации Ca2+ в среде,
что для инициации регенеративной реакции
чем РФТ [25]. Таким образом, кинетика соб-
требуется перенос через мембрану определен-
ственно ПФТ может быть определена как раз-
ного числа зарядов, деполяризующего ее на
ностный сигнал до и после всех этих воздей-
несколько мВ.
ствий (рис. 2, а).
Выраженная зависимость регенеративной
Максимальные амплитуды токов, наблю-
реакции от концентрации Ca2+ в среде и ее
даемые в насыщении ПФТ и РФТ соотносятся,
чувствительность к блокаторам кальциевых
как < 1 : 10. Деполяризация мембраны, одна-
каналов свидетельствуют о том, что она явля-
ко, пропорциональна не максимальному току,
ется результатом открывания потенциал-зави-
а числу зарядов, перенесенному через мембра-
симых кальциевых каналов в мембране жгу-
ны, т.е. интегралу тока. Медленное закрытие
тиков клетки [19, 20, 67]. Анализ изменения
каналов ПФТ приводит к тому, что деполяри-
амплитуды регенеративной реакции в процес-
зация мембраны благодаря РФТ и ПФТ оказы-
се отрастания жгутиков у клеток C. reinhardtii
вается практически одинаковой в насыщении,
после их ампутации показал, что опосредую-
хотя это насыщение отличается в 1000 раз по
щие ее каналы распределены по всей длине
интенсивности (рис. 2, б).
жгутика [104]. Наличие мутанта, не способно-
Кальциевые каналы, через которые проте-
го к генерации регенеративной реакции [74],
кает ПФТ, локализованы вблизи стигмы, но
позволило клонировать ген cav2, кодирую-
не обязательно в ее пределах. Именно эти вто-
щий эти каналы [105]. Иммунофлуоресцент-
ричные Ca2+-каналы обеспечивают крайне вы-
ная микроскопия выявила преимущественное
сокую, почти
«single-quantum» чувствитель-
сосредоточение белка CAV2 в проксимальной
ность фототаксиса [108]. Важно подчеркнуть,
части жгутика.
что, в отличие от каналов в мембране жгутика,
они не являются потенциал-зависимыми, по-
скольку генерируют градуальный ток (т.е. ток,
КОМПОНЕНТЫ
амплитуда которого меняется при изменении
ФОТОРЕЦЕПТОРНОГО ТОКА
величины стимула). В геноме C. reinhardtii
идентифицировано по крайней мере 43 гена
Использование наносекундных лазерных
Ca2+-каналов [109], но функции лишь немно-
вспышек и записи с высоким временным раз-
гих из кодируемых ими белков были установ-
решением позволило установить, что фоторе-
лены. В изолированных препаратах стигм об-
цепторный ток состоит из двух компонентов,
наруживается несколько Ca2+-связывающих
различающихся по своим свойствам [25, 32, 78,
белков, но не Ca2+-каналы [86, 110]. Одна из
95, 106, 107]. Эти компоненты выявляются у всех
возможных причин - недостаточная чувстви-
исследованных организмов, свидетельствуя об
тельность методов протеомики для идентифи-
общих принципах организации их фоторе-
кации интегральных мембранных белков. Так-
цепторных систем и цепей трансдукции сиг-
же вероятно, что эти гипотетические каналы
нала. Появление раннего фоторецепторного
не являются гомологами каких-либо прежде
тока (РФТ) ограничено только скоростью про-
известных Ca2+-каналов, и потому их последо-
пускания измерительной системы (<30 мкс -
вательности не распознаются как таковые.
для клетки на присоске [106] и <3 мкс - для
Механизмы активации вторичных каналов
суспензиального метода [31]). Напротив, позд-
при генерации ПФТ пока не ясны. В препаратах
ний фоторецепторный ток (ПФТ) регистриру-
изолированных стигм, содержащих и фоторе-
ется с задержкой вплоть до нескольких мил-
цепторную мембрану, были обнаружены гете-
лисекунд, длительность которой зависит от
ротримерные ГТФазы, Ca2+-зависимые про-
интенсивности светового стимула. По крайней
теин-киназы и фосфатазы [111-113]. Однако
мере два компонента выявляются и в кине-
эти белки могут быть элементами других сиг-
тике спада сигнала. Световое насыщение РФТ
нальных каскадов, например, запускаемых
БИОХИМИЯ том 88 вып. 10 2023
1886
ГОВОРУНОВА, СИНЕЩЕКОВ
Рис. 2. Характеристики компонентов фоторецепторного тока зеленой жгутиковой вородосли Chlamydomonas reinhardtii:
а - кинетика раннего и позднего фоторецепторных токов, измеренных в суспензии клеток; б - световая зависимость
пиковой амплитуды фоторецепторного тока (правая ось ординат) и интеграла под кривой тока (левая ось ординат)
фотовозбуждением фототропина, также обна-
кодирующего КР2, что привело к дальней-
руженного в препаратах стигм [86, 110]. Было
шему увеличению соотношения КР2/КР1 у
показано, что фототропин опосредует фото-
КР1-трансформанта. Ток, генерируемый КР1,
регуляцию размера стигмы и количества КР
по своей кинетике сходен с РФТ, а ток, гене-
в клетке [114].
рируемый КР2 - с ПФТ. Более того, КР1-ге-
Отсутствие лаг-периода и высокие интен-
нерируемый ток обладает высоким световым
сивости насыщения РФТ позволили предпо-
насыщением, как и РФТ, а ток, генерируе-
ложить, что этот ток протекает непосредствен-
мый КР2, - низким световым насыщением,
но через фоторецепторные пигменты [32, 103].
как и ПФТ. Кроме того, различаются и спек-
Попытки определить ионную селективность
тры действия двух токов, свидетельствующие
КР методом электрода-присоски у C. rein-
о различии спектров поглощения двух родоп-
hardtii [115, 116] и V. сarteri [68] не дали отчетли-
синов: спектральный максимум тока, опо-
вого результата из-за невозможности фикса-
средованного КР1, приходился на 510 нм, а
ции потенциала и трудности разделения РФТ
тока, генерируемого КР2, - на 470 нм, что под-
и ПФТ в таких экспериментах. Ионная селек-
твердилось путем измерения абсорбционных
тивность КР этих и десятков других микро-
спектров выделенных пигментов, полученных
организмов была установлена только в пэтч-
благодаря гетерологической экспрессии их ге-
кламп-экпериментах на культивируемых клетках
нов [84, 117, 118].
животных, трансформированных соответствую-
Измерение фотоориентации клеток ме-
щими генами.
тодом регистрации фототоков в суспензии
Идентификация генов КР в геноме C. rein-
предориентированных клеток и фотофобной
hardtii и развитие методов генетической транс-
реакции путем записи траекторий движения
формации этого модельного объекта позволило
показало, что оба КР служат фоторецепто-
подтвердить роль кодируемых белков как фото-
рами в обоих этих фоторегуляторных процес-
рецепторов, опосредующих фототаксис и фо-
сах [23, 28]. Измерение фотоориентации мето-
тофобную реакцию этой водоросли. При по-
дом светорассеяния у независимо полученного
мощи метода РНК-интерфереции К. Джангом
штамма с пониженным содержанием КР1 под-
в лаборатории Дж. Спудича были получены
твердило фоторецепторную роль этого бел-
трансформанты с пониженным содержанием
ка [84]. Тот факт, что задержанный ПФТ, обла-
каждого из двух родопсинов, первоначально
дающий более низким световым насыщением,
названных родопсинами А и В [23, 28] и впо-
генерируется преимущественно КР2, делает
следствии известных как канальные родопси-
его основным фоторецептором при фототак-
ны 1 и 2 (КР1 и КР2). Интересно, что подав-
сисе, в то время как КР1, преимущественно
ление экспрессии гена, кодирующего КР1,
генерирующий РФТ, вносит основной вклад
способствовало стимуляции экспрессии гена,
в фотофобную реакцию, возникающую при
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1887
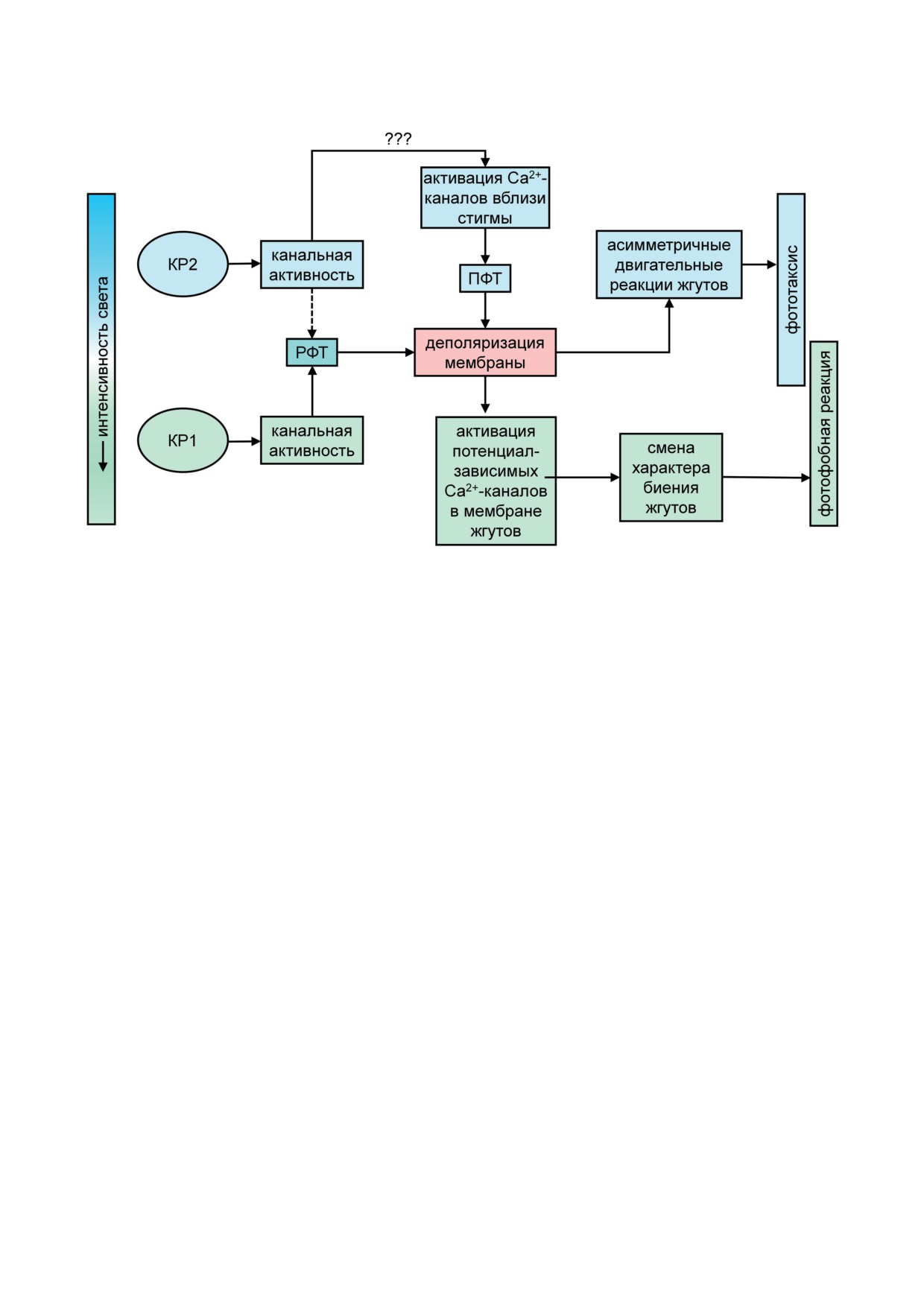
Рис. 3. Схема трансдукции светового сигнала при фототаксисе жгутиковых водорослей. КР1 и КР2 - канальные
родопсины 1 и 2; РФТ и ПФТ - ранний и поздний фоторецепторный ток соответственно
более высоких интенсивностях света (рис. 3).
Метод CRISPR/Cas9 позволил не только
Следует, однако, отметить, что сравнительное
разрушить гены КР, но и получить штаммы
содержание КР1 и КР2 различается у разных
C. reinhardtii, содержащие точечные мутации
штаммов дикого типа [23, 84, 119], что может
каждого из них [119]. У всех исследованных
сказываться и на сравнительном вкладе этих
мутантов наблюдалось снижение чувствитель-
белков в фотоповедение клеток.
ности фотоориентации, однако и содержа-
Метод РНК-интерфереции позволяет сни-
ние большинства мутантных белков в клетке
зить содержание кодируемого белка в клетке,
было пониженным по сравнению с контро-
но не полностью подавить его синтез. Послед-
лем. У мутанта КР2, обладающего пониженной
нее было достигнуто сначала при помощи
проницаемостью для протонов по сравнению
инсерционного мутагенеза
[85,
120], а за-
с ионами натрия, согласно исследованиям на
тем - путем целенаправленного разрушения
модельных клетках, фоторецепторные токи
генов КР [119, 121, 122]. У штамма, лишенного
удалось обнаружить только в присутствии на-
КР1 при помощи нуклеаз с цинковыми паль-
трия в среде, что подтвердило значение про-
цами, чувствительность фотоориентации сни-
тонных токов для фототаксиса у дикого типа.
зилась на 3 порядка, разрушение гена, кодирую-
щего КР2, имело менее выраженный эффект, а
разрушение обоих генов практически полно-
РОЛЬ ЦИТОПЛАЗМАТИЧЕСКОГО
стью подавило ответ [122]. При использовании
ФРАГМЕНТА КР
же для редактирования генома метода CRISPR/
Cas9 разрушение только одного из КР не ска-
Молекулы всех известных КР состоят из,
залось на чувствительности фотоориентации,
собственно, родопсинового домена, представ-
и только разрушение обоих генов подавило
ляющего собой комплекс из семи трансмем-
ее [119]. Различие между этими результатами
бранных α-спиралей, и почти равного ему по
связано, по всей вероятности, с использова-
числу аминокислотных остатков цитоплазма-
нием материнских штаммов, различающихся и
тического фрагмента. Как показала гетеро-
по исходной пропорции КР1 и КР2 в клетках,
логическая экспрессия, для осуществления
и по выраженности компенсационной реакции
канальной функции необходим и достаточен
после искусственного снижения концентрации
только семиспиральный родопсиновый домен.
одного из этих белков.
Соответственно, для оптогенетических целей
БИОХИМИЯ том 88 вып. 10 2023
1888
ГОВОРУНОВА, СИНЕЩЕКОВ
и функциональных исследований КР в модель-
РАЗНООБРАЗИЕ КР
ных клетках используются почти исключитель-
И ИХ ПРИМЕНЕНИЕ В ОПТОГЕНЕТИКЕ
но их трансмембранные домены. Изучение
же функций цитоплазматических фрагмен-
Регистрация фотоиндуцированных элек-
тов в клетках C. reinhardtii потребовало раз-
трических сигналов в клетках зеленых жгути-
вития методов редактирования генома этого
ковых водорослей показала, что КР широко
организма [121]. Было показано, что удаление
распространены у представителей этой систе-
последних 78 С-терминальных аминокислот-
матической группы
[25-27]. Зеленые водо-
ных остатков КР1 приводит к смещению поло-
росли
- ближайшие родственники назем-
жения стигмы в переднюю часть клетки (тот
ных растений, что послужило основанием для
же эффект наблюдается и после разрушения
секвенирования геномов многих их видов,
всего гена, кодирующего КР1) [122]. Более
включая те, что прежде были исследованы
того, присоединение флуоресцентной метки к
электрофизиологическими методами [129, 130].
С-терминальному участку вызывает наруше-
Биоинформатический анализ полученных дан-
ние транспортировки КР1 в плазмалемму. Эти
ных выявил >200 индивидуальных последова-
наблюдения подтверждают ранее высказанную
тельностей КР у этих микроорганизмов (спис-
гипотезу, что цитоплазматические фрагменты
ки которых опубликованы в работах Rozen-
КР отвечают за их правильную локализацию
berg et al. [127] и Govorunova et al. [131]), далеко
в клетке.
не все из которых были исследованы путем
Важная роль цитоплазматического домена
гетерологической экспрессии в модельных
в функционировании микробных родопси-
клетках. Подавляющее большинство из иссле-
нов была показана ранее на примере сенсор-
дованных таким образом микроорганизмов
ного родопсина из сине-зеленой водоросли
представляют собой, как и КР C. reinhardtii,
Anabaena [123]. Модификации цитоплазмати-
преимущественно протонные каналы, также
ческого домена КР также влияют на кинетику
способные проводить Na+, K+ и, в значитель-
фототоков [124]. Фосфорилирование амино-
но меньшей степени, Ca2+ [26, 27, 33, 132, 133].
кислотных остатков в проксимальном цито-
В совокупности эти белки известны в литера-
плазматическом сегменте КР1 и КР2 было
туре как «катионные КР» [58, 131, 134]. Эти КР
обнаружено при помощи масс-спектрометри-
широко используются в оптогенетике для сти-
ческого анализа препаратов C. reinhardtii [110].
муляции активности нейронов и других воз-
Быстрые изменения степени фосфорилирова-
будимых клеток при помощи света [40-42].
ния КР1 коррелируют со знаком фототаксиса,
Все исследованные криптофитовые водо-
т.е. направлением движения клеток к источ-
росли способны к фотоориентации [135-137],
нику света или от него [125]. Очевидно, что
а у одного из их пресноводных представите-
как локализация фоторецепторов, так и изме-
лей регистрируются фоторецепторные токи,
нения характеристик его фототока определяют
близкие по свойствам к токам зеленых жгу-
изменения знака фототаксиса.
тиконосцев [24]. Полностью отсеквенирован-
Биоинформационный анализ цитоплазма-
ный геном морской водоросли Guillardia theta
тических фрагментов КР некоторых протистов
кодирует несколько десятков родопсинов, сре-
(но не C. reinhardtii) выявил наличие гомологов
ди которых есть КР [48, 138], протонные пом-
разнообразных доменов, задействованных в
пы [139] и белки, не обладающие транспорт-
энзиматических сигнальных каскадах других
ной функцией [24]. По крайней мере пять КР
организмов [126, 127], однако об их функции
G. theta функционируют как катионные каналы
в клетках пока ничего не известно. Кроме
при экспрессии в клетках млекопитающих [138,
того, цитоплазматические фрагменты КР не-
140, 141], и многие их гомологи обнаружены
которых зеленых водорослей содержат сайты
у других криптофитов [142]. Примечательно,
связывания белка SUMO (small ubiquitin-like
что по своей первичной последовательности и
modifier), а биохимические данные подтвер-
некоторым деталям транспортного механизма
ждают обратимое связывание этого белка с КР1
эти белки больше похожи на галоархейные
в лизатах C. reinhardtii и регуляцию стабильно-
протонные помпы, чем на КР зеленых водо-
сти последнего [128]. Наконец, методом имму-
рослей, и потому получили название «бакте-
нопреципитации было показано связывание
риородопсин-подобные КР» [50]. Это сходство
цитоплазматических фрагментов КР1 и КР2
подтвердилось еще и тем, что эти белки пред-
с малой ГТФазой ARL11, принадлежащей к
ставляют собой тримеры [143, 144], а не ди-
семейству Arf ГТФаз, которые опосредуют
меры, как КР зеленых водорослей [145-147].
транспорт белков в жгутики и реснички кле-
Большинство бактериородопсин-подобных КР
ток животных [128].
генерируют маленькие токи при экспрессии
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1889
их генов в клетках животных, но по крайней
для К+, чем для Na+, привлекло внимание поль-
мере один их представитель, известный как
зователей. Первые два белка такого рода, на-
ChRmine, пользуется популярностью в каче-
званные «калийными КР», были найдены у
стве оптогенетического инструмента для сти-
гетеротрофного страменопила Hyphochytrium
муляции нейронов зеленым светом [148, 149].
catenoides [51], а впоследствии их гомологи были
Другая группа КР G. theta обладает ис-
обнаружены и у некоторых других организмов
ключительно анионной селективностью [48].
[167, 168]. Результаты первых опытов по подав-
Гомологичные им белки были обнаружены у
лению нейронной активности при помощи
многих других видов криптофитовых водорос-
калийных КР выглядят очень обнадеживаю-
лей и получили название «анионные КР» [150,
ще [51, 167, 169], так что можно надеяться, что
151]. Благодаря низкой концентрации Cl- в
в будущем именно они станут основным ин-
соме зрелых нейронов открывание этих КР
струментом для этой цели.
приводит к вхождению Cl- внутрь клетки, ги-
Необходимо отметить, что в настоящее
перполяризации мембраны и подавлению ге-
время в оптогенетике, основанной на КР, ис-
нерации потенциалов действия. Анионные КР
пользуется только одна функция этих пигмен-
были успешно использованы в качестве опто-
тов - прямой ток через молекулу. Вторая и
генетических ингибиторов нейронной актив-
важнейшая в нативных клетках функция - ге-
ности и поведения червей, насекомых, рыб и
нерация задержанного фоторецепторного каль-
млекопитающих [48, 152-158]. Кроме того, они
циевого тока с усилением в 1000 раз - пока не
нашли применение как инструмент для опто-
нашла практического применения, потому что
генетического контроля движения устьичных
осуществляющие ее кальциевые каналы пока
клеток и направления роста высших расте-
не удалось идентифицировать на молекуляр-
ний [159, 160].
ном уровне.
Помимо криптофитов, анионные КР были
обнаружены у гаптофитовых водорослей [49] и
даже у некоторых представителей морских зеле-
ЗАКЛЮЧЕНИЕ
ных вородослей [127]. Более того, гомологич-
ные белки (точнее, кодирующие их гены) были
В 1970-е гг., когда в МГУ начались иссле-
выявлены у гетеротрофных организмов, при-
дования фотоэлектрической активности бак-
надлежащих к надотделу страменопилов [49,
териородопсина и еще не идентифициро-
131, 161]. Примечательно, что большинство этих
ванных на молекулярном уровне КР, было,
организмов, если не все, обладают жгутиками
конечно, невозможно предвидеть появление
по крайней мере на одной из стадий своего
целой новой области биомедицины, извест-
жизненного цикла. Представляется вероятным,
ной сегодня как оптогенетика и основанной
что в своих нативных клетках анионные КР,
на использовании этих белков для манипуля-
так же как и катионные, служат фоторецепто-
ции мембранным потенциалом при помощи
рами при фототаксисе, хотя эта гипотеза тре-
света. В настоящее время лишь одна из функ-
бует экспериментальной проверки.
ций рецептров фототаксиса (их канальная ак-
Применение анионных КР, ~200 последо-
тивность) применяется в оптогенетике. Слож-
вательностей которых известны в настоящий
ный и исключительно чувствительный каскад
момент [127, 131] как оптогенетические инги-
трансдукции светового стимула при фото-
биторы, ограничено направлением их токов в
таксисе еще ждет своего применения. Тем не
клетках-реципиентах. В терминалах многих
менее этот пример служит наглядной иллю-
аксонов концентрация Cl- выше, чем в соме,
страцией важности фундаментальных иссле-
в результате чего фотовозбуждение анион-
дований для научно-технического прогресса.
ных КР деполяризует мембрану и даже может
приводить к генерации потенциалов действия
Вклад авторов. Е.Г. Говорунова - написа-
[162-165]. В какой-то мере эти побочные эф-
ние текста обзора; О.А. Синещеков - концеп-
фекты удается преодолеть путем добавления
ция работы, написание и редактирование тек-
к кодирующей последовательности так назы-
ста обзора.
ваемых
«направляющих сигналов», предот-
Финансирование. Работа выполнена за счет
вращающих транспорт КР в аксоны [163, 165,
частных средств авторов.
166], но полностью исключить возможность
Благодарности. Авторы выражают призна-
нежелательной деполяризации таким образом
тельность всем коллегам, работы которых про-
не удается.
цитированы в этом обзоре.
Вот почему обнаружение в прошлом году
Конфликт интересов. Авторы заявляют об
КР, обладающих большей проницаемостью
отсутствии конфликта интересов.
12
БИОХИМИЯ том 88 вып. 10 2023
1
890
ГОВОРУНОВА, СИНЕЩЕКОВ
Соблюдение этических норм. Настоящий следований с участием людей или животных
обзор не содержит описания каких-либо ис- в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Drachev, L. A., Kaulen, A. D., Ostroumov, S. A.,
terial sensory rhodopsin, Nature,
312,
509-513,
and Skulachev, V. P. (1974) Electrogenesis by bacte-
doi: 10.1038/312509a0.
riorhodopsin incorporated in a planar phospholip-
14.
Takahashi, T., Tomioka, H., Kamo, N., and
id membrane, FEBS Lett., 39, 43-45, doi: 10.1016/
Kobatake, Y. (1985) A photosystem other than PS370
0014-5793(74)80012-8.
also mediates the negative phototaxis of Halobacterium
2.
Drachev, L. A., Kaulen, A. D., and Skulachev, V. P.
halobium, FEMS Microbiol. Lett.,
28,
161-164,
(1978) Time resolution of the intermediate steps in the
doi: 10.1111/j.1574-6968.1985.tb00784.x.
bacteriorhodopsin-linked electrogenesis, FEBS Lett.,
15.
Feinleib, M. E. H., and Curry, G. M. (1971) The re-
87, 161-167, doi: 10.1016/0014-5793(78)80157-4.
lationship between stimulus intensity and oriented
3.
Драчев Л. А., Каулен А. Д., Скулачев В. П., Хит-
phototactic response (topotaxis) in Chlamydomo-
рина Л. В., Чекулаева Л. Н. (1981) Фазы фотоэлек-
nas, Physiol. Plantarum, 25, 346-352, doi: 10.1111/
трического ответа бактериородопсина, Биохимия,
j.1399-3054.1971.tb01453.x.
46, 998-1004.
16.
Kondratieva, E. N., and Gogotov, I. N.
(1969)
4.
Oesterhelt, D., and Stoeckenius, W. (1971) Rhodop-
Production of hydrogen by green photosynthetic
sin-like protein from the purple membrane of Halobac-
bacteria (Chloropseudomonas), Nature, 221, 83-84,
terium halobium, Nature, 233, 149-152, doi: 10.1038/
doi: 10.1038/221083a0.
newbio233149a0.
17.
Булычев А. А., Андрианов В. К., Курелла Г. А.,
5.
Балашов С. П., Литвин Ф. Ф. (1985) Фотохими-
Литвин Ф. Ф. (1971) Трансмембранный потенциал
ческие превращения бактериородопсина, Издатель-
хлоропласта и его фотоиндуцированные измене-
ство МГУ, Москва.
ния, Докл. Акад. Наук СССР, 197, 473-477.
6.
Kandori, H. (2000) Role of internal water molecules
18.
Синещеков О. А., Андрианов В. К., Курелла Г. А.,
in bacteriorhodopsin, Biochim. Biophys. Acta Bio-
Литвин Ф. Ф. (1976) Биоэлектрические явления
energetics,
1460,
177-191, doi:
10.1016/s0005-2728
у одноклеточной зеленой водоросли и их связь с
(00)00138-9.
фототаксисом и фотосинтезом, Физиол. растений,
7.
Lanyi, J. K. (2004) Bacteriorhodopsin, Annu. Rev.
23, 229-237.
Physiol., 66, 665-688, doi: 10.1146/annurev.physiol.
19.
Синещеков O. A., Синещеков В. A., Литвин Ф. Ф.
66.032102.150049.
(1978) Фотоиндуцированные биоэлектрические
8.
Wickstrand, C., Nogly, P., Nango, E., Iwata, S.,
реакции в фототаксисе одноклеточной жгутиковой
Standfuss, J., and Neutze, R. (2019) Bacteriorhodop-
водоросли, Докл. Aкад. Нaук СССР, 239, 471-474.
sin: Structural insights revealed using X-ray lasers and
20.
Litvin, F. F., Sineshchekov, O. A., and Sineshchekov,
synchrotron radiation, Annu. Rev. Biochem., 88, 59-83,
V. A. (1978) Photoreceptor electric potential in the
doi: 10.1146/annurev-biochem-013118-111327.
phototaxis of the alga Haematococcus pluvialis, Nature,
9.
Синещеков O. A., Литвин Ф. Ф. (1974) Фототак-
271, 476-478, doi: 10.1038/271476a0.
сис микроорганизмов, его механизм и связь с фо-
21.
Sineshchekov, O. A., Govorunova, E. G., Der, A.,
тосинтезом, Усп. соврем. биологии, 78, 58-75.
Keszthelyi, L., and Nultsch, W.
(1992) Photo-
10.
Nultsch, W., and Häder, D.-P. (1988) Photomove-
electric responses in phototactic flagellated algae
ment in motile microorganisms - II, Photochem.
measured in cell suspension, J. Photochem. Photo-
Photobiol.,
47,
837-869, doi:
10.1111/j.1751-1097.
biol. B Biol., 13, 119-134, doi: 10.1016/1011-1344
1988.tb01668.x.
(92)85051-U.
11.
Spudich, E. N., and Spudich, J. L. (1982) Control of
22.
Kreimer, G. (1994) Cell biology of phototaxis in
transmembrane ion fluxes to select halorhodopsin-
flagellate algae, Int. Rev. Cytol.,
148,
229-310,
deficient and other energy-trunsduction mutants of
doi: 10.1016/S0074-7696(08)62409-2.
Halobacterium halobium, Proc. Natl. Acad. Sci. USA,
23.
Sineshchekov, O. A., Jung, K.-H., and Spudich,
79, 4308-4312, doi: 10.1073/pnas.79.14.4308.
J. L. (2002) Two rhodopsins mediate phototaxis to
12.
Bogomolni, R., and Spudich, J. L. (1982) Identification
low- and high-intensity light in Chlamydomonas
of a third rhodopsin-like pigment in phototactic
reinhardtii, Proc. Natl. Acad. Sci. USA, 99, 8689-8694,
Halobacterium halobium, Proc. Natl. Acad. Sci. USA,
doi: 10.1073/pnas.122243399.
79, 6250-6254, doi: 10.1073/pnas.79.20.6250.
24.
Sineshchekov, O. A., Govorunova, E. G., Jung, K.-H.,
13.
Spudich, J. L., and Bogomolni, R. A.
(1984)
Zauner, S., Maier, U.-G., and Spudich, J. L. (2005)
Mechanism of colour discrimination by a bac-
Rhodopsin-mediated photoreception in cryptophyte
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1891
flagellates, Biophys. J., 89, 4310-4319, doi: 10.1529/
tion, Biochem. Biophys. Res. Commun., 301, 711-717,
biophysj.105.070920.
doi: 10.1016/s0006-291x(02)03079-6.
25.
Sineshchekov, O. A., and Spudich, J. L.
(2005)
36.
Nagel, G., Mockel, B., Buldt, G., and Bamberg, E.
Sensory rhodopsin signaling in green flagellate algae.
(1995) Functional expression of bacteriorhodopsin
in Handbook of Photosensory Receptors, Wiley-VCH,
in oocytes allows direct measurement of voltage de-
Weinheim, pp. 25-42, doi: 10.1002/352760510X.ch2.
pendence of light induced H+ pumping, FEBS Lett.,
26.
Govorunova, E. G., Spudich, E. N., Lane, C. E.,
377, 263-266, doi: 0014-5793(95)01356-3.
Sineshchekov, O. A., and Spudich, J. L.
(2011)
37.
Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G.,
New channelrhodopsin with a red-shifted spectrum
and Deisseroth, K.
(2005) Millisecond-timescale,
and rapid kinetics from Mesostigma viride, mBio, 2,
genetically targeted optical control of neural activity,
e00115-00111, doi: 10.1128/mBio.00115-11.
Nat. Neurosci., 8, 1263-1268, doi: 10.1038/nn1525.
27.
Govorunova, E. G., Sineshchekov, O. A., Li, H.,
38.
Nagel, G., Brauner, M., Liewald, J. F., Adeishvili, N.,
Janz, R., and Spudich, J. L. (2013) Characterization
Bamberg, E., and Gottschalk, A. (2005) Light ac-
of a highly efficient blue-shifted channelrhodop-
tivation of channelrhodopsin-2 in excitable cells of
sin from the marine alga Platymonas subcordiform-
Caenorhabditis elegans triggers rapid behavioral re-
is, J. Biol. Chem., 288, 29911-29922, doi: 10.1074/
sponses, Curr. Biol., 15, 2279-2284, doi: 10.1016/
jbc.M113.505495.
j.cub.2005.11.032.
28.
Govorunova, E. G., Jung, K.-W., Sineshchekov,
39.
Li, X., Gutierrez, D. V., Hanson, M. G., Han, J.,
O. A., and Spudich, J. L. (2004) Chlamydomonas sen-
Mark, M. D., Chiel, H., Hegemann, P., Landmess-
sory rhodopsins A and B: Cellular content and role in
er, L. T., and Herlitze, S. (2005) Fast noninvasive ac-
photophobic responses, Biophys. J., 86, 2342-2349,
tivation and inhibition of neural and network activity
doi: 10.1016/S0006-3495(04)74291-5.
by vertebrate rhodopsin and green algae channelrho-
29.
Foster, K.-W., and Smyth, R. D. (1980) Light antennas
dopsin, Proc. Natl. Acad. Sci. USA, 102, 17816-17821,
in phototactic algae, Microbiol. Rev., 44, 572-630,
doi: 10.1073/pnas.0509030102.
doi: 10.1128/mr.44.4.572-630.1980.
40.
Deisseroth, K. (2011) Optogenetics, Nat. Methods, 8,
30.
Foster, K.-W., Saranak, J., Patel, N., Zarrilli, G.,
26-29, doi: 10.1038/nmeth.f.324.
Okabe, M., Kline, T., and Nakanishi, K.
(1984)
41.
Yawo, H., Asano, T., Sakai, S., and Ishizuka, T.
A rhodopsin is the functional photoreceptor for
(2013) Optogenetic manipulation of neural and non-
phototaxis in the unicelullar eukaryote Chlamydomonas,
neural functions, Dev. Growth Differ., 55, 474-490,
Nature, 311, 756-759, doi: 10.1038/311756a0.
doi: 10.1111/dgd.12053.
31.
Sineshchekov, O. A., Govorunova, E. G., Der, A.,
42.
Deisseroth, K. (2015) Optogenetics: 10 years of micro-
Keszthelyi, L., and Nultsch, W. (1994) Photoinduced
bial opsins in neuroscience, Nat. Neurosci., 18, 1213-
electric currents in carotenoid-deficient Chlam-
1225, doi: 10.1038/nn.4091.
ydomonas mutants reconstituted with retinal and its
43.
Emiliani, V., Entcheva, E., Hedrich, R., Hege-
analogs, Biophys. J., 66, 2073-2084, doi: 10.1016/
mann, P., Konrad, K. R., Lüscher, C., Mahn, M.,
S0006-3495(94)81002-1.
Pan, Z.-H., Sims, R. R., Vierock, J., and Yizhar, O.
32.
Sineshchekov, O. A., and Govorunova, E. G. (1999)
(2022) Optogenetics for light control of biological sys-
Rhodopsin-mediated photosensing in green flagellated
tems, Nat. Rev. Methods Primers, 2, 55, doi: 10.1038/
algae, Trends Plant Sci., 4, 58-63, doi: 10.1016/s1360-
s43586-022-00136-4.
1385(98)01370-3.
44.
Chow, B. Y., and Boyden, E. S. (2013) Optogenetics
33.
Nagel, G., Ollig, D., Fuhrmann, M., Kateriya, S.,
and translational medicine, Sci. Transl. Med., 5,
Musti, A. M., Bamberg, E., and Hegemann, P. (2002)
177ps175, doi: 10.1126/scitranslmed.3003101.
Channelrhodopsin-1: a light-gated proton channel in
45.
Sasse, P., Funken, M., Beiert, T., and Bruegmann, T.
green algae, Science, 296, 2395-2398, doi: 10.1126/
(2019) Optogenetic termination of cardiac arrhyth-
science.1072068.
mia: Mechanistic enlightenment and therapeutic
34.
Nagel, G., Szellas, T., Huhn, W., Kateriya, S.,
application? Front. Physiol., 10, 675, doi: 10.3389/
Adeishvili, N., Berthold, P., Ollig, D., Hegemann, P.,
fphys.2019.00675.
and Bamberg, E. (2003) Channelrhodopsin-2, a di-
46.
Sahel, J. A., Boulanger-Scemama, E., Pagot, C.,
rectly light-gated cation-selective membrane chan-
Arleo, A., Galluppi, F., Martel, J. N., Esposti, S. D.,
nel, Proc. Natl. Acad. Sci. USA, 100, 13940-13945,
Delaux, A., de Saint Aubert, J. B., de Montleau, C.,
doi: 10.1073/pnas.1936192100.
Gutman, E., Audo, I., Duebel, J., Picaud, S.,
35.
Suzuki, T., Yamasaki, K., Fujita, S., Oda, K.,
Dalkara, D., Blouin, L., Taiel, M., and Roska, B.
Iseki, M., Yoshida, K., Watanabe, M., Daiya-
(2021) Partial recovery of visual function in a blind
su, H., Toh, H., Asamizu, E., Tabata, S., Miura, K.,
patient after optogenetic therapy, Nat. Med., 27, 1223-
Fukuzawa, H., Nakamura, S., and Takahashi, T.
1229, doi: 10.1038/s41591-021-01351-4.
(2003) Archaeal-type rhodopsins in Chlamydo-
47.
Chow, B. Y., Han, X., Dobry, A. S., Qian, X., Chuong,
monas: model structure and intracellular localiza-
A. S., Li, M., Henninger, M. A., Belfort, G. M.,
БИОХИМИЯ том 88 вып. 10 2023
12*
1892
ГОВОРУНОВА, СИНЕЩЕКОВ
Lin, Y., Monahan, P. E., and Boyden, E. S. (2010)
and their structure-function relationships, Front. Cell
High-performance genetically targetable optical neu-
Neurosci., 15, 800313, doi: 10.3389/fncel.2021.800313.
ral silencing by light-driven proton pumps, Nature,
60.
Boyden, E. S. (2011) A history of optogenetics: the
463, 98-102, doi: 10.1038/nature08652.
development of tools for controlling brain circuits with
48.
Govorunova, E. G., Sineshchekov, O. A., Liu, X.,
light, F1000 Biol. Rep., 3, 11, doi: 10.3410/B3-11.
Janz, R., and Spudich, J. L. (2015) Natural light-gated
61.
Fenno, L., Yizhar, O., and Deisseroth, K.
(2011)
anion channels: A family of microbial rhodopsins
The development and application of optogenetics,
for advanced optogenetics, Science, 349, 647-650,
Annu. Rev. Neurosci.,
34,
389-412, doi:
10.1146/
doi: 10.1126/science.aaa7484.
annurev-neuro-061010-113817.
49.
Govorunova, E. G., Sineshchekov, O. A., Li, H.,
62.
Hegemann, P., and Nagel, G.
(2013) From
Wang, Y., Brown, L. S., and Spudich, J. L. (2020)
channelrhodopsins to optogenetics, EMBO Mol. Med.,
RubyACRs, non-algal anion channelrhodopsins with
5, 1-4, doi: 10.1002/emmm.201202387.
highly red-shifted absorption, Proc. Natl. Acad. Sci.
63.
Boyden, E. S. (2015) Optogenetics and the future
USA, 117, 22833-22840, doi: 10.1073/pnas.2005981117.
of neuroscience, Nat. Neurosci.,
18,
1200-1201,
50.
Sineshchekov, O. A., Govorunova, E. G., Li, H., and
doi: 10.1038/nn.4094.
Spudich, J. L. (2017) Bacteriorhodopsin-like chan-
64.
Richards, R., and Dempski, R. E. (2015) From pho-
nelrhodopsins: Alternative mechanism for control of
totaxis to biomedical applications: Investigating the
cation conductance, Proc. Natl. Acad. Sci. USA, 114,
molecular mechanism of channelrhodopsins, in Elec-
E9512-E9519, doi: 10.1073/pnas.1710702114.
trophysiology of Unconventional Channels and Pores
51.
Govorunova, E. G., Gou, Y., Sineshchekov, O. A.,
(Delcour, A. H., ed) Springer International Pub-
Li, H., Lu, X., Wang, Y., Brown, L. S., St-Pierre, F.,
lishing Switzerland. pp.
361-381, doi:
10.1007/
Xue, M., and Spudich, J. L. (2022) Kalium channel-
978-3-319-20149-8_15.
rhodopsins are natural light-gated potassium channels
65.
Bamberg, E., Gärtner, W., and Trauner, D. (2018)
that mediate optogenetic inhibition, Nat. Neurosci.,
Introduction: Optogenetics and photopharmacol-
25, 967-974, doi: 10.1038/s41593-022-01094-6.
ogy, Chem. Rev., 118, 10627-10628, doi: 10.1021/
52.
Der, A., and Keszthelyi, L. (2001) Charge mo-
acs.chemrev.8b00483.
tion during the photocycle of bacteriorhodop-
66.
Baylor, D. A., and Hodgkin, A. L. (1973) Detec-
sin,
Biochemistry (Moscow),
66,
1234-1248,
tion and resolution of visual stimuli by turtle pho-
doi: 10.1023/A:1013179101782.
toreceptors, J. Physiol., 234, 163-198, doi: 10.1113/
53.
Sineshchekov, O. A., Govorunova, E. G., Wang, J.,
jphysiol.1973.sp010340.
Li, H., and Spudich, J. L. (2013) Intramolecular
67.
Harz, H., and Hegemann, P. (1991) Rhodopsin-
proton transfer in channelrhodopsins, Biophys. J., 104,
regulated calcium currents in Chlamydomonas, Nature,
807-817, doi: 10.1016/j.bpj.2013.01.002.
351, 489-491, doi: 10.1038/351489a0.
54.
Sineshchekov, O. A., Govorunova, E. G., Li, H., and
68.
Braun, F. J., and Hegemann, P. (1999) Two light-
Spudich, J. L. (2015) Gating mechanisms of a natural
activated conductances in the eye of the green alga
anion channelrhodopsin, Proc. Natl. Acad. Sci. USA,
Volvox carteri, Biophys. J., 76, 1668-1678, doi: 10.1016/
112, 14236-14241, doi: 10.1073/pnas.1513602112.
S0006-3495(99)77326-1.
55.
Sineshchekov, O. A., Govorunova, E. G., Li, H.,
69.
Yoshimura, K. (1996) A novel type of mechanorecep-
Wang, Y., and Spudich, J. L. (2023) Sequential
tion by the flagella of Chlamydomonas, J. Exp. Biol.,
absorption of two photons creates a bistable form of
199, 295-302, doi: 10.1242/jeb.199.2.295.
RubyACR responsible for its strong desensitization,
70.
Sineshchekov, O. A., and Govorunova, E. G. (2001)
Proc. Natl. Acad. Sci. USA,
120, e2301521120,
Electrical events in photomovements of green flagellated
doi: 10.1073/pnas.2301521120.
algae, in Comprehensive Series in Photosciences (Hader,
56.
Schneider, F., Grimm, C., and Hegemann, P. (2015)
D.-P., and Lebert, M., eds) Elsevier, Amsterdam,
Biophysics of channelrhodopsin, Annu. Rev. Bio-
pp. 245-280, doi: 10.1016/S1568-461X(01)80013-2.
phys.,
44,
167-186, doi:
10.1146/annurev-biophys-
71.
Sineshchekov, O. A., Govorunova, E. G., and
060414-034014.
Spudich, J. L. (2021) Probing channelrhodopsin electri-
57.
Deisseroth, K., and Hegemann, P. (2017) The form
cal activity in algal cell populations, in Channelrhodop-
and function of channelrhodopsin, Science,
357,
sin (Dempski, R., ed) 2020/09/01 Ed., Humana, New
eaan5544, doi: 10.1126/science.aan5544.
York. pp. 85-96, doi: 10.1007/978-1-0716-0830-2_6.
58.
Govorunova, E. G., Sineshchekov, O. A., Li, H.,
72.
Kreimer, G., Overländer, C., Sineshchekov, O. A.,
and Spudich, J. L. (2017) Microbial rhodopsins: Di-
Stolzis, H., Nultsch, W., and Melkonian, M. (1992)
versity, mechanisms, and optogenetic applications,
Functional analysis of the eyespot in Chlamydomonas
Annu. Rev. Biochem.,
86,
845-872, doi:
10.1146/
reinhardtii mutant ey 627, mt-, Planta, 188, 513-521,
annurev-biochem-101910-144233.
doi: 10.1007/BF00197043.
59.
Govorunova, E. G., Sineshchekov, O. A., and Spudich,
73.
Pazour, G., Sineshchekov, O., and Witman, G. B.
J. L. (2021) Emerging diversity of channelrhodopsins
(1995) Mutational analysis of the phototransduction
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1893
pathway of Chlamydomonas reinhardtii, J. Cell Biol.,
plasma membrane and chloroplast components during
131, 427-440, doi: 10.1083/jcb.131.2.427.
eyespot assembly, Eukaryot. Cell,
12,
1258-1270,
74.
Matsuda, A., Yoshimura, K., Sineshchekov, O., Hi-
doi: 10.1128/EC.00111-13.
rono, M., and Kamiya, R. (1998) Isolation and char-
86.
Schmidt, M., Gessner, G., Luff, M., Heiland, I.,
acterization of novel Chlamydomonas mutants that
Wagner, V., Kaminski, M., Geimer, S., Eitzinger, N.,
display phototaxis but not photophobic response,
Reissenweber, T., Voytsekh, O., Fiedler, M., Mittag, M.,
Cell Motil. Cytoskeleton, 41, 353-362, doi: 10.1002/
and Kreimer, G. (2006) Proteomic analysis of the eye-
(SICI)1097-0169(1998)41:4<353::AID-CM7>3.0.
spot of Chlamydomonas reinhardtii provides novel in-
CO;2-0.
sights into its components and tactic movements, Plant
75.
Govorunova, E. G., and Sineshchekov, O. A. (2003)
Cell, 18, 1908-1930, doi: 10.1105/tpc.106.041749.
Integration of photo- and chemosensory signaling
87.
Melkonian, M., and Robenek, H. (1980) Eyespot
pathways in Chlamydomonas, Planta, 216, 535-540,
membranes of Chlamydomonas reinhardtii: a freeze-
doi: 10.1007/s00425-002-0901-7.
fracture study, J. Ultrastruct. Res.,
72,
90-102,
76.
Govorunova, E. G., Altschuler, I. M., Häder, D. P.,
doi: 10.1016/S0022-5320(80)90138-0.
and Sineshchekov, O. A. (2000) A novel express bio-
88.
Awasthi, M., Ranjan, P., Sharma, K., Veetil, S. K.,
assay for detecting toxic substances in water by record-
and Kateriya, S. (2016) The trafficking of bacterial
ing rhodopsin-mediated photoelectric responses in
type rhodopsins into the Chlamydomonas eyespot
Chlamydomonas cell suspensions, Photochem. Photo-
and flagella is IFT mediated, Sci. Rep., 6, 34646,
biol., 72, 320-326, doi: 10.1562/0031-8655(2000)072
doi: 10.1038/srep34646.
<0320:anebfd>2.0.co;2.
89.
Awasthi, M., Ranjan, P., and Kateriya, S.
(2018)
77.
Govorunova, E. G., and Sineshchekov, O. A. (2017)
Cytoplasmic extensions of the channelrhodopsins 1
Express detection of water pollutants by photoelectric
and 2 interact in Chlamydomonas reinhardtii, J. Appl.
recording from algal cell suspensions, in Bioassays:
Biotechnol. Bioeng.,
5,
84-90, doi:
10.15406/jabb.
Advanced Methods and Applications (Häder, D.-P., and
2018.05.00121.
Erzinger, G. S., eds) Elsevier, Amsterdam, pp. 289-
90.
Синещеков О. А., Литвин Ф. Ф. (1988 ) Механизмы
308, doi: 10.1016/B978-0-12-811861-0.00014-0.
фототаксиса микроорганизмов. in Молекулярные
78.
Sineshchekov, O. A. (1991) Photoreception in unicel-
механизмы биологического действия оптического
lular flagellates: bioelectric phenomena in phototaxis, in
излучения (под ред. Рубин А. Б.) Наука, Москва,
Light in Biology and Medicine (Douglas, R. D., ed) Ple-
стр. 412-427.
num Press, New York, pp. 523-532, doi: 10.1007/978-
91.
Witman, G. B.
(1993) Chlamydomonas photo-
1-4684-5991-3_53.
taxis, Trends Cell Biol., 3, 403-408, doi: 10.1016/
79.
Синещеков, O. A. (1988) Фототаксис микроорга-
0962-8924(93)90091-e.
низмов и его роль в регуляции фотосинтеза, Фото-
92.
Kateriya, S., Nagel, G., Bamberg, E., and Hege-
трофные микроорганизмы (под ред. Гоготов, И. Н.)
mann, P. (2004) “Vision” in single-celled algae, News
Изд-во Академии Наук СССР, Пущино, стр. 11-18.
Physiol. Sci., 19, 133-137, doi: 10.1152/nips.01517.2004.
80.
Yoshimura, K. (1994) Chromophore orientation in
93.
Kreimer, G. (2009) The green algal eyespot apparatus:
the photoreceptor of Chlamydomonas as probed by
a primordial visual system and more? Curr. Genet., 55,
stimulation with polarized light, Photochem. Photobiol.,
19-43, doi: 10.1007/s00294-008-0224-8.
60, 594-597, doi: 10.1111/j.1751-1097.1994.tb05154.x.
94.
Böhm, M., and Kreimer, G. (2021) Orient in the
81.
Mast, S. O. (1911) Light and the Behavior of Organisms,
world with a single eye: The green algal eyespot and
Wiley, New York, doi: 10.5962/bhl.title.4601.
phototaxis, in Prog. Bot. (Cánovas, F. M., Lüttge, U.,
82.
Morel-Laurens, N. M. L., and Feinleib, M. E. (1983)
Risueño, M.-C., and Pretzsch, H., eds). pp. 259-304,
Photomovement in an “eyeless” mutant of Chlam-
doi: 10.1007/124_2020_38.
ydomonas, Photochem. Photobiol.,
37,
189-194,
95.
Sineshchekov, O. A. (1991) Electrophysiology of pho-
doi: 10.1111/j.1751-1097.1983.tb04457.x.
tomovements in flagellated algae. in Biophysics of
83.
Kreimer, G., and Melkonian, M. (1990) Reflection
Photoreceptors and Photomovements in Microorgan-
confocal laser scanning microscopy of eyespot in
isms (Lenci, F., Ghetti, F., Colombetti, G., Haeder,
flagellated green algae, Eur. J. Cell Biol., 53, 101-111,
D.-P., and Song, P.-S., eds) Plenum Press, New York.
doi: 10.1016/S1434-4610(99)70032-5.
pp. 191-202, doi: 10.1007/978-1-4684-5988-3_15.
84.
Berthold, P., Tsunoda, S. P., Ernst, O. P., Mages, W.,
96.
Rüffer, U., and Nultsch, W.
(1990) Flagella
Gradmann, D., and Hegemann, P. (2008) Channel-
photoresponses of Chlamydomonas cells held on
rhodopsin-1 initiates phototaxis and photophobic
micropipettes: I. Change in flagellar beat frequency,
responses in Chlamydomonas by immediate light-
Cell Motil. Cytoskeleton, 15, 162-167, doi: 10.1002/
induced depolarization, Plant Cell, 20, 1665-1677,
cm.970150305.
doi: 10.1105/tpc.108.057919.
97.
Rüffer, U., and Nultsch, W.
(1991) Flagellar
85.
Mittelmeier, T. M., Thompson, M. D., Ozturk, E., and
photoresponses of Chlamydomonas cells held on
Dieckmann, C. L. (2013) Independent localization of
micropipettes: II. Change in flagellar beat pattern,
БИОХИМИЯ том 88 вып. 10 2023
1
894
ГОВОРУНОВА, СИНЕЩЕКОВ
Cell Motil. Cytoskeleton, 18, 269-278, doi: 10.1002/
way, Plant Physiol.,
146,
772-788, doi:
10.1104/
cm.970180404.
pp.107.109645.
98. Josef, K., Saranak, J., and Foster, K.-W. (2005) Ciliary
111. Linden, L., and G., K. (1995) Calcium modulates
behavior of a negatively phototactic Chlamydomonas
rapid protein phosphorilation/dephosphorilation in
reinhardtii, Cell Motil. Cytoskeleton,
61,
97-111,
isolated eyespot apparatuses of the green alga Sper-
doi: 10.1002/cm.20069.
matozopsis similis, Planta, 197, 343-351, doi: 10.1007/
99. Josef, K., Saranak, J., and Foster, K.-W.
(2006)
BF00202656.
Linear systems analysis of the ciliary steering behavior
112. Schlicher, U., Linden, L., Calenberg, M., and
associated with negative-phototaxis in Chlamydomonas
Kreimer, G. (1995) G proteins and Ca2+ modulated
reinhardtii, Cell Motil. Cytoskeleton,
63,
758-777,
protein kinases of a plasma membrane enriched frac-
doi: 10.1002/cm.20158.
tion and isolated eyespot apparatuses of Spermatozopsis
100. Holland, E.-M., Harz, H., Uhl, R., and Hegemann, P.
similis (Chlorophycea), Eur. J. Phycol., 30, 319-330,
(1997) Control of phobic behavioral responses by
doi: 10.1080/09670269500651111.
rhodopsin-induced photocurrents in Chlamydomonas,
113. Calenberg, M., Brohnsonn, U., Zedlacher, M., and
Biophys. J., 73, 1395-1401, doi: 10.1016/S0006-3495
Kreimer, G. (1998) Light- and Ca2+-modulated het-
(97)78171-2.
eromeric GTPases in the eyespot apparatus of a flag-
101. Schmidt, J. A., and Eckert, R. (1976) Calcium couples
ellate green alga, Plant Cell, 10, 91-103, doi: 10.1105/
f lagella reversal to photostimulation in Chlamydomonas
tpc.10.1.91.
reinhardtii, Nature, 262, 713-715, doi: 10.1038/262713a0.
114. Trippens, J., Greiner, A., Schellwat, J., Neukam, M.,
102. Nultsch, W., and Häder, D.-P. (1979) Photomovement
Rottmann, T., Lu, Y., Kateriya, S., Hegemann, P., and
of motile microorganisms, Photochem. Photobiol., 29,
Kreimer, G. (2012) Phototropin influence on eyespot
423-437, doi: 10.1111/j.1751-1097.1979.tb07072.x.
development and regulation of phototactic behavior in
103. Harz, H., Nonnengässer, C., and Hegemann, P.
Chlamydomonas reinhardtii, Plant Cell, 24, 4687-702,
(1992) The photoreceptor current of the green alga
doi: 10.1105/tpc.112.103523.
Chlamydomonas, Phil. Trans. R. Soc. Lond. B, 338,
115. Holland, E.-M., Braun, F.-J., Nonnengässer, C.,
39-52, doi: 10.1098/rstb.1992.0127.
Harz, H., and Hegemann, P. (1996) The nature of
104. Beck, C., and Uhl, R. (1994) On the localization
rhodopsin-triggered photocurrents in Chlamydomonas.
of voltage-sensitive calcium channels in the flagella
I. Kinetics and influence of divalent ions, Biophys. J.,
of Chlamydomonas reinhardtii, J. Cell Biol.,
125,
70, 924-931, doi: 10.1016/S0006-3495(96)79635-2.
1119-1125, doi: 10.1083/jcb.125.5.1119.
116. Nonnengässer, C., Holland, E.-M., Harz, H., and
105. Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M.,
Hegemann, P. (1996) The nature of rhodopsin-ac-
and Yoshimura, K. (2009) Chlamydomonas CAV2
tivated photocurrents in Chlamydomonas. II. Influ-
encodes a voltage-dependent calcium channel required
ence of monovalent ions, Biophys. J., 70, 932-938,
for the flagellar waveform conversion, Curr. Biol., 19,
doi: 10.1016/S0006-3495(96)79636-4.
133-139, doi: 10.1016/j.cub.2008.11.068.
117. Ritter, E., Stehfest, K., Berndt, A., Hegemann, P.,
106. Sineshchekov, O. A., Litvin, F. F., and Keszthelyi, L.
and Bartl, F. J. (2008) Monitoring light-induced
(1990) Two components of photoreceptor potential
structural changes of Channelrhodopsin-2 by UV-
of the flagellated green alga Haematococcus pluvia-
visible and Fourier transform infrared spectroscopy,
lis, Biophys. J., 57, 33-39, doi: 10.1016/S0006-3495
J. Biol. Chem.,
283,
35033-35041, doi:
10.1074/
(90)82504-2.
jbc.M806353200.
107. Sineshchekov, O. A., Govorunova, E. G., and Spudich,
118. Bamann, C., Kirsch, T., Nagel, G., and Bamberg, E.
J. L. (2009) Photosensory functions of channelrho-
(2008) Spectral characteristics of the photocycle of
dopsins in native algal cells, Photochem. Photobiol., 85,
channelrhodopsin-2 and its implication for channel
556-563, doi: 10.1111/j.1751-1097.2008.00524.x.
function, J. Mol. Biol., 375, 686-694, doi: 10.1016/
108. Hegemann, P., and Marwan, W.
(1988) Single
j.jmb.2007.10.072.
photons are sufficient to trigger movement responses
119. Baidukova, O., Oppermann, J., Kelterborn, S.,
in Chlamydomonas reinhardtii, Photochem. Photobiol.,
Fernandez Lahore, R. G., Schumacher, D., Evers, H.,
48, 99-106, doi: 10.1111/j.1751-1097.1988.tb02793.x.
Kamrani, Y. Y., and Hegemann, P. (2022) Gating
109. Verret, F., Wheeler, G., Taylor, A. R., Farnham, G.,
and ion selectivity of channelrhodopsins are critical
and Brownlee, C.
(2010) Calcium channels in
for photo-activated orientation of Chlamydomonas as
photosynthetic eukaryotes: implications for evolution
shown by in vivo point mutation, Nat Commun, 13,
of calcium-based signalling, New Phytol., 187, 23-43,
7253, doi: 10.1038/s41467-022-35018-6.
doi: 10.1111/j.1469-8137.2010.03271.x.
120. Dent, R. M., Haglund, C. M., Chin, B. L., Kobayashi,
110. Wagner, V., Ullmann, K., Mollwo, A., Kaminski, M.,
M. C., and Niyogi, K. K. (2005) Functional genomics
Mittag, M., and Kreimer, G. (2008) The phosphopro-
of eukaryotic photosynthesis using insertional
teome of a Chlamydomonas reinhardtii eyespot frac-
mutagenesis of Chlamydomonas reinhardtii, Plant
tion includes key proteins of the light signaling path-
Physiol., 137, 545-556, doi: 10.1104/pp.104.055244.
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1895
121. Sizova, I., Greiner, A., Awasthi, M., Kateriya, S.,
of life for green plants, Annu. Rev. Plant Biol., 71, 741-
and Hegemann, P. (2013) Nuclear gene targeting
765, doi: 10.1146/annurev-arplant-042916-041040.
in Chlamydomonas using engineered zinc-finger
131. Govorunova, E. G., Sineshchekov, O. A., Li, H.,
nucleases, Plant J., 73, 873-882, doi: 10.1111/tpj.12066.
Wang, Y., Brown, L. S., Palmateer, A., Melkonian, M.,
122. Greiner, A., Kelterborn, S., Evers, H., Kreimer, G.,
Cheng, S., Carpenter, E., Patterson, J., Wong, G. K.
Sizova, I., and Hegemann, P. (2017) Targeting of
S., and Spudich, J. L. (2021) Cation and anion chan-
photoreceptor genes in Chlamydomonas reinhardtii via
nelrhodopsins: Sequence motifs and taxonomic dis-
zinc-finger nucleases and CRISPR/Cas9, Plant Cell,
tribution, MBio, 12, e0165621, doi: 10.1128/mBio.
29, 2498-2518, doi: 10.1105/tpc.17.00659.
01656-21.
123. Sineshchekov, O. A., Spudich, E. N., Trivedi, V. D.,
132. Glock, C., Nagpal, J., and Gottschalk, A. (2015) Mi-
and Spudich, J. L. (2006) Role of the cytoplasmic
crobial rhodopsin optogenetic tools: Application for
domain in Anabaena sensory rhodopsin photocycling:
analyses of synaptic transmission and of neuronal net-
vectoriality of Schiff base deprotonation, Biophys. J.,
work activity in behavior, Methods Mol. Biol., 1327,
91, 4519-4527, doi: 10.1529/biophysj.106.093641.
87-103, doi: 10.1007/978-1-4939-2842-2_8.
124. Tashiro, R., Sushmita, K., Hososhima, S., Sharma, S.,
133. Tsunoda, S. P., and Hegemann, P. (2009) Glu 87 of
Kateriya, S., Kandori, H., and Tsunoda, S. P. (2021)
channelrhodopsin-1 causes pH-dependent color tun-
Specific residues in the cytoplasmic domain modulate
ing and fast photocurrent inactivation, Photochem.
photocurrent kinetics of channelrhodopsin from the
Photobiol.,
85,
564-569, doi:
10.1111/j.1751-1097.
alga Klebsormidium nitens, Commun. Biol., 4, 235,
2008.00519.x.
doi: 10.1038/s42003-021-01755-5.
134. Говорунова Е. Г., Синещеков О. А., Спудич Д. Л.
125. Böhm, M., Boness, D., Fantisch, E., Erhard, H.,
(2017) Три семейства канальных родопсинов и их
Frauenholz, J., Kowalzyk, Z., Marcinkowski, N.,
использование в оптогенетике, Журн. Высш. Нерв-
Kateriya, S., Hegemann, P., and Kreimer, G. (2019)
ной Деятельности, 67, 1-9.
Channelrhodopsin-1 phosphorylation changes with
135. Watanabe, M., and Furuya, M. (1982) Phototactic
the phototactic behavior and responds to physiological
behavior of individual cells of Cryptomonas sp. in
stimuli in Chlamydomonas, Plant Cell, 31, 886-910,
response to continuous and intermittent light stimuli,
doi: 10.1105/tpc.18.00936.
Photochem. Photobiol.,
35,
559-563, doi:
10.1111/
126. Awasthi, M., Sushmita, K., Kaushik, M. S.,
j.1751-1097.1982.tb02609.x.
Ranjan, P., and Kateriya, S. (2020) Novel modu-
136. Rhiel, E., Häder, D.-P., and Wehrmeyer, W. (1988)
lar rhodopsins from green algae hold great potential
Photo-orientation in a freshwater Cryptomonas spe-
for cellular optogenetic modulation across the bio-
cies, J. Photochem. Photobiol. B Biol., 2, 123-132,
logical model systems, Life, 10, 259, doi: 10.3390/
doi: 10.1016/1011-1344(88)85041-3.
life10110259.
137. Erata, M., Kubota, M., Takahashi, T., Inouye, I., and
127. Rozenberg, A., Oppermann, J., Wietek, J., Fernandez
Watanabe, M. (1995) Ultrastructure and phototactic
Lahore, R. G., Sandaa, R. A., Bratbak, G., Hege-
action spectra of two genera of cryptophyte flagellate
mann, P., and Béjà, O. (2020) Lateral gene transfer of
algae, Cryptomonas and Chroomonas, Protoplasma,
anion-conducting channelrhodopsins between green
188, 258-266, doi: 10.1007/BF01280378.
algae and giant viruses, Curr. Biol., 30, 4910-4920,
138. Govorunova, E. G., Sineshchekov, O. A., and
doi: 10.1016/j.cub.2020.09.056.
Spudich, J. L. (2016) Structurally distinct cation chan-
128. Sharma, K., Sizova, I., Sanyal, S. K., Pandey, G. K.,
nelrhodopsins from cryptophyte algae, Biophys. J.,
Hegemann, P., and Kateriya, S. (2023) Deciphering
110, 2302-2304, doi: S0006-3495(16)30274-0.
the role of cytoplasmic domain of Channelrhodopsin
139. Gradinaru, V., Zhang, F., Ramakrishnan, C., Mat-
in modulating the interactome and SUMOylome of
tis, J., Prakash, R., Diester, I., Goshen, I., Thompson,
Chlamydomonas reinhardtii, Int. J. Biol. Macromol.,
K. R., and Deisseroth, K. (2010) Molecular and cel-
243, 125135, doi: 10.1016/j.ijbiomac.2023.125135.
lular approaches for diversifying and extending op-
129. Matasci, N., Hung, L. H., Yan, Z., Carpenter, E. J.,
togenetics, Cell, 141, 154-165, doi: 10.1016/j.cell.
Wickett, N. J., Mirarab, S., Nguyen, N., Warnow, T.,
2010.02.037.
Ayyampalayam, S., Barker, M., Burleigh, J. G.,
140. Yamauchi, Y., Konno, M., Ito, S., Tsunoda, S. P.,
Gitzendanner, M. A., Wafula, E., Der, J. P.,
Inoue, K., and Kandori, H.
(2017) Molecular
dePamphilis, C. W., Roure, B., Philippe, H., Ruh-
properties of a DTD channelrhodopsin from Guillardia
fel, B. R., Miles, N. W., Graham, S. W., et al. (2014)
theta, Biophys. Physicobiol., 14, 57-66, doi: 10.2142/
Data access for the 1,000 Plants (1KP) project, Giga-
biophysico.14.0_57.
science, 3, 17, doi: 10.1186/2047-217X-3-17.
141. Hososhima, S., Ueno, S., Okado, S., Inoue, K. I.,
130. Wong, G. K., Soltis, D. E., Leebens-Mack, J., Wickett,
Konno, M., Yamauchi, Y., Inoue, K., Terasaki, H.,
N. J., Barker, M. S., Van de Peer, Y., Graham, S. W.,
Kandori, H., and Tsunoda, S. P. (2023) A light-gated
and Melkonian, M. (2020) Sequencing and analyzing
cation channel with high reactivity to weak light, Sci
the transcriptomes of a thousand species across the tree
Rep., 13, 7625, doi: 10.1038/s41598-023-34687-7.
БИОХИМИЯ том 88 вып. 10 2023
1896
ГОВОРУНОВА, СИНЕЩЕКОВ
142. Sineshchekov, O. A., Govorunova, E. G., Li, H.,
151. Govorunova, E. G., Sineshchekov, O. A., Hemmati, R.,
Wang, Y., Melkonian, M., Wong, G. K.-S., Brown,
Janz, R., Morelle, O., Melkonian, M., Wong, G. K. S.,
L. S., and Spudich, J. L. (2020) Conductance mech-
and Spudich, J. L. (2018) Extending the time domain
anisms of rapidly desensitizing cation channelrho-
of neuronal silencing with cryptophyte anion chan-
dopsins from cryptophyte algae, mBio, 11, e00657-20,
nelrhodopsins, eNeuro, 5, ENEURO.0174-0118.2018,
doi: 10.1128/mBio.00657-20.
doi: 10.1523/ENEURO.0174-18.2018.
143. Kishi, K. E., Kim, Y. S., Fukuda, M., Inoue, M.,
152. Долгих Д. А., Малышев А. Ю., Саложин С. В.,
Kusakizako, T., Wang, P. Y., Ramakrishnan, C.,
Некрасова О. В., Петровская Л. Е., Рощин М. В.,
Byrne, E. F. X., Thadhani, E., Paggi, J. M., Matsui,
Бородинова А. А., Фельдман Т. Б., Балабан П. М.,
T. E., Yamashita, K., Nagata, T., Konno, M.,
Кирпичников М. П., Островский М. А. (2015)
Quirin, S., Lo, M., Benster, T., Uemura, T., Liu, K.,
Анионный канальный родопсин, экспресси-
Shibata, M., et al. (2022) Structural basis for channel
рованный в культуре нейронов и in vivo в мозге
conduction in the pump-like channelrhodopsin
мыши: светоиндуцированное подавление гене-
ChRmine, Cell, 185, 672-689.e623, doi: 10.1016/j.
рации потенциалов действия, Докл. Aкад. Нaук,
cell.2022.01.007.
465, 737-740, doi: 10.7868/S086956521536030X.
144. Tucker, K., Sridharan, S., Adesnik, H., and
153. Mohammad, F., Stewart, J. C., Ott, S., Chlebikova, K.,
Brohawn, S. G. (2022) Cryo-EM structures of the
Chua, J. Y., Koh, T. W., Ho, J., and Claridge-
channelrhodopsin ChRmine in lipid nanodiscs, Nat.
Chang, A. (2017) Optogenetic inhibition of behavior
Commun., 13, 4842, doi: 10.1038/s41467-022-32441-7.
with anion channelrhodopsins, Nat. Methods, 14,
145. Kato, H. E., Zhang, F., Yizhar, O., Ramakrishnan, C.,
271-274, doi: 10.1038/nmeth.4148.
Nishizawa, T., Hirata, K., Ito, J., Aita, Y., Tsukazaki, T.,
154. Mohamed, G. A., Cheng, R. K., Ho, J., Krishnan, S.,
Hayashi, S., Hegemann, P., Maturana, A. D.,
Mohammad, F., Claridge-Chang, A., and Je-
Ishitani, R., Deisseroth, K., and Nureki, O. (2012)
suthasan, S. (2017) Optical inhibition of larval zebraf-
Crystal structure of the channelrhodopsin light-gated
ish behaviour with anion channelrhodopsins, BMC
cation channel, Nature, 482, 369-374, doi: 10.1038/
Biol., 15, 103, doi: 10.1186/s12915-017-0430-2.
nature10870.
155. Bergs, A., Schultheis, C., Fischer, E., Tsunoda,
146. Volkov, O., Kovalev, K., Polovinkin, V., Bor-
S. P., Erbguth, K., Husson, S. J., Govorunova,
shchevskiy, V., Bamann, C., Astashkin, R., Marin, E.,
E. G., Spudich, J. L., Nagel, G., Gottschalk, A., and
Popov, A., Balandin, T., Willbold, D., Buldt, G.,
Liewald, J. F. (2018) Rhodopsin optogenetic toolbox
Bamberg, E., and Gordeliy, V. (2017) Structural in-
v2.0 for light-sensitive excitation and inhibition in
sights into ion conduction by channelrhodopsin 2,
Caenorhabditis elegans, PLoS One,
13, e0191802,
Science, 358, eaan8862, doi: 10.1126/science.aan8862.
doi: 10.1371/journal.pone.0191802.
147. Oda, K., Vierock, J., Oishi, S., Rodriguez-Rozada, S.,
156. Wilson, D. E., Scholl, B., and Fitzpatrick, D. (2018)
Taniguchi, R., Yamashita, K., Wiegert, J. S.,
Differential tuning of excitation and inhibition shapes
Nishizawa, T., Hegemann, P., and Nureki, O.
direction selectivity in ferret visual cortex, Nature,
(2018) Crystal structure of the red light-activated
560, 97-101, doi: 10.1038/s41586-018-0354-1.
channelrhodopsin Chrimson, Nat. Commun., 9, 3949,
157. Forli, A., Vecchia, D., Binini, N., Succol, F.,
doi: 10.1038/s41467-018-06421-9.
Bovetti, S., Moretti, C., Nespoli, F., Mahn, M.,
148. Marshel, J. H., Kim, Y. S., Machado, T. A., Quirin, S.,
Baker, C. A., Bolton, M. M., Yizhar, O., and Fellin, T.
Benson, B., Kadmon, J., Raja, C., Chibukhchyan, A.,
(2018) Two-photon bidirectional control and imaging
Ramakrishnan, C., Inoue, M., Shane, J. C., McKnight,
of neuronal excitability with high spatial resolution
D. J., Yoshizawa, S., Kato, H. E., Ganguli, S.,
in vivo, Cell Rep.,
22,
3087-3098, doi:
10.1016/
and Deisseroth, K.
(2019) Cortical layer-specific
j.celrep.2018.02.063.
critical dynamics triggering perception, Science, 365,
158. Andrei, A. R., Debes, S., Chelaru, M., Liu, X.,
eaaw5202, doi: 10.1126/science.aaw5202.
Rodarte, E., Spudich, J. L., Janz, R., and Dragoi, V.
149. Chen, R., Gore, F., Nguyen, Q. A., Ramakrishnan, C.,
(2021) Heterogeneous side-effects of cortical in-
Patel, S., Kim, S. H., Raffiee, M., Kim, Y. S.,
activation in behaving animals, Elife, 10, e66400,
Hsueh, B., Krook-Magnusson, E., Soltesz, I., and
doi: 10.7554/eLife.66400.
Deisseroth, K. (2020) Deep brain optogenetics without
159. Huang, S., Ding, M., Roelfsema, M. R. G., Dreyer, I.,
intracranial surgery, Nat. Biotechnol., 39, 161-164,
Scherzer, S., Al-Rasheid, K. A. S., Gao, S., Nagel, G.,
doi: 10.1038/s41587-020-0679-9.
Hedrich, R., and Konrad, K. R. (2021) Optogenetic
150. Govorunova, E. G., Sineshchekov, O. A., Rodarte,
control of the guard cell membrane potential and
E. M., Janz, R., Morelle, O., Melkonian, M., Wong,
stomatal movement by the light-gated anion channel
G. K.-S., and Spudich, J. L. (2017) The expanding
GtACR1, Sci Adv, 7, eabg4619, doi: 10.1126/sciadv.
family of natural anion channelrhodopsins reveals
abg4619.
large variations in kinetics, conductance, and spectral
160. Zhou, Y., Ding, M., Gao, S., Yu-Strzelczyk, J.,
sensitivity, Sci. Rep., 7, 43358, doi: 10.1038/srep43358.
Krischke, M., Duan, X., Leide, J., Riederer, M.,
БИОХИМИЯ том 88 вып. 10 2023
КАНАЛЬНЫЕ РОДОПСИНЫ
1897
Mueller, M. J., Hedrich, R., Konrad, K. R., and
and Yizhar, O. (2018) High-efficiency optogenetic si-
Nagel, G. (2021) Optogenetic control of plant growth
lencing with soma-targeted anion-conducting chan-
by a microbial rhodopsin, Nat. Plants, 7, 144-151,
nelrhodopsins, Nat. Commun., 9, 4125, doi: 10.1038/
doi: 10.1038/s41477-021-00853-w.
s41467-018-06511-8.
161. Oppermann, J., Fischer, P., Silapetere, A., Liepe, B.,
166. Mardinly, A. R., Oldenburg, I. A., Pegard, N. C.,
Rodriguez-Rozada, S., Flores-Uribe, J., Peter, E.,
Sridharan, S., Lyall, E. H., Chesnov, K., Brohawn,
Keidel, A., Vierock, J., Kaufmann, J., Broser, M.,
S. G., Waller, L., and Adesnik, H. (2018) Precise
Luck, M., Bartl, F., Hildebrandt, P., Simon Wieg-
multimodal optical control of neural ensemble activity,
ert, J., Beja, O., Hegemann, P., and Wietek, J. (2019)
Nat. Neurosci., 21, 881-893, doi: 10.1038/s41593-
MerMAIDs: a family of metagenomically discov-
018-0139-8.
ered marine anion-conducting and intensely desen-
167. Vierock, J., Peter, E., Grimm, C., Rozenberg, A.,
sitizing channelrhodopsins, Nat. Commun., 10, 3315,
Chen, I. W., Tillert, L., Castro Scalise, A. G.,
doi: 10.1038/s41467-019-11322-6.
Casini, M., Augustin, S., Tanese, D., Forget, B. C.,
162. Malyshev, A. Y., Roshchin, M. V., Smirnova, G. R.,
Peyronnet, R., Schneider-Warme, F., Emiliani, V.,
Dolgikh, D. A., Balaban, P. M., and Ostrovsky, M. A.
Béjà, O., and Hegemann, P. (2022) WiChR, a high-
(2017) Chloride conducting light activated channel
ly potassium selective channelrhodopsin for low-
GtACR2 can produce both cessation of firing and
light one- and two-photon inhibition of excitable
generation of action potentials in cortical neurons
cells, Sci. Adv., 8, eadd7729, doi: 10.1126/sciadv.
in response to light, Neurosci. Lett., 640, 76-80,
add7729.
doi: 10.1016/j.neulet.2017.01.026.
168. Govorunova, E. G., Sineshchekov, O. A., Brown,
163. Messier, J. E., Chen, H., Cai, Z. L., and Xue, M.
L. S., Bondar, A. N., and Spudich, J. L.
(2022)
(2018) Targeting light-gated chloride channels to
Structural foundations of potassium selectivity in
neuronal somatodendritic domain reduces their
channelrhodopsins, mBio, 13, e0303922, doi: 10.1128/
excitatory effect in the axon, Elife,
7, e38506,
mbio.03039-22.
doi: 10.7554/eLife.38506.
169. Fan, L. Z., Kim, D. K., Jennings, J. H., Tian, H.,
164. Mahn, M., Prigge, M., Ron, S., Levy, R., and
Wang, P. Y., Ramakrishnan, C., Randles, S., Sun, Y.,
Yizhar, O. (2016) Biophysical constraints of optoge-
Thadhani, E., Kim, Y. S., Quirin, S., Giocomo, L.,
netic inhibition at presynaptic terminals, Nat. Neuro-
Cohen, A. E., and Deisseroth, K. (2023) All-optical
sci., 19, 554-556, doi: 10.1038/nn.4266.
physiology resolves a synaptic basis for behavioral
165. Mahn, M., Gibor, L., Patil, P., Cohen-Kashi
timescale plasticity, Cell, 186, 543-559, doi: 10.1016/
Malina, K., Oring, S., Printz, Y., Levy, R., Lampl, I.,
j.cell.2022.12.035.
CHANNELRHODOPSINS: FROM PHOTOTAXIS TO OPTOGENETICS
Review
E. G. Govorunova and O. A. Sineshchekov*
e-mail: egovoru@yahoo.com; oleg_sinesh@yahoo.com
Channelrhodopsins stand out among other retinal proteins because of their capacity to generate passive
ionic currents following photoactivation. Owing to that, channelrhodopsins are widely used in neuroscience
and cardiology as instruments for optogenetic manipulation of the activity of excitable cells. Photocurrents
generated by channelrhodopsins were first discovered in the cells of green algae in the 1970s. In this review
we describe this discovery and discuss the current state of research in this field.
Keywords: rhodopsins, ion channels, photoreception, membrane potential, flagellate algae, neurons
БИОХИМИЯ том 88 вып. 10 2023