БИОХИМИЯ, 2023, том 88, вып. 10, с. 1898 - 1907
УДК 577.12
РЕТИНАЛЬ-СОДЕРЖАЩАЯ АНИОННАЯ ПОМПА
ИЗ ЦИАНОБАКТЕРИИ Tolypothrix campylonemoides
© 2023 Т.И. Рокицкая1*, А.А. Алексеев2, Ф.М. Цыбров2, С.М. Бухалович2,
Ю.Н. Антоненко1*, В.И. Горделий3*
1 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: rokitskaya@belozersky.msu.ru; antonen@belozersky.msu.ru
2 Московский физико-технический институт, 141701 Долгопрудный, Московская обл., Россия
3 Institut de Biologie Structurale (IBS), Université Grenoble Alpes, CEA, CNRS,
Grenoble, France; электронная почта: valentin.gordeliy@gmail.com
Поступила в редакцию 30.06.2023
После доработки 15.09.2023
Принята к публикации 15.09.2023
В данной работе получена функциональная характеристика родопсина TcaR из цианобактерии
Tolypothrix campylonemoides. Анализ аминокислотной последовательности TcaR выявил, что этот
белок обладает мотивом TSD, который отличается лишь одной аминокислотой от мотива извест-
ной хлорной помпы галородопсина TSA. Белок TcaR был экспрессирован в Escherichia coli, очищен
и реконструирован в протеолипосомы и нанодиски. Функциональная активность измерялась по
генерации электрического тока через плоские бислойные липидные мембраны с адсорбированны-
ми на одной поверхности мембраны протеолипосомами, а также по флуоресценции с использова-
нием потенциал-зависимого красителя оксонола VI. Мы показали, что родопсин TcaR функциони-
рует как мощная анионная помпа. Наши результаты показывают, что новый микробный анионный
транспортер TcaR заслуживает более глубокого изучения и может быть интересен как для фунда-
ментальных исследований мембранных белков, так и в качестве инструмента для оптогенетики.
КЛЮЧЕВЫЕ СЛОВА: микробный родопсин, светочувствительная ионная помпа, оптогенетика, протео-
липосомы, бислойная липидная мембрана.
DOI: 10.31857/S0320972523100123, EDN: OTRGBH
ВВЕДЕНИЕ
даже превосходит вклад хлорофильного фото-
синтеза [2]. Однако известны и другие функции
Микробные родопсины составляют боль-
данного семейства белков, а именно: сенсор-
шое семейство светочувствительных α-спи-
ная функция, способность формировать свето-
ральных белков, несущих ковалентно-присо-
индуцированные ионные каналы в мембра-
единенный ретиналь в качестве кофактора.
не [3] и даже регуляция ферментативной ак-
Такие белки встречаются в микроскопиче-
тивности [4]. Структурно-функциональные ис-
ских организмах всех доменов жизни, включая
следования новых микробных родопсинов
вирусы [1]. Одной из главных функций этих
очень важны для получения новых оптогене-
белков является способность осуществлять
тических инструментов [5]. Для поиска новых
свето-индуцированный транспорт протонов,
родопсинов часто применяют метагеномный
катионов или анионов. Ретиналь-содержащие
анализ, и при выборе новых объектов исследо-
белки участвуют в запасании энергии океани-
вания особое внимание обращают на необыч-
ческих микроорганизмов, причем, по грубым
ный мотив консервативных аминокислотных
оценкам, вклад родопсинового фотосинтеза
остатков. Наиболее изученная светочувстви-
в общую энергетику биосферы сравним или тельная протонная помпа, бактериородопсин
Halobacterium salinarum, обладает мотивом DTD
(D85, T89 и D96 - аминокислотные остатки,
Принятые сокращения: БЛМ - плоская бислойная
липидная мембрана, ПЛ - протеолипосомы, ХКФ - кар-
ключевые для переноса протона) [6].
бонилцианид-m-хлорофенилгидразона.
Ген, кодирующий опсин TcaR, был об-
* Адресат для корреспонденции.
наружен нами в ходе биоинформатического
1898
РЕТИНАЛЬ-СОДЕРЖАЩАЯ АНИОННАЯ ПОМПА
1899
поиска по открытым базам метагеномных
и XhoI. Таким образом, ген был поставлен
данных [7]. Он содержится в геноме цианобак-
непосредственно перед последовательностью
терии Tolypothrix campylonemoides VB511288, вы-
LEHHHHHH (полигистидиновая последова-
деленной из зеленой биопленки, которая была
тельность, использовавшаяся впоследствии
обнаружена на фасаде здания в городе Санти-
для никель-хелатной хроматографии). Экс-
никетан на востоке Индии. Анализ амино-
прессию в клетках E. coli штамма C41(DE3) и
кислотной последовательности TcaR выявил
очистку белка TcaR проводили по протоколу,
наличие мотива TSD. Родопсины из циано-
описанному ранее [17].
бактерий с таким мотивом были охарактери-
Для приготовления протеолипосом в стек-
зованы ранее [8-10], они обладают способ-
лянную колбу добавляли 1% (w/v) раствор
ностью закачивать анионы в клетки бактерий
азолектина из соевых бобов в хлороформе
в ответ на освещение. Мотив TSD отличается
(«Sigma», США). От хлороформа избавлялись с
лишь одной аминокислотой от мотива извест-
помощью роторного испарителя и вакуумного
ной хлорной помпы галородопсина - TSA [11].
насоса. Полученную тонкую липидную пленку,
В данной работе мы представляем дан-
образовавшуюся на стенках колбы, ресуспен-
ные функциональных исследований родопси-
дировали в растворе, содержащем 0,1 M NaCl
на TcaR электрофизиологическими [12, 13] и
(«Applichem», ФРГ), 2% (w/v) холата натрия с
оптическими методами, включая эксперимен-
конечной концентрацией азолектина 1% (w/v).
ты по определению его ионной селективности
Суспензию липидов обрабатывали ультразву-
в липидных везикулах и нанодисках. Исполь-
ком в течение 5 мин при 4 °C, после чего бы-
зованный нами электрофизиологический под-
стро добавляли солюбилизированный родоп-
ход был разработан в работах Л.А. Драчева и
син до конечной концентрации 0,7 мг/мл и
А.Д. Каулена и далее стал широко применять-
детергент-абсорбирующие частицы Bio-Beads
ся в исследованиях по изучению родопсинов в
SM-2 («Bio-Rad», США). Получившуюся смесь
варианте, предложенном Bamberg et al. [14-16].
перемешивали на орбитальной мешалке 2 ч
В основе метода лежит измерение электриче-
при минимальном освещении, а затем сменя-
ских фотоответов от макроскопической пло-
ли частицы (так проводилось минимум 4 сме-
ской бислойной липидной мембраны (БЛМ),
ны частиц).
на которой были адсорбированы протеолипо-
Нанодиски с TcaR. Сборку нанодисков и
сомы с ретиналь-содержащим белком. Такой
встраивание TcaR осуществляли по стандарт-
способ измерения получил широкое примене-
ным методикам, описанным ранее в лите-
ние благодаря тому, что он обладает высокой
ратуре
[18]. Димиристоилфосфатидилхолин
чувствительностью и, наряду с оптическими
(DMPC) («Avanti Polar Lipids», США) исполь-
методами, позволяет измерять быстрые пере-
зовался в качестве липида. Мы использовали
ходные процессы.
удлиненный вариант белка apolipoprotein-1
под названием MSP1E3D1. Молярное соот-
ношение DMPC/MSP1E3D1/TcaR = 100/2/3.
МАТЕРИАЛЫ И МЕТОДЫ
Сухую липидную пленку, полученную путём
растворения порошка DMPC в хлороформе с
Материалы. В работе использовали ре-
последующим упариванием на роторном ис-
агенты фирмы «Sigma-Aldrich», США (если не
парителе («Heidolph», ФРГ), регидратирова-
указано особо).
ли раствором детергента 100 мМ CHAPS так,
Протеолипосомы с родопсином TcaR. По-
чтобы соотношение липид/детергент состави-
следовательность нуклеотидов, кодирующая
ло 1 : 2. Далее, к раствору солюбилизирован-
TcaR (GenBank accession no. JXC B00 000 000),
ного в мицеллах целевого белка TcaR добавля-
была оптимизирована для экспрессии в клет-
ли формирующий нанодиск белок MSP1E3D1.
ках Escherichia coli с использованием GeneArt
Полученную смесь инкубировали в течение
(«ThermoFischer», США). Нуклеотидная по-
часа при комнатной температуре, после чего
следовательность на 5′-конце была оптимизи-
добавляли сорбент BioBeads™ («Bio-Rad») для
рована с помощью RNA WebServer (Институт
удаления детергентов в расчёте 1 г сорбента на
теоретической химии, Венский Университет) с
40 мг детергента. Удаление детергента прово-
целью уменьшения вероятности образования
дили в течение 3 ч.
шпилек РНК в области, включающей сайты
Плоская бислойная липидная мембрана фор-
связывания рибосомы. Ген был коммерчески
мировалась из раствора в декане, который
синтезирован («Eurofins», Люксембург) и кло-
содержал
2% дифитаноилфосфатидилхолина
нирован в экспрессионный вектор pET15b
и 0,04% (w/v) димиристоилэтилфосфатидил-
(«Novagen», США) по сайтам рестрикции XbaI
холина («Avanti Polar Lipids»), на отверстии
БИОХИМИЯ том 88 вып. 10 2023
1900
РОКИЦКАЯ и др.
в перегородке, разделяющей на два отсека те-
липосом, которые далее освещали зеленым
флоновую ячейку, содержащую буферный рас-
лазерным модулем, имеющим мощность 1 мВт.
твор [19]. Диаметр отверстия составлял 0,8 мм.
Для измерения генерации градиента рН на ли-
Состав буферного раствора варьировался и
посомах использовалась флуоресценция рН-
указан в подписях к рисункам. Все экспери-
зависимого красителя 9-аминоакридина (воз-
менты проводили при комнатной температу-
буждение - 425 нм, регистрация - 455 нм).
ре (23-25 °С).
Измерение спектров поглощения TcaR
Электрический ток регистрировался в усло-
проводили с помощью спектрофотометра
виях фиксации потенциала. Разность потен-
Specord 50 («Analytik», Германия).
циалов подавалась на хлорсеребряные элек-
троды, помещенные через агаровые мосты в
тефлоновую ячейку с двух сторон мембраны.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ток измерялся с помощью пэтч-клэмп уси-
лителя ОЕС-2 («ОПУС», Россия), оцифровы-
Помповая активность ретиналь-содержа-
вался с помощью NI-DAQmx («National Instru-
щих белков, по литературным данным, реги-
ments», США) и анализировался с использо-
стрируется обычно простым способом по
ванием компьютерной программы WinWCP
изменению рН в суспензии липосом рН-элек-
Strathclyde Electrophysiology Software, написан-
тродом, однако такой способ обладает низкой
ной Дж. Демпстером (Университет Стратклай-
чувствительностью и требует больших коли-
да, Великобритания).
честв белка. Существенно большей чувстви-
Для освещения БЛМ использовали галоге-
тельностью обладает более сложный метод, в
новую лампу Novaflex («World Precision Instru-
котором протеолипосомы налипают на поверх-
ments», США), плотность мощности которой
ность плоской бислойной липидной мембра-
составляет 0,77 Вт/см2. Лампа освещала ячей-
ны, но не сливаются с ней и остаются интакт-
ку с передней (cis) стороны, протеолипосомы
ными на поверхности БЛМ. Было показано,
добавляли к БЛМ с cis-стороны.
что в такой системе освещение приводит к ге-
Протеолипосомы (ПЛ) со встроенным ре-
нерации переходных электрических потенциа-
тиналь-содержащим белком TcaR добавлялись
лов [12, 13] и переходных токов через БЛМ [14-
с cis-стороны ячейки, более близкой к освети-
16], которые можно регистрировать обычными
телю. Высокоомный электрод находился в про-
макроскопическими электродами. Добавление
тивоположном отсеке ячейки с trans-стороны.
протонофоров в такой системе обычно при-
После добавления к БЛМ 25-50 мкл TcaR-
водит к появлению стационарных фототоков
протеолипосом и инкубации в течение 60 мин
через БЛМ, поскольку увеличивается электри-
в буферном растворе, содержащем 10 мМ Mes
ческая доступность внутренней водной фазы
и
10 мМ Tris (рН ≈ 7), липидную мембрану
протеолипосом [16, 20].
освещали светом видимого диапазона. БЛМ
После начала освещения регистрирова-
формировали из смеси липидов дифитаноил-
лось небольшое быстрое изменение тока БЛМ
фосфатидилхолина и катионного липида ди-
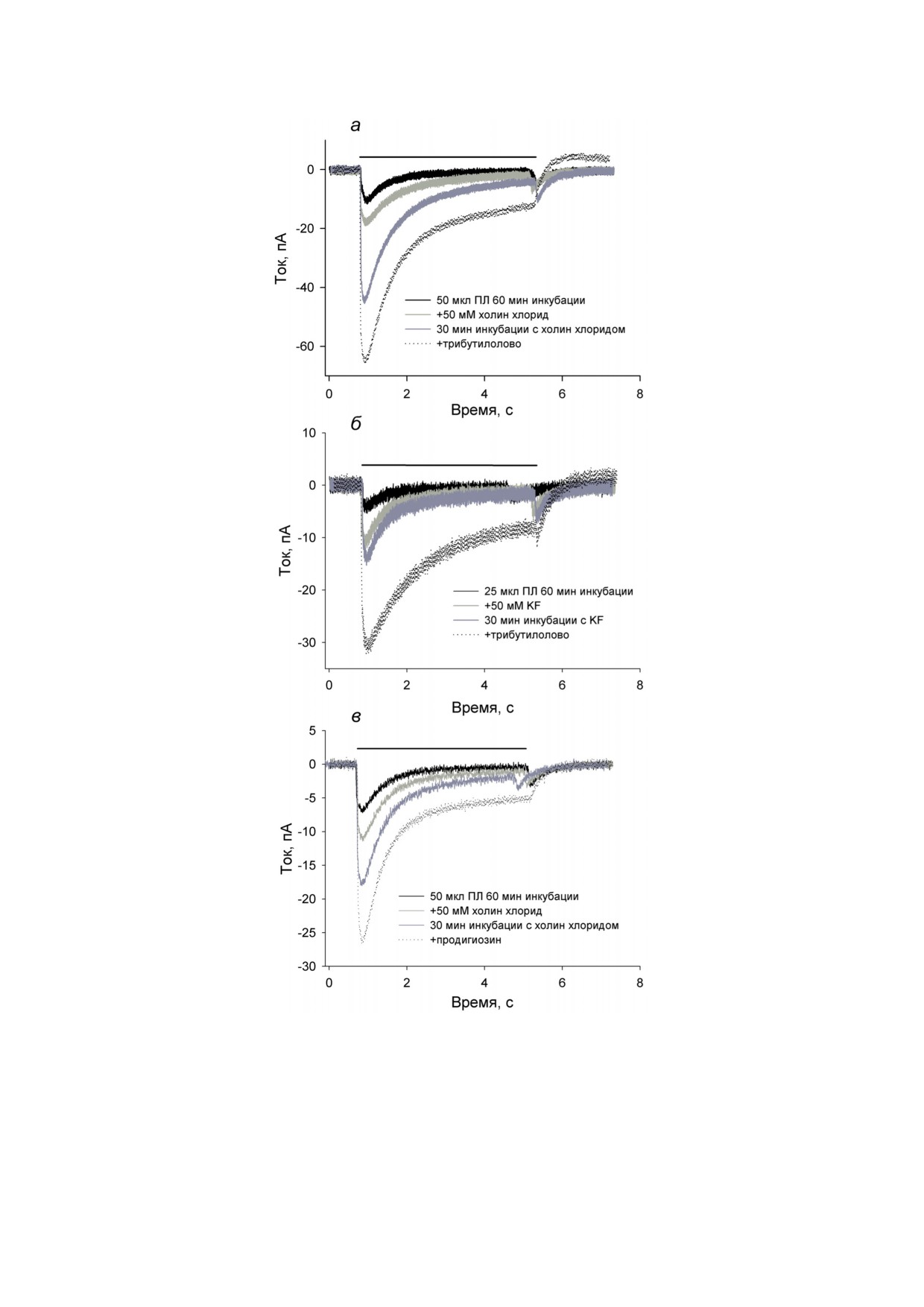
к отрицательным значениям (черная кривая
миристоилэтилфосфохолина, которая хорошо
на рис. 1, а и б), после которого значение тока
зарекомендовала себя как благоприятствую-
в секундной шкале возвращалось к первона-
щая адсорбции отрицательно-заряженных ли-
чальным величинам. Дальнейшее добавление
посом.
солей холин хлорида (рис. 1, а) или фторида
Для выявления достоверности различий
калия (KF) (рис. 1, б) приводило к момен-
использовали t-критерий Стьюдента.
тальному увеличению переходного тока на
Измерение генерации потенциала в суспен-
включение света (светло-серые кривые), а
зии протеолипосом, содержащих TcaR, про-
также к продолжающемуся со временем росту
водили с помощью измерения флуоресцен-
(темно-серые кривые, запись через 30 мин).
ции потенциал-зависимого красителя оксо-
Знак наблюдаемого переходного тока для ПЛ
нола VI (конечная концентрация 2 мкМ) в вод-
с TcaR соответствует таковому для ПЛ с бак-
ном буфере, содержащем 100 мМ NaH2PO4 и
териородопсином и указывает на несколько
1 M NaCl (pH 7,2), как это описано ранее [19].
возможных путей функционирования белка:
Измерения проводились на спектрофлуори-
помпирование протонов или одновалентных
метре Панорама Флюорат-02 («Люмэкс», Рос-
катионов внутрь липосом, помпирование од-
сия) при возбуждении на 590 нм и испускании
новалентных анионов наружу липосом или
на 620 нм (щели были 5 нм) при температуре
другие варианты. Последующее добавление с
15 °C. После установления заданной темпера-
двух сторон мембраны трибутилолова, кото-
туры в кювету добавляли 10-20 мкл протео-
рый является переносчиком моновалентных
БИОХИМИЯ том 88 вып. 10 2023
РЕТИНАЛЬ-СОДЕРЖАЩАЯ АНИОННАЯ ПОМПА
1901
Рис. 1. Измерение электрического тока через БЛМ с адсорбированными протеолипосомами с TcaR при потенциале
на БЛМ 0 мВ. Период освещения мембраны белым светом показан сплошной черной линией. а - Записи тока БЛМ
при инкубации с липосомами (50 мкл) в течение 60 мин (черная кривая). Светло-серая кривая - запись тока сразу
после добавления 50 мМ холин хлорида. Темно-серая кривая - после 30 мин инкубации с холин хлоридом. Пунктир-
ная кривая - после добавления 1 мкг/мл трибутилолова. б - Записи тока БЛМ при инкубации с липосомами (25 мкл)
в течение 60 мин (черная кривая). Светло-серая кривая - запись тока сразу после добавления 50 мМ KF. Темно-
серая кривая - после 30 мин инкубации с KF. Пунктирная кривая - после добавления 1 мкг/мл трибутилолова.
в - Записи тока БЛМ при инкубации с липосомами (25 мкл) в течение 60 мин (черная кривая). Светло-серая кривая -
запись тока сразу после добавления 50 мМ холин хлорида. Темно-серая кривая - после 30 мин инкубации с холин
хлоридом. Пунктирная кривая - после добавления 150 нМ продигиозина. Буферный раствор содержал 10 мМ Mes
и 10 мМ Tris (pH 7,0)
БИОХИМИЯ том 88 вып. 10 2023
1902
РОКИЦКАЯ и др.
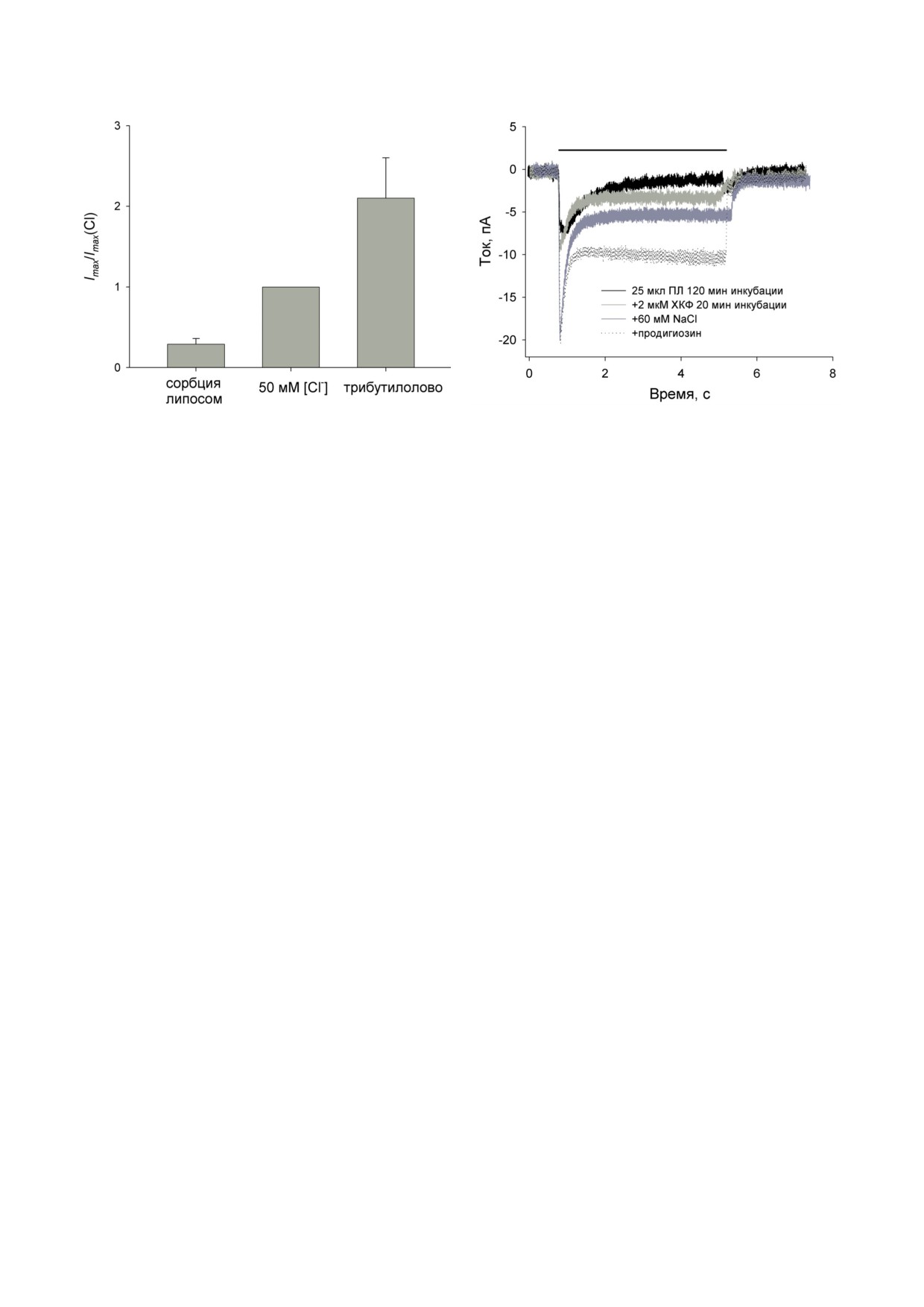
Рис. 2. Суммированные результаты четырех экспери-
Рис. 3. Измерение электрического тока через БЛМ с
ментов с TcaR-протеолипосомами по влиянию добав-
адсорбированными протеолипосомами с TcaR в среде с
ления 50 мМ ионов хлора и последующего добавления
100 мМ Na2SO4. Период освещения мембраны белым све-
1 мкг/мл трибутилолова на амплитуду начального фото-
том показан сплошной черной линией. Записи тока БЛМ
ответа БЛМ. За единицу принят начальный фототок
при инкубации с липосомами (25 мкл) в течение 120 мин
в условиях 50 мМ солей хлорид-аниона
(черная кривая). Светло-серая кривая - запись тока по-
сле добавления 2 мкМ ХКФ. Темно-серая кривая - после
добавления 60 мМ NaCl. Пунктирная кривая - после
добавления 150 нМ продигиозина. Буферный раствор со-
анионов [21, 22], приводило к значительному
держал 10 мМ Mes, 10 мМ Tris и 100 мМ Na2SO4 (pH 7,0)
увеличению не только начального, но и ста-
ционарного тока в ответ на освещение (пунк-
тирные кривые). При добавлении вместо трибу-
щее добавление 60 мМ хлорида натрия (темно-
тилолова в аналогичном эксперименте другого
серая кривая) приводило к значительному уве-
известного переносчика анионов, продигио-
личению начального тока в ответ на включе-
зина [23], также происходило увеличение на-
ние освещения. Продигиозин, добавленный
чального переходного и стационарного фото-
в конце эксперимента, значительно увеличил
токов БЛМ (рис. 1, в). На рис. 2 представлены
стационарный фототок БЛМ (рис. 3, пунктир-
результаты экспериментов с адсорбированны-
ная кривая).
ми ПЛ по влиянию добавления 50 мМ ионов
Во всех экспериментах с адсорбцией про-
хлора и последующего добавления 1 мкг/мл
теолипосом на БЛМ добавление хлорида
трибутилолова на амплитуду начального фо-
калия, хлорида натрия, хлорида холина или
тоответа БЛМ (4 эксперимента). За единицу
фторида калия, а также переносчиков моно-
принят начальный фототок в условиях 50 мМ
валентных анионов (трибутилолова и продигио-
солей хлорид-аниона. Видно, что соли хло-
зина) приводило к большому росту переходного
рида вызывают увеличение начального тока
фототока. Однако небольшие переходные фото-
(p < 0,0003), последующее добавление анион-
токи наблюдались после налипания липосом
ных переносчиков приводит к росту тока
на плоскую липидную мембрану и при отсут-
(p < 0,006).
ствии моновалентных анионов. Возможно, это
При проведении эксперимента в среде с
связано с наличием ионов хлора в липосомах
сульфат-анионом в качестве основного анио-
или его вытеканием из агарных мостов к элек-
на в электролите (состав среды: 10 мМ Mes,
тродам. Мы приготовили мембранные нано-
10 мМ Tris и 100 мМ Na2SO4 (рН 7,0)) длитель-
диски со встроенным белком TcaR и измерили
ная инкубация липосом с БЛМ также при-
фотоответы в их присутствии на БЛМ в раз-
водила к их адсорбции на поверхности пло-
ных средах. Нанодиски не имеют внутреннего
ской липидной мембраны, что проявлялось в
водного объема, поэтому эквивалентная элек-
появлении переходного тока при освещении
трическая схема в этом случае может отличать-
(рис. 3, черная кривая). Однако в этом случае
ся от опытов с липосомами. На рис. 4 пред-
величина амплитуды переходного тока была
ставлены результаты по измерению фототоков
меньше по сравнению с той, что наблюда-
БЛМ в буфере со 100 мМ NaCl (панель а),
лась в присутствии хлорид-аниона. Протоно-
100 мМ Na2SO4 (панель б) и 100 мМ глюконата
фор карбонилцианид-m-хлорофенилгидразон
калия (панель в) при добавлении 10 мкл нано-
(ХКФ) увеличивал стационарный ток при
дисков с cis-стороны БЛМ. Нанодиски быстро
освещении (светло-серая кривая), а последую-
адсорбировались на БЛМ, и уже через 20 мин
БИОХИМИЯ том 88 вып. 10 2023
РЕТИНАЛЬ-СОДЕРЖАЩАЯ АНИОННАЯ ПОМПА
1903
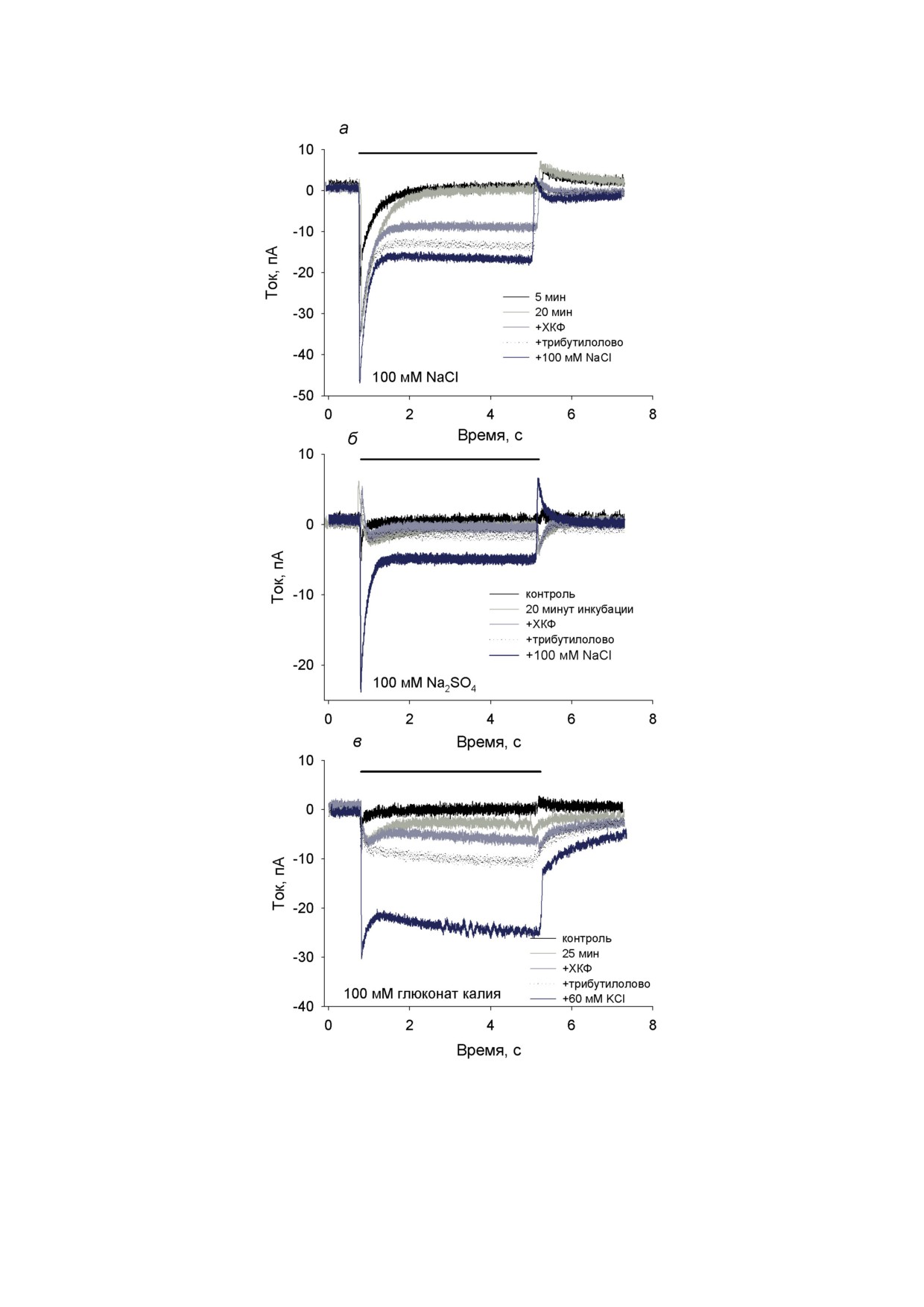
Рис. 4. Измерение электрического тока через БЛМ с адсорбированными нанодисками с TcaR при потенциале на БЛМ
0 мВ. Период освещения мембраны белым светом показан сплошной черной линией. а - Записи тока БЛМ при ин-
кубации с нанодисками (10 мкл) в течение 5 мин (черная кривая). Светло-серая кривая - после 20 мин инкубации с
нанодисками. Средне-серая кривая - после добавления 2 мкМ ХКФ. Пунктирная кривая - после добавления 1 мкг/мл
трибутилолова. Темно-серая кривая - после добавления NaCl (до концентрации 200 мМ). Буферный раствор содер-
жал 10 мМ Mes, 10 мМ Tris и 100 мМ NaCl (pH 7,0). б - Аналогичные записи тока в буферном растворе 10 мМ Mes,
10 мМ Tris, 100 мМ Na2SO4 (pH 7,0). в - Аналогичные записи тока в буферном растворе 10 мМ Mes, 10 мМ Tris, 100 мМ
глюконат калия (pH 7,0)
БИОХИМИЯ том 88 вып. 10 2023
1904
РОКИЦКАЯ и др.
ХКФ и анионного переносчика трибутилолова
стационарный фототок БЛМ значительно воз-
растал (средне-серые и пунктирные кривые
на рис. 5). В целом эти опыты говорят о спо-
собности ретиналь-содержащего белка TcaR
транспортировать анионы хлора через мем-
брану в ответ на освещение.
Данные, представленные на рис. 1, б, гово-
рят о способности этого белка транспортиро-
вать анионы фтора. Также мы не исключаем
переноса гидроксил-аниона. Ранее было по-
казано, что мембранные фрагменты с гало-
родопсином, имеющим близкую последова-
тельность важных аминокислот в белке TSA,
приводят к генерации фототока в присутствии
Cl-, Br- и I-, но не в присутствии SO2-, F-
и NO– [24]. Однако в зависимости от условий
освещения галородопсин может выступать как
светочувствительная хлорная помпа или про-
тонная помпа [25]. Согласно нашим резуль-
татам, перенос анионов под действием света
белком TcaR осуществляется изнутри липосом
наружу (эквивалентно переносу в цитоплазму
в клетках). Таким образом, направление ак-
тивного транспорта анионов белком TcaR и
галородопсином совпадает.
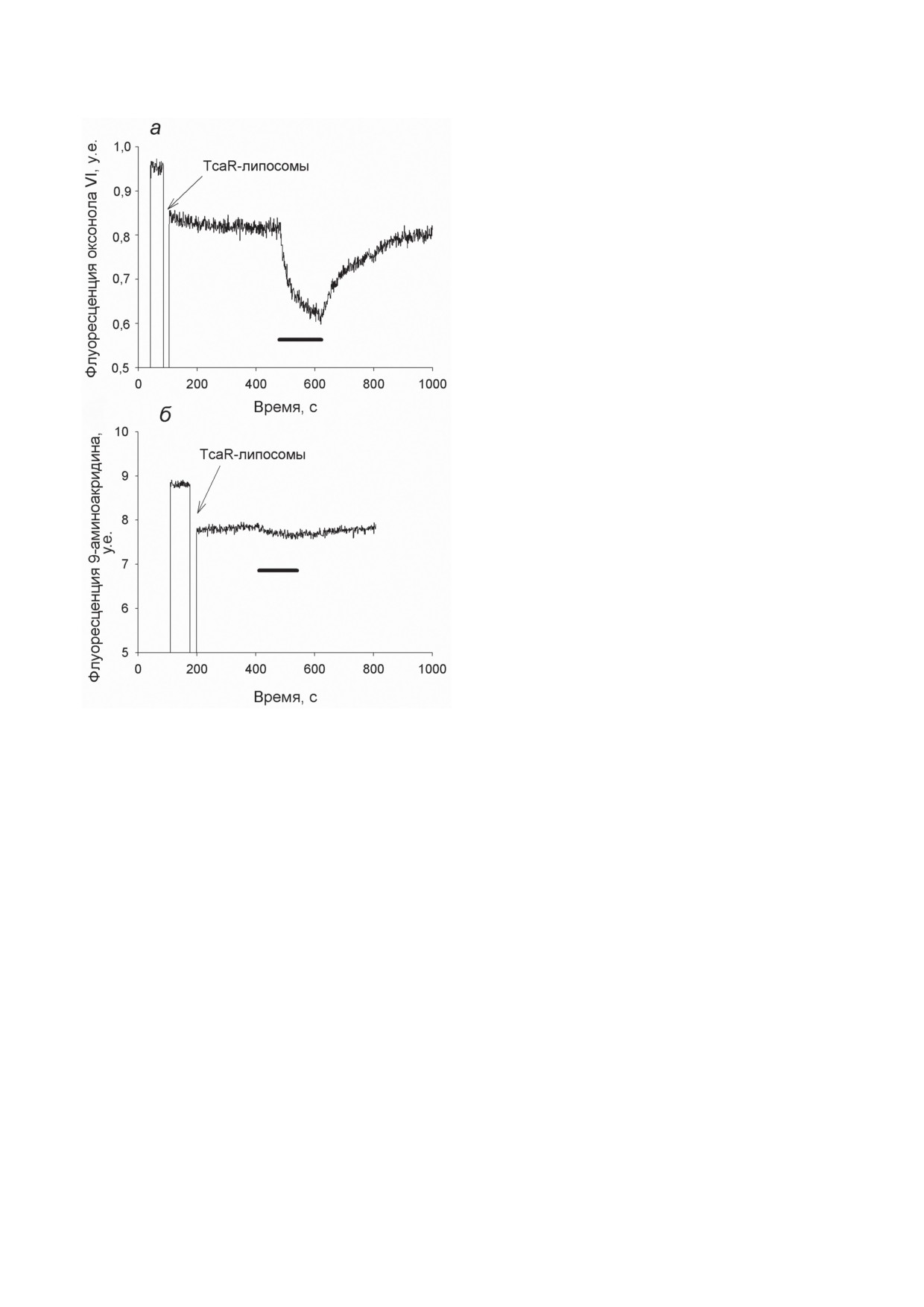
Ранее было показано, что для измерения
активности родопсиновых белков в суспензии
протеолипосом можно использовать флуорес-
центные методы в присутствии потенциал-
чувствительного красителя оксонола VI или
ΔрН-чувствительного красителя 9-аминоакри-
Рис. 5. Измерение ион-транспортирующих свойств TcaR
дина (9-АА) [19, 26]. На рис 5, а показан ти-
в суспензии протеолипосом по изменению флуоресцен-
ции 2 мкМ оксонола VI (а) и 4 мкМ 9-аминоакридина (б).
пичный ответ оксонола VI, добавленного к
10 мкл протеолипосом были суспендированы в 1 мл сре-
суспензии протеолипосом с TcaR. При осве-
ды, содержащей 1 М NaCl и 100 мМ NaH2PO4 (pH 7,2).
щении зеленым светом наблюдается значи-
Период освещения мембраны светом зеленого светодио-
тельное уменьшение сигнала флуоресценции,
да показан сплошной черной линией
что свидетельствует о генерации мембранного
потенциала на липосомах. Оксонол VI - это
наблюдались токи через БЛМ в ответ на вклю-
анионный краситель и падение его флуорес-
чение света. Хорошо видно, что значительные
ценции свидетельствует о генерации потен-
переходные токи были только в случае среды
циала со знаком плюс внутри липосом, что
с хлоридом натрия (рис. 4, а; светло-серая
соответствует той же полярности, что и в ана-
кривая). В присутствии сульфата натрия или
логичных экспериментах с бактериородопси-
глюконата калия фототоки были значительно
ном [26]. Следует сказать, что данный метод
меньше (светло-серые кривые на рис. 4, б и в).
по своей чувствительности существенно усту-
Более того, в случае 100 мМ Na2SO4 (рис. 4, б)
пает методу измерения фототока на БЛМ [19],
первоначальный быстрый ответ имел даже про-
и образование больших ответов в суспензии
тивоположный знак. Добавление хлорида на-
протеолипосом с TcaR (рис. 5, а) свидетель-
трия в конце каждой пробы приводило либо к
ствует о большой эффективности помпы TcaR.
появлению большого мгновенного изменения
Аналогичные опыты с использованием краси-
тока в ответ на включение света (рис. 4, б и в;
теля 9-АА показали, что генерация градиен-
темно-серые кривые), либо к дальнейшему
та рН в такой системе практически не проис-
увеличению начального тока (рис. 4, а). Этот
ходит (рис. 5, б).
результат дает основание утверждать, что ионы
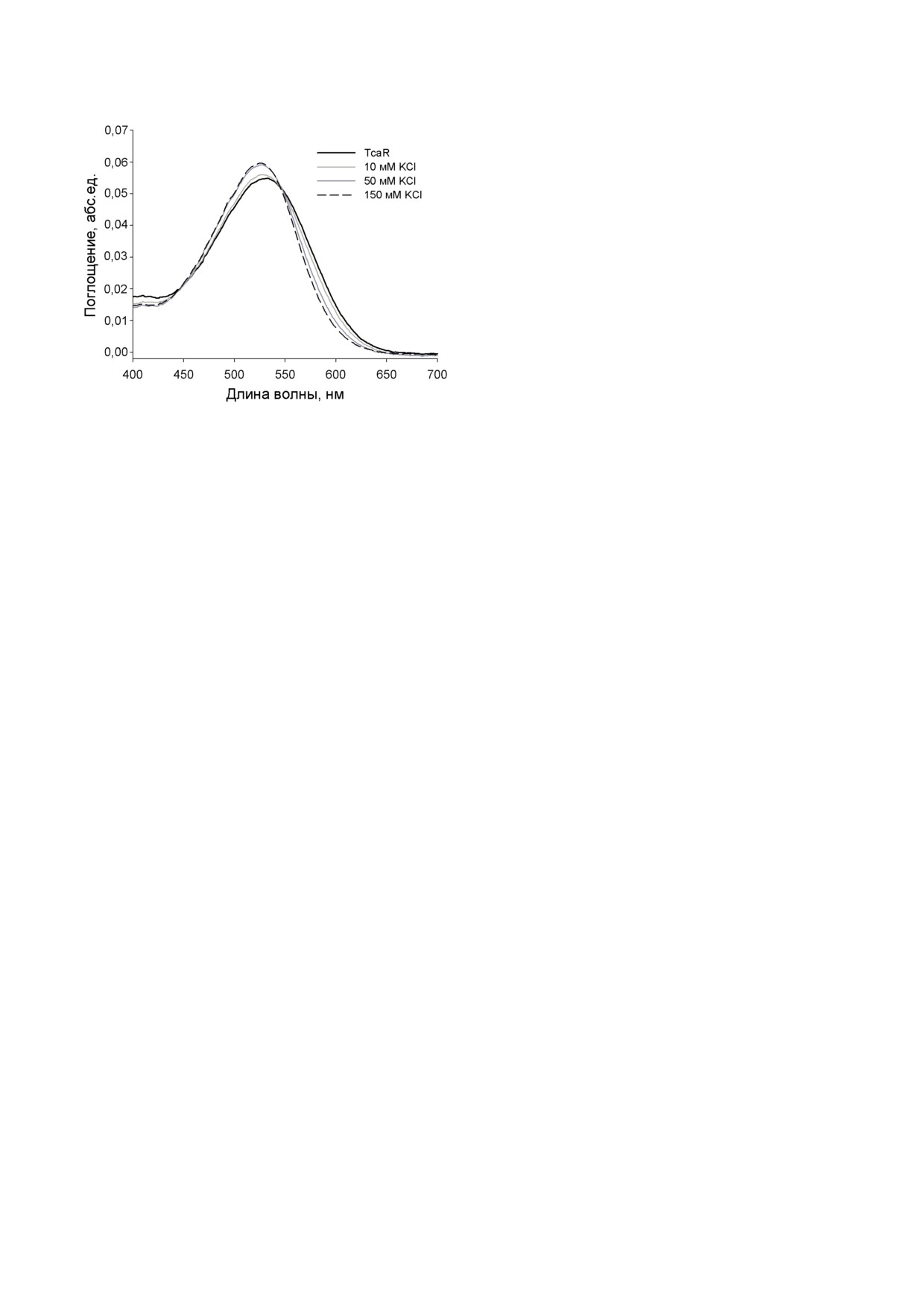
На рис. 6 приведена серия спектров погло-
натрия, калия, сульфата и глюконата не пере-
щения TcaR при отсутствии анионов хлора
носятся помпой. В присутствии протонофора
(черная кривая) и в присутствии нарастающих
БИОХИМИЯ том 88 вып. 10 2023
РЕТИНАЛЬ-СОДЕРЖАЩАЯ АНИОННАЯ ПОМПА
1905
положить, что физиологическая роль TcaR в
цианобактериях сходна. Поскольку галородоп-
син используется в оптогенетике, можно пред-
положить, что TcaR также может найти свою
нишу в палитре используемых оптогенетиче-
ских инструментов. Представляется, что белок
TcaR заслуживает более глубокого и всесторон-
него исследования, включая изучение особен-
ностей его фотоцикла, а также его структуры.
Вклад авторов. В.И. Горделий - концеп-
ция работы; А.А. Алексеев, Т.И. Рокицкая,
Ю.Н. Антоненко, С.М. Бухалович, Ф.М. Цыб-
ров - проведение экспериментов; Ю.Н. Анто-
ненко, В.И. Горделий, Т.И. Рокицкая - на-
Рис. 6. Спектры поглощения TcaR в нанодисках при раз-
писание первоначального текста статьи. Все
личных концентрациях хлорида калия. Среда измерения
авторы принимали участие в обсуждении
содержала 10 мМ Mes и 10 мМ Tris (рН 6,5). Концен-
результатов исследования и редактировании
трация хлорида калия составляла 0 мМ (черная линия),
окончательной версии статьи.
10 мМ (светло-серая линия), 50 мМ (темно-серая линия)
Финансирование. Работа выполнена при
и 150 мМ (пунктирная линия)
финансовой поддержке Российского научного
фонда (грант № 23-24-00038, электрофизиоло-
концентраций хлорид-аниона (серые и штри-
гические измерения), а также при поддержке
ховые линии). Положение максимума спектра
Министерства образования и науки РФ (зада-
поглощения белка TcaR в нанодисках состав-
ча «Исследование механизмов преобразования
ляет 531 нм, и при добавлении 50-150 мМ
энергии в мембранных системах, связанных
ионов хлора происходит сдвиг максимума
с циклическим переносом ионов водорода и
спектра поглощения в коротковолновую об-
натрия ферментами электрон-транспортных
ласть на 5 нм. Кроме того, происходит повы-
цепей, механизмов продукции активных форм
шение оптической плотности в максимуме по-
кислорода и их роли в физиологии клетки»,
глощения. Эти данные хорошо соответствуют
проект AAAA-A19-119031390114-5, спектро-
влиянию анионов хлора на спектры поглоще-
фотометрические измерения). Работы по экс-
ния галородопсинов, исследованных ранее [8,
прессии и очистке белка были выполнены при
9, 27], и подтверждают представление о том,
финансовой поддержке Российского научного
что TcaR является хлорной помпой.
фонда (грант № 21-64-00018).
Анализ аминокислотной последователь-
Конфликт интересов. Авторы заявляют об
ности TcaR и полученные нами результаты
отсутствии конфликта интересов.
позволяют предположить, что TcaR имеет
Соблюдение этических норм. Настоящая
функциональную схожесть c галородопсином.
статья не содержит каких-либо исследований
Галородопсин принимает участие в поддержа-
с участием людей или использованием живот-
нии солевого баланса бактерий, и можно пред-
ных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Gushchin, I., and Gordeliy, V. (2018) Microbial rho-
rhodopsins, Biochim. Biophys. Acta, 1837, 546-552,
dopsins, Subcell Biochem., 87, 19-56, doi: 10.1007/978-
doi: 10.1016/j.bbabio.2013.06.006.
981-10-7757-9_2.
4. Mukherjee, S., Hegemann, P., and Broser, M. (2019)
2. Gomez-Consarnau, L., Raven, J. A., Levine, N. M.,
Enzymerhodopsins: novel photoregulated catalysts for
Cutter, L. S., Wang, D., Seegers, B., Aristegui, J.,
optogenetics, Curr. Opin. Struct. Biol., 57, 118-126,
Fuhrman, J. A., Gasol, J. M., and Sanudo-Wilhelmy,
doi: 10.1016/j.sbi.2019.02.003.
S. A. (2019) Microbial rhodopsins are major contribu-
5. Кирпичников М. П., Островский М. А. (2019) Оп-
tors to the solar energy captured in the sea, Sci. Adv.,
тогенетика и зрение, Вестник Российской Академии
8, eaaw8855, doi: 10.1126/sciadv.aaw8855.
Наук, 89, 125-130, doi: 10.31857/S0869-5873892125-130.
3. Spudich, J. L., Sineshchekov, O. A., and Govorunova,
6. Luecke, H., Schobert, B., Richter, H. T., Cartailler,
E. G. (2014) Mechanism divergence in microbial
J. P., and Lanyi, J. K. (1999) Structure of bacterio-
13
БИОХИМИЯ том 88 вып. 10 2023
1
906
РОКИЦКАЯ и др.
rhodopsin at 1.55 A resolution, J. Mol. Biol., 291, 899-
Biol.,
321,
821-838, doi:
10.1016/s0022-2836
911, doi: 10.1006/jmbi.1999.3027.
(02)00696-4.
7.
Das, S., Singh, D., Madduluri, M., Chandrababunaidu,
17.
Shevchenko, V., Mager, T., Kovalev, K., Polovin-
M. M., Gupta, A., Adhikary, S. P., and Tripathy, S.
kin, V., Alekseev, A., Juettner, J., Chizhov, I.,
(2015) Draft genome sequence of bioactive-com-
Bamann, C., Vavourakis, C., Ghai, R., Gushchin, I.,
pound-producing cyanobacterium Tolypothrix cam-
Borshchevskiy, V., Rogachev, A., Melnikov, I.,
pylonemoides strain VB511288, Genome Announc.,
Popov, A., Balandin, T., Rodriguez-Valera, F.,
3, e00226-15, doi: 10.1128/genomeA.00226-15.
Manstein, D. J., Bueldt, G., Bamberg, E., and
8.
Hasemi, T., Kikukawa, T., Watanabe, Y., Aizawa, T.,
Gordeliy, V. (2017) Inward H+ pump xenorhodopsin:
Miyauchi, S., Kamo, N., and Demura, M. (2019)
mechanism and alternative optogenetic approach,
Photochemical study of a cyanobacterial chloride-ion
Sci. Adv., 3, e1603187, doi: 10.1126/sciadv.1603187.
pumping rhodopsin, Biochim. Biophys. Acta, 1860,
18.
Schuler, M. A., Denisov, I. G., and Sligar, S. G.
136-146, doi: 10.1016/j.bbabio.2018.12.001.
(2013) Nanodiscs as a new tool to examine lipid-
9.
Yun, J. H., Park, J. H., Jin, Z., Ohki, M., Wang, Y.,
protein interactions, Methods Mol. Biol., 974, 415-433,
Lupala, C. S., Liu, H., Park, S. Y., and Lee, W. (2020)
doi: 10.1007/978-1-62703-275-9_18.
Structure-based functional modification study of a
19.
Rokitskaya, T. I., Maliar, N. L., Siletsky, S. A.,
cyanobacterial chloride pump for transporting multiple
Gordeliy, V., and Antonenko, Y. N. (2022) Elec-
anions, J. Mol. Biol., 432, 5273-5286, doi: 10.3390/
trophysiological characterization of microbial rho-
ma13143061.
dopsin transport properties: electrometric and DpH
10.
Astashkin, R., Kovalev, K., Bukhdruker, S., Vaga-
measurements using planar lipid bilayer, collodi-
nova, S., Kuzmin, A., Alekseev, A., Balandin, T.,
on film, and fluorescent probe approaches, Meth-
Zabelskii, D., Gushchin, I., Royant, A., Volkov, D.,
ods Mol. Biol., 2501, 259-275, doi: 10.1007/978-1-
Bourenkov, G., Koonin, E., Engelhard, M., Bam-
0716-2329-9_12.
berg, E., and Gordeliy, V. (2022) Structural in-
20.
Rokitskaya, T. I., Maliar, N., Kovalev, K. V.,
sights into light-driven anion pumping in cyano-
Volkov, O., Gordeliy, V. I., and Antonenko, Y. N.
bacteria, Nat. Commun.,
13,
6460, doi:
10.1038/
(2021) Rhodopsin channel activity can be evalu-
s41467-022-34019-9.
ated by measuring the photocurrent voltage de-
11.
Oesterhelt, D., Tittor, J., and Bamberg, E. (1992)
pendence in planar bilayer lipid membranes, Bio-
A unifying concept for ion translocation by retinal
chemistry (Moscow),
86,
409-419, doi:
10.1134/
proteins, J. Bioenerg. Biomembr.,
24,
181-191,
S0006297921040039.
doi: 10.1007/BF00762676.
21.
Selwyn, M. J., Dawson, A. P., Stockdale, M., and
12.
Drachev, L. A., Jasaitis, A. A., Kaulen, A. D.,
Gains, N. (1970) Chloride-hydroxide exchange across
Kondrashin, A. A., Liberman, E. A., Nemecek, I. B.,
mitochondrial, erythrocyte and artificial lipid mem-
Ostroumov, S. A., Semenov, A. Yu., and Skulachev,
branes mediated by trialkyl-and triphenyltin com-
V. P. (1974) Direct measurement of electric cur-
pounds, Eur. J. Biochem., 14, 120-126, doi: 10.1111/
rent generation by cytochrome oxidase, H+-ATPase
j.1432-1033.1970.tb00268.x.
and bacteriorhodopsin, Nature,
249,
321-324,
22.
Antonenko, Y. N. (1990) Electrically silent anion
doi: 10.1038/249321a0.
transport through bilayer lipid membrane induced
13.
Drachev, L. A., Frolov, V. N., Kaulen, A. D., Liber-
by tributyltin and triethyllead, J. Membr. Biol., 113,
man, E. A., Ostroumov, S. A., Plakunova, V. G.,
109-113, doi: 10.1007/BF01872884.
Semenov, A. Y., and Skulachev, V. P. (1976) Recon-
23.
Sato, T., Konno, H., Tanaka, Y., Kataoka, T., Nagai, K.,
stitution of biological molecular generators of elec-
Wasserman, H. H., and Ohkuma, S. (1998) Prodigios-
tric current. Bacteriorhodopsin, J. Biol. Chem., 251,
ins as a new group of H+/Cl- symporters that uncouple
7059-7065.
proton translocators, J. Biol. Chem., 273, 21455-21462,
14.
Bamberg, E., Apell, H. J., Dencher, N. A., Sperling, W.,
doi: 10.1074/jbc.273.34.21455.
Stieve, H., and Lauger, P.
(1979) Photocurrents
24.
Bamberg, E., Hegemann, P., and Oesterhelt, D.
generated by bacteriorhodopsin on planar bilayer
(1984) Reconstitution of the light-driven electrogenic
membranes, Biophys. Struct. Mech.,
5,
277-292,
ion-pump halorhodopsin in black lipid membranes,
doi: 10.1007/BF02426663.
Biochim. Biophys. Acta, 773, 53-60, doi: 10.1016/
15.
Bamberg, E., Butt, H. J., Eisenrauch, A., and
0005-2736(84)90549-2.
Fendler, K. (1993) Charge transport of ion pumps on
25.
Bamberg, E., Tittor, J., and Oesterhelt, D. (1993)
lipid bilayer membranes, Q. Rev. Biophys., 26, 1-25,
Light-driven proton or chloride pumping by halo-
doi: 10.1017/s0033583500003942.
rhodopsin, Proc. Natl. Acad. Sci. USA, 90, 639-643,
16.
Friedrich, T., Geibel, S., Kalmbach, R., Chizhov, I.,
doi: 10.1073/pnas.90.2.639.
Ataka, K., Heberle, J., Engelhard, M., and Bam-
26.
Antonenko, Y. N., Denisov, S. S., Silachev, D. N.,
berg, E.
(2002) Proteorhodopsin is a light-driv-
Khailova, L. S., Jankauskas, S. S., Rokitskaya, T. I.,
en proton pump with variable vectoriality, J. Mol.
Danilina, T. I., Kotova, E. A., Korshunova, G. A.,
БИОХИМИЯ том 88 вып. 10 2023
РЕТИНАЛЬ-СОДЕРЖАЩАЯ АНИОННАЯ ПОМПА
1907
Plotnikov, E. Y., and Zorov, D. B. (2016) A long-linker
27. Steiner, M., Oesterhelt, D., Ariki, M., and Lanyi, J. K.
conjugate of fluorescein and triphenylphosphonium
(1984) Halide binding by the purified halorhodopsin
as mitochondria-targeted uncoupler and fluorescent
chromoprotein. I. Effects on the chromophore,
neuro- and nephroprotector, Biochim. Biophys. Acta,
J. Biol. Chem., 259, 2179-2184, doi: 10.1016/S0021-
1860, 2463-2473, doi: 10.1016/j.bbagen.2016.07.014.
9258(17)43334-5.
RETINAL-BASED ANION PUMP
FROM THE CYANOBACTERIUM Tolypothrix campylonemoides
T. I. Rokitskaya1*, A. A. Alekseev2, F. M. Tsybrov2, S. M. Bukhalovich2,
Y. N. Antonenko1*, and V. I. Gordeliy3*
1 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e-mail: rokitskaya@belozersky.msu.ru; antonen@belozersky.msu.ru
2 Moscow Institute of Physics and Technology, 141701 Dolgoprudny, Moscow Region, Russia
3 Institut de Biologie Structurale (IBS), Université Grenoble Alpes, CEA, CNRS,
Grenoble, France; e-mail: valentin.gordeliy@gmail.com
In this work, a functional characterization of TcaR rhodopsin from the cyanobacterium Tolypothrix cam-
pylonemoides was obtained. Analysis of the amino acid sequence of TcaR revealed that this protein pos-
sesses a TSD motif that differs by only one amino acid from the motif of the known halorodopsin chloride
pump TSA. The TcaR protein was expressed in E. coli, purified and incorporated into proteoliposomes
and nanodiscs. Functional activity was measured by electric current generation through the planar bilayer
lipid membranes (BLMs) with proteoliposomes adsorbed on one membrane surface, as well as by fluores-
cence using voltage-dependent dye oxonol VI. We have shown that TcaR rhodopsin functions as a powerful
anion pump. Our results show that the novel microbial anion transporter TcaR deserves deeper study and
may be of interest both for fundamental studies of membrane proteins and as a tool for optogenetics.
Keywords: microbial rhodopsin, photosensitive ion pump, optogenetics, proteoliposomes, bilayer lipid membrane
БИОХИМИЯ том 88 вып. 10 2023
13*