БИОХИМИЯ, 2023, том 88, вып. 10, с. 1940 - 1956
УДК 571.27
РОЛЬ И МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ
АЛЬТЕРНАТИВНОГО СПЛАЙСИНГА Th2-ЦИТОКИНОВ IL-4 И IL-5
В АЛЛЕРГИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЕ
Обзор
© 2023 И.П. Шиловский1*, В.И. Ковчина1, Е.Д. Тимотиевич1,
А.А. Никольский1, М.Р. Хаитов1,2
1 ФГБУ «ГНЦ Институт иммунологии» ФМБА России,
115522 Москва, Россия; электронная почта: ip.shilovsky@nrcii.ru
2 ФГАОУ ВО Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова Минздрава России, 117997 Москва, Россия
Поступила в редакцию 05.05.2023
После доработки 15.08.2023
Принята к публикации 15.08.2023
Бронхиальная астма (БА) - это хроническое воспалительное заболевание дыхательных путей,
включающее в себя несколько фенотипов, самым распространенным из которых (до 80% от всех
случаев) является аллергическая БА. Ключевыми участниками патогенеза этого заболевания явля-
ются Th2-цитокины (IL-4, IL-5, IL-9 и IL-13). Гены, кодирующие эти цитокины, как и подавляю-
щее большинство генов человека, состоят из нескольких экзонов, и, соответственно, из единого
мРНК-предшественника в результате альтернативного сплайсинга может образовываться несколь-
ко вариантов зрелых мРНК и изоформ белка, которые также могут участвовать в патогенезе БА.
Анализ научной литературы и баз данных показал наличие альтернативных мРНК-транскриптов
для IL-4, IL-5 и IL-13. При этом у IL-4 и IL-5 альтернативные транскрипты несут открытые рамки
считывания, а следовательно, могут кодировать функциональные белки. Для IL-4 показано суще-
ствование не только альтернативных мРНК-транскриптов, но и альтернативной изоформы бел-
ка (IL-4δ2), которая утратила часть, кодируемую экзоном-2. Сходный по структуре альтернатив-
ный транскрипт, утративший экзон-2 (IL-5δ2) был идентифицирован для IL-5. В данном обзоре
мы обобщаем сведения об известных на данный момент альтернативных мРНК-транскриптах
и белковых изоформах Th2-цитокининов, прежде всего, IL-4 и IL-5. Мы проанализировали из-
вестные биологические свойства альтернативных вариантов этих цитокинов, их возможную роль
в развитии аллергической БА, а также рассмотрели диагностический и терапевтический потенциал.
КЛЮЧЕВЫЕ СЛОВА: бронхиальная астма, Th2-цитокины, альтернативный сплайсинг, сигнальный путь.
DOI: 10.31857/S0320972523100159, EDN: OSYUPD
ВВЕДЕНИЕ
ствующих способов терапии. В то же время
создание новых методов лечения невозможно
Бронхиальная астма (БА) - гетерогенное
без раскрытия молекулярных и клеточных ме-
заболевание, обычно характеризующееся хро-
ханизмов патогенеза.
ническим воспалением дыхательных путей [1].
За последние три десятилетия получены
В отдельных странах заболеваемость дости-
убедительные доказательства участия клеток
гает 15-18% [2], в России - около 7% населе-
T-хелперов типа 2 (Th2) и продуцируемых ими
ния [3]. Рост распространенности БА, по всей
цитокинов (IL-4, IL-5, IL-9 и IL-13) в форми-
видимости, связан с недостаточностью суще- ровании основных проявлений БА [4]. Дли-
тельное время считалось, что это заболевание
Принятые сокращения: АПК
- антигенпрезенти-
развивается исключительно по Th2-зависи-
рующие клетки; БА - бронхиальная астма; пре-мРНК -
мому механизму и ассоциировано с инфиль-
мРНК-предшественник; ЭР - эндоплазматический ре-
трацией респираторного тракта провоспали-
тикулум; ILC2 - врожденные лимфоидные клетки 2-го
типа; ORF - открытая рамка считывания; Th2-клетки -
тельными клетками - эозинофилами. Однако
T-хелперы типа 2.
в свете новых данных астму рассматривают
* Адресат для корреспонденции.
как гетерогенное заболевание, включающее
1940
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1941
в себя несколько фенотипов. Так, например,
ваясь с рецепторами на поверхности тучных
в отдельный фенотип выделяют нейтрофиль-
клеток и базофилов, опосредует последующие
ную БА, характеризующуюся нейтрофильным
аллергические реакции [4, 15] (рис. 1). Кроме
(или смешанным) воспалением дыхательных
того, дендритные клетки и альвеолярные мак-
путей, которая развивается по Th17-зависимо-
рофаги, помимо выполнения функций АПК,
му механизму. Такая астма зачастую протека-
способны активироваться аллергенами (за
ет тяжело и трудно поддается традиционному
счет распознавания их рецепторами TLR2,
лечению кортикостероидами. Тем не менее
TLR4 и Dectin-1) и продуцировать провоспа-
самым распространенным фенотипом явля-
лительные цитокины, например TNFα, что
ется аллергическая БА (до 80% всех случаев),
также вносит вклад в патогенез БА [16, 17].
которая развивается с участием Th2-клеток и
На эффекторной стадии при повторном
продуцируемых ими цитокинов [5, 6].
контакте с аллергеном происходит его взаимо-
Согласно современным представлениям,
действие с IgE, который находится на поверх-
патогенез аллергической БА развивается в два
ности тучных клеток и базофилов, что спо-
этапа: 1) этап сенсибилизации, 2) эффектор-
собствует их дегрануляции и высвобождению
ный этап [4]. Сенсибилизация происходит при
провоспалительных медиаторов (гистамина,
первичном контакте с аллергенами, которые
лейкотриенов и хемокинов) во внеклеточное
попадают в организм через повреждения в
пространство. Гистамин и лейкотриены влия-
эпителии. Происходит презентация аллер-
ют на гладкую мускулатуру дыхательных путей,
гена с помощью молекул главного комплекса
вызывая бронхоспазм, а также увеличивают
гистосовместимости (МНС) класса II на анти-
проницаемость кровеносных сосудов, благо-
генпрезентирующих клетках (АПК), прежде
даря чему провоспалительные клетки (эозино-
всего дендритных клетках и альвеолярных
филы, нейтрофилы и лимфоциты) проника-
макрофагах [7]. После контакта с аллергеном
ют в ткань легких из системного кровотока.
АПК мигрируют в региональные лимфоузлы,
В участке воспаления Тh2-клетки активиру-
где активируют наивные Th0-клетки, которые
ются при повторном контакте с аллергеном и
под влиянием определенного цитокинового
продуцируют IL-4, IL-5, IL-9 и IL-13. Эти ци-
окружения дифференцируются в Th2-клетки,
токины способствуют гиперпродукции слизи
продуцирующие так называемые Th2-цито-
бронхиальным эпителием, гиперреактивности
кины (IL-4, IL-5, IL-9, IL-13) [4, 8]. Именно
бронхов и привлечению эозинофилов в уча-
данные цитокины обеспечивают формирова-
сток воспаления и их активации. Эозинофилы
ние основных проявлений патологии. Каким
в ходе своей дегрануляции дополнительно вы-
образом происходит дифференцировка Th0- в
свобождают медиаторы воспаления, приводя-
Th2-клетки, окончательно не известно. Соглас-
щие к повреждению окружающих тканей [4, 15]
но одному из предположений, ключевую роль
(рис. 1). Накоплено много экспериментальных
в этом процессе могут играть эпителиальные
доказательств участия Th2-цитокинов в пато-
клетки и врожденные лимфоидные клетки
генезе аллергической БА, что обобщено в ряде
2-го типа (ILC2). Некоторые аллергены спо-
современных обзоров [18-20].
собны активировать эпителиальные клетки (в
Примечательно, что гены всех вышеука-
том числе за счет взаимодействия с рецепто-
занных Th2-цитокинов в своей структуре
ром TLR4 [9]), что индуцирует продукцию ими
имеют несколько интронов и экзонов. Соот-
провоспалительных факторов (TNFα, IL-1β,
ветственно, при формировании зрелых тран-
IL-6, IL-8, TSLP, IL-25 и IL-33) [10]. В свою
скриптов молекулы мРНК-предшественников
очередь, IL-25 и IL-33 активируют ILC2, ко-
(пре-мРНК) подвергаются сплайсингу - про-
торые продуцируют IL-5 и IL-13, последний
цессу удаления интронов. Сплайсинг осущест-
из которых может способствовать дифферен-
вляется мультисубъединичным комплексом -
цировке Th2-клеток [11-13]. Примечательно,
сплайсосомой, которая включает несколько ма-
что, согласно новым данным, не только ILC2
лых ядерных рибонуклеопротеинов (мяРНП)
активируют Th2-клетки, но и, наоборот, Th2-
и большое количество вспомогательных бел-
клетки, продуцируя IL-4 и прочие факторы,
ков. Процесс сплайсинга представляет собой
способствуют экспансии ILC2 [14].
последовательное связывание и высвобож-
Параллельно в регионарных лимфоузлах
дение мяРНП и вспомогательных факторов,
происходит контакт аллергена с В-клетками,
в результате чего в цепи пре-мРНК проис-
что способствует их дифференцировке в плаз-
ходит два разрыва (на 5′- и на 3′-конце интро-
матические клетки, продуцирующие антитела.
на) с последующим сшиванием двух экзонов.
Под действием Th2-цитокинов (IL-4 и IL-13)
В результате образуется зрелый мРНК-тран-
В-клетки синтезируют IgE, который, связы-
скрипт. Молекулярный механизм сплайсинга
БИОХИМИЯ том 88 вып. 10 2023
1942
ШИЛОВСКИЙ и др.
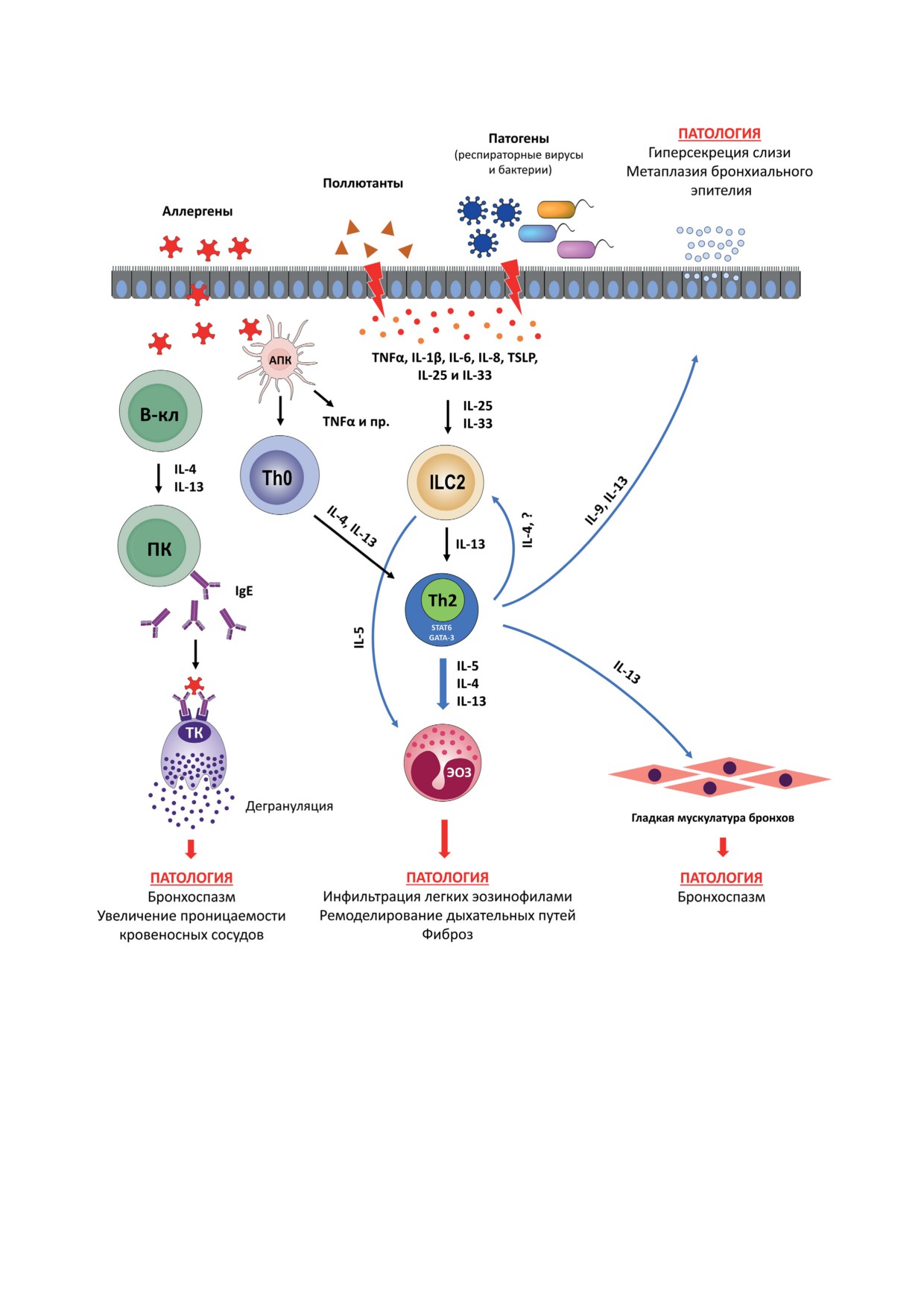
Рис. 1. Роль Th2-цитокинов в патогенезе аллергической БА. Аллерген поглощается АПК (например, дендритными
клетками, макрофагами и др.), которые мигрируют в регионарные лимфоузлы, где стимулируют дифференцировку
наивных Th0-клеток. Th0-Клетки дифференцируются в Th2 под действием IL-4 и IL-13. В свою очередь, Th2-клетки
вырабатывают цитокины IL-4, IL-5, IL-9 и IL-13. Под влиянием цитокинов (IL-4 и IL-13) происходит дифференци-
ровка В-лимфоцитов в плазматические клетки (ПК) и синтез IgE. Молекулы IgE связываются со специфическими
рецепторами (FcεR) на тучных клетках (ТК) и базофилах, что при повторном контакте с аллергеном приводит к их
дегрануляции и высвобождению гистамина, лейкотриенов, и т.д., вызывая бронхоспазм и увеличивая проницаемость
кровеносных сосудов. IL-5 способствует привлечению эозинофилов в участок воспаления, которые, в свою очередь,
вызывают повреждение ткани легких. IL-13 напрямую действует на гладкую мускулатуру, вызывая бронхоспазм.
IL-9 и IL-13 действуют на бронхиальный эпителий, приводя к гиперсекреции слизи. Аллергены (и прочие факторы)
способны активировать эпителиальные клетки, что индуцирует продукцию ими провоспалительных факторов (TNFα,
IL-1β, IL-6, IL-8, TSLP, IL-25 и IL-33). IL-25 и IL-33 активируют ILC2, которые продуцируют IL-5 и IL-13, последний
из которых может усиливать Th2-иммунный ответ. Th2-Клетки также способствуют экспансии ILC2 за счет продук-
ции IL-4 и других факторов. Кроме того, аллергены активируют АПК при помощи рецепторов TLR2, TLR4 и Dectin-1,
которые выступают дополнительными источниками провоспалительных цитокинов, например TNFα
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1943
относительно хорошо изучен и подробно опи-
жительно, могут кодировать белки, так как
сан в ряде обзоров [21, 22].
содержат открытые рамки считывания (ORF,
Под альтернативным сплайсингом пони-
open reading frame) [29, 33]. Для гена, кодирую-
мают процесс образования различных зрелых
щего IL-9, не идентифицировано альтернатив-
мРНК из одного предшественника, которые
ных транскриптов. Единственный известный
образуются в результате удаления из пре-мРНК
на сегодняшний день мРНК-транскрипт этого
не только интронов, но и экзонов (альтерна-
гена, кодирует полноразмерный IL-9 человека
тивных экзонов). Этот механизм обеспечивает
(144 а.о.); он имеет размер 605 нуклеотидов
разнообразие транскриптов, белков и их функ-
и состоит из 5 экзонов (таблица). Еще один
ций. Большинство генов человека содержат
Th2-цитокин (IL-13), хотя и имеет 4 альтер-
несколько экзонов, при этом для 95% мульти-
нативных мРНК-транскрипта, однако все они
экзонных генов человека характерен альтер-
не содержат ORF и, скорее всего, не кодируют
нативный сплайсинг [23, 24]. Процесс альтер-
белковые продукты, а следовательно их био-
нативного сплайсинга имеет сложную систему
логическая значимость неочевидна (таблица).
регуляции, которая заключается главным об-
Учитывая, что альтернативные мРНК-тран-
разом в повышении или уменьшении стери-
скрипты, кодирующие ORF, выявлены для
ческой доступности сайтов сплайсинга для
IL-4 и IL-5, в данном обзоре мы более по-
сплайсосомы. В итоге, включение или невклю-
дробно рассматриваем именно эти цитокины.
чение альтернативного экзона в зрелую мРНК
Также мы приводим анализ опубликованных
определяется балансом активаторов и инги-
экспериментальных данных о возможной роли
биторов сплайсинга, наличием регуляторных
альтернативных вариантов IL-4 и IL-5 в раз-
последовательностей (энхансеров и сайленсе-
витии аллергической астмы.
ров) в пре-мРНК, ее вторичной структурой,
которая может «маскировать» сайты сплай-
синга [25], а также «скоростью работы» РНК-
РОЛЬ АЛЬТЕРНАТИВНЫХ ВАРИАНТОВ
полимеразы [26]. Современные представления
IL-4 В БРОНХИАЛЬНОЙ АСТМЕ
о молекулярных механизмах альтернативного
сплайсинга обобщены в обзорах [24, 27, 28].
IL-4 - это многофункциональный цито-
Поскольку гены Th2-цитокинов содержат
кин, который был открыт в 1980-х гг. Глав-
несколько экзонов, то возможно существова-
ным образом он продуцируется Тh2-клетка-
ние альтернативных мРНК-транскриптов и
ми, а также тучными клетками, базофилами и
изоформ белков. Для некоторых Th2-цитоки-
эозинофилами [39]. IL-4 играет важную пато-
нов (IL-4 и IL-5) были идентифицированы аль-
генетическую роль при астме. В частности, он
тернативные изоформы белка и альтернатив-
вызывает дифференцировку Тh2-лимфоцитов,
ные мРНК-транскрипты, которые наравне с
синтез IgE В-клетками, альтернативную акти-
полноразмерными вариантами могут участво-
вацию макрофагов, выработку коллагена фиб-
вать в патогенезе аллергической БА. В данном
робластами, а также эозинофильное воспале-
обзоре мы обобщаем сведения об известных на
ние легких [40].
данный момент альтернативных мРНК-тран-
Свои биологические функции IL-4 реали-
скриптах и белковых изоформах Th2-цито-
зует при помощи двух типов рецепторов. Тип I
кининов и анализируем их возможную роль в
формируется цепями IL-4Rα и γc, а тип II -
развитии аллергической БА, а также диагно-
цепями IL-4Rα и IL-13Rα1. Примечательно,
стический и терапевтический потенциал.
что с рецептором типа II может связываться
другой Th2-цитокин - IL-13. Большинство
видов клеток экспрессируют оба типа рецеп-
АЛЬТЕРНАТИВНЫЕ ВАРИАНТЫ
торов, однако тип I наиболее представлен на
Th2-ЦИТОКИНОВ
гемопоэтических клетках (Т-, В-клетках, мак-
рофагах, эозинофилах, базофилах и тучных
Принимая во внимание тот факт, что
клетках), вследствие чего эти клетки реагиру-
гены всех Th2-цитокинов в своей структуре
ют преимущественно на IL-4. Рецептор типа II
имеют несколько интронов и экзонов, мож-
представлен на негемопоэтических клетках
но ожидать, что в результате альтернативного
(эпителиальных, клетках гладкой мускулатуры
сплайсинга образуется несколько мРНК-тран-
и др.) (рис. 2) [41]. Вследствие значительного
скриптов (таблица) [29-32]. Для генов, ко-
сходства рецепторов биологические эффекты
дирующих IL-4 и IL-5, идентифицированы
IL-4 и IL-13 схожи. Однако различный про-
альтернативные изоформы белка и альтернатив-
филь представленности рецепторов типов I
ные мРНК-транскрипты, которые, предполо-
и II на разных видах клеток обусловливают
БИОХИМИЯ том 88 вып. 10 2023
1
944
ШИЛОВСКИЙ и др.
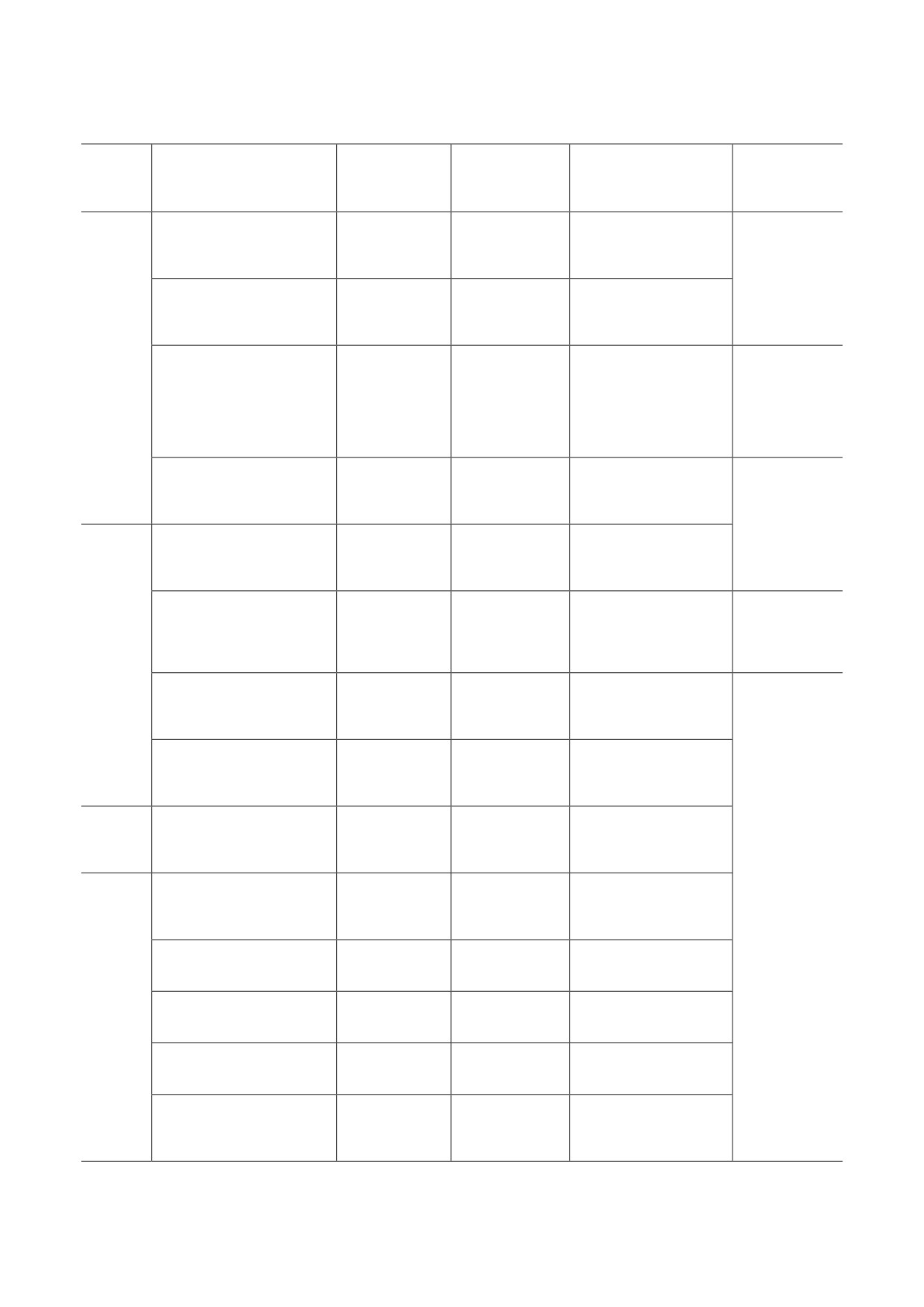
Альтернативные мРНК-транскрипты Th2-цитокинов человека и их характеристика
Размер мРНК-
ID мРНК-транскрипта
Цитокин
транскрипта,
Белок
Описание
Ссылка
нукл
содержит все 4 экзона
ENST00000231449.7
615
153 а.о.
и кодирует полнораз-
база данных
мерный белок IL-4
строения
геномов
отсутствует часть
позвоночных,
предполагаемый
ENST00000622422.1
717
экзона-3 и экзона-4,
ensembl.org
белок 136 а.о.
кодирует ORF
база данных
IL-4
строения
отсутствует экзон-2,
геномов
ENST00000350025.2
414
137 а.о.
кодирует изоформу
позвоночных,
IL-4δ2
ensembl.org,
[29, 34-38]
содержит фрагменты
ENST00000495905.1
305
нд
двух экзонов,
база данных
не кодирует ORF
строения
геномов
содержит все 4 экзона
позвоночных,
ENST00000231454.6
815
134 а.о.
и кодирует полнораз-
ensembl.org
мерный белок IL-5
отсутствует экзон-2,
предполагаемый
предположительно,
нд
нд
[33]
белок 123 а.о.
кодирует изоформу
IL-5δ2
IL-5
содержит фрагменты
ENST00000450655.1
276
51 а.о.
трех экзонов,
кодирует ORF
содержит фрагменты
ENST00000462418.1
905
нд
двух экзонов,
не кодирует ORF
содержит все 5 экзо-
IL-9
ENST00000274520.2
605
144 а.о.
нов и кодирует полно-
размерный белок IL-9
база данных
содержит все 4 экзона
строения
ENST00000304506.7
1283
146 а.о.
и кодирует полнораз-
геномов
мерный белок IL-13
позвоночных,
ensembl.org
не содержит экзонов,
ENST00000468334.5
1082
нд
кодирующих ORF
не содержит экзонов,
IL-13
ENST00000487267.5
1033
нд
кодирующих ORF
не содержит экзонов,
ENST00000459878.5
777
нд
кодирующих ORF
содержит фрагменты
ENST00000462480.1
1562
нд
трех экзонов,
не кодирует ORF
Примечание. ORF - открытая рамка считывания (open reading frame); нукл - нуклеотиды; нд - данные отсутствуют.
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1945
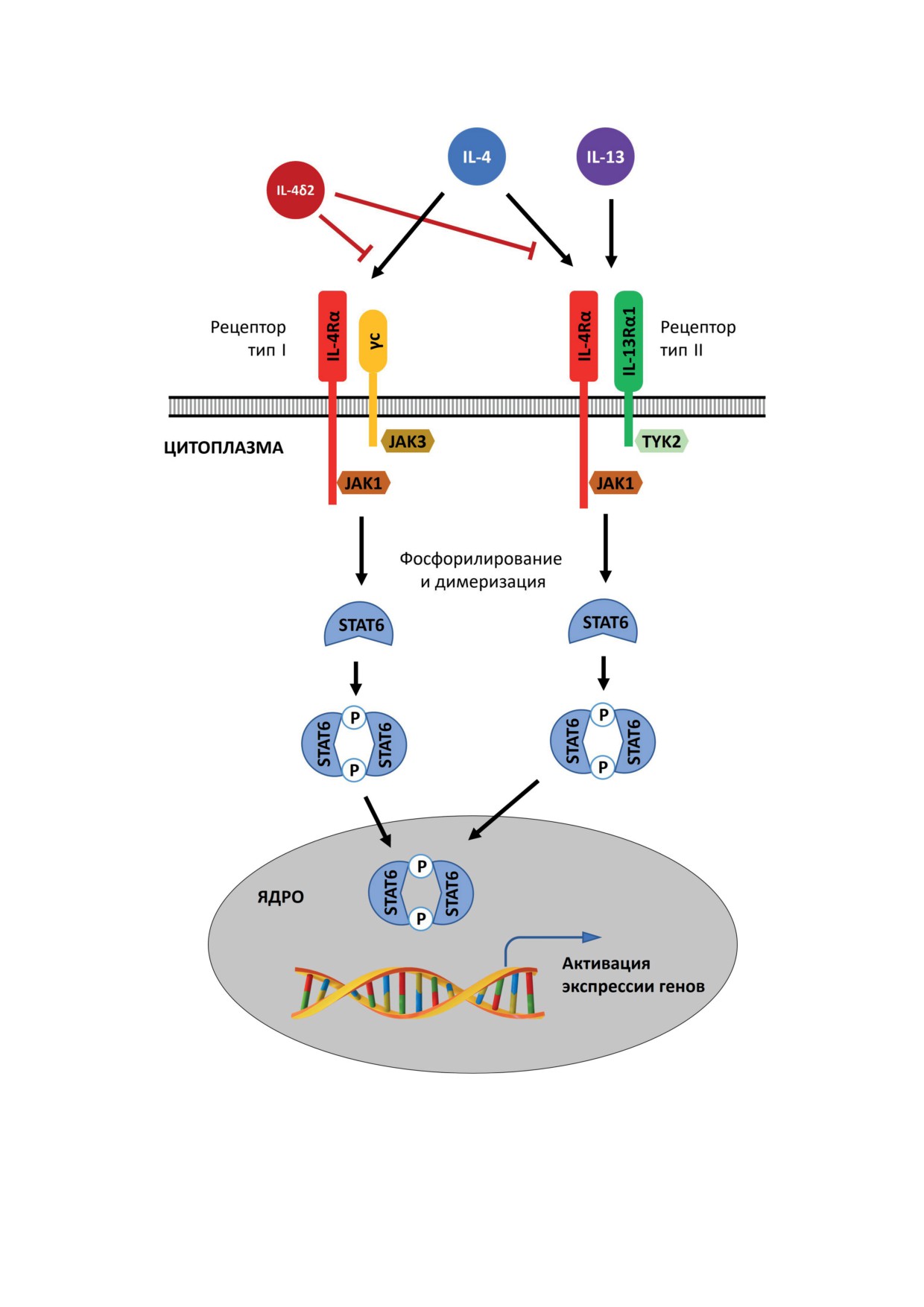
Рис. 2. Рецептор и сигнальные пути IL-4 и IL-4δ2, а также IL-13. IL-4 способен связываться с двумя типами рецеп-
торов. Рецептор типа I состоит из цепей IL-4Rα и γc; рецептор типа II состоит из цепей IL-4Rα и IL-13Rα1. Другой
Th2-цитокин - IL-13 - способен связываться только с рецептором типа II. После связывания IL-4 или IL-13 со своим
рецепторным комплексом происходит фосфорилирование киназ YAK и TYK, а также фактора транскрипции STAT6.
Фосфорилированный STAT6 димеризуется, после чего транслируется в ядро, где активирует экспрессию генов,
отвечающих за развитие Th2-иммунного ответа. IL-4δ2 способен связываться с цепью рецептора IL-4Rα, препятствуя
связыванию полноразмерного IL-4 со своим рецептором, тем самым ингибируя его активность
БИОХИМИЯ том 88 вып. 10 2023
1946
ШИЛОВСКИЙ и др.
некоторые различия в биологических функ-
и др.) моноцитами человека. В то же время
циях этих цитокинов. В отличие от IL-4, IL-13
IL-4δ2 ингибировал пролиферацию Т-клеток,
способен оказывать прямой эффект на клетки
индуцируемую полноразмерным IL-4 [34], и
гладкой мускулатуры бронхов и тем самым опо-
уменьшал его продукцию Th2-клетками [35],
средовать бронхоконстрикцию при БА [41, 42].
блокировал эффекты IL-4 в культуре моноци-
Кроме того, IL-13, действуя на эпителиальные
тов, а также ингибировал способность IL-4
клетки респираторного тракта, индуцирует ги-
запускать синтез IgE B-клетками [34]. Все эти
персекрецию слизи, что также является харак-
данные указывают на то, что изоформа IL-4δ2
терным проявлением этой патологии [41].
является негативным регулятором IL-4. Было
Связывание IL-4 с рецептором типа I при-
показано, что IL-4δ2 способен связываться с
водит к активации киназ JAK1 и JAK3, а свя-
теми же рецепторами, что и полноразмерный
зывание IL-4 (или IL-13) с рецептором типа II
IL-4, это позволяет укороченной форме кон-
активирует киназы JAK1 и TYK2/JAK2. Акти-
курентно ингибировать эффекты полнораз-
вированные киназы осуществляют фосфори-
мерной. Отсутствие фрагмента белка, коди-
лирование остатков тирозина в цитоплазма-
руемого экзоном-2, приводит к изменению его
тических доменах цепей рецептора, которые,
трехмерной структуры, что уменьшает срод-
в свою очередь, выступают в роли сайтов
ство IL-4δ2 к рецептору по сравнению с IL-4.
докинга для передачи сигнала последующей
Тем не менее этого сродства достаточно для
адапторной молекуле - фактору транскрип-
конкурентного ингибирования эффектов IL-4
ции STAT6. После активации путем фосфо-
in vitro [34, 38] (рис. 2).
рилирования этот фактор формирует димеры,
Дополнительно было показано, что в куль-
которые транслоцируются в ядро, где активи-
туре первичных Т-лимфоцитов человека IL-4δ2
рует транскрипцию определенных генов, во-
активировал продукцию IFNγ, IL-6, IL-10,
влеченных в активацию Th2-клеток и развитие
MCP-1 и TNFα [35]. Способность этой изо-
аллергических реакций (рис. 2) [41].
формы активировать продукцию IFNγ под-
Ген, кодирующий IL-4, состоит из четырех
тверждает представления о том, что IL-4δ2
экзонов [43, 44]. Полноразмерный белок IL-4
является негативным регулятором Th2-иммун-
(153 а.о.) кодируется всеми четырьмя экзонами.
ного ответа и, соответственно, может прини-
У человека идентифицирована еще одна изо-
мать участие в патогенезе аллергической БА.
форма этого белка (IL-4δ2 размером 136 а.о.),
Таким образом, исследования на клеточных
кодируемая экзонами 1, 3 и 4; т.е. в результате
культурах показали, что IL-4δ2 может быть ан-
альтернативного сплайсинга происходит деле-
тагонистом IL-4 и многообещающим терапев-
ция экзона-2. мРНК-транскрипт, кодирую-
тическим агентом.
щий IL-4δ2, был идентифицирован методом
Способность IL-4δ2 негативно регули-
секвенирования в 1996 г. [29]. Аналогичный
ровать Th2-иммунный ответ подтверждается
мРНК-транскрипт был идентифицирован и у
экспериментами in vivo, т.к. введение живот-
мышей, он выявлялся в селезенке и костном
ным IL-4δ2 активировало продукцию IFNγ,
мозге [45]; позднее был идентифицирован со-
являющегося антагонистом IL-4 [52-54]. При-
ответствующий белок [36]. Также было пока-
мечательно, что в ответ на введение IL-4δ2 в
зано, что оба транскрипта (кодирующих как
дыхательные пути мышей развивалось незна-
полноразмерный, так и укороченный белок)
чительное воспаление, выражавшееся в на-
выявлялись в более широком спектре тканей
коплении Т- и В-лимфоцитов в легких. В то
и клеток мыши [29, 34, 46-51]. При анализе
же время введение IL-4 провоцировало более
базы данных было идентифицировано еще два
выраженное воспаление, характеризующееся
альтернативных транскрипта, один из кото-
не только инфильтрацией Т- и В-лимфоцита-
рых несет ORF, кодирующую предполагаемый
ми, но и эозинофилами, а также гиперплазией
белок размером 136 а.о. (таблица). Однако от-
бокаловидных клеток респираторного эпите-
сутствуют публикации, описывающие его воз-
лия [36, 55]. Эти данные указывают на нали-
можные свойства.
чие собственной биологической активности
Биологические функции IL-4δ2. После по-
IL-4δ2, которая, по всей видимости, опосре-
лучения рекомбинантного белка IL-4δ2 была
дована рецептором для полноразмерного IL-4,
проведена серия экспериментов с целью уста-
так как нокаут мРНК, кодирующих STAT6 или
новить его биологические эффекты. В куль-
IL-4R, значительно нивелировал IL-4δ2-инду-
туре клеток было продемонстрировано, что, в
цированную инфильтрацию лимфоцитов [55].
отличие от полноразмерного цитокина, IL-4δ2
Независимость биологических свойств IL-4δ2
не влиял на пролиферацию Т-клеток [34] или
подтверждается также транскриптомными ис-
экспрессию цитокинов (IFNγ, IL-1, IL-6, IL-8
следованиями, которые показывают, что IL-4
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1947
и IL-4δ2 влияют на экспрессию разных ге-
его секреция, коррелирует ли его уровень с
нов; IL-4 регулирует экспрессию 283 генов, а
наличием патологии (бронхиальной астмы), а
IL-4δ2 - 84 генов, при этом 38 из них регули-
также оказывает ли он регулирующее действие
руются IL-4δ2, но не IL-4. Эти исследования
на первичные Т-клетки пациентов и здоровых
также продемонстрировали, что IL-4δ2 (а не
добровольцев?
IL-4) активировал IFNγ, тем самым подтвер-
Разработка антител, которые селективно
ждая, что IL-4δ2 обладает Th1-подобными
распознают изоформу IL-4δ2, позволила про-
свойствами [55]. В итоге обе изоформы (IL-4
вести исследования его возможной роли в раз-
и IL-4δ2) демонстрируют различные биологи-
личных патологиях человека, включая БА.
ческие эффекты, реализующиеся по единому
Было показано, что, несмотря на выявлен-
IL-4Rα/STAT6-сигнальному пути [55]. Чтобы
ную экспрессию мРНК-транскрипта IL-4δ2
установить, какие молекулярные механизмы
как у здоровых, так и у пациентов в широком
лежат в основе биологического эффекта IL-4δ2
спектре клеток, белок продуцируется в основ-
in vivo, требуются дополнительные исследо-
ном активированными Т-клетками пациентов,
вания.
страдающих БА, а не здоровых добровольцев.
Примечательно, что, в отличие от экспери-
При этом дифференцированные Th1-, Th2- и
ментов in vitro, в экспериментах in vivo IL-4δ2
Th17-клетки не являются основными проду-
не ингибировал эффекты полноразмерной
центами IL-4δ2 [35]. Примечательно, что ки-
формы, т.к. их совместное введение животным
нетика секреции IL-4δ2 Т-клетками отлича-
не предотвращало эозинофилию легких [55].
лась от таковой для полноразмерной формы.
Возможно, такое различие обусловлено пере-
IL-4 имел пик продукции через 12-24 часа
крестными связями между различными типами
после стимуляции и снижался через 48 часов.
клеток организма, отсутствующими в клеточ-
Напротив, IL-4δ2 не обнаруживался через 12-
ной культуре. Также авторы этого исследова-
24 часа, при этом его концентрация достигала
ния считают, что в условиях in vivo укороченная
максимумов через 48 часов, оставалась высо-
изоформа может иметь более высокую стабиль-
кой через 72 и 96 часов. Таким образом, про-
ность (за счет взаимодействия с другими белко-
дукция IL-4δ2 активированными Т-клетками
выми факторами) и тем самым оказывает био-
запускается позже, в сравнении с IL-4 [35]; это
логический эффект, отсутствующий in vitro [55].
свидетельствует о том, что в ходе реализации
Таким образом, ингибирование полно-
Th2-иммунного ответа происходит переклю-
размерного IL-4 без подавления IL-4δ2 может
чение продукции с полноразмерной формы
уменьшить воспаление, опосредованное эози-
на IL-4δ2 путем альтернативного сплайсинга.
нофилами, и продукцию слизи, но не воспале-
Вероятнее всего, такое переключение регули-
ние, опосредованное другими типами клеток,
руется избыточным Th2-иммунным ответом
например, лимфоцитами. Подавление обоих
при БА. В то же время стимулы к переключе-
изоформ IL-4, вероятно, будет иметь более вы-
нию на продукцию IL-4δ2 на данный момент
раженный антивоспалительный эффект. С дру-
не установлены.
гой стороны, подавление укороченной изо-
Первоначальные исследования в культуре
формы (IL-4δ2), которая выступает в роли
клеток показали, что IL-4δ2 не проявлял соб-
ингибитора полноразмерного IL-4, может иметь
ственных биологических эффектов (на про-
обратный эффект, приводя к усилению IL-4-
лиферацию Т-клеток, синтез IgE В-клетками
опосредованного воспаления. Требуются бо-
и т.д.), а являлся антагонистом полноразмер-
лее детальные исследования прежде всего в
ной формы [34, 37]. Однако в последующих
экспериментах на животных для уточнения
экспериментах на мышах было показано, что
биологических эффектов IL-4δ2.
IL-4δ2 независимо от IL-4 индуцирует инфиль-
Роль IL-4δ2 в БА. В ранних исследованиях
трацию легких лимфоцитами [36, 55]. В даль-
была продемонстрирована экспрессия мРНК
нейшем Luzina et al. [35] предположили, что
IL-4δ2 в мононуклеарных клетках перифери-
IL-4δ2 активирует лимфоциты, не вызывая их
ческой крови, тимоцитах и клетках бронхо-
пролиферацию. В действительности Т-клетки
альвеолярного лаважа. Эти первичные иссле-
как здоровых людей, так и пациентов с астмой
дования не выявили связи уровня экспрессии
после стимуляции этой изоформой продуци-
мРНК-транскрипта IL-4δ2 с наличием астмы
ровали Th1-цитокин - IFNγ, при этом IL-4δ2
или ее тяжестью, т.к. мРНК-транскрипты обо-
не влиял на продукцию Th2-цитокинов (IL-5,
их изоформ обнаруживались как у больных,
IL-13) и Th17-цитокина (IL-17) [35]. Эти ре-
так и у здоровых [35, 50, 56, 57]. В то же время
зультаты согласуются с предыдущими данны-
оставалось неясным, продуцируется ли белок
ми исследований in vivo [36, 55], что позволяет
IL-4δ2 и какими клетками осуществляется
считать IL-4δ2 про-Th1-цитокином.
БИОХИМИЯ том 88 вып. 10 2023
1948
ШИЛОВСКИЙ и др.
Таким образом, IL-4δ2 продуцируется
скрипты были обозначены как mIL-5δ2 (для
Т-клетками не только в виде мРНК, но и в
мыши) и hIL-5δ2 (для человека). Важно отме-
качестве белка. При этом продукция данной
тить, что экзон-2 гена человека имеет такой
изоформы ассоциирована с аллергической БА,
же размер (33 п.н.), что и экзон-2 гена мыши.
вследствие чего она может выступать в роли
Следовательно, предполагаемые белковые изо-
биомаркера этой патологии. Выявленные раз-
формы на 11 а.о. короче полноразмерных IL-5
личия в кинетике секреции IL-4 и IL-4δ2
человека и мыши. Делеция экзона-2 может
позволяют предполагать, что IL-4δ2, являясь
происходить в результате альтернативного
про-Th1-цитокином, негативно регулирует Th2-
сплайсинга. Показано, что мРНК IL-5δ2 экс-
иммунный ответ при БА, что позволяет рас-
прессируется вместе с канонической формой
сматривать ее как потенциальное терапевтиче-
в различных активированных лимфоидных
ское средство.
тканях мыши (тимус, селезенка, лимфоузлы
и клетки крови). Как и IL-4δ2, мРНК-тран-
скрипт IL-5δ2 человека наблюдали в моно-
РОЛЬ АЛЬТЕРНАТИВНЫХ ВАРИАНТОВ
нуклеарных клетках периферической крови
IL-5 В БРОНХИАЛЬНОЙ АСТМЕ
(PBMC, peripheral blood mononuclear cell) здо-
ровых добровольцев и пациентов с аллергиче-
Цитокин IL-5 был впервые описан не-
ской астмой [33].
сколькими независимыми группами ученых
Поскольку отсутствуют коммерческие моно-
как фактор роста В-клеток и фактор диффе-
клональные антитела, которые индивидуально
ренциации эозинофилов [58-61]. Несколько
распознают укороченную или полноразмер-
позднее был идентифицирован IL-5 челове-
ную форму IL-5, были проведены эксперимен-
ка [30]. IL-5 мыши имеет размер 133 а.о., вклю-
ты по индивидуальному клонированию этих
чая последовательность сигнального пептида
транскриптов в плазмидный вектор с после-
(21 а.о.) и три сайта для N-гликозилирования.
дующей экспрессией соответствующих белков
IL-5 человека размером 134 а.о. имеет сигналь-
(полноразмерного и укороченного) в клетках
ный пептид размером 22 а.о., а также два сайта
млекопитающих. В ходе этих экспериментов
для N-гликозилирования. Биологически актив-
продемонстрировано, что новая изоформа
ный IL-5 существуют в виде димеров, свя-
IL-5δ2 может экспрессироваться в виде белка
занных дисульфидными связями. Именно в
внутри клеток и секретироваться во внекле-
форме димера он взаимодействует со своим
точное пространство, но с меньшей интен-
рецептором, состоящим из двух цепей (IL5Rα
сивностью (примерно на 30%) в сравнении с
и IL5Rβ), и реализует свои биологические
полноразмерным IL-5. С применением поли-
эффекты [62]. Этот цитокин индуцирует диф-
клональных антител (распознают обе изофор-
ференцировку, рекрутирование и выживание
мы IL-5) и метода конфокальной микроскопии
эозинофилов в очаге воспаления, в т.ч. в лег-
продемонстрировано, что полноразмерный IL-5
ких при аллергической БА [63].
преимущественно локализуется в эндоплазма-
Возможная роль альтернативных форм IL-5
тическом ретикулуме (ЭР), тогда как укоро-
в БА. Анализ структуры гена показал, что IL-5
ченная изоформа обнаруживается в ЭР в
содержит 4 экзона. Соответственно, возможно
меньшей степени. Обычно сначала цитокины
существование нескольких альтернативных
образуются в ЭР, а затем транспортируются
мРНК-транскриптов. Анализ базы данных по-
в комплекс Гольджи. Такая измененная ком-
казал отсутствие альтернативных мРНК-тран-
партментализация белка IL-5δ2 (вне ЭР) может
скриптов IL-5 мыши. Однако имеются сведе-
свидетельствовать о его частичной деградации
ния о двух альтернативных транскриптах IL-5
и нарушенной секреции. Тем не менее наблю-
человека (таблица). Первый (TranscriptID:
даемые различия в экспрессии и секреции
ENST00000450655.1) содержит фрагменты трех
полноразмерной и укороченной форм не были
экзонов (полностью отсутствует экзон-4) и мо-
существенными [33].
жет кодировать белок размером 51 а.о., а вто-
Примечательно, что идентифицирован-
рой (TranscriptID: ENST00000462418.1) содер-
ные транскрипты IL-5δ2 (человека и мыши)
жит фрагменты двух экзонов и не имеет ORF,
имеют значительное сходство с ранее иденти-
поэтому, скорее всего, не кодирует белкового
фицированным транскриптом IL-4δ2; у обоих
продукта.
происходит делеция второго экзона (кото-
В недавней работе описана идентифи-
рый кодирует 11 и 16 а.о. соответственно) [64].
кация новых мРНК-транскриптов IL-5 че-
IL-4δ2 человека экспрессируется в клетке
ловека и мыши, которые лишены экзона-2
на уровне белка [50, 55, 56], специфически
(33 нуклеотида) [33]. Альтернативные тран-
взаимодействует с рецептором и конкурирует
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1949
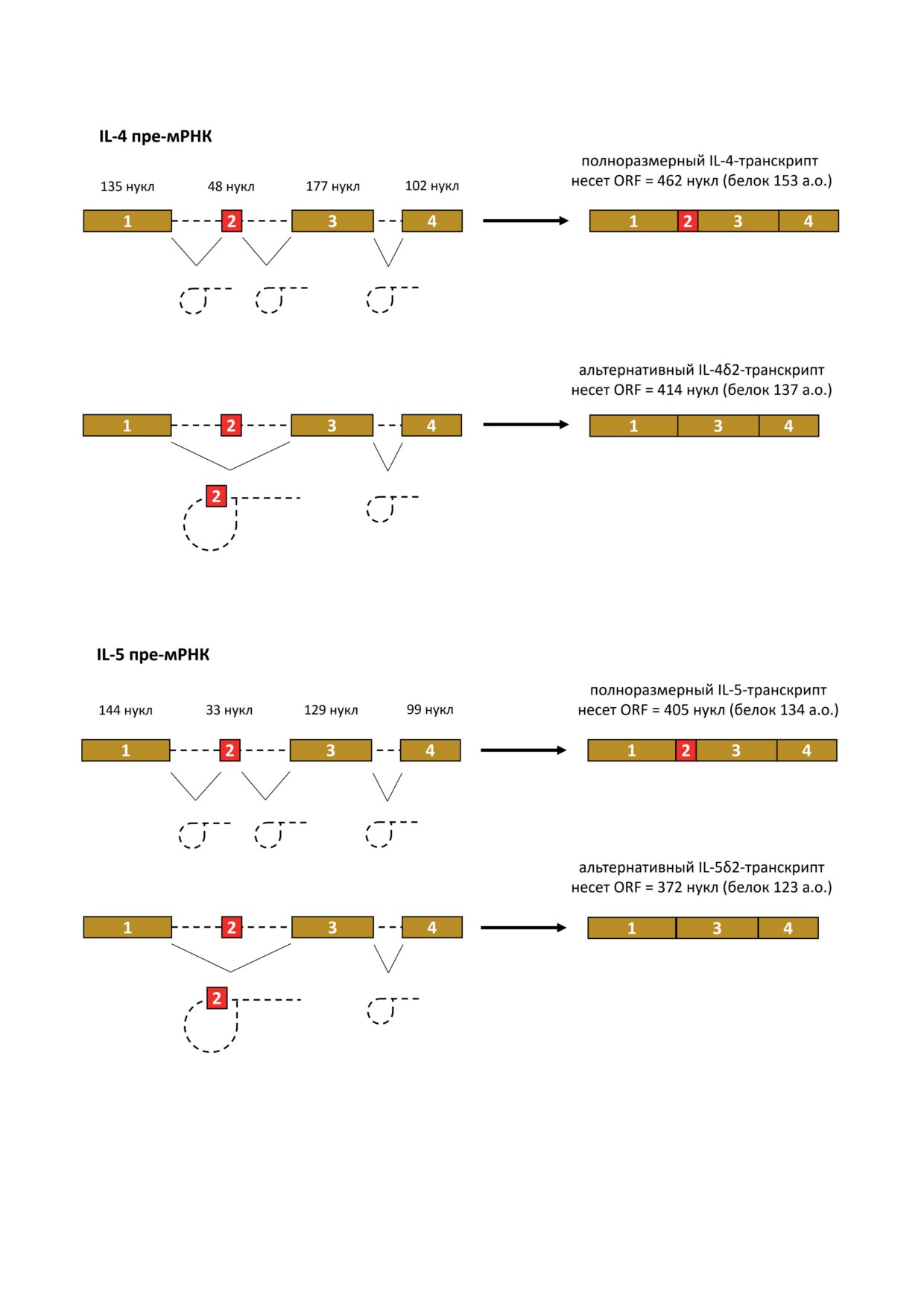
Рис. 3. Механизм альтернативного сплайсинга генов, кодирующих IL-4 и IL-5 человека. На рисунке представлена
схема структуры интронов и экзонов генов, кодирующих IL-4 и IL-5. В ходе созревания из пре-мРНК в результате
сплайсинга удаляются интроны, а четыре экзона объединяются в зрелый мРНК-транскрипт. Сплайсинг, в ходе ко-
торого происходит первый разрыв цепи пре-мРНК на 5′-конце интрона, а второй - на 3′-конце интрона и после-
дующее объединение двух экзонов, осуществляется сплайсосомой (мультисубъединичным комплексом). В результате
образуется зрелый мРНК-транскрипт и интрон в циклической форме. В ходе альтернативного сплайсинга происходит
удаление самого короткого экзона-2 (альтернативного экзона - отмечен красным) и формирование альтернативного
мРНК-транскрипта, включающего экзоны 1, 3 и 4; нукл - нуклеотид
БИОХИМИЯ том 88 вып. 10 2023
1950
ШИЛОВСКИЙ и др.
с полноразмерным IL-4 [34, 37]. Таким обра-
которая также в результате альтернативного
зом, аффинность IL-4δ2 к рецептору суще-
сплайсинга из четырех экзонов утрачивает
ственно не изменяется, несмотря на деле-
самый короткий экзон-2 (рис. 3). Изоформа
цию 16 а.о. [65].
IL-4δ2 была идентифицирована значительно
Размер белка, который транслируется с
ранее, чем IL-5δ2, поэтому ее биологические
мРНК IL-5δ2 мыши, должен составлять 122 а.о.,
эффекты более изучены. Согласно текущим
а человека - 123 а.о., что на 11 а.о. меньше пол-
представлениям, IL-4δ2 негативно регулирует
норазмерных цитокинов. Ввиду того что про-
активность полноразмерной формы IL-4, в
исходит делеция самого короткого экзона,
частности, нивелирует избыточный Th2-им-
предполагаемый белок IL-5δ2 может быть
мунный ответ при БА. Учитывая значительное
структурно очень похож на полноразмерный
сходство IL-4δ2 и IL-5δ2, можно полагать, что
IL-5. Однако в проведенном исследовании
IL-5δ2 также может играть определенную роль
продемонстрировано, что белок IL-5δ2 мыши
в патогенезе БА, например, негативно регу-
обнаруживался с помощью поликлональных,
лировать активность полноразмерного IL-5 и
а не моноклональных антител. Это позволяет
уменьшать избыточное эозинофильное воспа-
предположить, что
11 а.о., соответствующие
ление в легких. Однако данное предположение
экзону-2, могут быть важны для формирова-
требует подтверждения прежде всего в экспе-
ния эпитопной структуры цитокина [33].
риментах in vivo.
Предшествующее исследование [65] пока-
зало, что полноразмерный белок IL-5 состоит
из четырех α-спиралей (α1-α4), соединенных
ЗАКЛЮЧЕНИЕ
тремя петлями, содержащими β-тяжи и неупо-
рядоченные участки. Важно отметить, что изо-
Аллергическая БА к настоящему времени
форма IL-5δ2, несмотря на делецию экзона-2,
является самым изученным фенотипом этого
сохраняет консервативный остаток цистеина
заболевания. Многими исследованиями по-
в положении 62. Этот остаток необходим для
казано, что Th2-цитокины (IL-4, IL-5, IL-9
образования функционального гомодимера,
и IL-13) - это одни из ключевых участников
т.к. он участвует в образовании двух межмоле-
ее патогенеза. Именно они формируют основ-
кулярных дисульфидных связей Cys62-Cys104
ные проявления патологии: продукцию IgE,
и Cys104-Cys62. Одиннадцать а.о., отсут-
эозинофильное воспаление легких, гипер-
ствующих в IL-5δ2, полностью локализованы
реактивность бронхов и гиперсекрецию слизи
в петле α1-α2. Эти остатки участвуют в обра-
респираторным эпителием [4]. Гены, коди-
зовании межцепочечных водородных связей,
рующие эти цитокины, состоят из нескольких
тем самым стабилизируют структуру димера
экзонов; IL-4, IL-5 и IL-13 имеют четыре
IL-5 и формируют правильную ориентацию
экзона, а IL-9 - пять (таблица). Благодаря
для взаимодействия с рецептором. Следова-
такому мозаичному строению генов возмож-
тельно, делеция этого фрагмента потенциально
но существование альтернативных изоформ
может влиять на фолдинг белка IL-5δ2 и его
этих цитокинов. Анализ научной литературы
взаимодействие с рецептором. Кроме того, по-
и баз данных показал наличие альтернативных
казано, что не только петля α3-α4, но и петля
мРНК-транскриптов для IL-4 [67], IL-5 [33] и
α1-α2 принимают непосредственное участие
IL-13 (база данных строения геномов позво-
во взаимодействии IL-5 с рецептором [66].
ночных, ensembl.org). При этом у IL-4 и IL-5
Способен ли IL-5δ2 связываться с рецеп-
выявлены альтернативные транскрипты, кото-
тором и конкурентно ингибировать полнораз-
рые несут ORF, а следовательно, могут коди-
мерный IL-5, еще предстоит выяснить. Создание
ровать функциональные белки (таблица).
реагентов для специфического обнаружения
Для IL-4 была идентифицирована изо-
белка IL-5δ2, очистка рекомбинантного белка,
форма IL-4δ2, которая в результате альтерна-
исследования цитокиновых рецепторов, селек-
тивного сплайсинга утратила часть, кодируемую
тивный нокдаун мРНК, кодирующих изофор-
экзоном-2. Т-Клетки пациентов, у которых была
мы IL-5, и другие методы позволят уточнить
диагностирована аллергическая астма, способ-
функцию ранее неизвестной изоформы IL-5.
ны секретировать IL-4δ2, тогда как Т-клетки
Таким образом, IL-5δ2 образуется в резуль-
здоровых добровольцев - нет. Это обстоятель-
тате альтернативного сплайсинга из пре-мРНК
ство позволяет рассматривать IL-4δ2 в каче-
путем делеции самого короткого экзона-2 и
стве биомаркера этой патологии [67]. Кроме
включения в зрелый транскрипт экзонов 1, 3
того, обобщив результаты опубликованных
и 4. IL-5δ2 имеет значительное сходство с ра-
исследований, можно полагать, что укорочен-
нее идентифицированной изоформой IL-4δ2,
ная изоформа IL-4δ2, скорее всего, является
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1951
негативным регулятором полноразмерного
используют моноклональные антитела, кото-
IL-4, так как способна конкурировать с ним
рые нейтрализуют либо сам цитокин, либо
за связывание с рецептором, а также активи-
его рецептор, тем самым прерывая развитие
ровать экспрессию IFNγ, который является
патологического процесса [15]. Многие препа-
антагонистом IL-4 [67]. Учитывая это, IL-4δ2
раты на основе моноклональных антител, раз-
можно рассматривать в качестве потенциаль-
работанные для терапии БА, имеют ограничен-
ного терапевтического средства для подав-
ную эффективность [15]. Одним из наиболее
ления избыточного Th2-иммунного ответа,
успешных препаратов для лечения БА являет-
который лежит в основе патогенеза аллерги-
ся Dupilumab [68]. Он содержит моноклональ-
ческой БА.
ное антитело, которое нейтрализует общую
Примечательно, что структура экзонов гена,
цепь рецептора для IL-4 и IL-13 (IL-4Rα), тем
кодирующего IL-5, очень сходна с таковой для
самым нивелирует патологические эффекты
IL-4. Оба гена кодируют четыре экзона, при
обоих цитокинов одновременно [69]. Клини-
этом самый короткий - это экзон-2. Как и в
ческие исследования подтвердили его эффек-
случае с IL-4, для IL-5 был обнаружен аль-
тивность (прежде всего, при лечении пациен-
тернативный мРНК-транскрипт с делецией
тов с высоким уровнем эозинофилов) [70-72],
экзона-2 (IL-5δ2). Клонирование этого тран-
а сам препарат одобрен для медицинского при-
скрипта в экспрессионный вектор позволило
менения во многих странах мира, в том числе
установить, что IL-5δ2 может синтезировать-
и в России. Наряду с ограниченной эффек-
ся в виде белка и секретироваться во внекле-
тивностью [15], один из главных недостатков
точное пространство. Более того, делеция
препаратов на основе моноклональных анти-
экзона-2 не затрагивает остатки цистеина,
тел - высокая стоимость [73, 74]. В то же время
необходимые для образования функциональ-
получение рекомбинантных белковых инги-
ного гомодимера. Все эти факты позволяют с
биторов (например, IL-4δ2 и IL-5δ2) является
высокой степенью вероятности предполагать
более дешевой технологией, чем получение
существование естественной альтернативной
моноклональных антител, что может открыть
изоформы IL-5δ2, которая может играть роль
новые перспективы в создании противовоспа-
негативного регулятора IL-5 в патогенезе БА.
лительных препаратов.
Создание моноклональных антител для спе-
цифического обнаружения IL-5δ2, а также
Вклад авторов. И.П. Шиловский, М.Р. Хаи-
получение рекомбинантного белка позволит в
тов
- концепция и руководство работой;
будущем раскрыть его биологическую функ-
В.И. Ковчина - написание текста; Е.Д. Тимо-
цию. В случае подтверждения способности
тиевич, А.А. Никольский - редактирование
новой изоформы подавлять неблагоприятные
текста статьи, подготовка иллюстраций.
эффекты IL-5 она также может выступать в
Финансирование. Исследование выпол-
роли потенциального терапевтического сред-
нено при поддержке Российского научного
ства для лечения аллергической БА.
В настоящее время появляется много
project/23-24-00546/).
лекарственных средств для так называемой
Конфликт интересов. Авторы заявляют об
антицитокиновой терапии бронхиальной аст-
отсутствии конфликта интересов.
мы [15]. Суть этого подхода заключается в
Соблюдение этических норм. Настоящая
создании ингибиторов патогенетически зна-
статья не содержит описания каких-либо ис-
чимых цитокинов (прежде всего, Th2-цито-
следований с участием людей или животных
кинов). В качестве таких ингибиторов часто
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Global Initiative for Asthma (2022) Global Strategy for
Barac, A., Basu, S., Bedi, N., Bensenor, I. M.,
Asthma Management and Prevention.
Berhane, A., Beyene, A. S., Bhutta, Z. A., Biryukov, S.,
2. Soriano, J. B., Abajobir, A. A., Abate, K. H., Abera,
Boneya, D. J., Brauer, M., Carpenter, D. O., Casey, D.,
S. F., Agrawal, A., Ahmed, M. B., Aichour, A. N.,
Christopher, D. J., Dandona, L., Dandona, R.,
Aichour, I., Eddine Aichour, M. T., Alam, K., Alam, N.,
Dharmaratne, S. D., Do, H. P., Fischer, F.,
Alkaabi, J. M., Al-Maskari, F., Alvis-Guzman, N.,
Gebrehiwot, T. T., Geleto, A., Ghoshal, A. G., Gillum,
Amberbir, A., Amoako, Y. A., Ansha, M. G., Antó,
R. F., Mohamed Ginawi, I. A., Gupta, V., Hay, S. I.,
J. M., Asayesh, H., Atey, T. M., Avokpaho, E. F. G. A.,
Hedayati, M. T., Horita, N., Hosgood, H. D.,
БИОХИМИЯ том 88 вып. 10 2023
1952
ШИЛОВСКИЙ и др.
Jakovljevic, M. M. B., James, S. L., Jonas, J. B.,
10.
Shin, S. H., Ye, M. K., Lee, D. W., Chae, M. H.,
Kasaeian, A., Khader, Y. S., Khalil, I. A., Khan, E. A.,
and Han, B. D. (2020) Nasal epithelial cells activated
Khang, Y. H., Khubchandani, J., Knibbs, L. D.,
with Alternaria and house dust mite induce not only
Kosen, S., Koul, P. A., Kumar, G. A., Leshargie, C. T.,
Th2 but also Th1 immune responses, Int. J. Mol. Sci.,
Liang, X., Magdy Abd El Razek, H., Majeed, A.,
21, 2693, doi: 10.3390/ijms21082693.
Malta, D. C., Manhertz, T., Marquez, N., Mehari, A.,
11.
Wang, C., Liu, Q., Chen, F., Xu, W., Zhang, C., and
Mensah, G. A., Miller, T. R., Mohammad, K. A.,
Xiao, W. (2016) IL-25 promotes Th2 immunity re-
Mohammed, K. E., Mohammed, S., Mokdad, A. H.,
sponses in asthmatic mice via nuocytes activation, PLoS
Naghavi, M., Nguyen, C. T., Nguyen, G., Nguyen,
One, 11, e0162393, doi: 10.1371/journal.pone.0162393.
Q. Le, Nguyen, T. H., Ningrum, D. N. A., Nong,
12.
Eiwegger, T., and Akdis, C. A. (2011) IL-33 links
V. M., Obi, J. I., Odeyemi, Y. E., Ogbo, F. A.,
tissue cells, dendritic cells and Th2 cell development
Oren, E., Mahesh, P. A., Park, E. K., Patton, G. C.,
in a mouse model of asthma, Eur. J. Immunol., 41,
Paulson, K., Qorbani, M., Quansah, R., Rafay, A.,
1535-1538, doi: 10.1002/eji.201141668.
Rahman, M. H. U., Rai, R. K., Rawaf, S., Reinig, N.,
13.
Khaitov, M. R., Gaisina, A. R., Shilovskiy, I. P.,
Safiri, S., Sarmiento-Suarez, R., Sartorius, B.,
Smirnov, V. V, Ramenskaia, G., Nikonova, A. A., and
Savic, M., Sawhney, M., Shigematsu, M., Smith, M.,
Khaitov, R. M. (2018) The role of interleukin 33 in
Tadese, F., Thurston, G. D., Topor-Madry, R., Tran,
pathogenesis of bronchial asthma. New experimental
B. X., Ukwaja, K. N., van Boven, J. F. M., Vlassov,
data, Biochemistry (Moscow), 83, 13-25, doi: 10.1134/
V. V., Vollset, S. E., Wan, X., Werdecker, A., Hanson,
S0006297918010029.
S. W., Yano, Y., Yimam, H. H., Yonemoto, N., Yu, C.,
14.
Gurram, R. K., Wei, D., Yu, Q., Butcher, M. J.,
Zaidi, Z., Sayed Zaki, M. El, Lopez, A. D., Murray,
Chen, X., Cui, K., Hu, G., Zheng, M., Zhu, X.,
C. J. L., and Vos, T. (2017) Global, regional, and
Oh, J., Sun, B., Urban, J. F., Zhao, K., Leonard,
national deaths, prevalence, disability-adjusted life
W. J., and Zhu, J. (2023) Crosstalk between ILC2s
years, and years lived with disability for chronic
and Th2 cells varies among mouse models, Cell Rep.,
obstructive pulmonary disease and asthma, 1990-
42, 112073, doi: 10.1016/j.celrep.2023.112073.
2015: a systematic analysis for the Global Burden of
15.
Shilovskiy, I. P., Eroshkina, D. V., Babakhin, A. A.,
Disease Study 2015, Lancet Respir. Med., 5, 691-706,
and Khaitov, M. R. (2017) Anticytokine therapy of
doi: 10.1016/S2213-2600(17)30293-X.
allergic asthma, Mol. Biol., 51, 1-13, doi: 10.7868/
3.
Avdeev, S. N., Nenasheva, N. M., Zhudenkov, K. V.,
S0026898416060197.
Petrakovskaya, V. A., and Izyumova, G. V. (2018)
16.
Gersuk, G. M., Underhill, D. M., Zhu, L., and
Prevalence, morbidity, phenotypes and other charac-
Marr, K. A. (2006) Dectin-1 and TLRs permit macro-
teristics of severe bronchial asthma in Russian Fed-
phages to distinguish between different Aspergillus fu-
eration, Pulmonologiya, 28, 341-358, doi: 10.18093/
migatus cellular states, J. Immunol., 176, 3717-3724,
0869-0189-2018-28-3-341-358.
doi: 10.4049/jimmunol.176.6.3717.
4.
Bush, A.
(2019) Pathophysiological mechanisms
17.
Ito, T., Hirose, K., Norimoto, A., Tamachi, T.,
of asthma, Front. Pediatr.,
7,
68, doi:
10.3389/
Yokota, M., Saku, A., Takatori, H., Saijo, S.,
fped.2019.00068.
Iwakura, Y., and Nakajima, H. (2017) Dectin-1 plays
5.
Kuruvilla, M. E., Lee, F. E. H., and Lee, G. B.
an important role in house dust mite-induced allergic
(2019) Understanding asthma phenotypes, endo-
airway inflammation through the activation of CD11b+
types, and mechanisms of disease, Clin. Rev. Al-
dendritic cells, J. Immunol., 198, 61-70, doi: 10.4049/
lergy Immunol., 56, 219-233, doi: 10.1007/s12016-
jimmunol.1502393.
018-8712.
18.
Komlósi, Z. I., van de Veen, W., Kovács, N.,
6.
Shilovskiy, I. P., Nikolskii, A. A., Kurbacheva, O. M.,
Szűcs, G., Sokolowska, M., O’Mahony, L., Akdis,
and Khaitov, M. R. (2020) Modern view of neutro-
M., and Akdis, C. A. (2022) Cellular and molecular
philic asthma molecular mechanisms and therapy,
mechanisms of allergic asthma, Mol. Aspects Med.,
Biochemistry (Moscow), 85, 854-868, doi: 10.1134/
85, 100995, doi: 10.1016/j.mam.2021.100995.
S0006297920080027.
19.
Habib, N., Pasha, M. A., and Tang, D. D. (2022) Cur-
7.
Lambrecht, B. N., Persson, E. K., and Hammad, H.
rent understanding of asthma pathogenesis and bio-
(2017) Myeloid cells in asthma, Microbiol. Spectr., 5,
markers, Cells, 11, 2764, doi: 10.3390/cells11172764.
1-17, doi: 10.1128/microbiolspec.MCHD-0053-2016.
20.
Gans, M. D., and Gavrilova, T. (2020) Understand-
8.
Barnes, P. J. (2001) Th2 cytokines and asthma: an
ing the immunology of asthma: pathophysiology,
introduction, Respir. Res., 2, 64-65, doi: 10.1186/rr39.
biomarkers, and treatments for asthma endotypes,
9.
Choi, J., Lim, J. W., and Kim, H. (2015) Lyco-
Paediatr. Respir. Rev., 36, 118-127, doi: 10.1016/j.prrv.
pene inhibits house dust mites-induced TLR4 acti-
2019.08.002.
vation and oxidative stress in respiratory epithelial
21.
Singh, R. K., and Cooper, T. A. (2012) Pre-mRNA
cells, Free Radic. Biol. Med., 86, S21, doi: 10.1016/
splicing in disease and therapeutics, Trends Mol. Med.,
j.freeradbiomed.2015.07.082.
18, 472-482, doi: 10.1016/j.molmed.2012.06.006.
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1953
22.
Sahebi, M., Hanafi, M. M., van Wijnen, A. J.,
Identification of a novel splice variant for mouse
Azizi, P., Abiri, R., Ashkani, S., and Taheri, S.
and human interleukin-5, Heliyon,
6, e03586,
(2016) Towards understanding pre-mRNA splicing
doi: 10.1016/j.heliyon.2020.e03586.
mechanisms and the role of SR proteins, Gene, 587,
34.
Atamas, S. P., Choi, J., Yurovsky, V. V, and White, B.
107-119, doi: 10.1016/j.gene.2016.04.057.
(1996) An alternative splice variant of human
23.
Chen, M., and Manley, J. L. (2009) Mechanisms of
IL-4, IL-4 delta 2, inhibits IL-4-stimulated T cell
alternative splicing regulation: Insights from molecular
proliferation, J. Immunol., 156, 435-441.
and genomics approaches, Nat. Rev. Mol. Cell Biol.,
35.
Luzina, I. G., Lockatell, V., Lavania, S., Pickering,
10, 741-754, doi: 10.1038/nrm2777.
E. M., Kang, P. H., Bashkatova, Y. N., Andreev, S. M.,
24.
Zhang, Y., Qian, J., Gu, C., and Yang, Y. (2021)
and Atamas, S. P. (2012) Natural production and
Alternative splicing and cancer: a systematic review,
functional effects of alternatively spliced interleukin-4
Signal Transduct. Target. Ther., 6, 78, doi: 10.1038/
protein in asthma, Cytokine, 58, 20-26, doi: 10.1016/
s41392-021-00486-7.
j.cyto.2011.12.017.
25.
Hiller, M., Zhang, Z., Backofen, R., and Stamm, S.
36.
Luzina, I. G., Lockatell, V., Todd, N. W., Keegan,
(2007) Pre-mRNA secondary structures influence
A. D., Hasday, J. D., and Atamas, S. P. (2011) Splice
exon recognition, PLoS Genet.,
3,
2147-2155,
isoforms of human interleukin-4 are functionally
doi: 10.1371/journal.pgen.0030204.
active in mice in vivo, Immunology, 132, 385-393,
26.
De La Mata, M., Alonso, C. R., Kadener, S.,
doi: 10.1111/j.1365-2567.2010.03393.x.
Fededa, J. P., Blaustein, M., Pelisch, F., Cramer, P.,
37.
Arinobu, Y., Atamas, S. P., Otsuka, T., Niiro, H.,
Bentley, D., and Kornblihtt, A. R. (2003) A slow RNA
Yamaoka, K., Mitsuyasu, H., Niho, Y., Hamasaki, N.,
polymerase II affects alternative splicing in vivo, Mol.
White, B., and Izuhara, K. (1999) Antagonistic ef-
Cell, 12, 525-532, doi: 10.1016/j.molcel.2003.08.001.
fects of an alternative splice variant of human IL-4,
27.
Marasco, L. E., and Kornblihtt, A. R. (2023) The phys-
IL- 4δ2, on IL-4 activities in human monocytes and
iology of alternative splicing, Nat. Rev. Mol. Cell Biol.,
B cells, Cell. Immunol., 191, 161-167, doi: 10.1006/
24, 242-254, doi: 10.1038/s41580-022-00545-z.
cimm.1998.1431.
28.
Peng, Q., Zhou, Y., Oyang, L., Wu, N., Tang, Y.,
38.
Zav’yalov, V. P., Denesyuk, A. I., White, B.,
Su, M., Luo, X., Wang, Y., Sheng, X., Ma, J., and
Yurovsky, V. V., Atamas, S. P., and Korpela, T.
Liao, Q. (2022) Impacts and mechanisms of alterna-
(1997) Molecular model of an alternative splice vari-
tive mRNA splicing in cancer metabolism, immune
ant of human IL-4, IL-4δ2, a naturally occurring
response, and therapeutics, Mol. Ther., 30, 1018-1035,
inhibitor of IL-4-stimulated T cell proliferation, Im-
doi: 10.1016/j.ymthe.2021.11.010.
munol. Lett., 58, 149-152, doi: 10.1016/S0165-2478
29.
Alms, W. J., Atamas, S. P., Yurovsky, V. V., and
(97)00083-7.
White, B. (1996) Generation of a variant of huma
39.
Nelms, K., Keegan, A. D., Zamorano, J., Ryan,
interleukin-4 by alternative splicing, Mol. Immunol.,
J. J., and Paul, W. E. (1999) The IL-4 receptor:
33, 361-370, doi: 10.1016/0161-5890(95)00154-9.
Signaling mechanisms and biologic functions, Annu.
30.
Kinashi, T., Harada, N., Severinson, E., Tanabe, T.,
Rev. Immunol., 17, 701-738, doi: 10.1146/annurev.
Sideras, P., Konishi, M., Azuma, C., Tominaga, A.,
immunol.17.1.701.
Bergstedt-Lindqvist, S., Takahashi, M., Matsuda, F.,
40.
Moran, A., and Pavord, I. D. (2020) Anti-IL-4/
Yaoita, Y., Takatsu, K., and Honjo, T. (1986) Cloning
IL-13 for the treatment of asthma: the story
of complementary DNA encoding T-cell replacing
so far, Expert. Opin. Biol. Ther.,
20,
283-294,
factor and identity with B-cell growth factor II, Nature,
doi: 10.1080/14712598.2020.1714027.
324, 70-73, doi: 10.1038/324070a0.
41.
Nur Husna, S. M., Md Shukri, N., Mohd Ashari,
31.
McKenzie, A. N., Li, X., Largaespada, D. A., Sato, A.,
N. S., and Wong, K. K. (2022) IL-4/IL-13 axis as
Kaneda, A., Zurawski, S. M., Doyle, E. L., Mila-
therapeutic targets in allergic rhinitis and asthma,
tovich, A., Francke, U., and Copeland, N. G. (1993)
PeerJ, 10, e13444, doi: 10.7717/peerj.13444.
Structural comparison and chromosomal localization
42.
Eum, S. Y., Maghni, K., Tolloczko, B., Eidelman,
of the human and mouse IL-13 genes, J. Immunol.,
D. H., and Martin, J. G. (2005) IL-13 may mediate
150, 5436-5444, doi: 10.4049/jimmunol.150.12.5436.
allergen-induced hyperresponsiveness independently
32.
Townsend, M. J., Fallon, P. G., Matthews, D. J.,
of IL-5 or eotaxin by effects on airway smooth muscle,
Smith, P., Jolin, H. E., and McKenzie, A. N. J.
Am. J. Physiol. Lung Cell. Mol. Physiol., 288, 576-584,
(2000) IL-9-deficient mice establish fundamental
doi: 10.1152/ajplung.00380.2003.
roles for IL-9 in pulmonary mastocytosis and goblet
43.
Otsuka, T., Villaret, D., Yokota, T., Takebe, Y.,
cell hyperplasia but not T cell development, Immunity,
Lee, F., Arai, N., and Arai, K. I. (1987) Structural
13, 573-583, doi: 10.1016/S1074-7613(00)00056-X.
analysis of the mouse chromosomal gene encoding in-
33.
Shilovskiy, I., Andreev, S., Mazurov, D., Barvin-
terleukin 4 which expresses B cell, T cell and mast cell
skaia, E., Bolotova, S., Nikolskii, A., Sergeev, I.,
stimulating activities, Nucleic Acids Res., 15, 333-344,
Maerle, A., Kudlay, D., and Khaitov, M.
(2020)
doi: 10.1093/nar/15.1.333.
16
БИОХИМИЯ том 88 вып. 10 2023
1954
ШИЛОВСКИЙ и др.
44.
Arai, N., Nomura, D., Villaret, D., DeWaal
54.
Gajewski, T. F., and Fitch, F. W.
(1988) Anti-
Malefijt, R., Seiki, M., Yoshida, M., Minoshima, S.,
proliferative effect of IFN-gamma in immune
Fukuyama, R., Maekawa, M., and Kudoh, J. (1989)
regulation. IFN-gamma inhibits the proliferation
Complete nucleotide sequence of the chromosomal
of Th2 but not Th1 murine helper T lymphocyte
gene for human IL-4 and its expression, J. Immunol.,
clones, J. Immunol., 140, 4245-4252, doi: 10.4049/
142, 274-282, doi: 10.4049/jimmunol.142.1.274.
jimmunol.140.12.4245.
45.
Yatsenko, O. P., Filipenko, M. L., Khrapov, E. A.,
55.
Luzina, I. G., Lockatell, V., Todd, N. W., High-
Voronina, E. N., Kozlov, V. A., and Sennikov, S. V.
smith, K., Keegan, A. D., Hasday, J. D., and
(2004) Alternative splicing of mRNA of mouse in-
Atamas, S. P. (2011) Alternatively spliced variants of
terleukin-4 and interleukin-6, Cytokine, 28, 190-196,
interleukin-4 promote inflammation differentially,
doi: 10.1016/j.cyto.2004.08.009.
J. Leukoc. Biol., 89, 763-770, doi: 10.1189/jlb.0510271.
46.
Orsini, B., Vivas, J. R., Ottanelli, B., Amedei, A.,
56.
Seah, G. T., Gao, P. S., Hopkin, J. M., and Rook,
Surrenti, E., Galli, A., Milani, S., Pinzani, P., Del
G. A. W. (2001) Interleukin-4 and its alternatively
Prete, G., Surrenti, C., Baldari, C. T., Touati, E., and
spliced variant (IL-4δ2) in patients with atopic
D’Elios, M. M. (2007) Human gastric epithelium pro-
asthma, Am. J. Respir. Crit. Care Med., 164, 1016-1018,
duces IL-4 and IL-4δ2 isoform only upon Helicobacter
doi: 10.1164/ajrccm.164.6.2012138.
pylori infection, Int. J. Immunopathol. Pharmacol.,
57.
Glare, E. M., Divjak, M., Bailey, M. J., and Walters,
20, 809-818, doi: 10.1177/039463200702000417.
E. H. (2001) The usefulness of competitive PCR:
47.
Orsini, B., Ottanelli, B., Amedei, A., Surrenti, E.,
airway gene expression of IL-5, IL-4, IL-4δ2, IL-2,
Capanni, M., Del Prete, G., Amorosi, A., Milani, S.,
and ifnγ in asthma, Thorax, 56, 541-548, doi: 10.1136/
D’Elios, M. M., and Surrenti, C. (2003) Helicobacter
thorax.56.7.541.
pylori cag pathogenicity island is associated with
58.
Schimpl, A., and Wecker, E. (1972) Replacement of
reduced expression of interleukin-4 (IL-4) mRNA
t-cell function by a t-cell product, Nat. New Biol., 237,
and modulation of the IL-4δ2 mRNA isoform in
15-17, doi: 10.1038/newbio237015a0.
human gastric mucosa, Infect. Immun., 71, 6664-6667,
59.
Dutton, R. W., Falkoff, R., Hirst, J., Hoffman, M.,
doi: 10.1128/IAI.71.11.6664-6667.2003.
Kappler, J., Kettman, J. R., Lesley, J. F., and
48.
Pouliot, P., Turmel, V., Gélinas, É., Laviolette, M.,
Vann, D. (1971) Is there evidence for a nonantigen
and Bissonnette, É. Y. (2005) Interleukin-4 production
specific diffusable chemical mediator from the
by human alveolar macrophages, Clin. Exp. Allergy,
thymus-derived cell in the initiation of the immune
35, 804-810, doi: 10.1111/j.1365-2222.2005.02246.x.
response? Prog. Immunol., 1, 355-368, doi: 10.1016/
49.
Plante, S., Semlali, A. H., Joubert, P., Bissonnette, É.,
B978-0-12-057550-3.50033-8.
Laviolette, M., Hamid, Q., and Chakir, J. (2006)
60.
Howard, M., Farrar, J., Hilfiker, M., Johnson, B.,
Mast cells regulate procollagen I (α1) production by
Takatsu, K., Hamaoka, T., and Paul, W. E. (1982)
bronchial fibroblasts derived from subjects with asthma
Identification of a T cell-derived b cell growth factor
through IL-4/IL-4δ2 ratio, J. Allergy Clin. Immunol.,
distinct from interleukin 2, J. Exp. Med., 155, 914-923,
117, 1321-1327, doi: 10.1016/j.jaci.2005.12.1349.
doi: 10.1084/jem.155.3.914.
50.
Glare, E. M., Divjak, M., Rolland, J. M., and Walters,
61.
Sanderson, C. J., Warren, D. J., and Strath, M.
E. H.
(1999) Asthmatic airway biopsy specimens
(1985) Identification of a lymphokine that stimulates
are more likely to express the IL-4 alternative splice
eosinophil differentiation in vitro. Its relationship to
variant IL-4δ2, J. Allergy Clin. Immunol., 104, 978-
interleukin 3, and functional properties of eosinophils
982, doi: 10.1016/S0091-6749(99)70078-3.
produced in cultures, J. Exp. Med., 162, 60-74,
51.
De Moraes-Pinto, M. I., Vince, G. S., Flanagan, B. F.,
doi: 10.1084/jem.162.1.60.
Hart, C. A., and Johnson, P. M. (1997) Localization of
62.
Milburn, M. V., Hassell, A. M., Lambert, M. H.,
IL-4 and IL-4 receptors in the human term placenta,
Jordan, S. R., Proudfoot, A. E. I., Graber, P., and
decidua and amniochorionic membranes, Immunology,
Wells, T. N. C. (1993) A novel dimer configuration
90, 87-94, doi: 10.1046/j.1365-2567.1997.00139.x.
revealed by the crystal structure at 2.4 Å resolution
52.
Elser, B., Lohoff, M., Kock, S., Giaisi, M., Kirch-
of human interleukin-5, Nature,
363,
172-176,
hoff, S., Krammer, P. H., and Li-Weber, M.
doi: 10.1038/363172a0.
(2002) IFN-γ represses IL-4 expression via IRF-1
63.
Foster, P. S., Hogan, S. P., Ramsay, A. J., Matthaei,
and IRF-2, Immunity, 17, 703-712, doi: 10.1016/
K. I., and Young, I. G. (1996) Interleukin 5 deficiency
S1074-7613(02)00471-5.
abolishes eosinophilia, airways hyperreactivity, and
53.
Oriss, T. B., McCarthy, S. A., Morel, B. F., Campana,
lung damage in a mouse asthma model, J. Exp. Med.,
M. A., and Morel, P. A.
(1997) Crossregulation
183, 195-201, doi: 10.1084/jem.183.1.195.
between T helper cell (Th)1 and Th2: Inhibition of
64.
Vasiliev, A. M., Vasilenko, R. N., Kulikova, N. L.,
Th2 proliferation by IFN-gamma involves interference
Andreev, S. M., Chikileva, I. O., Puchkova, G. Y.,
with IL-1, J. Immunol., 158, 3666-3672, doi: 10.4049/
Kosarev, I. V., Khodyakova, A. V., Khlebnikov, V. S.,
jimmunol.158.8.3666.
Ptitsyn, L. R., Shcherbakov, G. Y., Uversky, V. N.,
БИОХИМИЯ том 88 вып. 10 2023
РОЛЬ АЛЬТЕРНАТИВНОГО СПЛАЙСИНГA Th2-ЦИТОКИНОВ
1955
DuBuske, L. M., and Abramov, V. M. (2003) Struc-
Lederer, D. J., and Hardin, M. (2021) Dupilumab
tural and functional properties of IL-4σ2, an
in children with uncontrolled moderate-to-severe
alternative splice variant of human IL-4, J. Proteome
asthma, New Engl. J. Med.,
385,
2230-2240,
Res., 2, 273-281, doi: 10.1021/pr025586y.
doi: 10.1056/nejmoa2106567.
65.
Tavernier, J., Tuypens, T., Plaetinck, G., Verhee, A,
71.
Castro, M., Corren, J., Pavord, I. D., Maspero, J.,
Fiers, W., and Devos, R. (1992) Molecular basis of
Wenzel, S., Rabe, K. F., Busse, W. W., Ford, L.,
the membrane-anchored and two soluble isoforms of
Sher, L., FitzGerald, J. M., Katelaris, C., Tohda, Y.,
the human interleukin 5 receptor alpha subunit, Proc.
Zhang, B., Staudinger, H., Pirozzi, G., Amin, N.,
Natl. Acad. Sci. USA, 89, 7041-7045, doi: 10.1073/
Ruddy, M., Akinlade, B., Khan, A., Chao, J., Mar-
pnas.89.15.7041.
tincova, R., Graham, N. M. H., Hamilton, J. D.,
66.
Kusano, S., Kukimoto-Niino, M., Hino, N.,
Swanson, B. N., Stahl, N., Yancopoulos, G. D., and
Ohsawa, N., Ikutani, M., Takaki, S., Sakamoto, K.,
Teper, A. (2018) Dupilumab efficacy and safety in
Hara-Yokoyama, M., Shirouzu, M., Takatsu, K., and
moderate-to-severe uncontrolled asthma, New Engl.
Yokoyama, S. (2012) Structural basis of interleukin-5
J. Med., 378, 2486-2496, doi: 10.1056/nejmoa1804092.
dimer recognition by its α receptor, Protein Sci., 21,
72.
Busse, W. W., Maspero, J. F., Rabe, K. F., Papi, A.,
850-864, doi: 10.1002/pro.2072.
Wenzel, S. E., Ford, L. B., Pavord, I. D., Zhang, B.,
67.
Luzina, I. G., Keegan, A. D., Heller, N. M., Rook,
Staudinger, H., Pirozzi, G., Amin, N., Akinlade, B.,
G. A. W., Shea-Donohue, T., and Atamas, S. P.
Eckert, L., Chao, J., Graham, N. M. H., and Teper, A.
(2012) Regulation of inflammation by interleukin-4: a
(2018) Liberty asthma QUEST: Phase 3 randomized,
review of “alternatives”, J. Leukoc. Biol., 92, 753-764,
double-blind, placebo-controlled, parallel-group study
doi: 10.1189/jlb.0412214.
to evaluate Dupilumab efficacy/safety in patients with
68.
Grey, A., and Katelaris, C. H. (2019) Dupilumab in
uncontrolled, moderate-to-severe asthma, Adv. Ther.,
the treatment of asthma, Immunotherapy, 11, 859-872,
35, 737-748, doi: 10.1007/S12325-018-0702-4.
doi: 10.2217/imt-2019-0008.
73.
Tohda, Y., Matsumoto, H., Miyata, M., Taguchi, Y.,
69.
Harb, H., and Chatila, T. A. (2020) Mechanisms of
Ueyama, M., Joulain, F., and Arakawa, I. (2022) Cost-
Dupilumab, Clin. Exp. Allergy, 50, 5-14, doi: 10.1111/
effectiveness analysis of dupilumab among patients
cea.13491.
with oral corticosteroid-dependent uncontrolled
70.
Bacharier, L. B., Maspero, J. F., Katelaris, C. H.,
severe asthma in Japan, J. Asthma, 59, 2162-2173,
Fiocchi, A. G., Gagnon, R., de Mir, I., Jain, N., Sher,
doi: 10.1080/02770903.2021.1996596.
L. D., Mao, X., Liu, D., Zhang, Y., Khan, A. H.,
74.
Buendía, J., and Patiño, D. (2022) Dupilumab in
Kapoor, U., Khokhar, F. A., Rowe, P. J., Deniz, Y.,
children with moderate-to-severe asthma: a cost
Ruddy, M., Laws, E., Patel, N., Weinreich, D. M.,
utility analysis, Pediatr. Pulmonol., 57, 2313-2319,
Yancopoulos, G. D., Amin, N., Mannent, L. P.,
doi: 10.1002/ppul.26033.
THE ROLE AND MOLECULAR MECHANISMS
OF ALTERNATIVE SPLICING OF Th2-CYTOKINES IL-4 AND IL-5
IN ATOPIC BRONCHIAL ASTHMA
Review
I. P. Shilovskiy1*, V. I. Kovchina1, E. D. Timotievich1,
A. A. Nikolskii1, and M. R. Khaitov1,2
1 Institute of Immunology, National Research Center, Federal Medical-Biological Agency Russia,
115522 Moscow, Russia; e-mail: ip.shilovsky@nrcii.ru
2 Federal State Autonomous Educational Institution of Higher Education
“N. I. Pirogov Russian National Research Medical University”
of the Ministry of Health of the Russian Federation,
117997 Moscow, Russia
Bronchial asthma (BA) is a heterogeneous chronic inflammatory disease of the respiratory tract. Allergic
asthma is the most common (up to 80% of cases) phenotype developing through Th2-dependent mecha-
nisms involving cytokines: IL-4, IL-5, IL-9 and IL-13. The genes encoding Th2-cytokines have a mosaic
structure (encode exons and introns). Therefore, several mature mRNA transcripts and protein isoforms
БИОХИМИЯ том 88 вып. 10 2023
16*
1956
ШИЛОВСКИЙ и др.
can be derived from a single mRNA precursor through alternative splicing, and they may contribute to
BA pathogenesis. Analysis of published studies and databases revealed the existence of alternative mRNA
transcripts for IL-4, IL-5, and IL-13. Alternative transcripts of IL-4 and IL-5 carry open reading frames
and therefore can encode functional proteins. It was shown that not only alternative mRNA transcripts
are exist for IL-4, but alternative protein isoforms, as well. Natural protein isoform IL-4δ2 lacking part
encoded by exon-2 was identified. Similarly, alternative mRNA transcript omitting exon-2 (IL-5δ2) was
also identified for IL-5. In this review, we summarize current knowledge about identified alternative mRNA
transcripts and protein isoforms of Th2-cytokinins, first of all IL-4 and IL-5. We have analyzed biological
properties of alternative variants of these cytokines, their possible role in the allergic asthma pathogenesis,
and considered their diagnostic and therapeutic potential.
Keywords: bronchial asthma, Th2-cytokines, alternative splicing, signaling pathway
БИОХИМИЯ том 88 вып. 10 2023